一种含双酶重组大肠杆菌固定化细胞及其固定化方法与应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物催化技术领域,具体涉及一种含双酶重组大肠杆菌固定化细胞及其固定化方法与应用。
背景技术
草铵膦(phosphinothricin,PPT)是一种高效、低毒的氨基酸类广谱除草剂,是一种外消旋混合物,有两种光学异构体,分别为L-草铵膦(L-PPT)和D-草铵膦(D-PPT),其中只有L构型的草铵膦才有除草活性。传统的制备手性纯L-草铵膦的方法主要两种:化学法和生物法。其中化学法包括化学拆分法和化学合成法。化学拆分法是通过手性拆分试剂拆分外化学法合成的外消旋D,L-草铵膦(D,L-PPT)或其衍生物,从而制得光学纯的L-草铵膦。然而该工艺需要使用手性拆分试剂、D-草铵膦需要消旋再利用,且需要多次拆分,难以实现大规模工业化生产。化学合成法以天然手性氨基酸或者不对称法合成L-草铵膦,但合成工艺中的氨基保护与脱保护过程复杂,步骤繁多,多用于实验室研究中。与之相比,生物催化法具有反应条件温和、立体选择性高、收率高等优点,是工业化制备L-草铵膦的重要趋势。
2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)是不对称合成光学纯L-草铵膦(一种低毒、广谱、安全的有机磷除草剂)的重要酮酸中间体,其除草活性是外消旋草铵膦的两倍。2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的不对称胺化,以转氨酶或谷氨酸脱氢酶为生物催化剂,生成L-PPT,具有最大理论收率100%的优势,成为工业化生产L-PPT的一种有前途的策略。考虑到严格的立体选择性、温和的反应条件、高的回收率和简单的分离纯化过程,外消旋草铵膦的DAAO脱氨基反应由于其严格的D-异构体对映选择性,保留了具有除草活性的L-异构体,将是一种理想的选择。
固定化微生物细胞是20世纪60年代酶学领域崛起的新技术,利用化学或物理的手段将游离细胞定位于限定的空间区域,从而把酶(细胞)固定成具有高活力、水不溶性、颗粒状的固定化制剂,以利于细胞内的一种酶或多种酶进行生物催化,并保持细胞活性,从而实现生产的连续化、自动化、低成本化、可反复使用的一种技术。与传统游离细胞相比,固定化酶(细胞)具有单位体积的菌体密度高、菌体易回收等优点。
发明内容
针对现有技术的不足,本发明是为了提供一种稳定性高、可重复使用、有效提升菌体的氧利用率、提高D-氨基酸氧化酶和过氧化氢酶催化效率、高效省时的含双酶重组大肠杆菌固定化细胞及其固定化方法,并将其应用于外消旋D,L-草铵膦(D,L-PPT)转化为2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的催化反应中。
为实现上述发明目的,本发明通过以下技术方案实现:
一种含双酶重组大肠杆菌固定化细胞,
包括含双酶重组大肠杆菌细胞以及用于固定含双酶重组大肠杆菌细胞的载体;
所述含双酶重组大肠杆菌细胞内部包含有氨基酸序列如SEQ ID NO.1所示的D-氨基酸氧化酶基因以及氨基酸序列如SEQ ID NO.2所示所示的过氧化氢酶基因;
所述含双酶重组大肠杆菌细胞以及载体均通过表面活性剂修饰改性。
表面活性剂,是指具有固定的亲水亲油基团,在溶液的表面能定向排列,并能使表面张力显著下降的物质。表面活性剂会与大肠杆菌的细胞膜相互作用,致使膜的渗透性增加、形变、溶解以及膜物理化学性质发生变化。离子型表面活性剂(包括阳离子型和阴离子型表面活性剂)可以通过较强的静电作用力与蛋白质结合,产生毒副作用,其疏水链穿透细胞壁,与细胞膜反应并最终导致细菌的裂解。与之相比,非离子表面活性剂一般只能通过较弱的氢键或范德华力与蛋白质结合,刺激性较小,形成的嵌段共聚物可以提升细胞膜渗透性,促进对物质的传递。
无论是真核细胞还是原核细胞,其细胞质及其胞内的细胞器均被以磷脂双分子层为骨架构成的生物膜所包裹。无论是哺乳动物细胞还是更低等的细菌和真菌,表面活性剂都能与其生物膜发生作用,从而影响其活性。有文献报道Pluronic表面活性剂可以通过疏水链段插入磷脂双分子层而导致生物膜的渗透性增强,且这种结合方式主要是由于疏水相互作用造成的,疏水链段含量越高则增强膜渗透性的作用越明显。生物膜通过选择性地阻隔底物或酶穿透膜,可以将酶促反应限制在一个特定的空间进行。本发明通过使用表面活性剂对含双酶重组大肠杆菌细胞进行修饰,有效改善其细胞膜的通透性,从而使得底物或含双酶重组大肠杆菌固定化细胞通过生物膜的通透性和转运机制,可以使酶促反应连续、协调地进行。
此外,外消旋D,L-草铵膦(D,L-PPT)的DAAO脱氨基反应是一个耗氧反应。在生物催化过程中能否提供足够的溶氧量对反应进程有着决定性影响。有效的气液接触都需要某种形式的两相流体流动,例如搅拌槽中的湍流。然而,当流体变得有效停滞时,通过气液接触提供的氧气遭到严重限制。液体停滞的一个重要例子是填充用作酶固定化载体的固体颗粒的大孔(孔径≤100nm)的液体,这将会严重影响氧气的传递,降低D-氨基酸氧化酶和过氧化氢酶的催化作用。本发明人发现,表面活性剂分子的使用能够改变固体颗粒(如钙基膨润土、硅藻土)的表面性质和孔径分布,使其增加氧气的通过性,从而有效提升含双酶重组大肠杆菌固定化细胞的氧利用率,进一步提高其催化效率。尤其是非离子型表面活性剂对载体的改性增加了O
另外,本发明通过载体对含双酶重组大肠杆菌细胞进行吸附,提高含双酶重组大肠杆菌细胞在载体的孔径内的附着性。同时向修饰、改性和吸附后的体系中加入交联剂通过醛胺缩合交联强化含双酶重组大肠杆菌细胞在载体内的固定效果,有效增强含双酶重组大肠杆菌固定化细胞的结构稳定性。
作为优选,所述表面活性剂为非离子表面活性剂,所述非离子表面活性剂为普朗尼克F127(Pluronic-F127)、吐温80(tween80)、月桂醇聚氧乙烯醚(AEO-9)中的任意一种。
作为进一步优选,所述非离子表面活性剂为吐温80(tween80)。
作为优选,所述载体为活性炭、硅藻土、皂土、蒙脱土K-10中的一种或多种的组合。
作为进一步优选,所述载体为200目活性炭、100目活性炭、20~32目活性炭、9.6μm硅藻土、19.6μm硅藻土、36.8μm硅藻土、皂土、蒙脱土K-10中的一种或多种的组合。
作为进一步优选,所述载体为36.8μm硅藻土。
一种如上所述的含双酶重组大肠杆菌固定化细胞的固定化方法,包括以下步骤:
将D-氨基酸氧化酶基因和过氧化氢酶基因共同导入宿主大肠杆菌,获得含有双酶基因的重组大肠杆菌,然后将重组大肠杆菌进行发酵培养获得含双酶重组大肠杆菌细胞;
取含双酶重组大肠杆菌细胞加水溶解制成菌悬液,然后向菌悬液中加入非离子表面活性剂从而对含双酶重组大肠杆菌细胞进行修饰;
再向修饰后的菌悬液中加入载体并搅拌均匀,使得非离子表面活性剂对载体进行改性,并通过载体对含双酶重组大肠杆菌细胞进行吸附;
向修饰、改性和吸附后的体系中加入交联剂进行搅拌,反应完全后过滤、冷冻,得到含双酶重组大肠杆菌固定化细胞。
作为进一步优选,一种如上所述的含双酶重组大肠杆菌固定化细胞的固定化方法,具体包括以下步骤:
将D-氨基酸氧化酶基因和过氧化氢酶基因共同导入宿主大肠杆菌,获得含有双酶基因的重组大肠杆菌,然后将重组大肠杆菌进行发酵培养、离心分离后获得含双酶重组大肠杆菌细胞;
取含双酶重组大肠杆菌细胞加水溶解制成菌悬液,然后在30~35℃下向菌悬液中加入非离子表面活性剂从而对含双酶重组大肠杆菌细胞进行修饰;
再向修饰后的菌悬液中加入载体并搅拌20min至均匀,使得非离子表面活性剂对载体进行改性,并通过载体对含双酶重组大肠杆菌细胞进行吸附;
向修饰、改性和吸附后的体系中加入交联剂Ⅰ,以600~800rpm搅拌转速搅拌1h后,加入交联剂Ⅱ,继续搅拌1h,反应完全后将溶液抽滤,滤饼置于-20℃冷藏保存,得到含双酶重组大肠杆菌固定化细胞颗粒。
作为优选,所述含有双酶基因的重组大肠杆菌为E.coli BL21(DE3)/ pCDFDuet-DAAO-CAT,所述含有双酶基因的重组大肠杆菌的菌体浓度为10~50g/L。
作为进一步优选,所述含有双酶基因的重组大肠杆菌的菌体浓度为30g/L。
作为优选,所述非离子表面活性剂的含量为1.67~10g/L。
作为进一步优选,所述非离子表面活性剂的含量为3g/L。
作为优选,所述载体的添加量为5~250g/L。
作为进一步优选,所述添加载体与添加含双酶重组大肠杆菌细胞的质量之比为1:2~5:1。
作为进一步优选,所述载体的添加量为60g/L,添加载体与添加含双酶重组大肠杆菌细胞的质量之比为2:1。
作为优选,所述交联剂包括交联剂Ⅰ和交联剂Ⅱ,所述交联剂Ⅰ为聚乙烯亚胺(PEI)、壳聚糖、硫酸铵中的一种或多种的组合;所述交联剂Ⅱ为戊二醛(GA)、乙二醛(GO)、环氧氯丙烷中的一种或多种的组合。
作为进一步优选,所述交联剂Ⅰ为MW600的聚乙烯亚胺、MW1800的聚乙烯亚胺、MW4000的聚乙烯亚胺、MW10000的聚乙烯亚胺、壳聚糖、硫酸铵中的一种或多种的组合。
作为进一步优选,所述交联剂Ⅰ为MW1800的聚乙烯亚胺(PEI),所述交联剂Ⅱ为戊二醛(GA)。
作为优选,所述添加的交联剂Ⅰ与体系中添加的水的体积之比为0.03~0.16%;所述添加的交联剂Ⅱ与体系中添加的水的体积之比为0.3~1.6%。
作为进一步优选,所述添加的交联剂Ⅰ与体系中添加的水的体积之比为0.1%;所述添加的交联剂Ⅱ与体系中添加的水的体积之比为1%。
如上所述的含双酶重组大肠杆菌固定化细胞在催化外消旋D,L-草铵膦(D,L-PPT)转化为2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)中的应用。
作为优选,所述应用的方法为:在1L反应釜中,加入300mL水并添加含双酶重组大肠杆菌固定化细胞,以30g/L含双酶重组大肠杆菌固定化细胞为催化剂,以400mM外消旋D,L-草铵膦(D,L-PPT)为底物构成反应体系,在30℃、600rpm转速条件下反应10~12h,并向反应液中通入空气,通气量为2L/min;向反应液中添加50%氨水,使溶液的pH保持在7.8~8.0之间,每隔2h取一次样,加入3.5μL浓度为6M的HCl终止反应,得到2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)。
因此,本发明具有以下有益效果:
(1)本发明通过使用非离子表面活性剂对含双酶重组大肠杆菌细胞进行修饰,有效改善其细胞膜的通透性,从而使得底物或含双酶重组大肠杆菌固定化细胞通过生物膜的通透性和转运机制,可以使酶促反应连续、协调地进行;
(2)本发明通过非离子型表面活性剂对载体进行改性,增加了O
(3)本发明通过载体对含双酶重组大肠杆菌细胞进行吸附,提高含双酶重组大肠杆菌细胞在载体的孔径内的附着性。同时向修饰、改性和吸附后的体系中加入交联剂通过醛胺缩合交联强化含双酶重组大肠杆菌细胞在载体内的固定效果,有效增强含双酶重组大肠杆菌固定化细胞的结构稳定性;
(4)本发明的含双酶重组大肠杆菌固定化细胞可回收再利用,且多次重复使用后酶活没有较为明显的下降。其固定化方法简单、高效省时、可批量快速便捷制备,在外消旋D,L-草铵膦(D,L-PPT)转化为2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的催化应用以及L-草铵膦(L-PPT)的生产中有着广泛的应用前景。
附图说明
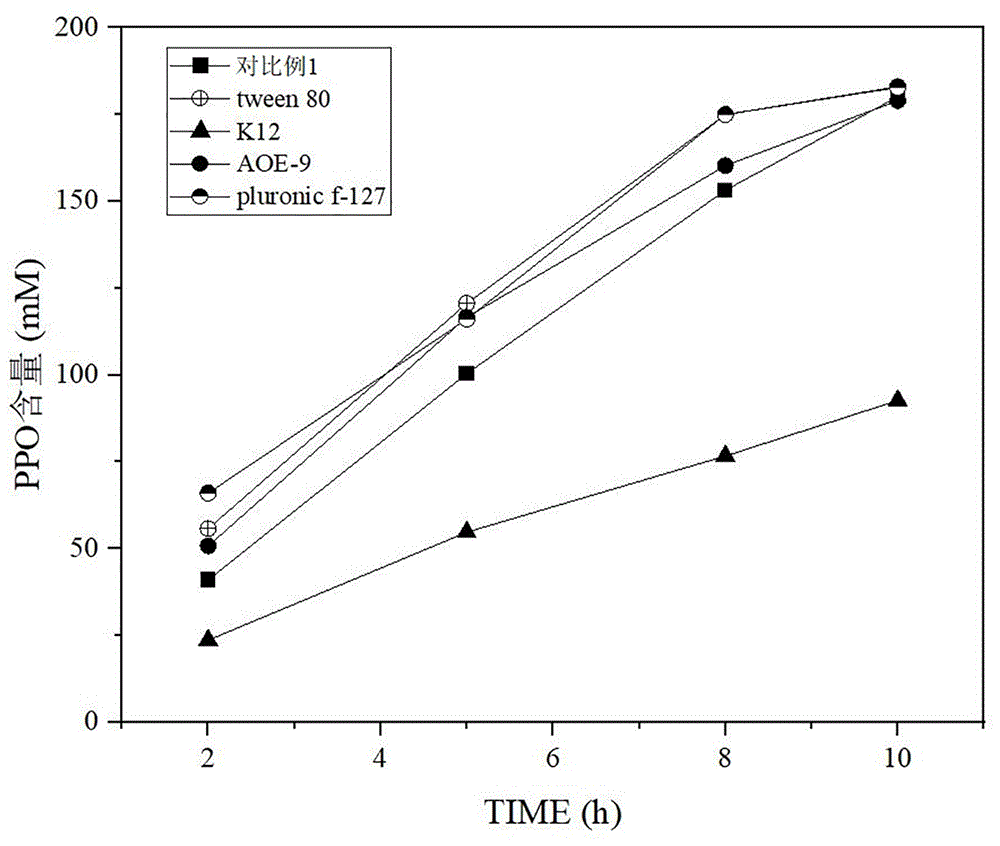
图1为含双酶重组大肠杆菌固定化细胞的催化效率在不同表面活性剂下与未添加表面活性剂下的对比图。
图2为不同表面活性剂修饰改性后的含双酶重组大肠杆菌固定化细胞反应液中的溶解氧情况。
图3为不同tween 80添加量下含双酶重组大肠杆菌固定化细胞的催化效率对比图。
图4为含双酶重组大肠杆菌固定化细胞重复使用20批次第10h的PPO生成量情况。
具体实施方式
下面结合说明书附图以及具体实施例对本发明做进一步描述。本领域普通技术人员在基于这些说明的情况下将能够实现本发明。此外,下述说明中涉及到的本发明的实施例通常仅是本发明一部分的实施例,而不是全部的实施例。因此,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
实施例1
【含有双酶基因的重组大肠杆菌的构建与含双酶重组大肠杆菌细胞的制备】
含有双酶基因的重组大肠杆菌构建过程:
利用蛋白质PDB数据库和NCBI数据库数据对D-氨基酸氧化酶基因序列和过氧化氢酶基因序列进行筛选,得到来源于红酵母(Rhodotorula taiwanensis)的D-氨基酸氧化酶(DAAO)基因(RtDAAO,GenBank accession no.POY70719.1)以及来源于Parageobacillus的过氧化氢酶(CAT)基因(CAT,GenBank accession no.WP_064552100.1)。根据该D氨基酸氧化酶和过氧化氢酶的氨基酸序列,并依据大肠杆菌密码子偏好性进行密码子优化,通过基因工程的常规操作以全合成的方法合成了DAAO和CAT的核苷酸序列。
将氨基酸序列为SEQ ID NO.1所示的D-氨基酸氧化酶基因DAAO(编码蛋白的氨基酸序列同专利申请CN202010191945.1中SEQ ID NO.9所示,核苷酸序列为SEQ ID NO.10所示)构建表达质粒pET-28b(+)-DAAO,氨基酸序列为SEQ ID NO.2所示的过氧化氢酶基因CAT(编码蛋白的氨基酸序列同专利申请CN202010191945.1中SEQ ID NO.7所示,核苷酸序列为SEQ ID NO.8所示)构建表达质粒pET-28b(+)-CAT。通过质粒提取试剂盒分别提取质粒pET-28b(+)-DAAO,pET-28b(+)-CAT以及空质粒pCDFDuet。将DAAO通过一步克隆试剂盒连接到多克隆位点载体pCDFduet上,酶切位点为NcoI和HindⅢ,构建得到质粒pCDFduet-DAAO。再在pCDFduet-DAAO质粒的基础上,通过一步克隆试剂盒将CAT连接到多克隆位点载体pCDFduet第二个克隆位点上,酶切位点为NdeI和XhoI,构建得到质粒pCDFduet-DAAO-CAT,然后将质粒pCDFduet-DAAO-CAT导入大肠杆菌,构建含有双酶基因的重组大肠杆菌E.coli BL21(DE3)/pCDFDuet-DAAO-CAT。D-氨基酸氧化酶基因DAAO和过氧化氢酶基因CAT的氨基酸序列如下表1所示。
表1
含双酶重组大肠杆菌细胞(即湿菌体)制备过程:
将E.coli BL21(DE3)/pCDFDuet- DAAO-CAT接种于含链霉素抗性(终浓度为50μg/mL)的50mL LB液体培养基中,于37℃,150rpm条件下培养8h,以2%(v/v)的接种量转接至100mL含链霉素抗性(终浓度为50μg/mL)LB液体培养基中,于37℃,150rpm条件下培养至菌液的OD值达到0.6~0.8,再向菌液中加入终浓度为0.1mM的异丙基-β-D-硫代半乳糖苷(IPTG)诱导剂,于25℃条件下诱导培养12h,将菌液于8000rpm条件下离心10min,弃上清,用生理盐水洗涤两次获得含双酶重组大肠杆菌细胞。
实施例2
一种含双酶重组大肠杆菌固定化细胞的固定化方法,具体包括以下步骤:
(S.1)按照实施例1的方法构建并培养能够表达D-氨基酸氧化酶基因和过氧化氢酶基因的共表达菌株:含有双酶基因的重组大肠杆菌E.coli BL21(DE3)/pCDFDuet-DAAO-CAT。然后将含有双酶基因的重组大肠杆菌进行发酵培养、离心分离后获得含双酶重组大肠杆菌细胞;
(S.2)取3g步骤(S.1)中得到的含双酶重组大肠杆菌细胞加300mL水溶解制成菌悬液,然后向菌悬液中加入1g吐温80(tween 80)在30~35℃下搅拌10min从而对含双酶重组大肠杆菌细胞进行修饰;
(S.3)再向步骤(S.2)中修饰后的菌悬液中加入1.5g硅藻土(36.8μm)并搅拌20min至均匀,使得吐温80(tween 80)对硅藻土(36.8μm)进行改性,并通过硅藻土(36.8μm)对含双酶重组大肠杆菌细胞进行吸附;
(S.4)向步骤(S.3)中修饰、改性和吸附后的体系中加入0.03mL MW1800的聚乙烯亚胺(PEI),以600~800rpm搅拌转速搅拌1h后,加入0.3mL浓度为50%的戊二醛(GA)溶液,在30~35℃下继续搅拌1h,反应完全后将溶液抽滤,滤饼置于-20℃冷藏保存,得到含双酶重组大肠杆菌固定化细胞。
实施例3
一种含双酶重组大肠杆菌固定化细胞的固定化方法,具体包括以下步骤:
(S.1)按照实施例1的方法构建并培养能够表达D-氨基酸氧化酶基因和过氧化氢酶基因的共表达菌株:含有双酶基因的重组大肠杆菌E.coli BL21(DE3)/pCDFDuet-DAAO-CAT。然后将含有双酶基因的重组大肠杆菌进行发酵培养、离心分离后获得含双酶重组大肠杆菌细胞;
(S.2)取15g步骤(S.1)中得到的含双酶重组大肠杆菌细胞加300mL水溶解制成菌悬液,然后向菌悬液中加入1g吐温80(tween 80)在30~35℃下搅拌10min从而对含双酶重组大肠杆菌细胞进行修饰;
(S.3)再向步骤(S.2)中修饰后的菌悬液中加入75g硅藻土(36.8μm)并搅拌20min至均匀,使得吐温80(tween 80)对硅藻土(36.8μm)进行改性,并通过硅藻土(36.8μm)对含双酶重组大肠杆菌细胞进行吸附;
(S.4)向步骤(S.3)中修饰、改性和吸附后的体系中加入0.16mL MW1800的聚乙烯亚胺(PEI),以600~800rpm搅拌转速搅拌1h后,加入1.6mL浓度为50%的戊二醛(GA)溶液,在30~35℃下继续搅拌1h,反应完全后将溶液抽滤,滤饼置于-20℃冷藏保存,得到含双酶重组大肠杆菌固定化细胞。
实施例4
一种含双酶重组大肠杆菌固定化细胞的固定化方法,具体包括以下步骤:
(S.1)按照实施例1的方法构建并培养能够表达D-氨基酸氧化酶基因和过氧化氢酶基因的共表达菌株:含有双酶基因的重组大肠杆菌E.coli BL21(DE3)/pCDFDuet-DAAO-CAT。然后将含有双酶基因的重组大肠杆菌进行发酵培养、离心分离后获得含双酶重组大肠杆菌细胞;
(S.2)取10g步骤(S.1)中得到的含双酶重组大肠杆菌细胞加300mL水溶解制成菌悬液,然后向菌悬液中加入1g吐温80(tween 80)在30~35℃下搅拌10min从而对含双酶重组大肠杆菌细胞进行修饰;
(S.3)再向步骤(S.2)中修饰后的菌悬液中加入20g硅藻土(36.8μm)并搅拌20min至均匀,使得吐温80(tween 80)对硅藻土(36.8μm)进行改性,并通过硅藻土(36.8μm)对含双酶重组大肠杆菌细胞进行吸附;
(S.4)向步骤(S.3)中修饰、改性和吸附后的体系中加入0.3mL MW1800的聚乙烯亚胺(PEI),以600~800rpm搅拌转速搅拌1h后,加入3mL浓度为50%的戊二醛(GA)溶液,在30~35℃下继续搅拌1h,反应完全后将溶液抽滤,滤饼置于-20℃冷藏保存,得到含双酶重组大肠杆菌固定化细胞。
实施例5
本实施例与实施例4的区别在于采用普朗尼克F127(Pluronic-F127)替换吐温80(tween 80),其他都与实施例4相同。
实施例6
本实施例与实施例4的区别在于采用月桂醇聚氧乙烯醚(AEO-9)替换吐温80(tween 80),其他都与实施例4相同。
实施例7
本实施例与实施例4的区别在于采用十二烷基硫酸钠(K12)替换吐温80(tween80),其他都与实施例4相同。
【不同表面活性剂修饰改性后的含双酶重组大肠杆菌固定化细胞的催化活力测定】
将分别按照实施例4~7以及对比例1中的固定化方法制备得到的含双酶重组大肠杆菌固定化细胞应用于催化外消旋D,L-草铵膦(D,L-PPT)转化为2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的反应中,从而测定含双酶重组大肠杆菌固定化细胞的催化效率。实验过程如下:
在1L反应釜中,加入300mL水并添加含双酶重组大肠杆菌固定化细胞,以30g/L含双酶重组大肠杆菌固定化细胞(分别按照实施例4~7以及对比例1中的固定化方法制备得到)为催化剂,以400mM外消旋D,L-草铵膦(D,L-PPT)为底物构成反应体系,在30℃、600rpm转速条件下反应10~12h,并向反应液中通入空气,通气量为2L/min;通过pH反馈调控装置,向反应液中添加50%氨水,使溶液的pH保持在7.8~8.0之间,每隔2h取一次样,加入3.5μL浓度为6M的HCl终止反应,得到2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)。通过HPLC分析样品中2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的含量。含双酶重组大肠杆菌固定化细胞的催化效率在不同表面活性剂下与未添加非离子表面活性剂下的对比情况如图1所示。
从图1中数据分析可知:经过不同表面活性剂改性过的含双酶重组大肠杆菌固定化细胞具有不同的催化效率。与对照组(对比例1)相比,非离子型表面活性剂(如实施例4、5、6)对催化效率有显著提升作用,而阴离子表面活性剂(如实施例7)则具有显著抑制作用。
【不同表面活性剂修饰改性后的含双酶重组大肠杆菌固定化细胞反应液中的溶氧值测定】
在上述不同表面活性剂修饰改性后的含双酶重组大肠杆菌固定化细胞进行催化外消旋D,L-草铵膦(D,L-PPT)转化为2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的反应过程中同时测量反应溶液中溶氧值的含量。实验结果如图2所示。
反应液中溶解氧的大小主要受溶液中的氧传质和氧化酶对氧的消耗值两个因素的影响。催化速率越快,氧化酶对氧的消耗值越高,反应液中溶氧值越低。因此只有溶液中的氧传质效率大大提高,才会使溶氧值越高。从图2中数据分析可知:催化效率越高的改性含双酶重组大肠杆菌固定化细胞反应液中溶氧值越高。说明非离子表面活性剂对载体的改性,使得氧传输速率变快,氧气利用率提升。
实施例8
本实施例与实施例4的区别在于采用0.5g吐温80(tween 80)替换1g吐温80(tween80),其他都与实施例4相同。
实施例9
本实施例与实施例4的区别在于采用2g吐温80(tween 80)替换1g吐温80(tween80),其他都与实施例4相同。
实施例10
本实施例与实施例4的区别在于采用3g吐温80(tween 80)替换1g吐温80(tween80),其他都与实施例4相同。
对比例1
本实施例与实施例4的区别在于不添加吐温80(tween 80)(也不添加任何其他非离子表面活性剂),其他都与实施例4相同。
对比例2
本实施例与实施例4的区别在于采用0.18g吐温80(tween 80)替换1g吐温80(tween 80),其他都与实施例4相同。
对比例3
本实施例与实施例4的区别在于采用3.6g吐温80(tween 80)替换1g吐温80(tween80),其他都与实施例4相同。
【不同tween 80添加量下含双酶重组大肠杆菌固定化细胞的催化效率测定】
将分别按照实施例4、实施例8~10以及对比例1~3中的固定化方法制备得到的含双酶重组大肠杆菌固定化细胞应用于催化外消旋D,L-草铵膦(D,L-PPT)转化为2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的反应中,从而测定含双酶重组大肠杆菌固定化细胞的催化效率。实验过程如下:
在1L反应釜中,加入300mL水并添加含双酶重组大肠杆菌固定化细胞,以30g/L含双酶重组大肠杆菌固定化细胞(分别按照实施例4、实施例8~10以及对比例2~3中的固定化方法制备得到)为催化剂,以400mM外消旋D,L-草铵膦(D,L-PPT)为底物构成反应体系,在30℃、600rpm转速条件下反应10~12h,并向反应液中通入空气,通气量为2L/min;通过pH反馈调控装置,向反应液中添加50%氨水,使溶液的pH保持在7.8~8.0之间,每隔2h取一次样,加入3.5μL浓度为6M的HCl终止反应,得到2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)。通过HPLC分析样品中D-草铵膦(D-PPT)的含量。不同tween 80添加量下含双酶重组大肠杆菌固定化细胞的催化效率对比情况如图3所示。
从图3中数据分析可知:实施例4的催化效果最好,实施例8、9的催化效果略低于实施例4。对比例2改性效果不明显,没有显著提升作用,与对比例1相似,而实施例10和对比例3中tween 80添加量过多,甚至产生了抑制作用。由此可知不同含量表面活性剂会显著影响经过改性的含双酶重组大肠杆菌固定化细胞的催化效率,表面活性剂含量过低起不到改性作用,含量过高则会使细胞膜物理化学性质产生剧烈变化从而产生毒性降低催化效率。
【含双酶重组大肠杆菌固定化细胞的重复使用情况测定】
在1L反应釜中,加入300mL水并添加含双酶重组大肠杆菌固定化细胞,以30g/L含双酶重组大肠杆菌固定化细胞(按照实施例4中的固定化方法制备得到)为催化剂,以400mM外消旋D,L-草铵膦(D,L-PPT)为底物构成反应体系,在30℃、600rpm转速条件下反应10h,并向反应液中通入空气,通气量为2L/min;通过pH反馈调控装置,向反应液中添加50%氨水,使溶液的pH保持在7.8~8.0之间,每隔2h取一次样,加入3.5μL浓度为6M的HCl终止反应(即为第一次反应过程);
反应10h后,将反应液过滤分离,得到滤饼。洗涤2次后得到第一次反应后回收的含双酶重组大肠杆菌固定化细胞,并将其与400mM的DL-PPT底物以及300mL水重新加入1L反应釜中,重复第一次反应过程,每隔2h取样测定D-草铵膦(D-PPT)和2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)的含量。经过20次重复使用后,计算出每一次的PPO的生成量并作出对比。含双酶重组大肠杆菌固定化细胞重复使用20批次第10h的PPO的生成量情况如图4所示。
从图4中数据分析可知:在重复使用20批次之后,该固定化方法仍保持了86%的催化活力。因此该方法具有稳定性高,重复利用活性好的优异特性。
以上所述仅是对本发明的优选实施例及原理进行了详细说明,对本领域的普通技术人员而言,依据本发明提供的思想,在具体实施方式上会有改变之处,而这些改变也应视为本发明的保护范围。
