一种天花粉融合蛋白及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物医学领域,更具体地,涉及一种天花粉融合蛋白及其应用。
背景技术
恶性肿瘤严重威胁着人类生命健康。近年来,除手术、放疗和化疗等治疗手段之外,,肿瘤免疫治疗已逐渐成为临床一线的治疗手段。随着肿瘤免疫微环境研究的不断深入,更多的免疫治疗靶点,更系统的肿瘤与其他免疫细胞关系被阐释及发现。
天花粉蛋白(TCS)是天花粉中提取的I型核糖体失活蛋白,分子量为27kDa,是国内已批准临床应用的蛋白药物,用于引产及治疗宫外孕、葡萄胎等。近年因其具有抗肿瘤和抗艾滋病毒等药理作用而备受关注。天花粉蛋白可通过多种机理杀伤和抑制肿瘤细胞,其中包括活性氧诱导凋亡、激活Caspase家族诱导凋亡,并改变肿瘤细胞的凋亡途径,减少环磷酸腺苷抑制肿瘤生长,抑制细胞骨架合成诱导肿瘤细胞死亡,下调STAT5改变肿瘤细胞恶性程度等。除了对肿瘤细胞的直接影响,天花粉蛋白还有较强的抑制血管生成能力,可抑制肿瘤细胞的病灶转移,这些特征证明TCS具有一定的抗肿瘤能力。
多项研究表明天花粉蛋白在荷瘤小鼠中表现出激活肿瘤免疫作用,可使被抑制的DC发育成熟和增加荷瘤小鼠淋巴细胞增殖能力和细胞因子分泌能力,增加肿瘤表面抗原肽的表达。此外,天花粉蛋白通过上调CI-MPR强化颗粒酶B对肿瘤细胞壁的穿透作用,在无抗原递呈细胞参与情况下直接激活NK细胞。这些特性提示其具有肿瘤免疫治疗的潜力。
肿瘤抗原(tumor antigen)泛指在肿瘤发生、发展过程中新出现或过度表达的抗原物质,包括肿瘤相关抗原及肿瘤特异性抗原。近年来,通过诱导机体免疫系统攻击肿瘤抗原从而抑制肿瘤的免疫治疗方法备受重视,同时有效的肿瘤抗原也被深入筛选并研究。
天花粉蛋白拥有较大的肿瘤免疫治疗应用潜力,通过配合其它免疫激活原件及肿瘤抗原,可以作为肿瘤免疫治疗的全新思路。在该思路的引导下,一种融合这些功能的一体化疫苗应运而生。
发明内容
本发明的技术目的是提供一种新的天花粉融合蛋白及其应用,具体地,为可用作肿瘤疫苗的重组天花粉融合蛋白及其应用。
一方面,本发明提供了一种天花粉融合蛋白,所述融合蛋白具有式(Ia)或式(Ib)所示的结构:
A-L1-B-L2-C 式(Ia);
A-L2-B 式(Ib),
其中,A表示免疫激活元件,B表示天花粉蛋白元件,C表示肿瘤相关抗原元件,L1、L2各自独立地为不存在或为连接肽元件,“-”表示连接各元件的肽键。
在一个优选实施方式中,所述天花粉蛋白元件包括野生型或突变型天花粉蛋白,优选地,所述天花粉蛋白包括其蛋白全长或其片段。所述突变型天花粉蛋白是指重组天花粉蛋白中一个或多个氨基酸发生改变,并对其蛋白功能活性产生影响的突变种类。可选实例为第120-123位氨基酸发生突变的重组天花粉蛋白,该重组天花粉蛋白的RIP活性大幅下降。
在另一个优选实施方式中,所述天花粉蛋白元件不含Cys。
在另一个优选实施方式中,所述野生型天花粉蛋白的氨基酸序列如SEQ ID No.:4所示。在一个实施方式中,编码所述野生型天花粉蛋白的核苷酸序列如SEQ ID No.:1所示。
免疫激活元件是一种可以增强机体或细胞免疫功能,促进免疫应答的生物活性成分,一般为多肽、蛋白(包括糖蛋白)、多糖等物质。常见应用实例有白介素、干扰素、肿瘤坏死因子、脂多糖、黄芪多糖、谷胱甘肽等。在本申请的一个优选实施方式中,所述免疫激活元件的氨基酸序列如SEQ ID No.:7所示。
肿瘤相关抗原是指非肿瘤细胞所特有的、正常细胞和其他组织上也存在的抗原,只是其含量在细胞癌变时明显增高。在本领域中,主要指成纤维细胞、神经内分泌细胞、脂肪细胞、免疫细胞、血管和淋巴管网络等细胞表面或胞内的抗原。在本申请的一个优选实施方式中,所述肿瘤相关抗原元件的氨基酸序列如SEQ ID No.:8所示。
在另一个优选实施方式中,所述连接肽元件包括0-10个相同或不同的氨基酸残基,优选为3-5个相同或不同的氨基酸残基。
在另一个优选实施方式中,所述连接肽元件为4个或5个Gly。
在另一个优选实施方式中,所述天花粉融合蛋白的氨基酸序列如SEQ ID No.:6所示。
在另一个优选实施方式中,所述天花粉融合蛋白还包含内含肽元件,在所述内含肽C端可含有标签序列。
在另一个优选实施方式中,所述标签序列没有特别限制,例如,包括几丁质结合域(CBD)标签序列、6His标签序列、GST标签序列或MBP标签序列。
本发明中天花粉融合蛋白的构成氨基酸可以是L-型氨基酸或D-型氨基酸,优选地,构成所述多肽的氨基酸中的一个或多个氨基酸可为D-形式的氨基酸。
本发明中天花粉融合蛋白中的各元件可以进一步被修饰。可以采用本领域公知的各种技术手段对各元件的多肽进行修饰,从而改变肽类化合物的理化性质、增加水溶性或疏水性、延长体内作用时间、改变其生物分布状况、消除免疫原性、降低毒副作用等。
另一方面,本发明提供了一种多核苷酸,所述多核苷酸编码如上文所述的天花粉融合蛋白。
在一个优选实施方式中,所述多核苷酸的序列如SEQ ID No.:2所示。
在一个优选实施方式中,所述多核苷酸的序列如SEQ ID No.:3所示。
另一方面,本发明提供了一种载体,所述载体含有如上所述的多核苷酸。
另一方面,本发明提供了一种宿主细胞,所述宿主细胞含有如上所述的载体或所述宿主细胞的基因中整合有如上所述的多核苷酸。
另一方面,本发明提供了一种生产如上所述的融合蛋白的方法,包括以下步骤:
在合适的条件下,培养如上所述的宿主细胞,通过所述宿主细胞表达获得所述融合蛋白或其前体蛋白。
在一个优选实施方式中,所述方法还包括以下步骤:
对所述融合蛋白或其前体蛋白进行分离和纯化。
在另一个优选实施方式中,所述分离和纯化包括直接采用内含肽介导的分离和纯化。
再一方面,本发明提供了一种体外非治疗性抑制肿瘤细胞的方法,包括以下步骤:向肿瘤细胞培养物中加入如上所述的天花粉融合蛋白从而抑制肿瘤细胞。
再一方面,本发明提供了一种体外激活免疫细胞的方法,包括以下步骤:向免疫细胞培养物中加入如上所述的天花粉融合蛋白从而刺激免疫细胞。
在另一个优选实施方式中,所述免疫细胞包括T细胞、巨噬细胞、DC细胞和NK细胞。
在另一个优选实施方式中,所述免疫细胞可以分泌细胞因子。
在另一个优选实施方式中,所述细胞因子包括IFNγ、Granzyme B、Perforin、TNF-α、TGF-β、IL-1β和IL-12。
在另一个优选实施方式中,所述T细胞包括CD8
在另一个优选实施方式中,所述巨噬细胞包括M1型巨噬细胞和M2型巨噬细胞。
再一方面,本发明提供了一种激活肿瘤免疫微环境的方法,包括以下步骤:向肿瘤细胞及免疫细胞混合培养物中,加入如上所述的天花粉融合蛋白。
在一个优选实施方式中,所述肿瘤免疫微环境为肿瘤相关巨噬细胞。
又一方面,本发明提供了一种药物组合物,其含有有效量的如上文所述的天花粉融合蛋白,以及药学上可接受的载体。
又一方面,本发明提供如上所述的天花粉融合蛋白或包含其的药物组合物在制备用于治疗肿瘤的药物中的用途。
在一个优选实施方式中,所述肿瘤包括实体肿瘤,优选地,为Legumain阳性肿瘤。
在另一个优选实施方式中,所述肿瘤包括结肠癌或黑色素瘤。
又一方面,本发明提供一种治疗肿瘤的方法,包括以下步骤:向有需要的对象施用安全有效剂量的如上所述的天花粉融合蛋白或包含其的药物组合物从而治疗肿瘤。
在一个优选实施方式中,所述有需要的对象可为哺乳动物,包括小鼠、大鼠、猴子或人,优选为人。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相结合,从而构成新的或优选的技术方案。限于篇幅,在此不一一累述。
本发明有益效果
本发明对重组天花粉蛋白进行了重组和整合,获得了抗原-佐剂-治疗一体化功能疫苗。本发明不仅提供了一种新的肿瘤免疫治疗思路,更为传统中药老药新用开辟了新的思路。
附图说明
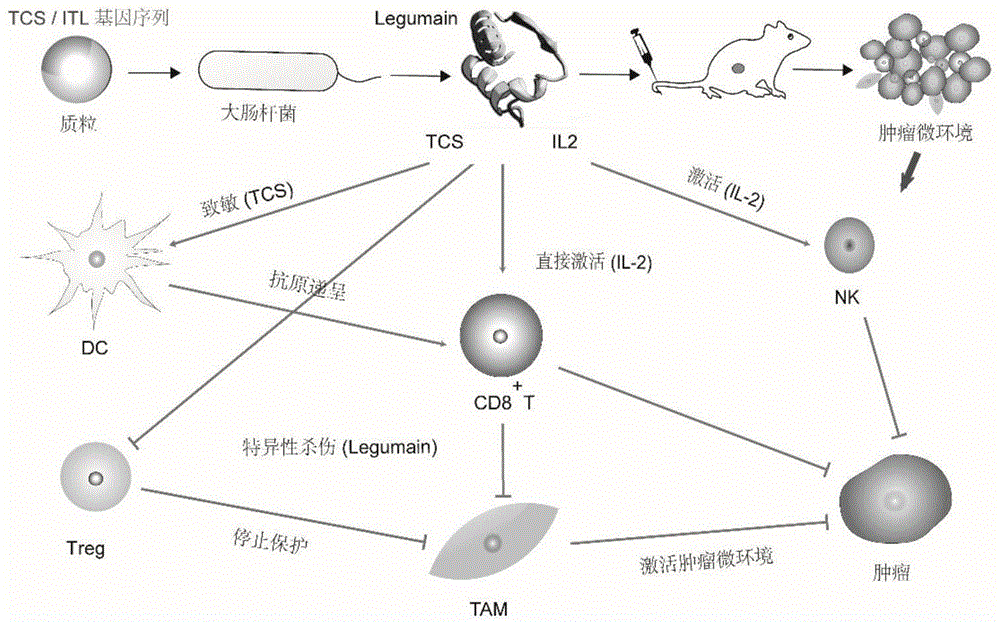
图1为根据本发明制备的免疫激活剂-TCS-抗原的免疫激活及抗肿瘤机理图。
图2为根据本发明的制备实施例1中免疫激活剂-TCS和制备实施例2中免疫激活剂-TCS-抗原的原核表达与纯化的电泳图。
图3为根据本发明的制备实施例1中免疫激活剂-TCS和制备实施例2中免疫激活剂-TCS-抗原的maldi-tof质谱图。A:TCS;B:IL2-TCS;C:ITL。
图4示出根据本发明的实验实施例3中DC细胞与免疫激活剂-TCS共培养后DC细胞CD80表达变化流式细胞术检测结果。
图5示出根据本发明的实验实施例3中DC细胞与免疫激活剂-TCS共培养后DC细胞CD86表达变化流式细胞术检测结果。
图6示出根据本发明的实验实施例3中DC细胞与免疫激活剂-TCS共培养后DC细胞MHC II表达变化流式细胞术检测结果。
图7示出根据本发明的实验实施例4中DC细胞及T细胞与免疫激活剂-TCS共培养后T细胞Ki67表达变化流式细胞术检测结果。
图8示出根据本发明的实验实施例4中DC细胞及T细胞与免疫激活剂-TCS共培养后T细胞穿孔素表达变化流式细胞术检测结果。
图9示出根据本发明的实验实施例4中DC细胞及T细胞与免疫激活剂-TCS共培养后T细胞颗粒酶B表达变化流式细胞术检测结果。
图10示出根据本发明的实验实施例4中DC细胞及T细胞与免疫激活剂-TCS共培养后Treg细胞表达变化流式细胞术检测结果。
图11示出根据本发明的实验实施例4中DC细胞及T细胞与免疫激活剂-TCS共培养后T细胞干扰素γ表达变化流式细胞术检测结果。
图12示出根据本发明的实验实施例4中DC细胞及NK细胞与免疫激活剂-TCS共培养后NK细胞穿孔素表达变化流式细胞术检测结果。
图13示出根据本发明的实验实施例4中DC细胞及NK细胞与免疫激活剂-TCS共培养后NK细胞颗粒酶B表达变化流式细胞术检测结果。
图14示出根据本发明的实验实施例4中DC细胞及NK细胞与免疫激活剂-TCS共培养后NK细胞干扰素γ表达变化流式细胞术检测结果。
图15示出根据本发明实验实施例4中DC细胞及淋巴细胞与免疫激活剂-TCS共培养后上清培养基中转化生长因子表达情况。
图16示出根据本发明实验实施例4中DC细胞及淋巴细胞与免疫激活剂-TCS共培养后上清培养基中干扰素γ表达情况。
图17示出根据本发明实验实施例4中DC细胞及淋巴细胞与免疫激活剂-TCS共培养后上清培养基中白介素12表达情况。
图18示出根据本发明实验实施例5中淋巴细胞与免疫激活剂-TCS对结肠癌细胞CT26的抑制效果。
图19为根据本发明实验实施例6中巨噬细胞、DC细胞、T细胞与免疫激活剂-TCS-抗原transwell共培养示意图。
图20为根据本发明实验实施例6中巨噬细胞的凋亡情况的流式分布图。
图21示出根据本发明的实验实施例6中DC细胞及淋巴细胞、巨噬细胞与免疫激活剂-TCS-抗原共培养后CD8
图22示出根据本发明的实验实施例6中DC细胞及淋巴细胞、巨噬细胞与免疫激活剂-TCS-抗原共培养后CD8
图23为根据本发明的实验实施例6中DC细胞及淋巴细胞、巨噬细胞与免疫激活剂-TCS-抗原共培养后CD8
图24为根据本发明的实验实施例7中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下的肿瘤实验抑制示意图。
图25示出根据本发明的实验实施例7中免疫激活剂-TCS-抗原对于CT26荷瘤小鼠的肿瘤体积的抑制影响。
图26示出根据本发明的实验实施例7中免疫激活剂-TCS-抗原对CT26荷瘤小鼠的肿瘤瘤重的影响。
图27示出根据本发明的实验实施例7中免疫激活剂-TCS-抗原对CT26荷瘤小鼠的肿瘤大小的影响。
图28为根据本发明的实验实施例7中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下的体重变化曲线图。
图29示出根据本发明的实验实施例7中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下的生存曲线。
图30为根据本发明的实验实施例7中免疫激活剂-TCS-抗原对B16F10荷瘤小鼠的肿瘤抑制试验示意图。
图31示出根据本发明的实验实施例7中免疫激活剂-TCS-抗原对B16F10荷瘤小鼠的肿瘤抑制情况。
图32示出根据本发明的实验实施例7中免疫激活剂-TCS-抗原对B16F10荷瘤小鼠的瘤重的影响。
图33为根据本发明的实验实施例7中B16F10荷瘤小鼠在免疫激活剂-TCS-抗原(ITL)的作用下的体重曲线。
图34为根据本发明的实验实施例7中B16F10荷瘤小鼠在免疫激活剂-TCS-抗原的作用下的生存曲线。
图35为根据本发明的实验实施例7中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下的HE切片染色图。
图36为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下淋巴结DC细胞MHC I表达情况的流式叠加图。
图37为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下淋巴结DC细胞MHC II表达情况的流式叠加图。
图38为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏T细胞Ki67表达情况的流式叠加图。
图39为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏T细胞穿孔素表达情况的流式叠加图。
图40为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏T细胞颗粒酶B表达情况的流式叠加图。
图41为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏T细胞肿瘤坏死因子α表达情况的流式叠加图。
图42为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏NK细胞干扰素γ表达情况的流式叠加图。
图43为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏NK细胞穿孔素表达情况的流式叠加图。
图44为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏NK细胞肿瘤坏死因子α表达情况的流式叠加图。
图45为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏T细胞Ki67表达情况的流式叠加图。
图46为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下脾脏T细胞CD8表达情况的流式叠加图。
图47为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内Treg细胞表达情况的流式分布图。
图48为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内T细胞肿瘤坏死因子α表达情况的流式叠加图。
图49为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内T细胞颗粒酶B表达情况的流式叠加图。
图50为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内T细胞穿孔素表达情况的流式叠加图。
图51为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内NK细胞穿孔素表达情况的流式叠加图。
图52为根据本发明的实验实施例8中在CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内NK细胞肿瘤坏死因子α表达情况的流式叠加图。
图53为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内NK细胞颗粒酶B表达情况的流式叠加图。
图54为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内巨噬表型变化情况的流式分布图。
图55为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内巨噬表型MR及Legumain变化情况的Western blot图。
图56为根据本发明的实验实施例8中CT26荷瘤小鼠在免疫激活剂-TCS-抗原的作用下瘤内T细胞、巨噬细胞及肿瘤细胞的共定位荧光显微镜图。
具体实施方式
本文中使用的缩略语及含义列于下表1中。
表1.附图缩略语对照表
附图中统计图说明
所有数据通过GraphPad Prism 7.6软件分析。图4-17,20-21,统计学差异通过one-way ANOVA进行分析,所有数据样本在进行分析前均进行了方差齐性分析,对于不满足方差齐性的数据进行Brown-Forsythe test分析,均无显著差别,故均满足单因素方差分析条件。图23统计学差异通过two-way ANOVA进行分析。因数据量较小(n=3),无法确定是否满足正态分布,本章中数据图表示均为M(P25~P75)值。图25、26、28、31、32、33数据统计学差异通过t test进行分析,数据在分析前均通过KS normality test法进行检测,结
果显示所有数据服从正态分布,结果表示均为
专利实施一般性流程
如图1所示,本专利提到的重组蛋白的应用过程主要包括重组蛋白的制备及应用。制备主要过程包括核苷酸序列的设计,制备和导入,重组蛋白的表达纯化。重组蛋白的应用可以针对不同免疫细胞,优选地,DC细胞,T细胞,NK细胞,巨噬细胞。也可以通过注射应用于实验动物从而起到激活免疫微环境和抗肿瘤效果。
核苷酸序列的设计,制备和导入
本发明融合蛋白或其元件的核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。对于PCR扩增法,可根据已公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cDNA库或按本领域技术人员已知的常规方法所制备的cDNA库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。用于PCR的引物可根据本文所公开的本发明的序列信息适当的选择,并可用于常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的DNA/RNA片段。
一旦获得有关序列,就可以用重组法大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或融合蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述蛋白质的方法。
本领域的技术人员熟知的方法能用于构建含本发明蛋白的编码DNA序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的DNA序列可有效连接到表达载体中的适当启动子上,以指导mRNA合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(GFP),或用于大肠杆菌的四环素或氨苄青霉素抗性。包含上述适当DNA序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
用重组DNA转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收DNA的感受态细胞可在指数生长期后收获,用CaCl
融合蛋白或其元件的表达
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中可用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度诱导或化学诱导)诱导选择的启动子,将细胞在培养一段时间。培养表达的蛋白质可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其他特性通过各种分离方法分离和纯化蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超声处理,超速离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(HPLC)和其他各种液相层析技术及这些方法的结合。
重组蛋白应用条件说明
本发明的药物组合物含有安全有效量的本发明的融合蛋白以及药学上可接受的载体。这类载体包括(但不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。活性成分的给药量是治疗有效量。本发明的药物制剂还可以制成缓释制剂。
本发明融合蛋白的有效剂量可随给药的模式和待治疗的疾病严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:本发明融合蛋白的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫情况、给药途径等。针对肿瘤患者,通常,本发明的融合蛋白每天以约(0.5mg/kg-5mg/kg)动物体重(较佳地3mg/kg-5mg/kg动物体重)的剂量给药,能得到令人满意的结果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
重组蛋白次要成分说明
1.内含肽(Intein)
内含肽介导的蛋白质原核表达、纯化及修饰方法是一种新型的蛋白质定点修饰技术。Intein是一种具有自我剪切功能的多肽。在目的蛋白C端融合intein序列以及几丁质结合域(CBD)亲和标签。该技术用大肠杆菌原核表达系统进行外源蛋白的表达,再用几丁质柱对目的蛋白进行亲和纯化时,用含有巯基的试剂进行柱上切割,在intein的介导下,能将目的蛋白从intein上切下,同时在C末端引入相应的活性基团,用于下游的蛋白修饰。
可用于本发明的亲和标签没有特别限制,可以为任何适用于内含肽自剪切的亲和标签,例如6His等。可用于本发明内涵介导的自剪切切割试剂也没有特别限制,优选为含有巯基的切割试剂。在一个优选实施例中,选择2-巯基乙烷磺酸钠进行切割,蛋白的末端会引入一个硫酯键,此时,蛋白能与N端为半胱氨酸的多肽进行高效反应;如果用L-半胱氨酸作为切割试剂,此时蛋白的末端会额外引入一个半胱氨酸,能够和马来酰亚胺为端基的物质反应。
2.连接肽
本发明提供了一种融合蛋白,它可任选地含有连接肽(肽接头)。连接肽大小和复杂性可能会影响蛋白的活性。通常,连接肽应该具有足够的长度和韧性,以保证连接的两个蛋白在空间上有足够的自由度以发挥其功能。同时避免连接肽中形成α螺旋或β折叠等对融合蛋白的稳定性的影响。连接肽的长度为0-10个氨基酸,较佳地3-5个氨基酸。
本发明的融合蛋白中,将内含肽、免疫激活序列、重组天花粉蛋白、抗原肽通过连接肽组合成抗原肽-TCS-免疫激活序列重组融合蛋白,该体系具有抗原-佐剂-治疗一体化功能。优选地,本发明重组融合蛋白为IL2-TCS-Legumain(SEQ ID No.:6)。重组融合蛋白可通过向表达融合蛋白表达载体中导入完整序列(SEQ ID No.:3)直接获得完整重组蛋白。
发明中涉及概念名词说明
1.在本发明中,“重组融合蛋白”、“本发明蛋白”、“本发明融合蛋白”、“融合蛋白”可互换使用,指具有式Ia或式Ib所述结构,即含有天花粉蛋白元件、免疫激活元件和抗原元件或含有天花粉蛋白元件和免疫激活元件的融合蛋白。本发明蛋白可以使单体或由单体形成的多聚体(如二聚体)。此外,应理解,所述术语还包括融合蛋白的活性片段和衍生物。
2.在本发明中,“ITL”和“IL2-TCS-Legumain”为“抗原-TCS-免疫激活序列”优选例,在实验实施例中二者可代表“抗原-TCS-免疫激活序列”。
3.在本发明中,“IL2-TCS”为“TCS-免疫激活序列”优选例,在实验实施例中“IL2-TCS”可代表“TCS-免疫激活序列”。
4.本发明还包括根据本发明融合蛋白的活性片段、衍生物和类似物。如本发明所用,术语“片段”、“衍生物”和“类似物”是指基本上保留人天花粉蛋白肿瘤抑制功能或免疫激活功能的多肽。本发明的多肽片段、衍生物或类似物可以是:(1)有一个或几个保守或非保守性氨基酸残基(优先保守性氨基酸残基)被取代的多肽,或(2)在一个或多个氨基酸残基中具有取代基团的多肽,或(3)融合蛋白与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(4)附加的氨基酸序列融合于此多肽序列(如前导序列、分泌序列或(5)His等标签序列融合而成的蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
5.如本发明所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多核苷酸和多肽是没有分离纯化的,将多核苷酸和多肽从天然状态中同存在的其他物质中分开,则为分离纯化的。
6.如本发明所用,“分离的重组融合蛋白”是指重组融合蛋白基本上不含天然与其相关的其他蛋白、脂类、糖类或其他物质。本领域的技术人员能用标准蛋白质技术纯化重组融合蛋白。基本上纯的蛋白在非还原聚丙烯酰胺凝胶上能产生单一的主带。
7.如本文所用,术语“引物”指的是在与模板配对,在DNA聚合酶的作用下能以其为起点进行合成与模板互补的DNA链的寡居核苷酸的总称。引物可以是天然的RNA、DNA,也可以是任何形式的天然核苷酸。引物甚至可以使非天然的核苷酸如LNA或ZNA等。引物“大致上”(或“基本上”)与模板上一条链上的一个特殊的序列互补。引物必须与模板上的一条链充分互补才可以开始延伸,但引物的序列不必与模板的序列完全互补。
8.如本文所用,术语“有效剂量”或“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量,如0.001-99wt%;较佳地0.01-95wt%;更佳地,0.1-90wt%。
9.如本文所用,“药学上可接受的”成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
发明中可变更替代元素说明
1.一类优选的活性衍生物指与式Ia或式Ib的氨基酸序列相比,有至多3个,较佳地至多2个,更加地至多1个氨基酸被性质相似的多肽替换。这些保守性变异多肽最好根据表2进行氨基酸替换而产生,优选地,所述的衍生物不含Cys。
表2.氨基酸替代表
2.本发明还提供本发明融合蛋白的类似物。有些类似物与SEQ ID No:.6所示的多肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。类似物还包括具有不同于天然L氨基酸的残基(如D-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性多肽。
3.修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化,羧基化,糖基化等修饰而产生的多肽。修饰形式还包括具有磷酸化氨基酸残基(如磷酸络氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。
4.本发明多肽还可以以由药学上或生理学可接受的酸或碱衍生的盐形式使用。这些盐包括(但不限于)与如下酸形成的盐:氢氯酸、氢溴酸、硫酸、柠檬酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、琥珀酸、草酸、富马酸、马来酸、草酰乙酸、甲磺酸、乙磺酸、苯磺酸或羟乙磺酸。其他盐包括:与碱金属或碱土金属(如纳、钾、钙或镁)形成的盐,以及以酯、氨基甲酸酯或其他常规的“前体药物”的形式。
5.本发明的多核苷酸可以是DNA形式或RNA形式。DNA形式可以是包括cDNA、基因组DNA或人工合成的DNA。DNA可以是单链的或是双链的。DNA可以是编码链或非编码链。RNA可以是编码链或非编码链。
6.本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的蛋白质片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替代形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码多肽的功能。
7.本发明中涉及的宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属的细菌细胞;真菌细胞如酵母;植物细胞;果蝇S2或Sf9的昆虫细胞;CHO、NSO、COS7或293细胞的动物细胞等。
实施例
以下实施例中所需的试剂和药品
大肠杆菌E.coli BL21(DE3)表达菌株购自Novoprotein。氨苄西林霉素Ampicillin,、异丙基硫代半乳糖苷购自美仑生物。蛋白胨、酵母粉购自Oxoid,England。原核表达载体pTXB1、几丁质亲和纯化柱填料购自New England Biolabs,England。2-巯基乙磺酸钠、半胱氨酸购自上海百灵威科技有限公司。丙烯酰胺、N,N'-甲叉双丙烯酰胺购自新赛美生物科技有限公司。过硫酸铵、TEMED、BCA蛋白定量试剂盒、26616蛋白分子量Marker购自上海碧云天生物技术有限公司。考马斯亮蓝G-250购自上海沃凯化学试剂有限公司。其余分析纯试剂均购自国药集团(上海)化学试剂有限公司。pMXB10导入IL2-TCS、ITL序列质粒由上海捷瑞有限公司合成。
制备实施例1:TCS-免疫激活序列的表达和纯化
(1)将TCS-免疫激活序列重组表达质粒(基因序列SEQ ID No.:2)转化大肠杆菌BL21(DE3)感受态细胞。
(2)将含有重组质粒的菌株用含有100μg/mL Amp的LB培养基,于37℃恒温摇床(太仓市实验设备厂)中220rpm培养至对数生长期(600nm吸光值为0.6-0.8),加入终浓度为1mM的IPTG,于25℃,180rpm表达过夜(14h)。
(3)用离心机(美国贝克曼库尔特有限公司,Microfuge 16)6,000rpm,4℃离心20min收集菌体。
(4)用柱结合缓冲液(含20mM HEPES,150mM NaCl,1mM EDTA,0.5‰吐温20,pH8.5)将菌体重悬。
(5)用探头超声破碎仪以400W功率超声破碎细胞30min。
(6)12,000rpm,4℃离心20min,收集上清液。
(7)依次使用3倍柱体积水和3倍柱体积柱结合缓冲液预平衡的几丁质亲和柱,加入滤液并调整流速约为1mL/min,等待滤液中的intein标签与几丁质基质充分结合,用25倍柱体积的柱结合缓冲液洗去非特异性结合的杂蛋白,再用3倍柱体积的切割缓冲液(称取0.3019mg半胱氨酸粉末或0.4102mg 2-巯基乙磺酸钠溶于50mL柱结合缓冲液中)流经层析柱,并保留少量切割缓冲液(约2~3mL)将亲和柱填料完全浸没,关闭层析柱出口,在柱上切割反应16h。
(8)打开柱子出口,收集流出的含有目的蛋白的缓冲液,并继续加入3倍柱体积的HEPES缓冲液,继续将目的蛋白(IL2-TCS)洗脱下来。
制备实施例2:抗原肽-TCS-免疫激活序列的表达和纯化
(1)将抗原肽-TCS-免疫激活序列重组表达质粒(基因序列SEQ ID No.:3)转化大肠杆菌BL21(DE3)感受态细胞。
(2)将含有重组质粒的菌株用含有100μg/mL Amp的LB培养基,于37℃恒温摇床中220rpm培养至对数生长期(600nm吸光值为0.6-0.8),加入终浓度为1mM的IPTG,于25℃,180rpm表达过夜(14h)。
(3)用离心机6,000rpm,4℃离心20min收集菌体。
(4)用柱结合缓冲液(含20mM HEPES,150mM NaCl,1mM EDTA,0.5‰吐温20,pH8.5)将菌体重悬。
(5)用探头超声破碎仪以400W功率超声破碎细胞30min。
(6)12,000rpm,4℃离心20min,收集上清液。
(7)将含有目的蛋白的上清液用HEPES缓冲液预平衡几丁质柱,流速为1mL/min。上样完成后,用25倍柱体积的HEPES缓冲液洗去非特异性结合的杂蛋白。
(8)用3倍柱体积的含有50mM MWSNA的HEPES缓冲液流经柱子,并保留少量缓冲液,关闭柱子出口,在柱上切割过夜(16h)。
(9)打开柱子出口,收集流出的含有目的蛋白的缓冲液,并继续加入3倍柱体积的HEPES缓冲液,继续将目的蛋白(IL2-TCS-Legumain,ITL)洗脱下来。
实验实施例1:重组蛋白表征验证
用本领域常用的SDS聚酰胺凝胶电泳来检测蛋白的分子量及纯度。将4mL水,3.3mL30%丙烯酰胺混合液,2.5mL 1.5mol/L Tris(PH 8.8)100μL 10%SDS,100μL 10%过硫酸铵和4μL TEMED混合后加入胶板,加入无水乙醇封闭胶面。待下层胶凝固后,将2.7mL水,0.67mL 30%丙烯酰胺混合液,0.5mL 1mol/L Tris(pH 6.8)40μL 10%SDS,40μL 10%过硫酸铵和4μL TEMED,混匀后加入凝胶凝固界面,用10孔梳子固定,放置半小时。将提取重组蛋白加以体积比4:1加入loading buffer涡旋混匀后沸水水浴5min,取出后将所制胶板加入电泳槽,取出梳子并于上样孔内加入loading buffer处理过的蛋白和分子量Marker,倒入Running buffer 80V跑胶90min。待前沿指示线跑出胶板时结束电泳,取出胶板并轻轻刮除上层胶,将下层胶放入配置好的考马斯亮蓝G250染色液中染色1-3小时,结束后取出凝胶放入脱色液中,清洗致蛋白条带清晰可见,使用凝胶成像系统(ChemiDoc MPTM ImagingSystem,BIORAD,USA)成像。
结果如下:从图2可以看出用制备的的TCS、IL2-TCS、IL2-TCS-Legumain均为单一均匀条带分别位于25kDa、40kDa、40kDa左右。
实验实施例2:重组蛋白的精确分子质量检测
将TCS、IL2-TCS、ITL的分子量进行表征。以超纯水为流动相,用脱盐柱将待测蛋白样品脱盐。脱盐完成后用30%乙腈溶液将芥子酸配成10mg/mL作为基质,与待测样品以体积比1:1混合,用质谱(MALDI TOF/TOF 5800analyzer,AB Sciex,Framingham,MA)进行检测。选择“positive linear”模式上机检测,并以Data Explorer Software 4.11软件进行分析。
结果如下:如图3所示,融合蛋白TCS、IL2-TCS、IL2-TCS-Legumain的精确分子量分别为27.8kDa、39.6kDa、41.4kDa。
实验实施例3:重组蛋白体外致敏树突状细胞
将6-8周大的Balb/C小鼠或C57BL/6小鼠安乐死后浸泡于75%的乙醇中10min,剥离出股骨和胫骨,并浸泡于75%的乙醇中5min,无菌PBS中浸泡5min,重复2次。将股骨和胫骨的两端剪去,使用1mL注射器吸取无血清DMEM培养基,将骨髓冲出,1800rpm离心5min,弃上清。加入3-5mL的红细胞裂解液,室温静置3min,1800rpm离心,将上清吸出。用BMDC诱导培养基(含40ng/mL GM-CSF+50ng/mL IL-4)将下层细胞重新分散,转移至100mm培养皿中,并于37℃、5%二氧化碳培养箱(MCO-18AIC,SANYO)中培养。培养三天后吸出一半培养基并补充新的DMEM培养基(含40ng/mL GM-CSF+50ng/mL IL-4),继续培养至长出细胞集落。轻轻吹打长出的树突状细胞集落成单细胞悬液,转移到无菌离心管离心收集未成熟的树突状细胞。用含10%FBS的完全培养基重悬后,以3×10
将细胞收集到1.5mL离心管中,250g离心10min,用1mL无菌PBS洗涤两遍,加入100μL 3%BSA重悬,冰上封闭15min。封闭完成后按每样品0.1μL加入CD80、CD86、MHC I、CD11c等表面Marker抗体,冰上孵育15min,加入1mL PBS洗涤两次备用。如需检测细胞因子,在孵育完成后250g离心10min,用200μL BD破膜固定液重悬,冰上孵育40min。孵育结束后加入1mLPBS洗涤两次,使用流式细胞仪CytoFLEX S(Beckman counter)上机检验。上清液使用ELISA试剂盒(达科为)检验IL12因子。
结果如下:如图4、图5所示,TCS、IL2-TCS可以有效增加DC细胞CD80和CD86的表达量,TCS与IL2-TCS并无统计学差异。如图6所示,MHC II表达在经过TCS刺激后会上调,IL2-TCS则会进一步提高。这说明重组天花粉蛋白可以在体外促进DC细胞成熟。如图17所示,上清液IL12表达升高。
实验实施例4:重组蛋白体外激活淋巴细胞
淋巴细胞(lymphocyte)是白细胞的一种,主要存在于淋巴管中循环的淋巴液中,是机体免疫应答功能的重要细胞成分。优选地,本发明选取T细胞和NK细胞作为检测指标。将6-8周大的C57BL/6小鼠安乐死后浸泡于75%的乙醇中10min,于超净台中剥离出脾脏。在35mm培养皿中加入4mL Mouse 1×淋巴细胞分离液,将脾脏研磨并用尼龙网过滤。将悬有脾脏细胞的分离液立即转移到15mL离心管中,覆盖1mL无血清RPMI1640培养基,室温,800g以较慢加速度及减速度离心30min。吸出淋巴细胞层,加入10mL RPMI 1640培养基,颠倒洗涤。室温,250g离心10min收集细胞。倾倒上清液,用DMEM培养基重悬。细胞均分,加入经过重组蛋白致敏的BMDC培养板里,继续于培养箱中培养,共培养7天,分别收集细胞与上清液。
将收集到的细胞转移到1.5mL离心管中,250g离心10min,用1mL无菌PBS洗涤两遍,加入100μL 3%BSA重悬,冰上封闭15min。封闭完成后按每样品0.1μL加入CD3、CD4、CD8、CD11c等表面Marker抗体,冰上孵育15min,加入1mL PBS洗涤两次备用。如需检测细胞因子,在孵育完成后250g离心10min,用200μL BD破膜固定液重悬,冰上孵育40min。孵育结束后加入1mL PBS洗涤两次,按每样品0.1μL加入IFN-γ、颗粒酶B、Ki67、foxp3、perforin等抗体孵育15min,通过流式细胞仪CytoFLEX S(Beckman counter)进行检测;收集到的上清液通过ELISA试剂盒(达科为)进行检测。
结果如下:如图7所示,TCS可以激活T细胞的增殖能力,而IL2-TCS则会进一步强化激活效果,甚至高于阳性对照组。如图8所示,TCS、IL2-TCS均有在体外刺激T细胞分泌穿孔素的效果,两者无统计学差异。如图9所示,TCS、IL2-TCS均有在体外刺激T细胞分泌颗粒酶B的效果,两者无统计学差异。如图11所示,TCS、IL2-TCS均有在体外刺激T细胞分泌IFNγ的效果,两者无统计学差异。如图10所示,本研究采用CD4
如图12所示,在TCS刺激后,NK细胞Perforin
实验实施例5:重组蛋白对抗肿瘤效应研究
利用MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅蓝,商品名噻唑蓝)法测定TCS、IL2-TCS对CT26的抗肿瘤效应。
将对数生长期的CT26细胞消化后稀释成密度为1.5×10
通过预实验确定最佳药物浓度范围,加入不同浓度的溶液,每个浓度做6个复孔。培养48小时,加入MTT(5mg/mL,购自美国Sigma-Aldrich公司)20μL,培养4h,加DMSO 200μL,震荡是结晶无充分溶解混匀。用酶标仪(型号:511 19300FI,Fisher)测定各组OD值,主波长为570nm,参考波长为490nm。计算各组的细胞增殖抑制率:增殖抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%。
结果如下:如图18所示,TCS和TCS-免疫激活序列均会随着浓度增强抗肿瘤作用,IL2-TCS稍强于TCS,二者半数致死量IC50分别为5.219μM、3.907μM。
实验实施例6:重组蛋白疫苗抗原递呈效果及淋巴细胞杀伤活性研究
将6-8周大的Balb/C小鼠或C57BL/6小鼠安乐死后浸泡于75%的乙醇中10min,剥离出股骨和胫骨,并浸泡于75%的乙醇中5min,无菌PBS中浸泡5min,重复2次。将股骨和胫骨的两端剪去,使用1mL注射器吸取无血清DMEM培养基,将骨髓冲出,1800rpm离心5min,弃上清。加入3-5mL的红细胞裂解液,室温静置3min,1800rpm离心,将上清吸出。用BMDC诱导培养基(含40ng/mL GM-CSF+50ng/mL IL-4)将下层细胞重新分散,转移至100mm培养皿中,并于37℃、5%二氧化碳培养箱中培养。培养三天后吸出一半培养基并补充新的DMEM培养基(含40ng/mL GM-CSF+50ng/mL IL-4),继续培养至长出细胞集落。轻轻吹打长出的树突状细胞集落成单细胞悬液,转移到无菌离心管离心收集未成熟的树突状细胞。用含10%FBS的完全培养基重悬后,以3×10
将6-8周大的Balb/C小鼠或C57BL/6小鼠安乐死后的脾脏取出,在35mm培养皿中加入4mL Mouse 1×淋巴细胞分离液,将脾脏研磨并用尼龙网过滤。将悬有脾脏细胞的分离液立即转移到15mL离心管中,覆盖1mL无血清RPMI 1640培养基,室温,800g以较慢加速度及减速度离心30min。吸出淋巴细胞层,加入10mL RPMI 1640培养基,颠倒洗涤。室温,250g离心10min收集细胞。倾倒上清液,用DMEM培养基重悬。细胞均分,加入经过重组蛋白致敏的BMDC培养板里,继续于培养箱中培养,共培养7天,获得DC细胞-T细胞共培养混合液。
将6-8周大的Balb/C小鼠或C57BL/6小鼠安乐死后浸泡于75%的乙醇中10min,剥离出股骨和胫骨,并浸泡于7 5%的乙醇中5min,无菌PBS中浸泡5min,重复2次。减去股骨和胫骨的两端,使用1mL注射器吸取无血清DMEM培养基,将骨髓冲出,1800rpm离心5min,弃上清。取适当体积的含20%血清及诱导因子M-CSF的DMEM培养基加到离心好的骨髓细胞中,重悬细胞,转移到另一皿中,稀释并混匀后,种12孔板中,每孔1mL培养基,摇匀细胞,放置于细胞培养箱中培养72h。培养完成后分别加入LPS(终浓度100ng/mL)+IFN-γ(终浓度20ng/mL)诱导M1型巨噬细胞;IL-4(终浓度:40ng/mL)诱导M2型巨噬细胞,孵育三天,获得M2型巨噬细胞。
如图19所示,将DC细胞-T细胞混合液轻轻用移液枪吹匀,加入M1、M2型巨噬细胞培养基中培养18h。
将培养后的细胞放入1.5mL离心管中,250g离心10min,用1mL无菌PBS洗涤两遍,加入100μL 3%BSA重悬,冰上封闭15min。封闭完成后按每样品0.1μL加入CD3、CD4、CD8、CD80、CD86、CD206等表面Marker抗体,冰上孵育15min,加入1mL PBS洗涤两次备用。如需检测细胞因子,在孵育完成后250g离心10min,用200μLBD破膜固定液重悬,冰上孵育40min。孵育结束后加入1mL PBS洗涤两次,按每样品0.1μL加入干扰素γ、颗粒酶B、抗体等孵育15min,通过流式细胞仪(USA,Becton Dickinson)进行检测。
将培养后的细胞放入1.5mL离心管中,按照ANNEXIN V-FITC/PI凋亡检测试剂盒(Beijing Solarbio Science&Technology Co,.Ltd)说明书操作。具体地,用27mL的去离子水稀释3ml Binding Buffer(10×)至30mL,每次用3mL。收集细胞(1×10
结果如下:经过ITL处理后的淋巴细胞在与靶细胞M2型巨噬细胞接触后,相对于未接触抗原刺激或接触抗原刺激后接触低表达靶向抗原细胞(M1型巨噬细胞)的淋巴细胞展现出了更强的特异性杀伤,巨噬细胞凋亡数量增加,同时CD8
经过ITL处理后的淋巴细胞在与靶细胞M2型巨噬细胞接触后,相对于未接触抗原刺激或接触抗原刺激后接触低表达靶向抗原细胞(M1型巨噬细胞)的淋巴细胞展现出了更强的特异性杀伤。如图20所示,巨噬细胞凋亡数量增加。如图21-23所示,CD8
实验实施例7:重组蛋白体内抗肿瘤研究
动物模型的建立:
CT26鼠源结肠癌皮下瘤模型建立:取雌性Balb/c小鼠,动物麻醉机中加入异氟烷使其麻醉,将右侧背部毛发用脱毛膏褪去,待小鼠醒来后放入SPF动物房中过夜。第二天将培养的CT26用0.25%胰酶消化,用PBS重悬并清洗两次,置于细胞计数板计数并制成4×10
B16F10鼠源黑色素瘤模型建立:取雌性C57BL/6小鼠,动物麻醉机中加入异氟烷使其麻醉,将右侧背部毛发用脱毛膏褪去,待小鼠醒来后放入SPF动物房中过夜。第二天将培养的B16F10用0.25%胰酶消化,用PBS重悬并清洗两次,置于细胞计数板计数并制成4×10
结果分析:
CT26鼠源结肠癌皮下瘤模型的抗肿瘤效果:图24为小鼠抗肿瘤实验示意图。待瘤体积成长至13.5cm
图25为肿瘤生长曲线,图26为肿瘤的瘤重统计图。从图中可以看出,肿瘤生长曲线结果显示PBS组生长速度较快,相比之下,TCS在产生较高毒性的前提下表现出了一定的抑制作用。而IL2-TCS-LEG(ITL)表现出了较高的体内抗肿瘤效果且与TCS组产生了统计学差异。图27为在实验终点时小鼠的肿瘤照片,从图中可以看出,注射PBS的小鼠肿瘤明显更大,而注射TCS组、抗原-TCS-免疫激活序列组肿瘤有不同程度减小。对实验结果进行抑瘤率分析,TCS组、抗原-TCS-免疫激活序列组抑瘤率分别为55.68%、69.01%。
图28为给药过程中各组别小鼠体重变化曲线图,图29为各组别小鼠的生存曲线图。从图中可以看出,TCS组在给药过程中体重明显下降,部分小鼠在给药过程中出现死亡现象,抗原-TCS-免疫激活序列组相比PBS组无明显体重变化,说明TCS全身毒性较大,而抗原-TCS-免疫激活的毒性相对较低。
B16F10鼠源黑色素瘤模型的抗肿瘤效果:图30为小鼠抗B16F10肿瘤实验示意图。待瘤体积成长至13.5cm
图31为肿瘤生长曲线图,图32位肿瘤生长瘤重图。结果显示PBS组瘤体积增长迅速,于第18天已有小鼠瘤体积增长至2000mm
图33为各组小鼠体重变化图,从图中可以看出减量后的TCS与抗原-TCS-免疫激活序列表现出了相似的小鼠全身毒性,但TCS组小鼠健康状态仍会明显下降。图34为各组小鼠生存曲线图,从图中可以看出,PBS对照组因肿瘤发展过快被判定为死亡,注射TCS小鼠因其全身毒性死亡,抗原-TCS-免疫激活序列组小鼠则可以存活较长时间。
图35为实验终点时将各组小鼠的脏器取出进行病理切片分析。HE染色由上海瑞雨生物科技包埋,切片,染色及图像采集。从图中可以看出,TCS对小鼠的肝、肾脏产生了毒性,具体表现如下:肝脏出现局部免疫细胞炎性浸润,肾脏出现肾小球肥大伴有炎性浸润,说明TCS对机体脏器有较强毒性。抗原-TCS-免疫激活序列组小鼠未见明显脏器病变,说明其毒性相较于TCS较弱。
实验实施例8:重组蛋白体内抗免疫激活效果实验
取雌性Balb/c小鼠,动物麻醉机中加入异氟烷使其麻醉,将右侧背部毛发用脱毛膏褪去,待小鼠醒来后放入SPF动物房中过夜。第二天将培养的CT26用0.25%胰酶消化,用PBS重悬并清洗两次,置于细胞计数板计数并制成4×10
利用流式细胞术将荷瘤小鼠淋巴结内的DC细胞表征并统计成熟情况。具体操作如下:实验终点时将小鼠瘤周淋巴结取出,冰上研磨,用尼龙网过滤。加入100μL3%BSA重悬,冰上封闭15min。封闭完成后按每样品0.1μL加入CD80、CD86、MHC I、MHC II、CD11c抗体,冰上孵育15min,加入1mL PBS洗涤两次备用。使用NovoCyte流式仪检测。
结果如下:图36为淋巴结中树突状细胞MHC I表达变化图,图37为淋巴结中树突状细胞MHC II表达变化图。结果显示在经过TCS处理后,瘤周淋巴结DC细胞中MHC I和MHC II表达量均有明显提高。在经过ITL处理后则会进一步提高。MHC I是DC细胞激活CD8
对荷瘤小鼠脾脏淋巴细胞分化情况进行研究,具体操作如下:实验终点时将小鼠脾脏取出,冰上研磨,用尼龙网过滤。将研磨液转移到15mL离心管中,加入3mL淋巴细胞分离液,覆盖1mL的RPMI 1640培养基。室温,800g离心30min。按分离液说明书指导设置较慢的加速度和减速度。轻轻吸出淋巴细胞层,PBS清洗一遍后800g离心收集细胞。若收集细胞呈红色,说明仍有较多红细胞,此时应加入3mL红细胞裂解液裂红3min后以800g离心收集细胞。加入100μL 3%BSA重悬,冰上封闭15min。封闭完成后按每样品0.1μL加入CD49b、CD3、Granzyme B、CD8、IFNγ、perforin、Ki67、NK1.1、TNFα流式抗体,使用NovoCyte流式仪检测。
结果如下:图38为脾脏T细胞Ki67表达量流式检测图。Ki67表达的情况可以代表细胞增殖分化活性。从图中可以看出,在经过ITL治疗后,脾脏T细胞Ki67表达量明显升高,说明ITL有效增强了T细胞增殖能力。TCS组内Ki67表达也有提高,但因为个体差异较大未产生统计学差异。图39、图40和图41分别为实验终点时小鼠脾脏T淋巴细胞穿孔素、颗粒酶B,肿瘤坏死因子α,表达情况流式统计图。从图中可以看出,经过TCS、ITL治疗后,小鼠脾脏IFNγ
图42、图43、图44为脾脏内NK细胞干扰素γ、穿孔素、肿瘤坏死因子α表达流式检测图,从图中可以看出经ITL治疗后,NK细胞中IFNγ、TNFα、Perforin三种细胞因子表达显著提高,代表NK细胞杀伤活性提高,NK细胞亦被激活。
对荷瘤小鼠肿瘤免疫微环境中的淋巴细胞进行研究,具体操作如下:剪取剥离下的肿瘤组织50g,用剪刀剪碎,加入无血清培养基,含胰蛋白酶和胶原(1mg/mL)置于摇床上37℃,150rpm,消化1-2h,待无明显块状物后过滤,3000rpm离心4min。收集细胞,加入100μL3%BSA重悬,冰上封闭15min。对细胞进行CD3、Granzyme B、CD8、IFNγ、perforin、Ki67、NK1.1、TNFα流式抗体染色,对细进行流式抗体染色,使用NovoCyte流式仪检测。
结果如下:图45为肿瘤T细胞Ki67表达量流式检测图。从图中可以看出,在经过ITL治疗后,脾脏T细胞Ki67表达量明显升高,说明尾静脉注射ITL也可以有效增强肿瘤中T细胞增殖能力。
图46、图47分别代表肿瘤中CD8
图48、图49和图50分别代表肿瘤内T细胞中肿瘤坏死因子α、颗粒酶B和穿孔素的表达情况。结果显示TCS本身并无直接激活T细胞杀伤的能力,而ITL体系可以显著增强三种因子在肿瘤细胞中的分泌,激活肿瘤微环境,说明其对肿瘤的抑制作用来源于免疫激活作用。
图51、图52和图53分别代表肿瘤细胞内NK细胞中穿孔素、肿瘤坏死因子α和颗粒酶B的分泌情况。TCS治疗后肿瘤中Granzyme B
对荷瘤小鼠肿瘤内巨噬细胞分群变化进行研究,具体操作如下:剪取剥离下的肿瘤组织50g,用剪刀剪碎,加入无血清培养基,含胰蛋白酶和胶原(1mg/mL)置于摇床上37℃,150rpm,消化1-2h,待无明显块状物后过滤,3000rpm离心4min。收集细胞,加入100μL 3%BSA重悬,冰上封闭15min。对细胞进行TGF-β、CD206、F4/80、CD49b流式抗体染色,对细进行流式抗体染色,使用NovoCyte流式仪检测。
剪取50mg肿瘤组织置于冰上,使用匀浆仪充分匀浆,用本领域一般Western blot方法进行蛋白浓度验证,具体步骤为:细胞用ripa强:cocktail蛋白酶抑制剂(体积比100:1)混合液重悬,冰上裂解30min,按体积比4:1加入loading buffer,沸水浴加热5min,按1.2.7进行SDS-PAGE凝胶电泳。剪取0.45μm PVDF膜(5x8 cm),放入甲醇活化1min,泡进半干转膜液备用,同时剪取两块同样规格的纸板,同样泡进半干转膜液至完全浸湿,按照纸板,PVDF膜,凝胶,纸板的顺序逐层叠加,注意避免产生气泡,最后用50mL EP管将剩余气泡赶出,盖好转膜仪12V转膜1.5h。转膜结束后弃去凝胶,将PVDF膜放于自封袋中,加入半干转膜液防止PVDF膜干燥,剪取目标条带标记后加入含5%BSA的TBST封闭液中封闭45min。封闭结束后倒去封闭液,将对应目标一抗用封闭液稀释到相应倍数后加入对应条带,于摇床上4℃孵育过夜。第二天回收一抗后加入2mL TBST洗涤5遍,每次5min,再加入含有1‰对应二抗的TBST孵育1h,加入2mL TBST洗涤5遍,将条带加入ECL荧光发光显色液(将A液与B液1:1混合)避光反应后使用成像仪(ChemiDoc MPTM Imaging System,BIO-RAD)成像。
结果如下:图54为肿瘤中M2型巨噬细胞比例流式分析图,M2型巨噬细胞是维持肿瘤微环境的重要免疫细胞。应用F4/80标记肿瘤中的巨噬细胞并使用CD206(MR,甘露糖受体)及TGF-β双分子标志物表征肿瘤中的M2型巨噬细胞。结果显示,ITL治疗组CD206
图55为Western blot成像结果。结果显示,在经过ITL治疗后,肿瘤组织中的M2型巨噬细胞biomarker MR及Legumain显著减少,再次证明M2型巨噬细胞比例已减少。
应用免疫荧光法检测检测巨噬细胞的清除途径,具体操作如下:取肿瘤组织,用O.C.T(SAKURA,USA)进行包埋,剪取2mL离心管协助定型,迅速放置-80℃冰箱速冻至包埋剂变硬。使用冷冻切片机切片,控制厚度为15-20μm,置4℃冰箱备用。将切片置于室温30min,PBS漂洗3次,每次洗3min;滴加4%多聚甲醛固定20min;滴加0.1M的柠檬酸缓冲液(pH=6),修复抗原30min。然后用PBS漂洗3次,每次3min;滴加0.3%的曲拉通PBS溶液为细胞打孔15min,然后用吸水纸吸干;免疫组化笔圈出待染组织,滴加5%BSA封闭液至完全淹没组织,室温封闭1h;吸水纸吸干封闭液,将MR、CD3一抗按说明书稀释至适宜浓度,每个组织样本加稀释后的抗体至完全覆盖组织。将片子放入避光湿盒,4℃恒温避光孵育12h。吸水纸吸干一抗,PBS清洗3次,每次3min;如需孵育二抗,按使用说明稀释荧光二抗,每个组织样本加稀释后的二抗溶液至完全覆盖组织,室温避光孵育1h。吸水纸吸干二抗,PBS洗涤3次,每次5min;吸水纸吸干组织上的残留液体,滴加30μL的DAPI染色液,使DAPI染液完全覆盖样本,室温避光孵育3min。吸水纸吸干染色液,PBS洗涤3次,每次3min;在组织上滴加少量PVP抗荧光淬灭的封片剂(上海碧云天有限公司),缓慢的将盖玻片覆盖组织,确保盖玻片和载玻片间无气泡,避光晾干。将处理完的片子用激光共聚焦扫描显微镜进行观察。
结果如下:图56为肿瘤组织中T细胞、M2型巨噬细胞进行了共定位。结果显示,在PBS组、TCS组中,T细胞(CD3
结合实验实施例8可以得出:ITL可有效激活荷瘤小鼠免疫系统并将抗原Legumian信息传递给机体免疫系统,诱使淋巴细胞特异性攻击M2型巨噬细胞并减少后者数量,激活免疫微环境,抑制肿瘤发展,起到免疫治疗的效果(参见图1)。
序列表
<110> 中国科学院上海药物研究所
<120> 一种天花粉融合蛋白及其应用
<130> DI21-1364-XC03
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 750
<212> DNA
<213> 人工序列
<220>
<223> 重组TCS的核苷酸序列
<400> 1
atggatgtta gcttccgttt atcaggtgca acaagcagtt cctatggagt tttcatttca 60
aatctgagaa aagctcttcc aaatgaaagg aaactgtacg atatccctct gttacgttcc 120
tctcttccag gttctcaacg ctacgcattg atccatctca caaattacgc cgatgaaacc 180
atttcagtgg ccatagacgt aacgaacgtc tatattatgg gatatcgcgc tggcgataca 240
tcctattttt tcaacgaggc ttctgcaaca gaagctgcaa aatatgtatt caaagacgct 300
atgcgaaaag ttacgcttcc atattctggc aattacgaaa ggcttcaaac tgctgcaggc 360
aaaataaggg aaaatattcc gcttggactc cctgctttgg acagtgccat taccactttg 420
ttttactaca acgccaattc tgctgcgtcg gcacttatgg tactcattca gtcgacgtct 480
gaggctgcga ggtataaatt tattgagcaa caaattggga agcgtgttga caaaaccttc 540
ctaccaagtt tagcaattat aagtttggaa aatagttggt ctgctctctc caagcaaatt 600
cagatagcga gtactaataa tggacagttt gaaagtcctg ttgtgcttat aaatgctcaa 660
aaccaacgag tcacgataac caatgttgat gctggagttg taacctccaa catcgcgttg 720
ctgctgaata gaaacaatat ggcactcgag 750
<210> 2
<211> 1065
<212> DNA
<213> 人工序列
<220>
<223> 重组IL2-TCS的核苷酸序列
<400> 2
catatggatg ttagcttccg tttatcaggt gcaacaagca gttcctatgg agttttcatt 60
tcaaatctga gaaaagctct tccaaatgaa aggaaactgt acgatatccc tctgttacgt 120
tcctctcttc caggttctca acgctacgca ttgatccatc tcacaaatta cgccgatgaa 180
accatttcag tggccataga cgtaacgaac gtctatatta tgggatatcg cgctggcgat 240
acatcctatt ttttcaacga ggcttctgca acagaagctg caaaatatgt attcaaagac 300
gctatgcgaa aagttacgct tccatattct ggcaattacg aaaggcttca aactgctgca 360
ggcaaaataa gggaaaatat tccgcttgga ctccctgctt tggacagtgc cattaccact 420
ttgttttact acaacgccaa ttctgctgcg tcggcactta tggtactcat tcagtcgacg 480
tctgaggctg cgaggtataa atttattgag caacaaattg ggaagcgtgt tgacaaaacc 540
ttcctaccaa gtttagcaat tataagtttg gaaaatagtt ggtctgctct ctccaagcaa 600
attcagatag cgagtactaa taatggacag tttgaaagtc ctgttgtgct tataaatgct 660
caaaaccaac gagtcacgat aaccaatgtt gatgctggag ttgtaacctc caacatcgcg 720
ttgctgctga atagaaacaa tatggcaggt ggcggtggtc ctaaaaaaaa aatccagctc 780
cacgcggaac atgccctgta tgatgcactg atgattctga atattgttaa aaccaatagt 840
cctccggccg aagaaaaact ggaagattat gcctttaatt ttgaactgat cttagaagaa 900
atcgctcgtc tgtttgaatc aggcgatcag aaagatgaag ccgaaaaagc caaacgcatg 960
aaagaatgga tgaaacgtat caaaacgacg gcaagcgaag atgaacagga agaaatggct 1020
aatgctatta tcacaatctt acagagttgg atctttagcc tcgag 1065
<210> 3
<211> 1119
<212> DNA
<213> 人工序列
<220>
<223> 重组 IL2-TCS-LEG的核苷酸序列
<400> 3
catatggaag atgtgacccc ggaaaatttt ctggcagtgt tacgcggcgg tggcggtggt 60
gatgttagct tccgtttatc aggtgcaaca agcagttcct atggagtttt catttcaaat 120
ctgagaaaag ctcttccaaa tgaaaggaaa ctgtacgata tccctctgtt acgttcctct 180
cttccaggtt ctcaacgcta cgcattgatc catctcacaa attacgccga tgaaaccatt 240
tcagtggcca tagacgtaac gaacgtctat attatgggat atcgcgctgg cgatacatcc 300
tattttttca acgaggcttc tgcaacagaa gctgcaaaat atgtattcaa agacgctatg 360
cgaaaagtta cgcttccata ttctggcaat tacgaaaggc ttcaaactgc tgcaggcaaa 420
ataagggaaa atattccgct tggactccct gctttggaca gtgccattac cactttgttt 480
tactacaacg ccaattctgc tgcgtcggca cttatggtac tcattcagtc gacgtctgag 540
gctgcgaggt ataaatttat tgagcaacaa attgggaagc gtgttgacaa aaccttccta 600
ccaagtttag caattataag tttggaaaat agttggtctg ctctctccaa gcaaattcag 660
atagcgagta ctaataatgg acagtttgaa agtcctgttg tgcttataaa tgctcaaaac 720
caacgagtca cgataaccaa tgttgatgct ggagttgtaa cctccaacat cgcgttgctg 780
ctgaatagaa acaatatggc aggtggcggt ggtcctaaaa aaaaaatcca gctccacgcg 840
gaacatgccc tgtatgatgc actgatgatt ctgaatattg ttaaaaccaa tagtcctccg 900
gccgaagaaa aactggaaga ttatgccttt aattttgaac tgatcttaga agaaatcgct 960
cgtctgtttg aatcaggcga tcagaaagat gaagccgaaa aagccaaacg catgaaagaa 1020
tggatgaaac gtatcaaaac gacggcaagc gaagatgaac aggaagaaat ggctaatgct 1080
attatcacaa tcttacagag ttggatcttt agcctcgag 1119
<210> 4
<211> 247
<212> PRT
<213> 人工序列
<220>
<223> 重组TCS的氨基酸序列
<400> 4
Asp Val Ser Phe Arg Leu Ser Gly Ala Thr Ser Ser Ser Tyr Gly Val
1 5 1015
Phe Ile Ser Asn Leu Arg Lys Ala Leu Pro Asn Glu Arg Lys Leu Tyr
202530
Asp Ile Pro Leu Leu Arg Ser Ser Leu Pro Gly Ser Gln Arg Tyr Ala
354045
Leu Ile His Leu Thr Asn Tyr Ala Asp Glu Thr Ile Ser Val Ala Ile
505560
Asp Val Thr Asn Val Tyr Ile Met Gly Tyr Arg Ala Gly Asp Thr Ser
65707580
Tyr Phe Phe Asn Glu Ala Ser Ala Thr Glu Ala Ala Lys Tyr Val Phe
859095
Lys Asp Ala Met Arg Lys Val Thr Leu Pro Tyr Ser Gly Asn Tyr Glu
100 105 110
Arg Leu Gln Thr Ala Ala Gly Lys Ile Arg Glu Asn Ile Pro Leu Gly
115 120 125
Leu Pro Ala Leu Asp Ser Ala Ile Thr Thr Leu Phe Tyr Tyr Asn Ala
130 135 140
Asn Ser Ala Ala Ser Ala Leu Met Val Leu Ile Gln Ser Thr Ser Glu
145 150 155 160
Ala Ala Arg Tyr Lys Phe Ile Glu Gln Gln Ile Gly Lys Arg Val Asp
165 170 175
Lys Thr Phe Leu Pro Ser Leu Ala Ile Ile Ser Leu Glu Asn Ser Trp
180 185 190
Ser Ala Leu Ser Lys Gln Ile Gln Ile Ala Ser Thr Asn Asn Gly Gln
195 200 205
Phe Glu Ser Pro Val Val Leu Ile Asn Ala Gln Asn Gln Arg Val Thr
210 215 220
Ile Thr Asn Val Asp Ala Gly Val Val Thr Ser Asn Ile Ala Leu Leu
225 230 235 240
Leu Asn Arg Asn Asn Met Ala
245
<210> 5
<211> 351
<212> PRT
<213> 人工序列
<220>
<223> 重组IL2-TCS的氨基酸序列
<400> 5
Asp Val Ser Phe Arg Leu Ser Gly Ala Thr Ser Ser Ser Tyr Gly Val
1 5 1015
Phe Ile Ser Asn Leu Arg Lys Ala Leu Pro Asn Glu Arg Lys Leu Tyr
202530
Asp Ile Pro Leu Leu Arg Ser Ser Leu Pro Gly Ser Gln Arg Tyr Ala
354045
Leu Ile His Leu Thr Asn Tyr Ala Asp Glu Thr Ile Ser Val Ala Ile
505560
Asp Val Thr Asn Val Tyr Ile Met Gly Tyr Arg Ala Gly Asp Thr Ser
65707580
Tyr Phe Phe Asn Glu Ala Ser Ala Thr Glu Ala Ala Lys Tyr Val Phe
859095
Lys Asp Ala Met Arg Lys Val Thr Leu Pro Tyr Ser Gly Asn Tyr Glu
100 105 110
Arg Leu Gln Thr Ala Ala Gly Lys Ile Arg Glu Asn Ile Pro Leu Gly
115 120 125
Leu Pro Ala Leu Asp Ser Ala Ile Thr Thr Leu Phe Tyr Tyr Asn Ala
130 135 140
Asn Ser Ala Ala Ser Ala Leu Met Val Leu Ile Gln Ser Thr Ser Glu
145 150 155 160
Ala Ala Arg Tyr Lys Phe Ile Glu Gln Gln Ile Gly Lys Arg Val Asp
165 170 175
Lys Thr Phe Leu Pro Ser Leu Ala Ile Ile Ser Leu Glu Asn Ser Trp
180 185 190
Ser Ala Leu Ser Lys Gln Ile Gln Ile Ala Ser Thr Asn Asn Gly Gln
195 200 205
Phe Glu Ser Pro Val Val Leu Ile Asn Ala Gln Asn Gln Arg Val Thr
210 215 220
Ile Thr Asn Val Asp Ala Gly Val Val Thr Ser Asn Ile Ala Leu Leu
225 230 235 240
Leu Asn Arg Asn Asn Met Ala Gly Gly Gly Gly Pro Lys Lys Lys Ile
245 250 255
Gln Leu His Ala Glu His Ala Leu Tyr Asp Ala Leu Met Ile Leu Asn
260 265 270
Ile Val Lys Thr Asn Ser Pro Pro Ala Glu Glu Lys Leu Glu Asp Tyr
275 280 285
Ala Phe Asn Phe Glu Leu Ile Leu Glu Glu Ile Ala Arg Leu Phe Glu
290 295 300
Ser Gly Asp Gln Lys Asp Glu Ala Glu Lys Ala Lys Arg Met Lys Glu
305 310 315 320
Trp Met Lys Arg Ile Lys Thr Thr Ala Ser Glu Asp Glu Gln Glu Glu
325 330 335
Met Ala Asn Ala Ile Ile Thr Ile Leu Gln Ser Trp Ile Phe Ser
340 345 350
<210> 6
<211> 369
<212> PRT
<213> 人工序列
<220>
<223> 重组IL2-TCS-LEG的氨基酸序列
<400> 6
Glu Asp Val Thr Pro Glu Asn Phe Leu Ala Val Leu Arg Gly Gly Gly
1 5 1015
Gly Gly Asp Val Ser Phe Arg Leu Ser Gly Ala Thr Ser Ser Ser Tyr
202530
Gly Val Phe Ile Ser Asn Leu Arg Lys Ala Leu Pro Asn Glu Arg Lys
354045
Leu Tyr Asp Ile Pro Leu Leu Arg Ser Ser Leu Pro Gly Ser Gln Arg
505560
Tyr Ala Leu Ile His Leu Thr Asn Tyr Ala Asp Glu Thr Ile Ser Val
65707580
Ala Ile Asp Val Thr Asn Val Tyr Ile Met Gly Tyr Arg Ala Gly Asp
859095
Thr Ser Tyr Phe Phe Asn Glu Ala Ser Ala Thr Glu Ala Ala Lys Tyr
100 105 110
Val Phe Lys Asp Ala Met Arg Lys Val Thr Leu Pro Tyr Ser Gly Asn
115 120 125
Tyr Glu Arg Leu Gln Thr Ala Ala Gly Lys Ile Arg Glu Asn Ile Pro
130 135 140
Leu Gly Leu Pro Ala Leu Asp Ser Ala Ile Thr Thr Leu Phe Tyr Tyr
145 150 155 160
Asn Ala Asn Ser Ala Ala Ser Ala Leu Met Val Leu Ile Gln Ser Thr
165 170 175
Ser Glu Ala Ala Arg Tyr Lys Phe Ile Glu Gln Gln Ile Gly Lys Arg
180 185 190
Val Asp Lys Thr Phe Leu Pro Ser Leu Ala Ile Ile Ser Leu Glu Asn
195 200 205
Ser Trp Ser Ala Leu Ser Lys Gln Ile Gln Ile Ala Ser Thr Asn Asn
210 215 220
Gly Gln Phe Glu Ser Pro Val Val Leu Ile Asn Ala Gln Asn Gln Arg
225 230 235 240
Val Thr Ile Thr Asn Val Asp Ala Gly Val Val Thr Ser Asn Ile Ala
245 250 255
Leu Leu Leu Asn Arg Asn Asn Met Ala Gly Gly Gly Gly Pro Lys Lys
260 265 270
Lys Ile Gln Leu His Ala Glu His Ala Leu Tyr Asp Ala Leu Met Ile
275 280 285
Leu Asn Ile Val Lys Thr Asn Ser Pro Pro Ala Glu Glu Lys Leu Glu
290 295 300
Asp Tyr Ala Phe Asn Phe Glu Leu Ile Leu Glu Glu Ile Ala Arg Leu
305 310 315 320
Phe Glu Ser Gly Asp Gln Lys Asp Glu Ala Glu Lys Ala Lys Arg Met
325 330 335
Lys Glu Trp Met Lys Arg Ile Lys Thr Thr Ala Ser Glu Asp Glu Gln
340 345 350
Glu Glu Met Ala Asn Ala Ile Ile Thr Ile Leu Gln Ser Trp Ile Phe
355 360 365
Ser
<210> 7
<211> 100
<212> PRT
<213> 人工序列
<220>
<223> 重组IL2的氨基酸序列
<400> 7
Pro Lys Lys Lys Ile Gln Leu His Ala Glu His Ala Leu Tyr Asp Ala
1 5 1015
Leu Met Ile Leu Asn Ile Val Lys Thr Asn Ser Pro Pro Ala Glu Glu
202530
Lys Leu Glu Asp Tyr Ala Phe Asn Phe Glu Leu Ile Leu Glu Glu Ile
354045
Ala Arg Leu Phe Glu Ser Gly Asp Gln Lys Asp Glu Ala Glu Lys Ala
505560
Lys Arg Met Lys Glu Trp Met Lys Arg Ile Lys Thr Thr Ala Ser Glu
65707580
Asp Glu Gln Glu Glu Met Ala Asn Ala Ile Ile Thr Ile Leu Gln Ser
859095
Trp Ile Phe Ser
100
<210> 8
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 重组LEG的氨基酸序列
<400> 8
Glu Asp Val Thr Pro Glu Asn Phe Leu Ala Val Leu Arg
1 5 10
