弓形虫TGME49_299780基因敲除虫株的构建方法及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及弓形虫基因敲除虫株,尤其是一种弓形虫TGME49_299780基因敲除虫株,经鉴定,该基因编码的蛋白属于弓形虫致密颗粒家族蛋白,本发明还涉及敲除虫株的构建方法及其用途,属于生物及基因工程领域。
背景技术
刚地弓形虫(简称弓形虫)作为一种细胞内专性寄生原虫,拥有复杂的生活史,其中间宿主十分广泛但终末宿主单一,是研究顶复门原虫的经典模式生物。由弓形虫感染引起的弓形虫病可以在包括人类在内的多个物种间传播,弓形虫病的流行病学调查结果显示,弓形虫病呈全球性广泛分布,在免疫功能正常的感染者体内一般不表现明显的临床症状,主要的危害群体为免疫缺陷者或处于妊娠期者,处于妊娠期的患者主要临床症状表现为流产、死胎,严重损害畜牧业经济发展的同时还引发了严重的公共卫生安全问题,因此,加强对弓形虫病的防控对于人类健康和畜牧养殖业的发展均有重要意义。
目前,药物治疗对弓形虫病的防控具有局限性,乙胺嘧啶和磺胺嘧啶等针对叶酸代谢途径的抑制剂对弓形虫速殖子有效,但被弓形虫感染后大多数个体都表现为无临床症状的慢性感染,大量弓形虫在宿主体内以缓殖子的形式存在,使用药物无法达到有效的治疗效果,因而构建具有良好免疫原性和免疫保护力的弓形虫疫苗具有重要价值。近年来,CRISPR/Cas9技术被广泛应用于弓形虫基因编辑,为弓形虫疫苗的开发提供了有力的支持。
致密颗粒家族蛋白(GRAs)是弓形虫重要的分泌蛋白,在纳虫泡形成的同时,GRAs以类似胞吐作用的形式被连续释放至纳虫泡空间和纳虫泡膜上发挥功能,还有少数的GRAs靶向宿主细胞核发挥功能。目前研究发现,GRAs是纳虫泡的重要组成部分,对修饰纳虫泡、促进纳虫泡的成熟和进一步发育为组织包囊至关重要,并在弓形虫获取能量完成寄生生活、躲避宿主免疫系统的攻击等方面发挥着重要的作用。
发明内容
本发明的目的是提供一种弓形虫TGME49_299780基因敲除虫株及其构建方法,本发明鉴定了TGME49_299780基因编码的蛋白属于弓形虫致密颗粒家族蛋白,所构建的虫株由于敲除了TGME49_299780基因导致其编码蛋白的功能缺失,具有毒力低,在动物体内繁殖量少等优点,相比野生型虫株能为动物提供更好的抵抗弓形虫感染的免疫能力,有制备抗弓形虫基因工程疫苗的潜力。
为实现上述目的,申请人首先以弓形虫RHΔku80虫株为出发虫株,构建了一种弓形虫蛋白定位虫株(简称299780-3×HA虫株),通过间接免疫荧光试验,发现299780蛋白可以与已知的弓形虫致密颗粒蛋白GRA7共定位,由此证明了299780蛋白属于弓形虫致密颗粒家族。
接着,申请人使用CRISPR/Cas9技术对出发虫株ME49进行基因敲除,敲除虫株的构建方法包括构建pSAG1-Cas9-TgU6-sg299780质粒、制备α-299780-5UTR::DHFR::α-299780-3UTR同源模板,共同电转至出发虫株ME49并进行乙胺嘧啶筛选、PCR鉴定等步骤,最终获得弓形虫基因敲除虫株ME49Δ299780。具体的构建方法如下:
(1)以pSAG1-Cas9-TgU6-sgUPRT质粒为模板,设计TGME49_299780基因的打靶位点,根据打靶位点设计引物进行定点突变,将上述模板质粒中的sgUPRT替换为TGME49_299780基因靶点特异的gRNA,构建pSAG1-Cas9-TgU6-sg299780质粒;
(2)以出发虫株的基因组为模板,设计引物,分别扩增TGME49_299780基因上下游同源臂,构建包含TGME49_299780基因上下游同源臂的同源重组模板;
(3)将步骤(1)构建的pSAG1-Cas9-TgU6-sg299780质粒和步骤(2)构建的同源重组模板共电转至出发虫株,经药物筛选、PCR鉴定获得弓形虫TGME49_299780基因缺失虫株。
其中,所述TGME49_299780基因打靶位点的序列如SEQ ID NO:2所示,根据该打靶位点设计的引物序列如SEQ ID NO:3、SEQ ID NO:4所示。
其中,所述TGME49_299780基因上下游同源臂的引物序列为:
U5α-299780-F:如SEQ ID NO:5所示;
U5α-299780-R:如SEQ ID NO:6所示;
U3α-299780-F:如SEQ ID NO:7所示;
U3α-299780-R:如SEQ ID NO:8所示。
其中,所述同源重组模板的载体质粒是pUC19,模板中还含有DHFR*药物筛选标签。
接着,利用构建的基因敲除虫株ME49Δ299780开展以下试验:
(1)进行了基因敲除虫株ME49Δ299780的毒力试验:以野生型虫株ME49为对照,腹腔接种1×10
(2)小鼠感染ME49Δ299780虫株后的荷虫量试验:对6周龄的雌性ICR小鼠腹腔接种1×10
(3)ME49Δ299780虫株对小鼠的免疫保护力:以1×10
附图说明
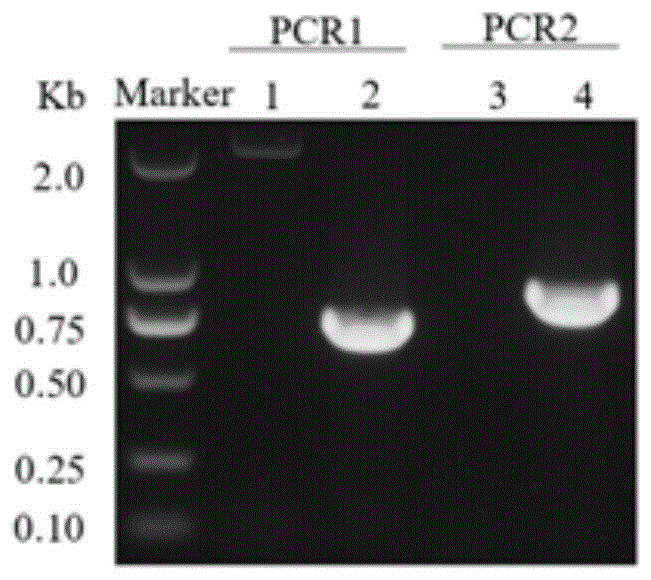
图1是299780-3×HA库的PCR鉴定结果。1.3:RHΔku80野生型,2.4:299780-3×HA库。
图2是299780-3×HA库的间接免疫荧光结果。
图3是p299780-5UTR::DHFR::299780-3UTR质粒的图谱
图4是ME49Δ299780的单克隆虫株PCR鉴定结果。1.3.5:ME49野生型,2.4.6:ME49Δ299780突变株。
图5是ME49Δ299780虫株对小鼠的毒力试验结果。
图6是小鼠感染ME49Δ299780虫株后腹水中的荷虫量。
图7是ME49Δ299780虫株对小鼠的免疫保护力试验结果。免疫ME49Δ299780 30d后,腹腔注射RH速殖子(A)和ME49速殖子(B)。
具体实施方式
下面结合具体实施例对本发明进行详细说明。
实施例1:TGME49_299780蛋白的鉴定
(1)出发虫株RHΔku80
RHΔku80是球虫目弓形虫科弓形科属的Ⅰ型虫株,所述打靶位点核苷酸序列如SEQID NO:1所示。
(2)pSAG1-Cas9-TgU6-sg299780C质粒的构建
①用gRNA在线设计网站(http://www.e-crisp.org/E-CRISP/designcrispr.html)对目标基因的打靶位点进行设计,根据所设计的靶点序列(GGATCCCCCTCGCGTACACT)设计gRNA引物:
上游引物gRNA-299780C-F:5’-AGTGTACGCGAGGGGGATCCGTTTTAGAGCTAGAAATAGC-3’
下游引物gRNA-R:5’-AACTTGACATCCCCATTTAC-3’
②在灭菌PCR管中配制如下反应体系,其中模板DNA:pSAG1-Cas9-TgU6-sgUPRT质粒:
③PCR反应条件如下:
④PCR结束以后,在PCR反应体系里直接加1μL DpnI,PCR仪里37℃消化40min。
⑤取新的灭菌PCR管,配制如下反应体系,在PCR仪中,25℃反应15min;
⑥取全部反应产物转化入DH5α(100μL)感受态细胞中,涂LB/Amp平板,37℃倒置培养过夜;挑取单菌落置于5ml LB/Amp液体培养基中,37℃/180rpm振荡培养10-12h至菌液浑浊;取500μL菌液进行测序分析,测序引物为M13反向引物,若测序结果显示靶点序列已完全被替换,即质粒构建成功,利用Omega公司的去内毒素质粒提取试剂盒(Endo-free PlasmidMini Kit II)对pSAG1-Cas9-TgU6-sg299780C质粒进行提取,并测定浓度、备用。
(3)3×HA-DHFR同源片段的制备:
①根据拟打靶的位点设计带有50bp同源臂的上下游引物,用高保真酶(Phanta)从带DHFR的质粒pSL24m-Linker-smFP-DHFR-LoxP-T7(购自http://www.addgene.org)上扩增3×HA-DHFR片段。其中上下游引物为:
299780-3×HA-F:
AGTCGAATCCAGAACAACTGAAGGCAGGCATTCTATTTGTAGTTTTGCATCGCTACCCCTACGATGTGCCGGATT
299780-3×HA-R:
GTAACCCAAATTCTCGAGGCAGAACTCGCCAGCACTTGCCGGTTCTTACGCACCGCTTTCTCAACAGGAAAAAGC
PCR体系如下所示:
温度体系如下:
/>
②对目的片段进行回收,并利用NanoDrop2000测定回收产物浓度备用;
(4)弓形虫蛋白定位虫株299780-3×HA的获得:
①收取步骤(1)所述新鲜的弓形虫速殖子RHΔku80,利用无菌的3μm孔径滤膜过滤除掉宿主细胞碎片,1500rpm离心5min;弃上清,用Cytomix(120mM KCl,0.15mM CaCl
②取250-300μL左右的虫体悬液到电转杯中,加入步骤(2)中pSAG1-Cas9-TgU6-sg299780C质粒和步骤(3)中3×HA-DHFR同源片段,其中质粒和同源片段的DNA摩尔比=5:1,转染DNA的总量为10μg,总体积350μL。
③用移液枪将DNA和RHΔku80虫体混合均匀于4mm电转杯中,并去除气泡;将电转杯置于Bio-Rad电转仪内,设置1550V、25μF、50Ω、4mm连续电击两次。
④在电转杯中立即加入1ml虫体培养液(DMEM+2%FBS+双抗)轻轻冲洗,再将该液体转移至新鲜的宿主细胞上进行培养(T25),同时设立无DNA的转染对照组,同时进行培养观察。
⑤在60-80%转染后的虫体逸出HFF宿主细胞后,将细胞裂解使虫体从宿主细胞中释放出来;取500-2000μL虫体悬液加入到新鲜的宿主细胞中(T25),在该培养基中加入1μM乙胺嘧啶筛选;
⑥在乙胺嘧啶作用3天后,可见宿主细胞内出现虫体增殖现象,在50%虫体从宿主细胞内逸出时将细胞裂解使虫体释放,取500-1000μL虫体传到新鲜的宿主细胞中,再进行药物筛选;
⑦在经过3-5代药物筛选后,对将虫体离心收集沉淀进行基因组DNA的提取(基因组提取方法参照基因组DNA提取试剂盒操作说明进行),并利用(表1)引物检测片段插入效率。PCR1、2均有条带说明同源臂均成功整合到弓形虫基因组中,结果表明3×HA-DHFR片段插入成功,且插入位点正确,299780-3×HA药筛库构建成功(图1)。
表1. 299780-3×HA药筛库的PCR鉴定引物
(5)间接免疫荧光试验鉴定299780蛋白的定位:
①向爬片(带有生长好的HFF细胞)中加入一定量299780-3×HA弓形虫速殖子,生长过夜。
②取出爬片,加入PBS洗涤3次,清洗细胞表面的虫子。
③加入4%多聚甲醛对爬片细胞进行固定,200μL/孔,室温静置20min。
④PBS洗涤3遍,加入0.1%Triton X-100透化细胞,200μL/孔,37℃培养箱静置20min。
(3)PBS洗3遍,加入10%FBS封闭,200μL/孔,37℃培养箱静置20min。
(4)PBS洗3遍,按一定浓度加入不同的一抗血清(鼠源HA抗体、兔源ALD抗体),1%FBS为一抗稀释液,50μL/孔,37℃孵育20min。
(5)PBS洗5遍,按1:1000加入不同的荧光二抗和染细胞核的Hoechst染料,1%FBS为二抗稀释液,避光配制,200μL/孔,37℃避光孵育18min。
(6)PBS洗5遍,将爬片取出,沥干水滴,倒扣在加有抗荧光淬灭剂的载玻片上,可避光保存一周。
(7)在荧光显微镜下,根据荧光的不同波长可观察不同颜色的荧光从而观察到一抗对应的蛋白。
从图2的试验结果可以看出,RHΔku80虫株染色HA标签不发光,299780-3×HA虫株染色HA标签发光,说明HA标签的发光是特异的,可以特异性的指示299780蛋白的定位。弓形虫致密颗粒蛋白GRA7,属于弓形虫致密颗粒蛋白家族成员,该家族成员具有相似的蛋白定位,即定位于弓形虫致密颗粒以及弓形虫纳虫泡膜等位置,
299780-3×HA虫株染色HA标签的发光位置可以GRA7的位置共定位,说明299780蛋白属于弓形虫致密颗粒家族蛋白。
实施例2:弓形虫ME49Δ299780虫株的构建
(1)出发虫株ME49
ME49是具有TGM49_299780基因的球虫目弓形虫科弓形科属的II型虫株,所述TGM49_299780基因的核苷酸序列如SEQ ID NO:1所示。
(2)pSAG1-Cas9-TgU6-sg299780质粒的构建
①用gRNA在线设计网站(http://www.e-crisp.org/E-CRISP/designcrispr.html)对目标基因打靶位点进行设计,根据所设计的靶点序列(TTTCGCACCGCTCCATTATC,SEQ ID NO:2)设计gRNA引物:
上游引物gRNA-299780-F:5’-GATAATGGAGCGGTGCGAAAGTTTTAGAGCTAGAAATAGC-3’(SEQ ID NO:3)
下游引物gRNA-R:5’-AACTTGACATCCCCATTTAC-3’(SEQ ID NO:4)
②操作方法参考实施例1中(2)的②-⑥步骤,得到pSAG1-Cas9-TgU6-sg299780质粒备用。
(3)α-299780-5UTR::DHFR::α-299780-3UTR同源模板的制备
①根据拟敲除基因的Gene ID在ToxoDB上确定该基因所在的locus,通过其所在的基因组序列确定5’同源臂(α-299780 -5UTR)和3’同源臂(α-299780 -3UTR);
②根据多片段无缝连接试剂盒说明书中所介绍的方法设计5’同源臂,3’同源臂,DHFR药物筛选标签,pUC19载体的无缝连接扩增引物;
③根据设计的引物(表2),用高保真酶(Phanta)分别从弓形虫ME49基因组DNA中扩增获得5’同源臂和3’同源臂片段,从带DHFR的质粒(购自http://www.addgene.org)中扩增获得DHFR片段,利用所设计的特异性引物线性化pUC19载体(购自http://www.addgene.org),分别对上述目的片段进行回收,并利用NanoDrop2000测定回收产物浓度;
表2.构建p299780-5UTR::DHFR::299780-3UTR质粒所使用的引物
④根据回收产物的浓度配制如下反应体系:
充分混匀后,37℃反应30min,冰上放置5min;
⑤将10μL连接产物全部转化入DH5α(100μL)感受态细胞中,涂LB/Amp平板,37℃倒置培养过夜;挑取单菌落置于含5ml LB/Amp液体培养基的无菌PV玻璃瓶中,37℃/180rpm振荡培养10h至菌液浑浊;分别利用M13正向和反向引物进行测序分析,若测序结果正确即可认为p299780-5UTR::DHFR::299780-3UTR质粒构建成功,遂将鉴定正确的菌液进行质粒提取,-20℃保存,该正确质粒的图谱如图3所示。
⑥利用高保真酶对目的片段α-299780 -5UTR::DHFR::α-299780 -3UTR进行PCR扩增,扩增模板为p299780-5UTR::DHFR::299780-3UTR质粒,扩增引物为U5α-299780-F上游引物和U3α-299780-R下游引物,对目的片段进行切胶回收并测定浓度、备用。
(4)弓形虫基因敲除虫株ME49Δ299780的获得
①参考实施例1,(4)中的步骤①-⑥,将步骤(2)中pSAG1-Cas9-TgU6-sg299780质粒和步骤(3)中α-299780-5UTR::DHFR::α-299780-3UTR同源模板电转进入弓形虫ME49虫株中,使用乙胺嘧啶对库进行药物筛选。
②在经过3-5代药物筛选后,将虫体置于含有宿主细胞的96孔板中进行单克隆筛选(接2块96孔板),每孔接种2个(计算量)速殖子;剩余虫子可进行基因组DNA的提取(基因组提取方法参照基因组DNA提取试剂盒操作说明进行),并利用(表3)引物检测同源臂整合效率和基因敲除效率,PCR1有条带说明299780的5’同源臂整合入弓形虫基因组中,PCR2有条带说明299780的3’同源臂整合入弓形虫基因组中,PCR3条带检测敲除基因299780是否还在基因组中,若对照组ME49有PCR3条带,而转染实验组无PCR3条带,则说明299780被成功敲除。
表3.ME49Δ299780单克隆虫株的PCR鉴定引物
③在96孔板中培养12天后观察是否存在单克隆,利用无菌枪头将含有单克隆的宿主细胞从孔内刮下,加入到含有宿主细胞的24孔板中,继续培养;当24孔板中有70%的宿主细胞被裂解时,即可将孔内的虫子150μL传到新的24孔板中培养,其余的用于DNA提取以鉴定克隆;
④利用PCR1,PCR2和PCR3对挑选的单克隆虫株进行检测,若PCR1和PCR2有特异性条带而PCR3无目的带说明该单克隆虫株为基因敲除虫株ME49Δ299780;将确定为ME49Δ299780的虫株继续扩大培养至T25培养瓶;对T25培养瓶中的基因敲除虫株再次进行PCR1,PCR2和PCR3检测,PCR反应体系如下,若仍为敲除表型即可在扩大后进行冻存。
在灭菌PCR管中配制如下反应体系:
PCR反应条件如下:
⑤PCR产物鉴定:扩增完成后,取PCR产物10μL,加1μL的10×核酸上样缓冲液混匀,点样,1.0%琼脂糖凝胶,1×TAE缓冲液,120V,电泳20分钟,凝胶成像系统观察,PCR鉴定结果如图4所示,表示ME49Δ299780的单克隆虫株构建成功。
实施例3弓形虫ME49Δ299780虫株的用途
(1)基因敲除虫株ME49Δ299780稀释注射液
①稀释注射液配方
②稀释注射液制作方法:
磁力搅拌器混匀10min,0.22μm滤器过滤除菌。
(2)ME49Δ299780敲除株对小鼠的毒力实验
①使用HFF细胞体外培养弓形虫速殖子,待有30-50%虫体逸出细胞;弃掉原培养瓶中的培养基,用PBS洗去已逸出的虫体和残留的培养基,加入新鲜不含FBS的稀释液。
②用一次性细胞刮将细胞刮下,5ml注射器反复吹打悬液8-10次,使纳虫泡破裂,虫体逸出,用无菌的3μm孔径滤膜过滤纯化虫体;用细胞计数板对虫体悬液进行计数、稀释。
③按照100个虫体/小鼠,腹腔接种6周龄雌性ICR小鼠,每组接10只,每天记录小鼠的存活情况,30天后对结果进行统计,结果如图5。从实验结果可以看出,接种ME49Δ299780敲除株的小鼠30天内没有小鼠死亡,存活率100%,而接种野生型ME49的小鼠30天内有60%死亡,说明ME49Δ299780敲除株的毒力远低于出发虫株。
(3)小鼠腹水中ME49Δ299780敲除虫体荷虫量实验
分别向不同组6周龄雌性ICR小鼠,按照每组每只接种1×10
将5ml生理盐水注入空白ICR小鼠,然后取出,形成阴性对照液,以0、10、10
表4.ME49Δ299780的荷虫量qPCR引物
在Hard-shell-PCR-Plates 96孔板中配制如下反应体系:
PCR反应条件如下:
qPCR结果如图6所示,接种ME49Δ299780敲除虫株小鼠腹水荷虫量显著低于野生型ME49的对照组小鼠腹水荷虫量,说明弓形虫ME49Δ299780在小鼠体内无明显繁殖,可以被宿主有效清除。
(4)ME49Δ299780敲除株对小鼠的免疫保护力实验
以1×10
观察、记录小鼠死亡情况,30天后统计小鼠死亡率。免疫实验结果如图7,RH对照组小鼠在感染后30天内全部死亡,ME49对照组小鼠在30天内仅有20%存活,经ME49Δ299780免疫过的小鼠再次感染高剂量RH或ME49野生型虫株,在30天后可全部存活。说明ME49Δ299780虫株对小鼠抵抗野生株毒力具有良好的保护力,有成为基因工程疫苗的潜力。
