抗SIGLEC-9抗体及其使用方法
文献发布时间:2023-06-19 19:30:30
本申请是申请日为2016年10月28日、申请号为201680076417.3、发明名称为“抗SIGLEC-9抗体及其使用方法”的发明专利申请的分案申请。
相关申请的交叉引用
本申请要求2015年10月29日提交的美国临时申请号62/248,231的权益,所述申请特此以引用的方式整体并入。
呈ASCII文本文件形式的序列表的提交
呈ASCII文本文件形式的以下提交的内容以引用的方式整体并入本文:序列表的计算机可读形式(CRF)(文件名:735022001040SEQLISTING.TXT,记录日期:2016年10月28日,大小:197KB)。
发明领域
本公开涉及抗Siglec-9抗体以及此类抗体的治疗用途。
发明背景
结合唾液酸的Ig样凝集素-9(Siglec-9)是在免疫和造血细胞上表达的1型免疫球蛋白样跨膜蛋白,所述免疫和造血细胞包括未成熟的和成熟的骨髓细胞如单核细胞、巨噬细胞、树突细胞、嗜中性粒细胞和小神经胶质细胞,以及淋巴细胞如天然杀伤细胞和T细胞亚群(Crocker等人(2007)Nat Rev Immunol.7:255–266;O’Reilly和Paulson(2009)Trendsin Pharm.Sci.30:5:240-248;以及Macauley等人(2014)Nat.Rev.Imm.14:653-666)。Siglec-9是结合糖蛋白和糖脂的唾液酸残基的凝集素的Siglec家族的成员。Siglec蛋白的一种潜在结合靶标是神经节苷脂;即由与唾液酸化聚糖连接的神经酰胺组成的糖脂。大多数神经节苷脂共有共同的乳-神经酰胺核心和一个或多个唾液酸残基。Siglec配体的多样性通过在不同键联(支链或末端)中添加其它中性糖和唾液酸以及唾液酸本身的修饰而产生。
已经在人类中鉴定了14种Siglec蛋白并且在小鼠中鉴定了9种Siglec蛋白,所述Siglec蛋白由包括氨基末端V-组结构域的2-17个细胞外Ig结构域组成,所述V-组结构域含有唾液酸结合位点。唾液酸结合区位于V-组Ig-样结构域上,所述结构域含有在所有Siglec中高度保守的两个芳族残基和一个精氨酸的基序(Crocker等人(2007)Nat RevImmunol.7:255–266;McMillan和Crocker(2008)Carbohydr Res.343:2050–2056;VonGunten和Bochner(2008)Ann NY Acad Sci.1143:61–82;May等人(1998)Mol Cell.1:719–728;Crocker等人(1999)Biochem J.341:355–361;以及Crocker和Varki(2001)TrendsImmunol.2:337–342)。与唾液酸化配体的结合位点已经通过有或无结合的配体的晶体结构作图(Attrill等人,(2006)J.Biol.Chem.281 32774-32783;Alphey等人(2003)J.Biol.Chem.278:5 3372-3377;Varki等人,Glycobiology,16第1R–27R页;以及May等人(1998)Mol.Cell1:5:719-728)。由于细胞膜富含唾液酸,因此Siglec的配体结合可以顺式和反式形式发生,两者均影响它们的功能性质。每种Siglec对于结合在哺乳动物细胞的表面上发现的不同类型的唾液酸化聚糖均具有不同的偏好(Crocker等人(2007)Nat RevImmunol.7:255–266;以及Crocker等人(2007)Nat Rev Immunol.7:255–266)。包括Siglec-9在内的大多数Siglec蛋白在其胞质尾区中含有一条或多条基于免疫受体酪氨酸的抑制性基序(ITIM)序列,所述序列通过募集酪氨酸磷酸酶SHP1和SHP2而使所述Siglec蛋白能够充当免疫功能的抑制性受体和负调节子(Crocker等人(2007)Nat Rev Immunol.7:255–266;McMillan和Crocker(2008)Carbohydr Res.343:2050–2056;以及Von Gunten和Bochner(2008)Ann NY Acad Sci.1143:61–82)。某些Siglec在其细胞质尾中含有基于免疫受体酪氨酸的活化基序(ITAM)序列,所述序列通过预测的脾酪氨酸激酶(Syk)募集而使所述Siglec能够充当免疫功能的活化受体和正调节子(Macauley SM.等人,(2014)NatureReviews Immunology 14,653–666)。Siglec蛋白家族与多种人疾病相关,所述疾病包括自身免疫性、对感染的易感性、多种类型的癌症(包括淋巴瘤、白血病和急性骨髓性白血病)、全身性红斑狼疮、类风湿性关节炎、神经退行性病症、哮喘、过敏症、败血症、慢性阻塞性肺疾病、移植物抗宿主疾病、嗜酸性粒细胞增多症和骨质疏松症(Macauley SM.等人,(2014)Nature Reviews Immunology 14,653–666)。
在2000年从外周血单核细胞克隆了Siglec-9(Angata和Varki(2000)J.Biol.Chem.275:29:22127-22135),并在粒细胞和单核细胞上检测到选择性表达。独立组从HL-60(人早幼粒细胞白血病)细胞中分离Siglec-9,并证实在单核细胞、嗜中性粒细胞、NK细胞和一小部分T细胞上表达(Zhang等人(2000)J.Biol.Chem.275:2922121-22126)。
Siglec-9含有细胞外N-末端Ig样(免疫球蛋白样)V-型结构域、两个Ig样C2-组结构域以及两个共有ITIM基序(在其细胞质结构域中)。Siglec-9在COS细胞中的表达证明由末端α2-3或α2-6唾液酸键联介导的红细胞的唾液酸依赖性结合(Angata和Varki(2000)J.Biol.Chem.275:22127-22135,Zhang等人(2000)J.Biol.Chem.275:2922121-22126)。进一步证实,Siglec-9被内源性细胞唾液酸掩蔽并仅在唾液酸酶处理细胞时结合至外源性末端α2-3或α2-6唾液酸探针(Yamaji(2002)J.Biol.Chem.277:8 6324-6332)。通过将Siglec-7与Siglec-9区域交换,将Siglec-9的N-末端V-组Ig样结构域内的配体特异性映射至小区域Asn
Siglec-9通过酪氨酸激酶(可能是c-Src或Lck)进行Tyr-433和Tyr-456的磷酸化并且充当抑制性受体(Avril等人,(2004)J.Imm.173:6841-6849)。在ITIM结构域中近端Tyr-433上磷酸化后,Siglec-9结合SHP-2/PTPN11和SHP-1/PTPN6。由于突变不会排除Siglec-9的酪氨酸磷酸化或抑制功能,所以膜远端ITIM基序看起来不显著贡献。已显示Siglec-9抑制大鼠嗜碱性白血病细胞中的FcεRI介导的活性,其先前已用于表征称为KIR(杀伤细胞Ig样受体)的NK细胞上表达的抑制性受体类别(杀伤细胞Ig样受体)(Avril等人,(2004)J.Imm.173:6841-6849)。磷酸酶活性另外与以下各项相关:细胞内钙动员减少和对多种蛋白质的酪氨酸磷酸化减少(Ulyanova,T.等人,(1999)Eur J lmmunol 29,3440-3449;Paul,S.P.等人,(2000).Blood 96,483-490)以及与信号转导和免疫应答的阻断,部分是通过相邻活化受体上的信号传导分子的去磷酸化,包括含有ITAM基序的那些、模式识别受体、Toll样受体和损伤相关分子模式(DAMP)受体。已经提出含有ITIM的Siglec受体与活化受体之间的缔合可由结合并桥接这些受体的细胞外配体介导(Macauley SM.等人,(2014)Nature Reviews Immunology 14,653–666)。
一些但并非所有的Siglec配体诱导受体下调(Macauley SM.等人,(2014)NatureReviews Immunology 14,653–666)。已经对酪氨酸激酶受体(Monsonego-Oran等人,(2002)Febs letters 528,83-89;和Fasen等人,(2008)Cell&Molecular Biology 9.251-266)以及类固醇受体(Callige等人,(2005)Mol.Cell.Biol.25.4349-4358;和Pollenz等人,(2006)Chemico-Biological Interactions.164.49-59)报道了配体诱导的受体降解。Siglec-9被认为是在急性骨髓性白血病(AML)细胞中组成性再生的,且已显示其介导这些细胞上的抗Siglec-9单克隆抗体的快速内吞作用(Biedermann等人(2007)Leuk.Res.31:2:211-220)。然而,在AML或正常原代免疫细胞中没有报道Siglec-9的细胞水平降低。同样,在任何类型的原代细胞中都没有报道受体再生或抗体依赖性受体下调。根据在过表达系统中进行的突变分析,Siglec-9在细胞表面上的表达部分取决于膜近端ITIM基序,但不取决于远端基序(Biedermann等人(2007)Leuk.Res.31:2:211-220)。
Siglec-9已被描述为对细胞因子产生具有免疫调节作用。已显示Siglec-9在巨噬细胞系中的过表达和伴随的TLR刺激与促炎性细胞因子TNF-α和IL-6的产生减少以及IL-10的上调相关(Ando等人(2008)Biochem.And Biophys.Res.Comm.369:878-883)。还已经显示肿瘤产生的粘蛋白与Siglec-9以及未成熟的DC结合(Ohta等人(2010)Biochem.andBiophys.Res.Comm.402:663-669)。在LPS和粘蛋白存在下,未成熟的DC产生较少IL-12,但维持IL-10产生。这表明Siglec-9将细胞因子产生从促炎性倾向于抗炎性,从而维持免疫耐受状态,而不是清除有害病原体、癌症或其他病理。
Siglec-9的抑制作用已在自然杀伤细胞的功能和淋巴细胞如T细胞和嗜中性粒细胞的调节方面进一步表征(Crocker等人,(2012)Ann.N Y Acad.Sci.1253,102–111;Pillai等人,(2012)Annu.Rev.Immunol.30,357–392;von Gunten和Bochner(2008)Ann.N YAcad.Sci.1143,61–82;Jandus等人(2014)J.Clin.Invest.124(4)1810-1820;Ikehara等人(2004)J.Biol.Chem.279:41 43117-43125;以及von Gunten等人(2005)Blood 106(4)1423-1431)。对天然杀伤细胞的功能研究已经证明表达Siglec-9结合唾液酸配体的肿瘤细胞抑制NK细胞活化和肿瘤细胞杀伤。许多人肿瘤稳健地上调结合Siglec-9的唾液酸配体,这使得能够免疫逃避和癌症进展(Jandus等人(2014)J.Clinic.Invest.124:4:1810-1820)。认为肿瘤上的唾液酸上调促进强烈抑制天然杀伤细胞免疫监视的“超自我”状态(Macauley和Paulson(2014)Nat.Chem.Biol.10:1:7-8)。在淋巴谱系细胞中,Siglec-9已显示经由ITIM酪氨酸磷酸化和SHP-1结合负调控T细胞受体信号传导。下游TCR信号传导分子ZAP-70显示对Tyr
Siglec-9的鼠同系物是Siglec-E,它是53%相似的。显示Siglec-E以唾液酸依赖性方式结合人红细胞,并且在功能上类似于Siglec-9,经由ITIM募集SHP-1和SHP-2以介导免疫细胞中的抑制性信号传导(Yu等人Biochem.J.(2001)353,483–492)。在小鼠中,Siglec-E的遗传失活不会导致明显的发育、组织学或行为异常;并且Siglec-E缺陷型小鼠正常繁殖,从而表明Siglec-E不是必需基因并且其功能可能限于先天免疫(McMillan等人(2013)Blood 121:11:2084-2094)。在用气溶胶LPS激发Siglec-E缺陷型小鼠后,展示肺中嗜中性粒细胞募集增加,这可通过阻断β2-整联蛋白CD11b而逆转。Siglec-E缺陷型嗜中性粒细胞显示以CD11b依赖性方式增加Syk和p38 MAPK的磷酸化。这表明Siglec-E在急性肺部炎症模型中遏制嗜中性粒细胞募集(McMillan等人(2013)Blood 121:11:2084-2094)。在同源癌症模型中,来自Siglec-E缺陷型小鼠的嗜中性粒细胞增强了离体肿瘤细胞杀伤,并表现出增加的ROS产生和诱导凋亡的配体如TRAIL和FasL(Laubli等人(2014)PNAS 111(39)14211–14216)。
在肿瘤学中,Siglec-9被认为是急性骨髓性白血病的治疗靶标,因为它在原发性AML细胞上表达,但在许多患者骨髓样品上的祖细胞中缺少(Biedermann等人(2007)Leuk.Res.31:2:211-220)。在实体癌中,上皮肿瘤细胞产生结合Siglec-9的重度糖基化粘蛋白,从而表明阻断增加的配体相互作用将是治疗上有益的(Ohta等人(2010)Biochem.andBiophys.Res.Comm.402:663-669;Belisle等人(2010)Mol.Cancer 9:118)。此外,在结直肠癌、乳腺癌、卵巢癌、非小细胞肺癌和前列腺癌的组织切片中发现了Siglec-9配体和肿瘤浸润性Siglec-9
近来有人提出,在癌细胞上表达的唾液酸糖蛋白经由Siglec-9结合将“活化”信号转导到肿瘤细胞中,从而导致粘着斑激酶(FAK)的降解和增加的细胞运动性和侵袭(Sabit等人(2013)J.Biol.Chem.288(49):35417-35427)。这些结果表明,Siglec-9-唾液酸基配体相互作用不仅有助于对免疫系统的许多细胞类型的抑制作用,而且还可经由直接作用于癌细胞来增强肿瘤转移。
已经在例如WO2007049044、US8394382、EP1954318和US20130302317中描述了针对Siglec-9的抗体。然而,没有报道降低Siglec-9的细胞水平或破坏Siglec-9与其一种或多种配体之间的相互作用的抗体。
因此,需要特异性地结合Siglec-9并降低细胞表面上的Siglec-9表达、减少Siglec-9与一种或多种Siglec-9配体之间的相互作用和/或降低一种或多种Siglec-9活性的治疗性抗体以便治疗与不希望的Siglec-9活性相关的一种或多种疾病、病症和病况。
本文所引用的所有参考文献(包括专利、专利申请和公布)均特此以引用的方式整体并入。
发明概述
本公开总体上涉及Siglec-9药剂,诸如抗Siglec-9抗体,以及使用此类Siglec-9药剂的方法。本文提供的方法可用于预防患有以下疾病的个体、降低所述个体的风险或治疗所述个体:痴呆、额颞叶痴呆、阿尔茨海默氏病(Alzheimer’s disease)、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病(Creutzfeldt-Jakob disease)、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病(Huntington’s disease)、tau蛋白病(taupathy disease)、那须哈科拉病(Nasu-Hakola disease)、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病(Crohn’s disease)、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病(Behcet's disease)、帕金森氏病(Parkinson's disease)、路易体痴呆(dementia with Lewy bodies)、多系统萎缩症、夏伊-德拉戈综合征(Shy-Drager syndrome)、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病(Paget's disease of bone)、实体癌和血癌、膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤(non-Hodgkin's lymphoma)、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9和/或Siglec-9配体的肿瘤、甲状腺癌、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染(Cruzi infection)、铜绿假单胞菌(Pseudomonas aeruginosa)感染、杜氏利什曼(Leishmania donovani)原虫感染、B族链球菌(group B Streptococcus)感染、空肠弯曲杆菌(Campylobacter jejuni)感染、脑膜炎奈瑟氏菌(Neisseria meningiditis)感染、I型HIV以及流感嗜血杆菌(Haemophilusinfluenza)。本文提供的方法还可用于诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖。本文提供的方法进一步用于降低以下各项的活性、功能性或存活:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、嗜中性粒细胞、天然杀伤(NK)细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、嗜中性粒细胞、NK细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞或慢性骨髓性白血病(CML)细胞。本文提供的方法还适用于降低Siglec-9的细胞水平。
本公开的某些方面至少部分地基于鉴定能够降低人原代免疫细胞和表达Siglec-9的细胞系上Siglec-9的细胞表面水平和/或能够抑制Siglec-9配体与Siglec-9的结合的抗Siglec-9抗体(参见例如实施例3-5)。
因此,本公开的某些方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体降低Siglec-9的细胞水平。在一些实施方案中,所述抗Siglec-9抗体降低Siglec-9的细胞水平而不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。在一些实施方案中,所述抗体进一步抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。本公开的其它方面涉及一种分离的(例如单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体降低Siglec-9的细胞水平并抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。
在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体降低Siglec-9的细胞表面水平、降低Siglec-9的细胞内水平、降低Siglec-9的总水平或其任何组合。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9降解、Siglec-9裂解、Siglec-9内化、Siglec-9脱落、Siglec-9表达的下调或其任何组合。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗体降低体内Siglec-9的细胞水平。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体抑制Siglec-9的细胞表面簇集。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体抑制一种或多种Siglec-9活性。在可与前述实施方案中的任一项组合的一些实施方案中,所述一种或多种Siglec-9活性选自由以下各项组成的组:(a)Siglec-9与一种或多种Siglec-9配体的结合,任选地其中所述一种或多种Siglec-9配体选自由以下各项组成的组:含唾液酸的糖蛋白、含唾液酸的糖脂以及其任何组合;(b)Siglec-9与SHP1或SHP2的结合;(c)由一种或多种SRC家族酪氨酸激酶诱导的Tyr-433、Tyr-456或两者的磷酸化,任选地,其中所述一种或多种SRC家族酪氨酸激酶选自由Syk、LCK、FYM和ZAP-70组成的组;(d)调节一种或多种促炎性细胞因子的表达,任选地其中所述一种或多种促炎性细胞因子选自FN-α4、IFN-β、IL-1β、IL-1α、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-33、MCP-1以及MIP-1-β;(e)调节一种或多种细胞中的一种或多种促炎性细胞因子的表达,所述一种或多种细胞选自由以下各项组成的组:巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;(f)调节一种或多种抗炎细胞因子的表达,任选地其中所述一种或多种抗炎细胞因子选自由以下各项组成的组:IL-4、IL-10、IL-13、IL-35、IL-16、TGF-β、IL-1Ra、G-CSF,以及TNF、IFN-β1a、IFN-β1b或IL-6的可溶性受体;(g)调节一种或多种细胞中的一种或多种抗炎细胞因子的表达,所述一种或多种细胞选自由以下各项组成的组:巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;(h)调节一种或多种选自由以下各项组成的组的蛋白质的表达:C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX、以及PYCARD;(i)抑制细胞外信号调控激酶(ERK)磷酸化;(j)降低一种或多种细胞蛋白上的酪氨酸磷酸化,任选地,其中所述一种或多种细胞蛋白包含ZAP-70并且所述酪氨酸磷酸化发生在ZAP-70的Tyr-319上;(k)调节C-C趋化因子受体7(CCR7)的表达;(l)抑制针对表达CCL19的细胞和表达CCL21的细胞的小神经胶质细胞趋化性;(m)减少由一种或多种细胞诱导的T细胞增殖,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞、M2小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞以及M2 NK细胞;(n)抑制破骨细胞产生,降低破骨细胞生成速率或两者;(o)降低一种或多种细胞的存活,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;(p)降低一种或多种细胞的增殖,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;(q)抑制一种或多种细胞的迁移,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;(r)抑制一种或多种细胞的一种或多种功能,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;(s)抑制一种或多种细胞的成熟,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;(t)抑制一种或多种类型的清除,所述清除选自由以下各项组成的组:凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除以及肿瘤细胞清除;任选地,其中所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自选自由以下各项组成的组的癌症:膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;(u)抑制以下中的一种或多种的吞噬作用:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞;任选地其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自由以下各项组成的组:膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤或甲状腺癌;(v)与肿瘤细胞上的Siglec-9配体结合;(w)与细胞上的Siglec-9配体结合,所述细胞选自由以下各项组成的组:嗜中性粒细胞、树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞以及NK细胞;(x)通过以下中的一种或多种抑制肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;(y)抑制以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;(z)抑制以下中的一种或多种的抗肿瘤细胞转移活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;(aa)抑制一种或多种含ITAM基序的受体,任选地其中所述一种或多种含ITAM基序的受体选自由以下各项组成的组:TREM1、TREM2、Sirpβ、FcgR、DAP10以及DAP12;(bb)通过一种或多种模式识别受体(PRR)抑制信号传导,任选地其中所述一种或多种PRR选自由以下各项组成的组:鉴定病原体相关分子模式(PAMP)的受体、鉴定损伤相关分子模式(DAMP)的受体以及其任何组合;(cc)抑制包含基序D/Ex
在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合不连续的Siglec-9表位。在可与前述实施方案中的任一项组合的一些实施方案中,所述不连续的Siglec-9表位包含两种或更多种肽、三种或更多种肽、四种或更多种肽、五种或更多种肽、六种或更多种肽、七种或更多种肽、八种或更多种肽、九种或更多种肽或10种或更多种肽。在可与前述实施方案中的任一项组合的一些实施方案中,所述肽各自包含SEQ IDNO:1的氨基酸序列的5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个或20个或更多个氨基酸残基;或对应于SEQ ID NO:1的氨基酸序列的哺乳动物Siglec-9蛋白上的5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个或20个或更多个氨基酸残基。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至Siglec-9的构象表位。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347内的一个或多个氨基酸;或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至选自由以下各项组成的组的氨基酸残基内的一个或多个氨基酸:i.SEQ ID NO:1的氨基酸残基62-76,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76的氨基酸残基;ii.SEQID NO:1的氨基酸残基62-76和86-92,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基;iii.SEQ ID NO:1的氨基酸残基86-92,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-92的氨基酸残基;iv.SEQ ID NO:1的氨基酸残基86-96,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96的氨基酸残基;v.SEQ ID NO:1的氨基酸残基86-96和105-116,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基;vi.SEQ ID NO:1的氨基酸残基105-116,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基105-116的氨基酸残基;vii.SEQ ID NO:1的氨基酸残基107-115,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基107-115的氨基酸残基;以及viii.SEQ ID NO:1的氨基酸残基185-194,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQID NO:1的氨基酸残基62-76内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基62-76和86-92内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-92内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-92的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-96内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-96和105-116内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基105-116内或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基105-116的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基107-115内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基107-115的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基185-194内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基内的一个或多个氨基酸。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体结合至一个或多个选自由以下各项组成的组的氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194,或哺乳动物Siglec-7蛋白上对应于选自由以下各项组成的组的氨基酸残基的一个或多个氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体与选自由2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合组成的组的一种或多种抗体竞争结合至Siglec-9。
在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域、所述重链可变结构域或两者包含至少一个、两个、三个、四个、五个或六个HVR,所述HVR选自单克隆抗体的HVR-L1、HVR-L2、HVR-L3、HVR-H1、HVR-H2以及HVR-H3,所述单克隆抗体选自由以下各项组成的组:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2。在可与前述实施方案中的任一项组合的一些实施方案中:(a)所述HVR-L1包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列;或(b)所述HVR-L2包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列;或(c)所述HVR-L3包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列;或(d)所述HVR-H1包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列;或(e)所述HVR-H2包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列;或(f)所述HVR-H3包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列。在可与前述实施方案中的任一项组合的一些实施方案中:(a)所述HVR-L1包含SEQ ID NO:6的氨基酸序列,所述HVR-L2包含SEQ ID NO:10的氨基酸序列,所述HVR-L3包含SEQ ID NO:14的氨基酸序列,所述HVR-H1包含SEQ ID NO:19的氨基酸序列,所述HVR-H2包含SEQ ID NO:22的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:26的氨基酸序列;或(b)所述HVR-L1包含SEQ ID NO:7的氨基酸序列,所述HVR-L2包含SEQ ID NO:11的氨基酸序列,所述HVR-L3包含SEQ ID NO:15的氨基酸序列,所述HVR-H1包含SEQ ID NO:20的氨基酸序列,所述HVR-H2包含SEQ ID NO:23的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:27的氨基酸序列;或(c)所述HVR-L1包含SEQ IDNO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ IDNO:16的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ IDNO:24的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:28的氨基酸序列;或(d)所述HVR-L1包含SEQ ID NO:9的氨基酸序列,所述HVR-L2包含SEQ ID NO:13的氨基酸序列,所述HVR-L3包含SEQ ID NO:17的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:25的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:29的氨基酸序列;或(e)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:18的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:28的氨基酸序列;或(f)所述HVR-L1包含SEQ ID NO:172的氨基酸序列,所述HVR-L2包含SEQ IDNO:174的氨基酸序列,所述HVR-L3包含SEQ ID NO:176的氨基酸序列,所述HVR-H1包含SEQID NO:178的氨基酸序列,所述HVR-H2包含SEQ ID NO:180的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:182的氨基酸序列;或(g)所述HVR-L1包含SEQ ID NO:173的氨基酸序列,所述HVR-L2包含SEQ ID NO:175的氨基酸序列,所述HVR-L3包含SEQ ID NO:177的氨基酸序列,所述HVR-H1包含SEQ ID NO:179的氨基酸序列,所述HVR-H2包含SEQ ID NO:181的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:183的氨基酸序列。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:6的氨基酸序列的HVR-L1、包含SEQ ID NO:10的氨基酸序列的HVR-L2以及包含SEQ ID NO:14的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:19的氨基酸序列的HVR-H1、包含SEQ ID NO:22的氨基酸序列的HVR-H2以及包含SEQ ID NO:26的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:7的氨基酸序列的HVR-L1、包含SEQ ID NO:11的氨基酸序列的HVR-L2以及包含SEQ ID NO:15的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:20的氨基酸序列的HVR-H1、包含SEQ ID NO:23的氨基酸序列的HVR-H2以及包含SEQ ID NO:27的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:8的氨基酸序列的HVR-L1、包含SEQ ID NO:12的氨基酸序列的HVR-L2以及包含SEQ ID NO:16的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:24的氨基酸序列的HVR-H2以及包含SEQ ID NO:28的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:9的氨基酸序列的HVR-L1、包含SEQ ID NO:13的氨基酸序列的HVR-L2以及包含SEQ ID NO:17的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:25的氨基酸序列的HVR-H2以及包含SEQ ID NO:29的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:8的氨基酸序列的HVR-L1、包含SEQ ID NO:12的氨基酸序列的HVR-L2以及包含SEQ ID NO:18的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:24的氨基酸序列的HVR-H2以及包含SEQ ID NO:28的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:172的氨基酸序列的HVR-L1、包含SEQ IDNO:174的氨基酸序列的HVR-L2以及包含SEQ ID NO:176的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:178的氨基酸序列的HVR-H1、包含SEQ ID NO:180的氨基酸序列的HVR-H2以及包含SEQ ID NO:182的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:173的氨基酸序列的HVR-L1、包含SEQ ID NO:175的氨基酸序列的HVR-L2以及包含SEQ ID NO:177的氨基酸序列的HVR-L3,并且其中所述重链可变区包含:包含SEQ ID NO:179的氨基酸序列的HVR-H1、包含SEQ IDNO:181的氨基酸序列的HVR-H2以及包含SEQ ID NO:183的氨基酸序列的HVR-H3。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:(a)HVR-L1,其包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列,或与选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-L2,其包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列,或与选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-L3,其包含选自由SEQ IDNO:14-18、176和177组成的组的氨基酸序列,或与选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;并且其中所述重链可变结构域包含:(a)HVR-H1,其包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列,或与选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-H2,其包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列,或与选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-H3,其包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列,或与选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域,所述轻链可变结构域包含选自由SEQ ID NO:61-115和197-204组成的组的氨基酸序列;和/或重链可变结构域,所述重链可变结构域包含选自由SEQ IDNO:116-170和205-212组成的组的氨基酸序列。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中:(a)所述轻链可变结构域包含SEQ ID NO:61的氨基酸序列;并且所述重链可变结构域包含SEQ IDNO:116的氨基酸序列;或(b)所述轻链可变结构域包含SEQ ID NO:72的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:127的氨基酸序列;或(c)所述轻链可变结构域包含SEQID NO:83的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:138的氨基酸序列;或(d)所述轻链可变结构域包含SEQ ID NO:94的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:149的氨基酸序列;或(e)所述轻链可变结构域包含SEQ ID NO:105的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:160的氨基酸序列;或(f)所述轻链可变结构域包含SEQ ID NO:197的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:205的氨基酸序列;或(g)所述轻链可变结构域包含SEQ ID NO:201的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:210的氨基酸序列。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含选自由以下各项组成的组的单克隆抗体的轻链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2;和/或选自由以下各项组成的组的单克隆抗体的重链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。
本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347内的一个或多个氨基酸;或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至选自由以下各项组成的组的氨基酸残基内的一个或多个氨基酸:i.SEQ ID NO:1的氨基酸残基62-76,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76的氨基酸残基;ii.SEQ ID NO:1的氨基酸残基62-76和86-92,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基62-76和86-92的氨基酸残基;iii.SEQ ID NO:1的氨基酸残基86-92,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-92的氨基酸残基;iv.SEQID NO:1的氨基酸残基86-96,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96的氨基酸残基;v.SEQ ID NO:1的氨基酸残基86-96和105-116,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基;vi.SEQ ID NO:1的氨基酸残基105-116,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基105-116的氨基酸残基;vii.SEQ ID NO:1的氨基酸残基107-115,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基107-115的氨基酸残基;以及viii.SEQ ID NO:1的氨基酸残基185-194,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基62-76内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基62-76和86-92内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-92内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-92的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-96内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-96和105-116内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基105-116内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基105-116的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基107-115内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基107-115的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基185-194内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至一个或多个选自由以下各项组成的组的氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194,或哺乳动物Siglec-7蛋白上对应于选自由以下各项组成的组的氨基酸残基的一个或多个氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194。
本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基62-76内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基62-76和86-92内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-92内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-92的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-96内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基86-96和105-116内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基105-116内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基105-116的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基107-115内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基107-115的氨基酸残基内的一个或多个氨基酸。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基185-194内或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基内的一个或多个氨基酸。
本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域、所述重链可变结构域或两者包含至少一个、两个、三个、四个、五个或六个HVR,所述HVR选自单克隆抗体的HVR-L1、HVR-L2、HVR-L3、HVR-H1、HVR-H2以及HVR-H3,所述单克隆抗体选自由以下各项组成的组:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2。在一些实施方案中:(a)所述HVR-L1包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列;或(b)所述HVR-H2包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列;或(c)所述HVR-L3包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列;或(d)所述HVR-H1包含选自由SEQID NO:19-21、178和179组成的组的氨基酸序列;或(e)所述HVR-H2包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列;或(f)所述HVR-H3包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列。在一些实施方案中:(a)所述HVR-L1包含SEQ ID NO:6的氨基酸序列,所述HVR-L2包含SEQ ID NO:10的氨基酸序列,所述HVR-L3包含SEQ ID NO:14的氨基酸序列,所述HVR-H1包含SEQ ID NO:19的氨基酸序列,所述HVR-H2包含SEQ ID NO:22的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:26的氨基酸序列;或(b)所述HVR-L1包含SEQ ID NO:7的氨基酸序列,所述HVR-L2包含SEQ ID NO:11的氨基酸序列,所述HVR-L3包含SEQ ID NO:15的氨基酸序列,所述HVR-H1包含SEQ ID NO:20的氨基酸序列,所述HVR-H2包含SEQ ID NO:23的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:27的氨基酸序列;或(c)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:16的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:28的氨基酸序列;或(d)所述HVR-L1包含SEQ ID NO:9的氨基酸序列,所述HVR-L2包含SEQ ID NO:13的氨基酸序列,所述HVR-L3包含SEQ ID NO:17的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:25的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:29的氨基酸序列;或(e)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:18的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:28的氨基酸序列;或(f)所述HVR-L1包含SEQ ID NO:172的氨基酸序列,所述HVR-L2包含SEQ ID NO:174的氨基酸序列,所述HVR-L3包含SEQ ID NO:176的氨基酸序列,所述HVR-H1包含SEQ ID NO:178的氨基酸序列,所述HVR-H2包含SEQ ID NO:180的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:182的氨基酸序列;或(g)所述HVR-L1包含SEQID NO:173的氨基酸序列,所述HVR-L2包含SEQ ID NO:175的氨基酸序列,所述HVR-L3包含SEQ ID NO:177的氨基酸序列,所述HVR-H1包含SEQ ID NO:179的氨基酸序列,所述HVR-H2包含SEQ ID NO:181的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:183的氨基酸序列。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:6的氨基酸序列的HVR-L1、包含SEQ ID NO:10的氨基酸序列的HVR-L2以及包含SEQ ID NO:14的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:19的氨基酸序列的HVR-H1、包含SEQ ID NO:22的氨基酸序列的HVR-H2以及包含SEQ ID NO:26的氨基酸序列的HVR-H3。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ IDNO:7的氨基酸序列的HVR-L1、包含SEQ ID NO:11的氨基酸序列的HVR-L2以及包含SEQ IDNO:15的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:20的氨基酸序列的HVR-H1、包含SEQ ID NO:23的氨基酸序列的HVR-H2以及包含SEQ ID NO:27的氨基酸序列的HVR-H3。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:8的氨基酸序列的HVR-L1、包含SEQ ID NO:12的氨基酸序列的HVR-L2以及包含SEQ ID NO:16的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ IDNO:24的氨基酸序列的HVR-H2以及包含SEQ ID NO:28的氨基酸序列的HVR-H3。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:9的氨基酸序列的HVR-L1、包含SEQ ID NO:13的氨基酸序列的HVR-L2以及包含SEQ ID NO:17的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:25的氨基酸序列的HVR-H2以及包含SEQ ID NO:29的氨基酸序列的HVR-H3。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:8的氨基酸序列的HVR-L1、包含SEQ ID NO:12的氨基酸序列的HVR-L2以及包含SEQ ID NO:18的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:24的氨基酸序列的HVR-H2以及包含SEQ ID NO:28的氨基酸序列的HVR-H3。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:172的氨基酸序列的HVR-L1、包含SEQ ID NO:174的氨基酸序列的HVR-L2以及包含SEQ ID NO:176的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:178的氨基酸序列的HVR-H1、包含SEQ IDNO:180的氨基酸序列的HVR-H2以及包含SEQ ID NO:182的氨基酸序列的HVR-H3。在一些实施方案中,所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:173的氨基酸序列的HVR-L1、包含SEQ ID NO:175的氨基酸序列的HVR-L2以及包含SEQ ID NO:177的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:179的氨基酸序列的HVR-H1、包含SEQ ID NO:181的氨基酸序列的HVR-H2以及包含SEQ ID NO:183的氨基酸序列的HVR-H3。在一些实施方案中,所述轻链可变结构域包含:(a)HVR-L1,其包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列,或与选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-L2,其包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列,或与选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-L3,其包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列,或与选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;并且其中所述重链可变结构域包含:(a)HVR-H1,其包含选自由SEQ IDNO:19-21、178和179组成的组的氨基酸序列,或与选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-H2,其包含选自由SEQ IDNO:22-25、180和181组成的组的氨基酸序列,或与选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-H3,其包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列,或与选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列。
本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:6的氨基酸序列的HVR-L1、包含SEQ ID NO:10的氨基酸序列的HVR-L2以及包含SEQ ID NO:14的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:19的氨基酸序列的HVR-H1、包含SEQ ID NO:22的氨基酸序列的HVR-H2以及包含SEQ ID NO:26的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ IDNO:7的氨基酸序列的HVR-L1、包含SEQ ID NO:11的氨基酸序列的HVR-L2以及包含SEQ IDNO:15的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:20的氨基酸序列的HVR-H1、包含SEQ ID NO:23的氨基酸序列的HVR-H2以及包含SEQ ID NO:27的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:8的氨基酸序列的HVR-L1、包含SEQ ID NO:12的氨基酸序列的HVR-L2以及包含SEQ ID NO:16的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ IDNO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:24的氨基酸序列的HVR-H2以及包含SEQ IDNO:28的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:9的氨基酸序列的HVR-L1、包含SEQ ID NO:13的氨基酸序列的HVR-L2以及包含SEQ ID NO:17的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:25的氨基酸序列的HVR-H2以及包含SEQID NO:29的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:8的氨基酸序列的HVR-L1、包含SEQ ID NO:12的氨基酸序列的HVR-L2以及包含SEQ ID NO:18的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:21的氨基酸序列的HVR-H1、包含SEQ ID NO:24的氨基酸序列的HVR-H2以及包含SEQ ID NO:28的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:172的氨基酸序列的HVR-L1、包含SEQ ID NO:174的氨基酸序列的HVR-L2以及包含SEQ ID NO:176的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:178的氨基酸序列的HVR-H1、包含SEQ ID NO:180的氨基酸序列的HVR-H2以及包含SEQ ID NO:182的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:包含SEQ ID NO:173的氨基酸序列的HVR-L1、包含SEQ ID NO:175的氨基酸序列的HVR-L2以及包含SEQ ID NO:177的氨基酸序列的HVR-L3,并且其中所述重链可变结构域包含:包含SEQ ID NO:179的氨基酸序列的HVR-H1、包含SEQ ID NO:181的氨基酸序列的HVR-H2以及包含SEQ ID NO:183的氨基酸序列的HVR-H3。本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域,所述轻链可变结构域包含选自由SEQ ID NO:61-115和197-204组成的组的氨基酸序列;和/或重链可变结构域,所述重链可变结构域包含选自由SEQ ID NO:116-170和205-212组成的组的氨基酸序列。本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,并且其中:(a)所述轻链可变结构域包含SEQ ID NO:61的氨基酸序列;并且所述重链可变结构域包含SEQ IDNO:116的氨基酸序列;或(b)所述轻链可变结构域包含SEQ ID NO:72的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:127的氨基酸序列;或(c)所述轻链可变结构域包含SEQID NO:83的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:138的氨基酸序列;或(d)所述轻链可变结构域包含SEQ ID NO:94的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:149的氨基酸序列;或(e)所述轻链可变结构域包含SEQ ID NO:105的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:160的氨基酸序列;或(f)所述轻链可变结构域包含SEQ ID NO:197的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:205的氨基酸序列;或(g)所述轻链可变结构域包含SEQ ID NO:201的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:210的氨基酸序列。本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体包含选自由以下各项组成的组的单克隆抗体的轻链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2;和/或选自由以下各项组成的组的单克隆抗体的重链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体与选自由2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合组成的组的一种或多种抗体竞争结合至Siglec-9。本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,所述抗Siglec-9抗体与选自由以下各项组成的组的单克隆抗体结合实质上相同的Siglec-9表位:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。本公开的其它方面涉及一种分离的(例如,单克隆)抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:(a)HVR-L1,其包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列,或与选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-L2,其包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列,或与选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-L3,其包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列,或与选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;并且其中所述重链可变结构域包含:(a)HVR-H1,其包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列,或与选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-H2,其包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列,或与选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-H3,其包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列,或与选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列。
在可与前述实施方案中的任一项组合的一些实施方案中,所述抗体具有IgG类、IgM类或IgA类。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体具有IgG1、IgG2、IgG3或IgG4同种型。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗体结合抑制性Fc受体。在可与前述实施方案中的任一项组合的一些实施方案中,所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。在可与前述实施方案中的任一项组合的一些实施方案中:(a)所述抗Siglec-9抗体具有人或小鼠IgG1同种型,并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:N297A、D265A、D270A、L234A、L235A、G237A、P238D、L328E、E233D、G237D、H268D、P271G、A330R、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E、N297Q、P238S、P238A、A327Q、A327G、P329A、K322A、T394D以及其任何组合,其中所述残基的编号根据EU或Kabat编号,或包含在Fc区中在对应于甘氨酸236的位置处的氨基酸缺失;(b)所述抗Siglec-9抗体具有IgG1同种型并且包含IgG2同种型重链恒定结构域1(CH1)和铰链区,任选地其中所述IgG2同种型CH1和铰链区包含ASTKGPSVFP LAPCSRSTSE STAALGCLVKDYFPEPVTVS WNSGALTSGVHTFPAVLQSS GLYSLSSVVT VPSSNFGTQT YTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:171)的氨基酸序列,并且任选地其中所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中所述残基的编号根据EU编号;(c)所述抗Siglec-9抗体具有IgG2同种型并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:P238S、V234A、G237A、H268A、H268Q、V309L、A330S、P331S、C214S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E、H268E、N297A、N297Q、A330L以及其任何组合,其中所述残基的编号根据EU或Kabat编号;(d)所述抗Siglec-9抗体具有人或小鼠IgG4同种型并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E、E233P、F234V、L234A/F234A、S228P、S241P、L248E、T394D、N297A、N297Q、L235E以及其任何组合,其中所述残基的编号根据EU或Kabat编号;或(e)所述抗Siglec-9抗体具有杂合IgG2/4同种型,并且任选地其中所述抗体包含氨基酸序列,所述氨基酸序列包含人IgG2的氨基酸118至260和人IgG4的氨基酸261至447,其中所述残基的编号根据EU或Kabat编号。在可与前述实施方案中的任一项组合的一些实施方案中:(a)所述抗Siglec-9抗体具有人或小鼠IgG1同种型,并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:N297A、N297Q、D270A、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E以及其任何组合,其中所述残基的编号根据EU或Kabat编号;(b)所述抗Siglec-9抗体具有IgG2同种型并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:P238S、V234A、G237A、H268A、H268Q、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E以及其任何组合,其中所述残基的编号根据EU或Kabat编号;或(c)所述抗Siglec-9抗体具有IgG4同种型并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:E233P、F234V、L234A/F234A、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q以及其任何组合,其中所述残基的编号根据EU或Kabat编号。在可与前述实施方案中的任一项组合的一些实施方案中:(a)所述Fc区还包含在选自由A330L、L234F、L235E、P331S以及其任何组合组成的组的位置处的一种或多种另外的氨基酸取代,其中所述残基的编号根据EU或Kabat编号;(b)所述Fc区还包含在选自由M252Y、S254T、T256E以及其任何组合组成的组的位置处的一种或多种另外的氨基酸取代,其中所述残基的编号根据EU或Kabat编号;或(c)所述Fc区还包含根据EU或Kabat编号的S228P氨基酸取代。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗体具有IgG4同种型。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体包含在残基位置228处的S228P氨基酸取代,在残基位置234处的F234A氨基酸取代,以及在残基位置235处的L235A氨基酸取代,其中所述残基位置的编号根据EU或Kabat编号。在可与前述实施方案中的任一项组合的一些实施方案中,所述Siglec-9蛋白是哺乳动物蛋白或人蛋白。在可与前述实施方案中的任一项组合的一些实施方案中,所述Siglec-9蛋白是野生型蛋白。在可与前述实施方案中的任一项组合的一些实施方案中,所述Siglec-9蛋白是天然存在的变体。在可与前述实施方案中的任一项组合的一些实施方案中,所述Siglec-9蛋白在选自由以下各项组成的组的一种或多种细胞上表达:人树突细胞、人巨噬细胞、人嗜中性粒细胞、人NK细胞、人单核细胞、人破骨细胞、人T细胞、人T辅助细胞、人细胞毒性T细胞、人粒细胞以及人小神经胶质细胞。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体特异性地结合至哺乳动物Siglec-9蛋白、人Siglec-9蛋白或两者。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体以pH依赖性方式结合Siglec-9。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体在5.5至8.0范围内的pH下结合Siglec-9。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体在小于5.0的pH下从Siglec-9解离。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体是结合至包含人Siglec-9或哺乳动物Siglec-9蛋白上的氨基酸残基的表位的抗体片段。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体是与选自由以下各项组成的组的一种或多种人蛋白质结合的抗体片段:人Siglec-9、人Siglec-9的天然存在的变体和人Siglec-9的疾病变体。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗体片段与第二抗体片段交联,所述第二抗体片段与选自由以下各项组成的组的一种或多种人蛋白质结合:人Siglec-9、人Siglec-9的天然存在的变体和人Siglec-9的疾病变体。在可与前述实施方案中的任一项组合的一些实施方案中,所述片段是Fab、Fab'、Fab'-SH、F(ab')2、Fv或scFv片段。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体是鼠抗体。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体是人源化抗体、双特异性抗体、单克隆抗体、多价抗体、缀合抗体或嵌合抗体。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体是识别第一抗原和第二抗原的双特异性抗体。在可与前述实施方案中的任一项组合的一些实施方案中,所述第一抗原是Siglec-9,并且所述第二抗原是:(a)促进跨血脑屏障的转运的抗原;(b)选自由以下各项组成的组的促进跨血脑屏障的转运的抗原:转铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体、CRM197、美洲驼单结构域抗体、TMEM30(A)、蛋白质转导结构域、TAT、Syn-B、穿膜肽、聚精氨酸肽、血管肽以及ANG1005;(c)选自由致病肽或蛋白或致病核酸组成的组的致病因子,其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽;(d)在免疫细胞上表达的配体和/或蛋白质,其中所述配体和/或蛋白质选自由以下各项组成的组:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73以及磷脂酰丝氨酸;以及(e)在一种或多种肿瘤细胞上表达的蛋白质、脂质、多糖或糖脂。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体是缀合抗体。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体缀合至可检测标记、毒素或治疗剂。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体缀合至选自由以下各项组成的组的毒素:蓖麻毒素、蓖麻毒素A链、多柔比星、道诺霉素、类美登素、紫杉醇、溴化乙锭、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春花碱、秋水仙碱、二羟基炭疽菌素二酮、放线菌素、白喉毒素、假单胞菌外毒素(PE)A、PE40、相思豆毒素、相思豆毒素A链、蒴莲根毒素A链、α-八叠球菌素、白树毒素、丝林霉素(mitogellin)、局限曲菌素(retstrictocin)、酚霉素、伊诺霉素、麻疯树逆境蛋白、巴豆毒素、加利车霉素、肥皂草抑制剂、糖皮质激素、奥瑞斯他汀、金霉素(auromycin)、钇、铋、康普瑞汀(combrestatin)、倍癌霉素(duocarmycins)、多拉司他汀、cc1065以及顺铂。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体与一种或多种特异性地结合致病蛋白的抗体组合使用,所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,以及其任何组合;或与结合选自由以下各项组成的组的免疫调节蛋白的一种或多种抗体组合使用:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73、TREM1、TREM2、CD33、Siglec-5、Siglec-7、Siglec-11、磷脂酰丝氨酸、致病核酸、反义GGCCCC(G2C4)重复序列-扩增RNA以及其任何组合。在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体对于人Siglec-9和哺乳动物Siglec-9具有在约10nM至约10pM或小于10pM范围内的解离常数(K
本公开的其它方面涉及一种分离的核酸,所述分离的核酸包含编码前述实施方案中的任一项的抗Siglec-9抗体的核酸序列。本公开的其它方面涉及一种载体,所述载体包含前述实施方案中的任一项的核酸。本公开的其它方面涉及一种分离的宿主细胞,所述宿主细胞包含前述实施方案种的任一项的载体。本公开的其它方面涉及一种产生抗Siglec-9抗体的方法,所述方法包括培养前述实施方案中的任一项的宿主细胞,以使得产生抗Siglec-9抗体。在一些实施方案中,所述方法还包括回收由所述宿主细胞产生的抗Siglec-9抗体。本公开的其它方面涉及一种通过前述实施方案中的任一项的方法产生的分离的抗Siglec-9抗体。本公开的其它方面涉及一种药物组合物,所述药物组合物包含前述实施方案中的任一项的抗Siglec-9抗体和药学上可接受的载体。
本公开的其它方面涉及一种预防疾病、病症或损伤、降低疾病、病症或损伤的风险或治疗疾病、病症或损伤的方法,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病和癌症、膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、表达一种或多种Siglec-9配体的肿瘤、甲状腺癌、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV以及流感嗜血杆菌,所述方法包括向有需要的个体施用治疗有效量的药剂,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者。本公开的其它方面涉及一种用于预防疾病、病症或损伤、降低疾病、病症或损伤的风险或治疗疾病、病症或损伤的药剂,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病和癌症、膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、表达一种或多种Siglec-9配体的肿瘤、甲状腺癌、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV以及流感嗜血杆菌。本公开的其它方面涉及一种药剂在制造用于预防疾病、病症或损伤、降低疾病、病症或损伤的风险或治疗疾病、病症或损伤的药物中的用途,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病和癌症、膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、表达一种或多种Siglec-9配体的肿瘤、甲状腺癌、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV以及流感嗜血杆菌。本公开的其它方面涉及一种预防疾病、病症或损伤、降低疾病、病症或损伤的风险或治疗疾病、病症或损伤的方法,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、tau蛋白病、感染以及癌症,所述方法包括向有需要的个体施用治疗有效量的降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂。本公开的其它方面涉及一种用于预防疾病、病症或损伤、降低疾病、病症或损伤的风险或治疗疾病、病症或损伤的药剂,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、tau蛋白病、感染以及癌症。本公开的其它方面涉及一种药剂在制造用于预防疾病、病症或损伤、降低疾病、病症或损伤的风险或治疗疾病、病症或损伤的药物中的用途,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、tau蛋白病、感染以及癌症。在一些实施方案中,所述疾病、病症或损伤是癌症,并且其中所述药剂抑制一种或多种选自由以下各项组成的组的Siglec-9活性:(a)促进以下中的一种或多种的增殖、成熟、迁移、分化和/或功能性:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关抑制嗜中性粒细胞、肿瘤相关抑制NK细胞以及调控性T细胞;(b)增强以下中的一种或多种浸润到肿瘤中:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关抑制嗜中性粒细胞、肿瘤相关抑制NK细胞以及调控性T细胞;(c)增加肿瘤、外周血或其它淋巴器官中肿瘤促进骨髓细胞/粒细胞免疫抑制细胞的数量;(d)增强骨髓源性抑制细胞(MDSC)的肿瘤促进活性;(e)增加肿瘤或外周血液中肿瘤促进细胞因子的表达,任选地其中所述肿瘤促进细胞因子是TGF-β或IL-10;(f)增加肿瘤促进FoxP3+调控性T淋巴细胞的肿瘤浸润;(g)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的活化;(h)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的浸润;(i)增加以下中的一种或多种浸润到肿瘤中:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关嗜中性粒细胞、肿瘤相关NK细胞、非致瘤性CD45
本公开的其它方面涉及一种诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖的方法,所述方法包括向所述个体施用治疗有效量的降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂。本公开的其它方面涉及一种用于诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖的药剂,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者。本公开的其它方面涉及一种药剂在制造用于诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖的药物中的用途,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者。在一些实施方案中,所述一种或多种免疫细胞选自由以下各项组成的组:树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、小神经胶质细胞、T细胞、T辅助细胞、细胞毒性T细胞以及其任何组合。在一些实施方案中,所述药剂选自由以下各项组成的组:抗体、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、Siglec-9免疫粘附素、反义分子、siRNA、小分子抑制剂、蛋白质以及肽。在一些实施方案中,所述药剂是分离的抗Siglec-9抗体。在一些实施方案中,所述抗Siglec-9抗体是前述实施方案中的任一项的抗Siglec-9抗体。在一些实施方案中,所述一种或多种免疫细胞选自由以下各项组成的组:树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、小神经胶质细胞、T细胞、T辅助细胞、细胞毒性T细胞以及其任何组合。
本公开的其它方面涉及一种降低以下各项的活性、功能性或存活的方法:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞或慢性骨髓性白血病(CML)细胞,所述方法包括向所述个体施用治疗有效量的与Siglec-9结合或相互作用的试剂。本公开的其它方面涉及一种药剂用于降低以下各项的活性、功能性或存活的用途,所述药剂与Siglec-9结合或相互作用:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞或慢性骨髓性白血病(CML)细胞。本公开的其它方面涉及一种药剂在制造用于降低以下各项的活性、功能性或存活的药物中的用途,所述药剂与Siglec-9结合或相互作用:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞或慢性骨髓性白血病(CML)细胞。在一些实施方案中,所述药剂是分离的抗Siglec-9抗体或抗Siglec-9抗体缀合物。在一些实施方案中,所述抗Siglec-9抗体是前述实施方案中的任一项的抗Siglec-9抗体。
本公开的其它方面涉及一种降低有需要的个体中一种或多种细胞上的Siglec-9的细胞水平的方法,所述方法包括向所述个体施用治疗有效量的分离的抗Siglec-9抗体。本公开的其它方面涉及分离的抗Siglec-9抗体用于降低有需要的个体中一种或多种细胞上的Siglec-9的细胞水平的用途。本公开的其它方面涉及分离的抗Siglec-9抗体在制造用于降低有需要的个体中一种或多种细胞上的Siglec-9的细胞水平的药物中的用途。在一些实施方案中,所述抗Siglec-9抗体降低体内Siglec-9的细胞水平。在一些实施方案中,所述抗Siglec-9抗体是前述实施方案中的任一项的抗Siglec-9抗体。
在可与前述实施方案中的任一项组合的一些实施方案中,所述方法还包括向所述个体施用至少一种特异性地结合至抑制性检查点分子的抗体,和/或一种或多种标准或研究性抗癌疗法。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种特异性地结合至抑制性检查点分子的抗体与所述抗Siglec-9抗体组合施用。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种特异性地结合至抑制性检查点分子的抗体选自由以下各项组成的组:抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体和抗HVEM抗体、抗B-和T-淋巴细胞衰减子(BTLA)抗体、抗杀伤抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM-1抗体、抗TIM3抗体、抗TIM-4抗体、抗A2AR抗体、抗CD39抗体、抗CD73抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体、抗CD30抗体、抗TNFa抗体、抗CD33抗体、抗Siglec-5抗体、抗Siglec-7抗体、抗Siglec-11抗体、拮抗性抗TREM1抗体、拮抗性抗TREM2抗体、抗TIGIT抗体、抗VISTA抗体、抗CD2抗体、抗CD5抗体以及其任何组合。在可与前述实施方案中的任一项组合的一些实施方案中,所述一种或多种标准或研究性抗癌疗法选自由以下各项组成的组:放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼疗法、曲妥珠单抗疗法、依那西普疗法、过继细胞转移(ACT)疗法、嵌合抗原受体T细胞转移(CAR-T)疗法、疫苗疗法以及细胞因子疗法。在可与前述实施方案中的任一项组合的一些实施方案中,所述方法还包括向所述个体施用至少一种特异性地结合至抑制性细胞因子的抗体。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种特异性地结合至抑制性细胞因子的抗体与所述抗Siglec-9抗体组合施用。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种特异性地结合至抑制性细胞因子的抗体选自由以下各项组成的组:抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体以及其任何组合。在可与前述实施方案中的任一项组合的一些实施方案中,所述方法还包括向所述个体施用至少一种特异性地结合至刺激性检查点蛋白的激动性抗体。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体与所述抗Siglec-9抗体组合施用。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体选自由以下各项组成的组:激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动性抗TREM1抗体、激动性抗TREM2抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导的TNFR相关蛋白GITR抗体、激动剂抗CD30抗体、激动剂抗BTLA抗体、激动剂抗HVEM抗体、激动剂抗CD2抗体、激动剂抗CD5抗体以及其任何组合。在可与前述实施方案中的任一项组合的一些实施方案中,所述方法还包括向所述个体施用至少一种刺激下细胞因子。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种刺激细胞因子与所述抗Siglec-9抗体组合施用。在可与前述实施方案中的任一项组合的一些实施方案中,所述至少一种刺激性细胞因子选自由以下各项组成的组:IFN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、MCP-1、MIP-1-β以及其任何组合。
本公开的其它方面涉及一种评估有需要的受试者对与Siglec-9结合或相互作用的药剂的应答性的方法,所述方法包括:a.测量在向所述受试者施用抗Siglec-9抗体之前从所述受试者获得的血液样品中非致瘤性骨髓细胞上CD45
附图简述
图1A描绘人Siglec-9(SEQ ID NO:1)、黑猩猩Siglec-9(SEQ ID NO:2)、绿猴Siglec-9(SEQ ID NO:3)、猕猴Siglec-9(SEQ ID NO:4)以及小鼠Siglec-9(SEQ ID NO:5)之间的氨基酸序列比对。星号(“*”)表示具有单个完全保守的残基的位置;冒号(“:”)表示具有强相似性质的组之间的保守性-在Gonnet PAM 250矩阵中得分>0.5;并且句点(“.”)表示具有弱相似性质的组之间的保守性-在Gonnet PAM250矩阵中得分=<0.5。图1B描绘了本公开的抗体的野生型Siglec-9(%WT)与所示Siglec-9突变体的结合反应性(百分比)。图1C描绘Siglec-9的Phyre2源性模型(基于Siglec-5的晶体结构;PDB ID2ZG2),其指示参与抗Siglec-9抗体2D4的结合的氨基酸残基。用于结合的关键残基用红球体表示。图1D描绘Siglec-9的Phyre2源性模型(基于Siglec-5的晶体结构;PDB ID 2ZG2),其指示参与抗Siglec-9抗体5C6的结合的氨基酸残基。用于结合的关键残基用红球体表示。图1E描绘Siglec-9的Phyre2源性模型(基于Siglec-5的晶体结构;PDB ID 2ZG2),其指示参与抗Siglec-9抗体12B12的结合的氨基酸残基。用于结合的关键残基用红球体表示。
图2示出人Siglec蛋白如Siglec-9的聚糖结合特异性。此图示出最常被研究的唾液酸化聚糖的最常报道的特异性的总结。在每种Siglec的研究内的相对结合被表示为++,强结合;+,可检测的结合;以及–,非常弱或不可检测的结合。未示出最近报道的hSiglec-8和mSiglec-F对6'-硫酸化-唾液酸-路易斯x(sLex)以及hSiglec-9对6-硫酸化-sLex的强结合偏好。除少数例外情况(CD22和MAG)外,不同研究者使用不同测定对人Siglec进行的结合特异性研究的结果显著不同。除了测定形式和聚糖接头问题之外,所研究的配体的密度和排列可能是造成这种变化的原因(Varki等人,(2006)Glycobiol.16:1R-27R)。
图3示出哺乳动物脑中的双唾液酸神经节苷脂的结构和代谢。所述图中的双唾液酸神经节苷脂的命名遵循Svennerholm(1964)J.Lipid Res.5:145–155(Ariga T等人(2008)J.Lipid Res.49:1157-1175)的系统。
图4描绘显示人原代免疫细胞中的Siglec-9表达的FACS分析的结果。
图5描绘与同种型对照相比,Siglec-9抗体与人原代树突细胞的结合的FACS分析。
图6A描绘示出本公开的Siglec-9抗体与纯化的Siglec-9-his标记的蛋白的结合亲和力的Biacore传感图。图6B描绘示出本公开的Siglec-9抗体与纯化的Siglec-9-his标记的蛋白的结合亲和力的ForteBio传感图。图6C示出用于组合抗Siglec-9抗体5C6(AbMS9-5C6.3)的人源化型式的抗体轻链可变区(VL)序列的示意图。在每个序列下方列出了另外的变体。所述图包括人源化抗体5C6的型式的序列。在所述图中,IGKV230*01(SEQ ID NO:213);连接区(SEQ ID NO:214);5C6.3(SEQ ID NO:215);2-30*01(SEQ ID NO:216);h5C6.3-L1(SEQ ID NO:217);h5C6.3-L2(SEQ ID NO:218);h5C6.3-L3(SEQ ID NO:219)。图6D示出用于组合抗Siglec-9抗体5C6(AbM S9-5C6.3)的人源化型式的抗体重链可变区(VH)序列的示意图。在每个序列下方列出了另外的变型。所述图包括人源化抗体5C6的型式的序列。在所述图中,IGHV1-18*01(SEQ ID NO:220);连接区(SEQ ID NO:221);5C6.3(SEQ IDNO:222);1-18*01(SEQ ID NO:223);h5C6.3-H1(SEQ ID NO:224);h5C6.3-H2(SEQ ID NO:225);h5C6.3-H3(SEQ ID NO:226);h5C6.3-H4(SEQ ID NO:227)。图6E示出用于组合抗Siglec-9抗体12B12(AbM S9-12B12.2)的人源化型式的抗体轻链可变区(VL)序列的示意图。在每个序列下方列出了另外的变型。所述图包括人源化抗体12B12的型式的序列。在所述图中,IGKV1-39*01(SEQ ID NO:228);连接区(SEQ ID NO:229);12B12.2(SEQ ID NO:230);1-39*01(SEQ ID NO:231);h12B12.2-L1(SEQ ID NO:232);h12B12.2-L2(SEQ ID NO:233);h12B12.2-L3(SEQ ID NO:234)。图6F示出用于组合抗Siglec-9抗体12B12(AbM S9-12B12.2)的人源化型式的抗体重链可变区(VH)序列的示意图。在每个序列下方列出了另外的变型。所述图包括人源化抗体12B12的型式的序列。在所述图中,IGHV3-23*04(SEQ IDNO:235);连接区(SEQ ID NO:236);12B12.2(SEQ ID NO:237);3-23*04(SEQ ID NO:238);h12B12.2-H1(SEQ ID NO:239);h12B12.2-H2(SEQ ID NO:240)。对于图6C-6F,CDR序列以粗体描绘;残基编号显示为顺序的(seq)或根据Chothia;“b”是指隐藏的侧链;“p”是指部分隐藏;“i”是指在VH与VL结构域之间的界面处的侧链;星号(*)表示人与鼠种系之间的序列差异;在序列下方标出框架中的潜在额外突变;CDR序列中的潜在变化在每个CDR序列下方标出(此类变化可防止天冬酰胺(N)脱酰胺,色氨酸(W)氧化或异天冬氨酸(DG)形成)。
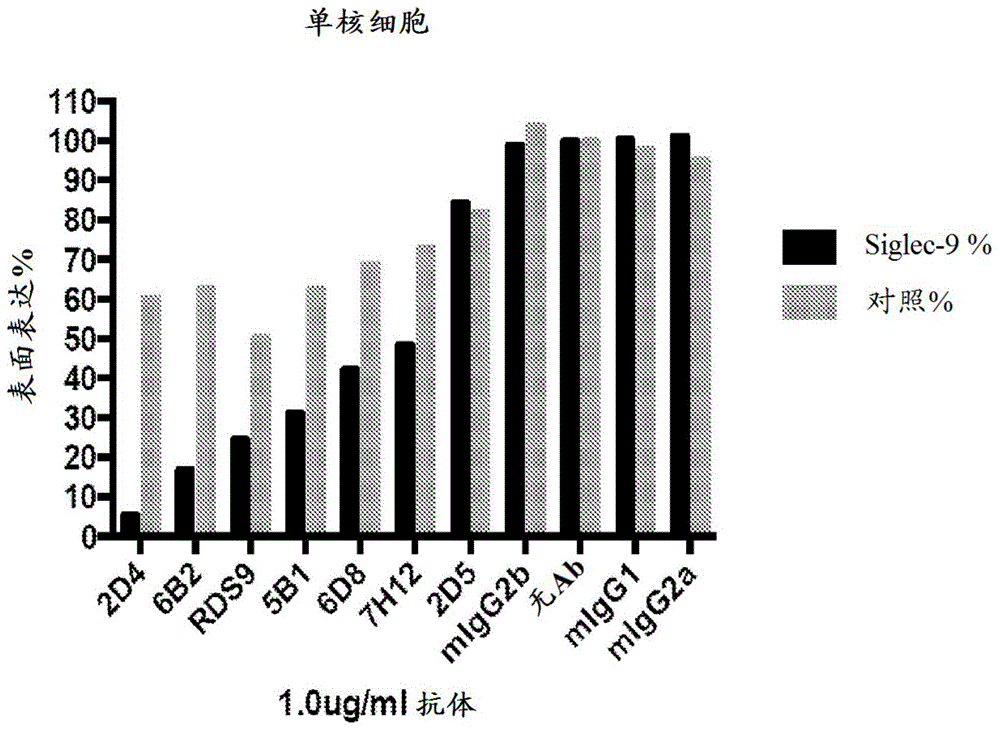
图7A-7H描绘在各种人细胞类型上细胞表面Siglec-9受体的Siglec-9抗体依赖性下调。图7A描绘THP-1急性单核细胞性淋巴瘤细胞。图7B描绘人原代单核细胞。图7C描绘人原代小神经胶质细胞。图7D描绘人原代巨噬细胞。图7E描绘人原代树突细胞。图7F描绘抗体与人原代树突细胞的滴定。图7G示出在体内抗体处理后Siglec-9的细胞表面水平的体内降低。图7H示出不相关的受体CD33的表达。使用CD33作为对照。在体内抗体处理后,CD33的细胞表面水平未显著降低。图7I描绘用Siglec-9抗体5C6(S9-5C6)、12B12(S9-12B12)、17C2(S9-17C2)和同种型对照(mIgG2a)降低人原代巨噬细胞上Siglec-9的细胞表面表达的抗体浓度滴定曲线。图7J描绘用Siglec-9抗体5C6(S9-5C6)、12B12(S9-12B12)、17C2(S9-17C2)和同种型对照(mIgG2a)降低人原代巨噬细胞上对照受体CD11b的细胞表面表达的抗体浓度滴定曲线。图7K描绘在用抗Siglec-9抗体2D4或同种型对照抗体(MOPC-21)处理21天后来自人源化NSG小鼠的外周骨髓细胞中的Siglec-9和CD33表达。图7L示出在体内抗体处理后Siglec-9的细胞表面水平的体内降低。图7M示出不相关的受体CD33的表达。使用CD33作为对照。在体内抗体处理后,CD33的细胞表面水平未显著降低。图7N示出在用抗Siglec-9抗体2D4或同种型对照抗体(MOPC-21)处理21天后来自人源化NSG小鼠的血液样品的FACS门控策略。图7O描绘与无抗体对照相比,用抗Siglec-9抗体2D4或同种型对照抗体处理后人树突细胞上Siglec-9表面表达和TREM2表面表达的水平。图7P描绘在用抗Siglec-9抗体2D4处理后人树突细胞上CD11c表面表达、Siglec-9表面表达和TREM2表面表达的水平。图7Q描绘本公开的Siglec-9抗体阻断Siglec-9(Siglec-9-FC)与U937癌细胞上内源性表达的唾液酸配体的结合的能力。
图8描绘FACS分析,其显示树突细胞上的唾液酸配体在与人原代细胞的混合淋巴细胞反应期间限制T细胞增殖。
图9描绘显示树突细胞上的唾液酸Siglec-9配体在混合淋巴细胞反应期间限制T细胞增殖的结果。
图10A-10H描绘显示由各种刺激诱导的人骨髓细胞上的Siglec-9受体和增加的Siglec-9配体表达的结果。图10A和10B描绘显示在用肿瘤上清液处理后人原代树突细胞上的Siglec-9受体和增加的Siglec-9配体表达的结果。图10C和10D描绘显示在用肿瘤上清液处理后人原代树突细胞上的增加的Siglec-9配体表达的结果。图10E和10F描绘显示在LPS诱导的炎症过程中人树突细胞上Siglec-9受体表达的结果。图10G和10H描绘显示在LPS诱导的炎症过程中人骨髓细胞上唾液酸表达增加的结果。这些发现表明肿瘤可通过上调肿瘤细胞和免疫细胞上针对Siglec-9的抑制性配体的水平来逃避免疫监视。
图11描绘显示唾液酸酶处理以从大肠杆菌除去Siglec-9配体增加人原代树突细胞的吞噬的结果。
图12描绘来自阿尔茨海默氏病脑(AD)和健康脑(非AD)的脑切片中的Siglec-9配体表达。图12示出来自两个供体(供体1和供体2)的AD和非AD脑样品中Siglec-9-Fc的免疫组织化学染色。
图13描绘显示抑制性Siglec-9配体的表达在肺肿瘤细胞、黑色素瘤细胞和结肠癌细胞中增加的结果。所述结果表明抑制性Siglec-9配体在这些肿瘤类型中促成癌症病理学。
图14描绘注射人外周血细胞的NOG小鼠细胞中Siglec-9的表达。在植入人胚胎肝CD34
图15A描绘用于免疫人源化小鼠中患者来源的癌症的小鼠模型的PD-1/Siglec-9组合抗体治疗方案。图15B描绘来自用单独或与抗Siglec-9抗体2D4组合的
发明详述
一般技术
本文描述或引用的技术和程序通常被本领域技术人员熟知并且通常使用常规方法学来采用,例如像描述于以下中的广泛使用的方法:Sambrook等人,Molecular Cloning:A Laboratory Manual第3版(2001)Cold Spring Harbor Laboratory Press,Cold SpringHarbor,N.Y.;Current Protocols in Molecular Biology(F.M.Ausubel,等人编,(2003));系列Methods in Enzymology(Academic Press,Inc.):PCR 2:A PracticalApproach(M.J.MacPherson,B.D.Hames和G.R.Taylor编(1995)),Harlow和Lane,编(1988)Antibodies,A Laboratory Manual,and Animal Cell Culture(R.I.Freshney,编(1987));Oligonucleotide Synthesis(M.J.Gait,编,1984);Methods in MolecularBiology,Humana Press;Cell Biology:A Laboratory Notebook(J.E.Cellis,编,1998)Academic Press;Animal Cell Culture(R.I.Freshney),编,1987);Introduction toCell and Tissue Culture(J.P.Mather和P.E.Roberts,1998)Plenum Press;Cell andTissue Culture:Laboratory Procedures(A.Doyle,J.B.Griffiths,和D.G.Newell,编,1993-8)J.Wiley和Sons;Handbook of Experimental Immunology(D.M.Weir和C.C.Blackwell,编);Gene Transfer Vectors for Mammalian Cells(J.M.Miller和M.P.Calos,编,1987);PCR:The Polymerase Chain Reaction,(Mullis等人,编,1994);Current Protocols in Immunology(J.E.Coligan等人,编,1991);Short Protocols inMolecular Biology(Wiley和Sons,1999);Immunobiology(C.A.Janeway和P.Travers,1997);Antibodies(P.Finch,1997);Antibodies:A Practical Approach(D.Catty.,编,IRL Press,1988-1989);Monoclonal Antibodies:A Practical Approach(P.Shepherd和C.Dean,编,Oxford University Press,2000);Using Antibodies:A Laboratory Manual(E.Harlow和D.Lane(Cold Spring Harbor Laboratory Press,1999);The Antibodies(M.Zanetti和J.D.Capra,编,Harwood Academic Publishers,1995);以及Cancer:Principles and Practice of Oncology(V.T.DeVita等人,编,J.B.Lippincott Company,1993)。
定义
如本文所用,术语“预防”包括关于个体的特定疾病、病症或病况的发生或复发提供预防。个体可能易患、易感特定疾病、病症或病况,或处于发展这种疾病、病症或病况的风险中,但尚未被诊断患有所述疾病、病症或病况。
如本文所用,处于发展特定疾病、病症或病况的“风险”的个体在本文描述的治疗方法之前可能具有或可能不具有可检测到的疾病或疾病症状,并且可能已显示或可能未显示可检测到的疾病或疾病症状。“处于风险”表示个体具有一种或多种风险因素,所述风险因素是如本领域中所已知与特定疾病、病症或病况的发展有关的可测量的参数。与没有这些风险因素中的一种或多种的个体相比,具有这些风险因素中的一种或多种的个体发展特定疾病、病症或病况的可能性更高。
如本文所用,术语“治疗”是指设计用来在临床病理学过程中改变所治疗的个体的天然过程的临床介入。治疗的合意作用包括降低特定疾病、病症或病况的进展速率、改善或缓解特定疾病、病症或病况的病理状态以及缓和或改善特定疾病、病症或病况的预后。例如当与特定疾病、病症或病况相关的一种或多种症状得到减轻或消除时,个体得到成功“治疗”。
“有效量”是指在必需剂量下且持续必需的时期,至少有效实现所需治疗或预防结果的量。有效量可在一次或多次施用中提供。本文的有效量可根据多种因素而不同,如个体的疾病状态、年龄、性别以及重量和治疗在个体体内引发所希望的应答的能力。有效量还是其中治疗有益作用超过治疗的任何毒性或有害作用的量。对于预防性用途,有利或所需的结果包括诸如以下的结果:消除或减少风险、减轻严重性或延缓疾病(包括所述疾病的生物化学的、组织学的和/或行为的症状、在所述疾病发展期间存在的所述疾病的并发症和中间病理表型)的发作。对于治疗性用途,有利或所需的结果包括诸如以下的临床结果:减少由疾病引起的一种或多种症状、提高患有疾病的患者的生活质量、减少治疗疾病所需的其它药物的剂量、诸如通过靶向来增强另一种药物的作用、延缓疾病进展和/或延长存活。药物、化合物或药物组合物的有效量是足以直接地或间接地完成预防性或治疗性治疗的量。在临床背景中所理解的是,与另一种药物、化合物或药物组合物结合,药物、化合物或药物组合物的有效量可以或可以不实现。因此,可认为“有效量”处于施用一种或多种治疗剂的背景中,并且如果与一种或多种其它药剂结合可实现或实现了理想结果,那么可认为单一药剂是以有效量给予的。
“治疗有效量”是实现特定病症、病症或病况的可测量的改善所需要的至少最低浓度。本文中的治疗有效量可根据以下因素而变化,如患者的疾病状态、年龄、性别和重量以及Siglec-9蛋白拮抗剂在个体体内引发所需应答的能力。治疗有效量还是治疗有益作用胜过Siglec-9蛋白拮抗剂的任何毒性或有害作用的量。
如本文所用,与另一种化合物或组合物“联合”施用包括同时施用和/或在不同时间施用。联合施用还包括作为共同制剂施用或作为独立组合物施用,包括以不同的给药频率或间隔并且使用相同的施用途径或不同的施用途径。
出于治疗、预防或降低风险目的的“个体”是指被归类为哺乳动物的任何动物,包括人、家养动物和农场动物,以及动物园动物、运动动物或宠物动物,如狗、马、兔、牛、猪、仓鼠、沙鼠、小鼠、雪貂、大鼠、猫等。优选地,所述个体是人。
术语“免疫球蛋白”(Ig)在本文中可与“抗体”互换使用。本文中的术语“抗体”是广义上使用的并且特定地涵盖单克隆抗体、多克隆抗体、由至少两种完整的抗体形成的多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们展示所需的生物活性。
基本的4链抗体单元是主要由两条相同的轻(L)链和两条相同的重(H)链组成的异四聚糖蛋白。V
来自任何脊椎动物物种的L链可基于其恒定结构域的氨基酸序列指定为两种明显不同类型(称为卡帕(“κ”)和拉姆达(“λ”))中的一者。取决于其重链的恒定结构域(CH)的氨基酸序列,免疫球蛋白可归属于不同的类别或同种型。存在五种类别的免疫球蛋白:IgA、IgD、IgE、IgG和IgM,其分别具有指定为阿尔法(“α”)、德尔塔(“δ”)、艾普斯龙(“ε”)、伽马(“γ”)和缪(“μ”)的重链。基于CH序列和功能的相对小的差异,γ和α类别被进一步分成亚类(同种型),例如,人表达以下亚类:IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。不同类别的免疫球蛋白的亚基结构和三维构型是众所周知的,并且通常描述于例如Abbas等人,Cellularand Molecular Immunology,第4版(W.B.Saunders Co.,2000)中。
天然抗体通常是约150,000道尔顿的异四聚体糖蛋白,由两条相同的轻(L)链和两条相同的重(H)链组成。每条轻链都借助一个共价二硫键连接到一条重链,但不同免疫球蛋白同种型的重链中二硫键链的数量不同。每条重链和轻链还具有规律性间隔的链内二硫桥。每条重链在一端具有一个可变结构域(V
“分离的”抗体(如本公开的抗Siglec-9抗体)是已经从其生产环境的组分(例如,天然或重组地)鉴定、分离和/或回收的抗体。优选地,分离的多肽不与来自其生产环境的所有其它污染物组分缔合。来自其生产环境的污染组分(如由重组转染的细胞产生的那些污染组分)是通常将干扰抗体的研究、诊断或治疗用途的物质,并且可包括酶、激素以及其它蛋白质或非蛋白质溶质。在优选实施方案中,所述多肽将:(1)被纯化至如通过例如劳立法(Lowry method)所测定大于95重量%的抗体且在一些实施方案中纯化至大于99重量%;(2)被纯化至足以通过使用旋杯式测序仪获得N端或内部氨基酸序列的至少15个残基的程度;或(3)通过使用考马斯蓝(Coomassie blue)或优选银染色,在非还原或还原条件下进行SDS-PAGE被纯化至均质。分离的抗体包括重组T细胞内的原位抗体,因为抗体的天然环境的至少一种组分将不存在。然而,通常将通过至少一个纯化步骤来制备分离的多肽或抗体。
抗体(如本公开的抗Siglec-9抗体)的“可变区”或“可变结构域”是指抗体的重链或轻链的氨基末端结构域。重链和轻链的可变结构域可分别称为“V
术语“可变”是指以下事实:可变结构域的某些区段在抗体(如本公开的抗Siglec-9抗体)之间的序列中存在广泛差异。V结构域介导抗原结合并限定特定抗体对其特定抗原的特异性。然而,可变性并不是均匀分布在整个可变结构域的范围内。而是,在轻链和重链可变结构域中,可变性集中在三个称为高变区(HVR)的区段中。可变结构域的更高度保守的部分称为框架区(FR)。天然重链和轻链的可变结构域各自包含由三个HVR连接的四个FR区域,所述四个FR基本上采用β-片层构型,所述三个HVR形成连接β-片层结构的环并且在一些情况下形成β-片层结构的部分。在每个链中的HVR由FR区保持紧靠在一起,并且与来自另一条链的HVR促成抗体的抗原结合位点的形成(参见Kabat等人,Sequences ofImmunological Interest,第5版,National Institute of Health,Bethesda,MD(1991))。虽然恒定结构域并不直接参与抗体与抗原的结合,但表现各种效应功能,诸如抗体参与抗体依赖性细胞毒性。
如本文所用,术语“单克隆抗体”是指从基本上同质抗体的群体获得的抗体(如本公开的抗Siglec-9抗体),即构成所述群体的单独抗体是相同的,除了可能以微量存在的可能的天然存在的突变和/或翻译后修饰(例如,异构化,酰胺化)。单克隆抗体是高度特异性的,从而针对一个或多个抗原位点。在一些实施方案中,本公开的单克隆抗体可以是双特异性抗体。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂不同,各单克隆抗体针对一个或多个抗原位点上的单一决定簇。修饰语“单克隆”指示抗体是从实质上均质的抗体群体获得的特性,且不应解释为需要通过任何特定方法来产生所述抗体。例如,待根据本公开使用的单克隆抗体可通过各种技术来制备,所述技术包括例如噬菌体展示技术(参见例如,Clackson等人,Nature,352:624-628(1991);Marks等人,J.Mol.Biol.222:581-597(1992);Sidhu等人,J.Mol.Biol.338(2):299-310(2004);Lee等人,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Nat’l Acad.Sci.USA 101(34):12467-472(2004);以及Lee等人,J.Immunol.Methods 284(1-2):119-132(2004)、杂交瘤方法(例如,,Kohler和Milstein.,Nature,256:495-97(1975);Hongo等人,Hybridoma,14(3):253-260(1995);Harlow等人,Antibodies:A Laboratory Manual,(Cold Spring Harbor LaboratoryPress,第2版1988);Hammerling等人,in:Monoclonal Antibodies and T-CellHybridomas 563-681(Elsevier,N.Y.,1981))、重组DNA方法(参见例如,美国专利号4,816,567)以及用于在具有部分或全部人免疫球蛋白基因座或编码人免疫球蛋白序列的基因的动物中产生人或人样抗体的技术(参见例如,WO 1998/24893;WO 1996/34096;WO 1996/33735;WO 1991/10741;Jakobovits等人,Proc.Nat’l Acad.Sci.USA 90:2551(1993);Jakobovits等人,Nature 362:255-258(1993);Bruggemann等人,Year in Immunol.7:33(1993);美国专利号5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;以及5,661,016;Marks等人,Bio/Technology 10:779-783(1992);Lonberg等人,Nature 368:856-859(1994);Morrison,Nature 368:812-813(1994);Fishwild等人,Nature Biotechnol.14:845-851(1996);Neuberger,Nature Biotechnol.14:826(1996);以及Lonberg和Huszar,Intern.Rev.Immunol.13:65-93(1995)。
术语“全长抗体”、“完整抗体”或“全抗体”可互换使用来指与抗体片段相反,呈其基本上完整形式的抗体,如本公开的抗Siglec-9抗体。具体地说,全抗体包括具有重链和轻链(包括Fc区)的抗体。恒定结构域可为天然序列恒定结构域(例如人天然序列恒定结构域)或其氨基酸序列变体。在一些情况下,完整抗体可具有一种或多种效应功能。
“抗体片段”包含完整抗体的一部分,优选地所述完整抗体的抗原结合区和/或可变区。抗体片段的实例包括Fab、Fab'、F(ab')
抗体(如本公开的抗Siglec-9抗体)的木瓜蛋白酶消化产生称为“Fab”片段的两个相同的抗原结合片段和反映容易结晶的能力名称的残余“Fc”片段。Fab片段由整条L链连同H链的可变区结构域(VH)以及一条重链的第一个恒定结构域(C
Fc片段包含通过二硫化物结合在一起的两条H链的羧基末端部分。抗体的效应功能由Fc区中的序列决定,所述区域也被某些类型的细胞上发现的Fc受体(FcR)识别。
“Fv”是含有完全抗原识别和结合位点的最小抗体片段。此片段由处于紧密、非共价缔合的一个重链可变区结构域和一个轻链可变区结构域的二聚体组成。从这两个结构域的折叠发出六个高变环(各自来自H和L链的3个环),所述高变环贡献氨基酸残基以用于抗原结合并赋予抗体以抗原结合特异性。然而,甚至单个可变结构域(或仅包含三个对抗原有特异性的HVR的一半Fv)具有识别和结合抗原的能力,尽管与整个结合位点相比,处于较低的亲和力下。
“单链Fv”也缩写为“sFv”或“scFv”是包含连接成单条多肽链的VH和VL抗体结构域的抗体片段。优选地,sFv多肽还包含V
抗体(如本公开的抗Siglec-9抗体)的“功能片段”包含完整抗体的一部分,通常包括完整抗体的抗原结合区或可变区或抗体的F区,所述F区保留或具有改变的FcR结合能力。抗体片段的实例包括线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。
术语“双抗体”是指通过在V
如本文所用,“嵌合抗体”是指抗体(免疫球蛋白),如本公开的抗Siglec-9抗体,其中重链和/或轻链的一部分与来源于特定物种或属于特定抗体类型或亚类的抗体中的对应序列一致或同源,而所述链的其余部分与来源于另一物种或属于另一个抗体类型或亚类的抗体、以及此类抗体的片段中的对应序列一致或同源,只要它们展示出所需的生物活性(美国专利号4,816,567;Morrison等人,Proc.Nat’l Acad.Sci.USA,81:6851-55(1984))。本文中的目标嵌合抗体包括
“人源化”形式的非人(例如鼠类)抗体(如本公开的抗Siglec-9抗体)是含有源自非人免疫球蛋白的最小序列的嵌合抗体。在一个实施方案中,人源化抗体是人免疫球蛋白(接受者抗体),其中来自接受者的HVR的残基被来自诸如小鼠、大鼠、兔或非人类灵长类动物的非人物种(供体抗体)的HVR的具有所需特异性、亲和力和能力的残基置换。在一些情况下,人免疫球蛋白的FR残基被相应的非人残基置换。另外,人源化抗体可包含在接受者抗体中或在供体抗体中没有见到的残基。可产生这些修饰来进一步细化抗体性能,如结合亲和力。通常,人源化抗体将包含至少一个且通常两个可变结构域的基本全部,其中全部或基本全部的高变环对应于非人免疫球蛋白序列的那些高变环且全部或基本全部的FR区为人免疫球蛋白序列的那些FR区,但是FR区可包含一个或多个单独的FR残基取代,所述取代提高抗体性能,如结合亲和力、异构化、免疫原性等。FR中这些氨基酸取代的数目在H链中通常不超过6个,并且在L链中不超过3个。所述人源化抗体可任选地还应当至少包括免疫球蛋白恒定区(Fc)的一部分,典型地人免疫球蛋白的一部分。关于进一步细节,参见例如,Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature 332:323-329(1988);以及Presta,Curr.Op.Struct.Biol.2:593-596(1992)。还参见例如,Vaswani和Hamilton,Ann.Allergy,Asthma&Immunol.1:105-115(1998);Harris,Biochem.Soc.Transactions23:1035-1038(1995);Hurle和Gross,Curr.Op.Biotech.5:428-433(1994);以及美国专利号6,982,321和7,087,409。
“人抗体”是具有对应于由人产生的抗体(如本公开的抗Siglec-9抗体)的氨基酸序列的氨基酸序列和/或已使用如本文公开的用于制备人抗体的任一种技术制造的抗体。人抗体的定义特异性地排除了包括非人抗原结合残基的人源化抗体。可使用本领域中已知的各种技术(包括噬菌体展示文库)产生人抗体。Hoogenboom和Winter,J.Mol.Biol.,227:381(1991);Marks等人,J.Mol.Biol.,222:581(1991)。也可用于制备人单克隆抗体的方法是描述于Cole等人,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,第77页(1985);Boerner等人,J.Immunol.,147(1):86-95(1991)中的方法。还参见van Dijk和vande Winkel,Curr.Opin.Pharmacol.5:368-74(2001)。人抗体可通过将抗原施用于转基因动物来制备,所述转基因动物已经被修饰以响应于抗原激发而产生此类抗体,但其内源基因座已经失效,例如免疫的异种小鼠(关于XENOMOUSE
当在本文中使用时,术语“高变区”、“HVR”或“HV”是指抗体可变结构域的区域,如本公开的抗Siglec-9抗体的区域,所述区域在序列中是高变的和/或形成结构限定的环。一般来说,抗体包含六个HVR;三个在VH中(H1、H2、H3),且三个在VL中(L1、L2、L3)。在天然抗体中,H3和L3展示6种HVR的最多样化,并且特别是认为H3在赋予针对抗体的良好特异性方面发挥独特作用。参见例如,Xu等人,Immunity 13:37-45(2000);Johnson和Wu,Methods inMolecular Biology 248:1-25(Lo,编,Human Press,Totowa,NJ,2003))。实际上,由重链组成的天然存在的骆驼科抗体仅在没有轻链的情况下是功能性且稳定的。参见例如,Hamers-Casterman等人,Nature 363:446-448(1993)和Sheriff等人,Nature Struct.Biol.3:733-736(1996)。
许多HVR描述正在使用中,并包含在本文中。作为EU或Kabat互补决定区(CDR)的HVR是基于序列变异性并且是最常用的(Kabat等人,同上)。而Chothia是指结构环的位置(Chothia和Lesk J.Mol.Biol.196:901-917(1987))。AbM HVR表示EU或Kabat CDR与Chothia结构化环之间的折衷,并且是通过Oxford Molecular的AbM抗体建模软件来使用。“接触”HVR是基于分析可用复合物晶体结构的。来自这些HVR中的每一个的残基如下所述。
HVR可包含如下的“延伸的HVR”:VL中的24-36或24-34(L1)、46-56或50-56(L2)以及89-97或89-96(L3),以及VH中的26-35(H1)、50-65或49-65(优选的实施方案)(H2)以及93-102、94-102或95-102(H3)。对于这些延伸的HVR定义中的每一个,可变结构域残基是根据EU或Kabat等人,同上进行编号。
“框架”或“FR”残基是除如本文所定义的HVR残基以外的那些可变结构域残基。
短语“如EU或Kabat中的可变结构域残基编号”或“如EU或Kabat中的氨基酸位置编号”及其变化形式是指用于EU或Kabat等人,上文中的抗体编译的重链可变结构域或轻链可变结构域的编号系统。使用此编号系统,实际线性氨基酸序列可含有较少或另外的氨基酸,其对应于可变结构域的FR或HVR的缩短或对其进行的插入。例如,重链可变结构域可包括H2的残基52之后的单个氨基酸插入(根据Kabat的残基52a)和重链FR残基82之后的插入残基(例如根据Kabat的残基82a、82b和82c等)。可通过在抗体序列的同源区处与“标准”Kabat编号序列比对来确定给定抗体的残基的EU或Kabat编号。
当提及可变结构域中的残基时,通常使用EU或Kabat编号系统(大约轻链的残基1-107和重链的残基1-113)(例如,Kabat等人,Sequences of Immunological Interest.第5版.Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。“EU或Kabat编号系统”或“EU索引”通常在提及免疫球蛋白重链恒定区中的残基时使用(例如,Kabat等人,上文中报告的EU索引)。“如Kabat中的EU索引”是指人IgG1 EU抗体的残基编号。除非本文另有说明,否则对抗体的可变结构域中的残基编号的提及是指由Kabat编号系统编号的残基。除非本文另有说明,否则对抗体的恒定结构域中的残基编号的提及是指由EU或Kabat编号系统编号的残基(例如,参见美国专利公布号2010-280227)。
如本文所用的“受体人框架”是包含源自人免疫球蛋白框架或人共有框架的VL或VH框架的氨基酸序列的框架。“源自”人免疫球蛋白框架或人共有框架的受体人框架可包含其相同的氨基酸序列,或者其可含有预先存在的氨基酸序列变化。在一些实施方案中,预先存在的氨基酸变化的数目是10或更小,9或更小,8或更小,7或更小,6或更小,5或更小,4或更小,3或更小,或2或更小。当在VH中存在预先存在的氨基酸变化时,优选那些变化仅在位置71H、73H和78H中的三个、两个或一个处发生;例如,那些位置处的氨基酸残基可以是71A、73T和/或78A。在一个实施方案中,VL受体人框架在序列上与VL人免疫球蛋白框架序列或人共有框架序列相同。
“人共有框架”是代表在人免疫球蛋白VL或VH框架序列的选择中最常存在的氨基酸残基的框架。一般来说,人免疫球蛋白VL或VH序列选自可变结构域序列的亚组。一般来说,所述序列亚组是如在Kabat等人,Sequences of Proteins of ImmunologicalInterest,第5版Public Health Service,National Institutes of Health,Bethesda,MD(1991)中的亚组。实例包括对于VL,所述亚组可以是如Kabat等人,同上中的亚组κI、κII、κIII或κIV。此外,对于VH,所述亚组可以是如Kabat等人,同上的亚组I、亚组II或亚组III。
例如本公开的抗Siglec-9抗体的指定位置处的“氨基酸修饰”是指指定残基的取代或缺失,或邻近指定残基插入至少一个氨基酸残基。“邻近”指定残基的插入是指在其一个至两个残基内插入。插入可为指定残基的N末端或C末端。本文优选的氨基酸修饰是取代。
“亲和力成熟”抗体(如本公开的抗Siglec-9抗体)是一个或多个HVR中具有一个或多个改变的抗体,所述变化导致与不具有那些改变的亲本抗体相比,抗体对于抗原的亲和力提高。在一个实施方案中,亲和力成熟抗体对靶抗原具有纳摩尔或甚至皮摩尔亲和力。亲和力成熟抗体是通过本领域中已知的程序产生。例如,Marks等人,Bio/Technology 10:779-783(1992)描述了通过VH-和VL-结构域改组的亲和力成熟。对HVR和/或框架残基的随机诱变由例如以下文献描述:Barbas等人Proc Nat.Acad.Sci.USA 91:3809-3813(1994);Schier等人Gene 169:147-155(1995);Yelton等人J.Immunol.155:1994-2004(1995);Jackson等人,J.Immunol.154(7):3310-9(1995);以及Hawkins等人,J.Mol.Biol.226:889-896(1992)。
如本文所用,术语“特异性地识别”或“特异性地结合”是指可测量的和可再现的相互作用,诸如靶标与抗体(如本公开的抗Siglec-9抗体)之间的吸引或结合,所述吸引或结合在存在包括生物分子的分子的异源群体的情况下确定靶标的存在。例如,特异性或优先结合靶标或表位的抗体(如本公开的抗Siglec-9抗体)是以比它结合至其它靶标或靶标的其它表位更大的亲和力、亲合力、更容易和/或更大的持续时间结合至靶标或表位。通过阅读这个定义还应理解,例如,特异性或优先结合至第一靶标的抗体(或部分)可以或可以不特异性或优先结合至第二靶标。因此,“特异性结合”或“优先结合”并不一定需要(尽管其可包括)排外的结合。特异性地结合至靶标的抗体可具有至少约10
如本文所用,Siglec-9蛋白与第二种蛋白质之间的“相互作用”包括但不限于蛋白质-蛋白质相互作用、物理相互作用、化学相互作用、结合、共价结合和离子结合。如本文所用,当抗体破坏、减少或完全消除两种蛋白质之间的相互作用时,抗体“抑制两种蛋白质之间的相互作用”。当本公开的抗体或其片段结合至两种蛋白质中的一种时,所述抗体或其片段“抑制两种蛋白质之间的相互作用”。
“激动剂”抗体或“活化”抗体是在抗体结合抗原后诱导(例如增加)所述抗原的一种或多种活性或功能的抗体,如本公开的激动剂抗Siglec-9抗体。
“阻断”抗体、“拮抗剂”抗体或“抑制性”抗体是在抗体结合抗原后抑制或减少(例如降低)抗体与一种或多种配体的结合和/或在抗体结合抗原后抑制或减少(例如降低)所述抗原的一种或多种活性或功能的抗体,如本公开的抗Siglec-9抗体。在一些实施方案中,阻断抗体、拮抗剂抗体或抑制性抗体基本上或完全抑制抗原与所述抗原的一种或多种配体的结合和/或所述抗原的一种或多种活性或功能。
抗体“效应功能”是指可归因于抗体的Fc区(天然序列Fc区或氨基酸序列变体Fc区)的那些生物活性,并且随抗体同种型变化。
本文的术语“Fc区”用于定义免疫球蛋白重链的C末端区,其包括天然序列Fc区和变体Fc区。尽管免疫球蛋白重链的Fc区的边界可能变化,但是人IgG重链Fc区通常被定义为从位置Cys226或Pro230处的氨基酸残基延伸至其羧基末端。例如,Fc区的C-末端赖氨酸(根据EU或Kabat编号系统的残基447)可例如在抗体的生产或纯化期间或通过重组改造编码抗体重链的核酸。因此,完整抗体的组合物可包含除去所有K447残基的抗体群体,不除去K447残基的抗体群体和具有有或无K447残基的抗体混合物的抗体群体。用于本公开的抗体的合适的天然序列Fc区包括人IgG1、IgG2、IgG3和IgG4。
“天然序列Fc区”包含的氨基酸序列与自然界中所存在的Fc区的氨基酸序列相同。天然序列人Fc区包括天然序列人IgG1 Fc区(非A和A同种异型);天然序列人IgG2 Fc区;天然序列人IgG3 Fc区;以及天然序列人IgG4 Fc区以及其天然存在的变体。
“变体Fc区”所包含的氨基酸序列与天然序列Fc区的氨基酸序列的不同之处在于至少一个氨基酸修饰,优选一个或多个氨基酸序列。优选地,与天然序列Fc区或亲本多肽的Fc区相比,变体Fc区具有至少一个氨基酸取代,例如,在天然序列Fc区中或在亲本多肽的Fc区中约1至约10个氨基酸取代,并且优选约1至约5个氨基酸取代。本文中的变体Fc区将优选与天然序列Fc区和/或与亲本多肽的Fc区具有至少约80%同源性,并且最优选与其具有至少约90%同源性,更优选与其具有至少约95%同源性。
“Fc受体”或“FcR”描述结合至抗体Fc区的受体。优选的FcR是天然序列人FcR。此外,优选的FcR是结合IgG抗体(γ受体)并且包括FcγRI、FcγRII和FcγRIII亚类的受体的FcR,包括这些受体的等位基因变体和可变剪接形式,FcγRII受体包括FcγRIIA(“活化受体”)和FcγRIIB(“抑制受体”),它们具有主要在其细胞质结构域中不同的相似氨基酸序列。活化受体FcγRIIA在其细胞质域中含有免疫受体酪氨酸基活化基序(“ITAM”)。抑制受体FcγRIIB在其细胞质域中含有免疫受体酪氨酸基抑制基序(“ITIM”)。(参见例如,M.
可例如在转基因小鼠或表达人FcRn的转染的人细胞系中或者在施用了具有变体Fc区的多肽的灵长类动物中测定与体内FcRn的结合以及人FcRn高亲和力结合多肽的血清半衰期。WO 2004/42072(Presta)描述了具有提高的或减弱的与FcR的结合的抗体变体。还参见例如Shields等人,J.Biol.Chem.9(2):6591-6604(2001)。
如本文所用,就肽、多肽或抗体序列而言的“氨基酸序列同一性百分比(%)”和“同源性”是指,在比对序列并且引入缺口(如果需要的话)以获得最大序列同一性百分比之后,候选序列中与特定肽或多肽序列中氨基酸残基相同的氨基酸残基的百分比,而不考虑任何保守取代作为序列同一性的一部分。用于测定氨基酸序列同一性百分比的目的的比对可以属于本领域中的技能的多种方式实现,所述方式例如使用可公开获得的计算机软件,诸如BLAST、BLAST-2、ALIGN或MEGALIGN
“分离的”细胞是从在产生其的环境中通常与其缔合的至少一种污染细胞鉴定并且分离的分子或细胞。在一些实施方案中,分离的细胞不与同生产环境相关的所有组分缔合。分离的细胞呈不同于它在自然界中所存在的形式或配置的形式。分离的细胞与组织、器官或个体中天然存在的细胞不同。在一些实施方案中,分离的细胞是本公开的宿主细胞。
编码抗体(如本公开的抗Siglec-9抗体)的“分离的”核酸分子是从在产生其的环境中通常与其缔合的至少一种污染核酸分子鉴定并且分离的核酸分子。优选地,分离的核酸不与同生产环境相关的所有组分缔合。编码本文的多肽和抗体的分离的核酸分子呈不同于它在自然界中所存在的形式或配置的形式。分离的核酸分子因此不同于在细胞中天然存在的编码本文的多肽和抗体的核酸。
如本文所用的术语“载体”意指能够转运其已连接的另一核酸的核酸分子。一种类型的载体是“质粒”,所述质粒是指可将额外的DNA区段连接到其中的环状双链DNA。另一种类型的载体是噬菌体载体。另一种类型的载体是病毒载体,其中额外的DNA区段可被连接到病毒基因组中。某些载体能够在它们被引入至其中的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体以及附加型哺乳动物载体)。其它载体(例如,非附加型哺乳动物载体)可以在引入到宿主细胞中后整合到宿主细胞的基因组中,并且由此与宿主基因组一起复制。此外,某些载体能够指导它们所可操作地连接的基因的表达。所述载体在本文中称为“重组表达载体”或简称为“表达载体”。一般而言,可用于重组DNA技术中的表达载体经常呈质粒形式。在本说明书中,“质粒”和“载体”可互换地使用,因为质粒是载体的最通常使用形式。
如本文可互换使用的“多核苷酸”或“核酸”是指具有任何长度的核苷酸的聚合物,并且包括DNA和RNA。所述核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基和/或它们的类似物、或可通过DNA或RNA聚合酶或通过合成反应并入聚合物中的任何底物。多核苷酸可包含修饰的核苷酸,如甲基化核苷酸及其类似物。如果存在,那么可在聚合物组装之前或之后赋予对核苷酸结构的修饰。核苷酸的序列可由非核苷酸组分间断。多核苷酸可包含在合成后进行的修饰,如缀合至标记。其它类型的修饰包括,例如,“加帽(cap)”、用类似物取代一种或多种天然存在的核苷酸、核苷酸间修饰,例如像,具有不带电荷的键联(例如,膦酸甲酯、磷酸三酯、磷酰胺酸酯(phosphoamidate)、氨基甲酸酯(carbamate),等等)和具有带电荷的键联(例如,硫代磷酸酯、二硫代磷酸酯,等等)的那些、含有侧悬部分(例如像,蛋白质(例如,核酸酶、毒素、抗体、信号肽、聚-L-赖氨酸,等等))的那些、具有嵌入剂(例如,吖啶、补骨脂素)的那些、含有螯合剂(例如,金属、放射性金属、硼、氧化金属,等等)的那些、含有烷化剂(alkylator)的那些、具有修饰的键联(例如,α端基异构核酸,等等)的那些、以及一种或多种多核苷酸未修饰形式。此外,通常存在于糖类中的任何羟基可被(例如)膦酸酯基、磷酸酯基置换、被标准保护基保护或被活化以提供与另外核苷酸的另外键联,或可与固体或半固体载体缀合。5'和3'末端OH可以被磷酸化或被胺或具有1至20个碳原子的有机加帽基团部分而取代。其它羟基也可衍生成标准保护基。多核苷酸还可以包含本领域众所周知的核糖或脱氧核糖的类似形式,包括,例如,2'-O-甲基-、2'-O-烯丙基、2'-氟-或2'-叠氮基-核糖、碳环糖类似物、α-端基异构糖、差向异构糖(如阿拉伯糖、木糖或来苏糖)、吡喃糖糖、呋喃糖糖、景天庚酮糖、无环类似物以及碱性核苷类似物(如甲基核苷)。一个或多个磷酸二酯键联可由替代连接基团来置换。这些替代连接基团包括,但不限于,其中磷酸酯被P(O)S(“硫代酸酯(thioate)”)、P(S)S(“二硫代酸酯(dithioate)”)、(O)NR2(“酰胺化物(amidate)”)、P(O)R、P(O)OR'、CO或CH2(“甲缩醛(formacetal)”)置换的实施方案,其中每个R或R'独立地是H或任选含有醚(-O-)键联的取代的或未取代的烷基(1-20个C)、芳基、烯基、环烷基、环烯基或芳烷基(araldyl)。多核苷酸中并非所有键联都需要相同。前文描述适用于本文所提及的所有多核苷酸,包括RNA和DNA。
“宿主细胞”包括可以是或已成为用于并入多核苷酸插入物的载体的接受者的个别细胞或细胞培养物。宿主细胞包括单一宿主细胞的子代,并且子代可由于天然、偶然或故意突变而不一定与初始亲本细胞完全相同(在形态方面或在基因组DNA互补体方面)。宿主细胞包括用本公开的多核苷酸体内转染的细胞。
如本文所用的“载体”包括在所采用的剂量和浓度下对暴露于其的细胞或哺乳动物无毒的药学上可接受的载体、赋形剂或稳定剂。通常生理学上可接受的载体是pH缓冲水溶液。生理学上可接受的载体的实例包括缓冲剂,如磷酸盐、柠檬酸盐以及其它有机酸;抗氧化剂,包括抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖以及其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖醇,如甘露糖醇或山梨糖醇;成盐抗衡离子,如钠;和/或非离子型表面活性剂类,如TWEEN
如本文所用,术语“细胞凋亡”是指细胞内细胞破坏的基因定向过程。细胞凋亡不同于坏死;它包括细胞骨架断裂、细胞质收缩和浓缩、细胞膜外表面上磷脂酰丝氨酸的表达以及起泡,从而导致细胞膜结合囊泡或凋亡小体的形成。所述过程也被称为“程序性细胞死亡”。在细胞凋亡期间,观察到特征性现象,如弯曲的细胞表面、核染色质的浓缩、染色体DNA的片段化以及线粒体功能的丧失。可使用各种已知的技术来检测细胞凋亡,如用膜联蛋白V、碘化丙啶、DNA片段化测定和YO-PRO-1(Invitrogen)染色细胞。在一些实施方案中,可使用用膜联蛋白V和碘化丙啶染色,并且膜联蛋白V+/PI+、膜联蛋白V+/PI-和膜联蛋白V-/PI+群体的组合百分比被认为是死细胞。
如本文所用,术语“降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂”是指减少(包括显著)、降低、阻断、抑制或干扰体外、原位和/或体内Siglec-9(哺乳动物,如人Siglec-9)生物活性的分子。术语“药剂”意味着没有任何特定的生物作用机制,并且明确地包括并涵盖与Siglec-9的所有可能的药理学、生理学和生物化学相互作用,无论是直接的还是间接的以及是与Siglec-9、一种或多种其配体还是通过另一种机制相互作用,并且其后果可通过各种不同的且化学相异的组合物来实现。示例性药剂包括但不限于特异性地结合至Siglec-9的抗Siglec-9抗体、可溶性Siglec-9受体蛋白、可溶性Siglec-9-Fc融合蛋白(例如,Siglec-9免疫粘附素)、结合至Siglec-9配体的可溶性Siglec受体、结合至Siglec-9配体的Siglec-Fc融合蛋白(例如,Siglec免疫粘附素)、针对编码Siglec-9的核酸的反义分子、针对编码Siglec-9的核酸的短干扰RNA(“siRNA”)分子、Siglec-9抑制性化合物、结合至Siglec-9的RNA或DNA适体以及Siglec-9结构类似物。在一些实施方案中,Siglec-9抑制剂(例如抗体)结合降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂(或与其物理相互作用),结合至Siglec-9配体和/或抑制(减少)Siglec-9合成或产生。在其它实施方案中,本公开抑制剂的药剂结合Siglec-9并防止其与一种或多种其配体的结合。在其它实施方案中,本公开的药剂减少或消除Siglec-9的表达(即转录或翻译)。本文提供了降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂的类型的实例。
如本文所用,术语“与Siglec-9结合或相互作用的药剂”是指与Siglec-9蛋白直接或间接相互作用的分子。术语“药剂”意味着没有任何特定生物作用的机制,并且明确地包括并涵盖与Siglec-9的所有可能的药理学、生理学和生物化学相互作用,无论是直接的还是间接的以及是与Siglec-9还是通过另一种机制相互作用,并且其后果可通过各种不同的且化学相异的组合物来实现。示例性药剂包括但不限于特异性地结合至Siglec-9的抗Siglec-9抗体。
如本文所用,术语“RNA干扰”或“RNAi”通常是指其中双链RNA分子或短发夹RNA分子减少或抑制双链或短发夹RNA分子与其具有基本上或完全同源性的核酸序列表达的过程。术语“短干扰RNA”或“siRNA”或“RNAi剂”是指引发RNA干扰的RNA序列。参见Kreutzer等人,WO 00/44895;Zernicka-Goetz等人,WO 01/36646;Fire,WO 99/32619;Mello和Fire,WO01/29058。如本文所用,siRNA分子包括包含化学修饰的核苷酸和非核苷酸的RNA分子。术语“ddRNAi剂”是指从外源载体转录的DNA定向的RNAi剂。术语“短发夹RNA”或“shRNA”是指具有双链体区和环区的RNA结构。在某些实施方案中,ddRNAi剂初始表达为shRNA。
如本文所用,术语“适体”是指能够与所需分子靶标紧密且特异性结合的异源寡核苷酸,例如像常见的代谢辅因子(例如辅酶A、S-腺苷甲硫氨酸等)、蛋白质(例如补体蛋白C5、抗体等)或核酸分子中的保守结构元件(例如,对转录因子等的结合重要的结构)。适体通常包含长度在约10至约100个核苷酸、约10至约75个核苷酸、约10至约50个核苷酸、约10至约35个核苷酸以及约10至约25个核苷酸的范围内的DNA或RNA核苷酸序列。合成DNA或RNA寡核苷酸可使用标准固相亚磷酰胺方法和设备来制备,如通过使用可获自AppliedBiosystems(Foster City,CA)的3900高通量DNA Synthesizer
如本文所用的术语“约”是指本技术领域的技术人员容易知道的相应值的通常误差范围。本文中对“约”某一个值或参数的提及包括(以及描述)针对所述值或参数本身的实施方案。
如本文中所使用,单数形式“一个/种(a/an)”和“所述”包括复数提及物,除非上下文另外清楚地指示。例如,对一种“抗体”的引用是对一种至许多抗体(如摩尔量)的引用,并且包括本领域技术人员已知的其等效物等。
应理解,本文中描述的本公开的方面和实施方案包括“包含”方面和实施方案、“由方面和实施方案组成”和/或“主要由方面和实施方案组成”。
综述
本公开涉及降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用、或结合Siglec-9而不降低Siglec-9的细胞水平和/或而不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂(例如抗Siglec-9抗体);制备和使用此类药剂(例如,抗Siglec-9抗体)的方法;含有此类药剂(例如抗Siglec-9抗体)的药物组合物;编码此类药剂(例如抗Siglec-9抗体)的核酸;以及含有编码此类药剂(例如抗Siglec-9抗体)的核酸的宿主细胞。
在一些实施方案中,本公开的抗Siglec-9抗体具有一种或多种拮抗活性,所述拮抗活性至少部分是由于抗体抑制Siglec-9与一种或多种天然聚糖配体之间的相互作用的能力。在一些实施方案中,本公开的抗Siglec-9抗体可具有一种或多种拮抗活性,所述拮抗活性至少部分是由于抗体通过诱导Siglec-9的降解、下调、裂解、受体脱敏和/或溶酶体靶向而降低Siglec-9的细胞表达(例如细胞表面表达)的能力。
在一些实施方案中,抗体诱导的Siglec-9活性可通过本文公开的任何技术(参见例如实施例1-5)在体外测定或测试,包括但不限于测试全长抗Siglec-9抗体的板结合以增加暴露于Siglec-9的抗体的密度、使抗Siglec-9抗体与二级抗体交联、使抗Siglec-9抗体与表达一种或多种Fcg受体(例如FcgRIIB)的细胞交联,使用溶液中的Siglec-9抗体以及使用Siglec-9抗体的Fab片段。
本公开的某些方面至少部分基于鉴定表现出与一种或多种Siglec-9配体竞争结合至Siglec-9的能力和/或降低细胞上Siglec-9的细胞表面水平、从而导致一种或多种Siglec-9活性的降低、中和、预防或遏制的能力的药剂,如抗Siglec-9抗体。示例性Siglec-9活性包括但不限于,通过Src家族酪氨酸激酶如Syk、LCK、FYM和/或ZAP70磷酸化Tyr-433和Tyr-456;募集并结合至酪氨酸特异性蛋白磷酸酶SHP1和SHP2;募集并结合至PLC-γ1,其充当发动蛋白-1(Dynamini-1)的鸟嘌呤核苷酸交换因子;募集并结合至含SH2结构域的蛋白质(例如Crk1);募集并结合至脾酪氨酸激酶Syk;募集并结合至SH3-SH2-SH3生长因子受体结合蛋白2(Grb2);募集并结合至多种含SH2的蛋白质;调节一种或多种促炎性细胞因子的表达,所述促炎性细胞因子如FN-α4、IFN-β、IL-1β、IL-1α、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、CRP、MCP-1以及MIP-1-β;调节一种或多种细胞中的一种或多种促炎性细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;增加一种或多种抗炎细胞因子的表达,所述抗炎细胞因子如IL-4、IL-10、IL-13、IL-35、IL-16、TGF-β、IL-1Ra、G-CSF以及TNF、IFN-β1a、IFN-β1b或IL-6的可溶性受体;调节一种或多种细胞中的一种或多种抗炎细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节一种或多种选自以下的蛋白质的表达:C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX、以及PYCARD;抑制细胞外信号调控激酶(ERK)磷酸化;降低一种或多种细胞蛋白上的酪氨酸磷酸化,任选地,其中所述一种或多种细胞蛋白包含ZAP-70并且所述酪氨酸磷酸化发生在ZAP-70的Tyr-319上;调节C-C趋化因子受体7(CCR7)的表达;抑制针对表达CCL19的细胞和表达CCL21的细胞的小神经胶质细胞趋化性;减少由一种或多种细胞诱导的T细胞增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞、M2小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞以及M2 NK细胞;抑制破骨细胞产生,降低破骨细胞生成速率或两者;降低一种或多种细胞的存活,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;降低一种或多种细胞的增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的迁移,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的一种或多种功能,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的成熟,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种类型的清除,所述清除选自凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除、以及肿瘤细胞清除;任选地,其中所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;抑制以下中的一种或多种的吞噬:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞;任选地其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤或甲状腺癌;与肿瘤细胞上的Siglec-9配体结合;与细胞上的Siglec-9配体结合,所述细胞选自嗜中性粒细胞、树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞以及NK细胞;通过以下中的一种或多种抑制肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制以下中的一种或多种的抗肿瘤细胞转移活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制一种或多种含ITAM基序的受体,任选地其中所述一种或多种含ITAM基序的受体选自TREM1、TREM2、Sirpβ、FcgR、DAP10以及DAP12;通过一种或多种模式识别受体(PRR)抑制信号传导,任选地其中所述一种或多种PRR选自鉴定病原体相关分子模式(PAMP)的受体、鉴定损伤相关分子模式(DAMP)的受体以及其任何组合;抑制包含基序D/Ex
在一些实施方案中,用诸如Siglec-9阻断抗体的药剂治疗癌症:(i)直接或间接降低在癌症患者的肿瘤、外周血和淋巴器官中累积的肿瘤促进骨髓细胞/粒细胞免疫抑制细胞的存活、增殖、成熟、分化和/或功能性;(ii)减少癌症患者的肿瘤、外周血和其它淋巴器官中的肿瘤促进骨髓细胞/粒细胞免疫抑制细胞的数量;(iii)阻断骨髓来源的抑制细胞(MDSC)的肿瘤促进活性;(iv)降低癌症患者的肿瘤和外周血中的肿瘤促进细胞因子如TGF-β和IL-10的表达;(v)降低肿瘤中的肿瘤促进FoxP3+调控性T淋巴细胞浸润;(vi)增加具有肿瘤杀伤潜力的T淋巴细胞的浸润和活化;(vii)增加具有肿瘤杀伤潜力的肿瘤特异性NK细胞的浸润;(viii)增加NK细胞的杀瘤潜力;(ix)增加具有增强免疫应答的潜力的肿瘤特异性B淋巴细胞的浸润;(x)减少肿瘤体积;(xi)降低肿瘤生长速度;(xii)减少和/或抑制转移;(xiii)降低肿瘤复发率;(xiv)提高调节抗肿瘤T细胞应答的免疫疗法和癌症疫苗的功效,所述免疫疗法如PD1/PDL1、CTLA4、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、KIR、GAL9、CD2、CD5、CD39、CD73、CD30、TIGIT、VISTA、TIM1、TIM3、TIM4;(xv)诱导、活化或以其它方式增加PLCγ/PKC/钙动员;以及(xvi)诱导、活化或以其它方式增加PI3K/Akt、Ras/MAPK信号传导。
免疫抑制细胞有时也被称为骨髓来源的抑制细胞(MDSC)。在人中,MDSC可通过以下标志物组合中的一种来定义:(1)CD14
本公开还涉及与Siglec-9结合或相互作用的药剂,如抗Siglec-9抗体。在某些实施方案中,所述抗Siglec-9抗体不显著降低Siglec-9的细胞表面水平,和/或不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。
Siglec-9蛋白
在一个方面,本公开提供与本公开的Siglec-9蛋白内的区域如表位相互作用或以其它方式结合至所述区域的分离的(例如单克隆)抗体。在一些实施方案中,本公开的药剂,如本公开的抗Siglec-9抗体结合至Siglec-9蛋白并在与Siglec-9蛋白结合后调节一种或多种Siglec-9活性,例如,与细胞中Siglec-9表达相关的活性。本公开的Siglec-9蛋白包括但不限于哺乳动物Siglec-9蛋白、人Siglec-9蛋白、小鼠Siglec-9蛋白和大鼠Siglec-9蛋白。
Siglec-9被不同地称为Siglec-9分子、结合唾液酸的Ig样凝集素9、CD329抗原、CD329、CDw329、FOAP-9和OBBP-LIKE。
Siglec-9是主要在骨髓谱系细胞(包括但不限于巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、破骨细胞、单核细胞和小神经胶质细胞)上表达的免疫球蛋白样受体。在一些实施方案中,Siglec-9与CD64形成受体-信号传导复合物。在一些实施方案中,Siglec-9信号传导导致PI3K或其它细胞内信号的下游抑制。在骨髓细胞上,Toll样受体(TLR)信号对于抑制Siglec-9活性是重要的,例如在感染应答的情况下。TLR在病理性炎症应答中也起关键作用,例如在巨噬细胞、嗜中性粒细胞、NK细胞和树突细胞中表达的TLR。
已知各种Siglec-9同系物,包括但不限于人Siglec-9、黑猩猩Siglec-9、绿猴Siglec-9、猕猴Siglec-9和小鼠Siglec-9。人Siglec-9的氨基酸序列在下文中列出为SEQID NO:1:
在一些实施方案中,所述Siglec-9是包含信号序列的前蛋白。在一些实施方案中,所述Siglec-9是成熟蛋白质。在一些实施方案中,所述成熟Siglec-9蛋白不包含信号序列。在一些实施方案中,所述成熟Siglec-9蛋白在细胞上表达。在一些实施方案中,所述成熟Siglec-9蛋白在细胞,如细胞表面上表达,所述细胞包括但不限于人树突细胞、人巨噬细胞、人单核细胞、人破骨细胞、人嗜中性粒细胞、人T细胞、人辅助T细胞、人细胞毒性T细胞、人粒细胞以及人小神经胶质细胞。本公开的药剂(如本公开的抗Siglec-9抗体)可结合在本文公开的任何细胞上表达的本公开的任何Siglec-9蛋白。
本公开的Siglec-9蛋白如人Siglec-9包含若干结构域,包括但不限于位于SEQ IDNO:1的氨基酸残基1-17处的信号序列,位于SEQ ID NO:1的氨基酸残基20-140处的细胞外免疫球蛋白样可变型(IgV)结构域,位于SEQ ID NO:1的氨基酸残基146-229和236-336的两个Ig-样C2-型结构域,位于SEQ ID NO:1的氨基酸残基348-370处的跨膜结构域,位于SEQID NO:1的氨基酸残基431-436处的ITIM基序以及位于SEQ ID NO:1的氨基酸残基454-459处的SLAM样基序。如本领域技术人员将理解,本公开的结构域的起始和结束残基可根据所使用的计算机建模程序或用于确定结构域的方法而变化。
本公开的某些方面提供与人Siglec-9或其同系物(包括但不限于来自其它物种的哺乳动物Siglec-9蛋白和Siglec-9直向同源物)结合的抗Siglec-9抗体。示例性Siglec-9同系物和直向同源物列于表A中。
表A:Siglec-9同系物和直向同源物
因此,如本文所用,本公开的“Siglec-9”蛋白包括但不限于哺乳动物Siglec-9蛋白、人Siglec-9蛋白和灵长类动物Siglec-9蛋白。此外,本公开的抗Siglec-9抗体可结合哺乳动物Siglec-9蛋白、人Siglec-9蛋白和灵长类动物Siglec-9中的一种或多种内的表位。在一些实施方案中,本公开的抗Siglec-9抗体可特异性地结合至哺乳动物Siglec-9蛋白、人Siglec-9蛋白或两者。在某些实施方案中,本公开的抗Siglec-9抗体可特异性地结合至人Siglec-9、灵长类动物Siglec-9或两者。
在一些实施方案中,本公开的降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或与Siglec-9结合或相互作用的药剂,如本公开的抗Siglec-9抗体可以pH依赖性方式结合Siglec-9。在一些实施方案中,本公开的药剂(如抗Siglec-9抗体)可在中性pH下结合至Siglec-9并被内化而不与Siglec-9蛋白解离。或者,在酸性pH下,本公开的药剂,如抗Siglec-9抗体一旦被内化并随后通过内体/溶酶体途径降解就可从Siglec-9解离。在某些实施方案中,抗Siglec-9抗体在5.5至8.0、5.5至7.5、5.5至7.0、5.5至6.5、5.5至6.0、6.0至8.0、6.5至8.0、7.0至8.0、7.5至8.0、6.0至7.5、6.0至7.0、6.5至7.5范围内的pH下结合Siglec-9。在某些实施方案中,抗Siglec-9抗体在小于6.0、小于5.5、小于5.0、小于4.5、小于4.0、小于3.5、小于3.0、小于2.5或小于2.0的pH下从Siglec-9解离。
在一些实施方案中,本公开的降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或与Siglec-9结合或相互作用的药剂,如本公开的抗Siglec-9抗体结合至本公开的野生型Siglec-9蛋白、其天然存在的变体和/或其疾病变体。
在一些实施方案中,本公开的降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或与Siglec-9结合或相互作用的药剂,如本公开的抗Siglec-9抗体结合人Siglec-9的变体。
在一些实施方案中,本公开的降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或与Siglec-9结合或相互作用的药剂,如本公开的抗Siglec-9抗体与细胞表面上表达的Siglec-9蛋白结合,所述细胞包括但不限于人树突细胞、人巨噬细胞、人NK细胞、人单核细胞、人破骨细胞、人嗜中性粒细胞、人T细胞、人T辅助细胞、人细胞毒性T细胞、人粒细胞以及人小神经胶质细胞。在一些实施方案中,本公开的降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或与Siglec-9结合或相互作用的药剂,如本公开的抗Siglec-9抗体与细胞表面上表达的Siglec-9蛋白结合,并在与表面表达的Siglec-9蛋白结合后调节(例如诱导或抑制)本公开的至少一种Siglec-9活性。在本公开的一些实施方案中,所述抗Siglec-9抗体特异性地结合至Siglec-9蛋白。在本公开的一些实施方案中,所述抗Siglec-9抗体进一步结合至至少一种另外的Siglec蛋白。在一些实施方案中,所述抗Siglec-9抗体调节至少一种另外的Siglec蛋白或表达所述至少一种另外的Siglec蛋白的细胞的一种或多种活性。
Siglec-9配体
本公开的Siglec-9蛋白可与一种或多种Siglec-9配体相互作用(例如结合)。
示例性Siglec-9配体包括但不限于唾液酸、含唾液酸的糖脂、含唾液酸的糖蛋白、含α-2,8-二唾液酸的糖脂、含支链α-2,6-连接的唾液酸的糖蛋白、含末端α-2,6-连接的唾液酸的糖脂、含末端α-2,3-连接的唾液酸的糖蛋白、双唾液酸神经节苷脂(例如含有与唾液酸化聚糖连接的神经酰胺的神经节苷脂或糖脂)、分泌的粘蛋白、在红细胞上表达的Siglec-9配体、在细菌细胞上表达的Siglec-9配体、在凋亡细胞上表达的Siglec-9配体、在神经细胞上表达的Siglec-9配体、在神经胶质细胞上表达的Siglec-9配体、在小神经胶质细胞上表达的Siglec-9配体、在星形胶质细胞上表达的Siglec-9配体、在肿瘤细胞上表达的Siglec-9配体、在病毒上表达的Siglec-9配体、在树突细胞上表达的Siglec-9配体、与β淀粉样蛋白斑块结合的Siglec-9配体、与Tau缠结结合的Siglec-9配体、致病蛋白上的Siglec-9配体、致病肽上的Siglec-9配体、在巨噬细胞上表达的Siglec-9配体、在嗜中性粒细胞上表达的Siglec-9配体、在天然杀伤细胞上表达的Siglec-9配体、在单核细胞上表达的Siglec-9配体、在T细胞上表达的Siglec-9配体、在T辅助细胞上表达的Siglec-9配体、在细胞毒性T细胞上表达的Siglec-9配体、在B细胞上表达的Siglec-9配体、在肿瘤包埋的免疫抑制树突细胞上表达的Siglec-9配体、在肿瘤包埋的免疫抑制巨噬细胞上表达的Siglec-9配体、在骨髓源性抑制细胞上表达的Siglec-9配体、在调控性T细胞上表达的Siglec-9配体。在一些实施方案中,本公开的Siglec-9配体是神经节苷脂(例如,双唾液酸神经节苷脂)。双唾液酸神经节苷脂通常共有乳-神经酰胺核心和一个或多个唾液酸残基。
合适的Siglec-9配体的其它实例描绘于图2中。
合适的神经节苷脂(例如,双唾液酸神经节苷脂)配体的其它实例描绘于图3中并列于表B中。通常,神经节苷脂(例如,双唾液酸神经节苷脂)是由糖链上连接有一种或多种唾液酸(例如,n-乙酰基-神经氨酸,NANA)的鞘糖脂构成的分子。
表B:示例性神经节苷脂Siglec-9配体的结构
Siglec-9药剂
本公开的某些方面涉及降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂(例如,Siglec-9药剂)。本公开的其他方面涉及结合Siglec-9而不降低Siglec-9的细胞水平和/或不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂(例如,Siglec-9药剂)。本公开的其它方面涉及与Siglec-9结合或相互作用的药剂(例如Siglec-9药剂)。在一些实施方案中,本公开的药剂阻断、抑制、降低或干扰体外、原位和/或体内Siglec-9蛋白的一种或多种活性。在一些实施方案中,本公开的药剂不会阻断、抑制、降低或干扰体外、原位和/或体内Siglec-9蛋白的一种或多种活性。在一些实施方案中,本公开的药剂增加、活化或诱导体外、原位和/或体内Siglec-9蛋白的一种或多种活性。
在某些实施方案中,本公开的药剂是降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂(例如,Siglec-9药剂)。本公开的降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂是具有一种或多种以下特征的分子:(1)抑制或降低一种或多种Siglec-9活性;(2)抑制或降低Siglec-9与一种或多种其配体结合的能力;(3)降低表达Siglec-9的细胞中的Siglec-9表达(如在mRNA水平和/或在蛋白质水平下)的能力;(4)与Siglec-9蛋白相互作用、结合或识别Siglec-9蛋白的能力;(5)与Siglec-9蛋白特异性地相互作用或结合的能力;以及(6)治疗、改善或预防本文描述或考虑的疾病或病症的任何方面的能力。
抑制Siglec-9产生的示例性药剂包括但不限于特异性地抑制Siglec-9合成和/或释放的化合物、针对Siglec-9的反义分子或针对编码Siglec-9的核酸的短干扰RNA(siRNA)分子。抑制一种或多种Siglec-9活性的其它示例性药剂包括但不限于,特异性地结合至Siglec-9蛋白的抗Siglec-9抗体、特异性地抑制一种或多种Siglec-9活性的化合物(如小分子抑制剂和/或肽抑制剂)、特异性地抑制Siglec-9与一种或多种配体的结合的化合物、Siglec-9结构类似物或结合Siglec-9的RNA或DNA适体。在一些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂是变构抑制剂。在一些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂是正构抑制剂。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂是小分子抑制剂,包括但不限于小肽或肽样分子、可溶性肽和合成的非肽基有机或无机化合物。小分子抑制剂可具有约100至约20,000道尔顿(Da)、约500至约15,000Da、约1000至约10,000Da中的任一个的分子量。用于制备和测试小分子对一种或多种Siglec-9活性的抑制作用的方法在本领域中是熟知的,并且此类方法可用于评估小分子抑制剂对Siglec-9活性的影响。例如,本文公开的任何方法和测定都可用于筛选降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的小分子抑制剂。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂是与Siglec-9结合或物理相互作用的抗Siglec-9抗体。所述抗体可对靶抗原(例如,Siglec-9)具有纳摩尔或甚至皮摩尔亲和力。在某些实施方案中,所述抗体的Kd是约0.05至约100nM。例如,所述抗体的Kd是以下中的任一个:约100nM、约50nM、约10nM、约1nM、约900pM、约800pM、约790pM、约780pM、约770pM、约760pM、约750pM、约740pM、约730pM、约720pM、约710pM、约700pM、约650pM、约600pM、约590pM、约580pM、约570pM、约560pM、约550pM、约540pM、约530pM、约520pM、约510pM、约500pM、约450pM、约400pM、约350pM、约300pM、约290pM、约280pM、约270pM、约260pM、约250pM、约240pM、约230pM、约220pM、约210pM、约200pM、约150pM、约100pM、或约50pM至约2pM、约5pM、约10pM、约15pM、约20pM或约40pM中的任一个。本文描述了用于制备和选择与Siglec-9特异性相互作用和/或结合的抗体的方法。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂包含至少一种能够通过靶向编码Siglec-9的核酸而阻断或降低功能性Siglec-9的表达的反义分子。Siglec-9的核酸序列在本领域中是已知的。例如,人Siglec-9可具有如在NCBI登录号NM_001198558.1中所示的核酸序列,并且黑猩猩Siglec-9可具有如在NCBI登录号XM_003316566.3中所示的核酸序列,并且小鼠SIGLEC-E可具有如在NCBI登录号NM_031181.2中所示的核酸序列。已知用于制备反义寡核苷酸分子的方法,并且此类方法可用于制备将特异性地结合一种或多种Siglec-9mRNA而不与其它多核苷酸交叉反应的反义寡核苷酸。靶向的示例性位点包括但不限于起始密码子、5'调控区、编码序列(包括任何保守的共有区)以及3'非翻译区。在某些实施方案中,反义寡核苷酸的长度是约10至约100个核苷酸、约15至约50个核苷酸、约18至约25个核苷酸或更多。在某些实施方案中,所述寡核苷酸还包含化学修饰以增加核酸酶抗性等,例如像本领域的普通技术人员已知的硫代磷酸酯键联和2'-O-糖修饰。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂包含至少一种能够通过靶向编码Siglec-9的核酸而阻断或降低功能性Siglec-9的表达的siRNA分子。用于制备siRNA分子的方法在本领域中是熟知的,并且此类方法可用于制备将特异性地靶向Siglec-9mRNA而不与其它多核苷酸交叉反应的siRNA分子。siRNA分子可通过诸如通过典型固相寡核苷酸合成的方法产生,并且通常将并入化学修饰以增加siRNA药剂的半衰期和/或功效,和/或允许更稳健的递送制剂。或者,使用编码用于siRNA的细胞内转录的表达盒的载体来递送siRNA分子。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂是与Siglec-9结合或物理相互作用的RNA或DNA适体,并阻断Siglec-9与一种或多种其配体之间的相互作用。在某些实施方案中,所述适体包含至少一种结合至成熟形式的Siglec-9的RNA或DNA适体。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂包含至少一种Siglec-9结构类似物。术语Siglec-9结构类似物是指具有与Siglec-9的三维结构的一部分类似的三维结构并且在生理条件下在体外或体内结合至一种或多种CD3配体的化合物,其中所述结合至少部分地抑制Siglec-9生物活性。合适的Siglec-9结构类似物可通过Siglec-9与本公开的配体(如Siglec-9配体)的结合的分子建模来设计和合成。Siglec-9结构类似物可以是相同或不同结构的任何所需组合的单体、二聚体或更高级多聚体,以获得改善的亲和力和生物作用。在一些实施方案中,所述药剂与Siglec-9的氨基酸序列结合或相互作用。
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂包含可溶性Siglec-9受体蛋白、可溶性Siglec-9-Fc融合蛋白(例如,Siglec-9免疫粘附素)、结合至Siglec-9配体的可溶性Siglec受体、结合至Siglec-9配体的Siglec-Fc融合蛋白(例如,Siglec免疫粘附素)。在某些实施方案中,此类药剂结合一种或多种Siglec-9配体,且由此防止给定Siglec-9配体与功能性Siglec-9受体之间的相互作用。
在某些实施方案中,本公开的药剂是与Siglec-9结合或相互作用的药剂(例如,Siglec-9药剂)。与Siglec-9结合或相互作用的示例性药剂包括但不限于惰性抗Siglec-9抗体、激动剂抗Siglec-9抗体、Siglec-9配体、Siglec-9配体激动剂片段、Siglec-9免疫粘附素、Siglec-9可溶性受体、Siglec-Fc融合蛋白(例如,Siglec免疫粘附素)、可溶性Siglec受体、Siglec-9配体模拟物以及小分子化合物。小分子化合物可具有约100至约20,000道尔顿(Da)、约500至约15,000Da、约1000至约10,000Da中的任一个的分子量。用于制备和测试药剂对一种或多种Siglec-9活性的作用的方法在本领域中是熟知的,并且此类方法可用于评估小分子抑制剂对Siglec-9活性的影响。例如,本文公开的任何方法和测定可用于筛选与Siglec-9结合或相互作用的小分子抑制剂。
测定
降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂可使用本领域中熟知的方法鉴定和/或表征,例如放射性标记的抑制剂测定、光学测定、蛋白质结合测定、生物化学筛选测定、免疫测定、质量偏移测量测定、荧光测定和/或荧光肽裂解测定。
结合测定和其它测定
在某些实施方案中,降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用的药剂可通过本领域中熟知的用于检测Siglec-9药剂候选物与Siglec-9的相互作用和/或结合亲和力的存在的技术来鉴定。
在某些实施方案中,可使用放射性标记的抑制剂测定来鉴定与Siglec-9相互作用的药剂。例如,已知量的放射性标记药剂候选物可与已知量的固定化Siglec-9和缓冲液一起孵育。随后,可用缓冲液洗涤固定化的Siglec-9,并且可使用本领域中已知的技术(例如像γ计数器)来测量固定化的Siglec-9的放射性标记的Siglec-9药剂候选物的剩余存在。指示放射性标记物质的存在的测量可指示放射性标记的药剂候选物能够与Siglec-9相互作用和/或结合。
在某些实施方案中,可使用光学技术来鉴定与Siglec-9相互作用的药剂。用于检测Siglec-9药剂的示例性光学技术可包括例如将Siglec-9连接至比色共振接枝表面、从而由于光必须采取的光学路径的变化而改变反射光的波长,并且随后在允许候选药剂与Siglec-9相互作用时测量反射光波长的另外变化。例如,当将药剂与Siglec-9一起孵育时,反射光的测量波长没有变化可能表明药剂候选物不能与Siglec-9相互作用。当药剂候选物与Siglec-9一起孵育时,反射光的测量波长的变化可表明所述药剂候选物能够与Siglec-9结合和/或相互作用。
在某些实施方案中,可使用蛋白质结合测定来鉴定与Siglec-9相互作用的药剂。用于检测Siglec-9药剂的示例性蛋白质结合测定可包括例如在药剂候选物存在下对Siglec-9的免疫共沉淀。例如,可将Siglec-9与药剂候选物一起在缓冲液中孵育,且随后可使用对捕获Siglec-9具有特异性的固定化分子(例如像抗Siglec-9抗体)来在药剂候选物存在下捕获Siglec-9并且在本领域中已知的洗涤程序期间结合Siglec-9,可能具有相互作用药剂候选物。随后,可释放可能具有相互作用药剂候选物的Siglec-9,并且可基于药剂候选特征通过例如像质谱和/或蛋白质印迹的技术来检测药剂候选物的存在。
在某些实施方案中,可使用本领域中熟知的生物化学和/或免疫测定测定来鉴定与Siglec-9相互作用的药剂。示例性技术可包括例如使用技术(例如像蛋白质印迹、免疫染色和免疫共沉淀)定量测量Siglec-9浓度和/或蛋白质半衰期的变化的测定。例如,可将药剂候选物与含有Siglec-9的样品(如表达Siglec-9的细胞)一起孵育,且随后可在时程研究期间的点处测量Siglec-9蛋白的量和/或细胞水平。与对照治疗相比,蛋白质量、细胞水平和/或蛋白质半衰期的变化可表明Siglec-9药剂候选物可能能够改变Siglec-9半衰期和/或活性。
在某些实施方案中,质量偏移测量测定可用于鉴定与Siglec-9相互作用的药剂。示例性质量偏移测量测定可包括例如通过使用仪器(如但不限于质谱仪)当药剂候选物与Siglec-9相互作用时测量Siglec-9质量的变化来检测强和/或共价结合的Siglec-9药剂的存在。例如,取决于药剂候选物相互作用的性质,可对整个蛋白质和/或基于肽的分析进行质量偏移测定。检测与向Siglec-9添加所述药剂候选物相关的质量偏移可表明药剂候选物可能能够与Siglec-9相互作用或以其它方式抑制Siglec-9。另外,示例性质量偏移测量测定可包括例如使用技术(例如像表面等离子体共振)当药剂候选物与Siglec-9相互作用时检测向Siglec-9添加与相应药剂候选物质量相关的质量。例如,可测量光的折射率的变化并且将其与传感器表面附着的Siglec-9的质量变化相关联。
在某些实施方案中,化学交联测定可用于鉴定与Siglec-9相互作用的Siglec-9试剂。例如,药剂候选物可与Siglec-9在体内或体外与能够将与Siglec-9相互作用的药剂候选物共价连接至所述Siglec-9分子的分子交联剂一起孵育。随后,可使用诸如但不限于质谱法和/或蛋白质印迹的技术来鉴定能够与Siglec-9相互作用或以其它方式抑制Siglec-9的药剂候选物。例如,检测与药剂候选物共价交联的Siglec-9可表明所述药剂候选物可能能够与Siglec-9相互作用或以其它方式抑制Siglec-9。
在某些实施方案中,可使用荧光测定来鉴定与Siglec-9相互作用的药剂。例如,已知量的荧光药剂候选物可与已知量的固定化Siglec-9和缓冲液一起孵育。随后,可用缓冲液洗涤固定化的Siglec-9,并且可使用本领域中已知的技术(如但不限于荧光检测)来测量固定化的Siglec-9的荧光Siglec-9药剂候选物的剩余存在。指示荧光物质的存在的测量可指示荧光药剂候选物能够与Siglec-9相互作用和/或结合。
活性测定
本领域已知和本文描述的测定(例如实施例1-10)可用于鉴定和测试本公开的Siglec-9药剂的生物活性。在一些实施方案中,提供了用于测试Siglec-9药剂调节一种或多种Siglec-9活性的能力的测定。
抗Siglec-9抗体
本公开的某些方面涉及降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)的抗Siglec-9抗体。在一些实施方案中,所述抗Siglec-9抗体降低Siglec-9的细胞水平而不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)。在一些实施方案中,所述抗Siglec-9抗体抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)。在一些实施方案中,所述抗Siglec-9抗体降低Siglec-9的细胞水平并抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)。本公开的其它方面涉及结合Siglec-9而不降低Siglec-9的细胞水平和/或不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)的抗Siglec-9抗体。
如本文所公开,Siglec-9可在细胞上组成性再循环,并且因此可将结合细胞表面上的Siglec-9的任何药剂(例如抗体)再循环到细胞中(例如内吞)。然而,这种内吞作用可能不会导致Siglec-9的细胞水平(例如细胞表面水平)降低。尽管已经显示急性骨髓性白血病(AML)细胞可介导与表面表达的Siglec-9结合的抗Siglec-9抗体的胞吞作用,但没有证实Siglec-9的细胞水平降低。因此,本公开的某些方面涉及不仅与细胞表面表达的Siglec-9结合、而且降低Siglec-9的细胞水平的抗Siglec-9抗体。在一些实施方案中,本公开的抗Siglec-9抗体结合细胞表面表达的Siglec-9并进一步内吞到细胞中。在一些实施方案中,本公开的抗Siglec-9抗体结合细胞表面表达的Siglec-9而不被内吞到细胞中。
Siglec-9的细胞水平可指但不限于Siglec-9的细胞表面水平、Siglec-9的细胞内水平和Siglec-9的总水平。在一些实施方案中,Siglec-9的细胞水平的降低包括Siglec-9的细胞表面水平的降低。如本文所用,如果抗Siglec-9抗体诱导Siglec-9的细胞表面水平降低21%或更多,如通过本文所述或本领域中已知的任何体外基于细胞的测定或合适的体内模型所测量,例如利用流式细胞术如荧光活化的细胞分选(FACS)来测量Siglec-9的细胞表面水平,则所述抗Siglec-9抗体降低Siglec-9的细胞表面水平。在一些实施方案中,Siglec-9的细胞水平的降低包括Siglec-9的细胞内水平的降低。如本文所用,如果抗Siglec-9抗体诱导Siglec-9的细胞内水平降低21%或更多,如通过本文所述或本领域中已知的任何体外基于细胞的测定或合适的体内模型(例如免疫染色、蛋白质印迹分析、免疫共沉淀以及细胞计数)所测量,则所述抗Siglec-9抗体降低Siglec-9的细胞内水平。在一些实施方案中,Siglec-9的细胞水平的降低包括Siglec-9的总水平的降低。如本文所用,如果抗Siglec-9抗体诱导Siglec-9的总水平降低21%或更多,如通过本文所述或本领域中已知的任何体外基于细胞的测定或合适的体内模型(例如免疫染色、蛋白质印迹分析、免疫共沉淀以及细胞计数)所测量,则所述抗Siglec-9抗体降低Siglec-9的总水平。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9降解、Siglec-9裂解、Siglec-9内化、Siglec-9脱落和/或Siglec-9表达的下调。在一些实施方案中,利用体外细胞测定在原代细胞(例如树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞和巨噬细胞)上或细胞系上测量Siglec-9的细胞水平。
在一些实施方案中,与在抗Siglec-9抗体不存在下Siglec-9的细胞水平相比,本公开的抗Siglec-9抗体使Siglec-9的细胞水平降低至少21%、至少22%、至少23%、至少24%、至少25%、至少26%、至少27%、至少28%、至少29%、至少30%、至少31%、至少32%、至少33%、至少34%、至少35%、至少36%、至少37%、至少38%、至少39%、至少40%、至少41%、至少42%、至少43%、至少44%、至少45%、至少46%、至少47%、至少48%、至少49%、至少50%、至少51%、至少52%、至少53%、至少54%、至少55%、至少56%、至少57%、至少58%、至少59%、至少60%、至少61%、至少62%、至少63%、至少64%、至少65%、至少66%、至少67%、至少68%、至少69%、至少70%、至少71%、至少72%、至少73%、至少74%、至少75%、至少76%、至少77%、至少78%、至少79%、至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多。
本文描述的或本领域中已知的任何体外基于细胞的测定或合适的体内模型可用于测量Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)的抑制。在一些实施方案中,利用本文所述的或本领域中已知的任何体外测定或基于细胞的培养测定,在饱和抗体浓度(例如67nM)下,本公开的抗Siglec-9抗体将Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)抑制至少21%、至少22%、至少23%、至少24%、至少25%、至少26%、至少27%、至少28%、至少29%、至少30%、至少31%、至少32%、至少33%、至少34%、至少35%、至少36%、至少37%、至少38%、至少39%、至少40%、至少41%、至少42%、至少43%、至少44%、至少45%、至少46%、至少47%、至少48%、至少49%、至少50%、至少51%、至少52%、至少53%、至少54%、至少55%、至少56%、至少57%、至少58%、至少59%、至少60%、至少61%、至少62%、至少63%、至少64%、至少65%、至少66%、至少67%、至少68%、至少69%、至少70%、至少71%、至少72%、至少73%、至少74%、至少75%、至少76%、至少77%、至少78%、至少79%、至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多。
在一些实施方案中,本公开的抗Siglec-9抗体抑制Siglec-9的细胞表面簇集。在一些实施方案中,本公开的抗Siglec-9抗体抑制Siglec-9蛋白的一种或多种活性,包括但不限于,通过Src家族酪氨酸激酶如Syk、LCK、FYM和/或ZAP70磷酸化Tyr-433和Tyr-456;募集并结合至酪氨酸特异性蛋白磷酸酶SHP1和SHP2;募集并结合至PLC-γ1,其充当发动蛋白-1的鸟嘌呤核苷酸交换因子;募集并结合至含SH2结构域的蛋白质(例如Crk1);募集并结合至脾酪氨酸激酶Syk;募集并结合至SH3-SH2-SH3生长因子受体结合蛋白2(Grb2);募集并结合至多种含SH2的蛋白质;调节一种或多种促炎性细胞因子的表达,任选地其中所述一种或多种抗炎细胞因子选自由以下各项组成的组:FN-α4、IFN-β、IL-1β、IL-1α、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-33、MCP-1以及MIP-1-β;调节一种或多种细胞中的一种或多种促炎性细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节一种或多种抗炎细胞因子的表达,任选地其中所述一种或多种抗炎细胞因子选自IL-4、IL-10、IL-13、IL-35、IL-16、TGF-β、IL-1Ra、G-CSF以及TNF、IFN-β1a、IFN-β1b或IL-6的可溶性受体;调节一种或多种细胞中的一种或多种抗炎细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节一种或多种选自以下的蛋白质的表达:C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX以及PYCARD;抑制细胞外信号调控激酶(ERK)磷酸化;降低一种或多种细胞蛋白上的酪氨酸磷酸化,任选地,其中所述一种或多种细胞蛋白包含ZAP-70并且所述酪氨酸磷酸化发生在ZAP-70的Tyr-319上;调节C-C趋化因子受体7(CCR7)的表达;抑制针对表达CCL19的细胞和表达CCL21的细胞的小神经胶质细胞趋化性;减少由一种或多种细胞诱导的T细胞增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞、M2小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞以及M2 NK细胞;抑制破骨细胞产生,降低破骨细胞生成速率或两者;降低一种或多种细胞的存活,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;降低一种或多种细胞的增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的迁移,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的一种或多种功能,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的成熟,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种类型的清除,所述清除选自凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除以及肿瘤细胞清除;任选地,其中所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;抑制以下中的一种或多种的吞噬:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞;任选地其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤或甲状腺癌;与肿瘤细胞上的Siglec-9配体结合;与细胞上的Siglec-9配体结合,所述细胞选自嗜中性粒细胞、树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞以及NK细胞;通过以下中的一种或多种抑制肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制以下中的一种或多种的抗肿瘤细胞转移活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;调节一种或多种炎性受体的表达,任选地其中所述一种或多种炎性受体包括CD86,并且所述一种或多种炎性受体在以下中的一种或多种上表达:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制一种或多种含ITAM基序的受体,任选地其中所述一种或多种含ITAM基序的受体选自TREM1、TREM2、Sirpβ、FcgR、DAP10以及DAP12;通过一种或多种模式识别受体(PRR)抑制信号传导,任选地其中所述一种或多种PRR选自鉴定病原体相关分子模式(PAMP)的受体、鉴定损伤相关分子模式(DAMP)的受体以及其任何组合;抑制包含基序D/Ex
在一些实施方案中,所述抗Siglec-9抗体抑制本公开的Siglec-9蛋白与一种或多种Siglec-9配体之间的相互作用(例如结合),所述一种或多种Siglec-9配体包括但不限于在红细胞上表达的Siglec-9配体、在细菌细胞上表达的Siglec-9配体、在凋亡细胞上表达的Siglec-9配体、在神经细胞上表达的Siglec-9配体、在神经胶质细胞上表达的Siglec-9配体、在小神经胶质细胞上表达的Siglec-9配体、在星形胶质细胞上表达的Siglec-9配体、在肿瘤细胞上表达的Siglec-9配体、在病毒上表达的Siglec-9配体、在树突细胞上表达的Siglec-9配体、与β淀粉样蛋白斑块结合的Siglec-9配体、与Tau缠结结合的Siglec-9配体、致病蛋白上的Siglec-9配体、致病肽上的Siglec-9配体、在巨噬细胞上表达的Siglec-9配体、在嗜中性粒细胞上表达的Siglec-9配体、在天然杀伤细胞上表达的Siglec-9配体、在单核细胞上表达的Siglec-9配体、在T细胞上表达的Siglec-9配体、在T辅助细胞上表达的Siglec-9配体、在细胞毒性T细胞上表达的Siglec-9配体、在B细胞上表达的Siglec-9配体、在肿瘤包埋的免疫抑制树突细胞上表达的Siglec-9配体、在肿瘤包埋的免疫抑制巨噬细胞上表达的Siglec-9配体、在骨髓源性抑制细胞上表达的Siglec-9配体、在调控性T细胞上表达的Siglec-9配体、分泌的粘蛋白、唾液酸、含唾液酸的糖脂、含唾液酸的糖蛋白、含α-2,8-二唾液酸的糖脂、含支链α-2,6-连接的唾液酸的糖蛋白、含末端α-2,6-连接的唾液酸的糖脂、含末端α-2,3-连接的唾液酸的糖蛋白以及神经节甘脂(例如,双唾液酸神经节苷脂)。
在一些实施方案中,本公开的抗Siglec-9抗体结合至在细胞表面上表达的本公开的Siglec-9蛋白,并且裸抗体抑制Siglec-9蛋白与一种或多种Siglec-9配体之间的相互作用(例如,结合)。在一些实施方案中,结合至本公开的Siglec-9蛋白的本公开的抗Siglec-9抗体通过降低可用于在细胞表面上或细胞内与这些蛋白质相互作用的Siglec-9的有效水平来抑制Siglec-9蛋白与一种或多种Siglec-9配体之间的相互作用(例如结合)。在一些实施方案中,结合至本公开的Siglec-9蛋白的本公开的抗Siglec-9抗体通过诱导Siglec-9的降解来抑制Siglec-9蛋白与一种或多种Siglec-9配体之间的相互作用(例如结合)。
在可与前述实施方案中的任一项组合的一些实施方案中,所述抗Siglec-9抗体展示一种或多种选自由以下各项组成的组的活性:(a)增加肿瘤浸润CD3
本公开的其它方面涉及抗Siglec-9抗体,所述抗Siglec-9抗体不显著降低Siglec-9的细胞表面水平和/或不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。
如本文所用,利用本文所述的或本领域中已知的任何体外基于细胞的测定或合适的体内模型,如果与不存在抗Siglec-9抗体的情况下Siglec-9的细胞水平相比,抗Siglec-9抗体使配体与Siglec-9的结合降低少于20%,则所述抗Siglec-9抗体不显著降低Siglec-9的细胞表面水平。在一些实施方案中,与不存在抗Siglec-9抗体情况下Siglec-9的细胞水平相比,本公开的抗Siglec-9抗体使Siglec-9的细胞表面水平降低小于20%、小于19%、小于18%、小于17%、小于16%、小于15%、小于14%、小于13%、小于12%、小于11%、小于10%、小于9%、小于8%、小于7%、小于6%、小于5%、小于4%、小于3%、小于2%或小于1%。
如本文所用,利用本文所述的或本领域中已知的任何体外测定或基于细胞的培养测定,如果抗Siglec-9抗体在饱和抗体浓度(例如,67nM)下使配体与Siglec-9的结合降低少于20%,则所述抗Siglec-9抗体不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)。在一些实施方案中,利用本文所述的或本领域中已知的任何体外测定或基于细胞的培养测定,在饱和抗体浓度(例如,67nM)下本公开的抗Siglec-9抗体将Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)抑制小于20%、小于19%、小于18%、小于17%、小于16%、小于15%、小于14%、小于13%、小于12%、小于11%、小于10%、小于9%、小于8%、小于7%、小于6%、小于5%、小于4%、小于3%、小于2%或小于1%。
如本文所用,Siglec-9的水平可指编码Siglec-9的基因的表达水平;编码Siglec-9的一种或多种转录物的表达水平;Siglec-9蛋白的表达水平;和/或细胞内和/或细胞表面上存在的Siglec-9蛋白的量。本领域中用于测量基因表达、转录、翻译和/或蛋白质丰度或定位的水平的任何已知方法可用于测定Siglec-9的水平。
另外,本公开的抗Siglec-9抗体可用于预防以下疾病、降低所述疾病的风险或治疗所述疾病:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特—雅格布病(Creutzfeldt-Jakob disease)、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、tau蛋白病(taupathy disease)、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞病(Behcet's disease)、帕金森氏病、路易体痴呆、多系统萎缩症、Shy-Drager综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病(Paget's disease of bone)、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、Cruzi感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和/或流感嗜血杆菌。在一些实施方案中,本公开的抗Siglec-9抗体可用于诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖;或用于降低有需要的个体中以下各项的活性、功能性或存活:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞和/或慢性骨髓性白血病(CML)细胞。在一些实施方案中,本公开的抗Siglec-9抗体是单克隆抗体。
在一些实施方案中,本公开的分离的抗Siglec-9抗体降低Siglec-9的细胞水平(例如,细胞表面水平、细胞内水平和/或总水平)。在一些实施方案中,本公开的分离的抗Siglec-9抗体诱导Siglec-9的下调。在一些实施方案中,本公开的分离的抗Siglec-9抗体诱导Siglec-9的裂解。在一些实施方案中,本公开的分离的抗Siglec-9抗体诱导Siglec-9的内化。在一些实施方案中,本公开的分离的抗Siglec-9抗体诱导Siglec-9的脱落。在一些实施方案中,本公开的分离的抗Siglec-9抗体诱导Siglec-9的降解。在一些实施方案中,本公开的分离的抗Siglec-9抗体诱导Siglec-9的脱敏。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物以瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9的细胞水平降低和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)之前瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9的降解之前瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9的裂解之前瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9的内化之前瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9的脱落之前瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9表达的下调之前瞬时活化Siglec-9。在一些实施方案中,本公开的分离的抗Siglec-9抗体充当配体模拟物并且在诱导Siglec-9的脱敏之前瞬时活化Siglec-9。
在一些实施方案中,本公开的分离的抗Siglec-9抗体是鼠抗体。在一些实施方案中,本公开的分离的抗Siglec-9抗体是人抗体、人源化抗体、双特异性抗体、单克隆抗体、多价抗体或嵌合抗体。此类抗体的示例性描述在整个本公开中发现。
在一些实施方案中,本公开的抗Siglec-9抗体结合至人Siglec-9或其同源物,包括但不限于哺乳动物Siglec-9蛋白、黑猩猩Siglec-9蛋白(NCBI登录号XP_003316614)、绿猴Siglec-9蛋白(NCBI登录号XP_007995940.1)、猕猴Siglec-9蛋白(NCBI登录号XP_001114560.2)以及小鼠SIGLEC-E蛋白(NCBI登录号NP_112458.2)。在一些实施方案中,本公开的抗Siglec-9抗体特异性地结合至人Siglec-9。在一些实施方案中,本公开的抗Siglec-9抗体特异性地结合至灵长类动物Siglec-9。在一些实施方案中,本公开的抗Siglec-9抗体特异性地结合至人Siglec-9和灵长类动物Siglec-9两者。
在一些实施方案中,本公开的抗Siglec-9抗体是结合至在细胞表面上表达的本公开的Siglec-9蛋白并且在结合至表面表达的Siglec-9蛋白后调节(例如,诱导或抑制)本公开的一种或多种Siglec-9活性的激动剂抗体或拮抗剂抗体。在一些实施方案中,本公开的抗Siglec-9抗体是惰性抗体。
在一些实施方案中,本公开的抗Siglec-9抗体不显著降低TREM2表达,包括但不限于TREM2的细胞表面水平、TREM2的细胞内水平和/或TREM2的总水平。在一些实施方案中,抗Siglec-9抗体不降低体内TREM2的细胞水平。在一些实施方案中,在选自树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞、嗜中性粒细胞和NK细胞的原代细胞上或在细胞系上测量TREM2的细胞水平,并且其中使用体外细胞测定来测量TREM2的细胞水平。如本文所用,利用本文所述的或本领域中已知的任何体外基于细胞的测定或合适的体内模型,如果与不存在抗Siglec-9抗体情况下的TREM2表达相比,抗Siglec-9抗体使TREM2降低少于20%,则所述抗Siglec-9抗体不显著降低cTREM2表达。在一些实施方案中,与不存在抗Siglec-9抗体情况下的TREM2表达相比,本公开的抗Siglec-9抗体使TREM2表达降低小于20%、小于19%、小于18%、小于17%、小于16%、小于15%、小于14%、小于13%、小于12%、小于11%、小于10%、小于9%、小于8%、小于7%、小于6%、小于5%、小于4%、小于3%、小于2%或小于1%。
抗Siglec-9抗体结合区
本公开的某些方面提供抗Siglec-9抗体,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基62-76内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基62-76的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基62-76和86-92内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基86-92内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基86-92的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ IDNO:1)的氨基酸残基86-96内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基86-96的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基86-96和105-116内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基105-116内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基105-116的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基107-115内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基107-115的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,所述抗Siglec-9抗体结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基185-194内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基内的一个或多个氨基酸。
在一些实施方案中,本公开的抗Siglec-9抗体结合至一个或多个选自以下的氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194,或哺乳动物Siglec-9蛋白上对应于选自以下的氨基酸残基的一个或多个氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194。在一些实施方案中,本公开的抗Siglec-9抗体结合至选自SEQ ID NO:1的D189、P190和R194的一个或多个、两个或更多个或全部三个氨基酸残基,或者哺乳动物Siglec-9蛋白上对应于选自SEQ ID NO:1的D189、P190和R194的氨基酸残基的一个或多个、两个或更多个或全部三个氨基酸残基。在一些实施方案中,本公开的抗Siglec-9抗体结合至选自SEQ ID NO:1的H48、W50、I51、Y52和I126的一个或多个、两个或更多个、三个或更多个、四个或更多个或全部五个氨基酸残基,或哺乳动物Siglec-9蛋白上对应于选自SEQ ID NO:1的H48、W50、I51、Y52和I126的氨基酸残基的一个或多个、两个或更多个、三个或更多个、四个或更多个或全部五个氨基酸残基。在一些实施方案中,本公开的抗Siglec-9抗体结合至选自SEQ ID NO:1的L22、H48、W50、I51、Y52和K123的一个或多个、两个或更多个、三个或更多个、四个或更多个、五个或更多个或全部六个氨基酸残基,或哺乳动物Siglec-9蛋白上对应于选自SEQ ID NO:1的L22、H48、W50、I51、Y52和K123的氨基酸残基的一个或多个、两个或更多个、三个或更多个、四个或更多个、五个或更多个或全部六个氨基酸残基。
如表8B中所示,参与由抗体2D4结合的关键Siglec-9残基对应于SEQ ID NO:1的氨基酸残基D189、P190和R194。参与由抗体12B12结合的关键Siglec-9残基对应于SEQ ID NO:1的氨基酸残基H48、W50、I51、Y52以及I126。参与由抗体5C6结合的关键Siglec-9残基对应于SEQ ID NO:1的氨基酸残基L22、H48、W50、I51、Y52以及K123。
本公开的其它方面提供抗Siglec-9抗体,所述抗Siglec-9抗体降低Siglec-9的细胞水平和/或抑制Siglec-9之间的相互作用(例如,结合)并且结合一种或多种Siglec-9配体,结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基62-76、62-76和86-92、86-92、86-96、86-96和105-116、105-116或107-115内的一个或多个氨基酸,或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基62-76、62-76和86-92、86-92、86-96、86-96和105-116、105-116或107-115的氨基酸残基的氨基酸残基内的一个或多个氨基酸。
本公开的其它方面提供了抗Siglec-9抗体,所述抗Siglec-9抗体不显著降低Siglec-9的细胞表面水平和/或不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合),并且结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基185-194内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基185-194的氨基酸残基内的一个或多个氨基酸。本公开的其它方面提供了抗Siglec-9抗体,所述抗Siglec-9抗体不显著降低Siglec-9的细胞表面水平和/或不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合),并且结合至人Siglec-9(SEQ ID NO:1)的氨基酸残基62-76内或Siglec-9同系物或直向同源物上对应于SEQ ID NO:1的氨基酸残基6的氨基酸残基内的一个或多个氨基酸。
在一些实施方案中,本公开的抗Siglec-9抗体可结合构象表位。在一些实施方案中,本公开的抗Siglec-9抗体可结合不连续的Siglec-9表位。在一些实施方案中,所述不连续的Siglec-9表位可具有两种或更多种肽、三种或更多种肽、四种或更多种肽、五种或更多种肽、六种或更多种肽、七种或更多种肽、八种或更多种肽、九种或更多种肽或10种或更多种肽。如本文所公开,Siglec-9表位可包含一种或多种肽,所述一种或多种肽包含SEQ IDNO:1的氨基酸序列的5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个或20个或更多个氨基酸残基,或对应于SEQ ID NO:1的氨基酸序列的哺乳动物Siglec-9蛋白上的5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个或20个或更多个氨基酸残基。
在一些实施方案中,本公开的抗Siglec-9抗体竞争性地抑制至少一种选自表2、3、4A、4B、7A和7B中列出的任何抗体的抗体的结合。在一些实施方案中,本公开的抗Siglec-9抗体竞争性地抑制至少一种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2的抗体的结合。
在一些实施方案中,本公开的抗Siglec-9抗体结合至人Siglec-9的表位,所述表位与由至少一种选自表2、3、4A、4B、7A和7B中列出的任何抗体的抗体结合的Siglec-9表位相同或重叠。在一些实施方案中,本公开的抗Siglec-9抗体结合至人Siglec-9的表位,所述表位与由至少一种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2的抗体结合的Siglec-9表位相同或重叠。
在一些实施方案中,本公开的抗Siglec-9抗体结合由至少一种选自表2、3、4A、4B、7A和7B中列出的任何抗体的抗体结合的基本上相同Siglec-9表位。在一些实施方案中,本公开的抗Siglec-9抗体结合由至少一种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2的抗体结合的基本上相同Siglec-9表位。用于对抗体所结合的表位作图的详细示例性方法提供于Morris(1996)“Epitope Mapping Protocols,”于Methods in MolecularBiology第66卷(Humana Press,Totowa,NJ)中。
在一些实施方案中,与不存在抗Siglec-9抗体的情况下与Siglec-9的结合相比,当本公开的抗Siglec-9抗体使一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体与Siglec-9的结合降低在约50%至100%范围内的量时,所述抗Siglec-9抗体与一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体竞争结合至Siglec-9。在一些实施方案中,与不存在抗Siglec-9抗体的情况下与Siglec-9的结合相比,当本公开的抗Siglec-9抗体使一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体与Siglec-9的结合降低至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%时,所述抗Siglec-9抗体与一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体竞争结合至Siglec-9。在一些实施方案中,本公开的使一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体与Siglec-9的结合降低100%的抗Siglec-9抗体指示所述抗Siglec-9抗体实质上完全阻断一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体与Siglec-9的结合。在一些实施方案中,所述抗Siglec-9抗体和所述一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体以对应于10:1比率、9:1比率、8:1比率、7:1比率、6:1比率、5:1比率、4:1比率、3:1比率、2:1比率、1:1比率、0.75:1比率、0.5:1比率、0.25:1比率、0.1:1比率、0.075:1比率、0.050:1比率、0.025:1比率、0.01:1比率、0.0075:1比率、0.0050:1比率、0.0025:1比率、0.001:1比率、0.00075:1比率、0.00050:1比率、0.00025:1比率、0.0001:比率、1:10比率、1:9比率、1:8比率、1:7比率、1:6比率、1:5比率、1:4比率、1:3比率、1:2比率、1:0.75比率、1:0.5比率、1:0.25比率、1:0.1比率、1:0.075比率、1:0.050比率、1:0.025比率、1:0.01比率、1:0.0075比率、1:0.0050比率、1:0.0025比率、1:0.001比率、1:0.00075比率、1:0.00050比率、1:0.00025比率或1:0.0001比率的抗Siglec-9抗体与一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体的量存在。在一些实施方案中,所述抗Siglec-9抗体以与一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体的量相比超过在约1.5倍至100倍或大于100倍范围内的量存在。在一些实施方案中,所述抗Siglec-9抗体以与一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体的量相比约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍或100倍过量的量存在。
可使用本领域中已知的任何合适的竞争测定或Siglec-9结合测定(如BIAcore分析、ELISA测定或流式细胞术)来确定抗Siglec-9抗体是否与一种或多种选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体竞争结合至Siglec-9。在示例性竞争测定中,将固定的Siglec-9或细胞表面上表达Siglec-9的细胞在包含结合至Siglec-9的第一标记抗体(例如人或非人灵长类动物)和第二未标记抗体的溶液中孵育,所述第二未标记抗体正在针对其与所述第一抗体竞争结合至Siglec-9的能力进行测试。第二抗体可存在于杂交瘤上清液中。作为对照,将固定的Siglec-9或表达Siglec-9的细胞在包含第一标记抗体而不含第二未标记抗体的溶液中孵育。在容许第一抗体与Siglec-9结合的条件下孵育之后,移除过量未结合的抗体,并且测量与固定的Siglec-9或表达Siglec-9的细胞缔合的标记的量。如果相对于对照样品,与固定的Siglec-9或表达Siglec-9的细胞缔合的标记的量在测试样品中基本上降低,则然后指示第二抗体与第一抗体竞争结合至Siglec-9。参见Harlow和Lane(1988)Antibodies:A Laboratory Manual第14章(Cold Spring HarborLaboratory,Cold Spring Harbor,NY)。
抗Siglec-9抗体轻链和重链可变区
在一些实施方案中,本公开的抗Siglec-9抗体包含(a)轻链可变区,其包含选自表2、3、4A、4B、7A和7B中列出或选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的任一种抗体的HVR-L1、HVR-L2和HVR-L3的至少一个、两个或三个HVR;和/或(b)重链可变区,其包含选自表2、3、4A、4B、7A和7B中列出或选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的任一种抗体的HVR-H1、HVR-H2和HVR-H3的至少一个、两个或三个HVR。在一些实施方案中,所述HVR-L1、HVR-L2、HVR-L3、HVR-H1、HVR-H2以及HVR-H3包含如表2、3、4A、4B、7A和7B中所示或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合的抗体的EU或Kabat CDR、Chothia CDR或接触CDR序列。
在一些实施方案中,本公开的抗Siglec-9抗体包含至少一个、两个、三个、四个、五个或六个选自以下的HVR:(i)HVR-L1,所述HVR-L1包含在表2、3、4A、4B、7A和7B中列出的HVR-L1序列中的任一个的氨基酸序列,或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体;(ii)HVR-L2,所述HVR-L2包含在表2、3、4A、4B、7A和7B中列出的HVR-L2序列中的任一个的氨基酸序列,或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体;(iii)HVR-L3,所述HVR-L3包含在表2、3、4A、4B、7A和7B中列出的HVR-L3序列中的任一个的氨基酸序列,或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体;(iv)HVR-H1,所述HVR-H1包含在表2、3、4A、4B、7A和7B中列出的HVR-H1序列中的任一个的氨基酸序列,或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体;(v)HVR-H2,所述HVR-H2包含在表2、3、4A、4B、7A和7B中列出的HVR-H2序列中的任一个的氨基酸序列,或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体;以及(vi)HVR-H3,所述HVR-H3包含在表2、3、4A、4B、7A和7B中列出的HVR-H3序列中的任一个的氨基酸序列,或来自选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体。
在一些实施方案中,本公开的抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含以下中的一个或多个:(a)HVR-L1,其包含选自SEQ IDNO:6-9、172和173的氨基酸序列,或与选自SEQ ID NO:6-9、172和173的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-L2,其包含选自SEQ ID NO:10-13、174和175的氨基酸序列,或与选自SEQ ID NO:10-13、174和175的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-L3,其包含选自SEQ ID NO:14-18、176和177的氨基酸序列,或与选自SEQ ID NO:14-18、176和177的氨基酸序列具有至少约90%同源性的氨基酸序列;和/或其中所述重链可变结构域包含以下中的一个或多个:(a)HVR-H1,其包含选自SEQ ID NO:19-21、178和179的氨基酸序列,或与选自SEQ ID NO:19-21、178和179的氨基酸序列具有至少约90%同源性的氨基酸序列;(b)HVR-H2,其包含选自SEQ ID NO:22-25、180和181的氨基酸序列,或与选自SEQ ID NO:22-25、180和181的氨基酸序列具有至少约90%同源性的氨基酸序列;以及(c)HVR-H3,其包含选自SEQ ID NO:26-29、182和183的氨基酸序列,或与选自SEQID NO:26-29、182和183的氨基酸序列具有至少约90%同源性的氨基酸序列。
在一些实施方案中,本公开的抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中:(a)所述HVR-L1包含SEQ ID NO:6的氨基酸序列,所述HVR-L2包含SEQ ID NO:10的氨基酸序列,所述HVR-L3包含SEQ ID NO:14的氨基酸序列,所述HVR-H1包含SEQ ID NO:19的氨基酸序列,所述HVR-H2包含SEQ ID NO:22的氨基酸序列,并且所述HVR-H3包含SEQID NO:26的氨基酸序列;(b)所述HVR-L1包含SEQ ID NO:7的氨基酸序列,所述HVR-L2包含SEQ ID NO:11的氨基酸序列,所述HVR-L3包含SEQ ID NO:15的氨基酸序列,所述HVR-H1包含SEQ ID NO:20的氨基酸序列,所述HVR-H2包含SEQ ID NO:23的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:27的氨基酸序列;(c)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:16的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:28的氨基酸序列;(d)所述HVR-L1包含SEQ ID NO:9的氨基酸序列,所述HVR-L2包含SEQ ID NO:13的氨基酸序列,所述HVR-L3包含SEQ ID NO:17的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ IDNO:25的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:29的氨基酸序列;(e)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:18的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:28的氨基酸序列;(f)所述HVR-L1包含SEQ ID NO:172的氨基酸序列,所述HVR-L2包含SEQ ID NO:174的氨基酸序列,所述HVR-L3包含SEQ ID NO:176的氨基酸序列,所述HVR-H1包含SEQ ID NO:178的氨基酸序列,所述HVR-H2包含SEQ ID NO:180的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:182的氨基酸序列;或(g)所述HVR-L1包含SEQ ID NO:173的氨基酸序列,所述HVR-L2包含SEQ ID NO:175的氨基酸序列,所述HVR-L3包含SEQ ID NO:177的氨基酸序列,所述HVR-H1包含SEQ ID NO:179的氨基酸序列,所述HVR-H2包含SEQ ID NO:181的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:183的氨基酸序列。
在一些实施方案中,本公开的抗Siglec-9抗体包含在表2、3、4A、4B、7A和7B中列出或选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体中的任一种的轻链可变区;和/或在表2、3、4A、4B、7A和7B中列出或选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2的抗体中的任一种的重链可变区。在一些实施方案中,本公开的抗Siglec-9抗体包含轻链可变区,所述轻链可变区包含选自SEQ ID NO:61-115和197-204中的任一个的氨基酸序列;和/或重链可变结构域,所述重链可变结构域包含选自SEQ ID NO:116-170和205-212中的任一个的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ ID NO:61的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:116的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ ID NO:72的氨基酸序列;并且所述重链可变结构域包含SEQID NO:127的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ ID NO:83的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:138的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ ID NO:94的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:149的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ ID NO:105的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:160的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ ID NO:197的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:205的氨基酸序列。在一些实施方案中,所述轻链可变结构域包含SEQ IDNO:201的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:210的氨基酸序列。
在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H1的重链可变结构域和抗体5C6-L1的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H2的重链可变结构域和抗体5C6-L2的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H2的重链可变结构域和抗体5C6-L3的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H3的重链可变结构域和抗体5C6-L2的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H3的重链可变结构域和抗体5C6-L3的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H4的重链可变结构域和抗体5C6-L2的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体5C6-H4的重链可变结构域和抗体5C6-L3的轻链可变结构域。
在一些实施方案中,所述抗Siglec-9抗体包含抗体12B12-H1的重链可变结构域和抗体12B12-L1的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体12B12-H2的重链可变结构域和抗体12B12-L1的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体12B12-H2的重链可变结构域和抗体12B12-L2的轻链可变结构域。在一些实施方案中,所述抗Siglec-9抗体包含抗体12B12-H2的重链可变结构域和抗体12B12-L3的轻链可变结构域。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体2D4。在一些实施方案中,所述抗Siglec-9抗体是与2D4结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体2D4的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体2D4的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体2D4的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体2D5。在一些实施方案中,所述抗Siglec-9抗体是与2D5结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体2D5的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体2D5的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体2D5的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体5B1。在一些实施方案中,所述抗Siglec-9抗体是与5B1结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体5B1的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体5B1的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体5B1的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体6B2。在一些实施方案中,所述抗Siglec-9抗体是与6B2结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体6B2的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体6B2的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体6B2的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体6D8。在一些实施方案中,所述抗Siglec-9抗体是与6D8结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体6D8的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体6D8的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体6D8的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体7H12。在一些实施方案中,所述抗Siglec-9抗体是与7H12结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体7H12的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体7H12的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体7H12的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体5C6。在一些实施方案中,所述抗Siglec-9抗体是与5C6结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体5C6的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体5C6的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体5C6的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体12B12。在一些实施方案中,所述抗Siglec-9抗体是与12B12结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体12B12的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体12B12的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体12B12的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
在一些实施方案中,所述抗Siglec-9抗体是抗Siglec-9单克隆抗体17C2。在一些实施方案中,所述抗Siglec-9抗体是与17C2结合基本相同的TREM2表位的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体17C2的重链可变结构域的HVR-H1、HVR-H2和HVR-H3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体17C2的轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。在一些实施方案中,所述抗Siglec-9抗体是包含单克隆抗体17C2的重链可变结构域的HVR-H1、HVR-H2和HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2和HVR-L3的分离的抗体。
本公开的任何抗体可由细胞系产生。在一些实施方案中,所述细胞系是哺乳动物细胞系。在某些实施方案中,所述细胞系是杂交瘤细胞系。在其它实施方案中,所述细胞系是可以是酵母细胞系。可使用本领域中已知的适用于抗体产生的任何细胞系来产生本公开的抗体。用于抗体产生的示例性细胞系在整个本公开中描述。
在一些实施方案中,所述抗Siglec-9抗体是选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2的抗Siglec-9单克隆抗体。在某些实施方案中,所述抗Siglec-9抗体是拮抗剂抗体。在某些实施方案中,所述抗Siglec-9抗体是激动剂抗体或惰性抗体。
抗Siglec-9抗体结合亲和力
抗Siglec-9抗体对人Siglec-9、哺乳动物Siglec-9或两者的解离常数(K
可通过本领域中已知的各种测定来鉴定、筛选和/或表征另外的抗Siglec-9抗体,例如特异性地结合至本公开的Siglec-9蛋白的抗体的物理/化学性质和/或生物活性。
能够结合Fcγ受体的抗Siglec-9抗体
在一些实施方案中,本公开的抗Siglec-9抗体保留结合Fcγ受体的能力。在一些实施方案中,当此类抗体具有与受体活化相容的正确表位特异性时,此类抗体可具有使其能够聚簇并瞬时刺激例如Siglec-9受体的特征。在一些实施方案中,此类抗体随后可通过诱导Siglec-9降解、Siglec-9脱敏、Siglec-9裂解、Siglec-9内化、Siglec-9脱落、Siglec-9表达的下调和/或Siglec-9的溶酶体降解而充当Siglec-9表达的长期抑制剂和/或Siglec-9蛋白的一种或多种活性。
在体内,本公开的抗Siglec-9抗体可簇集受体并通过多种潜在机制中的任何一种或多种瞬时活化Siglec-9。人抗体如IgG2的一些同种型由于其独特的结构而具有簇集受体或保留受体呈簇集构型、从而瞬时活化受体如Siglec-9而不结合至Fc受体的内在能力(例如,White等人,(2015)Cancer Cell 27,138–148)。
在一些实施方案中,其它抗体可通过结合至邻近细胞上的Fcg受体来簇集受体(例如,Siglec-9)。在一些实施方案中,抗体的恒定IgG Fc区与Fcg受体的结合可导致抗体的聚集,并且抗体进而可聚集它们通过它们的可变区所结合的受体(Chu等人(2008)MolImmunol,45:3926-3933;以及Wilson等人,(2011)Cancer Cell 19,101–113)。在一些实施方案中,结合至不引发细胞因子分泌、氧化爆发、增加的吞噬和增强的抗体依赖性细胞介导的细胞毒性(ADCC)的抑制性Fcg受体FcgR(FcgRIIB)是体内簇集抗体的优选方式,因为与FcgRIIB结合不与不利的免疫应答效应相关。
存在本公开的抗Siglec-9抗体可簇集受体的其它机制。例如,如上所述,交联在一起的抗体片段(例如,Fab片段)可用于以与具有结合Fcg受体的Fc区的抗体相似的方式簇集受体(例如,Siglec-9)。在一些实施方案中,如果交联的抗体片段(例如,Fab片段)诱导细胞表面上的受体簇集并结合靶标上的适当表位(例如,Siglec-9),则所述抗体片段可瞬时充当激动剂抗体。
因此,在一些实施方案中,结合Siglec-9蛋白的本公开的抗体可包括激动剂抗体,所述激动剂抗体在它们例如降低Siglec-9的细胞水平、抑制一种或多种Siglec-9活性(例如,由于Siglec-9的细胞水平降低)和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)之前由于其表位特异性而结合Siglec-9并瞬时活化一种或多种Siglec-9活性。在一些实施方案中,此类抗体可结合至Siglec-9上的配体结合位点并瞬时模拟天然配体的作用。或者,此类抗体可通过结合至一个或多个不是配体结合位点的结构域来刺激靶抗原转导信号。在一些实施方案中,此类抗体不会干扰配体结合。在一些实施方案中,无论抗体是否结合至Siglec-9上的配体结合位点,所述抗体都可随后通过诱导Siglec-9降解、Siglec-9脱敏、Siglec-9裂解、Siglec-9内化、Siglec-9脱落、Siglec-9表达的下调和/或Siglec-9的溶酶体降解来充当Siglec-9表达和/或Siglec-9蛋白的一种或多种活性的长期抑制剂。
在一些实施方案中,本公开的抗Siglec-9抗体是瞬时诱导Siglec-9蛋白的一种或多种活性的瞬时激动剂抗体。在一些实施方案中,所述抗体在与细胞中表达的Siglec-9蛋白结合后瞬时诱导一种或多种活性。在一些实施方案中,所述Siglec-9蛋白在细胞表面上表达。在一些实施方案中,Siglec-9蛋白的由本公开的瞬时激动剂抗Siglec-9抗体瞬时诱导的一种或多种活性可包括但不限于,通过Src家族酪氨酸激酶如Syk、LCK、FYM和/或ZAP70磷酸化Tyr-433和Tyr-456;募集并结合至酪氨酸特异性蛋白磷酸酶SHP1和SHP2;募集并结合至PLC-γ1,其充当发动蛋白-1的鸟嘌呤核苷酸交换因子;募集并结合至含SH2结构域的蛋白质(例如Crk1);募集并结合至脾酪氨酸激酶Syk;募集并结合至SH3-SH2-SH3生长因子受体结合蛋白2(Grb2);募集并结合至多种含SH2的蛋白质;调节一种或多种促炎性细胞因子的表达,所述促炎性细胞因子如FN-α4、IFN-β、IL-1β、IL-1α、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、CRP、MCP-1以及MIP-1-β;调节一种或多种细胞中的一种或多种促炎性细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;增加一种或多种抗炎细胞因子的表达,所述抗炎细胞因子如IL-4、IL-10、IL-13、IL-35、IL-16、TGF-β、IL-1Ra、G-CSF以及TNF、IFN-β1a、IFN-β1b或IL-6的可溶性受体;调节一种或多种细胞中的一种或多种抗炎细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节一种或多种选自以下的蛋白质的表达:C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX、以及PYCARD;抑制细胞外信号调控激酶(ERK)磷酸化;降低一种或多种细胞蛋白上的酪氨酸磷酸化,任选地,其中所述一种或多种细胞蛋白包含ZAP-70并且所述酪氨酸磷酸化发生在ZAP-70的Tyr-319上;调节C-C趋化因子受体7(CCR7)的表达;抑制针对表达CCL19的细胞和表达CCL21的细胞的小神经胶质细胞趋化性;减少由一种或多种细胞诱导的T细胞增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞、M2小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞以及M2 NK细胞;抑制破骨细胞产生,降低破骨细胞生成速率或两者;降低一种或多种细胞的存活,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;降低一种或多种细胞的增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的迁移,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的一种或多种功能,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种细胞的成熟,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;抑制一种或多种类型的清除,所述清除选自凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除、致病核酸清除以及肿瘤细胞清除;任选地,其中所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;抑制以下中的一种或多种的吞噬:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞;任选地其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤或甲状腺癌;与肿瘤细胞上的Siglec-9配体结合;与细胞上的Siglec-9配体结合,所述细胞选自嗜中性粒细胞、树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞以及NK细胞;通过以下中的一种或多种抑制肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制以下中的一种或多种的抗肿瘤细胞转移活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;抑制一种或多种含ITAM基序的受体,任选地其中所述一种或多种含ITAM基序的受体选自TREM1、TREM2、Sirpβ、FcgR、DAP10以及DAP12;通过一种或多种模式识别受体(PRR)抑制信号传导,任选地其中所述一种或多种PRR选自鉴定病原体相关分子模式(PAMP)的受体、鉴定损伤相关分子模式(DAMP)的受体以及其任何组合;抑制包含基序D/Ex
以下表C中提供了示例性抗体Fc同种型和修饰。在一些实施方案中,能够结合Fcγ受体的本公开的抗Siglec-9抗体具有在以下表C中列出的Fc同种型。
表C:能够结合Fcγ受体的示例性抗Siglec-9抗体Fc同种型
/>
/>
除了表C中描述的同种型,并且不希望受理论束缚,认为结合人中的Fcg受体I、IIA、IIC、IIIA、IIIB和/或小鼠中的Fcg受体I、III和IV的具有人IgG1或IgG3同种型及其突变体的抗体(例如Strohl(2009)Current Opinion in Biotechnology 2009,20:685–691)也可充当瞬时激动剂抗体。
在一些实施方案中,所述Fcγ受体结合抗体具有IgG类、IgM类或IgA类。在一些实施方案中,所述Fcγ受体结合抗体具有IgG1、IgG2、IgG3或IgG4同种型。
在某些实施方案中,所述Fcγ受体结合抗体具有IgG2同种型。在一些实施方案中,所述Fcγ受体结合抗体含有人IgG2恒定区。在一些实施方案中,所述人IgG2恒定区包括Fc区。在一些实施方案中,所述Fcγ受体结合抗体结合抑制性Fc受体。在某些实施方案中,所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。在一些实施方案中,所述Fc区含有一种或多种修饰。例如,在一些实施方案中,所述Fc区含有一种或多种氨基酸取代(例如,相对于同一同种型的野生型Fc区)。在一些实施方案中,所述一种或多种氨基酸取代选自V234A(Alegre等人,(1994)Transplantation 57:1537-1543.31;Xu等人,(2000)Cell Immunol,200:16-26)、G237A(Cole等人(1999)Transplantation,68:563-571)、H268Q、V309L、A330S、P331S(US 2007/0148167;Armour等人(1999)Eur J Immunol 29:2613-2624;Armour等人(2000)The Haematology Journal 1(增刊1):27;Armour等人(2000)The HaematologyJournal 1(增刊1):27)、C232S和/或C233S(White等人(2015)Cancer Cell 27,138–148)、S267E、L328F(Chu等人,(2008)Mol Immunol,45:3926-3933)、M252Y、S254T和/或T256E,其中所述氨基酸位置根据EU或Kabat编号惯例。
在一些实施方案中,Fcγ受体结合抗体具有IgG2同种型,其具有包含C127S氨基酸取代的重链恒定结构域,其中氨基酸位置根据EU或Kabat编号惯例(White等人,(2015)Cancer Cell 27,138-148;Lightle等人,(2010)PROTEIN SCIENCE 19:753-762;以及WO2008079246)。
在一些实施方案中,Fcγ受体结合抗体具有IgG2同种型,其具有包含C214S氨基酸取代的κ轻链恒定结构域,其中氨基酸位置根据EU或Kabat编号惯例(White等人,(2015)Cancer Cell 27,138-148;Lightle等人,(2010)PROTEIN SCIENCE 19:753-762;以及WO2008079246)。
在某些实施方案中,所述Fcγ受体结合抗体具有IgG1同种型。在一些实施方案中,所述Fcγ受体结合抗体含有小鼠IgG1恒定区。
在一些实施方案中,所述Fcγ受体结合抗体含有人IgG1恒定区。在一些实施方案中,所述人IgG1恒定区包括Fc区。在一些实施方案中,所述Fcγ受体结合抗体结合抑制性Fc受体。在某些实施方案中,所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。在一些实施方案中,所述Fc区含有一种或多种修饰。例如,在一些实施方案中,所述Fc区含有一种或多种氨基酸取代(例如,相对于同一同种型的野生型Fc区)。在一些实施方案中,所述一个或多个氨基酸取代选自N297A(Bolt S等人(1993)Eur J Immunol 23:403-411)、D265A(Shields等人(2001)R.J.Biol.Chem.276,6591–6604)、D270A、L234A、L235A(Hutchins等人(1995)Proc Natl Acad Sci USA,92:11980-11984;Alegre等人,(1994)Transplantation57:1537-1543.31;Xu等人,(2000)Cell Immunol,200:16-26)、G237A(Alegre等人(1994)Transplantation 57:1537-1543.31;Xu等人(2000)Cell Immunol,200:16-26)、P238D、L328E、E233D、G237D、H268D、P271G、A330R、C226S、C229S、E233P、L234V、L234F、L235E(McEarchern等人,(2007)Blood,109:1185-1192)、P331S(Sazinsky等人,(2008)Proc NatlAcad Sci USA 2008,105:20167-20172)、S267E、L328F、A330L、M252Y、S254T、T256E、N297Q、P238S、P238A、A327Q、A327G、P329A、K322A和/或T394D,其中所述氨基酸位置根据EU或Kabat编号惯例。
在一些实施方案中,所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区(White等人,(2015)Cancer Cell 27,138–148)。在某些实施方案中,所述IgG2同种型CH1和铰链区含有氨基酸序列ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:171)。在一些实施方案中,所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中所述氨基酸位置根据EU或Kabat编号惯例。
在某些实施方案中,所述Fcγ受体结合抗体具有IgG4同种型。在一些实施方案中,所述Fcγ受体结合抗体含有人IgG4恒定区。在一些实施方案中,所述人IgG4恒定区包括Fc区。在一些实施方案中,所述Fcγ受体结合抗体结合抑制性Fc受体。在某些实施方案中,所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。在一些实施方案中,所述Fc区含有一种或多种修饰。例如,在一些实施方案中,所述Fc区含有一种或多种氨基酸取代(例如,相对于同一同种型的野生型Fc区)。在一些实施方案中,所述一种或多种氨基酸取代选自L235A、G237A、S228P、L236E(Reddy等人,(2000)J Immunol,164:1925-1933)、S267E、E318A、L328F、M252Y、S254T和/或T256E,其中该氨基酸位置是根据EU或Kabat编号惯例。
在某些实施方案中,所述Fcγ受体结合抗体具有杂合IgG2/4同种型。在一些实施方案中,所述Fcγ受体结合抗体包含含有人IgG2的根据EU或Kabat编号的氨基酸118至260以及人IgG4的根据EU或Kabat编号的氨基酸261-447的氨基酸序列(WO 1997/11971;WO2007/106585)。
在某些实施方案中,所述抗体含有小鼠IgG4恒定区(Bartholomaeus,等人(2014).J.Immunol.192,2091–2098)。
在一些实施方案中,所述Fc区进一步含有一种或多种另外的氨基酸取代,所述氨基酸取代选自根据EU或Kabat编号的A330L、L234F、L235E或P331S以及其任何组合。
惰性抗体
本公开的抗Siglec-9抗体的另一类别包括惰性抗体。如本文所用,“惰性”抗体是指特异性地结合其靶抗原(例如Siglec-9)但不调节(例如降低/抑制或活化/诱导)抗原功能的抗体。例如,在Siglec-9的情况下,惰性抗体不调节Siglec-9的细胞水平,不调节Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合),或不调节Siglec-9蛋白的一种或多种活性。在一些实施方案中,不具有在细胞表面上簇集Siglec-9的能力的抗体可以是惰性抗体,即使它们具有与受体活化相容的表位特异性。
在一些实施方案中,结合Siglec-9蛋白的抗体可包括结合Siglec-9,但由于它们的表位特异性或特性不会降低Siglec-9的细胞水平和/或抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)的抗体。在一些实施方案中,此类抗体可用作货物以例如将毒素(例如化学治疗剂)转运到肿瘤细胞中。此类抗体可优于目前商业上可获得的降低Siglec-9的细胞水平的抗Siglec-9抗体,如与来自加利车霉素类的细胞毒性剂缀合并用于靶向和杀死急性骨髓性白血病肿瘤的吉姆单抗奥佐米星(Naito等人,(2000),Leukemia,14,1436-1443;Ricart(2011)Clin Cancer Res 17;6417-6436;Hamann等人,(2002)Journal:Bioconjugate Chemistry,13,47-58;Beitz等人,(2001)Clin Cancer Res7;1490–6;以及Malik M.等人(2015)Human Molecular Genetics,1–14.)。在一些实施方案中,本公开的惰性抗Siglec-9抗体可优于商业抗体,如吉姆单抗奥佐米星,因为不降低Siglec-9的细胞水平的抗体将使Siglec-9完整地留在肿瘤细胞的表面上以用于通过另外的毒素缀合的抗体靶向。相比之下,降低Siglec-9的细胞水平的抗体将从细胞表面除去Siglec-9,并且将导致保护肿瘤细胞免受毒素缀合抗体的进一步靶向。因此,在一些实施方案中,本公开的抗体是结合Siglec-9但不能降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)或诱导Siglec-9蛋白的一种或多种活性的惰性抗体。
降低或不降低细胞上Siglec-9的细胞水平的抗体可与展示与一种或多种Fcg受体降低的结合的惰性Fc区组合。以下表D中提供了此类Fc区和修饰的实例。在一些实施方案中,具有惰性Fc区的抗体具有以下表D中列出的Fc同种型。
拮抗剂抗Siglec-9抗体
本公开的抗Siglec-9抗体的第三类别包括拮抗剂抗体。在一些实施方案中,结合Siglec-9蛋白的抗体可包括拮抗剂抗体,所述拮抗剂抗体降低Siglec-9的细胞水平、抑制Siglec-9和/或一种或多种Siglec-9配体之间的相互作用(例如结合)并抑制Siglec-9蛋白的一种或多种活性。此类抗体通过在一种或多种Siglec-9配体存在下防止Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如结合)或通过防止信号转导从Siglec-9的细胞外结构域进入细胞质来抑制Siglec-9蛋白的一种或多种活性。拮抗剂抗体还可通过降低Siglec-9的细胞表面水平、诱导Siglec-9降解、Siglec-9脱敏、Siglec-9裂解、Siglec-9内化、Siglec-9脱落、Siglec-9表达的下调和/或Siglec-9的溶酶体降解来抑制Siglec-9蛋白的一种或多种活性。在一些实施方案中,此类拮抗性抗Siglec-9抗体可能不会瞬时活化Siglec-9。
在一些实施方案中,本公开的拮抗剂抗Siglec-9抗体可具有本公开的瞬时激动剂抗Siglec-9抗体的表位特异性,但具有不能结合Fcg受体并因此不能例如瞬时簇集和活化Siglec-9的Fc结构域。
在一些实施方案中,本公开的拮抗剂抗Siglec-9抗体具有但不限于一种或多种以下活性:降低Siglec-9蛋白与一种或多种Siglec-9配体(如含唾液酸的糖脂或含唾液酸的糖蛋白)结合的能力;降低细胞因子信号传导(SOCS)蛋白(例如,SOCS3蛋白)的抑制子与Siglec-9蛋白的结合的能力;增加Siglec-9蛋白的蛋白酶体降解的能力;降低循环树突细胞、巨噬细胞、单核细胞、T细胞和/或小神经胶质细胞表面上的Siglec-9的功能表达的能力;降低或抑制通过Src家族酪氨酸激酶如Syk、LCK、FYM和/或ZAP70磷酸化Tyr-433和Tyr-456的能力;抑制募集并结合至酪氨酸特异性蛋白磷酸酶SHP1和SHP2的能力;抑制募集并结合至PLC-γ1的能力,所述PLC-γ1充当发动蛋白-1的鸟嘌呤核苷酸交换因子;抑制募集并结合至含SH2结构域的蛋白质(例如Crk1)的能力;抑制募集并结合至脾酪氨酸激酶Syk的能力;抑制募集并结合至SH3-SH2-SH3生长因子受体结合蛋白2(Grb2)的能力;抑制募集并结合至多种含SH2的蛋白质的能力;调节一种或多种促炎性细胞因子的表达的能力,任选地其中所述一种或多种抗炎细胞因子选自FN-α4、IFN-β、IL-1β、IL-1α、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-33、MCP-1以及MIP-1-β;调节一种或多种细胞中的一种或多种促炎性细胞因子的表达的能力,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节一种或多种抗炎细胞因子的表达的能力,任选地其中所述一种或多种抗炎细胞因子选自IL-4、IL-10、IL-13、IL-35、IL-16、TGF-β、IL-1Ra、G-CSF以及TNF、IFN-β1a、IFN-β1b或IL-6的可溶性受体;调节一种或多种细胞中的一种或多种抗炎细胞因子的表达的能力,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节一种或多种选自以下的蛋白质的表达的能力:C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX以及PYCARD;抵消细胞外信号调控激酶(ERK)磷酸化的抑制;防止一种或多种细胞蛋白上的酪氨酸磷酸化降低,任选地,其中所述一种或多种细胞蛋白包含ZAP-70并且所述酪氨酸磷酸化发生在ZAP-70的Tyr-319上;调节C-C趋化因子受体7(CCR7)的表达的能力;防止抑制针对表达CCL19的细胞和表达CCL21的细胞的小神经胶质细胞趋化性的能力;防止减少由一种或多种细胞诱导的T细胞增殖的能力,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞、M2小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞以及M2 NK细胞;防止抑制破骨细胞产生的能力,防止降低破骨细胞生成速率的能力或两者;防止一种或多种细胞的存活降低的能力,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;防止降低一种或多种细胞的增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;增强一种或多种细胞的迁移的能力,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;防止一种或多种细胞的一种或多种功能的降低的能力,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;增强一种或多种细胞的成熟的能力,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;增强一种或多种类型的清除的能力,所述清除选自凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除以及肿瘤细胞清除;任选地,其中所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;抑制以下中的一种或多种的吞噬:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞;任选地其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤或甲状腺癌;与肿瘤细胞上的Siglec-9配体结合;与细胞上的Siglec-9配体结合,所述细胞选自嗜中性粒细胞、树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞以及NK细胞;通过以下中的一种或多种抑制肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;活化以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;增强以下中的一种或多种的抗肿瘤细胞转移活性的能力:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;增强一种或多种含ITAM基序的受体的活性的能力,任选地其中所述一种或多种含ITAM基序的受体选自TREM1、TREM2、SIRPβ、Fcγ受体(FcgR)、DAP10以及DAP12;通过一种或多种模式识别受体(PRR)增强信号传导的能力,任选地其中所述一种或多种PRR选自鉴定病原体相关分子模式(PAMP)的受体、鉴定损伤相关分子模式(DAMP)的受体以及其任何组合;增强包含基序D/Ex
在一些实施方案中,本公开的拮抗剂抗Siglec-9抗体具有展示与一种或多种Fcg受体降低的结合的Fc区。以下表D中提供了此类Fc区和修饰的实例。在一些实施方案中,所述抗体具有以下表D中列出的Fc同种型。
具有降低的与Fcγ受体的结合的抗体Fc同种型
在一些实施方案中,具有降低的与Fcγ受体的结合的抗Siglec-9抗体具有以下表D中列出的Fc同种型。
表D:具有降低的与Fcγ受体的结合的示例性抗Siglec-9抗体Fc同种型
在某些实施方案中,所述抗Siglec-9抗体具有IgG1同种型。在一些实施方案中,所述抗体含有小鼠IgG1恒定区。在一些实施方案中,所述抗体含有人IgG1恒定区。在一些实施方案中,所述人IgG1恒定区包括Fc区。在一些实施方案中,所述Fc区含有一种或多种修饰。例如,在一些实施方案中,所述Fc区含有一种或多种氨基酸取代(例如,相对于同一同种型的野生型Fc区)。
在一些实施方案中,所述一种或多种氨基酸取代选自N297A、N297Q(Bolt S等人(1993)Eur J Immunol 23:403-411)、D270A、D265A、L234A、L235A(McEarchern等人,(2007)Blood,109:1185-1192)、C226S、C229S(McEarchern等人,(2007)Blood,109:1185-1192)、P238S(Davis等人,(2007)J Rheumatol,34:2204-2210)、E233P、L234V(McEarchern等人,(2007)Blood,109:1185-1192)、P238A、A327Q、A327G、P329A(Shields RL.等人,(2001)JBiol Chem.276(9):6591-604)、K322A、L234F、L235E(Hezareh,等人,(2001)J Virol 75,12161–12168;Oganesyan等人,(2008).Acta Crystallographica 64,700–704)、P331S(Oganesyan等人,(2008)Acta Crystallographica 64,700–704)、T394D(Wilkinson等人(2013)MAbs 5(3):406–417)、A330L、M252Y、S254T和/或T256E,其中所述氨基酸位置根据EU或Kabat编号惯例。在某些实施方案中,所述Fc区在对应于根据EU或Kabat编号惯例的甘氨酸236的位置处进一步包含氨基酸缺失。
在一些实施方案中,所述抗Siglec-9抗体具有IgG1同种型,所述同种型具有包含根据EU或Kabat编号惯例的C220S氨基酸取代的重链恒定区。在一些实施方案中,所述Fc区进一步含有一种或多种另外的氨基酸取代,所述氨基酸取代选自根据EU或Kabat编号惯例的t A330L、L234F、L235E或P331S。在某些实施方案中,所述抗Siglec-9抗体具有IgG2同种型。在一些实施方案中,所述抗Siglec-9抗体含有人IgG2恒定区。在一些实施方案中,所述人IgG2恒定区包括Fc区。在一些实施方案中,所述Fc区含有一种或多种修饰。例如,在一些实施方案中,所述Fc区含有一种或多种氨基酸取代(例如,相对于同一同种型的野生型Fc区)。在一些实施方案中,所述一种或多种氨基酸取代选自P238S、V234A、G237A、H268A、H268Q、H268E、V309L、N297A、N297Q、V309L、A330S、P331S、C232S、C233S、M252Y、S254T和/或T256E,其中所述氨基酸位置根据EU或Kabat编号惯例(Vafa O.等人,(2014)Methods 65:114–126)。
在某些实施方案中,所述抗Siglec-9抗体具有IgG4同种型。在一些实施方案中,所述抗Siglec-9抗体含有人IgG4恒定区。在一些实施方案中,所述人IgG4恒定区包括Fc区。在一些实施方案中,所述Fc区含有一种或多种修饰。例如,在一些实施方案中,所述Fc区含有一种或多种氨基酸取代(例如,相对于同一同种型的野生型Fc区)。在一些实施方案中,所述一种或多种氨基酸取代选自E233P、F234V、L235A、G237A、E318A(Hutchins等人(1995)ProcNatl Acad Sci USA,92:11980-11984)、S228P、L234A/F234A、L236E、S241P、L248E(Reddy等人,(2000)J Immunol,164:1925-1933;Angal等人,(1993)Mol Immunol.30(1):105-8;US8614299 B2;Vafa O.等人,(2014)Methods 65:114–126)、T394D、M252Y、S254T、T256E、N297A、和/或N297Q,其中所述氨基酸位置根据EU或Kabat编号惯例。
在一些实施方案中,所述Fc区进一步含有一种或多种选自M252Y、S254T和/或T256E的另外氨基酸取代,其中所述氨基酸位置根据EU或Kabat编号惯例。
其它IgG突变
在一些实施方案中,本文所述的一种或多种IgG1变体可与A330L突变(Lazar等人,(2006)Proc Natl Acad Sci USA,103:4005-4010)或L234F、L235E和/或P331S突变中的一种或多种(Sazinsky等人,(2008)Proc Natl Acad Sci USA,105:20167-20172)组合,其中所述氨基酸位置根据EU或Kabat编号惯例以消除补体活化。在一些实施方案中,本文所述的IgG变体可与一种或多种突变组合以增强人血清中的抗Siglec-9抗体半衰期(例如根据EU或Kabat编号惯例的M252Y、S254T、T256E突变)(Dall’Acqua等人,(2006)J Biol Chem,281:23514-23524;以及Strohl等人,(2009)Current Opinion in Biotechnology,20:685–691)。
在一些实施方案中,本公开的IgG4变体可与根据EU或Kabat编号惯例的S228P突变(Angal等人,(1993)Mol Immunol,30:105-108)和/或与Peters等人,(2012)J BiolChem.13;287(29):24525-33)中描述的一种或多种突变组合以增强抗体稳定。
双特异性抗体
本公开的某些方面涉及结合至本公开的Siglec-9蛋白上的一个或多个结构域和第二抗原的双特异性抗体。产生双特异性抗体的方法是本领域中熟知的和本文描述的。在一些实施方案中,本公开的双特异性抗体结合至本公开的Siglec-9蛋白的一个或多个氨基酸残基,如人Siglec-9(SEQ ID NO:1)的一个或多个氨基酸残基,或Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基的的氨基酸残基。在一些实施方案中,本公开的双特异性抗体识别第一抗原和第二抗原。在一些实施方案中,第一抗原是Siglec-9蛋白或其天然存在的变体。在一些实施方案中,第二抗原也是Siglec-9蛋白或其天然存在的变体。在一些实施方案中,第二抗原是促进跨血脑屏障的转运的抗原(参见例如,Gabathuler R.,Neurobiol.Dis.37(2010)48-57)。此类第二抗原包括但不限于转铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体、CRM197、美洲驼单结构域抗体、TMEM 30(A)、蛋白质转导结构域、TAT、Syn-B、穿膜素、聚精氨酸肽、血管肽肽如ANG1005(参见例如,Gabathuler,2010)和其它在血脑屏障内皮细胞上富集的细胞表面蛋白质(参见例如,Daneman等人,PLoS One.2010年10月29日;5(10):e13741)。在一些实施方案中,第二抗原是致病蛋白,包括但不限于淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽。在一些实施方案中,第二抗原是在免疫细胞上表达的一种或多种配体和/或蛋白质,包括但不限于,PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73以及磷脂酰丝氨酸。在一些实施方案中,第二抗原是在一种或多种肿瘤细胞上表达的蛋白质、脂质、多糖或糖脂。
抗体片段
本公开的某些方面涉及结合至本公开的Siglec-9蛋白、Siglec-9蛋白的天然存在的变体和Siglec-9蛋白的疾病变体中的一种或多种的抗体片段。在一些实施方案中,所述抗体片段是Fab、Fab'、Fab'-SH、F(ab')2、Fv或scFv片段。
在一些实施方案中,所述抗体片段与第二Siglec-9抗体和/或与一种或多种特异性地结合致病蛋白的抗体组合使用,所述致病蛋白选自:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽以及其任何组合;或与结合选自以下各项的免疫调节蛋白的一种或多种抗体组合使用:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73以及磷脂酰丝氨酸。
在一些实施方案中,本公开的抗体片段可以是与本公开的任何抗Siglec-9抗体结合相同表位的功能片段。在一些实施方案中,所述抗体片段是本公开的抗Siglec-9抗体或抗体片段的微型化型式,其具有相应全长抗体的相同表位,但具有小得多的分子量。这种微型化抗Siglec-9抗体片段可具有更好的脑渗透能力和更短的半衰期,这对于成像和诊断应用是有利的(参见例如,Lütje S等人,Bioconjug Chem.2014年2月19日;25(2):335-41;TavaréR等人,Proc Natl Acad Sci U S A.2014年1月21日;111(3):1108-13;以及Wiehr S等人,Prostate.2014年5月;74(7):743-55)。因此,在一些实施方案中,本公开的抗Siglec-9抗体片段具有与其相应的全长抗体相比更好的脑渗透和/或具有与其相应的全长抗体相比更短的半衰期。
抗体框架
本文所述的任何抗体还包含框架。在一些实施方案中,所述框架是人免疫球蛋白框架。例如,在一些实施方案中,抗体(例如,抗Siglec-9抗体)包含如任何以上实施方案中的HVR,并且还包含受体人框架,例如人免疫球蛋白框架或人共有框架。人免疫球蛋白框架可以是人抗体的一部分,或者可通过用人框架区置换一个或多个内源框架来将非人抗体人源化。可用于人源化的人框架区包括但不限于:使用“最佳拟合”方法选择的框架区(参见例如,Sims等人J.Immunol.151:2296(1993));源于轻链或重链可变区的特定亚组的人抗体的共有序列的框架区(参见例如,Carter等人Proc.Natl.Acad.Sci.USA,89:4285(1992);以及Presta等人,J.Immunol.,151:2623(1993));人成熟(体细胞突变)框架区或人生殖系框架区(参见例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008));以及由筛选FR文库获得的框架区(参见例如Baca等人,J.Biol.Chem.272:10678-10684(1997)以及Rosok等人,J.Biol.Chem.271:22611-22618(1996))。
在一些实施方案中,抗体包含轻链可变区,所述轻链可变区包含本公开的HVR-L1、HVR-L2和HVR-L3以及如表4A中所示的轻链框架区中的一个、两个、三个或四个。在一些实施方案中,抗体包含重链可变区,所述重链可变区包含本公开的HVR-H1、HVR-H2和HVR-H3以及如表3B中所示的重链框架区中的一个、两个、三个或四个。在一些实施方案中,抗体包含轻链可变区,所述轻链可变区包含本公开的HVR-L1、HVR-L2和HVR-L3以及表4A中所示的轻链框架区中的一个、两个、三个或四个,并且还包含重链可变区,所述重链可变区包含本公开的HVR-H1、HVR-H2和HVR-H3以及表4B中所示的重链框架区中的一个、两个、三个或四个。
抗体制备
本公开的抗Siglec-9抗体可涵盖多克隆抗体、单克隆抗体、人源化和嵌合抗体、人抗体、抗体片段(例如Fab、Fab'-SH、Fv、scFv和F(ab')
(1)多克隆抗体
通常在动物中通过多次皮下(sc)或腹膜内(ip)注射相关抗原和佐剂来产生多克隆抗体,如多克隆抗Siglec-9抗体。使用双功能或衍生剂将相关抗原(例如,本公开的纯化或重组Siglec-9蛋白)缀合至在待免疫物种中具有免疫原性的蛋白质可以是有用的,所述蛋白质例如钥孔血蓝蛋白(KLH)、血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂,所述双功能试剂或衍生剂例如马来酰亚胺苯甲酰磺基琥珀酰亚胺酯(通过半胱氨酸残基进行缀合)、N-羟基琥珀酰亚胺(通过赖氨酸残基)、戊二醛、琥珀酸酐、SOCl
通过将例如100μg(对于兔)或5μg(对于小鼠)的蛋白质或缀合物与3体积的弗氏完全佐剂组合并且将所述溶液皮内注射在多个部位来针对所需抗原、免疫原性缀合物或衍生物对动物进行免疫。一个月后,通过在多个部位皮下注射,用1/5至1/10的初始量的于弗氏完全佐剂中的肽或缀合物对动物加强免疫。七到十四天后,将动物放血并测定血清的抗体滴度。对动物加强免疫,直到效价稳定。缀合物也可在重组细胞培养物中制备为蛋白质融合体。此外,如明矾的聚集剂适用于增强免疫应答。
(2)单克隆抗体
单克隆抗体如单克隆抗Siglec-9抗体从基本上同质抗体的群体获得,即构成所述群体的各个抗体是相同的,除了可能以微量存在的可能的天然存在的突变和/或翻译后修饰(例如,异构化,酰胺化)。因此,修饰语“单克隆”表明抗体的特征不是分立抗体的混合物。
例如,单克隆抗Siglec-9抗体可使用最初由Kohler等人,Nature,256:495(1975)描述的杂交瘤方法制备,或可通过重组DNA方法(美国专利号4,816,567)来制备。
在杂交瘤方法中,使小鼠或其它适当的宿主动物(诸如仓鼠)如上文所描述进行免疫以得到产生或能够产生将特异性结合至用于免疫的蛋白质(例如,本公开的纯化或重组Siglec-9蛋白)的抗体的淋巴细胞。可替代地,淋巴细胞可被体外免疫。然后,使用合适的融合剂(诸如聚乙二醇)使淋巴细胞与骨髓瘤细胞融合以形成杂交瘤细胞(Goding,Monoclonal Antibodies:Principles and Practice,第59-103页(Academic Press,1986))。
免疫剂通常将包括抗原蛋白(例如,本公开的纯化或重组Siglec-9蛋白)或其融合变体。一般来说,如果需要人来源的细胞,则使用外周血淋巴细胞(“PBL”);而如果需要非人哺乳动物来源的细胞,则使用脾细胞或淋巴结细胞。然后使用合适的融合剂(如聚乙二醇)将淋巴细胞与永生化细胞系融合,以形成杂交瘤细胞。Goding,Monoclonal Antibodies:Principles and Practice,Academic Press(1986),第59-103页。
永生化细胞系通常是转化的哺乳动物细胞,尤其是啮齿动物、牛或人来源的骨髓瘤细胞。通常,使用大鼠或小鼠骨髓瘤细胞系。接种所制备的杂交瘤细胞,并使其在优选含有一种或多种抑制未融合的亲本骨髓瘤细胞生长或存活的物质的合适的培养基中生长。例如,如果亲本骨髓瘤细胞缺乏酶次黄嘌呤鸟嘌呤磷酸核糖基转移酶(HGPRT或HPRT),那么用于杂交瘤的培养基通常将包括次黄嘌呤、氨基喋呤和胸苷(HAT培养基),其是防止缺乏HGPRT的细胞的生长的物质。
优选的永生化骨髓瘤细胞是那些有效融合、支持通过所选择的抗体产生细胞的稳定高水平抗体产生,且对培养基(诸如HAT培养基)敏感的骨髓瘤细胞。在这些之中,优选的是鼠类骨髓瘤系,诸如源自MOPC-21和MPC-11小鼠肿瘤(可从Salk Institute CellDistribution Center,San Diego,California USA获得)的的细胞系以及SP-2细胞及其衍生物(例如,X63-Ag8-653)(可从American Type Culture Collection,Manassas,VirginiaUSA获得)。人骨髓瘤和小鼠-人异源骨髓瘤细胞系还被描述用于人单克隆抗体的产生(Kozbor,J.Immunol.,133:3001(1984);Brodeur等人,Monoclonal Antibody ProductionTechniques and Applications,第51-63页(Marcel Dekker,Inc.,New York,1987))。
测定杂交瘤细胞生长所处的培养基中针对抗原的单克隆抗体(例如,本公开的Siglec-9蛋白)的产生。优选地,通过免疫沉淀法或通过体外结合测定(如放射免疫测定(RIA)或酶联免疫吸附测定(ELISA))来测定杂交瘤细胞产生的单克隆抗体的结合特异性。
可测定其中培养杂交瘤细胞的培养基中针对所需抗原的单克隆抗体(例如本公开的Siglec-9蛋白)的存在。优选地,可通过免疫沉淀法或通过体外结合测定(如放射免疫测定(RIA)或酶联测定(ELISA))来测定单克隆抗体的结合亲和力和特异性。此类技术和测定是本领域中已知的。例如,结合亲和力可通过Munson等人,Anal.Biochem.,107:220(1980)的斯卡查德分析(Scatchard analysis)确定。
在鉴定产生具有所需特异性、亲和力和/或活性的抗体的杂交瘤细胞后,就可通过有限稀释程序而将所述克隆进行亚克隆并且通过标准方法使其生长(Goding,同上)。用于这一目的的合适培养基包括例如D-MEM或RPMI-1640培养基。此外,杂交瘤细胞可作为哺乳动物体内的肿瘤在体内生长。
由亚克隆分泌的单克隆抗体可通过常规免疫球蛋白纯化程序(例如像蛋白质A-琼脂糖色谱法、羟基磷灰石色谱法、凝胶电泳、透析、亲和色谱法以及如上所述的其它方法)从培养基、腹水或血清中适合地分离。
抗Siglec-9单克隆抗体也可通过重组DNA方法来制备,如美国专利号4,816,567中公开和如上所述的那些方法。使用常规程序(例如,通过使用特异性地结合至编码鼠抗体的重链和轻链的基因的寡核苷酸探针)来容易地将编码单克隆抗体的DNA分离和/或测序。杂交瘤细胞充当这类DNA的优选来源。一旦分离,就可将DNA置于表达载体中,然后将其转染至宿主细胞,如大肠杆菌细胞、猴COS细胞、中国仓鼠卵巢(CHO)细胞、或不以另外的方式产生免疫球蛋白的骨髓瘤细胞中,以便在此类重组宿主细胞中合成单克隆抗体。关于在细菌中重组表达编码抗体的DNA的文献综述包括Skerra等人,Curr.Opin.Immunol.,5:256-262(1993)和Plückthun,Immunol.Rev.130:151-188(1992)。
在某些实施方案中,抗Siglec-9抗体可从使用在McCafferty等人,Nature,348:552-554(1990)中描述的技术产生的抗体噬菌体文库分离。Clackson等人,Nature,352:624-628(1991)和Marks等人,J.Mol.Biol.,222:581-597(1991)描述了分别从噬菌体文库分离鼠抗体和人抗体。随后的公布描述通过链改组(Marks等人,Bio/Technology,10:779-783(1992))以及组合感染和体内重组作为构建非常大的噬菌体库的策略(Waterhouse等人,Nucl.Acids Res.,21:2265-2266(1993))来产生高亲和力(纳摩尔(“nM”)范围)的人抗体。因此,这些技术是用于分离具有所需特异性的单克隆抗体(例如,结合本公开的Siglec-9蛋白的那些)的传统单克隆抗体杂交瘤技术的可行替代方案。
还可例如通过取代人重链和轻链恒定结构域的编码序列代替同源鼠序列(美国专利号4,816,567;Morrison等人,Proc.Natl Acad.Sci.USA,81:6851(1984))或通过将非免疫球蛋白多肽的编码序列的全部或一部分共价连接至免疫球蛋白编码序列来修饰编码DNA的抗体或片段。通常,此类非免疫球蛋白多肽取代抗体的恒定结构域或它们取代抗体的一个抗原组合位点的可变结构域以产生嵌合二价抗体,所述抗体包含具有针对抗原的特异性的一个抗原组合位点和具有针对不同抗原的特异性的另一个抗原组合位点。
本文所述的单克隆抗体(例如,本公开的抗Siglec-9抗体或其片段)可单价制备,其制备是本领域中熟知的。例如,一种方法涉及免疫球蛋白轻链和修饰的重链的重组表达。重链通常在Fc区中的任何点处截短以便防止重链交联。或者,相关的半胱氨酸残基可被另一个氨基酸残基取代或被缺失以防止交联。体外方法也适合于制备单价抗体。消化抗体以产生其片段,尤其是Fab片段可使用本领域中已知的常规技术来完成。
可使用合成蛋白质化学中的已知方法(包括涉及交联剂的那些)在体外制备嵌合或杂合抗Siglec-9抗体。例如,可使用二硫化物交换反应或通过形成硫醚键来构建免疫毒素。用于此目的的适合试剂的实例包括亚氨基硫醇酯和甲基-4-巯基丁酰亚氨酸酯。
(3)人源化抗体
本公开的抗Siglec-9抗体或其抗体片段可进一步包括人源化或人抗体。非人(例如鼠)抗体的人源化形式是嵌合免疫球蛋白、免疫球蛋白链或其片段(诸如Fab、Fab'-SH、Fv、scFv、F(ab')
用于人源化非人抗Siglec-9抗体的方法是本领域中熟知的。总体上,人源化抗体具有从非人来源引入其中的一个或多个氨基酸残基。这些非人氨基酸残基通常被称为“输入”残基,其通常取自“输入”可变结构域。人源化可基本上根据Winter和合作者,Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature 332:323-327(1988);Verhoeyen等人,Science 239:1534-1536(1988)的方法,或通过用啮齿动物CDR或CDR序列替换人抗体的相应序列来产生。因此,此类“人源化”抗体是嵌合抗体(美国专利号4,816,567),其中基本上小于完整人可变结构域已被来自非人物种的对应序列取代。实际上,人源化抗体通常是人抗体,其中一些CDR残基和可能一些FR残基被来自啮齿动物抗体中的类似部位的残基取代。
用于制备人源化抗体的人可变结构域轻链与重链的选择对降低抗原性来说是非常重要的。根据所谓的“最佳拟合”方法,针对已知的人可变结构域序列的整个文库筛选啮齿动物抗体的可变结构域的序列。与啮齿动物的序列最接近的人序列然后被接受作为人源化抗体的人框架(FR)。Sims等人,J.Immunol.,151:2296(1993);Chothia等人,J.Mol.Biol.,196:901(1987)。另一种方法使用源自轻链或重链的特定亚组的所有人抗体的共有序列的特定框架。相同的框架可用于若干不同的人源化抗体。Carter等人,Proc.Nat’l Acad.Sci.USA 89:4285(1992);Presta等人,J.Immunol.151:2623(1993)。
此外,重要的是抗体保留对抗原的高亲和力和其它有利的生物性质而被人源化。为实现这一目标,根据优选的方法,利用亲本序列和人源化序列的三维模型通过分析亲本序列和各种概念上人源化的产物的方法制备人源化抗体。三维免疫球蛋白模型通常可用并且是本领域的技术人员熟悉的。计算机程序可用,所述程序说明并展示选择的候选免疫球蛋白序列的可能的三维构象结构。对这些展示的检查允许分析残基在候选免疫球蛋白序列的功能中的可能作用,即分析可影响候选免疫球蛋白结合其抗原的能力的残基。以这种方式,可从接受者和输入序列中选择FR残基并组合,以使得实现所需的抗体特征,如对一种或多种靶抗原(例如本公开的Siglec-9蛋白)的亲和力增加。通常,所述CDR残基直接并且最显著地牵涉于影响抗原结合。
考虑了各种形式的人源化抗Siglec-9抗体。例如,人源化抗Siglec-9抗体可以是抗体片段如Fab,其任选地与一种或多种细胞毒性剂缀合以便产生免疫缀合物。或者,人源化抗Siglec-9抗体可以是完整抗体,如完整IgG1抗体。
(4)人抗体
或者,可产生人抗Siglec-9抗体。例如,现在有可能产生在不存在内源性免疫球蛋白产生的情况下在免疫之后能够产生人抗体的全谱系的转基因动物(例如,小鼠)。嵌合和种系突变小鼠中抗体重链连接区(J
或者,可使用噬菌体展示技术从来自未免疫供体的免疫球蛋白可变(V)结构域基因谱系体外产生人抗Siglec-9抗体和抗体片段。McCafferty等人,Nature 348:552-553(1990);Hoogenboom和Winter,J.Mol.Biol.227:381(1991)。根据这项技术,抗体V结构域基因是以框内方式克隆至丝状噬菌体(如M13或fd)的主要或次要外壳蛋白基因中,并且在噬菌体颗粒的表面上展示为功能性抗体片段。因为丝状颗粒含有噬菌体基因组的单链DNA拷贝,所以基于抗体的功能特性的选择还导致编码表现那些特性的抗体的基因的选择。因而,噬菌体模拟B细胞的一些特性。噬菌体展示可以例如综述于Johnson,Kevin S.和Chiswell,David J.,Curr.Opin Struct.Biol.3:564-571(1993)中的多种形式进行。若干V基因区段来源可以用于噬菌体展示。Clackson等人,Nature 352:624-628(1991)从源自免疫小鼠的脾脏的V基因的小随机组合文库分离了抗噁唑酮抗体的不同阵列。可构建来自未免疫人供体的V基因谱系,并且可按照由Marks等人,J.Mol.Biol.222:581-597(1991)或Griffith等人,EMBO J.12:725-734(1993)描述的技术而基本上分离针对抗原(包括自身抗原)的不同阵列的抗体。还参见美国专利号5,565,332和5,573,905。此外,酵母展示技术可用于在体外产生人抗Siglec-9抗体和抗体片段(例如,WO 2009/036379;WO 2010/105256;WO 2012/009568;US 2009/0181855;US 2010/0056386;以及Feldhaus和Siegel(2004)J.Immunological Methods 290:69-80)。在其它实施方案中,核糖体展示技术可用于在体外产生人抗Siglec-9抗体和抗体片段(例如,Roberts和Szostak(1997)Proc Natl AcadSci 94:12297-12302;Schaffitzel等人(1999)J.Immunolical Methods 231:119-135;Lipovsek和Plückthun(2004)J.Immunological Methods 290:51-67)。
Cole等人和Boerner等人的技术也可用于制备人抗Siglec-9单克隆抗体(Cole等人,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,第77页(1985)以及Boerner等人,J.Immunol.147(1):86-95(1991)。类似地,可通过将人免疫球蛋白基因座引入转基因动物,例如其中内源性免疫球蛋白基因已经部分或完全失活的小鼠来制备人抗Siglec-9抗体。在激发时,观察到人抗体产生,其与人中在所有方面中观察到的非常相似,包括基因重排、组装和抗体谱系。这种方法描述于例如美国专利号5,545,807;5,545,806、5,569,825、5,625,126、5,633,425、5,661,016以及以下科学出版物中:Marks等人,Bio/Technology 10:779-783(1992);Lonberg等人,Nature 368:856-859(1994);Morrison,Nature 368:812-13(1994);Fishwild等人,Nature Biotechnology 14:845-51(1996);Neuberger,Nature Biotechnology 14:826(1996)以及Lonberg和Huszar,Intern.Rev.Immunol.13:65-93(1995)中。
最后,人抗Siglec-9抗体也可由活化的B细胞体外产生(参见美国专利号5,567,610和5,229,275)。
(5)抗体片段
在某些实施方案中,使用抗Siglec-9抗体片段而不是完整的抗Siglec-9抗体是有利的。较小的片段大小允许实现快速清除和更好的脑渗透。
已经开发了用于产生抗体片段的各种技术。传统上,这些片段是经由完整抗体的蛋白水解消化而衍生的(参见例如,Morimoto等人,J.Biochem.Biophys.Method.24:107-117(1992);以及Brennan等人,Science 229:81(1985))。然而,现在可通过重组宿主细胞,例如使用编码本公开的抗Siglec-9抗体的核酸直接产生这些片段。所有Fab、Fv和scFv抗体片段都可在大肠杆菌中表达并且从其分泌,因而允许大量这些片段的直接生产。抗Siglec-9抗体片段还可从以上所讨论的抗体噬菌体文库分离。或者,Fab'-SH片段可直接从大肠杆菌中回收并且化学偶联以便形成F(ab')
(6)双特异性和多特异性抗体
双特异性抗体(BsAb)是对至少两种不同表位,包括相同或另一种蛋白质(例如本公开的一种或多种Siglec-9蛋白)上的那些表位具有结合特异性的抗体。或者,BsAb的一部分可配置为结合至靶Siglec-9抗原,并且另一部分可与结合至第二种蛋白质的臂组合。此类抗体可源自全长抗体或抗体片段(例如F(ab')
用于制备双特异性抗体的方法是本领域中已知的。全长双特异性抗体的传统产生是基于两个免疫球蛋白重链/轻链对的共表达,其中两个链具有不同的特异性。Millstein等人,Nature,305:537-539(1983)。归因于免疫球蛋白重链和轻链的随机搭配,这些杂交瘤(四链瘤)产生10种不同抗体分子的一种潜在混合物,其中只有一个具有正确的双特异性结构。通常通过亲和色谱步骤进行的正确分子的纯化十分繁琐,并且产物产率是低的。类似的程序公开于WO 93/08829和Traunecker等人,EMBO J.,10:3655-3659(1991)中。
根据一种不同的方法,具有所需结合特异性的抗体可变结构域(抗体-抗原组合位点)融合至免疫球蛋白恒定结构域序列。所述融合优选与免疫球蛋白重链恒定结构域一起,所述免疫球蛋白重链恒定结构域包含铰链、C
在这种方法的优选实施方案中,双特异性抗体由在一个臂中具有第一结合特异性的杂合免疫球蛋白重链和在另一个臂中的杂合免疫球蛋白重链-轻链对(从而提供第二结合特异性)组成。据发现这种不对称结构有助于将所需的双特异性化合物与不想要的免疫球蛋白链组合分开,因为在仅一半的双特异性分子中存在免疫球蛋白轻链提供了简单的分离方式。这一方法在WO 94/04690中公开。关于产生双特异性抗体的进一步细节,参见,例如,Suresh等人,Methods in Enzymology 121:210(1986)。
根据在WO 96/27011或美国专利号5,731,168中描述的另一种方法,一对抗体分子之间的界面可被工程化以便将从重组细胞培养物回收的异源二聚体的百分比最大化。优选的界面包含抗体恒定结构域的C
已经在文献中描述了从抗体片段产生双特异性抗体的技术。例如,双特异性抗体可使用化学键联来制备。Brennan等人,Science 229:81(1985)描述了一种程序,其中完整抗体被蛋白水解裂解以产生F(ab')
Fab'片段可直接从大肠杆菌中回收并化学偶联以形成双特异性抗体。Shalaby等人,J.Exp.Med.175:217-225(1992)描述了完全人源化的双特异性抗体F(ab')
还已经描述了直接自重组细胞培养物制备和分离二价抗体片段的各种技术。例如,已使用亮氨酸拉链产生了二价抗体。Kostelny等人,J.Immunol.,148(5):1547-1553(1992)。来自Fos和Jun蛋白的亮氨酸拉链肽通过基因融合与两种不同抗体的Fab'部分连接。抗体同二聚体在铰链区处还原以形成单体,并且然后再次氧化以形成抗体异二聚体。由Hollinger等人,Proc.Nat’l Acad.Sci.USA,90:6444-6448(1993)描述的“双抗体”技术已经提供了用于制备双特异性/二价抗体片段的替代机制。所述片段包含通过接头与轻链可变结构域(V
还考虑了具有超过两个价态的抗体。例如,可以制备三特异性抗体。Tutt等人,J.Immunol.147:60(1991)。
示例性双特异性抗体可结合至给定分子上的两个不同表位(例如,本公开的Siglec-9蛋白)。或者,靶向Siglec-9信号传导组分的臂可与结合至白细胞上的触发分子如T细胞受体分子(例如CD2、CD3、CD28或B7)或IgG的Fc受体(FcγR)(如FcγRI(CD64)、FcγRII(CD32)和FcγRIII(CD16)的臂组合,以便使细胞防御机制集中于表达特定蛋白质的细胞。双特异性抗体还可用于将细胞毒性剂定位至表达特定蛋白质的细胞。此类抗体拥有蛋白质结合臂和结合细胞毒性剂或放射性核素螯合剂(如EOTUBE、DPTA、DOTA或TETA)的臂。另一种目标双特异性抗体结合目标蛋白质并进一步结合组织因子(TF)。
(7)多价抗体
与二价抗体相比,多价抗体可由表达抗体所结合的抗原的细胞来更快地内在化(和/或异化)。本公开的抗Siglec-9抗体或其抗体片段可以是具有三个或更多个抗原结合位点的多价抗体(它们是IgM类别以外的)(例如,四价抗体),所述抗体可通过编码抗体的多肽链的核酸的重组表达来容易地产生。多价抗体可包含二聚化结构域和三个或更多个抗原结合位点。优选的二聚化结构域包含Fc区或铰链区。在这种情形下,抗体将包含Fc区和Fc区的氨基末端的三个或更多个抗原结合位点。本文优选的多价抗体含有3个至约8个、但优选4个抗原结合位点。多价抗体含有至少一条多肽链(且优选两条多肽链),其中一条或多条多肽链包含两个或更多个可变结构域。例如,所述一条或多条多肽链可包含VD1-(X1)n-VD2-(X2)n-Fc,其中VD1是第一可变结构域,VD2是第二可变结构域,Fc是Fc区的一条多肽链,X1和X2表示氨基酸或多肽,并且n是0或1。类似地,一条或多条多肽链可包含V
(8)异缀合物抗体
异缀合物抗体也在本公开的范围内。异缀合物抗体由两种共价连接的抗体(例如,本公开的抗Siglec-9抗体或其抗体片段)组成。举例来说,异缀合物中的一个抗体可偶联至抗生物素蛋白,另一个抗体可偶联至生物素。此类抗体已经(例如)被提出使免疫系统细胞靶向至非期望的细胞(美国专利号4,676,980)并且已经用于治疗HIV感染。国际公布号WO91/00360、WO 92/200373和EP 0308936。考虑可使用合成蛋白质化学中的已知方法(包括涉及交联剂的那些)在体外制备所述抗体。例如,可使用二硫化物交换反应或通过形成硫醚键来构建免疫毒素。用于此目的的合适试剂的实例包括亚氨基硫醇酯和甲基-4-巯基丁酰亚胺酸酯以及例如在美国专利号4,676,980中公开的那些。异缀合物抗体可使用任何便利的交联方法来制成。合适交联剂在本领域中是熟知的,并且与许多交联技术一起在美国专利号4,676,980中公开。
(9)效应功能工程化
修饰本公开的抗Siglec-9抗体以改变效应功能和/或增加抗体的血清半衰期也可以是合乎需要的。例如,恒定区上的Fc受体结合位点可被修饰或突变以除去或降低对某些Fc受体如FcγRI、FcγRII和/或FcγRIII的结合亲和力。在一些实施方案中,通过除去抗体的Fc区的N-糖基化(例如,在IgG的CH 2结构域中),效应功能受损。在一些实施方案中,通过修饰人IgG的诸如233-236、297和/或327-331的区域来使效应功能受损,如PCT WO 99/58572和Armour等人,Molecular Immunology 40:585-593(2003);Reddy等人,J.Immunology 164:1925-1933(2000)中所描述。
为了增加抗体的血清半衰期,可例如将补救受体结合表位掺入到抗体(尤其是抗体片段)中,如在美国专利号5,739,277中所描述的。如本文所用,术语“补救受体结合表位”是指引起IgG分子的体内血清半衰期的增加的IgG分子(例如,IgG
(10)其它氨基酸序列修饰
还考虑了本公开的抗Siglec-9抗体或其抗体片段的氨基酸序列修饰。例如,可能需要改善抗体或抗体片段的结合亲和力和/或其它生物性质。抗体或抗体片段的氨基酸序列变体可通过将适当核苷酸变化引入编码抗体或抗体片段的核酸中或通过肽合成来制备。此类修饰包括例如抗体的氨基酸序列内的残基的缺失和/或插入和/或取代。只要最终构建体具有所需特征(即与本公开的Siglec-9蛋白结合或物理相互作用的能力),则进行缺失、插入和取代的任何组合以达到最终构建体。氨基酸变化也可改变抗体的翻译后过程,如改变糖基化位点的数目或位置。
一种可用于鉴定抗Siglec-9抗体中为优选诱变位置的某些残基或区域的方法称作“丙氨酸扫描诱变”,如由Cunningham和Wells在Science,244:1081-1085(1989)中所描述。在此,鉴定残基或靶残基的组(例如,带电荷的残基诸如arg、asp、his、lys和glu),并用中性或带负电荷的氨基酸(最优选丙氨酸或聚丙氨酸)置换以影响氨基酸与靶抗原的相互作用。然后,对于取代显示功能敏感度的那些氨基酸位置通过在(或针对)取代位点引入另外的或其它变体而被改善(refined)。因此,尽管用于引入氨基酸序列变异的位点被预先确定,但本身突变的性质不需要预先确定。例如,为了分析给定位点处突变的表现,在靶密码子或区域进行丙氨酸扫描或随机诱变,并筛选所表达的抗体变体的所需活性。
氨基酸序列插入包括长度在一个残基至含有一百个或更多个残基的多肽的范围内的氨基(“N”)和/或羧基(“C”)末端融合,以及具有单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N末端甲硫氨酰基残基的抗体或融合至细胞毒性多肽的抗体。抗体分子的其它插入变体包括抗体的N端或C端与增加抗体的血清半衰期的酶或多肽的融合。
另一种类型的变体是氨基酸取代变体。这些变体在抗体分子中有至少一个氨基酸残基被不同的残基取代。取代诱变最感兴趣的位点包括高变区,但也考虑了FR改变。保守性取代展示于以下表E中的标题“优选取代”下。如果此类取代产生生物活性的改变,则可引入在表E中命名为“示例性取代”的、或如下进一步参考氨基酸类别所述的更多实质性改变,并且筛选产物。
表E:氨基酸取代
/>
抗体的生物性质的实质性修饰通过选择取代来实现,所述取代对维持(a)取代区域中的多肽主链的结构,例如呈薄片或螺旋构象;(b)分子在靶位点处的电荷或疏水性;或(c)侧链体积的影响显著不同。基于共同的侧链性质将天然存在的残基分组:
(1)疏水性:正亮氨酸、met、ala、val、leu、ile;
(2)中性亲水性:cys、ser、thr;
(3)酸性:asp、glu;
(4)碱性:asn、gln、his、lys、arg;
(5)影响链取向的残基:gly、pro;以及
(6)芳族:trp、tyr、phe。
非保守性取代需要将这些类别中的一类的成员更换成另一类别。
不参与维持抗体的适当构象的任何半胱氨酸残基还可被(通常用丝氨酸)取代以便改进分子的氧化稳定性并且防止异常交联。相反,可将半胱氨酸键添加至抗体以改进它的稳定性(特别是在抗体是如Fv片段的抗体片段的情况下)。
一种特别优选类型的取代变体涉及取代亲本抗体(例如,人源化或人抗Siglec-9抗体)的一个或多个高变区残基。一般而言,选择用于进一步发育的所得变体相对于产生它们的亲本抗体将具有改善的生物学性质。用于产生此类替代变体的便利方式涉及使用噬菌体展示的亲和力成熟。简言之,若干高变区位点(例如,6-7个位点)被突变以在每个位点产生所有可能的氨基酸取代。如此产生的抗体变体以单价方式从丝状噬菌体颗粒展示,作为与每个颗粒内包装的M13的基因III产物的融合物。然后,如本文所公开,针对噬菌体展示变体的生物活性(例如,结合亲和力)来筛选它们。为了鉴定用于修饰的候选高变区位点,可进行丙氨酸扫描诱变以鉴定对抗原结合有显著贡献的高变区残基。或者或另外,分析抗原-抗体复合物的晶体结构以鉴定抗体与抗原(例如,本公开的Siglec-9蛋白)之间的接触点可能是有益的。根据本文阐述的技术,此类接触残基和相邻残基是用于取代的候选物。一旦产生了此类变体,就如本文所述对一组变体进行筛选,并且可选择在一种或多种相关测定中具有优异性质的抗体用于进一步发育。
抗体的另一种类型的氨基酸变体改变抗体的原始糖基化模式。改变是指缺失抗体中发现的一个或多个碳水化合物部分,和/或添加不存在于抗体中的一个或多个糖基化位点。
抗体的糖基化通常是N-连接的或O-连接的。N-连接是指碳水化合物部分连接于天冬酰胺残基的侧链。其中X是除脯氨酸之外的任何氨基酸的三肽序列天冬酰胺-X-丝氨酸和天冬酰胺-X-苏氨酸是碳水化合物部分酶促连接于天冬酰胺侧链的识别序列。因此,在多肽中的这些三肽序列中的任何一个的存在产生潜在糖基化位点。O-连接的糖基化是指糖N-乙酰半乳糖胺、半乳糖或木糖之一与羟氨基酸连接,最常见的是丝氨酸或苏氨酸,不过也可以使用5-羟基脯氨酸或5-羟基赖氨酸。
糖化位点至抗体的添加宜通过改变氨基酸序列以使得其含有上述三肽序列中的一个或多个来实现(对于经N连接的糖化位点)。改变也可通过对原始蛋白的序列的一个或多个丝氨酸或苏氨酸残基的添加或取代来造成(对于O-连接的糖基化位点)。
编码抗IgE抗体的氨基酸序列变体的核酸分子通过本领域中已知的多种方法来制备。这些方法包括但不限于从天然来源分离(在天然存在的氨基酸序列变体的情况下)或通过抗体(例如本公开的抗Siglec-9抗体)或抗体片段的先前制备的变体或非变体型式的寡核苷酸介导(或定点)诱变、PCR诱变和盒式诱变制备。
(11)抗体缀合物
本公开的抗Siglec-9抗体或其抗体片段可与可检测标记、毒素或治疗剂缀合。可使用本领域中已知用于将分子如可检测标记、毒素或治疗剂缀合至抗体的任何合适的方法。
例如,药物缀合涉及将生物活性细胞毒性(抗癌剂)有效负载或药物偶联至特异性地靶向某种肿瘤标志物(例如,理想地,仅在肿瘤细胞之中或之上发现的蛋白质)的抗体。抗体在体内追踪这些蛋白质并将其自身附接到癌细胞表面。抗体与靶蛋白(抗原)之间的生物化学反应在肿瘤细胞中触发信号,其然后与细胞毒素一起吸收或内化抗体。在ADC被内化后,细胞毒性药物被释放并杀死癌症。由于这种靶向作用,理想情况下所述药物具有较低的副作用,并且比其它化学治疗药物给出更宽的治疗窗口。所公开的用于缀合抗体的技术是本领域中已知的(参见例如,Jane de Lartigue,OncLive 2012年7月5日;ADC Review onantibody-drug conjugates;和Ducry等人,(2010).Bioconjugate Chemistry21(1):5–13)。
在一些实施方案中,本公开的抗Siglec-9抗体可缀合至选自以下的毒素:蓖麻毒素、蓖麻毒素A链、多柔比星、道诺霉素、类美登素、紫杉醇、溴化乙锭、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春花碱、秋水仙碱、二羟基炭疽菌素二酮、放线菌素、白喉毒素、假单胞菌外毒素(PE)A、PE40、相思豆毒素、相思豆毒素A链、蒴莲根毒素A链、α-八叠球菌素、白树毒素、丝林霉素(mitogellin)、局限曲菌素(retstrictocin)、酚霉素、伊诺霉素、麻疯树逆境蛋白、巴豆毒素、加利车霉素、肥皂草抑制剂、糖皮质激素、奥瑞斯他汀、金霉素(auromycin)、钇、铋、康普瑞汀(combrestatin)、倍癌霉素(duocarmycins)、多拉司他汀、cc1065以及顺铂。
(12)其它抗体修饰
本公开的抗Siglec-9抗体或其抗体片段可进一步修饰以含有本领域中已知且容易获得的另外的非蛋白质部分。优选地,适合衍生化抗体的部分是水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于聚乙二醇(PEG)、乙二醇/丙二醇共聚物、羧甲基纤维素、右旋糖酐、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)、和右旋糖酐或聚(n-乙烯吡咯烷酮)聚乙二醇、聚丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如甘油)、聚乙烯醇及其混合物。聚乙二醇丙醛由于其在水中的稳定性可具有制造优势。所述聚合物可具有任何分子量,并且可为分支或未分支的。连接到抗体的聚合物的数目可变化,并且如果连接多于一个聚合物,那么其可为相同或不同分子。一般来说,用于衍生化的聚合物的数目和/或类型可基于包括但不限于有待改善的抗体的特定性质或功能、抗体衍生物是否将在限定定条件下用于疗法中等考虑因素加以确定。此类技术和其它合适的制剂公开于Remington:The Science and Practice of Pharmacy,第20版,Alfonso Gennaro,编.,PhiladelphiaCollege of Pharmacy and Science(2000)。
结合测定和其它测定
可例如通过已知的方法如ELISA、表面等离子体共振(SPR)、蛋白质印迹等来测试本公开的抗Siglec-9抗体的抗原结合活性。
在某些实施方案中,竞争测定可用于鉴定与表2、3、4A、4B、7A和7B中列出或选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2的抗体中的任一种竞争的抗体。在某些实施方案中,这种竞争抗体结合至由表2、3、4A、4B、7A和7B中列出或选自2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2的抗体中的任一种结合的相同表位(例如,线性或构象表位)。用于对抗体所结合的表位作图的详细示例性方法提供于Morris(1996)“EpitopeMapping Protocols,”于Methods in Molecular Biology第66卷(Humana Press,Totowa,NJ)中。
在示例性竞争测定中,将固定的Siglec-9或细胞表面上表达Siglec-9的细胞在包含结合至Siglec-9的第一标记抗体(例如人或非人灵长类动物)和第二未标记抗体的溶液中孵育,所述第二未标记抗体正在针对其与所述第一抗体竞争结合至Siglec-9的能力进行测试。第二抗体可存在于杂交瘤上清液中。作为对照,将固定的Siglec-9或表达Siglec-9的细胞在包含第一标记抗体而不含第二未标记抗体的溶液中孵育。在容许第一抗体与Siglec-9结合的条件下孵育之后,移除过量未结合的抗体,并且测量与固定的Siglec-9或表达Siglec-9的细胞缔合的标记的量。如果相对于对照样品,与固定的Siglec-9或表达Siglec-9的细胞缔合的标记的量在测试样品中基本上降低,则然后指示第二抗体与第一抗体竞争结合至Siglec-9。参见Harlow和Lane(1988)Antibodies:A Laboratory Manual第14章(Cold Spring Harbor Laboratory,Cold Spring Harbor,NY)。
核酸、载体和宿主细胞
可使用例如如美国专利号4,816,567中所描述的重组方法和组合物来产生本公开的抗Siglec-9抗体。在一些实施方案中,提供了具有编码本公开的任何抗Siglec-9抗体的核苷酸序列的分离的核酸。此类核酸可编码含有抗Siglec-9抗体的VL的氨基酸序列和/或含有抗Siglec-9抗体的VH的氨基酸序列(例如所述抗体的轻链和/或重链)。在一些实施方案中,提供一种或多种含有此类核酸的载体(例如表达载体)。在一些实施方案中,还提供一种含有这种核酸的宿主细胞。在一些实施方案中,宿主细胞含有(例如已用以下转导):(1)含有编码含有抗体的VL的氨基酸序列和含有抗体的VH的氨基酸序列的核酸的载体,或(2)含有编码含有抗体的VL的氨基酸序列的核酸的第一载体和含有编码含有抗体的VH的氨基酸序列的核酸的第二载体。在一些实施方案中,宿主细胞是真核的,例如中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0、NS0、Sp20细胞)。
提供了制备本公开的抗Siglec-9抗体的方法。在一些实施方案中,所述方法包括在适合表达抗体的条件下培养含有编码抗Siglec-9抗体的核酸的本公开的宿主细胞。在一些实施方案中,随后从宿主细胞(或宿主细胞培养基)回收抗体。
为了重组产生本公开的抗Siglec-9抗体,分离编码抗Siglec-9抗体的核酸并将所述核酸插入到一个或多个载体中以进一步在宿主细胞中克隆和/或表达。此类核酸可易于使用常规程序(例如通过使用能够特异性结合至编码抗体的重链和轻链的基因的寡核苷酸探针)进行分离和测序。
含有编码本公开的任何抗Siglec-9抗体的核酸序列或其片段多肽(包括抗体)的合适载体包括但不限于克隆载体和表达载体。合适的克隆载体可根据标准技术构建,或者可选自本领域中可用的大量克隆载体。尽管选择的克隆载体可根据预期使用的宿主细胞而变化,但有用的克隆载体通常具有自我复制的能力,可具有针对特定限制性内切核酸酶的单一靶标,和/或可携带可用于选择含有载体的克隆的标记的基因。合适的实例包括质粒和细菌病毒,例如,pUC18、pUC19、Bluescript(例如,pBS SK+)及其衍生物、mpl8、mpl9、pBR322、pMB9、ColE1、pCR1、RP4、噬菌体DNA以及穿梭载体如pSA3和pAT28。这些和许多其它克隆载体可从商业供应商如BioRad、Strategene和Invitrogen获得。
表达载体通常是含有本公开的核酸的可复制多核苷酸构建体。所述表达载体通常可在宿主细胞中作为游离基因或染色体DNA的整体部分复制。合适的表达载体包括但不限于PCT公布号WO 87/04462中公开的质粒、病毒载体,包括腺病毒、腺相关病毒、逆转录病毒、粘粒和表达载体。载体组分通常可包括但不限于以下中的一种或多种:信号序列;复制起点;一种或多种标记基因;合适的转录控制元件(如启动子、增强子和终止子)。为了表达(即翻译),通常还需要一种或多种翻译控制元件,如核糖体结合位点、翻译起始位点和终止密码子。
含有目标核酸的载体可通过多种适当方式中的任一种引入宿主细胞,所述方式包括电穿孔;使用氯化钙、氯化铷、磷酸钙、DEAE-葡聚糖或其它物质转染;微粒轰击;脂质体转染;以及感染(例如,在载体是传染因子如牛痘病毒的情况下)。引入载体或多核苷酸的选择通常将取决于宿主细胞的特征。在一些实施方案中,所述载体含有核酸,所述核酸含有编码本公开的抗Siglec-9抗体的一条或多条氨基酸序列。
用于克隆或表达抗体编码载体的合适宿主细胞包括原核或真核细胞。例如,本公开的抗Siglec-9抗体可在细菌中产生,特别是当不需要糖基化和Fc效应功能时。关于在细菌中表达抗体片段和多肽(例如,美国专利号5,648,237、5,789,199和5,840,523;以及Charlton,Methods in Molecular Biology,第248卷(B.K.C.Lo,编,Humana Press,Totowa,NJ,2003),第245-254页,其描述在大肠杆菌中表达抗体片段)。在表达之后,抗体可从细菌细胞糊状物分离于可溶性部分中并且可进一步纯化。
除原核生物之外,诸如丝状真菌或酵母的真核微生物也为适于抗体编码性载体的克隆或表达宿主,包括糖基化路径已被“人源化”,从而产生具有部分或完全人糖基化型态的抗体的真菌和酵母菌株(例如,Gerngross,Nat.Biotech.22:1409-1414(2004);以及Li等人,Nat.Biotech.24:210-215(2006))。
用于表达糖基化抗体的合适宿主细胞还可来源于多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已鉴别众多可连同昆虫细胞一起使用的杆状病毒株,尤其是用于转染草地夜蛾(Spodoptera frugiperda)细胞。植物细胞培养物也可用作宿主(例如,美国专利号5,959,177、6,040,498、6,420,548、7,125,978和6,417,429,其描述用于在转基因植物中产生抗体的PLANTIBODIES
脊椎动物细胞也可用作宿主。例如,可使用适于悬浮生长的哺乳动物细胞系。有用的哺乳动物宿主细胞系的其它实例是由SV40转化的猴肾CV1细胞系(COS-7);人胚肾系(如例如Graham等人,J.Gen Virol.36:59(1977)中所述的293或293细胞);幼仓鼠肾细胞(BHK);小鼠塞尔托利细胞(sertoli cells)(如例如Mather,Biol.Reprod.23:243-251(1980)中所述的TM4细胞)(如例如Mather,Biol.Reprod.23:243-251(1980)中所述的TM4细胞);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK;水牛大鼠肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳腺肿瘤(MMT060562);如例如Mather等人,Annals N.Y.Acad.Sci.383:44-68(1982)中所述的TRI细胞;MRC 5细胞;以及FS4细胞。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub等人,Proc.Natl.Acad.Sci.USA 77:4216(1980));以及骨髓瘤细胞系,如Y0、NS0及Sp2/0。对于适于抗体产生的某些哺乳动物宿主细胞系的综述,参见例如Yazaki和Wu,Methods in Molecular Biology,第248卷(B.K.C.Lo编,Humana Press,Totowa,NJ),第255-268页(2003)。
Siglec-9活性
PI3K活化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后诱导PI3K活化。
PI3K是能够磷酸化磷脂酰肌醇(PtdIns)的肌醇环的3位羟基的相关细胞内信号转导激酶家族。基于一级结构、调控和体外脂质底物特异性,PI3K家族被分为三种不同的类别(I类、II类和III类)。
活化的PI3K产生各种3-磷酸化磷酸肌醇,包括但不限于PtdIns3P、PtdIns(3,4)P2、PtdIns(3,5)P2以及PtdIns(3,4,5)P3。这些3-磷酸化磷酸肌醇的以将信号传导蛋白募集到各种细胞膜上的机制起作用。这些信号传导蛋白含有磷酸肌醇结合结构域,包括但不限于PX结构域、普列克底物蛋白(pleckstrin)同源结构域(PH结构域)和FYVE结构域。可使用本领域中已知用于确定PI3K活化的任何方法。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与降低的PI3K活性水平相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
调节的细胞因子的表达
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在结合至细胞表面上表达的Siglec-9蛋白之后调节(例如增加或减少)脑中的促炎性介质。在某些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)在结合至细胞中表达的Siglec-9蛋白后调节细胞因子(例如促炎性介质)的表达和/或减少抗炎介质的表达。
炎症是血管组织对诸如病原体、受损细胞或刺激物的有害刺激的复杂生物反应的一部分。急性炎症的典型症状是疼痛、发热、发红和肿胀。炎症是通过限制损伤部位或通过募集和活化免疫系统的细胞清除感染来保护生物体的免疫应答。炎症应答受到严密调控并在其持续时间和严重程度方面限制以避免对生物体造成损害。炎症可分为急性或慢性炎症。急性炎症是由先天性免疫应答驱动的,所述先天性免疫应答最初识别有害刺激物并将来自血液的白细胞募集到损伤组织中。一连串生物化学事件(包括细胞因子和趋化因子释放)传送炎性应答,涉及局部血管系统、免疫系统和损伤组织内的各种细胞。慢性炎症延长并持续,其导致参与炎症应答的免疫细胞类型逐渐改变。作为炎症过程的结果,慢性炎症的特征在于组织的进行性破坏和纤维化。
如本文所用,抗炎介质是直接或间接(例如通过抗炎信号传导途径)参与降低、抑制或灭活炎症应答的机制的蛋白质。可使用本领域中已知用于鉴定和表征抗炎介质的任何方法。抗炎介质的实例包括但不限于细胞因子,如IL-4、IL-10、IL-13、IL-35、IL-16、IFN-α、TGF-β、IL-1Ra、G-CSF以及TNF-α或IL-6的可溶性受体。促炎性介质的实例包括但不限于细胞因子,如FN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、CRP、IL-33、MCP-1以及MIP-1-β。
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可调节(例如增加或减少)细胞因子如IL-1b、IL-8和TNF-a的表达。在某些实施方案中,调节的细胞因子表达发生在巨噬细胞、嗜中性粒细胞、天然杀伤(NK)细胞、树突细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞(Langerhans cells of skin)、库普弗细胞(Kupffer cells)、T细胞和/或小神经胶质细胞中。调节的表达可包括但不限于基因表达的增加、转录表达的增加或蛋白质表达的增加。可使用本领域中已知用于确定基因、转录物(例如,mRNA)和/或蛋白质表达的任何方法。例如,RNA印迹分析可用于确定细胞因子基因表达水平,RT-PCR可用于测定细胞因子转录的水平,并且蛋白质印迹分析可用于确定细胞因子蛋白水平。
如本文所用,如果细胞因子在用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)治疗的受试者的一种或多种细胞中的表达与未用Siglec-9药剂治疗的相应受试者的一种或多种细胞中表达的相同细胞因子的表达相比得到调节,则所述细胞因子可具有调节的表达。在一些实施方案中,例如与未用Siglec-9药剂治疗的相应受试者的一种或多种细胞中的细胞因子表达相比,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可将受试者的一种或多种细胞中的细胞因子表达调节至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用Siglec-9药剂治疗的相应受试者的一种或多种细胞中的细胞因子表达相比,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)将受试者的一种或多种细胞中的细胞因子表达调节至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
在一些实施方案中,本公开的一些Siglec-9药剂,如本公开的抗Siglec-9抗体适用于预防与一种或多种促炎性介质的异常水平相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
调节的促炎性介质的表达
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在结合至细胞中表达的Siglec-9蛋白后调节(例如增加或减少)促炎性介质的表达。
如本文所用,促炎性介质是直接或间接(例如通过促炎信号传导途径)参与诱导、活化、促进或以其它方式增加炎症应答的机制的蛋白质。可使用本领域中已知用于鉴定和表征促炎性介质的任何方法。
促炎性介质的实例包括但不限于细胞因子,如I和II型干扰素、IL-1β、TNF-α、IL-6、IL-8、IL-20家族成员、IL-33、LIF、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18以及CRP。
在一些实施方案中,本公开的抗Siglec-9抗体可调节促炎性介质的功能性表达和/或分泌,所述促炎性介质如I型和II型干扰素、FN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、CRP、IL-33、MCP-1以及MIP-1-β。在某些实施方案中,调节的促炎性介质表达发生在巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞中。调节的表达可包括但不限于调节的基因表达、调节的转录表达或调节的蛋白质表达。可使用本领域中已知用于确定基因、转录物(例如,mRNA)和/或蛋白质表达的任何方法。例如,RNA印迹分析可用于确定促炎性介质基因表达水平,RT-PCR可用于测定促炎性介质转录的水平,并且蛋白质印迹分析可用于确定促炎性介质蛋白质水平。
在某些实施方案中,促炎性介质包括炎性细胞因子。因此,在某些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可调节一种或多种炎性细胞因子的分泌。可通过本公开的抗Siglec-9抗体调节分泌的炎性细胞因子的实例包括但不限于如I型和II型干扰素、FN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、CRP、IL-33、MCP-1以及MIP-1-β。
在某些实施方案中,促炎性介质包括炎性受体、补体级联蛋白和/或在免疫细胞上表达的受体。因此,在某些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可调节一种或多种炎性受体、补体级联蛋白和/或在免疫细胞上表达的受体的表达。可通过本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)调节表达的炎性受体、补体级联蛋白和/或在免疫细胞上表达的受体实例包括但不限于CD86、CD80、CD83、C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX以及PYCARD。
如本文所用,如果促炎性介质在用本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)治疗的受试者的一种或多种细胞中的表达与未用所述激动剂抗Siglec-9抗体处理的相应受试者的一种或多种细胞中表达的相同促炎性介质的表达相比得到调节(增加或减少),则所述促炎性介质可具有调节的表达。在一些实施方案中,例如与未用抗Siglec-9抗体处理的相应受试者的一种或多种细胞中的促炎性介质表达相比,本公开的抗Siglec-9抗体可将受试者的一种或多种细胞中的促炎性介质表达调节至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用抗Siglec-9抗体处理的相应受试者的一种或多种细胞中的促炎性介质表达相比,所述抗Siglec-9抗体可将受试者的一种或多种细胞中的促炎性介质表达调节至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
在一些实施方案中,本公开的一些Siglec-9药剂,如本公开的抗Siglec-9抗体可适用于预防与一种或多种促炎性介质的异常水平相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
ERK磷酸化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后诱导细胞外信号调控激酶(ERK)磷酸化。
细胞外信号调控激酶(ERK)是广泛表达的蛋白激酶细胞内信号传导激酶,所述激酶参与例如分化细胞中的减数分裂、有丝分裂和有丝分裂期后功能。各种刺激物(如生长因子、细胞因子、病毒感染、异三聚体G蛋白偶联受体的配体、转化剂和致癌物质)活化ERK途径。ERK的磷酸化导致其激酶活性的活化。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与ERK磷酸化水平降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
Syk磷酸化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后诱导脾酪氨酸激酶(Syk)磷酸化。
脾酪氨酸激酶(Syk)是细胞内信号传导分子,其通过磷酸化若干底物而在Siglec-9下游起作用,由此促进形成导致细胞活化和炎症过程的信号传导复合物。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与Syk磷酸化水平降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
Siglec-9磷酸化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后通过Src家族酪氨酸激酶(如Src、Syk、Fyn、Fgr、Lck、Hck、Blk、Lyn和Frk)瞬时诱导Tyr-433和Tyr-456的Siglec-9磷酸化。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与Siglec-9磷酸化水平降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
含有ITAM基序的受体的磷酸化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后诱导磷酸化含ITAM基序的受体,如TREM1、TREM2、Sirpβ、FcgR、DAP10和DAP12。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与含ITAM基序的受体的磷酸化水平降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
调节的C-C趋化因子受体7表达
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后调节C-C趋化因子受体7(CCR7)的表达。调节(例如增加或减少)表达可包括但不限于基因表达的调节、转录表达的调节或蛋白质表达的调节。可使用本领域中已知用于确定基因、转录物(例如,mRNA)和/或蛋白质表达的任何方法。例如,RNA印迹分析可用于确定抗炎介质基因表达水平,RT-PCR可用于测定抗炎介质转录的水平,并且蛋白质印迹分析可用于确定抗炎介质蛋白质水平。
C-C趋化因子受体7(CCR7)是G蛋白偶联受体家族的成员。CCR7在各种淋巴组织中表达并可活化B细胞和T细胞。在一些实施方案中,CCR7可调节记忆T细胞向次级淋巴器官如淋巴结的迁移。在其它实施方案中,CCR7可刺激树突细胞成熟。CCR7是可结合趋化因子(C-C基序)配体CCL19/ELC和CCL21的受体蛋白。
如本文所用,如果CCR7在用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)治疗的受试者的一种或多种细胞中的表达与未用Siglec-9药剂治疗的相应受试者的一种或多种细胞中表达的CCR7的表达相比得到调节(例如,增加或减少),则CCR7可具有调节的表达。在一些实施方案中,例如与未用Siglec-9药剂治疗的相应受试者的一种或多种细胞中的CCR7表达相比,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可将受试者的一种或多种细胞中的CCR7表达调节至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用Siglec-9药剂治疗的相应受试者的一种或多种细胞中的CCR7表达相比,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)将受试者的一种或多种细胞中的CCR7表达调节至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
在一些实施方案中,CCR7的表达增加在巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞和/或小神经胶质细胞中发生。CCR7的表达增加可诱导朝向表达趋化因子CCL19和CCL21的细胞的小神经胶质细胞趋化性。因此,在某些实施方案中,本公开的抗Siglec-9抗体可诱导朝向表达CCL19和CCL21的细胞的小神经胶质细胞趋化性。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体适用于预防与CCR7的异常水平相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力的增强或正常化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞中表达的Siglec-9蛋白结合后增强和/或正常化骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力。
在一些实施方案中,例如与未用Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)处理的相应受试者的一种或多种骨髓源性树突细胞中骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力相比,所述药剂可使骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力增强和/或正常化至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用Siglec-9药剂治疗的相应受试者的一种或多种骨髓源性树突细胞中骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力相比,所述Siglec-9药剂(如拮抗剂抗Siglec-9抗体)可使受试者的一种或多种骨髓源性树突细胞中骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力增强和/或正常化至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与骨髓源性树突细胞诱导抗原特异性T细胞增殖的能力降低或失调相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
破骨细胞产生
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在结合至细胞中表达的Siglec-9蛋白后诱导破骨细胞产生和/或增加破骨细胞生成速率。
如本文所用,破骨细胞是一种类型的骨细胞,所述骨细胞可通过移除其矿化基质并破坏有机骨(例如骨吸收)来移除骨组织。破骨细胞可通过骨髓系的细胞的融合而形成。在一些实施方案中,破骨细胞的特征可在于抗酒石酸酸性磷酸酶(TRAP)和组织蛋白酶K的高表达。
如本文所用,如果用本公开的Siglec-9药剂(如拮抗剂抗Siglec-9抗体)处理的受试者中破骨细胞生成的速率大于未用Siglec-9药剂治疗的相应受试者的破骨细胞生成速率,则破骨细胞生成速率可被提高。在一些实施方案中,例如与未用Siglec-9药剂治疗的相应受试者中的破骨细胞生成速率相比,本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)可使受试者中的破骨细胞生成速率提高至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用Siglec-9药剂治疗的相应受试者中的破骨细胞生成速率相比,本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)可使受试者中的破骨细胞生成速率提高至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
如本文所用,如果用本公开的Siglec-9药剂(如激动剂抗Siglec-9抗体)处理的受试者中的破骨细胞生成速率小于在未用Siglec-9药剂治疗的相应受试者中的破骨细胞生成速率,则破骨细胞生成速率可被降低。在一些实施方案中,例如与未用Siglec-9药剂治疗的相应受试者中的破骨细胞生成速率相比,本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)可使受试者中的破骨细胞生成速率降低至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用Siglec-9药剂治疗的相应受试者中的破骨细胞生成速率相比,本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)可使受试者中的破骨细胞生成速率降低至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)有益于预防与异常骨形成和维持相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况或疾病包括与骨密度的病理性降低相关的骨质疏松症和与骨密度的病理性增加相关的骨质疏松性疾病。
Siglec-9表达细胞的增殖和存活
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与细胞上表达的Siglec-9蛋白结合后增加树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、嗜中性粒细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小胶质细胞的增殖、存活和/或功能。
如本文所用,本公开的巨噬细胞包括但不限于M1巨噬细胞、活化的M1巨噬细胞和M2巨噬细胞。如本文所用,本公开的嗜中性粒细胞包括但不限于M1嗜中性粒细胞、活化的M1嗜中性粒细胞和M2嗜中性粒细胞。如本文所用,本公开的天然杀伤(NK)细胞包括但不限于M1 NK细胞、活化的M1 NK细胞和M2 NK细胞。如本文所用,本公开的小神经胶质细胞包括但不限于M1小神经胶质细胞、活化的M1小神经胶质细胞和M2小神经胶质细胞。
小神经胶质细胞是一种类型的神经胶质细胞,其是脑和脊髓的驻留巨噬细胞并因此充当中枢神经系统(CNS)中主动免疫防御的第一和主要形式。小神经胶质细胞构成脑内总胶质细胞群体的20%。小神经胶质细胞不断清除CNS的斑块、受损神经元和传染因子。脑和脊髓被认为是“免疫赦免”器官,因为它们通过一系列被称为血脑屏障的内皮细胞与身体其它部位分开,所述血脑屏障阻止大多数病原体到达易感神经组织。在传染因子直接引入脑或跨过血脑屏障的情况下,小神经胶质细胞必须迅速反应以限制炎症并在传染因子损伤敏感神经组织之前破坏传染因子。由于体内其它部位没有抗体(少数抗体足够小至跨过血脑屏障),小神经胶质细胞必须能够识别异物、吞咽它们并充当活化T细胞的抗原呈递细胞。由于此过程必须迅速完成以防止潜在的致命损伤,所以小神经胶质细胞对CNS中的甚至小的病理变化也极其敏感。它们实现这种敏感性的部分原因是具有独特的钾通道,所述钾通道对细胞外钾的即使较小变化也做出反应。
在一些实施方案中,本公开的抗Siglec-9抗体可增加树突细胞、单核细胞、巨噬细胞、嗜中性粒细胞、NK细胞和/或小神经胶质细胞上的CD80、CD83和/或CD86的表达。
如本文所用,如果用Siglec-9药剂(如本公开的抗Siglec-9抗体)治疗的受试者中树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或小神经胶质细胞的增殖率、存活率和/或功能大于未用Siglec-9药剂治疗的相应受试者中树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞的增殖率、存活率和/或功能,则巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、单核细胞、T细胞和/或小神经胶质细胞的增殖率、存活率和/或功能可包括增加的表达。在一些实施方案中,例如与未用Siglec-9药剂治疗的相应受试者中树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞的增殖率、存活率和/或功能相比,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可使受试者中的树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞的增殖率、存活率和/或功能提高至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%或至少200%。在其它实施方案中,例如与未用Siglec-9药剂治疗的相应受试者中树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞的增殖率、存活率和/或功能相比,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可使受试者中的树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞的增殖率、存活率和/或功能提高至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍或至少10倍。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与树突细胞、嗜中性粒细胞、巨噬细胞、嗜中性粒细胞、NK细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、T细胞和/或小神经胶质细胞的增殖、存活、凋亡增加和/或功能的降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
清除和吞噬
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在与以下中的一种或多种的细胞中表达的Siglec-9蛋白质结合后诱导清除和/或吞噬:凋亡神经元、神经系统的神经组织碎片、神经系统的非神经组织碎片、功能障碍性突触、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞。在某些实施方案中,致病蛋白包括但不限于淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽。在某些实施方案中,致病核酸包括但不限于反义GGCCCC(G2C4)重复序列-扩增RNA。
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可诱导一种或多种类型的清除,包括但不限于凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌或其它异物清除、致病蛋白清除、致病肽清除、致病核酸清除以及肿瘤细胞清除。
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可诱导以下中的一种或多种的吞噬:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸和/或肿瘤细胞。
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可在巨噬细胞集落刺激因子(M-CSF)水平降低的条件下增加嗜中性粒细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、单核细胞和/或小神经胶质细胞的吞噬。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的抗Siglec-9抗体有益于预防与凋亡神经元、神经系统的神经组织碎片、神经系统的非神经组织碎片、细菌、其它异物、致病蛋白相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
Siglec-9依赖性基因表达
在一些实施方案中,本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)可降低Siglec-9依赖性基因的活性和/或表达,并且通过其增加与活化免疫系统的信号级联相关的基因表达,如与含有ITAM的受体、模式识别受体、Toll样受体、损伤相关分子模式(DAMP)受体如转录因子的活化T细胞核因子(NFAT)家族的一种或多种转录因子的相关的基因表达。
在一些实施方案中,本公开的Siglec-9药剂,如本公开的拮抗剂抗Siglec-9抗体有益于预防与Siglec-9依赖性基因的高水平相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述病况和/或疾病包括但不限于:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和流感嗜血杆菌。
T细胞的Siglec-9依赖性活化
在一些实施方案中,本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)可增加细胞毒性T细胞、辅助T细胞或两者的活性。在一些实施方案中,本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)有益于预防与细胞毒性T细胞、辅助T细胞或两者的活性降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述疾病和/或病况包括但不限于肿瘤,包括实体肿瘤如膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌。
嗜中性粒细胞的Siglec-9依赖性抑制
在一些实施方案中,本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)可降低嗜中性粒细胞的活性。在一些实施方案中,本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)有益于预防与天然杀伤细胞、嗜中性粒细胞或两者的活性的活性降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述疾病和/或病况包括但不限于肿瘤,包括实体肿瘤如膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌。
天然杀伤(NK)细胞的Siglec-9依赖性增强的细胞杀伤
在一些实施方案中,本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)可提高NK细胞的杀伤活性。在一些实施方案中,本公开的Siglec-9药剂(如本公开的节抗性抗Siglec-9抗体)有益于预防与天然杀伤细胞、嗜中性粒细胞或两者的活性的活性降低相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况和/或疾病,所述疾病和/或病况包括但不限于肿瘤,包括实体肿瘤如膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌。
肿瘤相关免疫细胞的Siglec-9依赖性抑制
在一些实施方案中,本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)可降低T调控性细胞或抑制性肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的巨噬细胞、肿瘤相关嗜中性粒细胞、肿瘤相关NK细胞或骨髓源性抑制细胞的活性、增殖、存活率、功能性,降低所述细胞至肿瘤或淋巴器官(例如脾和淋巴结)的浸润和/或促进所述细胞的细胞凋亡。在一些实施方案中,本公开的Siglec-9药剂(如本公开的激动剂抗Siglec-9抗体)有益于预防与一种或多种类型的免疫抑制细胞的活性相关的病况和/或疾病、降低所述病况和/或疾病的风险或治疗所述病况或疾病,包括但不限于肿瘤,包括不表达Siglec-9的实体肿瘤,如膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、甲状腺癌以及表达Siglec-9的血液肿瘤,如白血病细胞。
药物组合物
本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可通过将诸如抗Siglec-9抗体的药剂与适当药学上可接受的载体或稀释剂组合而并入用于治疗性施用的各种制剂中,并且可被配制成固体、半固体、液体或气体形式的制剂。此类制剂的实例包括但不限于片剂、胶囊剂、粉剂、颗粒剂、软膏剂、溶液、栓剂、注射剂、吸入剂、凝胶剂、微球以及气雾剂。药物组合物可包括(取决于所需的制剂)药学上可接受的、非毒性稀释剂载体,所述稀释剂载体是常见用来配制用于动物或人施用的药物组合物的媒介物。选择所述稀释剂以免影响组合的生物活性。此类稀释剂的实例包括但不限于蒸馏水、缓冲水、生理盐水、PBS、林格氏溶液(Ringer’s solution)、右旋糖溶液和汉克氏溶液(Hank’s solution)。本公开的药物组合物或制剂还可包含其它载体、佐剂或非毒性非治疗性非免疫原性稳定剂、赋形剂等。所述组合物还可包含接近生理条件的另外物质,例如pH调节和缓冲剂、毒性调节剂、润湿剂和洗涤剂。
本公开的药物组合物还可例如包含诸如氧化剂的多种稳定剂中的任一种。当所述药物组合物包含多肽时,所述多肽可与多种熟知的化合物复合,所述化合物增强多肽的体内稳定性或另外增强其药理学性质(例如,增加多肽的半衰期、降低其毒性并增强溶解或吸收)。此类修饰或复合剂的实例包括但不限于硫酸盐、葡糖酸盐、柠檬酸盐和磷酸盐。组合物的多肽也可与增强其体内属性的分子复合。此类分子包括但不限于碳水化合物、多元胺、氨基酸、其它肽、离子(例如,钠、钾、钙、镁、锰)和脂质。
适用于多种施用类型的制剂的另外实例可见于Remington’s PharmaceuticalSciences,Mace Publishing Company,Philadelphia,PA,第17版(1985)中。对于药物递送方法的简评,参见Langer,Science 249:1527-1533(1990)。
对于口服施用,所述活性成分可以固体剂型(如胶囊剂、片剂和粉剂)施用或液体剂型(酏剂、糖浆剂和混悬剂)施用。可将活性组分与非活性成分和粉状载体一起封装在明胶胶囊中,所述粉状载体如葡萄糖、乳糖、蔗糖、甘露糖醇、淀粉、纤维素或纤维素衍生物、硬脂酸镁、硬脂酸、糖精钠、滑石、碳酸镁。可添加以提供所需的颜色、味道、稳定性、缓冲能力、分散或其它已知所需的特征的另外非活性成分的实例是氧化铁红、硅胶、月桂基硫酸钠、二氧化钛以及可食用白色墨水。类似的稀释剂可用于制造压缩片剂。片剂和胶囊剂都可制成持续释放产品,以在数小时内提供药物的连续释放。压缩片剂可以是糖衣或薄膜包衣以掩蔽任何令人不愉快的味道并保护片剂不受大气的影响,或肠溶包衣以在胃肠道中选择性崩解。用于口服施用的液体剂型可含有着色剂和调味剂以增加患者的接受性。
用于胃肠外施用的制剂包括水性和非水性等张无菌注射溶液,其可含有抗氧化剂、缓冲剂、抑菌剂和致使制剂与预定接受者的血液等张的溶质;及水性和非水性无菌混悬液,其可包括悬浮剂、增溶剂、增稠剂、稳定剂以及防腐剂。
用来配制药物组合物的组分优选地具有高纯度并且基本上不含潜在有害的污染物(例如,至少国家食品(NF)级、通常至少分析级并且更通常至少药物级)。此外,意图用于体内使用的组合物通常为无菌的。为了达到在使用之前必须合成给定的化合物的程度,所得到的产物通常基本上不含任何潜在的毒性剂、具体为任何内毒素,所述毒性剂可在合成或纯化过程期间存在。用于胃肠外施用的组合物也为无菌的,基本上等渗的并且在GMP条件下制得。
为了在脑或中枢神经系统中保留和稳定化,可优化制剂。当药剂被施用到颅隔室中时,希望药剂保留在隔室中,并且不扩散或以其它方式跨过血脑屏障。稳定技术包括交联、多聚化或连接至诸如聚乙二醇、聚丙烯酰胺、中性蛋白质载体等的基团以便实现分子量的增加。
用于增加保留的其它策略包括在生物可降解或生物可侵蚀植入物中包埋本公开的药剂,如本公开的抗Siglec-9抗体。治疗活性剂的释放速率由穿过聚合物基质的运输速率和植入物的生物降解来控制。药物通过聚合物屏障的运输还将受到化合物溶解度、聚合物亲水性、聚合物交联程度、聚合物在吸水时的膨胀以便使聚合物屏障更易透过药物、植入物的几何形状等影响。所述植入物具有与被选作植入部位的区域的大小和形状相称的尺寸。植入物可以是颗粒、片、贴片、斑块、纤维、微胶囊等,并且可具有与所选择的插入部位相容的任何大小或形状。
所述植入物可为整体的,即活性剂均匀地分布于整个聚合物基质中或包封,其中活性剂的储库由聚合物基质包封。待使用的聚合物组合物的选择将随施用部位、所需的治疗时间段、患者耐受性、待治疗的疾病的性质等而变化。聚合物的特性将包括在植入部位的生物降解性、与目标药剂的相容性、易于包封、在生理环境中的半衰期。
可使用的生物可降解聚合物组合物可以是有机酯或醚,其在降解时产生生理上可接受的降解产物,包括单体。酸酐、酰胺、原酸酯等本身或与其它单体组合可使用。聚合物将是缩聚物。聚合物可以是交联的或非交联的。另外特别关注羟基脂肪族羧酸聚合物(呈均聚物或共聚物)及多糖。关注的聚酯包括D-乳酸、L-乳酸、外消旋乳酸、乙醇酸、聚己内酯及其组合的聚合物。通过使用L-乳酸酯或D-乳酸酯获得缓慢生物降解的聚合物,而使用外消旋物时降解基本上增强。特别关注乙醇酸和乳酸的共聚物,其中通过乙醇酸与乳酸的比率控制生物降解速率。最快降解的共聚物具有大致相等量的乙醇酸和乳酸,其中均聚物更耐降解。乙醇酸与乳酸的比率也将影响植入物的脆弱性,其中对于较大的几何形状,更柔性的植入物是合乎需要的。目标多糖是海藻酸钙和官能化纤维素,尤其是特征为不溶于水、分子量为约5kD至500kD的羧甲基纤维素酯等。生物可降解水凝胶也可用于本公开的植入物中。水凝胶通常是一种共聚物材料,其特征在于吸收液体的能力。可使用的示例性生物可降解水凝胶在以下文献中进行了描述:Heller:Hydrogels in Medicine and Pharmacy,N.A.Peppes编,第III卷,CRC Press,Boca Raton,Fla.,1987,第137-149页。
药物剂量
含有本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)的本公开的药物组合物可根据已知的方法如作为团注静脉内施用或通过在一段时间内连续输注、通过肌内、腹膜内、脑脊髓内、颅内、脊柱内、皮下、关节内、滑膜内、鞘内、口服、局部或吸入途径施用至需要用Siglec-9药剂治疗的个体(优选人)。
本公开的药物组合物的剂量和所需药物浓度可根据预期的特定用途而变化。确定合适的施用剂量或途径完全在普通技术人员的技能范围内。动物实验为确定人疗法的有效剂量提供了可靠的指导。有效剂量的物种间缩放可按照以下文献中描述的原则进行:Mordenti,J.和Chappell,W.“The Use of Interspecies Scaling in Toxicokinetics,”In Toxicokinetics and New Drug Development,Yacobi等人,编,Pergamon Press,NewYork 1989,第42-46页。
为了体内施用本公开的任何Siglec-9药剂(如本公开的任何抗Siglec-9抗体),正常剂量的量可取决于施用途径,从每天约10ng/kg至约100mg/kg的个体体重或更多、优选约1mg/kg/天至10mg/kg/天变化。为在若干天或更长时间内重复施用,根据待治疗的疾病、病症或病况的严重程度,可持续治疗直至实现所需症状抑制。
示例性给药方案可包括施用约2mg/kg的本公开的Siglec-9药剂(如抗Siglec-9抗体)的初始剂量,随后每隔一周施用约1mg/kg的每周维持剂量。取决于医师所希望达到的药物动力学衰减的型态而定,其它剂量方案也可能适用。例如,本文预期一周向个体给予一次至二十一次。在某些实施方案中,可使用约3μg/kg至约2mg/kg(如约3μg/kg、约10μg/kg、约30μg/kg、约100μg/kg、约300μg/kg、约1mg/kg以及约2/mg/kg)范围内的给药。在某些实施方案中,给药频率是每天三次、每天两次、每天一次、每隔一天一次、每周一次、每两周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次或每月一次、每两个月一次、每三个月或更长一次。所述疗法的进展易于通过常规技术和测定进行监测。包括Siglec-9药剂(如所施用的抗Siglec-9抗体)的给药方案可独立于所使用的剂量随时间而变化。
用于特定Siglec-9药剂(如特定抗Siglec-9抗体)的剂量可在已经给予一次或多次施用Siglec-9药剂(如抗Siglec-9抗体)的个体中凭经验确定。向个体给予递增剂量的Siglec-9药剂,如抗Siglec-9抗体。为了评估Siglec-9药剂(如抗Siglec-9抗体)的功效,可监测本公开的任何疾病、病症或病况(例如,额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、癫痫发作、视网膜营养不良、创伤性脑损伤、脊髓损伤、长期抑郁症、动脉粥样硬化性血管疾病和正常老化的不良症状)的临床症状。
根据例如接受者的生理状况、施用目的是治疗性的还是预防性的和熟练从业人员已知的其它因素,本公开的Siglec-9药剂(如抗Siglec-9抗体)的施用可以是连续的或间断的。Siglec-9药剂(如抗Siglec-9抗体)的施用可在预先选择的时间段内基本上连续或可以是一系列间隔的剂量。
在文献中提供了关于特定剂量和递送方法的指导;参见例如美国专利号4,657,760;5,206,344;或5,225,212。在本公开的范围内的是不同的制剂对于不同的治疗和不同的病症将是有效的,并且意图治疗特定器官或组织的施用可能需要以不同于另一器官或组织的方式递送。而且,剂量可通过一次或多次分开的施用或通过连续输注施用。对于历经若干天或更长时间的重复施用,取决于情况,治疗持续直到出现所需疾病症状抑制。然而,可使用其它剂量方案。此疗法的进展易于通过常规技术和测定进行监测。
治疗用途
本公开的其它方面提供调节(例如,活化或抑制)有需要的个体中的一种或多种Siglec-9活性的方法,所述活性包括但不限于调节(例如,活化或抑制)本公开的Siglec-9蛋白;抵消Src家族酪氨酸激酶如Syk、LCK、FYM和/或ZAP70对Tyr-433和Tyr-456的一种或多种磷酸化;募集并结合至酪氨酸特异性蛋白磷酸酶SHP1和SHP2;募集并结合至PLC-γ1,其充当发动蛋白-1的鸟嘌呤核苷酸交换因子;募集并结合至含SH2结构域的蛋白质(例如Crk1);募集并结合至脾酪氨酸激酶Syk;募集并结合至SH3-SH2-SH3生长因子受体结合蛋白2(Grb2);募集并结合至多种含SH2的蛋白质;调节(例如,活化或抑制)一种或多种促炎性细胞因子的表达,任选地其中所述一种或多种抗炎细胞因子选自FN-α4、IFN-β、IL-1β、IL-1α、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-33、MCP-1以及MIP-1-β;调节(例如,活化或抑制)一种或多种细胞中的一种或多种促炎性细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节(例如,活化或抑制)一种或多种抗炎细胞因子的表达,任选地其中所述一种或多种抗炎细胞因子选自IL-4、IL-10、IL-13、IL-35、IL-16、TGF-β、IL-1Ra、G-CSF以及TNF、IFN-β1a、IFN-β1b或IL-6的可溶性受体;调节(例如,活化或抑制)一种或多种细胞中的一种或多种抗炎细胞因子的表达,所述一种或多种细胞选自巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞以及小神经胶质细胞;调节(例如,活化或抑制)一种或多种选自以下的蛋白质的表达:C1qa、C1qB、C1qC、C1s、C1R、C4、C2、C3、ITGB2、HMOX1、LAT2、CASP1、CSTA、VSIG4、MS4A4A、C3AR1、GPX1、TyroBP、ALOX5AP、ITGAM、SLC7A7、CD4、ITGAX、以及PYCARD;活化细胞外信号调控激酶(ERK)磷酸化;调节(例如,活化或抑制)一种或多种细胞蛋白上的酪氨酸磷酸化,任选地,其中所述一种或多种细胞蛋白包含ZAP-70并且所述酪氨酸磷酸化发生在ZAP-70的Tyr-319上;调节(例如,活化或抑制)C-C趋化因子受体7(CCR7)的表达;活化针对表达CCL19的细胞和表达CCL21的细胞的小神经胶质细胞趋化性;调节(例如,活化或抑制)由一种或多种细胞诱导的T细胞增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞、M2小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞以及M2 NK细胞;调节(例如,活化或抑制)破骨细胞产生,调节(例如,活化或抑制)破骨细胞生成速率或两者;调节(例如,活化或抑制)一种或多种细胞的存活,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;调节(例如,活化或抑制)一种或多种细胞的增殖,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;调节(例如,活化或抑制)一种或多种细胞的迁移,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;调节(例如,活化或抑制)一种或多种细胞的一种或多种功能,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;调节(例如,活化或抑制)一种或多种细胞的成熟,所述一种或多种细胞选自树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;活化一种或多种类型的清除,所述清除选自凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除、致病核酸清除以及肿瘤细胞清除;任选地,其中所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;活化以下中的一种或多种的吞噬:凋亡神经元、神经组织碎片、功能障碍性突触、非神经组织碎片、细菌、其它异物、致病蛋白、致病肽、致病核酸或肿瘤细胞;任选地其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自癌症,所述癌症选自膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤或甲状腺癌;抑制与肿瘤细胞上的Siglec-9配体结合;调节(例如,活化或抑制)与细胞上的Siglec-9配体结合,所述细胞选自嗜中性粒细胞、树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞以及NK细胞;通过以下中的一种或多种活化肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;活化以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;活化以下中的一种或多种的抗肿瘤细胞转移活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;调节(例如,活化或抑制)一种或多种含ITAM基序的受体,任选地其中所述一种或多种含ITAM基序的受体选自TREM1、TREM2、Sirpβ、FcgR、DAP10以及DAP12;调节(例如,活化或抑制)一种或多种模式识别受体(PRR)的信号传导,任选地其中所述一种或多种PRR选自鉴定病原体相关分子模式(PAMP)的受体、鉴定损伤相关分子模式(DAMP)的受体以及其任何组合;调节(例如,活化或抑制)包含基序D/Ex
如本文所公开,本公开的结合Siglec-9、降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或其任何组合的Siglec-9药剂(如本公开的抗Siglec-9抗体)可用于预防以下疾病、降低所述疾病的风险或治疗所述疾病:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和/或流感嗜血杆菌。在一些实施方案中,所述药剂选自抗体、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、Siglec-9免疫粘附素、结合一种或多种Siglec-9配体的可溶性Siglec受体、Siglec-Fc融合蛋白、Siglec免疫粘附素、反义分子、siRNA、小分子抑制剂、蛋白质以及肽。在一些实施方案中,所述Siglec-9药剂是激动剂抗体。在一些实施方案中,所述Siglec-9药剂是惰性抗体。在一些实施方案中,所述Siglec-9药剂是拮抗剂抗体。
在一些实施方案中,本公开提供预防以下疾病、降低所述疾病的风险或治疗所述疾病的方法:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病和癌症、膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和/或流感嗜血杆菌,所述方法通过向有需要的个体施用治疗有效量的本公开的药剂,所述药剂降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者。在一些实施方案中,所述药剂选自抗体、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、Siglec-9免疫粘附素、结合一种或多种Siglec-9配体的可溶性Siglec受体、Siglec-Fc融合蛋白、Siglec免疫粘附素、反义分子、siRNA、小分子抑制剂、蛋白质以及肽。在一些实施方案中,所述药剂是本公开的抗Siglec-9抗体。
在一些实施方案中,本公开提供通过向有需要的个体施用治疗有效量的本公开的降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂来预防癌症、降低癌症的风险或治疗癌症。在一些实施方案中,所述药剂选自抗体、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、Siglec-9免疫粘附素、结合一种或多种Siglec-9配体的可溶性Siglec受体、Siglec-Fc融合蛋白、Siglec免疫粘附素、反义分子、siRNA、小分子抑制剂、蛋白质以及肽。在一些实施方案中,所述药剂是本公开的抗Siglec-9抗体。在一些实施方案中,所述抗Siglec-9抗体抑制一种或多种选自以下的Siglec-9活性:(a)促进以下中的一种或多种的增殖、成熟、迁移、分化和/或功能性:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关抑制嗜中性粒细胞、肿瘤相关抑制NK细胞以及调控性T细胞;(b)增强以下中的一种或多种浸润到肿瘤中:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关抑制嗜中性粒细胞、肿瘤相关抑制NK细胞以及调控性T细胞;(c)增加肿瘤、外周血或其它淋巴器官中肿瘤促进骨髓细胞/粒细胞免疫抑制细胞的数量;(d)增强骨髓源性抑制细胞(MDSC)的肿瘤促进活性;(e)增加肿瘤或外周血液中肿瘤促进细胞因子的表达,任选地其中所述肿瘤促进细胞因子是TGF-β或IL-10;(f)增加肿瘤促进FoxP3+调控性T淋巴细胞的肿瘤浸润;(g)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的活化;(h)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的浸润;(i)减少具有肿瘤杀伤潜力的肿瘤特异性NK细胞的浸润;(j)降低NK细胞的肿瘤杀伤潜力;(k)减少具有增强免疫应答的潜力的肿瘤特异性B淋巴细胞的浸润;(l)增加肿瘤体积;(m)增加肿瘤生长速率;(n)增加转移;(o)增加肿瘤复发率;(p)降低一种或多种调节抗肿瘤T细胞应答的免疫疗法或癌症疫苗的功效,任选地其中所述一种或多种免疫疗法是靶向一种或多种靶蛋白的免疫疗法,所述一种或多种靶蛋白选自PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、TREM1、TREM2、CD39、CD73、CSF-1以及其任何组合;(q)抑制PLCγ/PKC/钙动员;以及(r)抑制PI3K/Akt、Ras/MAPK信号传导。在一些实施方案中,所述抗Siglec-9抗体抑制一种或多种选自由以下各项组成的组的Siglec-9活性:(a)促进以下中的一种或多种的增殖、成熟、迁移、分化和/或功能性:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、非致瘤性骨髓源性抑制细胞、肿瘤相关巨噬细胞、非致瘤性CD14
如本文所公开,本公开的药剂(如本公开的抗Siglec-9抗体)也可用于诱导和/或促进一种或多种免疫细胞(例如先天性免疫细胞或适应性免疫细胞)的存活成熟、功能性、迁移或增殖。在一些实施方案中,本公开提供诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖的方法,所述方法通过向所述个体施用治疗有效量的本公开的降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂。在一些实施方案中,所述药剂选自抗体、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、Siglec-9免疫粘附素、结合一种或多种Siglec-9配体的可溶性Siglec受体、Siglec-Fc融合蛋白、Siglec免疫粘附素、反义分子、siRNA、小分子抑制剂、蛋白质以及肽。在一些实施方案中,所述药剂是本公开的分离的抗Siglec-9抗体。在一些实施方案中,所述一种或多种免疫细胞选自树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、小神经胶质细胞、T细胞、T辅助细胞、细胞毒性T细胞以及其任何组合。
本公开的其它方面涉及一种评估有需要的受试者对与Siglec-9结合或相互作用的药剂的应答性的方法,所述方法包括:a.测量在向所述受试者施用抗Siglec-9抗体之前从所述受试者获得的血液样品中非致瘤性骨髓细胞上CD45
在一些实施方案中,所述药剂是激动剂抗Siglec-9抗体。在一些实施方案中,所述药剂是本公开的瞬时激动剂抗Siglec-9抗体,所述抗体最初充当激动剂且然后充当长期拮抗剂抗体。在一些实施方案中,所述药剂是惰性抗Siglec-9抗体。在一些实施方案中,所述药剂是拮抗剂抗Siglec-9抗体。在一些实施方案中,所述抗Siglec-9抗体降低Siglec-9的细胞(例如,细胞表面、细胞内或总)水平。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9的降解。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9的裂解。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9的内化。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9的脱落。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9表达的下调。在一些实施方案中,所述抗Siglec-9抗体抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(例如,结合)。在一些实施方案中,所述抗Siglec-9抗体瞬时活化并然后诱导Siglec-9的降解。在一些实施方案中,所述抗Siglec-9抗体瞬时活化并然后诱导Siglec-9的裂解。在一些实施方案中,所述抗Siglec-9抗体瞬时活化并然后诱导Siglec-9的内化。在一些实施方案中,所述抗Siglec-9抗体瞬时活化并然后诱导Siglec-9的脱落。在一些实施方案中,所述抗Siglec-9抗体瞬时活化并然后诱导Siglec-9表达的下调。在一些实施方案中,所述抗Siglec-9抗体瞬时活化并然后诱导Siglec-9的表达降低。在某些实施方案中,所述个体具有Siglec-9变体等位基因。
如本文所公开,本公开的与Siglec-9结合或相互作用的药剂(如本公开的抗Siglec-9抗体)可进一步用于降低以下各项的活性、功能性或存活:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、肿瘤包埋的免疫抑制嗜中性粒细胞、肿瘤包埋的免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关嗜中性粒细胞、肿瘤相关NK细胞、急性骨髓性白血病AML)细胞、慢性淋巴细胞性白血病(CLL)细胞和/或慢性骨髓性白血病(CML)细胞。在一些实施方案中,本公开提供通过向有需要的个体施用治疗有效量的与Siglec-9结合或相互作用的药剂来降低所述个体中以下各项的活性、功能性或存活的方法:调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、肿瘤包埋的免疫抑制嗜中性粒细胞、肿瘤包埋的免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关嗜中性粒细胞、肿瘤相关NK细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞或慢性骨髓性白血病(CML)细胞。在一些实施方案中,所述药剂选自抗体、拮抗剂抗体、惰性抗体、激动剂抗体、Siglec-9配体、Siglec-9配体激动剂片段、Siglec-9免疫粘附素、Siglec-9配体模拟物、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、结合一种或多种Siglec-9配体的可溶性Siglec受体、结合一种或多种Siglec-9配体的Siglec-Fc融合蛋白以及小分子化合物。在一些实施方案中,所述药剂是本公开的分离的抗Siglec-9抗体或抗Siglec-9抗体缀合物。在一些实施方案中,所述抗Siglec-9抗体缀合物包含缀合至可检测标记物、毒素或治疗剂的抗Siglec-9抗体。
如本文所公开,本公开的与Siglec-9结合或相互作用的药剂(如本公开的抗Siglec-9抗体)可用于在体外或体内降低一种或多种细胞上Siglec-9的细胞水平,所述细胞包括但不限于红细胞、细菌细胞、凋亡细胞、神经细胞、神经胶质细胞、小神经胶质细胞、星形胶质细胞、肿瘤细胞、病毒、树突细胞、与β淀粉状蛋白斑块结合的Siglec-9配体、与Tau缠结结合的Siglec-9配体、致病蛋白上的Siglec-9配体、致病肽上的Siglec-9配体、巨噬细胞、嗜中性粒细胞、天然杀伤细胞、单核细胞、T细胞、T辅助细胞、细胞毒性T细胞、B细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞和/或调控性T细胞。在一些实施方案中,本公开提供通过向有需要的个体施用治疗有效量的与Siglec-9结合或相互作用的药剂来降低所述个体的一种或多种细胞上Siglec-9的细胞水平的方法。在一些实施方案中,所述药剂选自抗体、拮抗剂抗体、惰性抗体、激动剂抗体、Siglec-9配体、Siglec-9配体激动剂片段、Siglec-9免疫粘附素、Siglec-9配体模拟物、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、结合一种或多种Siglec-9配体的可溶性Siglec受体、结合一种或多种Siglec-9配体的Siglec-Fc融合蛋白以及小分子化合物。在一些实施方案中,所述药剂是本公开的分离的抗Siglec-9抗体或抗Siglec-9抗体缀合物。在一些实施方案中,所述抗Siglec-9抗体缀合物包含缀合至可检测标记物、毒素或治疗剂的抗Siglec-9抗体。在一些实施方案中,所述一种或多种细胞选自红细胞、细菌细胞、凋亡细胞、神经细胞、神经胶质细胞、小神经胶质细胞、星形胶质细胞、肿瘤细胞、病毒、树突细胞、与β淀粉状蛋白斑块结合的Siglec-9配体、与Tau缠结结合的Siglec-9配体、致病蛋白上的Siglec-9配体、致病肽上的Siglec-9配体、巨噬细胞、嗜中性粒细胞、天然杀伤细胞、单核细胞、T细胞、T辅助细胞、细胞毒性T细胞、B细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞、调控性T细胞以及其任何组合。
Siglec-9的细胞水平可指但不限于Siglec-9的细胞表面水平、Siglec-9的细胞内水平和Siglec-9的总水平。在一些实施方案中,Siglec-9的细胞水平的降低包括Siglec-9的细胞表面水平的降低。如本文所用,如果抗Siglec-9抗体诱导Siglec-9的细胞表面水平降低21%或更多,如通过本文所述或本领域中已知的任何体外基于细胞的测定或合适的体内模型所测量,则所述抗Siglec-9抗体降低Siglec-9的细胞表面水平。在一些实施方案中,Siglec-9的细胞水平的降低包括Siglec-9的细胞内水平的降低。如本文所用,如果抗Siglec-9抗体诱导Siglec-9的细胞内水平降低21%或更多,如通过本文所述或本领域中已知的任何体外基于细胞的测定或合适的体内模型所测量,则所述抗Siglec-9抗体降低Siglec-9的细胞内水平。在一些实施方案中,Siglec-9的细胞水平的降低包括Siglec-9的总水平的降低。如本文所用,如果抗Siglec-9抗体诱导Siglec-9的总水平降低21%或更多,如通过本文所述或本领域中已知的任何体外基于细胞的测定或合适的体内模型所测量,则所述抗Siglec-9抗体降低Siglec-9的总水平。在一些实施方案中,所述抗Siglec-9抗体诱导Siglec-9降解、Siglec-9裂解、Siglec-9内化、Siglec-9脱落和/或Siglec-9表达的下调。在一些实施方案中,利用体外细胞测定在原代细胞(例如树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞和巨噬细胞)上或细胞系上测量Siglec-9的细胞水平。
在一些实施方案中,所述个体具有Siglec-9的杂合变体。
在一些实施方案中,本公开的方法可进一步涉及Siglec-9药剂(如抗Siglec-9抗体或双特异性抗Siglec-9抗体)与结合模式识别受体的抗体、结合Toll样受体的抗体、与损伤相关分子模式(DAMP)受体结合的抗体和/或与细胞因子结合的抗体或针对白细胞介素的抗体)的共同施用。
在一些实施方案中,本公开的方法还可包括向所述个体施用至少一种特异性地结合至抑制性检查点分子的抗体,和/或一种或多种标准或研究性抗癌疗法。在一些实施方案中,所述至少一种特异性地结合至抑制性检查点分子的抗体与所述抗Siglec-9抗体组合施用。在一些实施方案中,所述至少一种特异性地结合至抑制性检查点分子的抗体选自抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体和抗HVEM抗体、抗B-和T-淋巴细胞衰减子(BTLA)抗体、抗杀伤抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM-1抗体、抗TIM3抗体、抗TIM-4抗体、抗A2AR抗体、抗CD39抗体、抗CD73抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体、抗CD30抗体、抗TNFa抗体、抗CD33抗体、抗Siglec-5抗体、抗Siglec-7抗体、抗Siglec-11抗体、拮抗性抗TREM1抗体、拮抗性抗TREM2抗体、抗TIGIT抗体、抗VISTA抗体、抗CD2抗体、抗CD5抗体以及其任何组合。在一些实施方案中,所述一种或多种标准或研究性抗癌疗法选自放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼疗法、曲妥珠单抗疗法、依那西普疗法、过继细胞转移(ACT)疗法、嵌合抗原受体T细胞转移(CAR-T)疗法、疫苗疗法以及细胞因子疗法。
在一些实施方案中,本公开的方法还可包括向所述个体施用至少一种特异性地结合至抑制性细胞因子的抗体。在一些实施方案中,所述至少一种特异性地结合至抑制性细胞因子的抗体与所述Siglec-9药剂,如抗Siglec-9抗体组合施用。在一些实施方案中,所述至少一种特异性地结合至抑制性细胞因子的抗体选自抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体以及其任何组合。
在一些实施方案中,本公开的方法还可包括向所述个体施用至少一种特异性地结合至刺激性检查点蛋白的激动性抗体。在一些实施方案中,所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体与所述Siglec-9药剂如抗Siglec-9抗体组合施用。在一些实施方案中,所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体选自激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动性抗TREM1抗体、激动性抗TREM2抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导的TNFR相关蛋白GITR抗体、激动剂抗CD30抗体、激动剂抗BTLA抗体、激动剂抗HVEM抗体、激动剂抗CD2抗体、激动剂抗CD5抗体以及其任何组合。
在一些实施方案中,本公开的方法还可包括向所述个体施用至少一种刺激性细胞因子。在一些实施方案中,所述至少一种刺激性细胞因子与所述Siglec-9药剂,如抗Siglec-9抗体组合施用。在一些实施方案中,所述至少一种刺激性细胞因子选自FN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、MCP-1、MIP-1-β以及其任何组合。
痴呆
痴呆是一种非特异性综合征(即一组体征和症状),其表现为先前未受损害的人严重丧失全局认知能力,超出正常衰老所可能预期的。由于独特的全脑损伤,痴呆可能是静息的。或者,痴呆可能是渐进的,由于身体的损伤或疾病导致长期下降。虽然痴呆症在老年人群中较为常见,但也可发生在65岁以前。受痴呆影响的认知领域包括但不限于记忆、注意广度、语言和问题解决。一般来说,在个体被诊断为患有痴呆之前,症状必须存在至少六个月。
痴呆的示例性形式包括但不限于额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、词义性痴呆和路易体痴呆。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防痴呆、降低痴呆的风险和/或治疗痴呆。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有痴呆的个体中的一种或多种Siglec-9活性。
额颞叶痴呆
额颞叶痴呆(FTD)是由大脑额叶的进行性恶化引起的病况。随时间推移,退化可能进展至颞叶。患病率仅次于阿尔茨海默氏病(AD),FTD占早老性痴呆症病例的20%。FTD的临床特征包括记忆缺失、行为异常、人格改变以及语言障碍(Cruts,M.&Van Broeckhoven,C.,Trends Genet.24:186-194(2008);Neary,D.,等人,Neurology 51:1546-1554(1998);Ratnavalli,E.,Brayne,C.,Dawson,K.&Hodges,J.R.,Neurology 58:1615-1621(2002))。
大部分FTD病例以常染色体显性方式遗传,但即使在一个家族中,症状也可跨越伴随行为障碍的FTD,至原发性进行性失语、皮质基底神经节变性。与大多数神经退行性疾病一样,FTD的特征可在于患病脑中特定蛋白质聚集体的病理性存在。历史上,FTD的第一次描述认识到神经原纤维缠结或皮克体内存在过度磷酸化Tau蛋白的神经元内累积。微管相关蛋白Tau的因果作用得到了若干家族中编码Tau蛋白的基因突变的鉴定的支持(Hutton,M.,等人,Nature393:702-705(1998)。然而,大多数FTD大脑显示没有过度磷酸化Tau的累积,但对泛素(Ub)和TAR DNA结合蛋白(TDP43)缺失表现出免疫应答性(Neumann,M.,等人,Arch.Neurol.64:1388-1394(2007))。大多数带有Ub包涵体的那些FTD病例(FTD-U)显示在颗粒蛋白前体基因中携带突变。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防痴呆、降低痴呆的风险和/或治疗FTD。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有FTD的个体中的一种或多种Siglec-9活性。
阿尔茨海默氏病
阿尔茨海默氏病(AD)是痴呆的最常见形式。该疾病无法治愈,其随着疾病的进展恶化,且最终导致死亡。大多数情况下,AD在65岁以上的人群中得到诊断。然而,不太普遍的早发型阿尔茨海默氏病可早得多地发生。
阿尔茨海默氏病的常见症状包括行为症状,如难以记住最近的事件;认知症状、困惑、易怒和攻击、情绪波动、语言障碍以及长期记忆丧失。随着疾病进展,身体机能丧失,最终导致死亡。阿尔茨海默氏病在变得完全明显之前发展未知和可变的时间量,并且可在未确诊的情况下进展多年。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防阿尔茨海默氏病、降低阿尔茨海默氏病的风险和/或治疗阿尔茨海默氏病。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有阿尔茨海默氏病的个体中的一种或多种Siglec-9活性。
帕金森氏病
可被称为特发性或原发性帕金森综合征、运动功能减退的刚性综合症(HRS)或震颤性麻痹的帕金森氏病是影响运动系统控制的神经退行性脑病症。脑中多巴胺产生细胞的进行性死亡导致帕金森氏病的主要症状。大多数情况下,帕金森氏病在50岁以上的人群中得到诊断。帕金森氏病在大多数人中是特发性的(没有已知原因)。然而,遗传因素也在所述疾病中起作用。
帕金森氏病的症状包括但不限于手、手臂、腿、下巴和面部的颤抖、肢体和躯干的肌肉强直、运动缓慢(运动迟缓)、姿势不稳定、行走困难、神经精神问题、言语或行为改变、抑郁、焦虑、疼痛、精神病、痴呆、幻觉、以及睡眠问题。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防帕金森氏病、降低帕金森氏病的风险和/或治疗帕金森氏病。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有帕金森氏病的个体中的一种或多种Siglec-9活性。
肌萎缩性侧索硬化(ALS)
如本文所用,肌萎缩性侧索硬化(ALS)或运动神经元疾病或卢伽雷氏病(LouGehrig's disease)可互换使用,并且是指具有不同病因学的衰竭性疾病,其特征在于快速进行性无力、肌肉萎缩和束缚、肌肉痉挛、说话困难(构音障碍)、吞咽困难(difficultyswallowing)(吞咽困难(dysphagia))和呼吸困难(difficulty breathing)(呼吸困难(dyspnea))。
已经显示,颗粒蛋白前体在ALS中发挥作用(Schymick,JC等人,(2007)J NeurolNeurosurg Psychiatry.;78:754-6)并再次保护由引起ALS的蛋白质(如TDP-43)引起的损伤(Laird,AS等人,(2010).PLoS ONE 5:e13368)。还证明了pro-NGF在脊髓损伤后诱导p75介导的少突胶质细胞和皮质脊髓神经元的死亡(Beatty等人,Neuron(2002),36,第375-386页;Giehl等人,Proc.Natl.Acad.Sci USA(2004),101,第6226-30页)。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防痴呆、降低痴呆的风险和/或治疗ALS。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有肌萎缩性侧索硬化的个体中的一种或多种Siglec-9活性。
亨廷顿氏病
亨廷顿氏病(HD)是由亨廷顿基因(HTT)中的常染色体显性突变引起的遗传性神经退行性疾病。亨廷顿基因内的细胞因子-腺嘌呤-鸟嘌呤(CAG)三联体重复序列的扩增导致由所述基因编码的亨廷顿蛋白(Htt)的突变形式的产生。这种突变体亨廷顿蛋白(mHtt)是有毒的并且促成神经元死亡。亨廷顿氏病的症状最常出现在35岁与44岁之间,胆识它们可在任何年龄段出现。
亨廷顿氏病的症状包括但不限于运动控制问题、急躁、随机运动(舞蹈病)、异常眼运动、平衡受损、癫痫发作、咀嚼困难、吞咽困难、认知问题、言语改变、记忆缺陷、思维困难、失眠、疲劳、痴呆、人格变化、抑郁、焦虑以及强迫行为。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防亨廷顿氏病、降低亨廷顿氏病的风险和/或治疗亨廷顿氏病(HD)。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有亨廷顿氏病的个体中的一种或多种Siglec-9活性。
Tau蛋白病
Tau蛋白病(Taupathy diseases)或Tau蛋白病(Tauopathies)是由脑内微管相关蛋白tau的聚集引起的一类神经退行性疾病。阿尔茨海默氏病(AD)是最熟知的Tau蛋白病,并且以不溶性神经原纤维缠结(NFT)的形式在神经元中累积tau蛋白。其它Tau蛋白疾病和病症包括进行性核上性麻痹、拳击员痴呆症、与染色体17有关的额颞叶痴呆和帕金森综合征、利替可-波帝格病(Lytico-Bodig disease)(关岛帕金森氏痴呆综合征(Parkinson-dementia complex of Guam))、缠结主导型痴呆、神经节神经胶质瘤和神经节细胞瘤、脑膜血管瘤病、亚急性硬化性全脑炎、铅中毒脑病、结节性硬化症、哈-斯二氏病(Hallervorden-Spatz disease)、脂褐质沉积症、皮克氏病(Pick’s disease)、皮质基底变性、嗜银颗粒性病(AGD)、亨廷顿氏病以及额颞叶变性。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防tau蛋白病、降低tau蛋白病的风险和/或治疗tau蛋白病。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有tau蛋白病的个体中的一种或多种Siglec-9活性。
多发性硬化症
多发性硬化症(MS)也可被称为播散性硬化症或播散性脑脊髓炎。MS是一种炎性疾病,其中大脑和脊髓轴突周围的脂肪髓鞘受损,从而导致脱髓鞘和瘢痕形成以及广泛的体征和症状。MS影响大脑和脊髓中的神经细胞彼此有效通信的能力。神经细胞通过将称为动作电位的电信号向下传递给称为轴突的长纤维来进行通信,所述长纤维包含在称为髓磷脂的绝缘物质内。在MS中,身体自身的免疫系统攻击并损伤髓磷脂。当髓磷脂丢失时,轴突不再能有效地传导信号。MS发病通常在年轻人中发生,并且在女性中更常见。
MS的症状包括但不限于感觉的变化,如敏感性丧失或麻刺感;刺痛或麻木,如感觉减退和感觉异常;肌无力;阵挛;肌肉痉挛;移动困难;协调和平衡困难,如共济失调;言语困难,如构音障碍或吞咽困难,如吞咽困难;视觉问题,如眼球震颤,包括光幻视的视神经炎以及复视;疲劳;急性或慢性疼痛;以及膀胱和肠道困难;不同程度的认知障碍;抑郁或情绪不稳定的情感症状;乌特霍夫现象(Uhthoff’s phenomenon),其是由于暴露于高于平常环境温度而导致的现存症状恶化,其是由于暴露于高于平常环境温度而导致的现存症状恶化;和莱尔米体征(Lhermitte’s sign),其是在弯曲脖子时向下和向后流动的电感觉。
在一些实施方案中,施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可预防多发性硬化症、降低多发性硬化症的风险和/或治疗多发性硬化症。在一些实施方案中,施用Siglec-9药剂(如抗Siglec-9抗体)可调节患有多发性硬化症的个体中的一种或多种Siglec-9活性。
癌症
本公开的其它方面提供了通过向有需要的个体施用治疗有效量的本公开的Siglec-9药剂(如本公开的分离的抗Siglec-9抗体)来预防癌症、降低癌症的风险或治疗癌症的方法。公开的任何分离的抗体都可用于这些方法中。在一些实施方案中,分离的抗体是本公开的激动剂抗体。在其它实施方案中,分离的抗体是本公开的拮抗剂抗体。在其它实施方案中,分离的抗体是本公开的惰性抗体。在其它实施方案中,分离的抗体是本公开的抗体缀合物。
如本文所公开,已知肿瘤微环境含有异质免疫浸润物,其包括T淋巴细胞、巨噬细胞、嗜中性粒细胞、NK细胞以及骨髓/粒细胞谱系的细胞。T调控性细胞、肿瘤包埋的免疫抑制骨髓细胞和/或M2巨噬细胞、M2嗜中性粒细胞和/或M2-NK细胞在肿瘤中的存在和活性与不良预后相关。相比之下,细胞毒性T细胞的存在和活性有利于癌症治疗。预期直接或间接增强细胞毒性T细胞的活性并降低各种免疫抑制细胞的数目和活性的疗法提供显著治疗益处。开创性的临床前研究已经显示靶向免疫抑制细胞的药物(例如CSF1/CSF1R阻断抗体)与活化细胞毒性T细胞的免疫检查点阻断抗体之间的协同作用,从而表明操纵两种细胞类型在肿瘤模型中显示效力,其中个体疗法作用不佳(Zhu Y;Cancer Res.2014年9月15日;74(18):5057-69)。因此,在一些实施方案中,阻断在骨髓细胞、T细胞子集和肿瘤相关免疫细胞上表达的Siglec-9可刺激有益的抗肿瘤免疫应答,从而产生治疗性抗肿瘤免疫应答。
在一些实施方案中,用于预防癌症、降低癌症的风险或治疗患有癌症的个体的方法还包括向所述个体施用特异性地结合至抑制性检查点分子的至少一种抗体。特异性地结合至抑制性检查点分子的抗体的实例包括但不限于抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体和抗HVEM抗体、抗B-和T-淋巴细胞衰减子(BTLA)抗体、抗杀伤抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM-1抗体、抗TIM3抗体、抗TIM-4抗体、抗A2AR抗体、抗CD39抗体、抗CD73抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体、抗CD30抗体、抗TNFa抗体、抗CD33抗体、抗Siglec-5抗体、抗Siglec-7抗体、抗Siglec-11抗体、拮抗性抗TREM1抗体、拮抗性抗TREM2抗体、抗TIGIT抗体、抗VISTA抗体、抗CD2抗体、抗CD5抗体以及其任何组合。在一些实施方案中,特异性地结合至抑制性检查点分子的至少一种抗体与本公开的Siglec-9药剂(如本公开的拮抗剂抗Siglec-9抗体)组合施用。
在一些实施方案中,待通过本公开的方法预防或治疗的癌症包括但不限于鳞状细胞癌(例如上皮鳞状细胞癌)、肺癌(包括小细胞肺癌、非小细胞癌肺癌、肺腺癌以及肺鳞状癌)、腹膜癌、肝细胞癌、胃癌或胃脏癌(gastric or stomach cancer)(包括胃肠癌和胃肠道间质癌)、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、泌尿道癌、肝癌、乳腺癌、结肠癌、直肠癌、结肠直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌或肾脏癌(kidney orrenal cancer)、前列腺癌、外阴癌、甲状腺癌、肝癌、肛管癌、阴茎癌、黑色素瘤、浅表扩散性黑色素瘤、恶性雀斑样痣黑色素瘤、肢端雀斑样痣黑色素瘤、结节性黑色素瘤、多发性骨髓瘤和B细胞淋巴瘤、慢性淋巴细胞性白血病(CLL)、急性成淋巴细胞性白血病(ALL)、毛细胞白血病、慢性成髓细胞性白血病和移植后淋巴增殖性病症(PTLD)以及与瘢痣病相关的异常血管增生、水肿(如与脑肿瘤相关的水肿)、麦格氏综合征(Meigs’syndrome)、脑癌以及头颈癌和相关转移。在一些实施方案中,癌症是结肠直肠癌。在一些实施方案中,癌症选自非小细胞肺癌、成胶质细胞瘤、成神经细胞瘤、肾细胞癌、膀胱癌、卵巢癌、黑色素瘤、乳腺癌、胃癌以及肝细胞癌。在一些实施方案中,癌症是三阴性乳腺癌。在一些实施方案中,癌症可以是早期癌症或晚期癌症。在一些实施方案中,癌症可以是原发性肿瘤。在一些实施方案中,癌症可以是在第二部位处源自任何上述类型的癌症的转移性肿瘤。
在一些实施方案中,本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)可用于预防癌症、降低癌症的风险或治疗癌症,所述癌症包括但不限于膀胱癌、乳腺癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌。
在一些实施方案中,本公开提供了通过向患有癌症的个体施用治疗有效量的本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)来预防癌症、降低癌症的风险或治疗所述个体的方法。
在一些实施方案中,所述方法还包括向所述个体施用至少一种特异性地结合至抑制性免疫检查点分子的抗体和/或另一种标准或研究性抗癌疗法。在一些实施方案中,所述至少一种特异性地结合至抑制性检查点分子的抗体与Siglec-9药剂(如本公开的抗Siglec-9抗体)组合施用。在一些实施方案中,所述至少一种特异性地结合至抑制性检查点分子的抗体选自抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体和抗HVEM抗体、抗B-和T-淋巴细胞衰减子(BTLA)抗体、抗杀伤抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM-1抗体、抗TIM3抗体、抗TIM-4抗体、抗A2AR抗体、抗CD39抗体、抗CD73抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体、抗CD30抗体、抗TNFa抗体、抗CD33抗体、抗Siglec-5抗体、抗Siglec-7抗体、抗Siglec-11抗体、拮抗性抗TREM1抗体、拮抗性抗TREM2抗体、抗TIGIT抗体、抗VISTA抗体、抗CD2抗体、抗CD5抗体以及其任何组合。在一些实施方案中,所述标准或研究性抗癌疗法是选自以下各项的一种或多种疗法:放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼
在一些实施方案中,所述方法还包括向所述个体施用至少一种特异性地结合至抑制性细胞因子的抗体。在一些实施方案中,所述至少一种特异性地结合至抑制性细胞因子的抗体与Siglec-9药剂(如本公开的抗Siglec-9抗体)组合施用。在一些实施方案中,所述至少一种特异性地结合至抑制性细胞因子的抗体选自抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体以及其任何组合。
在一些实施方案中,所述方法还包括向所述个体施用至少一种特异性地结合至刺激性免疫检查点蛋白的激动性抗体。在一些实施方案中,所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体与Siglec-9药剂(如本公开抗Siglec-9抗体)组合施用。在一些实施方案中,所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体选自激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动性抗TREM1抗体、激动性抗TREM2抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导的TNFR相关蛋白GITR抗体、激动剂抗CD30抗体、激动剂抗BTLA抗体、激动剂抗HVEM抗体、激动剂抗CD2抗体、激动剂抗CD5抗体以及其任何组合。
在一些实施方案中,所述方法还包括向所述个体施用至少一种刺激性细胞因子。在一些实施方案中,所述至少一种刺激性细胞因子与所述Siglec-9药剂(如本公开的抗Siglec-9抗体)组合施用。在一些实施方案中,所述至少一种刺激性细胞因子选自FN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、MCP-1、MIP-1-β以及其任何组合。
试剂盒/制品
本公开还提供包括本公开的Siglec-9药剂(例如,本文所述的抗Siglec-9抗体)或其功能片段的试剂盒和/或制品。本公开的试剂盒和/或制品可包括一个或多个含有本公开的纯化抗体的容器。在一些实施方案中,所述试剂盒和/或制品还包括根据本公开的方法的使用说明书。在一些实施方案中,这些说明书包括施用本公开的Siglec-9药剂(如本公开的抗Siglec-9抗体)以根据本公开的任何方法预防选自以下各项的疾病、病症或损伤、降低所述疾病、病症或损伤的风险或治疗患有所述疾病、病症或损伤的个体的说明:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、克罗伊茨费尔特-雅格布病、正常压力脑积水、肌萎缩性侧索硬化、亨廷顿氏病、Tau蛋白病、那须哈科拉病、中风、急性创伤、慢性创伤、狼疮、急性和慢性结肠炎、类风湿性关节炎、伤口愈合、克罗恩氏病、炎性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩症、夏伊-德拉戈综合征、进行性核上性麻痹、皮质基底节变性、急性播散性脑脊髓炎、肉芽肿性病症、类肉瘤病、老化疾病、癫痫、脊髓损伤、创伤性脑损伤、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、狼疮、关节炎、多发性硬化症、低骨密度、骨质疏松症、骨生成、骨硬化病、骨佩吉特氏病、以及癌症(包括膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、多发性骨髓瘤、真性红细胞增多症、特发性血小板增多症、原发性或特发性骨髓纤维化、原发性或特发性骨髓硬化、骨髓源性肿瘤、表达Siglec-9的肿瘤、甲状腺癌)、感染、CNS疱疹、寄生虫感染、锥虫感染、克氏感染、铜绿假单胞菌感染、杜氏利什曼原虫感染、B族链球菌感染、空肠弯曲杆菌感染、脑膜炎奈瑟氏菌感染、I型HIV和/或流感嗜血杆菌。
在一些实施方案中,所述说明书包括如何检测例如个体中、组织样品中或细胞中的Siglec-9蛋白质的描述。所述试剂盒和/或制品可进一步包括基于鉴定个体是否患有疾病和疾病阶段来选择适合于治疗的个体的描述。
在一些实施方案中,所述试剂盒和/或制品还可包括本公开的另一种抗体(例如,至少一种特异性地结合至抑制性检查点分子的抗体,至少一种特异性地结合至抑制性细胞因子的抗体和/或至少一种特异性地结合至刺激性检查点蛋白的激动性抗体)和/或至少一种刺激性细胞因子。在一些实施方案中,所述试剂盒和/或制品可进一步包括根据本公开的任何方法,与本公开的Siglec-9药剂(例如,本文所述的抗Siglec-9抗体)组合使用所述抗体和/或刺激细胞因子的说明书,与抗体和/或刺激性细胞因子组合使用本公开的Siglec-9药剂(例如,本文所述的抗Siglec-9抗体)的说明书,或使用本公开的Siglec-9药剂(例如,本文描述的抗Siglec-9抗体)和抗体和/或刺激性细胞因子的说明书。
所述说明书通常包括关于预期治疗的剂量、给药方案和施用途径的信息。所述容器可为单位剂量、散装(bulk)包装(例如,多剂量包装)或亚单位剂量。在本公开的试剂盒和/或制品中提供的说明书通常是在标签或包装插页(例如包括在试剂盒中的纸张)上的书面说明,但机器可读指令(例如,在磁性或光存储盘上携带的指令)也是可以接受的。
标签或包装插页指示所述组合物用于治疗例如本公开的疾病。可提供说明书以实践本文所述的任何方法。
本公开的试剂盒和/或制品处于合适的包装中。合适的包装包括但不限于小瓶、瓶、罐、软包装(例如,密封的聚脂薄膜或塑料袋)等。还考虑与特定装置(如吸入器)、经鼻施用装置(例如雾化器))或输注装置(如微型泵)组合使用的包装。试剂盒和/或制品可具有无菌入口(例如,所述容器可以是具有皮下注射针头可刺穿的塞子的静脉内注射溶液袋或小瓶)。所述容器装还可具有无菌入口(例如,所述容器可以是具有皮下注射针头可刺穿的塞子的静脉注射溶液袋或小瓶)。所述组合物中的至少一种活性剂是本公开的Siglec-9药剂(例如本文所述的抗Siglec-9抗体)。所述容器可进一步包括第二药物活性剂。
试剂盒和/或制品可任选地提供附加组成部分,如缓冲剂和解释性信息。通常,所述试剂盒包括容器和在容器上或与容器相关的标签或一张或多张包装插页。
诊断用途
本公开的Siglec-9药剂,如本公开的分离的抗体(例如,本文所述的抗Siglec-9抗体)还具有诊断效用。因此,本公开提供使用本公开的抗体或其功能片段用于诊断目的,诸如检测个体中或来源于个体的组织样品中的Siglec-9蛋白的方法。
在一些实施方案中,个体是人。在一些实施方案中,个体是患有本公开的疾病、病症或损伤或处于发展所述疾病、病症或损伤风险中的人患者。在一些实施方案中,所述诊断方法涉及检测生物样品如生物活检标本、组织或细胞中的Siglec-9蛋白。使本公开的Siglec-9药剂(例如本文所述的抗Siglec-9抗体)与生物样品接触并检测抗原结合的抗体。例如,活检标本可用本文所述的抗Siglec-9抗体染色以便检测和/或定量疾病相关细胞。所述检测方法可涉及定量抗原结合抗体。生物样品中的抗体检测可用本领域中已知的任何方法进行,包括免疫荧光显微术、免疫细胞化学、免疫组织化学、ELISA、FACS分析、免疫沉淀或微正电子发射断层摄影术。在某些实施方案中,例如用
在其它实施方案中,本公开的分离的抗体(例如,本文所述的抗Siglec-9抗体)可用于检测和/或定量例如取自临床前疾病模型(例如,非人疾病模型)的脑标本中的小神经胶质细胞。如此,本公开的分离的抗体(例如,本文所述的抗Siglec-9抗体)可适用于评价与对照相比,在神经系统疾病或损伤(如额颞叶痴呆、阿尔茨海默氏病、血管性痴、癫痫发作、视网膜营养不良、动脉粥样硬化性血管疾病、那须哈科拉病或多发性硬化症)的模型中在治疗后的治疗应答。
通过参考以下实施例将更完全地理解本公开。然而,所述实施例并不应当被解释为对本公开的范围进行限制。贯穿本公开的所有引用据此以引用的方式明确并入本文中。
实施例
实施例1:抗Siglec-9抗体的产生、鉴定和表征
引言
人Siglec-9的氨基酸序列在下文在SEQ ID NO:1中列出。人Siglec-9含有位于SEQID NO:1的氨基酸残基1-17处的信号序列,位于SEQ ID NO:1的氨基酸残基20-140处的细胞外免疫球蛋白样可变型(IgV)结构域,位于SEQ ID NO:1的氨基酸残基146-229和236-336的两个Ig-样C2-型结构域,位于SEQ ID NO:1的氨基酸残基348-370处的跨膜结构域,位于SEQID NO:1的氨基酸残基431-436处的ITIM基序1以及位于SEQ ID NO:1的氨基酸残基454-459处的SLAM样基序。人Siglec-9与Siglec-9同系物的比对在图1A中示出。
Siglec-9氨基酸序列(SEQ ID NO:1):
以下实施例的目的是产生增强树突细胞、单核细胞、巨噬细胞、嗜中性粒细胞、NK细胞、T细胞和/或小神经胶质细胞的有益作用的Siglec-9结合抗体(例如,拮抗性抗体、Siglec-9特异性抗体)。使用小鼠杂交瘤技术、噬菌体展示技术和酵母展示技术产生了结合Siglec-9的细胞外结构域、特别是IgV结构域(SEQ ID NO:1的氨基酸残基20-140)的抗体。鉴定抗体,且然后在细胞中和动物体内筛选它们与Siglec-9配体竞争结合至Siglec-9、诱导Siglec-9下调、诱导Siglec-9脱敏、诱导Siglec-9降解、诱导Siglec-9靶向至溶酶体、诱导Siglec-9裂解、调节Siglec-9信号传导和/或一种或多种功能的能力,如以下实施例中所描述。由Siglec-9结合的示例性配体描绘于图2和图3中。
例如,选择靶向Siglec-9的IgV结构域(氨基酸残基20-140)的抗Siglec-9抗体。所述IgV结构域与唾液酸靶标结合,并且这种结合可被所述抗体阻断。因此,氨基酸残基20-140对应于将阻断Siglec-9与一种或多种内源性靶标(例如配体)的结合的抗体的Siglec-9肽靶标。
用于鉴定人Siglec-9蛋白内的有用位点的另一种方法是与Siglec-9M相比,通过选择不存在于Siglec-9m上的抗体靶向位点而进行,所述位点通常在IgV结构域内发现。Siglec-9m不能够抑制淀粉样蛋白β肽的清除。用于鉴定有用抗体的另一种方法是选择降低单核细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、小胶质细胞和/或T细胞的细胞表面上的Siglec-9水平的抗体。
如本文所述,鉴定并表征了9种抗Siglec-9抗体。
结果
抗Siglec-9抗体产生
免疫程序
快速初免法:
标准方法:
杂交瘤开发
根据标准Roche方案,在聚乙二醇(PEG 1500)存在下分离淋巴细胞并与鼠SP2/0骨髓瘤细胞融合。使用单步克隆方法(HAT选择)培养融合细胞。此方法使用基于半固体甲基纤维素的HAT选择性培养基来将杂交瘤选择和克隆组合到一个步骤中。单细胞来源的杂交瘤生长以在半固体培养基上形成单克隆菌落。在融合事件后10天,将948个所得杂交瘤克隆转移至96孔组织培养板并在含有HT的培养基中生长,直到达到对数生长中期(5天)。
杂交瘤筛选
通过间接ELISA关于筛选抗原(初步筛选)对来自948个杂交瘤的组织培养上清液进行测试,并使用山羊抗IgG/IgM(H&L)-HRP二级抗体探测IgG和IgM抗体,并用TMB底物显影。在此测定中克隆>0.2OD进行下一轮测试。阳性培养物关于筛选抗原进行重新测试以确认分泌并且关于不相关的抗原(人转铁蛋白)进行重新测试以消除非特异性或“粘性”mAb并排除假阳性。通过抗体捕获ELISA对所有目标克隆进行同种型分析,以确定它们是IgG还是IgM同种型。
杂交瘤细胞培养
将目标杂交瘤细胞系在转移至96孔板后在24孔培养板中在培养中维持32天。这被称为稳定期,并测试克隆是否保持稳定和分泌。在此稳定时间段期间,对所有目标克隆进行暂时冷冻细胞系备份以用于-80℃储存(存活6个月)。在此时间段期间定期测试杂交瘤的分泌和特异性。
亚克隆
对顶部杂交瘤细胞系(克隆)进行亚克隆以确保单克隆性。通过使用单步克隆系统再次涂铺亲本克隆来进行亚克隆。将24与90个之间的亚克隆转移至96孔培养板。通过间接ELISA和抗体捕获ELISA筛选亚克隆。每种亲本的顶部亚克隆被用于在培养中扩增。任何<50%克隆的亲本克隆都进行了第二轮亚克隆。
然后筛选抗体的Siglec-9结合。测试了对于与人Siglec-9结合为阳性的抗体在多种细胞类型中阻断配体结合的能力和降低Siglec-9的表面水平的能力。鉴定了6种Siglec-9抗体。表1中列出了分箱和同种型类别。
表1:抗Siglec-9抗体
抗体重链和轻链可变结构域序列
使用标准技术,测定编码所产生的抗体的轻链可变结构域和重链可变结构域的氨基酸序列。表2中列出了抗体的EU或Kabat轻链HVR序列。表3中列出了抗体的EU或Kabat重链HVR序列。表4A中列出了抗体的EU或Kabat轻链框架(FR)序列。表4B中列出了抗体的EU或Kabat重链框架(FR)序列。
表2:抗Siglec-9抗体的EU或Kabat轻链HVR序列
表3:抗Siglec-9抗体的EU或Kabat重链HVR序列
表4A:抗Siglec-9抗体的EU或Kabat轻链框架序列
表4B:抗Siglec-9抗体的EU或Kabat重链框架序列
Siglec-9抗体结合的表征
Siglec-9抗体的初始表征涉及确定其结合人原代单核细胞、人原代巨噬细胞、人原代树突细胞、人原代嗜中性粒细胞和人原代天然杀伤(NK)细胞上表达的Siglec-9的能力。收获细胞,在96孔板中以10
FACS染色分析表明Siglec-9在包括人原代单核细胞、巨噬细胞、树突细胞、嗜中性粒细胞和NK细胞的原代骨髓细胞和淋巴样细胞上表达(图4)。
表5展示抗体与表达Siglec-9的人原代细胞的结合。表5中列出了由Siglec-9抗体结合的细胞类型的阳性结合百分比和平均荧光强度(MFI)值。将结合与同种型对照进行比较。所述抗体与人原代单核细胞、人原代树突细胞和人原代巨噬细胞结合。在表5中,“缓冲液”是指仅用同上所述的PBS缓冲液处理的细胞;“二级Ab”是指仅用PE缀合的二级抗体处理的细胞;并且“mIgG1”、“mIgG2a”和“mIgG2b”是指同种型对照抗体。图5展示抗体与人原代树突细胞的结合。
表5:Siglec-9抗体与人原代细胞的结合
通过经由表面等离子体共振(SPR)测定测量它们的K
在固定有抗小鼠IgG的CM5传感器芯片(GE Healthcare)上捕获针对Siglec-9的小鼠源性抗体(25nM)(60秒接触时间,30uL/分钟流速,0秒稳定时间)。然后使组氨酸标记的人Siglec-9(NovoProtein)流过捕获的抗Siglec-9表面(120秒接触时间,30uL/分钟流速,300秒解离时间)。取决于从初始筛选获得的信息,抗原浓度范围为5nM至100nM。进行一式两份单浓度试验并用空白(0nM抗原)样品括起来。使用10mM甘氨酸-HCl(pH 1.7)(60秒接触时间,30uL/分钟流速,60秒稳定时间)在循环之间再生芯片表面。所得SPR信号作为来自空白流动池上进行的测量的响应差而获得。
使用1:1相互作用模型进行单浓度动力学分析(Canziani,等人(2004)AnalyticalBiochemistry 325:301-307)以推导出每种抗体的缔合和解离速率常数(分别为k
结果列于表6A中。图6A显示描绘抗体亲和力的SPR传感图。
表6A:Siglec-9抗体亲和力
还通过使用Fortebio Octet RED96系统测量它们的K
Fortebio Octet RED96结果列于表6B中。图6B显示描绘抗体亲和力的传感图。
表6B:Siglec-9抗体亲和力
抗体人源化
抗体人源化用于通过序列和结构关系转化在不同物种中产生的抗体以最好地类似于人抗体,以便防止人施用中的免疫原性。来自不同物种的抗体共享允许将非人抗体的特异性决定区(SDR)移植到人抗体框架上的特征性序列和结构特征。这导致保留了非人抗体的特异性。人源化过程涉及鉴定非人抗体序列和特征,包括框架区和SDR。使用以下标准来人源化抗体:1)非人抗体与已知人抗体之间的框架区的相似性百分比,2)非人抗体与已知人抗体之间的SDR的长度相似性,3)用于产生人抗体的框架区的基因,以及4)先前在人源化中使用人抗体框架并作为治疗剂。框架区和SDR长度的相似性是重要的,因为差异可在抗体中产生可改变抗体的特异性的结构差异。已知用于产生人抗体框架的特异性基因对抗体的稳定性或特异性是有益的或有害的,并且因此被选择性地使用或避免。最后,具有良好耐受性和良好半衰期的的先前成功的人源化框架(包括在人治疗剂中使用的那些)可能成为未来成功人源化的候选物。
如表7A和7B中所示,针对抗体2D4、2D5、5B1、6D8和7H12中的每种鉴定了10个人源化轻链和10个人源化重链可变区序列;针对抗体5C6鉴定了三个轻链可变区序列和四个重链可变区序列;并且针对抗体12B12鉴定了三个轻链可变区序列和两个重链可变区序列。在表7A和7B中,粗体字母表示HVR序列。
表7A:人源化轻链可变区
/>
/>
/>
/>
/>
/>
表7B:人源化重链可变区
/>
/>
/>
/>
/>
/>
抗体5C6的人源化
将鼠抗Siglec-9抗体5C6(S9-5C6.3)的重链可变区(VH)序列和轻链可变区(VL)序列与已知人种系序列的文库进行比较。所使用的数据库是IMGT人VH基因(F+ORF,273条种系序列)和IMGT人VLκ基因(F+ORF,74条种系序列)。
对于5C6抗体VL,选择人种系IGKV2-30(等位基因1)作为受体序列,并且从在
可能需要将人种系框架(即VH和VL中的非CDR残基)位置改变为相应的亲本鼠序列以优化人源化抗体的结合。每条人源化序列的潜在变化在图6C和6D中注释。图6C和6D显示抗Siglec-9抗体5C6(5C6.3)的人源化型式的序列。
在抗体5C6的VL结构域中,在CDR-L1中,Asp30c-Gly30d-Asn30d-Thr30e具有在Asn脱酰胺、随后在位置30c-30d的异天冬氨酸形成的高潜力。在此位点的翻译后修饰可影响抗体与靶标的结合。可对亲本小鼠抗体进行分析以确定翻译后修饰的水平(图6C)。或者抗体5C6可被人源化,且然后在最终步骤中NG可被修饰成例如SG、QG或AG,以确定是否维持结合;单独地,NT可被改变成例如QT或ST。在CDR-L2中,Asn53基于序列和构象具有较低脱酰胺作用潜力,但可显示低水平的这种翻译后修饰(图6C)。在CDR-L3中,Asn91基于序列和构象具有中等脱酰胺作用潜力,但可显示低水平的这种翻译后修饰(图6C)。基于上述的变体VL序列列于表7A中。
在抗体5C6(5C6.3)的VH结构域中,CDR-H1中的Asn33和Asn96基于序列和构象具有较低脱酰胺潜力,并且可显示低水平的翻译后修饰(图6D)。在CDR-H2中,Asn54-Gly55具有较低/中等脱酰胺、随后异天冬氨酸形成的潜力(图6D)。在此位点的翻译后修饰可影响抗体与靶标的结合。可对亲本小鼠抗体进行分析以确定翻译后修饰的水平。或者,可将抗体5C6人源化,且然后最终,可将NG改变成例如QG,以确定是否维持结合。基于上述的变体VH序列列于表7B中。
抗体12B12的人源化
将鼠抗Siglec-9抗体12B12(S9-12B12.2)的重链可变区(VH)序列和轻链可变区(VL)序列与已知人种系序列的文库进行比较。所使用的数据库是IMGT人VH基因(F+ORF,273条种系序列)和IMGT人VLκ基因(F+ORF,74条种系序列)。
对于12B12抗体VL,选择人种系IGKV1-39(等位基因1)作为受体序列,并且从在
可能需要将人种系框架(即VH和VL中的非CDR残基)位置改变为相应的亲本鼠序列以优化人源化抗体的结合。每条人源化序列的潜在变化在图6E和6F中注释。图6E和6F显示抗Siglec-9抗体12B12(12B12.2)的人源化型式的序列。
在抗体12B12的VL结构域中,CDR-L1中的Asn29、Asn53和Asn92基于序列和构象具有较低脱酰胺潜力,并且可显示低水平的翻译后修饰(图6E)。在CDR-L3中,Trp96可能是至少部分溶剂暴露的,且因此可在应力条件下发生氧化(图6E)。基于上述的变体VL序列列于表7A中。
在抗体12B12(12B12.2)的VH结构域中,CDR-H1中的Asn31基于序列和构象具有较低脱酰胺潜力,并且可显示低水平的翻译后修饰,而CDR-H1中的Asn52基于序列和构象具有中等脱酰胺潜力,并且可显示低水平的翻译后修饰(图6F)。在CDR-H2中,Asn53-Gly54-Gly55具有中等/高脱酰胺、随后异天冬氨酸形成的潜力(图6E)。在此位点的翻译后修饰可影响抗体与靶标的结合。可对亲本小鼠抗体进行分析以确定翻译后修饰的水平。或者可将抗体12B12人源化,且然后在最后一步中可将NGG改变成例如QGG或AGG,以确定是否保持结合。基于上述的变体VH序列列于表7B中。
实施例2:Siglec-9抗体的表位作图
测试了Siglec-9抗体结合跨越整个人Siglec-9的15或25-mer肽的能力。通过确定它们的Siglec-9结合区,还将Siglec-9抗体与参考Siglec-9抗体进行了比较。
方法
基于人Siglec-9(SEQ ID NO:1)的序列合成了线性15聚体肽,其中14个残基重叠。此外,基于人Siglec-9(SEQ ID NO:1)的序列合成了具有单个残基移位的线性25-mer肽。在基于ELISA的方法中测试了Siglec-9抗体与每种合成肽的结合。在此测定中,将肽阵列与一级抗体溶液一起孵育(在4℃下过夜)。在洗涤后,将肽阵列与抗体过氧化物酶缀合物(SBA,目录号2010-05)的1/1000稀释液在25℃下孵育1小时。在洗涤后,加入过氧化物酶底物2,2'-连氮基-二-3-乙基苯并噻唑啉磺酸盐(ABTS)和2μl/ml的3%H
使用标准夹心形式分箱测定(参见Estep等人,(2013)MAbs5(2):270-8),在ForteBio Octet Red384系统(Pall Forte Bio Corporation,Menlo Park,CA)上进行了抗体的表位分箱。将对照抗靶标IgG负载到AHQ传感器上,并用不相关的人IgG1抗体阻断传感器上未占据的Fc结合位点。然后将传感器暴露于100nM靶抗原,然后暴露于第二抗靶标抗体。使用ForteBio的数据分析软件7.0对数据进行处理。抗原缔合后第二抗体的另外结合指示未被占据的表位(非竞争物),而无结合指示表位阻断(竞争物)。
或者,为了重新构建靶分子的表位,合成了成环肽和组合肽的文库。氨基官能化聚丙烯载体通过以下步骤获得与专有亲水性聚合物制剂接枝、随后使用二环己基碳二亚胺(DCC)与N-羟基苯并三唑(HOBt)与叔丁氧基羰基-六亚甲基二胺(BocHMDA)反应,并且随后使用三氟乙酸(TFA)裂解Boc-基团。标准Fmoc-肽合成用于通过定制改良的JANUS液体处理站(Perkin Elmer)在氨基官能化固体支持物上合成肽。
结构模拟物的合成使用Pepscan专有的支架上化学连接肽(CLIPS)技术完成。CLIPS技术允许将肽结构化成单环和双环。CLIPS模板与半胱氨酸残基偶联。所述肽中多个半胱氨酸的侧链与一个或两个CLIPS模板偶联。例如,将mP2 CLIPS(2,6-双(溴甲基)吡啶)的0.5mM溶液溶解于碳酸氢铵(20mM,pH 7.8)/乙腈(1:3(v/v))中。将此溶液添加到肽阵列上。CLIPS模板将与存在于肽阵列(具有3μl孔的455孔板)的固相结合肽中的两个半胱氨酸的侧链结合。将肽阵列在溶液中轻轻摇动30至60分钟,同时完全覆盖在溶液中。最后,用过量的H2O充分洗涤肽阵列,并在含有PBS(pH 7.2)中的1%SDS/0.1%β-巯基乙醇的破碎缓冲液中于70℃超声处理30分钟,随后在H2O中超声处理另外45分钟。携带肽的T3 CLIPS(2,4,6-三(溴甲基)吡啶)以类似的方式制备,但现在用三个半胱氨酸。
环肽
在基于PEPSCAN的ELISA中测试了抗体与每种合成肽的结合。将肽阵列与由实验优化浓度的测试抗体和封闭溶液(例如4%马血清、5%卵清蛋白(w/v)的PBS/1%吐温80)组成的测试抗体溶液一起孵育。将肽阵列与测试抗体溶液一起在4℃孵育过夜。用洗涤缓冲液(1×PBS,0.05%Tween80)充分洗涤后,将肽阵列与适当抗体过氧化物酶缀合物的1/1000稀释液在25℃孵育1小时。在用洗涤缓冲液洗涤后,加入过氧化物酶底物2,2'-连氮基-二-3-乙基苯噻唑啉磺酸盐(ABTS)和2μl/ml的3%H2O2。在一小时后,测量颜色显色。用电荷耦合装置(CCD)照相机和图像处理系统对颜色显色进行量化。
结果
确定了3种抗Siglec-9抗体的Siglec-9结合区域。表8A中列出了结合区。
表8A:Siglec-9抗体结合区
如表8A中指出的,抗体6B2、7H12、2D5和5B1显示仅对于Siglec-9的细胞外IgV结构域内的肽的稳健结合。如表8A中所示,由抗体6B2和7H12识别的肽对应于SEQ ID NO:1的氨基酸残基107-115,并且具有氨基酸序列:RDARRSDAGR。由抗体2D5识别的肽对应于SEQ IDNO:1的氨基酸残基62-76和86-92,并且具有氨基酸序列:FREGANTDQDAPVAT和ETRDRFH。由抗体5B1和6B2识别的肽对应于SEQ ID NO:1的氨基酸残基86-96和105-116,并且具有氨基酸序列:ETRDRFHLLGD和IRDARRSDAGR。
如表8A中进一步指出的,抗体2D4显示仅对于Siglec-9的细胞外Ig样C2型结构域内的肽的稳健结合。如表8A中所示,由抗体2D4识别的肽对应于SEQ ID NO:1的氨基酸残基185-194,并且具有氨基酸序列:VSPLDPSTTR。
功能作图
使用用于siglec-9蛋白的丙氨酸扫描文库进行抗siglec-9抗体的鸟枪诱变表位作图。对编码C-末端V5表位标签的siglec-9表达构建体进行高通量丙氨酸扫描诱变(概述于Davidson和Doranz,2014Immunology 143,13-20中)以产生综合突变文库。使代表Siglec-9细胞外结构域的每个残基突变,最多突变为丙氨酸,而丙氨酸密码子被突变为丝氨酸。
将排列在384孔微板中的Siglec-9突变文库克隆分别转染到HEK-293T细胞中并使其表达22小时。将抗体消化以产生Fab,然后将细胞与在10%正常山羊血清(NGS)(Sigma-Aldrich,St.Louis,MO)中稀释的Fab一起孵育。在文库筛选之前,使用针对表达野生型Siglec-9的细胞的独立免疫荧光滴定曲线确定一级Fab浓度,以确保信号在线性检测范围内。使用7.5μg/ml AlexaFluor488缀合的二级抗体(Jackson ImmunoResearchLaboratories,Westgrove,PA)在10%NGS中检测Fab。将细胞用PBS-/-洗涤两次并重新悬浮于含有0.1%BSA(Sigma-Aldrich,St.Louis,MO)的Cellstripper(Cellgro,Manassas,VA)中。在一些情况下,使用更严格的条件,包括增加的pH、升高的温度和增加的解离时间。使用Intellicyt高通量流式细胞仪(HTFC,Intellicyt,Albuquerque,NM)检测平均细胞荧光。相对于野生型Siglec-9蛋白反应性,通过从模拟转染的对照中减去信号并且归一化至来自野生型Siglec-9转染的对照的信号来计算针对每种突变体克隆的Fab反应性。
如果关键克隆内的突变残基不支持测试Fab的反应性但确实支持可商购获得的参考Mab MAB1139(R&D Systems,目录号191240)或其它抗Siglec-9 Fab的反应性,则所述突变残基被鉴定为对于Fab表位而言是关键的。这种反向筛选策略有助于排除局部错误折叠或具有表达缺陷的Siglec-9突变体。
图1B描绘筛选中鉴定的所有关键残基的平均结合反应性和范围。主要关键残基被鉴定为其中所述突变对于测试抗体结合为阴性(<30%的与WT的结合)但对于对照抗体为阳性(>80%WT)的残基。图1C-1E描绘Siglec-9的晶体结构模型(PDB ID 2ZG2;Zhuravleva等人,2008),从而指示对于抗Siglec-9抗体2D4、5C6和12B12,关键残基为红球。表8B中列出了对抗体结合关键的氨基酸残基。
表8B:参与抗Siglec-9抗体结合的残基
如表8B中所示,参与由抗体2D4结合的关键Siglec-9残基对应于SEQ ID NO:1的氨基酸残基D
实施例3:Siglec-9抗体诱导的体外和体内Siglec-9的细胞表面水平的降低
Siglec-9的体外表达
以下实施例的目的是测试抗Siglec-9和/或Siglec-9双特异性抗体是否降低单核细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、T细胞和/或小神经胶质细胞上Siglec-9的细胞表面水平。
对抗Siglec-9抗体降低急性单核细胞性白血病细胞系THP-1以及人原代单核细胞、源自外周血单核细胞的人原代树突细胞(DC)、人原代巨噬细胞以及人原代小神经胶质细胞上的Siglec-9的细胞表面水平的能力进行了评价。将细胞样品以200,000个细胞/ml接种在24孔板中,或者以在2ml补充有10%Hyclone FBS、2mM谷氨酰胺、pen/strep和非必需氨基酸的RPMI中500,000个细胞接种于6孔皿中。以1.0μg/ml加入Siglec-9抗体或对照同种型,并在37℃、5%CO
为了评估受体动力学,允许抗体结合细胞1小时,洗出并在24小时和48小时后测定Siglec-9的表面水平。
通过FACS分析来检测细胞表面受体表达。将细胞与抗Siglec-9-FITC克隆HIM3-4以及对照表面标志物(U937:Siglec-5,人单核细胞:CD14,人树突细胞:CD11c,人巨噬细胞:CD11b)在黑暗中冰上一起孵育30分钟。将细胞在FACS缓冲液(PBS+2%FBS,2mM EDTA)中洗涤2次,并在BD FACS Canto上进行流式细胞术。使用TreeStar FlowJo软件分析数据。使用相应荧光团的MFI值,将数据计算为不存在抗体时受体表达的百分比。
表9A和9B描绘来自人细胞的Siglec-9细胞表面水平的结果。在表9A和9B中,“无Ab”是指未用抗体处理的细胞;并且“mIgG1”、“mIgG2a”和“mIgG2b”是指同种型对照抗体。
表9A:Siglec-9抗体降低人细胞系和人原代细胞中的Siglec-9的细胞表面水平
表9B:Siglec-9抗体降低人原代细胞中的Siglec-9的细胞表面水平
如表9A和9B中所示,大多数抗体能够降低多种类型的人细胞上Siglec-9的细胞表面水平。然而,使用Siglec-9的80%或更高的细胞表面表达水平的阈值,发现抗体2D5不降低任何测试的人细胞上Siglec-9的细胞表面水平。
图7A-7F进一步证明,大多数抗体能够降低THP-1细胞(图7A)、人原代单核细胞(图7B)、人原代小神经胶质细胞(图7C)、人原代巨噬细胞(图7D)以及人原代树突细胞(图7E)上Siglec-9的细胞表面水平。图7F证明当用Siglec-9抗体2D4和6B2处理时,人原代树突细胞上Siglec-9的表面水平以浓度依赖性方式降低。
此外,进行体外表面Siglec-9下调研究,其中Siglec-9抗体5C6、12B12和17C2以及同种型对照抗体(mIgG2a)被滴定2倍。如上所述收获原代人巨噬细胞并涂铺。将Siglec-9抗体以1nM至0.001μg/mL的浓度范围滴定10倍以评估结合。如上所述将抗体连续稀释并与细胞一起孵育。如图7I中所示,抗Siglec-9抗体5C6、12B12和17C2能够下调原代人树突细胞上Siglec-9的细胞表面表达。对照受体CD11b的细胞表面表达不受用Siglec-9抗体处理的影响(图7J)。
Siglec-9的体内表达
为了测试Siglec-9抗体在体内降低Siglec-9的细胞表面水平的能力,使用了人源化NSG小鼠(hu-NSG)。Hu-NSG小鼠是植入CD34+造血干细胞的NOD-scid IL2Rγnull小鼠。雌性Hu-NSG小鼠购自Jax并在植入人细胞后15周使用。小鼠在第0天接受腹膜内注射40mg/kg抗Siglec-9抗体2D4或同种型对照小鼠IgG1抗体(克隆MOPC-21)。在第1天,将血液样品从小鼠抽取到肝素中,并且进行处理以用于FACS分析。简言之,首先将血液样品在冰冷的ACK裂解缓冲液中孵育5分钟以裂解红细胞,且然后用冷PBS充分洗涤。此程序重复两次。然后将细胞在抗人CD45-Pe-Cy7、抗小鼠CD45-APC-Cy7、抗人CD3-PerCP-Cy5.5、抗人CD14-FITC、抗人CD11c-PB、抗Siglec-9-APC、抗CD33-PE以及存活力染料(Life Technologies,目录号L34957)存在下在FACS缓冲液(PBS+2%FBS,2mM EDTA)中在冰上在Fc封闭溶液存在下孵育30分钟,然后用冷FACS缓冲液洗涤两次。然后获得4%PFA固定的样品。数据在BD FACSCANTO
如图7G和7H中所示,当与对照mIgG1抗体处理相比时,用抗Siglec-9抗体2D4处理能够降低经处理的hu-NSG小鼠的外周血的细胞中Siglec-9的细胞表面水平。Siglec-9表达在抗体处理后早在第1天降低约80%(图7G)。作为比较,与在用mIgG1对照抗体处理后CD33的细胞表面水平相比,在抗Siglec-9抗体处理后无关表面受体CD33的细胞表面表达未显著降低(图7H)。
如图7K-7N中所示,当与同种型对照MOPC21抗体处理相比时,用抗Siglec-9抗体2D4处理能够降低经处理的hu-NSG小鼠的外周血的细胞中Siglec-9的细胞表面水平。Siglec-9表达在用抗体2D4抗体处理后早在第1天降低约80%(图7L)。Siglec-9表达的这种降低在处理后21天持续(图7K和7L)。作为比较,与在用mIgG1对照抗体处理后CD33的细胞表面水平相比,在抗Siglec-9抗体处理后无关表面受体CD33的细胞表面表达未显著降低(图7K和7M)。
这些结果证明,当使用人源化小鼠时,Siglec-9抗体体内接合Siglec-9并且功能性地下调人免疫细胞上的Siglec-9。所述结果进一步证明Siglec-9抗体2D4当注射到人源化小鼠中时,接合小鼠血液中循环的外周hCD45
Siglec-9抗体对TREM2表达的作用
为了测试降低Siglec-9的细胞表面水平的Siglec-9抗体调节TREM2表达的能力,在第6天收获了用GM-CSF和IL-4分化的人单核细胞来源的树突细胞,并且以每孔500,000个细胞与1.0μg/ml抗Silglec-9抗体2D4、同种型对照抗体一起涂铺于24孔皿中过夜或不处理。在第二天通过FACS分析检测CD11c、TREM2和Siglec-9的细胞表面受体表达。将细胞与生物素化的抗TREM2抗体10A9一起在冰上孵育20分钟。在一次洗涤后,将细胞在具有APC缀合的链霉亲和素(BD Biosciences,1:150稀释)、抗Siglec-9-PE、克隆K8(Biolegend)和抗CD11c-PECy7(BD Biosciences)的FACS缓冲液中在黑暗中在冰上孵育30分钟。将细胞在FACS缓冲液(PBS+2%FBS,2mM EDTA)中洗涤3次,并在BD FACS Canto上进行流式细胞术。使用TreeStar FlowJo软件分析数据。使用相应荧光团的MFI值,将数据计算为不存在抗体时受体表达的百分比。
如图7O和7P中所示,能够降低Siglec-9的细胞表面水平的抗Siglec-9抗体2D4不影响TREM2表达。
TREM2中的功能丧失突变与严重的神经变性(包括那须哈科拉病、额颞叶痴呆和阿尔茨海默氏病)相关。据信含有ITIM的Siglec受体的调节可影响TREM2表达。因此,不会降低人免疫细胞上的TREM2表达的抗Siglec-9抗体可能是积极治疗结果的关键。图7O和7P中的结果表明抗Siglec-9抗体克隆2D4(其稳健降低Siglec-9的细胞表面水平)不降低人树突细胞上的TREM2表达。
实施例4:确定Siglec-9抗体是否与Siglec-9配体竞争结合至人Siglec-9
以下实施例的目的是测试抗Siglec-9抗体是否识别Siglec-9上的配体结合位点并与配体竞争结合在细胞上的Siglec-9受体上。
为了确定Siglec-9抗体是否阻断与唾液酸配体的结合,U937细胞用于基于FACS的方案中,所述细胞稳健地表达主要结合至Siglec-9的唾液酸配体。简言之,将25μg/mlSiglec-9抗体在96孔圆底板中与25μg/ml Siglec-9-Fc(R&D Systems,目录号1139-SL-050)一起在冰上在缓冲液(具有0.25%BSA和1mM CaCl
表10中描绘了配体竞争测定的结果。在表10中,“Siglec-9-Fc”是指仅用Siglec-9-Fc处理的细胞;“同种型”是指同种型对照抗体;并且“二级Ab”是指仅用PE缀合的二级抗体处理的细胞。
表10:Siglec-9抗体不会阻断Siglec-9-Fc与U937细胞的结合
如表10中所示,Siglec-9抗体不能阻断Siglec-9-Fc与U937细胞的结合,因此表明抗体不竞争与Siglec-9上的配体结合位点的结合,并且不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用(即,不阻断配体与Siglec-9的结合)。
在单独实验中,在实验分析之前培养U937细胞并传代数次。用胰蛋白酶或EDTA收获U937细胞并在U-底96孔板中每孔涂铺约100,000个。将细胞在结合缓冲液(PBS+0.25%BSA和1mMCaCl
如图7Q中所示,Siglec-9抗体5C6、12B12和17C2能够阻断受体与U937细胞表达的内源性唾液酸配体的结合。与表10中的结果一致,抗体2D4不能阻断配体结合,而是似乎增强配体-受体相互作用(图7Q)。结果表明配体阻断可以是预防ITIM信号传导并抑制Siglec-9受体功能的一种方法。
实施例5:Siglec-9抗体功能研究的总结。
表11总结了以上实施例3和4中描述的细胞表面表达和配体结合研究的结果。如表11中所示,存在三种一般类别的Siglec-9抗体。一类抗体降低Siglec-9的细胞表面水平而不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。在此抗体类别中的抗体包括:2D4、5B1、6B2、6D8、7H12。
第二类抗体不降低Siglec-9的细胞表面水平并且不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。在此抗体类别中的抗体包括2D5。
第三类抗体降低Siglec-9的细胞表面水平并且抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。在此抗体类别中的抗体包括:5C6、12B12和17C2。
表11:Siglec-9抗体功能研究
实施例6:配体与树突细胞上的Siglec-9的结合抑制T细胞增殖和吞噬
用GM-CSF和IL-4使人树突细胞(DC)从外周血单核细胞中分化,并将其培养5天。收获未成熟(悬浮)DC并在12孔皿中以200,000个细胞/ml的密度接种。用TNFa(50μg/ml)、IL-1b(50μg/ml)、IL-6(150ng/ml)和前列腺素E2(1μg/ml)的细胞因子混合物活化DC 24小时。通过流式细胞术用可商购获得的针对LIN、CD11c、HLA-DR、CD86和CD83的抗体(BDBiosciences)确定树突细胞成熟。就在与同种异体分离的T细胞共培养之前,将活化的DC在无血清培养基中用唾液酸酶处理或不处理,在37℃下与来自霍乱弧菌(Vibrio cholera)的100mU/ml神经氨酸苷酶处理2小时。通过加入含血清的培养基猝灭酶促活性,将细胞沉淀并重新悬浮于完全培养基中。将唾液酸酶活化的、未处理的活化的或未活化的DC与同种异体CFSE标记的T细胞以1:10的比率共培养。将CD3/CD28 Dynal珠粒添加至仅T细胞作为阳性对照。在5天后,通过BD FACS Canto上的CFSE稀释来测量T细胞增殖。
图8和9示出树突细胞上的唾液酸在混合淋巴细胞反应(MLR)期间限制T细胞增殖。图9示出正常表达抑制性配体的DC诱导低水平的T细胞增殖(左图),而除去DC上的抑制性配体增加T细胞增殖(右图)。
如图8和9中所示,当与未处理的活化的DC相比时,从活化的DC酶促除去唾液酸增加了T细胞增殖。这些结果表明,当与同种异体DC共培养时,存在于DC上的唾液酸以抑制性方式作用于T细胞以限制T细胞增殖。这些结果表明阻断T细胞或树突细胞上的Siglec-9的抗体增强了T细胞和/或树突细胞功能性。使用CD3/CD28Dynal珠粒作为阳性对照。此外,这些结果表明阻断唾液酸与DC或任何其它细胞或生物来源的相互作用可增加T细胞功能。
实施例7:炎性病况诱导骨髓细胞中的Siglec-9唾液酸配体表达
用GM-CSF和IL-4使人树突细胞(DC)从外周血单核细胞中分化,并将其培养5天。未成熟的人DC在第5天收获并与来自B16、Lewis肺、MC38肿瘤上清液或10ng/ml LPS的无菌过滤上清液共培养。在24小时后,用直接缀合的Siglec-9-PE抗体通过流式细胞术测定Siglec-9表达。通过在冰上与50μg/ml的与人IgG1-Fc融合的可溶性Siglec-9孵育30分钟评估唾液酸配体表达,在存在人Fc阻断的情况下使用仅IgG1-Fc作为阴性对照。在洗涤步骤并在冰上与缀合至PE的抗人二级抗体一起孵育30分钟后,检测可溶性受体与细胞上唾液酸的结合。流式细胞术分析在BD FACS Canto上进行。
为了引发原代巨噬细胞,分离来自外周人血液样品的人单核细胞并直接使用或用50μg/ml M-CSF分化成巨噬细胞5天。为了确定Siglec-9在炎性细胞因子产生中的作用,将人巨噬细胞与各种炎症介质一起培养,并且测量培养上清液中的细胞因子水平。为了产生人巨噬细胞,分离来自外周人血液样品的单核细胞并直接使用或用50μg/ml M-CSF分化成巨噬细胞或用100μg/ml GM-CSF和100μg/ml IL-4分化成树突细胞持续5天。将细胞培养5天,并且用PBS中的1mM EDTA分离粘附细胞。将细胞以10
图10A和10B示出在暴露于肿瘤上清液后,Siglec-9表达在人树突细胞上维持。图10C和10D示出肿瘤上清液增加唾液酸(一种Siglec-9配体)的表达。图10E和10F示出在LPS诱导的炎症期间Siglec-9表达在人树突细胞上维持。图10G和10H示出LPS诱导的炎症增加唾液酸(一种Siglec-9配体)的表达。
这些结果表明炎性病状和肿瘤环境导致Siglec-9和唾液酸配体两者的上调。所述结果还表明增加的Siglec-9功能可免疫抑制人原代树突细胞。这些结果表明,用下调或阻断抗体抑制Siglec-9可减轻免疫抑制的骨髓来源的或肿瘤相关的骨髓细胞并恢复免疫功能。这些结果进一步表明,阻断骨髓细胞上的Siglec-9的抗体增强骨髓细胞功能。
实施例8:用唾液酸酶处理增加树突细胞对大肠杆菌的吞噬
以下实施例的目的是测试拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体是否诱导凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它异物以及致病蛋白(如Aβ肽、α突触核蛋白蛋白、Tau蛋白、TDP-43蛋白、朊病毒蛋白、亨廷顿蛋白)、RAN翻译产物抗原(包括由来自骨髓谱系的细胞如单核细胞、树突细胞、巨噬细胞和小神经胶质细胞中的甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)组成的二肽重复序列(DPR肽))的吞噬。双特异性抗体可以是识别Siglec-9抗原和包括但不限于以下各项的第二抗原的抗体:CD3、Aβ肽、抗原或α突触核蛋白蛋白抗原或Tau蛋白抗原或TDP-43蛋白抗原或朊病毒蛋白抗原或亨廷顿蛋白抗原或RAN翻译产物抗原,包括由甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)组成的二肽重复序列(DPR肽)。
使用RosetteSep
为了进行细菌吞噬测定,收获树突细胞并涂铺在无细胞因子的96孔平底板中持续2小时。根据制造商的方案将pHrodo标记的大肠杆菌BioParticles重新悬浮,并且用来自霍乱弧菌的0.2U/ml或0.4U/ml唾液酸酶或仅PBS在37℃下处理2.5小时。将BioParticles洗涤,重新悬浮于RPMI中并添加20ug/孔。将树突细胞和大肠杆菌细胞混合、沉淀并在37℃下孵育30分钟。将细胞松弛素D以10uM添加至对照孔中。就在FACS分析之前,将细胞转移至冰并在4℃下在FACS缓冲液中洗涤2X。在BD FACS Canto上通过流式细胞术在PE通道中检测到pHrodo标记的大肠杆菌吞噬。
图11示出唾液酸酶处理增加了大肠杆菌的树突细胞介导的吞噬。这些结果表明,例如降低Siglec-9的细胞表面表达和/或抑制一种或多种Siglec-9配体与Siglec-9的结合的拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体也可用于诱导或以其它方式增加吞噬。
实施例9:阿尔茨海默氏病患者的脑切片中Siglec-9配体的表达增加
用生物素化的Siglec-9-Fc(R&D)通过免疫组织化学在正常和阿尔茨海默氏病(AD)患者的脑中检测到唾液酸配体表达。根据制造商的说明书用EZ-Link磺基-NHS-生物素(Thermo Scientific)将Siglec-9-Fc蛋白生物素化。除了过夜孵育之外,在振荡器上进行IHC程序。将样品在10%MeOH、3%H
图12示出唾液酸Siglec-9配体在来自两名AD患者(供体1和供体2)的脑切片中上调。来自5名AD和5名非AD人脑的数据通过单向ANOVA显示Siglec-9唾液酸配体表达的统计上显著的增加,p=0.0159(图12)。
这些结果表明从细胞表面除去Siglec-9或阻断增加的配体相互作用的抗体可减轻对大脑中小神经胶质细胞或其它骨髓细胞的抑制性Siglec-9-依赖性信号传导并恢复这些细胞的正常功能,对阿尔茨海默氏病具有有益作用。
实施例10:癌细胞中Siglec-9配体的表达增加
体外研究
培养小鼠黑素瘤(B16)、Lewis肺肿瘤细胞或结肠癌(MC38)并在冰上与50μg/mlSiglec-9-Fc或IgG1-Fc对照一起孵育30分钟以确定这些细胞类型上的Siglec-9结合唾液酸配体表达的水平。结合相互作用在含有0.25%BSA、1mM CaCl
图13示出在黑色素瘤细胞、肺肿瘤细胞和结肠癌细胞中,抑制性Siglec-9配体的表达相对于本底增加至少20倍。不希望受理论束缚,在这些肿瘤细胞上抑制性唾液酸配体表达的鉴定表明癌细胞逃避免疫识别和清除的促成机制。肿瘤细胞上的唾液酸配体可经由在骨髓和淋巴免疫细胞上表达的Siglec-9介导免疫抑制相互作用。这些结果表明,从细胞表面移除Siglec-9或阻断增加的配体相互作用的抗体可减轻肿瘤对免疫系统的抑制作用并增强癌症疗法。
体内研究
在通过静脉内注射植入人胎儿肝CD34
如图14中所描绘,结果表明Siglec-9在人源化小鼠的移植的黑色素瘤肿瘤中在外周血、脾脏和肿瘤浸润免疫细胞中表达。重要的是,Siglec-9在人免疫细胞浸润黑色素瘤肿瘤中显著上调。这证明了此小鼠模型评估S Siglec-9抗体的治疗能力的相关性。
实施例11:通过拮抗性和/或双特异性Siglec-9抗体减少骨髓细胞中的抗炎细胞
此实施例的目的是测试在用拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体处理并用100ng/ml LPS(Sigma)刺激、通过与凋亡细胞共培养或通过类似的刺激进行刺激后骨髓来源的骨髓细胞是否显示抗炎细胞因子IL-10和其它抗炎介质的减少。
如先前所述进行人骨髓前体细胞的分离。在5天后更换培养基,并且将细胞再培养10-11天。在24小时后收集上清液,并且根据制造商的说明书(R&D Systems)通过IL-10ELISA测定从细胞释放的IL-10和其它抗炎细胞因子的水平(JEM(2005),201;647–657;以及PLoS Medicine(2004),4|第4期|e124)。
实施例12:通过拮抗性和/或双特异性Siglec-9抗体诱导来自骨髓谱系的细胞中
此实施例的目的是测试拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体是否诱导凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它异物以及致病蛋白(如Aβ肽、α突触核蛋白蛋白、Tau蛋白、TDP-43蛋白、朊病毒蛋白、亨廷顿蛋白)、RAN、翻译产物抗原(包括由来自骨髓谱系的细胞如单核细胞、树突细胞、巨噬细胞和小胶质细胞的细胞中的甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)组成的二肽重复序列(DPR肽))的吞噬。双特异性抗体可以是识别Siglec-9抗原和包括但不限于以下各项的第二抗原的抗体:Aβ肽、抗原或α突触核蛋白蛋白抗原或Tau蛋白抗原或TDP-43蛋白抗原或朊病毒蛋白抗原或亨廷顿蛋白抗原或RAN翻译产物抗原,包括由甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)组成的二肽重复序列(DPR肽)。
使用RosetteSep单核细胞分离抗体混合物(StemCell Technologies)分离来自外周人血液样品的单核细胞,并用50μg/ml M-CSF(PeproTech)分化成巨噬细胞、嗜中性粒细胞和NK细胞持续5天。将细胞涂铺在培养皿上的含有10%胎牛血清(Hyclone)的RPMI培养基(Invitrogen)中并在37℃下5%CO
根据在Etemad等人,JI(2012)和Ohgidani等人,Scientific Reports(2014)中描述的方法通过在含有1%Pen/Strep、10ng/ml GM-CSF、10ng/ml M-CSF、10ng/mlβ-NGF、100ng/ml CCL-2、100ng/ml IL-34的无血清RPMI中培养,从外周血单核细胞制备人小神经胶质细胞。当出现分枝形态时,在第7-10天收获细胞。
为了进行吞噬测定,将小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞与凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它异物和致病蛋白一起培养。将神经元培养5-10天,且然后以30nM的最终浓度加入冈田酸持续3小时以诱导细胞凋亡。用CellTracker CM-DiI膜染料(Molecular Probes)标记神经元细胞膜。在孵育后,将凋亡神经元或吞噬的其它靶标洗涤两次,并以1:20的效应子/靶标比添加至转导的小神经胶质细胞培养物中。在添加凋亡神经元后1小时和24小时,在共焦荧光显微术(Leica)下对具有吞噬神经元细胞膜的小神经胶质细胞的数量计数。在60的放大倍数下在三个不同区域中对凋亡细胞计数。通过流式细胞术确认吞噬的量。此外,在添加凋亡神经元后24、48或72小时,收集细胞并用于细胞因子的RT-PCR。
为了进行微球珠粒或细菌吞噬测定,将小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞用抗Siglec-9激动性抗体处理。收获细胞并涂铺在无细胞因子的96孔平底板中持续2小时。根据制造商的方案将pHrodo标记的大肠杆菌BioParticles重新悬浮,并且用来自霍乱弧菌的0.2U/ml或0.4U/ml唾液酸酶或仅PBS在37℃下处理2.5小时。将BioParticles洗涤,重新悬浮于RPMI中并添加20μg/孔。将细胞和大肠杆菌混合、沉淀并在37℃下孵育30分钟。将细胞松弛素D以10uM添加至对照孔中。就在FACS分析之前,将细胞转移至冰并在4℃下在FACS缓冲液中洗涤2次。在BD FACS Canto上通过流式细胞术在PE通道中检测到pHrodo标记的大肠杆菌吞噬。
在24小时后,添加1.00μm的红色荧光微球珠粒(Fluoresbrite PolychromaticRed Mi-crospheres;Polysciences Inc.)持续1小时。通过荧光显微术分析小神经胶质细胞对微球珠粒的吞噬。此外,从培养板收集小神经胶质细胞并通过流式细胞术分析。测定具有吞噬珠粒的小神经胶质细胞的百分比。因为吞噬因实验而异,所以吞噬的相对变化也被确定。数据被显示为用激动性抗体和对照抗体培养的小神经胶质细胞之间的吞噬的相对变化。
为了进行用于分析炎性基因转录物的RT-PCR,用Siglec-9载体或GFP1对照载体转导小神经胶质细胞。然后将细胞在培养皿上培养并用抗Siglec-9激动性抗体处理。在24、48和72小时后,使用Rneasy迷你试剂盒(Rneasy Mini Kit,QIAGEN)从小神经胶质细胞分离RNA。还从已用sh-Siglec-9 RNA、sh-对照RNA、wSiglec-9、GFP2、mtDAP12-GFP以及GFP1载体转导并与凋亡神经元共培养48小时的小神经胶质细胞中收集RNA。
然后进行RNA的逆转录。SYBR Green的定量RT-PCR在ABI Prism 5700序列检测系统(Prism 5700Sequence Detection System,PerkinElmer)上进行。GAPDH的扩增用于样品归一化。扩增方案遵循GeneAmp 5700序列检测系统软件(1.3版)。为了检测GAPDH、TNF-α、IL-1、NOS2和TGF-β转录物,以200nM的最终浓度使用以下正向和反向引物:
GAPDH正向引物:5'-CTCCACTCACGGCAAATTCAA-3'(SEQ ID NO:241),和GAPDH反向引物:5'-GATGACAAGCTTCCCATTCTCG-3'(SEQ ID NO:242);
TNF-α正向引物:5'-CCGTCAGCCGATTTGCTATCT-3'(SEQ ID NO:243),和TNF-α反向引物:5'-ACGGCAGAGAGGAGGTTGACTT-3'(SEQ ID NO:244);
IL-1α正向引物:5'-ACAA-CAAAAAAGCCTCGTGCTG-3'(SEQ ID NO:245),和IL-1α反向引物:5'-CCATTGAGGTGGAGAGCTTTCA-3'(SEQ ID NO:246);
NOS2正向引物:5'-GGCAAACCCAAGGTCTACGTTC-3'(SEQ ID NO:247),NOS2反向引物:5'-TACCTCATTGGCCAGCTGCTT-3'(SEQ ID NO:248);以及
TGF-β1正向引物:5'-AGGACCTGGGTTGGAAGTGG-3'(SEQ ID NO:249),和TGF-β1反向引物:5'-AGTTGGCATGGTAGCCCTTG-3'(SEQ ID NO:250)。
为了进行淀粉样蛋白吞噬测定,将HiLyteFluor
实施例13:通过拮抗性Siglec-9抗体和/或双特异性抗体诱导SYK和/或ERK活化
此实施例的目的是测试激动性抗Siglec-9抗体和/或Siglec-9双特异性抗体是否诱导Syk和ERK活化。
将小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞暴露于激动性抗Siglec-9和/或Siglec-9双特异性抗体1小时。在刺激后,将细胞在还原样品缓冲液中裂解以用于蛋白质印迹分析。通过蛋白质印迹分析(JEM(2005),201,647–657)分别用抗磷酸-Syk或ERK和抗Syk或ERK抗体(均来自Cell Signaling Technology)通过免疫检测确定ERK的磷酸化和Syk和/或ERK的总量。
实施例14:Siglec-9抗体和/或双特异性抗体诱导Syk磷酸化
脾酪氨酸激酶(Syk)是细胞内信号传导分子,其通过磷酸化若干底物而在Siglec-9下游起作用,由此促进形成导致细胞活化和炎症过程的信号传导复合物。通过培养人巨噬细胞、人嗜中性粒细胞、人NK细胞和人原代树突细胞并测量细胞提取物中Syk蛋白的磷酸化状态来测定激动剂Siglec-9抗体诱导Syk活化的能力。
将人原代树突细胞在1%血清RPMI中饥饿4小时,且然后用PBS-EDTA从组织培养皿中移出,用PBS洗涤并计数。将细胞用全长激动剂Siglec-9抗体或对照抗体在冰上涂覆15分钟。在用冷PBS洗涤后,将细胞在山羊抗人IgG存在下在37℃下孵育指定的时间段。在刺激后,将细胞用裂解缓冲液(1%v/v NP-40%、50Mm Tris-HCl(pH 8.0)、150mM NaCl、1mMEDTA、1.5mM MgCl
实施例15:通过拮抗性Siglec-9抗体和/或双特异性抗体诱导小神经胶质细胞、巨
此实施例的目的是测试抗Siglec-9抗体和/或Siglec-9双特异性抗体是否在小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞和树突细胞中诱导CCR7和朝向CCL19和CCL21的迁移。
将小神经胶质细胞、巨噬细胞或树突细胞与激动性抗Siglec-9和/或Siglec-9/DAP12双特异性抗体或与对照抗体一起培养。在72小时后收集细胞,用CCR7特异性抗体免疫标记,并通过流式细胞术分析。
为了确定增加的CCR7表达的任何功能性后果,进行趋化性测定。用拮抗性抗Siglec-9和/或Siglec-9/DAP12双特异性抗体经由Siglec-9刺激小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞并置于双室系统中。量化朝向趋化因子配体CCL19和CCL21迁移的小神经胶质细胞的数量(JEM(2005),201,647–657)。
对于趋化性测定,将小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞暴露于拮抗性抗Siglec-9抗体或Siglec-9双特异性抗体并用1μg/ml LPS处理。将小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞转移到transwell系统(3μm孔滤器;Millipore)的含有450μl培养基的上室中,其中下室中具有100ng/ml CCL19或CCL21(均来自PeproTech)。在1小时孵育期后,通过显微术在三个独立区域对已经迁移到下室的小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞的数量计数(JEM(2005),201,647–657)。
实施例16:通过拮抗性Siglec-9抗体和/或双特异性抗体诱导小神经胶质细胞、巨
此实施例的目的是测试拮抗性抗Siglec-9抗体或Siglec-9双特异性抗体是否在小胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞和树突细胞中诱导F-肌动蛋白。
将用Siglec-9转导或表达Siglec-9的目标小胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞或树突细胞和其它目标细胞添加至培养板,且然后暴露于拮抗性抗Siglec-9和/或Siglec-9双特异性抗体或对照抗体。将细胞固定、封闭,且然后在1小时后用Alexa Fluor546缀合的鬼笔环肽(Molecular Probes)染色,并用荧光染料标记F-肌动蛋白。通过共聚焦激光扫描显微术用40倍物镜收集图像(Leica)。(JEM(2005),201,647–657)。
实施例17:通过拮抗性Siglec-9抗体和/或双特异性抗体诱导破骨细胞产生并提
此实施例的目的是测试拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体是否诱导破骨细胞产生并提高破骨细胞生成速率。
将人单核细胞来源的单核细胞/巨噬细胞维持于补充有10%FBS(AtlanticBiologics,Atlanta,GA,USA)和青霉素-链霉素-谷氨酰胺(Mediatech)的RPMI-1640培养基(Mediatech)或另一适当培养基中。将细胞以3000个细胞/孔在96孔板中接种在补充有10%FBS、青霉素-链霉素-谷氨酰胺、50ng/ml RANKL和20ng/ml M-CSF的α-MEM培养基中。培养基每3天更换一次,暴露于抗Siglec-9拮抗性抗体,并对多核(至少3个细胞核)TRACP
或者,将巨噬细胞、嗜中性粒细胞或NK细胞一式三份接种到板上,并用RANKL、M-CSF和抗Siglec-9和/或Siglec-9双特异性抗体或同种型匹配的对照单克隆抗体进行处理。将培养基每3天更换一次,直到出现大量多核细胞。在培养3至5天后,将细胞用PBS中的3.7%甲醛固定10分钟。然后将板在PBS中洗涤两次,在50%丙酮和50%乙醇的溶液中孵育30秒,并用PBS洗涤。用来自Sigma的试剂盒(产品435)对细胞进行抗酒石酸酸性磷酸酶(TRAP)染色。如所描述(例如,Peng等人,(2010)Sci Signal.,3(122):ra38),然后通过光学显微术对多核(多于两个细胞核)TRAP阳性细胞进行计数。
实施例18:在整个动物中体内保护免遭EAE和铜宗
将成年7-9周龄的雌性C57BL/6小鼠(获自Charles River Laboratories)在尾根部双侧注射200μl含在不完全弗氏佐剂(Difco)中的100μg的髓磷脂少突胶质细胞糖蛋白肽35-55(氨基酸MEVGWYRSPFSRVVHLYRNGK(SEQ ID NO:251)Seqlab)的接种物和1mg结核分枝杆菌H37 Ra(Difco)。在免疫后第0天和第2天注射百日咳毒素(200ng;List Bio-logicalLaboratories)。临床体病征评分如下:0,无临床体征;1,完全尾松软;2,完全尾松软和步态异常;3,一个后肢轻瘫;4,完全后肢轻瘫;以及5,前肢和后肢瘫痪或垂死。仅在第14天具有疾病发作(临床评分为1或更高)的小鼠才用于实验。将激动性抗Siglec-9和/或Siglec-9双特异性抗体在第一次临床症状当天或在任何其它所需时间腹膜内或静脉内注射于EAE患病小鼠中(PLoS Med(2007)4(4):e124)。
向年轻或老龄野生型(WT)小鼠饲喂含有0.2%铜宗(CPZ)粉状草酸双(亚环己基酰肼)(Sigma-Aldrich)的标准饮食(Harlan)持续4、6或12周。对于组织学和免疫组织化学分析,在用4%多聚甲醛(PFA)小鼠灌注后除去大脑,在4%PFA中固定24小时,然后在30%蔗糖中浸泡24-48小时。为了评价髓磷脂完整性和损伤以及细胞增殖和炎症,将切片或小鼠脑用抗MBP(1:100;Abcam,ab7349)、抗dMBP(1:2000;Millipore;ab5864)、抗βAPP(1:100;Invitrogen,51-2700)、抗SMI-31(1:1000;Covance,smi-31R)、抗Iba1(1:600;Wako,019-19741)、抗BrdU(1:250;Abcam,ab1893)、抗GFAP(1:200;Invitrogen,13-0300)、抗iNOS(1:100;BD Pharmingen,610329)、抗LPL(1:400,来自Dr.G.Olivecrona)以及抗MHC II(1:100;BD Pharmingen,553549)染色。对于抗体的行为作用,使用透明聚苯乙烯外壳和计算机化光感仪器分析小鼠的自主活动。对一般活动变量(总步行、垂直后退站立)以及情绪指数(包括所花费的时间、行进距离和条目)进行分析。进行一系列感觉运动测试来评估平衡(台架和平台)、强度(倒屏)、协调(极点和倾斜屏幕)和开始运动(步行开始)。使用转棒方案研究运动协调和平衡(Cantoni等人,Acta Neuropathol
实施例19:拮抗性Siglec-9抗体和/或Siglec-9双特异性抗体在建立的创伤性脑
在创伤性脑损伤的建立的动物模型中测试拮抗性抗Siglec-9和/或Siglec-9双特异性抗体的治疗效用(Tanaka,Y等人(2013)Neuroscience 231 49-60)。可使用一般小鼠或在细菌人工染色体下或在骨髓启动子下表达人Siglec-9基因的小鼠。例如,使用诱导小神经胶质细胞和星形胶质细胞的活化的创伤性脑损伤模型。使用8或9周龄的雄性C57BL/6JWT小鼠(购自Charles River Laboratories或Jackson Laboratories)。通过腹膜内施用溶于无菌盐水中的甲苯噻嗪盐酸盐(8mg/kg)和水合氯醛(300mg/kg)将小鼠麻醉,且随后置于立体定位仪(Narishige,Tokyo,Japan)中。将头皮切开,且露出颅骨。将骨膜从头骨上清除,用牙钻在右大脑半球上钻一个孔,并用针尖除去硬脑膜。使用外径为0.5mm的不锈钢套管在右半球取得纵向刺伤伤口。将套管定位在中线侧面1.3mm和前囟后1mm处,并将其引入脑中直到尖端达到2mm的深度。然后将套管尾端移动2mm(前囟3mm),且然后向后移回2mm直到其初始位置。最后,从脑中取出套管,并缝合头皮伤口。然后根据标准程序用拮抗性抗Siglec-9和/或Siglec-9双特异性抗体处理小鼠,且然后通过组织学和免疫荧光染色和行为测试进行分析。这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例20:拮抗性Siglec-9抗体和/或Siglec-9双特异性抗体在毒素诱导的损伤
在毒素诱导的损伤后的神经炎症和神经元损失模型中测试了激动性抗Siglec-9和/或Siglec-9双特异性抗体的治疗效用(Martens,LH等人,(2012)The Journal ofClinical Investigation,122,3955)。将三个月大的一般小鼠每天用4次腹膜内注射MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)(4μg/g体重)(Sigma-Aldrich)或PBS处理2天。如所描述,根据标准方案用激动性抗Siglec-9和/或Siglec-9双特异性抗体处理小鼠,且然后使用体视学计数进行分析以定量黑质致密部(SNpc)中的多巴胺神经元和小神经胶质细胞。这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例21:拮抗性Siglec-9抗体和/或Siglec-9双特异性抗体在衰老、癫痫发作、
在老化、癫痫发作、脊髓损伤、视网膜营养不良、额颞叶痴呆、亨廷顿疾病、帕金森氏病、肌萎缩性侧索硬化和阿尔茨海默氏病的动物模型中测试了拮抗性抗Siglec-9和/或Siglec-9双特异性抗体的治疗效用,如先前所描述(例如,Beattie,MS等人,(2002)Neuron36,375-386;Volosin,M等人,(2006)J.Neurosci.26,7756-7766;Nykjaer,A等人,(2005)Curr.Opin.Neurobiol.15,49-57;Jansen,P等人,(2007)Nat.Neurosci.10,1449-1457;Volosin,M等人,(2008)J.Neurosci.28,9870-9879;Fahnestock,M等人,(2001)Mol.CellNeurosci.18,210-220;Nakamura,K等人,(2007)Cell Death.Differ.14,1552-1554;Yune,T等人,(2007)Brain Res.1183,32-42;Wei,Y等人,(2007)Neurosci.Lett.429,169-174;Provenzano,MJ等人,(2008)Laryngoscope 118,87-93;Nykjaer,A等人,(2004)Nature427,843-848;Harrington,AW等人,(2004)Proc.Natl.Acad.Sci.U.S.A.101,6226-6230;Teng,HK等人,(2005)J.Neurosci.25,5455-5463;Jansen,P等人,(2007)Nat.Neurosci.10,1449-1457;Volosin,M等人,(2008)J.Neurosci.28,9870-9879;Fan,YJ等人,(2008)Eur.J.Neurosci.27,2380-2390;Al-Shawi,R等人,(2008)Eur.J.Neurosci.27,2103-2114;以及Yano,H等人,(2009)J.Neurosci.29,14790-14802)。这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例22:拮抗性Siglec-9抗体和/或Siglec-9双特异性抗体在感染模型中的治
在感染模型中测试了拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体的治疗效用。例如,如先前所描述(例如,Yin,F等人,(2009)J.Exp.Med,207,117-128),可使用正常小鼠中的单核细胞增多性李斯特氏菌或其它感染。可使用一般小鼠或在细菌人工染色体下或在骨髓启动子下表达人Siglec-9基因的小鼠。
实施例23:拮抗性Siglec-9抗体和/或Siglec-9双特异性抗体在炎性疾病模型中
在炎性疾病模型中测试了拮抗性抗Siglec-9抗体和/或Siglec-9双特异性抗体的治疗效用。例如,类风湿性关节炎或另一种炎性疾病的建立模型中(Mizoguchi(2012)ProgMol Biol Transl Sci.,105:263-320;以及Asquith等人,(2009)Eur J Immunol.39:2040-4)。这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例24:筛选诱导或抑制Siglec-9和下游信号传导分子的磷酸化的抗Siglec-9
用PBS-EDTA从组织培养皿中移出细胞(J774、RAW 264.7、BMM细胞、人原代单核细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、T细胞、小神经胶质细胞或破骨细胞),用PBS洗涤并计数。将细胞与抗Siglec-9抗体和/或Siglec-9双特异性抗体或与1μg/10
实施例25:筛选诱导或抑制钙通量的抗Siglec-9和/或Siglec-9双特异性抗体
将BMM细胞用含HEPES的缓冲液[20mM HEPES(pH 7.3)、120mM NaCl、1mM CaCl、1mMMgCl、5mM KCl、葡萄糖(1mg/ml)、牛血清白蛋白(1mg/ml)]洗涤两次,然后在37℃下在0.05%Pluronic F-127(Invitrogen)和1μM Indo-1 AM(Invitrogen)中孵育20分钟。将细胞用HEPES缓冲液洗涤两次,且然后用抗Siglec-9抗体和/或Siglec-9双特异性抗体(16μg/ml)或用对照抗体(16μg/ml)刺激,并通过分光光度计(PTL Photon TechnologyInternational)监测。根据制造商的说明书(例如,Peng等人,(2010)Sci Signal.,3(122):ra38)将Indo-1荧光发射转化为钙(Ca
实施例26:Siglec-9增加巨噬细胞、嗜中性粒细胞、NK细胞和树突细胞的存活
为了评价Siglec-9在细胞存活中的作用,在存在炎性介质的情况下培养人或小鼠巨噬细胞、嗜中性粒细胞、NK细胞、小神经胶质细胞、T细胞和树突细胞,并测量细胞存活。
通过用冷PBS冲洗胫骨和股骨骨髓细胞获得来自表达Siglec-9的小鼠或WT小鼠的鼠骨髓前体细胞。用PBS洗涤一次后,将红细胞使用ACK裂解缓冲液(Lonza)裂解,用PBS洗涤两次并以0.5x10
为了分析骨髓源性巨噬细胞、嗜中性粒细胞或NK细胞的存活力,如上制备细胞并在MCSF中培养。在非组织培养物处理的板中将细胞以10
实施例27:Siglec-9增加巨噬细胞、嗜中性粒细胞或NK细胞上炎性细胞表面标志
为了确定Siglec-9在炎症标志物表达中的作用,将巨噬细胞、嗜中性粒细胞和NK细胞与各种炎性介质一起培养,并且在存在或不存在Siglec-9抗体下测量表面标志物(例如CD86和CD206)的表达。
将巨噬细胞、嗜中性粒细胞和NK细胞涂铺并使其在37℃下粘附4小时,并且以0.01-100ng/ml(LPS)或0.01-10μg/ml(酵母聚糖)范围内的浓度添加TLR激动剂LPS(马流产沙门氏菌)和酵母聚糖(酿酒酵母)。或者,在细胞因子IL-4(10ng/ml)或IFN(0.5-50ng/ml)存在下培养巨噬细胞、嗜中性粒细胞和NK细胞。48小时后在BD FACS Canto上进行CD86和CD206的FACS分析。使用FlowJo(TreeStar)软件10.0.7版进行数据分析。
实施例28:Siglec-9抗体和/或双特异性抗体的抗癌作用的分析
将8周龄(+/-2周龄)的10只C57B16/NTac小鼠组(一般小鼠或表达来自细菌人工染色体或来自骨髓启动子的人Siglec-9基因的小鼠)用悬浮在100ul PBS中的肿瘤细胞(例如1x10
表达人IL-3、人GM-CSF、人IL-6、人IL-2并用来自人胎盘、胎肝、外周血或另一来源的人免疫细胞接种的免疫缺陷小鼠或免疫缺陷转基因小鼠也可用于此类研究(Ito M等人,(2008)Curr Top Microbiol Immunol.;324:53-76;Ito R.,等人,(2012)Cellular&Molecular Immunology 9,208–214;Brehm等人,(2010)Curr Opin Endocrinol DiabetesObes.17(2):120–125;Zhou等人,(2013)Cancer Letters.344,13–19)。此类小鼠可与细胞系肿瘤或患者来源的人肿瘤异种移植物结合使用(Siolas等人,(2013)Cancer Res.;73(17):5315–5319)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例29:将Siglec-9抗体和/或双特异性抗体与针对抑制性检查点蛋白或抑制
如实施例28中所述,将8周龄(+/-2周龄)的15只C57B16/NTac小鼠组用肿瘤细胞皮下激发。在植入前将动物用异氟烷麻醉。从第2天开始,在第3天、第6天和第9天将小鼠用200ug抗Siglec-9抗体单独或与针对检查点蛋白的抗体(例如,抗PDL1 mAb克隆10F.9G2和/或抗CTLA4 mAb克隆UC10-4F10-11)组合每3天4个剂量i.p.注射。处理组包括抗Siglec-9;抗CTLA-4;抗PDL1;抗Siglec-9+抗CTLA4;抗Siglec-9+抗PDL1;以及同种型对照。用卡尺每两周监测肿瘤生长以在第4天开始测量肿瘤生长。实验的终点是2000mm
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例30:将Siglec-9抗体和/或双特异性抗体与活化刺激性检查点蛋白的抗体
如实施例28中所述,将8周龄(+/-2周龄)的15只C57B16/NTac小鼠组用肿瘤细胞皮下激发。在植入前将动物用异氟烷麻醉。从第2天开始,在第3天、第6天和第9天将小鼠用200ug抗Siglec-9抗体单独或与活化刺激性检查点蛋白的激动性抗体(例如OX40或ICOSmAb)组合每3天4个剂量i.p.注射。用卡尺每两周监测肿瘤生长以在第4天开始测量肿瘤生长。实验的终点是2000mm
表达人IL-3、人GM CSF、人IL-6、人Il2并用来自人胎盘、胎肝、外周血或另一来源的人免疫细胞接种的免疫缺陷小鼠或免疫缺陷转基因小鼠也可用于此类研究(Ito M等人,(2008)Curr Top Microbiol Immunol.;324:53-76;Ito R.,等人,(2012)Cellular&Molecular Immunology 9,208–214;Brehm等人,(2010)Curr Opin Endocrinol DiabetesObes.17(2):120–125;Zhou等人,(2013)Cancer Letters.344,13–19)。此类小鼠可与细胞系肿瘤或患者来源的人肿瘤异种移植物结合使用(Siolas等人,(2013)Cancer Res.;73(17):5315–5319)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有人Siglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例31:将Siglec-9抗体和/或双特异性抗体与刺激性细胞因子组合的组合疗
如实施例28中所述,将8周龄(+/-2周龄)的15只C57B16/NTac小鼠组用肿瘤细胞皮下激发。在植入前将动物用异氟烷麻醉。从第2天开始,将小鼠用200ug抗Siglec-9抗体单独或与刺激性细胞因子(例如IL-12、IFN-a)组合每3天4个剂量i.p.注射。用卡尺每两周监测肿瘤生长以在第4天开始测量肿瘤生长。实验的终点是2000mm
表达人IL-3、人GM CSF、人IL-6、人Il2并用来自人胎盘、胎肝、外周血或另一来源的人免疫细胞接种的免疫缺陷小鼠或免疫缺陷转基因小鼠也可用于此类研究(Ito M等人,(2008)Curr Top Microbiol Immunol.;324:53-76;Ito R.,等人,(2012)Cellular&Molecular Immunology 9,208–214;Brehm等人,(2010)Curr Opin Endocrinol DiabetesObes.17(2):120–125;Zhou等人,(2013)Cancer Letters.344,13–19)。此类小鼠可与细胞系肿瘤或患者来源的人肿瘤异种移植物结合使用(Siolas等人,(2013)Cancer Res.;73(17):5315–5319)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例32:Siglec-9抗体和/或双特异性抗体Fab刺激先天免疫细胞的存活力的能
在先天免疫细胞(例如巨噬细胞、嗜中性粒细胞和NK细胞)中评价板结合的交联抗Siglec-9抗体Fab片段的激动功能性。
巨噬细胞、嗜中性粒细胞和NK细胞在M-CSF和板结合的Siglec-9抗体Fab存在下培养,并测量细胞存活力。
将源自人单核细胞的巨噬细胞、嗜中性粒细胞、NK细胞和DC以及源自人单核细胞的T细胞和人小胶质细胞接种在用12.5nM或100nM交联Siglec-9 Fab预先涂覆的未经组织培养物处理的96孔板上。将细胞在10ng/ml M-CSF存在下培养48小时。使用
实施例33:Siglec-9抗体和/或双特异性抗体调节NFAT依赖性基因的能力的分析
在NFAT(活化的T细胞的核因子)启动子控制下,使用荧光素酶报道基因评价拮抗性抗Siglec-9抗体活化NFAT依赖性基因的能力。
将源自表达含有ITAM基序的共受体DAP12及其配体结合配偶体TREM2的小鼠T淋巴细胞BW5147.G.1.4(
实施例34:Siglec-9抗体和/或双特异性抗体的抗中风作用的分析
大脑中动脉(MCAO)的瞬时闭塞-一种非常类似于人中风的模型被用于诱导小鼠的脑梗塞。将单丝(70SPRe,Doccol Corp,USA)通过右颈总动脉的切口引入颈内动脉中。将大脑中动脉闭塞30分钟,伴随再灌注时间范围(6小时、12小时、24小时、2天、7天和28天)。在第12小时和第7天时使用假手术动物控制手术的作用。假手术动物经历相同的手术程序而不闭塞大脑中动脉。测试用拮抗性抗Siglec-9抗体或对照抗体处理的MCAO动物的梗塞体积、急性炎性应答(12小时再灌注)、促炎性细胞因子TNFa、IL-1a和IL-1b的转录、小神经胶质细胞活性(CD68、Iba1)、趋化因子CCL2(MCP1)、CCL3(MIP1a和趋化因子受体CX3CR1的转录以及CD3阳性T细胞的侵袭(Sieber等人(2013)PLoS ONE 8(1):e52982.doi:10.1371/journal.pone.0052982.)。这种实验可在一般小鼠或可替代地表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例35:抗Siglec-9抗体和/或双特异性抗体的抗阿尔茨海默氏病作用的分析
为了评价拮抗性抗Siglec-9抗体延迟、预防或逆转阿尔茨海默氏病(AD)的发展的能力,使用了5X FAD小鼠。5X FAD小鼠过度表达具有瑞典(K670N,M671L)、佛罗里达(I716V)和伦敦(V717I)家族性阿尔茨海默氏病(FAD)突变的突变体人APP(695)以及携带两种FAD突变M146L和L286V的人PS1。这两种转基因都受小鼠Thy1启动子调控,以驱动大脑上的过度表达并概述AD的主要特征。用组织提取物的免疫组织化学和通过ELISA测试了用激动性抗Siglec-9抗体或用对照抗体处理的小鼠的Aβ斑块负载。将它们针对脑中小神经胶质细胞的数目以及针对使用Morris水迷宫(一种空间学习和记忆任务)、八臂水迷宫(一种空间学习和记忆任务)、Y迷宫(将自发更迭量化为空间认知的量度)、在旷场中的新颖性偏好、评估学习和记忆的操作性学习以及恐惧条件反射(mousebiology.org网站;Wang等人,(2015)Cell.pii:S0092-8674(15)00127-0)的认知缺陷进行测试。这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例36:Siglec-9抗体和/或双特异性抗体在呼吸道感染中的保护作用的分析
为了评价拮抗剂Siglec-9抗体延迟、预防或治疗细菌呼吸道感染的能力,使用了涉及用肺炎链球菌(Streptococcus pneumoniae)激发C57B16小鼠的临床前小鼠模型。此模型涉及如所描述(参见例如Sharif O等人,2014 PLoS Pathog.2014年6月;10(6):e1004167;以及Schabbauer G等人,2010J Immunol 185:468–476),鼻内(i.n.)施用105个CFU肺炎链球菌血清型3(ATCC 6303)。在此模型中,大约90%的WT C57B16小鼠在感染后6天内死于感染。
将10至15只小鼠/组用肺炎链球菌激发,并且从第0天开始每隔一天用拮抗剂抗Siglec-9抗体伴随处理。第一剂量的抗Siglec-9抗体在用肺炎链球菌激发前3小时施用。每天监测小鼠持续15天以检查死亡事件。确定在细菌激发后存活的小鼠的%。
在单独实验中,还测定血液和肺中的细菌负荷和细胞因子表达的计数。在感染后24或48小时,将血液收集在含有EDTA的管中,并涂铺在琼脂板上以计算血浆中的细菌CFU。通过ELISA将血浆储存在-20℃下以进行细胞因子分析。收获肺,均质化并涂铺在琼脂板上以计算细菌CFU,或在裂解缓冲液中孵育30分钟并分析上清液的细胞因子测量值。
在单独的实验中,在细菌感染后40小时收集肺,将其固定在10%福尔马林中,并包埋在石蜡中用于H&E病理学分析。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例37:Siglec-9抗体和/或双特异性抗体在脓毒症中的保护作用的分析
为了评价拮抗剂Siglec-9抗体延迟、预防或治疗败血症的能力,使用了涉及用LPS全身激发C57B16小鼠的临床前小鼠模型。此模型涉及如所描述(参见例如,Gawish R等人,2014 FASEB J)腹膜内(i.p.)施用37mg/ml LPS。在此模型中,>95%WT C57Bl6小鼠在LPS注射后40小时内死于感染。
将小鼠群组用LPS激发,并且从第0天开始每天用拮抗剂抗Siglec-9抗体伴随处理。第一剂量的抗Siglec-9抗体在用LPS激发前3小时施用。在白天约每4小时监测小鼠,以检查死亡事件。确定从LPS激发存活的小鼠的百分比。
在单独的实验中,收集腹膜灌洗液(PLF)。将上清液储存在-20℃下以用于通过ELISA进行细胞因子分析;对沉淀的细胞计数以定量腹腔内募集的炎性细胞。可进行类似的研究以测试Siglec-9抗体在其它感染模型中的功效(参见例如,Sun等人,(2013)InvestOphthalmol Vis Sci.17;54(5):3451-62)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例38:Siglec-9抗体和/或双特异性抗体在急性和慢性结肠炎中的保护作用
为了评价拮抗剂抗Siglec-9抗体延迟、预防或治疗结肠炎的能力,使用了急性或慢性结肠炎的临床前小鼠模型。对于DSS诱导的结肠炎,小鼠在饮用水中自由接受3%DSS持续8天。对于TNBS诱导的结肠炎,将小鼠麻醉并用直肠内注射3mg于20%乙醇(vol/vol)中的TNBS或作为对照的单独媒介物进行处理。对于慢性结肠炎模型,将所有小鼠用3个循环的2%DSS处理5天,随后10天恢复期。对于所有模型,每天监测重量减轻、粪便稠度和大便潜血的存在并将其用于计算疾病活动指数,如所描述(参见例如,Correale C,2013,Gastroenterology,2013年2月,第346-356页.e3)。
从第0天开始每天用拮抗剂抗Siglec-9抗体处理小鼠群组,并进行DSS或TNBS施用。如所描述(参见例如,S.Vetrano,Gastroenterology,135(2008),第173–184页),每天监测小鼠以检查重量减轻、粪便稠度并且大便潜血的存在并将其用于计算疾病活动指数。
在单独的实验中,收集粘膜损伤的内窥镜和组织学图像以评价炎性细胞浸润和粘膜损伤。可进行类似的研究以测试Siglec-9抗体在其它自身免疫性(包括克罗恩氏病、炎性肠病和溃疡性结肠炎)模型中的益处(参见例如,Low等人,(2013)Drug Des Devel Ther.;7:1341-1357;以及Sollid等人,(2008)PLoS Med 5(9):e198)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例39:Siglec-9抗体和/或双特异性抗体在伤口愈合中的保护作用的分析
为了评价激动性抗Siglec-9抗体在损伤后增加结肠创伤修复的能力,使用结肠中活检损伤的小鼠模型。在此模型中,将具有外操作鞘的内窥镜插入到中降结肠中,并且检查粘膜到非直肠连接处。然后,用直径为3French的柔性活检钳除去整个粘膜和粘膜下层的单个全厚度区域,避免固有肌层的穿透。将每只小鼠在沿结肠背侧的3-5个部位进行活检损伤(参见例如,Seno H,2008,Proc Natl Acad Sci U S A.2009年1月6日;106(1):256-261)。
在活检损伤后2或3天用激动剂抗Siglec-9抗体处理小鼠群组。每天监测小鼠持续15天,以通过测量损伤的表面积来检查重量减轻和伤口愈合。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例40:Siglec-9抗体和/或双特异性抗体在视网膜变性中的保护作用的分析
AMD是外视网膜的退行性疾病。认为炎症,特别是炎性细胞因子和巨噬细胞、嗜中性粒细胞和/或NK细胞促成AMD疾病进展。
在玻璃疣、布鲁赫氏膜(Bruch’s membrane)、脉络膜和视网膜中记录了AMD病变附近的巨噬细胞、嗜中性粒细胞和NK细胞的存在。巨噬细胞、嗜中性粒细胞和NK细胞释放组织因子(TF)和血管内皮生长因子(VEGF),这触发显示脉络膜新生血管化患者中新血管形成的扩大。
存在于黄斑脉络膜中的巨噬细胞的类型随年龄而变化,从而显示与年轻人的眼睛相比,老年人眼中升高水平的M2巨噬细胞、嗜中性粒细胞和NK细胞。然而,与相似年龄的正常解剖眼睛相比,晚期AMD黄斑具有更高的M1至M2定量。(参见例如,Cao X等人,(2011),Pathol Int 61(9):pp528-35)。这表明在AMD进展的晚发中,眼内经典M1巨噬细胞活化之间存在联系。
视网膜小神经胶质细胞是通常也存在于内层视网膜中的组织驻留巨噬细胞。在损伤的情况下,小神经胶质细胞可被活化并充当炎症介体。已在AMD组织样品中检测到活化的小神经胶质细胞,并已被认为是导致AMD发病机制的炎性过程的一个潜在促成因子(Gupta等人,(2003)Exp Eye Res.,76(4):463-71.)。在一个或多个AMD模型中测试了Siglec-9抗体预防、延迟或逆转AMD的能力(参见例如,Pennesi等人,(2012)Mol Aspects Med.;33(4):487–509)。
记载总炎性巨噬细胞、嗜中性粒细胞和NK细胞(M1和/或活化的小神经胶质细胞)与AMD疾病进展相关,且因此代表拮抗剂Siglec-9抗体的治疗靶标。可在青光眼和遗传形式或视网膜变性如视网膜色素变性中获得类似的治疗益处。
在青光眼模型中测试了Siglec-9抗体预防、延迟或逆转青光眼中的视网膜神经节细胞变性的能力(参见例如,El-Danaf等人,(2015).J Neurosci.11;35(6):2329-43)。同样地,如Chang等人,(2002)Vision Res.;42(4):517-25和“Retinal Degeneration RatModel Resource Availability of P23H and S334ter Mutant Rhodopsin TransgenicRats and RCS Inbred and RCS Congenic Strains of Rats,”MM LaVail,2011年6月30日中所描述对REM2在遗传诱导的视网膜变性和视网膜色素变性中的治疗益处进行测试。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例41:Siglec-9抗体和/或双特异性抗体在脂肪形成和饮食诱导的肥胖症中
为了测试Siglec-9抗体在脂肪形成和肥胖症中的作用,使用高脂肪饮食(HFD)的小鼠模型(参见例如,Park等人,(2015)Diabetes.64(1):117-27)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例42:拮抗剂Siglec-9抗体和/或双特异性抗体在骨质疏松症中的保护作用
骨是不断重塑以支持钙稳态和结构需求的动态器官。破骨细胞是负责除去骨的有机和无机组分的细胞。破骨细胞来源于巨噬细胞谱系中的造血祖细胞并且响应于NFκB配体的肿瘤坏死因子家族细胞因子受体活化因子而分化。破骨细胞(唯一的骨再吸收细胞)对骨质疏松症的发病机理和骨质疏松症至关重要(Novack等人,(2008)Annual Rev Pathol.,3:457-84)。
骨质疏松症是一种进行性骨疾病,其特征在于骨质量和密度的降低,可导致骨折风险增加。它主要表现在绝经后的前几年,当骨转换加速时,破骨细胞和成骨细胞两者的活性增加。然而,由于再吸收和合成过程的不平衡,净作用是骨质流失,主要是骨小梁。因此,骨质疏松症中最普遍的骨折部位是腕关节、股骨颈和椎体,其中骨小梁结构是整体骨强度的关键。
如在缺乏DAP12 ITAM信号转导适体并且导致破骨细胞样细胞分化的显著缺陷的动物模型中所观察到,破骨细胞功能降低导致骨质疏松症,伴随骨量增加和骨髓空间消除(Koga等人,(2004)Nature 428:758–763)。
因此,施用本公开的拮抗剂抗Siglec-9抗体可预防骨质疏松症、降低骨质疏松症的风险和/或治疗骨质疏松症。在一些实施方案中,施用激动剂抗Siglec-9抗体可诱导患有骨质疏松症的个体中的一种或多种Siglec-9活性(例如,DAP12磷酸化、Syk活化和加速分化成破骨细胞)(Peng等人(2010).Sci Signal.2010 18;3 122;以及Humphrey等人,(2006)JBone Miner Res.,21(2):237-45)。
这种实验也可在表达来自细菌人工染色体或来自由骨髓启动子驱动的cDNA的人Siglec-9基因的小鼠中或在用含有hSiglec-9 cDNA的慢病毒或AAV病毒转导的小鼠中进行。
实施例43:Siglec-9抗体和/或双特异性抗体调节Siglec-9与SHP1、SHP2和其它信
用PBS-EDTA从组织培养皿中移出人原代单核细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、T细胞、小神经胶质细胞或破骨细胞,用PBS洗涤并计数。将细胞与抗Siglec-9抗体和/或Siglec-9双特异性抗体或与同种型匹配的对照抗体以1μg/10
实施例44:对Siglec-9抗体和/或双特异性抗体增强NK细胞的肿瘤细胞杀伤的能
使用RosetteSep人NK细胞富集混合物(STEMCELL Technologies)从人血液分离天然杀伤细胞。将分离的细胞在补充有10%Hyclone胎牛血清(GE Healthcare)、2%Hepes、2%GlutaMAX、2%青霉素-链霉素、2%丙酮酸钠和2%MEM非必需氨基酸(LifeTechnologies)的RPMI 1640(Mediatech)中培养。将NK细胞以25ng/ml IL-2(R&D)和25ng/ml IL-21(Peprotech)以1x10
培养后第7天,收获NK细胞并以1x10
实施例45:Siglec-9抗体分箱的分析
使用RosetteSep
在第5天,收获粘附的单核细胞源性的巨噬细胞并以100,000个细胞/孔涂铺在96孔U底非TC处理的板中。在含有1%BSA和2mM EDTA的PBS中的人Fc受体结合抑制剂(eBioscience)存在下,将5μg/ml纯化的Siglec-9抗体与细胞一起孵育。将样品在冰上孵育30分钟并在缓冲液中洗涤2次。以5μg/ml添加直接荧光团缀合的Siglec-9抗体,并在冰上孵育30分钟,随后在缓冲液中洗涤2次。在iQue筛选仪(IntelliCyt)上通过流式细胞术测定在结合的Siglec-9抗体、同种型或未处理的存在下缀合的Siglec-9抗体克隆结合细胞表面受体的能力,并用FlowJo软件(TreeStar)分析以确定克隆的竞争。所使用的缀合的抗Siglec-9抗体是:E10286(BD Biosciences)、K8(BioLegend)和191240(R&D Systems)。所使用的结合抗Siglec-9抗体是:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。
结果描绘于表12中。
表12:Siglec-9抗体分箱
结果表明Siglec-9抗体5C6、12B12和17C2与抗体2D4、2D5、5B1和7H12处于不同分箱内。结果与实施例1中的结果一致。
实施例46:抗Siglec-9和抗PD1抗体组合治疗的体内作用
在植入人源化小鼠之前,将CTG-0202患者来源的黑色素瘤肿瘤首先在预研究动物中传代。当储备动物中肿瘤达到1-1.5cm
将免疫受损的雌性小鼠(Taconic NOG)用胎儿肝来源的CD34
表13:用于Siglec-9抗体2D4的体内癌症功效研究的抗体给药方案和施用途径
在表13中,“n”是指每个处理组中的小鼠数量;“CTR mAb”是指同种型对照抗体;“2D4”是指抗Siglec-9抗体2D4;“ROA”是指施用途径;“IP”是指腹膜内;“q5dx6”是指每五天施用总共六个剂量的给药方案。
从第0天开始,每天观察小鼠并使用数字秤每周称量两次。每周通过数字卡尺测量肿瘤尺寸两次,并记录每组的数据,包括个体肿瘤体积和平均估计肿瘤体积(平均TV±SEM)。使用公式(1)计算肿瘤体积:TV=宽度2x长度x0.52。当对照组的平均肿瘤体积在第28天达到1500mm
在研究终止时,将收获的肿瘤在冰包装上的培养基中过夜运输并在第二天处理。将肿瘤样品在37℃下用胶原酶处理30分钟。将样品通过细胞过滤器解离并重新悬浮于PBS中的2%FBS中。将全血样品中的红细胞使用ACK裂解缓冲液裂解,且然后将细胞在PBS中的2%FBS中洗涤两次。使用血细胞计数器对细胞进行计数,并将一百万个细胞用荧光染料缀合的抗体在冰上染色30分钟,然后用PBS中的2%FBS洗涤。将细胞用PBS中的4%多聚甲醛固定。将所有染色的细胞在FACS Canto(BD Biosciences)上分析并且用FlowJo软件(TreeStar)分析数据。为了鉴定肿瘤浸润免疫细胞,根据标准程序使用hCD45、hCD3、hCD4、hCD8和hCD14抗体来对群体进行门控。
如图15B和15C中所示,使用Siglec-9抗体2D4和抗PD-1抗体
如图15D中所示,使用Siglec-9抗体2D4和抗PD-1抗体
如图15E中所示,使用Siglec-9抗体2D4和抗PD-1抗体
如图15F中所示,使用Siglec-9抗体2D4和抗PD-1抗体
如图15G中所示,使用Siglec-9抗体2D4和抗PD-1抗体
如图15H-15J中所示,用Siglec-9抗体2D4和抗PD-1抗体
对于本文描述的结果来说重要的是,肿瘤和对肿瘤应答的免疫系统两者都是人的。使用小鼠免疫系统经遗传消融和辐射清除骨髓的方法将小鼠的免疫系统人源化,然后用再生并发育骨髓和淋巴免疫细胞的人供体CD34
上述数据表明Siglec-9抗体2D4是外周和肿瘤浸润骨髓细胞上有效且显著的受体下调抗体。对循环和肿瘤浸润免疫细胞群体的分析表明CD3
更具体地,本申请提供下列各项:
1.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体降低Siglec-9的细胞水平。
2.如项1所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体降低Siglec-9的细胞水平而不抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。
3.如项1所述的抗Siglec-9抗体,其中所述抗体进一步抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。
4.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体降低Siglec-9的细胞水平并抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用。
5.如项1-4中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体降低Siglec-9的细胞表面水平、降低Siglec-9的细胞内水平、降低Siglec-9的总水平或其任何组合。
6.如项1-5中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体诱导Siglec-9降解、Siglec-9裂解、Siglec-9内化、Siglec-9脱落、Siglec-9表达下调或其任何组合。
7.如项1-6中任一项所述的抗Siglec-9抗体,其中所述抗体降低体内Siglec-9的细胞水平。
8.如项1-7中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体抑制Siglec-9的细胞表面簇集。
9.如项1-8中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体抑制一种或多种Siglec-9活性。
10.如项9所述的抗Siglec-9抗体,其中所述一种或多种Siglec-9活性选自由以下各项组成的组:
(a)Siglec-9与一种或多种Siglec-9配体的结合,任选地其中所述一种或多种Siglec-9配体选自由以下各项组成的组:含唾液酸的糖蛋白、含唾液酸的糖脂以及其任何组合;
(b)降低一种或多种细胞的增殖,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;
(c)抑制一种或多种细胞的迁移,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;
(d)抑制一种或多种细胞的一种或多种功能,所述一种或多种细胞选自由以下各项组成的组:树突细胞、骨髓源性树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、M1巨噬细胞、M1嗜中性粒细胞、M1 NK细胞、活化的M1巨噬细胞、活化的M1嗜中性粒细胞、活化的M1 NK细胞、M2巨噬细胞、M2嗜中性粒细胞、M2 NK细胞、单核细胞、破骨细胞、T细胞、T辅助细胞、细胞毒性T细胞、粒细胞、嗜中性粒细胞、小神经胶质细胞、M1小神经胶质细胞、活化的M1小神经胶质细胞以及M2小神经胶质细胞;
(e)抑制一种或多种类型的清除,所述清除选自由以下各项组成的组:凋亡神经元清除、神经组织碎片清除、功能障碍性突触清除、非神经组织碎片清除、细菌清除、其它异物清除、致病蛋白清除、致病肽清除以及肿瘤细胞清除;任选地,其中所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,并且所述肿瘤细胞来自选自由以下各项组成的组的癌症:膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤以及甲状腺癌;
(f)通过以下中的一种或多种抑制肿瘤细胞杀伤:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;
(g)抑制以下中的一种或多种的抗肿瘤细胞增殖活性:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;
(h)调节一种或多种炎性受体的表达,任选地其中所述一种或多种炎性受体包含CD86并且所述一种或多种炎性受体在以下中的一种或多种上表达:小神经胶质细胞、巨噬细胞、嗜中性粒细胞、NK细胞、树突细胞、骨髓源性树突状细胞、嗜中性粒细胞、T细胞、T辅助细胞或细胞毒性T细胞;
(i)促进或挽救以下中的一种或多种的功能性:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关嗜中性粒细胞、肿瘤相关NK细胞以及调控性T细胞;
(j)增加以下中的一种或多种浸润到肿瘤中:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关嗜中性粒细胞、肿瘤相关NK细胞、非致瘤性CD45
(k)增加肿瘤、外周血或其它淋巴器官中肿瘤促进骨髓细胞/粒细胞免疫抑制细胞和/或非致瘤性CD45
(l)增强骨髓源性抑制细胞和/或非致瘤性CD45
(m)增强非致瘤性骨髓源性抑制细胞和/或非致瘤性CD45
(n)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的活化;
(o)减少具有肿瘤杀伤潜力的肿瘤特异性NK细胞的浸润;
(p)增加肿瘤体积;
(q)增加肿瘤生长速率;以及
(r)降低一种或多种调节抗肿瘤T细胞应答的免疫疗法或一种或多种癌症疫苗的功效,任选地其中所述一种或多种免疫疗法是靶向一种或多种靶蛋白的免疫疗法,所述一种或多种靶蛋白选自由以下各项组成的组:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、TREM1、TREM2、CD39、CD73、CSF-1受体以及其任何组合。
11.如项1-8中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体展示一种或多种选自由以下各项组成的组的活性:
(a)增加肿瘤浸润CD3
(b)降低非致瘤性CD14
(c)减少非致瘤性CD14
(d)降低一种或多种细胞中的PD-L1水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(e)降低一种或多种细胞中的PD-L2水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(f)降低一种或多种细胞中的B7-H2水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(g)降低一种或多种细胞中的B7-H3水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(h)降低一种或多种细胞中的CD200R水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(i)降低一种或多种细胞中的CD163水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(j)降低一种或多种细胞中的CD206水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(k)降低实体肿瘤的肿瘤生长速率;
(l)减小肿瘤体积;
(m)提高一种或多种PD-1抑制剂的功效;
(n)提高一种或多种检查点抑制剂疗法和/或免疫调节疗法的功效,任选地其中所述一种或多种检查点抑制剂疗法和/或免疫调节疗法靶向以下中的一种或多种:CTLA4、腺苷途径、PD-L1、PD-L2、OX40、TIM3、LAG3或其任何组合;
(o)提高一种或多种化学治疗剂的功效,任选地其中所述化学治疗剂中的一种或多种是吉西他滨、卡培他滨、蒽环类、阿霉素
(p)在非致瘤性骨髓源性抑制细胞(MDSC)存在下增加T细胞的增殖。
(q)抑制非致瘤性骨髓源性抑制细胞的(MDSC)的分化、存活和/或一种或多种功能;以及
(r)当缀合至化学或放射性毒素时,杀死实体肿瘤和相关血管中表达CD33的免疫抑制非致瘤性骨髓细胞和/或非致瘤性CD14表达细胞。
12.如项1-11中任一项所述的抗Siglec-9抗体,其中所述一种或多种Siglec-9配体选自由以下各项组成的组:在红细胞上表达的Siglec-9配体、在细菌细胞上表达的Siglec-9配体、在凋亡细胞上表达的Siglec-9配体、在神经细胞上表达的Siglec-9配体、在神经胶质细胞上表达的Siglec-9配体、在小神经胶质细胞上表达的Siglec-9配体、在星形胶质细胞上表达的Siglec-9配体、在肿瘤细胞上表达的Siglec-9配体、在病毒上表达的Siglec-9配体、在树突细胞上表达的Siglec-9配体、与β淀粉样蛋白斑块结合的Siglec-9配体、与Tau缠结结合的Siglec-9配体、致病蛋白上的Siglec-9配体、致病肽上的Siglec-9配体、在巨噬细胞上表达的Siglec-9配体、在嗜中性粒细胞上表达的Siglec-9配体、在天然杀伤细胞上表达的Siglec-9配体、在单核细胞上表达的Siglec-9配体、在T细胞上表达的Siglec-9配体、在T辅助细胞上表达的Siglec-9配体、在细胞毒性T细胞上表达的Siglec-9配体、在B细胞上表达的Siglec-9配体、在肿瘤包埋的免疫抑制树突细胞上表达的Siglec-9配体、在肿瘤包埋的免疫抑制巨噬细胞上表达的Siglec-9配体、在骨髓源性抑制细胞上表达的Siglec-9配体、在调控性T细胞上表达的Siglec-9配体、分泌的粘蛋白、唾液酸、含唾液酸的糖脂、含唾液酸的糖蛋白、含α-2,8-二唾液酸的糖脂、含支链α-2,6-连接的唾液酸的糖蛋白、含末端α-2,6-连接的唾液酸的糖脂、含末端α-2,3-连接的唾液酸的糖蛋白以及双唾液酸神经节苷脂。
13.如项1-12中任一项所述的抗Siglec-9抗体,其中在选自选自由以下各项组成的组的原代细胞上或在细胞系上测量Siglec-9的细胞水平:树突细胞、骨髓源性树突细胞、单核细胞、小神经胶质细胞、巨噬细胞、嗜中性粒细胞以及NK细胞,并且其中使用体外细胞测定来测量Siglec-9的细胞水平。
14.如项1-13中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体不降低TREM2表达。
15.如项1-14中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合不连续的Siglec-9表位。
16.如项15所述的抗Siglec-9抗体,其中所述不连续的Siglec-9表位包含两种或更多种肽、三种或更多种肽、四种或更多种肽、五种或更多种肽、六种或更多种肽、七种或更多种肽、八种或更多种肽、九种或更多种肽或10种或更多种肽。
17.如项16所述的抗Siglec-9抗体,其中所述肽的每一种包含SEQ ID NO:1的氨基酸序列的5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个或20个或更多个氨基酸残基;或对应于SEQ ID NO:1的氨基酸序列的哺乳动物Siglec-9蛋白上的5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个或20个或更多个氨基酸残基。
18.如项1-14中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至Siglec-9的构象表位。
19.如项1-14中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347内的一个或多个氨基酸;或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347的氨基酸残基内的一个或多个氨基酸。
20.如项1-14中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至选自由以下各项组成的组的氨基酸残基内的一个或多个氨基酸:
i.SEQ ID NO:1的氨基酸残基62-76,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基62-76的氨基酸残基;
ii.SEQ ID NO:1的氨基酸残基62-76和86-92,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基;
iii.SEQ ID NO:1的氨基酸残基86-92,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基86-92的氨基酸残基;
iv.SEQ ID NO:1的氨基酸残基86-96,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基86-96的氨基酸残基;
v.SEQ ID NO:1的氨基酸残基86-96和105-116,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基;
vi.SEQ ID NO:1的氨基酸残基105-116,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基105-116的氨基酸残基;
vii.SEQ ID NO:1的氨基酸残基107-115,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基107-115的氨基酸残基;以及
viii.SEQ ID NO:1的氨基酸残基185-194,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基185-194的氨基酸残基。
21.如项1-14中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至一个或多个选自由以下各项组成的组的氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194,或哺乳动物Siglec-7蛋白上对应于选自由以下各项组成的组的氨基酸残基的一个或多个氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194。
22.如项1-21中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体与选自由2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、17C2以及其任何组合组成的组的一种或多种抗体竞争结合至Siglec-9。
23.如项1-22中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域、所述重链可变结构域或两者包含至少一个、两个、三个、四个、五个或六个HVR,所述HVR选自单克隆抗体的HVR-L1、HVR-L2、HVR-L3、HVR-H1、HVR-H2以及HVR-H3,所述单克隆抗体选自由以下各项组成的组:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2。
24.如项23所述的抗Siglec-9抗体,其中:
(a)所述HVR-L1包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列;或
(b)所述HVR-L2包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列;或
(c)所述HVR-L3包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列;或
(d)所述HVR-H1包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列;或
(e)所述HVR-H2包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列;或
(f)所述HVR-H3包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列。
25.如项23或24所述的抗Siglec-9抗体,其中:
(a)所述HVR-L1包含SEQ ID NO:6的氨基酸序列,所述HVR-L2包含SEQ ID NO:10的氨基酸序列,所述HVR-L3包含SEQ ID NO:14的氨基酸序列,所述HVR-H1包含SEQ ID NO:19的氨基酸序列,所述HVR-H2包含SEQ ID NO:22的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:26的氨基酸序列;或
(b)所述HVR-L1包含SEQ ID NO:7的氨基酸序列,所述HVR-L2包含SEQ ID NO:11的氨基酸序列,所述HVR-L3包含SEQ ID NO:15的氨基酸序列,所述HVR-H1包含SEQ ID NO:20的氨基酸序列,所述HVR-H2包含SEQ ID NO:23的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:27的氨基酸序列;或
(c)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:16的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:28的氨基酸序列;或
(d)所述HVR-L1包含SEQ ID NO:9的氨基酸序列,所述HVR-L2包含SEQ ID NO:13的氨基酸序列,所述HVR-L3包含SEQ ID NO:17的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:25的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:29的氨基酸序列;或
(e)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:18的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:28的氨基酸序列;或
(f)所述HVR-L1包含SEQ ID NO:172的氨基酸序列,所述HVR-L2包含SEQ ID NO:174的氨基酸序列,所述HVR-L3包含SEQ ID NO:176的氨基酸序列,所述HVR-H1包含SEQ IDNO:178的氨基酸序列,所述HVR-H2包含SEQ ID NO:180的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:182的氨基酸序列;或
(g)所述HVR-L1包含SEQ ID NO:173的氨基酸序列,所述HVR-L2包含SEQ ID NO:175的氨基酸序列,所述HVR-L3包含SEQ ID NO:177的氨基酸序列,所述HVR-H1包含SEQ IDNO:179的氨基酸序列,所述HVR-H2包含SEQ ID NO:181的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:183的氨基酸序列。
26.如项1-22中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:
(a)HVR-L1,其包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列,或与选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;
(b)HVR-L2,其包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列,或与选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及
(c)HVR-L3,其包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列,或与选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;并且
其中所述重链可变结构域包含:
(a)HVR-H1,其包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列,或与选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;
(b)HVR-H2,其包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列,或与选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及
(c)HVR-H3,其包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列,或与选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列。
27.如项1-22中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域,所述轻链可变结构域包含选自由SEQ ID NO:61-115和197-204组成的组的氨基酸序列;和/或重链可变结构域,所述重链可变结构域包含选自由SEQ ID NO:116-170和205-212组成的组的氨基酸序列。
28.如项1-22中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中:
(a)所述轻链可变结构域包含SEQ ID NO:61的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:116的氨基酸序列;或
(b)所述轻链可变结构域包含SEQ ID NO:72的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:127的氨基酸序列;或
(c)所述轻链可变结构域包含SEQ ID NO:83的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:138的氨基酸序列;或
(d)所述轻链可变结构域包含SEQ ID NO:94的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:149的氨基酸序列;或
(e)所述轻链可变结构域包含SEQ ID NO:105的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:160的氨基酸序列;或
(f)所述轻链可变结构域包含SEQ ID NO:197的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:205的氨基酸序列;或
(g)所述轻链可变结构域包含SEQ ID NO:201的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:210的氨基酸序列。
29.如项1-22中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含选自由以下各项组成的组的单克隆抗体的轻链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2;和/或选自由以下各项组成的组的单克隆抗体的重链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。
30.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347内的一个或多个氨基酸;或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基20-347、20-140、141-347、146-347、146-229、236-336或146-347的氨基酸残基内的一个或多个氨基酸。
31.如项30所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至选自由以下各项组成的组的氨基酸残基内的一个或多个氨基酸:
i.SEQ ID NO:1的氨基酸残基62-76,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基62-76的氨基酸残基;
ii.SEQ ID NO:1的氨基酸残基62-76和86-92,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基62-76和86-92的氨基酸残基;
iii.SEQ ID NO:1的氨基酸残基86-92,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基86-92的氨基酸残基;
iv.SEQ ID NO:1的氨基酸残基86-96,或哺乳动物Siglec-9蛋白上对应于SEQ IDNO:1的氨基酸残基86-96的氨基酸残基;
v.SEQ ID NO:1的氨基酸残基86-96和105-116,或哺乳动物Siglec-9蛋白上对应于SEQ ID NO:1的氨基酸残基86-96和105-116的氨基酸残基;
vi.SEQ ID NO:1的氨基酸残基105-116,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基105-116的氨基酸残基;
vii.SEQ ID NO:1的氨基酸残基107-115,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基107-115的氨基酸残基;以及
viii.SEQ ID NO:1的氨基酸残基185-194,或哺乳动物Siglec-9蛋白上对应于SEQID NO:1的氨基酸残基185-194的氨基酸残基。
32.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体结合至一个或多个选自由以下各项组成的组的氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194,或哺乳动物Siglec-7蛋白上对应于选自由以下各项组成的组的氨基酸残基的一个或多个氨基酸残基:SEQ ID NO:1的L22、H48、W50、I51、Y52、K123、I126、D189、P190、R194。
33.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域、所述重链可变结构域或两者包含至少一个、两个、三个、四个、五个或六个HVR,所述HVR选自单克隆抗体的HVR-L1、HVR-L2、HVR-L3、HVR-H1、HVR-H2以及HVR-H3,所述单克隆抗体选自由以下各项组成的组:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12以及17C2。
34.如项33所述的抗Siglec-9抗体,其中:
(a)所述HVR-L1包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列;或
(b)所述HVR-L2包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列;或
(c)所述HVR-L3包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列;或
(d)所述HVR-H1包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列;或
(e)所述HVR-H2包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列;或
(f)所述HVR-H3包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列。
35.如项33或项34所述的抗Siglec-9抗体,其中:
(a)所述HVR-L1包含SEQ ID NO:6的氨基酸序列,所述HVR-L2包含SEQ ID NO:10的氨基酸序列,所述HVR-L3包含SEQ ID NO:14的氨基酸序列,所述HVR-H1包含SEQ ID NO:19的氨基酸序列,所述HVR-H2包含SEQ ID NO:22的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:26的氨基酸序列;或
(b)所述HVR-L1包含SEQ ID NO:7的氨基酸序列,所述HVR-L2包含SEQ ID NO:11的氨基酸序列,所述HVR-L3包含SEQ ID NO:15的氨基酸序列,所述HVR-H1包含SEQ ID NO:20的氨基酸序列,所述HVR-H2包含SEQ ID NO:23的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:27的氨基酸序列;或
(c)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:16的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:28的氨基酸序列;或
(d)所述HVR-L1包含SEQ ID NO:9的氨基酸序列,所述HVR-L2包含SEQ ID NO:13的氨基酸序列,所述HVR-L3包含SEQ ID NO:17的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:25的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:29的氨基酸序列;或
(e)所述HVR-L1包含SEQ ID NO:8的氨基酸序列,所述HVR-L2包含SEQ ID NO:12的氨基酸序列,所述HVR-L3包含SEQ ID NO:18的氨基酸序列,所述HVR-H1包含SEQ ID NO:21的氨基酸序列,所述HVR-H2包含SEQ ID NO:24的氨基酸序列,并且所述HVR-H3包含SEQ IDNO:28的氨基酸序列;或
(f)所述HVR-L1包含SEQ ID NO:172的氨基酸序列,所述HVR-L2包含SEQ ID NO:174的氨基酸序列,所述HVR-L3包含SEQ ID NO:176的氨基酸序列,所述HVR-H1包含SEQ IDNO:178的氨基酸序列,所述HVR-H2包含SEQ ID NO:180的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:182的氨基酸序列;或
(g)所述HVR-L1包含SEQ ID NO:173的氨基酸序列,所述HVR-L2包含SEQ ID NO:175的氨基酸序列,所述HVR-L3包含SEQ ID NO:177的氨基酸序列,所述HVR-H1包含SEQ IDNO:179的氨基酸序列,所述HVR-H2包含SEQ ID NO:181的氨基酸序列,并且所述HVR-H3包含SEQ ID NO:183的氨基酸序列。
36.如项33所述的抗Siglec-9抗体,其中所述轻链可变结构域包含:
(a)HVR-L1,其包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列,或与选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;
(b)HVR-L2,其包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列,或与选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及
(c)HVR-L3,其包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列,或与选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;并且
其中所述重链可变结构域包含:
(a)HVR-H1,其包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列,或与选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;
(b)HVR-H2,其包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列,或与选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及
(c)HVR-H3,其包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列,或与选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列。
37.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域,所述轻链可变结构域包含选自由SEQ ID NO:61-115和197-204组成的组的氨基酸序列;和/或重链可变结构域,所述重链可变结构域包含选自由SEQ ID NO:116-170和205-212组成的组的氨基酸序列。
38.如项37所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,并且其中:
(a)所述轻链可变结构域包含SEQ ID NO:61的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:116的氨基酸序列;或
(b)所述轻链可变结构域包含SEQ ID NO:72的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:127的氨基酸序列;或
(c)所述轻链可变结构域包含SEQ ID NO:83的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:138的氨基酸序列;或
(d)所述轻链可变结构域包含SEQ ID NO:94的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:149的氨基酸序列;或
(e)所述轻链可变结构域包含SEQ ID NO:105的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:160的氨基酸序列;或
(f)所述轻链可变结构域包含SEQ ID NO:197的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:205的氨基酸序列;或
(g)所述轻链可变结构域包含SEQ ID NO:201的氨基酸序列;并且所述重链可变结构域包含SEQ ID NO:210的氨基酸序列。
39.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含选自由以下各项组成的组的单克隆抗体的轻链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2;和/或选自由以下各项组成的组的单克隆抗体的重链可变结构域:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。
40.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体与选自由2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12、77C2以及其任何组合组成的组的一种或多种抗体竞争结合至Siglec-9。
41.一种分离的抗Siglec-9抗体,所述抗Siglec-9抗体与选自由以下各项组成的组的单克隆抗体结合实质上相同的Siglec-9表位:2D4、2D5、5B1、6B2、6D8、7H12、5C6、12B12和17C2。
42.一种分离的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含轻链可变结构域和重链可变结构域,其中所述轻链可变结构域包含:
(a)HVR-L1,其包含选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列,或与选自由SEQ ID NO:6-9、172和173组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;
(b)HVR-L2,其包含选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列,或与选自由SEQ ID NO:10-13、174和175组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及
(c)HVR-L3,其包含选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列,或与选自由SEQ ID NO:14-18、176和177组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;并且
其中所述重链可变结构域包含:
(a)HVR-H1,其包含选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列,或与选自由SEQ ID NO:19-21、178和179组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;
(b)HVR-H2,其包含选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列,或与选自由SEQ ID NO:22-25、180和181组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列;以及
(c)HVR-H3,其包含选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列,或与选自由SEQ ID NO:26-29、182和183组成的组的氨基酸序列具有至少约90%同源性的氨基酸序列。
43.如项1-42中任一项所述的抗Siglec-9抗体,其中所述抗体具有IgG类、IgM类或IgA类。
44.如项43所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体具有IgG1、IgG2、IgG3或IgG4同种型。
45.如项44所述的抗Siglec-9抗体,其中所述抗体结合抑制性Fc受体。
46.如项45所述的抗Siglec-9抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
47.如项46所述的抗Siglec-9抗体,其中:
(a)所述抗Siglec-9抗体具有人或小鼠IgG1同种型,并且包含在Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:N297A、D265A、D270A、L234A、L235A、G237A、P238D、L328E、E233D、G237D、H268D、P271G、A330R、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E、N297Q、P238S、P238A、A327Q、A327G、P329A、K322A、T394D以及其任何组合,其中所述残基的编号根据EU编号,或包含在所述Fc区中在对应于甘氨酸236的位置处的氨基酸缺失;
(b)所述抗Siglec-9抗体具有IgG1同种型并且包含IgG2同种型重链恒定结构域1(CH1)和铰链区,任选地其中所述IgG2同种型CH1和铰链区包含ASTKGPSVFP LAPCSRSTSESTAALGCLVK DYFPEPVTVS WNSGALTSGVHTFPAVLQSS GLYSLSSVVT VPSSNFGTQT YTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:171)的氨基酸序列,并且任选地其中所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中所述残基的编号根据EU编号;
(c)所述抗Siglec-9抗体具有IgG2同种型并且包含在所述Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:P238S、V234A、G237A、H268A、H268Q、V309L、A330S、P331S、C214S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E、H268E、N297A、N297Q、A330L以及其任何组合,其中所述残基的编号根据EU编号;
(d)所述抗Siglec-9抗体具有人或小鼠IgG4同种型并且包含在所述Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E、E233P、F234V、L234A/F234A、S228P、S241P、L248E、T394D、N297A、N297Q、L235E以及其任何组合,其中所述残基的编号根据EU编号;或
(e)所述抗Siglec-9抗体具有杂合IgG2/4同种型,并且任选地其中所述抗体包含氨基酸序列,所述氨基酸序列包含人IgG2的氨基酸118至260和人IgG4的氨基酸261至447,其中所述残基的编号根据EU编号。
48.如项44所述的抗Siglec-9抗体,其中:
(a)所述抗Siglec-9抗体具有人或小鼠IgG1同种型,并且包含在所述Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:N297A、N297Q、D270A、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E以及其任何组合,其中所述残基的编号根据EU编号;
(b)所述抗Siglec-9抗体具有IgG2同种型并且包含在所述Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:P238S、V234A、G237A、H268A、H268Q、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E以及其任何组合,其中所述残基的编号根据EU编号;或
(c)所述抗Siglec-9抗体具有IgG4同种型并且包含在所述Fc区中在选自由以下各项组成的组的残基位置处的一种或多种氨基酸取代:E233P、F234V、L234A/F234A、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q以及其任何组合,其中所述残基的编号根据EU编号。
49.如项48所述的抗Siglec-9抗体,其中:
(a)所述Fc区还包含在选自由A330L、L234F、L235E、P331S以及其任何组合组成的组的位置处的一种或多种另外的氨基酸取代,其中所述残基的编号根据EU编号;
(b)所述Fc区还包含在选自由M252Y、S254T、T256E以及其任何组合组成的组的位置处的一种或多种另外的氨基酸取代,其中所述残基的编号根据EU编号;或
(c)所述Fc区还包含根据EU编号的S228P氨基酸取代。
50.如项1-42中任一项所述的抗Siglec-9抗体,其中所述抗体具有IgG4同种型。
51.如项50所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体包含在残基位置228处的S228P氨基酸取代、在残基位置234处的F234A氨基酸取代以及在残基位置235处的L235A氨基酸取代,其中所述残基位置的编号根据EU编号。
52.如项1-51中任一项所述的抗Siglec-9抗体,其中所述Siglec-9蛋白是哺乳动物蛋白或人蛋白。
53.如项1-52中任一项所述的抗Siglec-9抗体,其中所述Siglec-9蛋白是野生型蛋白。
54.如项1-52中任一项所述的抗Siglec-9抗体,其中所述Siglec-9蛋白是天然存在的变体。
55.如项1-54中任一项所述的抗Siglec-9抗体,其中所述Siglec-9蛋白在选自由以下各项组成的组的一种或多种细胞上表达:人树突细胞、人巨噬细胞、人嗜中性粒细胞、人NK细胞、人单核细胞、人破骨细胞、人T细胞、人T辅助细胞、人细胞毒性T细胞、人粒细胞以及人小神经胶质细胞。
56.如项1-55中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体特异性地结合至哺乳动物Siglec-9蛋白、人Siglec-9蛋白或两者。
57.如项1-56中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体以pH依赖性方式结合Siglec-9。
58.如项57所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体在5.5至8.0范围内的pH下结合Siglec-9。
59.如项57所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体在小于5.0的pH下从Siglec-9解离。
60.如项1-59中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体是结合至包含人Siglec-9或哺乳动物Siglec-9蛋白上的氨基酸残基的表位的抗体片段。
61.如项1-59中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体是结合至选自由以下各项组成的组的一种或多种人蛋白质的抗体片段:人Siglec-9、人Siglec-9的天然存在的变体和人Siglec-9的疾病变体。
62.如项60或项61所述的抗Siglec-9抗体,其中所述抗体片段与第二抗体片段交联,所述第二抗体片段结合至选自由以下各项组成的组的一种或多种人蛋白质:人Siglec-9、人Siglec-9的天然存在的变体和人Siglec-9的疾病变体。
63.如项60-62中任一项所述的抗Siglec-9抗体,其中所述片段是Fab、Fab'、Fab'-SH、F(ab')2、Fv或scFv片段。
64.如项1-63中任一项所述的抗Siglec-9抗体,其中所述Siglec-9抗体是鼠抗体。
65.如项1-63中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体是人源化抗体、双特异性抗体、单克隆抗体、多价抗体、缀合抗体或嵌合抗体。
66.如项1-63中任一项所述的抗Siglec-9抗体,其中所述Siglec-9抗体是识别第一抗原和第二抗原的双特异性抗体。
67.如项66所述的抗Siglec-9抗体,其中所述第一抗原是Siglec-9,并且所述第二抗原是:
(a)促进跨血脑屏障的转运的抗原;
(b)选自由以下各项组成的组的促进跨血脑屏障的转运的抗原:转铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体、CRM197、美洲驼单结构域抗体、TMEM 30(A)、蛋白质转导结构域、TAT、Syn-B、穿膜肽、聚精氨酸肽、血管肽以及ANG1005;
(c)选自由致病肽或蛋白或致病核酸组成的组的致病因子,其中所述致病核酸是反义GGCCCC(G2C4)重复序列-扩增RNA,所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽;以及
(d)在免疫细胞上表达的配体和/或蛋白质,其中所述配体和/或蛋白质选自由以下各项组成的组:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73以及磷脂酰丝氨酸;以及
(e)在一种或多种肿瘤细胞上表达的蛋白质、脂质、多糖或糖脂。
68.如项1-67中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体是缀合抗体。
69.如项68所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体缀合至可检测标记、毒素或治疗剂。
70.如项69所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体缀合至选自由以下各项组成的组的毒素:蓖麻毒素、蓖麻毒素A链、多柔比星、道诺霉素、类美登素、紫杉醇、溴化乙锭、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春花碱、秋水仙碱、二羟基炭疽菌素二酮、放线菌素、白喉毒素、假单胞菌外毒素(PE)A、PE40、相思豆毒素、相思豆毒素A链、蒴莲根毒素A链、α-八叠球菌素、白树毒素、丝林霉素、局限曲菌素、酚霉素、伊诺霉素、麻疯树逆境蛋白、巴豆毒素、加利车霉素、肥皂草抑制剂、糖皮质激素、奥瑞斯他汀、金霉素、钇、铋、康普瑞汀、倍癌霉素、多拉司他汀、cc1065以及顺铂。
71.如项1-70中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体与一种或多种特异性地结合致病蛋白的抗体组合使用,所述致病蛋白选自由以下各项组成的组:淀粉样蛋白β、寡聚淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(染色体9开放阅读框72)、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利钠因子、胰岛淀粉样蛋白多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、中介素、催乳素、甲状腺素运载蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、半胱氨酸蛋白酶抑制剂、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素以及脯氨酸-精氨酸(PR)重复序列肽,以及其任何组合;或与结合选自由以下各项组成的组的免疫调节蛋白的一种或多种抗体组合使用:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73、TREM1、TREM2、CD33、Siglec-5、Siglec-7、Siglec-11、磷脂酰丝氨酸、致病核酸、反义GGCCCC(G2C4)重复序列-扩增RNA以及其任何组合。
72.如前述项中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体对于人Siglec-9和哺乳动物Siglec-9具有在约10nM至约10pM或小于10pM范围内的解离常数(K
73.如前述项中任一项所述的抗Siglec-9抗体,其中所述抗Siglec-9抗体对于人Siglec-9具有在约9nM至约230pM或小于230pM范围内的解离常数(K
74.一种分离的核酸,其包含编码如前述项中任一项所述的抗Siglec-9抗体的核酸序列。
75.一种载体,其包含如项74所述的核酸。
76.一种分离的宿主细胞,其包含如项75所述的载体。
77.一种产生抗Siglec-9抗体的方法,其包括培养如项76所述的宿主细胞以使得产生所述抗Siglec-9抗体。
78.如项77所述的方法,其还包括回收由所述宿主细胞产生的所述抗Siglec-9抗体。
79.一种分离的抗Siglec-7抗体,其通过如项77或项78所述的方法产生。
80.一种药物组合物,其包含如项1-73中任一项所述的抗Siglec-9抗体以及药学上可接受的载体。
81.一种预防疾病、病症或损伤,降低所述疾病、病症或损伤的风险或治疗所述疾病、病症或损伤的方法,所述疾病、病症或损伤选自由以下各项组成的组:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合性痴呆、tau蛋白病、感染以及癌症,所述方法包括向有需要的个体施用治疗有效量的降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂。
82.如项81所述的方法,其中所述疾病、病症或损伤是癌症,并且其中所述药剂抑制一种或多种选自由以下各项组成的组的Siglec-9活性:
(a)促进以下中的一种或多种的增殖、成熟、迁移、分化和/或功能性:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关抑制嗜中性粒细胞、肿瘤相关抑制NK细胞、非致瘤性CD14
(b)增强以下中的一种或多种浸润到肿瘤中:免疫抑制树突细胞、免疫抑制巨噬细胞、免疫抑制嗜中性粒细胞、免疫抑制NK细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、肿瘤相关抑制嗜中性粒细胞、肿瘤相关抑制NK细胞以及调控性T细胞;
(c)增加肿瘤、外周血或其它淋巴器官中肿瘤促进骨髓细胞/粒细胞免疫抑制细胞和/或非致瘤性CD14
(d)增强骨髓源性抑制细胞(MDSC)和/或非致瘤性CD14
(e)增加肿瘤或外周血液中肿瘤促进细胞因子的表达,任选地其中所述肿瘤促进细胞因子是TGF-β或IL-10;
(f)增加肿瘤促进FoxP3+调控性T淋巴细胞的肿瘤浸润;
(g)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的活化;
(h)减少具有肿瘤杀伤潜力的肿瘤特异性T淋巴细胞的浸润;
(i)减少具有肿瘤杀伤潜力的肿瘤特异性NK细胞的浸润;
(j)降低NK细胞的肿瘤杀伤潜力;
(k)减少具有增强免疫应答的潜力的肿瘤特异性B淋巴细胞的浸润;
(l)增加肿瘤体积;
(m)增加肿瘤生长速率;
(n)增加转移;
(o)增加肿瘤复发率;
(p)降低一种或多种调节抗肿瘤T细胞应答的免疫疗法或一种或多种癌症疫苗的功效,任选地其中所述一种或多种免疫疗法是靶向一种或多种靶蛋白的免疫疗法,所述一种或多种靶蛋白选自由以下各项组成的组:PD1/PDL1、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD30、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR-5、CD2、CD5、CD39、CD73以及其任何组合;
(q)抑制PLCγ/PKC/钙动员;以及
(r)抑制PI3K/Akt、Ras/MAPK信号传导。
83.如项81所述的方法,其中所述疾病、病症或损伤是癌症,并且其中所述药剂表现出一种或多种选自由以下各项组成的组的Siglec-9活性:
(a)增加肿瘤浸润CD3
(b)降低非致瘤性CD14
(c)减少非致瘤性CD14
(d)降低一种或多种细胞中的PD-L1水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(e)降低一种或多种细胞中的PD-L2水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(f)降低一种或多种细胞中的B7-H2水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(g)降低一种或多种细胞中的B7-H3水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(h)降低一种或多种细胞中的CD200R水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(i)降低一种或多种细胞中的CD163水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(j)降低一种或多种细胞中的CD206水平,任选地其中所述一种或多种细胞是非致瘤性骨髓源性抑制细胞(MDSC);
(k)降低实体肿瘤的肿瘤生长速率;
(l)减小肿瘤体积;
(m)提高一种或多种PD-1抑制剂的功效;
(n)提高一种或多种检查点抑制剂疗法和/或免疫调节疗法的功效,任选地其中所述一种或多种检查点抑制剂疗法和/或免疫调节疗法靶向以下中的一种或多种:CTLA4、腺苷途径、PD-L1、PD-L2、OX40、TIM3、LAG3或其任何组合;
(o)提高一种或多种化学治疗剂的功效,任选地其中所述化学治疗剂中的一种或多种是吉西他滨、卡培他滨、蒽环类、阿霉素
(p)在非致瘤性骨髓源性抑制细胞(MDSC)存在下增加T细胞的增殖。
(q)抑制非致瘤性骨髓源性抑制细胞的(MDSC)的分化、存活和/或一种或多种功能;以及
(r)当缀合至化学或放射性毒素时,杀死实体肿瘤和相关血管中表达CD33的免疫抑制骨髓细胞和/或表达CD14的细胞。
84.如项82或项83所述的方法,其中所述癌症表达Siglec-9或一种或多种Siglec-9配体。
85.如项81-84中任一项所述的方法,其中所述癌症选自由以下各项组成的组:膀胱癌、脑癌、乳腺癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤、急性成淋巴细胞性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)以及多发性骨髓瘤。
86.一种诱导或促进有需要的个体中一种或多种免疫细胞的存活、成熟、功能性、迁移或增殖的方法,所述方法包括向所述个体施用治疗有效量的降低Siglec-9的细胞水平、抑制Siglec-9与一种或多种Siglec-9配体之间的相互作用或两者的药剂。
87.如项86所述的方法,其中所述一种或多种免疫细胞选自由以下各项组成的组:树突细胞、巨噬细胞、嗜中性粒细胞、NK细胞、小神经胶质细胞、T细胞、T辅助细胞、细胞毒性T细胞以及其任何组合。
88.如项81-87中任一项所述的方法,其中所述药剂选自由以下各项组成的组:抗体、可溶性Siglec-9受体、Siglec-9-Fc融合蛋白、Siglec-9免疫粘附素、反义分子、siRNA、小分子抑制剂、蛋白质以及肽。
89.如项81-87中任一项所述的方法,其中所述药剂是分离的抗Siglec-9抗体。
90.如项89所述的方法,其中所述抗Siglec-9抗体是如项1-73中任一项所述的抗Siglec-9抗体。
91.一种降低有需要的个体中调控性T细胞、肿瘤包埋的免疫抑制树突细胞、肿瘤包埋的免疫抑制巨噬细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、急性骨髓性白血病(AML)细胞、慢性淋巴细胞性白血病(CLL)细胞或慢性骨髓性白血病(CML)细胞的活性、功能性或存活的方法,所述方法包括向所述个体施用治疗有效量的与Siglec-9结合或相互作用的试剂。
92.如项91所述的方法,其中所述药剂是分离的抗Siglec-9抗体或抗Siglec-9抗体缀合物。
93.如项92所述的方法,其中所述抗Siglec-9抗体是如项1-73中任一项所述的抗Siglec-9抗体。
94.一种降低有需要的个体中一种或多种细胞上的Siglec-9的细胞水平的方法,所述方法包括向所述个体施用治疗有效量的分离的抗Siglec-9抗体。
95.如项94所述的方法,其中所述抗Siglec-9抗体降低体内Siglec-9的细胞水平。
96.如项94或项95所述的方法,其中所述抗Siglec-9抗体是如项1-73中任一项所述的抗Siglec-9抗体。
97.如项81-96中任一项所述的方法,其还包括向所述个体施用至少一种特异性地结合至抑制性检查点分子的抗体,和/或一种或多种标准或研究性抗癌疗法。
98.如项97所述的方法,其中所述至少一种特异性地结合至抑制性检查点分子的抗体与所述抗Siglec-9抗体组合施用。
99.如项97或项98所述的方法,其中所述至少一种特异性地结合至抑制性检查点分子的抗体选自由以下各项组成的组:抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体和抗HVEM抗体、抗B-和T-淋巴细胞衰减子(BTLA)抗体、抗杀伤抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM-1抗体、抗TIM3抗体、抗TIM-4抗体、抗A2AR抗体、抗CD39抗体、抗CD73抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体、抗CD30抗体、抗TNFa抗体、抗CD33抗体、抗Siglec-5抗体、抗Siglec-7抗体、抗Siglec-11抗体、拮抗性抗TREM1抗体、拮抗性抗TREM2抗体、抗TIGIT抗体、抗VISTA抗体、抗CD2抗体、抗CD5抗体以及其任何组合。
100.如项97所述的方法,其中所述一种或多种标准或研究性抗癌疗法选自由以下各项组成的组:放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼疗法、曲妥珠单抗疗法、依那西普疗法、过继细胞转移(ACT)疗法、嵌合抗原受体T细胞转移(CAR-T)疗法、疫苗疗法以及细胞因子疗法。
101.如项81-100中任一项所述的方法,其还包括向所述个体施用至少一种特异性地结合至抑制性细胞因子的抗体。
102.如项101所述的方法,其中所述至少一种特异性地结合至抑制性细胞因子的抗体与所述抗Siglec-9抗体组合施用。
103.如项101或项102所述的方法,其中所述至少一种特异性地结合至抑制性细胞因子的抗体选自由以下各项组成的组:抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体以及其任何组合。
104.如项81-103中任一项所述的方法,其还包括向所述个体施用至少一种特异性地结合至刺激性检查点蛋白的激动性抗体。
105.如项104所述的方法,其中所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体与所述抗Siglec-9抗体组合施用。
106.如项104或项105所述的方法,其中所述至少一种特异性地结合至刺激性检查点蛋白的激动性抗体选自由以下各项组成的组:激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动性抗TREM1抗体、激动性抗TREM2抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导的TNFR相关蛋白GITR抗体、激动剂抗CD30抗体、激动剂抗BTLA抗体、激动剂抗HVEM抗体、激动剂抗CD2抗体、激动剂抗CD5抗体以及其任何组合。
107.如项81-106中任一项所述的方法,其还包括向所述个体施用至少一种刺激性细胞因子。
108.如项107所述的方法,其中所述至少一种刺激性细胞因子与所述抗Siglec-9抗体组合施用。
109.如项107或项108所述的方法,其中所述至少一种刺激性细胞因子选自由以下各项组成的组:IL-2、IFN-α4、IFN-β、IL-1β、TNF-α、IL-6、IL-8、CRP、IL-20家族成员、LIF、IFN-γ、OSM、CNTF、GM-CSF、IL-11、IL-12、IL-17、IL-18、IL-23、CXCL10、IL-33、MCP-1、MIP-1-β以及其任何组合。
