一种融合蛋白、表达该融合蛋白的重组菌株及其应用
文献发布时间:2024-04-18 19:53:33
技术领域
本发明涉及一种融合蛋白、表达该融合蛋白的重组菌株及其应用,属于遗传工程技术领域。
背景技术
鸡传染性支气管炎(Infectious bronchitis,IB)是由鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的急性、高度接触性病毒性传染病,主要引起雏鸡死亡、肉鸡的饲料报酬低、产蛋鸡的产蛋能力下降。该病主要通过接种疫苗进行防控,但由于疫苗交叉保护性差导致该病在免疫鸡群中仍时有发生。鸡α干扰素(IFN-α)是鸡免疫相关细胞产生的一种高活性、多功能的生物活性糖蛋白,具有抗病毒活性。鸡α干扰素抗病毒作用并不是直接杀死病毒,而是间接的通过机体细胞来发挥作用,鸡α干扰素通过自分泌或者旁分泌作用,与细胞膜表面上的特定受体结合后,引发级联性的信号放大过程,最后将信号传递到细胞核内,对一系列基因的表达进行调控,并介导各种生理生化反应。对于鸡用抗病毒生物制品来说,与传统的化学药物和疫苗相比,重组鸡IFN-α不会产生耐药性与药物残留等安全性问题。干扰素作为一种广谱抗病毒药物,如何提高干扰素的特异性抗病毒效果也将成为研究的重点。
氨肽酶N(APN)亲和肽是位于细胞表面的一种锌离子依赖的金属糖蛋白,是大多数Ⅰ型和Ⅱ型冠状病毒发生感染时的细胞受体。鸡传染性支气管炎病毒(IBV)属于Ⅲ型冠状病毒中的一种禽类冠状病毒,在进化上被认为是处于Ⅰ型和Ⅱ型冠状病毒之间。目前研究表明APN亲和肽是鸡传染性支气管炎病毒感染的功能性受体,且APN基因敲除鸡能够显著提高抗IBV感染能力,开发APN分子抑制剂一直是目前研究抗IBV药物的重点。
现有技术中未见鸡α干扰素与氨肽酶N亲和肽结合制备融合蛋白的报道。
发明内容
针对现有技术的上述不足,本发明提供一种融合蛋白、表达该融合蛋白的重组菌株及其应用,实现以下发明目的:
在保留干扰素广谱抗病毒活性的条件下,还特异性的防治鸡传染性支气管炎病毒,降低感染病毒后鸡的发病率和死亡率;提高融合蛋白的表达量和抗病毒活性。
为解决上述技术问题,本发明采取以下技术方案:
一种融合蛋白,所述融合蛋白由氨肽酶N亲和肽、连接子、IFNα依次串联得到;所述氨肽酶N亲和肽的核酸序列如序列表中SEQ ID NO.7所示;所述连接子的核酸序列如序列表中SEQ ID NO. 8所示;所述IFNα的核酸序列如序列表中SEQ ID NO. 9所示。
所述融合蛋白的核苷酸序列如序列表中SEQ ID NO.6所示,所述融合蛋白的氨基酸序列如序列表中SEQ ID NO.2所示。
一种表达所述融合蛋白的重组菌株,所述重组菌株为重组毕赤酵母。
所述重组菌株的保藏编号为CCTCC NO:M 20211521,分类命名为毕赤酵母
所述的融合蛋白在制备治疗鸡传染性支气管炎药物中的应用。
本发明表达APN-G-(GGGGS)3-IFNα的重组毕赤酵母X-33-chIFNα,分类命名为:毕赤酵母
相对于现有技术,本发明的有益效果在于:
(1)本发明所述APN-G-(GGGGS)
(2)本发明对APN亲和肽、IFNα、连接子的核苷酸序列进行了优化,并采用特定长度的连接子,可以提高毕赤酵母中融合蛋白的表达量,提高融合蛋白的特异性抗病毒效果,降低感染病毒后鸡的发病率和死亡率。
本发明纯化后的融合蛋白中鸡α干扰素的浓度为17.52g/L;
本发明纯化后的融合蛋白的抗IBV病毒活性为1.09×10
本发明纯化后的融合蛋白用于感染IBV的鸡后,总发病率为20%,总死亡率为4%。
附图说明
图1为本发明重组毕赤酵母的阳性克隆电泳图;
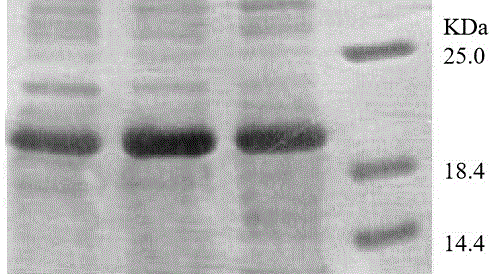
图2为鉴定本发明APN-G-(GGGGS)3-IFNα融合蛋白特异性的SDS-PAGE图;
图3为本发明纯化后的APN-G-(GGGGS)3-IFNα融合蛋白的SDS-PAGE图。
具体实施方式
下述实施例中为了更方便表述,将氨肽酶N简称为APN。
实施例1一种含鸡α干扰素、氨肽酶N亲和肽的融合蛋白的制备方法
一、APN亲和肽的筛选
根据目前已知的APN亲和肽的氨基酸序列(表1),通过委托生工生物工程(上海)股份有限公司合成,并委托山东省农业科学院进行APN亲和肽的体外活性检测,确定对IBV抑制效果最好的亲和肽。
表1 APN亲和肽的氨基酸序列
采用CEK-IBV检测系统检测APN亲和肽对IBV入侵CEK细胞的抑制作用,各APN亲和肽针对IBV的抗病毒活性见表2。
表2各APN亲和肽针对IBV的抗病毒活性检测结果
由表2可见,APN亲和肽a(命名为G)针对IBV的抗病毒活性最高,采用该APN亲和肽进行后续试验。
二、将融合蛋白APN-G-(GGGGS)
优化前融合蛋白APN-G-(GGGGS)
优化前融合蛋白APN-G-(GGGGS)3-IFNα由以下模块依次串联得到:
(1)APN亲和肽,其核酸人工序列如序列表中SEQ ID NO.3所示;
(2)连接子,其核酸人工序列如序列表中SEQ ID NO.4所示;
(3)IFNα,其核酸人工序列如序列表中SEQ ID NO.5所示;
本发明针对上述SEQ ID NO.1序列进行了密码子优化,得到优化后融合蛋白APN-G-(GGGGS)3-IFNα的核酸人工序列,如序列表中SEQ ID NO.6所示。
优化后融合蛋白APN-G-(GGGGS)
(1)优化后APN亲和肽,其核酸人工序列如序列表中SEQ ID NO.7所示;
(2)优化后连接子,其核酸人工序列如序列表中SEQ ID NO.8所示;
(3)优化后IFNα,其核酸人工序列如序列表中SEQ ID NO.9所示;
将优化后APN亲和肽的核酸人工序列、优化后连接子的核酸人工序列、优化后IFNα的核酸人工序列,委托生工生物工程(上海)股份有限公司合成其整个表达框,并插入pPICZαA载体
三、电转化以及阳性菌株的筛选
对上述获得的pPICZαA-APN-G-(GGGGS)
采用异丙醇法快速纯化DNA,具体操作为:在上述体系加0.6倍体积的异丙醇于室温下充分混匀,于4℃离心25min,用乙醇清洗DNA 沉淀,在4℃再次离心25min,弃上清液,使DNA 沉淀干燥后,用20μL TE 缓冲液重新溶解DNA沉淀,得到DNA溶液。
最后将DNA溶液与毕赤酵母X-33感受态菌悬液以1:8 (V/V)混合后进行电转(2000V,25µF,200Ω,电击5ms),电转后,立即加入1mL预冷的1mol/L山梨醇,于28℃静置1.5h;然后加入1mL YPD,于150r/min、28℃培养1.5h;离心收集菌体,涂布于含100μg/mL博来霉素的YPD平板,于28℃培养至酵母单菌落长出;挑取长势良好的酵母菌落,以其基因组DNA为模板,进行PCR,对重组毕赤酵母菌株X-33/pPICZαA-APN-G-(GGGGS)
所述毕赤酵母X-33菌株购自山东赛恩斯科技有限公司;
所述毕赤酵母X-33感受态菌悬液采用CN114539426A的实施例1中毕赤酵母X-33感受态菌悬液的制备方法制得。
四、APN-G-(GGGGS)
取步骤三得到的重组毕赤酵母X-33-chIFNα冻干粉1支(1克)接种于50mL YPD培养基,于28℃、250r/min培养12h;取10mL上述培养液转接于50mL BMGY培养基;在同样条件下继续培养24h,离心收集菌体,全部菌体转接于甲醇浓度为1.5%(V/V)的50mL BMMY培养基,于28℃、250r/min继续培养64h,得到发酵液,取发酵液的上清液用于SDS-PAGE,结果表明在21.31kD 处有明显条带 (图2);
所述BMGY培养基,包括以下组分:1%(质量体积比)酵母粉、2%(质量体积比)胰蛋白胨、1.34%(质量体积比)YNB、4×10
所述的BMMY液体培养基,包括以下组分:1%(质量体积比)酵母粉、2%(质量体积比)胰蛋白胨、1.34%(质量体积比)YNB、4×10
五、融合蛋白的制备
参考CN110684681A实施例4的方法进行融合蛋白制备。具体步骤如下:
(1)菌株活化与筛选
将重组毕赤酵母X-33-chIFNα划线接种到含300μg/mL、600μg/mL、900μg/mL博来霉素的YPD固体培养基上,筛选出稳定多拷贝的高产菌种。
(2)一级种子培养
从第三次筛选的YPD固体培养基上挑取单菌落,接入装有250mL YPD液体培养基的1L三角瓶中,置于摇床中,在30℃、200rpm的条件下培养至OD600=0.7,作为一级种子液。
(3)二级种子培养
将4瓶一级种子液共1L接种到已灭菌的100L BMGY发酵培养基中,使用发酵种子罐培养,控制通气量在5L/min,温度30℃,转速200rpm,待OD600=0.7,为二级种子液备用。
(4)发酵培养
用泵将备好的100L二级种子液泵入1吨BMMY液体培养基中,发酵条件控制在转速200rpm,温度30℃,pH5.0,通气量10L/min。每4h取样一次测定其碳源剩余、菌体浓度,初期使用分光光度计测量其600nm吸光值(OD600),后期测量湿重作为参考。发酵期间通过调整转速和通气量使溶氧保持在30%以上,以溶氧电极数值上升到100%为标志表示初始碳源已消耗殆尽,即可进入边富集边诱导阶段,具体为以7mL/h/L的恒定速率补加浓度为0.1g/mL的山梨醇溶液,以2.5mL/h/L的恒定速率补加甲醇,发酵条件控制在转速200rpm,温度28℃,pH5.0,溶氧(DO)在20~30%之间,每6h取样1次,测OD600、细胞湿重及细胞干重,分析酵母菌生长状态,菌体湿重达400g/L以上时,停止补加山梨醇,转入菌体诱导阶段,具体为以10mL/h/L的速率补加甲醇,发酵条件控制在转速200rpm,温度28℃,pH6.0,DO在20~30%之间,湿重达到500g/L以上,结束发酵,得发酵液。
(5)纯化工艺
将上述发酵液在8000r/min下离心30min,收集上清液,再将上清液通过30kD孔径超滤膜包将发酵液上清浓缩10倍;在浓缩后的上清中加入等量的平衡缓冲液并调pH至7.4,加入钴柱中与介质充分结合;分别使用含5mmol/L和150mmol/L咪唑的缓冲液进行洗涤和洗脱。
将含目标蛋白脱液合并,使用30kD超滤管超滤去除杂带、浓缩目标蛋白,收集截留液为纯化后融合蛋白。SDS-PAGE结果表明本发明纯化工艺可以有效除去大多数降解条带,保留较高纯度的APN-G-(GGGGS)
表3本发明融合蛋白中鸡α干扰素浓度 (g/L)
表4本发明融合蛋白的抗IBV病毒活性
实施例2 APN-G-(GGGGS)
将75只14日龄鸡随机分成3组,每组25只,第1组为本发明APN-G-(GGGGS)
观察防治效果,统计发病及死亡情况。结果表明第1组在鸡静脉注射本发明APN-G-(GGGGS)
表5实验室治疗结果
。
对比例1连接子的选择试验
为了将APN亲和肽和鸡α干扰素更好地进行连接,在二者之中分别加入柔性(GGGGS)
表6各融合蛋白体外抗IBV病毒活性检测结果
表6可见,融合蛋白中加入柔性Linker后,可以提高IBV的抑制率,实施例1制备的融合蛋白((GGGGS)
对比例2优化前融合蛋白中鸡α干扰素和抗病毒活性的测定
优化前融合蛋白APN-G-(GGGGS)3-IFNα基因序列SEQ ID NO.1委托生工生物工程(上海)股份有限公司合成其整个表达框,并插入pPICZαA载体
将含有优化前融合蛋白APN-G-(GGGGS)3-IFNα序列的重组毕赤酵母按实施例1的步骤五的操作进行发酵和纯化,得到优化前融合蛋白。将优化前融合蛋白进行3批次实验,采用鸡α干扰素定量检测试剂盒测定融合蛋白中鸡α-干扰素的浓度,委托山东省农业科学院采用CEK-IBV检测系统检测融合蛋白的抗IBV病毒活性。
表7优化前融合蛋白中鸡α干扰素的浓度 (g/L)
表8优化前融合蛋白的抗IBV病毒活性
本发明融合蛋白中鸡α-干扰素的浓度为17.52g/L,明显高于优化前融合蛋白,本发明融合蛋白的抗病毒活性为1.09×10
