神经疾病的治疗
文献发布时间:2024-04-18 19:58:53
技术领域
本申请涉及再生医学、神经病学和生物制药领域。特别地,本申请涉及用于将非神经元细胞分化为神经元细胞的方法和组合物,用于治疗神经退行性疾病和病症。
背景技术
神经退行性疾病是与神经系统各部分神经元的进行性损失相关的破坏性疾病。在另一个方面,再生医学在治疗导致细胞(如神经元)损失的神经退行性疾病方面具有巨大前景。一种方法采用细胞替代换,而另一种方法利用细胞转分化。
转分化利用内源细胞现有的细胞可塑性来产生新的细胞类型。然而,然而,这种方法的一个挑战是鉴定不仅在培养中,更重要的是在其体内天然环境中,特别是在所需位置(例如,组织或器官类型)中将某些靶细胞转化为所需细胞类型(例如,神经元)的有效策略。
最近的研究表明,下调纹状体中的单个基因多聚嘧啶束结合蛋白1(Ptbp1)可以直接将小鼠的星形胶质细胞转化为多巴胺能神经元,并减轻帕金森病小鼠模型的症状(Zhouet al.,2020,Cell 181:590-603)。然而,尚不清楚这种策略是否可以应用于非人灵长类和人类。许多在啮齿动物模型中显示有效性的实验疗法在非人灵长类和人类中可能无效的或不切实际的;这些策略可能因多种原因而失败,包括内在的生物学差异和缺乏可扩展性。对非人灵长类的研究是关键的步骤,对于在临床试验前解决这些问题具有重要价值。
因此,本申请的目的是提供用于将非神经元细胞分化为神经元细胞的方法和组合物,用于治疗灵长类,即人类和非人灵长类的神经退行性疾病和病症。
发明概述
在第一方面,本申请涉及治疗与非人灵长类或人类的神经系统区域中的功能性神经元退化相关的神经病况的方法。
在一个实施方案中,方法包括向有需要的受试者的神经系统区域中的非神经元细胞施用有效量的包含核酸分子的组合物,所述核酸分子靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列,以抑制非神经元细胞中灵长类PTB蛋白的表达或活性,从而允许非神经细胞重编程为功能性神经元,其中靶序列包含在与SEQ ID NO:87至少95%相同的序列中,并且其中当用向导RNA(gRNA)靶向靶序列时,向导序列与SEQ ID NOs:1-86中的至少一个序列有至少10个核苷酸重叠,所述gRNA在Cos7细胞和293T细胞的至少一个中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达小于0.5。
SEQ ID NO:87:
在一个实施方案中,方法包括向有需要的受试者的神经系统区域中的非神经元细胞施用有效量的包含核酸分子的组合物,所述核酸分子靶向灵长类PTB基因、转录物或mRNA的靶序列或其互补序列,以抑制非神经元细胞中PTB的表达或活性,从而允许非神经细胞重编程为功能性神经元,其中靶序列包含在与SEQ ID NO:87的位置951-1487至少95%相同的序列中。在方法的一些实施方案中,当用向导RNA(gRNA)靶向靶序列时,向导序列与SEQ IDNOs:38-68中至少一个序列有至少10个核苷酸重叠,所述gRNA在Cos7细胞和293T细胞中至少一种中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,观察到PTB mRNA的相对表达小于0.4
在一个实施方案中,该方法是这样的方法,其中核酸分子是或编码反义核酸、RNAi分子或向导RNA(gRNA)中的至少一种。在一些实施方案中,在一个实施方案中,该方法是这样的方法,其中组合物包含:i)Cas效应蛋白和至少一种gRNA,或ii)编码Cas效应蛋白和编码至少一种gRNA的至少一种表达载体,其中任选地,Cas效应蛋白和至少一种gRNA或至少一种表达载体包含在纳米颗粒,优选脂质体中。
在一个实施方案中,该方法是这样的方法,其中:a)Cas效应蛋白是靶向RNA的Cas效应蛋白;并且,b)gRNA包含与如下序列中的17-60个核苷酸的连续一段序列互补的向导序列,该序列与SEQ ID NO:87至少95%相同。在一些实施方案中,该方法是这样的方法,其中靶向RNA的Cas效应蛋白选自下组:Cas13d、CasRx、Cas13e、Cas13a、Cas13b、Cas13c、Cas13f及其功能性结构域,其中优选为CasRx。在一些实施方案中,该方法是这样的方法,其中gRNA中的向导序列包含SEQ ID NOs:1-86中至少一个序列的至少10、11、12、13、14、15、16、17个连续核苷酸或所有核苷酸,或由其组成,并且其中,优选地,当gRNA与CasRx在Cos7细胞和293T细胞中的至少一种中共表达时,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达小于0.5、0.45、0.4、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。在一些实施例中,该方法是这样的方法,其中gRNA中的向导序列包含选自下组的至少一种序列或由选自下组的至少一种序列组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51和46。
在一个实施方案中,该方法是这样的方法,其中组合物包含靶向灵长类PTB mRNA序列的仅单一类型的gRNA或两种、三种、四种、五种或六种不同的gRNA,或者包含靶向灵长类PTB mRNA序列的仅单一类型的gRNA或两种、三种、四种、五种或六种不同的gRNA的表达载体。
在一个实施方案中,该方法是这样的方法,其中至少一个表达载体包含:i)编码Cas效应蛋白的核苷酸序列,其可操作地连接到引起Cas效应蛋白在灵长类非神经元细胞中表达的启动子,其中优选地所述启动子是神经胶质细胞特异性启动子或米勒神经胶质(MG)细胞特异性启动子,其中神经胶质细胞特异性启动子更优选选自GFAP启动子、ALDH1L1启动子、EAAT1/GLAST启动子、谷氨酰胺合成酶启动子、S100β启动子和EAAT2/GLT-1启动子,或者,米勒神经胶质(MG)细胞特异性启动子更优选选自GFAP启动子、ALDH1L1启动子、GLAST(也称为Slc1a3)启动子和Rlbp1启动子;和,ii)编码靶向灵长类PTB mRNA序列的gRNA的至少一个核苷酸序列,所述核苷酸序列可操作地连接到在非神经元细胞中引起gRNA表达的启动子,如U6启动子。
在一个实施方案中,该方法是这样一种方法,其中表达载体包含在纳米颗粒中,或者其中所述表达载体是基因治疗载体,优选病毒基因治疗载体,更优选选自下组的病毒载体:腺相关病毒(AAV)载体、腺病毒载体、慢病毒载体、逆转录病毒载体、疱疹病毒、SV40载体、痘病毒载体及其组合,其中最优选为AAV。
在一个实施方案中,该方法是这样的方法,其中将组合物局部施用于以下至少一种细胞:i)成熟视网膜中的非神经元细胞;ii)纹状体中的非神经元细胞,优选壳核中的非神经元细胞;iii)黑质中的非神经元细胞,iv)内耳中的非神经元细胞;v)脊髓中的非神经元细胞;vi)前额皮质中的非神经元细胞;vii)运动皮质中的非神经元细胞;和viii)中脑腹侧被盖区(VTA)中的非神经元细胞。在一些实施方案中,该方法是这样的方法,其中将组合物施用于纹状体中的非神经元细胞以产生功能性多巴胺能神经元,由此,优选地,所述非神经元细胞是神经胶质细胞,其中优选地,将所述组合物施用于壳核和黑质中的至少一种。在优选的实施方案中,神经胶质细胞是星形胶质细胞。在一些实施方案中,该方法是这样的方法,其中所述神经病况是与功能性神经元退化相关的病况,其选自下组:帕金森病;阿尔茨海默病;亨廷顿病;精神分裂症;抑郁症;药物成瘾性;中风;运动障碍,如舞蹈病、脊髓损伤、舞蹈徐动症和异动症;双相障碍;孤独症谱系障碍(ASD);和功能障碍。在一些实施方案中,该方法是这样的方法,其中组合物进一步包含:i)一种或多种多巴胺神经元相关因子,或ii)至少一种表达载体,其用于在非神经元细胞中表达一种或多种多巴胺神经元相关因子。在优选的实施方案中,一种或多种多巴胺神经元相关因子选自下组:Lmx1a、Lmx1b、FoxA2、Nurr1、Pitx3、Gata2、Gata3、FGF8、BMP、En1、En2、PET1、Pax家族蛋白、SHH、Wnt家族蛋白和TGF-β家族蛋白。
在一个实施方案中,该方法是这样的方法,其中将组合物施用于成熟视网膜中的神经胶质细胞或米勒神经胶质细胞(MG)以产生功能性视网膜神经节细胞(RGC)神经元。在一个实施方案中,该方法是这样的方法,将组合物施用于成熟视网膜中的神经胶质细胞或米勒神经胶质细胞(MG)以产生功能性视网膜光感受器。在一些实施方案中,该方法是这样的方法,其中神经病况是与成熟视网膜中功能性神经元退化相关的病况,其选自下组:青光眼、与年龄相关的RGC损失、视神经损伤、视网膜缺血和莱伯遗传性视神经病变。在一个实施方案中,该方法是这样的方法,其中组合物进一步包含:i)选自下组的一种或多种因子:β-连环蛋白、Oct4、Sox2、Klf4、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl,和/或ii)至少一种表达载体,用于在非神经元细胞中表达选自下组的一种或多种因子:β-连环蛋白、Oct4、Sox2、Klf4、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl。
在一个实施方案中,该方法是这样的方法,其中方法进一步包括在施用细胞编程剂之前、同时或之后施用免疫抑制剂,其中更优选地,免疫抑制剂选自下组:皮质类固醇、钙调磷酸酶抑制药、mTOR抑制剂、IMDH抑制剂、免疫抑制抗体、干扰素、Janus激酶抑制剂和生物制剂如阿那白滞素。
在第二方面,本申请涉及包含核酸分子的组合物,所述核酸分子靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列,其中靶序列如本文所定义。在一些实施方案中,组合物包含:i)Cas效应蛋白和至少一种gRNA或ii)编码Cas效应蛋白并编码至少一种gRNA的表达载体,其中任选地,Cas效应蛋白和至少一种gRNA或至少一种表达载体包含在纳米颗粒优选脂质体中。在优选的实施方案中,Cas效应蛋白和至少一种gRNA如本文所定义。在优选的实施方案中,表达载体是如本文定义的表达载体。
在一个实施方案中,用于产生功能性多巴胺能神经元的组合物进一步包含i)一种或多种多巴胺神经元相关因子,或ii)至少一种表达载体,其用于在非神经元细胞中表达一种或多种多巴胺神经元相关因子,其中优选地,一种或多种多巴胺神经元相关因子选自下组:Lmx1a、Lmx1b、FoxA2、Nurr1、Pitx3、Gata2、Gata3、FGF8、BMP、En1、En2、PET1、Pax家族蛋白、SHH、Wnt家族蛋白和TGF-β家族蛋白。
在一个实施方案中,用于产生功能性RGC神经元的组合物进一步包含:i)选自下组的一种或多种因子:β-连环蛋白、Oct4、Sox2、Klf4、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl,和/或ii)至少一种表达载体,其用于在非神经元细胞中表达选自下组的一种或多种因子:β-连环蛋白、Oct4、Sox2、Klf4、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl。
在一个实施方案中,组合物被配制用于注射、吸入、肠胃外施用、静脉内施用、皮下施用、肌肉内施用、皮内施用、局部施用或口服施用。
在第三方面,本申请涉及AAV载体,包含:(a)靶向RNA的Cas效应蛋白的编码序列;和(b)编码本文定义的gRNA的至少一种核苷酸序列。在一些实施方案中,AAV载体是这样的载体,其中靶向RNA的Cas效应蛋白选自下组:Cas13d、CasRx、Cas13e、Cas13a、Cas13b、Cas13c、Cas13f及其功能性结构域,其中优选为CasRx。在一些实施方案中,AAV载体是这样的载体,其中:i)编码Cas效应蛋白的核苷酸序列可操作地连接到引起Cas效应蛋白在灵长类非神经元细胞中表达的启动子,其中优选地所述启动子是神经胶质细胞特异性启动子或米勒神经胶质细胞(MG)细胞特异性启动子,其中神经胶质细胞特异性启动子更优选选自GFAP启动子、ALDH1L1启动子、EAAT1/GLAST启动子、谷氨酰胺合成酶启动子、S100β启动子和EAAT2/GLT-1启动子,或者,米勒神经胶质(MG)细胞特异性启动子更优选选自GFAP启动子、ALDH1L1启动子、GLAST(也称为Slc1a3)启动子和Rlbp1启动子;并且ii)编码gRNA的至少一种核苷酸序列可操作地连接到在非神经元细胞中引起gRNA表达的启动子,如U6启动子。
附图说明
图1
图2
图3
图4
图5
(A)AAV载体和注射策略的示意图。载体1(AAV-GFAP-mCherry)编码由星形胶质细胞特异性启动子GFAP驱动的mCherry,载体2(AAV-GFAP-CasRx)编码CasRx,载体3(AAV-GFAP-CasRx-Ptbp1)编码CasRx和gRNA。用AAV-GFAP-CasRx-Ptbp1或对照载体AAV-GFAP-CasRx和AAV-GFAP-mCherry注射纹状体。在注射后约2-3周评估星形胶质细胞到多巴胺神经元的转化。ST,纹状体。
(B)代表性图像显示mCherry(载体1)和CasRx(与Flag融合,载体3)在小鼠星形胶质细胞中特异性表达。注意,GFAP是星形胶质细胞特异性标志物。(C)和(D)共焦图像显示在注射载体1+3后2周,在小鼠中观察到转化的mCherry
图6
共焦成像显示在注射AAV-GFAP-mCherry+AAV-GFAP-CasRx-Ptbp1、AAV-GFAP-mCherry+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-FoxA2、AAV-GFAP-mCherry+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-Lmx1a、AAV-GFAP-mCherry+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-FoxA2+AAV-GFAP-Lmx1a和AAV-GFAP-mCherry+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-FoxA2+AAV-GFAP-Lmx1a+AAV-GFAP-Nurr1后2-3周,在小鼠中观察到转化的mCherry
图7
通过在中年小鼠中共同注射β-连环蛋白来提高MG到RGC的转化效率。
(A)显示MG到RGC转化的示意图。载体I(AAV-GFAP-GFP-Cre)表达由MG特异性启动子GFAP驱动的Cre重组酶和GFP。载体II(AAV-GFAP-CasRx-Ptbp1)表达CasRx和gRNA。为了诱导MG到RGC的转化,用AAV-GFAPCasRx-Ptbp1或对照AAV-GFAP-CasRx与AAV-GFAP-GFP-Cre一起注射视网膜(Ai9小鼠,4-5月龄)。注射后2-3周,检验RGC转化的诱导。ONL,外核层;OPL,外丛状层;INL,内核层;IPL,内丛状层;GCL,神经节细胞层。
(B-E)代表性图像表示,GCL中RBPMS+tdTomato+细胞,以及AAV-GFAP-GFP-Cre+AAV-GFAP-CasRx、AAV-GFAP-GFP-Cre+AAV-GFAP-β-连环蛋白、AAV-GFAP-GFP-Cre+AAV-GFAP-CasRx-Ptbp1和AAV-GFAP-GFP-Cre+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-β-连环蛋白组中RBPMS+tdTomato+视神经的共定位。
注意,AAV-GFAP-GFP-Cre+AAV-GFAP-CasRx和AAV-GFAP-GFP-Cre+AAV-GFAP-β-连环蛋白是对照组。黄色箭头显示了注射了AAV-GFAP-GFP-Cre、AAV-GFAP-CasRx-Ptbp1和AAV-GFAP-β-连环蛋白的视网膜中tdTomato和RBPMS的共定位。RBPMS是RGC的特异性标志物。使用gRNA 60。
发明说明
定义
除非另有定义,否侧本文使用的技术和科学术语与本公开所属领域的普通技术人员通常理解的含义相同。本领域技术人员将认识到许多与本文描述的方法和材料相似或等同的方法和材料,它们可以用于实施本申请。实际上,本申请决不限于该方法。
在本文件及其权利要求中,动词“包含”及其变形以其非限制性意义使用,表示包括该词后面的项目,但不排除未具体提及的项目。此外,不定冠词“一(a)”或“一个(an)”提及的元件不排除存在多于一个元件的可能性,除非上下文明确要求有且仅有一个元件。因此,不定冠词“一”或“一个”通常表示“至少一个”。
如本文所用,术语“和/或”表示一种或多种所述情况可能单独发生或与所述情况中的至少一种组合发生,直至与所有所述情况组合发生。
如本文所用,“至少”特定值表示该特定值或更多。例如,“至少2”应理解为与“2或更多”相同,即2、3、4、5、6、7、8、9、10、11、12、13、14、15、...等。
当与数值(例如约10)结合使用时,词语“约”或“大约”优选指该值可以是该值(10的)的给定值的约0.1%。
“星形胶质细胞”一般指脑和脊髓中特征性的星形神经胶质细胞,其特征在于以下中的一种或多种:星形;标志物的表达如神经胶质纤维酸性蛋白(GFAP)、醛脱氢酶1家族成员LI(ALDH1L1)、兴奋性氨基酸转运体1/谷氨酸天冬氨酸转运体(EAAT1/GLAST)、谷氨酰胺合成酶、S100β或兴奋性氨基酸转运体1/GLAST1(EAAT2/GLT-1);血脑屏障与内皮细胞一起参与;递质摄取和释放;调节细胞外间隙的离子浓度;对神经元损伤的反应和参与神经系统修复;和周围神经元的代谢支持。
在某些实施方案中,星形胶质细胞是指神经系统中的非神经元细胞,其表达神经胶质纤维酸性蛋白(GFAP)、醛脱氢酶1家族成员L1(ALDH1L1)或两者。
在某些实施方案中,星形胶质细胞是指神经系统中的非神经元细胞,其表达神经胶质纤维酸性蛋白(GFAP)启动子驱动的转基因(例如,红色荧光蛋白(RFP),Cre重组酶)。
在某些实施方案中,米勒神经胶质细胞(MG)是指在视网膜中发现的非神经元神经胶质细胞,其表达MG特异性启动子驱动的转基因(例如,红色荧光蛋白(RFP))。MG特异性启动子包括来自GFAP、GLAST(也称为Slc1a3)和Rlbp1的启动子。
“BRN2转录因子”或“Brain-2转录因子”,也称为“POU结构域,3类转录因子2”(“POU3F2”)或“Oct-7”,可指III类POU结构域转录因子,其具有DNA结合POU结构域,该结构域由约75个氨基酸的N末端POU特异性结构域和约60个氨基酸的C末端POU同源结构域组成,它们通过包含短a-螺旋折叠的接头连接,并且可以主要在中枢神经系统中表达。
术语“细胞编程剂”一般指通过抑制PTB和/或nPTB的表达和/或功能将分化的非神经元细胞重编程为神经元细胞的药剂。在具体的实施方案中,细胞编程剂是指带有与PTBmRNA或nPTB mRNA互补的向导RNA(gRNA)的CRISPR/Cas效应蛋白(可以包括或不包括其任何变体、衍生物、功能等同物或片段),并且可以将PTB或nPTB的表达和/或活性敲低到足以将非神经元细胞转化为神经元细胞的程度,优选在体内在局部微环境中进行,在该微环境中转化的神经元预期具有功能性。细胞编程剂还可以指编码如上定义的此类CRISPR/Cas效应蛋白和/或向导RNA(gRNA)的多核苷酸。多核苷酸可以包括如上所定义的Cas效应子的mRNA。多核苷酸还可以包括编码如上定义的Cas效应子和/或与PTB/nPTB mRNA互补的gRNA的DNA。编码如上定义的Cas效应子和/或gRNA的DNA可以是载体的一部分,包括病毒载体(例如,AAV载体或慢病毒载体,或下文描述的任何其他病毒载体)。在AAV的情况下,可以使用任何对CNS和/或PNS中的神经胶质细胞或非神经元细胞具有趋向性的AAV,包括AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV10、AAV11、AAV12、AAV13、AAV14、AAV15、AAV16等。同样在AAV的情况下,可以使用如上定义的任何Cas效应子,只要Cas效应子的编码序列小于AAV的包装容量,例如4.7kb、4.5kb、4.0kb、3.5kb、3.0kb、2.5kb、2.0kb、1.5kb或更小。可用于本申请的示例性Cas效应子包括Cas13a、Cas13b、Cas13c、Cas13d、CasRx、Cas13e、Cas13f、Cpf1、Cas9及其功能等同物或片段。在某种最狭义的意义上,术语“细胞编程剂”可以与带有gRNA的Cas效应子或编码它们的多核苷酸(例如,DNA或载体)互换使用。
可用于本文所述申请的Cas效应蛋白包括CRISPR-Cas 2类系统,其利用单个大Cas蛋白来降解靶核酸(例如mRNA)。合适的2类Cas效应子可以包括II型Cas效应子,例如Cas9(例如,化脓性链球菌SpCas9和嗜热链球菌Cas9)。合适的Cas效应子也可以是2类V型Cas蛋白,包括Cas12a(以前称为Cpf1,如新凶手弗朗西丝菌Cpf1和普雷沃氏菌Cpf1)、C2c1和C2c3,它们缺乏HNH核酸酶,但具有RuvC核酸酶活性。特别合适的Cas效应蛋白可以包括2类VI型Cas蛋白,包括Cas13(也称为C2c2)、Cas13a、Cas13b、Cas13c、Cas13d/CasRx、Cas13e和Cas13f,每个都是RNA向导的RNase(即,这些Cas蛋白质使用它们的crRNA来识别靶RNA序列,而不是Cas9和Cas12a中的靶DNA序列)。总的来说,与传统的RNAi和CRISPRi技术相比,CRISPR/Cas13系统可以实现更高的RNA消化效率,同时与RNAi相比,表现出更少的脱靶切割。
因此,在一个具体的实施方案中,本申请的细胞编程剂是或编码与其典型gRNA一起靶向PTB或nPTB mRNA的Cas效应蛋白。在其他实施方案中,Cas效应子靶向PTB或nPTBDNA。
术语用本公开的组合物“接触”细胞是指将组合物(例如,化合物、核酸、病毒载体等)置于将允许其接触细胞的位置以产生“接触的”细胞。接触可以使用任何合适的方法完成。例如,在一个实施方案中,接触是通过将化合物添加到细胞培养物中。接触也可以通过将其注射或将组合物递送至身体内的位置使得组合物“接触”靶向的细胞类型来实现。
术语“分化(differentiation/或differentiate)”或“转化”或“诱导分化”可互换使用,指将默认细胞类型(基因型和/或表型)改变为非默认细胞类型(基因型和/或表型)。因此,“在星形胶质细胞中诱导分化”是指诱导细胞将其形态从星形胶质细胞的形态改变为神经元细胞类型的形态(即,通过基因分析如微阵列确定的基因表达的改变)和/或表型(即,蛋白质表达的改变)。
如本文所用,“有效量”是指相对于未治疗的患者改善疾病症状所需的药剂的量。用于实施本申请以治疗例如癌症的活性剂的有效量,根据施用方式、受试者的年龄、体重和总体健康状况而变化。最终,主治医师或兽医将决定适当的量和给药方案。这样的量被称为“有效”量,其可以被确定为每千克基因组拷贝数(GC/kg)。因此,关于在当前公开的上下文中“有效对抗”疾病或病况的药物的施用,表明以临床上适当的方式施用对至少统计学上显著部分的患者产生有益效果,例如症状改善、治愈、至少一种疾病体征或症状减轻、寿命延长、生活质量改善或熟悉治疗特定类型疾病或病况的医生普遍认为是积极的其他效果。
术语“表达控制序列”旨在至少包括其存在被设计为影响表达的序列,并且还可以包括额外的有利组分。例如,前导序列和融合伴侣序列是表达控制序列。该术语还可以包括核酸序列的设计,使得从序列中去除框内和框外不需要的、潜在起始密码子。它还可以包括核酸序列的设计,使得去除不需要的潜在剪接位点。它包括指导添加polyA尾的序列或聚腺苷酸化序列(pA),即mRNA 的3'-端的一串腺嘌呤残基,称为polyA序列。它还可以设计用于增强mRNA的稳定性。影响转录和翻译稳定性的表达控制序列,例如启动子,以及影响翻译的序列,例如Kozak序列,在本领域本身是已知的。表达控制序列可以具有调节与其可操作地连接的核苷酸序列的性质,从而实现较低的表达水平或较高的表达水平。
术语“基因”是指包含区域(转录区域)的DNA片段,该区域在细胞中被转录成RNA分子(例如mRNA),可操作地连接到合适的调控区域(例如启动子)。基因通常包含几个可操作地连接的片段,例如启动子、5'前导序列、编码区和包含多聚腺苷酸化位点的3'-非翻译序列(3'-端)。“基因的表达”是指这样的过程,其中可操作地连接到适当的调控区域,特别是启动子的DNA区域被转录成具有生物活性的RNA,即能够被翻译成具有生物活性的蛋白质或肽。
术语“神经胶质细胞”通常可以指中枢神经系统(例如脑和脊髓)和外周神经系统中的一种支持细胞。
在一些实施方案中,神经胶质细胞不传导电脉冲或表现出动作电位。在一些实施方案中,神经胶质细胞彼此之间不传递信息,也不通过突触连接或电信号与神经元传递信息。在神经系统或体外培养系统中,神经胶质细胞可以包围神经元并为神经元提供支持和神经元之间的绝缘。神经胶质细胞的非限制性实例包括少突胶质细胞、星形胶质细胞、米勒神经胶质细胞、室管膜细胞、施万细胞、小神经胶质细胞、螺旋神经节神经胶质细胞和卫星细胞。
“向导序列”在本文中应理解为将RNA或DNA向导的核酸内切酶引导至RNA或DNA分子中的特定位点的序列。在向导RNA(gRNA)-CAS复合物的上下文中,“向导序列”在本文中进一步应理解为gRNA(或crRNA)的部分,其是将gRNA-CAS复合物靶向靶RNA或DNA分子的特定位点所必需的。gRNA中的“向导序列”与靶RNA或DNA分子中的特定位点互补,该位点是“靶序列”(另见下文)。
术语“同源的”当用于表示给定(重组)核酸或多肽分子与给定宿主生物体或宿主细胞之间的关系时,应理解为意指在自然界中,核酸或多肽分子由相同物种,优选相同变种或菌株的宿主细胞或生物体产生。如果与宿主细胞同源,则编码多肽的核酸序列通常(但不一定)可操作地连接至另一个(异源的)启动子序列,并且如果适用,与自然环境中另一个(异源)分泌信号序列和/或终止子序列可操作地连接。应当理解调控序列、信号序列、终止子序列等也可以与宿主细胞同源。在这种上下文中,仅使用“同源”序列元件允许构建“自我克隆”的转基因生物体(GMO's)(自我克隆在本文中的定义与欧洲指令98/81/EC附件II中的定义相同)。当用于表示两个核酸序列的相关性时,术语“同源”是指一个单链核酸序列可以与互补的单链核酸序列杂交。杂交的程度可能取决于许多因素,包括序列之间的同一性量和杂交条件,例如稍后讨论的温度和盐浓度。
当用于核酸(DNA或RNA)或蛋白质时,术语“异源”和“外源”是指核酸或蛋白质不作为存在的生物体、细胞、基因组或DNA或RNA序列的一部分天然存在的,或者在不同于自然界中发现的细胞或基因组或DNA或RNA序列中的一个或多个位置中发现的核酸或蛋白质。异源和外源核酸或蛋白质对引入它们的细胞不是内源的,而是已经从另一个细胞获得或者是合成的或重组产生的。通常但不一定,此类核酸编码蛋白质,即外源蛋白质,其通常不由转录或表达DNA的细胞产生。类似地,外源RNA编码通常在外源RNA存在的细胞中不表达的蛋白质。异源/外源核酸和蛋白质也可称为外来核酸或蛋白质。本领域技术人员认为的对其表达的细胞来说是外来的任何核酸或蛋白质在本文中涵盖在术语异源或外源核酸或蛋白质中。术语异源和外源也适用于核酸或氨基酸序列的非天然组合,即其中至少两个组合序列相对于彼此是外源的组合。
“microRNA”或“miRNA”是指非编码核酸(RNA)序列,其结合至少部分互补核酸序列(mRNA)并在转录后水平负调控靶mRNA的表达。microRNA通常从具有双链发夹环结构的“前体”miRNA加工成“成熟”形式。通常,成熟microRNA序列的长度约为19-25个核苷酸。
“miR-9”是一种短的非编码RNA基因,其参与基因调控并且从果蝇和小鼠到人都是高度保守的。成熟的~21nt miRNA由Dicer酶从发夹前体序列加工得到。miR-9可能是发育中和成年脊椎动物脑中表达最高的microRNA之一。关键转录调节因子如FoxG1、Hesl或Tlx可以是miR-9的直接靶标,将其置于控制神经元祖细胞状态的基因网络的核心。
如本文所用的术语“神经元”或“神经元细胞”可具有本领域技术人员所理解的普通含义。在一些实施方案中,神经元可以指电可兴奋细胞,其可以通过电信号(如膜电位放电)和化学信号(如神经递质的突触传递)接收、处理和传递信息。如本领域技术人员所理解的,在神经元之间转导的化学信号(例如,基于神经递质的释放和识别)可以通过称为突触的专门连接发生。
术语“成熟神经元”可以指分化的神经元。在一些实施方案中,如果神经元表达例如下述成熟神经元的一种或多种标志物,则它是成熟神经元:微管相关蛋白2(MAP2)和神经元核抗原(NeuN)、神经元特异性烯醇化酶(NSE)、160kDa神经丝介质、200kDa神经丝重链、突触后密度蛋白95(PDS-95)、突触蛋白I、突触生长蛋白(synaptophysin)、谷氨酸脱羧酶67(GAD67)、谷氨酸脱羧酶67(GAD65)、小清蛋白、多巴胺和cAMP调节的神经元磷蛋白32(DARPP32)、囊泡谷氨酸转运体1(vGLUT1)、囊泡谷氨酸转运体2(vGLUT2)、乙酰胆碱和酪氨酸羟化酶(TH)等。
术语“功能性神经元”可以指能够通过化学或电信号发送或接收信息的神经元。在一些实施方案中,功能性神经元表现出存在于正常神经系统中的成熟神经元的一种或多种功能特性,包括但不限于:兴奋性(例如,表现出动作电位的能力,例如跨越细胞膜的电压或膜电位的快速上升和随后下降)、与其他神经元形成突触连接、突触前神经递质释放和突触后响应(例如,兴奋性突触后电流或抑制性突触后电流)。
在一些实施方案中,功能性神经元的特征在于其表达一种或多种功能性神经元的标志物,包括但不限于突触蛋白、突触生长蛋白、谷氨酸脱羧酶67(GAD67)、谷氨酸脱羧酶67(GAD65)、小清蛋白、多巴胺和cAMP调节的神经元磷蛋白32(DARPP32)、囊泡谷氨酸转运体1(vGLUT1)、囊泡谷氨酸转运体2(vGLUT2)、乙酰胆碱、酪氨酸羟化酶(TH)、多巴胺、囊泡GABA转运体(VGAT)和γ-氨基丁酸(GABA)。
术语“非神经元细胞”可以指不是神经元的任何类型的细胞。示例性的非神经元细胞是具有不同于神经元谱系(例如造血谱系)的细胞谱系的细胞。在一些实施方案中,非神经元细胞是神经元谱系的细胞但不是神经元,例如神经胶质细胞。在一些实施方案中,非神经元细胞是非神经元的体细胞,例如但不限于神经胶质细胞、成人原代成纤维细胞、胚胎成纤维细胞、上皮细胞、黑素细胞、角质形成细胞、脂肪细胞、血细胞、骨髓基质细胞细胞、朗格汉斯细胞、肌肉细胞、直肠细胞或软骨细胞。在一些实施方案中,非神经元细胞来自非神经元细胞系,例如但不限于成胶质母细胞瘤细胞系、Hela细胞系、NT2细胞系、ARPE19细胞系或N2A细胞系。
“细胞谱系”或“谱系”可以表示受精胚胎的组织或器官的发育史。
“神经元谱系”可以指从神经干细胞到成熟神经元的发育史,包括沿该过程的各个阶段(称为神经发生),例如但不限于神经干细胞(神经上皮细胞、放射状胶质细胞)、神经祖细胞(例如,中间神经元前体)、神经元、星形胶质细胞、少突胶质细胞和小胶质细胞。
如本文所用,当用于提及生物体时,术语“非天然存在的”是指该生物体具有至少一种通常在参考物种的天然存在的菌株(包括参考物种的野生型菌株)中没有发现的遗传学改变。遗传学改变包括,例如,引入编码蛋白质或酶的可表达核酸的修饰、其他核酸添加、核酸缺失、核酸替换或生物体遗传物质的其他功能性破坏。此类修饰包括例如参考物种的异源或同源多肽的编码区及其功能片段。额外的修饰包括,例如非编码调控区,其中修饰改变基因或操纵子的表达。对编码酶或其功能片段的核酸分子的遗传学修饰可以赋予非天然存在生物体从其天然存在状态改变的生化反应能力或代谢途径能力。
本文可互换使用的术语“核酸”和“多核苷酸”可指单链或双链形式的脱氧核糖核苷酸或核糖核苷酸及其聚合物。该术语可涵盖含有已知核苷酸类似物或修饰的主链残基或连接的核酸,它们是合成的、天然存在的和非天然存在的,具有与参考核酸相似的结合特性,并且以与参考核苷酸相似的方式代谢。此类类似物的实例包括但不限于硫代磷酸酯、氨基磷酸酯、磷酸甲酯、手性磷酸甲酯、2-O-甲基核糖核苷酸、锁核酸(LNA)和肽-核酸(PNA)。
“核酸构建体”或“核酸载体”在本文中应理解为指使用重组DNA技术产生的人造核酸分子。因此,术语“核酸构建体”不包括天然存在的核酸分子,尽管核酸构建体可以包含(部分)天然存在的核酸分子。“载体”是用于将外源核酸序列(即DNA或RNA)转移到宿主细胞中的核酸构建体(通常是DNA或RNA)。载体优选地通过自主复制和整合到宿主细胞基因组中的至少一种保持在宿主中。术语“表达载体”或“表达构建体”是指能够影响基因在与此类序列相容的宿主细胞或宿主生物体中表达的核苷酸序列。这些表达载体通常包括至少一个“表达盒”,其是能够影响编码待表达产物的序列表达的功能单元,并且其中编码序列可操作地连接至合适的表达控制序列,表达控制序列至少包含合适的转录调控序列和任选的3'转录终止信号。还可能存在影响表达所必需或有帮助的其他因子,例如表达增强子元件。表达载体将被引入合适的宿主细胞并且能够在宿主细胞的体外细胞培养物中影响编码序列的表达。优选的表达载体将适合于表达病毒蛋白和/或核酸,特别是重组AAV蛋白和/或核酸。
“少突胶质细胞”可以指一种类型的神经胶质细胞,它可以产生围绕神经元轴突的髓鞘,以为中枢神经系统中的轴突提供支持和绝缘。少突胶质细胞的特征还在于它们表达PDGF受体α(PDGFR-α)、SOXIO、神经/胶质抗原2(NG2)、Olig 1、Olig 2和Olig 3、少突胶质细胞特异性蛋白(OSP)、髓磷脂碱性蛋白(MBP)或髓鞘少突胶质细胞糖蛋白(MOG)。
“多聚嘧啶束结合蛋白”或“PTB”及其同系物神经PTB(nPTB)都是普遍存在的RNA结合蛋白。PTB也可以称为多聚嘧啶束结合蛋白1,在人中由PTBP1基因编码。PTBP1基因属于普遍表达的异质核核糖核蛋白(hnRNP)亚家族。
hnRNP是RNA结合蛋白,它们与异质核RNA(hnRNA)复合。这些蛋白质与细胞核中的前体mRNA相关,并且似乎影响前体mRNA的加工以及mRNA代谢和转运的其他方面。PTB可以有四个重复的结合RNA的准RNA识别基序(RRM)结构域。与其广泛表达相一致,PTB可以有助于抑制大量选择性剪接事件。PTB可以识别位于富含嘧啶的环境中的短RNA基序,例如UCUU和UCUCU,并且通常与组成型和替代外显子的3'剪接位点上游的多聚嘧啶束相关。
在一些情况下,PTB的结合位点还可以包括外显子序列和调控外显子下游的内含子中的序列。
在大多数由PTB调控的替代剪接系统中,抑制可以通过PTB与替代外显子周围的多个PTB结合位点的相互作用来实现。
在一些情况下,抑制可能涉及单个PTB结合位点。PTB的剪接抑制可以通过PTB和U2AF65之间的直接竞争发生,这反过来可以阻止U2 snRNP在分支点上的组装。在一些情况下,PTB的剪接抑制可能涉及位于替代外显子两侧的PTB结合位点,并且可能是环出RNA的PTB分子之间的协同相互作用产生,从而使剪接位点无法进入剪接机制。PTB的剪接抑制还可能涉及PTB从高亲和力结合位点的多聚化,这会产生覆盖替代外显子并阻止其识别的抑制波。
PTB可在非神经元细胞中广泛表达,而nPTB可仅局限于神经元。PTB和nPTB可以在神经元分化过程中经历编程转换。例如,在神经元分化过程中,PTB在神经元诱导阶段逐渐下调,巧合地或必然地,nPTB水平逐渐上调至峰值水平。之后,当神经元分化进入神经元成熟阶段时,nPTB水平在最初上升后经历下降,然后恢复到与神经元分化过程中的峰值水平相比相对较低的水平,此时细胞发育成成熟的神经元。
PTB和nPTB的序列是已知的(参见,例如Romanelli et al.(2005)Gene356:11-8;Robinson et al.,PLoS One.(2008)3(3):el801.doi:10.1371/journal.pone.0001801;Makeyev et al.,Mol.Cell(2007)27(3):435-448);因此,本领域技术人员可以设计和构建gRNA分子等来调控,例如降低或抑制PTB/nPTB的表达以实施本申请的方法。
术语“蛋白质”、“肽”和“多肽”可互换使用,并且可以指氨基酸聚合物或一组两种或更多种相互作用或结合的氨基酸聚合物,而不涉及特定的作用模式、大小、三维结构或来源。
如本文所用,术语“启动子”或“转录调控序列”是指具有控制一个或多个编码序列的转录功能的核酸片段,其位于编码序列转录起始位点转录方向的上游,在结构上通过依赖DNA的RNA聚合酶的结合位点、转录起始位点和任何其它DNA序列的存在来识别,包括但不限于转录因子结合位点、阻遏物和激活物蛋白结合位点、增强子和本领域技术人员已知的用于直接或间接调节启动子转录量的任何其他核苷酸序列。“组成型”启动子是在大多数环境和发育条件下在大多数组织中有活性的启动子。“诱导型”启动子是受环境或发育调节,例如通过应用化学诱导剂或生物实体诱导的启动子。
如本文所用,术语“可操作地连接”是指功能关系中的多核苷酸(或多肽)元件的连接。当核酸被置于与另一个核酸序列的功能关系中时,它是“可操作地连接的”。例如,如果转录调控序列影响编码序列的转录,则它可操作地连接到编码序列。可操作地连接指被连接的DNA序列通常是连续的,并且在必要时连接两个蛋白质编码区,是连续的并且在阅读框中。当表达控制序列控制和调控核苷酸序列的转录和/或翻译时,表达控制序列“可操作地连接”到核苷酸序列。因此,表达控制序列可以包括启动子、增强子、内部核糖体进入位点(IRES)、转录终止子、蛋白质编码基因前的起始密码子、内含子的剪接信号和终止密码子。
术语“重编程”或“转分化”可以指从不同类型的细胞(例如成纤维细胞)生成某种谱系的细胞(例如神经元细胞),而没有将细胞去分化成表现出多能干细胞特征的细胞的中间过程。
“多能性”可以指细胞形成身体或体细胞(即胚胎本身)所有谱系的能力。示例性的“多能干细胞”可以包括胚胎干细胞和诱导的多能干细胞。
术语“序列同一性”、“同源性”等在本文中可互换使用。序列同一性在本文中定义为两个或多个氨基酸(多肽或蛋白质)序列或两个或多个核酸(多核苷酸)序列之间的关系,如通过比较序列所确定的。在本领域中,“同一性”还指氨基酸或核酸序列之间的序列相关性的程度,视情况而定,如此类序列的串之间的匹配所确定的。两个氨基酸序列之间的“相似性”通过将一种多肽的氨基酸序列及其保守氨基酸取代物与第二多肽的序列进行比较来确定。“同一性”和“相似性”可以通过已知方法容易地计算。
“序列同一性”和“序列相似性”可以通过使用全局或局部比对算法比对两个肽或两个核苷酸序列来确定,这取决于两个序列的长度。相似长度的序列优选使用全局比对算法(例如,Needleman Wunsch)进行比对,该算法在整个长度上对序列进行最佳比对,而本质上不同长度的序列优选使用局部比对算法(例如,Smith Waterman)进行比对。当序列(当通过例如程序GAP或BESTFIT使用默认参数进行最佳比对时)共享至少某一最小百分比的序列同一性时(如下文所定义),序列可被称为“基本相同”或“基本相似”。GAP使用Needleman和Wunsch全局比对算法在整个长度(全长)上比对两个序列,从而最大化匹配的数量并最小化缺口的数量。当两个序列具有相似长度时,全局比对适合用于确定序列同一性。通常,使用GAP默认参数,缺口产生罚分=50(核苷酸)/8(蛋白质),缺口延伸罚分=3(核苷酸)/2(蛋白质)。对于核苷酸,使用的默认评分矩阵是nwsgapdna,对于蛋白质,默认评分矩阵是Blosum62(Henikoff&Henikoff,1992,PNAS 89,915-919)。序列比对和百分比序列同一性的分数可以使用计算机程序来确定,例如GCGWisconsin Package,10.3版,可从AccelrysInc.,9685Scranton Road,San Diego,CA 92121-3752USA获得,或使用开源软件,例如EmbossWIN版本2.10.0中的程序“needle”(使用全局Needleman Wunsch算法)或“water”(使用局部Smith Waterman算法),使用与上述GAP相同的参数,或者使用默认设置(对于“needle”和“water”以及对于蛋白质和DNA比对,默认缺口开放罚分是10.0,默认缺口延伸罚分是0.5;默认的评分矩阵是蛋白质的Blossum62和DNA的DNAFull)。当序列具有实质上不同的总长度时,首选局部比对,例如使用Smith Waterman算法的那些。
或者,百分比相似性或同一性可以通过使用诸如FASTA、BLAST等算法对公共数据库进行搜索来确定。因此,本申请的核酸和蛋白质序列可进一步用作“查询序列”来对公共数据库进行搜索以例如鉴定其他家族成员或相关序列。可以使用Altschul,et al.(1990)J.Mol.Biol.215:403—10的BLASTn和BLASTx程序(2.0版)进行此类搜索。BLAST核苷酸搜索可以用NBLAST程序(得分=100,字长=12)进行,以获得与本申请的核酸分子同源的核苷酸序列。BLAST蛋白质搜索可以用BLASTx程序(得分=50,字长=3)进行,以获得与本申请的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的缺口比对,可以如Altschul etal.,(1997)Nucleic Acids Res.25(17):3389-3402中所述利用Gapped BLAST。当利用BLAST和Gapped BLAST程序时,可以使用各自程序的默认参数(例如,BLASTx和BLASTn)。参见http://www.ncbi.nlm.nih.gov/国家生物技术信息中心的主页。
除非另有说明,否则可互换使用的术语“受试者”和“患者”可以指哺乳动物,例如人类和非人灵长类,以及兔、大鼠、小鼠、山羊、猪和其它哺乳动物物种。该术语不一定表示受试者已被诊断出患有特定疾病,而是可以指在医学监督下的个体。
“靶序列”是指待靶向的核酸内的核苷酸顺序(例如其中引入或检测改变)。在向导RNA(gRNA)-CAS复合物的上下文中,“靶序列”在本文中进一步理解为RNA或DNA分子内的部分,其通过与gRNA中“向导序列”的互补性而被gRNA-CAS复合物靶向(也见上文)。同样,反义寡核苷酸或miRNA通过其与待靶向的RNA或DNA分子内的“靶序列”的互补性而被靶向。
例如,靶序列是DNA双链体的第一链所包含的核苷酸顺序。
例如,受益于所公开的方法和组合物的哺乳动物物种包括但不限于灵长类,例如猿、黑猩猩、猩猩和人。
“载体”是能够将另一种核酸转运到细胞中的核酸。当载体存在于合适的环境中时,其能够指导载体所携带的由一个或多个基因编码的一种或多种蛋白质或由多核苷酸编码的microRNA的表达。
本文件中描述的物质作为药物的用途也可以解释为该物质在药物制造中的用途。类似地,当一种物质用于治疗或作为药物时,它也可以用于制造治疗药物。本文所述作为药物使用的产品可用于治疗方法,其中此类治疗方法包括施用使用的产品。
“病毒载体”是能够将另一种核酸转运到细胞中的病毒衍生核酸。当病毒载体存在于合适的环境中时,病毒载体能够指导由载体所携带的一种或多种基因编码的一种或多种蛋白质或由载体所携带的多核苷酸编码的microRNA的表达。病毒载体的实例包括但不限于逆转录病毒、腺病毒、慢病毒和腺相关病毒载体。
发明详细说明
通用方法和组合物
在一方面,本申请涉及一种治疗与非人灵长类或人类的神经系统区域中功能性神经元退化相关的神经病况的方法。方法优选地包括向有需要的受试者施用有效量的包含细胞编程剂的组合物。在一个实施方案中,包含细胞编程剂的组合物至少包含靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列的核酸分子,以抑制非神经元细胞中PTB的表达或活性,从而允许非神经细胞重新编程为功能性神经元。靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列的核酸分子因此可以是或者可以编码反义核酸(例如用于诱导外显子跳跃)、miRNA或向导RNA中的至少一种(gRNA,用于指导CRISPR/Cas效应蛋白的核酸酶活性)。
在一个实施方案中,包含细胞编程剂的组合物中的核酸分子是靶向灵长类PTB基因、转录物或mRNA中的靶序列的核酸分子,或在双链PTB DNA或RNA序列的情况下,核酸分子可以靶向两条互补链中的任何一条。核酸分子靶向灵长类PTB基因、转录物或mRNA中的靶序列(或其互补序列)被理解为是指至少部分核酸分子与灵长类PTB核酸中的靶序列基本上互补,使得可以与灵长类PTB核酸碱基配对,优选在生理条件下,以发挥其生物学效应,即抑制非神经元细胞中的PTB表达或活性。
发明人已经鉴定了灵长类或人类PTB基因、转录物或mRNA有效靶序列中的靶序列,本申请的核酸分子对靶序列的靶向确保了高效抑制非神经元细胞中的PTB表达或活性,这将在下文中进一步详述。
在一个实施方案中,包含细胞编程剂的组合物包含:i)CRISPR/Cas效应蛋白和与聚嘧啶序列结合蛋白(,PTB)mRNA互补的gRNA,或ii)至少一种编码CRISPR/Cas效应蛋白和与PTB mRNA互补的向导RNA (gRNA)的表达载体。
具体而言,本申请的一个方面提供了将非神经元细胞重编程为成熟神经元的方法。示例性方法包括:提供非神经元细胞,以及使非神经元细胞与包含抑制非神经元细胞中PTB和/或nPTB的表达和/或活性的细胞编程剂(例如具有向导RNA(gRNA)的CRISPR/Cas效应子或编码它们的多核苷酸)的组合物接触,从而将非神经元细胞重编程为成熟神经元。方法和组合物不仅在体外转化细胞,而且在神经系统(例如纹状体、视网膜、内耳和脊髓)中直接在体内转化。
在一些实施方案中,本申请涉及治疗与非人灵长类或人类的神经系统区域中的功能性神经元退化相关的神经病况的方法,所述方法包括向有需要的受试者的神经系统区域中的非神经元细胞施用有效量的组合物,其包含i)靶向RNA的Cas效应蛋白和靶向灵长类PTB mRNA序列的向导RNA(gRNA);或ii)至少一种编码靶向RNA的Cas效应蛋白并编码靶向灵长类PTB mRNA序列的gRNA的表达载体,以抑制非神经元细胞中PTB的表达或活性,从而允许将非神经细胞重编程为功能性神经元。
根据本公开的一些实施方案,抑制非人灵长类或人类的非神经元细胞(例如,成熟视网膜中的MG细胞或纹状体中的星形胶质细胞)中PTB/nPTB的表达和/或活性的单一细胞编程剂(例如,Cas/gRNA)可以直接将非神经元细胞转化为成熟神经元(例如,分别为视网膜神经节细胞(RGC)神经元、视网膜光感受器或多巴胺神经元)。在一些实施方案中,通过单一细胞编程剂(例如,Cas/gRNA)将非神经元细胞直接转化为神经元可能意味着将非神经元细胞转化为神经元不需要其他干预,只需与单一细胞编程剂接触。
在另一个实施方案中,本公开提供了将星形胶质细胞重编程为成熟神经元的方法。示例性方法包括:提供待重编程的星形胶质细胞;以及将星形胶质细胞与包含抑制星形胶质细胞中PTB的表达或活性的细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas或编码它们的多核苷酸)的组合物接触至少1天,从而将星形胶质细胞重编程为成熟的神经元,例如多巴胺神经元。在一些实施方案中,抑制星形胶质细胞中PTB表达或活性的单一细胞编程剂(例如,具有靶向PTB的gRNA的Cas)可以将星形胶质细胞直接转化为神经元,例如多巴胺神经元。在一些实施例中,星形胶质细胞在纹状体中。
在另一个实施方案中,本申请提供了将MG细胞(例如成熟视网膜中的细胞)重编程为RGC神经元的方法。示例性方法包括:提供待重编程的MG单元;以及使MG细胞与包含抑制MG细胞中PTB和/nPTB的表达或活性的细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas或编码它们的多核苷酸)的组合物接触至少1天,从而将MG细胞重编程为RGC神经元。在一些实施方案中,抑制MG细胞中PTB表达或活性的单一细胞编程剂(例如,具有靶向PTB的gRNA的Cas)可以将MG细胞直接转化为RGC神经元。在一些实施方案中,MG细胞在成熟视网膜中。
根据本公开,在某些情况下,PTB减少可以诱导许多关键的神经元分化因子。例如,不希望受某种理论的束缚,PTB和nPTB可以分别参与两个独立但相互缠绕的环,这在神经元分化中可能很重要。PTB可以抑制神经元诱导环,其中microRNAmiR-124可以抑制转录阻遏物RE1-沉默转录因子(REST),后者又可以阻断miR-124和许多神经元特异性基因的诱导(环I)。在正常的神经元分化过程中,PTB可以逐渐下调,因此PTB的下调可以诱导nPTB的表达,nPTB是神经元成熟的第二环的部分,包括转录激活因子Brn2和miR-9(环II)。在环II中,nPTB可以抑制Brn2,因此可以抑制miR-9,而miR-9反过来可以抑制nPTB。
根据一些实施方案,非神经元细胞中的miR-9或Brn2的表达水平可通过抑制非神经元细胞中的PTB的表达或活性的细胞编程剂影响非神经元细胞向成熟神经元的转化。例如,成人成纤维细胞可能具有低表达水平的miR-9和Brn2。在一些实施方案中,抑制成人成纤维细胞中的PTB表达或活性的单一药剂可诱导成人成纤维细胞分化成神经元样细胞,例如Tuj1蛋白的表达,但不会分化成成熟神经元,例如,NeuN蛋白或成熟神经元的其他标志物的表达。
不希望受特定理论的束缚,在一些实施方案中,主题方法和组合物在引导非神经元细胞转化为神经元的分子变化中产生强化反馈环方面特别有效。不希望受特定理论的束缚,当PTB表达或活性最初被外源性抗PTB药剂下调时,REST水平可以下调,这又可以导致miR-124水平上调。
不希望受特定理论的束缚,在某些情况下,由于miR-124可以靶向并抑制PTB的表达,因此上调的miR-124可以强化对细胞中PTB的抑制;这种积极的强化作用可以是持久的,即使在某些情况下,抗PTB药剂,例如针对PTB的反义寡核苷酸,可能存在于细胞中并仅暂时具有活性。
根据本公开的一些实施方案,抑制人非神经元细胞中PTB/nPTB的表达或活性的单一细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas或编码它们的多核苷酸)可以将非神经元细胞直接转化为成熟神经元,任选地当人非神经元细胞以高于成人成纤维细胞中表达的水平表达miR-9或Brn2时。
可用于本文提供的方法的示例性人非神经元细胞以比成人成纤维细胞中表达的水平高至少两倍的水平表达miR-9或Brn2。在一些实施方案中,人非神经元细胞比成人成纤维细胞中表达的水平高至少约1.2、1.5、2、5、10、15、20或50倍的水平表达miR-9或Brn2。
在一些实施方案中,当人类非神经元细胞以高于成人成纤维细胞中表达的水平表达miR-9和Brn2时,抑制人非神经元细胞中PTB/nPTB表达或活性的单一细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas)可以将非神经元细胞直接转化为成熟神经元。
可用于本文提供的方法中的示例性人非神经元细胞以比成人成纤维细胞中表达的水平高至少两倍的水平表达miR-9和Brn2。在一些实施方案中,人类非神经元细胞以比成人成纤维细胞中表达的水平高至少约1.2、1.5、2、5、10、15、20或50倍的水平表达miR-9和Brn2。
在一些实施方案中,当人非神经元细胞以高于成人成纤维细胞中表达的水平表达内源性miR-9或内源性Brn2时,抑制人非神经元细胞中PTB/nPTB的表达或活性的单一细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas)可将非神经元细胞直接转化为成熟神经元。在一些实施方案中,没有将外源性miR-9引入到人非神经元细胞。在一些实施方案中,没有将外源性Brn2引入人非神经元细胞。
在一些实施方案中,非神经元细胞中miR-9或Brn2的表达水平可以通过本领域技术人员理解的任何技术来评估。例如,细胞中miR-9的表达水平可以通过逆转录(RT)-聚合酶链式反应(PCR)、miRNA阵列、RNA测序(RNA-seq)和多重miRNA分析来测量。miR-9的表达水平也可以通过原位方法如原位杂交测定。Brn2作为蛋白质的表达水平可以通过常规技术如蛋白质印迹、酶联免疫吸附分析(ELISA)和免疫染色,或通过其他技术,如但不限于蛋白微阵列和光谱法(例如,高效液相色谱法(HPLC)和液相色谱-质谱法(LC/MS))进行测定。在一些实施方案中,关于细胞或某种类型的组织/细胞中miR-9的表达水平的信息可以通过参考可公开获得的microRNA数据库来获得,例如但不限于人MiRNA表达数据库(HMED)、miRGator3.0、miRmine和PhenomiR。在一些实施例中,关于细胞或某种类型的组织/细胞中miR-9的表达水平的信息可以通过参考可公开获得的蛋白质表达数据库来获得,包括但不限于人类蛋白质图谱、GeMDBJ蛋白质组学、人类蛋白质小儿科(Human Proteinpedia)和Kahn动态蛋白质组学数据库。
根据某些实施方案,示例性方法包括提供待重编程的人非神经元细胞;以及使人非神经元细胞与包含单一细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas)的组合物接触,该单一细胞编程剂导致人非神经元细胞中PTB的表达或活性的降低,以及PTB表达或活性降低后nPTB的表达或活性降低。在一些实施方案中,细胞编程剂可以导致关于PTB和nPTB在某种类型的非神经元细胞(例如人非神经元细胞,例如人神经胶质细胞)中的表达或活性水平的连续事件。在一些实施方案中,与细胞编程剂(例如,具有靶向PTB的gRNA的Cas)接触的直接作用是降低非神经元细胞中PTB的表达或活性。在一些实施方案中,在非神经元细胞中,非神经元细胞中PTB表达或活性的降低伴随着非神经元细胞中nPTB表达水平的初始增加。在一些实施方案中,随着PTB的表达或活性被抑制,初始nPTB表达水平增加至高nPTB表达水平。在一些实施方案中,在初始增加之后,nPTB表达从高nPTB表达水平降低至低nPTB表达水平。在一些实施方案中,在抑制PTB的表达或活性之后,低nPTB表达水平仍高于初始nPTB表达水平。在一些实施方案中,除了抑制PTB表达或活性的细胞编程剂之外,在没有外部干预的情况下,nPTB表达水平在初始增加后自发降低。不受某种理论的束缚,在PTB表达或活性被细胞编程剂降低后,非神经元细胞中nPTB表达水平的随后降低可与通过细胞编程剂非神经元细胞直接转化为成熟神经元相关。根据一些实施方案,抑制PTB表达或活性的单一细胞编程剂(例如,具有靶向PTB的gRNA的Cas)不会在成人成纤维细胞(例如nPTB)中诱导上述顺序事件,例如nPTB可经历表达水平的初始升高,但没有随后降低至某一低水平。
在一些实施方案中,在人星形胶质细胞中,抑制人星形胶质细胞中PTB表达或活性的单一细胞编程剂(例如,具有靶向PTB的gRNA的Cas)导致PTB表达或活性立即降低,nPTB表达水平的初始增加,以及nPTB表达水平的随后降低。在一些实施方案中,抑制PTB表达或活性的单一细胞编程剂(例如,具有靶向PTB的gRNA的Cas)将人星形胶质细胞直接转化为成熟神经元。在一些实施方案中,非神经元细胞中miR-9或Brn2的表达水平可以与非神经元中的nPTB表达水平在PTB表达或活性被细胞编程剂抑制后的初始增加后是否降低相关联。例如,在人星形胶质细胞中,miR-9或Brn2的表达水平高于成人成纤维细胞,非神经元中的nPTB表达水平在PTB表达或活性被细胞编程剂抑制后的初始增加后降低,而在成人成纤维细胞中,如上所述,在某些情况下,nPTB表达水平的随后降低可能不会发生。
根据一些实施方案,在本文提供的方法中可被重编程为成熟神经元的示例性非神经元细胞可包括神经胶质细胞,例如但不限于星形胶质细胞、少突胶质细胞、室管膜细胞、小胶质细胞、米勒胶质细胞、螺旋神经节神经胶质细胞、施万细胞(Schwan cell)、NG2细胞和卫星细胞。在一些实施方案中,神经胶质细胞可以是灵长类神经胶质细胞,例如,人神经胶质细胞或非人灵长类神经胶质细胞。优选地,神经胶质细胞是灵长类星形胶质细胞,例如,人星形胶质细胞或非人灵长类星形胶质细胞。
在一些实施方案中,可用于本文提供的方法的神经胶质细胞是从脑中分离的神经胶质细胞。在一些实施方案中,神经胶质细胞是细胞培养物中的神经胶质细胞,例如,从亲代神经胶质细胞分裂的神经胶质细胞。在一些实施方案中,本文提供的神经胶质细胞是在外部诱导下从不同类型的细胞分化的神经胶质细胞,例如,在含有分化因子的培养基中从神经元干细胞体外分化的神经胶质细胞,或从诱导的多能干细胞分化的神经胶质细胞。在一些其他实施方案中,神经胶质细胞是神经系统中的神经胶质细胞,例如,成熟视网膜中的MG细胞,或存在于脑区如纹状体中的星形胶质细胞。
在一些实施方案中,可用于本文提供的方法的星形胶质细胞是脑或脊髓中的星形神经胶质细胞。在一些实施方案中,星形胶质细胞表达公认的星形胶质细胞标志物中的一种或多种,包括但不限于神经胶质纤维酸性蛋白(GFAP)和醛脱氢酶1家族成员LI(ALDH1L1)、兴奋性氨基酸转运体1/天冬氨酸谷氨酸转运体(EAAT1/GLAST)、谷氨酰胺合成酶、S100β或兴奋性氨基酸转运体1/谷氨酸转运体1(EAAT2/GLT-1)。在一些实施方案中,星形胶质细胞表达神经胶质纤维酸性蛋白(GFAP)、醛脱氢酶1家族成员LI(ALDH1L1)或两者。在某些实施方案中,星形胶质细胞是神经系统中的非神经元细胞,其表达神经胶质纤维酸性蛋白(GFAP)启动子驱动的转基因(例如,红色荧光蛋白(RFP)、Cre重组酶)。在一些实施方案中,本文所述的星形胶质细胞对神经元标志物例如Tuj1、NSE、NeuN、GAD67、VGluT1或TH不是免疫阳性的。在一些实施方案中,本文所述的星形胶质细胞对于少突胶质细胞标志物例如少突胶质细胞转录因子2、OLIG2不是免疫阳性的。在一些实施方案中,本文所述的星形胶质细胞对小神经胶质细胞标志物例如跨膜蛋白119(TMEM119)、CD45、离子钙结合衔接分子1(Ibal)、CD68、CD40、F4/80或CD11抗原样家庭成员B(CDllb)不是免疫阳性的。在一些实施方案中,本文所述的星形胶质细胞对NG2细胞标志物(例如,神经/胶质细胞抗原2、NG2)不是免疫阳性的。在一些实施方案中,本文所述的星形胶质细胞对神经祖细胞标志物例如巢蛋白、CXCR4、Musashi、Notch-1、SRY-Box 1(SOX1)、SRY-Box 2(SOX2)、阶段特异性胚胎抗原1(SSEA-1,也称为CD15)或波形蛋白不是免疫阳性的。在一些实施方案中,本文所述的星形胶质细胞对于多能性标志物例如,NANOG、八聚体结合转录因子4(Oct-4)、SOX2、Kruppel样因子4(KLF4)、SSEA-1或阶段特异性胚胎抗原4(SSEA-4)不是免疫阳性的。在一些实施方案中,本文所述的星形胶质细胞对成纤维细胞标志物(例如,纤连蛋白)不是免疫阳性的。
星形胶质细胞可以包括不同的类型或分类。本申请的方法适用于不同类型的星形胶质细胞。不同类型星形胶质细胞的非限制性实例包括1型星形胶质细胞,其可以是Ran2
细胞编程剂、其组分和包含其的组合物
如本文所提供,包含细胞编程剂的组合物含有靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列的核酸分子,以抑制非神经元细胞中PTB的表达或活性,从而允许非神经细胞重编程为功能性神经元。在一个实施方案中,核酸分子是或编码至少一种靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列的反义核酸、RNAi或向导RNA(gRNA)。
在某些实施方案中,核酸分子(例如gRNA)靶向灵长类PTB基因序列例如非人灵长类PTB基因序列或优选人类PTB基因序列中的靶序列。待靶向的灵长类PTB基因序列的实例包括例如人类PTBP1基因序列(例如,GenBank ID 5725)。
灵长类和人类PTB和nPTB的序列是已知的(参见例如Romanelli et al.(2005)Gene,August 15:356:11-8;Robinson et al.,PLoS One.2008Mar.12;3(3):e1801.doi:10.1371/journal.pone.0001801;Makeyev et al.,Mol.Cell(2007)August 3;27(3):435-48);因此,本领域技术人员可以设计和构建反义、miRNA、siRNA向导RNA分子等以调节,例如,降低或抑制灵长类PTB和/或nPTB的表达来实施本申请的方法。
在一些实施方案中,核酸分子(例如gRNA)靶向灵长类PTB基因、转录物或mRNA序列中的靶序列,其在人类和非人灵长类之间是保守的。
在某些实施方案中,核酸分子(例如gRNA)靶向灵长类PTB mRNA序列中,例如非人灵长类PTB mRNA序列或优选地人类PTB mRNA序列的靶序列。在一些实施方案中,核酸分子(例如gRNA)靶向灵长类mRNA序列中蛋白质编码序列中的靶序列。
在某些实施方案中,PTB基因、转录物或mRNA中的靶序列包含在与SEQ ID NO:87至少95%、96%、97%、98%、99%或100%相同的PTB序列中。优选的靶序列是其靶向导致有效抑制非神经细胞中灵长类PTB蛋白表达或活性的靶序列。因此,在一个实施方案中,PTB基因、转录物或mRNA中的靶序列包含在与SEQ ID NO:87至少95、96、97、98、99或100%相同的PTB序列中,其中当用向导RNA(gRNA)靶向靶序列时,所述gRNA的向导序列与SEQ ID NOs:1-86中至少一个序列有至少10个核苷酸重叠,所述gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达量小于0.5、0.45、0.4、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。更优选地,PTB基因、转录物或mRNA中的靶序列包含在与SEQ ID NO:87至少95、96、97、98、99或100%相同的PTB序列中,其中当用向导RNA(gRNA)靶向靶序列时,所述gRNA的向导序列包含SEQ ID NOs:1-86中的至少一种或由SEQ ID NOs:1-86中的至少一种组成,所述gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达量小于0.5、0.45、0.4、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
在一个实施方案中,PTB基因、转录物或mRNA中的靶序列包含与PTB序列中至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸和/或不超过60、55、50、45、40、35、34、33、32、31、30、29、28、27或26个核苷酸的连续序列或由其组成,其中该PTB序列与SEQ ID NO:87至少95、96、97、98、99或100%相同。
在一个实施方案中,PTB基因、转录物或mRNA中的靶序列包含PTB序列中至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸和/或不超过60、55、50、45、40、35、34、33、32、31、30、29、28、27或26个核苷酸的连续序列或由其组成,其中该PTB序列与SEQ ID NO:87的位置951-1487至少95、96、97、98、99或100%相同,并且其中优选地,当用向导RNA(gRNA)靶向靶序列时,所述gRNA的向导序列包含SEQ ID NOs:38-68中的至少一个或者由其组成,所述gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达,与仅表达CasRx的相应的对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达量小于0.50、0.45、0.40、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
在一个实施方案中,PTB基因、转录物或mRNA中的靶序列包含PTB序列中至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸和/或不超过60、55、50、45、40、35、34、33、32、31、30、29、28、27或26个核苷酸的连续序列或由其组成,其中该PTB序列与以下至少一种至少95、96、97、98、99或100%相同:SEQ ID NO:87的位置1000-1487;SEQ IDNO:87的位置1050-1487;SEQ ID NO:87的位置1100-1487;SEQ ID NO:87的位置1150-1487;SEQ ID NO:87的位置1200-1487;SEQ ID NO:87的位置1250-1487;SEQ ID NO:87的位置1300-1487;SEQ ID NO:87的位置1350-1487;SEQ ID NO:87的位置1400-1487;SEQ ID NO:87的位置951-1400位;SEQ ID NO:87的位置951-1350;SEQ ID NO:87的位置951-1300;SEQID NO:87的位置951-1250;SEQ ID NO:87的位置951-1200;SEQ ID NO:87的位置951-1150;SEQ ID NO:87的位置951-1100;SEQ ID NO:87的位置951-1050;和SEQ ID NO:87的位置951-1000;并且其中优选地,当用向导RNA(gRNA)靶向靶序列时,所述gRNA的向导序列包含SEQ ID NOs:38-68中的至少一种或由其组成,所述gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达量小于0.50、0.45、0.40、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
根据本申请用于靶向灵长类PTB靶序列的核酸分子或核酸序列可以是寡核苷酸、核苷酸、多核苷酸,或任何这些的片段,基因组或合成来源(可以是单链或双链并且可能代表有义链或反义链)的DNA或RNA,肽核酸(PNA),或天然或合成来源的任何DNA样或RNA样物质。用于实施本申请的核酸分子包括“核酸”或“核酸序列”,包括寡核苷酸、核苷酸、多核苷酸或任何这些的任何片段;包括基因组或合成来源(可以是单链或双链;可能代表有义链或反义链)的DNA或RNA(例如,mRNA、rRNA、tRNA、iRNA),或肽核酸(PNA),或天然或合成来源的任何DNA样或RNA样物质,包括例如iRNA、核糖核蛋白(例如,双链iRNA,例如iRNP)。用于实施本申请的核酸分子包括核酸,即寡核苷酸,其含有天然核苷酸的已知类似物。用于实施本申请的核酸分子包括具有合成骨架的核酸样结构,参见例如Mata(1997)Toxicol.Appl.Pharmacol.144:189-197;Strauss-Soukup(1997)Biochemistry36:8692-8698;Samstag(1996)Antisense Nucleic Acid Drug Dev 6:153-156。用于实施本申请的核酸分子包括“寡核苷酸”,包括可以化学合成的单链多脱氧核苷酸或两条互补的多脱氧核苷酸链。用于实施本申请的核酸分子包括不具有5'磷酸盐的合成寡核苷酸,因此在激酶存在下不加入具有ATP的磷酸盐,就不会连接到另一个寡核苷酸。合成的寡核苷酸可以与未去磷酸化的片段连接。
在一个实施方案中,根据本申请用于靶向灵长类PTB靶序列的核酸分子是反义抑制性核酸分子。在一些实施方案中,本申请因此提供了能够降低或抑制PTB和/或nPTB基因或蛋白质表达的反义或其他抑制性核酸分子。在一个实施方案中,反义抑制性核酸分子能够通过诱导PTB pre-MRNA的外显子跳跃来降低或抑制PTB和/或nPTB基因或蛋白质的表达。在一些实施方案中,本申请的方法包括可产生PTB和nPTB敲低,或消除或显著降低PTB和nPTB表达的分子的用途。在一些实施方案中,本申请的方法包括这些分子顺序敲低首先PTB,然后是nPTB,从而有效地将灵长类非神经细胞转化为具有成熟神经元标志物的功能性神经元细胞的用途。
天然存在的或合成的核酸可用作反义寡核苷酸。反义寡核苷酸可以是任何长度;例如,在替代方面,反义寡核苷酸在约5至100、约10至80、约15至60、约18至40之间。最佳长度可通过常规筛选确定。反义寡核苷酸可以以任何浓度存在。最佳浓度可通过常规筛选确定。已知多种合成的、非天然存在的核苷酸和核酸类似物可以解决这个潜在问题。例如,可以使用含有非离子骨架(例如N-(2-氨基乙基)甘氨酸单元)的肽核酸(PNA)。也可以使用具有硫代磷酸酯键的反义寡核苷酸,如在WO 97/03211;WO 96/39154;Mata(1997)ToxicolAppl Pharmacol 144:189-197;Antisense Therapeutics,ed.Agrawal(Humana Press,Totowa,N.J.,1996)中所述。本申请提供的具有合成DNA骨架类似物的反义寡核苷酸还可以包括二硫代磷酸酯、甲基膦酸酯、氨基磷酸酯、烷基磷酸三酯、氨基磺酸酯、3'-硫代缩醛、亚甲基(甲基亚氨基)、3'-N-氨基甲酸酯和吗啉代氨基甲酸酯核酸。
在一些实施方案中,本申请使用能够减少或抑制灵长类PTB或nPTB基因、信息或蛋白质表达的RNAi抑制性核酸分子。
在一个实施方案中,RNAi分子包含双链RNA (dsRNA)分子。RNAi分子可包含双链RNA(dsRNA)分子,例如siRNA、miRNA(microRNA)和/或短发夹RNA(shRNA)分子。例如,在一个实施方案中,本申请使用抑制或阻止灵长类PTB和/或nPTB的表达和/或活性的抑制性核酸,例如siRNA、miRNA或shRNA。
在一些实施方案中,RNAi的长度为约11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或更多个双链核苷酸。虽然本申请不受任何特定作用机制的限制,但RNAi可以进入细胞并引起相似或相同序列的单链RNA(ssRNA),包括内源性mRNA的降解。当细胞暴露于双链RNA(dsRNA)时,来自同源基因的mRNA会通过称为RNA干扰(RNAi)的过程选择性地降解。RNAi(例如用于抑制转录的siRNA和/或用于抑制翻译的miRNA)背后可能的基本机制是将与特定基因序列匹配的双链RNA(dsRNA)断裂成称为短干扰RNA的短片段,这触发了与其序列匹配的mRNA的降解。在一个方面,本申请的RNAi用于基因沉默治疗,例如沉默负责维持分化细胞的分化表型的转录因子中的一个或一组;参见,例如Shuey(2002)Drug Discov.Today7:1040-1046。在一个方面,本申请提供了使用本申请的RNAi选择性降解RNA的方法。在一个方面,本申请的RNAi分子可用于在细胞中产生功能丧失突变。这些过程可以在体外、离体或体内进行。
在一个实施方案中,RNAi(例如,miRNA或siRNA)的细胞内引入是通过结合到包含被吸附的RNAi(例如,microRNA)的RNA结合蛋白的靶细胞特异性配体的内化进行的。配体可以对独特的靶细胞表面抗原具有特异性。配体可以在与细胞表面抗原结合后自发内化。如果独特的细胞表面抗原在与其配体结合后没有自然内化,则可以通过将富含精氨酸的肽或其他膜可渗透肽掺入配体或RNA结合蛋白的结构或与将此类肽与配体或结合蛋白连接来促进内化。参见,例如,美国专利申请公开20060030003;20060025361;20060019286;20060019258。在一个方面,本申请提供了用于递送的脂质基制剂,例如,将本申请的核酸作为包含RNAi分子的核酸-脂质颗粒引入细胞,参见,例如美国专利申请公开20060008910。
用于制备和使用选择性降解RNA的RNAi分子(例如siRNA和/或miRNA)的方法是本领域中众所周知的,参见例如美国专利6,506,559;6,511,824;6,515,109;6,489,127。制备表达构建体(例如载体或质粒)的方法是众所周知的和常规的,从表达构建体转录抑制性多核苷酸(例如,本申请的双链siRNA)。调控区(例如,启动子、增强子、沉默子、剪接供体、受体等)可用于从表达构建体转录抑制性多核苷酸的一条或多条RNA链。在制备双链siRNA抑制性分子时,靶向IRES的靶向部分的有义链和反义链可以转录为将退火在一起的两条单独的RNA链,或者转录为形成发夹环并与自身退火单个RNA链。例如,将靶向基因部分的构建体插入两个启动子之间,使得转录双向发生并且将产生互补的RNA链,其随后可以退火以形成本申请的抑制性siRNA。
或者,基因、编码序列、启动子或转录物的靶向部分可以被设计为单个表达载体上一起的第一和第二反义结合区;例如,包含在相对于其控制启动子有义方向的靶基因的第一编码区,并且其中该基因的第二编码区在相对于其控制启动子的反义方向。如果靶基因的靶部分的有义和反义编码区的转录发生自两个独立的启动子,则结果可能是两条独立的RNA链,它们可以随后退火形成用于实施本申请的基因抑制性siRNA。
在另一个实施方案中,靶向基因的有义和反义靶向部分的转录由单个启动子控制,并且所产生的转录物将是自我互补的单个发夹RNA链,即通过自身折叠形成双链体以产生基因抑制性siRNA分子。在这种构型中,靶基因的靶部分的有义和反义编码区之间的间隔物,例如核苷酸的间隔物可以提高单链RNA形成发夹环的能力,其中发夹环包含间隔物。在一个实施方案中,间隔物包含长度为约5至50个核苷酸之间的核苷酸。在一个方面,siRNA的有义和反义编码区可各自位于单独的表达载体上并受其自身启动子的控制。
在一个实施方案中,核酸分子是靶向PTB pre-mRNA的反义寡核苷酸,以诱导外显子跳跃,从而引起非神经元细胞中灵长类PTB蛋白的表达或活性的抑制。本文中的外显子跳跃是指在细胞中诱导不含有通常存在于其中的特定外显子的成熟mRNA。外显子跳跃是通过向表达所述mRNA的前体mRNA的细胞提供能够干扰序列的分子来实现的,该序列例如是允许剪接的酶促过程所必需的剪接供体或剪接受体序列,或者能够干扰将一段核苷酸识别为将包括在mRNA中的外显子所需的外显子包含信号的分子。术语前体mRNA是指未加工或部分加工的前体mRNA,它是通过转录从细胞核中的DNA模板合成的。在本申请的上下文中,如本文所示的诱导和/或促进外显子的跳跃是指非神经元细胞中至少1%、10%、20%、30%、40%、50%、60%、70%、80%、90%或更多的PTB mRNA将不包含所述外显子。这优选通过实例中所述的PCR进行评估。
在一个优选的实施方案中,靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列的核酸分子是CRISPR/Cas家族效应蛋白(Cas效应蛋白)的向导RNA (gRNA)。因此,在一个实施方案中,组合物包含细胞编程剂,其包含:i)Cas效应蛋白和至少一种靶向灵长类PTB基因、转录物或mRNA中的靶序列或其互补序列的gRNA,或ii)至少一种编码Cas效应蛋白并编码至少一种gRNA的表达载体。同样,本申请提供了包含此类细胞编程剂的组合物。
在一些实施方案中,细胞编程剂(例如包含Cas效应蛋白和至少一种gRNA,或至少一种表达载体)包含在纳米颗粒,例如脂质体中。
在一个实施方案中,CRISPR/Cas家族效应蛋白(Cas效应蛋白)和靶向PTB基因序列的向导RNA(gRNA),细胞编程剂包含至少一种编码Cas效应蛋白并编码gRNA的表达载体,所述gRNA靶向PTB基因序列。
在一些实施方案中,细胞编程剂中的Cas效应蛋白选自下组:Cas13d、CasRx、Cas13e、CRISPR/Cas9、Cpf1、Cas9、Cas13a、Cas13b、Cas13c、Cas13f及其功能性结构域。在某些实施方案中,Cas效应蛋白由4.5kb或更小、4kb或更小、3.5kb或更小、3kb或更小、2.5kb或更小、或2.1kb或更小、或1.5kb或更小的ORF(从起始密码子到终止密码子)编码。在一些实施方案中,Cas效应蛋白被修饰以包含核定位信号。在一些实施方案中,Cas效应蛋白是靶向DNA的Cas效应蛋白。在一些实施方案中,Cas效应蛋白是靶向DNA的Cas效应蛋白,其选自下组:spCas9或其变体、SaCas9或其变体、Cpf1或其变体及其组合。
在某些实施方案中,细胞编程剂中的Cas效应蛋白是靶向RNA的Cas效应蛋白。靶向RNA的Cas效应蛋白在本文中被理解为使用Cas效应蛋白的crRNA/gRNA来识别和降解靶RNA序列而不是靶DNA序列的Cas效应蛋白。在一些实施方案中,Cas效应蛋白是VI型CRISPR-CAS系统的效应蛋白,优选VI-D型CRISPR-CAS系统的效应蛋白。在一些实施方案中,Cas效应蛋白含有2个HEPN核糖核酸酶基序,含有RXXXXH-基序(参见Anantharaman et al.,2013,BiolDirect.2013;8:15)。在一些实施方案中,靶向RNA的Cas效应蛋白选自下组:Cas13a、Cas13b、Cas13c、Cas13d/CasRx、CRISPR/Cas9、Cpf1、Cas13e和Cas13f及其功能性结构域。在某些实施方案中,靶向RNA的Cas效应蛋白由4.5kb或更小、4kb或更小、3.5kb或更小、3kb或更小、2.5kb或更小、或2.1kb或更小,或1.5kb或更小的ORF(从起始密码子到终止密码子)编码。在一些实施方案中,靶向RNA的Cas效应蛋白被修饰以包含核定位信号。
在优选的实施方案中,靶向RNA的Cas效应蛋白是Cas13d或其直系同源物,其中最优选为CasRx(由Konermann et al.,2018,Cell 173,665–676描述)。CasRx是CRISPR-Cas13d的直系同源物,具有最小的尺寸并表现出高的靶向特异性和效率,使其成为体内治疗应用的首选。
靶向灵长类PTB mRNA序列的gRNA优选与靶向RNA的CRISPR/Cas家族效应蛋白组合用于本申请的细胞编程剂中。因此,在一些实施方案中,gRNA包含与灵长类PTB mRNA中的靶序列互补的序列,例如人类PTBP1编码序列(NM_002819;SEQ ID NO:87),优选地,gRNA包含与如本文上述定义的靶序列互补的序列。
在一个实施方案中,gRNA包含与灵长类PTB mRNA序列(例如SEQ ID NO:87)中的14-60个核苷酸的连续区段互补的向导序列。优选地,gRNA包含与灵长类PTB mRNA序列(例如SEQ ID NO:87)中的至少17个且不超过60个核苷酸的连续区段互补的向导序列。在一些特定的实施方案中,gRNA包含与灵长类PTB mRNA序列(例如SEQ ID NO:87)中的至少17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸的连续区段互补的向导序列,和/或与灵长类PTB序列(例如SEQ ID NO:87)中不超过60、55、50、49、48、47、46、45、44、43、42、41或40个核苷酸的连续区段互补的向导序列。在一些实施方案中,gRNA包含与灵长类PTB mRNA序列(例如SEQ ID NO:87)中的25-45个核苷酸的连续区段互补的向导序列。
在一个实施方案中,gRNA中的向导序列包含SEQ ID NOs:1-86中的至少一种的至少10、11、12、13、14、15、16、17个连续核苷酸或所有核苷酸或由其组成。
在一个实施方案中,gRNA中的向导序列包含SEQ ID NOs:1-86中的至少一种的至少10、11、12、13、14、15、16、17个连续核苷酸或所有核苷酸或由其组成,其中当gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达时,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达小于0.5、0.45、0.4、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
在一个实施方案中,gRNA中的向导序列包含SEQ ID NOs:1-86中的至少一种或由其组成。在一个实施方案中,gRNA中的向导序列包含SEQ ID NOs:1-86中的至少一种或由其组成,并且优选地产生如表1中所确定的相对表达,即不超过0.5、0.45、0.4、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
在一个实施方案中,gRNA中的向导序列包含选自下组中的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51、46、79、07、58、53、38、64、63、59、54、62、81、83、57、05、08、70、73、76、10、04、36、52、26、67、25、39、34、80、06、23、85、24、30、02、13、03、77、31、21、69、16、75、12、78、20、74、71和37。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51、46、79、07、58、53、38、64、63、59、54、62、81、83、57、05、08、70、73、76、10、04、36、52、26、67、25、39、34、80、06、23、85、24、30和02。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51、46、79、07、58、53、38、64、63、59、54、62、81、83、57、05、08、70、73、76、10、04、36、52、26、67和25。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51、46、79、07、58、53、38、64、63、59、54、62、81、83、57、05、08、70、73和76。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51、46、79、07、58、53、38、64、63和59。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66、49、51和46。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40、61、50、55、41、44、42、66和49。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45、40和61。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43、45和40。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48、43和45。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47、48和43。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56、60、47和48。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ IDNOs:56、60和47。在一个实施方案中,gRNA中的向导序列包含选自下组的至少一种序列或由其组成:SEQ ID NOs:56和60。
在优选的实施方案中,gRNA中的向导序列包含SEQ ID NO:60或由其组成。在另一个优选实施方案中,gRNA中的向导序列包含SEQ ID NO:56或由其组成。
在某些实施方案中,gRNA靶向灵长类PTB mRNA中的序列,该序列对应于选自下组的序列:a)SEQ ID NO:87的位置59-91;b)SEQ ID NO:87的位置303-349;c)SEQ ID NO:87的位置422-451;d)SEQ ID NO:87的位置460-489;e)SEQ ID NO:87的位置542-576;f)SEQ IDNO:87的位置646-681;g)SEQ ID NO:87的位置706-769;h)SEQ ID NO:87的位置773-806;i)SEQ ID NO:87的位置1079-1139;j)SEQ ID NO:87的位置1152-1184;k)SEQ ID NO:87的位置1191-1254;l)SEQ ID NO:87的位置1374-1434;m)SEQ ID NO:87的位置951-1487;n)SEQID NO:87的位置1502-1575;和o)SEQ ID NO:87的位置1626-1669。在本文中应理解,对应于相对于SEQ ID NO:87位置的序列的灵长类PTB mRNA中的序列(除了SEQ ID NO:87)是在核苷酸序列比对中对应于SEQ ID NO:87中那些位置的序列,优选使用全局Needleman Wunsch算法,使用默认设置(默认空位开放罚分为10.0,默认空位延伸罚分为0.5;默认打分矩阵DNAFull)。
在一些特定的实施方案中,gRNA包含灵长类PTB mRNA序列的至少17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸和/或不超过60、55、50、49、48、47、46、45、44、43、42、41或40个核苷酸或由其组成,该灵长类PTB mRNA序列与SEQ ID NO:87的位置951-1487至少95、96、97、98、99%或100%相同,并且其中优选地,当用向导RNA(gRNA)靶向靶序列时,所述gRNA的向导序列包含SEQ ID NOs:38-68中的至少一种或由其组成,所述gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达小于0.50、0.45、0.40、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
在一个实施方案中,gRNA包含与灵长类PTB mRNA序列至少17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸,和/或不超过60、55、50、49、48、47、46、45、44、43、42、41或40个核苷酸的连续区段互补的向导序列或由其组成,该灵长类PTB mRNA序列与下述序列的至少一种至少95%、96%、97%、95%、96%、97%、98%、99%或100%相同:SEQ ID NO:87的位置1000-1487;SEQ ID NO:87的位置1050-1487;SEQ ID NO:87的位置1100-1487;SEQID NO:87的位置1150-1487;SEQ ID NO:87的位置1200-1487位;SEQ ID NO:87的位置1250-1487;SEQ ID NO:87的位置1300-1487;SEQ ID NO:87的位置1350-1487;SEQ ID NO:87的位置1400-1487;SEQ ID NO:87的位置951-1400;SEQ ID NO:87的位置951-1350;SEQ ID NO:87的位置951-1300;SEQ ID NO:87的位置951-1250;SEQ ID NO:87的位置951-1200;SEQ IDNO:87的位置951-1150;SEQ ID NO:87的位置951-1100;SEQ ID NO:87的位置951-1050;和SEQ ID NO:87的位置951-1000;并且其中优选地,当用向导RNA(gRNA)靶向靶序列时,所述gRNA的向导序列包含SEQ ID NOs:38-68中的至少一种或由其组成,所述gRNA在Cos7细胞和293T细胞的至少一种中与CasRx共表达,与仅表达CasRx的相应对照细胞相比,在上述细胞中观察到PTB mRNA的相对表达小于0.50、0.45、0.40、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.015。
在一些实施方案中,与仅表达CasRx的相应对照细胞相比,本申请的gRNA与CasRx一起在人或非人灵长类细胞(例如,在Cos7细胞和293T细胞中的至少一种)中的共表达引起PTB mRNA相对表达不超过0.9、0.85、0.8、0.75、0.7、0.65、0.6、0.55、0.5、0.45、0.4、0.35、0.3、0.25、0.24、0.23、0.22、0.21、0.20、0.19、0.18、0.17、0.16、0.15、0.14、0.13、0.12、0.11、0.10、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.01。本申请的gRNA的相对表达可以如本文实施例中所述进行测定。例如,可以使用Lipofectamine3000(或类似的转染试剂),用4μg表达CAG-CasRx-P2A-GFP的载体和2μgU6-gRNA-CMV-mCherry质粒进行瞬时共转染。仅用CAG-CasRx-P2A-GFP质粒转染的细胞可用作对照。瞬时转染后两天,通过荧光激活细胞分选(FACS)收集约30K GFP和mCherry双阳性(GFP前20%)细胞并裂解用于qPCR分析,以确定与相应量的对照细胞(仅分选GFP前20%)相比PTB mRNA的相对表达。
如本文所提供,细胞编程剂(例如,具有靶向PTB的gRNA的Cas或编码它们的多核苷酸)抑制PTB的表达或活性至少约为内源性或天然水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%。如本文所提供,细胞编程剂(例如,具有靶向nPTB的gRNA的Cas或编码它们的多核苷酸)抑制nPTB的表达或活性约为内源性或天然水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。
在一些实施方案中,本文提供的细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas或编码它们的多核苷酸)直接抑制PTB/nPTB的表达水平,例如,抑制PTB和/或nPTB的转录、翻译或蛋白质稳定性。
在一些实施方案中,本文提供的细胞编程剂(例如,具有靶向PTB/nPTB的gRNA的Cas或编码它们的多核苷酸)直接影响PTB/nPTB的表达或活性,而不影响其他细胞信号传导通路。
在一些实施方案中,包含细胞编程剂的组合物含有靶向灵长类PTB mRNA序列的至少一种gRNA,或者至少一种表达载体编码靶向灵长类PTB mRNA序列的至少一种gRNA。在另一个实施方案中,包含细胞编程剂的组合物含有靶向灵长类PTB mRNA序列的不超过一种(类型)的gRNA,或者至少一种表达载体编码靶向灵长类PTB mRNA序列的不超过一种(类型)的gRNA。在又一个实施方案中,包含细胞编程剂的组合物含有靶向灵长类PTB mRNA序列的两种、三种、四种、五种或六种不同(类型)的gRNA,或者至少一种表达载体编码靶向灵长类PTB mRNA序列的两种、三种、四种、五种或六种不同(类型)的gRNA。
如本文所提供的,使非神经元细胞与包含如本文所提供的细胞编程剂的组合物接触,可以以任何合适的方式进行,这取决于待重编程的非神经元细胞的类型、非神经元细胞所处的环境以及所需的细胞重编程结果。
在一些实施方案中,使非神经元细胞与包含如本文提供的细胞编程剂的组合物接触,该细胞编程剂的形式为编码具有靶向PTB/nPTB的gRNA的Cas的多核苷酸。因此,在一个实施方案中,使非神经元细胞与包含本文提供的细胞编程剂的组合物接触,该细胞编程剂的形式为编码Cas效应蛋白和编码靶向灵长类PTB mRNA序列的至少一种gRNA的表达载体。
在一些实施方案中,至少一种表达载体包含编码Cas效应蛋白的核苷酸序列,该核苷酸可操作地连接到引起Cas效应蛋白在非神经元细胞中表达的启动子。在一些实施方案中,引起在非神经元细胞中表达的启动子是神经胶质细胞特异性启动子或米勒神经胶质(MG)细胞特异性启动子。在一些实施方案中,神经胶质细胞特异性启动子选自下组:GFAP启动子、ALDH1L1启动子、EAAT1/GLAST启动子、谷氨酰胺合成酶启动子、S100β启动子和EAAT2/GLT-1启动子。在一些实施方案中,MG细胞特异性启动子选自下组:GFAP启动子、ALDH1L1启动子、GLAST(也称为Slc1a3)启动子和Rlbp1启动子。在一些实施方案中,神经胶质细胞特异性启动子或米勒神经胶质细胞(MG)细胞特异性启动子是灵长类、人或非人灵长类启动子。
在一些实施方案中,至少一种表达载体包含编码靶向灵长类PTB mRNA序列的gRNA的至少一种核苷酸序列,该核苷酸序列可操作地连接到引起gRNA在非神经元细胞中表达的启动子。在一些实施例中,与gRNA编码序列可操作地连接的启动子(并且引起gRNA在非神经元细胞中的表达)是来自U6snRNA基因的启动子,优选灵长类、人类或非人灵长类U6启动子。
在一些实施方案中,编码Cas效应蛋白的核苷酸序列适合于优化它们的密码子使用以适应于灵长类、人类或非人灵长类(非神经元)宿主细胞的密码子使用。编码多肽的核苷酸序列对宿主细胞密码子使用的适应性可以表示为密码子适应指数(CAI)。密码子适应指数在本文中定义为基因的密码子使用对特定宿主细胞或生物体中高表达基因的密码子使用的相对适应性的测量。每个密码子的相对适应性(w)是每个密码子的使用与相同氨基酸最丰富密码子的使用的比率。CAI指数定义为这些相对适应性值的几何平均值。非同义密码子和终止密码子(取决于遗传密码)被排除在外。CAI值范围从0到1,值越高表示最丰富密码子的比例越高(参见Sharp and Li,1987,Nucleic Acids Research 15:1281-1295;也参见:Jansen et al.,2003,Nucleic Acids Res.31(8):2242-51)。编码Cas效应蛋白的适应核苷酸序列优选具有至少0.2、0.3、0.4、0.5、0.6、0.7、0.8或0.9的CAI。在异源生物体中用于最佳基因表达的密码子优化方法是本领域已知的并且之前已经描述(参见,例如Welchet al.,2009,PLoS One 4:e7002;Gustafsson et al.,2004,Trends Biotechnol.22:346-353;Wu et al.,2007,Nucl.Acids Res.35:D76-79;Villalobos et al.,2006,BMCBioinformatics 7:285;美国专利公开2011/0111413;和美国专利公开2008/0292918)。
在这些配置中,利用非病毒转染方法或病毒转导方法来引入细胞编程剂。非病毒转染可以指不通过病毒介导的所有细胞转染方法。非病毒转染的非限制性实例包括电穿孔、显微注射、磷酸钙沉淀、用阳离子聚合物如DEAE-葡聚糖随后聚乙二醇转染、用树枝状聚合物转染、脂质体介导的转染(“脂质转染”)、微粒轰击(“基因枪”)、fugene、直接声波加载、细胞挤压、光学转染、原生质体融合、穿刺转染、磁转染、核转染及其任意组合。
在一些实施方案中,本文提供的方法利用基因治疗载体,例如病毒载体作为合适的介质用于将细胞编程剂递送至非神经元细胞。如本文所提供,病毒载体方法可包括使用DNA或RNA病毒载体。合适的病毒载体的实例可以包括腺病毒、慢病毒、腺相关病毒(AAV)、脊髓灰质炎病毒、单纯疱疹病毒(HSV)或基于鼠马洛尼(murine Maloney-based)的病毒载体。
在一些实施例中,载体是AAV载体。在一些实施方案中,细胞编程剂以AAV载体的形式施用。在一些实施方案中,细胞编程剂以慢病毒载体的形式施用。例如,可以使用慢病毒或腺病毒相关病毒(AAV)将细胞编程剂递送至非神经元细胞,以表达具有针对PTB/nPTB的gRNA的Cas效应蛋白。
根据本公开的一些实施方案,本文提供的方法包括通过足够量的细胞编程剂抑制非神经元细胞(例如神经胶质细胞或星形胶质细胞)中的PTB/nPTB的表达或活性,以将非神经元细胞重编程为成熟的神经元。如本领域技术人员容易理解那样,足够量的细胞编程剂可以根据经验确定。在一些实施方案中,细胞编程剂的量可以通过检查细胞编程剂在非神经元细胞中的活性的任何类型的测定来确定。
例如,当细胞编程剂被配置为抑制非神经元细胞中PTB/nPTB的表达时,足够量的细胞编程剂可以通过在施用药剂后,例如通过蛋白质印迹评估示例性非神经元细胞中PTB/nPTB的表达水平来确定。在一些实施方案中,在将细胞编程剂递送至示例性非神经元细胞后,利用功能测定评估PTB/nPTB的活性。在一些实施方案中,检查下游神经元特性的其他功能测定,例如神经元标志物的免疫染色、神经元功能特性的电记录,用于确定足够量的细胞编程剂。
在一些实施方案中,细胞编程剂以病毒载体的形式递送。病毒载体可包含一个或多个拷贝的编码细胞编程剂的表达序列,例如,具有一个或多个拷贝的针对PTB/nPTB的gRNA编码序列的Cas效应蛋白,例如1、2、3、4、5、6、7、8、9、10拷贝。
如本领域技术人员能够确定的,可以将病毒载体滴定至任何合适的施用量。例如,通过PCR、RT-PCR或其他方法确定的滴度可以是至少约10
在一些实施方案中,待施用的病毒载体的滴度为至少约10
在本申请的其他实施方案中,包含如上所定义的靶向PTB的细胞编程剂的组合物含有附加组分,例如一种或多种非靶向PTB的细胞编程剂,以进一步提高神经元转化效率。
靶向PTB的细胞编程剂与一种或多种非靶向PTB的细胞编程剂的组合可以协同作用以提高神经元转化效率。
因此,在一个实施方案中,包含如上所定义的靶向PTB的细胞编程剂的组合物还含有:i)一种或多种多巴胺神经元相关因子,和/或ii)至少一种用于表达一种或多种多巴胺神经元相关因子的表达载体,优选在非神经元细胞中。优选地,包含靶向PTB的细胞编程剂和多巴胺神经元相关因子的此类组合物用于局部施用至纹状体中的非神经元细胞。更优选地,将组合物施用于纹状体中的非神经元细胞以产生功能性多巴胺能神经元,由此进一步优选将组合物施用于纹状体中的神经胶质细胞以产生功能性多巴胺能神经元。
在一个实施方案中,一种或多种多巴胺神经元相关因子选自下组:Lmx1a、Lmx1b、FoxA2、Nurr1、Pitx3、Gata2、Gata3、FGF8、BMP、En1、En2、PET1、Pax家族蛋白、SHH、Wnt家族蛋白和TGF-β家族蛋白。在一个实施方案中,一种或多种多巴胺神经元相关因子选自下组:FoxA2、Lmx1a和Nurr1。在优选的实施方案中,一种或多种多巴胺神经元相关因子是单独的FoxA2、单独的Lmx1a、单独的Nurr1、FoxA2和Lmx1a的组合、FoxA2和Nurr1的组合、Nurr1和Lmx1a的组合或FoxA2、Lmx1a和Nurr1的组合。这些多巴胺神经元相关因子/基因的合适的灵长类和人氨基酸和/或核苷酸序列是技术人员已知的并且可以在公开可用的数据库中访问。用于在非神经元细胞中表达一种或多种多巴胺神经元相关因子的表达载体的构建和递送可以如上文针对靶向PTB的细胞编程剂的表达载体所述。
在另一个实施方案中,包含如上所定义的靶向PTB的细胞编程剂的组合物进一步含有:i)选自下组的一种或多种因子:β-连环蛋白、OSK因子(也称为Oct4、Sox2、Klf4和细胞再循环或表观遗传重塑中涉及的其他因子)、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl,和/或ii)至少一种用于表达选自下组的一种或多种因子的表达载体:β-连环蛋白、OSK因子(也称为Oct4、Sox2、Klf4和细胞再循环或表观遗传重塑中涉及的其他因子)、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl,优选在非神经元细胞中。在一个实施方案中,一种或多种因子选自下组:β-联蛋白和OSK因子、Oct4、Sox2和Klf4。在优选的实施方案中,一种或多种因子是β-连环蛋白和Oct4的组合、β-连环蛋白和Sox2的组合、β-连环蛋白和Klf4的组合、β-连环蛋白和Oct4与Sox2的组合、β-连环蛋白和Oct4与Klf4的组合,β-连环蛋白和Sox2与Klf4的组合,β-连环蛋白和所有三个OSK因子Oct4、Sox2和Klf4的组合,或所有三个OSK因子Oct4、Sox2和Klf4(不含β-连环蛋白)的组合。优选地,包含靶向PTB的细胞编程剂和因子的此类组合物用于局部施用至成熟视网膜中的非神经元细胞。更优选地,将组合物施用于成熟视网膜中的非神经元细胞以产生功能性视网膜神经节细胞(RGC)神经元和/或功能性视网膜光感受器,由此进一步优选将组合物施用于成熟视网膜中的神经胶质细胞或米勒神经胶质(MG)细胞,用于产生功能性视网膜神经节细胞(RGC)神经元和/或功能性视网膜光感受器。在优选的实施方案中,因子是β-连环蛋白。β-连环蛋白、Oct4、Sox2、Klf4、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl或其基因的合适的灵长类和人类氨基酸和/或核苷酸序列是技术人员已知的并且可以在公开可用的数据库中访问。用于在非神经元细胞中表达选自β-连环蛋白、Oct4、Sox2、Klf4、Crx、Brn3a、Brn3b、Math5、Nr2e3和Nrl的一种或多种因子的表达载体的构建和递送可如上文针对靶向PTB细胞编程剂的表达载体所述。
给药和治疗方案
本文提供的方法可包括抑制非神经元细胞中PTB/nPTB的表达或活性一段时间,其足以将非神经元细胞重编程为成熟神经元。
在一些实施方案中,示例性方法包括使非神经元细胞与抑制非神经元细胞中PTB/nPTB的表达或活性的细胞编程剂接触至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天、至少11天、至少12天、至少13天、至少14天、至少15天,至少3周、至少4周、至少5周、至少2个月、至少3个月、至少4个月、至少5个月,或至少1年,从而将非神经元细胞重编程为成熟的神经元。
在某些实施方案中,PTB和nPTB表达或活性的抑制是相继的。例如,在nPTB的表达或活性被抑制之前,PTB的表达或活性首先被抑制例如上述任何一个时间段。
在某些实施方案中,PTB和nPTB表达或活性的抑制是同时发生的。
在一些实施方案中,示例性方法包括使非神经元细胞与抑制非神经元细胞中的PTB表达或活性的细胞编程剂接触约1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、3周、4周、5周、2个月、3个月、4个月或5个月,然后将非神经元细胞与抑制非神经元细胞中nPTB表达或活性的细胞编程剂接触,从而将非神经元细胞重编程为成熟神经元。
在一些配置中,本文提供的方法包括仅施用一次细胞编程剂,例如,将细胞编程剂加入到包含非神经元细胞的细胞培养物中,或将细胞编程剂递送至包含非神经元细胞(例如,纹状体)的脑区域仅一次,并且细胞编程剂可以在抑制非神经元细胞中PTB/nPTB的表达或活性所需的时间量(例如,至少1天、至少2天、至少4天或最后10天)方面保持活性。例如,当细胞编程剂包含表达Cas效应子和抗PTB gRNA的编码序列的AAV载体时,AAV载体的设计可以使其在延长的一段时间内保持转录活性。
在一些实施方案中,本文提供的方法包括施用细胞编程剂不止一次,例如至少2次、至少3次、至少4次、至少5次、至少6次、至少7次、至少8次、至少9次、至少10次、至少12次、至少15次、至少20次或更多次。
在一些实施方案中,本文提供的方法进一步包括施用至少一种免疫抑制剂。在一个实施方案中,例如,当细胞编程剂包含表达Cas效应子和抗PTB gRNA的编码序列的AAV载体时,免疫抑制剂在施用细胞编程剂之前、同时和/或之后施用。合适的免疫抑制剂包括例如皮质类固醇(如泼尼松、泼尼松龙、地塞米松等)、钙调磷酸酶抑制药(如环孢素、他克莫司等)、mTOR抑制剂(西罗莫司、依维莫司等)、IMDH抑制剂(硫唑嘌呤、霉酚酸酯等)、抗体(如巴利昔单抗、利妥昔单抗、阿仑单抗等),干扰素(例如IFN-β、IFN-γ等)、Janus激酶抑制剂(如托法替尼等)和生物制剂(阿那白滞素等)。在一个实施方案中,在施用细胞编程剂之前和/或之后约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、3周、4周、5周、2个月、3个月、4个月或5个月施用免疫抑制剂。在一个实施方案中,免疫抑制剂与细胞编程剂的施用大约同时施用。
标志物
根据本公开的一些实施方案,本文提供的方法包括以高效率将多个非神经元细胞重编程为成熟神经元。
在一些实施方案中,该方法包括将MG细胞或星形胶质细胞重编程为成熟神经元,并且至少60%的MG细胞/星形胶质细胞转化为Map2或NeuN阳性的成熟神经元。
在一些实施方案中,至少40%的星形胶质细胞转化为Map2阳性的成熟神经元。在一些实施方案中,至少约20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%、99%或100%的MG细胞/星形胶质细胞转化为NeuN或Map2阳性的成熟神经元。
在一些实施方案中,在每10mmX50μm的视网膜神经节细胞层(GCL)中至少10个MG细胞被转化为表达Brn3a或Rbpm的RGC。在一些实施方案中,在每10mmX50μm的视网膜神经节细胞层(GCL)中,至少约1、2、4、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60个MG细胞被转化为表达Brn3a或Rbpms的RGC。
在一些实施方案中,该方法包括将人星形胶质细胞重编程为成熟神经元,并且至少40%、至少60%或至少80%的人星形胶质细胞转化为Map2或NeuN阳性的成熟神经元。在一些实施方案中,至少20%、至少40%或至少60%的人星形胶质细胞转化为Map2或NeuN阳性的成熟神经元。在一些实施方案中,至少约20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%、99%或100%的人星形胶质细胞转化为Map2或NeuN阳性的成熟神经元。
在一些实施方案中,本文提供的方法包括将多个非神经元细胞,例如人非神经元细胞,例如人神经胶质细胞或星形胶质细胞,以及至少约20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或99%的非神经元细胞,例如人非神经元细胞,例如人神经胶质细胞,或星形胶质细胞重编程为成熟神经元。在一些实施方案中,本文提供的方法重编程约20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%、99%或100%的非神经元细胞,例如人非神经元细胞,例如人神经胶质细胞、MG细胞或星形胶质细胞被重编程为成熟神经元。
在一些实施方案中,成熟神经元的特征在于其表达选自下组的一种或多种神经元标志物:NeuN(神经元核抗原)、Map2(微管相关蛋白2)、NSE(神经元特异性烯醇化酶)、160kDa神经丝介质、200kDa神经丝重链(neurofilament heavy)、PDS-95(突触后密度蛋白95)、突触蛋白I、突触生长蛋白、GAD67(谷氨酸脱羧酶67)、GAD65(谷氨酸脱羧酶65)、小清蛋白、DARPP32(多巴胺和cAMP调节的神经元磷蛋白32)、vGLUT1(囊泡谷氨酸转运体1)、vGLUT2(囊泡谷氨酸转运体2)、乙酰胆碱、囊泡GABA转运体(VGAT)、γ-氨基丁酸(GABA)和TH(酪氨酸羟化酶)。在一些实施方案中,至少40%的非神经元细胞,例如人非神经元细胞,例如人神经胶质细胞,或星形胶质细胞被重编程为成熟神经元。
在一些实施方案中,将MG细胞转化成视网膜光感受器,其特征在于表达选自视紫红质和GNAT1的一种或多种杆细胞标志物(rod cell marker),和/或特征在于表达选自S-视蛋白、M-视蛋白和mCAR的一种或多种锥细胞标志物。
本领域的普通技术人员很容易理解,上述所有那些标记的表达可以通过任何常规技术来评估。例如,使用本文所述的针对特定细胞类型标志物的抗体进行免疫染色可以揭示目标细胞是否表达相应的细胞类型标志物。在某些条件下的免疫染色还可以揭示细胞类型标记的亚细胞分布,这对于确定目标细胞的发育阶段也很重要。例如,Map2的表达可以在有丝分裂后的成熟神经元的各种神经突起(例如树突)中发现,但在神经元的轴突中不存在。电压门控钠离子通道的表达(例如,a亚基Navi.1-1.9)和b亚基)可以是另一个实例,它们可以聚集在轴突起始片段的成熟神经元(这里可以启动动作电位)以及郎飞结中。在一些实施方案中,其他技术,例如但不限于流式细胞术、质谱、原位杂交、RT-PCR和微阵列,也可用于评估本文所述的特定细胞类型标志物的表达。
转化效率
本公开的某些方面提供的方法包括重编程多个非神经元细胞,以及至少约20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或99%的非神经元细胞,例如人非神经元细胞,例如人神经胶质细胞细胞、MG细胞或星形胶质细胞被重编程为功能性神经元。
在一些实施方案中,本文提供的方法重编程至少20%的非神经元细胞,例如,人非神经元细胞,例如人神经胶质细胞、MG细胞或星形胶质细胞被重编程为功能性神经元。在一些实施方案中,本文提供的方法重编程约20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%、99%或100%的非神经元细胞,例如人非神经元细胞,例如人神经胶质细胞、MG细胞或星形胶质细胞被重编程为功能性神经元。
在一些实施方案中,其中本文提供的方法包括下述组合的用途:i)如本文定义的靶向PTB的细胞编程剂,和ii)一种或多种如本文定义的非靶向PTB的细胞编程剂,所述组合将神经元转化效率提高了至少1.1、1.2、1.5、2.0、3.0、4.0、5.0、8.0、10、15或20倍。
功能评估
在一些实施方案中,功能性神经元的特征在于它们形成神经元网络、发送和接收神经元信号或两者的能力。在一些实施方案中,功能性神经元激发动作电位。在一些实施方案中,功能性神经元与其他神经元建立突触连接。例如,功能性神经元可以是突触中的突触后神经元,例如,具有其树突末端,例如树突棘,在突触中与另一个神经元形成突触后隔室。例如,功能性神经元可以是突触中的突触前神经元,例如,具有在突触中与另一个神经元形成突触前末端的轴突末端。
功能性神经元可与另一个神经元形成的突触可包括但不限于轴轴突触、轴树突触和轴体突触。功能性神经元可以与另一个神经元形成的突触可以是兴奋性的(例如,谷氨酸能的)、抑制性的(例如,氨基丁酸能的)、调节性的或其任何组合。在一些实施方案中,功能性神经元与另一个神经元形成的突触是谷氨酸能的、氨基丁酸能的、胆碱能的、肾上腺素能的、多巴胺能的或任何其他合适的类型。作为突触前神经元,功能神经元可以释放神经递质,例如但不限于谷氨酸、GABA、乙酰胆碱、天冬氨酸、D-丝氨酸、甘氨酸、一氧化氮(NO)、一氧化碳(CO)、硫化氢(H2S)、多巴胺、正肾上腺素(又称去甲肾上腺素)、肾上腺素(epinephrine,adrenaline)、组胺、5-羟色胺、苯乙胺、N-甲基苯乙胺、酪胺、3-碘甲状腺原氨酸(3-iodothyronamine)、章鱼胺、色胺、生长抑素、P物质、阿片肽、三磷酸腺苷(ATP)、腺苷和大麻素。作为突触后神经元,功能性神经元可以引发对突触前神经元释放到突触间隙中的神经递质的突触后反应。在本文提供的方法中产生的功能性神经元的突触后反应可以是兴奋性的、抑制性的或其任何组合,这取决于功能性神经元表达的神经递质受体的类型。在一些实施方案中,功能性神经元表达离子型神经递质受体,例如离子型谷氨酸受体和离子型GABA受体。离子型谷氨酸受体可以包括但不限于α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)型谷氨酸受体(例如,GluAl/GRIAl;GluA2/GRIA2;GluA3/GRIA3;GluA4/GRIA4)、δ受体(例如,GluDl/GRIDl;GluD2/GRID2)、红藻氨酸受体(例如,GluKl/GRIKl;GluK2/GRIK2;GluK3/GRIK3;GluK4/GRIK4;GluK5/GRIK5)和N-甲基-D-天冬氨酸(NMDA)受体(例如,GluNl/GRINl;GluN2A/GRIN2A;GluN2B/GRIN2B;GluN2C/GRIN2C;GluN2D/GRIN2D;GluN3A/GRIN3A;GluN3B/GRIN3B)。离子型GABA受体可包括但不限于GABAA受体。在一些实施方案中,功能性神经元表达代谢型神经递质受体,例如代谢型谷氨酸受体(例如,mGluRi、mGluRs、mGluR、mGluR、mGluRi、mGluRe、mGluR、mGluRs)和代谢型GABA受体(例如,GABAB受体)。在一些实施方案中,功能性神经元表达一种类型的多巴胺受体,或者是D1样家族多巴胺受体,例如D1和D5受体(DIR和D5R),或者是D2样家族多巴胺受体,例如D2、D3和D4受体(D2R、D3R和D4R)。在一些实施方案中,本文提供的功能性神经元与另一个神经元形成电突触(例如间隙连接)。在一些实施方案中,本文提供的功能性神经元与其自身形成化学突触或电突触,被称为自突触。
功能性神经元的特征可以通过本领域技术人员可用的常规技术来评估。例如,功能性神经元的电特性,例如动作电位的激发和对神经递质释放的突触后反应,可以通过例如膜片钳记录(例如电流钳和电压钳记录)、细胞内记录和细胞外记录(例如,四极管记录、单线记录和场电位记录(filed potential recording))的技术进行检查。功能性神经元的特定特性(例如,离子通道的表达和静息膜电位)也可以通过膜片钳记录来检查,其中膜片钳记录的不同变体可以应用于不同的目的,例如细胞贴附式膜片,内面向外式膜片、外面向外膜片、全细胞记录、穿孔膜片、松散膜片。通过电方法评估突触后反应可以与突触前神经元的电刺激、神经递质或受体激动剂或拮抗剂的应用相结合。在某些情况下,AMPA型谷氨酸受体介导的突触后电流可以通过AMPA受体激动剂(例如AMPA)或拮抗剂(例如2,3-羟基-6-硝基-7-磺酰氨基-苯并喹喔啉(NBQX)或6-氰基-7-硝基喹喔啉-2,3-二酮(CNQX)来评估。在某些情况下,NMDA型谷氨酸受体介导的突触后电流可以通过NMDA受体激动剂(例如NMDA和甘氨酸)或拮抗剂(例如AP5和氯胺酮)来评估。
在一些实施方案中,功能性神经元通过电学方法以外的技术进行检查。例如,可以利用最近开发的各种荧光染料或基因编码的荧光蛋白和成像技术来监测功能神经元传递或传输的电信号。在这种情况下,钙依赖性荧光染料(例如钙指示剂),例如但不限于fura-2、indo-1、fluo-3、fluo-4和钙绿-1,以及钙依赖性荧光蛋白,例如但不限于Cameleons、FIP-CBSM、Pericams、GCaMP、TN-L15、TN-humTnC、TN-XL、TNXXL和Twitch's,可用作追踪钙流入和流出,作为神经元膜电位的指标。或者或另外,可以响应电压变化改变其光谱特性的电压敏感染料也可用于监测神经元活动。
神经递质释放可以是功能性神经元的重要方面。本文提供的方法可包括将非神经元细胞重编程为释放某种类型的神经递质的功能性神经元。在一些实施方案中,功能性神经元释放神经递质,例如但不限于谷氨酸、GABA、乙酰胆碱、天冬氨酸、D-丝氨酸、甘氨酸、一氧化氮(NO)、一氧化碳(CO)、硫化氢(H2S)、多巴胺、正甲肾上腺素(又称去甲肾上腺素)、肾上腺素、组胺、5-羟色胺、苯乙胺、N-甲基苯乙胺、酪胺、3-碘甲状腺原氨酸、章鱼胺、色胺、生长抑素、P物质、阿片肽、三磷酸腺苷(ATP)、腺苷和大麻素。
在一些实施方案中,功能性神经元释放多巴胺作为主要神经递质。在一些实施方案中,功能性神经元释放不止一种类型的神经递质。在一些实施方案中,功能性神经元响应于动作电位而释放神经递质。在一些实施方案中,功能性神经元响应于分级电势(例如,不超过引发动作电位的阈值的膜电势变化)而释放神经递质。在一些实施方案中,功能性神经元在基础水平(例如,自发的神经递质释放)上表现出神经递质释放。可以通过本领域普通技术人员可用的各种技术来评估如本文所述的功能性神经元释放的神经递质。在一些实施方案中,成像方法可用于表征功能性神经元的神经递质释放,例如,通过对包含泡蛋白的基因编码荧光融合分子进行成像,可以监测突触囊泡与突触前膜融合的过程。
或者或另外,可以应用其他方法来直接监测特定神经递质的水平。例如,HPLC探针可用于测量培养皿或功能性神经元将其轴突投射到的脑区中多巴胺的含量。HPLC检测到的多巴胺水平可以指示功能性神经元的突触前活动。在一些实施方案中,此类评估可与功能性神经元的刺激相结合,以改变其膜电位,例如,使其引发动作电位。
在一个方面,本公开提供了一种在体内产生功能性神经元的方法。示例性方法包括在神经系统区域的非神经元细胞(例如神经胶质细胞或星形胶质细胞)中,向受试者的神经系统区域,例如成熟视网膜或内耳或脑或脊髓中的区域(例如,纹状体)施用包含细胞编程剂(例如,Cas效应蛋白和靶向/互补于PTB和/或nPTB的gRNA,或编码它们的多核苷酸),并允许非神经元细胞重编程为功能性神经元。在一些实施方案中,细胞编程剂抑制PTB和/或nPTB的表达或活性。
施用途径
根据本公开的一些实施方案,本文提供的方法包括将细胞编程剂(例如,Cas效应蛋白和靶向/互补于PTB和/或nPTB的gRNA或编码它们的多核苷酸)直接施用到受试者的神经系统区域(例如成熟的视网膜或内耳或脑或脊髓中的区域(例如纹状体))中。在一些实施方案中,将细胞编程剂(例如,Cas效应蛋白和靶向/互补于PTB和/或nPTB的gRNA或编码它们的多核苷酸)局部递送至神经系统中的区域(例如,成熟视网膜或脑或脊髓中的区域(例如纹状体))。在一个实施方案中,包含细胞编程剂,例如病毒载体(例如病AAV载体)的组合物通过立体定向(stereotaxic)或对流增强递送至脑区(例如纹状体)施用于受试者或生物体。
使用立体定向定位系统,本领域技术人员将能够定位将要施用包含细胞编程剂的组合物的特定的脑区(例如,纹状体)。此类方法和装置可容易地用于将本文提供的组合物递送至受试者或生物体。在另一个实施方案中,将本文提供的组合物全身递送至受试者或受试者的神经系统区域,例如脑(例如,纹状体)或脊髓,例如递送至脑脊液或脑室,并且该组合物包含一种或多种药剂,其被配置为将细胞编程剂重新定位到受试者神经系统中的特定区域(例如,纹状体)或受试者神经系统中的特定类型的细胞。
在一些实施方案中,本文提供的方法中使用的细胞编程剂包含表达Cas效应子和抗PTB或抗nPTB gRNA的病毒,并且该方法包括立体定向地将病毒注射到所需脑区域。在一些实施方案中,病毒包括腺病毒、慢病毒、腺相关病毒(AAV)、脊髓灰质炎病毒、单纯疱疹病毒(HSV)或基于鼠马洛尼的病毒。可用于本文提供的方法的AAV可以是任何合适的AAV血清型,例如但不限于AAV2、AAV5、AAV6、AAV7、AAV8和AAV9。在一些实施方案中,方法包括递送基于AAV2或AAV9的病毒载体,所述病毒载体表达抑制神经系统区域(例如脑(例如纹状体)或脊髓)中非神经元细胞中PTB和/或nPTB的表达或活性的药剂。
在一些实施方案中,如上所述,本文提供的方法包括将多种非神经元细胞重编程为成熟神经元。在一些实施方案中,本文提供的方法包括向受试者的神经系统区域(例如脑(例如纹状体)或脊髓)施用包含细胞编程剂的组合物,该细胞编程剂抑制多种非神经元细胞中PTB和/或nPTB的表达或活性,该非神经元细胞为例如但不限于神经胶质细胞,例如神经系统中的星形胶质细胞、少突胶质细胞、NG2细胞、卫星细胞或室管膜细胞,并且允许非神经元细胞重编程为功能性神经元。在一些实施方案中,本文提供的方法包括将受试者的神经系统区域(例如脑(例如纹状体)或脊髓)中的星形胶质细胞重编程为功能性神经元。
如上所述,本文提供的方法可包括将特定脑区域(例如纹状体)中的非神经元细胞重编程为功能性神经元。可以在本文提供的方法中使用的示例性脑区域可以在后脑、中脑或前脑中的任何一个中。在一些实施方案中,本文提供的方法包括向受试者的中脑、纹状体或皮层施用包含细胞编程剂的组合物,该细胞编程剂抑制成熟视网膜或纹状体中的非神经元细胞中PTB的表达或活性,并允许非神经元细胞重编程为功能性神经元。在一些实施方案中,本文提供的方法包括向受试者的成熟视网膜或纹状体施用包含细胞编程剂的组合物,该细胞编程剂抑制成熟视网膜或纹状体中的非神经元细胞中PTB/nPTB的表达或活性,并允许非神经元细胞重编程为功能性神经元。
在一些实施方案中,本文提供的方法包括将脑区域中的非神经元细胞重编程为功能性神经元,所述脑区域例如为但不限于延髓、髓质锥体、橄榄体、下橄榄核、延髓头端腹外侧、延髓尾端腹外侧、孤束核、呼吸中枢-呼吸组、背侧呼吸组、腹侧呼吸组或长吸中枢(apneustic centre)、前包钦格复合体、包钦格复合体(botzinger complex)、斜方体核、面后核、疑后核、副疑核、旁正中网状核、巨细胞网状核、侧颜区(parafacial zone)、楔束核、薄束核、舌下核、中间核、前置核、舌下核、最后区、髓质脑神经核、下泌涎核、疑核、迷走神经背核、舌下神经核、后脑、脑桥、脑桥核、脑桥脑神经核、三叉神经感觉核主核或脑桥核、三叉神经运动核(v)、外展神经核(vi)、面神经核(vii)、前庭耳蜗核(前庭核和耳蜗核)(viii)、上泌涎核、桥被盖、脑桥排尿中枢(巴林顿核)、蓝斑、脚桥核、外侧被盖核、桥脑被盖网状核、臂旁区、臂旁内侧核、臂旁外侧核、臂旁核(kdlliker-fuse核)、脑桥呼吸组、上橄榄复合体、上橄榄内侧核(medial superior olive)、上橄榄外侧核、斜方体内侧核、桥脑旁正中网状结构、小细胞网状核、桥脑尾侧网状核、小脑脚、小脑上脚、小脑中脚、小脑下脚、第四脑室、小脑、小脑蚓部、小脑半球、前叶、后叶、绒球小结叶、小脑核、顶核、间位核、球状核、栓状核、齿状核、中脑(midbrain/mesencephalon)、顶盖、四迭体、下丘、上丘、前顶盖、被盖、导水管周围灰质、内侧纵束头端间质核、中脑网状结构、中缝背核、红核、腹侧被盖区、旁臂核(parabrachial pigmented nucleus)、黑质旁核、吻内侧被盖核(rostromedial tegmentalnucleus)、尾侧线状核(caudal linear nucleus)、中缝吻端线状核(rostral linearnucleus of the raphe)、束间核、黑质、致密部、网状部、脚间核、大脑脚(cerebralpeduncle/crus cerebri)、中脑脑神经核、动眼神经核(iii)、动眼神经副核(edinger-westphal nucleus)、滑车核(iv)、中脑管(大脑水管、西尔维斯水管)、前脑(forebrain/prosencephalon)、间脑、上丘脑、松果体、缰核、髓纹、丘脑带(taenia thalami)、第三脑室、连合下器官、丘脑、前核群、前腹侧核(a.k.A.腹前核)、前背侧核、前内侧核、内侧核群、背内侧核、中线核群、带旁核、连接核(reuniens nucleus)、菱形核、板内核群、中央中核、束旁核、中央旁核、中央外侧核、外侧核群、外侧背核、外侧后核、丘脑枕、腹侧核群、腹前核、腹外侧核、腹后核、腹后外侧核、腹后内侧核、后丘脑、内侧膝状体、外侧膝状体、丘脑网状核、下丘脑(边缘系统)(hpa轴)、前部、中间区域、视前区部分、视前内侧核、视交叉上核、室旁核、视上核(主要)、下丘脑前核、侧区、视前区部分、视前外侧核、外侧核前部、视上核部分、视前区其他核、视前正中核、视前室周核、结节部、内侧区、下丘脑背内侧核、腹内侧核、弓状核、侧区、外侧核结节部、外侧结节核、后部、内侧区、乳头核、后核、侧区、外侧后核、视交叉、穹窿下器、室周核、垂体柄、灰质结节、结节核、结节乳头核、结节区、乳头体、乳头核、底丘脑、底丘脑核、未定带、脑垂体、神经垂体、中间部(中间叶)、腺垂体、额叶、顶叶、枕叶、颞叶、小脑、脑干、半卵圆中心、辐射冠、内囊、外囊、最外囊(extreme capsule)、下皮质、海马体、齿状回、海马(CA区域)、海马1区(CA1)、海马2区(CA2)、海马3区(CA3)、海马4区(CA4)、杏仁核、杏仁核中央核、杏仁核内侧核、杏仁核皮质核和基底内侧核、杏仁核外侧核和基底外侧核、泛杏仁核结构(extended amygdala)、终纹、终纹床核、屏状核、基底节、纹状体、背侧纹状体、壳核、尾状核、腹侧纹状体、伏隔核、嗅结节、苍白球、腹侧苍白球、底丘脑核、基底前脑、前穿质、无名质、基底核、布罗卡斜带、隔核、内侧隔核、终板、终纹血管器、嗅脑(古皮层)、嗅球、嗅束、嗅前核、梨状皮质、前连合、钩回(uncus)、杏仁核周围皮质、大脑皮质、额叶、皮质、初级运动皮质(中央前回、Ml)、补充运动皮质、前运动皮质、前额叶皮质、眼窝前额皮质、背外侧前额叶皮质、脑回、额上回、额中回、额下回、布罗德曼分区4、6、8、9、10、11、12、24、25、32、33、44、45、46和47、顶叶、皮质、初级躯体感觉皮质(SI)、次级躯体感觉皮质(S2)、后顶叶皮层、脑回、中央后回(初级躯体感受区)、楔前叶、布罗德曼分区1、2、3、5、7、23、26、29、31、39和40、枕叶、皮质、初级视觉皮质(VI)、v2、v3、v4、v5/mt、脑回、枕外侧回、楔叶、布罗德曼分区17(VI,初级视觉皮质);18和19、颞叶、皮质、初级听觉皮质(A1)、次级听觉皮层质(A2)、下颞皮质、后下颞皮质、脑回、颞上回、颞中回、颞下回、内嗅皮质、围嗅皮质(perirhinalcortex)、海马旁回、梭状回、布罗德曼分区20、21、22、27、34、35、36、37、38、41和42、内侧颞上区(MST)、岛叶皮质、扣带回皮质、前扣带回区、后扣带回、压后皮质、灰被、膝下区25和布罗德曼分区23、24;26、29、30(压后区);31和32。
在一个方面,本申请提供了一种在体内产生多巴胺能神经元的方法。示例性方法包括向受试者脑中的纹状体施用包含细胞编程剂(例如,Cas效应蛋白和针对PTB和/或nPTB的gRNA的编码序列)的组合物,该细胞编程剂抑制脑中非神经元细胞(例如神经胶质细胞或星形胶质细胞)中的PTB和/或nPTB的表达或活性,并允许非神经元细胞重编程为多巴胺能神经元。在一些实施方案中,方法包括向受试者的壳核施用包含细胞编程剂(例如,Cas效应蛋白和针对PTB和/或nPTB的gRNA的编码序列)的组合物,该细胞编程剂抑制脑中非神经元细胞(例如神经胶质细胞或星形胶质细胞)中的PTB和/或nPTB的表达或活性,并允许非神经元细胞重编程为多巴胺能神经元。在一些实施方案中,方法包括向受试者的壳核专门施用(例如,避免向尾状核和/或纹状体的其他部分施用)包含细胞编程剂(例如,Cas效应蛋白和针对PTB和/或nPTB的gRNA编码序列)的组合物,该细胞编程剂抑制脑中非神经元细胞(例如神经胶质细胞或星形胶质细胞)中的PTB和/或nPTB的表达或活性,并允许非神经元细胞重编程为多巴胺能神经元。
在另一个方面,本发明提供了一种在体内产生RGC神经元的方法。示例性方法包括向受试者的成熟视网膜施用包含细胞编程剂(例如,Cas效应蛋白和针对PTB和/或nPTB的gRNA编码序列)的组合物,该细胞编程剂抑制成熟视网膜中非神经元细胞(例如神经胶质细胞或MG细胞)中的PTB和/或nPTB的表达或活性,并允许非神经元细胞重编程为RGC神经元。
在一些实施方案中,本文提供的方法包括向受试者的神经系统区域(例如脑或脊髓)施用包含细胞编程剂(例如Cas效应蛋白和针对PTB和/或nPTB的gRNA的编码序列)的组合物,该细胞编程剂抑制区域中非神经元细胞中PTB和/或nPTB的表达或活性,并允许非神经元细胞重编程为该区域中占优势的亚型的功能性神经元。
不受特定理论的束缚,当在体内将非神经元细胞重编程为功能性神经元时,本文提供的方法可以利用区域(例如特定脑区域)中的局部诱导信号。例如,纹状体中的局部信号可能诱导PTB/nPTB抑制的非神经元细胞转化为多巴胺神经元。局部神经元、非神经元细胞(例如星形胶质细胞、小胶质细胞或两者)或纹状体的其他局部成分可有助于神经元的亚型特异性,所述神经元是在细胞编程剂诱导下由非神经元细胞产生的。
在一些实施方案中,本文提供的方法包括向受试者的脑区域(例如,纹状体)施用包含细胞编程剂(例如,Cas效应蛋白和针对PTB和/或nPTB的gRNA的编码序列)的组合物,该细胞编程剂抑制脑区域中多个非神经元细胞中的PTB/nPTB的表达或活性,并且方法进一步包括将至少约5%、10%、20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或99%的非神经元细胞重编程为多巴胺能神经元。
在一些实施方案中,本文提供的方法包括向受试者的成熟视网膜或脑区域(例如,纹状体)施用包含细胞编程剂(例如,Cas效应蛋白和针对PTB和/或nPTB的gRNA的编码序列)的组合物,该细胞编程剂抑制脑区域多个非神经元细胞中PTB/nPTB的表达或活性,并且通过该方法产生的至少约5%、10%、20%、25%、30%、35%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或99%的功能性神经元分别是RGC神经元或多巴胺能神经元。
在一些实施方案中,本文提供的方法中产生的多巴胺能神经元表达多巴胺能神经元的一种或多种标志物,包括但不限于多巴胺、酪氨酸羟化酶(TH)、多巴胺转运体(DAT)、囊泡单胺转运体2(VMAT2)、锯齿状同源框1(Enl)、核受体相关蛋白-1(Nuclear receptorrelated-1,Nurrl)、G蛋白调节内向整流钾通道2(Girk2)、叉头框A2(FoxA2)、邻牙本质同源框2(orthodenticle homeobox 2,OTX2)和/或LIM同源框转录因子1α(Lmx1a)。
在一些实施方案中,在本文提供的方法中产生的多巴胺神经元表现出Ih电流,其可由超极化激活的环核苷酸门控(HCN)通道介导。Ih电流可表征为缓慢激活的内向电流,可通过超极化步骤激活。例如,在电压钳和保持电位Vh为-40mV的情况下,多巴胺神经元可触发内向缓慢激活电流,反转电位接近-30mV。在本文提供的方法中产生的多巴胺神经元的Ih电流特征的激活曲线可以在-50到-120mV的范围内,中间激活点为-84-1mV。
在一些实施方案中,在本文提供的方法中产生的多巴胺能神经元具有与天然多巴胺能神经元类似的基因表达谱。
在一些实施方案中,在本文提供的方法中产生的多巴胺能神经元释放多巴胺作为神经递质。
在本文提供的方法中产生的多巴胺能神经元可以是多巴胺能神经元的任何亚型,包括但不限于A9(例如,对Girk2免疫阳性)、A10(例如,对钙结合蛋白-D28 k免疫阳性)、A11、A12、A13、A16、Aaq和端脑多巴胺神经元。
根据本公开的一些实施方案,本文提供的方法包括将受试者的神经系统区域,例如成熟视网膜或脑或脊髓区域(例如纹状体)中的非神经元细胞重编程为功能性神经元。在一些实施方案中,此处讨论的功能性神经元被整合到神经系统中的神经网络中。如本文所述,重编程的功能神经元可以与局部神经元(例如与重编程的功能神经元相邻的神经元)形成突触连接。例如,当重编程的神经元在体内成熟时,重编程的神经元和邻近的初级神经元(例如,谷氨酸能神经元)、GABA能中间神经元或其他邻近的神经元(例如,多巴胺能神经元、肾上腺素能神经元或胆碱能神经元)之间的突触连接可以形成。在这些与局部神经元的突触连接中,重编程的功能性神经元可以是突触前神经元、突触后神经元或两者。
在一些实施方案中,重编程的功能性神经元将轴突投射发送到远程脑区域。
在一些实施方案中,重编程的功能性神经元可以将其自身整合到脑或脊髓中的一个或多个现有神经通路中,例如但不限于上纵束、弓状束、钩束、穿通通路、丘脑皮质辐射、胼胝体、前连合、杏仁核腹侧传出通路、丘脑间粘合、后连合、缰连合、穹窿、乳头被盖束、脑下丘脑通路、大脑脚、前脑内侧束、内侧纵束、肌阵挛三角、中脑皮层通路、中脑边缘通路(mesolimbic pathway)、黑质纹状体通路、结节漏斗通路(tuberoinfundibular pathway)、锥体外系统、锥体束、皮质脊髓束或脑脊髓纤维、皮质脊髓侧束、皮质脊髓前束、皮质脑桥纤维、额桥纤维、颞叶脑桥纤维、皮质延髓束、皮质中脑束、顶盖脊髓束、脊髓间质束、红核脊髓束、红核橄榄束、橄榄小脑束、橄榄脊束、前庭脊髓束、外侧前庭脊髓束、内侧前庭脊髓束、网状脊髓束、外侧中缝脊髓束、后柱-内侧丘系通路、薄束(gracile fasciculus)、楔形束、内侧丘系、脊髓丘脑束、脊髓丘脑侧束、脊髓丘脑前束、脊髓中脑束、脊髓小脑束、脊髓橄榄束和脊髓网状束。
不受特定理论的束缚,局部细胞环境可以与根据本公开的一些实施方案生成的功能性神经元的投射相关。例如,根据本文提供的方法的一些实施方案在纹状体中产生的功能性神经元可能受到纹状体局部环境中的其他细胞的影响。
可治疗的病况/疾病
在一个方面,本公开提供了治疗与神经系统区域中的功能性神经元退化相关的神经病况的方法。示例性方法包括向有需要的受试者的神经系统区域,例如成熟视网膜或脑或脊髓(spinal)区域(例如纹状体)或内耳施用包含细胞编程剂的组合物,该细胞编程剂抑制该区域中非神经元细胞中的PTB/nPTB的表达或活性,并允许非神经元细胞重编程为功能性神经元(例如,RGC或多巴胺能神经元),从而补充该区域中退化的功能性神经元。
根据本公开的一些实施方案,本文提供的方法包括治疗神经病况,包括但不限于帕金森病、失明、耳聋、脊髓损伤、阿尔茨海默病、亨廷顿病、精神分裂症、抑郁症和药物成瘾性。
适用的神经病况还可以包括与脊髓中神经元损失相关的病症,例如但不限于肌萎缩侧索硬化(ALS)和运动神经元疾病。本文提供的方法还可用于治疗或改善神经退行性疾病的一种或多种症状,包括但不限于常染色体显性小脑性共济失调、Charlevoix-Saguenay型常染色体隐性痉挛性共济失调、皮质基底节变性、皮质基底节综合征、克罗伊茨费尔特-雅各布疾病(Creutzfeldt-Jakob disease)、脆性X相关震颤/共济失调综合征、17号染色体连锁额颞叶痴呆合并相关的帕金森综合征、Kufor-Rakeb综合征、莱姆病、马查多-约瑟夫疾病(Machado-Joseph disease)、尼曼-匹克病、桥脑小脑发育不全、雷夫叙姆病、丙酮酸脱氢酶复合物缺乏症(pyruvate dehydrogenase complex deficiency)、桑德霍夫病、Shy-Drager综合症、泰伊-萨克斯二氏病(Tay-Sachs disease)和摇摆刺猬综合症(Wobblyhedgehog syndrome)。
如本文所提供,“神经退行性”或其语法等同物可指神经元结构、功能或两者的进行性丧失,包括神经元死亡。
神经退行性可能是由任何类型的机制引起。本文提供的方法适用的神经病况可以是任何病因。神经病况可以是遗传性的或偶发性的,可能是由于基因突变、蛋白质错误折叠、氧化应激或环境暴露(例如,毒素或滥用药物)引起的。
在一些实施方案中,本文提供的方法治疗与脑区域中的多巴胺能神经元退化相关的神经病况。在一些实施方案中,本文提供的方法治疗与成熟视网膜中RGC神经元退化相关的神经病况。在其他实施方案中,本文提供的方法治疗与任何类型的神经元退化相关的神经病况,例如但不限于谷氨酸能神经元、GABA能神经元、胆碱能神经元、肾上腺素能神经元、多巴胺能神经元或任何其他合适类型的神经元,所述神经元释放神经递质天冬氨酸、D-丝氨酸、甘氨酸、一氧化氮(NO)、一氧化碳(CO)、硫化氢(H2S)、正肾上腺素(也称为去甲肾上腺素)、组胺、5-羟色胺、苯乙胺、N-甲基苯乙胺、酪胺、3-碘甲状腺原氨酸、章鱼胺、色胺、生长抑素、P物质、阿片肽、三磷酸腺苷(ATP)、腺苷或大麻素。本文提供的方法可用于治疗与任何区域的神经元退化性相关的神经病况,该区域例如为但不限于中脑区域(例如,黑质或腹侧被盖区)、前脑区域、后脑区域或脊髓。本文提供的方法可包括将神经系统中任何适当区域中的非神经元细胞重编程为功能性神经元,以治疗与神经元退行性相关的神经病况。
本文提供的方法可用于治疗或改善与帕金森病相关的一种或多种症状。帕金森病是黑质致密部(SNpc)中多巴胺能神经元出现早期显著功能性损害或死亡的神经退行性疾病。由此产生的基底神经节内多巴胺缺乏可导致以典型帕金森运动症状为特征的运动障碍。帕金森病也可能与许多非运动症状有关。诊断帕金森氏病的一个标准可以是在尸检病理检查中是否存在SNpc变性和Lewy病理学。Lewy病理学可能包括突触核蛋白的异常聚集,称为Lewy体和Lewy神经突。帕金森病患者可表现出多种症状,包括运动症状和非运动症状。本文提供的方法可以治疗或改善与帕金森病相关的这些运动或非运动症状中的一种或多种。帕金森病的运动症状(帕金森综合征症状)可包括运动迟缓(缓慢)、僵硬、平衡受损、步态缓慢和姿势不稳。帕金森病患者的运动特征可能是异质性的,这促使人们尝试对疾病的亚型进行分类,例如震颤为主的帕金森病(相对缺乏其他运动症状)、非震颤为主的帕金森病(其中可能包括被描述为运动不能-强直综合征(akinetic-rigid syndrome)和姿势不稳步态障碍的表型),以及具有混合或不确定表型的其他亚组,其中有几种严重程度相当的运动症状。帕金森病的非运动症状可包括嗅觉功能障碍、认知损害、精神症状(例如抑郁症)、睡眠障碍、自主神经功能障碍、疼痛和疲劳。这些症状在早期帕金森病中很常见。在经典运动症状发作之前,帕金森病也可能经常出现非运动特征。这种疾病的运动前期或前驱期的特征是嗅觉受损、便秘、抑郁、白天过度嗜睡和快速眼动睡眠行为障碍。
在一些实施方案中,本文提供的方法减轻或减缓帕金森病的进展。帕金森病的进展可以以运动功能的恶化为特征。随着疾病的发展,可能会出现与长期对症治疗相关的并发症,包括运动和非运动波动、运动障碍和精神病。
帕金森病的一种病理学特征可能是黑质例如黑质致密部(SNpc)内多巴胺能神经元的损失。根据一些实施方案,本文提供的方法补充由于患者的黑质(例如,SNpc)中多巴胺神经元损失而减少的多巴胺(从纹状体中转化的多巴胺神经元分泌)。帕金森病的神经元损失也可能发生在许多其他脑区域,包括蓝斑、迈纳特基底核(nucleus basalis ofMeynert)、脚桥核、中缝核、迷走神经背侧运动核、杏仁核和下丘脑。在一些实施方案中,如本文提供的治疗或改善受试者的帕金森氏病的一种或多种症状的方法包括将帕金森病患者中经历神经元损失的脑区域中非神经元细胞重编程为功能性神经元。
本文提供的方法可用于治疗不同病因的帕金森病。例如,由于一种或多种基因突变可能导致帕金森病,基因突变例如但不限于基因SNCA、LRRK2、VPS35、EIF4G1、DNAJC13、CHCHD2、Parkin、PINK1、DJ-1、ATP13A2、C9ORF72、FBX07、PLA2G6、POLG1、SCA2、SCA3、SYNJ1、RAB39B的突变,以及可能在22qll2中微缺失综合征受影响的一个或多个基因。或者是没有已知遗传特征的帕金森病。
如本文所提供的,本文所提供的方法可以改善的帕金森病的一种或多种症状可以不仅包括如上所述的运动症状和非运动症状,还可以包括其他水平的病理特征。例如,帕金森病患者脑中多巴胺信号传导的减少可以通过本文提供的方法通过补充功能性多巴胺神经元来逆转或减轻,该功能性多巴胺神经元可以整合到神经回路中并将多巴胺神经元投射重建到适当的脑区域中。
在一个方面,本公开还提供了在与正常水平相比多巴胺生物发生量减少的受试者中恢复多巴胺释放的方法。示例性方法包括重编程受试者脑区域(例如纹状体)中的非神经元细胞,并允许非神经元细胞重编程为多巴胺能神经元,从而恢复至少50%的多巴胺减少量。在一些实施方案中,重编程通过向受试者的脑区域(例如,纹状体)施用包含细胞编程剂的组合物来进行,该细胞编程剂抑制脑区域中非神经元细胞(例如,星形胶质细胞)中PTB/nPTB的表达或活性。在一些实施方案中,本文提供的方法恢复至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或98%的多巴胺减少量。在一些实施方案中,本文提供的方法恢复约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或100%的多巴胺减少量。在一些实施方案中,本文提供的方法恢复至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或98%的多巴胺减少量。在一些实施方案中,本文提供的方法恢复至少约50%的多巴胺减少量。
药物组合物
在一个方面,本公开提供包含有效量的细胞编程剂的药物组合物,该有效量的细胞编程剂通过抑制非神经元细胞中PTB/nPTB的表达或活性将哺乳动物非神经元细胞重编程为成熟神经元。示例性药物组合物可进一步包含药学上可接受的载体或赋形剂。如上所述,本文提供的细胞编程剂可以是Cas效应蛋白和针对PTB/nPTB的gRNA的编码序列。
本文提供的药物组合物可包含一种或多种载体和赋形剂(包括但不限于缓冲液、糖类、甘露醇、蛋白质、肽或氨基酸如甘氨酸、抗氧化剂、抑菌剂、螯合剂、悬浮剂、增稠剂和/或防腐剂)、水、油类(包括石油、动物、植物或合成来源的那些),如花生油、大豆油、矿物油、芝麻油等,盐溶液、葡萄糖和甘油水溶液、调味剂、着色剂、防粘剂和其他可接受的添加剂,或粘合剂,接近生理条件所需的其他药学上可接受的辅助物质,如pH缓冲剂、张力调节剂、乳化剂、润湿剂等。赋形剂的实例包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、甘油单硬脂酸酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。在另一种情况下,该组合物基本上不含防腐剂。在其他实施方案中,该组合物含有至少一种防腐剂。关于药物剂型的通用方法可以在Ansel et ah,Pharmaceutical DosageForms and Drug Delivery Systems(Lippencott Williams&Wilkins,Baltimore Md.(1999))中找到。应当认识到,虽然本领域普通技术人员已知的任何合适的载体都可以用于施用本文所述的药物组合物,但是载体的类型可以根据施用方式而变化。合适的制剂和额外的载体描述于Remington“The Science and Practice of Pharmacy”(20th Ed.,Lippincott Williams&Wilkins,Baltimore Md.),其教导通过引用整体并入本文。
示例性药物组合物可配制成用于注射、吸入、肠胃外施用、静脉内施用、皮下施用、肌肉内施用、皮内施用、局部施用或口服施用。
在某些实施方案中,可以将包含编码Cas效应子的AAV载体和针对PTB/nPTB的gRNA的编码序列的药物组合物注射到成熟视网膜或受试者脑的纹状体中。
如本领域普通技术人员所理解的,药物组合物可以包含任何合适的载体或赋形剂,这取决于细胞编程剂的类型和组合物被设计的施用途径。例如,包含本文所提供的细胞编程剂的组合物可以被配制成用于肠胃外施用,并且可以以单位剂量形式存在于安瓿、预填充注射器、小体积输注中或存在于添加有防腐剂的多剂量容器中。该组合物可以采用诸如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,例如在水性聚乙二醇中的溶液。例如,对于可注射的制剂,可以从本领域已知的合适的那些中选择媒介物,包括含有芝麻油、玉米油、棉籽油或花生油的水溶液或油悬浮液,或乳剂以及酏剂、甘露醇、葡萄糖或无菌水溶液,以及类似的药物媒介物。
该制剂还可以包含生物相容的、可生物降解的聚合物组合物,例如聚乳酸-羟基乙酸共聚物。这些材料可以制成微球或纳米球,负载药物并进一步包衣或衍生化以提供优异的持续释放性能。
适用于眼周或眼内注射的媒介物包括例如活性剂在注射级水中的悬浮液、脂质体和适用于亲脂性物质的媒介物和本领域已知的那些。除细胞编程剂和药学上可接受的载体或赋形剂之外,本文提供的组合物还可包含额外的药剂。例如,可以提供额外的试剂用于促进神经元存活的目的。或者或另外,可以提供额外的试剂用于监测药效学目的。在一些实施方案中,组合物包含额外的试剂作为渗透增强剂或用于活性成分(例如细胞编程剂)的持续释放或控制释放。
本文提供的组合物可以以约0.0005、0.001、0.002、0.005、0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.45、0.5、0.55、0.6、0.7、0.8、0.9、1.0mL或更多的剂量体积施用于受试者。组合物可以以1、2、3、4、5、6、7、8、9、10个或更多个剂量-疗程方案施用。有时,该组合物可以以2、3或4个剂量-疗程方案施用。有时,组合物可以以1个剂量-疗程方案施用。
2个剂量-疗程方案的第一剂(例如,编码Cas效应子和针对PTB的gRNA的AAV载体)和第二剂(例如,编码Cas效应子和针对nPTB的gRNA的AAV载体)的施用可以相隔约0天、1天、2天、5天、7天、14天、21天、30天、2个月、4个月、6个月、9个月、1年、1.5年、2年、3年、4年、5年、10年、20年或更长时间。可以每天一次、每周一次、两周一次、每月一次、一年一次、一年两次、一年三次、每1、2、3、4、5、6、7、8、9、10年或更多年一次将本文所述的组合物施用于受试者。
有时,可以每2、3、4、5、6、7年或更多年一次将组合物施用于受试者。有时,可以将组合物施用于受试者一次。
其它方面
本公开的一些实施方案提供了用于细胞或组织移植的方法和组合物。示例性方法可包括在体外将非神经元细胞重编程为神经元,并将重编程的神经元移植到受试者的脑区域中。在一些实施方案中,可以根据本文提供的方法进行体外重编程。示例性组合物可包含根据本文提供的方法的任何实施方案重编程的神经元。
在其他实施方案中,本文提供的方法包括在体内将非神经元细胞重编程为神经元,以及外植重编程的神经元。在一些实施方案中,外植体包括含有重编程神经元的脑组织。在一些实施方案中,外植体被移植到受试者的脑区域中。如本文所提供的,根据本文所提供的方法重编程的神经元移植可用于补充患有与神经元损失相关的病症的受试者中的退化神经元。
本公开的一些其他方面涉及包含根据本文提供的方法的任何实施方案重编程的神经元的动物。
如本文所提供的,动物可以是任何哺乳动物。动物可以是人类。动物可以是非人灵长类,例如但不限于恒河猴、食蟹猴、短尾猕猴、猪尾猕猴、松鼠猴、猫头鹰猴、狒狒、黑猩猩、狨猴和蜘蛛猴。动物可以是研究动物、转基因动物或任何其他合适类型的动物。
本文还提供了动物的脑组织(例如,外植体),其包含根据本公开的任何实施方案重编程的一个或多个神经元。这样的脑组织可以是活的。在一些实施方案中,脑组织可以通过任何合适的固定剂固定。脑组织可用于移植、医学研究、基础研究或任何类型的目的。
本公开证明该方法适用于神经退行性的疾病模型。例如,本公开表明星形胶质细胞到神经元的转化策略可以在化学诱导的帕金森病模型中起作用。该方法和组合物可以将星形胶质细胞转化为神经元,包括多巴胺能神经元、谷氨酸能神经元和GABA能神经元,这些神经元能够在脑中形成突触,值得注意的是,转化后的神经元可以有效地重建受损的黑质纹状体通路,以纠正可测量的帕金森表型。这种方法的有效性在培养的星形胶质细胞(人和小鼠)以及小鼠帕金森氏病模型体内得到证实。因此,该策略具有治愈帕金森病的潜力,也可应用于广泛的神经退行性疾病(例如,与神经元功能障碍相关的其他神经疾病)。
在一些实施方案中,本公开的方法利用已经存在但潜伏在两种哺乳动物星形胶质细胞中的神经元成熟程序的遗传基础,一旦星形胶质细胞被PTB抑制重编程,它们就逐渐产生成熟神经元。这些发现提供了临床上可行的方法,可以使用单剂量的载体从哺乳动物脑中的局部星形胶质细胞生成神经元,该载体包含Cas效应子的编码序列和针对PTB/nPTB的gRNA。PTB/nPTB敲低诱导的神经元的表型可能与它们产生的环境和/或它们的来源星形胶质细胞的有关。
本公开证明了星形胶质细胞向神经元(例如,纹状体中的多巴胺神经元)的有效转化。更具体地,本公开显示在灵长类模型中,该策略可以有效地将星形胶质细胞转化为神经元,从而满足体内重编程的所有五个因素。本文提供的数据表明,灵长类脑中PTB的减少可以将星形胶质细胞转化为多巴胺神经元(例如,多巴胺能神经元)。
本公开的组合物的“治疗有效量”将根据诸如个体的疾病状态、年龄、性别和体重以及组合物在个体中引发期望应答的能力等因素而变化。治疗有效量也可以是其中组合物的任何毒性或有害作用超过治疗有益作用的量。不希望受特定理论的束缚,预期在一些情况下,本文提供的细胞编程剂的治疗有效量可以是转化脑区域(经历神经元损失)中一定比例的星形胶质细胞的细胞编程剂的量,脑区域中这种比例的星形胶质细胞转化为功能性神经元足以改善或治疗与脑区域中神经元损失相关的疾病或病况,同时,星形胶质细胞的这种比例不超过可能导致嫌恶效应的阈值水平,所述嫌恶效应可能超过神经元转化带来的有益效果,例如,由于神经元转化的直接结果导致脑区域星形胶质细胞数量的过度减少。
下面的实施例旨在说明但不限制本公开内容。虽然它们是可能使用的典型例子,但本领域技术人员已知的其他程序也可替代使用。
实施例
实施例1
方法和材料
小鼠和细胞系
C57BL/6小鼠购自上海SLAC实验室。小鼠被安置在有水和食物的亮/暗循环室中。所有动物实验均由中国上海的中国科学院CEBSIT动物保护和使用委员会进行和批准。Cos7、293T和N2a细胞系来自中国科学院上海生物化学与细胞生物学研究所(SIBCB)的细胞库,在37℃的培养箱中,在5% CO
转染、qPCR和RNA-seq
使用脂质体3000,用4μg表达CAG-CasRx-P2A-GFP的载体+2μgU6-gRNA-CMV-mCherry质粒进行瞬时转染。CAG-CasRx-P2A-GFP质粒用作对照。瞬时转染后两天,通过荧光激活细胞分选(FACS)收集约30K GFP和mCherry双阳性(GFP前20%)的细胞,并裂解用于qPCR分析。首先使用Trizol(Ambion)提取RNA,然后使用逆转录试剂盒(用于qPCR的HiScript Q RT SuperMix,Vazyme,Biotech)将其转化为cDNA。通过AceQ qPCR SYBR GreenMaster Mix(Vazyme,Biotech)追踪扩增。对于RNA-seq,在10-cm培养皿中培养Cos7细胞。通过FACS分离出约100k阳性细胞(GFP前20%),提取RNA并逆转录为cDNA,然后用于RNA-seq。RNA-seq数据分析如先前报道的那样进行(Zhou et al.,2018,Cell 181:590-603),并表示为所有重复的平均值。
向导RNA序列
所用的向导RNA中的向导序列(即与待靶向的PTB mRNA序列互补的序列)如表1所示。
表1
/>
立体定向注射和免疫荧光染色
本研究中使用了AAV8。如前所述在小鼠中进行立体定向注射(Zhou et al.,2014,Elife 3,e02536,doi:10.7554/eLife.02536)。将小鼠置于立体定向框架内。接下来,用剃刀剃掉颅骨上的皮肤,并将其打开。在额骨和顶骨边界上方进行坐标(AP+0.8mm,ML±1.6mm)开颅手术,允许放置注射微量移液器(尖端外径~20μm)。缓慢注射含有AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-mCherry或AAV-GFAP-CasRx+AAV-GFAP-mCherry的病毒溶液(~0.3μl/min)。向小鼠纹状体(AP+0.8mm、ML±1.6mm和DV 2.6mm)注射AAV(>1X 10
视网膜下注射和免疫荧光染色
通过视网膜下注射引入NMDA和AAV(AAV8)。对于视网膜下注射,将小鼠麻醉,并将AAV缓慢注射到视网膜下腔。为了确定完整视网膜中的转化,通过视网膜下注射将总共1μlAAV-GFAP-GFP-Cre(0.2μl)和AAV-GFAP-CasRx-Ptbp1(0.4μl)或AAV-GFAP-GFP-Cre(0.2μl)和AAV-GFAP-CasRx(0.4ml)和PBS(0.4μl)或AAV-GFAP-GFP-Cre(0.2μl)和AAV-GFAP-CasRx-Ptbp1(0.4μl)和AAV-GFAP-β-连环蛋白(0.4μl)递送至视网膜(Ai9和C57BL/6小鼠,4月龄)。注射AAV后2-3周,收集眼睛和视神经,用4%多聚甲醛(PFA)固定,然后保存在含30%蔗糖的溶液中。包埋后,将眼睛切片,将切片洗涤并用封片剂(Life Technology)覆盖。使用Olympus FV3000显微镜收集图像。
结果实施例1
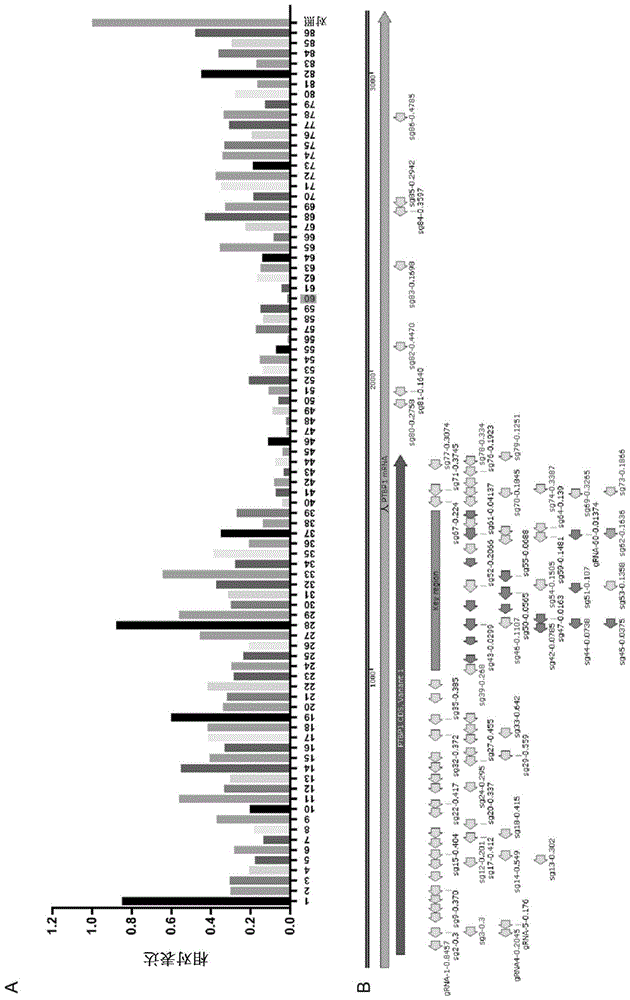
在这项研究中,我们设计了系统,其可以特异性地下调小鼠、食蟹猴和人细胞中Ptbp1的表达,并进一步表明CasRx介导的Ptbp1的下调可以直接地将食蟹猴纹状体中的星形胶质细胞高效率地转化为多巴胺神经元。总之,我们的研究提供了临床前证据,证明Ptbp1介导的多巴胺神经元转化在灵长类(即人类和非人灵长类)中也是可行的,为临床试验铺平了道路。
为了敲低Ptbp1的表达,我们使用了RNA导向的和靶向RNA的CRISPR蛋白CasRx,这是下调RNA的有效和特异方法。为了检验CasRx介导的Ptbp1敲低的效率,我们设计了86个靶向人类Ptbp1基因的gRNA。我们观察到,转染后2天,含有CasRx基因的载体与靶向Ptbp1的gRNA的共转染导致人293T细胞中Ptbp1 mRNA的减少(图1A;对于gRNA序列,见表1)。具体而言,靶向人类Ptbp1基因的关键区域(SEQ ID NO:87的位置951-1487,对应于SEQ ID NO:88的位置1-536)经常诱导有效的下调(图1B)。在该实验中,靶向该关键区域的gRNA实现了40%或更低的敲低,并且仅在该关键区域中观察到10%或更低的有效敲低。
SEQ ID NO:88:
gRNA 60的靶向位点在食蟹猴、人Ptbp1和小鼠基因中是保守的,并且能够在人293T、猴Cos7细胞和小鼠N2a细胞中有效下调Ptbp1基因,因此将其用于以下实验(图2和3)。为了确定该策略的靶向特异性,我们进行了RNA-seq,发现Ptbp1在Cos7细胞中特异性下调(图4)。最近的研究表明,Ptbp1敲低可以将纹状体星形胶质细胞转化为多巴胺神经元,我们接下来检验了非人灵长类动物纹状体星形胶质细胞中的Ptbp1敲低在是否可以在体内将星形胶质细胞局部转化为多巴胺神经元。为了在体内验证AAV载体,我们首先向野生型小鼠注射表达CasRx的AAV-GFAP-CasRx-Ptbp1和gRNA 60,以及荧光标记星形胶质细胞的AAV-GFAP-mCherry。我们还构建了不表达Ptbp1 gRNA的对照载体AAV-GFAP-CasRx(图5A)。注射后一周,我们发现mCherry和CasRx均在星形胶质细胞中特异性表达,并在纹状体中显示出高的共定位效率。此外,高百分比的mCherry
此外,我们还探索了通过结合其他多巴胺神经元转化相关转录因子,如FoxA2、Lmx1a和Nurr1,来提高多巴胺神经元转化效率的可能性。我们假设这些转录因子的过表达可能增强多巴胺神经元的转化。实际上,我们的结果显示,与单独表达AAV-GFAP-CasRx-Ptbp1相比,AAV-GFAP-CasRx-Ptbp1与AAV-GFAP-FoxA2、AAV-GFAP-Lmx1a、AAV-GFAP-FoxA2+AAV-GFAP-Lmx1a或AAV-GFAP-foxa 2+AAV-GFAP-Lmx1a+AAV-GFAP-Nur R1共表达提高小鼠纹状体中多巴胺神经元转化的效率(见图6)。
除星形胶质细胞性多巴胺神经元转化外,我们之前的结果显示,在4-8周龄的成熟视网膜中,敲低Ptbp1可将米勒神经胶质(MG)转化为视网膜神经节细胞(RGCs)。但是,不清楚该策略是否适用于中老年小鼠。因此,我们通过视网膜下注射将AAV-GFAP-CasRx-Ptbp1和AAV-GFAP-GFP-Cre引入4-5个月龄的ai9小鼠(CAG-LSL-tdTomato)的眼睛中,并在注射后3周观察到视神经中有少量的tdTomato
实施例2
减轻MD模型猴的症状
为了确定星形胶质细胞向多巴胺神经元的转化是否可以在猴PD模型的壳核中实现,我们进行了组织学以观察在注射了AAV-GFAP-mCherry和AAV-GFAP-CasRx-Ptbp1的壳核中大部分mCherry
NMDA诱导的视网膜损伤猴模型中的MG到RGC转换(RGC)
为了检验诱导的RGC是否可以补充视网膜损伤猴模型中的RGC,我们向成年猴玻璃体内注射N-甲基-D-天冬氨酸(NMDA),这导致了大多数RGC的损失。注射NMDA后2-3周,向眼睛注射AAV-GFAP-tdTomato+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-β-连环蛋白、AAV-GFAP-tdTomato+AAV-GFAP-CasRx-Ptbp1,或不编码靶向Ptbp1的gRNA的对照AAV(AAV-GFAP-tdTomato+AAV-GFAP-CasRx+AAV-GFAP-β-连环蛋白和AAV-GFAP-tdTomato+AAV-GFAP-GFAP-CasRx)。我们进一步假设OSK(Oct4(也称为Pou5f1)、Sox2和Klf4基因)与CasRx-Ptbp1在中年或老年视网膜的MG中共表达可能促进RGC转化。因此,我们也将AAV-GFAP-tdTomato+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-OSK注入视网膜。注射AAV后一到两个月,我们观察到在注射了AAV-GFAP-TD tomato+AAV-GFAP-CasRx-ptbp 1+AAV-GFAP-β-连环蛋白、AAV-GFAP-TDtomato+AAV-GFAP-CasRx-ptbp 1+AAV-GFAP-OSK或AV-GFAP-TD tomato+AAV-GFAP-CasRx-ptbp 1的视网膜中,GCL中的tdTomato
方法
PD模型猴
成年(7~10岁)雄性食蟹猴用于本研究。为了产生非人灵长类帕金森病模型,向动物静脉注射MPTP(1-甲基4-苯基1,2,3,6-四氢吡啶)以耗尽黑质中的多巴胺神经元,直到我们观察到持续的症状,如震颤、运动迟缓和平衡受损。在注射AAV之前,观察到稳定的症状超过5周。
正电子发射断层扫描(PET)研究(PD部分)
为了监测完整猴脑中转化的多巴胺神经元的多巴胺能功能,在AAV注射前和注射后一个月左右进行PET成像(18F-DOPA、18F-DTBZ和18F-FP-CIT)。在扫描前,对猴子进行麻醉,然后将动物放在PET扫描仪中,并监测所有的生理参数。扫描后使用标准协议对PET数据进行分析。
行为恢复的视频分析(PD部分)
为了进行视频分析,记录了注射AAV前和注射后一个月、两个月猴子的运动。收集后对记录的视频进行分析。使用以下项目评估猴PD症状:检查头部运动、面部表情、自发性活动、对刺激作出响应的运动、震颤、姿势和步态。
NMDA诱导的视网膜损伤猴模型的产生及AAV注射(RGC部分)
NMDA和AAV分别通过玻璃体内和视网膜下注射进行注射。对于玻璃体内注射,将猴子麻醉并将爱尔凯因滴入眼睛。将NMDA溶液注射到玻璃体中以耗尽大部分RGC,然后将氧氟沙星眼膏涂在眼睛上以防止感染。对于视网膜下注射,猴在NMDA注射后2-3周被麻醉,瞳孔放大。将AAV缓慢注射到视网膜下腔。注射后取下针头并施用眼膏。为了确定转化,我们设计了三种诱导MG向RGC转化的策略:AAV-GFAP-tdTomato+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-β-连环蛋白、AAV-GFAP-tdTomato+AAV-GFAP-CasRx-Ptbp1+AAV-GFAP-OSK,以及AAV-GFAP-tdTomato+AAV-GFAP-CasRx-Ptbp1。此外,我们注射不编码靶向Ptbp1的gRNA的对照AAV:AAV-GFAP-tdTomato+AAV-GFAP-CasRx+AAV-GFAP-β-连环蛋白,AAV-GFAP-tdTomato+AAV-GFAP-CasRx+AAV-GFAP-OSK,或AAV-GFAP-tdTomato+AAV-GFAP-CasRx。我们注意到gRNA的转录是由U6启动子驱动的。AAV通过视网膜下送到视网膜。AAV注射后约一到两个月,提取眼睛、视神经和脑,用4%多聚甲醛(PFA)固定,然后保存在30%蔗糖溶液中。包埋后,将眼睛和脑切片,与抗体一起孵育,并在显微镜下观察。
序列表
<110>上海鲸奇生物科技有限公司
<120>神经疾病的治疗
<130>TPG03079A
<160>88
<170>PatentIn version 3.5
<210>1
<211>31
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>1
uccccgcuuu guaccaacgg cuauaucugg g 31
<210>2
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>2
uaaacggucc guuagugaca caaguagaga 30
<210>3
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>3
ugauaaacgg uccguuagug acacaaguag 30
<210>4
<211>25
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>4
cgguccguua gugacacaag uagag25
<210>5
<211>25
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>5
cagaagccga guugcugcuc augau25
<210>6
<211>29
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>6
cuucuugcug ucauuuccgu uugcugcag29
<210>7
<211>27
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>7
acgccugcac uucggcuguc accuuug27
<210>8
<211>25
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>8
agcuuccgga uguggaucac ucuag25
<210>9
<211>32
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>9
agaugacuuc ccccuccgug acgucgaugg gg32
<210>10
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>10
cuucagcauc aggagguugg ugaccuuccc 30
<210>11
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>11
gccuccuccg uguucaucuc gaugaaggcc 30
<210>12
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>12
uuggcagccu ccuccguguu caucucgaug 30
<210>13
<211>29
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>13
ccaugguguu ggcagccucc uccguguuc29
<210>14
<211>29
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>14
guguaguagu ucaccauggu guuggcagc29
<210>15
<211>31
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>15
ccgaggugua guaguucacc augguguugg c 31
<210>16
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>16
cuggauguag augggcuggc cgcgcagcac 30
<210>17
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>17
gcuccuugug guuggagaac uggauguaga 30
<210>18
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>18
cugucggucu ucagcuccuu gugguuggag 30
<210>19
<211>31
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>19
gagcugucgg ucuucagcuc cuugugguug g 31
<210>20
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>20
gggccgccug ggcccgcgcc ugguugggag 30
<210>21
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>21
ggccagguuc cccgacugga ccgaguucac 30
<210>22
<211>26
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>22
cguccacggc cgccgccgag gcagcc 26
<210>23
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>23
gguucuccac gaugauccug agcacggggc 30
<210>24
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>24
gaagagguuc uccacgauga uccugagcac 30
<210>25
<211>27
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>25
ugcagcacau ccagggucac aggguag27
<210>26
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>26
augaucuuca acacugugcc gaacuuggag 30
<210>27
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>27
cugguuguuc uuggugaagg ugaugaucuu 30
<210>28
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>28
gcagggccug gaacugguug uucuugguga 30
<210>29
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>29
cugcagcagg gccuggaacu gguuguucuu 30
<210>30
<211>25
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>30
guccgcauac ugcagcaggg ccugg25
<210>31
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>31
uguucugccc guccagcgac agcuuggcgu 30
<210>32
<211>36
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>32
cagcaggcgu uguagauguu cugcccgucc agcgac36
<210>33
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>33
gcgugcagca ggcguuguag auguucugcc 30
<210>34
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>34
agucgaugcg cagcgugcag caggcguugu 30
<210>35
<211>31
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>35
uuguacuuga cguugaggcu ggugagcuug g 31
<210>36
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>36
uuguuguacu ugacguugag gcuggugagc 30
<210>37
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>37
ucugguccag cgagggcugg cuguccccgg 30
<210>38
<211>28
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>38
agaggcugag auuauaccag gugcaccg 28
<210>39
<211>33
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>39
ccugcagcuu gaggaauggc aaagguggga ggg 33
<210>40
<211>27
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>40
ccagggcgcc guggacguuc ggaacgg27
<210>41
<211>25
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>41
ggauggcgau ccgaccugcc gccgc25
<210>42
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>42
gguugcugac cagcaauaca gaauuuccug 30
<210>43
<211>37
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>43
acucucucug gguugagguu gcugaccagc aauacag 37
<210>44
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>44
cucucucugg guugagguug cugaccagca 30
<210>45
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>45
acucucucug gguugagguu gcugaccagc 30
<210>46
<211>34
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>46
ugugacucuc ucuggguuga gguugcugac cagc34
<210>47
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>47
aggcuuuggg gugugacucu cucuggguug 30
<210>48
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>48
cugcacguca ccguagacgc cgaaaagaau 30
<210>49
<211>33
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>49
aucuucacgc gcugcacguc accguagacg ccg 33
<210>50
<211>39
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>50
ccguccgcca ucugcacuag ggcguucucc uucuuauug 39
<210>51
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>51
gcugggccug guugccgucc gccaucugca 30
<210>52
<211>40
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>52
gcucauggcc agcugggccu gguugccguc cgccaucugc40
<210>53
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>53
uggccagcug ggccugguug ccguccgcca 30
<210>54
<211>36
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>54
uggcucaugg ccagcugggc cugguugccg uccgcc36
<210>55
<211>34
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>55
cuucccgugc agcuugugcc cguucaggug gcuc34
<210>56
<211>25
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>56
cagcugcacg uucuggugcu ucgag25
<210>57
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>57
guugccguag uccuugguca ggcccugguc 30
<210>58
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>58
gcccggcuuc uugaagcggu gcagggguga 30
<210>59
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>59
guucuuggag cccggcuucu ugaagcggug 30
<210>60
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>60
uucuggaagu ucuuggagcc cggcuucuug 30
<210>61
<211>36
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>61
aauauguucu ggaaguucuu ggagcccggc uucuug36
<210>62
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>62
uauguucugg aaguucuugg agcccggcuu 30
<210>63
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>63
gggcgggaau auguucugga aguucuugga 30
<210>64
<211>28
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>64
cguggccgag ggcgggaaua uguucugg 28
<210>65
<211>33
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>65
auguuggaga ggugcagcgu ggccgagggc ggg 33
<210>66
<211>27
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>66
agauccuccu cggagacuga gggcggg27
<210>67
<211>32
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>67
cuugaauccu uugacgacgc ccccauugcu gg32
<210>68
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>68
cuugaauccu uugacgacgc ccccauugcu 30
<210>69
<211>29
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>69
ccaucuugcg guccuucugg aagaacuug29
<210>70
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>70
gugccaucuu gcgguccuuc uggaagaacu 30
<210>71
<211>36
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>71
cccaucugga ucagugccau cuugcggucc uucugg36
<210>72
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>72
aucagugcca ucuugcgguc cuucuggaag 30
<210>73
<211>27
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>73
aucagugcca ucuugcgguc cuucugg27
<210>74
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>74
gcccaucugg aucagugcca ucuugcgguc 30
<210>75
<211>32
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>75
ccuggaccgc cuccuccacg gagcccaucu gg32
<210>76
<211>29
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>76
uucuccccga ggucgugguu gugcagguc29
<210>77
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>77
gaaggagacc cgcagguggu gguucucccc 30
<210>78
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>78
ugguggacuu ggagaaggag acccgcaggu 30
<210>79
<211>28
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>79
ccugugcccc uagauggugg acuuggag 28
<210>80
<211>28
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>80
ucccugucac cgcaggguga gcaaggug 28
<210>81
<211>27
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>81
ccgggaacuc ccgcugccac agucacc27
<210>82
<211>28
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>82
acaccccggg ugggugugug gcugcagg 28
<210>83
<211>29
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>83
uauugcuagg cacagacguc ugcaacugc29
<210>84
<211>26
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>84
cuggguccug ccugugacuu aauuac 26
<210>85
<211>30
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>85
acccacuggg cggccccgcc ugcucucugg 30
<210>86
<211>28
<212>RNA
<213>人工序列
<220>
<223>Ptbp1-gRNA-#
<400>86
cccccgggac aggacgcggg ggcgguag 28
<210>87
<211>1674
<212>DNA
<213>智人
<400>87
atggacggca ttgtcccaga tatagccgtt ggtacaaagc ggggatctga cgagcttttc60
tctacttgtg tcactaacgg accgtttatc atgagcagca actcggcttc tgcagcaaac 120
ggaaatgaca gcaagaagtt caaaggtgac agccgaagtg caggcgtccc ctctagagtg 180
atccacatcc ggaagctccc catcgacgtc acggaggggg aagtcatctc cctggggctg 240
ccctttggga aggtcaccaa cctcctgatg ctgaagggga aaaaccaggc cttcatcgag 300
atgaacacgg aggaggctgc caacaccatg gtgaactact acacctcggt gacccctgtg 360
ctgcgcggcc agcccatcta catccagttc tccaaccaca aggagctgaa gaccgacagc 420
tctcccaacc aggcgcgggc ccaggcggcc ctgcaggcgg tgaactcggt ccagtcgggg 480
aacctggcct tggctgcctc ggcggcggcc gtggacgcag ggatggcgat ggccgggcag 540
agccccgtgc tcaggatcat cgtggagaac ctcttctacc ctgtgaccct ggatgtgctg 600
caccagattt tctccaagtt cggcacagtg ttgaagatca tcaccttcac caagaacaac 660
cagttccagg ccctgctgca gtatgcggac cccgtgagcg cccagcacgc caagctgtcg 720
ctggacgggc agaacatcta caacgcctgc tgcacgctgc gcatcgactt ttccaagctc 780
accagcctca acgtcaagta caacaatgac aagagccgtg actacacacg cccagacctg 840
ccttccgggg acagccagcc ctcgctggac cagaccatgg ccgcggcctt cggtgcacct 900
ggtataatct cagcctctcc gtatgcagga gctggtttcc ctcccacctt tgccattcct 960
caagctgcag gcctttccgt tccgaacgtc cacggcgccc tggcccccct ggccatcccc1020
tcggcggcgg cggcagctgc ggcggcaggt cggatcgcca tcccgggcct ggcgggggca1080
ggaaattctg tattgctggt cagcaacctc aacccagaga gagtcacacc ccaaagcctc1140
tttattcttt tcggcgtcta cggtgacgtg cagcgcgtga agatcctgtt caataagaag1200
gagaacgccc tagtgcagat ggcggacggc aaccaggccc agctggccat gagccacctg1260
aacgggcaca agctgcacgg gaagcccatc cgcatcacgc tctcgaagca ccagaacgtg1320
cagctgcccc gcgagggcca ggaggaccag ggcctgacca aggactacgg caactcaccc1380
ctgcaccgct tcaagaagcc gggctccaag aacttccaga acatattccc gccctcggcc1440
acgctgcacc tctccaacat cccgccctca gtctccgagg aggatctcaa ggtcctgttt1500
tccagcaatg ggggcgtcgt caaaggattc aagttcttcc agaaggaccg caagatggca1560
ctgatccaga tgggctccgt ggaggaggcg gtccaggccc tcattgacct gcacaaccac1620
gacctcgggg agaaccacca cctgcgggtc tccttctcca agtccaccat ctag1674
<210>88
<211>536
<212>DNA
<213>智人
<400>88
gccattcctc aagctgcagg cctttccgtt ccgaacgtcc acggcgccct ggcccccctg60
gccatcccct cggcggcggc ggcagctgcg gcggcaggtc ggatcgccat cccgggcctg 120
gcgggggcag gaaattctgt attgctggtc agcaacctca acccagagag agtcacaccc 180
caaagcctct ttattctttt cggcgtctac ggtgacgtgc agcgcgtgaa gatcctgttc 240
aataagaagg agaacgccct agtgcagatg gcggacggca accaggccca gctggccatg 300
agccacctga acgggcacaa gctgcacggg aagcccatcc gcatcacgct ctcgaagcac 360
cagaacgtgc agctgccccg cgagggccag gaggaccagg gcctgaccaa ggactacggc 420
aactcacccc tgcaccgctt caagaagccg ggctccaaga acttccagaa catattcccg 480
ccctcggcca cgctgcacct ctccaacatc ccgccctcag tctccgagga ggatct 536
