融合构建体及其使用方法
文献发布时间:2023-06-19 10:36:57
本申请要求2018年7月9日提交的第62/695,623号、2018年7月9日提交的第62/695,627号、2019年6月19日提交的第62/863,710号、2019年6月20日提交的第62/864,367号和2019年6月25日提交的第62/866,420号美国临时专利申请的权益,这些申请均通过引用整体并入本文。
背景技术
最近,基于中断传递给适应性免疫系统的抑制信号的基于单克隆抗体的癌症免疫疗法已在临床上显示出前景。随着FDA批准CTLA-4抗体抑制剂(例如伊匹木单抗(ipilimumab))和PD-1抑制剂(例如派姆单抗(pembrolizumab)、纳武单抗(nivolumab)),现在有更多治疗选择可用于治疗包括肺癌、肾细胞癌和卵巢癌在内的实体瘤。然而,在大多数共表达PD-1/PD-L1和TGF-β的适应症(例如,卵巢癌、胃癌和结直肠癌)中,没有或几乎没有观察到对免疫检查点抑制剂的反应。因此,在本领域中持续需要获得更安全且更有效的癌症治疗方法。
本说明书中所提及的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入。
发明内容
本文提供了一种融合蛋白,其包含:(a)能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或所述抗体的变体;和(b)转化生长因子β(TGF-β)细胞因子阱;其中所述融合蛋白的一个或多个多肽通过连接体连接。
在一个实施方案中,所述连接体包含(G4S)n,其中n为2、3、4、5或6。在一个实施方案中,所述连接体包含(Gly)n,其中n为6、7或8。在一个实施方案中,所述连接体包含(EAAAK)n,其中n为1、2、3、4、5或6。在一个实施方案中,所述连接体包含A(EAAAK)
在一个实施方案中,所述TGFβR是转化生长因子β受体II(TGFβRII)或其所述功能片段。在一个实施方案中,TGFβRII的所述功能片段是TGFβRII胞外域(ECD)。在一个实施方案中,所述ECD结合TGF-β1。在一个实施方案中,所述ECD结合TGF-β3。在一个实施方案中,所述ECD结合TGF-β1和TGF-β3。在一个实施方案中,所述ECD结合TGF-β1和TGF-β3,但不结合TGF-β2。在一个实施方案中,所述TGF-β细胞因子阱包含与SEQ ID NO:14、SEQ ID NO.141或SEQ ID NO:142所示的序列至少80%相同的序列。在一个实施方案中,所述TGF-β细胞因子阱包含SEQ ID NO:14、SEQ ID NO.141或SEQ ID NO:142所示的序列。
在一个实施方案中,所述TGF-β细胞因子阱包含SEQ ID NO:14所示的序列。在一个实施方案中,所述抗体(抗PD1)是免疫球蛋白G(IgG)抗体。在一个实施方案中,所述IgG是IgG1、IgG2、IgG3或IgG4。在一个实施方案中,所述IgG4在SEQ ID NO:146或SEQ ID NO:292的位置108处包含突变。在一个实施方案中,所述突变是S108P突变。在一个实施方案中,所述IgG4通过所述连接体连接至所述TGF-β细胞因子阱。在一个实施方案中,所述抗体的所述片段是Fab、(Fab)
在一个实施方案中,所述抗体包含所述抗体的重链可变区(V
在一个实施方案中,所述轻链可变区(V
在一个实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ ID NO:16所示的序列。在一个实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ IDNO:143所示的序列。在一个实施方案中,所述重链可变区(VH)与SEQ ID NO:7所示的序列至少90%相同,并且所述轻链可变区与SEQ ID NO:13所示的序列至少90%相同。在一个实施方案中,所述重链可变区(V
在一个实施方案中,所述融合蛋白包含SEQ ID NO:296所示的序列和SEQ ID NO:145所示的序列。在一个实施方案中,所述融合蛋白包含SEQ ID NO:296所示的序列和SEQID NO:144所示的序列。在一个实施方案中,所述抗体进一步包含片段可结晶区(F
在一个实施方案中,所述TGFβ细胞因子阱包含所述TGFβ抑制肽或其所述变体。在一个实施方案中,所述TGFβ抑制肽包含SEQ ID NO.193-227中任一个所示的序列。
本文提供了一种编码本文公开的融合蛋白的多核苷酸。
本文提供了一种表达载体,其包含编码本文公开的融合蛋白的多核苷酸,其中所述多核苷酸可操作地连接至启动子。在一个实施方案中,所述启动子是组成型启动子、组织特异性启动子或诱导型启动子。在一个实施方案中,所述诱导型启动子是基于两个多肽蜕皮素受体的小分子配体诱导型基因开关。在一个实施方案中,所述载体是腺病毒载体。
本文提供了一种药物组合物,其包含:(a)本文公开的融合蛋白,(b)编码本文公开的融合蛋白的多核苷酸,或(c)本文公开的表达载体,以及(d)药学上可接受的赋形剂。
本文提供了一种治疗癌症的方法,其包括:使细胞接触(a)本文公开的融合蛋白,(b)编码本文公开的融合蛋白的多核苷酸,或(c)本文公开的表达载体。在一个实施方案中,所述细胞是癌细胞。在一个实施方案中,所述细胞是哺乳动物细胞。
本文提供了一种治疗患有癌症的受试者的方法,该方法包括:施用包含融合蛋白的组合物,该融合蛋白包含(a)能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或变体,和(b)转化生长因子受体(TGFβR)或其功能片段、抗TGF-β抗体或其抗原结合片段、TGF-β1抑制肽或其变体;其中所述融合蛋白的一个或多个多肽通过连接体连接。
在一个实施方案中,所述连接体包含(G4S)n,其中n为2、3、4、5或6。在一个实施方案中,所述连接体包含(Gly)n,其中n为6、7或8。在一个实施方案中,所述连接体包含(EAAAK)n,其中n为1、2、3、4、5或6。在一个实施方案中,所述连接体包含A(EAAAK)4ALEA(EAAAK)4A。在一个实施方案中,所述连接体包含SEQ ID NO:17-34中任一个所示的序列。在一个实施方案中,所述转化生长因子受体蛋白是TGFβRII。在一个实施方案中,所述TGFβRII的所述功能片段是TGFβRII胞外域(ECD)。在一个实施方案中,所述TGF-β细胞因子阱包含与SEQ ID NO:14、SEQ ID NO.141或SEQ ID NO:142所示的序列至少80%相同的序列。在一个实施方案中,所述TGF-β细胞因子阱包含SEQ ID NO:14、SEQ ID NO.141或SEQ ID NO:142所示的序列。
在一个实施方案中,所述抗体是免疫球蛋白G(IgG)抗体。在一个实施方案中,所述IgG是IgG1、IgG2、IgG3或IgG4。在一个实施方案中,所述IgG4在SEQ ID NO:146或SEQ IDNO:292的位置108处包含突变。在一个实施方案中,所述突变是S108P突变。在一个实施方案中,所述抗体的所述片段是所述抗体的Fab、(Fab)2、(Fab’)2、Fv、(Fv)2或scFv。在一个实施方案中,所述抗体或所述抗体的片段或所述抗体的变体包含重链可变区(V
在一个实施方案中,所述重链可变区(V
在一个实施方案中,所述轻链可变区(V
在一个实施方案中,所述融合蛋白包含SEQ ID NO:15(VL5 Igg4)所示的序列和SEQ ID NO:143所示的序列。在一个实施方案中,所述重链可变区(VH)与SEQ ID NO:7所示的序列至少90%相同,并且所述轻链可变区(V
在一个实施方案中,所述抗体进一步包含片段可结晶区(F
在一个实施方案中,所述CTLA-4抑制剂是抗CTLA-4抗体或其片段或变体。在一个实施方案中,所述方法进一步包括施用一种或多种细胞因子。在一个实施方案中,所述受试者是哺乳动物受试者。在一个实施方案中,所述受试者是人。在一个实施方案中,所述癌症是间皮瘤、胶质母细胞瘤、子宫内膜癌、结直肠癌、胃癌、宫颈癌、卵巢癌、胰腺癌、前列腺癌、乳腺癌、胃癌、膀胱癌、肝癌、霍奇金淋巴瘤、肺癌、皮肤癌、肾癌或头颈癌。
在一个实施方案中,所述皮肤癌是皮肤鳞状细胞癌、黑素瘤或基底细胞癌。在一个实施方案中,所述肺癌是非小细胞肺癌(NSLC)或小细胞肺癌(SCLC)。在一个实施方案中,所述乳腺癌是三阴性乳腺癌(TNBC)。在一个实施方案中,所述方法进一步包括施用有效量的被工程改造为表达外源受体的T细胞。在一个实施方案中,所述外源受体是嵌合抗原受体。在一个实施方案中,所述嵌合抗原受体是工程化T细胞受体。
在一个实施方案中,所述嵌合抗原受体包含能与CD19、BCMA、CD44、α-叶酸受体、CAIX、CD30、ROR1、CEA、EGP-2、EGP-40、HER2、HER3、叶酸结合蛋白、GD2、GD3、IL-13R-a2、KDR、EDB-F、间皮素、CD22、EGFR、叶酸受体α、MUC-1、MUC-4、MUC-16、MAGE-A1、h5T4、PSMA、TAG-72、EGFR、CD20、EGFRvIII、CD123或VEGF-R2上的表位结合的抗原结合域。在一个实施方案中,所述抗原结合域包含选自SEQ ID NO:37-56的序列。在一个实施方案中,所述抗原结合域包含选自SEQ ID NO:35-36的序列。
在一个实施方案中,工程化T细胞的有效量为至少10
本文提供了一种治疗有需要的受试者中的癌症的方法,其包括(a)施用包含融合蛋白的组合物,该融合蛋白包含能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或所述抗体的变体;和转化生长因子受体(TGFβR)蛋白或其功能片段;其中所述融合蛋白的一个或多个多肽通过连接体连接;以及(b)向所述受试者施用一剂或多剂有效量的工程化T细胞,其中所述工程化T细胞包含嵌合受体和膜结合的IL-15。
在一个实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ ID NO:294所示的序列。在一个实施方案中,所述融合蛋白包含SEQ ID NO:296所示的序列和SEQID NO:295所示的序列。在一个实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ ID NO:294所示的序列。在一个实施方案中,所述融合蛋白包含SEQ ID NO:13所示的序列和SEQ ID NO:295所示的序列。
本文尤其公开了融合蛋白,其包含:(a)能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或所述抗体的变体;和(b)腺苷脱氨酶(ADA)蛋白或其功能片段;
其中所述融合蛋白的一个或多个多肽通过连接体连接。在一个实施方案中,所述连接体包含(G4S)n,其中n为2、3、4、5或6。在一些实施方案中,
所述连接体包含(Gly)n,其中n为6、7或8。在另一个实施方案中,所述连接体包含(EAAAK)n,其中n为1、2、3、4、5或6。在某些实施方案中,所述连接体包含A(EAAAK)4ALEA(EAAAK)4A。在某些实施方案中,所述连接体包含SEQ ID NO:17-34中任一个所示的序列。
在一个实施方案中,所述腺苷脱氨酶蛋白是腺苷脱氨酶2(ADA2)或其突变体或其变体。在另一个实施方案中,所述腺苷脱氨酶(ADA)蛋白包含ADA2突变体1(SEQ ID NO:273)、ADA2突变体2(SEQ ID NO:274)、ADA2突变体3(SEQ ID NO 275)、ADA2突变体4(SEQ IDNO:276)、ADA2突变体5(SEQ ID NO:277)或ADA2突变体6(SEQ ID NO:278)、ADA2突变体7(SEQ ID NO:279)或野生型ADA2(SEQ ID NO:284)中的任何一个。在其他实施方案中,所述腺苷脱氨酶(ADA)蛋白包含与SEQ ID NO:284或273-279中任一个所示的序列至少80%相同的序列。在某些实施方案中,所述腺苷脱氨酶(ADA)蛋白包含SEQ ID NO:284或273-279中任一个所示的序列。
在一个实施方案中,所述抗体是免疫球蛋白G(IgG)抗体。在某些实施方案中,所述IgG是IgG1、IgG2、IgG3或IgG4。在一个实施方案中,所述IgG4在SEQ ID NO:146或292的位置108处包含突变。在一些实施方案中,所述突变是S108P突变。在一些实例中,所述抗体的片段是该抗体的Fab、(Fab)2、(Fab’)2、Fv、(Fv)2或scFv。在一个实施方案中,所述抗体或所述抗体的片段或所述抗体的变体包含重链可变区(V
在一个实例中,所述重链可变区(V
在一个实例中,所述融合蛋白包含SEQ ID NO:12(VL5)所示的序列和SEQ ID NO:280(VH6 IgG4(mut)-ADA2 wt)所示的序列。在另一个实例中,所述融合蛋白包含SEQ IDNO:12(VL5)所示的序列和SEQ ID NO:281(VH6 igG4(mut)ADA2 mut 7)所示的序列。在一个实例中,所述重链可变区(V
本文提供了一种编码融合蛋白的多核苷酸。本文进一步提供了一种表达载体,其包含编码任一个上述方面的融合蛋白的多核苷酸,其中该多核苷酸可操作地连接至启动子。在一些实施方案中,所述启动子是组成型启动子、组织特异性启动子或诱导型启动子。在一些实施方案中,所述诱导型启动子是基于两个多肽蜕皮素受体的小分子配体诱导型基因开关。在一些实施方案中,所述载体是腺病毒载体。
本文提供了一种治疗癌症的方法,其包括:使细胞接触所述融合蛋白、编码所述融合蛋白的多核苷酸或所述表达载体。在一些实施方案中,所述细胞是癌细胞。在一些实施方案中,所述细胞是哺乳动物细胞。
本文进一步提供了一种药物组合物,其包含所述融合蛋白;或编码所述融合蛋白的多核苷酸;或所述表达载体,以及药学上可接受的赋形剂。
本文提供了一种治疗患有癌症的受试者的方法,该方法包括施用包含融合蛋白的组合物,该融合蛋白包含能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或所述抗体的变体;和腺苷脱氨酶蛋白或其功能片段;其中所述融合蛋白的一个或多个多肽通过连接体连接。在某些情况下,所述腺苷脱氨酶蛋白是腺苷脱氨酶2(ADA2)。在其他实施方案中,所述腺苷脱氨酶(ADA)蛋白包含ADA2突变体1(SEQ ID NO:273)、ADA2突变体2(SEQ ID NO:274)、ADA2突变体3(SEQ ID NO 275)、ADA2突变体4(SEQ ID NO:276)、ADA2突变体5(SEQ ID NO:277)或ADA2突变体6(SEQ ID NO:278)、ADA2突变体7(SEQ ID NO:279)或野生型ADA2(SEQ ID NO:284)中的任何一个。
在某些情况下,所述连接体包含(G4S)n,其中n为2、3、4、5或6。在一些实施方案中,所述连接体是(Gly)n,其中n为6、7或8。在一些实施方案中,所述连接体包含(EAAAK)n,其中n为1、2、3、4、5或6。在一些实施方案中,所述连接体包含A(EAAAK)
本文提供了一种治疗患有癌症的受试者的方法。在某些情况下,所述癌症是间皮瘤、胶质母细胞瘤、子宫内膜癌、结直肠癌、胃癌、宫颈癌、卵巢癌、胰腺癌、前列腺癌、乳腺癌、胃癌、膀胱癌、肝癌、霍奇金淋巴瘤、肺癌、皮肤癌、肾癌或头颈癌。在某些情况下,所述皮肤癌是皮肤鳞状细胞癌、黑素瘤或基底细胞癌。在其他情况下,所述肺癌是非小细胞肺癌(NSLC)或小细胞肺癌(SCLC)。在一些情况下,所述乳腺癌是三阴性乳腺癌(TNBC)。
在另一个实施方案中,存在一种治疗患有癌症的受试者的方法,该方法包括施用包含融合蛋白的组合物,该融合蛋白包含能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或所述抗体的变体;和腺苷脱氨酶蛋白或其功能片段;其中所述融合蛋白的一个或多个多肽通过连接体连接。在进一步的实施方案中,所述治疗患有癌症的受试者的方法进一步包括施用有效量的被工程改造为表达外源受体的T细胞。
在一些情况下,所述外源受体是嵌合抗原受体。在其他情况下,所述嵌合抗原受体是工程化T细胞受体。在一种情况下,所述嵌合抗原受体包含能与CD19、BCMA、CD44、α-叶酸受体、CAIX、CD30、ROR1、CEA、EGP-2、EGP-40、HER2、HER3、叶酸结合蛋白、GD2、GD3、IL-13R-a2、KDR、EDB-F、间皮素、CD22、EGFR、叶酸受体α、MUC-1、MUC-4、MUC-16、MAGE-A1、h5T4、PSMA、TAG-72、EGFR、CD20、EGFRvIII、CD123或VEGF-R2上的表位结合的抗原结合域。在一些实施方案中,所述抗原结合域包含选自SEQ ID NO:37-56的序列。在其他实施方案中,所述抗原结合域包含选自SEQ ID NO:35-36的序列。
在一个实施方案中,工程化T细胞的有效量为至少10
在进一步的实施方案中,所述工程化T细胞进一步表达细胞因子。在另一个实施方案中,所述细胞因子是包含IL-15和IL-15Rα的融合蛋白。
本文提供了一种治疗有需要的受试者中的癌症的方法,其包括施用包含融合蛋白的组合物,该融合蛋白包含能与程序性细胞死亡蛋白-1(PD-1)结合的抗体或所述抗体的片段或所述抗体的变体;和腺苷脱氨酶蛋白或其功能片段;其中所述融合蛋白的一个或多个多肽通过连接体连接,以及向所述受试者施用一剂或多剂有效量的工程化T细胞,其中所述工程化T细胞包含嵌合受体和膜结合的IL-15。
附图说明
在所附权利要求书中具体阐述了本发明的特征。通过参考以下对利用本公开的原理的说明性实施方案加以阐述的详细描述以及附图,将会对本公开的特征和优点获得更好的理解,在这些附图中:
图1是免疫抑制中的PD-1/PD-L1的示意图。
图2是免疫抑制中的TGF-β的示意图。
图3显示了与卵巢癌患者子集中的转移性疾病和预后不良相关的TGF-β相关基因簇(在III/IV期富含)。
图4A、图4B和图4C显示了抗PD1-TGFRII融合蛋白设计的方案设计。在其他示例性实施方案中,ADA2可以与抗PD1融合。
图5是显示抗PD1(VH6-VL5)IgG1-TGFβRII和抗PD1(VH6-VL5)IgG4-TGFβRII对PD-1/PD-L1相互作用的阻断的图形。
图6是显示抗PD1(VH6-VL5)IgG1-TGFβRII和抗PD1(VH6-VL5)IgG4-TGFβRII对TGF-β1同种型信号传导的中和的图形。
图7是显示抗PD1(VH6-VL5)IgG1-TGFβRII和抗PD1(VH6-VL5)IgG4-TGFβRII对TGF-β2同种型的中和的图形。
图8是显示抗PD1(VH6-VL5)IgG1-TGFβRII和抗PD1(VH6-VL5)IgG4-TGFβRII对TGF-β3同种型信号传导的中和的图形。
图9A、图9B和图9C中的图形显示,与抗PD1或对照抗体相比,在抗PD1-TGFRII融合蛋白的存在下,受刺激的PBMC的增殖和IFN-γ产生以剂量依赖性方式增强。
图9D和图9E中的图形分别显示,当将抗PD1-TGFRII融合蛋白加入PBMC和结直肠癌(结直肠腺癌)细胞系的共培养物中时,PD1受体在CD8
图9F和图9G中的图形分别显示,当将抗PD1-TGFRII融合蛋白加入PBMC和头颈癌(咽癌)细胞系的共培养物中时,PD1受体在CD8+T细胞上的占据和IFN-γ产生。
图9H和图9I中的图形分别描绘了在抗PD1-TGFRII融合蛋白的存在下,在PBMC和结直肠癌(结直肠腺癌)细胞共培养物上清液中的TGF-β1和TGF-β2浓度。
图9J和图9K中的图形分别描绘了在抗PD1-TGFRII融合蛋白的存在下,在PBMC和头颈癌(咽癌)细胞共培养物上清液中的TGF-β1和TGF-β2浓度。
图9L和图9M中的图形分别描绘了与单独的抗PD1相比,在抗PD1-TGFRII融合蛋白的存在下,结直肠癌(结直肠腺癌)细胞或头颈癌(咽癌)细胞和PBMC的3D球体培养物中的IFN-γ产生。
图10A-10D显示了在重组TGF-β1的存在下,抗PD1-TGFRII融合蛋白处理对T细胞增殖和活化的影响。
图11A-11F显示了在重组TGF-β1的存在下和在抗PD1、抗PD1-TGFRII融合蛋白或对照抗体的存在下,各种细胞因子由PBMC的表达。
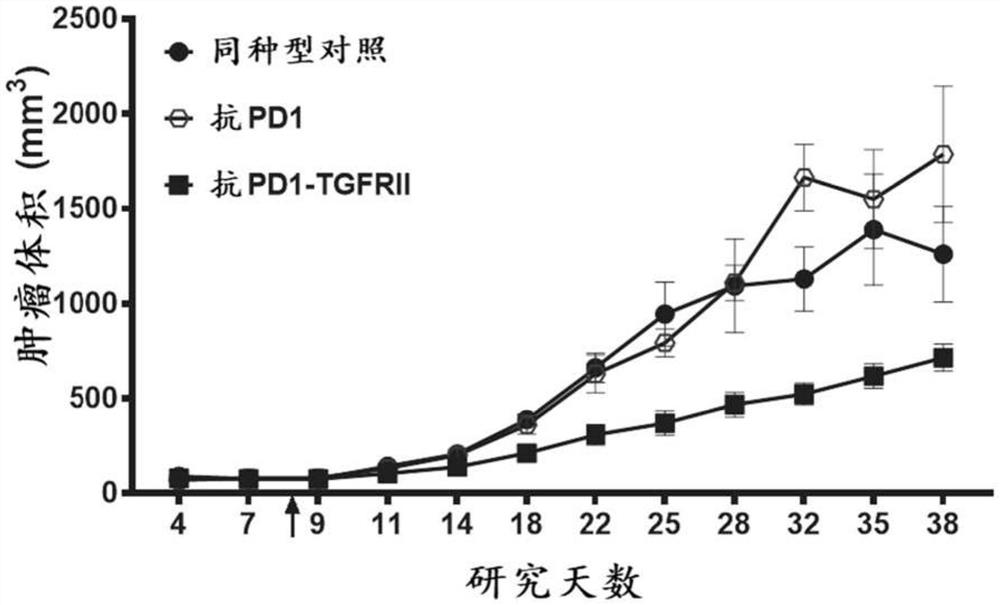
图12A显示了在结直肠癌的人源化小鼠模型中,与单独的抗PD1相比,抗PD1-TGFRII融合蛋白对肿瘤生长的影响。
图12B显示了在结直肠癌的人源化小鼠模型中,用抗PD1-TGFRII融合蛋白治疗显著增加了肿瘤中CD8
图12C显示了在结直肠癌的人源化小鼠模型中,与抗PD1治疗相比,抗PD1-TGFRII融合蛋白治疗对穿孔蛋白表达水平的影响。
图12D和图12E显示了在结直肠癌的人源化小鼠模型中,分别与抗PD1治疗相比,抗PD1-TGFRII融合蛋白治疗对TGF-β1和TGF-β2浓度的影响。
图13A显示了在头颈癌的体外模型中,与抗PD1治疗相比,采用抗PD1-TGFRII融合蛋白的治疗显著改善IFNγ的产生。图13B-13G显示了采用抗PD1-TGFRII融合蛋白的治疗显著增加T细胞功能,如通过各种途径基因的表达分析所证实的。
图14A显示了在头颈癌的人源化小鼠模型中,与单独的抗PD1相比,抗PD1-TGFRII融合蛋白对肿瘤生长的影响。
图14B显示了当用抗PD1-TGFRII融合蛋白治疗时,相比于用单独的抗PD1或同种型对照治疗时,在头颈癌的人源化小鼠模型中荷瘤小鼠的存活率。
图14C显示了在头颈癌的人源化小鼠模型中,用抗PD1-TGFRII融合蛋白治疗的小鼠的肿瘤中CD8
图14D和图14E显示了在头颈癌的人源化小鼠模型中,与单独的抗PD1相比,抗PD1-TGFRII融合蛋白对TGF-β1和TGF-β2浓度的影响。
图14F显示了在头颈癌的人源化小鼠模型中,抗PD1-TGFRII融合蛋白对IFN-γ的产生的影响。
图15A-15B显示了抗PD1(VH7/VL6)--TGFRII融合蛋白对原发性结直肠癌患者样品中的IFN-γ产生和TGF-β1浓度的影响。
图15C显示了与抗PD1(VH7/VL6)--TGFRII融合蛋白共培养的原发性结直肠癌患者样品的基因表达分析。
图16显示的图形描绘了与抗PD-L1--TGFRII融合蛋白相比,抗PD1(VH7/VL6)-TGFRII融合蛋白的细胞毒性测定的结果。
图17中的图形描绘了相比于抗PD-1联合CAR T细胞,相比于单独的CAR T细胞,抗PD1(VH7/VL6)-TGFRII融合蛋白联合嵌合受体抗原(CAR)T细胞的细胞毒性测定的结果。
图18A和图18B中的图形分别描绘了抗PD1(VH6/VL5)-TGFRII融合蛋白联合CD33CAR-T的细胞毒性测定结果和抗PD1(VH7/VL6)-TGFRII融合蛋白联合CD33 CAR-T的细胞毒性测定结果。
图19A和图19B中的图形描绘了当与NK细胞共培养时,分别使用抗PD1(VH6/VL5)-TGFRII融合蛋白和抗PD1(VH7/VL6)-TGFRII融合蛋白的肿瘤细胞裂解。
图20中的图形描绘了使用不同的连接体,TGF-b1和PD1同时被抗PD1(VH6/VL5)-TGFRII融合蛋白结合的Biacore分析。
图21是显示抗PD1 IgG4-ADA2对PD-1/PD-L1相互作用的阻断的图形。
图22是显示针对抗PD1 hIgG1-ADA2和抗PD1 hIgG4-ADA2测量的ADA2酶活性的图形。
图23A-23C是显示抗PD1和抗PD1-ADA2融合蛋白的各种变体对PD-L1/PD-1相互作用的影响的图形。
图24A-24F是显示通过ADA酶活性测量的,抗PD1-ADA2融合蛋白的各种变体的酶活性的图形。
图25是显示通过ADA酶活性测量的,抗PD1-mutADA2相比于抗PD1-wtADA2的酶活性的图形。
图26A-26D是描绘抗PD1-wtADA2的变体对T细胞增殖的影响的图形。
图26E是描绘与抗PD1或同种型对照相比,抗PD1-wtADA2引起的IFNγ的产生的图形。
图27A-27B是描绘wtADA2和mutADA2逆转腺苷介导的T细胞增殖抑制的有效性的图形。
图28是描绘抗PD1-ADA2融合蛋白的变体对PD1-PDL1相互作用的阻断的影响的图形。
图29是显示通过ADA酶活性测量的,抗PD1-ADA2-scFv-Fc的酶活性的图形。
图30是显示通过ADA酶活性测量的,抗PD1-ADA2的变体的酶活性的条形图。
图31A-31B是描绘抗PD1-wtADA2对原发性CRC患者肿瘤中的IFN-γ产生和肿瘤浸润淋巴细胞(TIL)增殖的影响的图形。
图32是描绘抗PD1相比于抗PD1-wtADA2对肺癌人源化小鼠模型的肿瘤体积的影响的图形。
图33A-33C显示了抗PD1-腺苷脱氨酶2(ADA2)设计——抗PD1-ADA2——的方案设计。
具体实施方式
以下描述和实施例详细阐明了本公开的实施方案。
应当理解,本公开内容不限于本文所述的特定实施方案,因此可以变化。本领域技术人员将会认识到,本公开存在变化和修改,这些均涵盖在本公开内容的范围内。
所有术语均应按照它们将被本领域技术人员所理解的那样来理解。除非另有定义,否则本文使用的所有技术和科学术语均具有与本公开所属领域的普通技术人员通常所理解的含义相同的含义。
本文所用的章节标题仅用于组织编排的目的,而不应解释为限制所描述的主题。
尽管本公开的各个特征可以在单个实施方案的语境中描述,但是这些特征也可以单独提供或以任何合适的组合提供。相反,尽管为了清楚起见,本文可以在单独的实施方案的语境中描述本公开,但是本公开也可以在单个实施方案中实现。
以下定义补充了本领域中的定义,并且针对本申请,而不应归于任何相关或不相关的情况,例如任何共同拥有的专利或申请。本文描述了优选的材料和方法,但是与本文描述的方法和材料类似或等同的任何方法和材料可以在测试本公开内容的实践中使用。因此,本文使用的术语仅仅是为了描述特定实施方案的目的,而并非旨在限制。
定义
在本申请中,除非另有特别说明,否则单数形式的使用包括复数形式。必须指出,除非上下文另有明确说明,否则如本说明书中所用的,单数形式“一个”、“一种”和“该”包括复数指示物。
在本申请中,除非另有说明,否则“或”的使用意指“和/或”。如本文所用的术语“和/或”和“其任意组合”及其语法等同语可互换使用。这些术语可表达,具体涉及任何组合。仅为了说明目的,下列短语“A、B和/或C”或“A、B、C或其任意组合”可指“单独A;单独B;单独C;A和B;B和C;A和C;以及A、B和C”。术语“或”可以合取性使用或析取性使用,除非上下文具体指出为析取性使用。
此外,术语“包括”以及其他形式如“包含”、“含有”和“具有”的使用不是限制性的。
本说明书中提及“一些实施方案”、“实施方案”、“一个实施方案”或“其他实施方案”意指与该实施方案相关描述的特定特征、结构或特性包含在本公开的至少一些实施方案中,但不一定包含在所有实施方案中。
如在本说明书和权利要求书中所用的,词语“包含”(和任何形式的包含)、“具有”(和任何形式的具有)、“包括”(和任何形式的包括)或“含有”(和任何形式的含有)是包含性的或开放式的,并不排除其他未列举的要素或方法步骤。可以想到,本说明书中讨论的任何实施方案可以采用本公开的任何方法或组合物来实施,反之亦然。此外,本公开的组合物可以用来实现本公开的方法。
如本文所用的,关于参考数值的术语“约”及其语法等同语可包括该数值本身和该数值加或减10%的值的范围。
术语“约”或“大约”意指在本领域普通技术人员测定的特定值的可接受误差范围内,该可接受误差范围将部分取决于该值如何测量或测定,即,测量系统的局限性。例如,根据本领域中的实践,“约”可指在1个或大于1个标准偏差内。或者,“约”可指给定值的最多20%、最多10%、最多5%或最多1%的范围。在另一个实例中,“约10”的量包括10以及9至11的任何量。在又一个实例中,关于参考数值的术语“约”还可以包括该数值加或减10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的数值范围。或者,特别是关于生物系统或过程,术语“约”可表示在某个值的一个数量级内,优选5倍以内,更优选2倍以内。在本申请和权利要求书中描述特定值的情况下,除非另有说明,否则应推定术语“约”意指在该特定值的可接受误差范围内。
如本文所用的“多核苷酸”或“寡核苷酸”是指任何长度的核苷酸或核酸——核糖核苷酸或脱氧核糖核苷酸——的聚合形式。该术语仅指分子的一级结构。因此,该术语包括双链和单链DNA、三链DNA以及双链和单链RNA。它还包括修饰形式(例如通过甲基化和/或通过加帽)和未修饰形式的多核苷酸。该术语还意在包括包含非天然存在的核苷酸或合成核苷酸以及核苷酸类似物的分子。
如本文所用的“转染”、“转化”或“转导”是指通过使用物理或化学方法将一种或多种外源多核苷酸引入宿主细胞中。可以通过例如转染、转化或转导将本文公开或考虑的多核苷酸序列和载体引入细胞中。许多转染技术是本领域已知的,并且包括例如磷酸钙DNA共沉淀(参见,例如,Murray E.J.(编著),Methods in Molecular Biology,Vol.7,GeneTransfer and Expression Protocols,Humana Press(1991));DEAE-葡聚糖;电穿孔;阳离子脂质体介导的转染;钨颗粒促进的微粒轰击(Johnston,Nature,346:776-777(1990));以及磷酸锶DNA共沉淀(Brash等人,Mol.Cell Biol.,7:2031-2034(1987))。在合适的包装细胞中生长感染性颗粒后,可将噬菌体或病毒载体引入宿主细胞中,其中许多包装细胞可商购获得。
如本文所用的“多肽”、“肽”及其语法等同语是指氨基酸残基的聚合物。多肽可任选地包含在给定细胞环境中对给定蛋白质而言典型的糖基化或其他修饰的蛋白质。本文公开的多肽和蛋白质(包括其功能部分和功能变体)可包含合成氨基酸来代替一种或多种天然存在的氨基酸。这类合成氨基酸是本领域已知的,并且包括,例如,氨基环己烷羧酸、正亮氨酸、α-氨基正癸酸、高丝氨酸、S-乙酰基氨基甲基-半胱氨酸、反式-3-和反式-4-羟基脯氨酸、4-氨基苯丙氨酸、4-硝基苯丙氨酸、4-氯苯丙氨酸、4-羧基苯丙氨酸、β-苯基丝氨酸β-羟基苯丙氨酸、苯基甘氨酸、α-萘基丙氨酸、环己基丙氨酸、环己基甘氨酸、吲哚啉-2-羧酸、1,2,3,4-四氢异喹啉-3-羧酸、氨基丙二酸、氨基丙二酸单酰胺、N’-苄基-N’-甲基-赖氨酸、N’,N’-二苄基-赖氨酸、6-羟基赖氨酸、鸟氨酸、α-氨基环戊烷羧酸、α-氨基环己烷羧酸、α-氨基环庚烷羧酸、α-(2-氨基-2-降莰烷)-羧酸、α,γ-二氨基丁酸、α,β-二氨基丙酸、高苯丙氨酸和α-叔丁基甘氨酸。本公开进一步预期,本文所述多肽在工程化细胞中的表达可与多肽或蛋白质的一种或多种氨基酸的翻译后修饰相关。翻译后修饰的非限制性实例包括磷酸化、酰化(包括乙酰化和甲酰化)、糖基化(包括N-连接的和O-连接的)、酰胺化、羟基化、烷基化(包括甲基化和乙基化)、泛素化、加入吡咯烷酮羧酸、形成二硫键、硫酸化、豆蔻酰化、棕榈酰化、异戊二烯化、法尼基化、牻牛儿基化(geranylation)、糖基磷脂酰肌醇化(glypiation)、脂化(lipoylation)和碘化。
在两个核酸序列或多肽的氨基酸序列的语境中,如本文所用的术语“相同的”及其语法等同语或“序列同一性”,是指在指定的比较窗口上,两个序列中的残基在为了获得最大对应性而对齐时相同。如本文所用的“比较窗口”是指至少约20个连续位置,通常约50至约200、更通常约100至约150个连续位置的区段,其中可在两个序列经过最佳比对后将一个序列与具有相同数目的连续位置的参考序列进行比较。用于比较的序列比对方法在本领域中是公知的。用于比较的序列的最佳比对可以通过以下方法进行:Smith和Waterman,Adv.Appl.Math.,2:482(1981)的局部同源性算法;Needleman和Wunsch,J.Mol.Biol.,48:443(1970)的比对算法;Pearson和Lipman,Proc.Nat.Acad.Sci.U.S.A.,85:2444(1988)的相似性搜索方法;这些算法的计算机化实现(包括但不限于Intelligentics,MountainView Calif.的PC/Gene程序中的CLUSTAL,Wisconsin Genetics Software Package中的GAP、BESTFIT、BLAST、FASTA和TFASTA,Genetics Computer Group(GCG),575Science Dr.,Madison,Wis.,U.S.A.);CLUSTAL程序在以下文献中充分描述:Higgins和Sharp,Gene,73:237-244(1988)以及Higgins和Sharp,CABIOS,5:151-153(1989);Corpet等人,NucleicAcids Res.,16:10881-10890(1988);Huang等人,Computer Applications in theBiosciences,8:155-165(1992);及Pearson等人,Methods in Molecular Biology,24:307-331(1994)。比对通常还通过检查和手动比对来进行。在一类实施方案中,本文的多肽与参考多肽或其片段至少80%、85%、90%、98%、99%或100%相同,例如,如通过BLASTP(或CLUSTAL,或任何其他可用的比对软件)使用默认参数来测定的。类似地,核酸也可以参考起始核酸来描述,例如,它们可以与参考核酸或其片段50%、60%、70%、75%、80%、85%、90%、98%、99%或100%相同,例如,如通过BLASTN(或CLUSTAL,或任何其他可用的比对软件)使用默认参数来测定的。当描述一个分子与较大分子具有一定百分比的序列同一性时,这意味着当两个分子最佳对齐时,根据两个分子最佳对齐的顺序,较小分子中所述百分比的残基在较大分子中找到匹配残基。
应用于核酸或氨基酸序列的术语“基本上相同的”及其语法等同语是指使用标准程序,与使用上述程序(例如BLAST)的参考序列相比,核酸或氨基酸序列包含具有至少90%或更高、至少95%、至少98%和至少99%的序列同一性的序列。例如,BLASTN程序(用于核苷酸序列)默认使用字长(W)为11,期望(E)为10,M=5,N=-4,以及两条链的比较。对于氨基酸序列,BLASTP程序默认使用字长(W)为3,期望(E)为10和BLOSUM62评分矩阵(参见Henikoff&Henikoff,Proc.Natl.Acad.Sci.USA 89:10915(1992))。通过在比较窗口上比较两个最佳比对的序列来确定序列同一性百分比,其中与用于两个序列最佳比对的参考序列(其不包括添加或缺失)相比,比较窗口中的多核苷酸序列的部分可包括添加或缺失(即空位)。通过以下方法来计算百分比:确定在两个序列中均出现相同核酸碱基或氨基酸残基的位置的数目以得到匹配位置的数目,将匹配位置的数目除以比较窗口中的位置总数,并将所得结果乘以100以得到序列同一性百分比。在一些实施方案中,在长度至少约50个残基的序列的区域上,在至少约100个残基的区域上存在基本同一性,并且在一些实施方案中,序列在至少约150个残基上基本相同。在一些实施方案中,序列在编码区的整个长度上基本相同。
通常从两种或更多种核酸或蛋白质(或其序列)之间的序列同一性推断“同源性”。可用于确立同源性的序列间精确同一性百分比随所讨论的核酸和蛋白质而变化,但是常规使用低至25%的序列同一性来确立同源性。更高水平的序列同一性,例如30%、40%、50%、60%、70%、80%、90%、95%或99%或更高,也可用来确立同源性。用于确定序列同一性百分比的方法(例如,使用默认参数的BLASTP和BLASTN)在本文中描述并且通常是可获得的。当核酸和/或核酸序列天然地或人工地衍生自共同的祖先核酸或核酸序列时,它们是“同源的”。当蛋白质和/或蛋白质序列的编码DNA天然地或人工地衍生自共同的祖先核酸或核酸序列时,这些蛋白质和/或蛋白质序列是“同源的”。同源分子可称为“同源物”。例如,任何天然存在的蛋白质均可以通过任何可用的诱变方法进行修饰。当表达时,该诱变的核酸编码的多肽与原始核酸编码的蛋白质同源。
如本文所用的术语“分离的”及其语法等同语是指将核酸从其天然环境中取出。如本文所用的术语“纯化的”及其语法等同语是指纯度增加的分子或组合物,无论是从自然界中取出的(包括基因组DNA和mRNA)还是在实验室条件下合成(包括cDNA)和/或扩增的,其中“纯度”是一个相对的术语,而不是“绝对纯度”。然而,应该理解,核酸和蛋白质可以与稀释剂或佐剂一起配制,而出于实际目的仍然是分离的。例如,当用于引入细胞中时,核酸通常与可接受的载体或稀释剂混合。如本文所用的术语“基本上纯化的”及其语法等同语是指这样的核酸序列、多肽、蛋白质或其他化合物,其基本上不含,即超过约50%不含、超过约70%不含、超过约90%不含与该核酸、多肽、蛋白质或其他化合物天然关联的多核苷酸、蛋白质、多肽和其他分子。
“表达载体”或“载体”是任何遗传元件,例如质粒、染色体、病毒、转座子,其表现为细胞内多核苷酸复制的自主单元(即能够在其自身控制下复制)或通过插入宿主细胞染色体中而能够复制,其已附接有另一多核苷酸区段,以便实现所附接的区段的复制和/或表达。合适的载体包括但不限于质粒、转座子、噬菌体和粘粒。载体可含有实现载体连接或插入所需宿主细胞中以及实现附接区段的表达所必需的多核苷酸序列。这样的序列根据宿主生物体而不同;它们包括实现转录的启动子序列、增加转录的增强子序列、核糖体结合位点序列以及转录和翻译终止序列。或者,表达载体可以能够直接表达其中编码的核酸序列产物,而无需载体连接或整合到宿主细胞DNA序列中。在一些实施方案中,所述载体是“附加型表达载体”或“附加体”,其能够在宿主细胞中复制,并且在适当选择压力的存在下作为DNA的染色体外区段存在于宿主细胞内(参见,例如,Conese等人,Gene Therapy,11:1735-1742(2004))。代表性的可商购的附加型表达载体包括但不限于利用EB核抗原1(EBNA1)和EB病毒(EBV)复制起点(oriP)的附加型质粒。来自Invitrogen(Carlsbad,Calif.)的载体pREP4、pCEP4、pREP7和pcDNA3.1以及来自Stratagene(La Jolla,Calif.)的pBK-CMV代表了使用T-抗原和SV40复制起点来代替EBNA1和oriP的附加型载体的非限制性实例。载体还可以包含选择标记基因。
如本文所用的,术语“选择标记基因”是指在相应选择剂的存在下允许表达核酸序列的细胞被特异性选择或排除的核酸序列。合适的选择标记基因是本领域已知的,并描述于例如国际专利申请公开WO 1992/08796和WO 1994/28143;Wigler等人,Proc.Natl.Acad.Sci.USA,77:3567(1980);O’Hare等人,Proc.Natl.Acad.Sci.USA,78:1527(1981);Mulligan&Berg,Proc.Natl.Acad.Sci.USA,78:2072(1981);Colberre-Garapin等人,J.Mol.Biol.,150:1(1981);Santerre等人,Gene,30:147(1984);Kent等人,Science,237:901-903(1987);Wigler等人,Cell,11:223(1977);Szybalska&Szybalski,Proc.Natl.Acad.Sci.USA,48:2026(1962);Lowy等人,Cell,22:817(1980);和美国专利5,122,464和5,770,359。
如本文所用的术语“编码序列”是指编码蛋白质或多肽的多核苷酸区段。该区域或序列由5'端附近的起始密码子和3'端附近的终止密码子来界定。编码序列也可以被称为开放阅读框。
如本文所用的术语“可操作地连接的”是指DNA区段与另一DNA区段的物理和/或功能连接,从而允许这些区段以其预期方式起作用。当编码基因产物的DNA序列与调节序列如启动子、增强子和/或沉默子以某种方式连接,使得允许直接或间接调节该DNA序列的转录时,该DNA序列与调节序列可操作地连接。例如,当DNA序列与启动子在启动子的转录起始位点下游连接,与该转录起始位点符合正确的阅读框架,并允许转录延伸通过该DNA序列进行时,该DNA序列与该启动子可操作地连接。当增强子或沉默子以某种方式连接到编码基因产物的DNA序列上,从而分别增加或减少该DNA序列的转录时,该增强子或沉默子与该DNA序列可操作地连接。增强子和沉默子可位于DNA序列的编码区的上游、下游或嵌入其中。如果信号序列被表达为参与多肽分泌的前蛋白质,则该信号序列的DNA与编码该多肽的DNA可操作地连接。DNA序列与调节序列的连接通常通过在合适的限制位点连接或通过使用本领域技术人员已知的限制性内切核酸酶插入该序列中的衔接子或连接体来完成。
如本文所用的术语“诱导”及其语法等同语是指相对于一定的基础转录水平,由转录调节物引起的核酸序列转录、启动子活性和/或表达的增加。
术语“转录调节物”是指这样的生化元件,其在某些环境条件下用来阻止或抑制启动子驱动的DNA序列的转录(例如,阻遏物或核抑制蛋白),或者在某些环境条件下用来允许或刺激启动子驱动的DNA序列的转录(例如,诱导物或增强子)。
如本文所用的术语“增强子”是指增加例如与其可操作地连接的核酸序列的转录的DNA序列。增强子可以位于远离核酸序列编码区的数千碱基处,并且可以介导调节因子的结合、DNA甲基化的模式或DNA结构的改变。来自多种不同来源的大量增强子是本领域公知的,并且可作为克隆的多核苷酸(来自诸如ATCC等保藏中心以及其他商业或个体来源)或在克隆的多核苷酸内获得。许多包含启动子(如常用的CMV启动子)的多核苷酸也包含增强子序列。增强子可位于编码序列的上游、内部或下游。术语“Ig增强子”是指衍生自定位于免疫球蛋白(Ig)基因座内的增强子区域的增强子元件(这样的增强子包括例如重链(μ)5’增强子、轻链(κ)5’增强子、κ和μ内含增强子和3’增强子)(一般性地参见Paul W.E.(编著),Fundamental Immunology,第3版,Raven Press,New York(1993),第353-363页;以及美国专利5,885,827)。
术语“启动子”是指启动编码序列转录的多核苷酸区域。启动子位于基因的转录起始位点附近,位于DNA的同一链和上游(朝向有义链的5’区)。一些启动子是组成型的,因为它们在细胞中在所有情况下都具有活性,而其他启动子响应于特定刺激被调节变得具有活性,例如诱导型启动子。术语“启动子活性”及其语法等同语是指与正被测量活性的启动子可操作地连接的核苷酸序列的表达程度。启动子活性可以通过确定产生的RNA转录物的量直接测定(例如通过Northern印迹分析),或通过确定由所连接的核酸序列(如与启动子连接的报道核酸序列)编码的产物的量间接测定。
如本文所用的“诱导型启动子”是指通过转录调节物(例如,生物或非生物因素)的存在或不存在而诱导活性的启动子。诱导型启动子是有用的,因为与它们可操作连接的基因的表达可以在生物体的某些发育阶段或在特定组织中打开或关闭。诱导型启动子的非限制性实例包括醇调节的启动子、四环素调节的启动子、类固醇调节的启动子、金属调节的启动子、发病机理调节的启动子、温度调节的启动子和光调节的启动子。诱导型启动子可以是基因开关或遗传开关的部分。
如本文所用的“T细胞”或“T淋巴细胞”是在细胞介导的免疫中起重要作用的一种类型的淋巴细胞。它们与其他淋巴细胞如B细胞和自然杀伤细胞(NK细胞)的区别可在于在细胞表面上存在T细胞受体(TCR)。
如本文所用的,术语“抗体”,也称为免疫球蛋白(Ig),可以是单克隆或多克隆抗体。如本文所用的,术语“单克隆抗体”是指由B细胞的单个克隆产生并结合相同表位的抗体。相反,“多克隆抗体”是指由不同B细胞产生并结合相同抗原的不同表位的抗体群体。抗体可以来自任何动物来源。抗体可以是IgG(包括IgG1、IgG2、IgG3和IgG4)、IgA(包括IgA1和IgA2)、IgD、IgE或IgM和IgY。在一些实施方案中,抗体可以是完整抗体,包括单链完整抗体。在一些实施方案中,抗体可以是抗体的片段,其可以包括但不限于Fab、Fab'、F(ab’)
术语“抗体的片段”、“抗体片段”、“抗体的片段”、“抗原结合部分”或其语法等同语在本文中可互换使用,是指保留特异性结合抗原的能力的抗体的一个或多个片段或部分(大体上参见Holliger等人,Nat.Biotech.,23(9):1126-1129(2005))。例如,抗体片段理想地包含一个或多个CDR、可变区(或其部分)、恒定区(或其部分)或其组合。抗体片段的非限制性实例包括(1)Fab片段,其为由V
“抗原识别部分”、“抗原识别域”、“抗原结合域”或“抗原结合区”是指与抗原特异性结合的分子或分子部分。在一个实施方案中,抗原识别部分是抗体、抗体样分子或其片段。
术语“保守氨基酸置换”或“保守突变”是指将一个氨基酸置换为另一个具有共同性质的氨基酸。定义各个氨基酸之间的共同性质的功能性方法是分析同源生物体的相应蛋白质之间氨基酸变化的归一化频率(Schulz,G.E.和Schirmer,R.H.,Principles ofProtein Structure,Springer-Verlag,New York(1979))。根据这样的分析,可以定义氨基酸组,其中组内的氨基酸彼此优先交换,因此它们在对总体蛋白质结构的影响上彼此最相似(Schulz,G.E.和Schirmer,R.H.,同上)。保守突变的实例包括上述亚组内的氨基酸的氨基酸置换,例如赖氨酸置换精氨酸,反之亦然,使得可以保持正电荷;谷氨酸置换天冬氨酸,反之亦然,使得可以保持负电荷;丝氨酸置换苏氨酸,使得可以保持游离-OH;谷氨酰胺置换天冬酰胺,使得可以保持游离-NH
术语“非保守突变”涉及不同组之间的氨基酸置换,例如,赖氨酸置换色氨酸,或苯丙氨酸置换丝氨酸,等等。在这种情况下,优选非保守氨基酸置换不干扰或不抑制功能变体的生物活性。非保守氨基酸置换可以增强功能变体的生物活性,使得与同源亲本蛋白质相比,功能变体的生物活性增加。
如本文所提及的术语“增殖性疾病”是指统一的概念,其中细胞的过度增殖和/或细胞基质的更新对包括癌症在内的疾病的发病机理有显著贡献。在一些实施方案中,该增殖性疾病是癌症。
如本文所用的“患者”或“受试者”是指被诊断为患有或怀疑患有或发展为增殖性病症如癌症的哺乳动物受试者。在一些实施方案中,术语“患者”是指发展为增殖性病症如癌症的可能性高于平均值的哺乳动物受试者。示例性患者可以是人、猿、狗、猪、牛、猫、马、山羊、绵羊、啮齿动物和其他可以受益于本文公开的疗法的哺乳动物。示例性的人类患者可以是男性和/或女性。“有需要的患者”或“有需要的受试者”在本文中是指被诊断为患有或怀疑患有疾病或病症,例如但不限于癌症的患者。
“施用”在本文中是指向患者或受试者提供一种或多种本文所述的组合物。作为实例而非限制的,组合物施用(例如,注射)可通过静脉内(i.v.)注射、皮下(s.c.)注射、皮内(i.d.)注射、腹膜内(i.p.)注射或肌肉内(i.m.)注射进行。可以采用一种或多种这样的途径。肠胃外施用可以是,例如,通过推注或通过随时间平缓灌注。备选地地或同时地,可通过口服途径施用。此外,还可以通过手术沉积细胞团或细胞丸或放置医疗装置来施用。在实施方案中,本公开的组合物可以以有效治疗或预防增殖性病症的量包含表达本文所述核酸序列的工程化细胞或宿主细胞,或包含至少一种本文所述核酸序列的载体。药物组合物可包含本文所述的靶细胞群体,以及一种或多种药学上或生理学上可接受的载剂、稀释剂或赋形剂。这类组合物可以包含缓冲液,如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸,如甘氨酸;抗氧化剂;螯合剂,如EDTA或谷胱甘肽;佐剂(例如氢氧化铝);和防腐剂。
如本文所用的,术语“治疗”、“处理”或其语法等同语是指获得所需的药理学和/或生理学效果。在实施方案中,该效果是治疗性的,即该效果部分或完全地治愈疾病和/或由该疾病引起的不良症状。在一些实施方案中,术语“治疗”可包括“预防”疾病或病况。
如本文所用的,“治疗期间”是指治疗周期,例如可以(例如按规律时间表)重复的治疗剂的给药过程。在实施方案中,给药方案可以在治疗期间之间具有一个或多个不施用治疗剂的时期。例如,治疗期间可以包括一剂与第二治疗剂,例如CAR-T细胞联合(之前、同时或之后)施用的融合蛋白。
如本文所用的术语“联合施用”或“共同施用”或“共同给药”或“共同提供”是指在受试者患病过程中向该受试者递送两种(或更多种)不同的治疗,例如,在受试者被诊断出患有该病症之后,并且在该病症已被治愈或消除或由于其他原因而停止治疗之前,递送两种或更多种治疗。在一些实施方案中,一种治疗的递送在第二治疗的递送开始时仍在进行,因此在给药方面存在重叠。这在本文中有时被称为“同时”或“并行递送”。在其他实施方案中,一种治疗的递送在另一种治疗的递送开始之前结束。在任一种情况的一些实施方案中,由于联合施用,治疗更有效。例如,第二治疗更有效,例如,与不存在第一治疗时施用第二治疗所观察到的相比,以较少的第二治疗观察到相同的效果,或者第二治疗以更大程度减轻症状,或者对于第一治疗观察到类似的情况。在一些实施方案中,递送使得症状或与病症有关的其他参数的减少大于在不存在另一种治疗时递送一种治疗所观察到的减少。两种治疗的效果可以是部分累加的、完全累加的或大于累加的。递送可以使得当递送第二治疗时仍然可以检测到所递送的第一治疗的效果。
在一些实施方案中,第一治疗和第二治疗可以在相同或分开的组合物中同时(例如,在相同时间)施用,或顺序施用。顺序施用是指在施用附加(例如第二)治疗之前(例如,在临施用前,在之前不到5、10、15、30、45、60分钟;1、2、3、4、6、8、10、12、16、20、24、48、72、96或更多小时;4、5、6、7、8、9或更多天;1、2、3、4、5、6、7、8或更多周之前)施用一种治疗。第一和第二治疗的施用顺序也可以颠倒。
术语“治疗有效量”、“治疗量”、“免疫有效量”、“抗肿瘤有效量”、“肿瘤抑制有效量”或其语法等同语是指在必要的剂量和一段时间内有效达到所需治疗结果的量。治疗有效量可根据诸如个体的疾病状态、年龄、性别和体重等因素以及本文所述组合物在一个或多个受试者中引发所需反应的能力而变化。待施用的本公开的组合物的精确量可以由医生考虑年龄、体重、肿瘤大小、感染或转移的程度以及患者(受试者)的状况的个体差异来确定。
或者,向患者或受试者施用一种或多种本文所述组合物的药理学和/或生理学效果可以是“预防性的”,即该效果完全或部分地预防疾病或其症状。“预防有效量”是指在必要的剂量和时间段上有效获得所需预防结果(例如,疾病发作的预防)的量。
程序性细胞死亡蛋白和其他检查点抑制剂
程序性细胞死亡蛋白1,也称为PD-1或CD279(分化簇279),是一种免疫检查点蛋白。PD-1/PD-L1信号传导轴可促进肿瘤介导的免疫逃逸。在一些情况下,肿瘤微环境中的肿瘤细胞、辅助细胞如髓样来源的抑制细胞(MDSC)、肿瘤相关巨噬细胞(TAM)、抗原呈递细胞(APC)可能过表达PDL-1。在一些情况下,PD-1可被“耗竭”的T细胞上调,并且可以在与其配体(PDL-1、PDL2和CD80)结合时发出信号以抑制效应T细胞功能。抗PD-1或抗PD-L1对PD-1/PD-L1途径的阻断可以恢复耗竭的T细胞的功能,并促进对肿瘤细胞的杀伤(图1)。
在一些实施方案中,包含PD-1抑制剂和TGF-β阱的融合蛋白可包括但不限于全长纳武单抗(抗PD-1)、MK-3945(抗PD-1)、派姆单抗(抗PD-1)、pidilizumab(抗PD-1)、REGN2810(抗PD-1)、AMP-224(抗PD-1)、MEDI0680(抗PD-1)、PDR001(抗PD-1)、CT-001(抗PD-1)或其功能片段或变体。在一些实施方案中,该PD-1抑制剂是纳武单抗。在一些实施方案中,该PD-1抑制剂是派姆单抗。
融合蛋白
在一些实施方案中,本文提供的融合蛋白或其片段或其变体包含经由连接体与细胞因子阱融合的PD-1抑制剂或抗体。
在一些实施方案中,PD-1抑制剂可以是靶向PD-1的抗体或该抗体的片段或该抗体的变体。在一些实施方案中,包含prembrolizumab的融合蛋白可以与细胞因子阱(例如,TGF-β阱)融合。在一些实施方案中,包含纳武单抗的融合蛋白可以与细胞因子阱(例如,TGF-β阱)融合。
在一些实施方案中,本文所述的融合蛋白或其片段或其变体包含如上所述的细胞因子阱和靶向免疫检查点基因的抗体、该抗体的片段或变体。在一些实施方案中,靶向免疫检查点如细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)和程序性细胞死亡配体-1(PDL1)的抗体或该抗体的片段或该抗体的变体,可以经由连接体与TGF-β阱融合。在一些实施方案中,该PD-L1抑制剂是阿特珠单抗。
在一些实施方案中,本文提供的融合蛋白或其片段或其变体包含与本文所述的腺苷脱氨酶(例如ADA2)或其功能变体或衍生物融合的PD1抑制剂或抗体。
细胞因子阱
细胞因子对许多生物过程具有影响。抑制细胞因子可以在例如癌症中具有临床益处。已经证明数种细胞因子是多种疾病的致病因子。这类细胞因子包括但不限于IL-1、IL-4、Il-6、TNF-α、TGF-β及其各种同种型。如本文所用的术语“细胞因子阱”是指细胞因子作用的阻断剂或中和剂。这类细胞因子阱的实例可包括但不限于细胞因子受体的胞外域、与细胞因子结合的抗体以及与细胞因子结合的肽(例如抑制肽)。在一个实施方案中,该细胞因子是TGF-β。在一个实施方案中,该细胞因子是TGF-β1。在一个实施方案中,该细胞因子是TGF-β3。在一个实施方案中,该细胞因子是TGF-β1和TGF-β3。在进一步的实施方案中,靶向TGF-β的细胞因子阱(例如TGF-β阱)可包括TGF-βRII或其变体的胞外域(例如SEQ ID NO141和142)、抗TGF-β抗体以及TGF-β1、TGF-β2和/或TGF-β3的抑制肽。
转化生长因子
转化生长因子-β(TGF-β)是一组多功能的肽,其可以控制许多细胞类型中的增殖、分化和其他功能。TGF-β在诱导转化中可以与TGF-α协同作用。它也可以充当负的自分泌生长因子。TGF-β激活和信号传导的失调可导致凋亡。许多细胞可以合成TGF-β,并且几乎所有细胞都具有该肽的特异性受体。TGF-β1、TGF-β2和TGF-β3都可以通过相同的受体信号传导系统起作用。TGF-β1在控制免疫系统中可以发挥重要作用,并且可以对不同类型的细胞或处于不同发育阶段的细胞显示不同的活性。大多数免疫细胞(或白细胞)可分泌TGF-β1。TGF-β1是通过蛋白水解切割从前体蛋白质的C末端衍生的112个氨基酸残基的肽。TGF-β是一种分泌的小多肽,可以通过II型丝氨酸/苏氨酸激酶二聚体受体(TGFβRII)发出信号,该受体可以募集并磷酸化I型二聚体受体(TGFβRI)。TGFβRI可以磷酸化并激活SMAD,SMAD可能是调节参与细胞增殖、分化、凋亡和生长的基因的转录因子。已知许多晚期癌症都过表达TGF-β和TGFβR,从而促进侵袭性肿瘤的形成。抑制TGFB信号传导途径可能是治疗癌症的关键治疗策略。
一些T细胞(例如调节性T细胞)可以释放TGF-β1来抑制其他T细胞的作用。TGF-β1的活性可以阻止活化的T细胞的IL-1和IL-2依赖性增殖,以及静息的辅助T细胞和细胞毒性T细胞的活化。类似地,TGF-β1可以抑制包括但不限于干扰素-γ、肿瘤坏死因子α(TNF-α)和各种白介素的许多其他细胞因子的分泌和活性。它还可以降低细胞因子受体如IL-2受体的表达水平,以下调免疫细胞的活性。然而,TGF-β1还可以增加T细胞中某些细胞因子的表达,并能促进它们的增殖,特别是在细胞不成熟的情况下(图2)。
TGF-β1可以对B细胞具有类似的作用,该作用根据细胞的分化状态而不同。它可以抑制B细胞的增殖并可以刺激B细胞的凋亡,并且可以在控制抗体、转铁蛋白和MHC II类蛋白在未成熟和成熟B细胞上的表达中发挥作用。
TGF-β1对巨噬细胞和单核细胞的作用可能主要是抑制性的;该细胞因子可以抑制这些细胞的增殖,并可以防止它们产生活性氧(例如超氧化物(O
转化生长因子-βIII(TGF-β3)是细胞因子家族的子集,负责多种功能,包括细胞增殖、胚胎发生、免疫系统调节和分化。
转化生长因子-β受体II(TGFβRII)
TGF-β受体(TGFβR)是单通过丝氨酸/苏氨酸激酶受体。它们可以以若干不同的同种型存在,这些同种型可以是同二聚体或异二聚体的。TGF-β超家族中已表征的配体的数目可以远超过已知受体的数目,提示配体与受体相互作用之间的混杂。三种对TGF-β具有特异性的TGF-β超家族受体(TGFβR)可以通过其结构和功能性质加以区分。TGFβRI(ALK5)和TGFβRII可能具有相似的配体结合亲和力,并且只有通过肽作图才能彼此区分。TGFβRI和TGFβRII均对TGF-β1具有高亲和力,并对TGF-β2具有低亲和力。TGFβRIII(β-聚糖)可能对同型二聚体TGF-β1和TGF-β2均具有高亲和力,并且另外对异二聚体TGF-β1,2具有高亲和力。TGFβ受体还可以与TGF-β3结合。所谓“TGFβRII”或“TGFβ受体II”是指具有野生型人TGFβ受体2型同种型A序列(例如,NCBI参考序列(RefSeq)登录号NP_001020018的氨基酸序列(SEQ IDNO:289))的多肽,或具有野生型人TGFβ受体2型同种型B序列(例如,NCBI RefSeq登录号NP_003233的氨基酸序列(SEQ ID NO:290))或具有与SEQ ID NO:289或SEQ ID NO:290的氨基酸序列基本相同的序列的多肽。TGFβRII可以保留野生型序列的TGFβ结合活性的至少0.1%、0.5%、1%、5%、10%、25%、35%、50%、75%、90%、95%或99%。表达的TGFβRII的多肽缺乏信号序列。
TGF-β1可以降低MHC II在星形胶质细胞和树突细胞中的功效,这进而降低适当的辅助T细胞群体的活化。TGF-β1可随着癌症进展促进肿瘤生长,并且在一些实施方案中,不抑制炎性细胞应答,但是可以促进调节性T细胞功能。TGF-β1可由肿瘤细胞、肿瘤相关的成纤维细胞、调节性T细胞和未成熟的髓样细胞产生。TGF-β1可以抑制T细胞引发并促进耗竭的表型。TGF-β1可以抑制包括自然杀伤细胞、巨噬细胞和树突细胞在内的先天免疫细胞群体的抗肿瘤活性。TGF-β受体II可以被肿瘤相关的髓样细胞上调,并可以促进转移。
TGF-β阱融合蛋白或其片段或变体
本文提供了一种融合蛋白或其片段或变体,其包含免疫检查点抑制剂,如PD-1抑制剂或抗体,以及可以中和细胞因子(例如TGF-β)的细胞因子阱。在某些情况下,细胞因子阱可以是包含SEQ ID NO.142的TGF-β阱(也称为TGF-βRII或其片段或变体)。TGF-β阱的实例可以包括但不限于受体(例如,TGFβRII)或其功能变体或衍生物的胞外域(ECD)、TGF-β抑制肽(例如,SEQ ID NO.193-227)或抗TGF-β抗体。在一些实施方案中,该抗TGF-β抗体包含重链可变区(V
本文提供的融合蛋白或其片段或变体(例如,与细胞因子阱如TGF-β阱融合的PD-1抑制剂或抗体)由于同时阻断例如肿瘤细胞上的PD-L1与免疫细胞上的PD-1之间的相互作用,并中和例如肿瘤微环境中的TGF-β,而可以引发协同的抗肿瘤效应。不受理论的束缚,这种效果是从同时阻断两种主要的免疫逃逸机制和单分子实体对肿瘤微环境中TGF-β的靶向消耗所获得的。该消耗可通过以下一种或多种来实现:(1)肿瘤细胞的抗PD-1靶向;(2)TGF-β阱(例如,TGFbRII)对肿瘤微环境中的TGF-β的结合;和/或(3)通过PD-L1受体介导的内吞作用对结合的TGF-β的破坏。本文提供的融合蛋白或其片段或变体(例如,与细胞因子阱如TGF-β阱融合的PD-1抑制剂或抗体)也可以促进自然杀伤细胞介导的肿瘤细胞杀伤。
(i)TGFβRII阱融合蛋白或其片段或变体
在一些实施方案中,融合蛋白或其片段或变体还包含细胞因子阱和PD-1抑制剂或抗PD-1抗体或其片段或变体。在一些实施方案中是融合蛋白或其片段或变体,其包含任选地经由可切割或不可切割的连接体与PD-1抑制剂融合的细胞因子阱(例如,TGF-β阱)。在一些实施方案中,该细胞因子阱(例如,TGF-β阱)是细胞因子受体(例如,TGFβRII)。在一些实施方案中,本文所述的融合蛋白中的细胞因子受体序列包含受体(例如TGFβRII)或其功能变体或衍生物的胞外域(ECD)。在一些实施方案中,TGFβRII的胞外域(ECD)包含如SEQ IDNO:14所示的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列包含与SEQ ID NO:14的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白中的细胞因子受体序列包含受体(例如TGFβRII)或其功能变体或衍生物的胞外域(ECD)。在一些实施方案中,TGFβRII的胞外域(ECD)包含如SEQ ID NO:141所示的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列包含与SEQ ID NO:141的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白中的细胞因子受体序列包含受体(例如TGFβRII)或其功能变体或衍生物的胞外域(ECD)。在一些实施方案中,TGFβRII的胞外域(ECD)包含如SEQ ID NO:142所示的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列包含与SEQ ID NO:142的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列结合TGF-β1和/或TGF-β3,但不结合TGF-β2。在某些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列仅结合TGF-β1。在某些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列仅结合TGF-β3。在某些实施方案中,本文所述的融合蛋白或其片段或变体中的细胞因子受体序列仅结合TGF-β1和/或TGF-β3,但对TGF-β2具有低亲和力或无亲和力。
在一些实施方案中,PD-1抗体与TGFβRII或其片段(例如,TGFβRII的ECD)融合。在一些实施方案中,PD-1抗体部分经由连接体与TGFβRII或其片段(例如,TGFβRII的ECD)融合。在一些实施方案中,PD-1抗体部分与TGFβRII的至少一个胞外域融合。在一些实施方案中,PD-1抗体部分经由连接体与TGFβRII的至少一个胞外域融合。
在一些实施方案中,PD-1抗体片段或变体是PD-1抗体的Fab、Fab
非限制性示例性融合蛋白在图4A-4C中示出。在一些实施方案中,包含与TGF-β阱融合的抗PD-1抗体或其片段或变体的融合蛋白由于同时阻断肿瘤细胞上的PD-L1与免疫细胞上的PD-1之间的相互作用,并中和肿瘤微环境中的TGF-β,而可以引发协同的抗肿瘤效应。不受理论的束缚,这种效果是从同时阻断两种主要的免疫逃逸机制和单分子实体对肿瘤微环境中TGF-β的靶向消耗所获得的。该消耗如下实现:(1)肿瘤细胞的PD-1靶向;(2)TGF-β阱(例如,TGFβRII)对肿瘤微环境中的TGF-β的结合;和(3)通过PD-L1受体介导的内吞作用对结合的TGF-β的破坏。
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的重链可变区(V
术语“抗PD1(VL/VH)-TGFβRII”或“抗PD1(VH/VL)-TGFβRII”可互换使用,并且表示在融合蛋白中使用的特定VL或VH。在一个实施方案中,术语“抗PD1(VL/VH)-TGFβRII”或“抗PD1(VH/VL)-TGFβRII”是指与抗PD1的重链恒定区融合的TGF-β阱(例如TGFβRII),或者是指与抗PD1的轻链恒定区融合的TGF-β阱(例如TGFβRII)。
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的Fab融合。在一些实施方案中,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的Fab融合。在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的Fab
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的Fv融合。在一些实施方案中,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的Fv融合。在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的(Fv)
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的scFv融合。在一些实施方案中,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的scFv融合。在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的scFv-F
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的F
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的双抗体融合。在一些实施方案中,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的双抗体融合。在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的三抗体融合。在一些实施方案中,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的三抗体融合。在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的微型抗体融合。在一些实施方案中,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的微型抗体融合。在一方面,TGF-β阱(例如TGFβRII)经由连接体与PD-1抗体或其片段/变体的微型抗体的N末端或C末端融合。
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的V
在一些实施方案中,TGF-β阱(例如TGFβRII)与PD-1抗体或其片段/变体的V
在一些实施方案中,PD-1抗体部分与TGFβRII或其片段或变体(例如,TGFβRII的ECD)融合。在一些实施方案中,PD-1抗体部分经由连接体与TGFβRII或其片段或变体(例如,TGFβRII的ECD)融合。在一些实施方案中,PD-1抗体部分与TGFβRII的至少一个胞外域融合。在一些实施方案中,PD-1抗体部分经由连接体与TGFβRII的至少一个胞外域融合。非限制性示例性融合蛋白在图4A-4C中示出。
在一些实施方案中,PD-1抗体片段是PD-1抗体的Fab、Fab
在一些实施方案中,PD-1抗体或其片段/变体的重链可变区(V
在一些实施方案中,PD-1抗体或其片段/变体的重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:15所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:16所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ ID NO:16所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:15所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:143所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ ID NO:143所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:15所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:294所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在实施方案中,所述融合蛋白包含SEQ ID NO:15所示的序列和SEQ ID NO:294所示的序列。
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:296所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:145所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:296所示的序列和SEQ ID NO:145所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:296所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:144所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:296所示的序列和SEQ ID NO:144所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:296所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:295所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:296所示的序列和SEQ ID NO:295所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:12所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:16所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:12所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:143所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:13所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:145所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。在一些实施方案中,所述融合蛋白包含如SEQ ID NO:145所示的序列。
在一些实施方案中,所述融合蛋白包含连接体以及重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:15所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:15所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:16所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:16所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:143所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:143所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:144所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:144所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:145所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:145所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
(ii)抗TGFβ抗体-融合蛋白或其片段或变体
在其他实施方案中,细胞因子阱是针对TGF-β的抗体、抗体片段或抗体变体。在这样的实施方案中,此类抗体可包括泛中和抗TGFβ抗体或阻断受体与TGFβ1、2和/或3结合的抗受体抗体。在某些实施方案中,该抗体片段或变体是TGFβ抗体的Fab、Fab
(iii)TGF-β拮抗肽-融合蛋白或其片段或变体
在某些实施方案中,细胞因子阱可包括TGF-β拮抗肽或TGF-β抑制肽。可以使用噬菌体展示从头生成此类肽。在一个实施方案中,此类肽可衍生自TGF-β同种型或TGF-β受体的区段,TGF-β拮抗肽的实例可包括但不限于SEQ ID NO.193-227。TGF-β抑制肽的实例可包括但不限于SEQ ID NO:193-227。在一个实施方案中,所述肽可经由连接体与PD-1抗体或其片段/变体的V
腺苷:
腺苷是肿瘤微环境中的关键免疫调节剂。细胞外腺苷在与大多数免疫细胞中主要表达的亚型——A2A腺苷受体(A2AR)结合后抑制炎性应答。若干种肿瘤表达高水平的CD39和CD73,它们分别是负责将ATP和ADP转化为AMP以及将AMP转化为腺苷的胞外核苷酸酶。因此,腺苷通过诱导Foxp3、CD39和CD73的表达来促进调节性T细胞的抑制活性。另外,低氧通过诱导CD39和CD73来诱导肿瘤微环境中细胞外腺苷的积累。另外,肿瘤微环境中高水平的细胞外腺苷分别通过核苷酸转运蛋白ENT-1的低氧诱导因子(HIF)依赖性抑制以及防止腺苷在细胞内空间中的重新定位并防止形成AMP的腺苷激酶的抑制而得以维持。因此,在肿瘤微环境中靶向减少细胞外腺苷被理解为增强免疫细胞功能并促进肿瘤细胞杀伤。
在本文提供的实施方案中,是包含腺苷脱氨酶(例如ADA2)的融合蛋白,以靶向减少肿瘤微环境中的细胞外腺苷。
腺苷脱氨酶
腺苷脱氨酶(也称为腺苷氨基水解酶,或ADA)ADA不可逆地对腺苷进行脱氨基,通过将氨基取代为酮基将其转化为相关的核苷肌苷。然后可以用另一种被称为嘌呤核苷磷酸化酶(PNP)的酶对肌苷进行去核糖基化(从核糖中去除),将其转化为次黄嘌呤。来自食物的腺苷的分解和组织中核酸的更新需要ADA。其在人类中的主要功能是发展和维持免疫系统。然而,还发现ADA与上皮细胞分化、神经传递和妊娠维持相关。ADA有2种同种型:ADA1和ADA2。
ADA1被发现于大多数身体细胞中,特别是淋巴细胞和巨噬细胞中,在这些细胞中,ADA1不仅存在于胞质溶胶和细胞核中,而且还以与二肽基肽酶-4(也称为CD26)附接的胞外形式存在于细胞膜上。ADA1主要参与细胞内活性,并以小形式(单体)和大形式(二聚体)两种形式存在。小到大形式的相互转换受肺中“转换因子”的调节。
ADA2最先在人类脾脏中得到鉴定。随后在包括巨噬细胞在内的其他组织中被发现,在这些组织中,它与ADA1共存。这两种同种型调节腺苷与脱氧腺苷之比。ADA2主要存在于人血浆和血清中,并且主要以同型二聚体形式存在。ADA2是人血浆中存在的主要形式,在许多疾病中增多,尤其是与免疫系统相关的疾病:例如类风湿性关节炎、银屑病和结节病。在大多数癌症中,血浆ADA2同种型也增加。ADA2并非普遍存在,但在单核细胞-巨噬细胞中与ADA1共存。
ADA2融合蛋白或其片段或变体
本文提供了一种融合蛋白或其片段或变体,其包含免疫检查点抑制剂,如PD-1抑制剂或抗体,以及可以中和腺苷的腺苷脱氨酶(例如ADA2)。本文提供的融合蛋白或其片段或变体(例如,与腺苷脱氨酶(例如ADA2)融合的PD-1抑制剂或抗体)由于同时阻断例如肿瘤细胞上的PD-L1与免疫细胞上的PD-1之间的相互作用,并中和例如肿瘤微环境中的腺苷,而可以引发协同的抗肿瘤效应。不受理论的束缚,这种效果是从同时阻断两种主要的免疫逃逸机制和单分子实体对肿瘤微环境中腺苷的靶向消耗所获得的。该消耗可通过以下一种或多种来实现:(1)肿瘤细胞的抗PD-1靶向;(2)腺苷脱氨酶(例如ADA2)对肿瘤微环境中的腺苷的结合;和(3)通过PD-L1受体介导的内吞作用对结合的腺苷的破坏。
在一些实施方案中,腺苷脱氨酶(例如ADA2)是还包含PD-1抑制剂或抗体或其片段或变体的融合蛋白或其片段或变体的一部分。在一些实施方案中是融合蛋白或其片段或变体,其包含任选地经由可切割或不可切割的连接体与PD-1抑制剂融合的腺苷脱氨酶(例如ADA2)。在一些实施方案中,腺苷脱氨酶是腺苷脱氨酶2(ADA2)。在一些实施方案中,本文所述的融合蛋白包含本文所述的腺苷脱氨酶(例如ADA2)或其功能变体或衍生物。ADA2和变体的实例在WO 2016061286中描述,其通过引用整体并入本文。在一些实施方案中,TGF-β细胞因子阱包含ADA2突变体1、ADA2突变体2、ADA2突变体3、ADA2突变体4、ADA2突变体5、ADA2突变体6或ADA2突变体7中的任一种。在一些实施方案中,本文提供的融合蛋白或其片段或变体包含经由连接体与ADA蛋白或其功能片段融合的PD-1抑制剂或抗体。在一些实施方案中,该PD-1抑制剂可以是靶向PD-1的抗体或该抗体的片段或变体。
在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:284的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:273的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:274的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:37275的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:276的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:277的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:278的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。在一些实施方案中,本文所述的融合蛋白或其片段或变体包含与SEQ ID NO:279的多肽序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%同一性的多肽序列。
在一些实施方案中,本文所述的融合蛋白或其片段或变体包含如上所述的腺苷脱氨酶(例如ADA2)和靶向免疫检查点基因的抗体、该抗体的片段或变体。在一些实施方案中,靶向免疫检查点如细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)和程序性细胞死亡-1(PD-1)的抗体或该抗体的片段或变体,可以经由连接体与腺苷脱氨酶(例如ADA2)融合。
在一些实施方案中,PD-1抗体部分与腺苷脱氨酶(例如ADA2)或其片段融合。在一些实施方案中,PD-1抗体部分经由连接体与腺苷脱氨酶(例如ADA2)融合。在一些实施方案中,PD-1抗体部分与ADA2的至少一个结构域融合。在一些实施方案中,PD-1抗体部分经由连接体与ADA2的至少一个结构域融合。
在一些实施方案中,PD-1抗体片段或变体是PD-1抗体的Fab、Fab
非限制性示例性融合蛋白在图33A-33C中示出。在一些实施方案中,包含与腺苷脱氨酶(例如ADA2)融合的抗PD-1抗体或其片段或变体的融合蛋白由于同时阻断肿瘤细胞上的PD-L1与免疫细胞上的PD-1之间的相互作用,并靶向减少肿瘤微环境中的细胞外腺苷,而可以引发协同的抗肿瘤效应。
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的重链可变区(V
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的Fab融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)经由连接体与PD-1抗体或其片段/变体的Fab融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的Fab
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的Fv融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)经由连接体与PD-1抗体或其片段/变体的Fv融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的(Fv)
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的scFv融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)经由连接体与PD-1抗体或其片段/变体的scFv融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的scFv-F
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的F
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的双抗体融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)经由连接体与PD-1抗体或其片段/变体的双抗体融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的三抗体融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)经由连接体与PD-1抗体或其片段/变体的三抗体融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的微型抗体融合。在一些实施方案中,腺苷脱氨酶(例如ADA2)经由连接体与PD-1抗体或其片段/变体的微型抗体融合。
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的V
在一些实施方案中,腺苷脱氨酶(例如ADA2)与PD-1抗体或其片段/变体的V
在一些实施方案中,PD-1抗体或其片段/变体的重链可变区(V
在一些实施方案中,PD-1抗体或其片段/变体的重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:12所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:280所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:12所示的序列和SEQ ID NO:280所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:12所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:281所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:12所示的序列和SEQ ID NO:281所示的序列。
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:13所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:282所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:13所示的序列和SEQ ID NO:282所示的序列。
在一些实施方案中,所述融合蛋白包含与SEQ ID NO:13所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列,以及与SEQ ID NO:283所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的序列。
在一些实施方案中,所述融合蛋白包含SEQ ID NO:13所示的序列和SEQ ID NO:283所示的序列。
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:15所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:15所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:280所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:280所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:281所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:281所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:282所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:282所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含如SEQ ID NO:283所示的多肽序列。在一些实施方案中,所述融合蛋白包含与SEQ ID NO:283所示的序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或100%相同的多肽序列。
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含重链可变区(V
在一些实施方案中,所述融合蛋白包含轻链可变区(V
连接体
在一些实施方案中,所述连接体包含一个或多个如SEQ ID NO:17-34中任一个所示的多肽序列。在一些实施方案中,该连接体可以是柔性连接体。当连接的结构域需要一定程度的移动或相互作用时,可以应用柔性连接体。柔性连接体可以由小的非极性(例如,Gly)或极性(例如,Ser或Thr)氨基酸组成。柔性连接体可以具有主要由Gly和Ser残基(“GS”连接体)段组成的序列。柔性连接体的非限制性实例可具有序列(Gly-Gly-Gly-Gly-Ser)n,其中n可以是1、2、3、4、5、6、7、8、9或10。通过调整拷贝数“n”,可以优化该示例性GS连接体的长度以实现功能域的适当隔离或维持必需的结构域间相互作用。除GS连接体外,其他柔性连接体也可用于重组融合蛋白。在一些实施方案中,柔性连接体可具有序列(Gly)n,其中n可以是6、7或8。在一些情况下,柔性连接体也可以富含小氨基酸或极性氨基酸如Gly和Ser,但可以含有另外的氨基酸如Thr和Ala以维持柔性。在一些情况下,本文所述的连接体可以是刚性连接体。刚性连接体可以用来维持本文所述的融合蛋白或其片段或变体的结构域之间的固定距离。刚性连接体的非限制性实例可以是:α-螺旋形成连接体、富含Pro的序列、(XP)n、X-Pro骨架、(EAAAK)n(n=1-6)。在一些情况下,刚性连接体可以通过采用α-螺旋结构或通过包含多个Pro残基来表现出相对僵硬的结构。在一些实施方案中,免疫检查点抑制剂,如PD-1抑制剂,和可以中和本文所述的融合蛋白或其片段或变体中的细胞因子(例如TGF-β)的细胞因子阱(例如TGF-β阱),可以被编码间插连接体多肽的间插序列隔开。在一些实施方案中,免疫检查点抑制剂,如PD-1抑制剂,和本文所述的融合蛋白或其片段或变体中的ADA2(或其突变体),可以被编码间插连接体多肽的间插序列隔开。在某些实施方案中,连接体多肽包含下表中公开的序列:
表1.连接体氨基酸序列和多核苷酸序列
在一些实施方案中,连接体可以是柔性连接体、刚性连接体、体内可切割连接体或其任何组合。在一些情况下,连接体可以将功能域连接在一起(如在柔性和刚性连接体中)或在体内释放游离功能域,如同在体内可切割连接体中那样。在一些实施方案中,连接体可以改善生物活性、增加表达产率和实现理想的药代动力学谱。在一些实施方案中,连接体还可以包含腙、肽、二硫键或硫醚(thioesther)。
在一些情况下,本文所述的连接体序列可以包括柔性连接体。当连接的结构域需要一定程度的移动或相互作用时,可以应用柔性连接体。柔性连接体可以由小的非极性(例如,Gly)或极性(例如,Ser或Thr)氨基酸组成。柔性连接体可以具有主要由Gly和Ser残基(“GS”连接体)段组成的序列。柔性连接体的实例可具有序列(G4S)n,其中n为1、2、3、4、5、6、7、8、9或10。在一些实施方案中,柔性连接体可具有序列(Gly)n,其中n可以是6、7或8。在一些情况下,柔性连接体也可以富含小氨基酸或极性氨基酸如Gly和Ser,但可以含有另外的氨基酸如Thr和Ala以维持柔性。在其他情况下,可以使用极性氨基酸如Lys和Glu来提高溶解度。通过调整拷贝数“n”,可以优化这些非限制性示例性连接体的长度,以实现功能域的适当分隔,或维持必要的结构域间相互作用。除GS连接体外,其他柔性连接体也可用于本文所述的融合蛋白或其片段或变体。在一些情况下,柔性连接体也可以富含小氨基酸或极性氨基酸如Gly和Ser,但可以含有另外的氨基酸如Thr和Ala以维持柔性。在其他情况下,可以使用极性氨基酸如Lys和Glu来提高溶解度。
包含在本文所述连接体序列中的柔性连接体可以富含小氨基酸或极性氨基酸,如Gly和Ser,以提供良好的柔性和溶解度。当融合蛋白结构域或其片段或变体需要特定的移动或相互作用时,柔性连接体可能是合适的选择。另外,虽然柔性连接体没有刚性结构,但它们可以用作惰性连接体以保持功能域之间的距离。可以调节柔性连接体的长度,以允许适当折叠或实现融合蛋白或其片段或变体的最佳生物活性。
在一些情况下,本文所述的连接体可以进一步包括刚性连接体。刚性连接体可以用来维持本文所述的融合蛋白或其片段或变体的结构域之间的固定距离。刚性连接体的实例可以是(举几个例子来说):α-螺旋形成连接体、富含Pro的序列、(XP)n、X-Pro骨架、(EAAAK)n(n=1-6)。在一些情况下,刚性连接体可以通过采用α-螺旋结构或通过包含多个Pro残基来表现出相对僵硬的结构。
在一些实施方案中,本文所述的连接体可以是可切割的连接体。在其他情况下,连接体是不可切割的。不可切割的连接体可将融合蛋白或其片段或变体的功能域共价接合在一起,以在整个体内过程或体外过程中充当一个分子。连接体还可以是体内可切割的。可以引入可切割的连接体,以在体内释放游离的功能域。举几个例子来说,可通过还原试剂、蛋白酶的存在来切割可切割的连接体。例如,可以利用二硫键的还原来产生可切割的连接体。在二硫键连接体的情况下,通过与硫醇如谷胱甘肽的二硫键交换的切割事件可以产生切割。在其他情况下,重组融合蛋白中连接体的体内切割也可以通过蛋白酶进行,该蛋白酶可在病理条件(例如癌症或炎症)下于特定细胞或组织中体内表达或约束于某些细胞区室内。在一些情况下,可切割的连接体可允许靶向切割。例如,许多蛋白酶的特异性可以在约束区室中提供较慢的连接体切割。可切割的连接体还可以包含腙、肽、二硫键或硫醚(thioesther)。例如,腙可以赋予血清稳定性。在其他情况下,腙可以允许在酸性区室中切割。酸性区室可具有最高为7的pH。连接体还可以包括硫醚。硫醚可以是不可还原的。硫醚可以被设计用于细胞内蛋白水解降解。
在一些情况下,连接体可以是工程化连接体。例如,可以将连接体设计为包含化学特性,如疏水性。在一些情况下,至少两个不同的连接体多肽序列可以编码相同的多肽连接体序列。设计连接体的方法可以是计算的。在一些情况下,计算方法可以包括图形技术。可以使用计算方法从源自数据库的三维肽结构文库中搜索合适的肽。例如,可以使用Brookhaven Protein Data Bank(PDB)跨越连接体的选定氨基酸之间的空间距离。在一些情况下,多肽连接体还可包含一个或多个GS连接体序列,例如(G4S)n、(GS)n、(SG)n、(GSG)n和(SGSG)n,其中n可以是零至十五的任何数字。
治疗癌症的方法
本文还提供了一种用融合蛋白治疗癌症的方法,该融合蛋白包含免疫检查点抑制剂,如PD-1抑制剂,以及可以中和细胞因子(例如TGF-β)的细胞因子阱(例如TGF-β阱)。本文还提供了一种用融合蛋白治疗癌症的方法,该融合蛋白包含免疫检查点抑制剂,如PD-1抑制剂,和腺苷脱氨酶蛋白。靶向阻断免疫检查点途径如PD1和PD-L1/2信号传导途径以及CTLA-4和CD80/86信号传导途径的单克隆抗体的发展已经彻底改变了癌症治疗,它们在包括但不限于黑素瘤、非小细胞肺癌、肾细胞癌、膀胱癌、头颈部鳞状细胞癌、MSI高结直肠癌、Merkel细胞癌和霍奇金淋巴瘤的多种癌症适应症中显示出持久的临床活性。尽管有持久的反应,但反应率仍然极低,并且有若干患者产生了抗性,导致疾病进展。此外,在诸如卵巢癌、胃食管癌、前列腺癌、胰腺癌和其他许多癌症等若干适应症中,检查点抑制剂未能显示出任何实质性的临床反应。
检查点阻断的失败可归因于肿瘤微环境中存在的免疫抑制因子的复杂性。这些因素可包括但不限于抑制性细胞,如髓样来源的抑制性细胞、肿瘤相关的巨噬细胞(TAM);抑制性细胞因子和生长因子,如TGF-β和白介素10(IL-10);以及代谢衍生物,如腺苷和吲哚胺2,3-双加氧酶(IDO)副产物。本文提供的抗PD1-TGFβRII融合蛋白是可以靶向肿瘤微环境中的两个负抑制途径的疗法的实例。这些途径可以包括肿瘤细胞介导的细胞内在相互作用,其中PD-1/PD-L1相互作用可以起主要作用,以及免疫抑制性细胞因子介导的细胞外在相互作用,TGF-β可能是其主要成员。
在一些实施方案中,所述癌症是但不限于胶质母细胞瘤、结直肠癌、胃癌、宫颈癌、卵巢癌、胰腺癌、前列腺癌、乳腺癌和肾癌。另外,本文所述的融合蛋白可以适用于适应症,例如在非小细胞癌(NSCL)和黑素瘤中,其中检查点阻断的反应率较低并且TGF-β高表达。
癌症包括但不限于B细胞癌症,例如,多发性骨髓瘤、瓦尔登斯特伦巨球蛋白血症(Waldenstrom's macroglobulinemia)、重链病(例如α链疾病、γ链疾病及μ链疾病)、良性单克隆丙种球蛋白病和免疫细胞淀粉样变性、黑素瘤、乳腺癌、肺癌、支气管癌、结直肠癌、前列腺癌(例如,转移性、激素难治性前列腺癌)、胰腺癌、胃癌、卵巢癌、膀胱癌、脑或中枢神经系统癌症、周围神经系统癌、食管癌、宫颈癌、子宫癌或子宫内膜癌、口腔或咽部的癌症、肝癌、肾癌、睪丸癌、胆道癌、小肠或阑尾癌、唾液腺癌、甲状腺癌、肾上腺癌、骨肉瘤、软骨肉瘤、血液组织的癌症等。适用于本公开所涵盖的方法的癌症类型的其他非限制性实例包括人类肉瘤和癌,例如,纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因瘤(Ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、结直肠癌、胰腺癌、乳腺癌、三阴性乳腺癌、卵巢癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝细胞瘤、胆管癌、肝癌、肝细胞癌(HCC)、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯瘤、宫颈癌、骨癌、脑瘤、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、黑素瘤、神经母细胞瘤、视网膜母细胞瘤;白血病,例如,急性淋巴细胞白血病及急性髓细胞性白血病(成髓细胞性、早幼粒细胞性、粒单核细胞性、单核细胞性和红白血病);慢性白血病(慢性髓细胞性(粒细胞性)白血病及慢性淋巴细胞白血病);以及真性红细胞增多症、淋巴瘤(霍奇金病及非霍奇金病)、多发性骨髓瘤、瓦尔登斯特伦巨球蛋白血症和重链病。在一些实施方案中,通过本公开的方法确定其表型的癌症是上皮癌,例如但不限于膀胱癌、乳腺癌、宫颈癌、结肠癌、妇科癌症、肾癌、喉癌、肺癌、口腔癌、头颈癌、卵巢癌、胰腺癌、前列腺癌或皮肤癌。在其他实施方案中,该癌症是乳腺癌、前列腺癌、肺癌或结肠癌。在另外其他的实施方案中,该上皮癌是非小细胞肺癌、非乳头状肾细胞癌、宫颈癌、卵巢癌(例如,浆液性卵巢癌)或乳腺癌。上皮癌可以用各种其他方式表征,包括但不限于浆液性、子宫内膜样、粘液性、透明细胞、布伦纳型(brenner)或未分化的。在一些实施方案中,本公开用于淋巴瘤或其亚型(包括但不限于套细胞淋巴瘤)的治疗、诊断和/或预后。
在某些实施方案中,本文提供的抗PD1-TGFβRII融合蛋白是可用于治疗对标准疗法(包括但不限于化疗、化学疗法和当前的临床试验疗法)有大约0、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的平均反应率的癌症的疗法的实例。在某些实施方案中,本文提供的抗PD1-ADA2融合蛋白是可用于治疗对标准疗法(包括但不限于化疗、化学疗法和当前的临床试验疗法)有大约0、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的平均反应率的癌症的疗法的实例。此类癌症包括但不限于霍奇金淋巴瘤、黑素瘤、非小细胞肺癌(NSCLC)、微卫星不稳定性(MSI)高或错配修复(MMR)缺陷的实体瘤、CSCC、RCC、CRC、黑素瘤、Merkel细胞癌、膀胱癌、RCC、肝细胞癌(HCC)、头颈癌(H&N)、宫颈癌、胃癌、小细胞肺癌(SCLC)、子宫内膜癌、间皮瘤、卵巢癌、三阴性乳腺癌(TNBC)、乳腺癌、结直肠癌(CRC)、胰腺癌、前列腺癌。
联合疗法
在一些实施方案中,融合蛋白与附加治疗剂一起作为联合疗法施用。在一些实施方案中,附加治疗剂包含生物分子,如抗体。例如,治疗可涉及将融合蛋白与针对肿瘤相关抗原的抗体(包括但不限于结合EGFR、HER2/ErbB2和/或VEGF的抗体)联合施用。在某些实施方案中,附加治疗剂是对癌症干细胞标志物具有特异性的抗体。在某些实施方案中,附加治疗剂是作为血管生成抑制剂的抗体(例如,抗VEGF或VEGF受体抗体)。在某些实施方案中,附加治疗剂是贝伐珠单抗(AVASTIN)、雷莫芦单抗(ramucirumab)、曲妥珠单抗(HERCEPTIN)、帕妥珠单抗(OMNITARG)、帕尼单抗(VECTIBIX)、尼妥珠单抗(nimotuzumab)、扎鲁木单抗(zalutumumab)或西妥昔单抗(ERBITUX)。在一些实施方案中,附加治疗剂包含诸如小分子的药剂。例如,治疗可涉及将本文提供的融合蛋白或其片段或变体与充当针对肿瘤相关抗原(包括但不限于EGFR、HER2(ErbB2)和/或VEGF)的抑制剂的小分子联合施用。在一些实施方案中,该融合蛋白或其片段或变体与选自下组的蛋白激酶抑制剂联合施用:吉非替尼(IRESSA)、厄洛替尼(TARCEVA)、舒尼替尼(SUTENT)、拉帕替尼(lapatanib)、凡德他尼(ZACTIMA)、AEE788、CI-1033、西地尼布(RECENTIN)、索拉菲尼(NEXAVAR)和帕唑帕尼(GW786034B)。在一些实施方案中,附加治疗剂包含mTOR抑制剂。在另一个实施方案中,附加治疗剂是减少T
在一些实施方案中,所述方法可以进一步包括一种或多种检查点抑制剂联合本文所述的融合蛋白或其片段或变体。在一些实施方案中,附加检查点抑制剂可以是抗CTLA-4抗体。抗CTLA-4抗体(例如伊匹木单抗)在晚期黑素瘤参与者中显示出持久的抗肿瘤活性并延长了生存期,因此在2011年获得了美国食品药品监督管理局(FDA)的批准。参见Hodi等人,Improved survival with ipilimumab in patients with metastatic melanoma.NEngl J Med.(2010)8月19日;363(8):711-23。在一些实施方案中,所述一种或多种检查点抑制剂可以是抗PD-L1抗体。在一些实施方案中,该抗PD-L1抗体可以是全长阿特珠单抗(抗PD-L1)、avelumab(抗PD-L1)、durvalumab(抗PD-L1)或其片段或变体。在一些实施方案中,所述一种或多种检查点抑制剂可以是CD27抑制剂、CD28抑制剂、CD40抑制剂、CD122抑制剂、CD137抑制剂、OX40(也称为CD134)抑制剂、GITR抑制剂、ICOS抑制剂中的任何一种或多种,或其任意组合。在一些实施方案中,所述一种或多种检查点抑制剂可以是A2AR抑制剂、B7-H3(也称为CD276)抑制剂、B7-H4(也称为VTCN1)抑制剂、BTLA抑制剂、IDO抑制剂、KIR抑制剂、LAG3抑制剂、TIM-3抑制剂、VISTA抑制剂中的任何一种或多种,或其任意组合。
在某些实施方案中,附加治疗剂包含第二免疫治疗剂。在一些实施方案中,附加免疫治疗剂包括但不限于集落刺激因子、白介素、阻断免疫抑制功能的抗体(例如,抗CTLA-4抗体、抗CD28抗体、抗CD3抗体、抗PD-L1抗体、抗TIGIT抗体)、增强免疫细胞功能的抗体(例如,抗GITR抗体、抗OX-40抗体、抗CD40抗体或抗4-1BB抗体)、toll样受体(例如,TLR4、TLR7、TLR9)、可溶性配体(例如,GITRL、GITRL-Fc、OX-40L、OX-40L-Fc、CD40L、CD40L-Fc、4-1BB配体或4-1BB配体-Fc)或B7家族成员(例如,CD80、CD86)。在一些实施方案中,附加免疫治疗剂靶向CTLA-4、CD28、CD3、PD-L1、TIGIT、GITR、OX-40、CD-40或4-1BB。
在一些实施方案中,附加治疗剂是附加免疫检查点抑制剂。在一些实施方案中,该附加免疫检查点抑制剂是抗PD-L1抗体、抗CTLA-4抗体、抗CD28抗体、抗TIGIT抗体、抗LAG3抗体、抗TIM3抗体、抗GITR抗体、抗4-1BB抗体或抗OX-40抗体。在一些实施方案中,附加治疗剂是抗TIGIT抗体。在一些实施方案中,附加治疗剂是选自BMS935559(MDX-1105)、阿特利珠单抗(atexolizumab)(MPDL3280A)、德瓦鲁单抗(MEDI4736)和阿维鲁单抗(MSB0010718C)的抗PD-L1抗体。在一些实施方案中,附加治疗剂是选自伊匹木单抗(YERVOY)和曲美木单抗的抗CTLA-4抗体。在一些实施方案中,附加治疗剂是选自BMS-986016和LAG525的抗LAG-3抗体。在一些实施方案中,附加治疗剂是选自MEDI6469、MEDI0562和MOXR0916的抗OX-40抗体。在一些实施方案中,附加治疗剂是选自PF-05082566的抗4-1BB抗体。在一些实施方案中,该融合蛋白或其片段或变体可与选自下组的生物分子联合施用:细胞因子、肾上腺髓质素(AM)、血管生成素(Ang)、BMP、BDNF、EGF、促红细胞生成素(EPO)、FGF、GDNF、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、巨噬细胞集落刺激因子(M-CSF)、干细胞因子(SCF)、GDF9、HGF、HDGF、IGF、迁移刺激因子、肌肉生长抑制素(GDF-8)、NGF、神经营养蛋白、PDGF、促血小板生成素、TGF-α、TGF-β、TNF-α、VEGF、PlGF、γ-IFN、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-12、IL-15和IL-18。
细胞因子
在一些情况下,该细胞因子包括至少一种趋化因子、干扰素、白介素、淋巴因子、肿瘤坏死因子或其变体或组合。在一些情况下,该细胞因子是白介素。在一些情况下,该白介素是IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-14、IL-15、IL-16、IL-17、IL-18、IL-19、IL-20、IL-21、IL-22、IL-23、IL-24、IL-25、IL-26、IL-27、IL-28、IL-29、IL-30、IL-31、IL-32、IL-33及其功能变体和片段中的至少一种。在一些实施方案中,该细胞因子可以是膜结合的或分泌的。在实施方案中,该细胞因子是可溶性IL-15、可溶性IL-15/IL-15Rα复合物(例如,ALT-803)。在某些情况下,该白介素可包含膜结合的IL-15(mbIL-15)或IL-15与IL-15Rα的融合体。在一些实施方案中,mbIL-15是膜结合的嵌合IL-15,其可以与本文所述的经修饰的免疫效应细胞共表达。在一些实施方案中,该mbIL-15包含与全长IL-15Rα、其片段或变体符合读框地融合的全长IL-15(例如,天然IL-15多肽)或其片段或变体。在一些情况下,该IL-15通过连接体与IL-15Rα间接连接。在一些情况下,该mbIL-15如Hurton等人,“Tethered IL-15 augments antitumor activity andpromotes a stem-cell memory subset in tumor-specific T cells,”PNAS 2016所述。在一些情况下,该细胞因子与CAR在相同的免疫效应细胞中表达。
在一些实施方案中,mbIL-15与细胞标签如本文所述的HER1t、HER-1t-1、CD20t-1或CD20一起表达。mbIL-15可以与HER1t、HER-1t-1、CD20t-1或CD20符合读框地表达。
在一些实施方案中,mbIL-15可以在用于基因转录的诱导型启动子的控制下。在一个方面,诱导型启动子可以是基因开关配体诱导型启动子。在一些情况下,诱导型启动子可以是小分子配体诱导型基于双多肽蜕皮素受体的基因开关,如
在另一方面,白介素可包括IL-12。在一些实施方案中,该IL-12是单链IL-12(scIL-12)、蛋白酶敏感的IL-12、去稳定的IL-12、膜结合的IL-12、嵌入型IL-12。在一些情况下,IL-12变体如WO2015/095249、WO2016/048903、WO2017/062953中描述,其全部通过引用并入本文。在一些实施方案中,以上描述的细胞因子可以在用于基因转录的诱导型启动子的控制下。在一个方面,诱导型启动子可以是基因开关配体诱导型启动子。在一些情况下,诱导型启动子可以是小分子配体诱导型基于双多肽蜕皮素受体的基因开关,如
在一些实施方案中,如本文所述的融合蛋白可以在用于基因转录的诱导型启动子的控制下。在一个方面,诱导型启动子可以是基因开关配体诱导型启动子。在一些情况下,诱导型启动子可以是小分子配体诱导型基于双多肽蜕皮素受体的基因开关,如
基因开关
本文提供了基因开关多肽,编码配体诱导型基因开关多肽的多核苷酸,以及包含这些多肽和/或多核苷酸的方法和系统。术语“基因开关”是指与启动子关联的应答元件例如与基于蜕皮素受体(EcR)的系统的组合,其在一种或多种配体的存在下,调节并入了应答元件和启动子的基因的表达。紧密调节的诱导型基因表达系统或基因开关可用于各种应用,如基因疗法、细胞中的大规模蛋白质生产、基于细胞的高通量筛选试验、功能基因组学以及转基因植物和动物中性状的调节。这类诱导型基因表达系统可包括配体诱导型异源基因表达系统。
早期形式的基于EcR的基因开关使用黑腹果蝇(Drosophila melanogaster)EcR(DmEcR)和小鼠(Mus musculus)RXR(MmRXR)多肽,并且显示这些受体在类固醇、百日青蜕皮酮A的存在下在哺乳动物细胞系和转基因小鼠中反式激活报道基因(Christopherson等人,1992;No等人,1996)。后来,Suhr等人,1998表明非甾类蜕皮素激动剂虫酰肼在不存在外源异二聚体配偶体的情况下通过家蚕(Bombyx mori)EcR(BmEcR)在哺乳动物细胞中诱导报道基因的高水平反式激活。
国际专利申请PCT/US97/05330(WO 97/38117)和PCT/US99/08381(WO99/58155)公开了调节外源基因表达的方法,其中包含外源基因和蜕皮素应答元件的DNA构建体被包含蜕皮素受体的第二DNA构建体激活,该蜕皮素受体在其配体的存在下,任选地在能够充当沉默配偶体的受体的存在下,与蜕皮素应答元件结合以诱导基因表达。在该实例中,蜕皮素受体是从黑腹果蝇中分离的。通常,此类系统需要存在沉默配偶体,优选类视黄醇X受体(RXR),以提供最佳激活。在哺乳动物细胞中,昆虫蜕皮素受体(EcR)能够与哺乳动物类视黄醇X受体(RXR)异二聚化,从而用于以配体依赖性方式调节靶基因或异源基因的表达。国际专利申请PCT/US98/14215(WO 99/02683)披露,从蚕蛾家蚕中分离的蜕皮素受体在哺乳动物系统中是功能性的,不需要外源二聚体配偶体。
美国专利6,265,173披露,类固醇/甲状腺超家族受体的各个成员可以与黑腹果蝇超螺旋受体(USP)或其至少包含USP二聚化结构域的片段相组合,以用于基因表达系统。美国专利5,880,333公开了在植物中使用的黑腹果蝇EcR和超螺旋(USP)异二聚体系统,其中反式激活域和DNA结合域位于两个不同的杂合蛋白上。在这些情况中的每一种中,反式激活域和DNA结合域(如国际专利申请PCT/US98/14215中的天然EcR或国际专利申请PCT/US97/05330中的修饰的EcR)并入单个分子中,并且其他异二聚体配偶体(USP或RXR)以其天然状态使用。
国际专利申请PCT/US01/0905公开了基于蜕皮素受体的诱导型基因表达系统,其中反式激活域和DNA结合域通过将它们置于两个不同的蛋白质上而彼此分离,导致在不存在配体的情况下背景活性大大降低,而在配体的存在下,活性比背景显著增加。与申请PCT/US97/05330和PCT/US98/14215中公开的两种系统相比,这种双杂交系统是显著改进的诱导型基因表达调节系统。据认为,这种双杂交系统利用了一对相互作用蛋白质的以下能力:它们使转录激活域相对于DNA结合域处于更有利的位置,使得当DNA结合域与基因上的DNA结合位点结合时,反式激活域更有效地激活启动子(参见,例如,美国专利5,283,173)。这种双杂交基因表达系统包含两个基因表达盒;第一个编码与核受体多肽融合的DNA结合域,第二个编码与不同的核受体多肽融合的反式激活域。在配体的存在下,认为诱导了构象变化,这促进抗体与TGF-β细胞因子阱的相互作用,从而导致DNA结合域与反式激活域的二聚化。由于DNA结合域和反式激活域位于两个不同的分子上,因此在不存在配体的情况下,背景活性大大降低。
与甾类配体(例如,百日青蜕皮酮A(“PonA”)或幕黎甾酮A(“MurA”)相比,所述双杂交系统的某些修饰还可以提供对非甾类配体(例如,二酰基肼)的改善的敏感性。也就是说,与类固醇相比,非甾类配体在较低的配体浓度下提供较高的基因转录活性。此外,所述双杂交系统避免了由于当使用未修饰的RXR作为开关配偶体时可能发生的RXR过表达而导致的一些副作用。在优选的双杂交系统中,消除了EcR或RXR的天然DNA结合域和反式激活域,因此,这些杂合分子与细胞中存在的其他类固醇激素受体相互作用的机会较少,从而导致副作用降低。
蜕皮素受体(EcR)是核受体超家族的成员,并且被分类为亚家族1,H组(在本文中称为“H组核受体”)。每组的成员在E(配体结合)结构域中具有40-60%的氨基酸同一性(Laudet等人,A Unified Nomenclature System for the Nuclear Receptor Subfamily,1999;Cell 97:161-163)。除蜕皮素受体外,该核受体亚家族1,H组的其他成员还包括:遍在受体(UR)、孤儿受体1(OR-1)、类固醇激素核受体1(NER-1)、RXR相互作用蛋白-15(RIP-15)、肝x受体β(LXRβ)、类固醇激素受体样蛋白(RLD-1)、肝x受体(LXR)、肝x受体(LXRα)、类法尼醇x受体(FXR)、受体相互作用蛋白质14(RIP-14)和法尼醇受体(HRR-1)。
在一些情况下,诱导型启动子(“IP”)可以是小分子配体诱导型基于双多肽蜕皮素受体的基因开关,如Intrexon Corporation的
如本文所用的,应用于配体激活的基于蜕皮素受体的基因开关的术语“配体”是具有不同溶解度的小分子(如二酰基肼化合物),其具有激活基因开关以刺激基因表达的能力(即,其中提供多核苷酸(例如,mRNA、miRNA等)和/或多肽的配体诱导型表达)。此类配体的实例包括但不限于以下所述:WO 2004/072254(PCT/US2004/003775);WO 2004/005478(PCT/US2003/021149);WO 2005/017126(PCT/US2004/005149);WO 2004/078924(PCT/US2004/005912);WO 2008/153801(PCT/US2008/006757);WO 2009/114201(PCT/US2009/001639);WO 2013/036758(PCT/US2012/054141);WO 2014/144380(PCT/US2014/028768);和WO 2016/044390(PCT/US2015/050375);其中每一个均通过引用整体并入本文。
配体的实例还包括但不限于:蜕皮类固醇,如蜕皮素、20-羟基蜕皮酮、百日青蜕皮酮A、幕黎甾酮A等,9-顺式-视黄酸,视黄酸的合成类似物,N,N’-二酰基肼,如美国专利6,258,603、6,013,836、5,117,057、5,530,028、5,378,726、7,304,161、7,851,220、8,748,125、9,272,986、7,456,315、7,563,928、8,524,948、9,102,648、9,169,210、9,255,273和9,359,289中公开的那些;噁二唑啉,如美国专利8,669,072和8,895,306所述;二苯甲酰基烷基氰基肼,如欧洲申请2,461,809中所公开的那些;N-烷基-N,N’-二芳酰基肼,如美国专利5,225,443中公开的那些;N-酰基-N-烷基羰基肼,如欧洲申请234,994中公开的那些;N-芳酰基-N-烷基-N’-芳酰基肼,如美国专利4,985,461中所述的那些;氨基酮,如美国专利7,375,093、8,129,355和9,802,936中所述的那些;以上每一个均通过引用并入本文,以及其他类似物质,包括3,5-二叔丁基-4-羟基-N-异丁基-苯甲酰胺、8-O-乙酰基哈巴苷、氧化固醇、22(R)羟基胆甾醇、24(S)羟基胆甾醇、25-环氧胆甾醇、T0901317、5-α-6-α-环氧胆甾醇-3-硫酸酯(ECHS)、7-酮基胆甾醇-3-硫酸酯、金合欢醇(framesol)、胆汁酸、1,1-二膦酸酯、保幼激素III等。可用于本发明的二酰基肼配体的实例包括RG-115819(3,5-二甲基-苯甲酸N-(1-乙基-2,2-二甲基-丙基)-N’-(2-甲基-3-甲氧基-苯甲酰基)-酰肼-)、RG-115932((R)-3,5-二甲基-苯甲酸N-(1-叔丁基-丁基)-N’-(2-乙基-3-甲氧基-苯甲酰基)-酰肼)和RG-115830(3,5-二甲基-苯甲酸N-(1-叔丁基-丁基)-N’-(2-乙基-3-甲氧基-苯甲酰基)-酰肼)。参见,例如,WO 2008/153801(PCT/US2008/006757)和WO 2013/036758(PCT/US2012/054141),以上两者均通过引用整体并入本文。
例如,基于蜕皮素受体的基因开关的配体可以选自任何合适的配体。天然存在的蜕皮素或蜕皮素类似物(例如20-羟基蜕皮素、幕黎甾酮A、百日青蜕皮酮A、百日青蜕皮酮B、百日青蜕皮酮C、26-碘代百日青蜕皮酮A、牛膝蜕皮酮或26-甲磺酰基牛膝蜕皮酮)和非类固醇诱导剂可以用作本发明的基因开关的配体。美国专利6,379,945号描述了一种分离自烟芽夜蛾(Heliothis virescens)的昆虫类固醇受体(“HEcR”),其能够充当对类固醇和某些非甾类诱导剂都有反应性的基因开关。在该系统和其他许多对类固醇和非类固醇诱导剂都有反应性的系统中,非甾类诱导剂相对于类固醇具有明显的优势,其原因有几个,包括,例如:较低的生产成本,代谢稳定性,不存在于昆虫、植物或哺乳动物中,以及环境可接受性。美国专利6,379,945描述了两种二苯甲酰基肼——1,2-二苯甲酰基-1-叔丁基肼和虫酰肼(N-(4-乙基苯甲酰基)-N'-(3,5-二甲基苯甲酰基)-N'-叔丁基肼)作为基于蜕皮素的基因开关的配体的应用。本发明中还包括其他二苯甲酰基肼作为配体,如美国专利5,117,057中公开的那些。在美国专利6,147,282中也公开了虫酰肼作为来自黑腹果蝇(Drosophilamelanogaster)的蜕皮素受体的化学配体的用途。蜕皮素配体的其他非限制性实例是3,5-二叔丁基-4-羟基-N-异丁基-苯甲酰胺、8-O-乙酰基哈巴苷、1,2-二酰基肼、N'-取代的-N,N′-二取代的肼、二苯甲酰基烷基氰肼、N-取代的-N-烷基-N,N-二芳酰基肼、N-取代的-N-酰基-N-烷基、羰基肼或N-芳酰基-N'-烷基N'-芳酰基肼。(参见美国专利6,723,531)。
在一个实施方案中,基于蜕皮素的基因开关系统的配体是二酰基肼配体或手性二酰基肼配体。基因开关系统中使用的配体可以是式I化合物
其中A为烷氧基、芳基烷氧基或芳氧基;B为任选取代的芳基或任选取代的杂芳基;且R1和R2独立地为任选取代的烷基、芳基烷基、羟基烷基、卤代烷基、任选取代的环烷基、任选取代的烯基、任选取代的炔基、任选取代的杂环、任选取代的芳基或任选取代的杂芳基;或其药学上可接受的盐、水合物、结晶形式或无定形形式。
在另一个实施方案中,所述配体可以是对映体富集的式II化合物
其中A为烷氧基、芳基烷氧基、芳氧基、芳基烷基、任选取代的芳基或任选取代的杂芳基;B为任选取代的芳基或任选取代的杂芳基;且R1和R2独立地为任选取代的烷基、芳基烷基、羟基烷基、卤代烷基、任选取代的环烷基、任选取代的烯基、任选取代的炔基、任选取代的杂环、任选取代的芳基或任选取代的杂芳基;条件是R1不等于R2;其中在带有R1和R2的不对称碳原子处的绝对构型主要为S;或其药学上可接受的盐、水合物、结晶形式或无定形形式。
在某些实施方案中,所述配体可以是对映体富集的式III化合物
其中A为烷氧基、芳基烷氧基、芳氧基、芳基烷基、任选取代的芳基或任选取代的杂芳基;B为任选取代的芳基或任选取代的杂芳基;且R1和R2独立地为任选取代的烷基、芳基烷基、羟基烷基、卤代烷基、任选取代的环烷基、任选取代的烯基、任选取代的炔基、任选取代的杂环、任选取代的芳基或任选取代的杂芳基;条件是R1不等于R2;其中在带有R1和R2的不对称碳原子处的绝对构型主要为R;或其药学上可接受的盐、水合物、结晶形式或无定形形式。
在一个实施方案中,配体可以是至少95%对映体过量的(R)-3,5-二甲基-苯甲酸N-(1-叔丁基-丁基)-N'-(2-乙基-3-甲氧基-苯甲酰基)-酰肼,或其药学上可接受的盐、水合物、结晶形式或无定形形式。
当与基于蜕皮素的基因开关系统一起使用时,式I的二酰基肼配体和式II或III的手性二酰基肼配体提供了用于外部时间调节本发明的治疗性多肽或治疗性多核苷酸的表达的手段。参见美国专利:8,076,517;8,884,060;和9,598,355;其中每一个都通过引用完全并入本文。
在本发明中使用的配体可以形成盐。如本文所用的术语“盐”表示与无机和/或有机酸和碱形成的酸式和/或碱式盐。另外,当式I、II或III化合物同时包含碱性部分和酸性部分时,两性离子(“内盐”)可以形成,并且包括在本文所用的术语“盐”中。使用药学上可接受的(即无毒的、生理学上可接受的)盐,但是其他盐也是有用的,例如在制备过程中可以使用的分离或纯化步骤中。式I、II或III化合物的盐可以如下形成,例如,使化合物与一定量(例如当量)的酸或碱在介质(诸如盐在其中沉淀的介质)或水性介质中反应,然后冻干。
含有碱性部分的配体可以与多种有机酸和无机酸形成盐。示例性的酸加成盐包括乙酸盐(例如与乙酸或三卤代乙酸如三氟乙酸形成的盐)、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、硼酸盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐(与盐酸形成)、氢溴酸盐(与溴化氢形成)、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐(与马来酸形成)、甲磺酸盐(与甲磺酸形成)、2-萘磺酸盐、烟酸盐、硝酸盐、草酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、水杨酸盐、琥珀酸盐、硫酸盐(例如与硫酸形成的盐)、磺酸盐(如本文提及的那些盐)、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一烷酸盐等。
含有酸性部分的配体可以与多种有机碱和无机碱形成盐。示例性的碱式盐包括铵盐,碱金属盐,如钠、锂和钾盐,碱土金属盐,如钙和镁盐,与有机碱(例如有机胺)如苄星青霉素、二环己基胺、海巴青霉素(由N,N-双(脱氢松香基)乙二胺形成)、N-甲基-D-葡糖胺、N-甲基-D-葡糖酰胺、叔丁胺形成的盐,以及与氨基酸如精氨酸、赖氨酸等形成的盐。
诱导型基因表达系统的配体的非限制性实例还包括利用FK506结合域的那些,是FK506、环孢菌素A或雷帕霉素。FK506、雷帕霉素及其类似物公开于美国专利6,649,595、6,187,757、7,276,498和7,273,874中。
在一些实施方案中,用于诱导型基因表达的二酰基肼配体以约5、10、15、20、25、30、35、40、50、60、70、80、90、100或120mg的单位日剂量施用。在一些实施方案中,二酰基肼配体以约5mg的单位日剂量施用。在一些实施方案中,二酰基肼配体以约10mg的单位日剂量施用。在一些实施方案中,二酰基肼配体以约15mg的单位日剂量施用。在一些实施方案中,二酰基肼配体每天以约20mg的单位日剂量施用。
在一些实施方案中,具有两种或更多种治疗剂的联合疗法可以使用通过不同作用机制起作用的药剂,尽管这不是必需的。使用具有不同作用机制的药剂的联合治疗可引起累加或协同效应。联合治疗可以允许每种药剂的剂量低于单一疗法中所使用的剂量,从而降低毒性副作用和/或增加药剂的治疗指数。联合治疗可以降低耐药性癌细胞发展的可能性。在一些实施方案中,联合治疗包含影响免疫应答(例如,增强或激活该应答)的治疗剂和影响(例如,抑制或杀死)肿瘤/癌细胞的治疗剂。
在某些实施方案中,除了施用本文所述的融合蛋白或其片段或变体外,所述方法或治疗进一步包括施用至少一种附加治疗剂。附加治疗剂可在药剂施用之前、同时和/或之后施用。在一些实施方案中,所述至少一种附加治疗剂包含1、2、3种或更多种附加治疗剂。
可与本文所述的融合蛋白或其片段或变体联合施用的治疗剂包括化疗剂。因此,在一些实施方案中,所述方法或治疗涉及将本文所述的药剂与化疗剂联合或与化疗剂的混合物联合施用。在一些实施方案中,所述方法可以进一步包括一种或多种抗肿瘤剂,如顺铂、卡培他滨或5-氟尿嘧啶,联合本文所述的融合蛋白或其片段或变体。使用药剂的治疗可以在施用化学疗法之前、同时或之后进行。联合施用可包括以单一药物制剂或使用分开的制剂进行共同施用,或以任一顺序连续施用,但通常在一段时间内进行,以使得所有活性剂可同时发挥其生物活性。这类化疗剂的制备和给药方案可根据制造商的说明书使用或由技术人员凭经验确定。这类化学疗法的制备和给药方案也描述于The Chemotherapy SourceBook,第4版,2008,M.C.Perry编,Lippincott,Williams&Wilkins,Philadelphia,PA中。
有用的化疗剂类别包括,例如,抗微管蛋白剂、奥利斯他汀(auristatin)、DNA小沟结合剂、DNA复制抑制剂、烷化剂(例如,铂络合物,例如顺铂、单(铂)、双(铂)和三核铂络合物以及卡铂)、蒽环类、抗生素、抗叶酸剂、抗代谢物、化疗增敏剂、多卡米星(duocarmycin)、依托泊苷、氟化嘧啶、离子载体、来西托辛(lexitropsin)、亚硝基脲、普拉汀诺(platinol)、嘌呤抗代谢物、嘌呤霉素(puromycin)、辐射增敏剂、类固醇、紫杉烷、拓扑异构酶抑制剂、长春花生物碱(vinca alkaloid)等。在某些实施方案中,第二治疗剂是烷化剂、抗代谢物、抗有丝分裂剂、拓扑异构酶抑制剂或血管生成抑制剂。
本文提供的融合蛋白或其片段或变体可单独使用或与常规治疗方案如手术、放射、化学疗法和/或骨髓移植(自体、同基因、同种异体或无关)联合使用。例如,一组肿瘤抗原可用于例如大部分癌症患者中。
与嵌合受体联合的融合蛋白
在一些实施方案中,所述融合蛋白与附加治疗剂一起作为联合疗法施用。在一些实施方案中,附加治疗剂包含嵌合受体,如嵌合抗原受体或工程化T细胞受体。例如,治疗可包括同时施用融合蛋白和嵌合受体。在一个实施方案中,治疗可包括共同施用融合蛋白与包含嵌合受体的修饰的效应细胞。在一个实施方案中,治疗可包括顺序施用包含嵌合受体的修饰的效应细胞,随后施用融合蛋白。在另一个实施方案中,治疗可包括顺序施用融合蛋白,随后施用包含嵌合受体的修饰的效应细胞。在一方面,在施用之间可以有至少0.5、1、2、3、4、5、6、8、10、12、15、18、20或24小时的滞后。在另一方面,在施用之间可以有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、75、90天或更多天。
在一些实施方案中,经修饰的免疫效应细胞是包含T细胞和/或自然杀伤细胞的经修饰的免疫细胞。T细胞或T淋巴细胞是参与细胞介导的免疫的白细胞亚型。示例性T细胞包括T辅助细胞、细胞毒性T细胞、TH17细胞、记忆性干细胞样T细胞(TSCM)、幼稚T细胞、记忆T细胞、效应T细胞、调节性T细胞或自然杀伤T细胞。在某些方面,本文所述的实施方案包括制备和/或扩充经修饰的免疫效应细胞(例如,T细胞、Treg、NK细胞或NK T细胞),其包括用含有编码嵌合受体的DNA(或RNA)构建体的表达载体转染细胞。
在一些实施方案中,本文所述包括经修饰的效应细胞,其包含在细胞表面上表达的嵌合受体。在一些情况下,嵌合受体包含能够识别并结合肿瘤抗原(例如肿瘤相关抗原或肿瘤特异性抗原)的抗原结合区。在一些情况下,抗原结合区包含抗体或结合片段,例如Fab、Fab’、F(ab’)
本文进一步提供了一种免疫效应细胞,其包含用作杀伤开关、选择标记、生物标志物或其组合的细胞标签。在一些实施方案中,该细胞标签包含HER1t、HER1t-1、CD20t-1或CD20。在一些情况下,该细胞标签包含HER1t,并且所述HER1t包含SEQ ID NO:68的多肽序列。在一些情况下,该细胞标签包含HER1t-1,并且所述HER1t-1包含SEQ ID NO:69的多肽序列。
嵌合抗原受体(CAR)
嵌合抗原受体(CAR)是将外源特异性移植到免疫效应细胞上的工程化受体。在一些情况下,CAR包含细胞外结构域(胞外域)和细胞内结构域(胞内域),该胞外域包含抗原结合域、茎区、跨膜域。在一些情况下,胞内域进一步包含一个或多个细胞内信号传导域。在一些情况下,本文所述的CAR包含抗原结合域、茎区、跨膜域、一个或多个共刺激域和用于T细胞活化的信号传导域。
抗原结合域可包含单克隆抗体的互补决定区、单克隆抗体的可变区和/或其抗原结合片段。互补决定区(CDR)是在抗原受体(例如,免疫球蛋白和T细胞受体)蛋白的可变域中发现的短氨基酸序列,该短氨基酸序列与该抗原互补,因此为受体提供针对该特定抗原的特异性。抗原受体的每条多肽链可含有三个CDR(CDR1、CDR2和CDR3)。在一些情况下,抗原结合域包含F(ab’)
在一些实施方案中,本文描述的CAR包含能与CD19、BCMA、CD44、α-叶酸受体、CAIX、CD30、ROR1、CEA、EGP-2、EGP-40、HER2、HER3、叶酸结合蛋白、GD2、GD3、IL-13R-a2、KDR、EDB-F、间皮素、CD22、EGFR、叶酸受体α、诸如MUC-1、MUC-4或MUC-16等粘蛋白、MAGE-A1、h5T4、PSMA、TAG-72、EGFR、CD20、EGFRvIII、CD123或VEGF-R2上的表位结合的抗原结合域。在一个实施方案中,本文描述的CAR包含能与MUC16上的表位结合的抗原结合域。在一些实施方案中,本文描述的CAR包含能与CD19或CD33上的表位结合的抗原结合域。在一些情况下,本文描述的CAR包含能与CD19上的表位结合的抗原结合域。在一些情况下,本文描述的CAR包含能与CD33上的表位结合的抗原结合域。在进一步的实施方案中,本文描述的CAR包含自身抗原或能与HLA-A2、髓鞘少突胶质细胞糖蛋白(MOG)、因子VIII(FVIII)、MAdCAM1、SDF1或II型胶原蛋白上的表位结合的抗原结合区。
在一些实施方案中,本文描述的CAR和方法可用于治疗过度增殖性疾病如癌症、自身免疫性疾病,或用于治疗感染,如病毒、细菌或寄生虫感染。在一些方面,CAR靶向在癌细胞、自身免疫细胞或被病毒、细菌或寄生虫感染的细胞中升高的抗原。可以被靶向的病原体包括但不限于疟原虫、锥虫、曲霉属(Aspergillus)、假丝酵母属(Candida)、甲型肝炎、乙型肝炎、丙型肝炎、HSV、HPV、RSV、EBV、CMV、JC病毒、BK病毒或埃博拉病原体。自身免疫性疾病可包括移植物抗宿主病、类风湿性关节炎、狼疮、乳糜泻、克罗恩病、舍格伦综合征、风湿性多肌痛、多发性硬化、视神经脊髓炎、强直性脊柱炎、1型糖尿病、斑秃、血管炎、颞动脉炎、大疱性类天疱疮、银屑病、寻常型天疱疮或自身免疫性葡萄膜炎。
被CAR识别的病原体可以基本上是任何种类的病原体,但在一些实施方案中,病原体是真菌、细菌或病毒。示例性病毒病原体包括以下科的病毒病原体:腺病毒科、EB病毒(EBV)、巨细胞病毒(CMV)、呼吸道合胞病毒(RSV)、JC病毒、BK病毒、HPV病毒科、HSV病毒科、HHV病毒科、肝炎病毒科、小核糖核酸病毒科、疱疹病毒科、肝脱氧核糖核酸病毒科、黄病毒科、逆转录病毒科、正粘病毒科、副粘病毒科、乳头多瘤空泡病毒科、多瘤病毒、弹状病毒科和披膜病毒科。示例性的致病病毒引起天花、流感、流行性腮腺炎、麻疹、水痘、埃博拉和风疹。示例性的致病真菌包括假丝酵母属、曲霉属、隐球酵母属、组织胞浆菌属、肺囊虫属和葡萄穗霉属。示例性的致病细菌包括链球菌属、假单胞菌属、志贺菌属、弯曲杆菌属、葡萄球菌属、螺杆菌属、大肠杆菌、立克次体属、芽孢杆菌属、博德特氏菌属、衣原体属、螺旋体属和沙门菌属。在一些实施方案中,病原体受体Dectin-1可用于生成识别真菌如曲霉的细胞壁上的碳水化合物结构的CAR。在另一实施方案中,CAR可以基于识别病毒决定簇(例如来自CMV和埃博拉的糖蛋白)的抗体来制备,以中断病毒感染和病理学。
在一些实施方案中,使用“茎区”或“间隔体”或“铰链”区将抗原结合域与跨膜域连接。在一些情况下,“茎结构域”或“茎区”包括任何寡核苷酸或多肽,其起到将跨膜域连接到胞外域或多肽链中的胞质域的作用。在一些实施方案中,其足够灵活以允许抗原结合域在不同方向上定向,从而促进抗原识别。在一些情况下,茎区包含来自IgG1的铰链区。在备选的情况下,茎区包含免疫球蛋白的CH2CH3区和可选的CD3的部分。在一些情况下,茎区包含CD8α铰链区、IgG4-Fc 12氨基酸铰链区(ESKYGPPCPPCP)或IgG4铰链区,如WO/2016/073755所述。
跨膜域可以来自天然或合成来源。在来源是天然的情况下,该结构域可以衍生自任何膜结合蛋白或跨膜蛋白。合适的跨膜域可包括T细胞受体的α、β或ζ链的跨膜区;或来自CD28、CD3ε、CD3ζ、CD45、CD4、CD5、CD8α、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137或CD154的跨膜区。或者,跨膜域可以是合成的,并且可以包含疏水性残基,如亮氨酸和缬氨酸。在一些实施方案中,在合成跨膜域的一个或两个末端发现苯丙氨酸、色氨酸和缬氨酸的三联体。任选地,在一些实施方案中长度为2至10个氨基酸的短寡核苷酸或多肽连接体可以在CAR的跨膜域与细胞质信号传导域之间形成连接。在一些实施方案中,连接体是甘氨酸-丝氨酸连接体。
在一些实施方案中,跨膜域包含CD8α跨膜域或CD3ζ跨膜域。在一些实施方案中,跨膜域包含CD8α跨膜域。在其他实施方案中,跨膜域包含CD3ζ跨膜域。
胞内域可包含一个或多个共刺激域。示例性共刺激域包括但不限于CD8、CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合。在一些情况下,本文所述的CAR包含选自CD8、CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的共刺激域中的一种或多种或两种或更多种。在一些情况下,本文所述的CAR包含选自CD27、CD28、4-1BB(CD137)、ICOS、OX40(CD134)或其片段或组合的共刺激域中的一种或多种或两种或更多种。在一些情况下,本文所述的CAR包含选自CD8、CD28、4-1BB(CD137)或其片段或组合的共刺激域中的一种或多种或两种或更多种。在一些情况下,本文所述的CAR包含选自CD28、4-1BB(CD137)或其片段或组合的共刺激域中的一种或多种或两种或更多种。在一些情况下,本文所述的CAR包含共刺激域CD28和4-1BB(CD137)或其各自的片段。在一些情况下,本文所述的CAR包含共刺激域CD28和OX40(CD134)或其各自的片段。在一些情况下,本文所述的CAR包含共刺激域CD8和CD28或其各自的片段。在一些情况下,本文所述的CAR包含共刺激域CD28或其片段。在一些情况下,本文所述的CAR包含共刺激域4-1BB(CD137)或其片段。在一些情况下,本文所述的CAR包含共刺激域OX40(CD134)或其片段。在一些情况下,本文所述的CAR包含共刺激域CD8或其片段。
在一些实施方案中,胞内域进一步包含用于T细胞活化的信号传导域。在一些情况下,用于T细胞活化的信号传导域包含来源于TCRζ、FcRγ、FcRβ、CD3γ、CD3δ、CD3ε、CD5、CD22、CD79a、CD79b或CD66d的结构域。在一些情况下,用于T细胞活化的信号传导域包含来源于CD3ζ的结构域。
在一些实施方案中,将本文所述的CAR与一种或多种另外的治疗剂一起施用于受试者,所述另外的治疗剂包括但不限于本文所述的细胞因子。在进一步的实施方案中,表达本文所述的CAR的免疫效应细胞表达膜结合的IL-15(“mIL-15或mbIL-15”)。在本发明的方面,该mbIL-15包含IL-15与IL-15Rα之间的融合蛋白。在进一步的实施方案中,该mbIL-15包含与SEQ ID NO:69的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在某些情况下,CAR和细胞因子在单独的载体中表达。在特定情况下,所述载体可以是慢病毒载体、逆转录病毒载体或Sleeping Beauty转座子。
CD19特异性CAR
CD19是免疫球蛋白超家族的细胞表面糖蛋白,并且主要发现于恶性B谱系细胞中。在一些情况下,还已经在诸如胰腺癌、肝癌和前列腺癌的实体瘤中检测到CD19。
在一些实施方案中,本文所述包括CD19特异性CAR,其中抗原结合域包含F(ab’)
在一些实施方案中,抗原结合域识别CD19上的表位,该表位也被JCAR014、JCAR015、JCAR017或19-28z CAR(Juno Therapeutics)识别。在一些实施方案中,本文所述包括CD19特异性CAR-T细胞,其中抗原结合域识别CD19上的表位,该表位也被JCAR014、JCAR015、JCAR017或19-28z CAR(Juno Therapeutics)识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述包括包含scFv抗原结合域的CD19特异性CAR-T细胞,并且抗原结合域识别CD19上的表位,该表位也被JCAR014、JCAR015、JCAR017或19-28z CAR(Juno Therapeutics)识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述的CD19特异性CAR-T细胞包含US20160152723中描述的抗CD19抗体。在一些实施方案中,本文所述的CD19特异性CAR-T细胞包含WO2015/123642中描述的抗CD19抗体。在一些实施方案中,本文所述的CD19特异性CAR-T细胞包含衍生自克隆FMC63的抗CD19 scFv(Nicholson等人.Construction and characterisation of afunctional CD19 specific single chain Fv fragment for immunotherapy of Blineage leukaemia and lymphoma.Mol.Immunol.,34:1157-1165,1997)。
在一些实施方案中,抗原结合域识别CD19上的表位,该表位也被KTE-C19(KitePharma,Inc.)识别。在一些实施方案中,本文所述包括CD19特异性CAR-T细胞,其中抗原结合域识别CD19上的表位,该表位也被KTE-C19识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述包括包含scFv抗原结合域的CD19特异性CAR-T细胞,并且抗原结合域识别CD19上的表位,该表位也被KTE-C19识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述的CD19特异性CAR-T细胞包含WO2015187528中描述的抗CD19抗体或其片段或衍生物。
在一些实施方案中,抗原结合域识别CD19上的表位,该表位也被CTL019(Novartis)识别。在一些实施方案中,本文所述包括CD19特异性CAR-T细胞,其中抗原结合域识别CD19上的表位,该表位也被CTL019识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述包括包含scFv抗原结合域的CD19特异性CAR-T细胞,并且抗原结合域识别CD19上的表位,该表位也被CTL019识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,抗原结合域识别CD19上的表位,该表位也被UCART19(Cellectis)识别。在一些实施方案中,本文所述包括CD19特异性CAR-T细胞,其中抗原结合域识别CD19上的表位,该表位也被UCART19识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述包括包含scFv抗原结合域的CD19特异性CAR-T细胞,并且抗原结合域识别CD19上的表位,该表位也被UCART19识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,抗原结合域识别CD19上的表位,该表位也被BPX-401(Bellicum)识别。在一些实施方案中,本文所述包括CD19特异性CAR-T细胞,其中抗原结合域识别CD19上的表位,该表位也被BPX-401识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述包括包含scFv抗原结合域的CD19特异性CAR-T细胞,并且抗原结合域识别CD19上的表位,该表位也被BPX-401识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些情况下,抗原结合域识别CD19上的表位,该表位也被兰妥莫单抗(Amgen)、克托西单抗(coltuximabravtansine)(ImmunoGen Inc./Sanofi-aventis)、MOR208(Morphosys AG/Xencor Inc.)、MEDI-551(Medimmune)、地宁图珠单抗(denintuzumabmafodotin)(Seattle Genetics)、B4(或DI-B4)(Merck Serono)、泰普利莫单抗(taplitumomabpaptox)(National Cancer Institute)、XmAb 5871(Amgen/Xencor,Inc.)、MDX-1342(Medarex)或AFM11(Affimed)识别。在一些情况下,CD19特异性CAR进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
在一些实施方案中,本文所述包括CD19特异性CAR-T细胞,其中抗原结合域包含F(ab’)
在一些情况下,本文所述的CD19特异性CAR-T细胞包含scFv抗原结合域,并且抗原结合域识别CD19上的表位,该表位也被FMC63、兰妥莫单抗(Amgen)、克托西单抗(ImmunoGenInc./Sanofi-aventis)、MOR208(Morphosys AG/Xencor Inc.)、MEDI-551(Medimmune)、地宁图珠单抗(Seattle Genetics)、B4(或DI-B4)(Merck Serono)、泰普利莫单抗(NationalCancer Institute)、XmAb 5871(Amgen/Xencor,Inc.)、MDX-1342(Medarex)或AFM11(Affimed)识别。在一些情况下,CD19特异性CAR-T细胞进一步包含选自CD8α跨膜域或CD3ζ跨膜域的跨膜域;选自CD27、CD28、4-1BB(CD137)、ICOS、DAP10、DAP12、OX40(CD134)或其片段或组合的一个或多个共刺激域;以及来自CD3ζ的信号传导域。
CD33特异性CAR
“CD33”是67kDa单次跨膜糖蛋白,并且是唾液酸结合免疫球蛋白样凝集素(Siglecs)超家族的成员。CD33的特征在于负责唾液酸结合的V-组Ig样结构域和其胞外域中的C2-组Ig样结构域。CD33 mRNA的可变剪接导致缺乏V-组Ig样结构域以及连接V-组和C2-组Ig样结构域的二硫键的较短同种型(CD33m)。在健康受试者中,CD33主要被表达为在正常多能骨髓前体、单能集落形成细胞、单核细胞和成熟粒细胞上发现的髓样分化抗原。CD33在超过80%的髓样白血病细胞上表达,但在正常的造血干细胞或成熟粒细胞上不表达。(Andrews,R.等人,The L4F3 antigen is expressed by unipotent and multipotentcolony-forming cells but not by their precursors,Blood,68(5):1030-5(1986))。已报道CD33在恶性骨髓细胞、活化T细胞和活化NK细胞上表达,并且在绝大多数AML患者的至少一部分母细胞上发现(Pollard,J.等人,Correlation of CD33 expression level withdisease characteristics and response to gemtuzumab ozogamicin containingchemotherapy in childhood AML,Blood,119(16):3705-11(2012))。除了在AML母细胞上的广泛表达之外,CD33还可以在导致AML的干细胞上表达。
在实施方案中,本文描述的CAR的抗原结合部分对CD33是特异性的(CD33 CAR)。当在细胞表面上表达时,CD33特异性CAR将T细胞的特异性重定向至人CD33。在实施方案中,抗原结合域包含单链抗体片段(scFv),后者包含通过柔性连接体如甘氨酸-丝氨酸连接体或Whitlow连接体连接的靶抗原特异性单克隆抗CD33抗体的轻链可变域(VL)和重链可变域(VH)。在实施方案中,该scFv是M195、m2H12、DRB2和/或My9-6。在实施方案中,该scFv是人源化的,例如hM195。在一些实施方案中,抗原结合部分可包含定向连接的VH和VL,例如,从N末端到C末端、VH-连接体-VL或VL-连接体-VH。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:35氨基酸序列(hM195 VL)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:36氨基酸序列(hM195 VH)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:37氨基酸序列(M2H12 VH)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:38氨基酸序列(M2H12 VL)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:39氨基酸序列(DRB2 VH)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:40氨基酸序列(DRB2 VL)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:41氨基酸序列(My9-6 VH)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:42氨基酸序列(My9-6 VL)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
MUC16特异性CAR
MUC16是一种大的碳水化合物抗原,也称为CA-125。MUC16由位于人类19号染色体上的MUC16基因编码。MUC16是包含3个结构域的高度糖基化的多结构域I型跨膜蛋白。C末端结构域包含多个具有自蛋白水解活性的细胞外SEA(海胆精子蛋白、肠激酶和聚集蛋白)模块。SEA在跨膜(TM)域的附近有两个蛋白水解位点。被称为CA-125的切割的大结构域在酸性pH下释放到循环中。CA-125通常用作卵巢癌的疾病生物标志物。高度保守的截短的细胞外膜束缚的蛋白质结构域被称为MUCl6ecto结构域。鉴定出一种MUC16抗体,其特异性结合保留在肿瘤细胞表面上的MUC16的胞外域。目的细胞(如癌细胞)的“MUC16过表达”是指与对照细胞(如非癌细胞、正常细胞等)相比,目的细胞表达的MUC16蛋白和/或mRNA的水平更高。
在实施方案中,本文描述的CAR的抗原结合部分对MUC16是特异性的(MUC16 CAR)。当在细胞表面上表达时,MUC16特异性CAR将T细胞的特异性重定向至人MUC16。在实施方案中,抗原结合域包含单链抗体片段(scFv),后者包含通过柔性连接体如甘氨酸-丝氨酸连接体或Whitlow连接体连接的靶抗原特异性单克隆抗MUC16抗体的轻链可变域(VL)和重链可变域(VH)。在实施方案中,该scFv是MUC16-1scFv(SEQ ID NO:43-44)、MUC16-2 scFv(SEQID NO:45-46)、MUC16-3 scFv(SEQ ID NO:47-48)、MUC16-4 scFv(SEQ ID NO:49-50)、MUC16-5 scFv(SEQ ID NO:51-52)、MUC16-6 scFv(SEQ ID NO:53-54)或MUC16-7 scFv(SEQID NO:55-56)。在实施方案中,该scFv是人源化的。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:43氨基酸序列(MUC16-1)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:44氨基酸序列(MUC16-1)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:45氨基酸序列(MUC16-2)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:46氨基酸序列(MUC16-2)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:47氨基酸序列(MUC16-3)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:48氨基酸序列(MUC16-3)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:49氨基酸序列(MUC16-4)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:50氨基酸序列(MUC16-4)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:51氨基酸序列(MUC16-5)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:52氨基酸序列(MUC16-5)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:53氨基酸序列(MUC16-5)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:54氨基酸序列(MUC16-6)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:55氨基酸序列(MUC16-7)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VL多肽。
在实施方案中,本文描述的CAR包含抗原结合部分,该抗原结合部分包含与SEQ IDNO:56氨基酸序列(MUC16-7)具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的VH多肽。
在一些实施方案中,抗原结合部分可包含定向连接的VH和VL,例如,从N末端到C末端、VH-连接体-VL或VL-连接体-VH。
工程化T细胞受体(TCR)
在一些实施方案中,所述嵌合受体包含工程化T细胞受体。T细胞受体(TCR)由两条链(αβ或γδ)组成,这两条链在T细胞表面上配对以形成异二聚体受体。在一些情况下,αβTCR在体内的大多数T细胞上表达,并且已知参与特定MHC限制性抗原的识别。每条α和β链由两个结构域组成:恒定域(C),其将蛋白质锚定至细胞膜并与CD3信号传导器的不变亚单位缔合;以及可变域(V),其通过称为互补决定区(CDR)的六个环赋予抗原识别。在一些情况下,每个V结构域包含三个CDR;例如,CDR1、CDR2和CDR3,其中CDR3作为高变区。这些CDR与抗原肽结合至由主要组织相容性复合物(pepMHC)编码的蛋白质而形成的复合物(例如,HLA-A、HLA-B、HLA-C、HLA-DPA1、HLA-DPB1、HLA-DQA1、HLA-DQB1、HLA-DRA或HLA-DRB1复合物)相互作用。在一些情况下,恒定域进一步包含将恒定域连接到可变域的接合区。在一些情况下,β链进一步包含构成接合区的一部分的较短的多样性区域。
在一些情况下,这样的TCR对特定肿瘤抗原(例如NY-ESO、Mage A3、Titin)具有反应性。在其他情况下,这样的TCR对患者肿瘤内表达的特定新抗原(即,由肿瘤表达的患者特异性突变、体细胞突变、非同义突变)具有反应性。在一些情况下,工程化TCR可以是亲和力增强的。
在一些实施方案中,使用国际免疫遗传学(IMGT)TCR命名法描述TCR,并且该TCR链接至TCR序列的IMGT公共数据库。例如,可存在几种类型的α链可变(Vα)区和几种类型的β链可变(Vβ)区,按其框架、CDR1、CDR2和CDR3序列区分。因此,Vα类型可以在IMGT命名法中指代为独特的TRAV编号。例如,“TRAV21”定义了具有独特框架和CDR1和CDR2序列以及CDR3序列的TCR Vα区域,该CDR3序列由在TCR之间保守的氨基酸序列部分限定但也包括在TCR之间变化的氨基酸序列。类似地,“TRBV5-1”定义了具有独特框架和CDR1和CDR2序列以及仅部分限定的CDR3序列的TCR Vβ区域。
在一些情况下,β链多样性区域在IMGT命名法中用缩写TRBD表示。
在一些情况下,由IMGT命名法定义的独特序列是公知的,并且可供TCR领域的工作人员访问。例如,它们可见于IMGT公共数据库和“T cell Receptor Factsbook”,(2001)LeFranc和LeFranc,Academic Press,ISBN 0-12-441352-8中。
在一些实施方案中,例如,αβ异二聚体TCR作为具有胞质域和跨膜域的全长链转染。在一些情况下,TCR在相应恒定域的残基之间含有引入的二硫键,如例如WO 2006/000830中所述。
在一些情况下,本文所述的TCR是单链形式,例如参见WO 2004/033685。单链形式包括Vα-L-Vβ、Vβ-L-Vα、Vα-Cα-L-Vβ、Vα-L-Vβ-Cβ、Vα-Cα-L-Vβ-Cβ类型的αβTCR多肽,其中Vα和Vβ分别是TCRα和β可变区,Cα和Cβ分别是TCRα和β恒定区,并且L是连接体序列。在某些实施方案中,本发明的单链TCR可以在相应恒定域的残基之间具有引入的二硫键,如WO 2004/033685中所述。
本文所述的TCR可以与可检测标记、治疗剂或PK修饰部分缔合。
用于诊断目的的示例性可检测标记包括但不限于荧光标记、放射性标记、酶、核酸探针和造影剂。
可与本文所述TCR缔合的治疗剂包括免疫调节剂、放射性化合物、酶(例如穿孔蛋白)或化疗剂。为了确保在所需位置发挥毒性作用,毒素可以处于与TCR连接的脂质体内,使得化合物以受控方式释放。在一些情况下,受控释放使体内转运过程中的破坏作用最小化,并确保毒素在TCR与相关抗原呈递细胞结合后具有最大效果。
在一些实施方案中,其他合适的治疗剂包括,例如:
a.小分子细胞毒性剂,例如具有杀伤哺乳动物细胞的能力、分子量小于700道尔顿的化合物。这样的化合物还可含有能够具有细胞毒性作用的有毒金属。此外,应当理解,这些小分子细胞毒性剂还包括前药,即在生理条件下分解或转化以释放细胞毒性剂的化合物。这类药剂的实例包括顺铂、美登素衍生物、雷查霉素(rachelmycin)、加利车霉素、多西他赛、依托泊苷、吉西他滨、异环磷酰胺、伊立替康、美法仑、米托蒽醌、sorfimersodiumphotofrin II、替莫唑胺、拓扑替康、葡萄糖醛酸三甲曲沙(trimetreateglucuronate)、瑞奥西汀E(auristatin E)、长春新碱和多柔比星;
b.肽细胞毒素,即具有杀伤哺乳动物细胞能力的蛋白质或其片段。例如,蓖麻毒素、白喉毒素、假单胞菌细菌外毒素A、DNA酶和RNA酶;
c.放射性核素,即伴随有α或β粒子或γ射线中的一种或多种的发射而衰变的不稳定的元素同位素。例如,碘131、铼186、铟111、钇90、铋210和213、锕225和砹213;可利用螯合剂来促进这些放射性核素与高亲和力TCR或其多聚体的缔合;
d.免疫刺激剂,即刺激免疫应答的免疫效应分子。例如,细胞因子,如IL-2和IFN-γ,
e.超抗原及其突变体;
f.TCR-HLA融合物;
g.趋化因子如IL-8、血小板因子4、黑素瘤生长刺激蛋白等;
h.抗体或其片段,包括抗T细胞或NK细胞决定簇抗体(例如抗CD3、抗CD28或抗CD16);
i.具有抗体样结合特性的备选蛋白质支架
j.补体激活剂;以及
k.异种蛋白结构域、同种异体蛋白结构域、病毒/细菌蛋白结构域、病毒/细菌肽。
剂量
所使用的融合蛋白和修饰的免疫效应细胞的合适剂量将取决于受试者的年龄和体重以及所使用的具体药物。融合蛋白和修饰的免疫效应细胞的剂量和治疗方案可由技术人员确定。
在某些实施方案中,融合蛋白以1至30mg/kg,例如约5至25mg/kg、约10至20mg/kg、约1至5mg/kg或约3mg/kg的剂量通过注射(例如,皮下或静脉内)施用。在一些实施方案中,融合蛋白以约1mg/kg、约3mg/kg、约5mg/kg、约10mg/kg、约20mg/kg、约30mg/kg或约40mg/kg的剂量施用。在一些实施方案中,融合蛋白以约1-3mg/kg或约3-10mg/kg的剂量施用。在一些实施方案中,融合蛋白以约0.5-2、2-4、2-5、5-15或5-20mg/kg的剂量施用。给药时间表可以从例如每周一次到每2、3或4周一次不等。在一个实施方案中,融合蛋白每隔一周以约10至20mg/kg的剂量施用。在另一个实施方案中,融合蛋白以每两周一次约1mg/kg、每两周一次约3mg/kg、每两周一次10mg/kg、每四周一次3mg/kg或每四周一次5mg/kg的剂量施用。
在其他实施方案中,融合蛋白以约200mg至500mg,例如约250mg至450mg、约300mg至400mg、约250mg至350mg、约350mg至450mg或约300mg或约400mg的剂量(例如平剂量)通过注射(例如,皮下或静脉内)施用。在一些实施方案中,融合蛋白以约200mg、约250mg、约300mg、约350mg、约400mg、约450mg或约500mg的剂量施用。在一些实施方案中,融合蛋白以200或300mg的剂量施用。在一些实施方案中,融合蛋白以约250-450mg或约300-400mg的剂量施用。在一些实施方案中,融合蛋白以约200-300mg、250-350mg、300-400mg、350-450mg或400-500mg的剂量施用。给药时间表可以从例如每周一次到每2、3、4、5或6周一次不等。在一个实施方案中,融合蛋白每三周一次或每四周一次以约300mg至400mg的剂量施用。在一个实施方案中,融合蛋白每三周一次以约300mg的剂量施用。在一个实施方案中,融合蛋白每四周一次以约400mg的剂量施用。在一个实施方案中,融合蛋白每四周一次以约300mg的剂量施用。在一个实施方案中,融合蛋白每三周一次以约400mg的剂量施用。融合蛋白可以施用一次或多次,例如,一次、两次、三次、四次、五次、六次、七次或更多次。在一个实施方案中,融合蛋白施用六次。可以在施用表达CAR的细胞,例如MUC16、CD33、CD19或BCMA特异性CAR表达细胞后至少5天,例如约5、6、7、8、9、10、11、12、13、14、20、25、30、35或40天施用融合蛋白。在一些实施方案中,可以在施用表达CAR的细胞,例如MUC16特异性CAR表达细胞或CD33特异性CAR表达细胞后约8天或约15天施用融合蛋白。
融合蛋白可以通过本领域已知的多种方法施用,尽管对于许多治疗应用而言,优选的给药途径/方式是静脉内注射或输注。例如,融合蛋白可以通过静脉内输注以大于20mg/min,例如20-40mg/min,并且一般大于或等于40mg/min的速率施用,以达到约35至440mg/m2,一般约为70至310mg/m2,更一般约为110至130mg/m2的剂量。在实施方案中,融合蛋白可以通过静脉内输注以小于10mg/min,优选小于或等于5mg/min的速率施用,以达到约1至100mg/m2,优选约5至50mg/m2、约7至25mg/m2且更优选约10mg/m2的剂量。
融合蛋白可以通过静脉内输注以大于20mg/min,例如20-40mg/min,并且一般大于或等于40mg/min的速率施用,以达到约35至440mg/m2,一般约为70至310mg/m2,更一般约为110至130mg/m2的剂量。在实施方案中,约110至130mg/m2的输注速率达到约3mg/kg的水平。在其他实施方案中,融合蛋白可以通过静脉内输注以小于10mg/min,例如小于或等于5mg/min的速率施用,以达到约1至100mg/m2,例如约5至50mg/m2、约7至25mg/m2或约10mg/m2的剂量。在一些实施方案中,在约30分钟的时间内输注抗体。
经修饰的效应细胞的剂量
在一些实施方案中,将一定量的经修饰的效应细胞施用于有需要的受试者,并且基于功效和诱导细胞因子相关毒性的潜力来确定该量。在一些情况下,经修饰的效应细胞的量包含约10
在一些实施方案中,经修饰的效应细胞是经修饰的T细胞。在一些情况下,经修饰的T细胞是CAR-T细胞。在一些情况下,CAR-T细胞的量包含约10
在一些实施方案中,CAR-T细胞是CD19特异性CAR-T细胞。在一些情况下,CD19特异性CAR-T细胞的量包含约10
在一些实施方案中,经修饰的T细胞是工程化TCR T细胞。在一些情况下,工程化TCR T细胞的量包含约10
应当指出,剂量值可随待缓解的病况的类型和严重程度而变化。应当进一步理解,对于任何特定的受试者,具体的剂量方案应根据个体的需要和施用或监督组合物给药者的专业判断随时间而调整,并且本文所提出的剂量范围仅为示例性的,并非旨在限制所请求保护的组合物的范围或实施。
融合蛋白的表达和纯化系统
本文所述的融合蛋白或其片段或变体可以如下从细胞中产生:在足以允许表达该融合蛋白或其片段或变体的条件下和时间长度下,培养用包含一种或多种编码该融合蛋白或其片段或变体的多核苷酸的表达载体转化的宿主细胞。例如,在大肠杆菌中表达的多肽可以从包涵体重折叠(参见,例如,Hou等人(1998)Cytokine10:319-30)。细菌表达系统及其使用方法在本领域中是公知的(参见Current Protocols in Molecular Biology,Wiley&Sons,和Molecular Cloning–A Laboratory Manual–第三版,Cold Spring HarborLaboratory Press,New York(2001))。密码子、合适的表达载体和合适的宿主细胞的选择可以根据许多因素而变化,并且可以根据需要容易地进行优化。本文所述的融合蛋白或其片段或变体可以在哺乳动物细胞或包括但不限于酵母、杆状病毒和体外表达系统的其他表达系统中表达(参见,例如,Kaszubska等人(2000)Protein Expression and Purification18:213-220)。
表达后,可以纯化或分离融合蛋白或其片段或变体。应用于本文所述的任何融合蛋白或其片段或变体的术语“纯化的”或“分离的”可指已经从自然伴随的组分(例如,蛋白质或其他天然存在的生物或有机分子)(例如表达该蛋白质的原核生物中的其他蛋白质、脂质和核酸)中分离或纯化的多肽或蛋白质。通常,当多肽以重量计占样品中总蛋白质的至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%时,该多肽是纯化的。
本文所述的融合蛋白或其片段或变体可以根据样品中存在何种其他成分而以多种方式分离或纯化。标准纯化方法包括电泳、分子、免疫学和色谱技术,包括离子交换、疏水、亲和和反相HPLC色谱法。例如,可以使用标准的抗融合蛋白抗体亲和柱纯化融合蛋白或其片段或变体。超滤和渗滤技术以及蛋白质浓缩也是有用的。参见,例如,Scopes(1994)“Protein Purification,第3版,”Springer-Verlag,New York City,N.Y.。必要的纯化程度可以根据所需的用途而变化。在一些情况下,表达的融合蛋白或其片段或变体不需要纯化。
用于确定纯化的融合蛋白或其片段或变体的产率或纯度的方法可包括,例如,Bradford测定、紫外分光光度法、双缩脲蛋白质测定、Lowry蛋白质测定、酰胺黑蛋白质测定、高压液相色谱法(HPLC)、质谱法(MS)和凝胶电泳法(例如,使用蛋白质染色剂,如考马斯蓝或胶体银染色剂)。一旦表达、纯化或在表达后纯化后,可使用体外或体内测定,如本文所述的任何一种,来测定本文所述的融合蛋白或其片段或变体的多种所需性质中的任何一种。例如,可以测定本文所述的融合蛋白或其片段或变体的例如抑制PD-1和捕获TGF-β的能力。
可以使用多种技术来产生本文所述的融合蛋白或其片段或变体。例如,可以将编码本文所述的融合蛋白或其片段或变体的多核苷酸插入含有转录和翻译调节序列的表达载体中,所述转录和翻译调节序列可包括,例如,启动子序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列、转录终止子信号、聚腺苷酸化信号以及增强子或激活子序列。在一些实施方案中,该调节序列可包括启动子以及转录起始和终止序列。另外,该表达载体可以包括一个以上的复制系统,使其可以在两种不同的生物体中维持,例如在哺乳动物或昆虫细胞中进行表达,并在原核宿主中进行克隆和扩增。
几种可能的载体系统可用于在哺乳动物细胞(例如宿主细胞)中从核酸表达融合蛋白或其片段或变体。例如,一类载体依赖于所需基因序列向宿主细胞基因组中的整合。可以通过同时引入抗药性基因如大肠杆菌gpt(Mulligan和Berg(1981)Proc Natl Acad SciUSA 78:2072)或Tn5neo(Southern和Berg(1982)Mol Appl Genet1:327)来选择具有稳定整合的DNA的细胞。选择标记基因可以与待表达的DNA基因序列连接,也可以通过共转染引入同一细胞中(Wigler等人(1979)Cell 16:77)。另一类载体利用赋予染色体外质粒自主复制能力的DNA元件。这些载体可衍生自动物病毒,如牛乳头瘤病毒(Sarver等人(1982)ProcNatl Acad Sci USA,79:7147)、多瘤病毒(Deans等人(1984)Proc Natl Acad Sci USA81:1292)或SV40病毒(Lusky和Botchan(1981)Nature293:79)。可以以适合核酸后续表达的方式将表达载体引入细胞(例如宿主细胞)中。引入方法主要由靶向细胞类型决定,如下所述。非限制性的示例性方法可包括CaPO
用于表达融合蛋白或其片段或变体的合适的宿主细胞可包括但不限于酵母、细菌、昆虫、植物以及如上所述的哺乳动物细胞。令人感兴趣的是诸如大肠杆菌的细菌,诸如酿酒酵母(Saccharomyces cerevisiae)和巴斯德毕赤酵母(Pichia pastoris)的真菌,诸如SF9的昆虫细胞,哺乳动物细胞系(例如人细胞系),以及原代细胞系(例如原代哺乳动物细胞)。在一些实施方案中,融合蛋白或其片段或变体可以在中国仓鼠卵巢(CHO)细胞或合适的骨髓瘤细胞系如(NS0)中表达。合适的细胞系还包括,例如,BHK-21(幼仓鼠肾)细胞;293(人胚肾)细胞;HMEpC(人乳腺上皮细胞);3T3(小鼠胚胎成纤维细胞)细胞。
本文所述的方法提供了融合蛋白或其片段或变体在各种基于细胞的表达系统中的表达和纯化,如在细菌、哺乳动物、昆虫、酵母和chymadomonas细胞中的蛋白质产生。蛋白质表达可以是组成型的或诱导型的,使用诱导剂,如硫酸铜,诸如半乳糖的糖、甲醇、甲胺、硫胺素、四环素或IPTG。在宿主细胞中表达融合蛋白或其片段或变体后,裂解宿主细胞以释放该融合蛋白或其片段或变体以进行纯化。裂解各种宿主细胞的方法在“SamplePreparation-Tools for Protein Research”EMD Bioscience and in the CurrentProtocols in Protein Sciences(CPPS)中描述。非限制性的示例性纯化方法是亲和色谱法,例如针对例如组氨酸标记的融合蛋白或其片段或变体使用镍、钴或锌亲和树脂的离子-金属亲和色谱。Clontech描述了使用其Talonx钴树脂纯化组氨酸标记的蛋白质的方法,Novagen在其pET系统手册(第10版)中对其进行了描述。另一种非限制性的示例性纯化策略是通过免疫亲和色谱法,例如,可以使用抗myc抗体缀合的树脂来亲和纯化例如myc标记的融合蛋白或其片段或变体。用丝氨酸蛋白酶如凝血酶和肠激酶进行的酶消化,从组氨酸或myc标签上切割并释放融合蛋白或其片段或变体,从而从亲和树脂中释放融合蛋白或其片段或变体,而组氨酸标签和myc标签保持附着在亲和树脂上。
将编码融合蛋白或其片段或变体的多核苷酸引入细胞(例如宿主细胞)中并表达的方法是本领域已知的。在表达载体的情况下,可以通过本领域的任何方法,将包含编码融合蛋白或其片段或变体的多核苷酸的载体容易地引入宿主细胞,例如哺乳动物细胞、细菌、酵母或昆虫细胞中。例如,可以通过物理、化学或生物方式将表达载体转移到宿主细胞中。
用于将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀、脂质转染、粒子轰击、显微注射、电穿孔等。用于产生包含载体和/或外源核酸的细胞的方法是本领域公知的。参见,例如,Sambrook等人(Molecular Cloning:A Laboratory Manual,Cold Spring HarborLaboratory,New York(2001))。在实施方案中,用于将多核苷酸引入宿主细胞的方法是磷酸钙转染或聚乙烯亚胺(PEI)转染。
将编码融合蛋白或其片段或变体的多核苷酸引入宿主细胞中的生物学方法可包括使用DNA和RNA载体。病毒载体,尤其是逆转录病毒载体,已成为用于将基因插入哺乳动物细胞(例如人细胞)中的最广泛使用的方法。其他病毒载体可以衍生自慢病毒、痘病毒、单纯疱疹病毒I、腺病毒和腺相关病毒等。参见,例如,美国专利5,350,674和5,585,362。
在一些实施方案中,表达载体可具有必需的5’上游和3’下游调节元件,如启动子序列,核糖体识别和结合TATA盒,以及3’UTR AAUAAA转录终止序列,以供在其各自的宿主细胞中进行有效的基因转录和翻译。表达载体可具有额外的序列,如6X-组氨酸、V5、硫氧还蛋白、谷胱甘肽-S-转移酶、c-Myc、VSV-G、HSV、FLAG、麦芽糖结合肽、金属结合肽、HA和“分泌”信号(蜜蜂蜂毒肽、α-因子、PHO、Bip),将其引入表达的融合蛋白或其片段或变体中。另外,在这些序列之后可以引入酶消化位点,以在不需要它们之后促进它们的酶促去除。这些额外的序列可用于检测融合蛋白表达,通过亲和色谱法进行蛋白质纯化,提高重组蛋白在宿主细胞质中的溶解度,和/或将融合蛋白分泌到培养基中、原核细菌的周质中或酵母细胞的原生质球中。融合蛋白的表达在宿主细胞中可以是组成型的,或者可以进行诱导,例如采用硫酸铜、诸如半乳糖的糖、甲醇、甲胺、硫胺素、四环素、杆状病毒感染以及(异丙基-β-D-硫代吡喃半乳糖苷)IPTG(乳糖的稳定合成类似物)。
表达载体和宿主细胞的非限制性实例可包括pET载体(Novagen)、pGEX载体(Amersham Pharmacia)和pMAL载体(New England labs.Inc.),用于在诸如BL21、BL21(DE3)和AD494(DE3)pLysS、Rosetta(DE3)和Origami(DE3)(Novagen)等大肠杆菌宿主细胞中表达蛋白质;基于强CMV启动子的pcDNA3(Invitrogen)和pCIneo载体(Promega),用于在诸如CHO、COS、HEK-293、Jurkat和MCF-7等哺乳动物细胞系中表达;复制缺陷的腺病毒载体pAdeno X、pAd5F35、pLP-Adeno-X-CMV(Clontech)、pAd/CMV/V5-DEST、pAd-DEST载体(Invitrogen),用于腺病毒介导的基因转移和在哺乳动物细胞中的表达;与来自Clontech的Retro-XTM系统一起使用的pLNCX2、pLXSN和pLAPSN逆转录病毒载体,用于逆转录病毒介导的基因转移和在哺乳动物细胞中的表达;pLenti4V5-DEST.TM.、pLenti6/V5-DESTTM和pLenti6.2/V5-GW/lacZ(Invitrogen),用于慢病毒介导的基因转移和在哺乳动物细胞中的表达;腺病毒相关病毒表达载体,如pAAV-MCS、pAAV-IRES-hrGFP和pAAV-RC载体(Stratagene),用于腺相关病毒介导的基因转移和在哺乳动物细胞中的表达;BACpak6杆状病毒(Clontech)和pFastBacTM-HT(Invitrogen),用于在草地贪夜蛾(Spodoperafrugiperda)9(S9)和Sfl1昆虫细胞系中表达;pMT/BiP/V5-His(Invitrogen),用于在果蝇Schneider S2细胞中表达;用于在巴斯德毕赤酵母中表达的毕赤酵母表达载体pPICZα、pPICZ、pFLDα和pFLD(Invitrogen)以及用于在甲醇毕赤酵母(P.methanolica)中表达的载体pMETα和pMET;用于在酿酒酵母中表达的pYES2/GS和pYD1(Invitrogen)载体。GriesbeckC.等人.2006Mol.Biotechnol.34:213-33和Fuhrmann M.2004,Methods Mol Med.94:191-5描述了在莱茵衣藻(Chlamydomonas reinhardtii)中大规模表达异源蛋白质的最新进展。
除了基于细胞的表达系统外,也想到无细胞表达系统。与传统的基于细胞的表达方法相比,无细胞表达系统具有若干优点,包括易于修改反应条件以利于蛋白质折叠,降低对产物毒性的敏感性,以及对高通量策略(如快速表达筛选或大量蛋白质生产)的适用性,因为减少了反应体积并缩短了处理时间。无细胞表达系统可以使用质粒或线性DNA。而且,翻译效率的提高已导致每毫升反应混合物的蛋白质产量超过一毫克。
在一个实施方案中,连续的无细胞翻译系统可用于产生融合蛋白或其片段或变体。Spirin A S.等人,Science 242:1162(1988)描述了一种能够以高产率产生蛋白质的连续无细胞翻译系统。该方法使用进料缓冲液的连续流设计,其在整个反应混合物中含有氨基酸、三磷酸腺苷(ATP)和三磷酸鸟苷(GTP),并连续去除翻译的多肽产物。该系统使用大肠杆菌裂解物来提供无细胞的连续进料缓冲液。该连续流系统与原核和真核表达载体均相容。Chang G.等人,Science 310:1950-3(2005)描述了大规模的无细胞生产。
其他可商购获得的无细胞表达系统包括ExpresswayTM Cell-Free ExpressionSystems(Invitrogen),该系统利用基于大肠杆菌的体外系统进行有效的耦合的转录和翻译反应,以便以管反应形式产生高达毫克量的活性重组蛋白;Rapid Translation System(RTS)(Roche Applied Science),其也使用基于大肠杆菌的体外系统;以及TNT CoupledReticulocyte Lysate Systems(Promega),其使用基于兔网织红细胞的体外系统。
在其他示例性生产方法中,本文所述的融合蛋白或其片段或变体可以使用化学方法全部或部分从头合成。例如,可以通过固相技术合成融合蛋白或其片段或变体的组成氨基酸序列,从树脂上切下,并通过制备型高效液相色谱法纯化,然后化学连接以形成所需的多肽。合成肽的组成可以通过氨基酸分析或测序来确认。
用于检测和/或测量样品中(纯化之前和之后)存在的内毒素含量的方法可以基于可商购获得的试剂盒。例如,可以使用QCL-1000Chromogenic试剂盒(BioWhittaker),基于鲎变形细胞溶解物(LAL)的试剂盒,如可从Associates of Cape Cod Incorporated获得的
在一些实施方案中,在表达和纯化之后,可以修饰本文所述的融合蛋白或其片段或变体。所述修饰可以是共价或非共价修饰。可以通过例如使融合蛋白或其片段或变体的靶向氨基酸残基与能够与所选侧链或末端残基反应的有机衍生化剂反应,将此类修饰引入融合蛋白或其片段或变体中。可以使用多种标准中的任何一种来选择合适的修饰位点,所述标准包括,例如,融合蛋白或其片段或变体的结构分析或氨基酸序列分析。
在一些示例性生产方法中,本文所述的融合蛋白或其片段或变体可以与异源部分缀合。在一些实施方案中,该异源部分可以是例如异源多肽、治疗剂(例如毒素或药物)或可检测标记,例如但不限于放射性标记、酶标记、荧光标记或发光标记。合适的异源多肽可包括,例如,用于纯化抗体或其片段或变体的抗原标签(例如,FLAG、聚组氨酸、血凝素(HA)、谷胱甘肽-S-转移酶(GST)或麦芽糖结合蛋白(MBP))。异源多肽还可包括可用作诊断标记或可检测标记的多肽,例如,萤光素酶、绿色荧光蛋白(GFP)或氯霉素乙酰基转移酶(CAT)。当异源部分是多肽时,可以将该部分并入本文所述的融合蛋白或其片段或变体中,从而得到包含该异源部分的融合蛋白。
启动子
“启动子”是指启动编码序列转录的多核苷酸区域。启动子位于基因的转录起始位点附近,位于DNA的同一链和上游(朝向有义链的5’区)。一些启动子是组成型的,因为它们在细胞中在所有情况下都具有活性,而其他启动子响应于特定刺激被调节变得具有活性,例如诱导型启动子。另外其他的启动子是组织特异性或活化的启动子,包括但不限于T细胞特异性启动子。
术语“启动子活性”及其语法等同语是指与正被测量活性的启动子可操作地连接的核苷酸序列的表达程度。启动子活性可以通过确定产生的RNA转录物的量直接测定(例如通过Northern印迹分析),或通过确定由所连接的核酸序列(如与启动子连接的报道核酸序列)编码的产物的量间接测定。
如本文所用的“诱导型启动子”是指通过转录调节物(例如,生物或非生物因素)的存在或不存在而诱导活性的启动子。诱导型启动子是有用的,因为与它们可操作连接的基因的表达可以在生物体的某些发育阶段或在特定组织中打开或关闭。诱导型启动子的实例是醇调节的启动子、四环素调节的启动子、类固醇调节的启动子、金属调节的启动子、发病机理调节的启动子、温度调节的启动子和光调节的启动子。
合适的启动子的一个实例是立即早期巨细胞病毒(CMV)启动子序列。该启动子序列是强组成型启动子序列,能够驱动与其可操作地连接的任何多核苷酸序列的高水平表达。然而,也可以使用其他组成型启动子序列,包括但不限于猴病毒40(SV40)早期启动子、小鼠乳腺肿瘤病毒(MMTV)、人免疫缺陷病毒(HIV)长末端重复序列(LTR)启动子、MoMuLV启动子、禽白血病病毒启动子、EB病毒立即早期启动子、劳斯肉瘤病毒启动子,以及人基因启动子,诸如但不限于肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子和肌酸激酶启动子。进一步地,本公开内容不应限于组成型启动子的使用。诱导型启动子也被考虑为本公开内容的一部分。诱导型启动子的使用提供了一种分子开关,其能够开启可操作地连接的多核苷酸序列的表达(当需要这样的表达时),或者当不需要表达时关闭表达。诱导型启动子的实例包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
在一些实施方案中,所述启动子是组成型启动子、组织特异性启动子或诱导型启动子。在一些实施方案中,所述诱导型启动子是基于两个多肽蜕皮素受体的小分子配体诱导型基因开关。
另外的启动子元件,例如增强子,可调节转录起始的频率。尽管最近已示出许多启动子也包含在起始位点下游的功能元件,但通常这些启动子元件位于起始位点上游30-110bp的区域。启动子元件之间的间隔通常是柔性的,因此当元件相对于彼此倒置或移动时保留启动子功能。在胸苷激酶(tk)启动子中,启动子元件之间的间隔可以在活性开始下降之前增加至相隔50bp。似乎各个元件可以协同或独立地起作用以激活转录,这取决于启动子。
报道基因
报道基因可用于鉴定潜在转染的细胞和评价调节序列的功能。通常,报道基因是不存在于宿主细胞中或不由宿主细胞表达的基因,并且其编码多肽,该多肽的表达通过一些易于检测的性质(例如酶活性)而表现出来。在将编码融合蛋白或其片段或变体的多肽引入宿主细胞后的合适时间测定报道基因的表达。合适的报道基因可包括但不限于编码萤光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌的碱性磷酸酶的基因,或绿色荧光蛋白基因(例如,Ui-Tei等人,FEBS Letters 479:79-82(2000))。合适的表达系统是公知的,并且可以使用已知技术制备或商购获得。通常,显示报道基因最高表达水平的具有最小5'侧翼区的多核苷酸构建体被鉴定为启动子。这样的启动子区可以与报道基因连接,并用于评价药剂调节启动子驱动的转录的能力。
变体
术语“片段”或“变体”是指本文所述的融合蛋白的变体和衍生物,其包含与例如PD-1和/或TGF-β的一个或多个结合部分。在某些实施方案中,涉及融合蛋白的氨基酸序列变体。例如,在一些实施方案中,预期本文所述的融合蛋白的氨基酸序列变体改善融合蛋白的结合亲和力和/或其他生物学性质。用于制备氨基酸变体的示例性方法包括但不限于将适当的修饰引入编码融合蛋白的核苷酸序列中,或者通过肽合成。这类修饰包括,例如,融合蛋白的氨基酸序列内的残基的缺失和/或插入和/或置换。
可对各个结构域进行缺失、插入和置换的任意组合以得到最终融合蛋白,条件是最终融合蛋白具有期望的特性,例如PD-1抑制和TGF-β阱。在一些实施方案中,提供了具有一个或多个氨基酸置换的融合蛋白变体。在一些实施方案中,用于置换诱变的感兴趣的位点可包括CDR和框架区。在一些实施方案中,可将氨基酸置换引入感兴趣的靶标结合蛋白的可变域中,并针对所需活性,例如,保留/改善的抗原结合、降低的免疫原性或改善的抗体依赖性细胞介导的细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)来筛选产物。保守和非保守的氨基酸置换均可考虑用于制备抗体变体(例如,PD-1抗体变体)。
在用来产生变异融合蛋白的置换的另一个实例中,可以是置换亲本抗体的一个或多个高变区残基。通常,之后基于与亲本抗体相比的所需性质的改善,例如,增加的亲和力、降低的亲和力、降低的免疫原性、增加的结合的pH依赖性来选择变体。例如,可以使用例如基于噬菌体展示的亲和力成熟技术,如本文所述和本领域已知的技术,来生成亲和力成熟的变异抗体。可以在亲本抗体的高变区(HVR)中进行置换以生成变体,然后基于结合亲和力,即通过亲和力成熟来选择变体。在亲和力成熟的一些实施方案中,可通过多种方法中的任一种(例如,易错PCR、链改组或寡核苷酸定点诱变)向选择用于成熟的可变基因中引入多样性。然后可创建次级文库。然后可筛查文库,以鉴定具有所需亲和力的任何抗体变体。引入多样性的另一种方法可涉及HVR定向方法,其中若干个HVR残基(例如,一次4-6个残基)可被随机化。参与抗原结合的HVR残基可以例如使用丙氨酸扫描诱变或建模来特异性鉴别。置换可以在亲本抗体序列内的一个、两个、三个、四个或更多个位点处。
在一些实施方案中,本文所述的融合蛋白的片段或变体可包含VL结构域和VH结构域,所述结构域具有分别对应于天然存在的VL或VH结构域的氨基酸序列的氨基酸序列,但是已经“人源化”,即通过用存在于来自人类的常规4链抗体的VL或VH结构域中相应位置处的一个或多个氨基酸残基替换天然存在的VL或VH结构域(特别是框架序列中)的氨基酸序列中的一个或多个氨基酸残基。这可以按本领域已知的方式进行,该方式对于本领域技术人员可能是显而易见的,例如基于本文的进一步描述。应当指出,此类人源化融合蛋白或其片段或变体以本质上已知的任何合适的方式获得,因此不严格限于使用包含天然存在的VL和/或VH结构域的多肽作为起始材料获得的多肽。
在一些实施方案中,如本文所述的融合蛋白的片段或变体包含VL和VH结构域,所述结构域具有分别对应于天然存在的VL或VH结构域的氨基酸序列的氨基酸序列,但是已经“骆驼化”,即通过用存在于重链抗体的VL或VH结构域中的相应位置处的一个或多个氨基酸残基替换来自常规4链抗体的天然存在的VL或VH结构域的氨基酸序列中的一个或多个氨基酸残基。此类“骆驼化”可优选地在形成VH-VL界面和/或存在于VH-VL界面处的氨基酸位置处以及/或者在所谓的骆驼科标志残基处插入(参见例如WO 94/04678,以及Davies和Riechmann(1994和1996))。在一些实施方案中,用作生成或设计骆驼化单结构域的起始材料或起始点的VH序列可以是来自哺乳动物如人类的VH序列,如VH3序列。应当指出,此类骆驼化融合蛋白或其片段或变体在某些实施方案中可以以本领域已知的任何合适的方式获得,因此不严格限于使用包含天然存在的VL和/或VH结构域的多肽作为起始材料获得的多肽。
例如,“人源化”和“骆驼化”均可如下进行:分别提供编码天然存在的VL和/或VH结构域的核苷酸序列,然后分别以新多核苷酸序列编码“人源化”或“骆驼化”融合蛋白或其片段或变体的方式改变该核苷酸序列中的一个或多个密码子。然后可以表达该多核苷酸,以提供所需的结合能力(例如PD-1)。或者,在其他实施方案中,融合蛋白或其片段或变体包含使用已知的肽合成技术,从包含VL和/或VH结构域的天然存在的抗体的氨基酸序列从头合成的“人源化”或“骆驼化”抗体。在一些实施方案中,融合蛋白或其片段或变体包含使用已知的肽合成技术,分别从包含VL和/或VH结构域的天然存在的抗体的氨基酸序列或核苷酸序列从头合成的“人源化”或“骆驼化”抗体,分别设计编码本公开的所需人源化或骆驼化抗体的核苷酸序列,然后使用已知的核酸合成技术从头合成,之后使用已知的表达技术表达由此获得的核酸,以提供所需抗体。
用于从VL或VH结构域的天然存在的序列开始获得融合蛋白或其片段或变体的其他合适方法和技术包括,例如,以合适的方式组合一个或多个天然存在的VL或VH序列(诸如一个或多个框架(FR)序列和/或互补决定区(CDR)序列)的一个或多个部分,以及/或者一个或多个合成或半合成序列,以及/或者CH2结构域的天然存在的序列,以及CH3结构域的天然存在的序列(其包含相对于同型二聚体更有利于形成异二聚体的氨基酸置换),以便提供融合蛋白或其片段或变体。
抗体工程化
在一些实施方案中,可能希望如下将含有暴露的侧链的某些氨基酸改变为另一氨基酸残基,以提供最终抗体(例如,PD-1抗体)的更高的化学稳定性。天冬酰胺的脱酰胺作用可在N-G或D-G序列上发生,并导致异天冬氨酸残基的产生,该残基将纽结(kink)引入多肽链并降低其稳定性(异天冬氨酸作用)。在一些实施方案中,本公开的融合蛋白的抗体不包含天冬酰胺异构位点。
例如,可将天冬酰胺(Asn)残基改变为Gln或Ala,以降低在任何Asn-Gly序列上,特别是在CDR内形成异天冬氨酸的可能性。在Asp-Gly序列上可能会发生类似的问题。Reissner和Aswad(2003)Cell.Mol.Life Sci.60:1281。异天冬氨酸的形成可减弱或完全消除抗体与其靶抗原的结合。参见,Presta(2005)J.Allergy Clin.Immunol.116:731,734。在一个实施方案中,天冬酰胺可以被改变为谷氨酰胺(Gln)。还可能希望改变与天冬酰胺(Asn)或谷氨酰胺(Gln)残基相邻的氨基酸,以降低脱酰胺的可能性,当小氨基酸与天冬酰胺或谷氨酰胺相邻时,脱酰胺的发生率更高。参见,Bischoff&Kolbe(1994)J.Chromatog.662:261。另外,CDR中的任何甲硫氨酸残基(通常是暴露于溶剂的Met)都可以被改变为Lys、Leu、Ala或Phe,以减少甲硫氨酸硫被氧化的可能性,这可以降低抗原结合亲和力,并且还可以有助于最终抗体制品中的分子异质性。同上。在一个实施方案中,甲硫氨酸可以被改变为丙氨酸(Ala)。另外,为了防止或最小化潜在的易裂解Asn-Pro肽键,可能希望将CDR中所见的任何Asn-Pro组合改变为Gln-Pro、Ala-Pro或Asn-Ala。随后可以筛选具有这类置换的抗体,以确保该置换不会将抗体对人PD-L1的亲和力或特异性或其他所需的生物活性降低至不可接受的水平。
本文公开的融合蛋白的抗体也可以缀合至化学部分,如放射性核素或其他可检测标记。放射性核素包括
可以使用本领域已知用于将抗体分子与各种部分缀合的任何方法,包括Hunter等人,(1962)Nature 144:945;David等人,(1974)Biochemistry 13:1014;Pain等人,(1981)J.Immunol.Meth.40:219;和Nygren,J.,(1982)Histochem.and Cytochem.30:407描述的方法。用于缀合抗体的方法是本领域中常规且公知的。
药物组合物
本公开提供了一种组合物,其包含本文所述的融合蛋白或其片段或变体,及其载体(例如药学上可接受的载体)。该组合物理想地是生理学上可接受的(例如,药学上可接受的)组合物,其包含载体,优选生理学上(例如,药学上)可接受的载体,以及融合蛋白或其片段或变体。在本公开的背景中可以使用任何合适的载体,并且这样的载体在本领域中是公知的。载体的选择将部分取决于组合物的特定用途(例如,施用于动物)和用来施用该组合物的特定方法。理想地,在复制缺陷型腺病毒载体的情况下,药物组合物优选不含有复制能力的腺病毒。药物组合物任选地可以是无菌的。
合适的组合物包括水性和非水性等渗无菌溶液,其可以包含抗氧化剂、缓冲液和抑菌剂,以及水性和非水性无菌悬浮液,其可以包含悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。该组合物可以呈现于单剂量或多剂量密封容器如安瓿和小瓶中,并且可以在冷冻干燥(冻干)的条件下储存,仅需要在临使用前添加无菌液体载体,例如水。临时溶液和悬浮液可以由无菌粉末、颗粒和片剂制备。优选地,该载体是缓冲盐水溶液。在一些情况下,融合蛋白或其片段或变体是配制用于保护融合蛋白或其片段或变体在施用前不受损害的组合物的一部分。例如,可以将组合物配制为减少融合蛋白或其片段或变体在用于制备、储存或施用融合蛋白或其片段或变体的装置上的损失,该装置例如是玻璃器皿、注射器或针。可以将组合物配制为降低融合蛋白或其片段或变体的光敏性和/或温度敏感性。为此,组合物优选地包含药学上可接受的液体载体,例如以上描述的那些,以及选自聚山梨酯80、L-精氨酸、聚乙烯吡咯烷酮、海藻糖及其组合的稳定剂。使用这样的组合物将延长融合蛋白或其片段或变体的保存期限,并有利于其施用。包含融合蛋白或其片段或变体的组合物的制剂在例如美国专利6,225,289、美国专利6,514,943和国际专利申请公开WO 2000/034444中进一步描述。
还可以将组合物配制为增强转导效率。另外,本领域普通技术人员将会理解,融合蛋白或其片段或变体可以与其他治疗剂或生物活性剂一起存在于组合物中。例如,诸如布洛芬或类固醇等控制炎症的因素可以是组合物的一部分,以减少与融合蛋白或其片段或变体的体内施用相关的肿胀和炎症。可以存在抗生素,即杀微生物剂和杀真菌剂,以治疗现有的感染和/或降低将来感染的风险,例如与施用程序相关的感染。
在一些情况下,使用一种或多种生理学上可接受的载体,以常规方式配制包含本文所述融合蛋白或其片段或变体的药物组合物,该载体包括有助于将活性化合物加工成可药用的制品的赋形剂和助剂。适当的制剂取决于选定的给药途径。本文所述的药物组合物的概述可见于,例如,Remington:The Science and Practice of Pharmacy,第19版(Easton,Pa.,Mack Publishing Company,1995);Hoover,John E.,Remington’sPharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.和Lachman,L.编,Pharmaceutical Dosage Forms,Marcel Decker,NewYork,N.Y.,1980;和Pharmaceutical Dosage Forms and Drug Delivery Systems,第7版(Lippincott Williams&Wilkins 1999)。
任选地以常规方式制备药物组合物,仅举例来说,例如通过常规的混合、溶解、制粒、制糖衣丸、研磨、乳化、包封、包埋或压缩方法。
在某些实施方案中,组合物还可包含一种或多种pH调节剂或缓冲剂,包括酸,如乙酸、硼酸、柠檬酸、乳酸、磷酸和盐酸;碱,如氢氧化钠、磷酸钠、硼酸钠、柠檬酸钠、乙酸钠、乳酸钠和三羟甲基氨基甲烷;和缓冲液,如柠檬酸盐/右旋糖、碳酸氢钠和氯化铵。这类酸、碱和缓冲液以使组合物的pH保持在可接受范围内所需的量包含在内。
在其他实施方案中,组合物还可包含使组合物的重量摩尔渗透压浓度处于可接受范围内所需的量的一种或多种盐。这类盐包括具有钠、钾或铵阳离子和氯离子、柠檬酸根、抗坏血酸根、硼酸根、磷酸根、碳酸氢根、硫酸根、硫代硫酸根或亚硫酸氢根阴离子的盐;合适的盐包括氯化钠、氯化钾、硫代硫酸钠、亚硫酸氢钠和硫酸铵。
本文所述的药物组合物通过任何合适的给药途径施用,包括但不限于口服、肠胃外(例如,静脉内、皮下、肌肉内、脑内、脑室内、关节内、腹膜内或颅内)、鼻内、颊部、舌下或直肠给药途径。在一些情况下,配制药物组合物用于肠胃外(例如,静脉内、皮下、肌肉内、脑内、脑室内、关节内、腹膜内或颅内)给药。
将本文所述的药物组合物配制成任何合适的剂型,包括但不限于用于由待治疗个体口服摄取的水性口服分散体、液体、凝胶、糖浆、酏剂、浆液、悬浮液等,固体口服剂型、气雾剂、控制释放制剂、快速熔化制剂、泡腾制剂、冻干制剂、片剂、粉剂、丸剂、糖衣丸、胶囊、延迟释放制剂、延长释放制剂、脉冲释放制剂、多颗粒制剂,以及立即和控制释放混合型制剂。在一些实施方案中,将药物组合物配制成胶囊。在一些实施方案中,将药物组合物配制成溶液(例如,用于IV给药)。在一些情况下,将药物组合物配制成输注剂。在一些情况下,将药物组合物配制成注射剂。
本文所述的药物固体剂型任选地包含此处所述的融合蛋白或其片段或变体和一种或多种药学上可接受的添加剂,如相容的载剂、粘合剂、填充剂、悬浮剂、调味剂、甜味剂、崩解剂、分散剂、表面活性剂、润滑剂、着色剂、稀释剂、增溶剂、润湿剂、增塑剂、稳定剂、渗透增强剂、湿润剂、消泡剂、抗氧化剂、防腐剂或其一种或多种组合。
在其他方面,使用标准包衣程序,如Remington's Pharmaceutical Sciences,第20版(2000)中所述的标准包衣程序,在组合物周围可提供膜包衣。在一些实施方案中,将组合物配制成颗粒(例如用于通过胶囊施用)并且可对一些或所有颗粒进行包衣。在一些实施方案中,将组合物配制成颗粒(例如用于通过胶囊施用)并且可对一些或所有颗粒进行微胶囊化。在一些实施方案中,可将组合物配制成颗粒(例如用于通过胶囊施用)并且一些或所有颗粒未制成微胶囊且未包衣。
在某些实施方案中,本文提供的组合物还可包含一种或多种防腐剂以抑制微生物活性。合适的防腐剂包括含汞物质,如硼酸苯汞(merfen)和硫柳汞(thiomersal);稳定化的二氧化氯;以及季铵化合物,如苯扎氯铵、十六烷基三甲基溴化铵和西吡氯铵。
“消泡剂”减少加工过程中的起泡,这种起泡可以造成水性分散体的凝聚、成品膜中的气泡或通常受损的加工。示例性的消泡剂包括硅乳剂或失水山梨醇倍半油酸酯(sorbitan sesquoleate)。
“抗氧化剂”包括例如丁羟甲苯(BHT)、抗坏血酸钠、抗坏血酸、偏亚硫酸氢钠和生育酚。在某些实施方案中,如需要,抗氧化剂增强化学稳定性。
本文所述的制剂可受益于抗氧化剂、金属螯合剂、含巯基的化合物和其他普通稳定剂。这类稳定剂的实例包括但不限于:(a)约0.5%至约2%w/v甘油;(b)约0.1%至约1%w/v甲硫氨酸,(c)约0.1%至约2%w/v一硫代甘油,(d)约1mM至约10mM EDTA,(e)约0.01%至约2%w/v抗坏血酸,(f)0.003%至约0.02%w/v聚山梨醇酯80,(g)0.001%至约0.05%w/v聚山梨醇酯20,(h)精氨酸,(i)肝素,(j)硫酸葡聚糖,(k)环糊精,(l)多硫酸戊聚糖酯和其它类肝素类,(m)二价阳离子,如镁和锌;或(n)其组合。
“粘合剂”赋予粘结性质,并且包括例如藻酸及其盐;纤维素衍生物,如羧甲基纤维素、甲基纤维素(例如
“载剂”或“载剂材料”包括任何在制药学中常用的赋形剂,并且应根据与本文公开的化合物如依鲁替尼和抗癌剂化合物的相容性以及所需剂型的释放谱性质而选择。示例性的载剂材料包括,例如,粘合剂、悬浮剂、崩解剂、填充剂、表面活性剂、增溶剂、稳定剂、润滑剂、润湿剂、稀释剂等。
药学上相容的载剂材料可包括但不限于阿拉伯胶、明胶、胶体二氧化硅、甘油磷酸钙、乳酸钙、麦芽糖糊精、甘油、硅酸镁、聚乙烯吡咯烷酮(PVP)、胆固醇、胆固醇酯、酪蛋白酸钠、大豆卵磷脂、牛磺胆酸、磷脂酰胆碱、氯化钠、磷酸三钙、磷酸氢二钾、纤维素和纤维素缀合物、糖硬脂酰乳酸钠、角叉菜胶、甘油单酯、甘油二酯、预胶化淀粉等。参见,例如Remington:The Science and Practice of Pharmacy,第十九版(Easton,Pa.:MackPublishing Company,1995),Hoover,John E.,Remington’s Pharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975,Liberman,H.A.和Lachman,L.编,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980,以及Pharmaceutical Dosage Forms and Drug Delivery Systems,第七版(LippincottWilliams&Wilkins1999)。
“分散剂”和/或“粘度调节剂”包括通过液体介质或造粒方法或混合方法控制药物的扩散和均匀性的材料。在一些实施方案中,这些药剂还有助于包被或侵蚀基质的有效性。示例性扩散促进剂/分散剂包括例如亲水性聚合物、电解质、
一种或多种蚀解促进剂与一种或多种扩散促进剂的组合也可以在本发明的组合物中使用。
术语“稀释剂”是指用来在递送前稀释感兴趣的化合物的化学化合物。稀释剂也可用来稳定化合物,因为它们可提供更稳定的环境。本领域中利用溶解于经缓冲的溶液(其也可以提供pH控制或维持)中的盐作为稀释剂,包括但不限于磷酸盐缓冲的盐水溶液。在某些实施方案中,稀释剂增加组合物的体积,以便于压缩或者产生用于均匀掺合以供胶囊填充的足够体积。这类化合物包括例如乳糖、淀粉、甘露醇、山梨醇、右旋糖、微晶纤维素如
“填充剂”包括诸如乳糖、碳酸钙、磷酸钙、磷酸氢钙、硫酸钙、微晶纤维素、纤维素粉末、右旋糖、葡萄糖结合剂、葡聚糖、淀粉、预胶化淀粉、蔗糖、木糖醇、乳糖醇、甘露醇、山梨醇、氯化钠、聚乙二醇等化合物。
“润滑剂”和“助流剂”是防止、减少或抑制材料粘附或摩擦的化合物。示例性的润滑剂包括例如硬脂酸,氢氧化钙,滑石,硬脂酰富马酸钠,烃如矿物油,或氢化植物油如氢化大豆油
“增塑剂”是用来软化微胶囊化材料或膜包衣以使其更不易碎的化合物。合适的增塑剂包括例如聚乙二醇如PEG 300、PEG 400、PEG 600、PEG 1450、PEG 3350和PEG 800、硬脂酸、丙二醇、油酸、三乙基纤维素和三醋精。在一些实施方案中,增塑剂也可用作分散剂或润湿剂。
“增溶剂”包括诸如三醋精、柠檬酸三乙酯、油酸乙酯、辛酸乙酯、十二烷基硫酸钠、多库酯钠、维生素E TPGS、二甲基乙酰胺、N-甲基吡咯烷酮、N-羟乙基吡咯烷酮、聚乙烯吡咯烷酮、羟丙基甲基纤维素、羟丙基环糊精、乙醇、正丁醇、异丙醇、胆固醇、胆汁盐、聚乙二醇200-600、四氢呋喃聚乙二醇醚(glycofurol)、二乙二醇单乙基醚(transcutol)、丙二醇、二甲基异山梨醇等化合物。
“稳定剂”包括诸如任何抗氧化剂、缓冲液、酸、防腐剂等化合物。
“悬浮剂”包括诸如聚乙烯吡咯烷酮如聚乙烯吡咯烷酮K12、聚乙烯吡咯烷酮K17、聚乙烯吡咯烷酮K25或聚乙烯吡咯烷酮K30、乙烯基吡咯烷酮/乙酸乙烯酯共聚物(S630)、聚乙二醇(例如,聚乙二醇可具有约300至约6000,或约3350至约4000,或约7000至约5400的分子量)、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙酸硬脂酸羟甲基纤维素、聚山梨醇酯-80、羟乙基纤维素、藻酸钠、树胶如黄蓍胶和阿拉伯胶、瓜尔胶、黄原胶(包括黄原树胶)、糖、纤维素如羧甲基纤维素钠、甲基纤维素、羧甲基纤维素钠、羟丙基甲基纤维素、羟乙基纤维素、聚山梨醇酯-80、藻酸钠、聚乙氧基化失水山梨醇单月桂酸酯、聚乙氧基化失水山梨醇单月桂酸酯、聚维酮等化合物。
“表面活性剂”包括诸如十二烷基硫酸钠、多库酯钠、吐温60或80、三醋精、维生素ETPGS、失水山梨醇单油酸酯、聚氧乙烯失水山梨醇单油酸酯、聚山梨醇酯、泊洛沙姆(polaxomer)、胆汁盐、单硬脂酸甘油酯、环氧乙烷和环氧丙烷的共聚物如
“粘度增强剂”包括例如甲基纤维素、黄原胶、羧甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素、乙酸硬脂酸羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、卡波姆、聚乙烯醇、藻酸盐、阿拉伯胶、壳聚糖及其组合。
“润湿剂”包括诸如油酸、单硬脂酸甘油酯、失水山梨醇单油酸酯、失水山梨醇单月桂酸酯、油酸三乙醇胺、聚氧乙烯失水山梨醇单油酸酯、聚氧乙烯失水山梨醇单月桂酸酯、多库酯钠、油酸钠、十二烷基硫酸钠、多库酯钠、三醋精、吐温80、维生素E TPGS、铵盐等化合物。
试剂盒/制品
在某些实施方案中,本文公开了与一种或多种本文所述的方法一起使用的试剂盒和制品。这样的试剂盒包括载具、包装或容器,该容器被区室化为容纳一个或多个容器如小瓶、管等,每个容器包含在本文描述的方法中使用的一个单独元件。合适的容器包括,例如,瓶子、小瓶、注射器和试管。在一个实施方案中,该容器由多种材料如玻璃或塑料形成。
本文提供的制品含有包装材料。药物包装材料的实例包括但不限于泡罩包装、瓶子、管、袋、容器、瓶子,和任何适于选定制剂和预期给药和治疗模式的包装材料。
试剂盒一般包括列出了内容物的标签和/或使用说明书,以及带有使用说明的包装插页。一般也包括一套说明书。
在一些实施方案中,标签处于容器上或与容器相关联。在一个实施方案中,当构成标签的字母、数字或其他字符附着、模制或蚀刻在容器本身上时,标签处于容器上;当标签存在于也容纳容器的接纳器或载具内(例如作为包装插页)时,标签与容器相关联。在一个实施方案中,标签用来指示内容物将用于特定的治疗性应用。标签还指示内容物的使用说明,例如在本文所述方法中的使用说明。
实施例
提供这些实施例仅仅是为了说明性目的,而并非限制本文提供的权利要求书的范围。
实施例1.抗PD1-TGF-β阱的融合蛋白
合成抗PD1 VH和VL,并以IgG、scFv-Fc或scFv构型格式化,其中TGFβRII通过连接体(G4S)2在C末端融合。根据制造商的方案,在Expi293细胞中瞬时表达抗PD1阱融合蛋白。为了纯化融合蛋白,使用AKTA AVANT将转染的上清液加载到蛋白L柱上。用PBS洗柱,之后用IgG洗脱缓冲液(Pierce)洗脱蛋白质。然后使用PD-10柱(GE Healthcare)将洗脱的蛋白质缓冲液交换到PBS中。
表面等离子体共振
使用Biacore3000、CM5芯片、胺偶联试剂盒、10X HBS-P运行缓冲液和用于再生的甘氨酸(GE Healthcare)进行了表面等离子体共振(SPR)分析。对于抗PD1动力学测定,使用预先确定的配体固定程序将纯化的PD-1Fc融合蛋白固定在CM5芯片上。将纯化的抗PD1阱融合蛋白在HBS-P运行缓冲液中稀释至一定范围的终浓度,并注入。使其解离,随后是10mM甘氨酸(pH 1.5)的脉冲,以使芯片表面再生。
为了研究抗PD1阱融合蛋白是否可以同时结合PD1和TGFβRII,将100nM的抗PD1阱融合蛋白注入到固定有PD1的CM5芯片上3分钟,然后解离3分钟。随后,注入TGF-β的不同同种型以检查TGF-β与PD1键抗PD1阱融合蛋白的结合。
为了分析抗PD1-TGFβRII与TGF-β同种型的结合亲和力,将抗-PD 1-TGFβRII固定在CM5芯片上,然后将TGF-β蛋白在HBS-P运行缓冲液中稀释至一定范围的终浓度,并注入,以测量TGF-β与固定的抗PD1-TGFβRII的结合亲和力。表2中显示了抗PD1(VH6-VL5或VH7-VL6)-TGFβRII融合蛋白对固定的PD-1的亲和力(图6-8)。表3显示了TGF-β同种型对固定的抗PD-1IgG4抗体(VH6-VL5)-TGFβRII融合蛋白的亲和力。如观察到的,该融合蛋白以高亲和力与TGF-β1和TGF-β3结合,而以较低亲和力与TGF-β2结合。
表2.抗PD1-TGFβRII对固定的PD-1的亲和力
表3.TGF-β对固定的抗PD1(VH6-VL5)IgG4-TGFβRII的亲和力
使用Biacore 3000通过表面等离子体共振(SPR)分析评估了与TGFβRII融合的各种抗PD-1变体的结合亲和力。与人Fc区融合的PD-1被固定在传感器芯片CM5上。在溶液相中注入不同浓度的各种融合蛋白,并使用BIAevaluation分析数据以计算融合蛋白的KD。与单独的相应抗PD1相比,发现诸如抗PD1(VH6-VL5)-TGFβRII融合蛋白和抗PD1(VH7-VL6)-TGFβRII融合蛋白等变体与PD1具有相似的结合亲和力。
表5.与单独的相应抗PD1抗体相比,两种抗PD1-TGFβRII融合蛋白的亲和力
PD-1/PDL-1阻断试验
为了研究抗PD1-TGFβRII融合蛋白是否可以通过阻断PD-1/PD-L1相互作用来起抗PD1抗体的作用,使用来自Promega的PD-1/PD-L1阻断生物测定试剂盒。简言之,在测定开始前一天将PD-L1 aAPC/CHO-K1细胞解冻,并使其在37℃、5%CO
HEK-Blue TGF-β测定
为了检查抗PD1 TGFβRII融合蛋白中和TGF-β功能的效力,采用具有诱导的报道基因的稳定细胞系(HEK-Blue
表6和表7进一步列出了测试的各种融合蛋白构建体和对TGF-β1诱导的报道基因活性的抑制。
表6:各种融合构建体对TGF-β1诱导的报道基因活性的IC
表7:各种融合构建体的TGF-β1中和活性的总结
各种抗PD1 IgG4-TGFbRII融合构建体的PD1结合
将PD1-Fc抗原和参考抗原固定在Biacore CM5表面上。在PD1-Fc抗原和参考表面上系列注入6-12个重复的系列稀释浓度的各种抗PD1 IgG4-TGFbRII(表8)。对于1:1模型:具有传质的Langmuir,评价动力学数据。如表7中所观察到的,抗PD1 IgG4-TGFbRII与PD1-Fc抗原的结合亲和力(K
表8:PD1 IgG4-TGFbRII融合蛋白的PD1结合亲和力分析
各种抗PD1 IgG4-TGFβRII融合构建体的同时PD1和TGF-β1结合
为了研究具有不同连接体的抗PD1-TGFRII融合蛋白(表9)是否可以同时结合PD1和TGF-β1,制备并在Biacore实验中测试以下构建体。将PD1-Fc抗原固定在Biacore CM5芯片表面上。将抗PD1(VL5-VH6).IgG4-连接体-TGFbRII注射到传感器表面上,随后将TGFβ1注入到传感器表面之上。如图20所示,所有抗PD1(VL5-VH6).IgG4-连接体-TGFRII构建体同时与PD1-Fc抗原和TGFβ1两者结合。
表9:具有各种连接体的抗PD1(VL5-VH6).IgG4-连接体-TGFRII构建体
实施例2.抗PD1-TGF-β阱在体外培养中促进T细胞活化
为了评估抗PD1-TGF-β阱促进T细胞功能的能力,在体外使用通过Ficoll-Hypaque从白细胞分离术产物(根据机构审查委员会(IRB)批准的方案从正常健康供体获得)中纯化的外周血单核细胞(PBMC)。用细胞增殖染料CellTrace紫标记PBMC,并用抗CD3和抗CD28进行刺激。在孵育结束时,收集并储存上清液,直到用于IFN-γ释放测定。用荧光缀合的抗体标记细胞,以评估T细胞增殖。
与抗PD1或抗RSV对照抗体相比,在抗PD1-TGF-β阱的存在下刺激的PBMC以剂量依赖性方式显示出增强的增殖和IFN-γ产生,表明融合分子既能靶向PD-1/PD-L1途径又能靶向TGF-β途径(图9A-9C)。数据还证明了与单独的抗PD1相比,融合分子的累加增强作用。
在结直肠癌的体外模型中,与单独的抗PD1相比,抗PD1-TGF-RII表现出优异的抗肿瘤反应
在结直肠癌的体外模型中评价了抗PD1-TGFRII融合蛋白的有效性。从健康供体纯化的PBMC与癌细胞系HT-29共培养5天。在同种型对照、抗PD1或抗PD1-TGFRII融合蛋白的存在下,用抗CD3刺激细胞。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量。收集细胞,并通过流式细胞术分析T细胞上的靶标占据。通过Luminex按照制造商的方案对细胞培养上清液中的TGF-β1、TGF-β2和TGF-β3水平进行定量。
图9D显示,与抗PD1相似,抗PD1-TGFRII与CD8+T细胞表面上的PD1结合。如图9E所示,与抗PD1或同种型对照相比,抗PD1-TGFRII融合蛋白促进了更高水平的IFN-γ产生。图9H.即使在最低测试剂量下,在抗PD1-TGFRII处理后,HT-29PBMC共培养系统中产生的TGF-β1也被完全中和。图9I.在抗PD1-TGFRII处理后,HT-29PBMC共培养系统中产生的TGF-β2被部分中和。总体而言,该体外模型的结果显示出与抗PD1抗体相比,抗PD1-TGFRII融合蛋白的优异的抗肿瘤反应。
在头颈癌的体外模型中,与单独的抗PD1相比,抗PD1-TGFRII表现出优异的抗肿瘤反应
在头颈癌的体外模型中评价了抗PD1-TGFRII融合蛋白的有效性。从健康供体纯化的PBMC与癌细胞系Detroit 562共培养5天。在同种型对照、抗PD1或抗PD1-TGFRII融合蛋白的存在下,用抗CD3刺激细胞。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量。收集细胞,并通过流式细胞术分析T细胞上的靶标占据。通过Luminex按照制造商的方案对细胞培养上清液中的TGF-β1、TGF-β2和TGF-β3水平进行定量。
图9F显示,与抗PD1相似,抗PD1-TGFRII与CD8+T细胞表面上的PD1结合。如图9G所示,与抗PD1或同种型对照相比,抗PD1-TGFRII融合蛋白促进了更高水平的IFN-γ产生。图9J.即使在最低测试剂量下,在抗PD1-TGFRII处理后,Detroit 562PBMC共培养系统中产生的TGF-β1也被完全中和。图9K.在抗PD1-TGFRII处理后,Detroit 562PBMC共培养系统中产生的TGF-β2被部分中和。总体而言,该体外模型的结果显示出与抗PD1抗体相比,抗PD1-TGFRII融合蛋白的优异的抗肿瘤反应。
在结直肠癌的体外3D肿瘤球体模型中,与单独的抗PD1相比,抗PD1-TGF-RII表现出优异的抗肿瘤反应
在结直肠癌的体外3D肿瘤球体模型中评价了抗PD1-TGFRII融合蛋白的有效性。通过将结直肠癌细胞系HT-29和成纤维细胞系共培养来生成3D肿瘤球体。然后将从健康供体中纯化的PBMC添加到球体培养物中。在同种型对照、抗PD1或抗PD1-TGFRII融合蛋白的存在下,用抗CD3刺激细胞5天。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量。
如图9L所示,与抗PD1或同种型对照相比,抗PD1-TGFRII融合蛋白促进了更高水平的IFN-γ产生。总体而言,该3D肿瘤球体模型的结果显示出与抗PD1抗体相比,抗PD1-TGFRII融合蛋白的优异的抗肿瘤反应。
在头颈癌的体外3D肿瘤球体模型中,与单独的抗PD1相比,抗PD1-TGF-RII表现出优异的抗肿瘤反应
在结直肠癌的体外3D肿瘤球体模型中评价了抗PD1-TGFRII融合蛋白的有效性。通过将Detroit 562细胞系和成纤维细胞系共培养来生成3D肿瘤球体。然后将从健康供体中纯化的PBMC添加到球体培养物中。在同种型对照、抗PD1或抗PD1-TGFRII融合蛋白的存在下,用抗CD3刺激细胞5天。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量。
如图9M所示,与抗PD1或同种型对照相比,抗PD1-TGFRII融合蛋白促进了更高水平的IFN-γ产生。总体而言,该3D肿瘤球体模型的结果显示出与抗PD1抗体相比,抗PD1-TGFRII融合蛋白的优异的抗肿瘤反应。
实施例3.在体外在重组TGF-β1的存在下,与抗PD1相比,抗PD1-TGF-β阱具有优异的活性
为了评估抗PD1-TGF-β阱在具有高水平TGF-β的环境中促进T细胞功能的能力,在重组TGF-β1的存在下,如上所述刺激PBMC。在孵育结束时,收集并储存上清液,直到用于细胞因子分析。用荧光缀合的抗体标记细胞,并评估T细胞增殖和IL-2受体α或CD25的上调作为活化的读出。
重组TGF-β1抑制了T细胞的活化、增殖以及细胞因子和趋化因子的产生(图10和图11)。与抗PD1相比,该抑制被抗PD1-TGF-β1阱以剂量依赖性方式显著逆转。数据表明融合蛋白中和大量外源TGF-β1并破坏PD-1/PD-L1途径,从而增强T细胞免疫应答的能力。因此,融合分子对PD-1/PD-L1的阻断和对TGF-β的中和可能是一种有吸引力的免疫疗法,用于在检查点抑制剂治疗失败的癌症适应症中引发有效的抗肿瘤反应。
实施例4.在结直肠癌的人源化小鼠模型中,与单独的抗PD1相比,抗PD1-TGF-RII表现出优异的抗肿瘤反应
在人源化小鼠模型中评价了抗PD1-TGFRII融合蛋白抑制结直肠癌肿瘤的能力。向人源化NOG小鼠施用HT-29癌细胞。将荷瘤小鼠随机化,并每周两次施用抗PD1-TGFRII融合蛋白、单独的抗PD1抗体或同种型对照。如图12A所示,与抗PD1和同种型对照相比,抗PD1-TGFRII融合蛋白显著抑制了肿瘤生长。研究结束时对肿瘤的分析表明,抗PD1-TGFRII融合蛋白治疗的小鼠具有更高的肿瘤浸润淋巴细胞(TIL)频率。来自抗PD1-TGFRII治疗的小鼠的肿瘤的分析还显示更高的CD8+T细胞与调节性T细胞(Tregs)之比。
实施例5.在头颈癌的体外模型中,与单独的抗PD1相比,抗PD1-TGFRII表现出优异的抗肿瘤反应
在头颈癌的体外模型中评价了抗PD1-TGFRII融合蛋白的有效性。从健康供体纯化的PBMC与癌细胞系Detroit 562共培养48小时。在同种型对照、抗PD1或抗PD1-TGFRII融合蛋白的存在下,用抗CD3刺激细胞。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量。在培养期结束时通过离心收集来自共培养物的细胞沉淀物,并使用Qiagen RNAeasy micro试剂盒根据制造商的方案纯化RNA。使用纳米串(nanostring),根据制造商的说明,将纯化的RNA用于基因表达分析。使用Nanostring nCounter软件分析基因表达。
如图13A所示,与抗PD1或同种型对照相比,抗PD1-TGFRII融合蛋白促进了更高水平的IFN-γ产生。与抗PD1治疗相比,抗PD1-TGFRII融合蛋白治疗导致干扰素途径基因(图13B)以及细胞毒性基因(图13C)的显著上调,突出显示了在肿瘤的存在下与抗PD1抗体相比改善的细胞毒性功能。此外,抗PD1-TGFRII融合蛋白治疗导致与肿瘤转移和血管生成途径有关的基因的显著下调(图13D)。总体而言,该体外模型的结果显示出与抗PD1抗体相比,抗PD1-TGFRII融合蛋白的优异的抗肿瘤反应。
实施例6.在头颈癌的人源化小鼠模型中,与单独的抗PD1相比,抗PD1-TGFRII表现出优异的抗肿瘤反应
在人源化小鼠模型中评价了抗PD1-TGFRII融合蛋白抑制头颈癌的能力。向人源化NSG小鼠施用D562细胞系。将荷瘤小鼠随机化,并每周两次施用抗PD1-TGFRII融合蛋白、单独的抗PD1抗体或同种型对照。如图14所示,与抗PD1和同型对照相比,抗PD1-TGFRII融合蛋白显著抑制肿瘤生长(图14A)、改善荷瘤小鼠的存活率(图14B)并增加IFNγ水平(图14F)。用抗PD1-TGFRII融合蛋白治疗显著改善了肿瘤中CD8
实施例7.在原发性结直肠癌(CRC)患者样品中,与单独的抗PD1相比,抗PD1-TGFRII表现出优异的抗肿瘤反应
在原发性结直肠癌患者样品中评价了抗PD1-TGFRII融合蛋白的有效性。将来自CRC患者的PBMC与解离的肿瘤细胞共培养。在同种型对照、抗PD1或抗PD1-TGFRII融合蛋白的存在下刺激细胞。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量。通过Luminex按照制造商的方案评估了TGF-β水平。在培养期结束时通过离心收集来自共培养物的细胞沉淀物,并使用Qiagen RNAeasy micro试剂盒根据制造商的方案纯化RNA。使用纳米串(nanostring),根据制造商的说明,将纯化的RNA用于基因表达分析。使用Nanostring nCounter软件分析基因表达。
如图15A所示,与抗PD1或同种型对照相比,抗PD1-TGFRII融合蛋白促进了更高水平的IFN-γ产生。抗PD-TGFRII融合蛋白完全中和了由患者PBMC和解离的肿瘤细胞产生的TGF-β1(图15B)。与抗PD1治疗相比,抗PD1-TGFRII融合蛋白治疗导致细胞毒性基因的显著上调(图15C),突出显示了在肿瘤的存在下与抗PD1抗体相比改善的细胞毒性功能。此外,抗PD1-TGFRII融合蛋白治疗导致与肿瘤转移和血管生成途径有关的基因的显著下调(图15C)。如预期的那样,在抗PD1-TGFRII融合蛋白治疗组中,TGF-β信号传导途径被显著下调。总体而言,该患者来源的样品的结果显示出与抗PD1抗体相比,抗PD1-TGFRII融合蛋白的优异的抗肿瘤反应。
实施例8.在卵巢癌体外模型中,与抗PD-L1-TGFRII相比,抗PD1-TGFRII表现出增加的细胞毒性
在卵巢癌体外模型中,将抗PD1-TGFRII的有效性与抗PD-L1-TGFRII进行比较。从健康供体纯化的PBMC与癌细胞系SK-OV-3共培养。在同种型对照、抗PD1-TGFRII融合蛋白或抗PD-L1-TGFRII融合蛋白的存在下刺激免疫细胞。使用Incucyte活细胞分析系统评估了整个培养期间对肿瘤细胞的杀伤。
如图16所示,与抗PD-L1-TGFRII融合蛋白相比,抗PD1-TGFRII融合蛋白的存在表现出增加的对肿瘤细胞的杀伤。总体而言,与抗PD-L1-TGFRII相比,抗PD1-TGFRII表现出改善的细胞毒性。
实施例9.与联合抗PD1或单独的CAR-T相比,抗PD1-TGF-RII与CAR-T的组合显著增强3D肿瘤球体杀伤
在卵巢癌的体外3D肿瘤球体模型中评价了抗PD1-TGFRII融合蛋白与CAR-T细胞的组合。注意,在该实施例中,CAR-T细胞是指经工程改造以表达MUC16 CAR的T细胞。通过将卵巢癌细胞系SK-OV-3和成纤维细胞系共培养来生成3D肿瘤球体。然后在抗PD1-TGFRII融合蛋白或抗PD1的存在下,将CAR-T细胞添加至3D肿瘤球体培养物中。使用Incucyte活细胞分析系统评估了整个期间对3D肿瘤球体的靶标特异性杀伤。
如图17所示,与抗PD1和CAR-T细胞的组合或单独的CAR-T细胞相比,抗PD1-TGFRII融合蛋白与CAR-T细胞的组合显示出增加的对3-D肿瘤球体的杀伤。总体而言,该杀伤试验的结果表明,向CAR-T细胞添加抗PD-1-TGF-RII增强了CAR-T细胞的抗肿瘤反应。
实施例10.抗PD1-TGF-RII与CD33特异性CAR-T细胞的组合
将CD33 CAR-T细胞与MOLM-13AML肿瘤细胞系在细胞毒性测定中共培养,并在IncuCyte S3活细胞分析仪中孵育培养物。将抗PD1或抗PD1-TGFRII以等摩尔浓度添加至所示的培养物中。在培养开始时直接添加Sytox Green,以允许对培养物中即将死亡的细胞进行鉴定和计数。使用IncuCyte S3软件进行分析。呈现在图形中的数据是一式三份孔的平均值±SD,每孔扫描5次。如图18A所示,与CAR T细胞和抗PD1(VH6/VL5)组合或单独的CAR T细胞相比,抗PD1(VH6/VL5)-TGFRII融合蛋白与CD33 CAR T细胞的组合显示出增加的杀伤。
如图18B所示,与CAR-T细胞和抗PD1组合或单独的CAR-T细胞相比,抗PD1(VH7/VL6)-TGFRII融合蛋白与CD33 CAR-T细胞的组合显示出增加的杀伤。总体而言,这些细胞毒性测定的结果证明,抗PD1(VH6/VL5)-TGFRII融合蛋白和抗PD1(VH7/VL6)-TGFRII融合蛋白增强CAR-T细胞的抗肿瘤免疫应答。
实施例11.抗PD1-TGF-RII与CD19 CAR-T细胞的组合增强肿瘤细胞杀伤
在抗PD1-TGFRII融合蛋白或抗PD1的存在下,将CD19 CAR-T细胞与在细胞表面上表达CD19抗原的肿瘤细胞共培养。与抗PD1和CAR-T细胞的组合或单独的CAR-T细胞相比,抗PD1-TGFRII融合蛋白与CD19 CAR-T细胞的组合显示出肿瘤细胞杀伤增加。
实施例12.抗PD1-TGF-RII与BCMA特异性CAR-T的组合改善CAR-T细胞的细胞毒性潜力
在存在或不存在抗PD1-TGFRII融合蛋白或抗PD1的情况下,将BCMA特异性CAR-T细胞与表达BCMA抗原的肿瘤细胞系共培养。与抗PD1和CAR-T细胞的组合或单独的CAR-T细胞相比,抗PD1-TGFRII融合蛋白与CAR-T细胞的组合改善CAR-T细胞的细胞毒性潜力。
实施例13.抗PD1-TGF-RII与PSMA特异性CAR-T的组合增强CAR-T细胞对肿瘤细胞的杀伤
在存在或不存在抗PD1-TGFRII融合蛋白或抗PD1的情况下,将PSMA特异性CAR-T细胞与表达PSMA抗原的肿瘤细胞系共培养。与抗PD1和CAR-T细胞的组合或单独的CAR-T细胞相比,抗PD1-TGFRII融合蛋白与CAR-T细胞的组合改善CAR-T细胞的细胞毒性。
实施例14.抗PD1-TGFRII改善NK细胞靶细胞裂解
在卵巢癌的体外模型中评估了抗PD1(VH7/VL6)-TGFRII和抗PD1(VH6/VL5)-TGFRII促进自然杀伤细胞介导的肿瘤细胞杀伤的能力。从健康供体中纯化效应NK细胞,并在抗RSV-TFGBRII(对照)、抗PD1(VH6/VL5)和抗PD1(VH7/VL6)、抗PD1(VH7/VL6)-TGFRII和抗PD1(VH6/VL5)-TGFRII的存在下,以不同的E:T细胞比与SK-OV-3靶细胞系共培养过夜。将碘化丙锭添加到培养物中以鉴定死细胞,并使用Nexcelom Celigo测定细胞死亡。如在图19A和图19B中所观察到的,与单独的抗PD1或TGFBRII(抗RSV-TGFBRII)相比,抗PD1-TGFBRII融合蛋白促进了更高的肿瘤细胞杀伤。
实施例15:抗PD1-ADA2的融合蛋白
合成抗PD1 VH和VL,并以IgG、scFv-Fc或scFv构型格式化,其中腺苷脱氨酶2(ADA2)通过连接体(G4S)2在C末端融合。根据制造商的方案,在Expi293细胞中瞬时表达抗PD1-腺苷脱氨酶融合蛋白,并使用AKTA AVANT系统进行纯化。
表面等离子体共振
使用Biacore3000、CM5芯片、胺偶联试剂盒、10X HBS-P运行缓冲液和甘氨酸进行了表面等离子体共振(SPR)分析。对于抗PD1动力学测定,使用预先确定的配体固定程序将重组PD-1Fc蛋白固定在芯片上。将纯化的抗PD1-腺苷脱氨酶融合蛋白在运行缓冲液中稀释至一定范围的终浓度,并注入。使其解离,随后使芯片表面再生。
表10.抗PD1-ADA2对固定的PD1的亲和力
PD-1/PDL-1阻断试验
为了研究抗PD1-ADA2融合蛋白是否可以通过阻断PD-1/PD-L1相互作用来起抗PD1抗体的作用,如实施例1所述使用来自Promega的PD-1/PD-L1阻断生物测定试剂盒。使用这些值作为PD-1/PD-L1阻断效力的量度(图21)。
ADA酶活性测定
为了确定抗PD1 ADA2融合蛋白的酶活性,根据制造商的建议使用比色腺苷脱氨酶(ADA)活性试剂盒(Abcam)。选择2分钟和30分钟时间点来计算随时间变化的ADA酶活性。如图22所示,抗PD1-ADA2融合蛋白随时间表现出酶活性。
实施例16:抗PD1 IgG4 S108P-wtADA2和-mutADA2的PD1结合亲和力分析
将PD1-Fc抗原和参照物固定在Biacore CM5表面上,然后将6-12个重复的系列稀释浓度的抗PD1 IgG4 S108P-wtADA2和-mutADA2系列注入到PD1-Fc抗原和参照物表面上。对于1:1模型:具有传质的Langmuir,评价动力学数据。结果如表11所示。
表11:抗PD1(VH6/VL5)和(VH7/VL6)IgG4 S108P和抗PD1-wtADA2和-mutADA2的结合亲和力
实施例17:抗PD1-ADA2融合蛋白有效地阻断PD-L1/PD1信号传导
使用实施例12中提到的报道生物测定来评价抗PD1-ADA2融合蛋白阻断PD1/PD-L1相互作用的能力。
如图23A-23B所示,抗PD1(VH7/VL6)-wtADA2和–mut7ADA2、抗PD1(VH6/VL5)-wtADA2和–mut7ADA2以相似的效力阻断PD1/PD-L1相互作用。
实施例18:ADA2酶活性
在实施例12中提到的体外ADA酶活性测定中评价抗PD1-ADA2融合蛋白酶促降解腺苷的能力。
如图24A-24F所示,在较低腺苷浓度时,与wtADA2相比,mut7ADA2具有较高的酶活性。
实施例19:抗PD1-mut7-ADA2具有比抗PD1-wtADA2更高的酶活性
使用荧光ADA2酶测定试剂盒测量了抗PD1(VH6/VL5)-wtADA2和抗PD1(VH6/VL5)-mut7ADA2的Michaelis Menten常数(Km)。如图25所观察到的,与抗PD1-wtADA2相比,抗PD1-mut7ADA2具有更高的Km。
实施例20:抗PD1-wtADA2逆转腺苷介导的T细胞增殖抑制
使用正常供体PBMC在体外评估了抗PD1-wtADA2促进T细胞增殖的能力。在浓度逐渐增加的抗PD1(VH6/VL5)-wtADA2和抗PD1(VH6/VL5)的存在下,对在含有1mM腺苷的培养基中共培养的CellTrace紫标记的PBMC进行刺激。收集上清液用于细胞因子分析。通过流式细胞术测定细胞的T细胞增殖。数据显示,与抗PD1(VH6/VL5)或同种型对照相比,抗PD1(VH6/VL5)-wtADA2显著逆转了腺苷介导的CD4
在浓度逐渐增加的抗D1(VH7/VL6)、抗PD1(VH7/VL6)-wtADA2或同型对照的存在下,通过在含有腺苷的培养基中刺激PBMC,进一步评估了抗PD1(VH7/VL6)-wtADA2促进T细胞功能的能力。收集培养物上清液并测定IFNγ的产生。图26E显示,与抗PD1或同种型对照相比,抗PD1(VH7/VL6)-wtADA2处理诱导显著更多的IFN-γ。
实施例21:WtADA2和mutADA2显示出相当的对腺苷介导的T细胞增殖抑制的逆转
在浓度逐渐增加的抗PD1-wtADA2、抗PD1-mutADA2、抗RSV-wtADA2和抗RSV-mutADA2的存在下,通过在含有腺苷的培养基中刺激标记的PBMC来评估wtADA2和mutADA2逆转腺苷介导的T细胞增殖抑制的有效性。将细胞染色,然后通过流式细胞术分析增殖。wtADA2和mutADA融合蛋白在逆转腺苷介导的对CD4 T细胞(图27A)和CD8T细胞(图27B)的抑制方面均同样有效。
实施例22:抗PD1(VH6/VL5)-ADA2对PD1-PDL1相互作用的阻断
使用实施例12中提到的报道生物测定来评价各种形式的抗PD1-ADA2融合蛋白阻断PD1/PD-L1相互作用的能力。
如图28所示,通过PD1/PD-L1阻断生物测定所测量的,抗PD1(VH6/VL5)scFv-Fc-ADA2、hIgG1-ADA2和scFv-ADA2均显示出功能活性。
实施例23:抗PD1-ADA2-scFv-Fc的ADA酶活性
在实施例12中提到的体外ADA酶活性测定中评价各种形式的抗PD1-ADA2融合蛋白酶促降解腺苷的能力。
如图29所示,抗PD1(VH7/VL6)scFv-Fc-ADA2和(VH6/VL5)scFv-Fc-ADA2具有与对照相当的类似的ADA2酶活性。
实施例24:各种抗PD1-ADA2和抗PD1-mutADA2构建体的ADA酶活性
如上所述进行ADA酶活性测定。如图30所示,在10nM腺苷时,与wtADA2相比,mutADA2具有更高的酶活性。
实施例25:在原发性CRC患者肿瘤中,抗PD1-ADA2促进IFN-γ的产生和肿瘤浸润淋巴细胞(TIL)的增殖
将从CRC患者中纯化的PBMC与匹配的解离肿瘤细胞共培养。在同种型对照、抗PD1(VH6/VL5)或抗PD1(VH6/VL5)-wtADA2融合蛋白的存在下,用抗CD3和抗CD28刺激CellTrace紫标记的细胞。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量,并评估细胞的T细胞增殖。对于基因表达分析,通过离心收集细胞沉淀物,并使用QiagenRNAeasy micro试剂盒根据制造商的方案纯化RNA。使用纳米串(nanostring),根据制造商的说明,将纯化的RNA用于基因表达分析。使用Nanostring nCounter软件分析基因表达。
如图31A所示,与抗PD1或同种型对照相比,抗PD1-wtADA2融合蛋白促进了更高水平的IFN-γ产生和T细胞增殖(图31B)。与抗PD1治疗相比,抗PD1-wtADA2融合蛋白治疗导致IFN-γ信号传导和趋化因子信号传导基因以及细胞毒性基因的显著上调(图31C),突出显示了T细胞在肿瘤的存在下与抗PD1抗体相比改善的细胞毒性功能。
实施例26:抗PD1-wtADA2融合蛋白在肺癌的人源化小鼠模型中的作用
向用外周血单核细胞人源化的NSG小鼠在胰腺内(正位注射)接种胰腺癌细胞系Panc.08.fLuc.eGFP。每周测量小鼠体重,并在第38天研究结束时测量肿瘤重量。将小鼠随机分入治疗组,并每周两次用HBSS(媒介物对照)、抗PD1(VH6/VL5)和抗PD1(VH6/VL5)-wtADA2处理。如图32中可见,与用抗PD1或同型对照处理的小鼠相比,用抗PD-wtADA2处理的小鼠具有显著更小的肿瘤。
如图32中可见,与用抗PD1或同型对照处理的小鼠相比,用抗PD-wtADA2处理的小鼠具有显著更小的肿瘤。
实施例27:抗PD1(VH6/VL5)-wtADA2处理下调腺苷途径、血管生成并且上调细胞毒性和细胞因子基因
将从CRC患者中纯化的PBMC与匹配的解离肿瘤细胞共培养。在同种型对照、抗PD1(VH6/VL5)或抗PD1(VH6/VL5)-wtADA2融合蛋白的存在下,用抗CD3和抗CD28刺激CellTrace紫标记的细胞。收集培养物上清液,并按照制造商的方案通过MSD对IFN-γ水平进行定量,并评估细胞的T细胞增殖。对于基因表达分析,重复培养,通过离心收集细胞沉淀物,并使用Qiagen RNAeasy micro试剂盒根据制造商的方案纯化RNA。使用纳米串(nanostring),根据制造商的说明,将纯化的RNA用于基因表达分析。使用Nanostring nCounter软件分析基因表达。
与抗PD1或同种型对照相比,抗PD1-wtADA2融合蛋白促进了更高水平的IFN-γ产生和T细胞增殖。与抗PD1处理相比,抗PD1-wtADA2融合蛋白处理还导致IFN-γ信号传导和趋化因子信号传导基因以及细胞毒性基因的显著上调(数据未示出),突出显示了T细胞在肿瘤的存在下与抗PD1抗体相比改善的细胞毒性功能。
序列
本文提供了本文提供的实施方案中包括的某些序列的代表性列表。
表4.非限制性示例性多肽和核苷酸序列
表12示例性抗TGFβVH和VL序列
表12提供了用于本文所述的抗PD1融合蛋白的示例性TGFβ受体序列。在举例说明具有例如TGFβRII ECD的融合蛋白的任何实施方案中,可以代替地使用抗TGFβ抗体(例如,scFv、Fab)。
表13示例性TGFβ1抑制肽和核苷酸序列
表13提供了用于本文所述的抗PD1融合蛋白的示例性TGFβ1抑制肽。在举例说明具有例如TGFβRII ECD的融合蛋白的任何实施方案中,可以代替地使用TGFβ1抑制肽。
表14.示例性ADA2序列
表14提供了用于本文所述的抗PD1融合蛋白的示例性ADA2序列。在举例说明具有例如TGFβRII ECD的融合蛋白的任何实施方案中,可以代替地使用ADA2序列。
表15.示例性抗PD1 VH/VL对
表15提供了用于本文所述的融合蛋白的示例性抗PD1 VH/VL对。
表16示例性抗PD1-TGFbRII ECD融合蛋白序列
表16提供了示例性抗PD1-TGFbRII ECD融合蛋白序列。抗PD1融合蛋白包含编码轻链的抗PD1可变区的序列和编码重链的抗PD1可变区的序列。ECD代表胞外域。“wt”是指野生型序列,而“mut”是指突变序列。
表17示例性抗PD1-ADA2融合蛋白序列
表17提供了示例性抗PD1-ADA2融合蛋白序列抗PD1融合蛋白包含编码轻链的抗PD1可变区的序列和编码重链的抗PD1可变区的序列。“wt”是指野生型序列,而“mut”是指突变序列
- 融合构建体及其使用方法
- 溶解结构域融合构建体及其制备和使用方法
