将干细胞分化为多巴胺能祖细胞的方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及将干细胞分化为腹侧中脑多巴胺能祖细胞和中脑多巴胺能神经元的方法及其组合物、试剂盒和用途。
背景技术
神经退行性疾病诸如帕金森氏病、阿尔茨海默氏病和亨廷顿氏病是导致神经元群体的进行性退化和/或死亡的不可治愈的并使人衰弱的病症。帕金森氏病(PD)与中脑一部分黑质致密部(SNpc)中多巴胺能(DA)神经元的进行性丧失有关,因此主要影响运动系统,导致动作迟缓、僵硬和静息性震颤。
使用细胞移植治疗神经退行性疾病始于20世纪80年代后期的临床试验,其中将来自胎儿大脑的多巴胺神经元祖细胞移植到患有帕金森氏病的个体中。这些试验表明,移植的细胞可以恢复丢失的多巴胺神经传递,并逆转运动缺陷。(
已经进行了广泛的发展以试图控制多能干细胞分化为中脑多巴胺能(mDA)神经元。Kirkeby,A.等人.《细胞报道(Cell Rep.)》1,703–714(2012),Kriks,S.等人《自然(Nature)》480,547–551(2011),和Marton,R.M.&Ioannidis,J.P.A.《干细胞转化医学(StemCells Transl.Med.)》8,366–374(2019))。移植的hPSC衍生的制剂在动物PD模型中显示出功能功效,并且使用同种异体ESCs或自体iPSCs作为起始材料的临床试验已经开始或计划在不久的将来进行(Barker,R.A.,Parmar,M.,Studer,L.&Takahashi,J.《细胞干细胞(CellStem Cell)》21,569–573(2017))。
尽管取得了这些进步,但仍然需要增强分化方案的稳健性,以便在使用新的hPSC线时提高一致性并最大限度地减少批次间的调整(Nolbrant,S.,Heuer,A.,Parmar,M.&Kirkeby,A.《自然实验手册(Nat.Protoc.)》12,1962–1979(2017)。当考虑将患者特异性自体iPSC系或大量人类白细胞抗原(HLA)匹配的供体iPSC用于常规临床实践时,这一点尤其重要,因为从免疫学角度来看,免疫学匹配的iPSC优于同种异体ESC系(Wang,S.等人《细胞发现(Cell Discov.)》1,1–11(2015)和Morizane,A.等人《自然通讯(Nat.Commun.)》8,1–12(2017))。
在培养物中产生hPSC衍生的功能性人类神经元所需的延长时间提供了另一个挑战和成本负担,这阻碍了hPSC衍生的细胞在疾病建模或高通量药物开发中的常规应用(Qi,Y.等人《自然生物技术(Nat.Biotechnol.)》35,154–163(2017))。就所需细胞类型的产率而言,用于产生mDA神经元的方案已逐步得到改进,但自2004年描述第一个基于hPSC的方案以来,在培养中获得成熟mDA神经元的时间基本上保持不变(Marton,R.M.&Ioannidis,J.P.A.(2019))。据报道,产生成熟的人类mDA神经元需要(通常需要)60天或更长时间,这些神经元在培养中表现出所需的电生理特征(Niclis,J.C.等人《干细胞转化医学(Stem CellsTransl.Med.)》6,937–948(2017)和Riessland,M.等人《细胞干细胞》25,514-530.e8(2019)),它可以反映细胞达到功能状态所需的最短时间。然而,单细胞分析表明,相对于hPSC衍生的mDA神经元的体内对应物,其动力学更慢,且发育进程控制更不严格,(LaManno,G.等人《细胞(Cell)》167,566-580.e19(2016))这增加了当前方法在分化时间方面尚未优化的可能性。
目前的mDA神经元方案利用WNT信号传导或WNT和FGF信号传导的定时激活,以通过模拟在中脑(MB)与后脑(HB)之间的边界处由峡部组织者产生的WNT1和FGF8的模式活性来指定中脑(MB)特征(Tao,Y.&Zhang,S.-C.《细胞干细胞》19,573–586(2016))。糖原合成酶激酶3β(GSK3β)抑制剂CHIR99021用于激活WNT通路,但CHIR99021对前后(AP)身份的规范是高度浓度敏感的(Lu,J;Zhong,等人S.《自然生物技术(Nat.Biotechnol.)》34,89–95(2015))。这影响了一致性,并且需要非常小心地各个hPSC系进行滴定。此外,在大鼠PD模型中对大量基于CHIR99021的移植实验的评估揭示了显著的实验间变异性,并且移植物不良结果与移植前制剂中间脑基因的表达相关,这表明即使在CHIR99021的优化滴定后,细胞的区域规范也不精确(Kirkeby,A.等人《细胞干细胞》20,135–148(2017))。
因此,需要替代方法来更有效地从干细胞衍生mDA神经元。
发明内容
在此背景下,发明人惊奇地发现了一种新的基于视黄酸(RA)的方法,用于以高产率稳健且快速地衍生人类mDA神经元。不同于将hPSC分化成多巴胺能神经元的其他方法,所述方法可能是冗长的、可变的,并且需要对单个hPSC系进行大量的方案调整(并且产生生物学上不相关的表型),本发明允许干细胞被强有力地分化成腹侧中脑多巴胺能祖细胞,然后可将其用于移植,或者以增加的速度和前所未有的可扩展性进一步分化成成熟的真正的中脑多巴胺能神经元,同时自始至终保持适当的中脑表型。
一方面,本发明提供了一种将干细胞分化成腹侧中脑多巴胺能祖细胞,该方法包含使多个干细胞与有效量的至少一种视黄酸(RA)信号激活剂接触,以及在足以引起干细胞分化成包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养干细胞。
“干细胞”包括在胚胎和成人组织中发现的具有自我更新和分化成不同细胞类型能力的细胞。干细胞根据其产生多种细胞谱系的潜力分为全能、多能、多能力或单能。下面讨论本发明上下文中优选的干细胞。
本发明的方法的“多个干细胞”可以包含至少或约10
通过“分化”和“分化”,我们包括一个过程,其中非特化或特化程度较低(未定型)的干细胞,诸如多能干细胞(PS)或诱导多能干细胞(iPS),获得具有特定目的和功能的特化细胞(终末分化的细胞)的表型特征,诸如神经细胞干细胞的分化可以通过本领域公知的方法来确定,包括分析与确定分化状态的细胞相关联的细胞标志物或形态学特征。
因此,在本发明的上下文中,“将干细胞分化”包括诱导干细胞产生具有不同于该干细胞的特征的细胞,诸如转录组和/或表型(即一个蛋白质(诸如叉头盒蛋白A2(FOXA2))或一组蛋白质(诸如叉头盒蛋白A2(FOXA2)和LIM同源盒转录因子1α(LMX1A))表达的变化)。
术语“中脑(MB)”,也称为“中脑”,包括前脑(FB)(前部)与后脑(HB)(后部)之间的发育中的脊椎动物大脑区域。中脑包括顶盖、被盖和黑质(SN),并且由许多分子和功能不同类型的神经元构成。中脑在运动移动,特别是眼睛的移动以及听觉和视觉处理中发挥重要作用。
如本文所用,术语“背侧”和“腹侧”用作动物体内位置的解剖学术语,本文背侧是指身体的“后端”,而腹侧是指“前端”。术语“背腹轴”、“背腹轴”或“D-V轴”是指通过连接这些点获得的假想线。如本文所用,术语“前部”、“后部”、“头侧和“尾侧”用作动物体内位置的解剖学术语,其中前部是指身体的“头端”,而后部是指与前部相反的极性(“尾端”)。术语“前部”和“头侧”可互换使用,并且术语“后部”和“尾部”可互换使用。术语“前后轴”、“前-后轴”、“前-后轴”或“A-P轴”是指连接这两点的假想线。
通过“多巴胺能”(DA)神经元包括中枢神经系统中合成神经递质多巴胺(DA)的一组神经元。中脑或中脑多巴胺能神经元(mDA)发育分为三个不同的核:(i)黑质致密部(A9组),主要受帕金森氏病影响,(ii)腹侧被盖区(A10组),和(iii)红核后区(A8组)。SNpc和VTA DA神经元表示哺乳动物大脑中九个主要DA神经元群中的两个,这是通过酪氨酸羟化酶(TH)染色鉴定的,该酶催化多巴胺合成中的限速步骤。
mDA神经元的一个独特特征是它们起源于MB腹侧中线的最初非神经元底板(FP)细胞,并且祖细胞必须在分化为神经元之前获得神经元潜能。
“祖细胞”包括部分分化的细胞。术语“祖细胞”和“祖细胞”在本文中可以互换使用。祖细胞具有分化成多种神经亚型的能力;尤其是多种多巴胺能神经元亚型,在培养适当的因子诸如本文所述的那些后。在本发明的上下文中,祖细胞是神经祖细胞,特别是腹侧中脑多巴胺能祖细胞,其被引发分化成DA神经元,诸如A9或A10神经元。
应当理解,神经干细胞(NSCs)的非干细胞后代被称为神经祖细胞。神经祖细胞具有增殖和分化成多于一种神经元细胞类型的能力。神经祖细胞的一个显著特征是,与干细胞不同,它具有有限的增殖能力并且不表现出自我更新。
在胎儿发育期间,DA神经元的祖细胞在发育中的中脑的腹侧神经管中形成。来自所谓底板区域的祖细胞的特征在于包括LMX1A、FOXA2和OTX2在内的转录因子的表达。这些细胞产生DA SNpc神经元(A9组)和DA VTA神经元(A10组)。如本文所用,这些祖细胞被称为“腹侧中脑多巴胺能祖细胞”。腹侧中脑多巴胺能祖细胞不单独或组合表达NKX2.1、BARHL1、BARHL2、PITX2、NKX2.2、PHOX2B、PHOX2A和NKX6.1,而是定义在腹侧HB中产生丘脑下神经元、GABA能中脑神经元、颅运动神经元(Mn)和血清素能神经元(5HTNs)的祖细胞。腹侧中脑多巴胺能祖细胞具有分化成成熟的功能性多巴胺能(DA)神经元的能力。
腹侧中脑祖细胞可以与间脑丘脑下神经元祖细胞相区别,后者也表达LMX1A、FOXA2和OTX2。然而,间脑丘脑下神经元祖细胞也表达BARHL1、BARHL2、PITX2和NKX2.1,这将它们与腹侧中脑祖细胞区分开来。
本发明人已经表明,这些正确模式化的祖细胞在移植到成年大鼠中时产生成熟的和功能性中脑DA神经元(参见实施例和图5a-c及图11b(补充图5b))。
使细胞与化合物(例如,一种或多种抑制剂、激活剂和/或诱导剂)“接触”包括提供与细胞物理接近的化合物,以便产生(获得)“接触的”细胞,换句话说,在允许该一个细胞或多个细胞接近该化合物的位置提供该化合物。可以使用任何合适的方法来实现接触。例如,可以通过将浓缩形式的化合物添加到一个细胞或细胞群中,例如在细胞培养的情况下,以达到所需的浓度来实现接触。也可以通过包括化合物作为配制培养基的成分来实现接触。
“有效量”包括足以实现所需生理和/或治疗效果的量。在用于将干细胞分化为腹侧中脑多巴胺能祖细胞的方法的上下文中,物质的有效量是能够对神经干细胞指定中脑同一性的物质的任何量和/或足以将多能干细胞的命运导向具有中脑同一性的多巴胺能神经元的量。确定“有效量”的方法是本领域技术人员熟知的,并且通常包括滴定物质的剂量直至达到所需的效果。
“神经干细胞(NSC)”包括能够增殖和自我更新,并产生子代细胞的多能细胞,这些子代细胞最终分化为中枢神经系统的三种主要细胞类型:神经元、星形胶质细胞和少突胶质细胞。相比之下,神经祖细胞具有更有限的发育潜能和有限的增殖能力。此外,它们只能分化成更有限种类的细胞类型(即,已经成为致力于产生仅一类神经成分的谱系的细胞,例如,神经胶质细胞对神经元)。
“激活剂”包括增加、诱导、刺激、激活、促进或增强分子或通路的信号传导功能(例如,RA信号传导等)的激活的化合物。与没有加入激活剂或加入激活剂之前的通路的活性相比,激活剂可以使要被激活的通路增强或增加10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多。
应当理解,本文使用的术语“视黄酸(RA)信号传导激活剂”包括能够增强或取代视黄酸(RA)信号传导的任何化合物或分子。这种激活剂可能参与视黄酸下游或上游的信号传导,或者是信号传导通路的小分子激动剂。本文提供视黄酸(RA)信号传导激活剂的非限制性列表,包括视黄酸衍生物或其激动剂。
视黄酸及其衍生物,特别是9-顺式视黄酸(9cRA)、13-顺式视黄酸(13cRA)和全反式视黄酸(ATRA),是一组来源于维生素A(视黄醇)的结构简单的脂质分子,其反式激活许多基因,并对所有脊椎动物体内和体外的细胞生长、分化和体内平衡产生多效性影响。它们通过结合至两类核受体视黄酸受体(RAR)和类视黄醇X受体(RXR)来调节靶基因表达。ATRA和13cRA只能有效地与RAR结合,但9cRA是核受体RAR和RXR的配体。本发明考虑了任何可以模拟视黄酸作用的分子。技术人员可以确定一种分子是否是视黄酸(RA)信号传导激活剂,例如,通过免疫细胞化学、qPCR、免疫印迹、RNA-seq或本领域已知的其他生物化学技术分析RA表达的靶基因。靶基因可能包括CYP26A1、RARA、RARB、MEIS2、HOXA1、CRABP1、CRABP2。
在一个实施方案中,至少一种视黄酸(RA)信号传导激活剂的有效量是足以提供在培养基中约10-800nM的最终浓度的量。在一个具体实施方案中,至少一种视黄酸(RA)信号传导激活剂的有效量是足以提供在培养基中约100-800nM的最终浓度的量。在一个具体实施方案中,至少一种视黄酸(RA)信号传导激活剂的有效量是足以提供在培养基中约200-800nM的最终浓度的量。在一个具体实施方案中,至少一种视黄酸(RA)信号传导激活剂的有效量是足以提供在培养基中约200-500nM的最终浓度的量。在一个具体实施方案中,至少一种视黄酸(RA)信号传导激活剂的有效量是足以提供在培养基中约200-400nM的最终浓度的量。在一个具体实施方案中,至少一种视黄酸(RA)信号传导激活剂的有效量是足以提供在培养基中约300nM的最终浓度的量。激活剂根据其性质可以在不同的浓度范围内起作用。例如,一个不太有效的因素可能只在μM浓度下显示出效果。相反,不能被CYP26酶降解的RA-类似物EC23可以在低浓度(10nM)下使干细胞具有vMB-身份,如图9c(补充图3c)所示。
应当理解,“至少一种视黄酸(RA)信号传导激活剂的有效量”可以根据RA信号传导激活剂的特性而变化。例如,当RA信号传导激活剂是ATRA时,视黄酸的有效量可以是足以提供在培养基中约100-800nM的最终浓度的量。在一个具体实施方案中,ATRA的有效量可以是足以提供在培养基中约200-500nM的最终浓度的量。在一个具体实施方案中,ATRA的有效量可以是提供足以在培养基中约200-400nM的最终浓度的量。在一个具体实施方案中,ATRA的有效量可以是足以提供在培养基中约300nM的最终浓度的量。
当RA信号传导激活剂是除ATRA以外的分子时,应当理解,该分子的有效量将是产生与有效量的ATRA(例如上一段中描述的任何有效量)相同的效果(即指定中脑身份)的量。例如,当RA信号传导激活剂是13-顺式-RA时,13-顺式-RA的有效量将是产生与有效量的ATRA(例如上一段中描述的任何有效量)相同的效果(即指定中脑身份)的13-顺式-RA的量。如本发明人在实施例中所证明的,将细胞暴露于500nM的ATRA类似物(9-顺式RA、13-顺式RA和异生素RA类似物他扎罗汀酸(TA))48小时,通过强加LMX1A+/NKX2.1-vMB身份来模拟ATRA的模式化活性(图3h和图9b(补充图3b))。
与ATRA、9-顺式RA、13-顺式RA和他扎罗汀酸(TA)不同,合成RA类似物EC23更稳定,因为它能抵抗CYP26介导的氧化(Lopez-Real,R.E.et al.J.Anat.224,392–411(2014))。因此,当细胞暴露于200nM的EC23时,细胞获得了后脑身份。滴定实验表明,EC23可以将多能干细胞分化为腹侧中脑多巴胺能祖细胞,但这需要浓度降低约20倍和细胞处理仅24小时(图9c(补充图3c))。因此,本领域技术人员可以进行本文所述或本领域已知的滴定实验,以确定将干细胞分化为腹侧中脑多巴胺能祖细胞所需要的任何给定RA信号传导激活剂的有效量。
如本文所用,术语“群体”是指一组细胞。在特定实施例中,所述细胞组可以包含至少两个细胞,诸如至少或约10
群体可以是包含一种细胞类型的纯群体,诸如神经元细胞群或未分化的多能干细胞群。另选地,群体可包含多于一种细胞类型,例如混合的细胞群。
通过“在足以引起干细胞分化为包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养干细胞”包含在至少一种RA信号传导激活剂存在下,在干细胞能够分化成腹侧中脑多巴胺能祖细胞的条件下培养干细胞的意义。可以使用任何合适的条件。例如,干细胞可以暴露于一种或多种试剂和/或环境条件,当细胞存在至少一种RA信号传导激活剂时,这些试剂和/或环境条件引导多个干细胞分化为腹侧中脑多巴胺能祖细胞。还包括促进细胞存活力所必需的条件。这种条件在培养干细胞的领域中是熟知的,并且应当理解,技术人员将能够针对给定的干细胞类型选择合适的条件。
这种培养条件可以包括模拟分级模式信号的那些条件,其沿着神经管的前后(AP)和背腹(DV)轴强加NSCs的独特区域身份。例如,这种条件可以包括能够对干细胞强加腹侧区域规范的试剂。这可以通过一种或多种激活豪猪通路信号传导的试剂来实现。
响应于分级模式信号,在神经管的不同位置产生不同类型的神经元,这些分级模式信号沿着神经管的前后(AP)和背腹(DV)轴对NSCs强加独特的区域身份。在神经发育和hPSC培养中,NSC在没有模式信号的情况下默认获得皮质前脑(FB)身份。WNT、FGF和视黄酸(RA)是三种主要的信号传导通路,涉及对NSCs强加更多的后中脑(MB)、后脑(HB)或脊髓(SC)特征。分级的索尼克豪猪(SHH)和BMP信号依次沿着神经管的DV轴对NSCs强加不同的身份。由转录因子LMX1A、LMX1B、OTX2和FOXA2的共表达定义的mDA神经元祖细胞位于发育中的MB的腹侧中线处。当前基于hPSC的mDA神经元方案在技术上是相关的,并利用WNT信号传导的定时激活或WNT和FGF信号传导的组合来指定MB特征和SHH信号传导以诱导NSCs的腹侧mDA神经元祖细胞身份。WNT和FGF在这些方案中的应用被用于试图模拟峡部的WNT1和FGF8信号传导,该峡部是在MB与HB之间的边界处建立的次级组织者中心。
RA信号传导在HB和脊髓的模式化中的作用已经被很好地确立,并且RA信号传导通常用于基于hPSC的方案中,以用于在神经管中产生具有尾侧起源的神经元,诸如躯体运动神经元。在发育的胚胎中,RA信号传导从后到前的梯度被认为到达HB的头侧部分,但不进入注定成为MB或FB的更多头侧区域。由于RA强烈的尾状核化作用,推测RA信号传导与具有头侧起源的神经元(包括mDA神经元)的产生不相容。事实上,许多当前最先进的基于hPSC的mDA神经元方案因此在其各自的分化程序中主动排除RA或RA的前体维生素A(Kirkeby etal.,2017;Nolbrant et al.,2017;Monzel et al.,2017;Jovanic et al.,2018;Lehnenet al.,2017)。
在一个优选的实施方案中,至少一种视黄酸(RA)信号传导激活剂有效地将腹侧中脑身份指定给神经干细胞。
例如,当在足以引起干细胞分化成包含腹侧中脑多巴胺能祖细胞的细胞群的条件下时,至少一种激活剂有效地将腹侧中脑身份指定给神经干细胞。
本文所用术语“腹侧中脑身份”包括神经祖细胞在体外表达对中脑特异的标志物,而不表达对脑的其他区域祖细胞(即前脑或后脑)特异的标志物。腹侧中脑祖细胞表达LMX1A、LMX1B、FOXA2、OTX2,而不表达NKX2.1、NKX2.2、BARHL1、BARHL2、PITX2、NKX6.1、PHOX2B、PHOX2A、FOXG1、EMX2、PAX6、SIX3、SIX6、LHX2、HOXA2、HOXB4。
在一个实施方案中,包含腹侧中脑多巴胺能祖细胞的细胞群中至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的细胞对腹侧中脑多巴胺能祖细胞的标志物呈阳性。
如本文所用,术语“标志物”是指在感兴趣的细胞中差异表达的核酸或多肽分子。在本发明的上下文中,差异表达是指与未分化的细胞相比,阳性标志物的水平升高而阴性标志物的水平降低。与其他细胞相比,感兴趣的细胞中标志物核酸或多肽的可检测水平足够高或足够低,从而可以鉴定感兴趣的细胞并将其与其他细胞区分开来。用于观察和定量标志物表达的多种方法是本领域已知的并且包括免疫细胞化学和免疫组织化学(参见实施例)和免疫印迹、qPCR和RNA测序。
如本文所用,当在细胞中检测到特定标志物时,细胞对特异性标志物为“阳性”或“阳性的”。相反,当在细胞中未检测到特异性标志物时,该细胞对特异性标志物为“阴性”或“阴性的”。结合标志物使用“+”或“-”符号在本文中意在理解为对所述标志物呈阳性或阴性(例如LMX1A+细胞对标志物LMX1A是阳性的)。
在一个具体实施方案中,腹侧中脑多巴胺能祖细胞表达叉头盒蛋白A2(FOXA2)和LIM同源盒转录因子1α(LMX1A)。
“FOXA2”是在人类中由FOXA2基因编码的蛋白质。叉头盒蛋白A2是叉头类DNA结合蛋白的成员。FOXA2可以包含如Uniprot No.Q9Y261所描述的蛋白质序列。术语FOXA2涵盖任何FOXA2核酸分子或多肽并且还可以包含其片段或变体。本领域技术人员知道如何检测FOXA2。这些方法也在实施例中描述。
LIM同源盒转录因子1α(LMX1A)是一种在人类中由LMX1A基因编码的蛋白质。LMX1是一种LIM同源盒转录因子,结合胰岛素启动子中富含A/T的序列并刺激胰岛素的转录。LMX1A可包含如Uniprot编号Q8TE12所示的蛋白质序列。术语LMX1A涵盖任何LMX1A核酸分子或多肽,并且也可以包含其片段或变体。本领域技术人员知道如何检测LMX1A。这些方法也在实施例中描述。
在一个优选的实施方案中,腹侧中脑多巴胺能祖细胞另外表达LIM同源盒转录因子1β(LMX1B)和正齿同源盒同源盒2(OTX2)。
LIM同源盒转录因子1β(LMX1B)是一种在人类中由LMX1B基因编码的蛋白质。LMX1B是一种LIM同源盒转录因子,在脊椎动物肢体的背-腹模式中起重要作用。LMX1B可以包含如Uniprot编号060663描述的蛋白质序列。术语LMX1B涵盖任何LMX1B核酸分子或多肽,并且也可以包含其片段或变体。本领域技术人员知道如何检测LMX1 B。这些方法也在实施例中描述。
正齿同源盒2(OTX2)是一种在人类中由OTX2基因编码的蛋白质。OTX2可包含如Uniprot编号P32243所示的蛋白质序列。术语OTX2涵盖任何OTX2核酸分子或多肽并且还可以包含其片段或变体。技术人员知道如何检测OTX2 B。这些方法也在实施例中描述。
神经干细胞的LMX1A+/LMX1B+/FOXA2+/OTX2+身份长期以来被认为是对产生mDA神经元的vMB祖细胞特异的分子印记,但后来表明这种身份也被尾侧间脑中产生丘脑下核神经元(STN)的腹侧祖细胞所共有(图2d)。BARHL1、BARHL2、PITX2和NKX2.1由STN谱系选择性表达,且因此可用于区分间脑STN祖细胞和腹侧中脑多巴胺能祖细胞。
应当理解,腹侧中脑多巴胺能祖细胞不会表达指示FB身份的标志物,包括FOXG1、EMX2、PAX6、SIX3、SIX6。
应当理解,腹侧中脑多巴胺能祖细胞不会表达指示HB身份的标志物,包括NKX2.2、PHOX2B、HOXA2、HOXB4。
在一个具体实施方案中,细胞群包含至少约50%、至少约60%、至少约70%或至少约80%的腹侧中脑多巴胺能祖细胞。
在一个实施方案中,至少60%、65%、70%、75%、80%、85%、90%或95%的细胞是对FoxA2和/或Lmx1呈阳性的腹侧中脑多巴胺能祖细胞。在一些实施方案中,细胞群包含对FoxA2和/或Lmx1呈阳性的至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的腹侧中脑多巴胺能祖细胞(例如,约90%-98%或95%-99%的腹侧中脑多巴胺能祖细胞)。
换句话说,细胞群至少60%、65%、70%、75%、80%、85%、90%或95%对FoxA2和/或Lmx1呈阳性。这可以使用本领域已知的方法进行定量,例如通过在免疫细胞化学后对细胞群中阳性细胞的比例进行计数。
在一个具体的实施方案中,在所述细胞群首次与至少一种视黄酸(RA)信号传导激活剂接触后至少7天后,诸如约9-16天,诸如约14天,细胞群包含至少约50%、至少约60%、至少约70%或至少约80%的腹侧中脑多巴胺能祖细胞。
换句话说,至少在7DDC,诸如约9-16DDC,诸如约14DDC后,细胞群包含至少约50%、至少约60%、至少约70%、或至少约80%的腹侧中脑多巴胺能祖细胞。
在一个具体的实施方案中,在所述细胞群首次与至少一种视黄酸(RA)信号传导激活剂接触后7-16天,诸如约7天、8天、9天、10天、11天、12天、13天、14天或约15天,细胞群包含至少约50%、至少约60%、至少约65%、至少约70%、至少约75%或至少约80%的腹侧中脑多巴胺能祖细胞。在一个实施方案中,在所述细胞群首次与至少一种视黄酸(RA)信号传导激活剂接触后约14天,细胞群包含至少约80%的腹侧中脑多巴胺能祖细胞。
如本文所述,腹侧中脑多巴胺能祖细胞在最初暴露于RA后7天内(即,在7DDC,见下文定义)衍生自hPSCs。这些7DDC细胞共表达FOXA2和LMX1A。如在所附实施例中可见,在14天内(即,到14DDC时),衍生自hPSCs的约80%的细胞群是共表达FOXA2、LMX1A、LMX1B和OTX2以及vMB标志物CORIN的腹侧中脑多巴胺能祖细胞(图2g),如通过免疫细胞化学确定的。
在一个优选的实施方案中,包含腹侧中脑多巴胺能祖细胞的群体可在约7-16DDC内,诸如约8DDC内,诸如约9DDC内,诸如约10DDC内,诸如约11DDC内,诸如约12DDC内,诸如约13DDC内,诸如约14DDC内,诸如约15DDC内获得。
因此,暴露于定时RA脉冲和索尼克豪猪信号传导小分子激活剂(SHH)的绝大多数hPSC衍生的NSCs表达LMX1A+/LMX1B+/FOXA2+/OTX2+,并具有腹侧中脑(vMB)身份,表达相邻间脑、HB或侧MB区域身份的细胞很少被污染。
在一个具体实施方案中,该方法是体外方法。
“体外”包括身体外部的环境。体外环境包括但不限于试管和细胞培养物。
在一个具体的实施方案中,所述多个干细胞选自包含以下项的组:多能干细胞;多潜能干细胞;非胚胎干细胞,诸如成人类干细胞(ASCs);并且其中所述多个干细胞来源于人类,任选地,其中人类是具有神经障碍症状的患者;啮齿动物;或者灵长类动物。
用于产生腹侧中脑多巴胺能祖细胞的多个干细胞可以从多种来源获得,包括胚胎和非胚胎来源,例如,hESCs和非胚胎hiPSCs、体干细胞、疾病干细胞,即分离自帕金森氏病患者的分离的多能细胞和工程衍生的干细胞、癌症干细胞、人类或哺乳动物多能细胞等。
在一个优选的实施方案中,多个干细胞是多能干细胞。在一个实施方案中,多个干细胞是源自人类、灵长类动物、猪、狗或啮齿动物的多能干细胞。在进一步优选的实施方案中,多个干细胞是人类多能干细胞。
“多能干细胞”包括能够产生所有三个胚层(即内胚层、中胚层和外胚层)细胞的细胞。尽管理论上多能干细胞可以分化成身体的任何细胞,但是多能性的实验确定通常是基于多能细胞分化成每个胚层的几种细胞类型。多能干细胞可以是源自囊胚的内细胞团的胚胎干(ES)细胞。在其他实施方案中,多能干细胞可以是诱导多能干细胞(iPS),其通过本领域已知的细胞重编程的方法诱导成年体细胞的去分化而获得(Takahashi K.,Yamanaka S.《细胞(Cell.)》2006;126(4):663–676)。在某些实施方案中,多能干细胞是通过体细胞核移植(NT-ESC)获得的胚胎干细胞。
多潜能干细胞是能够分化成给定器官或组织的所有细胞类型并且仅分化成该器官或组织的细胞的体干细胞。多潜能干细胞的一个示例是神经干细胞。
在一个具体的实施方案中,多个干细胞选自包含以下项的组:小鼠多能干细胞、小鼠ESC、小鼠iPS细胞、小鼠神经干细胞、化学诱导的干细胞、灵长类多能干细胞、灵长类ESC、灵长类iPS细胞、灵长类神经干细胞、化学诱导的灵长类干细胞、猪ESC、猪iPS细胞、猪神经干细胞、化学诱导的猪干细胞、狗多能干细胞、狗ESC、狗iPS细胞、狗神经干细胞、化学诱导的狗干细胞、大鼠多能干细胞、大鼠ESC、大鼠iPS细胞、大鼠神经干细胞、化学诱导的大鼠干细胞、人类多能干细胞、人类成体干细胞、人类ESC、人类iPS细胞、化学诱导的人类干细胞、NT-ESC、人类羊膜干细胞、脐带血干细胞衍生的人类ESC、人类神经干细胞、源自人类ESC的长期神经干细胞、源自人类iPS细胞的长期神经干细胞;和源自NT-ESC的长期神经干细胞,任选地,其中人类是具有帕金森氏病(PD)症状的患者。
胚胎干细胞(ES)是来源于囊胚内细胞团的多能细胞。获得人类ES细胞及分离恒河猴和普通狨猴ES细胞的方法也是已知的(Thomson等人,1995以及Thomson,和Marshall,1998)。在一个具体的实施方案中,所述人类ESCs先前已经由他人在不破坏胚胎的情况下获得。例如,这些细胞可能已经通过从八细胞胚泡中提取细胞而获得(Chung Y等人,(2008)《细胞干细胞(Cell Stem Cell)》,2月7日;2(2):1 13-7)。本领域技术人员知道用于在不破坏胚胎的情况下衍生ESC的其他方法。
ES细胞的另一个来源是已建立的ES细胞系。各种小鼠细胞系和人类ES细胞系是已知的,并且它们生长和繁殖的条件已经被确定,例如人类W A-09细胞系中的细胞。如本文所用,术语“ES细胞系”包括胚胎干细胞克隆群体的含义,该克隆群体表达多能性特性,并且可以在允许细胞增殖和繁殖达数天、数月至数年而不分化的体外条件下培养。不同的ES细胞系是彼此独立建立的,并且基因型不同,在一定程度上表型也不同,诸如对发育信号传导分子具有不同的反应。应当理解,所有这种ES细胞系都可以用于本发明。
诱导的多能干细胞(iPS)是具有ES细胞特征的细胞,但通过对分化的体细胞进行重编程而获得。iPSCs能够在体外自我更新并分化成所有三个胚层,即内胚层、中胚层和外胚层的细胞。iPS细胞已经通过本领域已知的各种方法获得,并且与ES细胞不同,iPSC是通过引入某些胚胎基因(诸如OCT4、SOX2和KLF4转基因)人工形成的。2006年报道了小鼠iPSCs(Takahashi和Yamanaka),且2007年末报道了人类iPSCs(Takahashi等人和Yu等人)。
iPS细胞可以是哺乳动物细胞,例如小鼠、人类、大鼠、牛、羊、马、仓鼠、狗、豚鼠或非人灵长类动物细胞。例如,体细胞的重新编程提供产生患者特异性或疾病特异性多能干细胞的机会。iPS细胞在形态、增殖、基因表达和畸胎瘤形成方面与ES细胞难以区分。人类iPS细胞也是可扩增的,并且在形态和增殖方面与人类胚胎干细胞(ES)没有区别。
间充质细胞可用于产生iPS细胞,并且可以从任何合适的来源获得,并且可以是任何特异性间充质细胞类型。例如,如果最终目标是产生用于移植到患者体内的治疗性细胞,则来自该患者的间充质细胞理想地用于产生iPS细胞。合适的间充质细胞类型包括成纤维细胞(诸如皮肤成纤维细胞)、造血细胞、肝细胞、平滑肌细胞和内皮细胞。在合适的实施方案中,本方法中使用的iPS细胞来源于PD患者。
通过体细胞核移植(NT-ESC)衍生的胚胎干细胞是通过体细胞核移植制备的多能干细胞,其中供体细胞核被转移到无纺锤体的卵母细胞中,例如如Tachibana等人,(2013)《细胞(Cell)》;153(6):1 228-38所述。
如本文所用,术语“体细胞(成体)干细胞”是指在许多器官和分化的组织中发现的相对罕见的未分化的细胞,其自我更新和分化能力有限。一个示例包括造血干细胞,
其会产生所有红细胞和白细胞以及血小板。
如本文所用,术语“脐带血干细胞”指从出生时的脐带收集的干细胞,其具有至少产生体内所有血细胞(造血细胞)的能力。
细胞培养和分化多能干细胞的方法可参照本领域的标准文献进行。Lemke、Kristen A.、Alireza Aghayee和Randolph S.Ashton“使用人类多能干细胞对于CNS组织进行衍生、再生和工程化(Deriving,regenerating,and engineering CNS tissues usinghuman pluripotent stemcells.)”《生物技术新观点(Current opinion inbiotechnology)》47(2017):36-42描述了合适的技术。
本领域技术人员知道适合神经干细胞生长的细胞培养基,诸如但不限于基础培养基的任何修饰,诸如DMEM、F 12、RPMI 1640和MEM。本领域技术人员知道基础培养基可以被修饰用于许多不同的目的。合适培养基的非限制性示例包括来自生命科技的示例性Neurobasal
应当理解,说明了不同的细胞培养基,它们是经过修饰的。
通过添加分化因子和/或模式因子来获得多种不同的细胞培养基。
在一个具体实施方案中,细胞培养基包含DMEM/F12和Neurobasal培养基。在一个优选的实施方案中,细胞培养基是包含补充有N2(赛默飞世尔;目录号:17502048)和B27(赛默飞世尔)(含有维生素A)的Neurobasal(赛默飞世尔目录号:21103049)的细胞培养基(参见Ying,Qi-Long,等人“(贴壁单培养中胚胎干细胞向神经外胚层前体细胞的转化(Conversion of embryonic stem cells into neuroectodermal precursors inadherent monoculture.))”《自然生物技术》21.2(2003):183-186)。
在一个实施方案中,细胞培养基是补充有一种或多种可溶性因子的细胞培养基,该可溶性因子选自包含N2、B27(含有维生素A)、β-巯基乙醇和L-谷氨酰胺(诸如Glutamax
在一些实施方案中,用于分化的培养条件可以包含将细胞解离成基本上单细胞培养物。如在所附实施例中可见,将细胞在铺板前和在9DDC和23DDC时解离。解离包括使用现在已知或以后开发的能够将细胞解离成更小的组或单细胞悬浮液的任何方法。在一个示例性实施方案中,细胞可以通过蛋白酶处理或机械处理如移液,或使用干细胞传代工具(赛默飞世尔科技)解离,如所附实施例中所述。例如,蛋白酶可以是Accutase(赛默飞世尔科技)、胶原酶、胰蛋白酶-EDTA、分散酶或其组合。另选地,螯合剂可用于解离细胞,诸如柠檬酸钠、EGTA、EDTA或其组合。基本上单细胞培养物可以是这样一种细胞培养物,其中希望生长的细胞彼此解离,使得大部分细胞是单细胞,或至多两个保持结合的细胞(双联体)。
在某些方面,单细胞培养物可以在有效增加克隆效率和解离后细胞存活的小分子存在下,诸如ROCK抑制剂或肌球蛋白II抑制剂,如随附实施例中所述。
在某些实施方案中,细胞可以在附着于固体或半固体底物(贴壁或单层培养物)的同时进行培养,如所附实施例中所述。本领域已知各种基质成分,并且它们可用于培养、维持或分化人类多能干细胞。例如,用于细胞粘附的底物包括胶原蛋白、明胶、聚-L-赖氨酸、聚-D-赖氨酸、聚-L-鸟氨酸、层粘连蛋白、玻连蛋白和纤连蛋白及其混合物,诸如Matrigel
细胞也可以在培养基中漂浮生长(悬浮培养)。
在某些实施方案中,非静态培养可用于培养和分化多能干细胞。非静态培养可以是通过使用例如摇动、旋转或搅拌平台或培养容器,特别是大体积旋转生物反应器,将细胞保持在受控移动速度下的任何培养。搅拌可以改善营养物质和细胞废物的循环,并且也可以通过提供更均匀的环境来控制细胞聚集。例如,可以将旋转速度设定为至少或至多约25、30、35、40、45、50、75、100rpm,或其中可导出的任何范围。
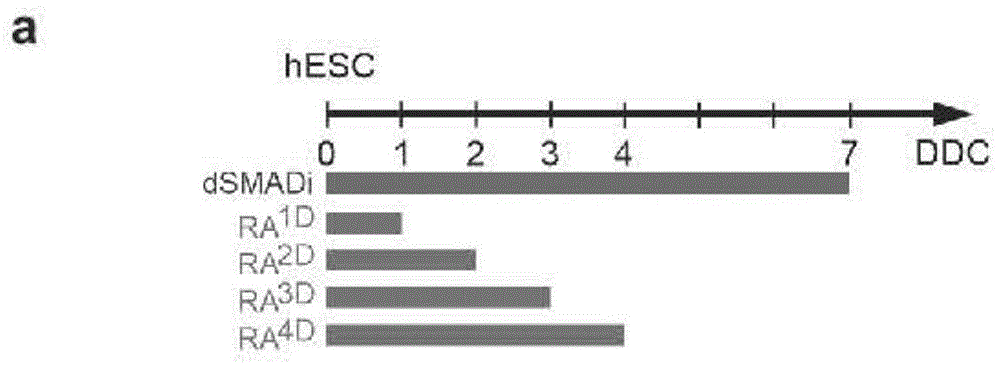
应当理解,在足以引起干细胞分化成包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养干细胞通常包含使干细胞与在不同时间点添加的一种或多种因子接触达不同持续时间。方便地,这些时间点和持续时间通过参考“分化条件下的天数(DDC)”命名法来描述。例如,1DDC是指这些细胞已经在分化培养中1天,并且2DDC是指这些细胞已经在分化培养中2天,以此类推。这样,DDC可用作分化培养中时间点的参照,1DDC对应于第1天,2DDC对应于第2天,依此类推。类似地,暴露的持续时间和时间点可以参考DDC来描述。例如,细胞可以在3DDC与5DDC之间暴露于特定因子2天。如所附实施例中所述,分化方案在细胞铺板的第0天(即0DDC)开始。14天后(14DDC),细胞可以准备进行移植(见图4o)。
在一个实施方案中,在足以引起干细胞分化成包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养干细胞包含使干细胞与至少一种豪猪(Hh)信号传导激活剂接触。
众所周知,豪猪(HH或Hh)信号传导在调节脊椎动物器官发生中发挥关键作用,诸如在四肢手指的生长和大脑组织中。脊椎动物豪猪蛋白家族由索尼克豪猪(SHH)、印度豪猪(IHH)和沙漠豪猪(DHH)组成,它们具有许多功能特征并通过共同的通路发出信号。例如,在CNS发育期间,SHH充当形态发生剂,一种扩散以形成浓度梯度的分子,并且因此根据其浓度对发育中的神经系统的细胞具有不同的影响。简而言之,Hh通过与包含两种成分;修补(Ptc)和平滑(Smo)的Hh受体复合物相互作用而发出信号,这两种成分将Hh信号转换到细胞中。Ptc被认为通过与细胞膜中的Smo结合来抑制Hh信号传导。在Hh配体存在的情况下,这种抑制得到缓解,并且Smo能够发出信号。在脊椎动物中,锌指蛋白Gli1、Gli2和Gli3是Hh信号传导的下游介质,并以Hh依赖性方式参与控制靶基因的转录反应。
技术人员将理解术语“Hh信号传导激活剂”包括增强或替代Hh信号传导的因子或其衍生物或激动剂。这些因素可能参与Hh下游的信号传导,或者是小分子激动剂。
在一个实施方案中,至少一个豪猪(Hh)信号的激活剂选自包含以下项的组:索尼克豪猪(SHH)、印度豪猪(IHH)、沙漠豪猪(DHH)、嘌呤胺、平滑激动剂(SAG)诸如SAG 1.3(Hh-1.3)、Hh-1.2、Hh-1.4、Hh-1.5及其组合。
在一个优选的实施方案中,Hh信号传导激活剂是SAG 1.3。此类激活剂可从例如圣克鲁斯生物技术商购获得。
在某些实施方案中,至少一种Hh信号传导激活剂与细胞接触至少约4、5、6、7、8、9或10天或更长时间,例如约4至10天,或约5至9天,或约6至9天。在某些实施方案中,至少一种Hh信号传导激活剂与细胞接触至多约4、5、6、7、8、9或10天或更长时间。在某些实施方案中,至少一种Hh信号传导激活剂与细胞接触约8-9天。在某些实施方案中,至少一种Hh信号传导激活剂与细胞接触约9天,从0到9DDC。
从随附实施例和图8c(补充图2c))中可以看出,干细胞在第0DDC天或第1DDC天初始暴露于至少一种豪猪(Hh)信号传导激活剂导致有效诱导NSCs的vMB身份。因此,在某些实施方案中,从第1DDC天到第9DDC天,使至少一种Hh信号传导激活剂与细胞接触约8天。在另一个实施方案中,从第0DDC天到第9DDC天,使至少一种Hh信号传导激活剂与细胞接触约9天
在某些实施方案中,从第0天到第9天,每天或每隔一天将至少一种Hh信号传导激活剂添加到包含干细胞的细胞培养基中。在某些实施方案中,从第1天到第9天,每天或每隔一天将至少一种Hh信号传导激活剂添加到包含干细胞的细胞培养基中。在某些实施方案中,在第0、2、4、6、8DDC天添加至少一种Hh信号传导激活剂。在某些实施方案中,在第1、3、5、7、9DDC天添加至少一种Hh信号传导激活剂。
在某些实施方案中,至少一种Hh信号传导激活剂以约50至1000nM、或约100至950nM、或约150至900nM、或约200至850nM、或约250至800nM、或约300至750nM、或约350至700nM、或约400至650nM、或约450至600nM、或约500至550nM和介于两者之间的值的浓度与细胞接触。在某些实施方案中,一种或多种Hh信号传导激活剂以约400、450、500、550或600nM的浓度与细胞接触。在某些实施方案中,至少一种Hh信号传导激活剂以约300nM的浓度与细胞接触。
从随附实施例中可以看出,图8d(补充图2D)中显示的滴定数据证明当以50nM–1000nM的浓度使用至少一种Hh信号传导激活剂时,可以有效地诱导干细胞的vMB身份。
在一个具体的非限制性实施方案中,使细胞与至少一种Hh信号传导激活剂SAG1.3例如以约300nM的浓度;接触约9天(即从0到9DDC)。
在另一个具体的非限制性实施方案中,细胞与至少一种Hh信号传导激活剂SAG1.3以例如约300nM的浓度接触约8天(即从1至9DDC)。
在一个优选的实施方案中,在足以引起干细胞分化成包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养干细胞包含使干细胞与至少一种TGFβ/激活素-节点信号传导抑制剂和至少一种骨形态发生蛋白(BMP)信号通路抑制剂接触。
如本文所用,“TGFβ/激活素-节点信号传导抑制剂”可简称为“TGFβ/激活素-节点抑制剂”。类似地,“BMP信号传导抑制剂”在本文中可以简称为“BMP抑制剂”。
“抑制剂”包括干扰(例如,降低、减少、抑制、消除或阻断)分子或通路的信号传导功能的任何化合物或分子(例如,小分子、肽、肽模拟物、天然化合物、siRNA、反义核酸、适体或抗体)。抑制剂可以是改变特定蛋白质信号传导分子的任何活性的任何化合物或分子,任何与特定信号传导分子有关的分子。
例如,TGFβ/激活素-节点信号传导抑制剂可以通过直接接触SMAD信号传导、接触SMAD mRNA、引起SMAD构象变化、降低SMAD蛋白水平或干扰SMAD与信号传导伴侣的相互作用(例如,包括本文所述的那些)以及影响SMAD靶基因表达(例如,本文所述的那些)来发挥作用当与没有加入抑制剂或加入抑制剂之前的通路的活性相比时,抑制剂可以将待抑制的通路减少或降低10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多。
TGFβ/激活素-节点信号传导抑制剂还包括通过拦截上游信号传导分子(例如,在细胞外结构域内,信号传导分子和效应的示例包括:螯合骨形态发生蛋白的头蛋白,抑制ALK受体1、2、3和6的激活,从而阻止下游SMAD激活)来间接调节生物活性,例如SMAD生物活性的分子。同样,Chordin、Cerberus、Follistatin类似地隔离SMAD信号传导胞外激活剂。Bambi是一种跨膜蛋白,也作为一种假受体隔离细胞外TGFβ信号传导分子)。阻断上游或下游蛋白质的抗体也可用于中和蛋白质信号传导的细胞外激活剂。除了通过与指定信号分子上游的分子结合并影响该分子从而导致指定分子的抑制所诱导的抑制之外,抑制剂还被描述为竞争性抑制(以排除或减少另一种已知结合化合物的结合的方式与活性位点结合)和变构抑制(以改变蛋白质构象的方式与蛋白质结合,从而干扰化合物与蛋白质活性位点的结合)。抑制剂可以是通过实际接触信号传导靶标来抑制信号传导靶标或信号传导靶标通路的“直接抑制剂”。
在某些实施方案中,本发明提供将干细胞分化为腹侧中脑多巴胺能祖细胞的方法,该方法包含使一群或多个人类干细胞与一种或多种TGFβ/激活素-结信号传导抑制剂(即第一SMAD抑制剂)和一种或多种BMP信号传导抑制剂(即第二SMAD抑制剂)接触。
TGFβ/激活素-结点信号传导和BMP信号传导的抑制被称为“SMAD信号传导的双重抑制”或“双重SMAD抑制”或“dSMADi”。双重SMAD抑制先前已被用作从hPSCs诱导一种类型的神经谱系细胞的快速且高效的方法(Chambers,等人,《自然生物技术》27,(2009))。
哺乳动物SMAD蛋白家族是一个具有八个成员的家族,作为TGFβ超家族的细胞内信号传导介质。Smad2和Smad3介导TGFβ和激活素/抑制素信号传导,而BMP信号传导由Smad1、Smad5和Smad8介导。
本领域已知TGF信号传导涉及胚胎发生、细胞分化和细胞凋亡以及其他功能。TGF超家族配体,例如,TGFB1、TGFB2、TGFB3、激活素A、激活素B、激活素AB和/或NODAL,与由两种I型受体激酶(也称为ALK5,包括例如TGFBR2、ACVR2A和/或ACVR2B)和两种II型受体激酶(包括例如,TGFBR1、ACVR1B和/或ACVR1C)组成的异源四聚受体复合物结合。这种结合诱导由R-SMAD(包括例如SMAD2和/或SMAD3)和Co-SMAD(包括例如SMAD4)组成的异聚复合物的磷酸化和激活。RSMAD/CoSMAD复合物在核中积累,其中其作为转录因子并参与靶基因表达的调节。
技术人员将会理解,术语“TGFβ/激活素-节点信号传导的抑制剂”是指形成该信号传导通路一部分的任何一种分子的抑制剂。例如,抑制剂可以是ACVR2A和/或ACVR1B(ALK4)受体的拮抗剂或TGFβII型受体激酶和/或ALK5受体的拮抗剂。此类抑制剂TGFβ/激活素-结信号传导通路的这种抑制剂在本领域是已知的,并且是可商购的。
在一个优选的实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂选自包含SB431542和SB505124的组。
本发明考虑到TGFβ/激活素节点信号传导抑制剂是TGFβI型受体抑制剂。在一个实施方案中,TGFβ/激活素-节点信号传导抑制剂抑制ALK5以及激活素I型受体ALK4和/或节点I型受体ALK7,它们在激酶结构域上与ALK5高度相关。
TGFβ/激活素-节点信号传导抑制剂的示例性、非限制性示例包括SB431542(CASNo.:301836-41-9)、SB-505124(CAS No.:694433-59-5)、A-83-01、GW6604、IN-I 130、Ki26894、LY2157299、LY364947(HTS-466284)、LY550410、LY5 73636、LY580276、NPC-30345、SD-093、Sml6、SM305、SX-007、Antp-Sm2A、GW788388、LY2109761和R 268712、D 4476、ITD 1及RepSox。TGFβ/激活素-节点信号传导抑制剂的非限制性示例也公开于Chambers,等人,《自然生物技术》27,(2009)中,并且这些抑制剂通过引用并入。在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂是SB431542及其衍生物。例如,SB431542可以从美天旎生物技术公司获得。
在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂与细胞接触至少约2、3、4、5、6、7、8、9或10天或更长时间。在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂与细胞接触至少约3和9天。在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂与细胞接触至少约4和8天。在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂与细胞接触至少约5和7天。在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂与细胞接触约7天,从第0DDC天到第7DDC天,信号。
在某些实施方案中,从第0天至第10天,每天或每隔一天向包含干细胞的细胞培养基中加入至少一种TGFβ/激活素-节点信号传导抑制剂。在某些实施方案中,在第0、2、4和6天添加至少一种TGFβ/激活素-节点信号传导抑制剂。在一个实施方案中,每隔一天,即隔天更换培养基,并添加新鲜抑制剂。
在某些实施方案中,至少一种TGFβ/激活素-节点信号传导抑制剂以约1至50μM、或约1至20μM、或约2至15μM、或约3至10μM、或约5至10μM和起见的值的浓度与细胞接触。在某些实施方案中,至少一种Fβ/激活素-节点信号传导抑制剂以约5、6、7、8、9或10μΜ的浓度与细胞接触。在某些实施方案中,至少一种Fβ/激活素-节点信号传导抑制剂以约5μM的浓度与细胞接触。
在一个具体的非限制性实施方案中,细胞与至少一种TGFβ/激活素-节点信号传导抑制剂(即第一SMAD抑制剂)(例如SB431542)以约5-10μM的浓度接触约7天(即从的第0DDC天到第7DDC)。
BMP信号传导通路是本领域已知的(Jiwang Zhanga,Linheng Lia(《发育生物学(Developmental Biology)》284卷,第1次发行,(2005),第1-11页)。
简而言之,BMP通过受体介导的细胞内信号传导发挥作用,并随后影响靶基因转录。在这个过程中需要两种类型的受体,称为I型和II型。虽然只有一种II型BMP受体(Bmprll),但有三种I型受体:Alk2、Alk3(Bmpr1 a)和Alk6(Bmpr1 b)。BMP信号传导转换可以通过至少两条信号传导通路进行。经典BMP通路由受体I介导的Smad1、Smad5或Smad8(R-Smad)的磷酸化来介导两个磷酸化的R-Smad与一个共同的Smad4(co-Smad)形成异源三聚体复合物。Smad异源三聚体复合物可以转移到细胞核中,并可以与其他转录因子协同调节靶基因表达。BMP信号的平行通路由TGFβ1激活的酪氨酸激酶1(TAK1,一种MAPKKK)和有丝分裂原激活的蛋白激酶(MAPK)介导,这也涉及BMP与Wnt通路之间的串扰。
在一个实施方案中,BMP信号传导抑制剂是典型的BMP信号传导抑制剂。BMP信号传导抑制剂的示例性非限制性示例包括DMH1(CAS 1206711-16-1);DMH2;LDN-193189(CASNo.:1062368-24-4);LDN-214117;腱蛋白;小精灵;凡托平;卵泡抑素;noggin;K02288;和Dorsomorphin(CAS No.:866405-64-3)。DMH-1可以例如从Santa Cruz Biotech获得。
在一个优选的实施方案中,至少一种BMP信号传导抑制剂选自包含以下项的组:DMH-1;LDN-193189;和Noggin。
在某些实施方案中,至少一种BMP信号传导抑制剂与细胞接触至少约2、3、4、5、6、7、8、9或10天或更长时间。在某些实施方案中,至少一种BMP信号传导抑制剂与细胞接触至少约3和9天。在某些实施方案中,至少一种BMP信号传导抑制剂与细胞接触至少约4和8天。在某些实施方案中,至少一种BMP信号传导抑制剂与细胞接触至少约5和7天。在某些实施方案中,至少一种BMP信号传导抑制剂与细胞接触约7天,从第0DDC天到第7DDC天。
在某些实施方案中,从第0天到第10天每天或每隔一天将至少一种BMP信号传导抑制剂添加到包含干细胞的细胞培养基中。在某些实施方案中,在第0、2、4和6天添加至少一种BMP信号传导抑制剂。在一个实施方案中,每隔一天,即隔天更换培养基,并添加新鲜抑制剂。
在某些实施方案中,至少一种BMP信号传导抑制剂以约0.01μM至约50μM、或约1至25μM、或约1至15μM、或约1至10μM、或约1至5μM、或在约2至4μM以及其间的值的浓度与细胞接触。在某些实施方案中,至少一种BMP信号传导抑制剂以约2.5μM的浓度与细胞接触。
在一个具体的非限制性实施方案中,细胞与至少一种BMP信号传导抑制剂(即第二SMAD抑制剂)(例如DMH1)以约250nM的浓度接触约7天(即从第0DDC天至第7DDC天)。
SMAD的双重抑制可以用多种化合物来实现,这些化合物为诸如上述化合物,包括Noggin、SB431542、LDN-193189、DMH-1、Dorsomorphin或其他阻断TGFβ、BMP和激活素/节点信号传导的分子。一个优选的实施方案包含以0.1μM-250μM、或更优选1-25μM或最优选5μM的SB431542和2.5μM的DMH-1的浓度使用SB431542和DMH-1。
在一个具体的非限制性实施方案中,细胞与至少一种TGFβ/激活素-节点信号传导抑制剂(即第一SMAD抑制剂)(例如SB431542)以约5μΜ的浓度接触约7天(即从第0DDC天到第7DDC天);与至少一种BMP信号传导抑制剂(即第二SMAD抑制剂)(例如DMH1)以约250nM的浓度接触约7天(即从第0DDC天到第7DDC天);并且与至少一种Hh信号传导激活剂(例如SAG1.3)以约300nM的浓度接触约9天(即从第0DDC天到第9DDC天),接触约8天(即从第1DDC天到第9DDC天)。
在一个优选的实施方案中,干细胞与视黄酸(RA)信号传导激活剂接触约1-4天,任选约1-3天。
如本文所用,“1-4天”包括视黄酸激活剂与干细胞接触约24至96小时。如本文所用,“1-3天”包括24至72小时。在进一步的实施方案中,干细胞与视黄酸(RA)信号传导激活剂接触约1.5-3天,即约36-72小时。
如所附实施例所示,当视黄酸(RA)信号传导激活剂是EC23时,在与干细胞接触约1天(即约24小时)(即0至1DDC,或1至2DDC,或2至3DDC,或3至4DDC)后,EC23可将多能干细胞分化成腹侧中脑多巴胺能祖细胞。当视黄酸(RA)信号传导激活剂是ATRA时,在与干细胞接触约2天(即约48小时),从0DDC到2DDC后,ATRA可以将多能干细胞分化成腹侧中脑多巴胺能祖细胞。
在一个优选的实施方案中,在与多个干细胞接触约1-4天,任选约1-3天后,至少一种视黄酸(RA)信号传导激活剂不以有效量存在。
在一个实施方案中,在多个干细胞与多个干细胞接触约1-4天,任选约1-3天后,在没有有效量的至少一种视黄酸(RA)信号传导激活剂的情况下培养干细胞达至少接下来的7天。
如所附实施例中所述,至少一种视黄酸(RA)信号传导激活剂以“脉冲”形式递送,且因此在脉冲后将其从培养基中除去。
在一个实施方案中,干细胞在与至少一种视黄酸(RA)信号传导激活剂接触的同时,与至少一种豪猪(Hh)信号传导激活剂、至少一种TGFβ/激活素-节点信号传导抑制剂、和至少一种骨形态发生蛋白(BMP)信号传导抑制剂接触。
从随附的实施例和图4o可以看出,将干细胞暴露于至少一种豪猪(Hh)信号传导激活剂(即SAG)和至少一种TGFβ/激活素-节点信号传导抑制剂以及至少一种骨形态发生蛋白(BMP)信号传导抑制剂(即双重SMAD抑制)和至少一种视黄酸(RA)信号传导激活剂,导致有效诱导NSCs的vMB身份。
在一个替代实施方案中,干细胞在与至少一种视黄酸(RA)信号传导激活剂接触之前,与至少一种豪猪(Hh)信号传导激活剂、至少一种TGFβ/激活素-节点信号传导抑制剂至少一种骨形态发生蛋白(BMP)信号传导抑制剂接触。
从随附的实施例和图8b(补充图2b)可以看出,干细胞在第0天和第2DDC天之间最初暴露于至少一种视黄酸(RA)信号传导激活剂达随后的48小时,导致有效诱导NSCs的vMB身份。因此,在一个实施方案中,至少一种视黄酸(RA)信号传导激活剂与细胞接触从0至2DDC的约2天;或接触从1至3DDC的约2天;或者接触从2到4DDC的约2天。换句话说,RA脉冲将在0-2DDC之间启动。
从随附的实施例和图8c(补充图2c)中可以看出,干细胞在第0DDC天或第1DDC天初始暴露于至少一种豪猪(Hh)信号传导激活剂导致有效诱导NSCs的vMB身份。
本发明人惊奇地发现,在LMX1A/B+/FOXA2+/OTX2腹侧中脑多巴胺能祖细胞的基于RA的规范中,或者在成熟mDA神经元的产生中,既不需要WNT激动剂也不需要FGF。如随附示例中所述,(dSMADi)用于通过阻止hPSCs选择替代的体细胞或胚胎外命运选项来促进一般神经命运;至少一种视黄酸(RA)信号传导激活剂促进从多能性到NSC-状态的开关样转变,并伴随地将MB样身份强加给NSC;并且将至少一种豪猪(Hh)信号传导激活剂应用于腹侧化细胞并诱导mDA神经元祖细胞的LMX1A+/FOXA2+/OTX2+vMB身份特征。
本发明人用RA而不是WNT处理的干细胞获得了以LMX1A/B+/FOXA2+/OTX2+EN1-的表达为特征的更多的吻侧腹侧中脑身份,而不是尾侧中脑身份。
在一个实施方案中该方法包含在多个干细胞与至少一种视黄酸(RA)信号传导激活剂初始接触后,顺序加入WNT信号传导激活剂,以诱导尾侧中脑标志物ENGRAILED-1(EN1)的表达。这将产生尾状腹侧中脑祖细胞(LMX1A/B+/FOXA2+/OTX2+EN1+)。因此,应当理解,本发明的方法中不使用Wnt来指定干细胞的腹侧中脑身份。
如所附实施例中所述,本发明人惊奇地发现,在用Wnt信号激动剂CHIR99021处理的RA诱导的中脑祖细胞中,EN1表达上调。本发明人发现用于产生EN1+LMX1A+FOXA2+OTX+祖细胞的CHIR99031的最佳浓度在0.6μM与10μM之间,诸如在2.5μM和10μM之间。在一个实施方案中,CHIR99021以5μM的浓度用于本发明的方法中。
EN1(ENGRAILED-1)是一个同源盒基因,调节中脑尾部和后脑前部的发育。EN1的分级表达依赖于位于MB与HB之间的边界处的峡部组织所表达的WNT1进行的信号传导。
如所附实施例所示,在4-9DDC时,多个干细胞与无翼(WNT)信号传导激活剂CHIR99021接触(图6)。在一个具体的非限制性实施方案中,细胞与WNT信号传导激活剂接触约4-6天,优选约5天。在进一步的实施方案中,细胞在4-9DDC与WNT信号传导激活剂接触。
在一个实施方案中,在干细胞已经与至少一种RA信号传导激活剂接触后,多个干细胞与无翼(WNT)信号传导激活剂接触。优选地,在干细胞已经与至少一种RA信号传导激活剂接触后约24小时,诸如在干细胞已经与至少一种RA信号传导激活剂接触后约36小时、诸如约48小时、诸如约60小时、诸如约72小时、诸如约84小时、诸如约96小时,多个干细胞与无翼(WNT)信号传导激活剂接触。
因此,应当理解,该方法可以包含使多个干细胞依次与至少一种视黄酸(RA)信号传导激活剂和无翼(WNT)信号传导激活剂接触,并且优选地,干细胞在无翼(WNT)信号传导激活剂之前依次与至少一种视黄酸(RA)信号传导激活剂接触。
在一个实施方案中,该方法不包含使多种干细胞在与至少一种视黄酸(RA)信号传导激活剂接触的同时与无翼(WNT)信号传导激活剂接触。
关于信号通路的“WNT”或“无翼”包括由Wnt家族配体和Wnt家族受体构成的信号通路,诸如Frizzled和Derailed/RYK受体,用或不用β连环蛋白介导。出于本文所述的目的,优选的WNT信号传导通路包括β-连环蛋白的介导,即典型的WNT信号传导。
例如,WNT信号传导激活剂可以是糖原合酶激酶3(GSK3)抑制剂。抑制剂GSK3抑制剂的非限制性示例包括CHIR9902、NP031112、TWSl 19、SB216763、CHIR-98014、AZD2858、AZD1080、SB415286、LY2090314和1。在某些方面,WNT信号传导激活剂可以是购自MiltenyiBiotech的CHIR99021。在某些方面,WNT信号传导激活剂可以0.6-10μM使用
在一个实施方案中,该方法不包含使多个干细胞在与至少一种视黄酸(RA)信号传导激活剂接触的同时与成纤维细胞生长因子(FGF)家族信号传导激活剂接触。
在一个实施方案中,FGF信号传导激活剂是FGF8a,成纤维细胞生长因子8基因产物的剪接变体,其产生预测分子量为21kDa的蛋白质。
在一个优选的实施方案中,至少一种视黄酸(RA)信号传导激活剂选自包含以下项的组:视黄酸类似物;RARα激动剂;RARβ激动剂;RARγ激动剂;和RXR激动剂。
“类似物”包括与主题化合物具有相似物理、化学、生化或药理学特性的化合物。
RARα、RARβ、RARγ和/或RXR“激动剂”包括加强、诱导或增强RARα、RARβ、RARγ和/或RXR信号传导的任何化合物/分子。此类化合物/分子可能参与视黄酸下游的信号传导,或者是小分子激动剂。用于测试化合物/分子是否能够诱导或增强信号传导通路的活性的方法是技术人员已知的。
RARα激动剂;RARβ激动剂;RARγ激动剂;和RXR激动剂的非限制性示例包括:CD3254、二十二碳六烯酸、Fluorobexarotene、LG 100268、SR 11237、AC 261066、AC 55649、阿达帕林、AM 580、AM 80、BMS 753、BMS 961、CD 1530、CD 2314、CD 437、Ch 55、TTNPB。在一个优选的实施方案中,激动剂是选择性激动剂(例如,如果激动剂对RARα表现出比RARβ更大的选择性,则称该激动剂是选择性的。
在一个优选的实施方案中,至少一种视黄酸(RA)信号传导激活剂选自包含以下项的组:视黄酸、全反式视黄酸;AM 580;TTNPB;Ch 55;CD437;BMS 961;BMS 753;AM 80;CD2314;AC 261066;AC 55649;CD 1530;阿达帕林;他扎罗汀酸;他扎罗汀;EC 19;EC23;或其功能类似物、异构体、代谢物或衍生物。
应当理解,9-顺式视黄酸(9cRA)是全反式视黄酸(ATRA)的异构体。
CYP26基因家族(CYP26A1、CYP26B1、CYP26C1)编码细胞色素p450家族的酶,这些酶通过氧化代谢RA(Thatcher,J.E.&Isoherranen,N.《药物代谢和毒理学专家意见(ExpertOpin.Drug Metab.Toxicol.)》5,875–86(2009))。CYP26A1由最靠近头侧的神经外胚层表达,并且有助于防止在神经发育的早期阶段HB身份向头侧延伸(参考文献22)。此外,在HB的AP模式中,通过CYP26蛋白诱导的自我增强降解对RA信号传导的负反馈调节对于形成RA梯度和缓冲RA水平的波动是重要的(White,R.J.&Schilling,T.F.《发育动力学(Dev.Dyn.)》237,2775–2790(2008)和Schilling,T.F.,Nie,Q.&Lander,A.D.《遗传学与发展的最新观点(Curr.Opin.Genet.Dev.)》22,562–569(2012))。
不受理论的束缚,本发明人假设他扎罗汀酸;他扎罗汀和内源性类视黄醇9-顺式和13-顺式以及ATRA可被CYP26降解。其他合成类视黄醇如EC23不能被CYP26酶降解。
从所附实施例可以看出,本发明人测试了四种可降解的RA类似物(全反式,9-顺式,13-顺式RA他扎罗汀酸),并且在48小时处理(即0至2DDC)后,它们都可以诱导腹侧中脑多巴胺能(vMB)祖细胞,其特征为LMX1A+/NKX2.1-图9b(补充图3b)。当CYP26活性被阻断时,这种vMB诱导反应消失。不可降解的EC23在48小时的处理中不能诱导vMB祖细胞,但在较低的EC23浓度下(即0至1DDC)一天的处理中可以诱导LMX1A+/NKX2.1祖细胞。如上所述,技术人员可以使用已知的技术如滴定来确定本发明方法中所需的视黄酸(RA)信号传导激活剂的有效量。
因此,通过激活RARα、RARβ、RARγ和/或RXR受体而发挥作用并经历CYP26降解的视黄酸(RA)信号传导激活剂及其不可降解的类似物也包括在本文中。
在一个实施方案中,至少一种视黄酸(RA)信号传导激活剂可被CYP26酶降解。
在一个优选的实施方案中,至少一种视黄酸(RA)信号传导激活剂选自包含以下项的组:视黄酸;和全反式视黄酸,如9-顺式RA和13-顺式RA,和他扎罗汀酸。
存在三种立体异构形式的RA,全反式视黄酸(ATRA)、9-顺式视黄酸(9cRA)和13-顺式视黄酸(13cRA),它们对视黄酸受体表现出不同的结合亲和力。ATRA和13cRA只能有效地与RAR结合,但9cRA是核受体RAR和RXR两者的配体。全反式视黄酸和视黄酸在本文中可互换使用。
他扎罗汀酸是他扎罗汀的一种活性代谢物,是与RARα、RARβ和RARγ结合的类视黄醇受体(RAR)的强效选择性激动剂。他扎罗汀酸相对选择性地激活RARβ和RARγ。他扎罗汀酸是人类视黄酸羟化酶CYP26A1和CYP26B1的第一种外源性底物。
9-顺式视黄酸(9cRA)是全反式视黄酸(ATRA)的异构体,两者都是由共同的前体维生素A合成的脂质分子9cRA是视黄酸X受体(RXR)和视黄酸受体(RAR)的强效激动剂。它具有神经营养功能,促进神经元分化,并可能在治疗中风方面具有治疗潜力。它还调节细胞因子分泌和淋巴细胞增殖。9cRA有利于多巴胺细胞的存活并在神经退行性疾病如帕金森氏病中诱导神经保护。它引发抗炎功能并刺激肥大细胞并抑制白细胞介素4和5的表达水平。9cRA正处于治疗难治性癌症的II期临床试验中。
13-顺式视黄酸(13cRA)是全反式视黄酸(ATRA)的异构体,并且具有抗炎和抗肿瘤作用。RA的作用是通过RAR-β和RAR-α受体介导的。RA减弱细胞因子刺激的鼠系膜细胞中的iNOS表达和活性。它诱导线粒体膜通透性转变,观察为肿胀和膜电位降低,并通过细胞凋亡通路刺激细胞色素c的释放,涉及多种机制。这些活性被EGTA和环孢菌素A逆转。RA还通过增加转录部分增加MMP-1蛋白的表达。
在一个具体的非限制性实施方案中,细胞与至少一种TGFβ/激活素节点信号传导抑制剂(即第一SMAD抑制剂)(例如SB431542)以约5μΜ的浓度接触约7天(即0天至7DDC天);与至少一种BMP信号传导抑制剂(即第二SMAD抑制剂)(例如DMH1)以约250nM的浓度接触约7天(即0至7DDC);与至少一种Hh信号传导激活剂(例如SAG 1.3)以约300nM的浓度接触约9天(即0至9DDC),或接触约8天(即1至9DDC);和与至少一种视黄酸(RA)信号传导激活剂(例如EC23)以约20nΜ的浓度接触约1天(即0至1DDC、或1至2DDC、或2至3DDC、或3至4DDC。
在一个具体的非限制性实施方案中,细胞与至少一种TGFβ/激活素节点信号传导抑制剂(即第一SMAD抑制剂)(例如SB431542)以约5μΜ的浓度接触约7天(即0天至7DDC);与至少一种BMP信号传导抑制剂(即第二SMAD抑制剂)(例如DMH1)以约250nM的浓度接触约7天(即0至7DDC);与至少一种Hh信号传导激活剂(例如SAG 1.3)以约300nM的浓度接触约9天(即0至9DDC),或接触约8天(即1至9DDC);和与至少一种视黄酸(RA)信号传导激活剂(例如ATRA)以约300nΜ的浓度接触约2天(即0至2DDC、或1至3DDC、或2至4DDC)。
在一个实施方案中,细胞与本文所述的激活剂和抑制剂以有效增加细胞中LMX1A、LMX1B、FOXA2和OTX2中一种或多种的可检测表达水平的浓度和时间接触。
在一个优选实施例中,至少一种视黄酸(RA)信号传导激活剂来自外源。
“外源”包括至少一种视黄酸(RA)信号传导激活剂从生物体(干细胞)或系统外引入或产生。换句话说,至少一种视黄酸(RA)信号传导激活剂不是来自内源,即不是在生物体(干细胞)或系统内产生或合成。
在一个优选实施方案中,在足以引起干细胞分化以产生包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养所述干细胞在二维和/或三维细胞培养物中进行。
在一个实施方案中,细胞可以在二维(2D)细胞培养物中培养。这种类型的细胞培养物为本领域技术人员所熟知。在二维细胞培养物中,细胞在平的塑料培养皿诸如培养皿、烧瓶和多孔板上生长。生物衍生的基质(如纤维蛋白、胶原蛋白和本文所述)和合成水凝胶(如PAA、PEG)可用于促进2D细胞培养。
“三维细胞培养”或“3D细胞培养”包括细胞在人工创造的环境中生长,在该环境中,允许细胞在所有三维空间中生长或与其周围环境相互作用。3D细胞培养的条件是本领域已知的。例如,为了实现细胞培养物的三维特性,细胞在基质或支架中生长或分化。原则上,可用于三维细胞培养物的合适基质或支架是本领域技术人员已知的。因此,此类基质或支架可以是任何基质或支架。例如,基质或支架可以是包含天然分子或合成聚合物的细胞外基质。
在一个优选实施方案中,细胞群包含治疗有效量的腹侧中脑多巴胺能祖细胞。
“治疗有效量”包括足以在治疗时影响有益或期望的临床结果的量。可以以一个或多个剂量来施用有效量。就治疗而言,有效量是足以减轻、改善、稳定、逆转或减缓神经退行性疾病诸如帕金森氏病的进展,或以其他方式减少神经退行性疾病诸如帕金森氏病的病理后果的量。有效量通常由医师根据具体情况确定并且在本领域技术人员的技术范围内。在确定达到有效量的适当剂量时,通常会考虑几个因素。这些因素包括受试者的年龄、性别和体重、所治疗的病症、病症的严重程度以及所施用细胞的形式和有效浓度。
在一个实施方案中,该方法还包含将包含腹侧中脑多巴胺能祖细胞的群体分化为中脑多巴胺能神经元。
如所附实施例中所述,腹侧中脑多巴胺能祖细胞在7-9天内(7-9DDC)衍生自hPSCs。这些第7天细胞共表达FOXA2和LMX1A。这些第9天的细胞共表达FOXA2、LMX1A和OTX2,并且在以后的祖细胞阶段也保持这些标志物的表达。随着vMB DA祖细胞分化成有丝分裂后神经元,它们开始表达泛神经元标志物Tuj1,并且随后表达DA神经元递质调节因子NURR1。如所附实施例中所述,本发明人使用免疫细胞化学分析在12DDC观察到TuJ1+神经元的存在,表明神经发生的早期启动。在14DDC内,约80%来源于hPSCs的细胞群是表达FOXA2、LMX1A、LMX1B和OTX2的腹侧中脑多巴胺能祖细胞。
共表达FOXA2和LMX1A的腹侧中脑祖细胞可以与额外的小分子接触,以诱导进一步分化为到30DDC对TH、FOXA2和LMX1A呈阳性的成熟的中脑多巴胺能神经元。
在一个实施方案中,将包含腹侧中脑多巴胺能祖细胞的群体分化为中脑多巴胺能神经元包含进一步使vMB祖细胞与DA神经元谱系特异性激活剂和/或抑制剂接触,该激活剂和/或抑制剂包括但不限于脑源性神经营养因子(BDNF)、神经胶质细胞源性神经营养因子(GDNF)、抗坏血酸(AA)和γ-分泌酶抑制剂如DAPT(也称为((2S)-N-[(3,5-二氟苯基)乙酰基)-L-丙氨酰-2-苯基]甘氨酸1,1-二甲基乙酯)。在此,这个过程被称为“终末分化”。
在一个实施方案中,DA神经元谱系特异性激活剂和/或抑制剂包含在包含B27+补充物(也称为“B27+培养基”)的Neurobasal+培养基中,称为“终末分化培养基”(赛默飞世尔,A3653401)。应当理解,神经元可以维持在本领域技术人员已知的适合支持培养物中的神经元的任何培养基中。
在一个实施方案中,腹侧中脑祖细胞以约1至50ng/mL、或约5至40ng/mL、或约5至30ng/mL、或约10至20ng/mL的浓度与BDNF接触。在某些实施方案中,细胞以约10ng/mL的浓度与BDNF接触。
在一个实施例中,腹侧中脑祖细胞以约1至50ng/mL、或约5至40ng/mL、或约5至30ng/mL、或约10至20ng/mL的浓度与GDNF接触。在某些实施方案中,细胞以约10ng/mL的浓度与BDNF接触。
在一个实施方案中,腹侧中脑祖细胞与以约50至500μM、或约100至400μM、或约150至300μM、或约180至250μM的浓度与AA接触。在某些实施方案中,细胞以约200μM的浓度与AA接触。
在一个实施方案中,腹侧中脑祖细胞以约1至100μM、或约5至50μM、或约10至20μM的浓度与DAPT接触。在某些实施方案中,细胞以约10μM的浓度与AA接触。
在一个实施方案中,在终末分化之前,在第16天和第25天之间(即在16-25DDC)再次将腹侧中脑祖细胞重新铺板,以避免过高的培养物密度和细胞脱离。
在一个具体的非限制性实施方案中,为了在体外终末分化成多巴胺能神经元,在23或24DDC解离腹侧中脑祖细胞,并将其铺板在B27+培养基中的包被表面上,该培养基补充有BDNF(10ng/ml)和GDNF(10ng/ml)(美天旎生物技术公司)、抗坏血酸(0.2mM)(西格玛)和任选的10μM DAPT(美天旎生物技术公司),直到达到所需的成熟阶段。
在一个实施方案中,腹侧中脑祖细胞与DA神经元谱系特异性激活剂和/或抑制剂接触至少约2、3、4、5、6、7、8、9、10、14天或更多天,例如,在从腹侧中脑祖细胞终末分化为成熟多巴胺能神经元的整个过程中。在一个实施方案中,腹侧中脑祖细胞在整个终末分化过程中与BDNF、GDNF和AA接触。在一个实施方案中,γ-分泌酶抑制剂(如DAPT)仅与腹侧中脑祖细胞接触约7天。
已发现中脑多巴胺能神经元的发育起源不同于其他神经元,因为它们并非源自PAX6+神经上皮祖细胞,而是源自FOXA2+/LMX1A+腹侧中脑祖细胞。
“中脑多巴胺能神经元”或“中脑多巴胺神经元”是指在培养物中至少部分采用特征性神经元形态、表达一种或多种中脑多巴胺能神经元标志物(例如酪氨酸羟化酶(TH))、产生和/或释放多巴胺;和/或获得典型的中脑多巴胺神经元的电生理特性。任选地,中脑多巴胺能神经元另外表达核受体相关1(NURR1);成对样式的同源结构域3(PITX3)、GIRK2、囊泡单胺转运蛋白(VMAT2)和突触素中的一种或多种。术语“中脑多巴胺能神经元”可以互换使用。
体外mDA神经元的功能成熟可以通过多巴胺(DA)的产生和释放以及通过确定多巴胺神经元获得自发动作电位、诱发动作电位以及电压依赖性Na+和K+电流的时间来监测。通过本发明的方法衍生的多巴胺神经元显示出自发的动作电位和诱发动作电位两者,其可以在40DDC下被记录(参见图4n)。不受理论的束缚,这些数据表明基于RA的分化导致在培养40天内(即第40DDC天)产生表现出成熟功能特征的mDA神经元。如所附实施例所示,多巴胺能神经元也表达成熟神经元标志物突触素和单胺能标志物囊泡单胺转运蛋白(VMAT2)。一子组细胞表达GIRK2或CALBINDIN,表明中脑多巴胺神经元的A9和A10样亚型的存在。在培养的第30-40天(30-40DDC天)之间,神经元显示出轴突生长和复杂性的显著增加。
在一个优选实施方案中,中脑多巴胺能神经元表达叉头盒蛋白A2(FOXA2)、LIM同源盒转录因子1α(LMX1A)、LIM同源盒转录因子1β(LMX1B)、正齿同源盒2(OTX2)、核受体相关1(NURR1);成对样式的同源结构域3(PITX3)、GIRK2、囊泡单胺转运蛋白(VMAT2)、突触素和酪氨酸羟化酶(TH)中的一种或多种。
“Tuj1”也称为“13111微管蛋白”,包括一种在人类中由TUBB3基因编码的蛋白质。蛋白质13111微管蛋白(TuJ1)存在于新产生的未成熟有丝分裂后神经元和分化的神经元中。人类Tuj可以包含Uniprot编号Q13509中所示的序列。术语Tuj1涵盖任何Tuj1核酸分子或多肽,并且也可包含其片段或变体。本领域技术人员知道如何检测Tuj1,并且这些方法也在所附实施例中描述。
“NURR1”是人类中由NR4A2基因编码的蛋白质,并且是31种细胞内转录因子的核受体家族的成员。NURR1在维持大脑多巴胺能系统中起关键作用。人类NURR1可以包含如Uniprot编号P43354所描述的蛋白质序列。术语NURR1涵盖任何NURR1核酸分子或多肽,并且还可以包含其片段或变体。本领域技术人员知道如何检测NURR1。此类方法也在所附实施例中进行了描述。
“GIRK2”(见图5g)是一种富含A9型DA神经元的标志物。
“Pitx3”也是一种特异性mDA神经元标志物,并在mDA神经元及其有丝分裂后前体中特异性表达。mDA神经元分化的最后阶段随着Pitx3+细胞和Th+细胞向腹部迁移而进行。人类Pitx3可包含如Uniprot编号O75364所示的蛋白质序列。术语Pitx3包含任何Pitx3核酸分子或多肽,并且也可以包括其片段或变体。本领域技术人员知道如何检测Pitx3。此类方法也在所附实施例中进行了描述。
“TH”是指酪氨酸羟化酶/酪氨酸3-单加氧酶/酪氨酸酶,一种在人体中由TH基因编码的蛋白质。TH是负责催化氨基酸L-酪氨酸转化为L-3,4-二羟基苯丙氨酸(L-多巴)的酶。人类TH可以包含Uniprot编号P07101的蛋白质序列。术语TH涵盖任何TH核酸分子或多肽并且还可以包含其片段或变体。本领域技术人员知道如何检测TH。此类方法也在所附实施例中进行了描述。
在一个优选实施方案中,包含分化的中脑多巴胺能神经元的群体可在首次使多个干细胞与至少一种视黄酸(RA)信号传导激活剂接触后约30-40天内获得。
如上所述,通过本发明的方法衍生的分化的多巴胺神经元显示出可以在40DDC记录的自发动作电位和诱发动作电位(见图4n)。不受理论的束缚,这些数据表明基于RA的分化导致在培养40天内(即40DDC)产生表现出成熟功能特征的mDA神经元。
在一个实施方案中,使细胞与本文所述的DA神经元谱系特异性激活剂和/或抑制剂以有效增加DA神经元的一种或多种标志物的可检测表达水平的浓度和时间接触,例如叉头盒蛋白A2(FOXA2)、LIM同源盒转录因子1α(LMX1A)、LIM同源盒转录因子1β(LMX1B)、正齿同源盒2(OTX2)、核受体相关1(NURR1);成对样式的同源结构域3(PITX3)、GIRK2、囊泡单胺转运蛋白(VMAT2)、突触素和酪氨酸羟化酶(TH)。
如所附实施例所示,TH+多巴胺能神经元在30-35DDC表达mDA神经元标志物LMX1A、LMX1B、FOXA2、NURR1和OTX2(图4e)。
在一个优选的实施方案中,包含分化的中脑多巴胺能神经元的群体可在约30-40DDC内、诸如约在31DDC内、诸如约在32DDC内、诸如约在33DDC内、诸如约在34DDC内、诸如约在35DDC内、诸如约在36DDC内、诸如约在37DDC内、诸如约在38DDC内、诸如约在39DDC内、诸如约在40DDC内获得。
在一个优选实施方案中,在使多个干细胞首次与至少一种视黄酸(RA)信号传导激活剂接触后约30-40天内,总细胞群包含至少60%、诸如至少70%、或至少80%的中脑多巴胺能神经元。
在一个优选的实施方案中,总细胞群包含至少65%的中脑多巴胺能神经元,诸如至少66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%,或诸如至少80%的中脑多巴胺能神经元。
在一个优选实施方案中,在使多个干细胞首次与至少一种视黄酸(RA)信号传导激活剂接触后约30-40天内,神经元细胞群包含至少70%、诸如至少80%或至少90%的中脑多巴胺能神经元。
在一个优选的实施方案中,神经元细胞群包含至少70%、71%、72%、73%、74%、75%的中脑多巴胺能神经元,诸如至少76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或诸如至少90%的中脑多巴胺能神经元。
“总细胞群”包括群体中对核标志物DAPI呈阳性的所有细胞。“神经元细胞群”包括细胞群中的所有神经元,诸如群中对神经元标志物HuCD呈阳性的所有细胞。如所附实施例中所示,约80%的所有神经元在35DDC时是TH+(即中脑多巴胺能神经元),这相当于约65%的总DAPI+细胞(图4i,j)。
在一个方面,本发明提供一种筛选候选药物的方法,该方法包含(a)提供通过本发明的方法可获得或获得的腹侧中脑多巴胺能祖细胞群,或提供通过本发明的方法可获得或获得的分化的中脑多巴胺能神经元群;(b)使群体与候选药物接触;和(c)确定候选药物对细胞群的作用。
在一个方面,本发明提供一种筛选候选药物的方法,该方法包含(a)提供通过本发明的方法可获得或获得的腹侧中脑多巴胺能祖细胞群;(b)使群体与候选药物接触;和(c)确定候选药物对细胞群的作用。
通过本发明的方法产生的vMB祖细胞可用于筛选促进和/或增强培养物中神经元分化和成熟的因子(诸如小分子药物、肽和多核苷酸)或环境条件(诸如培养条件或操作)。
在一些应用中,vMBs可用于筛选促进祖细胞沿神经谱系成熟,或促进这些细胞在长期培养物中的增殖和维持的因子。例如,通过使候选神经成熟因子或生长因子与vMBs接触,然后根据细胞进一步培养和使用的理想标准,确定产生的任何表型变化,来测试候选神经成熟因子或生长因子。
在一个方面,本发明提供了一种筛选候选药物的方法,该方法包含(a)提供通过本发明的方法可获得或获得的分化的中脑多巴胺能神经元群;(b)使群体与候选药物接触;和(c)确定候选药物对细胞群的作用。
在一些应用中,分化的mDA可用于鉴定支持和/或增强mDA神经元存活的分子,且因此可用于治疗神经退行性疾病如帕金森氏病。
本发明的特定筛选应用涉及药物研究中药物化合物的测试。在某些实施方案中,通过本文所述方法产生的细胞可用作标准药物筛选和毒性测定的测试细胞(例如,以鉴定、确认和测试功能规范或测试治疗特定疾病的治疗分子的递送)。候选药物化合物活性的评估通常包括将在本发明的某些方面提供的腹侧中脑多巴胺能祖细胞群或中脑多巴胺能神经元群与候选化合物结合,确定可归因于该化合物的细胞的形态学、标志物表型或代谢活性的任何变化(与未处理的细胞或用惰性(对照)化合物处理的细胞相比),然后将该化合物的作用与观察到的变化相关联。进行筛选可能是因为该化合物被设计成对vMB多巴胺能祖细胞或多巴胺能神经元具有药理学作用,或者是因为被设计成对其他地方具有作用的化合物可能具有非预期的神经副作用。如将理解的,可以组合测试两种或更多种药物(通过同时或依次与细胞结合),以检测可能的药物-药物相互作用效应。
在某些应用中,最初筛选化合物的潜在神经毒性。细胞毒性可以首先通过对细胞存活力、存活、形态学的影响或本领域已知的其他技术来确定。进行更详细的分析以确定化合物是否会影响细胞功能(诸如神经传递)而不引起毒性。
在一个方面,本发明提供了一种用于提供以下富集群体的方法:
i.腹侧中脑多巴胺能祖细胞,其中该方法包含将多个干细胞与有效量的至少一种视黄酸(RA)信号传导激活剂接触,并在足以引起干细胞分化成包含腹侧中脑多巴胺能祖细胞的细胞群的条件下培养干细胞;或者
ii.中脑多巴胺能(DA)神经元,其中该方法包含在(i)中定义的方法,并且还包含将包含腹侧中脑多巴胺能祖细胞群分化为中脑多巴胺能神经元。
如本文所用,术语“富集群体”指细胞群,诸如培养皿中的细胞群,其以比对照群体更高的百分比或数量表达标志物,例如,免疫细胞化学证实,与在17DDC和21DDC时使干细胞与至少一种WNT信号传导激活剂和至少一种Hh信号传导激活剂(例如SAG)接触相比,使干细胞与至少一种RA信号传导激活剂和至少一种Hh信号传导激活剂(例如SAG)接触导致中脑多巴胺能神经元的富集群体(图4c)。
在其他示例中,富集群体是从不表达所需标志物的细胞中分选或分离表达一种或多种标志物的细胞而得到的群体,诸如FOXA2+和LMX1A+富集群体、A9富集群体等。应当理解,可以针对至少一种腹侧中脑多巴胺能祖细胞或中脑多巴胺能神经元的标志物对通过本发明的方法产生的细胞群进行分类。
在一个实施方案中,在中脑多巴胺能神经元的富集群体中,至少60%,诸如至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的细胞对中脑多巴胺能神经元的标志物呈阳性。在一个实施方案中,中脑多巴胺能神经元的富集群体包含至少1x10
在一个实施方案中,在腹侧中脑多巴胺能祖细胞的富集群体中,至少60%,诸如至少65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的细胞对腹侧中脑多巴胺能祖细胞的标志物呈阳性。在进一步的方面,通过实施方案的方法产生的中脑DA神经元的富集群体包含至少1x10
在一个方面,本发明提供了一种神经元细胞群,其包含治疗有效量的通过本文公开的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,任选地,其中至少60%、诸如至少65%、诸如至少70%、诸如至少75%、或至少80%的细胞群是腹侧中脑多巴胺能祖细胞。
在一个优选的实施方案中,至少约80%的神经元细胞群表达叉头盒蛋白A2(FOXA2)、LIM同源盒转录因子1α(LMX1A)、LIM同源盒转录因子1β(LMX1B)和正齿同源盒2(OTX2)。
如本文所述,腹侧中脑多巴胺能祖细胞在最初暴露于RA后7天内(即第7DDC天)衍生自hPSCs。这些7DDC细胞共表达FOXA2和LMX1A。如在所附实施例中可以看到的,在14DDC时,约80%衍生自hPSCs的细胞群是共表达FOXA2、LMX1A、LMX1B和OTX2以及vMB标志物CORIN(图2g)的腹侧中脑多巴胺能祖细胞,如通过免疫细胞化学确定的。因此,应当理解,这是富含腹侧中脑多巴胺能祖细胞的细胞群。
在一个方面,本发明提供了分化的细胞群体,其包含治疗有效量的通过本文公开的任何方法获得或可获得的中脑多巴胺能神经元,任选地,其中至少60%、诸如至少65%、诸如至少70%、诸如至少75%、或至少80%的总细胞是中脑多巴胺能神经元。
如所附实施例中所示,约80%的所有神经元在35DDC时是TH+(即中脑多巴胺能神经元),这相当于约65%的总DAPI+细胞(图4i,j)。因此,应当理解,这是富含中脑多巴胺能神经元的细胞群。
在一个方面,本发明提供至少一种视黄酸(RA)信号传导激活剂用于将干细胞分化为腹侧中脑多巴胺能祖细胞的用途。
在一个优选的实施方案中,将干细胞分化成腹侧中脑多巴胺能祖细胞如本文所述。
在一个方面,本发明提供了一种分离的细胞群,其包含治疗有效量的腹侧中脑多巴胺能祖细胞。
在一个方面,本发明提供了一种分离的细胞群,其包含治疗有效量的通过本文所述的方法获得或可获得的腹侧中脑多巴胺能祖细胞。
在一个方面,本发明提供了一种分离的细胞群,其包含治疗有效量的中脑多巴胺能神经元。
在一个方面,本发明提供了一种分离的细胞群,其包含治疗有效量的通过本文所述的方法获得或可获得的中脑多巴胺能神经元。
当提到一种材料时,“分离的”包括一种部分或完全与自然伴随它的其他材料去除的材料。因此,关于细胞群,术语“分离的”是指在体内基本上没有伴随它的其他细胞群的细胞。
在一个实施方案中,所述分离的群体来自选自由哺乳动物、灵长类动物、人类和具有帕金森氏病(PD)症状的患者组成的组的细胞群。
在进一步的实施方案中,在稳定的冷冻溶液中提供分离的细胞群,其包含活的腹侧中脑多巴胺能祖细胞,或中脑多巴胺能神经元,或其混合物。在一些实施方案中,稳定冷冻溶液中的分离的细胞群由至少60%、65%、70%、75%、80%、85%、90%或95%的对FoxA2和/或Lmx1a表达呈阳性的细胞构成。在进一步的方面,在一个冻融循环后,实施方案的群体包含至少约40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%的活vMBs。
稳定的冷冻溶液包含一种或多种细胞培养基、蛋白酶或蛋白酶混合物、稳定剂(例如,DMSO或甘油)、生长因子、缓冲液或细胞外基质成分。在进一步的实施例中,提供了一种密封小瓶。
在一个优选的实施方案中,至少约80%的细胞群表达叉头盒蛋白A2(FOXA2)、LIM同源盒转录因子1α(LMX1A)、LIM同源盒转录因子1β(LMX1B)和正齿同源盒2(OTX2)。
在一个方面,本发明提供了用于医学的药物组合物,其包含细胞群,该细胞群包含治疗有效量的如本文任何方面或实施方案中所述和/或通过本文所述任何方法获得或可获得的腹侧中脑多巴胺能祖细胞。
在一个优选的实施方案中,药物组合物还包含药学上可接受的载体、稀释剂和/或赋形剂。
在干细胞分化成本文所述的腹侧中脑多巴胺能祖细胞之后,在一个实施方案中,可以制备细胞用于移植。细胞可以悬浮在生理上可接受的载体中,诸如细胞培养基(例如Eagle氏基本培养基)、磷酸盐缓冲盐水或人工脑脊液(aCSF)。待植入的细胞悬浮液的体积将根据植入部位、治疗目标和溶液中的细胞密度而变化(Nolbrant,Sara,等人"(用于体外成熟和脑内移植的高纯度人腹侧中脑多巴胺能祖细胞的产生(Generation of high-purity human ventral midbrain dopaminergic progenitors for in vitromaturation and intracerebral transplantation.))"《自然实验手册》12.9(2017):1962)。
药学上可接受的载体和稀释剂包括盐水、水性缓冲溶液、溶剂和/或分散介质。此类载体和稀释剂的使用在本领域中是众所周知的。该溶液优选是无菌的和流动的。合适地,溶液在生产和储存条件下是稳定的,并且通过使用例如对羟基苯甲酸酯、氯代丁醇、苯酚、抗坏血酸或硫柳汞来防止微生物诸如细菌和真菌的污染作用。本发明的溶液可以通过将如本文所述的细胞掺入药物上可接受的载体或稀释剂中以及根据需要掺入其他成分来制备。
本公开的腹侧中脑多巴胺能祖细胞和包含所述细胞的药物组合物可以方便地以无菌液体制剂(例如等渗水溶液、悬浮液、乳液、分散液或粘性组合物)的形式提供,其可以缓冲至选定的pH,液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。此外,液体组合物在施用稍微更方便一些,尤其是通过注射施用。另一方面,粘性组合物可以在适当的粘度范围内配制,以提供与特定组织的更长接触时间。液体或粘性组合物可以包含载体,其可以是含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如甘油、丙二醇、液体聚乙二醇等)和其合适的混合物的溶剂或分散介质。无菌可注射溶液可通过将本文公开的主题的组合物(例如包含本文公开的干细胞衍生的前体的组合物)掺入所需量的适当溶剂中,并根据需要掺入不同量的其他成分来制备。这种组合物可以与合适的载体、稀释剂或赋形剂如无菌水、生理盐水、葡萄糖、右旋糖等混合。该组合物也可以被冻干。组合物可以含有辅助物质,如润湿剂、分散剂或乳化剂(例如甲基纤维素)、pH缓冲剂、胶凝或增粘添加剂、防腐剂、调味剂、色素等,这取决于取决于施用途径和所需的制剂。
可以添加提高组合物稳定性和无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。可以通过各种抗菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等)来确保防止微生物的作用。可注射药物形式的延长吸收可通过使用延迟吸收的试剂(例如明矾尿烷单硬脂酸酯和明胶)来实现。然而,根据当前公开的主题,所使用的任何载体、稀释剂或添加剂必须与本公开的腹侧中脑多巴胺能祖细胞相容。
如果需要,可以使用药学上可接受的增稠剂将组合物的粘度保持在选定的水平。可以使用甲基纤维素,因为它容易且经济地获得并且易于使用。其他合适的增稠剂包括例如黄原胶、羧甲基纤维素、羟丙基纤维素、卡波姆等。增稠剂的浓度可以取决于所选择的试剂。重要的一点是使用能够达到所选粘度的量。合适的载体和其他添加剂的选择将取决于确切的施用途径和特定剂型的性质,例如液体剂型(例如,是否将组合物配制成溶液、悬浮液、凝胶或另一液体形式,如缓释形式或充液形式)。
应当理解,组合物的成分应当选择为化学惰性的,并且不会影响本公开的腹侧中脑多巴胺能祖细胞的存活力或功效。
在一个优选的实施方案中,药物组合物被配制用于移植。
在一个方面,本发明提供了一种用于在体外将多个干细胞分化成腹侧中脑多巴胺能祖细胞或分化成中脑多巴胺能神经元的试剂盒,该试剂盒包含:
-至少一种视黄酸(RA)信号传导激活剂;
-至少一种索尼克豪猪(SHH)信号传导激活剂;
-至少一种TGFβ/激活素-节点信号传导抑制剂;和/或
-至少一种骨形态发生蛋白(BMP)信号传导抑制剂。
在一个实施方案中,该试剂盒还包含一种或多种用于细胞粘附的底物。用于细胞粘附的非限制性底物包括胶原、明胶、聚-L-赖氨酸、聚-D-赖氨酸、聚-L-鸟氨酸、层粘连蛋白、玻连蛋白和纤连蛋白及其混合物如Matrigel或Geltrex,以及裂解的细胞膜制剂。
在一个实施方案中,该试剂盒还包含多个腹侧中脑多巴胺能祖细胞或中脑多巴胺能神经元的标志物。
在一个方面,本发明提供了一种试剂盒,其包含治疗有效量的通过本文所述的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,以及一种或多种多巴胺能神经元谱系特异性激活剂和/或抑制剂。
在进一步的实施方案中,所必需的一种或多种DA神经元谱系特异性激活剂和/或抑制剂适用于腹侧中脑多巴胺能祖细胞终末分化为中脑多巴胺能神经元。此类成分如上所述,并且包括但不限于脑源性神经营养因子(BDNF)、神经胶质细胞源性神经营养因子(GDNF)、抗坏血酸(AA)、抗坏血酸(AA)和γ-分泌酶抑制剂如DAPT(也称为(2S)-N-[(3,5-二氟苯基)乙酰基]-L-丙氨酰-2-苯基]甘氨酸1,1-二甲基乙酯)。适用于终末分化所需的一种或多种特异性活化剂和/或抑制剂可以包含在B27+培养基中,或单独提供。
在一个实施方案中,该试剂盒包含用于向患有神经退行性疾病或以中脑多巴胺能神经元丧失为特征的疾病和/或病症的受试者施用本公开的腹侧中脑多巴胺能祖细胞群或包含其的组合物的说明。
在一个方面,本发明提供了一种细胞群,其包含治疗有效量的如本文任何方面或实施方案中所述和/或通过本文所述的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,用于医学。
在一个方面,本发明提供了一种细胞群,其包含治疗有效量的如本文任何方面或实施方案中所述和/或通过本文所述的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,用于治疗或预防受试者的神经变性和/或受试者中以脑多巴胺能神经元丧失为特征的疾病和/或病症。
在一个方面,本发明提供了一种用于治疗或预防受试者的神经变性和/或受试者中以脑多巴胺能神经元丧失为特征的疾病和/或病症的方法,该方法包含以有效治疗或预防受试者的神经变性和/或疾病和/或受试者中以脑多巴胺能神经元丧失为特征的疾病和/或病症的量向受试者施用细胞群,该细胞群包含治疗有效量的如本文任何方面或实施方案所述和/或通过本文所述的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞。
在一个方面,本发明提供了细胞群的用途,该细胞群包含治疗有效量的如本文任何方面或实施方案中所述和/或通过本文所述的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,用于制造治疗或预防受试者的神经变性和/或受试者中以脑多巴胺能神经元丧失为特征的疾病和/或病症所用的药物。
“受试者中的神经变性”包括作为受试者中神经变性过程的结果的神经元功能的进行性丧失。中脑腹侧黑质中DA神经元的选择性丧失可引起神经变性。还包括由神经退行性疾病引起的神经退行性疾病,包括但不限于帕金森氏病、亨廷顿病、阿尔茨海默氏病和多发性硬化症。
“以中脑多巴胺能神经元丧失为特征的疾病和/或病症”包括受试者中表现出由多巴胺能神经元丧失引起的症状的任何疾病和/或病症。目前认为SNpc中的神经元丧失是由线粒体损伤、能量衰竭、氧化应激、兴奋性毒性、蛋白质错误折叠及其聚集、蛋白质清除通路受损、细胞自主机制和/或朊病毒样蛋白质感染引起的。如上所述,DA产生神经元的区域来自被盖,并且被称为黑质致密部(SNc,A9组)和腹侧被盖区(VTA,A10组)。本领域技术人员知道SNc的中脑多巴胺能(mDA)神经元在控制多种脑功能中起重要作用。它们的轴突向头侧上升到皮质的背外侧纹状体,其中它们释放神经递质多巴胺。SNc的mDA神经元在帕金森氏病(PD)中选择性地经历变性,这是一种进行性神经退行性疾病,其特征是黑质中多巴胺能神经元的进行性丧失。mDA神经元的丧失导致纹状体中缺乏DA,DA在生理条件下控制身体的随意运动。鉴定中脑多巴胺能神经元丧失的方法是本领域已知的并且包括电生理学、测量诱发的多巴胺释放和行为分析。
在一个实施方案中,受试者中以中脑多巴胺能神经元丧失为特征的疾病和/或病症包括神经退行性疾病,包括但不限于帕金森氏病、帕金森综合征、阿尔茨海默氏病、中风、肌萎缩性侧索硬化、宾斯旺格病、亨廷顿舞蹈病、多发性硬化、重症肌无力和皮克病。在一个实施方案中,神经退行性疾病是帕金森氏病,其指与基底神经节中多巴胺不足有关的疾病,基底神经节是大脑中控制运动的部分。
帕金森氏病通常伴有感觉、睡眠和情绪问题。“帕金森症”或“帕金森综合征”是主要的运动症状。
帕金森综合征的非限制性示例包括路易体痴呆、特发性帕金森氏病(PD)、进行性核上性麻痹(PSP)、多系统萎缩(MSA)、皮质基底节变性(CBD)和血管性帕金森综合征(VaP)以及其他更罕见的帕金森综合征病因。
在一个实施方案中,神经退行性疾病是帕金森氏病(PD)。目前,PD分为原发性和继发性两种亚型。原发性帕金森综合征包括疾病的遗传和特发性形式,并且继发性帕金森综合征包括由药物、感染、毒素、血管缺陷、脑外伤或肿瘤或代谢功能障碍引起的形式。
帕金森氏病的主要运动症状包括,例如但不限于,
静息性震颤(手、臂、腿、颌、头、舌、唇、下巴的颤抖是在PD中观察到的主要运动症状)、僵硬、运动迟缓(缓慢运动)和姿势不稳定或平衡和协调受损。继发性运动症状包括弯腰姿势、前倾倾向、肌张力障碍、疲劳、精细和粗大运动协调受损、手臂摆动减少、静坐不能、痉挛、流口水、吞咽和咀嚼困难以及性功能障碍。PD患者常见的非运动症状包括抑郁、失眠和认知功能障碍。
可以由熟练的临床医生使用例如国际帕金森和运动障碍学会(MDS)定义的帕金森氏病临床诊断标准(MDS-PD标准)来诊断PD。
“在治疗”或“治疗”包括对受试者疾病的任何治疗,并且包括:抑制疾病,例如预防移植失败和/或缓解疾病,例如使一种或多种症状消退。例如,治疗可以包括缓解一种或多种选自包含静息性震颤、僵硬、运动迟缓(缓慢运动)和姿势不稳定或平衡和协调受损的组的神经症状
通常,给定治疗的功效可以由技术人员确定。然而,治疗被认为是如本文所用的术语的“有效的治疗”,如果任何一种或所有的体征或症状,例如震颤,以有益的方式改变,其他临床上可接受的症状得到改善,或甚至改善,例如,在用本文所述的细胞群治疗后改善至少10%。也可以通过由住院治疗、对药物干预的需要(即疾病的发展停止)或移植失败的发生率评估的个体不再恶化来测量疗效。测量这些指标的方法是本领域技术人员已知的和/或在本文中描述。在本发明的上下文中,可以在帕金森氏病的动物模型中评估疗效,例如,通过执行行为测试,如阶梯测试和圆柱测试。可以通过评估例如DA神经元植入/移植的物理指标来确定治疗的功效,这些物理指标为诸如包括静止性震颤、僵硬、运动迟缓(缓慢运动)和姿势不稳定或平衡和协调受损的神经症状。
“在预防”或“预防”通常包括减少或缩减受试者中病症或病症的发生,或延迟疾病或病症的一种或多种症状的发作。在本发明的上下文中,预防可以包括预防变性,即减少细胞损失,或减少细胞功能的损失,例如在多巴胺能神经元的情况下多巴胺的释放。预防还包括减少或降低源自多巴胺能祖细胞丧失和/或黑质神经元丧失的神经病症的严重性。
受试者可以是脊椎动物,更优选哺乳动物。哺乳动物包括但不限于农场动物,包括猪、灵长类动物、狗、马和啮齿动物。哺乳动物可以是人类、狗、猫、牛、猪、小鼠、大鼠等。因此,在一个实施方案中,受试者是脊椎动物。最优选地,受试者是人类受试者。受试者可以是患有神经退行性疾病如帕金森氏病的受试者。特别地,受试者可以是包含与家族性帕金森氏病相关的LRRK2-G2019S突变的受试者。受试者也可以是未患有神经退行性疾病如帕金森氏病的受试者。
腹侧中脑多巴胺能祖细胞或多巴胺能神经元可局部或全身施用于受试者。施用方法是本领域已知的。如果受试者接受来自他或她自己细胞的细胞,这称为自体移植;这种移植不太可能导致排斥反应。
将干细胞或分化的细胞施用于受试者,特别是人类受试者的示例性方法包括将细胞注射或移植到受试者的靶位点(例如,纹状体和/或黑质)。vMB祖细胞和/或DA神经元可以插入到递送装置中,该递送装置通过将细胞注射或移植到受试者中来促进引入。这种递送装置包括用于将细胞和流体注射到受体对象体内的管,例如导管。在一个优选的实施方案中,管另外具有针头,例如注射器,通过该针头可以将本发明的细胞在所需位置处引入受试者。vMB祖细胞可以不同形式插入这种递送装置,例如注射器。例如,细胞可以悬浮在溶液中,或者当包含在这种递送装置中时包埋在支持基质中。
可以掺入或包埋vMB前体的支持基质包括与受体相容并降解成对受体无害的产物的基质。支持基质可以是天然的(例如,胶原等)和/或合成的可生物降解的基质。合成生物可降解基质包括合成聚合物,如聚酸酐、聚原酸酯和聚乳酸。
如在所附实施例中可见,通过将6-羟基多巴胺(6-OHDA)单侧注射到内侧前脑束中以完全损伤右半球的黑质纹状体多巴胺能通路,在大鼠中诱导了帕金森氏病。在分化的第14天(14DDC)分离hPSC衍生的VM b-祖细胞,并且用细胞消化液解离成单细胞悬液,重悬于生理缓冲液如(HBSS缓冲液+脱氧核糖核酸酶)中至为37,500–75,000个细胞/μl的浓度,并移植入6-OHDA损伤侧的宿主大鼠纹状体。
在一个优选的实施方案中,受试者表现出至少一种神经症状,其中神经症状选自包含以下项的组:静息性震颤、僵硬、运动迟缓(缓慢运动)和姿势不稳和/或平衡和协调受损。
在一个优选的实施方案中,受试者表现出至少一种所述神经症状的减轻。
在一个优选的实施方案中,包含腹侧中脑多巴胺能祖细胞的群通过在允许细胞群体内移植的条件下移植到受试者中来施用。
在一个方面,本文所述的方法提供了一种用于增强在受试者中vMB祖细胞或DA神经元的植入的方法。在一个实施方案中,受试者可以是哺乳动物。在另一个实施方案中,哺乳动物可以是人类,尽管本发明对所有哺乳动物都有效。
移植可以是同种异体的(即同一物种的遗传不同成员之间)、自体的(即有机体自身细胞或组织的移植)、同基因的(即同一物种的遗传相同成员之间(例如同卵双胞胎))或异种的(即不同物种的成员之间)。
将本发明的任何方面或实施方案中描述的细胞移植到患有神经退行性疾病的患者的脑中导致丧失的、无功能和/或功能障碍的DA神经元的替代。将细胞以适合替代丧失和/或功能障碍的DA神经元的量引入患有神经退行性疾病的受试者,从而至少部分减少或减轻该疾病的至少一种副作用或症状。细胞可以通过任何合适的途径施用于受试者,该途径导致将细胞递送到受试者中至少一部分细胞保持存活的期望位置。
优选至少约5%、优选至少约10%、更优选至少约20%、还更优选至少约30%、还更优选至少约40%、且最优选至少约50%或更多的细胞在移植入受试者后保持存活。施用于受试者后,细胞的存活期可以短至几小时,例如24小时,至几天,长至几周到几个月。应当理解,可以使用技术人员已知的可用于将细胞递送至受试者的任何移植方法(Parmar,Malin."以干细胞为基础的帕金森氏病疗法(Towards stem cell based therapies forParkinson's disease.)"《发展(Development)》145.1(2018):dev156117)。
在一个方面,本发明提供了一种细胞群,其包含治疗有效量的本文任何方面或实施方案中所述和/或通过本文所述任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,用于移植到有需要的受试者中。
在一个方面,本发明提供了一种将细胞群移植到有需要的受试者体内的方法,该细胞群包含治疗有效量的如本文任何方面或实施方案中所述和/或通过本文所述任何方法获得或可获得的腹侧中脑多巴胺能祖细胞
在一个方面,本发明提供了细胞群的用途,该细胞群包含治疗有效量的如本文任何方面或实施方案中所述和/或通过本文所述的任何方法获得或可获得的腹侧中脑多巴胺能祖细胞,用于制造移植到有需要的受试者中的药物。
在一个优选的实施方案中,受试者患有或有患神经退行性疾病的风险,所述神经退行性疾病选自包含以下项的组:帕金森氏病、帕金森综合征、阿尔茨海默氏病、中风、肌萎缩性侧索硬化、宾斯旺格氏病、亨廷顿舞蹈病、多发性硬化、重症肌无力和皮克氏病。
在一个实施方案中,帕金森氏病是散发性帕金森氏病、家族性帕金森氏病,例如包含LRRK2-G2019S突变,和/或常染色体隐性早发性帕金森氏病。
一方面,本发明参考所附的描述、实施例和附图,提供了基本上如本文所述的区分方法、使用的群体、群体的用途、治疗方法或试剂盒。
附图说明
现在将参考以下附图和实施例进一步描述本发明。
图1:为期两天的RA脉冲导致快速诱导表达MB样身份的NSC。(a)hPSC分化示意图以及dSMADi和RA治疗时间表。(b)在双重SMAD抑制剂(dSMADi)或dSMADi以及两天RA脉冲(RA
A.U.,任意单位。FB,前脑。MB,中脑。HB,后脑。
图2:使用RA和SHH信号传导的具有腹侧中脑身份的NSC的规范。(a)hPSC分化示意图以及RA和SHH信号传导激活剂(SAG)的治疗时间表(顶部)。如图1a所示,所有培养物都在dSMADi条件下分化。在dSMADi+SAG条件下分化并用RA脉冲处理1、2或4天的培养物中,在9DDC时所示标志物的免疫细胞化学(底部)。(b)在dSMADi+SAG条件下分化并用RA处理所示时间的9DDC培养物中所示基因的相对基因表达(FPKM)。(c)在dSMADi+SAG条件下分化并用RA处理指定时间的9DDC培养物的差异表达基因的热图和系统聚类。(d)定义间脑(Di)、中脑(MB)和后脑(HB)位置中不同腹侧祖细胞的基因表达谱示意图。(e)在dSMADi+SAG+RA
图3:RA-CYP26调节环是强大的RA介导的模式反应的核心。(a-c)RA(a)或CHIR99221(b)浓度变化对在dSMADi+SAG条件下分化的9DDC培养物中定义腹侧前脑(NKX2.1
图4:在体外培养物中快速产生功能性多巴胺能神经元。(a-m)分析在dSMADi+RA
图5:RA指定的vMB制剂在移植到PD大鼠模型后分化成功能性多巴胺能神经元并恢复运动缺陷。(a-h)将vMB制剂(150.000个细胞)移植入纹状体后七个月,单侧6-OHDA损伤大鼠的免疫组织学分析。(a)纹状体和黑质(SN)中的TH表达。注意整个纹状体的TH免疫反应性和损伤侧SN中缺乏TH表达(右)。(b-g)移植物中所示标志物的免疫组织化学。(h)基线安非他命诱导的旋转评分≥5次同侧旋转/分钟的大鼠的每分钟净旋转的定量(n=5)。(i)所有移植动物(n=9)在移植前(实线)和移植后(虚线)施用安非他命后随时间的旋转行为。。(j)损伤后和移植后七个月对侧爪使用的偏好。
图6:经RA和CHIR99021的顺序处理导致尾中脑身份的规范。(a)(a)腹侧MB祖细胞在14DDC时的身份的免疫细胞化学分析。在RA
图7(补充图1):
(a)在dSMADi或dSMADi+RA
图8(补充图2):
(a)在dSMADi+SAG条件下分化并且用RA从0DDC脉冲处理0(RA
图9(补充图3):
(a)在dSMADi+SAG
图10(补充图4):
(a)显示在dSMADi+RA
图11(补充图5):
(a)在6-OHDA损伤的大鼠中移植测定和分析的时间表示意图。(b)对所有移植大鼠的移植物中人类标志物(HuNu)和多巴胺能神经元标志物(TH)的表达进行免疫组织学分析。(c)支配周围背外侧纹状体(dlSTR)的移植物衍生的TH
具体实施方式
实施例1:用于从人类多能干细胞中快速且稳定地衍生可移植的多巴胺神经元的
在引导人类多能干细胞(hPSCs)分化为中脑多巴胺(mDA)神经元以用于帕金森氏病(PD)的细胞替代疗法或疾病建模方面已经取得了重大进展,但是仍然存在增加分化程序的稳健性、效率和速度的持续激励。在这项研究中,我们概述了一种用于人类mDA神经元的大量、快速衍生的新的基于视黄酸(RA)的方法。RA暴露的持续时间是hPSCs向表达中脑身份的神经干细胞进行开关样转化的关键决定因素。与通常用于指定中脑命运的GSK3β抑制剂CHIR99021不同,细胞对RA的模式反应对改变的RA水平具有显著的耐受性。RA-和SHH信号传导的组合激活诱导mDA神经元祖细胞,其在早期以高速度启动神经发生,并且表现出功能特征的mDA神经元在培养40天内获得。当移植到PD动物模型中时,RA特异性祖细胞成熟为功能性DA神经元,这些功能性神经元缓解运动缺陷。该研究提供了一种生产人类mDA神经元的新方法,该方法应有助于体外疾病建模和药物开发,并且可能为用于PD细胞替代疗法的细胞生成提供一种替代途径。
介绍
胚胎干细胞(ESCs)或诱导多能干细胞(iPSCs)形式的人类多能干细胞(hPSCs)为特定神经元亚型的生产提供了可扩展的细胞来源,其可用于神经退行性疾病的高通量药物开发、疾病建模或细胞替代疗法
从hPSCs衍生mDA神经元的方案已逐步得到改进,并且在临床前移植实验中进行广泛评估后,现在已达到使用同种异体ESCs或自体iPSCs作为起始材料进行临床试验的阶段
还需要进一步提高分化程序的稳健性,以提高细胞系之间的一致性并最大限度地减少批次间的差异
峡部组织者是在头侧神经板区域化为大脑区域后建立的次级信号中心
结果
48小时的RA脉冲促进hPSC快速转化为表达中脑样身份的NSC
为了探索RA对响应于dSMADi
为了确定暴露于RA不同时间段的hPSC来源的NSC的区域性身份,我们分析了培养物在9DDC时对于单独或联合表达的转录因子的表达可以区分FB、MB或HB的区域性身份。dSMADi处理包括在以下所有实验中,并且在描述实验设置时不再进一步强调。正如预期的那样,在未暴露于RA(RA
RA和SHH信号传导的联合激活对hPSC衍生的NSC强加腹侧中脑身份
接下来,我们激活Shh信号传导,通过用平滑的激动剂SAG
长期以来,NCS的LMX1A
来自峡部组织者的WNT1和FGF8信号传导将EN1和EN2分级表达强加给尾侧MB和头侧HB
通过CYP26A1自我增强的RA降解提供了稳健的vMB模式反应
为了确定分化程序对RA浓度改变的敏感性,我们在RA
CYP26基因家族(CYP26A1、CYP26B1、CYP26C1)编码通过氧化代谢RA的细胞色素p450家族的酶
与全反式RA一样,9-顺式RA、13-顺式RA和异生素RA类似物他扎罗汀酸(TA)是CYP26介导的氧化作用的底物
在体外快速衍生表现出成熟和功能性特性的mDA神经元
mDA神经元的独特特征是它们最初起源于MB腹侧中线的非神经元底板(FP)细胞,并且祖细胞必须在分化为神经元之前获得神经元电位
在30-45DDC之间的RA
RA特异性细胞在移植到PD大鼠模型后植入并逆转运动缺陷
为了确定响应于RA
讨论
干细胞研究的一个中心目标是开发简单而稳健的分化技术,以高产率持续生产所需细胞
RA暴露的持续时间是vMB规范的核心参数,并且细胞的模式反应对RA浓度的改变具有显著的耐受性,这可归因于一种称为自我增强衰变的反馈机制
材料和方法
人类PSC培养物
将人类ESC(HS980和401,卡罗琳学院)和iPSC(SM55、SM56)维持iPS-Brew XF培养基(美天旎生物技术公司)中的重组人类玻连蛋白(VTN)(赛默飞世尔科技公司)包被的平板上。用EDTA(0.5mM)传代细胞,并在铺板后的最初24小时向培养基中加入最终浓度为10μM的ROCK抑制剂。所有细胞系的支原体污染检测均呈阴性。
人类PSC分化
将80-90%汇合的PSC培养物用PBS漂洗两次,用EDTA(0.5mM,在PBS中)处理5-7分钟,并重新悬浮在PBS中的单细胞悬浮液中。将细胞以400g离心并重悬于N2B27培养基(DMEM/F12:Neurobasal(1∶1),0.5×N2和0.5×B27(加维生素A)补充剂,1×非必需氨基酸,1%谷氨酰胺,55μMβ-巯基乙醇-均来自赛默飞世尔科技公司)中,该培养基含有5μMSB431542(美天旎生物技术公司)和2.5μM DMH1(圣克鲁斯生物技术公司)(双重SMAD抑制)以及10μM ROCK抑制剂(用于接种后的前48小时)。对于基于RA和RA类似物的实验,将细胞以60,000–80,000个细胞/cm
免疫细胞化学和免疫组织化学
将细胞在室温(RT)下在PBS中的4%多聚甲醛中固定12分钟,在PBST(含0.1%Triton-X100的PBS)中冲洗3次,并在室温下用封闭溶液(PBS中的3% FCS/0.1% Triton-X100)封闭1小时。然后将细胞与一级抗体在4℃孵育过夜,接着与荧光团缀合的二级抗体在室温孵育1小时一级抗体和荧光团缀合的二级抗体二者都在封闭溶液中稀释。使用的一级抗体列于补充表1中。使用了适当的Alexa(488、555、647)缀合的二级抗体(分子探针公司)。
如前所述进行免疫组织化学
补充表1.用于表征体外分化过程和验证体内移植后细胞身份的抗体列表。
/>
基因表达分析
使用Quick-RNA Mini Prep Plus试剂盒(Zymo研究公司)分离总RNA。使用Maxima第一链cDNA合成试剂盒(赛默飞世尔科技公司)制备cDNA。使用Fast SYBR Green PCRMaster Mix(应用生物系统公司)在7500快速实时PCR系统热循环仪中进行定量实时PCR。使用2-ΔΔCt方法进行基因表达分析,其中相对基因表达被归一化为GAPDH转录水平。引物列于补充表2中。
对于Illumina RNA测序,使用Agilent 2100生物分析仪(安捷伦科技公司)在Agilent RNA6000Pico芯片上确定RNA的完整性。具有Poly-A选择的Illumina TruSeq多链mRNA试剂盒用于文库构建。聚类由“cBot”完成,并且将样品在NovaSeq6000(NovaSeq控制软件1.6.0/RTA v3.4.4)上测序,该软件具有2x51设置,在“S1”模式流通池中使用“NovaSeqXp”工作流程。使用CASAVA软件套件中的bcl2fastq_v2.19.1.403执行Bcl到FastQ的转换。将读数映射到人类基因组的组装,使用Tophat(v 2.0.4)构建GRCm38。使用袖扣将基因水平的丰度估计为FPKMs(v 2.1.1)
热图绘图和PCA可视化是使用“https://www.evinet.org/”
补充表2.用于神经元分化不同阶段的qPCR基因表达分析的引物。
/>
蛋白质印迹
将细胞在补充有蛋白酶和磷酸酶抑制剂混合物(赛默飞世尔科技公司)的RIPA缓冲液(西格玛)中裂解,并在冰上振荡孵育30分钟。通过离心(20 000g,4℃下20分钟)来清除裂解物,并通过二辛可宁酸(BCA)测定来确定蛋白质浓度。将蛋白质裂解物重悬于含有2.5%2-巯基乙醇的LDS缓冲液(赛默飞世尔科技公司)中,并在95℃变性5分钟。将4-15%SDS聚丙烯酰胺凝胶(伯乐公司)的每个泳道装载15-30μg蛋白质,并使用Trans-Blot Turbo系统(伯乐公司)转移到硝酸纤维素膜(伯乐公司)上。将膜在封闭溶液(含0.1%吐温-20(TBST)和5%脱脂奶粉的TBS)中在室温孵育1小时,然后与一级抗体在4℃孵育过夜。在室温下用TBST洗涤3次后,将膜与HRP缀合的二级抗体在室温下孵育1小时。HRP的检测通过化学发光底物SuperSignal West Dura底物来进行,并在ChemiDoc成像系统(伯乐公司)上检测信号。用于免疫印迹的一级抗体列于补充表1中。
HPLC
通过高效液相色谱(HPLC)及电化学检测法确定了42个DDC培养物中去甲肾上腺素(NA)、多巴胺(DA)和血清素(5-HT)的浓度。
将在dSMADi+RA
电生理学。
将含有35至60天龄神经元的载玻片(n=22张载玻片,n=4次实验)置于电生理学介质(Neurabasal介质,Electro,赛默飞世尔科技)中的记录室中。为了记录,使用具有60倍物镜(Olympus,日本东京)的DIC显微镜(Scientifica,英国奥克菲尔德)对神经元进行可视化。在P-87Flaming/Brown微量移液器拉出器(萨特仪器公司,美国加利福尼亚州诺瓦托)上拉出的膜片移液器(电压钳记录的电阻为3-5MΩ,电流钳记录的电阻为5-10MΩ),填充有用于电压钳记录的154mM NaCl溶液或用于电流钳记录的含有8mM生物素的120mM KCl溶液。用Axon MultiCalmp 700B放大器记录信号,并用Axon Digidata 1550B数字化仪(分子仪器,美国加利福尼亚州圣何塞)以20kHz数字化。接入电阻和移液管电容得到补偿。细胞附着的电压钳记录在2Hz低/1kHz高时进行带通滤波,并且显示超极化后的事件被认为是自发动作电位。为了评估尖峰模式,以电流钳模式记录的神经元保持在-60mV的膜电位。应用接近阈值电流步骤来确定基强度电流,然后应用与基强度电流成比例的1s电流步骤。在电压钳模式下,通过施加从保持-60mV开始间隔为10mV的脉冲来确定钠电流的存在。使用自定义编写的Matlab(迈斯沃克,美国马萨诸塞州纳蒂克)脚本提取电气特性。记录后,如上所述对载玻片进行固定、染色和成像。用Streptavidin Alexa Fluor 488(赛默飞世尔公司)。
移植物放置和行为分析。
所有动物程序均按照欧盟指令(2010/63/EU)执行,并经当地实验动物使用伦理委员会和瑞典农业部(Jordbruksverket)批准。成年雌性无胸腺“裸鼠”购自Harlan/Envigo实验室(Hsd:RH-Foxn1rnu)并如前所述饲养
所有外科手术和单侧注射6-羟基多巴胺(6-OHDA)对黑质纹状体通路的损伤均如所述进行
在6-OHDA损伤后4周和移植后7个月,如前所述在玻璃圆筒中评估自发性爪使用不对称性作为探索行为
在行为分析后对动物进行灌注并进行免疫组织化学处理。
统计分析
除非另有说明,否则数值显示为平均值±SD,并且图中的星号表示两组之间学生t检验的显著性。对于旋转和圆柱行为分析,分别使用了具有Bonferroni校正的单向方差分析和和配对抽样学生t检验。对于所有数字,*p<0.05,**p<0.01,***p<0.001,ns=不显著。
实施例2-用RA和CHIR99021的顺序处理导致尾侧中脑身份的规范
中脑多巴胺神经元构成几个不同的亚型,我们基于RA的方案产生足够的治疗性A9亚型多巴胺能神经元来逆转PD动物模型中的运动缺陷。中脑多巴胺神经元亚型规范的潜在机制仍然很难解决,但可能涉及沿中脑中外侧轴和头尾轴的腹侧中脑多巴胺能祖细胞的亚模式(Brignani,S,和Pasterkamp,《神经解剖学前沿》11,1–18(2017))。从中脑-后脑边界处的峡部组织者发出的WNT1信号传导通过诱导同源结构域蛋白EN1和EN2从尾侧高到头侧低的表达梯度,建立了中脑祖细胞沿头侧-尾侧轴的极性(Wurst,W.and Bally-Cuif,L.神经系统科学自然评论2,99-108(2001))。RA
实施例参考文献
1.Rowe,R.G.&Daley,G.Q.在疾病建模和药物发现中诱导多能干细胞(Inducedpluripotent stem cells in disease modelling and drug discovery).《自然遗传学评论(Nat.Rev.Genet.)》,20,377–388(2019)。
2.Barker,R.A.,Parmar,M.,Studer,L.&Takahashi,J.干细胞衍生的多巴胺神经元治疗帕金森氏病的人类试验:新时代的黎明.《细胞干细胞》21,569–573(2017)。
3.Qi,Y.等人.组合的小分子抑制加速了从人类多能干细胞中衍生出功能性皮质神经元.《自然生物技术(Nat.Biotechnol.)》35,154–163(2017)。
4.
5.Marton,R.M.&Ioannidis,J.P.A.人类多能干细胞衍生多巴胺能神经元方案的综合分析.《干细胞转化医学(Stem Cells Transl.Med.)》8,366–374(2019)。
6.Niclis,J.C.等人。来自人类多能干细胞的有效指定的腹侧中脑多巴胺神经元在无异种条件下恢复帕金森啮齿类动物的运动缺陷《干细胞转化医学》6,937–948(2017)。
7.Riessland,M.等人。SATB1缺失诱导有丝分裂后多巴胺能神经元p21依赖性细胞衰老.《细胞干细胞》25,514-530.e8(2019)。
8.La Manno,G.等人.小鼠、人类和干细胞中脑发育的分子多样性.《细胞(Cell)》167,566-580.e19(2016)。
9.Nolbrant,S.,Heuer,A.,Parmar,M.&Kirkeby,A.用于体外成熟和脑内移植的高纯度人腹侧中脑多巴胺能祖细胞的产生.《自然实验手册(Nat.Protoc.)》12,1962–1979(2017)。
10.Wang,S.等人.非人灵长类帕金森氏病模型中自体iPSC衍生的多巴胺神经元移植.《细胞发现(Cell Discov.)》1,1–11(2015)。
11.Morizane,A.等人。MHC匹配改善了iPSC衍生的神经元在非人类灵长类动物中的植入。《自然通讯》.8,1–12(2017)。
12.Kirkeby,A.等人。在确定的条件下从人类胚胎干细胞产生区域特定的神经祖细胞和功能性神经元。《细胞报告(Cell Rep)》1,703–714(2012)。
13.Kriks,S.等人。源自人类ES细胞的多巴胺神经元有效地移植到帕金森氏病动物模型中《自然(Nature)》480,547–551(2011)。
14.Chambers,S.M.等人。通过双重抑制SMAD信号传导实现人ES和iPS细胞的高效神经转化《自然生物技术》27,275–80(2009)。
15.Tao,Y.&Zhang,S.-C.人多能干细胞的神经亚型规范.《细胞干细胞》19,573–586(2016)。
16.Lu,J;Zhong,X;Liu,H;Hao,L;Tzu-Ling Huang,C;Amin Sherafat,M;Jones,J;Ayala,M;Li,L;&Zhang,S.从人类多能干细胞中产生血清素神经元。《自然生物技术》34,89–95(2015)。
17.Bain,J.等人。蛋白激酶抑制剂的选择性:进一步更新。《生物化学杂志(Biochem.J.)》408,297–315(2007)。
18.Toledo,E.M.,Gyllborg,D.&Arenas,E.将WNT发展计划转化为治疗帕金森氏病的干细胞替代策略.《英国临床药理学杂志(Br.J.Pharmacol.)》174,4716–4724(2017)。
19.Gibbs,H.C.,Chang-Gonzalez,A.,Hwang,W.,Yeh,A.T.&Lekven,A.C.中脑-后脑边界的形态发生:Wnt和Fgf信号传导的交汇点《神经解剖学前沿》11,1–17(2017)。
25.Frank-Kamenetsky,M.等人。豪猪信号传导的小分子调节剂:平滑激动剂和拮抗剂的鉴定和表征.《生物学杂志》1,1–19(2002)。
26.Ericson,J.,Muhr,J.,Jessell,T.M.&Edlund,T.索尼克豪猪:沿神经管头尾侧轴的腹侧模式的常见信号.《国际发育生物学杂志(Int.J.Dev.Biol.)》39,809–816(1995)。
27.Kee,N.等人。单细胞分析揭示了分化多巴胺和丘脑底核神经元谱系之间的密切关系。《细胞干细胞》20,29–40(2017)。
28.Pattyn,A.等人。运动神经元和血清素能神经元从CNS祖细胞的共同库产生的协调的时间和空间控制《基因与发育(Genes Dev.)》17,729–37(2003)。
29.Kirkeby,A.等人。预测标志物指导分化以改善基于hESC的帕金森氏病疗法临床转化的移植结果。《细胞干细胞》20,135–148(2017)。
30.Ono,Y.等人。沿前后位置的底板细胞中神经源性电位的差异:中脑多巴胺能神经元起源于中脑底板细胞。《发展(Development)》134,3213–3225(2007)。
31.
32.Dias,J.M.,Alekseenko,Z.,Applequist,J.M.&Ericson,J.Tgfβ信号传导调节中枢神经系统中神经干细胞的时间神经发生和效力。《神经元(Neuron)》84,927–39(2014)。
33.Deng,Q.等人。Lmx1a、Lmx1b和Phox2a在腹侧中脑发育中的特定和综合作用。《发展》138,3399–3408(2011)。
34.Kala,K.等人。Gata2是中脑GABA能神经元的组织特异性有丝分裂后选择基因。《发展》136,253–262(2009)。
35.Liu,A.&Joyner,A.L.中脑和小脑的早期前/后模式。《神经科学年鉴(Annu.Rev.Neurosci.)》24,869–96(2001)。
36.Hynes,M.&Rosenthal,A.脊椎动物CNS中多巴胺能和血清素能神经元的规范。《神经生物学的最新见解(Curr.Opin.Neurobiol.)》9,26–36(1999)。
37.Thatcher,J.E.&Isoherranen,N.CYP26酶在视黄酸清除中的作用。《药物代谢与毒理学专家意见(Expert Opin.Drug Metab.Toxicol.)》5,875–86(2009)。
38.White,R.J.&Schilling,T.F.如何退化:后脑发育中的Cyp26s。《发育与动力学(Dev.Dyn.)》237,2775–2790(2008)。
39.Schilling,T.F.,Nie,Q.&Lander,A.D.视黄酸形态发生素梯度的动态性和精确性。《遗传学与发育新见Opin.Genet.)》《发育与22,562–569(2012)。
40.Hernandez,R.E.,Putzke,A.P.,Myers,J.P.,Margaretha,L.&Moens,C.B.Cyp26酶产生后脑发育所必需的视黄酸反应模式。《发育》134,177–187(2007)。
41.Foti,R.S.等人。鉴定他扎罗汀酸是人类视黄酸羟化酶CYP26A1和CYP26B1的第一个异生素底物。《药理学与实验疗法杂志(J.Pharmacol.Exp.Ther.)》357,281–292(2016)。
42.White,J.A.等人。鉴定主要在成人小脑中表达并负责全反式视黄酸代谢的人类细胞色素P450,P450RAI-2。Proc Natl Acad Sci U S A.97,6403–8(2000)。
43.Lopez-Real,R.E.等人。在体内小鸡胚胎发生期间,应用合成的光稳定类视黄醇诱导新的肢体和面部表型。《解剖学杂志(J.Anat.)》224,392–411(2014)。
44.Andersson,E.等人。鉴定中脑多巴胺神经元的内在决定因素。《细胞(Cell)》124,393–405(2006)。
45.Reyes,S.等人。GIRK2在黑质和腹侧被盖区多巴胺神经元中的表达。《比较神经学杂志(J.Comp.Neuron.)》520,2591–2607(2012)。
46.Grealish,S.等人。当移植到帕金森氏病大鼠模型中时,人类ESC衍生的多巴胺神经元显示出与胎儿神经元相似的临床前功效和效力。《细胞干细胞》15,653–665(2014)。
47.Marklund,U.等人。早期发育的人类神经管中调节基因的详细表达分析。《干细胞与发育(Stem Cells Dev.)》23,5–15(2014)。
48.Vadodaria,K.C.,Stern,S.,Marchetto,M.C.&Gage,F.H.精神病学中的FH血清素:使用患者衍生的神经元的体外疾病建模。《细胞组织研究(Cell Tissue Res.)》371,161–170(2018)。
49.Okaty,B.W.,Commons,K.G.&Dymecki,S.M.拥抱5-HT神经元系统的多样性。《神经系统科学自然评论(Nat.Rev.Neurosci.)》20,397–424(2019)。
50.Zeltner,N.&Studer,L.基于多能干细胞的疾病建模:当前的障碍和未来的前景。《细胞生物学的最新观点(Curr.Opin.Cell Biol.)》37,102–10(2015)。
51.Chen,Y.等人。帕金森氏病小鼠模型中移植的人类PSC衍生的神经元的化学控制。《细胞干细胞》18,817–26(2016)。
52.Kikuchi,T.等人。人类iPS细胞衍生的多巴胺能神经元在灵长类帕金森氏病模型中发挥作用。《自然(Nature)》548,592–596(2017)。
53.Taylor,C.J.,Peacock,S.,Chaudhry,A.N.,Bradley,J.A.&Bolton,E.M.根据已知的供体和受体hla类型为HLA匹配的组织移植生成iPSC库。《细胞干细胞》11,147–152(2012)。
54.Jho,E.等人。Wnt/β-连环蛋白/Tcf信号传导诱导Axin2,信号通路的负调节因子的转录。《分子与细胞生物学(Mol.Cell.Biol.)》22,1172–83(2002)。
55.Trapnell,C.RNA-Seq的转录物组装和定量揭示了细胞分化过程中未标记的转录物和同种型转换《自然生物技术》28,511–5(2010)。
56.Benjamini,Y.&Hochberg,Y.控制错误发现率:一种实用且强大的多重测试方法。《皇家统计学会杂志(J.R.Stat.Soc.Ser.)》B 57,289–300(1995)。
57.Jeggari,A.等人。EviNet:一个用于网络富集分析的网络平台,具有灵活的基因集定义。《核酸研究(Nucleic Acids Res.)》46,W163–W170(2018)。
58.Yang,L.&Beal,M.F.通过HPLC-ECD确定帕金森氏病模型中的神经递质水平。《分子生物学方法(Methods Mol Biol)》793,401–15(2011)。
59.Brignani,S,and Pasterkamp,R.J.,《神经解剖学前沿》11,1–18(2017)。
60.Wurst,W.and Bally-Cuif,L.《神经系统科学自然评论》2,99-108(2001)。
