一种大肠杆菌腐胺转氨酶突变体及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种大肠杆菌腐胺转氨酶突变体及其应用,属于生物工程技术领域。
背景技术
1,4-环己烷二甲胺(1,4-BAC),主要应用于医药中间体、环氧树脂固化剂和聚氨酯中间体等生产中,具有较高工业价值。
目前其主要采用化学法生成,存在金属催化剂价格昂贵,反应条件苛刻和环境污染性大等问题,需寻找更绿色的合成方法替代。通过生物法制备1,4-环己烷二甲胺具有产品质量稳定安全、工艺条件温和、高效、环保等特点,可以减轻环境和资源压力,促进我国低碳和循环经济的发展,因此迫切需要一种有效的生物法高效制备1,4-环己烷二甲胺。
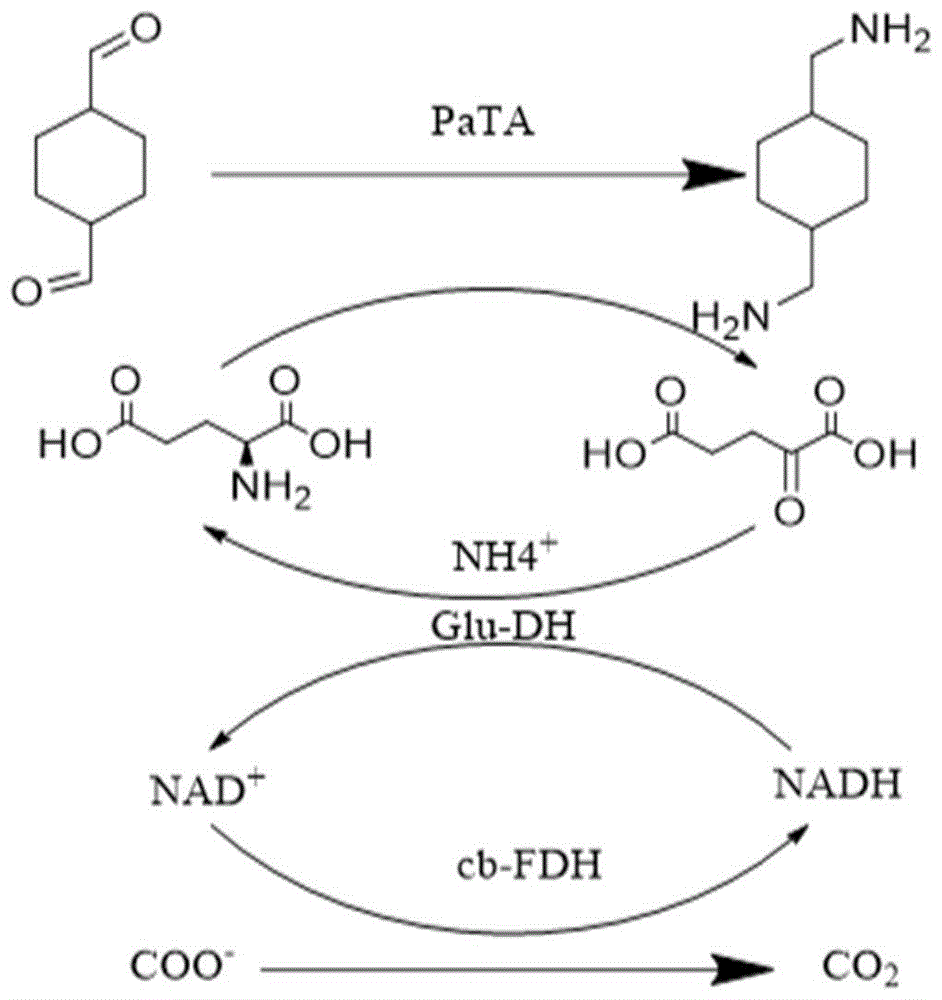
微生物法生产1,4-环己烷二甲胺涉及到一个关键的酶腐胺转氨酶(PaTA,putrescine aminotransferase enzyme),它具有高度的底物特异性,可以催化1,4-环己烷二甲醛还原胺化,形成1,4-环己烷二甲胺。目前,由于酶转化法具备高产量、高转化率以及较短的转化周期等优点而更具备工业应用价值。但是,酶转化法大规模制备1,4-环己烷二甲胺受到以下限制:(1)底物1,4-环己烷二甲醛成本高,对工业不经济;(2)高浓度的1,4-环己烷二甲醛对细胞具有毒害性;(3)伴随着催化反应的进行,会导致PaTA催化稳定性降低,这极大程度限制了1,4-环己烷二甲胺产业化的发展,是目前研究的重点问题。因此,从工业角度来看,迫切需要解决PaTA催化稳定性降低的问题,使得通过酶转化法制备1,4-环己烷二甲胺实现规模化应用。
近几十年来,蛋白质工程已经成为在分子水平改善酶的性质的有效策略,如扩大底物范围、提高酶的活性和改善酶的稳定性的最有效的方法。因此,通过蛋白质工程设计PaTA,可能解决其催化稳定性差的问题。蛋白质工程改造主要可以分四类:传统的定向进化(即非理性设计)、半理性设计、理性设计(基于结构与计算机技术)和多种策略的组合应用。目前,关于利用蛋白质工程改造转氨酶已经取得了一定的研究进展,然而,催化稳定性的改善效果仍然有限,远不能满足实际的工业化需求。
此外,多酶级联反应也是酶生物转化中的重要手段,具有许多优点。例如,它可以避开反应中间体的积累,利用廉价易得的原料作为反应的起始底物,并且多酶反应间的协同性可以通过调控酶之间的表达比例得以调节。
发明内容
本发明提供了一种可以用于制备1,4-环己烷二甲胺的PaTA突变体,并利用该突变体蛋白催化1,4-环己烷二甲醛制备1,4-环己烷二甲胺。本发明所构建的菌株在1,4-环己烷二甲胺制备中具有高生产强度,高催化稳定性,减少了转化中的投菌量,极大节约了工业化的生产成本。
本发明提供了一种腐胺转氨酶PaTA突变体,以SEQ ID NO.1所示的大肠杆菌来源的腐胺转氨酶PaTA为亲本序列,将第91位苯丙氨酸突变为酪氨酸。
在一种实施方式中,所述突变体的氨基酸序列如SEQ ID NO.2所示。
本发明还提供了编码所述突变体的基因,所述基因的核苷酸序列如SEQ ID NO.4所示。
本发明还提供了携带所述基因的表达载体。
在一种实施方式中,所述载体包括但不限于pET28a(+)。
本发明提供了一种制备所述PaTA突变体的方法,所述方法包括:
(1)设计定点突变的突变引物,以携带大肠杆菌腐胺转氨酶PaTA基因的载体为模板进行定点突变;构建含突变体的质粒载体;
(2)将步骤(1)构建的含突变体的质粒转化进宿主细胞;
(3)挑选步骤(2)制备的阳性克隆进行发酵培养,收集培养物中的腐胺转氨酶PaTA。
在一种实施方式中,所述宿主细胞为细菌或真菌细胞。
在一种实施方式中,所述宿主细胞为大肠杆菌。
本发明还提供了一种细胞催化剂,所述细胞催化剂含有表达所述突变体的微生物细胞。
在一种实施方式中,所述细胞催化剂还含有共表达大肠杆菌来源的谷氨酸脱氢酶以及念珠菌来源的甲酸脱氢酶的重组微生物细胞。
本发明提供了一种共表达谷氨酸脱氢酶基因和甲酸脱氢酶基因的重组的大肠杆菌,所述重组大肠杆菌以pACYCDuet-1为表达载体。
在一种实施方式中,所述谷氨酸脱氢酶基因的核苷酸序列如SEQ ID NO.5所示;所述甲酸脱氢酶基因的核苷酸序列如SEQ ID NO.6所示。
本发明提供了一种制备1,4-环己烷二甲胺的方法,所述方法中以1,4-环己烷二甲醛为反应底物,将表达所述突变体的BL21-PaTA细胞和表达谷氨酸脱氢酶以及甲酸脱氢酶的pACYCDuet-GLUDH-cbFDH细胞加入至反应体系中,在pH6-8.5、16-45℃条件下反应24h。
本发明还提供所述突变体或所述细胞催化剂在转化1,4-环己烷二甲醛生产1,4-环己烷二甲胺中的应用。
在一种实施方式中,转化反应的pH为6.5~7.5。
在一种实施方式中,转化反应的温度为20~37℃。
在一种实施方式中,底物1,4-环己烷二甲醛的浓度为10~15g/L。
本发明还要求保护所述突变体在生产含1,4-环己烷二甲胺的产品中的应用。
有益效果:本发明构建的腐胺转氨酶PaTA的突变体可用于催化生产1,4-环己烷二甲胺,提高了单位催化剂的生产能力,有效降低了生产成本。本发明还提供了应用所述突变体催化生产1,4-环己烷二甲胺的方法,该转化反应仅以水为催化介质,具有反应条件温和、操作简便、收率高等优点。本发明得到的突变体以1,4-环己烷二甲醛为底物产生1,4-环己烷二甲胺的产量可达5.12g/L,转化率50.48%。
附图说明
图1为本发明的反应路径图。
图2为本发明所涉及的产物1,4-环己烷二甲胺OPA衍生后的高效液相色谱图。
图3为本发明PaTA酶诱导表达的SDS-PAGE图;泳道1~3分别是25℃下0.2mM IPTG浓度诱导表达后全细胞、上清液和沉淀中所目的蛋白条带大小。
具体实施方式
基因来源:本发明所涉及到的生物酶PaTA基因来源于Escherichia coli;pET28a(+)质粒购自Novagen(Madison,WI,U.S.A.);限制性内切酶、T4 DNA连接酶、primeSTAR等购自TaKaRa(Dalian,China)。O-diacetylbenzene和标样购自SIGMA。BsPanD突变体均为分子改造所得,其余试剂均为市场购买所得。
配制LB培养基:蛋白胨10g/L,酵母粉5g/L,氯化钠10g/L,在121℃灭菌20min。
配制发酵培养基:胰蛋白胨12g/L,酵母提取物(安琪酵母粉802)24g/L,甘油4mL/L,KH
HPLC法测定1,4-环己烷二甲胺:使用邻苯二甲醛(OPA)柱前衍生反相HPLC来测定转化液中产物1,4-环己烷二甲胺的产量。具体地,使用戴安高效液相色谱仪、AgilentZORBAX SB-aq色谱柱(250×4.6mm,5μm),流动相A:0.01M KH
表1 1,4-环己烷二甲胺梯度洗脱表
配制pH7.5的HEPES缓冲液:0.1mol/L的HEPES缓冲液,具体配方见《工业微生物实验技术手册》(中国轻工业出版社,诸葛健主编)。
比酶活测定方法:采用HPLC法测PaTA的酶活。1个单位的PaTA的酶活被定义为生成1μmol 1,4-环己烷二甲胺产物所需的酶量(U)。通过测定1,4-环己烷二甲胺的含量即可计算酶活力。
比酶活定义为每毫克蛋白质所含的酶活力单位数(U/mg蛋白),并按如下公式进行计算:
1,4-环己烷二甲胺含量的测定:反应产物采用高效液相色谱法(HPLC)测定。液相检测条件参见上述HPLC法测定1,4-环己烷二甲胺。
摩尔产率的计算方法:
摩尔产率=产物的质量/产物的分子量÷底物的质量/底物的分子量。
实施例1:单突突变体的构建和筛选及pACYCDuet-GLUDH-cbFDH的构建
1、单突突变体构建:设计PaTA
表2单突变体突变引物序列
构建反应PCR扩增体系:PrimSTAR酶0.5μL、5×PrimeSTAR Buffer 10μL、dNTP 4μL每个突变位点的两条引物各1μL、模板(PaTA
将上述反应体系在37℃孵育3h以消化质粒模板(消化体系为:DpnI 0.5μL、上述反应PCR产物45μL、10×T Buffer 5μL),消化结束后得到的消化产物通过化学转化方法导入大肠杆菌BL21感受态细胞,化学转化法具体步骤:
(1)将10μl同源重组产物导入100μl BL21感受态细胞;
(2)冰浴15-30min;
(3)42℃水浴热激90s,取出后迅速放入冰中静置冰浴3-5min;
(4)加入800μl无抗性LB培养基混匀,于37℃,200rpm培养1h;
(5)5000rpm离心2min收菌;
(6)移去上清,剩余100-200μl吹吸混匀涂布至含0.05mg/mL卡那霉素抗性平板上,37℃恒温培养12h左右。
(7)挑取单克隆于含0.05mg/mL卡那霉素抗性LB中,200rpm、37℃恒温培养12h后,送去公司测序,测序正确的即为阳性转化子。
2、pACYCDuet-GLUDH-cbFDH的构建
(1)在100uL体系中加入2000-3000ng左右的质粒(pACYCDuet)、10uLBuffer、5uLEcoRI、5uLSalI,其余用水补齐,37℃孵育3h,对质粒进行双酶切。
(2)将(1)中的结果进行胶回收得到同源重组的载体。
(3)在100uL体系中加入65uL水、20uL 5×Ps Buffer、8uL dNTP、2uL上游引物、2uL
下游引物、2uL模板(连有SEQ ID NO.5所示Glu-DH序列的PET-28a质粒)、1uLPrimestar酶,按如下程序进行PCR反应①94℃5min;②98℃10s;③55℃30s;④72℃2min;⑤将②~④三个步骤循环29次;⑥72℃5min;⑦12℃保温。
(4)将(3)中的结果进行胶回收得到同源重组的片段。
(5)将(2)和(4)的结构进行同源重组
(6)将(5)中同源重组后得到的质粒导入感受态中,37℃摇床培养50min,在LB平板上涂板,挑取单菌落送测序。
(7)参照(1)-(6)将cbFDH(SEQ ID NO.6所示)连入到pACYCDuet-GLUDH,再将pACYCDuet-GLUDH转化至本实施例第1部分构建的表达单突变体的微生物细胞中。
实施例2:突变体酶的表达纯化方法
将实施例1制备得到的重组菌株阳性转化子接种至LB培养基,37℃培养至OD
按照上述方法制备菌体,加入10mL结合液A(20mM磷酸钠、0.5mM NaCl、20mM咪唑、1%甘油,用HCl调pH至7.4)充分重悬菌体,然后将离心管置于冰浴中,放入超声波细胞破碎仪中,超声破碎的条件为:工作时间4s,间隔时间4s,共计10min。将获得的破碎液进行低温高速离心,4℃、8000rpm离心30min,得粗酶液。用0.22μm微孔滤膜过滤,备用。
准备镍离子亲和层析柱,首先,在4℃环境下利用恒流泵,向柱子里泵入超纯水冲洗柱子(约6~12倍柱体积),然后用10mL结合液A平衡柱子环境。待柱子下端的流出液与泵入柱子的低盐浓度缓冲液pH值一致时(约需5倍柱体积缓冲液),将得到的过膜粗酶液加入到柱子中。先用结合液A冲洗杂蛋白至基线平衡,再用洗脱液B(20mM磷酸钠、0.5mM NaCl、500mM咪唑)洗脱。收集吸收峰的洗脱液,测定酶活,获得达到电泳纯的目的蛋白。经测定,10g湿菌体可表达63mg酶蛋白,比酶活为2.56U/mg。
实施例3:不同pH下全细胞转化生产1,4-环己烷二甲胺
在100mL锥形瓶中加入30g/L全细胞(全细胞按照实施例2的方法制备)、10g/L 1,4-环己烷二甲醛、100mM 4-羟乙基哌嗪乙磺酸(HEPES)、200mM甲酸铵、20mM谷氨酸、1mM NAD
结果显示,PaTA在pH 6.0-pH 7.5内环化活性随着pH的上升而增长,在pH 7.5左右达到峰值,1,4-环己烷二甲胺产量为4.32g/L,摩尔产率为42.40%,随后环化活性随pH的进一步升高而下降。这说明微碱性环境对PaTA催化转氨反应更有利,全细胞在pH 7.5具有更优的转氨活性。
表3pH优化结果
实施例4:不同温度下全细胞转化生产1,4-环己烷二甲胺
具体实施方式参见实施例3,区别在于,在缓冲液pH为7.5的条件下测定PaTA在不同温度条件下(16、20、25、30、37、45℃)转化24h的1,4-环己烷二甲胺产量,并计算摩尔产率。结果显示,PaTA在16-30℃范围内转氨活性随着温度的上升而上升,而在30-45℃范围内环化活性却随着温度的上升而下降,在30℃达到峰值,1,4-环己烷二甲胺产量为4.60g/L,摩尔产率为45.35%。
表4反应温度优化结果
实施例5:不同底物浓度下全细胞转化生产1,4-环己烷二甲胺
具体实施方式参见实施例3,区别在于,在缓冲液pH为7.5、30℃的条件下测定PaTA在不同底物浓度下(5、10、15、20、25g/L)转化24h的1,4-环己烷二甲胺产量,并计算摩尔产率。结果显示,PaTA在5-10g/L范围内环化活性随着温度的上升而上升,而在10-25g/L范围内环化活性却随着温度的上升而下降,在10g/L时1,4-环己烷二甲胺产量为4.82g/L,摩尔产率为47.52%。
表5底物浓度优化结果
对比例1:
具体实施方式同实施例1~2,区别在于,将突变位点分别替换为第327位或419位,将第327位苯丙氨酸突变为酪氨酸,或将第419位亮氨酸突变为丙氨酸。以野生酶为对照,按照实施例5相同的方法进行测定,突变体的比酶活如表6所示。
表6不同突变体的比酶活
对比例2:
具体实施方式同实施例5,区别在于,将以表达野生酶PaTA
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
