金属多酚纳米声敏药物及其制备方法和抗肿瘤药物
文献发布时间:2024-01-17 01:27:33
技术领域
本发明涉及生物医用材料技术领域,具体而言,涉及金属多酚纳米声敏药物及其制备方法和抗肿瘤药物。
背景技术
cGAS-STING通路是机体中的固有免疫通路,当细菌、微生物及寄生虫等病原体入侵体内时,它们释放出的游离DNA会被环状GMP-AMP合酶(cGAS)识别,将传递至第二信使cGAMP,二聚化的干扰素基因刺激因子(STING)马上与cGAMP结合,其自身构象发生变化,经过磷酸化、泛素化修饰后募集TBK1蛋白,磷酸化并激活干扰素调节因子(IRFs)和NF-κB,诱导I型干扰素和趋化因子配体(CCL)等炎症因子的表达,激活抗原呈递细胞(APCs),进一步激活下游T细胞介导的获得性免疫反应。除了抗病毒、细菌的免疫反应,cGAS-STING通路在抗肿瘤免疫过程中也发挥着重要作用。为此,以cGAS-STING通路为主的固有免疫在抗肿瘤免疫治疗中的应用逐渐获得人们的关注。
近年来有报道称,线粒体中的环状线粒体DNA的释放可以起到激活cGAS-STING通路,从而介导机体内的天然免疫应答。但是线粒体损伤后,往往会通过线粒体自噬来进行自我修复。线粒体自噬是一种线粒体质量控制机制,线粒体首先通过分裂的方式将受损部分分离,之后通过自噬体选择性地去除受损线粒体,最后通过溶酶体对其进行分解代谢。由于线粒体自噬功能的存在,受损线粒体中的DNA无法大量释放,从而不会激活cGAS-STING通路。通过抑制线粒体自噬过程,可以促进线粒体DNA向细胞质内泄露,从而激活抗肿瘤免疫反应。另外,一些金属离子如锰离子、锌离子,具有直接激活cGAS蛋白活性的功能,可以大幅提高cGAS-STING通路的敏感性。
因此,研究一种激活cGAS-STING通路而达到肿瘤免疫治疗的纳米制剂具有极大的意义和价值。设计合适的纳米药物,从而实现金属离子递送和刺激线粒体DNA释放双重目的,是激活固有免疫通路达到抗肿瘤免疫治疗的关键。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供金属多酚纳米声敏药物及其制备方法和抗肿瘤药物。本发明实施例提供的金属多酚纳米声敏药物改善单一的治疗方式难以产生足够的双链DNA以达到激活cGAS-STING通路。
本发明是这样实现的:
第一方面,本发明提供一种金属多酚纳米声敏药物,其包括金属多酚网络和负载于所述金属多酚网络的线粒体自噬抑制剂,其中,所述金属多酚网络由修饰有多酚并共价连接声敏剂的聚合物与金属离子形成。
在可选的实施方式中,所述聚合物上修饰的多酚包括邻苯二酚基团;
优选地,所述聚合物上修饰的邻苯二酚基团来源于多巴胺结构;
优选地,所述聚合物上共价连接的声敏剂选自卟吩类化合物、碘化物和卟啉类化合物中的任意一种;
优选地,所述聚合物上共价连接的声敏剂选自二氢卟吩e6、IR 780和Purpurin 18中的一种;
优选地,所述聚合物为聚乙二醇;
优选地,所述金属多酚网络由邻苯二酚基团修饰共价连接声敏剂的聚乙二醇和金属离子形成,其中,声敏剂选自卟吩类化合物、碘化物和卟啉类化合物中的任意一种。
在可选的实施方式中,所述聚合物上修饰的多酚与共价连接的声敏剂的摩尔比为4-7:1,优选为7:1;
优选地,所述聚合物上修饰的邻苯二酚基团与共价连接的声敏剂的摩尔比为4-7:1,优选为7:1。
在可选的实施方式中,所述金属离子选自铜离子、锰离子和锌离子中的一种或至少两种的组合。
在可选的实施方式中,修饰有多酚并共价连接声敏剂的所述聚合物与所述金属离子的质量比为1:9-20,优选为1:15。
在可选的实施方式中,所述线粒体自噬抑制剂选自Mdivi-1、氯喹、羟氯喹和3-Methyladenine中的至少一种。
在可选的实施方式中,所述金属多酚网络与所述线粒体自噬抑制剂的质量比为15-30:1,优选为30:1。
第二方面,本发明提供一种前述实施方式所述的金属多酚纳米声敏药物的制备方法,将修饰有多酚并共价连接声敏剂的聚合物与金属盐溶液混合搅拌,而后再与线粒体自噬抑制剂混合。
在可选的实施方式中,加入所述线粒体自噬抑制剂后,进行超声。
第三方面,本发明提供一种抗肿瘤药物,其包括前述实施方式所述的金属多酚纳米声敏药物。
本发明具有以下有益效果:本发明实施例的金属多酚纳米声敏药物可以在酸性的肿瘤微环境和溶酶体环境中降解,释放出金属离子及抑制剂,一方面协同声动力治疗破坏线粒体功能抑制肿瘤细胞生长,另一方面促进线粒体DNA释放,激活cGAS-STING通路,增强抗肿瘤免疫效果。该金属多酚纳米声敏药物具有安全可靠、性能优良的特点,为肿瘤特别是实体瘤的治疗提供了一种新方法。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1提供金属多酚纳米声敏药物的表征结果图;
图2为本发明实验例1提供的检测结果图;
图3为本发明实验例2提供的检测结果图;
图4为本发明实验例3提供的检测结果图;
图5为本发明实验例4提供的检测结果图;
图6为本发明实验例5提供的检测结果图;
图7为本发明实验例6提供的检测结果图;
图8为本发明实验例7提供的检测结果图;
图9本发明实验例8提供的检测结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
第一方面,本发明提供一种金属多酚纳米声敏药物,其包括金属多酚网络和负载于所述金属多酚网络的线粒体自噬抑制剂,其中,所述金属多酚网络由修饰有多酚并共价连接声敏剂的聚合物与金属离子形成。
本发明的金属多酚纳米声敏药物可以通过静脉给药用于癌症治疗,起到激活体内固有免疫反应,从而发挥抗肿瘤免疫的作用。具体地,该金属多酚纳米声敏药物可协同声动力治疗促进肿瘤细胞内活性氧成分产生,同时在声动力的作用下促进肿瘤细胞线粒体损伤释放线粒体DNA,从而激活抗肿瘤免疫反应。
其中,聚合物上修饰的多酚包括邻苯二酚基团;所述聚合物上修饰的邻苯二酚基团来源于多巴胺结构。
所述聚合物上共价连接的声敏剂选自卟吩类化合物、碘化物和卟啉类化合物中的任意一种;例如,所述聚合物上共价连接的声敏剂选自二氢卟吩e6(Ce6)、IR 780和Purpurin 18中的一种;聚合物为聚乙二醇;
具体地,所述金属多酚网络由邻苯二酚修饰并共价连接声敏剂的聚乙二醇和金属离子形成,其中,声敏剂选自卟吩类化合物、碘化物和卟啉类化合物中的任意一种。
进一步地,聚合物上修饰的多酚与共价连接的声敏剂的摩尔比为4-7:1,优选为7:1;所述聚合物上修饰的邻苯二酚基团与共价连接的声敏剂的摩尔比为4-7:1,优选为7:1。例如摩尔比为4:1、4.5:1、5:1、5.5:1、6:1、6.5:1以及7:1等4-7:1之间的任意数值以及任意数值之间的两个范围值。
进一步地,金属离子选自铜离子、锰离子和锌离子中的一种或至少两种的组合。通过选择不同的金属离子,功能化的金属多酚网络结构可以起到不同的治疗作用。当金属离子为铜离子时,金属多酚网络响应肿瘤细胞内酸性环境释放铜离子引起铜死亡,并通过类芬顿反应协同声动力治疗产生ROS造成线粒体损伤,线粒体DNA的释放进一步激活cGAS-STING通路,引发抗肿瘤免疫反应。当金属离子为锰离子、锌离子时,可以直接活化cGAS-STING通路从而激活抗肿瘤免疫反应,同时联合声动力治疗杀伤肿瘤细胞。
修饰有多酚并共价连接声敏剂的所述聚合物与所述金属离子的质量比为1:9-20,优选为1:15。例如为1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19以及1:20等1:9-20之间的任意数值以及任意数值之间的两个范围值。
线粒体自噬抑制剂选自Mdivi-1、氯喹、羟氯喹和3-Methyladenine中的至少一种。
金属多酚网络与所述线粒体自噬抑制剂的质量比为15-30:1,优选为30:1。例如为15:1、20:1、25:1以及30:1等15-30:1之间的任意数值以及任意数值之间的两个范围值。
第二方面,本发明提供一种前述实施方式所述的金属多酚纳米声敏药物的制备方法,将修饰有多酚并共价连接声敏剂的聚合物与金属盐溶液混合搅拌,而后再与线粒体自噬抑制剂混合。优选加入所述线粒体自噬抑制剂后,进行超声。
本发明实施例提供的制备方法操作简单、稳定可靠,使用两步法可快速合成金属多酚纳米声敏药物。
具体的,将金属离子的盐溶液缓慢滴加至修饰有多酚并共价连接声敏剂的聚合物水溶液中,并剧烈搅拌2-24小时,得到金属多酚网络,之后向金属多酚网络中缓慢滴加线粒体自噬抑制剂的有机溶液并剧烈搅拌5-30分钟,并使用超声(50Hz,35%强度,30s–5min),得到金属多酚纳米声敏药物,之后可通过透析、冻干及超滤等实验室常见方法得到纯化和浓缩的金属多酚纳米声敏药物。
需要说明的是,修饰有多酚并共价连接声敏剂的聚合物可以参照现有的方法合成得到,本发明实施例不再详述。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本发明实施例提供一种金属多酚纳米声敏药物的制备方法,包括:
首先,将0.025mol平均分子量为20000Da的8臂PEG琥珀酰亚胺基琥珀酸酯(三季戊四醇核)溶解于DMF中。其次,将0.0125mmol Ce6-NHS溶解于DMF中并加入8臂PEG琥珀酰亚胺基琥珀酸酯(三季戊四醇核)溶液中搅拌。之后将0.0875mmol多巴胺溶解于DMF中并加入前述混合溶液中,最后加入95μL三乙胺搅拌过夜。通过透析和冻干得到PEG-polyphenol-Ce6。
将0.3mL的3mg/mL氯化铜水溶液缓慢滴加至4.7mL的3mg/mL PEG-polyphenol-Ce6水溶液中,并剧烈搅拌8小时,得到铜-多酚网络,之后向含有15mg铜-多酚网络的5mL水溶液中缓慢滴加150μL含有0.529mg Mdivi-1的DMSO溶液并剧烈搅拌5分钟,并使用超声(50Hz,35%强度,30s),得到PCM纳米颗粒。用大量去离子水和100kD Millipore超滤离心管洗涤PCM纳米粒,离心条件为3500rpm,20分钟,4℃,离心次数为3次。最终得到5mg/mL的PCM纳米粒水溶液。
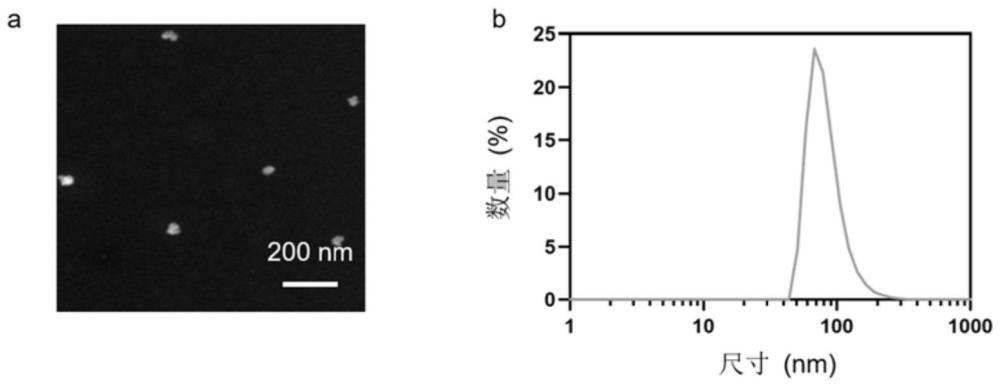
表征:对PCM金属多酚纳米声敏药物进行电镜和粒径分布检测,结果参见图1,根据图1中a可知,透射电镜电镜结果显示PCM纳米粒直径大小约为50nm,如图1中b可知,PCM纳米粒的水合粒径大小为78nm。PCM纳米粒的表面电势为-16.4mV。
实施例2-实施例4
参照实施例1提供的制备方法制备金属多酚纳米声敏药物,区别在于操作条件有所不同,具体如下:
实施例2:金属盐为氯化锌,修饰有多酚并共价连接声敏剂的聚合物为PEG-polyphenol-Ce6;线粒体自噬抑制剂选羟氯喹;聚合物与所述金属离子的质量比为1:10;金属多酚网络与所述线粒体自噬抑制剂的质量比为15:1。
实施例3:金属盐为氯化锰,修饰有多酚并共价连接声敏剂的聚合物为PEG-polyphenol-Ce6;线粒体自噬抑制剂选3-Methyladenine;聚合物与所述金属离子的质量比为1:18;金属多酚网络与所述线粒体自噬抑制剂的质量比为20:1。
实施例4:金属盐为氯化铜,修饰有多酚并共价连接声敏剂的聚合物为PEG-polyphenol-Ce6;线粒体自噬抑制剂选氯喹;聚合物与所述金属离子的质量比为1:16;金属多酚网络与所述线粒体自噬抑制剂的质量比为25:1。
实验例1
对小鼠三阴性乳腺癌细胞的杀伤作用研究
为验证PCM纳米粒对小鼠三阴性乳腺癌细胞的杀伤作用,4T1细胞以5×10
PBS组:培养基中加入等体积PBS;Mdivi-1组:培养基中含有10μMMdivi-1;PC-Cu组:培养基中含有147μg/mL PC-Cu金属多酚网络;PCM组:培养基中含有PCM金属多酚纳米声敏药物,其Cu浓度为147μg/mLμM,Mdivi-1浓度为10μM;-US组:药物处理24h;+US组:药物处理18h后,超声1分钟(1MHz,1W cm
结果见图2,根据图2可知,PCM纳米粒杀伤了30%的4T1细胞,并且在声动力治疗协同作用下杀伤肿瘤细胞的能力进一步提高。
实验例2
对小鼠三阴性乳腺癌细胞的线粒体呼吸抑制作用研究
为验证PCM纳米粒对小鼠三阴性乳腺癌细胞的线粒体呼吸抑制作用,4T1细胞以5×10
PBS组:培养基中加入等体积PBS;Mdivi-1组:培养基中含有10μMMdivi-1;PC-Cu组:培养基中含有147μg/mL PC-Cu金属多酚网络;PCM组:培养基中含有PCM金属多酚纳米声敏药物,其Cu浓度为147μg/mLμM,Mdivi-1浓度为10μM。
结果见图3,其中图3中a表示经过不同处理后4T1细胞线粒体压力测试结果,图3中b表示处理后4T1细胞的线粒体备用呼吸容量。根据图3中a可知,PCM纳米粒处理后4T1细胞的线粒体耗氧率明显下降。根据图3中b可知,统计结果证明,PCM纳米粒可以显著降低4T1细胞的线粒体备用呼吸容量。
实验例3
验证PCM纳米粒对cGAS-STING通路的激活作用
为验证PCM纳米粒对cGAS-STING通路的激活作用,4T1细胞以1×10
如图4所示,在PCM纳米粒处理后,通路中STING、IRF3和TBK1蛋白的磷酸化水平升高,证明了cGAS-STING通路被激活。
实验例4
验证PCM纳米粒对线粒体自噬的抑制作用
为验证PCM纳米粒对线粒体自噬的抑制作用,4T1细胞以1×10
如图5所示,在加入线粒体自噬抑制剂Mdivi-1后,线粒体自噬水平下降,而在PC-Cu处理后线粒体自噬水平明显上升,但PCM纳米粒处理后,相比PC-Cu组线粒体自噬水平下降,由于外界刺激引发的线粒体自噬受到抑制。
实验例5
验证PCM金属多酚纳米声敏药物对4T1原位癌模型的治疗作用
如图6中a所示,为建立小鼠原位乳腺癌模型,1×10
在种植肿瘤后的第8天,尾静脉注射PCM纳米粒,其他组注射等体积PBS或等浓度的Mdivi-1或等浓度的PC-Cu。每次注射次日对近端肿瘤进行声动力治疗(1MHz,2.5W cm
结果见图6中b和c。如图6中b和c所示,PCM纳米粒有效地抑制了近端及远端肿瘤的生长,相比其他组PCM纳米粒协同声动力治疗组有更强的肿瘤抑制效果。
实验例6
验证PCM纳米粒协同声动力治疗对小鼠体内天然免疫应答的激活作用
建立了另一批小鼠原位乳腺癌模型,方法与实验例5相同,在最后一次治疗后第4天,各治疗组分别收集4只小鼠的淋巴结和肿瘤组织,消化处理后得到单细胞悬液。荧光抗体染色标记后,借助流式细胞仪分析淋巴结内树突状细胞共刺激分子CD80和CD86表达情况,以及肿瘤内NK细胞水平和NK细胞中脱粒标志物CD107的表达情况。
结果见图7,其中图7中a表示:使用BALB/c小鼠模型验证PCM金属多酚纳米声敏药物对4T1原位癌模型的抗肿瘤免疫激活作用,最后一次治疗后第4天时小鼠淋巴结内树突状细胞CD80和CD86共表达情况图;图7中b表示最后一次治疗后第4天时小鼠肿瘤部位自然杀伤细胞(NK细胞)水平;图7中c表示NK细胞中CD107表达情况图。如图7中a所示,PCM纳米粒协同声动力治疗可显著提高淋巴结内树突状细胞共刺激分子CD80和CD86表达,促进树突状细胞的成熟。图7中b和c则表明,PCM纳米粒协同声动力治疗可显著肿瘤部位NK细胞比例,并且增加NK细胞中脱粒标志物CD107的表达,提高NK细胞杀伤能力。
实验例7
验证PCM纳米粒协同声动力治疗对小鼠体内cGAS-STING通路的激活作用
为验证PCM纳米粒协同声动力治疗对小鼠体内cGAS-STING通路的激活作用建立了另一批小鼠原位乳腺癌模型,方法与实施例5相同,在最后一次治疗后第4天,各治疗组分别收集4只小鼠的肿瘤组织,裂解后提取组织内蛋白。使用ELISA试剂盒方法测试小鼠肿瘤组织内I型干扰素IFN-β和趋化因子CXCL10的浓度。
结果参见图8,其中,图8中的a表示使用BALB/c小鼠模型验证PCM金属多酚纳米声敏药物对4T1原位癌模型的cGAS-STING通路激活作用,最后一次治疗后第4天时小鼠肿瘤部位I型干扰素IFN-β的浓度;图8中b表示趋化因子CXCL10的浓度。
根据图8中a和b,PCM纳米粒协同声动力治疗可显著提高肿瘤部位IFN-β和CXCL10浓度,证实了协同治疗可以激活cGAS-STING通路。
实验例8
将0.3mL的9mg/mL二氯化锰水溶液缓慢滴加至4.7mL的3mg/mL PEG-polyphenol-Ce6水溶液中,并剧烈搅拌8小时,得到锰-多酚网络,之后向5mL锰-多酚网络水溶液中缓慢滴加150μL 10mM Mdivi-1的DMSO溶液并剧烈搅拌5分钟,并使用超声处理(50Hz,35%强度,30s),得到PMM纳米颗粒。用大量去离子水和100kD Millipore超滤离心管洗涤PCM纳米粒,离心条件为3500rpm,20分钟,4℃,离心次数为3次。最终得到5mg/mL的PMM纳米粒水溶液。
如图9所示,水合粒径大小为92nm。此结果表明,不同的金属离子与修饰了邻苯二酚基团的聚合物配位后同样可以包裹药物形成粒径均一的纳米粒。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
