用于确定抑制多种微生物样品生长的组合物的适宜性的方法和系统
文献发布时间:2024-04-18 19:58:30
相关申请的交叉引用
本申请要求2021年2月17日提交的美国专利申请号17/178,091、2021年4月14日提交的PCT申请号PCT/US21/27336、2021年6月1日提交的美国专利申请号17/335,767、2021年6月1日提交的美国临时申请号63/195,502和2021年10月1日提交的美国临时申请号63/251,433的优先权,其说明书通过引用整体并入本文。
发明的背景
技术领域
本申请涉及用于鉴定多种微生物样品(例如多种微生物感染)的方法和系统,以及确定一种或多种组合物用于抑制多种微生物样品生长的适宜性的方法,例如,提供与使用一种或多种组合物抑制多种微生物样品生长成功可能性相关的信息。本申请还描述了向用户提供关于多种微生物样品的信息的方法,例如但不限于关于用于抑制多种微生物样品生长的组合物的适宜性的信息。
背景技术
传染病可影响多个器官系统,并造成显着的发病率、死亡率和经济影响。感染原通常表现为复杂的多种微生物感染,而不是单一病原体感染。在体内,这些多种微生物感染通过各种相互作用相互配合,既改变了生物体易感的抗生素类型,又改变了治疗感染所需的抗生素水平以及单个病原体的毒力。
本申请描述了用于确定一种或多种组合物用于抑制多种微生物样品生长的适宜性的方法,例如,与使用一种或多种组合物抑制多种微生物样品生长成功可能性相关的信息。本申请还描述了提供与一种或多种组合物用于抑制多种微生物样品生长的适宜性相关的信息的方法。
本发明描述了检测和鉴定细菌的非培养方法,例如基于多重PCR的方法(基于DNA)(M-PCR)。例如,M-PCR不需要生长并且靶向尿路致病菌种。M-PCR提供与培养物相当的半定量信息,并以例如<9999个细胞/mL、10000至49999个细胞/mL、50000至99999个细胞/mL和>100000个细胞/mL等范围呈现。同样,细胞的数量/mL与CFU的数量相当。通过M-PCR鉴定的绝大多数尿路病原体的浓度>100000个细胞/mL,这表明检测并不是由于PCR的灵敏度增加所致;相反,这是由于SUC无法检测到细菌。不可培养生物体的浓度与可培养生物体的浓度相当。在一项针对有症状患者的大型前瞻性试验中,发现通过M-PCR检测到的这些尿路病原体与症状有关。
本发明还描述了混合抗生素敏感性测试(P-AST)(美国专利号10,160,991,其说明书通过引用整体并入本文),其涉及在抗生素存在的情况下同时培养所有检测到的细菌,然后测量敏感性。因此,P-AST考虑了共生细菌物种之间的相互作用,并且可以作为抗生素敏感性的更准确的预测因子。
本发明还描述了基因型抗生素抗性(ABR)测试,其中测试多种微生物感染的细菌的特定遗传标记。应用多种微生物感染对特定抗生素产生抗性的几率来确定适当的治疗方案。
本发明描述了所述方法和系统用于鉴定尿液中的多种微生物感染的用途、鉴定或提供治疗所述尿液中的多种微生物感染的治疗方案的用途。例如,本发明提供了允许快速鉴定UTI的方法和系统以及快速鉴定用于UTI治疗方案的方法和系统。本发明不限于与尿液相关的多种微生物感染。
发明内容
本文公开了确定一种或多种组合物用于抑制多种微生物样品中生物体生长的适宜性的方法,例如,提供与用一种或多种组合物成功抑制多种微生物样品生长的可能性相关的信息。本申请还描述了向用户提供关于多种微生物样品的信息的方法,例如但不限于关于用于抑制多种微生物样品生长的组合物的适宜性的信息(例如,关于用特定组合物或治疗方案成功抑制多种微生物感染生长的可能性的统计或信息等)。本发明还描述了用于向用户提供所述信息的文档、演示文稿或其他媒体。
本发明的特征还在于用于检测和鉴定多种微生物样品(例如,多种微生物感染)的生物体的方法,用于确定样品中多种微生物样品(例如,多种微生物感染)对抗生素或其他治疗剂的敏感性或抗性的表型混合敏感性试验,以及抗性基因(例如可能指示对特定治疗的抗性的遗传标记)的鉴定。总之,这些数据可以应用于特定已知的多种微生物样品(例如,多种微生物感染)的抗生素/治疗敏感性或抗性数据库,以便提供与多种微生物样品(例如,多种微生物感染)的一种或多种治疗方案成功可能性相关的信息。本发明的特征还在于用于鉴定多种微生物感染和鉴定或提供多种微生物感染的治疗方案的方法和系统。本发明的特征还在于用于治疗多种微生物感染的方法和系统。
本文的方法的特征在于:(1)检测和鉴定多种微生物感染的生物体(例如,细菌或其他感染原),(2)进行混合抗生素敏感性试验,用于确定样品中多种微生物感染对抗生素或其他治疗剂的敏感性或抗性,以及(3)鉴定多种微生物感染中的感染原中的抗性基因,例如,可以指示对特定抗生素或其他治疗剂或治疗的抗性的遗传标记。可以一起应用来自(1)、(2)和(3)的数据(例如,使用针对特定已知的多种微生物感染的抗生素/治疗敏感性或抗性的数据库),以便为多种微生物感染提供一种或多种治疗方案。
在一些实施方案中,生物体是细菌。本发明不限于细菌感染原并且可以包括病毒、真菌、原生动物、细菌或其组合。
本发明描述了一种用于提供治疗患者多种微生物感染或疑似多种微生物感染的治疗方案的方法。在一些实施方案中,所述方法包括对从患者中多种微生物感染原获得的样品的一部分进行基因鉴定测试,以检测和鉴定样品中的一种或多种生物体。所述方法还可以包括对所述样品的一部分进行遗传抗性标记测试,以检测和鉴定所鉴定的生物体中的一种或多种抗性基因(例如,赋予对一种或多种治疗剂抗性的抗性基因)。所述方法还可以包括对样品的一部分进行混合表型抗生素抗性测试(混合敏感性测试),其中表型抗生素抗性测试进行以下之一或两者:鉴定多种微生物感染对其具有抗性的一种或多种治疗剂,和/或鉴定多种微生物感染对其敏感的一种或多种治疗剂。在表型抗生素抗性测试之前,未首先分离样品中多种微生物感染的一种或多种生物体。所述方法还可以包括将来自基因鉴定测试、遗传抗性标记测试和混合抗生素敏感性测试的结果应用于数据库,例如数据库的预定阈值。该分析鉴定出一种或多种可有效治疗多种微生物感染的治疗剂(例如,“治疗方案”)。
本发明的特征还在于用于治疗有需要的患者中多种微生物感染或疑似多种微生物感染的方法。在一些实施方案中,所述方法包括对从患者中多种微生物感染原获得的样品的一部分进行基因鉴定测试,以检测和鉴定样品中的一种或多种生物体。所述方法还可以包括对所述样品的一部分进行遗传抗性标记测试,以检测和鉴定所鉴定的生物体中的一种或多种抗性基因(例如,赋予对一种或多种治疗剂抗性的抗性基因)。所述方法还可以包括对所述样品的一部分进行混合表型抗生素抗性测试,其中表型抗生素抗性测试进行以下任一或两者:鉴定多种微生物感染对其具有抗性的一种或多种治疗剂,和/或鉴定多种微生物感染对其敏感的一种或多种治疗剂。在表型抗生素抗性测试之前,未首先分离样品中的多种微生物感染的一种或多种生物体。所述方法还可以包括将来自基因鉴定测试、遗传抗性标记测试和混合抗生素抗性测试的结果应用于数据库,例如数据库的预定阈值。该分析鉴定出一种或多种可有效治疗多种微生物感染的治疗剂(例如,“治疗方案”)。所述方法还可以包括向患者施用已鉴定的至少一种治疗剂,其中所述至少一种治疗剂对治疗所述多种微生物感染有效。
指示哪些治疗剂对治疗多种不同的多种微生物感染有效的数据库可以通过对表型抗生素抗性测试、多种不同多种微生物感染的遗传抗性标记测试的结果进行汇编来生成。
在某些实施方案中,治疗方案可包含一种适用的治疗剂。在一些实施方案中,治疗方案包含两种或更多种适用的治疗剂。在一些实施方案中,治疗方案包含三种或更多种适用的治疗剂。在一些实施方案中,治疗方案包含四种或更多种适用的治疗剂。在一些实施方案中,治疗方案包含五种或更多种适用的治疗剂。
参考本文的任何实施方案,所述方法还可包括编译数据集,所述数据集包括选自以下的一个或多个数据点:(i)表型抗生素抗性测试的结果,(ii)基因鉴定测试的结果,(iii)遗传抗性标记测试的结果,(iv)预计多种微生物感染对其具有增加的抗性的治疗剂,(v)预计多种微生物感染对其具有降低的抗性的治疗剂,(vi)建议的治疗剂,以及(vii)建议的治疗剂的制剂。
在某些实施方案中,所述方法还包括生成传达数据集的报告。在某些实施方案中,报告以图表和/或表格和/或简图为特征。在某些实施方案中,所述方法还包括向医疗专业人员提供报告,其中所述报告传达对患者的治疗的建议。
在某些实施方案中,所述方法还包括测量样品中存在的生物体的数量或浓度。在一些实施方案中,所述方法还包括超广谱β-内酰胺酶(ESBL)测试。在一些实施方案中,所述方法还包括测试与艰难梭菌(Clostridium difficile)相关的基因。在一些实施方案中,所述方法还包括确定多种微生物感染的生物体的微生物抑制浓度(MIC)。
在某些实施方案中,基因鉴定测试包括PCR、荧光原位杂交(FISH)、培养、质谱、电化学生物传感、自动生化鉴定、流式细胞术或其组合。在某些实施方案中,遗传抗性标记测试包括PCR或测序。在某些实施方案中,混合表型抗生素抗性测试包括:将所述样品的一部分的级分引入到一个或多个培养基样品中,每个培养基样品包含治疗剂,将所述培养基样品与所述级分一起孵育(例如,在适合生长的条件下),并且随后在孵育后测量培养基样品中的生物体的活力(viability)。在某些实施方案中,培养基样品位于试管、培养板孔、琼脂板或显微镜载玻片中。在某些实施方案中,生物体的活力通过光密度(OD)、荧光或化学发光来测量。
在某些实施方案中,样品具有至少一种抗性标记。在某些实施方案中,样品具有至少2种抗性标记。在某些实施方案中,样品具有至少3种抗性标记。在某些实施方案中,至少一种抗性标记是mecA基因、vanA/B基因、TEM基因、SHV基因、OXA基因、CTX-M基因、KPC基因、NDM基因、OXA基因、VIM基因、IMP基因或其组合。在某些实施方案中,所述一种或多种抗性基因是ErmA+ErmB、TEM、CTX-M组1、SHV、VEB、OXA-1、CTX-M组2、CTX-M组9、CTX-M组8/25、PER-1、PER-2、GES、blaNDM-1、VIM、KPC、IMP-2组、IMP-1组、OXA-23、IMP-16、IMP-7、OXA-72、OXA-40、OXA-58、OXA-48、NDM、blaOXA-48、QnrA、QnrB、mecA、ampC、FOX、ACC、DHA、MOX/CMY、BIL/LAT/CMY、vanA1、vanA2、vanB、vanC1或vanC2-C3-2。
可测试和/或存在于多种微生物感染中的生物体的非限制性实例包括以下中的一种或其组合:鲍曼不动杆菌(Acinetobacter baumannii)、沙氏放线菌(Actinotignumschaalii)、尿气球菌(Aerococcus urinae)、尿气球菌(Aerococcus urinae)、广栖别样斯卡多维亚菌(Alloscardovia omnicolens)、白色念珠菌(Candida albicans)、光滑念珠菌(Candida glabrata)、近平滑念珠菌(Candida parapsilosis)、热带念珠菌(Candidatropicalis)、衣原体(Chlamydia)、弗氏柠檬酸杆菌(Citrobacter freundii)、克氏柠檬酸杆菌(Citrobacter koseri)、艰难梭菌(Clostridium difficile)、里氏棒状杆菌(Corynebacterium riegelii)、产气克雷伯菌(Klebsiella aerogenes)、粪肠球菌(Enterococcus faecalis)、大肠杆菌(Escherichia coli)、产酸克雷伯菌(Klebsiellaoxytoca)、肺炎克雷伯菌(Klebsiella pneumoniae)、摩氏根氏菌(Morganella morganii)、结核分枝杆菌(Mycobacterium tuberculosis)、生殖支原体(Mycoplasma genitalium)、人型支原体(Mycoplasma hominis)、淋病奈瑟菌(Neisseria gonorrhea)、成团泛菌(Pantoeaagglomerans)、奇异变形杆菌(Proteus mirabilis)、斯氏普罗威登斯菌(Providenciastuartii)、铜绿假单胞菌(Pseudomonas aeruginosa)、粘质沙雷氏菌(Serratiamarcescens)、金黄色葡萄球菌(Staphylococcus aureus)、凝固酶阴性葡萄球菌(coagulase-negative Staphylococcus)、无乳链球菌(Streptococcus agalactiae)、化脓性链球菌(Streptococcus pyogenes)、草绿色链球菌(Viridans Group Streptococcus)、阴道毛滴虫(Trichomonas vaginalis)、解脲支原体(Ureaplasma urealyticum)、HHV-6、HHV-7、BK病毒、JC病毒、HSV 1&2、腺病毒或CMV。
在一些实施方案中,治疗剂是以下中的一种或其组合:青霉素、四环素、头孢菌素、喹诺酮类、林可霉素、大环内酯类、磺胺类、糖肽类抗生素、氨基糖苷类、碳青霉烯类、安沙霉素、安那霉素、脂肽、磷霉素、单环β-内酰胺类、硝基呋喃、恶唑烷酮、两性霉素B、艾沙康唑、伊曲康唑、米卡芬净、泊沙康唑、伏立康唑、西多福韦、阿糖腺苷、磷甲酸、阿昔洛韦、伐昔洛韦或其组合。
在一些实施方案中,多种微生物感染包含2种或更多种生物体。在一些实施方案中,多种微生物感染包含3种或更多种生物体。在一些实施方案中,多种微生物感染包含4种或更多种生物体。在一些实施方案中,多种微生物感染包含5种或更多种生物体。在一些实施方案中,多种微生物感染包含6种或更多种生物体。在一些实施方案中,多种微生物感染包含7种或更多种生物体。
在某些实施方案中,多种微生物感染中两种或更多种生物体的存在改变了多种微生物感染对已知对单独存在于多种微生物感染中的至少一种生物体有效的抗生素或治疗剂的敏感性。
本发明还提供了用于为患有或疑似患有多种微生物感染的患者制备治疗方案的工作流程方法。所述方法可包括本文所述的一个或多个步骤,例如对样品的一部分进行基因鉴定测试、对样品的一部分进行遗传抗性标记测试、以及对样品的一部分进行混合抗生素抗性测试。
在某些实施方案中,样品包括尿液、血液、血浆、脑脊液、唾液、痰液、肺灌洗液、阴道分泌物、伤口灌洗液、活检组织、伤口拭子、直肠拭子、鼻拭子、组织、粪便、精子样品、精液样品或前列腺液。
参考本文的任何实施方案,本文描述的步骤可以以任何顺序或同时执行。
本文描述的任何特征或特征的组合都包括在本发明的范围内,只要任何这样的组合中包括的特征不是相互矛盾的,这将从上下文、本说明书和本领域普通技术人员的知识中显而易见。本发明的其他优点和方面在以下详细的描述和权利要求中是显而易见的。
附图的几个视图的简要说明
本发明的特征和优点将从结合附图给出的以下详细描述中变得显而易见,其中:
图1显示了特定细菌之间的互利共生的示意图。
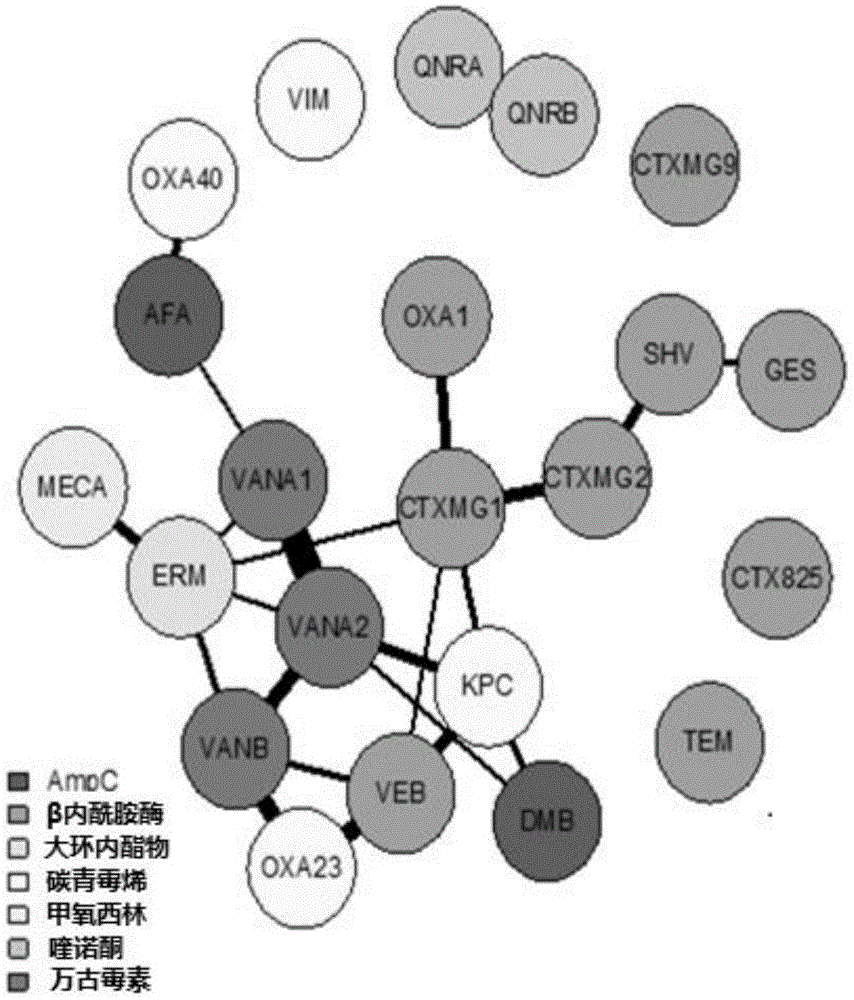
图2显示了某些抗性基因同时出现的频率。相关性的强度由连接基因的边缘的宽度表示。仅显示大于0.1的相关性。
图3显示了多种微生物感染被确定为对抗生素表型敏感但基因型抗性的频率之间的比较(反之亦然),例如,表型和基因型敏感性结果不一致的频率(n=764名有多种微生物感染症状的患者和表型数据)。
图4显示了包含针对特定的多种微生物感染的一种或多种治疗方案的报告的实施例。
图5显示了基于本发明的方法(“指导UTI测试”)治疗的患者、经验治疗的患者和未经治疗的患者的症状缓解的比较。
图6显示了通过培养或PCR检测出各种细菌呈阳性的患者数量(所有患者,n=2511)。
图7显示了研究中多种微生物感染中检测到的细菌。
图8显示了在68.6%(1710/2493)细菌呈阳性的患者中检测到的细菌分布,显示了单一微生物、多种微生物和聚生体混合物中生物体的分布。
图9显示了聚生体中最常见的细菌之间关系的网络图。
图10显示了单一微生物感染和多种微生物感染以及聚生体中革兰氏阳性菌和革兰氏阴性菌的检出率。
图11显示了多种微生物样品与单一微生物样品中抗生素抗性的优势比,以及多种微生物样品中细菌物种数量每次增加的抗性优势比。
图12显示生物体相互作用对抗生素抗性的影响。向上的箭头表示抗性增加。向下的箭头表示抗性减小(灵敏度增加)。
图13显示了大肠杆菌(E.coli)和肺炎克雷伯菌(K.pneumoniae)相互作用对氨必西林/舒巴坦、头孢克洛和四环素的抗性的影响(p=0.05)。
图14描述了一个示例性的抗生素源板,其具有孔内容物和抗生素浓度(μg/mL)。Nitro=呋喃妥因,Cipro=环丙沙星,Mero=美罗培南,Ceftriaxone=头孢曲松,TMP/SMX=甲氧苄啶+磺胺甲恶唑,Pip/Tazo=哌拉西林+唑巴坦,Levo=左氧氟沙星,Cepoxitin=头孢西丁,Tetra=四环素,Amp/Sulb=氨必西林+舒巴坦,Amp=氨必西林,Vanco=万古霉素。
图15描述了一个示例性的抗生素源板,其具有孔内容物和抗生素浓度(μg/mL)。Cefazolin=头孢唑林,Cefepime=头孢吡肟,Ceftazidime=头孢他啶,Gentamicin=庆大霉素,Amox/Clav=阿莫西林+克拉维酸,Cefaclor=头孢克洛。
图16显示了通过多重聚合酶链式反应(M-PCR)检测到的抗生素抗性基因(ABR)的存在与通过混合抗生素敏感性测试(P-AST)检测到有症状的尿路感染(UTI)患者尿液样品的抗生素敏感性之间的一致性。虚线表示所有样品的加权平均一致性(60%)。缩写:Combo,组合抗生素,包括氨必西林/舒巴坦、阿莫西林/克拉维酸盐和哌拉西林/他唑巴坦。
图17显示了对美罗培南、哌拉西林/他唑巴坦或万古霉素敏感或具有抗性的ABR基因的患者(具有多种微生物感染或单一微生物感染)的数量。
图18显示了通过混合抗生素敏感性测试(P-AST)的抗生素抗性和所分析的所有14种抗生素的抗生素抗性(ABR)基因的存在。还显示了在研究中检测到的不同聚生体的每个患者的检测频率和相关的临床发现的平均数。临床发现被定义为以下一种或多种症状或异常实验室结果,包括尿失禁、排尿困难、肉眼血尿、疼痛/骨盆不适、尿液浑浊或尿液气味重、下尿路症状(LUTS)和异常尿检或试纸结果。
图19显示了通过多重聚合酶链式反应检测到的抗生素抗性(ABR)基因的存在与使用混合抗生素敏感性测试(P-AST)检测来自有症状的尿路感染(UTI)患者的尿液样品的抗生素敏感性之间的总体一致性。
术语
如本文所用,术语“最高单剂相互作用原理”是指一种统计模型,其中多种微生物感染的抗性被预测为具有最高抗性的细菌的抗性。例如,如果物种A的抗性概率为20%,物种B的抗性概率为50%,则细胞池的抗性概率为50%。
如本文所用,术语“联合原理”是指一种统计模型,其中物种A和物种B的多种微生物感染由物种A的一个菌落(或一种遗传变异体)和物种B的一个菌落(或一种遗传变异体)组成,如果物种A的菌落具有抗性,或者如果物种B的菌落具有抗性,则该多种微生物感染具有抗性。例如,如果将抗生素应用于多种微生物感染,它可能会杀死物种A,但如果物种B存活下来,则该多种微生物感染被称为具有抗性。例如,如果物种A的抗性概率为20%,物种B的抗性概率为50%,则细胞池的抗性概率为:P(细胞池抗性)=P(A)+P(B)-P(A和B)
如本文所用,术语“逻辑加性模型”是指一种统计模型,其中在逻辑模型中评估物种A和物种B对多种微生物感染的抗性的效应。物种A的效应是物种A存在时相对于不存在时的抗性优势比;类似地,物种B的效应是物种B存在时相对于不存在时的抗性优势比。加性模型将两个物种的效应预测为对数优势比之和;或两个单独优势比的乘积。例如,如果背景抗性为50%,则在没有相互作用的情况下,预期的多种微生物感染(物种A和物种B)抗性为20%;如果背景抗性为20%,则预期的多种微生物感染抗性为50%。
本方法可以使用选自可用于治疗患者的大量抗生素的多种抗生素来进行。抗生素的类别(也称为抗微生物剂或抗菌剂)包括但不限于青霉素类、四环素类、头孢菌素类、喹诺酮类、林可霉素类、大环内酯类、磺胺类、糖肽类抗生素、氨基糖苷类、碳青霉烯类、安沙霉素类、安那霉素类、脂肽类、单环β-内酰胺类、硝基呋喃类、恶唑烷酮类和多肽类。
青霉素类抗生素可包括但不限于青霉素、甲氧西林、阿莫西林、氨必西林、氟氯西林、青霉素G、青霉素V、羧苄西林、哌拉西林、替卡西林、苯唑西林、双氯西林、阿洛西林、氯唑西林、美洛西林、替莫西林和萘夫西林。此外,青霉素类抗生素通常与β-内酰胺酶抑制剂联合使用,以提供更广谱的活性;这些组合抗生素包括阿莫西林/克拉维酸、氨必西林/舒巴坦、哌拉西林/他唑巴坦和克拉维酸/替卡西林。四环素类抗生素包括但不限于四环素、多西环素、地美环素、米诺环素和土霉素。头孢菌素类抗生素可包括但不限于头孢羟氨苄、头孢拉定、头孢唑啉、头孢氨苄、头孢吡肟、头孢洛林、氯碳头孢、头孢替坦、头孢呋辛、头孢丙烯、头孢西丁、头孢克洛、头孢布烯、头孢曲松、头孢噻肟、头孢泊肟、头孢地尼、头孢克肟、头孢妥仑、头孢唑肟、头孢哌酮、头孢噻吩、头孢孟多(cefamanadole)、头孢洛林酯、头孢托罗(cetobiprole)和头孢他啶。头孢菌素类抗生素通常与β-内酰胺酶抑制剂联合使用,以提供更广谱的活性;这些组合抗生素包括但不限于阿维巴坦/头孢他啶和头孢洛扎/他唑巴坦(ceftolozane/tazobactam)。喹诺酮类抗生素包括但不限于洛美沙星、氧氟沙星、诺氟沙星、加替沙星、环丙沙星、莫西沙星、左氧氟沙星、吉米沙星、西诺沙星、萘啶酸、曲伐沙星、依诺沙星、戈帕沙星、替马沙星和司帕沙星。林可霉素类抗生素可包括但不限于克林霉素和林可霉素。大环内酯类抗生素可包括但不限于阿奇霉素、克拉霉素、红霉素、替利霉素、地红霉素、罗红霉素、醋竹桃霉素、螺旋霉素和非达霉素。磺酰胺类抗生素可包括但不限于磺胺甲恶唑、柳氮磺胺吡啶、磺胺米隆、磺胺醋酰胺、磺胺嘧啶、磺胺嘧啶银、磺胺二甲氧嘧啶、磺胺、磺胺异恶唑、偶氮磺胺和磺胺异恶唑。磺酰胺类抗生素常与甲氧苄啶联合使用以提高杀菌活性。糖肽类抗生素可包括但不限于达巴万星、奥利万星、特拉万星、替考拉宁和万古霉素。氨基糖苷类抗生素可包括但不限于巴龙霉素、妥布霉素、庆大霉素、阿米卡星、卡那霉素、新霉素、奈替米星、链霉素和壮观霉素。碳青霉烯类抗生素包括但不限于亚胺培南、美罗培南、多尼培南、厄他培南和亚胺培南/西司他丁。安沙霉素类抗生素可包括但不限于格尔德霉素、除莠霉素和利福昔明。脂肽类抗生素可以包括但不限于达托霉素。单环β-内酰胺类抗生素可包括但不限于氨曲南。硝基呋喃类抗生素可包括但不限于呋喃唑酮和呋喃妥因。恶唑烷酮抗生素可包括但不限于利奈唑胺、泼斯唑利、雷得唑来和托雷唑胺。多肽类抗生素可包括但不限于杆菌肽、粘菌素和多粘菌素B。
不属于任何上述组别的其他抗生素包括但不限于氯法齐明、氨苯砜、卷曲霉素、环丝氨酸、乙胺丁醇、乙硫异烟胺、异烟肼、吡嗪酰胺、利福平、利福布丁、利福喷汀、链霉素、胂那明(arsphenamine)、氯霉素、磷霉素、夫西地酸、甲硝唑、莫匹罗星、平西霉素、奎努普丁/达福普汀、甲砜霉素、替加环素、替硝唑和甲氧苄啶。
另外,本发明公开的方法的范围包括包含尚未已知的或尚未得到监管机构批准的抗生素。目前要求保护的测定可以用任何抗菌剂进行并且不限于本文公开的抗生素。
具体实施方式
用于治疗多种微生物感染的治疗方案
本文公开了用于鉴定多种微生物感染以及鉴定或提供针对患者中的多种微生物感染或疑似多种微生物感染的治疗方案的方法和系统。本发明的特征还在于用于治疗患者的多种微生物感染或疑似多种微生物感染的方法和系统。
患者可能表现出感染症状。症状的非限制性实例包括:发烧、排出分泌物、瘙痒、排尿困难、尿频或尿急增加等。然而,在一些实施方案中,所述方法应用于未经历感染症状的患者。如本文所用,患者是指哺乳动物(例如,人类或其他合适的哺乳动物)。
本文的方法的特征是:(1)检测和鉴定多种微生物感染的生物体(例如,细菌或其他感染原,例如病毒、真菌、原生动物等,其组合),(2)进行混合抗生素敏感性测试,以确定样品中的多种微生物感染对抗生素或其他治疗剂的敏感性或抗性,以及(3)鉴定多种微生物感染中的感染原中的抗性基因,例如可能表明对特定抗生素或其他治疗剂或治疗具有抗性的遗传标记。可以一起应用来自(1)、(2)和(3)的数据(例如,使用针对特定已知的多种微生物感染的抗生素/治疗敏感性或抗性的数据库),以便为多种微生物感染提供一种或多种治疗方案。
本发明不限于任何特定类型的感染。本发明不限于细菌感染原并且还可以包括病毒感染原、真菌感染原和/或原生动物。
样品可以是液体、生物物质或组织(例如活检)的形式。样品可包括但不限于血液样品、尿液样品、血浆样品、唾液样品、肺灌洗样品、阴道分泌物、伤口灌洗液、活检样品、伤口样品、精子样品、精液样品、前列腺液样品、脑脊液样品、滑液样品、腹膜液样品、心包液样品、胸水样品、痰样品、粪便样品、粘膜样品、脓肿样品、鼻腔样品、直肠样品等
本发明包括对疑似感染的患者的样品进行生物体检测方法,以检测和鉴定样品中存在的生物体。本领域普通技术人员众所周知的定量聚合酶链式反应(PCR)可用于快速检测样品中的生物体。
生物体检测方法可以允许检测多种生物体,例如,多于5种生物体、多于10种生物体、多于20种生物体、多于30种生物体、多于40种生物体、多于50种生物体等。
然后对被鉴定为感染相关生物体(例如尿路感染相关生物体)呈阳性的样品进行测试,以确定感染的抗生素敏感性概况。例如,对样品进行表型抗生素敏感性测试,例如,混合抗生素敏感性测试(P-AST),用于确定感染对一种以上抗生素或治疗剂的敏感性或抗性,以及基因型抗生素抗性测试(G-ABR)用于确定抗生素抗性基因的存在,这可能表明对特定抗生素或其他治疗剂或治疗的抗性。
混合抗生素敏感性测试(P-AST)
本发明的方法还包括混合敏感性测试,其中将样品在多种抗生素或其他治疗剂中孵育。样品并未首先进行细菌或生物体分离。
作为示例,样品可以被分级并且所有或部分级分可以被引入到含有抗生素或其他治疗剂的培养基中。P-AST测试可以在多孔板中进行;然而,本发明不限于多孔板形式。
孵育后,对感染原(例如细菌)的浓度进行定量,从而确定样品中多种微生物感染对抗生素或其他治疗剂的敏感性或抗性。例如,可以在分光光度计中读取培养基以确定OD,从而测量细胞密度。本发明不限于使用分光光度计来确定OD,从而测量细菌浓度。可以考虑任何其他合适的方法,例如荧光、化学发光等。例如,在一些实施方案中,利用颜色矩阵系统,其中观察和/或计算指示剂的颜色变化。在一些实施方案中,本发明使用流式细胞术(其包括使用针对生物体的抗体)。在一些实施方案中,利用电气系统。本发明不限于前述方法。
在某些实施方案中,P-AST的特征在于测试1种抗生素或治疗剂。在某些实施方案中,P-AST的特征在于测试2种或至少2种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试3种或至少3种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试4种或至少4种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试5种或至少5种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试6种或至少6种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试7种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试8种或至少8种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试9种或至少9种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试10种或至少10种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试11种或至少11种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试12种或至少12种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试13种或至少13种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试14种或至少14种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试15种或至少15种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试16种或至少16种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试17种或至少17种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试18种或至少18种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试19种或至少19种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试20种或至少20种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试25种或至少25种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试30种或至少30种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试35种或至少35种抗生素和/或治疗剂。在某些实施方案中,P-AST的特征在于测试40种或多于40种抗生素和/或治疗剂。
抗生素和其他治疗剂的非限制性实例在本文中公开并且为本领域普通技术人员所熟知。
图1描述了对混合抗生素敏感性测试(P-AST)的多种微生物感染中特定细菌相互作用的研究。例如,一种生物体(例如代谢物)可以喂养另一种生物体;在一些实施例中,一些生物体可能会保护其他生物体免受特定抗生素的侵害,或者使其更容易受到特定抗生素的影响。
遗传抗生素抗性检测(G-ABR)
下面的表1列出了在遗传抗生素抗性测试(G-ABR)中测试的基因的非限制性实例。以下一种或多种基因的存在可能赋予对AmpC、碳青霉烯类、广谱β-内酰胺酶、大环内酯、甲氧西林、喹诺酮、氟喹诺酮或万古霉素的抗性。
表1
在某些实施方案中,G-ABR的特征在于测试指示对特定治疗剂具有抗性的1种遗传标记(例如,抗菌抗性基因、抗病毒抗性基因、抗真菌抗性基因)。在某些实施方案中,G-ABR的特征在于测试指示对特定治疗剂具有抗性的2个或至少2个遗传标记(例如,抗菌抗性基因、抗病毒抗性基因、抗真菌抗性基因)。在某些实施方案中,G-ABR的特征在于测试指示对特定治疗剂具有抗性的3个或至少3个遗传标记(例如,抗菌抗性基因、抗病毒抗性基因、抗真菌抗性基因)。在某些实施方案中,G-ABR的特征在于测试指示对特定治疗剂具有抗性的4个或至少4个遗传标记(例如,抗菌抗性基因、抗病毒抗性基因、抗真菌抗性基因)。在某些实施方案中,G-ABR的特征在于测试5个或至少5个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试6个或至少6个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试7个或至少7个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试8个或至少8个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试9个或至少9个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试10个或至少10个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试11个或至少11个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试12个或至少12个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试13个或至少13个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试14个或至少14个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试15个或至少15个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试16个或至少16个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试17个或至少17个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试18个或至少18个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试19个或至少19个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试20个或至少20个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试25个或至少25个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试30个或至少30个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试35个或至少35个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试40个或至少40个指示对特定治疗剂具有抗性的遗传标记。在某些实施方案中,G-ABR的特征在于测试超过40个指示对特定治疗剂具有抗性的遗传标记。
遗传标记(例如,抗菌抗性基因、抗病毒抗性基因、抗真菌抗性基因)的非限制性实例在本文中公开并且为本领域普通技术人员所熟知。
图2显示了一项研究的结果,其中测试了样品中抗性基因的存在以及特定抗性基因一起被发现的频率。图3显示了一项研究的结果,其中评估了一组样品的ABR状态(敏感性或抗性)并测试了针对一种或多种抗生素的抗性标记(抗性基因型或敏感基因型)。值得注意的是,在某些情况下,两个结果不一致,例如,生物体对抗生素表型敏感但具有抗性基因型的情况(见第3栏),以及生物体表型抗性但具有敏感基因型的情况(见第4栏)。这可用于帮助确定表型敏感性或抗性的可能性,即使生物体不能在培养物中生长。
可以一起分析P-AST数据和G-ABR数据(例如,应用或与标准化值或阈值比较)以确定抗生素/治疗敏感性或抗性,以便为多种微生物感染提供一种或多种治疗方案。阈值将特定于每个测试,例如基因鉴定测试、混合敏感性测试、抗性基因测试。例如,基因鉴定测试的阈值可以包括对该生物体测试呈阳性的最低生物体数量。注意,本发明还包括对将来将鉴定的抗性基因的测试。本发明还包括目前不能培养但将来随着生长条件扩展可以培养的细菌的培养。
在某些实施方案中,治疗剂是以下的一种或组合:青霉素、四环素、头孢菌素、喹诺酮、林可霉素、大环内酯、磺胺、糖肽抗生素、氨基糖苷、碳青霉烯、安沙霉素、安那霉素、脂肽、磷霉素、单环β-内酰胺类、硝基呋喃、恶唑烷酮和/或多肽。在某些实施方案中,治疗剂是西多福韦、阿糖腺苷、膦甲酸、阿昔洛韦和/或伐昔洛韦中的一种或其组合。在某些实施方案中,治疗剂是两性霉素B、艾沙康唑、伊曲康唑、米卡芬净、泊沙康唑和/或伏立康唑中的一种或其组合。
治疗剂的制剂包括但不限于口服(PO)、静脉注射(IV)和/或注射。
图4显示了描述本发明方法对多种微生物感染样品的结果的报告的实例,包括一种或多种治疗方案。
本文的方法有助于提供快速结果并减少对经验性治疗的需要。不希望将本发明限制于任何理论或机制,相信本发明的方法与当前的护理实践标准例如标准尿培养相比提供更好的准确性。参考图5,与未治疗的患者或经验治疗的患者相比,使用本发明的方法(“指导UTI测试”)治疗的患者表现出明显更好的症状消退。
实施例
以下是本发明的非限制性实施例。应当理解,所述实施例并不旨在以任何方式限制本发明。等价物或替代物在本发明的范围内。
实施例1多重聚合酶链反应检测与尿培养诊断有症状尿路感染的多地点前瞻性比较
尿培养传统上用于检测和鉴定病原体,以诊断和治疗尿路感染(UTI)。然而,越来越多的证据表明,聚合酶链反应(PCR)检测可能更适合病原体的检测和鉴定。这项前瞻性多中心研究比较了PCR与传统尿培养对2511名出现尿路感染症状的患者(平均年龄73岁;范围24-100岁)中细菌的检测和鉴定。对所有患者的样品进行了尿培养和PCR。PCR在62.7%(1575/2511)的病例中检出细菌,而尿培养在43.7%(1098/2511)的病例中检出细菌。74.6%的病例中PCR和培养结果一致:均为阳性,占40.5%(1018/2511),均为阴性,占34.1%(856/2511)。25.4%的病例PCR和培养结果不一致:22.2%(557/2511)PCR呈阳性而培养呈阴性,3.2%(80/2511)PCR呈阴性而培养呈阳性。共报告了861例多种微生物感染,其中PCR报告834例(96.9%),培养报告168例(19.5%)。268名患者(10.7%)报告了多种微生物感染,其中培养结果呈阴性。培养完全遗漏了五种具有临床意义的细菌病原体。遗漏的细菌检测可能会导致对细菌抗性和敏感性考虑不充分,进而导致治疗失败。PCR更高的敏感性和特异性可能为更有效地治疗尿路感染提供机会。
研究参与者是在泌尿外科诊所出现尿路感染症状的患者。来自七个州37个泌尿科办公室的75名医生对患者进行了评估。2018年7月26日至2019年2月27日期间,共有2511名符合纳入标准的连续患者入组。没有对男性和女性受试者的性别参与施加预先确定的配额或比例。
纳入标准:患有急性膀胱炎、复杂性尿路感染、持续性尿路感染或复发性尿路感染、或前列腺炎、肾盂肾炎和/或间质性膀胱炎症状的患者;任何年龄的间质性膀胱炎的症状;60岁以上出现其他病症的症状;样品体积足以进行尿培养和指南4.0;患者知情同意;记录样品的采集和稳定时间。
排除标准:之前参与过本研究;在登记时因尿路感染(UTI)以外的任何原因服用抗生素;长期(>10天)留置导尿管;自行导尿;尿流改道患者;没有书面知情同意书和/或HIPAA授权书。
通过自行清洁排尿或通过导尿管插入术从患者处获取尿液样品。收集样品并运送至Pathnostics(加利福尼亚州欧文市)进行培养测试。对于培养,将尿液涡旋,并使用无菌塑料环(1μL)接种血琼脂板。还使用无菌塑料环(1μL)来接种粘菌素和萘啶酸琼脂/麦康凯琼脂(CNA/MAC)板,一个在板的CNA侧充满尿液的环和另一个在MAC侧充满尿液的环。将所有板在35℃、5%CO
根据标准操作程序,使用VITEK 2Compact System(北卡罗来纳州达勒姆市BioMerieux)确认病原体鉴定。简而言之,使用无菌拭子将形态相似的菌落从阳性血琼脂板转移到含有3.0mL无菌盐水的准备好的聚苯乙烯试管中。调整样品的密度(相当于McFarland No.0.50至0.63)。将样品管和适当的鉴定卡放入盒中并插入VITEK 2仪器。细菌的身份用于确定革兰氏状态,革兰氏阴性菌使用GN卡,革兰氏阳性菌使用GP卡。酵母菌使用的是YST卡。从VITEK 2仪器读取病原体鉴定结果。
使用KingFisher/MagMAX自动DNA提取仪和MagMAX DNA多样品Ultra试剂盒(ThermoFisher,卡尔斯巴德,加利福尼亚州)从尿液样品中提取DNA。简而言之,将400μL尿液转移至96孔深孔板的孔中,密封,离心浓缩样品;除去上清液。添加酶裂解混合物(220μL/孔)并在65℃下孵育20分钟。添加蛋白酶K混合物(50μL/孔)并在65℃下孵育30分钟。添加裂解缓冲液(125μL/孔)和DNA结合珠混合物(40μL/孔),并将样品振荡至少5分钟。将96孔板装入KingFisher/MagMAX自动DNA提取仪中,按照标准操作程序进行操作。
DNA样品使用Pathnostics Guidance
根据情况,通过双样品t检验或Fisher精确检验比较男性和女性患者的人口统计学和症状。使用McNemar检验比较特定细菌检测阳性的样本比例的PCR和培养结果。在2511名参与者中,1360名(54%)为女性,1151名(46%)为男性,年龄在24岁至100岁之间。女性出现排尿困难、尿失禁、尿液混浊或尿液气味重、低烧以及腹部、胁腹、腰背或骨盆疼痛的频率明显高于男性。女性的疼痛比男性更严重。下尿路症状中,女性尿频和尿急明显更常见,而男性夜尿和微血尿更常见。女性比男性明显更多地出现这些症状或体征:精神状态的急剧变化;跌倒或笨拙的情况增加;疲劳;感觉不适;以及日常生活活动能力下降。女性尿液中白细胞数量和亚硝酸盐浓度的增加比男性尿液中的白细胞数量和亚硝酸盐浓度的增加更多,女性使用抗生素治疗UTI的频率明显高于男性。
表2(如下)说明了传统尿培养与PCR在患有UTI症状的患者中的一致(或不一致)百分比。在2511个案例中,有1874个案例(74.6%)两次测试的结果一致;1018/2511(40.5%)例培养和PCR均为阳性,856/2511(34.1%)例培养和PCR均为阴性。557/2511(22.2%)例PCR呈阳性,培养呈阴性;80/2511(3.2%)例PCR呈阴性,培养呈阳性。培养物未检测到PCR检测到的6种细菌:沙氏放线菌(Actinotignum schaalii)、广栖别样斯卡多维亚菌(Alloscardovia omnicolens)、里氏棒状杆菌(Corynebacterium riegelii)、生殖支原体(Mycoplasma genitalium)、人型支原体(Mycoplasma hominis)和解脲支原体(Ureaplasmaurealyticum)。这六种细菌占单一微生物感染的9.0%(67/741),但在多种微生物感染中也检测到了60.7%(523/861)。
表2-尿路感染症状患者的PCR和传统尿培养的一致性
PCR没有检测到通过培养检测到的3种细菌(图6)。PCR没有检测到这些细菌并不是PCR的失败,因为PCR检测板不包含针对它们的探针。
本前瞻性研究中使用的多重组合测试了24种细菌和两个细菌群。PCR检测出24种不同的细菌,培养检测出21种不同的细菌。培养未能检测到六种细菌会产生与PCR产生的细菌谱截然不同的细菌谱(见表3)。
表3最常检测到的细菌的排名
培养和PCR排序之间的唯一相似之处在于,大肠杆菌是两者中最常检测到的细菌。然而,大肠杆菌占培养检测到的细菌的42.1%,而大肠杆菌仅占PCR检测到的细菌的18%。培养(532名患者)和PCR(570名患者)之间检测到大肠杆菌的患者数量没有太大差异,尽管一致性存在统计学差异(麦克尼马尔检验p值=0.0002)。然而,由于PCR检测到的细菌种类较多,且每种细菌的数量较多,因此大肠杆菌所占比例较小。例如,肺炎克雷伯菌是培养物中第三大最常检测到的细菌(11.1%),但它是通过PCR检测到的第七大最常检测到的细菌(4.6%)。PCR检测到肺炎克雷伯菌的患者数量(145)高于培养检测的患者数量(140),但对于PCR和培养,该物种的一致性没有统计学差异(麦克尼马尔检验p值=0.50)。
在这项研究中,发现培养物检测和鉴定多种微生物感染的能力有限(见下表4)。
表4多种微生物感染的检出率
PCR和培养相结合,检测出861例多种微生物感染。这占患者总数的34.3%(861/2511),占阳性结果总数的52%(861/1655)。PCR检出861例中的834例(96.9%),培养检出861例中的168例(19.5%);861例中的141例(16.4%)经PCR和培养均检测出多种微生物。多种微生物感染占PCR阳性的53.0%(534/1575),但仅占培养阳性的15.3%(168/1098)。
在本研究中,PCR检测到的六种细菌在培养中未检测到。其中3种细菌(沙氏放线菌(Actinotignum schaalii)、广栖别样斯卡多维亚菌(Alloscardovia omnicolens)和里氏棒状杆菌(Corynebacterium riegelii))位列10种最常检测到的细菌之列,合计占所有细菌检测量的20.6%。更重要的是,沙氏放线菌(Actinotignum schaalii)是比任何其他细菌更常参与多种微生物感染的细菌,并且涉及所有多种微生物感染的53.0%(442/834)(图7)。
这项对2500多名有UTI症状的患者进行的前瞻性研究发现,多重PCR在62.7%的患者中呈阳性,而传统尿培养的阳性率为43.7%。22%的PCR阳性患者尿培养呈阴性,PCR检测到的多种微生物感染比尿培养多五倍(834例对168例)。因此,这项研究的结果提供了证据,表明PCR比传统培养对细菌性UTI的诊断具有更高的检测灵敏度和鉴定特异性。
PCR相对于传统培养的优越性在检测多种微生物感染方面尤其明显:在总计861例病例中,PCR检测到834例,而培养检测到168例。培养在检测和解析多种微生物感染中病原体的能力方面存在本质上的限制。尽管培养的局限性有多种原因,但一个重要因素是某些细菌无法培养。在本研究中,PCR检测到的六种细菌在培养中未检测到。其中3种细菌(沙氏放线菌(Actinotignum schaalii)、广栖别样斯卡多维亚菌(Alloscardovia omnicolens)和里氏棒状杆菌(Corynebacterium riegelii))位列10种最常检测到的细菌之列,合计占所有细菌检测的20.6%。更重要的是,沙氏放线菌(Actinotignum schaalii)是最常参与多种微生物感染的细菌,占所有多种微生物感染的53.0%(442/834)。
有充足的证据支持PCR检测到的所有六种细菌的临床相关性,但尿培养则不然。所有六种细菌的检测水平均远高于10
如果未能检测和鉴定这些细菌,则可能会因未知的抗生素抗性而导致治疗失败。例如,解脲支原体(Ureaplasma urealyticum)的细胞壁中没有肽聚糖层,并且不合成叶酸,这意味着它对大多数可用的抗生素具有抗性。几篇论文报道了临床抗生素抗性(患者的抗生素反应)与根据实验室测试结果预测的抗性不同。这种差异可能因多种原因而发生,但使用分离的细菌培养物进行敏感性试验意味着无法检测到细菌会导致敏感性试验失败。
作为这个问题的实施例,培养检测到肺炎克雷伯菌,但不能检测到沙氏放线菌;在这项研究中,尽管这2种细菌具有非常不同的抗性和敏感性特征,但在培养和PCR中,这2种细菌的出现率均排名第二;在某些方面,它们的抗性/敏感性概况是彼此的镜像,检测肺炎克雷伯菌而不检测沙利氏菌可能导致选择不合适的抗生素。例如,培养检测到肺炎克雷伯菌,但未检测到沙氏放线菌。由于肺炎克雷伯菌和沙氏放线菌在抗生素抗性和敏感性方面没有共同点,因此仅根据肺炎克雷伯菌的检测来选择抗生素治疗方案将导致使用对沙氏放线菌具有抗性的抗生素进行治疗。
未能适当治疗尿路感染会增加出现其他医疗问题的风险,其中一些问题可能比复发性尿路感染更严重。尽管多种感染与急性缺血性中风相关,但尿路感染的风险最大,优势比为5.32。本研究中培养遗漏但通过PCR检测到的七种细菌与败血症和菌血症、心内膜炎、福尼尔坏疽和腹腔脓肿的风险增加有关。
本研究中多种微生物感染患者占总人数的比例为34.3%。然而,另一种观点是,在细菌性尿路感染检测呈阳性的患者中,多种微生物感染的数量(52%,861/1655)多于单一微生物感染的数量(48%,794/1655)。
所有细菌对发病机制的贡献并不相同。对于多种微生物感染尤其如此:某些细菌可能比其他细菌更具致病性。
这项对2500多名有UTI症状的患者进行的前瞻性研究结果表明,PCR比传统尿培养具有更高的检测灵敏度和鉴定特异性,特别是在检测多种微生物感染方面。在尿路感染评估中使用PCR可能会改善病原菌的检测以及对抗生素抗性和敏感性的考虑。这些优势反过来可能会导致更有效的初始治疗和预防复发性尿路感染。
实施例2细菌聚生体导致多种微生物尿路感染的发病机制
尿液不是无菌的,并且具有独特的微生物组,称为尿微生物组。尿液是无菌的观点源于标准尿液培养(SUC)的局限性,该培养方法是为了检测常见病原体(例如尿路致病性大肠杆菌)而开发的。然而,独立于SUC的方法,如聚合酶链式反应(PCR),已证明即使在健康个体中,培养也无法检测尿液中的大多数细菌。此外,扩大的定量尿液培养方法提高了细菌的生长条件,表明通过分子方法独特检测到的生物体是可行的。检测和鉴定健康和疾病状态下尿微生物组中微生物的能力使得能够对生态失调作为尿路感染(UTI)病因的潜在机制进行更详细的评估。
生态失调可以有3种形式,所有这些都涉及微生物组中细菌平衡的改变。一种类型的生态失调被称为功能获得性生态失调,其中病原体过度生长会导致疾病。第二种类型称为功能丧失,即原本具有保护健康功能的细菌消失了。功能丧失失调通常与抗生素的使用有关,导致有益生物和致病生物的丧失。第三种生态失调是功能获得和丧失的混合体。
该分析研究了可能导致多种微生物尿路感染发病机制的获得性功能失调模式。细菌聚生体和生物膜的形成可导致获得性功能失调。聚生体是非随机的多种微生物群落,它们协同相互作用,为群落成员提供比浮游、自由漂浮的微生物更好的生长和生存优势。与生物膜一样,聚生体是自组织结构,并且聚生体可以附着在表面上成为生物膜。在单个生物膜内可能会发现多个聚生体,由充满液体的间隙空间隔开。然而,生物膜可以是单一微生物的,而聚生体本质上是多种微生物的。
许多(如果不是大多数)感染都是多种微生物感染。然而,并非所有多种微生物感染都会形成聚生体或生物膜。那些这样做的可能更具毒性并且对治疗具有抗性力。更好地了解尿路感染中构成聚生体的细菌之间的关系可能有助于改进诊断和干预策略。本研究试图通过对在多个繁忙的泌尿外科诊所就诊的有尿路感染症状的患者的前瞻性数据进行回顾性分析来表征尿路感染中的细菌聚生体。其次,本研究试图确定与已鉴定的细菌聚生体相关的可能症状模式。
如本文所使用的,聚生体可以被定义为在有症状的患者中一起发现的细菌群落的非随机模式。
本研究是对一项关于尿路感染细菌检出率的前瞻性研究收集的数据的回顾性分析。研究参与者包括2018年7月至2019年2月期间在美国37个不同地理位置的任一泌尿外科诊所就诊的2493患者。所有患者均按照Western IRB批准的表格(20181661)提供了书面知情同意书。所有受试者均符合以下纳入和排除标准。纳入标准包括:≥60岁;急性膀胱炎、复杂性尿路感染、持续性尿路感染、复发性尿路感染、前列腺炎、肾盂肾炎或间质性膀胱炎的症状;样品体积足以进行尿液培养和多重聚合酶链反应(M-PCR);记录了收集样品并在灰顶管中用硼酸稳定的时间。排除标准包括入组时因尿路感染以外的任何原因服用抗生素、长期(>10天)留置导尿管、自行导尿和尿流改道。医生记录每次临床就诊的ICD-10代码,以及患者出现的UTI症状和尿液分析试纸结果。根据患者的能力,收集导尿和清洁排尿的尿液样品。
使用KingFisher/MagMAX自动DNA提取仪和MagMAX DNA多样品Ultra试剂盒(ThermoFisher,卡尔斯巴德,加利福尼亚州)从尿液样品中提取DNA。简而言之,将400μL尿液转移至96孔深孔板的孔中,密封,离心浓缩样品;除去上清液。添加酶裂解混合物(220μL/孔)并在65℃下孵育20分钟。添加蛋白酶K混合物(50μL/孔)并在65℃下孵育30分钟。添加裂解缓冲液(125μL/孔)和DNA结合珠混合物(40μL/孔),并将样品振荡至少5分钟。将96孔板装入KingFisher/MagMAX自动DNA提取仪中,按照标准操作程序进行操作。
DNA样品使用Pathnostics Guidance
细菌:鲍曼不动杆菌(Acinetobacter baumannii)、沙氏放线菌(Actinotignumschaalii)、尿气球菌(Aerococcus urinae)、广栖别样斯卡多维亚菌(Alloscardoviaomnicolens)、弗氏柠檬酸杆菌(Citrobacter freundii)、艰难梭菌(Clostridiumdifficile)、克氏柠檬酸杆菌(Citrobacter koseri)、里氏棒状杆菌(Corynebacteriumriegelii)、产气肠杆菌(Enterobacter aerogenes)、粪肠球菌(Enterococcus faecalis)、大肠杆菌(Escherichia coli)、产酸克雷伯菌(Klebsiella oxytoca)、肺炎克雷伯菌(Klebsiella pneumoniae)、摩氏根氏菌(Morganella morganii)、结核分枝杆菌(Mycobacterium tuberculosis)、生殖支原体(Mycoplasma genitalium)、人型支原体(Mycoplasma hominis)、成团泛菌(Pantoea agglomerans)、奇异变形杆菌(Proteusmirabilis)、斯氏普罗威登斯菌(Providencia stuartii)、铜绿假单胞菌(Pseudomonasaeruginosa)、粘质沙雷氏菌(Serratia marcescens)、金黄色葡萄球菌(Staphylococcusaureus)、无乳链球菌(Streptococcus agalactiae)和解脲支原体(Ureaplasmaurealyticum)。
细菌群:凝固酶阴性葡萄球菌(coagulase-negative Staphylococcus)(表皮葡萄球菌(Staphylococcus epidermidis)、溶血葡萄球菌(Staphylococcus haemolyticus)、路邓葡萄球菌(Staphylococcus lugdunensis)、腐生葡萄球菌(Staphylococcussaprophyticus));草绿色链球菌(Viridans Group Streptococcus)、(咽峡炎链球菌(Streptococcus anginosus)、口腔链球菌(Streptococcus oralis)、巴氏链球菌(Streptococcus pasteuranus))。
为了区分细菌的聚生体和随机组合,将10作为发生频率的截止值,本发明不限于截止值为10。
提供了患者人口统计数据(年龄和性别)、ICD-10编码的诊断组、样本收集方法、症状总数的频率以及研究样本的12种症状中的每一种。计算24种细菌中每一种的单一微生物感染和多种微生物感染的总体患病率和个体患病率。为了区分细菌的聚生体和随机组合,将10名患者作为发生频率的截止值,本发明不限于截止值为10。
下面的假设示例解释了两种细菌之间关联性的测量。
两种细菌的列联实施例如表5所示。
表5
每对细菌的Phi系数(或均方列联系数)计算如下
其中a、b、c和d已在上面进行了解释。Phi系数的解释与Pearson相关系数类似,范围从-1(完全负相关)到1(完全正相关)。
使用网络图直观地描述聚生体中最常见的细菌之间的关系,并说明最常检测到的聚生体的频率以及患者中出现的症状的相关计数。最后,对聚生体中不同数量细菌的组间平均症状数进行汇总统计和方差分析比较。使用SAS 9.4版(北卡罗来纳州卡里市SASInstitute,Inc.)和R 3.5.3进行分析。
共有2493名连续患者入组,全部年龄在60岁及以上。在本次分析的2493名参与者中,该研究组患者的平均年龄为73.4岁,其中53.9%为女性。自然排尿是最常见的样品采集方法(2384/2493,95.6%)。
对来自社区泌尿科诊所的2493名患者提供的样品进行了24种细菌的检测。M-PCR检测到该患者群体中的所有24种细菌。图8显示了68.6%(1710/2493)细菌阳性患者中检测到的细菌分布。
在研究人群中,31.4%(783/2493)的患者细菌检测呈阴性,68.6%(1710/2493)的患者细菌检测呈阳性;27.4%(683/2493)表现出单一微生物尿路感染。沙氏放线菌(ASchaalia)(27.4%,684/2493)、尿气球菌(A urinae)(26.7%,666/2493)和大肠杆菌(Ecoli)(24.3%,605/2493)是本研究中最常检测到的细菌。这3种细菌也是多种微生物感染中最常检测到的细菌[沙氏放线菌(A Schaalia):61.1%(627/1027)、尿气球菌(Aurinae):57.5%(591/1027)和大肠杆菌(E coli):40.2%(413/1027)]和聚生体[沙氏放线菌(A Schaalia)-73.0%(316/433)、尿气球菌(A urinae)-62.8%(272/433)和大肠杆菌(Ecoli)-40.6%(175/433)]。相比之下,单一微生物感染中最常检测到的细菌是大肠杆菌(Ecoli)(7.7%,192/2493)、凝固酶阴性葡萄球菌(coagulase-negative Staphylococcus)(4.1%,102/2493)、尿气球菌(A urinae)(3.0%,75/2493)、沙氏放线菌(A Schaalia)(2.3%,57/2493)和草绿色链球菌(Viridans Group Streptococcus)(2.0%,51/2493)。
41.2%(1027/2493)的全部患者中发现多种微生物感染,60.1%(1027/1710)的细菌检测呈阳性的患者中发现多种微生物感染。超过90%的里氏棒状杆菌(C riegelli)(95.4%)、广栖别样斯卡多维亚菌(A omnicolens)(94.4%)和沙氏放线菌(A Schaalia)(91.7%)在多种微生物感染中发现。除了在多种微生物感染中未发现的生殖支原体外,铜绿假单胞菌(53.8%)和金黄色葡萄球菌(51.6%)在多种微生物感染中检出的可能性最低。
多种微生物尿路感染中的细菌倾向于聚集在定义为聚生体的群体中。表6列出了在10次检测的定义截止频率下检测到的定义的聚生体。图9显示了聚生体中最常见的细菌之间关系的网络图。17.4%(433/2493)的所有患者和42.2%(433/1027)的多种微生物感染中发现了聚生体。八种细菌形成了18个不同的聚生体,其数量从2到4种生物体不等。其中11个聚生体由2种生物体组成,6个聚生体由3种生物体组成,1个聚生体由4种生物体组成。
表6单一微生物感染、聚生体和临床发现。
/>
临床结果是尿液分析结果和尿路感染症状的结合。
沙氏放线菌(ASchaalia)和尿气球菌(A urinae)构成了最常检测到的细菌和聚生体中最常见的细菌组合,在9.7%(242/2493)的所有患者中、38.9%(7/18)的聚生体类型中以及在55.9%(242/433)的聚生体实例。相比之下,一些细菌,如铜绿假单胞菌和金黄色葡萄球菌,在多种微生物感染中被检测到,但在聚生体中未发现。其他细菌,如里氏棒状杆菌(C riegelli)和粪肠球菌(Enterococcus faecalis),经常出现在多种微生物感染中,但很少形成聚生体。里氏棒状杆菌(C riegelli)的总体患病率为4.4%(109/2493);其中95.4%(104/109)存在于多种微生物感染中,但只有10.1%(11/109)存在于聚生体中。同样,粪肠球菌(Enterococcus faecalis)的总体患病率为9.0%(224/2493);其中81.7%(183/224)发生在多种微生物感染中,而只有4.5%(10/224)发生在聚生体中。
单一微生物感染、多种微生物感染和聚生体中革兰氏阳性菌和革兰氏阴性菌的检测也存在鲜明对比;参见图10革兰氏阴性菌占单一微生物感染中检测到的细菌的55.1%(376/683),占多种微生物感染中检测到的细菌的76.4%(2369/3100)。然而,革兰氏阳性菌在聚生体中占主导地位:在聚生体中检测到的细菌中有80.3%(813/1013)是革兰氏阳性菌。41.1%(422/1027)的多种微生物感染仅包含革兰氏阳性菌,而53.8%(233/433)的聚生体仅包含革兰氏阳性菌。在多种微生物感染中,56.7%(582/1027)同时包括革兰氏阳性菌和革兰氏阴性菌;在聚生体中,46.2%(200/433)包含革兰氏阳性和革兰氏阴性细菌。仅由革兰氏阴性菌组成的多种微生物感染很少见,占感染的2.2%(23/1027);不存在仅由革兰氏阴性菌组成的聚生体。在8.7%(89/1027)的多种微生物感染中检测到超过一种革兰氏阴性细菌,但没有在任何定义的聚生体中检测到。相比之下,在36.9%(379/1027)的多种微生物感染和77.6%(336/433)的定义的聚生体中检测到一种以上的革兰氏阳性细菌。
在数据分析过程中,革兰氏染色分类和症状表现之间的关系也变得明显。在18个定义的聚生体中,有10个与三种或更多临床发现的临床表现相关。在这10个具有3种或更多症状的聚生体中,8个包括革兰氏阴性细菌;6个包括大肠杆菌,2个包括肺炎克雷伯菌。另外8个聚生体与临床表现期间报告的不超过2个临床发现相关;其中只有一种包含革兰氏阴性细菌,即大肠杆菌。含有革兰氏阴性菌并与3种或更多症状相关的8个聚生体,在所有患者中占8.4%(209/2493),在聚生体患者中占48.3%(209/433)。8个不含有革兰氏阴性菌且与不超过2种症状相关的聚生体,出现在9.0%(224/2493)的所有患者和51.7%(224/433)的聚生体患者中。
本研究旨在确定来自美国37个不同泌尿科诊所的出现尿路感染症状的患者中是否存在细菌聚生体。使用M-PCR,在34%的患者中检测到多种微生物尿路感染,这与之前的研究一致。此外,大多数细菌检测呈阳性的患者(60.1%)均检测到多种微生物感染,这也与之前的报道一致。在17.4%的所有患者和42.2%的多种微生物感染中检测到定义的聚生体。
在患者群体中,在多种微生物感染中检测到23种不同的细菌,但在定义的聚生体中仅检测到8种细菌。其中,仅四种细菌(沙氏放线菌(A Schaalia)、尿气球菌(A urinae)、大肠杆菌(E coli)和草绿色链球菌(Viridans Group Streptococcus))就占了聚生体中检测到的细菌的89.6%。这四种细菌中的3种((沙氏放线菌(A Schaalia)、尿气球菌(Aurinae)和草绿色链球菌(Viridans Group Streptococcus))是革兰氏阳性菌,占菌群中检测到的细菌的75.3%。此外,不存在含有超过一种革兰氏阴性细菌的聚生体。
本研究观察到细菌平衡的显着转变,从单一微生物和多种微生物感染中以革兰氏阴性菌为主转变为聚生体中以革兰氏阳性菌为主。单一微生物感染(55.1%)和多种微生物感染(76.4%)中的大多数细菌为革兰氏阴性。然而,聚生体由80.3%的革兰氏阳性菌组成。沙氏放线菌(A Schaalia)是一种革兰氏阳性细菌,在77.6%的聚生体中检测到,但仅在2.3%的单一微生物感染中检测到,在49.0%的非聚生体多种微生物感染中检测到。同样,在67.7%的聚生体中检测到另一种革兰氏阳性细菌尿气球菌(Aurinae),但仅在3.0%的单一微生物感染中检测到,在50.2%的非聚生体多种微生物感染中检测到。聚生体和非聚生体多种微生物感染中最常见的细菌组合是沙氏放线菌(A Schaalia)和尿气球菌(Aurinae),出现在55.9%的聚生体感染中,但仅在33.0%的非聚生体多种微生物感染中出现。聚生体中细菌的平衡不仅转向革兰氏阳性菌,而且转向特定的革兰氏阳性菌。
聚生体中仅检测到两种革兰氏阴性菌,即大肠杆菌和肺炎克雷伯菌,占聚生体的46.2%。在革兰氏阳性菌中观察到的转变在革兰氏阴性菌中没有观察到。大肠杆菌出现在40.6%的聚生体多种微生物感染和39.9%的非聚生体多种微生物感染中。在5.5%的聚生体和15.0%的非聚生体多种微生物感染中检测到肺炎克雷伯菌。此外,77.6%的聚生体包含超过一种革兰氏阳性细菌,但没有一个聚生体含有超过一种革兰氏阴性细菌。相比之下,68.2%的非聚生体多种微生物感染包括一种以上革兰氏阴性细菌。
聚生体中细菌平衡的这种转变可以解释为表明获得性功能失调。革兰氏阳性菌显着过度生长,特别是沙氏放线菌(ASchaalia)和尿气球菌(A urinae)。与此同时,革兰氏阴性菌的检测也发生了转变:在多种微生物感染中检测到了13种不同的革兰氏阴性菌,但在聚生体中只检测到了2种。
尽管革兰氏阴性菌占聚生体中的少数,但它们似乎是症状表现的重要因素:含有革兰氏阴性菌聚生体的患者比不含革兰氏阴性菌聚生体的患者在临床上出现更多症状。18种已定义的聚生体中,有10种与大量临床发现相关,而这10种聚生体中的8种含有革兰氏阴性细菌。这8个样品中有6个含有大肠杆菌,2个含有肺炎克雷伯菌。在与较少临床发现相关的8个聚生体中,只有一个含有革兰氏阴性细菌,即大肠杆菌。
微生物形成聚生体和生物膜,因为这样做可以促进生长和生存优势。这四种细菌形成聚生体的一个可能因素是它们之间的关系并不密切。先前的结果表明,属水平上的关系抑制了聚生体的形成。众所周知,聚生体和生物膜内的遗传多样性可以提高群落的整体适应性,从而产生更具弹性的群落。群落结构,称为尿型,已在正常人类尿微生物组中被鉴定。每种正常尿型均以单一属为主,最常见的是乳杆菌(Lactobacillus)、链球菌(Streptococcus)、加德纳菌(Gardnerella)和大肠杆菌(E coli)。以沙氏放线菌(ASchaalia)或尿气球菌(A urinae)为主的尿型尚未见报道。沙氏放线菌(A Schaalia)和尿气球菌(Aurinae)在UTI聚生体中占主导地位意味着生态失调和致病性尿型的形成。
在18个定义的聚生体中的14个中出现了沙氏放线菌(A Schaalia)或尿气球菌(Aurinae),这可能表明它们是致病聚生体形成的关键细菌。关键细菌通常有能力引发环境中关键能源底物的降解,从而向聚生体的其他成员释放能量。一些人认为,从聚生体中战略性地去除关键细菌会导致聚生体崩溃,但证据表明情况并非如此。聚生体内部的功能冗余可能会防止它们因移除个别物种而崩溃;细菌聚生体中复杂的代谢网络可能提供这种类型的冗余。此外,功能冗余可能涉及其他类型的网络,包括宏基因组、抗生素抗性和底物修饰。
这些发现提供了证据表明,聚生体的形成构成了尿微生物组的菌群失调。观察到的生态失调类型是功能获得,包括特定革兰氏阳性菌沙氏放线菌(A Schaalia)和尿气球菌(A urinae)的过度生长。一般来说,革兰氏阳性细菌非常挑剔,不适合在标准培养物中生长。越来越多的证据表明,SUC由于敏感性差而不够充分,这导致人们对分子方法诊断UTI的临床价值达成了越来越多的共识。最近的证据表明,沙氏放线菌(A Schaalia)和尿气球菌(A urinae)不是通过培养检测到的,而是通过PCR检测到的。PCR等分子方法作为临床诊断工具的出现对于增进对多种微生物尿路感染的理解至关重要,这种尿路感染往往更具有抗生素抗性,并且更常见地导致尿脓毒症和死亡率增加。
结果表明,聚生体中细菌的特定组合可能比其他细菌更具致病性和毒性。
实施例3通过混合抗生素敏感性测试(P-AST)检测多种微生物尿液样品中的细菌相互作用
诊断尿路感染(UTI)的护理标准是标准尿培养(SUC)以及抗菌药物敏感性测试,自20世纪50年代初以来一直用于指导治疗。所述方法基于“以大肠杆菌(E.coli)为中心”的观点,认为尿路感染是由一种或两种病原体引起的。然而,最近的研究结果表明,SUC常常会漏掉绝大多数尿路病原体,而这些感染中高达39%的感染本质上是多种微生物。与此同时,抗生素抗性在单一微生物感染中已得到充分研究,但在多种微生物感染中的特征却较少。然而,细菌之间的相互作用可以改变对抗生素的反应。
目前,抗生素敏感性测试(AST)忽略了细菌相互作用。在AST中,每种细菌都单独针对抗生素进行测试,无法评估细菌之间的相互作用。忽视细菌相互作用可能导致潜在的治疗失败或阻止有效抗生素的使用。这2种情况都会产生严重的临床后果。
本发明讨论了称为混合抗生素敏感性测试(P-AST)的方法,所述方法涉及在抗生素存在下同时培养所有检测到的细菌,然后测量敏感性。因此,P-AST考虑了共生细菌物种之间的相互作用。尿液样品取自37个泌尿科诊所出现类似尿路感染症状的患者。首先,估计了样品中18种抗生素抗性与样品中细菌种类数量增加的关系。我们发现多种微生物样品中的抗菌药物敏感性模式与单一微生物样品中观察到的不同。由于护理标准依赖于对单一微生物感染的抗生素敏感性的评估,这些发现表明P-AST可以作为抗生素敏感性的更准确的预测因子。
这项研究结合了两项关于老年患者抗生素抗性模式研究的数据,这些患者的症状与尿路感染一致。回顾性数据和患者信息(Western IRB编号20171870)是从单一地点(综合泌尿科,罗亚尔奥克,密歇根州)获得的,涉及2018年3月至7月期间就诊的613名患者。2018年7月至2019年2月期间,在美国37家地理位置不同的诊所中,获得了2511名患者的前瞻性数据和患者信息(Western IRB编号20181661)。所有受试者均符合以下纳入和排除标准。纳入标准包括:急性膀胱炎症状、复杂性尿路感染、持续性尿路感染、复发性尿路感染、前列腺炎、肾盂肾炎、间质性膀胱炎(任何年龄)、≥60岁的其他病症症状、样品量足以进行尿培养和多重检测聚合酶链式反应(M-PCR)结合抗生素敏感性测试(P-AST)、患者知情同意、记录样品收集时间并在灰顶管中用硼酸稳定。排除标准包括先前参与本研究、入组时因尿路感染以外的任何原因服用抗生素、长期(>10天)留置导尿管、自行导尿和尿流改道。3124名患者中的1352名患者(43.3%)可获得抗生素敏感性数据。
使用KingFisher/MagMAX
使用
通过将1mL患者尿液样品等分到1.7mL微量离心管中进行抗生素敏感性混合测试(P-AST)。离心后,吸出并丢弃上清液,在微量离心管中留下大约500μL的患者样品。然后将1mL的Mueller Hinton生长培养基等分到微量离心管中的患者样品中,并且将管在非CO
使用逻辑回归来比较单一微生物和多种微生物感染的抗性率(resistancerate)。具体来说,数据拟合了18种不同的逻辑回归模型:响应变量是样品是否对特定抗生素具有抗性的指标,预测变量是感染是单一微生物还是多种微生物的指标。如果检测到单一细菌种类高于10000个细胞/mL阈值,则样品被归类为单一微生物;如果检测到2种或多种不同的细菌种类高于该阈值,则它们被归类为多种微生物。还运行了类似的逻辑回归模型,使用不同细菌种类的数量作为预测变量。
使用逻辑回归模型研究细菌物种对之间的相互作用,以预测特定细菌物种存在时的抗性。在此模型中,响应是抗性指示变量,预测变量是16个指标以下细菌物种或菌群存在的指标,这些细菌物种或菌群在至少30个样品中检测呈阳性;这些是沙氏放线菌(ASchaalia)、尿气球菌(A urinae)、广栖别样斯卡多维亚菌(A.omnicolens)、CoNS、里氏棒状杆菌(C.riegelii)、粪肠球菌(E.faecalis)、大肠杆菌(E.coli)、产酸克雷伯菌(K.oxytoca)、肺炎克雷伯菌(K.pneumoniae)、摩氏根氏菌(M.morganii)、奇异变形杆菌(Pmirabilis)、铜绿假单胞菌(P aeruginosa)、金黄色葡萄球菌(S.aureus)、无乳链球菌(S.agalactiae)、解脲支原体(U.urealyticum)和VGS。使用α=0.10的进入显着性水平和α=0.05的退出显着性水平,对具有所有主效应和所有成对相互作用的模型进行向后逐步模型选择,以获得最佳拟合模型。该模型用于预测存在特定细菌物种或存在一对特定物种时的抗性率。
使用上述逻辑回归模型,将一对物种的抗性率与单独每个物种的抗性率进行比较。应用两种不同的原理来计算对一对不相互作用的物种的预期抗性率:(a)最高单药原则(HSAP)(药物相互作用的常用模型)和(b)联合原理(UP)(也用于模拟药物相互作用)。
使用HSAP,如果一对物种的抗性率与两个物种各自的最高抗性率在统计上不同,则认为该对物种具有相互作用。该模型基于这样的想法:只有当更具抗性的物种存活下来时,包含两个物种的细胞池才能在使用特定抗生素时存活下来。当抗生素被应用到细胞池中时,它可能会杀死物种A,但如果物种B存活下来,则该细胞池被称为抗性。
UP假设一对细菌(物种A和物种B)由物种A的一个遗传变体和物种B的一个遗传变体组成,并且如果物种A有抗性或物种B有抗性,则该细胞池具有抗性。如果物种A以概率P(A)抗性,物种B以概率P(E)抗性,则细胞池抗性概率为:
P(细胞池抗性)=P(A)+P(B)—P(A)P(B)
这假设两个物种不相互作用,因此独立行动。
使用1352名具有抗生素抗性结果的患者的自举样品对相互作用进行统计测试;每个患者都是随机选择的并进行替换。具有上述选择的最佳拟合模型中的项的逻辑回归适合每个自举样品。使用适合引导样品的模型(假设HSAP或UP),将当存在一对物种时的预测抗性与单独每个物种的预测抗性进行比较。生成并分析了5000个自举样品。如果97.5%或更多的自举样品表现出比预期更高的混合抗性,则认为该相互作用与抗性增加存在统计上显着的相互作用。如果97.5%或更多的自举样品表现出混合抗性低于预期,则认为相互作用具有统计显着性与抗性力下降的相互作用。
该研究最初纳入了来自两项研究和来自美国37个不同地理位置的泌尿外科诊所的总计3124名患者,这些患者的症状与UTI一致。其中43.3%(1352)的患者可获得P-AST数据。人口统计数据如下:平均年龄为75岁,66%(887/1352)为女性,而34%(465/1352)为男性。
通过M-PCR,38.9%(1214/3124)的样品细菌呈阴性,而61.1%(1910/3124)呈阳性。这1910份阳性样品中的1352份(70.7%)可获得P-AST数据。在这1352个样品中,43.9%(594/1352)为单一微生物,而56.1%(758/1352)为多种微生物。
558个阳性样品缺乏抗菌药物敏感性数据,原因如下:(1)没有检测到≥10000个细胞/mL(与菌落形成单位/mL相关)的物种,因此没有对任何物种进行抗生素测试;(2)PCR检测的物种要求严格(即需要特定的生长条件、极其严格的生长条件或极长的时间才能进行药敏试验);(3)先前使用抗菌药物导致细菌在P-AST检测中无法繁殖;(4)由于M-PCR反应受到抑制而未鉴定物种(基于与阴性和阳性对照的比较)。当干扰物质阻止与目标DNA相关的PCR产物的扩增和后续检测时,就会发生M-PCR抑制。
多种微生物与单一微生物样品中抗生素抗性的优势比如图11所示,以及多种微生物样品中细菌种类数量每次增加的抗性优势比。多种微生物样品的抗性率普遍高于单一微生物样品的抗性率;统计上,18种抗生素中有10种对多种微生物样品的抗性率较高。在多种微生物样品中发现的每一个额外物种对氨必西林、阿莫西林/克拉维酸、测试的六种头孢菌素中的五种、万古霉素和四环素的抗性几率都会增加。哌拉西林/他唑巴坦的情况正好相反,复合微生物样品中每增加一个物种,就会导致抗性率降低75%(95% Cl 0.61、0.94,p=0.01)。
图12显示了特定物种相互作用对每种测试抗生素抗性增加或降低的可能性的影响。呋喃妥因和哌拉西林/他唑巴坦未检测到相互作用。尽管随着检测到的物种数量的增加,对氨必西林、阿莫西林/克拉维酸、6种不同头孢菌素类、万古霉素和四环素的抗性也随之增加,但在19个实例中,13对细菌中的11对导致对相同抗生素的敏感性降低。
使用HSAP,在44个实例中,13对细菌显示出统计上显着的相互作用,这些相互作用增加或减少了对所测试抗生素的抗性可能性。根据HSAP原理,大多数相互作用都会导致抗性概率降低。只有6/44(13.6%)的配对导致抗生素抗性可能性增加,而38/44(86.4%)的配对发生抗生素抗性可能性下降。
根据HSAP模型,增加抗生素抗性可能性的细菌组合是粪肠球菌和肺炎克雷伯菌(阿莫西林/克拉维酸,p=0.02和氨必西林/舒巴坦,p=0.03)、大肠杆菌和肺炎克雷伯菌(氨必西林)/舒巴坦,p=0.04和头孢克洛,p=0.05)、CoNS和大肠杆菌和(左氧氟沙星,p<0.001)、粪肠球菌和无乳链球菌(四环素,p<0.001)。
UP模型确定了49种具有统计学意义的相互作用,所有这些相互作用都表明对所测试的抗生素产生抗性的可能性降低。
为了说明该模型,以图形形式呈现了一个特定的对。图13显示了大肠杆菌和肺炎克雷伯菌的单一微生物阳性培养物以及大肠杆菌和肺炎克雷伯菌两者都呈阳性的多种微生物培养物对氨必西林/舒巴坦、头孢克洛和四环素的抗性的预测概率。当使用HSAP模型时,大肠杆菌和肺炎克雷伯菌的配对导致抗性概率显着增加或显着降低,具体取决于所测试的抗生素。例如,当氨必西林/舒巴坦或头孢克洛联合用于大肠杆菌和肺炎克雷伯菌时,抗性率高于单独使用大肠杆菌或肺炎克雷伯菌。相比之下,大肠杆菌和肺炎克雷伯菌的相同物种组合对四环素的抗性率介于对每个物种单独的抗性率之间。
这些结果表明,多种微生物感染(占具有敏感性结果的阳性样品的56.1%(758/1352))可以改变对抗生素的反应。他们还表明,这种改变对特定的细菌组合和测试的抗生素都很敏感。当使用HSAP和UP在18种抗生素中的16种上测试时,十三对细菌具有一种或多种显着的相互作用。在这些相互作用中,有38种导致抗性概率降低,而6种则导致抗性概率增加。大肠杆菌和肺炎克雷伯菌的组合导致对氨必西林/舒巴坦和头孢克洛的抗性概率增加,但对四环素的抗性概率降低。粪肠球菌与肺炎克雷伯菌一起导致对阿莫西林/克拉维酸和氨必西林/舒巴坦的抗性增加,但对左氧氟沙星、美罗培南和四环素的抗性降低。粪肠球菌与无乳链球菌结合后,对四环素的抗性增加,但对氨必西林和万古霉素的抗性降低。类似地,CoNS和大肠杆菌的组合产生对左氧氟沙星的抗性的可能性增加,但相同的组合产生对阿莫西林/克拉维酸、头孢曲松、四环素和甲氧苄啶/磺胺甲恶唑的抗性的可能性降低。这些差异可能归因于特定抗生素的独特作用机制。
从单个抗生素的角度观察到一组类似的对比。不同对的细菌导致对阿莫西林/克拉维酸、氨必西林/舒巴坦、头孢克洛、左氧氟沙星和四环素的抗性增加和降低。例如,大肠杆菌与肺炎克雷伯菌结合产生对头孢克洛的抗性增加,而大肠杆菌与奇异变形杆菌结合产生对头孢克洛的抗性降低。这些结果强调了在多种微生物感染中准确鉴定细菌的重要性:一种物种的鉴定差异可能会影响抗生素抗性。
观察到的对多种微生物感染中抗生素抗性的影响可能是由于细菌之间的合作和/或竞争相互作用。抗性细菌可以通过降解抗生素来协同保护敏感细菌,就像分泌的β-内酰胺酶降解β-内酰胺抗生素时发生的情况一样。抗生素抗性可以通过抗生素抗性基因的水平基因转移(HGT)由一种细菌赋予另一种细菌。细菌与宿主巨噬细胞的相互作用可以促进HGT。例如,铜绿假单胞菌存在于生物膜中时,会产生细胞外DNA,诱导中性粒细胞产生促炎细胞因子(IL-8和IL-1β)。随后的炎症可促进大肠杆菌参与的HGT。有趣的是,一些抗生素也可以促进HGT:引起细菌裂解的抗生素会释放出可以被其他细菌吸收的DNA和蛋白质。此外,一种细菌可以刺激另一种细菌的基因表达,导致外排泵上调,从而增加抗生素抗性。多种微生物生物膜内的细菌群落空间结构也可能影响抗生素的功效。
多种微生物样品中抗生素抗性降低也可能是由于细菌之间的竞争机制。据记载,铜绿假单胞菌可以产生抗生素,而肠球菌则可以产生和分泌细菌素。革兰氏阴性细菌已经发展出许多可以发挥保护功能的专门分泌系统。V型分泌系统分泌消化IgA的蛋白酶、结合IgG恒定区的表面受体以及促进定植的毒力因子/粘附素蛋白。VI型分泌系统允许革兰氏阴性细菌将抗菌毒素直接分泌到其他细菌中。同时,VI型系统通过HGT介导DNA获取;一个实施例是鲍曼不动杆菌通过VI型转移系统快速从大肠杆菌中获取抗性基因的能力。
一种类型的细菌相互作用可能会导致矛盾的结果:细菌之间的交叉喂养会降低抗生素抗性。这可以解释我们观察到的大多数特定生物组合中抗生素抗性概率降低的原因。交叉喂养是一种生物体产生促进另一种生物体生存的代谢物的过程。然而,这种相互作用会产生一系列依赖性,使整个链条仅与最易受影响的细菌一样具有抗性。Adamowicz等人研究表明,在交叉饲养菌群中,细菌种类在抗生素浓度显着低于单一培养的情况下受到抑制,这被称为“最弱环节”模型。
该研究的优势包括来自美国多个泌尿外科诊所的大量样品。此外,还使用从临床环境中收集的样品分析了相互作用。需要检查影响观察到的敏感性模式的特定相互作用。
细菌是在物种内部和物种之间相互作用的社会生物。关键相互作用在细菌物种的生长、发病机制和毒力中发挥着关键作用。由于这些关键和特定的相互作用,正确鉴定细菌物种的重要性增加。为了准确评估这些相互作用并提供临床背景,我们开发了P-AST,一种混合抗生素敏感性测试。使用这种方法,我们根据观察到的物种类型以及所施用的抗生素类别观察到抗生素敏感性的增加和降低。阐明多种微生物感染中抗生素反应发生改变的分子机制需要进一步的研究。基于这些发现,P-AST测试可能更接近患者中的多种微生物环境,并可能提供更多有关抗生素敏感性的临床重要信息。
实施例4在家庭初级保健中利用M-PCR和P-AST诊断和管理尿路感染
本发明描述了除了P-AST之外还利用M-PCR来确定由M-PCR鉴定的生物体的抗生素敏感性和抗性。测试单个病原体对抗生素的抗生素敏感性测定可能会错过多种微生物环境中细菌之间的相互作用。P-AST可同时测试尿液样品中的所有病原体对抗抗生素,并且可以提供有关由于细菌相互作用而导致的抗生素反应变化的信息。发明人最近表明,多种微生物感染中的细菌相互作用可能会改变抗生素敏感性。这些变化会显着影响治疗患者所需的抗生素类型和剂量。此外,使用M-PCR/P-AST测试可显着缩短周转时间,在24小时内提供结果,而SUC需要长达5天才能得出结果。因此,M-PCR/P-AST检测同时可以快速检测2种或更多生物体,同时还提供多种微生物样品中的敏感性信息。在本回顾性研究中,使用ED使用率和住院率作为门诊治疗效果的替代指标,评估了M-PCR/P-AST是否优于SUC:更有效的门诊治疗应导致ED使用率和住院率降低。
这是一项观察性回顾性研究,比较了两个患者队列的急诊就诊和住院次数。研究人群包括初级保健提供者看诊的患者,他们在家中或辅助生活设施中照顾患者。本研究中的所有患者都接受了可能的尿路感染。患者被分为两个时间段队列。SUC队列由2016年3月1日至2017年7月31日期间根据SUC结果接受抗生素门诊治疗的患者组成。清洗期为7个月(2017年8月1日至2018年2月28日)。M-PCR/P-AST队列包括根据2018年3月1日至2019年7月31日期间M-PCR检测结果接受抗生素门诊治疗的患者。通过自行清洁捕获或导尿从患者处获取尿液样品。收集样品并运送至Lab Corp(美国多个地点)或Quest Diagnostics(美国多个地点),使用标准程序进行培养测试。
使用KingFisher/MagMAX
使用
P-AST通过将1mL患者尿液样品等分到1.7mL微量离心管中进行。离心后,吸出并丢弃上清液,在微量离心管中留下大约500μL的患者样品。然后将1mL的Mueller Hinton生长培养基等分到微量离心管中的患者样品中,并且将管在非CO
使用Health Catalyst(数据仓库)收集两组患者的患者人口统计、合并症和设施水平数据。人口统计变量包括年龄和性别。此外,还收集了Charlson/Deyo(CD)指数评分以及每位患者就诊的次数。
使用医疗保险和医疗补助服务中心(CMS)提供的文件中的主要诊断代码来确定尿路感染的急诊就诊和住院率。研究数据包括带有ICD-9和ICD-10代码的病历。SUC队列期间仍在使用ICD-9编码,直到M-PCR/P-AST队列期间向ICD-10编码的过渡生效。适用的ICD-9诊断代码包括5990(尿路感染)、788.1(排尿困难)、590.10(急性肾盂肾炎)、590.80(肾盂肾炎)、5999(尿路疾病)和59000(慢性肾盂肾炎)。ICD-10诊断代码包括N39.0(尿路感染,未指定部位)、R30.0(排尿困难)、R35.0(排尿频率)、R32(未明确的尿失禁)、Z87.440(尿路感染个人史)。如果记录表明国家提供者标识符(NPI)与参与研究的所列研究者的标识符不匹配、患者居住在临终关怀医院或诊断代码缺失,则病例将被排除。
使用标准化差值(SD)分析队列1(SUC)和队列2(M-PCR/P-AST)队列之间的差异。SD计算为平均值(或比例)差异除以标准差的混合估计值,0.1的值被认为可以忽略不计,0.2至0.49被认为两组之间的差异很小。SD越来越多地用于比较研究组之间基线协变量的平衡,因为与其他统计检验不同,例如产生p值的Student's t检验;SD不受样品量的影响。同时,它还可以对不同单位测量的变量进行比较。
计算每个队列因尿路感染急诊就诊和/或住院的平均次数。使用广义线性模型来比较两个队列之间急诊就诊次数和/或的住院情况,使用带有对数链接的负二项分布来解释计数数据的过度分散。因变量是每个队列中每位患者的急诊就诊和/或住院次数的计数数据,自变量是队列。每个患者发生多次尿路感染事件可能会影响急诊就诊和/或住院的次数。还进行了患者层面的分析,总结了因尿路感染而发生急诊科或住院事件的患者的频率和比例。具有Logit连接的逻辑回归模型用于此二元结果,以评估两组之间的差异。因变量是每个队列中每位患者住院和/或急诊就诊的二分变量;自变量是队列。
描述了两个队列的每位患者住院/急诊就诊的频率,以阐明经历多次事件的患者数量。在那些接受过急诊或住院治疗的患者中,按队列评估了性别分布。使用SAS 9.4版(北卡罗来纳州卡里市SAS Institute,Inc.)和StataSE 16进行分析。
总体而言,回顾性图表综述包括SUC队列中的34414名独特患者和M-PCR/P-AST队列中的31967名独特患者。
这两个队列相似,因为所有变量的人口统计变量的SD均小于0.20。SUC队列的平均年龄为73.5岁,M-PCR/P-AST队列的平均年龄为72.9岁。俄亥俄州、佛罗里达州和华盛顿州的患者数量差异可以忽略不计。俄亥俄州的M-PCR/P-AST队列患者较少(23%比17.1%,SD=-0.148),而华盛顿州的患者较多(1.5%比3.4%,SD=-0.097)和佛罗里达州(8.3%比11.7%,SD=0.112)。两个队列中的性别分布相似,SUC队列中62.9%的患者为女性,M-PCR/P-AST队列中62%的患者为女性。SUC队列的平均就诊次数为6.2次,M-PCR/P-AST队列的平均就诊次数为6.1次,两个队列的中位数均为5.0次。
与SUC队列中的患者相比,M-PCR/P-AST队列中的患者急诊就诊和/或住院的频率较低。在SUC队列的34414例患者病例中,研究期间共有1307例(3.79%)急诊就诊或住院事件。相比之下,在M-PCR/P-AST队列中审查的31967例患者病例中发生了1045例(3.27%)类似事件,这意味着两个队列之间存在统计显着性(p=0.003)差异。
总体而言,两个队列之间的急诊就诊次数有所减少,从SUC队列的802次(2.33%)减少到M-PCR/P-AST队列的657次(2.06%),但这种差异接近统计显着性(p=0.047)。M-PCR/P-AST队列中的住院人数(388例;1.21%)显着低于SUC队列中的住院人数(509例,1.48%;p=0.008)。每个患者多次住院可能会混淆住院次数。如果每位患者每次UTI事件仅计数一次,则使用ED或住院的患者数量会出现统计学上的显着减少,从SUC队列的1041例(3.02%)减少到M-PCR/p-AST队列的831例(2.60%,p=0.001)。
关于ED或住院频率的患者水平分布,一名患者在研究期间可能经历多次ED或医院使用事件,每位患者最多9次。M-PCR/P-AST队列中经历多种事件的患者(150例,0.47%)略少于SUC队列中的患者(180例,0.52%;p=0.32)。
对数据进行分析,以确定患有多种事件的患者的年龄与急诊就诊和/或住院次数之间是否存在关系。总体而言,那些未经历ED/住院事件或经历1-3次事件的患者年龄相似。可以看出,M-PCR/P-AST队列中经历4次或以上就诊的患者比SUC队列中的患者年龄更大,但结果显示,M-PCR/P-AST队列的ED就诊率和住院率小于SUC队列。
本研究试图评估患者从SUC到M-PCR/P-AST的过渡测试对ED和住院率的影响。根据文献报道,VPA已放弃SUC,表明SUC的假阴性率>30%,并且遗漏了大量尿路病原体。内化该测试的另一个动机是减少与SUC测试相关的周转,从而减少经验性治疗。研究样品分为两组,一组根据SUC和抗菌药物敏感性测试的结果做出UTI治疗决策,另一组根据M-PCR/P-AST的结果做出UTI治疗决策。这两个队列人群在年龄、性别、种族、CD风险评分、地点和就诊次数方面相似。
研究发现,使用M-PCR/P-AST检测与ED使用率和住院率的降低之间存在显着相关性。具体而言,既往门诊治疗以SUC结果为指导的患者的ED使用率和尿路感染住院率高于既往门诊治疗由M-PCR/P-AST测定结果为引导的患者。住院率的这种相关性比急诊室使用率的相关性更强。此外,基于M-PCR/P-AST检测结果管理的患者(0.47%,150/31967)比使用SUC管理的患者(0.52%,180/34414,p=0.32)管理的患者重复住院事件更少。
本研究将病原体M-PCR检测和P-AST与传统尿培养相结合的检测方法在UTI治疗中进行了比较。我们发现M-PCR/P-AST的使用与急诊室使用率和住院率的减少之间存在统计学上显着的关联。M-PCR/P-AST提供的更高的诊断准确性和更短的周转时间可能促成了这一发现。
实施例5:抗生素抗性(ABR)测试板
参考本文中公开的其他方法,可以根据标准收集方案在无菌容器中从受试者收集样品并将其运输至测试设施。
抗生素抗性(ABR)测试板的制备例涉及两个步骤。首先是抗生素溶液的制备,第二是细菌生长培养基板的制备。针对任何给定样品测试的抗生素包括已知可用于治疗疑似感染的组织的抗生素,或了解特定患者样品的医学或实验室专业人员要求的任何抗生素。预计大多数检测将根据医疗专业人员疑似的感染类型和位置,使用标准抗生素组进行。在一些实施方案中,标准抗生素组包括呋喃妥因、环丙沙星、美罗培南、头孢曲松、甲氧苄啶/磺胺甲恶唑、哌拉西林/他唑巴坦、左氧氟沙星、头孢西丁、四环素、氨必西林/舒巴坦、氨必西林、四环素、塞法洛、头孢唑啉、阿莫西林/克拉维酸、头孢他啶、磷霉素、头孢呋辛、头孢拉新(cephalalexine)、万古霉素中的一种或其组合、本文包括附图等公开的任何其他抗生素等或其组合。然而,已知对抗生素过敏或敏感,或有抗生素抗性史的患者可能需要定制抗生素组合。该测定可以与无限数量的抗生素同时进行。
使用适合每种抗生素的溶剂制备抗生素储备溶液,然后制备10倍溶液并储存在多孔板中,以便有效转移到测试板。每种抗生素均在最低浓度下进行测试。在一些实施方案中,三种浓度、四种浓度、五种浓度、六种浓度、七种浓度、八种浓度、九种浓度或十种浓度的抗生素或抗生素组合被包括在测定中。通常制备抗生素的系列稀释液,其中每次稀释液代表较高浓度的一半浓度。根据为分析所选择的抗生素组建立的板计划,将10倍抗生素溶液储存在多孔板中。在图14和图15中的抗生素源板中描绘了示例性的板平面图。抗生素原液和10倍溶液在2-8℃下储存,直到需要为止。
ABR测试板可以是多孔板(例如,6孔、12孔、24孔、48孔、96孔、384孔板或任何适合此目的的多孔板)含有细菌生长培养基和培养细菌。在一些实施方案中,板是96孔板。在一些实施方案中,将无菌琼脂细菌生长培养基分配到板的每个孔中。示例性的琼脂-细菌生长培养基包括但不限于Mueller-Hinton琼脂、血琼脂、胰蛋白酶大豆琼脂等。琼脂在室温下凝固后,根据预定的板计划将1/10体积(细菌生长培养基)的10倍抗生素溶液添加到测试板的每个孔中。将抗生素引入细菌生长培养基后,让板静置至少一小时。为了长期保存,含抗生素的ABR板保存在2-8℃下。在一些实施方案中,将与样品混合的无菌液体肉汤细菌生长培养基分配到含有1/10体积(细菌生长培养基)的根据预定板计划排列的10倍抗生素溶液的板的每个孔中。将含有1/10体积(最终孔体积的细菌生长培养基和抗生素溶液)的多孔板储存在2-8℃下,以供以后使用或长期储存。
用于所公开的抗生素抗性测试的样品可以任选地在无菌水溶液中稀释或与细菌生长培养基混合。在一些实施方案中,首先将用于公开的抗生素抗性测试的一定体积的样品与生长培养基混合并在35±4℃的孵育温度下孵育0-24小时。然后用盐水稀释样品,然后与生长培养基混合,并以多孔板中每孔的9/10体积添加到室温ABR测试板中。在一些实施方案中,将样品以孔中存在的细菌生长培养基的1/20体积添加至室温ABR板。每ABR板使用一个患者样品。如果要测试多个患者样品,则每个样品都在其自己的板中进行分析。接种后,将板覆盖并孵育以促进细菌生长。使用多于一个板来测定单个样品的实施例也在本方法的范围内。
该板可用于培养厌氧或需氧细菌。对于厌氧细菌的培养,将板在一定温度和低氧环境下孵育以促进厌氧细菌的生长。对于需氧细菌的培养,将板在一定温度和含氧环境中孵育以促进需氧细菌的生长。
孵育温度可能会根据预期的细菌类型而有所不同,但最有可能在35-40℃的范围内。将含有样品的板孵育12至48小时、12至24小时、24至28小时、12至36小时、14至30小时、16至24小时、16至20小时、或16至18小时、或由这些数字限定的任意范围。
在一些实施方案中,其中用含有琼脂的培养基进行测定,在孵育后,通过在水性液体中重悬来回收存在于每个孔中的细菌。合适的液体包括但不限于水、盐水、培养基等。水性液体应该是无菌的,或者至少没有细菌生长。将相当于细菌生长培养基体积100%的液体小心地添加到ABR板的孔中,并静置至少30分钟。在一些实施方案中,使板静置35分钟、40分钟、45分钟、50分钟或60分钟。然后根据预定的板计划将所得悬浮液小心地从每个孔移入干净的多孔板的各个孔中。在除去悬浮液之前,任选地搅动板以使细菌与液体混合。在使用液体生长培养基进行测定的一些实施例中,多孔板将在孵育后立即应用于OD
然后在分光光度计中读取含有含细菌悬浮液的多孔板。在OD
对每个孔的多个OD
然后根据阈值将空白结果转换为“抗性”(R)或“敏感”(S)分数。OD
在一些实施方案中,阈值是针对含琼脂培养基的。在一些实施方案中,基于与标准参考方法的相关性,阈值被确定为0.010至1.000、0.010-0.090、0.015至0.035、或0.020至0.030。在一些实施方案中,阈值确定为约0.010、约0.015、约0.020、约0.025、约0.030、约0.035、约0.040、约0.045、约0.050、约0.055、约0.060、约0.065、约0.070、基于与标准参考方法的相关性,约0.075、约0.080、约0.085或约0.090。在一些实施方案中,基于与标准参考方法的相关性,阈值被确定为0.025。
在一些实施方案中,阈值是针对液体介质的。在一些实施方案中,基于与两种标准参考方法之间的一致性分数的相关性,阈值已确定为0.010至1.000、0.020至0.090、0.050至0.080、0.055至0.075、或0.060至0.070。在一些实施方案中,阈值确定为约0.010、约0.015、约0.020、约0.025、约0.030、约0.035、约0.040、约0.045、约0.050、约0.055、约0.060、约0.065、约0.070、基于与2种标准参考方法之间的一致性分数的相关性,约0.075、约0.080、约0.085、约0.090或约0.095。在一些实施方案中,基于与两种标准参考方法之间的一致得分的相关性,阈值被确定为0.065。
在其他实施方案中,大于空白OD
然后根据培养物在多种抗生素浓度下的敏感性或抗性计算每种有效抗生素的最低抑制浓度。
本文公开的抗生素耐药性测定的结果被传送给适当的医疗专业人员,然后,适当的医疗专业人员可以选择开出一种或多种对患者感染有效的抗生素,将抗生素更换为更有效的抗生素,或要求进行额外的检查。
实施例6利用含琼脂培养基的抗生素抗性(ABR)测定
使用BD Vacutainer(灰顶)管或其他合适的防漏无菌容器收集、运输和储存适合用该测定处理的尿样。在测试结果受到影响之前,尿液样品可以在室温下保存48小时。
将没有现成溶液的抗生素溶解在适当的溶剂中,并根据其各自的溶解度(例如,作为抗生素原液,以测定中所需浓度的10倍)。抗生素原液存储在2-8℃下,并避免阳光直射。将制备的抗生素储备溶液等分到一个或多个96深孔板(Thermo Fisher Scientific)中以形成抗生素原液,例如图14所示,并通过抗生素名称和浓度(μg/mL;10倍最终浓度)进行鉴定。抗生素可包括呋喃妥因、环丙沙星、美罗培南、头孢曲松、甲氧苄啶、磺胺甲恶唑、甲氧苄啶/磺胺甲恶唑、哌拉西林、他唑巴坦、哌拉西林/他唑巴坦、左氧氟沙星、头孢西丁、四环素、氨必西林/舒巴坦、氨必西林、舒巴坦、阿莫西林、阿莫西林/克拉维酸、头孢克洛、头孢唑啉、头孢吡肟、头孢他啶、磷霉素、庆大霉素和/或万古霉素,单独或组合使用。在一些实施方案中,一个或多个孔被指定为AB-混合物,其含有抗生素的组合以确保没有细菌生长。
将Mueller-Hinton琼脂培养基(例如100微升)等分到96孔微量培养板(VIS 96/F-PS,Eppendorf)的每个适当的孔位置中。使介质在室温下固化至少10分钟。
然后将不同浓度的抗生素(10μL)从抗生素源板等分到所需的孔中。将抗生素引入琼脂培养基后,ABR微孔板在使用前静置至少1小时。如果需要长期保存,含有抗生素琼脂的ABR微孔板应在-8℃下避光保存。
测试时,将尿样以1:20稀释在无菌盐水中并涡旋。每个患者样品均使用单个ABR微孔板。将5微升稀释的患者样品添加到室温微孔板的每个孔中,将板密封并在37℃下孵育16-18小时。
孵育后,将板从培养箱中取出并小心地揭开盖子。将200微升去离子水添加到每个孔中以悬浮琼脂上方的细胞,并将板在室温下孵育30分钟。30分钟后,从每个孔中取出100μl至新板中,并在分光光度计中测定OD
对照包括:无抗生素对照、阴性对照板和AB-混合物。无抗生素对照:任何含有未注入抗生素的培养基的孔,以确保患者尿液样品中存在的细菌细胞的活力并包含在每个板中。如果任何给定患者的无抗生素对照没有产生生长,则使用未经稀释的相同患者样品进行二次测试。阴性对照板:含有抗生素琼脂培养基的微孔板,不添加患者样品或培养的细菌生物体,以确保试剂不污染。AB-混合物:一个或多个含有抗生素组合的孔,以确保没有细菌生长。
表7显示了抗生素、孔位置、平均OD(原始数据)、空白OD以及对抗生素的抗性(R)或敏感性(S)的评估。每个孔位置对应于一定浓度的特定抗生素。表7中的孔按类似抗生素分类排列在一起。空白列是指使用从AB-Blend孔获得的测量结果空白的原始数据,如表7所示,收集的原始数据显示为“平均”OD。为了确定患者样品中存在的细菌有机体对一定浓度的特定抗生素是否具有抗性或敏感,将空白OD读数与0.025的阈值OD
表7
/>
在此实施例中,样品含有对呋喃妥因、环丙沙星、美罗培南、头孢曲松、哌拉西林/他唑巴坦和头孢西丁敏感的细菌。左氧氟沙星的结果是模棱两可的。
然后可以提供每种药物的MIC。最低抑菌浓度(MIC)是样品敏感的最低测试抗生素浓度。基于上述结果的美罗培南的示例性MIC测定如表8所示。
表8
通过将测试方法的抗生素抗性结果与通过抗生素琼脂方法评估的混合和分离培养物获得的结果进行比较来评估准确性。总计测试了19个细菌细胞池(细胞池由2-4种生物体组成)、17种分离的生物体和9份常规处理的尿液样品对12种抗生素的抗性。准确性根据特异性(真阴性)、灵敏度(真阳性)和总体准确性(所有样品)进行评估。该检测在所有三个类别中均显示出良好的准确性:总体准确度=96%;特异性准确度百分比=95%;灵敏度准确度百分比=96%。
通过在三天内测试“准确度”样品组中的三个样品来评估测定间精度。通过在一批中一式三份地测试每个样品来评估测定内精度。通过确定所有5次重复的一致结果,然后计算与一致结果匹配的重复次数,来评估每个样品的精度。然后将该数字除以所有测量值的总和(所有药物的测量)以确定%精度。通过将所有正确匹配的总和除以所有样品的测量总数来计算总体精度。该测定显示出非常好的精度。所有精密样品的总匹配数为690个,匹配率为93%。
通过确定产生准确结果的最低细菌浓度来评估分析灵敏度或检测限(LOD)。在某些情况下,低于10000个细胞/mL的细菌浓度不被视为UTI阳性,因此测试的最低浓度为10000个细胞/mL。在测试的最低细菌浓度下获得了与共识结果相关的一致结果(>98%)。该测定的LOD为10000个细胞/mL。注意,本发明不限于10000个细胞/mL的浓度。
通过测试细菌浓度为100000000个细胞/mL的样品来评估该测定的分析特异性。这种浓度通常在常规尿路感染患者样品中观察不到,但在饱和过夜细菌培养物中达到。然后通过测试“准确度”样品集中的三个样品来评估分析测量范围(AMR),每个样品稀释如下:100000000个细胞/mL、1000000个细胞/mL、100000个细胞/mL和10000个细胞/mL。在测试的所有细菌浓度下获得了与一致结果相关的一致结果(>94%)。该测定在细菌浓度高达100000000个细胞/mL时具有特异性。本发明不限于10000个细胞/mL的浓度。
实施例7利用液体生长培养基的抗生素抗性(ABR)测定
使用BD Vacutainer管或其他合适的防漏无菌容器收集、运输和储存适合用该测定处理的尿样。在测试结果受到影响之前,尿液样品可以在室温下保存48小时。
将未收到的现成溶液中的抗生素溶解在适当的溶剂中,并根据其各自的溶解度达到测定中所需浓度的50倍,并作为抗生素储备液储存。抗生素库存储存在2-8℃下,并避免阳光直射。将制备的抗生素储备溶液等分到96深孔板(ThermoFisher Scientific)中以形成50倍抗生素源板,然后按1:5稀释以形成10倍抗生素源板,如图15所示,其中每个孔都通过抗生素名称和浓度(μg/mL;10倍最终浓度)进行标识。该测定中包括的抗生素有阿莫西林、克拉维酸、氨必西林、舒巴坦、头孢克洛、头孢唑林、头孢吡肟、头孢西丁、头孢他啶、头孢曲松、环丙沙星、磷霉素、庆大霉素、左氧氟沙星、美罗培南、呋喃妥因、哌拉西林、他唑巴坦、四环素、甲氧苄啶、磺胺甲恶唑和万古霉素,单独或组合使用。一个孔被指定为叠氮化钠,以确保该孔中不会观察到细菌生长。
将20微升每种抗生素溶液从10倍抗生素源板等分到96孔微孔板(VIS 96/F-PS,Eppendorf)的预定孔中,以创建用于接种的ABR测试板。这些ABR测试板在使用前可在2-8℃的黑暗条件下放置长达24小时。
测试时,将尿液样品离心以浓缩所有细菌细胞,然后与液体Mueller-Hinton培养基混合并在37℃下孵育6-16小时。初次孵育后,将样品在盐水中稀释至0.5-0.6McF,然后将500μl的该悬浮液添加到29.5μl的Mueller-Hinton培养基中。然后将180微升稀释样品等分到已含有10倍抗生素溶液的ABR微孔板的每个孔中,使所有抗生素达到所需的最终浓度。然后将板密封并在37℃下孵育12至16小时。
孵育后,将板从培养箱中取出,小心地揭开盖子,并通过分光光度计测定每个适当孔的OD
表9显示了抗生素、孔位置、平均OD(原始数据)、空白OD以及对抗生素的抗性(R)或敏感性(S)的评估。每个孔位置对应于一定浓度的特定抗生素。这些孔按类似抗生素分类排列在一起。空白列是指使用从叠氮化钠孔中获得的测量结果来空白的原始数据。收集的原始数据显示为“平均”OD。为了确定患者样品中存在的细菌有机体对一定浓度的特定抗生素是否具有抗性或敏感,将空白OD读数与0.025的阈值OD
表9
/>
在此实施例中,样品含有对阿莫西林/克拉维酸、氨必西林、氨必西林/舒巴坦、环丙沙星、庆大霉素、左氧氟沙星、呋喃妥因、哌拉西林/他唑巴坦和万古霉素敏感的细菌。
然后可以提供每种药物的MIC。最低抑制浓度(MIC)是样品敏感的最低测试抗生素浓度。基于上述结果的美罗培南的示例性MIC测定如表10所示。
表10
通过将测试方法的抗生素抗性结果与标准参考方法获得的一致结果进行比较来评估准确性。总计测试了15种分离的生物体和20份常规处理的患者尿液样品对18种抗生素的抗性,每种抗生素均在多个浓度下进行测试,总计57种抗生素浓度。根据特异性(真阴性)、灵敏度(真阳性)和总体准确度(所有样品)评估准确度。该检测在所有三个类别中均显示出良好的准确性:总体准确度=96%;特异性=95%;灵敏度=97%。
通过在不同的三天内测试五个样品来评估批间测定精确度。通过在一天内一式三份地测试相同的五个样品来评估批内测定精确度。计算一致性百分比以测量通过该测定获得的结果的精确度。该测定显示出非常好的精确度。在批内测定中,855次测量中匹配数为841次(一致性为98%);对于批间测定,测量的1425个匹配项中有1388个(一致性为97%)。
通过创建大肠杆菌和粪肠球菌的稀释系列来评估分析灵敏度,每种生物体的最低细菌浓度低于100个细胞/mL。测试了每种分离株的每种稀释水平,以显示低至最低浓度的结果的再现性。2种分离株的所有稀释水平均观察到98%的相关性,表明该测定的检测限(LOD)低于100个细胞/ml。
分析敏感性是在过多细菌细胞超载测定的抑制作用的背景下进行评估的。准确度较低(由于假抗性结果)在高细菌浓度下接种的样品中观察到。这表明所有样品在预培养后和ABR接种前必须稀释至指定的细胞密度。
该测定在将样品引入抗生素之前采用预培养步骤。在6小时和16小时测试了2个分离株(大肠杆菌和粪肠球菌)的预培养孵育持续时间。在6小时和16小时预培养孵育后,观察到每种分离株均具有良好的准确性,表明该测定的预培养窗口为6至16小时。83次测量中匹配次数为81次(准确度为98%)。
样品加入抗生素后,孵育12至16小时。该孵育长度是通过在孵育12小时和16小时后获得精密样品的OD测量值来确定的。在12至16小时的孵育窗口内,所有样品均观察到良好的百分比一致性。2850次测量中,匹配次数为2758次(准确度为97%)。
为了确认浑浊度(高OD测量值)是由细菌生长引起的,从与敏感和抗性结果相对应的孔中提取DNA,并通过PCR进行病原体鉴定测试。鉴定结果证实,抗性(浑浊)孔中的细菌浓度显着高于敏感(透明)孔(参见表11)。
表11.
实施例8:通过多重PCR测定的抗生素抗性基因的存在与有尿路感染症状的患者中的敏感性试验之间的一致性
抗生素抗性有2种机制:先天抗性和获得性抗性。先天抗生素抗性通常是染色体编码的,例如非特异性外排泵、抗生素灭活酶或渗透性屏障。水平转移的抗性基因提供获得性抗性,并且包括质粒编码的ABR基因,用于特定的外排泵和可以修饰靶向抗生素的酶。
虽然已知的ABR基因数量不断增加,但ABR基因的检测并不能保证该基因的活性。由于许多ABR基因的调控尚未完全了解,因此需要进一步研究来了解ABR基因的存在与其活性相关的频率。本发明分析了从有UTI症状的患者收集的尿样中ABR基因的存在或不存在与抗生素敏感性测试之间的一致性和不一致性。
这项一致性研究基于2018年7月26日至2019年2月27日期间入组的2512名连续患者的前瞻性UTI研究队列的子集。简而言之,来自美国37家泌尿外科诊所的75名医生对出现尿路感染症状的患者进行了评估。该研究纳入了在泌尿外科就诊并疑似患有急性膀胱炎、复杂性尿路感染、持续性尿路感染、复发性尿路感染、前列腺炎或肾盂肾炎的60岁或以上患者。此外,该研究还包括任何年龄、有间质性膀胱炎病史的患者。如果患者没有尿路感染症状、在入组时因尿路感染以外的任何原因服用抗生素、患有尿流改道以及在入组时使用长期(>10天)留置导尿管或自行导尿,则被排除在外咨询。具有没有正确记录样品收集方法、不符合测试收集标准或不包含至少3mL体积的尿液样品的患者被排除在研究之外。所有患者均提供了书面知情同意书,并附有西部IRB批准的表格(20181661)。
使用每位患者的3ml尿液通过M-PCR进行细菌检测(方法如下)。在2512名患者中,M-PCR检测出总计1579名患者的细菌。372份患者样品中含有完全苛养细菌,按照实验室标准,这些细菌被认为是不可培养的;因此,无法进行敏感性测试。由于细菌在测试过程中未能繁殖,因此无法获得52名患者的混合抗生素敏感性测试(P-AST)结果。因此,一致性分析数据基于总研究队列的一个子集(N=1155)。该子集仅包括M-PCR细菌鉴定呈阳性的患者、P-AST的抗菌药物敏感性结果以及M-PCR的ABR检测结果。
使用KingFisher/MagMAX自动DNA提取仪和MagMAX DNA多样品Ultra试剂盒(ThermoFisher,卡尔斯巴德,加利福尼亚州)从尿液样品中提取DNA。简而言之,将400μL尿液转移至96孔深孔板的孔中,密封,离心浓缩样品;除去上清液。添加酶裂解混合物(220μL/孔)并在65℃下孵育20分钟。添加蛋白酶K混合物(50μL/孔)并在65℃下孵育30分钟。添加裂解缓冲液(125μL/孔)和DNA结合珠混合物(40μL/孔),并将样品振荡至少5分钟。将96孔板装入KingFisher/MagMAX自动DNA提取仪中,按照标准操作程序进行操作。
如前所述,使用Pathnostics
使用Pathnostics
如前所述,使用标准曲线方法测定每种细菌种类的数量。简而言之,每种细菌的标准曲线是通过对已知浓度的DNA/培养物稀释系列进行重复测试而生成的;根据标准曲线建立了未知样品中每种细菌物种定量所需的常数。将患者样品中目标细菌的PCR循环值与标准曲线进行比较,并推断并确定样品中存在的目标细菌种类的浓度(细胞/mL)。数量>10000个细胞/mL的细菌被定义为“阳性”或“检测到”。细菌数量<10000个/mL被定义为“阴性”。本发明不仅限于这些阈值。
使用Pathnostics
如果ABR基因的循环数(Ct)高于特定阈值,则确定细菌对该ABR基因呈阳性。该阈值是通过比较一系列阴性样品、提取对照样品和特异性样品(非目标生物体/基因的基因组DNA)来确定的。确定了这些测定中的最低Ct。其次,测试了质粒稀释系列(ThermoFisher为每个目标ABR基因提供了质粒)。检测到50%或更多重复的Ct值低于第一步中确定的循环数时的最低质粒浓度被确定为测定的检测下限(LLOD)。然后将任何特定目标ABR基因测定的阈值Ct设置为该基因确定的LLOD的循环当量。Ct值不高于该基因的Ct阈值的ABR基因定义为“阳性”或“检测到”,Ct值高于阈值的ABR基因定义为“阴性”或“未检测到”。对于mecA基因,mecA的“阳性”或“检测到”状态仅限于检测到金黄色葡萄球菌的患者。
本发明不限于本文公开的阈值。
在P-AST测定中评估了代表6类抗生素(氨基青霉素类、β-内酰胺酶抑制剂组合、头孢菌素、氟喹诺酮类、碳青霉烯类和糖肽类)的总计18种抗生素。四种抗生素与Pathnostics
P-AST如前所述进行。简言之,将1mL患者尿液样品等分到1.7mL微量离心管中。离心后,吸出并丢弃上清液,在微量离心管中留下大约500μL的患者样品。然后将1mL的Mueller Hinton生长培养基等分到微量离心管中的样品中,并且将管在非CO
总结了整个研究队列中患者的人口统计和临床信息,以及细菌种类的检测频率、ABR基因是否存在以及抗生素抗性。对于每种抗生素,如果检测到任何一个或多个相关ABR基因,则ABR基因的状态被编码为“存在”。本发明不限于本文公开的阈值。
针对每种抗生素、每种抗生素类别、单一微生物感染、多种微生物感染和整个组,生成ABR基因的存在与敏感性测试结果之间的一致性。使用卡方检验比较单一微生物和多种微生物样品之间每种抗生素的一致性。使用SAS9.4版进行分析。
在纳入一致性分析的1155名患者中,784名(67.9%)为女性,371名(32.1%)为男性。中位年龄74.3岁,其中99.3%年龄在60岁以上。所有患者均出现尿路感染症状,包括排尿困难、尿液混浊或尿液气味重、疼痛或盆腔不适、发烧和/或下尿路症状(LUTS)。89.0%的研究人群的尿液分析结果显示血液、白细胞和/或亚硝酸盐呈阳性。14.3%的患者在参加研究前三周内服用了抗生素。
表12
M-PCR在23.3%(269)的患者中检测到多种微生物感染,定义为2种或多种细菌,其中886名(76.7%)患者含有一种微生物。总体而言,患者尿液样品中检出最多的细菌是大肠杆菌(564/1155,48.8%),CoNS组(282/1155,24.4%)和粪肠球菌(242/1155,21.0%)。未显示的数据:检测到的每种细菌的检测频率。
每种抗生素的抗性率范围为6.2%(哌拉西林/他唑巴坦)至50.9%(头孢曲松)(参见表12)。ABR基因的检出率范围为0.3%(对于美罗培南、左氧氟沙星和环丙沙星相关ABR基因)至36.8%(对于阿莫西林/克拉维酸相关ABR基因)(参见表12)。
M-PCR在36.2%(419/1155)的患者样品中检测到24个ABR基因470次,其中大多数[379/419(90.5%)]仅检测到1种ABR基因。M-PCR在29/419(6.92%)的样品中检测到2种ABR基因,在11/419(2.63%)的样品中检测到3种ABR基因。最常鉴定的ABR基因是TEM、SHV和CTX-M第1组基因,分别存在于205名(17.7%)、100名(8.7%)和47名(4.1%)患者中。在任何患者样品中均未检测到9种ABR基因,包括GES、IMP-1组、PER-1、PER-2、IMP-7、OXA-72、OXA-58、NDM-1和OXA-23。
372名患者的样品仅含有8种苛养菌,其中26种(7.0%)被鉴定出存在ABR基因。24个样品含有1种ABR基因,1个含有2种基因,1个含有3种基因,总计鉴定出15种基因。这些患者被排除在一致性分析之外,因为无法获得P-AST结果。样品中检测到的ABR基因与以下类别抗生素的抗性相关:氨基青霉素类、β-内酰胺酶抑制剂/抗生素组合、糖肽类、氟喹诺酮类、碳青霉烯类和头孢菌素类。数据未显示:372名患者中每种ABR基因的患病率。
通过M-PCR检测ABR基因的存在与通过P-AST检测的抗菌药物敏感性结果之间观察到的总体一致性为60%。有2种不同类型的一致性值:M-PCR不存在ABR基因/P-AST抗生素敏感(48.4%),P-AST存在ABR基因/抗生素抗性(11.5%)。40%不一致的病例还包括2种情况:ABR基因不存在/抗生素抗性(25%)和ABR基因存在/抗生素敏感(15%)。
一些抗生素类别的一致性高于总体一致性。例如,氨基青霉素类、β-内酰胺酶抑制剂/抗生素组合、氟喹诺酮类和碳青霉烯类的一致性>67.2%。相比之下,头孢菌素类仅表现出48.5%的一致性(参见图16)。
共有14种抗生素参与了一致性分析。每种抗生素的总体一致性范围为44.7%(头孢曲松)至78.4%(氨必西林)。大多数抗生素与单一微生物和多种微生物感染的一致性相似。然而,多种微生物对3种抗生素(包括万古霉素、美罗培南和哌拉西林/他唑巴坦)的一致性显着较低,绝对差异为9.3%(p值=0.002)、13.1%(p值=<0.0001)和19.0%(p值=0.019)(参见表13)。多种微生物数据集中万古霉素和美罗培南的不一致性较高,是因为在多种微生物环境中缺乏ABR基因检测的情况下,表型抗性率比单一微生物环境中更高。哌拉西林/他唑巴坦较高的不一致是由于在敏感表型存在的情况下ABR基因检测水平增加。
表13
抗生素抗性,尤其是尿路病原体的抗性,是一个日益重要的问题。可靠、快速的微生物鉴定和抗性信息对于尿路感染的管理和抗生素管理至关重要。基于M-PCR的测试已开发用于临床UTI检测ABR基因。然而,ABR基因的检测可能不会转化为表型抗性,它们的不存在也不能表明易感性。
该研究从美国37个不同的泌尿外科诊所采集了1155名患有UTI症状的患者的尿液样品。该研究使用基于M-PCR的测试来检测不同细菌和ABR基因的存在,通过P-AST测试评估抗菌敏感性,并测量两个测试结果之间的一致性,例如ABR基因状态(存在或不存在)和P-AST测试的抗菌敏感性结果。两个结果的总体一致性为60%,其中48%的结果缺乏ABR基因并产生敏感的P-AST结果,12%的结果显示ABR基因的存在并产生抗性的P-AST结果。40%的不一致性包括25%缺乏ABR基因和抗性P-AST结果,以及15%存在ABR基因和敏感性P-AST结果。
尽管60%的一致性进一步验证了AB基因在抗生素抗性中的作用,但40%的不一致性表明单独使用ABR基因的存在或不存在来做出临床决策的局限性。目前的这项研究使用M-PCR OpenArray芯片鉴定了35个ABR基因,但在数百种细菌中,有数千个ABR基因与数百种抗生素相关。将所有ABR基因纳入单一测定中是不可能的。此外,由于正在进行的研究,发现的ABR基因数量正在增加。因此,检测到的抗生素抗性可能部分是由于涉及ABR基因的机制未包含在测试组中。
另一方面,在大约15%的情况下,ABR基因的存在并不赋予表型抗性。这种不一致性可能是由多种原因造成的。PCR检测在DNA水平上检测ABR基因的存在。为了使ABR基因最终产生抗性,细菌必须首先将该基因转录为信使核糖核酸(mRNA)。接下来,核糖体将mRNA翻译成蛋白质;然后在某些情况下,当收到信号时,蛋白质必须被激活。例如,如果基因启动子区域发生突变,它可能不会产生蛋白质,因此不会产生抗生素抗性。此外,ABR基因编码区的突变,例如移码突变,也可能无法产生ABR基因的下游蛋白质产物,从而阻止细菌产生抗生素抗性表型。因此,本研究表明,仅ABR基因的存在或缺失在预测细菌抗生素反应方面并不完全可靠,并支持抗菌药物敏感性在帮助临床治疗决策方面的临床效用。
不同抗生素类别的一致性有所不同。例如,单一药剂青霉素的一致性高达78%,而头孢菌素的一致性低至48.4%。在单个抗生素水平上,五种抗生素的ABR基因和P-AST结果之间存在显着不匹配,其中四种包括:美罗培南、环丙沙星、左氧氟沙星和万古霉素。用于环丙沙星、左氧氟沙星、美罗培南和万古霉素检测的ABR基因数量少于头孢菌素、β-内酰胺酶抑制组合和青霉素个体水平的ABR基因数量。因此,与环丙沙星、左氧氟沙星、美罗培南和万古霉素抗性相关的其他未知ABR基因可能未包括在测试组中。
哌拉西林/他唑巴坦是第五种表现出高不一致性的抗生素。在哌拉西林/他唑巴坦的情况下,ABR基因的鉴定百分比高于P-AST结果的抗性率。仅6.2%的病例检测到抗性,而35.7%的病例显示ABR抗性基因。Cabolt等人表明对哌拉西林/他唑巴坦的抗性需要AmpC的过表达以及另外两个ABR基因mexB和mexY的帮助,这两个基因在研究中都不是靶向基因。因此,在研究中测试的35.7%的ABR基因阳性的人中,很大一部分可能是mexB或mexY阴性,并且没有过表达AmpC,因此未能产生对哌拉西林/他唑巴坦的抗性表型。有趣的是,临床发现:Patterson JE等人和Lee J等人发现哌拉西林/他唑巴坦的使用增加不会像其他抗生素那样导致抗性增加。这可能是由于这样的观念:可能需要发生几个事件才能产生对哌拉西林/他唑巴坦的抗性。
该研究观察到大多数抗生素(11/14)在单一微生物和多种微生物样品之间具有相似性。然而,包括万古霉素、美罗培南和哌拉西林/他唑巴坦在内的3种抗生素与多种微生物感染的一致性显着低于单一微生物感染。由于相对于万古霉素和美罗培南检测到的ABR基因,细菌抗性较高,不一致性增加。这种不一致性可能是由于多种微生物样品中与其他生物体的相互作用造成的。另一方面,多种微生物样品中哌拉西林/他唑巴坦的不一致性是由于抗性基因检测的增加。先前的研究表明,每增加一个微生物,哌拉西林/他唑巴坦的抗性率就会降低。如前所述,不一致性的增加可能是由于需要过表达Amp并且可能随着向混合物中引入其他物种,AmpC的过表达会减少。无论如何,这3种抗生素的作用相对较强,通常用于治疗高度抗性的细菌感染。
P-AST无法对PCR鉴定为仅含有苛养细菌的372个样品生成敏感性结果,因为它们不在培养物中生长。因此,该研究无法对这些患者进行一致性分析。然而,通过PCR分析了这些样品中是否存在ABR基因,结果显示这些样品中存在15个ABR基因。由于同样的生长挑剔的原因,传统的尿培养和基于分离株的抗菌药物敏感性测试在临床上也不可行。因此,ABR基因结果为单纯苛养细菌感染的患者提供了具有临床价值的信息。
虽然该研究测试了相对大量的ABR基因,但它只能检测到有引物的基因。此外,该研究能够检测ABR基因的存在或不存在,但没有量化ABR基因。因此,该研究无法评估ABR基因相对于细菌生物负荷的浓度及其对抗菌药物敏感性的影响。未来的规划研究包括更新的ABR基因测试组和定量方法。
来自多个机构的大样品研究表明,ABR基因的存在与否与P-AST检测结果之间的一致性为60%。在其余不一致的病例中,40%的病例在没有表型数据的情况下依赖M-PCR ABR报告可能导致不适当的治疗。因此,有必要向医生提供ABR基因结果和敏感性试验结果,特别是考虑了细菌相互作用的P-AST结果,以协助他们做出临床治疗决策。
除非另有说明,说明书和权利要求书中使用的表示成分的量、性质例如分子量、反应条件等的所有数字应理解为在所有情况下都被术语“约”修饰。如本文所用,术语“约”和“大约”是指在10%至15%内,优选在5%至10%内。因此,除非有相反的指示,否则说明书和所附权利要求书中提出的数值参数是近似值,其可以根据本发明寻求获得的期望特性而变化。至少,并且不试图将等同原则的应用限制于权利要求的范围,每个数值参数至少应当根据所报告的有效数字的数量并通过应用普通舍入技术来解释。尽管阐述本发明的广泛范围的数值范围和参数是近似值,但是尽可能精确地报告了具体实施例中阐述的数值。然而,任何数值本质上都包含一定的误差,这些误差必然是由其各自的测试测量中发现的标准偏差引起的。
在描述本发明的上下文中(尤其是在以下权利要求的上下文中)使用的术语“a”、“an”、“The”和类似引用应解释为包括单数和复数,除非本文另有说明或与上下文明显矛盾。本文中数值范围的列举仅旨在用作单独提及落入该范围内的每个单独值的速记方法。除非本文另有说明,否则每个单独的值均被并入说明书中,如同其在本文中单独引用一样。本文描述的所有方法可以以任何合适的顺序执行,除非本文另外指示或另外与上下文明显矛盾。本文提供的任何和所有示例或示例性语言(例如,“诸如”)的使用仅旨在更好地阐明本发明,并且不对另外要求保护的本发明的范围构成限制。
说明书中的任何语言均不应被解释为指示对于本发明的实践而言必要的任何未要求保护的元素。
本文所公开的本发明的替代元件或实施例的分组不应被解释为限制。每个组成员都可以被提及和单独或与本文中发现的组的其他成员或其他元素的任意组合要求保护。预期出于方便和/或可专利性的原因,可以将组的一个或多个成员包括在组中或从组中删除。当发生任何此类包含或删除时,说明书被视为包含经修改的基团,从而满足所附权利要求中使用的所有马库什组的书面描述。
本文描述了本发明的某些实施方案,包括发明人已知的用于实施本发明的最佳模式。当然,在阅读前述描述后,这些所描述的实施例的变化对于本领域普通技术人员来说将变得显而易见。发明人期望技术人员适当地采用此类变化,并且发明人意图以本文具体描述之外的方式实践本发明。因此,本发明包括适用法律允许的所附权利要求中记载的主题的所有修改和等同物。此外,除非本文另有说明或与上下文明显矛盾,否则本发明涵盖上述元件在其所有可能变型中的任何组合。
本文公开的具体实施方案可以使用语言“由或基本上由...组成”进一步限定在权利要求中。当在权利要求中使用时,无论是提交的还是根据修正案添加的,过渡术语“由……组成”排除权利要求中未指定的任何元件、步骤或成分。过渡术语“基本上由......组成”将权利要求的范围限制为指定的材料或步骤以及那些不会对基本和新颖特征产生实质性影响的材料或步骤。所要求保护的本发明的实施方案在本文中固有地或明确地描述和实现。
此外,在本说明书中,大量引用了专利和印刷出版物。上述引用的每一个参考文献和印刷出版物均通过引用单独并入本文。
最后,应当理解,本文公开的本发明的实施例是对本发明原理的说明。可以采用的其他修改也在本发明的范围内。因此,作为示例而非限制,可以根据本文的教导来利用本发明的替代配置。因此,本发明不限于所显示和描述的。
本发明的实施例在不相互排斥的情况下可以彼此自由组合。
虽然已经示出和描述了本发明的优选实施例,但对本领域技术人员来说,可以对其进行不超出所附权利要求范围的修改是显而易见的。因此,本发明的范围仅由所附权利要求来限定。在一些实施方案中,本专利申请中呈现的附图是按比例绘制的,包括角度、尺寸比率等。在一些实施方案中,附图仅是代表性的并且权利要求不受附图尺寸的限制。在一些实施方案中,本文中使用短语“包括”描述的发明的描述包括可被描述为“基本上由...组成”或“由...组成”的实施方案,,并且因此满足了使用短语“基本上由...组成”或“由...组成”要求本发明的一个或多个实施方案的书面描述要求。
- 用于促进人毛发生长和/或抑制或延迟毛发脱落的化合物以及用于此类用途的组合物
- 用于检测和鉴别微生物培养样品中的微生物的方法、系统和装置
- 用于从福尔马林固定的石蜡包埋的生物样品中表征抗药性细菌的方法和组合物
- 用于抑制WNT信号传导的组合物和方法
- 包含酰基乳酰乳酸盐和二醇的抗微生物组合物以及利用该抗微生物组合物抑制微生物生长的方法
- 用于在医疗装置上抑制微生物薄膜的生长和增殖的抗微生物组合物
