一种血浆分离膜及其制备方法和应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及血液净化材料技术领域,具体而言,涉及一种血浆分离膜及其制备方法和应用。
背景技术
高血脂症是一种常见的疾病,系人体脂代谢失常所致,主要指血清总胆固醇、甘油三酯和低密度脂蛋白水平过高或高密度脂蛋白水平过低。高血脂症可加速动脉粥样硬化,一旦动脉赌塞,就会引起很多疾病,如心脑血管疾病、肾脏病和肝脏疾病等。传统的治疗方法是通过控制饮食和药物降低患者的低密度脂蛋白和胆固醇水平,但是口服降脂药很可能导致对肝的损害,通过血液净化能够有效降低低密度脂蛋白和胆固醇的浓度,从而降低对肝的损害,并起到较好的效果。
现有技术中采用血液净化对高血脂症的治疗方式主要包括血浆置换和血液灌流。但是使用血浆置换治疗高血脂症时,存在异体血浆的输入对人体产生的影响,如常见的过敏症状,同时会造成大量自身血浆有益物质的丢失。而使用双重血浆置换治疗高血脂症时,虽可减少血浆丢失,但由于低密脂蛋白等血脂成分分子量接近3×10
发明内容
本发明旨在解决现有的血浆分离膜对低密度脂蛋白的清除效果不佳的问题。
为解决上述问题,本发明第一方面提供了一种血浆分离膜的制备方法,包括如下步骤:
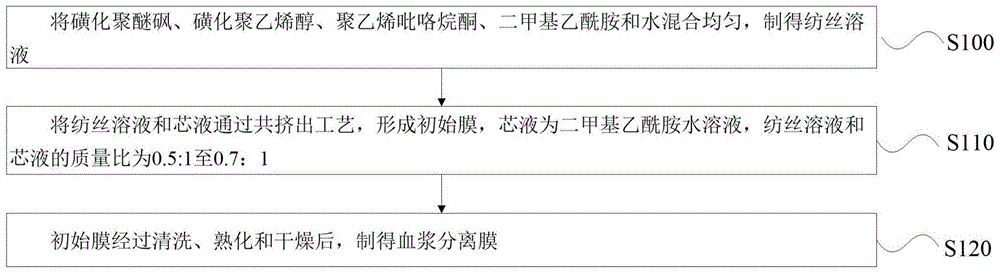
将磺化聚醚砜、磺化聚乙烯醇、聚乙烯吡咯烷酮、二甲基乙酰胺和水混合均匀,制得纺丝溶液;
将所述纺丝溶液和芯液通过共挤出工艺,形成初始膜,所述芯液为二甲基乙酰胺水溶液,所述纺丝溶液和所述芯液的质量比为0.5:1至0.7:1;
所述初始膜经过清洗、熟化和干燥后,制得血浆分离膜。
进一步地,所述磺化聚乙烯醇采用如下方法制备得到:
将聚乙烯醇溶胀后,制得溶胀后的聚乙烯醇,将所述溶胀后的聚乙烯醇与胺化剂混合均匀后,进行胺化反应,制得胺化聚乙烯醇;
将所述胺化聚乙烯醇溶胀后,制得溶胀后的胺化聚乙烯醇,所述溶胀后的胺化聚乙烯醇与第一磺化剂进行磺化反应,制得磺化聚乙烯醇。
进一步地,所述将所述溶胀后的聚乙烯醇与胺化剂混合均匀后,进行胺化反应,制得胺化聚乙烯醇,包括:
在0~4℃下,浸泡所述溶胀后的聚乙烯醇与所述胺化剂,浸泡完毕后,升温至20~30℃进行胺化反应,反应完毕后,降温至0~4℃析出晶体,将所述晶体经过纯洗、淋洗、真空干燥后,得到胺化聚乙烯醇。
进一步地,所述将所述胺化聚乙烯醇溶胀后,制得溶胀后的胺化聚乙烯醇,所述溶胀后的胺化聚乙烯醇与第一磺化剂进行磺化反应,制得磺化聚乙烯醇,包括:
将所述胺化聚乙烯醇研磨成粉末后,用二甲基乙酰胺溶胀所述胺化聚乙烯醇,制得溶胀后的胺化聚乙烯醇;
在50~60℃下,向所述溶胀后的胺化聚乙烯醇中逐滴滴加第一磺化剂,进行磺化反应,反应完毕后,将反应产物水洗至中性,并经过干燥后,得到磺化聚乙烯醇。
进一步地,所述胺化剂为二乙烯三胺、三甲胺、三乙烯四胺、四乙烯五胺中的一种或几种的组合;所述第一磺化剂为氯磺酸。
进一步地,所述磺化聚醚砜采用如下方法制备得到:
将聚醚砜溶解于二甲基亚砜中,通入氮气后,用活化剂活化聚醚砜,制得活化后的聚醚砜;
在70~80℃下,所述活化后的聚醚砜与第二磺化剂进行磺化反应,制得磺化聚醚砜。
进一步地,所述活化剂为NaOH,所述NaOH的加入量为所述聚醚砜质量的10~15%;所述第二磺化剂为丙磺酸内酯或丙磺酸乙酯,所述第二磺化剂的加入量为所述聚醚砜质量的5~7%。
进一步地,所述纺丝溶液包括:质量百分比为10~15%的磺化聚醚砜、质量百分比为1~2%的磺化聚乙烯醇、质量百分比为2~6%聚乙烯吡咯烷酮,以及质量百分比为72~84%的二甲基乙酰胺。
本发明第二方面提供了一种血浆分离膜,采用如第一方面任一项所述的制备方法制备得到,所述血浆分离膜的膜内径为67~77μm,膜壁厚为35~45μm,膜平均孔径0.029~0.075μm。
本发明第三方面提供了一种血浆成分分离器,包含如第一方面任一项所述的制备方法制备的血浆分离膜,或者如第二方面所述的血浆分离膜。
本发明所述的血浆分离膜的制备方法,以磺化聚乙烯醇和磺化聚醚砜作为纺丝液的主要组分,磺化聚乙烯醇同时具有胺基和磺酸基,两者协同作用,一方面能够提高血液的相容性,便于聚乙烯醇表面的活性位点特异性吸附更多的低密度脂蛋白,有利于提高血浆分离膜对低密度脂蛋白的清除效果,另一方面在血浆分离膜的表面增加胺基和磺酸基之后,改善了血浆分离膜的亲水性,能够减少蛋白在血浆分离膜表面的粘附,避免造成血浆分离膜的堵塞,影响血浆分离膜的性能;磺化聚醚砜能够提高与磺化聚乙烯醇的共混性能,使纺丝溶液更均匀的混合,且在聚乙烯醇的表面接枝磺酸基,能够改善聚乙烯醇的亲水性能,使亲水性物质稳定在血浆分离膜的表面,能够进一步提高血浆分离膜的血液相容性;以二甲基乙酰胺水溶液作为芯液,芯液和纺丝溶液中的溶剂相同,不仅有利于提高芯液和纺丝溶液的相容性以及提高初始膜的亲水性,还有利于纺丝溶液和芯液之间的相互扩散,形成结构稳定的血浆分离膜;此外,通过调控纺丝溶液和芯液的质量比,以及将纺丝溶液和芯液共挤出后依次经过空气段后再经过凝固浴,有利于对初始膜的壁厚、内径和膜孔等工艺参数进行调控,从而有利于降低血浆分离膜在透析过程中的阻力,有利于提高血液净化的效率。
本发明所述的血浆分离膜,有利于降低后续制得的血浆分离膜在透析过程中的阻力,有利于降低血浆分离膜在透析过程中的阻力,有利于提高血液净化的效率。
本发明所述的血浆成分分离器,能够特异性清除血浆中的低密度脂蛋白。
附图说明
图1为本发明实施例提供的血浆分离膜的制备方法的流程图;
图2为本发明实施例1提供的血浆分离膜的SEM图;
图3为本发明实施例2提供的血浆分离膜的SEM图;
图4为本发明实施例1提供的血浆分离膜的断面图。
具体实施方式
为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施例做详细的说明。
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
另外,术语“包含”、“包括”、“含有”、“具有”的含义是非限制性的,即可加入不影响结果的其它步骤和其它成分。如无特殊说明的,材料、设备、试剂均为市售。
此外,本发明虽然对制备中的各步骤进行了如S100、S110、S120等形式的描述,但此描述方式仅为了便于理解,如S100、S110、S120等形式并不表示对各步骤先后顺序的限定。
结合图1所示,本发明的实施例提供了一种血浆分离膜的制备方法,包括如下步骤:
步骤S100、将磺化聚醚砜、磺化聚乙烯醇、聚乙烯吡咯烷酮、二甲基乙酰胺和水混合均匀,制得纺丝溶液。
具体地,按如下质量百分比备料:10~15%的磺化聚醚砜、1~2%的磺化聚乙烯醇、2~6%聚乙烯吡咯烷酮、72~84%的二甲基乙酰胺,其余为水;将磺化聚乙烯醇溶解于二甲基乙酰胺、水和聚乙烯吡咯烷酮中,搅拌2~3h后得到澄清溶液,再向澄清溶液中加入磺化聚醚砜,持续搅拌形成均一的淡黄色溶液,真空脱泡后,制得纺丝溶液。
其中,磺化聚醚砜和磺化聚乙烯醇为纺丝溶液的主要成分,有利于后续制备得到可特异性结合血浆中低密度脂蛋白的血浆分离膜,聚乙烯吡咯烷酮为亲水改性剂,有利于提高纺丝溶液的亲水性,提高后续制备得到的血浆分离膜的亲水性,二甲基乙酰胺和水为溶剂,有利于各个组分之间的混溶,提高纺丝溶液的稳定性。将纺丝溶液中各组分的用量比例限定在一定的范围内,有利于对血浆分离膜的表面性能进行改善,改善后续制备得到的血浆分离膜的亲水性能,提高血浆分离膜的血液相容性;此外,还可避免纺丝溶液的黏度较大,不利于后期拉丝成膜。
其中,磺化聚乙烯醇采用如下方法制备得到:
S101、将聚乙烯醇溶胀后,制得溶胀后的聚乙烯醇,将溶胀后的聚乙烯醇与胺化剂混合均匀后,进行胺化反应,制得胺化聚乙烯醇。
具体地,将聚乙烯醇在水中充分溶胀后,将溶胀后的聚乙烯醇和胺化剂混合,在0~4℃下,将溶胀后的聚乙烯醇和胺化剂浸泡24h,浸泡完毕后,搅拌混合均匀,升温至20~30℃进行胺化反应,恒温反应8h后,降温至0~4℃,沉淀析出晶体,将晶体经过纯洗、淋洗、真空干燥后,得到胺化聚乙烯醇。
本实施例中,聚乙烯醇为中低聚合度的聚乙烯醇,具体地,聚乙烯醇的分子量为2.5×10
作为一种可选实施方式,胺化剂为二乙烯三胺、三甲胺、三乙烯四胺、四乙烯五胺中的一种或几种的组合,胺化剂和聚乙烯醇的质量比为1:10,由此,通过选用上述几种物质作为胺化剂,并限定胺化剂和聚乙烯醇的质量比在上述范围内,有利于在聚乙烯醇的表面接枝较多的胺基。
作为一种可选实施方式,纯洗包括:将晶体经过大量的纯化水进行清洗,清洗过滤未反应的胺化剂,直至滤液呈中性,且无明显的异味。淋洗包括:用99%的无水乙醇或甲醇淋洗晶体,淋洗所用的无水乙醇或甲醇的体积至少为聚乙烯醇体积的4倍。
本实施例中,通过将聚乙烯醇溶胀后,再将溶胀后的聚乙烯醇浸泡于胺化剂中,有利于对聚乙烯醇表面的活性位点进行活化,后续在进行胺化反应时,更利于胺基接枝至聚乙烯醇的表面,反应完毕后,降温至0~4℃有利于析出更多的反应产物,从而有利于提高胺化聚乙烯醇的产量。
S102、将胺化聚乙烯醇溶胀后,制得溶胀后的胺化聚乙烯醇,溶胀后的胺化聚乙烯醇与第一磺化剂进行磺化反应,制得磺化聚乙烯醇。
具体地,将胺化聚乙烯醇研磨成粉末后,将二甲基乙酰胺和胺化聚乙烯醇混合,在0℃下,用二甲基乙酰胺充分溶胀胺化聚乙烯醇,制得溶胀后的胺化聚乙烯醇;升温至50~60℃,向溶胀后的胺化聚乙烯醇中逐滴滴加第一磺化剂,滴加完毕后,继续恒温反应4~6h,使胺化聚乙烯醇充分磺化,反应完毕后,将反应产物水洗至中性,并经过干燥后,得到磺化聚乙烯醇。
作为一种可选实施方式,第一磺化剂为氯磺酸,氯磺酸的反应活性较高,反应温度温和,且对反应条件要求较低,由此,有利于提高磺化反应的效率,并提高磺化反应的安全性。
第一磺化剂的用量为胺化聚乙烯醇质量的3~7%,由此,通过将第一磺化剂的用量限定在上述范围内,使第一磺化剂可以只对部分胺基进行磺化,而未对全部胺基进行磺化,从而使磺化聚乙烯醇的表面能够同时具有胺基和磺酸基,有利于提高后续制得的血浆分离膜对低密度脂蛋白的清除效果。
作为一种可选实施方式,第一磺化剂的滴加速度为1滴/min,搅拌速度为100r/min至150r/min,由此,有利于控制磺化反应速率,避免聚乙烯醇在局部范围内过度反应,影响磺化聚乙烯醇表面的磺酸基的量。
本实施例中,制得的磺化聚乙烯醇的分子结构如下所示:
由上述分子结构可以看出,本实施例制备得到的磺化聚乙烯醇既含有胺基,还含有磺酸基。本实施例中通过先进行胺化反应制得胺化聚乙烯醇,再将胺化聚乙烯醇进行磺化反应制得磺化聚乙烯醇,能够在聚乙烯醇的表面接枝较多的胺基,提高对低密度脂蛋白的清除效果,对部分胺基进行磺化,使聚乙烯醇的表面具有磺酸基,能够改善聚乙烯醇的亲水性能,提高血浆分离膜的血液相容性;本实施例制得的磺化聚乙烯醇同时具有胺基和磺酸基,两者协同作用,一方面能够提高血液的相容性,便于聚乙烯醇表面的活性位点捕获更多的低密度脂蛋白,另一方面能够减少蛋白在血浆分离膜表面的粘附,避免造成血浆分离膜的堵塞,影响血浆分离膜的性能。
磺化聚醚砜采用如下方法制备得到:
将聚醚砜溶解于二甲基亚砜中,通入氮气后,用活化剂活化聚醚砜,制得活化后的聚醚砜;在70~80℃下,活化后的聚醚砜与第二磺化剂进行磺化反应,制得磺化聚醚砜。
具体地,将聚醚砜溶解于二甲基亚砜中,通入氮气后,升温至100℃,使聚醚砜完全溶解,再加入活化剂活化2h,制得活化后的聚醚砜;将活化后的聚醚砜与第二磺化剂混合均匀后,在80℃下反应12h,反应完毕后,冷却至常温,将反应液倒入无水乙醇或甲醇中进行沉淀,过滤后得到沉淀物质,用无水乙醇或甲醇淋洗沉淀物质,再将沉淀物质真空干燥至恒重,制得磺化聚醚砜。
作为一种可选实施方式,活化剂为NaOH,NaOH的加入量为聚醚砜质量的10~15%,由此,有利于对聚醚砜上的活性位点进行活化,便于后续接枝磺酸基。
作为一种可选实施方式,第二磺化剂为丙磺酸内酯或丙磺酸乙酯,第二磺化剂的加入量为聚醚砜质量的5~7%。由此,通过第二磺化剂对聚醚砜进行磺化处理,并控制第二磺化剂的用量,使聚醚砜表面接枝的磺酸基控制在合适的范围内,有利于提高聚醚砜和磺化聚乙烯醇的共混性能,使纺丝溶液混合的更均匀,有利于提高纺丝溶液的稳定性,从而有利于提高后续制备的血浆分离膜的质量。
步骤S110、将纺丝溶液和芯液通过共挤出工艺,形成初始膜,芯液为二甲基乙酰胺水溶液,纺丝溶液和芯液的质量比为0.5:1至0.7:1。
具体地,将纺丝溶液和芯液分别经过离心泵和计量泵同时从喷丝头挤出,根据双扩散的原理,纺丝溶液中的溶剂向芯液扩散,芯液向纺丝溶液扩散,两者相互扩散,再依次经过空气段和凝固浴,形成初生丝,再将初生丝依次经过水洗槽和漂洗槽后,形成初始膜。
本实施例中,芯液为质量百分比为60~65%的二甲基乙酰胺水溶液,通过选用二甲基乙酰胺水溶液作为芯液,有利于提高芯液和纺丝溶液的相容性,也有利于提高初始膜的亲水性。
本实施例中通过调控纺丝溶液和芯液的质量比,以及将纺丝溶液和芯液共挤出后依次经过空气段后再经过凝固浴,有利于对初始膜的壁厚、内径和膜孔等工艺参数进行调控,从而有利于降低后续制得的血浆分离膜在透析过程中的阻力,有利于提高血液净化的效率。
步骤S120、初始膜经过清洗、熟化和干燥后,制得血浆分离膜。
具体地,用水洗定型之后的初始膜,水洗12h之后,于50~60℃的水中熟化2h,再于80℃的微波干燥箱内进行干燥,得到血浆分离膜。
通过水洗能够去除血浆分离膜中的添加剂和溶剂等化学物质,通过熟化能够尽可能的将添加剂和溶剂等化学物质浸出,这些化学物质的残留量对血液相容性有极大的影响,通过干燥去除血浆分离膜中的水分,能够消除内应力,提高血浆分离膜的尺寸的稳定性。
本实施例提供的血浆分离膜的制备方法,以磺化聚乙烯醇和磺化聚醚砜作为纺丝液的主要组分,磺化聚乙烯醇同时具有胺基和磺酸基,两者协同作用,一方面能够提高血液的相容性,便于聚乙烯醇表面的活性位点特异性吸附更多的低密度脂蛋白,有利于提高血浆分离膜对低密度脂蛋白的清除效果,另一方面在血浆分离膜的表面增加胺基和磺酸基之后,改善了血浆分离膜的亲水性,能够减少蛋白在血浆分离膜表面的粘附,避免造成血浆分离膜的堵塞,影响血浆分离膜的性能;磺化聚醚砜能够提高与磺化聚乙烯醇的共混性能,使纺丝溶液更均匀的混合,且在聚乙烯醇的表面接枝磺酸基,能够改善聚乙烯醇的亲水性能,使亲水性物质稳定在血浆分离膜的表面,能够进一步提高血浆分离膜的血液相容性;以二甲基乙酰胺水溶液作为芯液,芯液和纺丝溶液中的溶剂相同,不仅有利于提高芯液和纺丝溶液的相容性以及提高初始膜的亲水性,还有利于纺丝溶液和芯液之间的相互扩散,形成结构稳定的血浆分离膜;此外,通过调控纺丝溶液和芯液的质量比,以及将纺丝溶液和芯液共挤出后依次经过空气段后再经过凝固浴,有利于对初始膜的壁厚、内径和膜孔等工艺参数进行调控,从而有利于降低血浆分离膜在透析过程中的阻力,有利于提高血液净化的效率。
本实施例第二方面提供了一种血浆分离膜,该血浆分离膜采用第一方面所述的制备方法制备得到。该血浆分离膜的膜内径为72±5μm,膜壁厚为40±5μm,膜平均孔径为0.052±0.023μm,即该血浆分离膜的膜内径为67~77μm,膜壁厚为35~45μm,膜平均孔径为0.029~0.075μm。由此,将血浆分离膜的工艺参数控制在上述范围内,有利于降低后续制得的血浆分离膜在透析过程中的阻力,有利于降低血浆分离膜在透析过程中的阻力,有利于提高血液净化的效率。
本实施例第三方面提供了一种血浆成分分离器,该血浆成分分离器包含了上述血浆分离膜,该血浆成分分离器能够特异性清除血浆中的低密度脂蛋白。
为了对本发明进行进一步详细说明,下面将结合具体实施例对本发明进行进一步说明。本发明中的实施例中所使用的实验方法如无特殊说明,均为常规方法;本发明中的实施例中所用的材料、试剂等,如无特殊说明,均为市场购买所得,其中,本发明中的实施例中所用的水均为纯化水或者血液透析用水。
实施例1
本实施例提供了一种血浆分离膜的制备方法,包括如下步骤:
(1)磺化聚乙烯醇的制备:
称取50g中聚合度的聚乙烯醇(分子量2.5×10
将胺化聚乙烯醇固体,使用研磨机研磨至细粉,在40~50℃鼓风烘箱中干燥至恒重,然后将干燥后的胺化聚乙烯醇置于盛有DMAC(二甲基乙酰胺)的三口瓶中,在0℃下充分溶胀24h,缓慢搅拌,逐渐升温至60℃,然后向三口瓶中逐滴滴加氯磺酸,氯磺酸加入量为胺化聚乙烯醇质量的3%wt,滴加速度控制在1滴/min,控制搅拌速度在100r/min至150r/min,滴加完毕后,继续恒温反应4h,使得胺化聚乙烯醇充分磺化。反应结束后,过滤回收反应溶剂,将过滤后的聚乙烯醇固体用纯化水清洗至中性,并于40~60℃恒温干燥至恒重,得到磺化聚乙烯醇。
(2)磺化聚醚砜的制备:
将500g的聚醚砜溶解于2L DMSO(二甲基亚砜)中,通氮气加热至100℃,均匀搅拌至聚醚砜完全溶解,缓慢加入聚醚砜质量10%wt的NaOH活化2h,向活化后的聚醚砜中缓慢加入丙磺酸内酯,丙磺酸内酯的加入量为聚醚砜质量的5%wt,在80℃反应12h,反应完毕后,冷却至常温,将反应液倒入一定量的无水乙醇中进行沉淀,将沉淀物质过滤,再用无水乙醇淋洗沉淀物质,将淋洗后的沉淀物质在40℃真空干燥至恒重,制得磺化聚醚砜。
(3)纺丝液的制备:
按如下质量百分比备料:15%的步骤(2)中的磺化聚醚砜、2%的步骤(1)中的磺化聚乙烯醇、6%聚乙烯吡咯烷酮、72%的二甲基乙酰胺,加水补充至100%;将磺化聚乙烯醇溶解于二甲基乙酰胺、水和聚乙烯吡咯烷酮中,搅拌速度500r/min,搅拌2~3h后得到澄清溶液,再向澄清溶液中加入磺化聚醚砜,持续搅拌直至形成均一的淡黄色溶液,真空脱泡后,制得纺丝溶液。
(4)初始膜的制备:以质量百分比为60%的二甲基乙酰胺水溶液作为芯液,将步骤(3)中的纺丝溶液和芯液分别经过离心泵和计量泵同时从喷丝头挤出,通过20cm至25cm的空气浴,再经过凝固浴后形成初生丝,再将初生丝依次经过水洗槽和漂洗槽后,形成初始膜。
(5)血浆分离膜的制备:用水洗定型之后的初始膜,水洗12h之后,截取40cm长的初始膜20束至30束,于50~60℃的水中熟化2h,再于80℃的微波干燥箱内进行干燥,得到血浆分离膜,记为样品一。
实施例2
本实施例提供了一种血浆分离膜的制备方法,包括如下步骤:
(1)磺化聚乙烯醇的制备:
称取50g低聚合度的聚乙烯醇(分子量2.5×10
将胺化聚乙烯醇固体,使用研磨机研磨至细粉,在40~50℃鼓风烘箱中干燥至恒重,然后将干燥后的胺化聚乙烯醇置于盛有DMAC的三口瓶中,在0℃下充分溶胀24h,缓慢搅拌,逐渐升温至60℃,然后向三口瓶中逐滴滴加氯磺酸,氯磺酸加入量为胺化聚乙烯醇质量的5%wt,滴加速度控制在1滴/min,控制搅拌速度在100r/min至150r/min,滴加完毕后,继续恒温反应6h,使得胺化聚乙烯醇充分磺化。反应结束后,过滤回收反应溶剂,将过滤后的聚乙烯醇固体用纯化水清洗至中性,并于40~60℃恒温干燥至恒重,得到磺化聚乙烯醇。
(2)磺化聚醚砜的制备:
将500g的聚醚砜溶解于2L DMSO中,通氮气加热至100℃,均匀搅拌至聚醚砜完全溶解,缓慢加入聚醚砜质量10%wt的NaOH活化2h,向活化后的聚醚砜中缓慢加入丙磺酸内酯,丙磺酸内酯的加入量为聚醚砜质量的7%wt,在80℃反应12h,反应完毕后,冷却至常温,将反应液倒入一定量的甲醇中进行沉淀,将沉淀物质过滤,再用甲醇淋洗沉淀物质,将淋洗后的沉淀物质在40℃真空干燥至恒重,制得磺化聚醚砜。
(3)纺丝液的制备:
按如下质量百分比备料:10%的步骤(2)中的磺化聚醚砜、1%的步骤(1)中的磺化聚乙烯醇、2%聚乙烯吡咯烷酮、84%的二甲基乙酰胺,加水补充至100%;将磺化聚乙烯醇溶解于二甲基乙酰胺、水和聚乙烯吡咯烷酮中,搅拌速度500r/min,搅拌2~3h后得到澄清溶液,再向澄清溶液中加入磺化聚醚砜,持续搅拌直至形成均一的淡黄色溶液,真空脱泡后,制得纺丝溶液。
(4)初始膜的制备:以质量百分比为65%的二甲基乙酰胺水溶液作为芯液,将步骤(3)中的纺丝溶液和芯液分别经过离心泵和计量泵同时从喷丝头挤出,通过20cm至25cm的空气浴,再经过凝固浴后形成初生丝,再将初生丝依次经过水洗槽和漂洗槽后,形成初始膜。
(5)血浆分离膜的制备:用水洗定型之后的初始膜,水洗12h之后,截取40cm长的初始膜20束至30束,于50~60℃的水中熟化2h,再于80℃的微波干燥箱内进行干燥,得到血浆分离膜,记为样品二。
测试实施例1和实施例2中制得的血浆分离膜的各项工艺参数,测试结果如表1所示。
表1
采用SEM观测实施例1和实施例2中制得的血浆分离膜,获得血浆分离膜的外表面孔径尺寸及其分布参数,得到如图2至图4所示的SEM图,其中,图2和图3均在3.2HV加速电压下拍摄的血浆分离膜外表面的SEM图,图4为断面图,采用Matlab程序进行孔结构统计分析,可知实施例1和实施例2中的血浆分离膜的工艺参数在表1的范围内,且由图2和图3可以看出血浆分离膜的表面具有较多的孔隙,有利于降低对血浆进行透析,吸附血浆中的低密度脂蛋白,并提高血液净化的效率。
采用红外光谱分析实施例1和实施例2中制得的血浆分离膜,发现样品一和样品二在3300cm
依据YY0464-2019《一次性使用空心纤维血浆分离器和血浆成分分离器》和ISO8637-3《Extracorporeal systems for blood purification-Part3:Plasmafilters》对实施例1和实施例2中制得的血浆分离膜进行蛋白筛选系数测试,测试结果如表2所示。
表2
由表2可以看出,样品一和样品二的蛋白筛选系数较低,说明样品一和样品二对血浆中的有益成分清除较少,能够有效的避免血浆中的有益成本丢失。
以市售的血浆成分分离器作为对照品,并将包含实施例1的血浆分离膜的血浆成分分离器作为样品一,将包含实施例2的血浆分离膜的血浆成分分离器作为样品二,体外模拟血浆分离过程,通过观察外部添加低密脂蛋白的血浆中低密脂蛋白的浓度变化,检测样品对低密脂蛋白的清除能力,检测结果如表3所示。
表3
由表3可以看出,在240min时,包含实施例1的血浆分离膜的血浆成分分离器和包含实施例2的血浆分离膜的血浆成分分离器对低密脂蛋白的清除率约为35%,远高于对照品的血浆成分分离器对低密脂蛋白的清除率,且在试验过程中,实施例1的血浆分离膜和实施例2的血浆分离膜跨膜压压力稳定,说明在血浆处理过程中,未发生血浆分离膜的膜孔堵塞的问题,上述结果说明,本实施例中提供的血浆分离膜和包含血浆分离膜的血浆成分分离器,具备优异的低密脂蛋白清除能力,表现出优异的血液净化功能。
虽然本公开披露如上,但本公开的保护范围并非仅限于此。本领域技术人员在不脱离本公开的精神和范围的前提下,可进行各种变更与修改,这些变更与修改均将落入本发明的保护范围。
