一种靶向甲型流感病毒HA蛋白的广谱抗体
文献发布时间:2023-06-19 09:27:35
技术领域
本发明属于细胞免疫学、基因工程领域,涉及一种靶向甲型流感病毒HA蛋白的广谱抗体FHA3。
背景技术
流感病毒(Influenza Virus)属于正粘病毒科(Ortho myxo viridae),根据流感病毒内部核蛋白(Nucleoprotein,NP)和基质蛋白(Matrix Protein,M1)的抗原性可以分为甲型(A),乙型(B),丙型(C)流感病毒。目前最新的报道提出存在丁(D)型流感病毒(CollinEA,etl.Cocirculation of Two Distinct Genetic and Antigenic Lineages ofProposed Influenza D Virus in Cattle.Journal of Virology 2015,89(2):1036-1042.)。丙型流感病毒只造成轻微的上呼吸道感染,甲型和乙型流感病毒则会导致很多严重的病症,包括下呼吸道感染,肺炎,脑膜炎等,每年全球季节性的流感暴发感染约6亿人。其中,甲型流感病毒对人类健康危害最为严重(Baigent SJ,McCauley JW:Influenza typeA in humans,mammals and birds:determinants of virus virulence,host-range andinterspecies transmission.Bioessays 2003,25(7):657-671.),除每年季节性暴发感染大量人群,偶尔的大流行更会造成灾难性的后果。
甲型流感病毒是具有包膜的单负链RNA病毒,其基因组包含8条独立的基因节段(segment),总长度约13kb,可编码多达16个蛋白。血凝素节段(Hemagglutinin,HA)编码流感病毒识别宿主细胞表面受体的糖蛋白HA。HA蛋白是甲型流感病毒表面丰度最高的糖蛋白,由头部和颈部两个部分构成,负责识别受体进入宿主细胞,并介导病毒包膜和宿主细胞内体(endosome)的膜融合过程,从而使流感病毒将核酸释放到宿主细胞中。HA蛋白是流感病毒最主要的表面抗原,是宿主免疫反应的主要靶点。
目前,我国针对流感病毒的检测主要采用传统生物学方法、常规RT-PCR技术结合一代测序技术、以及荧光定量RT-PCR方法。这些方法要么费时费力,无法满足快速检测的需求;要么成本过高,无法满足大批量筛选的需求。而且由于病毒的持续变异,亟待系统筛选和鉴定流行毒株差异性诊断抗原标识,以及治疗流感病毒感染引起的疾病的新技术和产品。因此,为了能够快速检测病毒以及治疗流感病毒感染引起的疾病,针对流感病毒开展抗病毒HA蛋白单克隆抗体的制备具有重要的意义。
发明内容
为了弥补现有技术的不足,本发明的目的之一,在于提供一种抗流感病毒的广谱抗体。
本发明的目的之二,在于提供一种诊断流感病毒感染疾病的手段及产品。
本发明的目的之三,在于提供一种治疗流感病毒感染疾病的手段和药物组合物。
为了实现上述目的,本发明采用如下技术方案:
本发明的第一方面提供了一种抗流感病毒的广谱单克隆抗体,所述单克隆抗体包含三个CDR的重链可变区和三个CDR的轻链可变区;其中,所述重链可变区CDR1、CDR2、CDR3的氨基酸序列如SEQ ID NO.1、2、3所示,轻链可变区CDR1、CDR2、CDR3的氨基酸序列如SEQID NO.10、11、12所示。
进一步,所述重链可变区还包括重链可变区框架区FR1、FR2、FR3和FR4;轻链可变区还包括轻链可变区框架区FR1、FR2、FR3和FR4,其中,重链可变区框架区FR1、FR2、FR3和FR4的氨基酸序列如SEQ ID NO.4、5、6、7所示;轻链可变区框架区FR1、FR2、FR3和FR4的氨基酸序列如SEQ ID NO.13、14、15、16所示。
进一步,所述重链可变区的氨基酸序列如SEQ ID NO.8所示,所述轻链可变区的氨基酸序列如SEQ ID NO.17所示。
进一步,所述单克隆抗体包含抗体重链恒定区和/或抗体轻链恒定区的全部或者部分。
在本发明中,所述单克隆抗体被命名为FHA3,该抗体特异性靶向流感病毒HA蛋白颈部保守序列的人源性抗体。
本发明的第二方面提供了一种核酸分子,所述核酸分子包括编码本发明第一方面所述的单克隆抗体的核苷酸序列,其中,编码抗体重链可变区的核苷酸序列如SEQ ID NO.9所示,编码轻链可变区的核苷酸序列如SEQ ID NO.18所示。
编码本发明的抗体分子的DNA序列可由本领域技术人员熟知的方法来获得。例如,编码部分或全部抗体重链和轻链的DNA序列可按需要从确定的DNA序列或基于对应的氨基酸序列来合成。
本发明的第三方面提供了一种表达载体,所述表达载体包括本发明第二方面所述的核酸分子。
本发明中的表达载体包括(但不限于)由Celltrion Inc.(韩国)生产的MarEx表达载体;市场上可广泛买到的pCDNA载体;F、R1、RP1、Col、pBR322、ToL、Ti载体;粘粒;噬菌体,诸如λ噬菌体、λ形噬菌体、M13噬菌体、Mu噬菌体、P1噬菌体、P22噬菌体、Qβ噬菌体、T-偶数噬菌体、T2噬菌体、T4噬菌体、T7噬菌体等;植物病毒。本发明中可使用本领域技术人员已知的各种表达载体的任意一种,且表达载体的选择依赖于所选择的宿主细胞的性质。宿主细胞中载体的导入可通过(但并不限于)磷酸钙转染、病毒感染、DEAE-葡聚糖介导的转染、脂质体转染或电穿孔实现,且本领域的任何技术人员可选择和使用适用于所用的表达载体和宿主细胞的导入方法。优选地,上述载体包含一种或多种选择标记,但并不限于此,且还可使用不包含选择标记的载体。选择标记的选择可依赖于选择的宿主细胞(如本领域的技术人员公知的),但这对于本发明并不是关键性的。
为了促进本发明的核酸分子的纯化,可将标签(tag)序列插入表达载体中。标签的实例包括(但不限于)六个组氨酸标签、myc标签或FLAG标签。可在本发明中使用本领域的技术人员已知的促进纯化的任何标签。
本发明的第四方面提供了一种宿主细胞,所述宿主细胞包括本发明第二方面所述的核酸分子,或包含本发明第三方面所述的表达载体。
在本发明中,任何适当的宿主细胞/载体系统可用于编码本发明的抗体分子的DNA序列的表达。可使用细菌(例如大肠杆菌)及其它微生物系统,或还可使用真核生物(例如哺乳动物)宿主细胞表达系统。上述细胞包含(但并不限于)哺乳动物细胞、植物细胞、昆虫细胞、真菌细胞或细菌来源的细胞。作为哺乳动物细胞,可优选使用选自(但并不限于)由CHO细胞、F2N细胞、CSO细胞、BHK细胞、Bowes黑色素瘤细胞、HeLa细胞、911细胞、AT1080细胞、A549细胞、HEK293细胞和HEK293T细胞组成的组中的一种作为宿主细胞。在本领域中可使用本领域的技术人员已知的可用作哺乳动物宿主细胞的任何细胞。
本发明的第五方面提供了一种药物组合物,所述药物组合物包括本发明第一方面所述的单克隆抗体。
进一步,所述抗体还包括药学上可接受的载体。
本发明的药物组合物还可包括一种或多种其它治疗剂。治疗剂可包含抗体、小分子、有机或无机化合物、酶、多核苷酸序列等。
本发明的第六方面提供了如下任一项所述的应用,包括:
1)本发明第一方面所述的单克隆抗体在制备诊断流感病毒感染疾病的产品中的应用;
2)本发明第一方面所述的单克隆抗体在制备治疗流感病毒感染疾病的药物组合物中的应用;
3)本发明第一方面所述的单克隆抗体在制备防治流感病毒感染的药物组合物中的应用;
4)本发明第二方面所述的核酸分子在制备治疗流感病毒感染疾病的药物组合物中的应用;
5)本发明第三方面所述的表达载体在制备治疗流感病毒感染疾病的药物组合物中的应用;
6)本发明第四方面所述的宿主细胞在制备治疗流感病毒感染疾病的药物组合物中的应用;
7)本发明第五方面所述的药物组合物在制备治疗流感病毒感染疾病的产品中的应用。
进一步,所述流感病毒为甲型流感病毒。
进一步,所述甲型流感病毒包括H1N1,H3N2,H5N1、H7N9。
进一步,1)中所述产品包括试剂盒、试纸、芯片等。其中,所述芯片包括蛋白质芯片;所述蛋白质芯片包括固相载体以及固定在固相载体的上述单克隆抗体或其片段;所述蛋白免疫检测试剂盒;所述蛋白免疫检测试剂盒包括上述单克隆抗体或其片段。
在本发明中,单克隆抗体涵盖与所述抗体的氨基酸序列或者编码该抗体的任何核苷酸序列具有一定程度的序列一致性或序列同源性的序列,本发明中,“同源性”可等同于“一致性”。
本领域技术人员还将理解的是,抗体可以进行各种翻译后修饰。这些修饰的类型和程度常常取决于用于表达抗体的宿主细胞系以及培养条件。这样的修饰可以包括在糖基化、甲硫氨酸氧化、哌嗪二酮形成、天冬氨酸异构化和天冬酰胺脱酰胺化中的变化。常见修饰是由于羧肽酶的作用导致的羧基末端碱性残基(诸如赖氨酸或精氨酸)的缺失。
本发明还包括将上述抗体的氨基酸序列通过对氨基酸残基的添加、删除、修改形成所得到的包括人源与非人源抗体,并具有与FHA3抗体相同功能或改造及优化的一切抗体。缺失、取代、插入或添加可以同时发生,并且被取代、插入或添加的氨基酸可以是天然类型或非天然类型的。
本发明的CDR可包括变体,例如当将本文中所公开的CDR回复突变为不同的框架区时。通常,个体变体CDR与本文所述序列的氨基酸同一性为至少70%或80%,更典型地具有优选至少75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%和几乎100%的渐增的同一性。
如本发明所用,“同一性”指示在比对的序列的任何特定位置上,序列之间的氨基酸残基是相同的。如本文所用,“相似性”指示在比对的序列的任何特定位置上,序列之间的氨基酸残基为相似类型。例如,亮氨酸可被置换成异亮氨酸或缬氨酸。可通常彼此置换的其它氨基酸包括(但不限于):苯丙氨酸、酪氨酸和色氨酸(具有芳族侧链的氨基酸),赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸),天冬氨酸和谷氨酸(具有酸性侧链的氨基酸),天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸),以及半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸)。
通常,一个蛋白质中一个或多个氨基酸的修饰不会影响蛋白质的功能。本领域技术人员会认可改变单个氨基酸或小百分比的氨基酸或对氨基酸序列的个别添加、缺失、插入、替换是保守修饰,其中蛋白质的改变产生具有相似功能的蛋白质。提供功能相似的氨基酸的保守替换表是本领域公知的。
可利用取代、缺失、插入或其任意组合来实现最终的衍生物或变体。通常,这些变化在几个氨基酸上进行以使分子的改变最小化,特别是抗原结合蛋白的免疫原性和特异性。然而,在某些情况下可以容忍更大的变化。氨基酸取代通常是单个碱基的;插入通常将为大约一个至大约二十个氨基酸残基的数量级,虽然可能容忍显著更大的插入。缺失的范围为大约一个至大约二十个氨基酸残基,虽然在一些情况下,缺失可以大得多。
本发明公开的抗体和片段从宿主细胞以良好水平表达。因此,抗体和/或结合片段的性质适合用于商业规模的表达。
在本发明中,药物组合物包含本发明的上述单克隆抗体或抗体片段作为活性成分。包含本发明的单克隆抗体或其抗体片段或其结合物的药物组合物可以只包含抗体或其抗体片段或其结合物作为活性成分。一般来说,优选情况下,将所述药物组合物制备成通过制药学技术领域中公知的适合方法、通过将其与一种或多种可药用载体混合而生产的药物制剂。本发明的药物组合物可以使用不同的添加剂进行制备,例如缓冲剂、稳定剂、抑菌剂、等渗剂、螯合剂、pH控制剂及表面活性剂。本发明所述药物组合物可以通过任何途径给予受体。
抗体片段的例子包括Fab、Fab′、F(ab′)2和Fv片段;双抗体;线性抗体;单链抗体分子;及由抗体片段形成的多特异性抗体。“Fab”是指含有一条轻链的可变区和恒定区和一条重链的可变区和恒定区经二硫键结合起来的抗体分子的一部分;“Fab′”是指包含了部分铰链区的Fab片段;“F(ab′)2”指的是Fab’的二聚体;“Fv”指的是含有抗体重链可变区、轻链可变区并具有全部抗原结合位点的最小抗体片段。
本发明的药物组合物在制造和储存条件下必须是无菌和稳定的。在用于制备无菌可注射溶液的无菌粉末的情况下,制备的优选方法是真空干燥和冷冻干燥,真空干燥和冷冻干燥从活性成分和其它期望成分的预先无菌过滤过的溶液产生活性成分和其它期望成分的粉末。可选择地,本发明的组合物可在溶液中,且在递送之前或递送时可加入和/或混合适当的药学上可接受的赋形剂以提供可注射的单位剂型。优选地,本发明中使用的药学上可接受的赋形剂适用于高药物浓度,可保持适当的流动性,且如果需要可延迟吸收。
本发明的药物组合物的最佳给药途径的选择会受到几个因素的影响,包含组合物中活性分子的物理化学性质、临床表现的紧迫性和活性分子的血浆浓度与期望的治疗效果之间的关系。例如,可与载剂一起制备本发明的单克隆抗体,其中载剂将保护它们以防止快速释放(诸如控释制剂),该载剂包含植入物、透皮贴剂和微胶囊化的递送系统。可在本发明中使用生物可降解的、生物相容的聚合物,诸如乙烯醋酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚正酯和聚乳酸。进一步地,单克隆抗体可包被有防止抗体失活的材料或化合物、或与这样的材料或化合物同时给药。例如,单克隆抗体可与适当的载剂(例如脂质体或稀释剂)一起给药。
本发明的药物组合物的给药途径可分成口服给药和胃肠外给药。优选的给药途径是静脉注射,但并不限于此。
在本发明中,用于检测或测定流感病毒的量的方法可以是任何已知方法。例如,它包括免疫检测或测定方法。免疫检测或测定方法是使用标记的抗原或抗体检测或测定抗体量或抗原量的方法。免疫检测或测定方法的实例包括放射性物质标记的免疫抗体方法(RIA)、酶免疫测定法(EIA或ELISA)、荧光免疫测定法(FIA)、发光免疫测定法、蛋白质免疫印迹法、物理化学方法等。
在本发明中,对于流感病毒相关的疾病没有限制,只要它是与表达流感病毒的相关的疾病即可。
在本发明中,流感病毒感染疾病可以通过用本发明的单克隆抗体或抗体片段检测或测定表达流感病毒的细胞来诊断。根据所需的诊断方法,含有本发明的单克隆抗体或其抗体片段或其结合物的诊断剂还可以含有用于执行抗原-抗体反应的试剂或用于检测反应的试剂。用于执行抗原-抗体反应的试剂包括缓冲剂、盐等。用于检测的试剂包括通常用于免疫检测或测定方法的试剂,例如识别所述单克隆抗体、其抗体片段或其结合物的标记的第二抗体和与所述标记对应的底物等。
本文术语“单克隆抗体”在用于本文时指从一群基本上同质的抗体获得的抗体,即构成群体的各个抗体相同和/或结合相同表位,除了生产单克隆抗体的过程中可能产生的可能变体外,此类变体一般以极小量存在。此类单克隆抗体典型的包括包含结合靶物的多肽序列的抗体,其中靶物结合多肽序列是通过包括从众多多肽序列中选择单一靶物结合多肽序列在内的过程得到的。例如,选择过程可以是从众多克隆诸如杂交瘤克隆、噬菌体克隆或重组DNA克隆的集合中选择独特克隆。应当理解,选定的靶物结合序列可进一步改变,例如为了提高对靶物的亲和力、将靶物结合序列人源化、提高其在细胞培养物中的产量、降低其在体内的免疫原性、创建多特异性抗体等,而且包含改变后的靶物结合序列的抗体也是本发明的单克隆抗体。与典型的包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物不同,单克隆抗体制备物的每种单克隆抗体针对抗原上的单一决定簇。在它们的特异性以外,单克隆抗体制备物的优势在于它们一般未受到其它免疫球蛋白的污染。修饰语“单克隆”指示抗体从基本上同质的抗体群获得的特征,不应解释为要求通过任何特定方法来生成抗体。
本发明的优点和有益效果:
本发明提供了一种抗流感病毒的抗体,该抗体特异性结合HA蛋白、亲和力高、稳定性好,能在较低剂量结合甲型流感病毒。
本发明的抗体能够有效的抑制流感病毒,为相关病毒感染疾病提供了一种治疗手段。
附图说明
图1是FHA3抗体的SDS-PAGE电泳图;
图2是ELISA检测FHA3抗体的抗原结合特异性图;
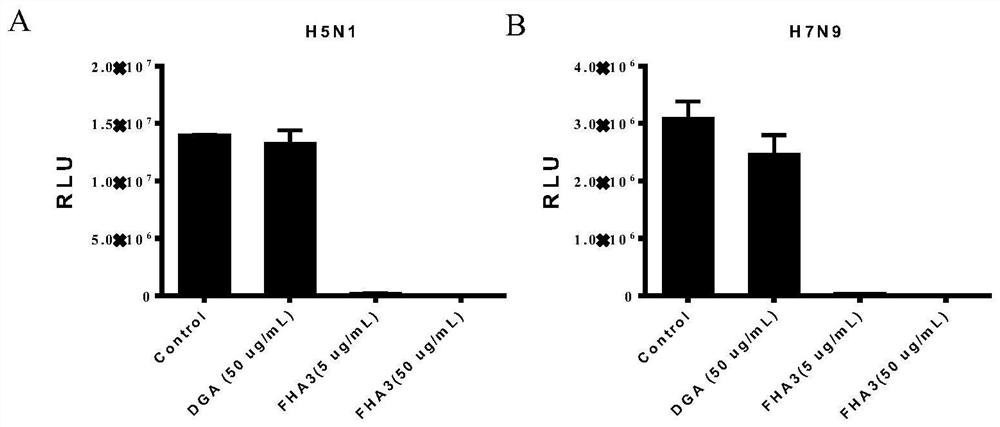
图3是FHA3抗体对甲型流感病毒的中和活性检测结果图,其中,图A是H5N1,图B是H7N9。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。
以下实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1筛选抗HA蛋白抗体
1、构建噬菌体抗体库
以计算机设计的合成抗体库为模板,通过多聚酶链反应(PCR)分别扩增抗体可变区的重链(VH)库和轻链(VL)库基因;插入噬菌体载体后表达scFv单链抗体库,scFv由VH和VL之间通过人工接头相连。
2、抗流感病毒H1N1,H3N2,H5N1以及H7N9抗体的筛选
(1)展示的噬菌体库依次黏附H1N1,H3N2,H5N1以及H7N9蛋白;
(2)反复洗涤去除非特异性结合,洗脱并依次收集与H1N1,H3N2,H5N1以及H7N9结合的噬菌体;
(3)再次感染大肠杆菌,挑选单克隆展示于噬菌体表面,ELISA筛选同时识别H1N1,H3N2,H5N1以及H7N9抗原的阳性克隆。
3、抗体可变区基因序列的测定、分析
阳性克隆送到上海生工生物技术有限公司进行抗体可变区基因序列测定,对测序结果用DNAMAN和数据库进行检索分析。
4、结果
通过上述步骤筛选出了同时抗H1N1,H3N2,H5N1以及H7N9的广谱单克隆抗体FHA3,经序列比对,获得了编码FHA3单克隆抗体的轻链可变区的氨基酸序列和编码FHA3单克隆抗体的重链可变区的氨基酸序列,其中重链的CDR1-3序列如SEQ ID NO.1~3所示,重链可变区框架区FR1、FR2、FR3和FR4的氨基酸序列如SEQ ID NO.4~7所示,重链可变区序列如SEQID NO.8所示,轻链的CDR1-3序列如SEQ ID NO.10~12所示,轻链可变区框架区FR1、FR2、FR3和FR4的氨基酸序列如SEQ ID NO.13~16所示,轻链可变区的氨基酸序列如SEQ IDNO.17所示。
实施例2单克隆抗体FHA3的制备
1、利用PCR方法扩增抗体FHA3重链可变区序列(氨基酸序列如SEQ ID NO.8所示,核苷酸序列如SEQ ID NO.9所示)轻链可变区序列(氨基酸序列如SEQ ID NO.17,核苷酸序列如SEQ ID NO.18所示),并将其利用分子克隆的方法将片段克隆入表达载体中。
2、将同时含有单克隆抗体轻链以及重链基因的载体转染进哺乳动物细胞中,进行表达。
3、收集表达上清,利用GE公司的Protein A FF蛋白柱进行纯化。
4、用pH3.0的柠檬酸缓冲液洗脱,收集流出液,并立即用1mol/L pH 8.5TRIS-HCL缓冲液中和,用pH7.2,0.01mol/L的PBS透析72h,0.22μm滤膜过滤除菌。
5、利用SDS-PAGE和Western Blot实验检验抗体的表达及纯化情况,以及利用BCA方法检测纯化抗体浓度,4℃保存。
6、结果如图1所示,证实得到较纯蛋白,并可清察到解链后的抗体轻、重链。
实施例3单克隆抗体FHA3的特异性检测
采用ELISA法检测单克隆抗体FHA3的特异性。
1、在ELISA板中包被1μg/ml的甲型流感病毒H1N1,H3N2,H5N1以及H7N9的HA抗原,4℃过夜;
2、用脱脂奶粉封闭未结合的位点,然后用含0.1%吐温的PBS缓冲液洗涤5次;
3、配置不同浓度的抗体FHA3,加入步骤2中的ELISA板条中,37℃孵育1h,用含0.1%吐温的PBS缓冲液洗涤5次;
4、加入HRP-标记的羊抗人抗体,37℃孵育30min,用含0.1%吐温的PBS缓冲液洗涤5次;加入TMB显色,1mol/L的硫酸终止后检测OD
5、结果
结果如图2所示,抗体FHA3能有效地结合甲型流感病毒抗原蛋白H1N1,H3N2,H5N1以及H7N9,且呈剂量依赖关系。
实施例4假病毒中和实验
用假病毒在感染MDCK细胞的过程中分别加入FHA3抗体进行中和实验,用无关抗体DGA作为对照。具体步骤如下:
1、假病毒包装:
1)将10cm培养皿中的HEK 293T细胞培养长至80%;
2)甲型流感假病毒的制备:
分别将HA5、NA1表达质粒与pNL-4.3-luc或者HA7、NA9表达质粒与pNL-4.3-luc以1:1:2的比例利用转染试剂lipoamine3000共转染进HEK-293T细胞中;
3)转染6h后,换用新鲜的完全DMEM培养基,继续培养66h后,收集细胞上清,3000rpm/min离心10min,用0.45μm的滤膜过滤后,添加20%血清,分装为200μl/管,保存于-80℃低温冰箱中。
2、假病毒感染
接种MDCK细胞于96孔细胞培养板,细胞密度为1X10
3、结果
病毒的检测结果如图3所示,FHA3能够有效地中和甲型流感病毒H5N1以及H7N9,从而抑制病毒对靶细胞的感染。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
序列表
<110> 中国人民解放军军事科学院军事医学研究院
<120> 一种靶向甲型流感病毒HA蛋白的广谱抗体
<141> 2020-10-09
<160> 18
<170> SIPOSequenceListing 1.0
<210> 1
<211> 7
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Ser Tyr His Ala Val Trp Asn
1 5
<210> 2
<211> 18
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 2
Arg Thr Tyr Tyr Arg Ser Gly Trp Tyr Asn Asp Tyr Ala Glu Ser Val
1 5 10 15
Lys Ser
<210> 3
<211> 16
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 3
Ser Gly His Ile Thr Val Phe Gly Val Asn Val Asp Ala Phe Asp Met
1 5 10 15
<210> 4
<211> 30
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 4
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Gly Ser Val Ser
20 25 30
<210> 5
<211> 14
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 5
Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu Gly
1 5 10
<210> 6
<211> 32
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 6
Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn Gln Phe Ser Leu Gln
1 5 10 15
Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 7
<211> 11
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 7
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
1 5 10
<210> 8
<211> 128
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Gly Ser Val Ser Ser Tyr
20 25 30
His Ala Val Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Gly Trp Tyr Asn Asp Tyr Ala
50 55 60
Glu Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Ser Gly His Ile Thr Val Phe Gly Val Asn Val
100 105 110
Asp Ala Phe Asp Met Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120 125
<210> 9
<211> 384
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
caggtgcagc tgcagcagag cggcccgggc ctggtgaaac cgagccagac cctgagcctg 60
acctgcgcga ttagcggcgg cagcgtgagc agctatcatg cggtgtggaa ctggattcgc 120
cagagcccga gccgcggcct ggaatggctg ggccgcacgt attatcgcag cggctggtat 180
aacgattatg cggaaagcgt gaaaagccgc attaccatta acccggatac cagcaaaaac 240
cagtttagcc tgcagctgaa cagcgtgacc ccggaagata ccgcggtgta ttattgcgcg 300
cgcagcggcc atattaccgt gtttggcgtg aacgtggatg cgtttgatat gtggggccag 360
ggcacaatgg tgaccgtgag cagc 384
<210> 10
<211> 11
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 10
Arg Thr Ser Asn Ser Leu Ser Ser Tyr Thr His
1 5 10
<210> 11
<211> 7
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 11
Ala Ala Ser Ser Arg Gly Ser
1 5
<210> 12
<211> 5
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 12
Gln Gln Ser Arg Arg
1 5
<210> 13
<211> 23
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 14
<211> 15
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 14
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 15
<211> 32
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 15
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 16
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 16
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 17
<211> 103
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Asn Ser Leu Ser Ser Tyr
20 25 30
Thr His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Arg Gly Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Arg Arg Phe Gly Gln
85 90 95
Gly Thr Lys Val Glu Ile Lys
100
<210> 18
<211> 309
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 18
gatattcaga tgacccagag cccgagcagc ctgagcgcga gcgtgggcga tcgcgtgacc 60
attacctgcc gcaccagcaa tagcctgagc agctataccc attggtatca gcagaaaccg 120
ggcaaagcgc cgaaactgct gatttatgcg gcgagcagcc gcggcagcgg cgtgccgagc 180
cgctttagcg gcagcggcag cggcaccgat tttaccctga ccattagcag cctgcagccg 240
gaagattttg cgacctatta ttgccagcag agccgcaggt ttggccaggg caccaaagtg 300
gaaattaaa 309
