一种制备强活性、高表达量的重组鸡α干扰素新工艺
文献发布时间:2023-06-19 09:27:35
技术领域
本发明属于干扰素技术领域,涉及一种制备强活性、高表达量的重组鸡α干扰素新工艺。
背景技术
鸡α干扰素(IFN-α)是一类由病毒及脂多糖等物质诱导机体产生的具有广谱抗病毒、抗肿瘤和免疫调节作用的蛋白质,1957年由Issacs和Lindeman首先发现,它是一类多功能的细胞因子,与细胞受体结合后,可诱导机体产生多种特异性蛋白质和酶类,主要通过抑制病毒基因转录和降解病毒RNA来抑制病毒的生长繁殖及发挥抗肿瘤等的活性。现已知,鸡α干扰素在体内可有选择性地作用于病毒感染细胞,通过抑制受染细胞内的病毒蛋白质的生物合成,发挥广谱和高效抗病毒作用,但对正常宿主细胞无作用。
酵母表达系统繁殖快,高密度发酵,可以得到表达量高的重组外源蛋白。酵母是一种益生菌,酵母的全基因组序列已经清楚,生物安全性好;酵母培养简单,原料成本低,表达条件易于控制,用工业发酵罐可以诱导表达大量高浓度的目的蛋白,利于工业化生产。毕赤酵母宿主菌常用的有GS115和KM71两种,都具有HIS营养缺陷标记。其中,GS115菌株具有AOX1基因,是Mut
现有技术中,重组鸡α干扰素生产方法得到的重组鸡α干扰素基因的蛋白表达量低、不利于纯化以及菌株不稳定的问题,限制了其向规模化生产的转化。
发明内容
本发明提出一种制备强活性、高表达量的重组鸡α干扰素新工艺,解决了现有技术中重组鸡α干扰素基因的蛋白表达量低、不利于纯化的问题。
本发明的技术方案是这样实现的:
一种制备强活性、高表达量的重组鸡α干扰素新工艺,包括以下步骤:
S1.构建重组鸡α干扰素的克隆载体
S11.从鸡淋巴细胞中提取RNA,对RNA进行反转录,得到鸡α干扰素的cDNA,用ChIFNα引物对cDNA进行PCR扩增,得到鸡α干扰素基因PCR产物,与质粒pJET连接,转化,得到重组质粒pJET-ChIFNα;
S12.使用EcoRⅠ和XbaⅠ对步骤S11得到的重组质粒pJET-ChIFNα进行双酶切,得到鸡干扰素基因ChIFNαDNA,以ChIFNαDNA为模板,用mChIFNα引物进行RCR扩增,得到重组鸡α干扰素mChIFNαDNA;
S2.构建重组鸡α干扰素的毕赤酵母表达载体
用酶切和同源重组方法分别把鸡α干扰素基因ChIFNα和mChIFNα插入酵母表达载体pPICZαC中,在E.coli DH5α菌落扩增,得到重组鸡α干扰素质粒pPICZαC-ChIFNα和pPICZαC-mChIFNα;
S3.重组鸡α干扰素的蛋白表达
把重组质粒pPICZαC-ChIFNα通过电转化到毕赤酵母GS115菌株,筛选阳性转化子,并进行甲醇诱导表达,得到鸡α干扰素重组蛋白。
作为进一步的技术方案,所述ChIFNα引物为:
ChIFNα上游引物:5’-AGCAGAATTCATGGCTGTGCCTGCAAGC-3’,
ChIFNα下游引物:5’-TAACAAGCTTCTAAGTGCGCGTGTTGCCTGC-3’,
所述mChIFNα引物为:
mChIFNα上游引物:5'-GCT AAA GAA GAA GGG GTA TCT C’TC GAG AAG AGA GAGGCT GAA GCA TGT AAC CAC CTT CGC CCC CAG GAT GCC-3‘,
mChIFNα下游引物:5'-TGA GAT GAG TTT TTG TTC TAG AGT GCG CGT GTT GCCTGT GAG GTT-3'。
作为进一步的技术方案,步骤S2具体包括以下步骤:
S21.将毕赤酵母载体pPICZαC转化到大肠杆菌E.coli DH5α,得到E.coliDH5α-pPICZαC菌落,用AOX1通用引物进行PCR扩增,EcoR I、Xba I双酶切,得到pPICZαC载体,
S22.分别将鸡α干扰素基因ChIFNα、mChIFNα与毕赤酵母表达载体pPICZαC连接反应,得到重组质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα;
S23.将重组质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα酶切线性化、纯化,得到线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα。
作为进一步的技术方案,步骤S3具体包括以下步骤:
S31.制备感受态毕赤酵母细胞,将线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα电转化毕赤酵母细胞pichia pastoris GS115,得到毕赤酵母重组子;
S32.对毕赤酵母重组子进行抗性筛选,筛选出阳性转化子,确定Mut表型;
S33.对毕赤酵母重组子菌落进行甲醇诱导表达,得到鸡α干扰素重组蛋白。
作为进一步的技术方案,步骤S11中反转录反应条件为在42℃反应1h后,在70℃反应5~10min,反转录反应完后,得到的cDNA在-20℃保存;PCR扩增反应条件为在98℃预变性10s,在58℃变性15s,在72℃变性10s,连续35个循环后,在72℃延伸10min。
作为进一步的技术方案,步骤S22具体为:将鸡α干扰素基因ChIFNα与毕赤酵母表达载体pPICZαC在22℃连接反应10min,得到重组质粒pPICZαC-ChIFNα;将mChIFNα与毕赤酵母表达载体pPICZαC在37℃连接反应30min,得到重组质粒pPICZαC-mChIFNα。
作为进一步的技术方案,步骤S23中酶切线性化反应条件为在37℃酶切30min,所述酶为Thermo SacⅠ。
作为进一步的技术方案,步骤S31制备感受态毕赤酵母细胞具体包括以下步骤:
S311.从YPD平板上挑取单个毕赤酵母菌落在28℃、250rpm过夜培养;
S312.接种过夜培养菌液0.05-0.25mL到250mL YPD培养液在28℃、250rpm过夜培养,至OD
S313.在4℃、1500r/min离心5分钟,去上清,用250mL 0℃无菌水重悬细胞。
S314.重复步骤S313离心,去上清,用125mL 0℃无菌水重悬细胞;
S315.重复步骤S313离心,去上清,用10mL 0℃1M无菌山梨醇重悬细胞;
S316.重复步骤S313离心,去上清,用0.5-1mL 0℃1M无菌山梨重悬细胞,得到感受态毕赤酵母细胞,冰上放置。
作为进一步的技术方案,步骤S31中电转化条件为:在2000V、300Ω下电转化5ms。
作为进一步的技术方案,步骤S33得到的鸡α干扰素重组蛋白的蛋白表达量为0.445mg/mL,活性为2.3×10
本发明的工作原理及有益效果为:
1、本发明中,成功构建了重组鸡α干扰素的克隆载体pPICZαC-ChIFNα和pPICZαC-mChIFNα,利用基因同源重组的方法,去除了α干扰素信号肽及其优化了α干扰素密码子,从而大大提高了毕赤酵母细胞的蛋白表达量,表达量高达0.445mg/mL。从鸡外周血中的淋巴细胞提取RNA,反转录得到鸡α干扰素的cDNA,然后通过引物插入酶切位点,连接pJET1.2/Blunt载体,成功地把带有EcoR1和Xba1酶切位点的鸡α干扰素基因(579bp)插入pJET1.2/Blunt载体中;同时,通过设计引物,PCR扩增,去掉了鸡α干扰素基因自身的信号肽序列(93bp),得到486bp的成熟鸡α干扰素基因,把密码子tgc优化成酵母偏爱的密码子tgt,两端插上同源臂,利于表达载体的同源重组。
2、本发明中,成功构建了重组鸡α干扰素的毕赤酵母表达载体。利用酶切和同源重组方法分别把鸡α干扰素基因ChIFNα和mChIFNα插入酵母表达载体pPICZαC中,在E.coliDH5α菌扩增重组鸡α干扰素质粒pPICZαC-ChIFNα和pPICZαC-mChIFNα,然后通过酶切、PCR扩增和基因测序证明得到的重组表达质粒中已经正确插入鸡α干扰素基因ChIFNα和mChIFNα。
3、本发明中,重组鸡α干扰素的蛋白表达量可以高达0.445mg/mL。利用真核表达系统适用于真核来源的外源蛋白表达原理,通过形成正确的折叠和后期修饰,糖基化、乙酰化、脂肪酸酰基化等过程,确保表达的外源重组蛋白的天然状态和生物活性;而且Westernblot结果进一步验证了鸡α干扰素的表达的rChIFNα蛋白的表达量为0.33mg/mL,rmChIFNα蛋白的表达量高达0.445mg/mL。
4、本发明中,本发明得到的鸡α干扰素重组蛋白具有强生物学活性,活性可达2.3×10
附图说明
下面结合附图和具体实施方式对本发明作进一步详细的说明。
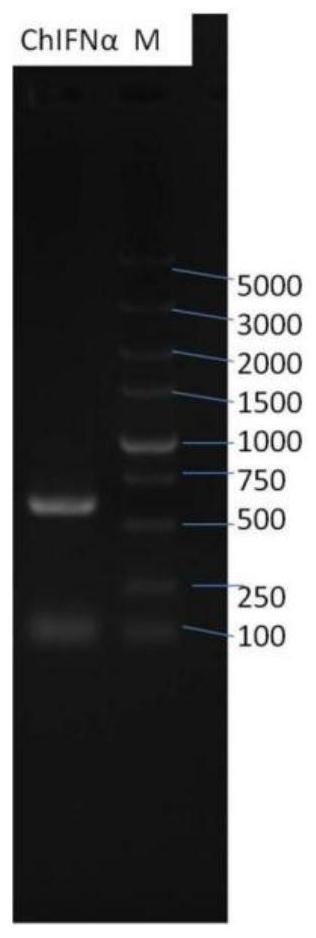
图1为本发明ChIFNα基因PCR扩增产物琼脂糖凝胶电泳图;
图2为本发明质粒pJET-ChIFNαPCR扩增产物琼脂糖凝胶电泳图;
图3为本发明用同源重组引物扩增的鸡α干扰素基因产物琼脂糖凝胶电泳图;
图4为本发明Sac1单酶切毕赤酵母载体pPICZαC凝胶电泳图;
图5为本发明重组质粒pPICZαC-ChIFNα用ChIFNα引物的菌液PCR扩增产物琼脂糖凝胶电泳图;
图6为本发明重组鸡α干扰素pPICZαC-ChIFNα质粒的双酶切琼脂糖凝胶电泳图;
图7为本发明同源重组质粒pPICZαC-ChIFNα用ChIFNα引物的菌液PCR扩增产物琼脂糖凝胶电泳图;
图8为本发明同源重组质粒pPICZαC-mChIFNαSacⅠ单酶切产物琼脂糖凝胶电泳图;
图9为本发明电击转化进pPICZαC-ChIFNα、pPICZαC-mChIFNα及pPICZαC的抗Zeocin重组毕赤酵母克隆菌落图;
图10为本发明不同抗Zeocin浓度下鸡α干扰素重组酵母克隆的生长状态菌落图;
图11为本发明鸡α干扰素重组毕赤酵母Mut型的鉴定图;
图12为本发明鸡α干扰素重组毕赤酵母DNA PCR扩增琼脂糖凝胶电泳图;
图13为本发明鸡α干扰素重组毕赤酵母DNA PCR扩增琼脂糖凝胶电泳图;
图14为本发明重组鸡α干扰素的SDS-PAGE琼脂糖凝胶电泳图;
图15为本发明不同时间点的重组鸡α干扰素mChIFNα的SDS-PAGE琼脂糖凝胶电泳图;
图16为本发明蛋白标准品的标准曲线图;
图17为本发明rChIFNα蛋白浓度测定图;
图18为本发明rChIFNαmF蛋白浓度测定图;
图19为本发明重组鸡α干扰素的Western Blot琼脂糖凝胶电泳图
图20为本发明重组鸡α干扰素mF的Western Blot琼脂糖凝胶电泳图
图21为本发明干扰素标准品标准剂量反应曲线图;
图22为本发明.Vero细胞感染100TCID50 NDV 48小时细胞成像图;
图2中:1和2为pJET1.2通用引物扩增pJET-ChIFNα重组质粒1
图3中:1为pChIFNα引物对照;2和3为用ChIFNα扩增的鸡α干扰素DNA片段645bp(包括引物);4为用mChIFNα扩增的鸡α干扰素DNA片段552bp(包括引物);5为mChIFNα引物对照;
图4中:1为酶切1小时;2为酶切45分钟;3为酶切30分钟;4和5为酶切15分钟;
图5中:1-8为阳性克隆菌液PCR产物579bp;
图6中:1.2.3.4.5.7.9.10.11.13.14.15有二条条带,大小分别为3.6kb和579bp.;
图7中:1-14为pPICZαC-ChIFNα阳性克隆菌液PCR产物579bp;
图8中:1为同源重组质粒pPICZαC-mChIFNα用mChIFNα引物的菌液PCR扩增产物,486bp;2为同源重组质粒pPICZαC-ChIFNαSac1单酶切产物;3为同源重组质粒pPICZαC-mChIFNαSac1单酶切产物;4为毕赤酵母空载体pPICZαC Sac1单酶切产物;
图9中:a为电击转化pPICZαC-ChIFNα的抗Zeocin重组毕赤酵母克隆GS115;b为电击转化pPICZαC-mChIFNα的抗Zeocin重组毕赤酵母克隆GS115;c为电击转化酵母载体pPICZαC的抗Zeocin重组毕赤酵母克隆GS115;
图10中:a为Zeocin浓度为400μg/mL的YPD平板上鸡α干扰素重组酵母克隆的生长状态;b为Zeocin浓度为800μg/mL的YPD平板上鸡α干扰素重组酵母克隆的生长状态;c为Zeocin浓度为1200μg/mL的YPD平板上鸡α干扰素重组酵母克隆的生长状态;
图12中:1-5PCR使用AOX1通用引物:1为酵母细胞DNA;2为pPICZαC重组酵母细胞DNA;3、4无条带;5为pPICZαC-ChIFNα重组酵母细胞DNA;6-10PCR使用ChIFNα引物:6.为酵母细胞DNA;7为pPICZαC重组酵母细胞DNA;8、9无条带;10为pPICZαC-ChIFNα重组酵母细胞DNA;
图13中:1为pPICZαC重组酵母细胞DNA;2为pPICZαC-ChIFNαmF重组酵母细胞DNA;
图14中:1为1#GS115(pPICZαC-ChIFNα)表达重组鸡α干扰素;2为2
图15中:1-3为1#GS115(mChIFNα)表达重组鸡α干扰素分别于48h、72h和96h;4-5为1
图19中:1为空载体对照;2为2
图20中:1为1
图22中:a为正常Vero细胞,b为鸡α干扰素640倍稀释度预孵育,c为NDV对照。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种制备强活性、高表达量的重组鸡α干扰素新工艺,包括以下步骤:
S1.构建重组鸡α干扰素的克隆载体
S11.从鸡淋巴细胞中提取RNA,对RNA进行反转录,得到鸡α干扰素的cDNA,用ChIFNα引物对cDNA进行PCR扩增,得到鸡α干扰素基因PCR产物,与质粒pJET连接,转化,得到重组质粒pJET-ChIFNα,具体包括以下步骤:
S111.从鸡淋巴细胞中提取RNA:静脉无菌采取鸡的全血5mL,加入5mL含1%的无菌肝素钠1640培养液中,得到含肝素钠的全血,在10mL的玻璃试管中预先加入淋巴细胞分离液5mL,缓慢加入含肝素钠的全血5mL于分离液的上面,在1500rpm下室温离心20分钟,用毛吸管吸取上面的血浆层,用毛吸管吸取淋巴细胞层,重悬于2倍体积的不完全培养液中,得到鸡淋巴细胞样品,根据RNA提取试剂盒(AxyGen)上的操作步骤,从提取的鸡淋巴细胞样品中提取RNA;
S112.对RNA进行反转录,得到鸡α干扰素的cDNA,反转录反应体系如下:
将上述反应混合物在42℃反应1h,在70℃反应5-10min反转录反应完后,得到的cDNA在-20℃保存;
S113.使用ChIFNα引物对cDNA进行PCR扩增,得到鸡α干扰素基因PCR产物:设计ChIFNα引物如下:
ChIFNα上游引物:5’-AGCAGAATTCATGGCTGTGCCTGCAAGC-3’,
ChIFNα下游引物:5’-TAACAAGCTTCTAAGTGCGCGTGTTGCCTGC-3’。
PCR扩增反应体系如下:
反应条件为:在98℃预变性10s,在58℃变性15s,在72℃变性10s,连续35个循环后,在72℃延伸10min;
S114.鸡α干扰素基因(ChIFNα)PCR产物电泳检测及纯化回收
1.2%琼脂糖凝胶电泳、成像后,用DNA回收试剂盒(AxyGen DNA gel kit)纯化回收ChIFNα,操作步骤按照回收试剂盒说明;琼脂糖凝胶电泳结果见图1:显示得到了579bp的目的片段,初步证明PCR扩增产物为鸡α干扰素基因,从鸡外周血中的淋巴细胞提取RNA,反转录得到鸡α干扰素的cDNA,然后通过引物插入酶切位点,连接pJET1.2/Blunt载体,成功地把带有EcoR1和Xba1酶切位点的鸡α干扰素基因(579bp)插入pJET1.2/Blunt载体中(pJET1.2/Blunt载体是平末端和粘末端都能连接的载体,连接转化的成功率高);
取10μL纯化回收产物送测序公司(Biosun)测序,测序结果中鸡α干扰素基因ChIFNα如序列表SEQ ID NO:1所示,带有EcoR1和Xba1酶切位点的鸡α干扰素基因测序结果如序列表SEQ ID NO:2所示;
S115.将得到的鸡α干扰素基因PCR产物与质粒pJET连接,转化,得到重组质粒pJET-ChIFNα:使用pJET Blunt PCR Cloning Kit(Thermo),连接反应体系如下:
连接反应条件为:在22℃反应1h;
取100μLE.coli DH5α感受态,冰浴静置5-10min,取pJET-ChIFNα5μL,加入E.coliDH5α感受态细胞中,轻轻混匀,冰浴静置30分钟,得到混合物;将上述混合物在42℃金属浴60-90s后迅速置于冰浴2-3min,加入1mL不含Amp的LB液体培养基,37℃培养1小时,复苏细菌,取100μL转化复苏的E.coliDH5α-pJET-ChIFNα菌液涂在含Amp的LB固体培养基上,37℃倒置培养12-14小时,筛选菌落,挑取单克隆菌落,接种到5mL含Amp的LB液体培养基上,在37℃过夜培养,得到重组质粒pJET-ChIFNα;
S116.pJET-ChIFNα的菌液PCR鉴定:取E.coliDH5α-pJET-ChIFNα菌落稀释到10μLddH2O,100℃煮沸5-10min,用ChIFNα引物进行PCR扩增,扩增反应体系及反应条件与S113相同,凝胶成像,结果见图2:显示pJET-ChIFNα重组克隆质粒构建成功;
S12.使用EcoRⅠ和XbaⅠ对步骤S11得到的重组质粒pJET-ChIFNα进行双酶切,得到鸡干扰素基因ChIFNαDNA,以ChIFNαDNA为模板,用mChIFNα引物进行RCR扩增,得到重组鸡α干扰素mChIFNαDNA,具体包括以下步骤:
S121.按照质粒提取试剂盒(AxyGen plasmid mini kit)说明操作步骤进行提取重组质粒pJET-ChIFNα,送测序公司(BioSun)测序。
S122.使用EcoRⅠ和XbaⅠ对步骤S11得到的重组质粒pJET-ChIFNα进行双酶切,得到鸡干扰素基因ChIFNαDNA:
酶切反应体系如下:
反应条件为在30℃反应30min;
S123.对ChIFNαDNA割胶纯化回收:1.2%琼脂糖凝胶电泳、成像后,用DNA回收试剂盒(AxyGen DNA gel kit)纯化回收鸡α干扰素基因(ChIFNα),操作步骤按照回收试剂盒说明,具体包括以下步骤:
S1231.紫外光下尽量切下只含DNA的凝胶,置于已知重量1.5mL离心管中,称得凝胶重量;
S1232.按每100mg=100μL体积换算,加入3倍体积BufferDE-A,75℃水浴溶胶不超过8分钟,每2-3分钟颠倒混匀助溶;
S1233.加入0.5倍Buffer-A体积的Bufer-B,颠倒混匀,使混合液全部变为黄色;
S1234.把DNA吸附柱装入2mL制备管中,把上述混合液加入吸附柱,12000rpm离心1分钟,弃滤液;
S1235.于DNA吸附柱中加入Buffer W1 700μL,12000rpm离心1分钟,弃滤液;
S1236.于DNA吸附柱中加入Buffer W2 700μL,12000rpm离心1分钟,弃滤液,重复本步骤一次;
S1237.将DNA吸附柱12000rpm空离1分钟;
S1238.取出DNA吸附柱,将其转入nuclease-free 1.5离心管,于吸附膜中央滴加65℃预热的nuclease-free无菌水25μL,室温静置1-2分钟,12000rpm,离心1分钟,回收DNA产物,测浓度,于-20℃保存备用;
S124.鸡α干扰素自身信号肽的去除及密码子的优化:以得到的ChIFNαDNA为模板,用mChIFNα引物进行RCR扩增,得到重组鸡α干扰素mChIFNαDNA;凝胶电泳纯化回收mChIFNαDNA,在-20℃保存备用;其中mChIFNα引物如下:
mChIFNα上游引物:5'-GCT AAA GAA GAA GGG GTA TCT C’TC GAG AAG AGA GAGGCT GAA GCA TGT AAC CAC CTT CGC CCC CAG GAT GCC-3‘,
mChIFNα下游引物:5'-TGA GAT GAG TTT TTG TTC TAG AGT GCG CGT GTT GCCTGT GAG GTT-3'。
凝胶电泳结果见图3,显示鸡α干扰素基因mChIFNα为486bp,说明通过设计引物、PCR扩增,去掉了鸡α干扰素基因自身的信号肽序列93bp,得到486bp的成熟鸡α干扰素基因,把密码子tgc优化成酵母偏爱的密码子tgt,两端插上同源臂,利于后面的表达载体的同源重组。
S2.构建重组鸡α干扰素的毕赤酵母表达载体
用酶切和同源重组方法分别把鸡α干扰素基因ChIFNα和mChIFNα插入酵母表达载体pPICZαC中,在E.coli DH5α菌落扩增,得到重组鸡α干扰素质粒pPICZαC-ChIFNα和pPICZαC-mChIFNα,具体为以下步骤:
S21.毕赤酵母载体pPICZαC转化到大肠杆菌E.coli DH5α得到E.coliDH5α-pPICZαC菌落:
S211.取100μL E.coli DH5α感受态细胞,冰浴静置5-10min,取pPICZαC 5μL,加入E.coli DH5α感受态细胞中,轻轻混匀,冰浴静置30分钟,得到混合物;将上述混合物置于42℃金属浴60-90s后迅速置于冰浴2-3min,加入1mL不含Zeocin的LLB液体培养基,37℃培养1小时,复苏细菌;取100μL转化复苏的E.coliDH5α-pPICZαC菌液涂在含Zeocin的LLB固体培养基上,37℃,倒置培养12-14小时,筛选菌落;挑取单克隆菌落,接种到5mL含Zeocin的LLB液体培养基上,37℃过夜培养,得到E.coliDH5α-pPICZαC菌落;
S212.对E.coliDH5α-pPICZαC菌落中的毕赤酵母载体pPICZαC质粒提取:按照质粒提取试剂盒(AxyGen plasmid mini kit)说明操作步骤进行提取质粒,对提取的质粒进行单酶切,确定载体大小正确,见图4,载体大小为3.6kb,酶切最佳时间为15-30min;
S213.对E.coliDH5α-pPICZαC菌落中的毕赤酵母载体pPICZαC进行鉴定:取E.coliDH5α-pPICZαC菌落加10μL ddH
S214.对E.coliDH5α-pPICZαC菌落中的毕赤酵母载体pPICZαC进行双酶切:对毕赤酵母载体pPICZαC用EcoR I、Xba I双酶切,酶切反应体系如下:
酶切反应条件为在37℃反应30min,得到双酶切线性化pPICZαC载体;
S215.对得到的双酶切线性化pPICZαCDNA割胶纯化回收:用1.2%琼脂糖凝胶电泳、成像后,用DNA回收试剂盒(AxyGen DNA gel kit)纯化回收鸡α干扰素基因(ChIFNα),操作步骤按照回收试剂盒说明。
S22.分别将鸡α干扰素基因ChIFNα、mChIFNα与毕赤酵母表达载体pPICZαC连接反应,得到重组质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα;
S221.使用DNA连接酶T4 DNAligase(Thermo Scientific)将鸡α干扰素基因ChIFNα与毕赤酵母表达载体pPICZαC连接反应,连接反应体系如下:
反应条件为:在22℃反应10min,得到重组质粒pPICZαC-ChIFNα
S222.使用ClonExpress Multis One Step Clone Kit(Vazyme)将鸡α干扰素基因mChIFNα与毕赤酵母表达载体pPICZαC连接反应,连接反应体系如下:
反应条件为:在37℃反应30min,反应完成后,立即将反应管置于冰水浴中冷却5min,得到同源重组质粒pPICZαC-mChIFNα质粒;
S223.将得到的重组质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα转化到大肠杆菌E.coli DH5α:取100μL E.coli DH5α感受态(江苏康为世纪生物科技有限公司),冰浴静置5-10min;取pPICZαC-ChIFNα5μL、pPICZαC-mChIFNα5μL,分别加入E.coli DH5α感受态细胞中,轻轻混匀,冰浴静置30分钟后得到混合物;将上述混合物置于42℃金属浴60-90s后,迅速置于冰浴2-3min,加入1mL不含Zeo的LLB液体培养基,37℃培养1小时,复苏细菌;取100μL转化复苏的E.coli DH5α/pPICZαC-ChIFNα菌液涂在含Zeo的LLB固体培养基上,37℃,倒置培养12-14小时,筛选菌落;挑取单克隆菌落,接种到5mL含Zeo的LLB液体培养基上,37℃,过夜培养;
S224.pPICZαC-ChIFNα、pPICZαC-mChIFNα的菌液PCR:取E.coli DH5α/pPICZαC-ChIFNα和E.coli DH5α/pPICZαC-mChIFNα菌落稀释到10μL ddH
S225.E.Coli DH5α/pPICZαC-ChIFNα和E.Coli DH5α/pPICZαC-mChIFNα质粒提取:按照质粒提取试剂盒(AxyGen plasmid mini kit)说明操作步骤进行提取重组质粒pPICZαC–ChIFNα、pPICZαC-mChIFNα,送测序公司(BioSun)测序,
测序结果:重组质粒pPICZαC–ChIFNα如序列表SEQ ID NO:3所示,重组质粒pPICZαC-mChIFNα如序列表SEQ ID NO:4所示。
S226.E.Coli DH5α/pPICZαC-ChIFNα和E.Coli DH5α/pPICZαC-mChIFNα酶切:使用EcoRⅠ和XbaⅠ(Thermofisher)对重组质粒pPICZαC-ChIFNα进行双酶切,酶切反应体系如下:
反应条件为:在37℃反应30min,然后在65℃反应10min,终止酶切反应;
S227.E.Coli DH5α/pPICZαC-ChIFNα和E.Coli DH5α/pPICZαC-mChIFNα鉴定:用1.2%琼脂糖凝胶电泳、成像;
S23.将重组质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα酶切线性化、纯化,得到线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα,具体包括以下步骤:
S231.将重组鸡α干扰素表达质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα酶切线性化,选用SacⅠ(Thermo快切酶)酶切质粒,酶切反应体系如下:
反应条件为:在37℃反应30min,反应完成后,得到线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα,结果见6,确认大小条带都正确的菌落;
反应条件为:在37℃反应30min,反应完成后,得到线性化重组鸡α干扰素表达质粒pPICZαC-mChIFNα;
S232.线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα的纯化:1.2%琼脂糖凝胶电泳,用DNA回收试剂盒(AxyGen DNA gel kit)纯化回收鸡α干扰素基因(ChIFNα),操作步骤按照回收试剂盒说明。
线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα的琼脂糖凝胶电泳结果见图8,结果进一步确认鸡α干扰素基因已经插入进毕赤酵母载体pPICZαC之中;
S3.重组鸡α干扰素的蛋白表达
把重组质粒pPICZαC-ChIFNα通过电转化到毕赤酵母GS115菌株,筛选阳性转化子,并进行甲醇诱导表达,得到鸡α干扰素重组蛋白。
S31.制备感受态毕赤酵母细胞,将线性化重组鸡α干扰素表达质粒pPICZαC-ChIFNα、pPICZαC-mChIFNα电转化毕赤酵母细胞pichia pastoris GS115,得到毕赤酵母重组子,具体包括以下步骤:
S311.从YPD平板上挑取单个毕赤酵母菌落在28℃、250rpm过夜培养;
S312.接种过夜培养菌液0.05-0.25mL到250mL YPD培养液在28℃、250rpm过夜培养,至OD
S313.在4℃、1500r/min离心5分钟,去上清,用250mL 0℃无菌水重悬细胞;
S314.重复步骤S313离心,去上清,用125mL 0℃无菌水重悬细胞;
S315.重复步骤S313离心,去上清,用10mL 0℃1M无菌山梨醇重悬细胞;
S316.重复步骤S313离心,去上清,用0.5-1mL 0℃1M无菌山梨重悬细胞,得到感受态毕赤酵母细胞,冰上放置。
S32.重组质粒pPICZαC-ChIFNα通过电转化到毕赤酵母细胞pichia pastorisGS115(p.p.GS115),具体包括以下步骤:
S321.分别取5-10μg线性化的pPICZαC-ChIFNα、pPICZαC-mChIFNα及空载体pPICZαC DNA(5-10μL无菌水)与80μL感受态细胞轻轻混合于0.2cm电转杯,冰上放置5分钟,电转仪(BioRad)设置参数为2000V、300Ω,进行电转化5ms;
S322.迅速加入1mL冰预冷的1M山梨醇,混匀,收集于1.5mL离心管中,28-30℃,复苏细菌;
S323.取100μL、200μL、300μL和500μL转化复苏的p.p.GS115/pPICZαC-ChIFNα、p.p.GS115/pPICZαC-mChIFNα和p.p.GS115/pPICZαC菌液涂在含Zeo的YPDS固体培养基上,28-30℃,先正置培养1小时,然后倒置培养3-5天,筛选菌落,结果见图9;
S33.对毕赤酵母重组子进行抗性筛选,筛选出阳性转化子,确定Mut表型,具体包括以下步骤:
S331.对毕赤酵母重组子进行抗性筛选,筛选出阳性转化子:
S3311.转化后4-6天内,挑菌落分别接种于Zeocin浓度梯度YPD平板培养基上,Zeocin浓度分别为0、100、400、800、1200、1600和2000μg/mL,每个浓度培养基设三个平行试验,28-30℃培养,2-5天观察结果,以0浓度培养基2-3天出现菌落为宜;
S3312.挑取每个浓度平板中都生长的对应于浓度400μg/mL的菌落,接种到Zeocin浓度800μg/mL的平板上,设三个平行,28-30℃培养,2-5天观察结果;
S3313.把上述平板中长出的菌落接种到Zeocin浓度1200μg/mL的平板上,设三个平行,28-30℃培养,2-5天观察结果;
S3314.把上述平板中长出的菌落接种到Zeocin浓度1600μg/mL的平板上,设三个平行,28-30℃培养,2-5天观察结果;
S3315.挑取长势较好的菌落,把相应各个浓度的菌落溶于50%无菌甘油中,-80保存以备后续实验;Zeocin浓度分别为400μg/mL、800μg/mL、1200μg/mL的YPD平板上鸡α干扰素重组酵母克隆的生长状态见图10;
S332.确定Mut表型:
S3321.用无菌牙签,挑挑在各抗性平板上长势都良好的阳性重组克隆规则地涂到MMH和MDH平板上,28-30℃确定MMH先涂;
S3322.换一根无菌牙签,按照步骤S337涂10个转化子,一个转化子一个无菌牙签;
S3323.在MMH和MDH平板上,分别涂上毕赤酵母GS115 Muts和GS115/Ppicz/lacZMut
S34.对毕赤酵母重组子菌落进行甲醇诱导表达,得到鸡α干扰素重组蛋白,具体包括以下步骤:
S341.用DNA提取试剂盒(AxyGen)提取酵母基因组:
S3411.收集2×106-5×107酵母细胞,10000×g离心1min。用350μL PBS悬浮细胞并转移至研钵中,加入液氮,待样品被完全冷冻后,快速、用力研磨至粉末状,将研钵放入56℃水浴至样品粉末刚刚开始融化时进入下一步操作;
S3412.加入1.2μL RNaseA储存液,快速用力研磨30s;
S3413.转移350μL研磨好的匀浆至2mL离心管中,如匀浆体积不足350μL,补充PBS至350μL;
S3414.加入150μL Buffer C-L和20μL Proteinase K。立即漩涡振荡1min混合均匀。短暂离心后,将离心管置56℃水浴10min;
S3415.加入350μL Buffer P-D,漩涡振荡30s混合均匀,12000×g离心10min;
S3416.将DNA制备管置于2mL离心管中,将上述混合液移至制备管中,12000×g离心1min;
S3417.弃滤液,将制备管置回到原来的2mL离心管中,加入500μL Buffer W1,12000×g离心1min;
S3418.弃滤液,将制备管置回到原来的2mL离心管中,加入700μL Buffer W2,12000×g离心1min,以同样的方法,用700μL Buffer W2再洗涤一次;
S3419.弃滤液,将制备管置回原来的2mL离心管中,12000×g离心1min;
S34110.将DNA制备管置于另一洁净的1.5mL离心管中,在制备管膜中央加100-200μL Eluent或去离子水,室温静置1min,12000×g离心1min,洗脱DNA。
S342.阳性重组酵母DNA PCR鉴定:取提取的酵母DNA,AOX1通用引物和ChIFNα引物对AOX1和ChIFNα进行PCR鉴定,结果见图12、13;
S343.重组蛋白在酵母菌诱导表达:
S3431.挑取单个菌落,接种到25mL BMGY于250mL挡板锥形瓶中,28-30℃,250rpm培养至OD600=2-6(约16-18个小时),细胞处于对数生长期;
S3432.1500-3000×g室温离心5分钟,倒掉上清液,把细胞重悬到BMMY中,使OD600=1.0,BMMY约100-200mL于1L挡板锥形瓶中,用2层无菌纱布封口;
S3433.28-30℃,250rpm继续培养;
S3434.每过24小时滴加100%甲醇,使甲醇终浓度为0.5%;
S3435.分别于0,6,12,24(1天),36,48(2天),60,72(3天),84,和96(4天)取1mL表达液于1.5mL离心管中,台式离心机最高转速室温离心2-3分钟,储存于-80℃,用于表达分析及诱导收获时间优化确定;
鸡α干扰素重组毕赤酵母克隆的诱导表达结果:
(1)rChIFNα毕赤酵母克隆的诱导表达结果:筛选好的重组克隆按照Mut
(2)rmChIFNα毕赤酵母克隆的诱导表达结果:去掉鸡α干扰素自身信号肽后的重组蛋白分子量约18kDa,带有His标签,从不同时间点采集的样品进行蛋白电泳,在诱导表达到96小时,表达量达到最高值,见图15。
S344.鸡α干扰素重组蛋白的电泳和Western Blot检测
S3441.样品处理:在密封的螺盖微量离心管中,用2×加样缓冲液按1:1稀释蛋白质样品溶液,于100℃煮沸3-5min;
S3442.15%分离胶的制备:
S3443.15%浓缩胶的制备:
S3444.Western Blot(蛋白质免疫印迹)检测:
S34441.转膜:采用BioRad半干转膜仪,转膜条件为11V、45min;
S34442.封闭:用5%脱脂奶粉PBST溶液,4℃,过夜,PBST漂洗3次,每次5min;
S34443.一抗孵育:1:1500鼠抗His-tag抗体,室温,1h,PBST漂洗3次,每次5min;
S34444.二抗孵育:1:15000羊抗鼠抗体,室温,1h,PBST漂洗3次,每次15min;
S34445.洗片:曝光1min,显影1min,定影5min;
S3445.重组蛋白浓度测定:使用BCA蛋白浓度检测试剂盒(Thermo)
S34451.蛋白标准品的配制
S34452.工作试剂WR配制:(BCA试剂A:B=50:1),对上述样品,将50mL试剂A与1mL试剂B混合;
S34453.加样和标准品,样品(各稀释度标准品):WR=1:20,震动30s,然后37℃温育30min;
S34454.在562nm波长下测得分光光度值,见下表:
根据标准品不同浓度的分光光度值,绘制标准曲线,见图16,
S3444.重组蛋白浓度计算:
p.p.GS115(ChIFNα)诱导表达蛋白总浓度计算结果:p.p.GS115(ChIFNα)酵母诱导表达的上清液总蛋白蛋白经过2倍稀释后,测定OD570为1.005,减去空白对照后,通过标准曲线公式计算得到总蛋白浓度为3.4mg/mL;
p.p.GS115(mChIFNα)诱导表达蛋白总浓度计算结果:p.p.GS115(mChIFNα)酵母诱导表达的上清液总蛋白蛋白经过2倍稀释后,测定OD570为0.848,减去空白对照后,通过标准曲线公式计算得到总蛋白浓度为2.8mg/mL;
rChIFNα蛋白浓度计算结果:运用凝胶成像系统(Tanon)自带的分析软件,半定量法,根据目的条带所占总蛋白浓度的百分比,计算得出重组鸡α干扰素rChIFNα蛋白占总蛋白浓度的9.7%(图17),根据上面的总蛋白浓度3.4mg/mL,最终得到rChIFNα蛋白的浓度为0.33mg/mL;重组鸡α干扰素rmChIFNα蛋白占总蛋白浓度的15.97%(图18),根据上面的总蛋白浓度2.8mg/mL,最终得到rmChIFNα蛋白的浓度为0.445mg/mL;
Western blot方法用鼠抗Histag抗体作为一抗,山羊抗鼠的抗体作为二抗孵育后,显色结果见图19-20,显示毕赤酵母表达的rChIFNα和rmChIFNα蛋白都带有His标签,分子量大小与图14-15SDS-PAGE的结果一致,分别为22kDa和18kD。
一、重组鸡α干扰素的生物活性检测(WISH/VSV)
1、试剂:MEM或RPMI1640培养液,取MEM或RPMI1640培养基粉末(规格1L),加水溶解并稀释至1000mL,加青霉素105IU和链霉素105IU,再加碳酸氢钠2.1g,溶解后,混匀,除菌过滤,4℃保存;完全培养液,量取新生牛血清10mL,加MEM或RPMI1640培养液90mL,4℃保存;消化液,称取乙二胺四乙酸钠1.152g、磷酸二氢钾0.2g,加水溶解并稀释至1000mL,经121℃、15分钟灭菌;染色液,称取结晶紫50mg,加无水乙醇20mL溶解后,加水稀释至100mL,即得;脱色液,量取无水乙醇50mL、醋酸0.1mL,加水稀释至100mL;PBS,称取氯化钠8.0g、氯化钾0.20g、磷酸氢二钠1.44g、磷酸二氢钾0.24g,加水溶解并稀释至1000mL,经121℃、15分钟灭菌;
标准品溶液的制备:取人干扰素生物学活性测定的国家标准品,干扰素α1b国家标准品(批准文号:(2003)国生标字0002;批号:97/01;效价:15000IU/支),按说明书复溶后,用测定培养液稀释至每1mL含1000IU,在96孔细胞培养板中,做4倍系列稀释,共8个稀释度,每个稀释度做2孔,在无菌条件下操作。
供试品溶液的制备:将供试品按标示量溶解后,用测定培养液稀释成每1mL约含1000IU,在96孔细胞培养板中,做4倍系列稀释,共8个稀释度,每个稀释度做2孔,在无菌条件下操作。
2、测定法:使WISH细胞在培养基中贴壁生长,按(1︰2)~(1︰4)传代,每周2~3次,于完全培养液中生长,取培养的细胞弃去培养液,用PBS洗2次后消化和收集细胞,用完全培养液配制成每1mL含2.5×10
3、试验数据采用计算机程序或四参数回归计算法进行处理,并按下式计算结果:
供试品生物学活性(IU/mL)=Pr×(Ds×Es)/(Dr×Er)
式中Pr为标准品生物学活性,IU/mL;
Dr为供试品预稀释倍数;
Es为供试品相当于标准品半效量的稀释倍数;
Er为标准品半效量的稀释倍数。
4、结果:记录酶标仪在570nm的吸光值,去掉2个末尾数值,绘制IFNα1b的标准曲线,见图21,标准曲线为线性,R2﹥0.9,实验数据可信。按照干扰素的活性检测公式计算生物活性:
Pr:15000(IU/mL)
Dr:15×4=60
Ds(rChIFNα):1×10
Er:2
Es(rChIFNα):2
rChIFNα生物学活性(IU/mL)
=Pr×[(Ds×Es)/(Dr×Er)]
=15000×[(1000×6)/(60×64)]
=2.3×10
计算得到rmChIFNα生物学活性为2.3×10
运用细胞病变抑制法WISH/VSV生物学活性检测系统,测得表达的鸡α干扰素重组蛋白具有生物学活性,活性为2.3×10
二、重组鸡α干扰素的抗病毒作用实验:采用微量细胞病变抑制法检测重组鸡α干扰素的抗病毒能力。
1、测定法:在96孔板中接种Vero细胞(2×105~3×106cells/mL),37℃贴壁培养4-6小时,用含有FBS的DMEM将诱导表达的重组鸡α干扰素上清液稀释10倍,用0.2μm滤膜过滤除菌,重组鸡α干扰素无菌液,用含有FBS的DMEM稀释4倍,用不同稀释倍数的鸡α干扰素无菌液100μL于96孔板中37℃孵育Vero细胞12~16小时,吸出96孔板中孵育培养基,加入100μL含有100TCID50的NDV病毒液(3%FBS的DMEM稀释),37℃培养24~48小时,观察细胞感染情况
2、结果:如图22所示,未预先孵育鸡α干扰素的vero细胞,在感染NDV 48小时,90%的细胞圆缩、脱落死亡,存活率只有10%,预先孵育鸡α干扰素的Vero细胞,鸡α干扰素孵育稀释倍数为10×64=640时,感染NDV 48小时,约40%的vero细胞生长形态正常,起到了意料不到的效果。稀释倍数低或者高的抗病毒感染作用则没有稀释640倍的效果好。结果说明,把表达得到鸡α干扰素rmChIFNα稀释640倍后,可以使细胞具有很好的抗NDV病毒作用,与未预先孵育鸡α干扰素的vero细胞相,细胞存活率由10%提高至40%,说明本发明得到的重组鸡α干扰素起到了很好的抗病毒效果。
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 石家庄石牧药业有限公司
<120> 一种制备强活性、高表达量的重组鸡α干扰素新工艺
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 579
<212> DNA
<213> 人工序列
<400> 1
atggctgtgc ctgcaagccc acagcaccca cgggggtacg gcatcctgct gctcacgctc 60
cttctgaaag ctctcgccac caccgcctcc gcctgcaacc accttcgccc ccaggatgcc 120
accttctctc acgacagcct ccagctcctc cgggacatgg ctcccacact accccagctg 180
tgcccacagc acaacgcgtc ttgctccttc aacgacacca tcctggacac cagcaacacc 240
cggcaagccg acaaaaccac ccacgacatc cttcagcacc tcttcaaaat cctcagcagc 300
cccagcactc cagcccactg gaacgacagc caacgccaaa gcctcctcaa ccggatccac 360
cgctacaccc agcacctcga gcaatgcttg gacagcagcg acacgcgctc ccggacgcga 420
tggcctcgca accttcacct caccatcaaa aaacacttca gctgcctcca caccttcctc 480
caagacaacg attacagcgc ctgcgcctgg gaacacgtcc gcctgcaagc tcgtgcctgg 540
ttcctgcaca tccacaacct cacaggcaac acgcgcact 579
<210> 2
<211> 595
<212> DNA
<213> 人工序列
<400> 2
cagaattcca tggctgtgcc tgcaagccca cagcacccac gggggtacgg catcctgctg 60
ctcacgctcc ttctgaaagc tctcgccacc accgcctccg cctgcaacca ccttcgcccc 120
caggatgcca ccttctctca cgacagcctc cagctcctcc gggacatggc tcccacacta 180
ccccagctgt gcccacagca caacgcgtct tgctccttca acgacaccat cctggacacc 240
agcaacaccc ggcaagccga caaaaccacc cacgacatcc ttcagcacct cttcaaaatc 300
ctcagcagcc ccagcactcc agcccactgg aacgacagcc aacgccaaag cctcctcaac 360
cggatccacc gctacaccca gcacctcgag caatgcttgg acagcagcga cacgcgctcc 420
cggacgcgat ggcctcgcaa ccttcacctc accatcaaaa aacacttcag ctgcctccac 480
accttcctcc aagacaacga ttacagcgcc tgcgcctggg aacacgtccg cctgcaagct 540
cgtgcctggt tcctgcacat ccacaacctc acaggcaaca cgcgcactct agacg 595
<210> 3
<211> 1244
<212> DNA
<213> 人工序列
<400> 3
aacctttttt tttatcatca ttattagctt actttcataa ttgcgactgg ttccaattga 60
caagcttttg attttaacga cttttaacga caacttgaga agatcaaaaa acaactaatt 120
attcgaaacg atgagatttc cttcaatttt tactgctgtt ttattcgcag catcctccgc 180
attagctgct ccagtcaaca ctacaacaga agatgaaacg gcacaaattc cggctgaagc 240
tgtcatcggt tactcagatt tagaagggga tttcgatgtt gctgttttgc cattttccaa 300
cagcacaaat aacgggttat tgtttataaa tactactatt gccagcattg ctgctaaaga 360
agaaggggta tctctcgaga agagagaggc tgaagcatcg atgaattcca tggctgtgcc 420
tgcaagccca cagcacccac gggggtacgg catcctgctg ctcacgctcc ttctgaaagc 480
tctcgccacc accgcctccg cctgcaacca ccttcgcccc caggatgcca ccttctctca 540
cgacagcctc cagctcctcc gggacatggc tcccacacta ccccagctgt gcccacagca 600
caacgcgtct tgctccttca acgacaccat cctggacacc agcaacaccc ggcaagccga 660
caaaaccacc cacgacatcc ttcagcacct cttcaaaatc ctcagcagcc ccagcactcc 720
agcccactgg aacgacagcc aacgccaaag cctcctcaac cggatccacc gctacaccca 780
gcacctcgag caatgcttgg acagcagcga cacgcgctcc cggacgcgat ggcctcgcaa 840
ccttcacctc accatcaaaa aacacttcag ctgcctccac accttcctcc aagacaacga 900
ttacagcgcc tgcgcctggg aacacgtccg cctgcaagct cgtgcctggt tcctgcacat 960
ccacaacctc acaggcaaca cgcgcactct agaacaaaaa ctcatctcag aagaggatct 1020
gaatagcgcc gtcgaccatc atcatcatca tcattgagtt tgtagcctta gacatgactg 1080
ttcctcagtt caagttgggc acttacgaga agaccggtct tgctagattc taatcaagag 1140
gatgtcagaa tgccatttgc ctgagagatg caggcttcat ttttgatact tttttatttg 1200
taacctatat agtataggat tttttttgtc attttgtttc ttct 1244
<210> 4
<211> 1079
<212> DNA
<213> 人工序列
<400> 4
aacctttttt tttatcatca ttattagctt actttcataa ttgcgactgg ttccaattga 60
caagcttttg attttaacga cttttaacga caacttgaga agatcaaaaa acaactaatt 120
attcgaaacg atgagatttc cttcaatttt tactgctgtt ttattcgcag catcctccgc 180
attagctgct ccagtcaaca ctacaacaga agatgaaacg gcacaaattc cggctgaagc 240
tgtcatcggt tactcagatt tagaagggga tttcgatgtt gctgttttgc cattttccaa 300
cagcacaaat aacgggttat tgtttataaa tactactatt gccagcattg ctgctaaaga 360
agaaggggta tctctcgaga agagagaggc tgaagcatgt aaccaccttc gcccccagga 420
tgccaccttc tctcacgaca gcctccagct cctccgggac atggctccca cactacccca 480
gctgtgccca cagcacaacg cgtcttgctc cttcaacgac accatcctgg acaccagcaa 540
cacccggcaa gccgacaaaa ccacccacga catccttcag cacctcttca aaatcctcag 600
cagccccagc actccagccc actggaacga cagccaacgc caaagcctcc tcaaccggat 660
ccaccgctac acccagcacc tcgagcaatg cttggacagc agcgacacgc gctcccggac 720
gcgatggcct cgcaaccttc acctcaccat caaaaaacac ttcagctgcc tccacacctt 780
cctccaagac aacgattaca gcgcctgcgc ctgggaacac gtccgcctgc aagctcgtgc 840
ctggttcctg cacatccaca acctcacagg caacacgcgc actctagaac aaaaactcat 900
ctcagaagag gatctgaata gcgccgtcga ccatcatcat catcatcatt gagtttgtag 960
ccttagacat gactgttcct cagttcaagt tgggcactta cgagaagacc ggtcttgcta 1020
gattctaatc aagaggatgt cagaatgcca tttgcctgag agatgcaggc ttcattttt 1079
