作为相应的5-硫烷基组氨酸和其二硫化物的前体的新型5-酰基硫烷基-组氨酸化合物
文献发布时间:2023-06-19 09:29:07
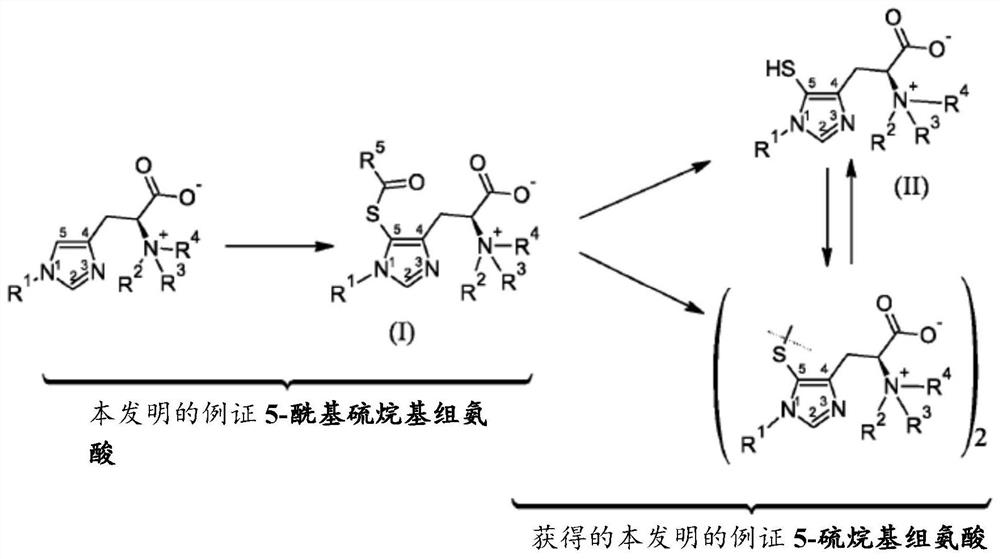
本申请为申请日是2015年5月29日、申请号是201580040441.7 (PCT/FR2015/051416)、发明名称为“作为相应的5-硫烷基组氨酸和其二硫化物的前体的新型5-酰基硫烷基-组氨酸化合物”的中国申请的分案申请。
本发明涉及:
-新型5-酰基硫烷基-组氨酸化合物(和其衍生物);
-用于制备所述化合物和衍生物的方法;
-其作为相应的5-硫烷基组氨酸和其二硫化物的前体的用途。
本发明涉及新型5-酰基硫烷基-组氨酸化合物和其衍生物,以及用于制备所述化合物和衍生物的方法以及其作为相应的5-硫烷基组氨酸和其二硫化物的前体的用途。更特定地,本发明涉及新型5-酰基硫烷基-组氨酸化合物和其衍生物、作为相应的5-硫烷基组氨酸和其二硫化物的直接前体的其盐的合成。关于“-SH”基团的新近IUPAC命名“硫烷基”用于本发明中所述的化合物来代替过去在文献中所用的不同术语,如“硫代组氨酸”、“硫醇组氨酸”或“巯基组氨酸”。
现有技术
5-硫烷基-咪唑基团很少在自然界中发现(Caroll A.和Avrey V.M.;J.Nat.Prod.;2009;72;696-699)。迄今已经发现极少数包含5-硫烷基组氨酸主链(在咪唑环的位置3中甲基化或未甲基化)的天然产物 (Hand C.E.和Honek J.F.;J.Nat.Prod.;2005;68;293-308)。大多数为细菌或海洋来源。第一实例由腺素红(adenochromine)A、B和C(Ito S. 和Prota G.;JCS Chem.Comm.;1977;251-252;Rossi F.,Nardi G., Palumbo A.和Prota G.;Comp.Biochem.Physiol.1985,80b,843-845)和断-腺素红A、B和C(Ito S.,Nardi G.和Prota G.;JCS Chem.Comm.; 1976;1042)的组组成。由皮革海星(Dermasteriasimbricate)产生的苯基四氢异喹啉生物碱(Imbricatine)构成了第二实例(Pathirana C.和 Andersen R.J.;J.Am.Chem.Soc.;1986;108,8288-8289)。卵硫醇A、 B和C(Turner E.,Klevit R.E.和Shapiro B.M.;J.Biol.Chem.;1986; 261;13056)构成了包含在位置3中甲基化的5-硫烷基组氨酸主链的天然产物的甚至更受限组的第三实例(应注意,甲基的位置最初不正确地位于组氨酸的N1氮上,如Holler等人JOC 1987,4421-4423对比 Palumba等人,THL 1982,3207-3208所证明)。最近,发现了含有5- 硫烷基组氨酸主链的新型吲哚生物碱Leptoclinidamine C(Caroll A.和 Avrey V.M.;J.Nat.Prod.;2009;72;696-699)。
已经描述了卵硫醇A、B和C的生物合成(Vogt R.N.,Spies H.S.C. 和SteenkampD.J.;Eur.J.Biochem.;2001,268,5229-5241)。L-组氨酸的咪唑环的位置5中硫的引入是在亚砜合酶酶(OvoA)以及亚铁离子 (Fe
通过化学合成来制备2-硫烷基组氨酸和其衍生物已经由申请人用文件证明(专利US 13/121,891和专利US 13/500,887 A1)。
通过化学合成来制备5-硫烷基组氨酸和其衍生物结果比其2-硫烷基组氨酸异构体的制备难得多。考虑并且测试了数种合成策略,但不成功。迄今,仅2种获取途径(accessroutes)已经仅产生5-硫烷基-3- 甲基组氨酸的系列。第一种方法由在卵硫醇A和C的合成背景下以10至12个步骤重头合成5-硫烷基咪唑环(Hopkins P.等人;JOC;1987, 52,2977和4420)组成。第二种方法由在苯基四氢异喹啉生物碱的合成背景下通过CHO甲醛吸电子基团(Ohba M.,Nishimura Y.,Kato M. 和Fujii T.;Tetrahedron;1999,55,4999-5016)活化的5-溴咪唑环的亲核取代组成。目前,尚无已知的用于将硫原子直接引入至组氨酸或其衍生物之一内的咪唑环的位置5中的非酶促化学方法。
SPALTENSTEIN在“The Journal of Organic Chemistry,第52卷, 第14期,第2977-2979页”中的文章公开了一种用于制备通过相应的硫酰胺(thionoamide)的环化获得的化合物8(第2978页)的方法,但所述硫酰胺鉴于以下技术要素无法对应于本发明的任何化合物。
以相同方式,Heng Song在标题为“Regioselectivity of the oxidative C-SBond Formation in Ergothioneine and Ovothiol Biosyntheses,”的 OrganicLetters,第15卷,第18期,2013年9月20日,第4854-4857 页中的文章公开了化合物卵硫醇(8)(第4855页,方案1),所述化合物鉴于以下技术要素不对应于本发明的任何化合物。
实际上,如上文第2页第16-20行所提到,卵硫醇A、B和C的初始结构在SPALTENSTEIN和Song的这两篇文章中关于组氨酸的咪唑环的氮上甲基基团的定位不正确地加以定义。最初不正确地位于组氨酸的N1氮上,这个甲基基团在N3氮上“再定位”,如Holler等人 JOC 1987,20,4421-4423对比Palumba等人,THL 1982,3207-3208)中所证明。
因此,卵硫醇A、B和C的结构根据Holler等人(JOC 1987,20, 4421-4423)的公布充分确立,所述公布根据以下实例已经在本申请中引用并且被科学界接受:
卵硫醇C:参见Bailly等人,Bioorg.Med.Chem.,2003,11, 4623-4630,图1,第4624页;
卵硫醇A、B和C:参见De Luna等人,J.Phys.Chemistry,2013, DOI:10.1021/jp402514w;
卵硫醇A:参见Mashabela等人,Chem.Comm.,2013,49, 7714-7716。
由于SPALTENSTEIN和Song文档是基于位置N1中甲基的错误位置,当其应正确地位于位置N3中时,结果是SPALTENSTEIN或 Song的化合物8(具有经过校正的结构)对应于下文描述的本发明式 (II)的条件。
所述5-酰基硫烷基-组氨酸化合物和其衍生物将构成5-硫烷基组氨酸和其衍生物的极佳前体。由于这些5-酰基硫烷基-组氨酸化合物和其衍生物未知,因此将有必要具有一种使得能够直接将酰基硫烷基基团引入组氨酸的位置5中的合成方法。据我们所知,迄今尚未描述此类方法。用于在组氨酸或其衍生物之一的位置5中直接引入酰基硫烷基基团的这种新型方法在任何情况下均将更有利,因为所述方法可能无需保护基并且在作为反应溶剂的水中进行。
发明目标
本发明的目标之一因此是提供能够作为相应的5-硫烷基组氨酸和其二硫化物的前体的新型5-酰基硫烷基-组氨酸化合物和其衍生物。
本发明的另一目标是一种使用将酰基硫烷基基团直接引入组氨酸或其衍生物之一的位置5中而无需保护基并且在作为溶剂的水中的新型方法来制备这些新型5-酰基硫烷基-组氨酸化合物和其衍生物的方法。
本发明的另一目标是这些新型5-酰基硫烷基-组氨酸化合物和其衍生物作为相应的5-硫烷基组氨酸和其二硫化物的前体的用途。
这些目标由本发明通过使用用于引入酰基硫烷基基团的新型方法实现,本发明是基于新型5-酰基硫烷基-组氨酸化合物和其衍生物的设计和制备,所述化合物和衍生物显示为相应的5-硫烷基组氨酸和其二硫化物的卓越前体。这已经由申请人举例说明。
发明描述
因此,本发明的目标是:
1)解决技术问题,即提供新型5-酰基硫烷基-组氨酸化合物和其衍生物,因此构成相应的5-硫烷基组氨酸和其二硫化物的前体;
2)根据包括一种使用将酰基硫烷基基团直接引入组氨酸的咪唑环的位置5中而无需保护基并且在作为反应溶剂的水中的新型方法来制备这些新型5-酰基硫烷基-组氨酸衍生物的方法的解决方案来解决这一技术问题。
上文陈述的技术问题首次通过本发明以极简单并且经济的方式同时解决,所述用于制备所述新型5-酰基硫烷基-组氨酸衍生物的方法极简单地进行,同时产生良好产率。
根据第一方面,本发明涉及具有以下通式(I)的新型5-酰基硫烷基 -组氨酸化合物和其衍生物:
其中:
R
R
R
R
本发明包括单独或呈混合物形式取得的所有立体异构体、非对映异构体和对映异构体,特别地就携带基团COOH的碳原子来说。
本发明还包括所述通式(I)的化合物的所有药学上可接受的酸的盐。
在通式(I)的化合物中,本发明尤其涉及:
-特征在于R
-在实验部分中制备的那些,尤其
1.L-5-乙酰基硫烷基-组氨酸(化合物1);
2.L-5-乙酰基硫烷基-组氨酸-α,N,N(二甲基)-组氨酸(化合物2);
3.L-5-乙酰基硫烷基-α,N,N,N(三甲基)-组氨酸(化合物3);
4.L-5-乙酰基硫烷基-α,N(甘氨酰基)-组氨酸(化合物4);
5.L-5-乙酰基硫烷基-α,N,N(二甲基)-1-甲基组氨酸(化合物5);
6.L-5-乙酰基硫烷基-α,N,N,N(三甲基)-1-甲基组氨酸(化合物6);
7.L-5-乙酰基硫烷基-α,N(L-丙氨酰基)-组氨酸(化合物7);
8.L-5-乙酰基硫烷基-α,N(戊酰基)-组氨酸(化合物8);
9.L-5-乙酰基硫烷基-α,N(甲基)-组氨酸(化合物9);
10.L-5-乙酰基硫烷基-α,N(乙酰基)-组氨酸(化合物10);
11.L-5-乙酰基硫烷基-α,N(苯甲酰基)-组氨酸(化合物11);
12.L-5-乙酰基硫烷基-α,N(β-丙氨酰基)-组氨酸(化合物12);
13.L-1-甲基-5-乙酰基硫烷基-组氨酸(化合物13);
14.L-5-苯甲酰基硫烷基-组氨酸(化合物14);
15.L-5-苯甲酰基硫烷基-α,N,N(二甲基)-组氨酸(化合物15);
16.L-5-苯甲酰基硫烷基-α,N,N,N(三甲基)-组氨酸(化合物16);
17.L-5-乙酰基硫烷基-α,N(L-苯基丙氨酰基)-组氨酸(化合物17)。
在药学上可接受的酸中,可以非限制性方式列举无机酸,如盐酸、氢溴酸、氢碘酸、硫酸、和磷酸,或有机酸,如甲酸、乙酸、酒石酸、三氟乙酸、丙酸、苯甲酸、马来酸、富马酸、琥珀酸、柠檬酸、草酸、乙醛酸、和天冬氨酸;和烷烃磺酸,如甲烷磺酸、三氟甲烷磺酸、乙烷磺酸,和芳基磺酸,如苯磺酸和对甲苯磺酸。
在以上式(I)中:
-烷基表示包含1至6个碳原子的直链或环状(可能支链)基团,
-取代的烷基表示由一个或多个氟原子取代,或由包含一个或多个碳-碳双键的烯基取代,或由一个或多个OH或SH或NH
-芳基表示任选氟化或全氟化的苯基基团,并且任选地包含一个或多个OH或SH或NH
-α-氨基-酰基表示任何蛋白氨基酸的酰基,所述蛋白氨基酸也就是说进入植物或动物世界(包括人)中发现的蛋白的组成中的任何氨基酸。
根据第二方面,本发明还涉及一种用于制备在附图1中明确给出的通式(I)的新型5-酰基硫烷基-组氨酸化合物和其衍生物的方法A,并且其特征在于其包括以下步骤:
1)该组氨酸、外消旋体(DL)或其对映异构体之一(D或L),或
-在咪唑环的位置1中的氮上烷基化的其衍生物之一、外消旋体 (DL)或其对映异构体之一(D或L),或
-在α-胺官能的氮上烷基化或酰化的其衍生物之一、外消旋体 (DL)或其对映异构体之一(D或L),或
-在咪唑环的位置1中的氮上烷基化并且在α-胺官能的氮上烷基化或酰化的其衍生物之一、外消旋体(DL)或其对映异构体之一(D或 L),
在1至2当量的无机酸或有机酸存在下,与
a)产生卤鎓离子X
b)式烷基C(=O)SH的硫代羟酸类型的含硫试剂或其盐之一在极性质子溶剂中反应,
2)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化。
根据根据本发明的方法A的一个特定实施方案:所述产生卤鎓离子X
a)溴Br
b)NBS或任何N-溴-酰亚胺和N-溴-酰胺衍生物
根据根据本发明的这一方法A的另一特定实施方案,所述极性质子溶剂可为水或水溶液。
根据根据本发明的方法A的另一特定实施方案,所述硫代羟酸类型的含硫试剂可为例如硫代乙酸;或硫代苯甲酸,或其混合物。
根据根据本发明的方法A的另一特定实施方案,所述硫代羟酸盐类型的含硫试剂可为例如硫代乙酸钾,任选地呈具有上文提到的硫代羟酸的混合物形式。
根据根据本发明的这一方法A的另一特定实施方案,所述温度将为0-5℃。
这一方法A的创新特征是基于将酰基硫烷基RC(=O)S基团直接引入组氨酸或其衍生物之一的咪唑环的位置5中,而不使用保护基并且在作为反应溶剂的水中的新型反应。这特别令人吃惊,假定在相同操作条件下,使用半胱氨酸来代替硫代羟酸会导致咪唑环的位置2中硫的引入,如专利US 13/121,891和专利US 13/500,887 A1所示。
根据第三方面,本发明涉及上文提到的式(I)的5-酰基硫烷基化合物或其衍生物的用途,其用于制备下文所述的相应的5-硫烷基组氨酸化合物和其二硫化物。
根据第四方面,本发明涵盖具有以下通式(II)的新型5-硫烷基组氨酸化合物和其衍生物:
其中:
R
R
应理解当R
本发明包括分别地或呈混合物形式取得的所有立体异构体、非对映异构体和对映异构体,特别地就携带COOH基团的碳原子来说,以及所有相应的二硫化物。
本发明还包括所述通式(II)的化合物的所有药学上可接受的酸的盐。
在通式(II)的化合物中,本发明尤其涉及:
-特征在于R
-在实验部分中制备的那些,尤其:
1.L-5-硫烷基-α,N(甲基)-组氨酸的二硫化物(化合物22);
2.L-5-硫烷基-α,N(甲基)-组氨酸(化合物23);
3.L-5-硫烷基-α,N,N(二甲基)-组氨酸的二硫化物(化合物24);
4.L-5-硫烷基-α,N,N(二甲基)-组氨酸(化合物25);
5.L-5-硫烷基-α,N,N,N(三甲基)-组氨酸(化合物26);
6.L-5-硫烷基-α,N,N,N(三甲基)-组氨酸的二硫化物(化合物27);
7.L-5-硫烷基-α,N(乙酰基)-组氨酸的二硫化物(化合物28);
8.L-5-硫烷基-α,N(乙酰基)-组氨酸(化合物29);
9.L-5-硫烷基肌肽(化合物30);
10.命名为异-卵硫醇A的二硫化物的L-5-硫烷基-1-甲基组氨酸的二硫化物(化合物31);
11.命名为异-卵硫醇A的L-5-硫烷基-1-甲基组氨酸(化合物 32);
12.L-5-硫烷基-α,N,N(二甲基)-1-甲基组氨酸的二硫化物(化合物 33);
13.L-5-硫烷基-α,N,N,N(三甲基)-1-甲基组氨酸(化合物34);
14.L-5-硫烷基-α,N(L-丙氨酰基)-组氨酸(化合物35);
15. 5-硫烷基-α,N(戊酰基)-组氨酸的二硫化物(化合物36)。
在药学上可接受的酸中,可以非限制性方式列举无机酸,如盐酸、氢溴酸、氢碘酸、硫酸、磷酸,或有机酸,如甲酸、乙酸、酒石酸、三氟乙酸、丙酸、苯甲酸、马来酸、富马酸、琥珀酸、柠檬酸、草酸、乙醛酸、天冬氨酸;烷烃磺酸,如甲烷磺酸、三氟甲烷磺酸、乙烷磺酸,芳基磺酸,如苯磺酸和对甲苯磺酸。
在以上式(II)中:
-烷基表示包含1至6个碳原子的直链或环状(任选地支链)基团
-取代的烷基表示由一个或多个氟原子取代,或由包含一个或多个碳-碳双键的烯基取代,或由一个或多个OH或SH或NH
-芳基表示任选氟化或全氟化的苯基基团,并且任选地包含一个或多个OH或SH或NH
-α-氨基-酰基表示任何蛋白氨基酸的酰基,所述蛋白氨基酸也就是说进入植物或动物世界(包括人)中发现的蛋白的组成中的任何氨基酸。
-二硫化物表示通过本发明所述的5-硫烷基组氨酸类型的衍生物的两个相同分子之间的氧化获得的任何化合物。
所述具有通式(II)的新型5-硫烷基组氨酸化合物和其衍生物以及其二硫化物可能证明为营养性的、美容或医学活性物质。
根据第五方面,本发明进一步涉及一种用于制备由上文方法A 中所述的通式(I)的5-酰基硫烷基-组氨酸化合物和其衍生物获得的通式(II)的5-硫烷基组氨酸化合物和其衍生物的方法B,且其特征在于其包括以下步骤:
1)直接地(方法B1):
a)通过在硫醇存在下在20℃以上的温度下搅拌使根据本发明获得的5-酰基硫烷基-组氨酸衍生物在极性质子溶剂中水解,
b)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化。
2)或间接地(方法B2):
a)通过在20℃以上的温度下搅拌使根据本发明获得的5-酰基硫烷基-组氨酸衍生物在极性质子溶剂中水解以便获得相应的二硫化物,
b)接着,通过与硫醇反应来还原所述二硫化物,
c)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化。
根据根据本发明的这一方法B的一个特定实施方案,所述极性质子溶剂可为水或水溶液。
根据根据本发明的方法B的另一特定实施方案,所述硫醇可为例如巯基丙酸或二硫苏糖醇,或其混合物。
根据根据本发明的这一方法B的另一特定实施方案,所述温度可在20与130℃之间。
通过这一方面,申请人证明了所述通式(I)的化合物在水解后作为通式(II)的5-硫烷基组氨酸化合物和其衍生物的前体的能力。
根据第六方面,本发明还涉及一种用于制备5-硫烷基组氨酸和其衍生物的二硫化物的方法C:
1)直接地由所述通式(I)的5-酰基硫烷基-组氨酸化合物和其衍生物制备,其特征在于其包括以下步骤:
a)通过在空气中并且在20℃以上的温度下搅拌使根据本发明获得的通式(I)的5-酰基硫烷基-组氨酸衍生物在极性质子溶剂中水解以便获得相应的二硫化物,
b)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化;
2)或由通式(II)的5-酰基硫烷基-组氨酸和其衍生物制备,其特征在于其包括以下步骤:
a)通过氧气或二甲亚砜或本领域技术人员众所周知的任何其它氧化方法进行氧化,
b)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化。
通过这一方面,申请人证明了所述通式(I)的5-酰基硫烷基-组氨酸化合物在水解和氧化后作为5-硫烷基组氨酸和其衍生物的二硫化物的前体的能力。
根据第七方面,本发明还涉及一种通过组合方法A与B或C而制备所述5-硫烷基组氨酸衍生物和由相应的组氨酸衍生物制备其相应的二硫化物的“一锅”方法D,且其特征在于其包括以下步骤:
在1至2当量的无机酸或有机酸存在下,与:
a)产生卤鎓离子X
b)式烷基C(=O)SH的硫代羟酸类型的含硫试剂或其盐之一在极性质子溶剂中反应,
随后,
1):
c)通过在硫醇存在下在70与130℃之间的温度下搅拌使所获得的5-酰基硫烷基-组氨酸衍生物在极性质子溶剂中水解,
d)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化。
2)或:
d)通过在70与130℃之间的温度下搅拌使所获得的5-酰基硫烷基-组氨酸衍生物在极性质子溶剂中水解以便获得相应的二硫化物,
e)接着,任选地,通过柱液相色谱法或本领域技术人员众所周知的任何其它纯化方法进行纯化。
附图描述
本发明包括4个图。
实施例描述:
以下实施例以及本发明方法的方案(参见图1)仅为了说明而提供并且决不能限制本发明的范围。
在下文所述的实施例中,除非另外指出,否则温度为环境温度或以摄氏度给出的温度,并且压力为大气压力。
除了以下化合物外,所用试剂可从如SAF(France)、Alfa Aesar、 FisherScientific、TCI Europe、Bachem(Switzerland,AKOS(Germany) 的国际供应商购得:N-甲基组氨酸盐酸盐、N,N-二甲基组氨酸盐酸盐水合物和L-组氨酸三甲基内盐,其根据所引用的方案制备。
除非另外指出,否则所有实验均在环境大气下进行。
在第一段中,给出通过用二溴或N-溴琥珀酰亚胺(NBS)活化和用硫代乙酸形成的中间体的反应来制备5-酰基硫烷基-组氨酸衍生物的实施例。
在第二段中,给出作为5-硫烷基组氨酸和其衍生物的前体的一般原位制备的这些5-酰基硫烷基衍生物的用途的实施例。
实施例1:通过用二溴活化和与硫代乙酸反应来制备L-5-乙酰基硫烷基-组氨酸(化合物1)
将单水合L-组氨酸的盐酸盐(52.93g;250mmol;1当量)溶解于 1.5L脱矿物质水中,接着将所述溶液在30分钟内冷却至0℃。在强烈搅拌下,极快速地逐滴添加二溴(16.7mL;51.93g;325mmol;1.3 当量)。所述溶液变红。极快速地添加硫代乙酸(73.3mL;78.46g;1 mol;4当量):所述溶液立即脱色并且从红色改变为浅黄色。将剧烈搅拌在0℃下维持1h。
化合物1以72mol%的反应产率获得,如从
所述混合物的样品的
在2.48ppm处检测到对应于过量的硫代乙酸的单峰,也在2.0 ppm处检测到对应于如乙酸的副产物的低强度信号。代表性光谱包括于图2中。
LCMS(APCI):228.0[M-H]
实施例2:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备 L-5-乙酰基硫烷基-组氨酸(化合物1)
将单水合L-组氨酸的盐酸盐(10.48g;50mmol;1当量)溶解于 300mL含有37%浓盐酸溶液(4.17mL;4.92g;50mmol;1当量)的脱矿物质水中,接着将所述溶液冷却至0℃。维持极强烈搅拌。一次性添加N-溴琥珀酰亚胺(11.56g;65mmol;1.3当量):所述混合物在 30秒后变为清澈橙色。温度上升至1℃。2分30秒后,一次性添加硫代乙酸(14.7mL;15.69g;200mmol;4当量):脱色极快速地发生。温度上升至4℃。在冷却至0℃之后,剧烈搅拌维持1h。
化合物1以75mol%的反应产率获得,如从H
实施例3:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备 L-5-乙酰基硫烷基-α,N,N(二甲基)-组氨酸(化合物2)
将单水合α-N,N(二甲基)-组氨酸的盐酸盐(6.06g;25mmol;1当量)(参见V.N.Reinhold等人,J.Med.Chem.1968,11,258-260)溶解于135mL脱矿物质水中。接着,添加37%浓盐酸溶液(2.1mL;2.46g; 25mmol;1当量),并且将所得溶液冷却至1℃。维持极剧烈搅拌。快速地添加N-溴琥珀酰亚胺(2.31g;13mmol;1.3当量)。1分钟之后,极快速地添加硫代乙酸(2.94mL,3.14g;40mmol;4当量)。将剧烈搅拌在0℃下维持30分钟。
化合物2以70mol%的反应产率获得,如从
所述混合物的样品的
在2.47ppm处检测到对应于过量的硫代乙酸的单峰,也在2.0 ppm处检测到对应于如乙酸的副产物的低强度信号。代表性光谱包括于图3中。
将化合物2在二氧化硅柱上使用乙酸乙酯/乙醇梯度、随后用水洗脱进行纯化。
在8.33ppm处检测到对应于水解产物(化合物18b)的低强度单峰。
LCMS(APCI):258.9[M+H]
实施例4:通过用二溴活化和与硫代乙酸反应来制备L-5-乙酰基硫烷基-α,N,N(二甲基)-组氨酸(化合物2)
将单水合α-N,N(二甲基)组氨酸的盐酸盐(1.66g;6.98mmol;1 当量)(参见V.N.Reinhold等人,J.Med.Chem.1968,11,258-260)溶解于57mL脱矿物质水中,接着将所述溶液冷却至0℃。在强烈搅拌下,在3分钟内逐滴添加二溴(470μL;1.45g;9.08mmol;1.3当量)。所述溶液变红。1分钟之后,极快速地添加硫代乙酸(2.56mL;2.74g; 34.91mmol;5当量):所述溶液立即脱色并且从红色改变为澄清黄色。剧烈搅拌在0℃下维持1h。
化合物2以69mol%的反应产率获得,如从
实施例5:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备 L-5-乙酰基硫烷基-α,N,N,N(三甲基)-组氨酸(化合物3)
将L-组氨酸三甲基内盐(2.0g;9.96mmol;1当量)(参见V.N. Reinhold等人,J.Med.Chem.1968,11,258-260)溶解于55mL脱矿物质水中。接着,添加37%浓盐酸溶液(1.66mL;1.96g;19.91mmol; 2当量),并且冷却至0℃。在强烈搅拌下,添加N-溴琥珀酰亚胺(2.48 g;13.94mmol;1.4当量):所述溶液变红。5分钟之后,极快速地添加硫代乙酸(4.4mL;4.69g;59.74mmol;6当量)。所述搅拌维持40 分钟。
化合物3以65mol%的反应产率获得,如从
所述混合物的样品的
对应于过量的硫代乙酸和对应于所述琥珀酰亚胺的两个单峰在 2.44ppm和2.76ppm处,也在2.0ppm处检测到对应于如乙酸的副产物的低强度信号。代表性光谱包括于图4中。
将产物在二氧化硅柱(乙酸乙酯/乙醇/水梯度)上纯化。
LCMS(APCI):272.1[M+H]
实施例6:通过用溴活化和与硫代乙酸反应来制备L-5-乙酰基硫烷基-α,N,N,N(三甲基)-组氨酸(化合物3)
将L-组氨酸三甲基内盐(1.0g,5mmol;1当量)溶解于35mL脱矿物质水中。接着,添加37%浓盐酸溶液(417μL;5mmol;1当量),并且将所述溶液冷却至1℃。在强烈搅拌下,添加二溴(0.33mL;1.03 g;6.5mmol;1.3当量):红色胶状物在第一相中形成并且30分钟之后溶解。4分钟之后,极快速地添加硫代乙酸(2.20mL;2.68g;25 mmol;10当量)。所述搅拌持续30分钟。
化合物3以68mol%的反应产率获得,如从
实施例7:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备 L-5-乙酰基硫烷基-α,N(甘氨酰基)-组氨酸(化合物4)
将α,N(甘氨酰基)-组氨酸(212mg,1mmol;1当量)溶解于7mL 脱矿物质水和1mL乙腈中。接着,添加37%浓盐酸溶液(170μL,2 mmol;2当量),并且将所述溶液冷却至0℃。在强烈搅拌下,添加 N-溴琥珀酰亚胺(230mg,1.3mmol;1.3当量)。3分钟之后,极快速地添加硫代乙酸(370μL,5.0mmol;5当量)。搅拌在0℃下维持30 分钟。
化合物4以62mol%的反应产率获得,如从
所述混合物的样品的
在2.48ppm处检测到对应于过量的硫代乙酸的单峰,在2.78ppm 处检测到对应于所述琥珀酰亚胺的单峰,也在2.0ppm处检测到对应于如乙酸的副产物的低强度信号。
LCMS(APCI):287.3[M+H]+
实施例8:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备 L-5-乙酰基硫烷基-α,N,N(二甲基)-1-甲基组氨酸衍生物(化合物5)。
a)制备α,N,N(二甲基)-1-甲基-L-组氨酸
α,N,N(二甲基)-1-甲基-L-组氨酸与关于α,N,N(二甲基)-L-组氨酸所述的方案(V.N.Reinhold等人,J.Med.Chem.1968,11,258-260)类似由1-甲基-L-组氨酸和甲醛通过在钯/活化炭(88%)存在下还原胺化来制备。
b)制备L-5-乙酰基硫烷基-α,N,N(二甲基)-1-甲基组氨酸衍生物
将α,N,N(二甲基)-1-甲基组氨酸(604mg,3mmol;1当量)溶解于 22mL脱矿物质水中。添加37%浓盐酸(250μL,3mmol;3当量),接着将所述溶液冷却至0℃。维持极强烈搅拌。快速地添加N-溴琥珀酰亚胺(700mg,3.9mmol;1.3当量)。3分钟之后,极快速地添加硫代乙酸(1.1mL,15mmol;5当量)。将剧烈搅拌在0℃下维持30分钟。
化合物5以65mol%的反应产率获得,如从
所述混合物的样品的
在2.48ppm处检测到对应于过量的硫代乙酸的单峰,在2.78ppm 处检测到对应于所述琥珀酰亚胺的单峰,也在2.0ppm处检测到对应于如乙酸的副产物的低强度信号。
将产物在二氧化硅柱上使用2/2/1乙酸乙酯/乙醇/水梯度进行纯化,随后用1/1乙醇/水混合物洗脱。获得透明油状物形式的化合物5 (48%)。
在1.18ppm和3.65ppm处检测到乙醇的信号。
LCMS(APCI):272.3[M+H]+
实施例9:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备 L-5-乙酰基硫烷基-α,N,N,N(三甲基)-1-甲基组氨酸(化合物6)
a)制备1-甲基-组氨酸三甲基内盐
1-甲基-组氨酸三甲基内盐与关于组氨酸三甲基内盐所述的方案 (V.N.Reinhold等人,J.Med.Chem.1968,11,258-260)类似由1-甲基- 二甲基-L-组氨酸和碘甲烷通过在甲醇(89%)中季铵化来制备。
b)制备L-5-乙酰基硫烷基-α,N,N,N(三甲基)-1-甲基组氨酸(化合物6)
将1-甲基-组氨酸三甲基内盐(430mg,2mmol;1当量)溶解于 15mL脱矿物质水中。添加37%浓盐酸(170μL,2mmol;1当量),接着将所述溶液冷却至0℃。在强烈搅拌下,添加N-溴琥珀酰亚胺(465 mg,2.6mmol;1.3当量)。3分钟之后,极快速地添加硫代乙酸(740μL,10mmol;5.0当量)。将搅拌在0℃下维持30分钟。
化合物6以67mol%的反应产率获得,如从
所述混合物的样品的
在2.48ppm处检测到对应于过量的硫代乙酸的单峰,在2.78ppm 处检测到对应于所述琥珀酰亚胺的单峰,也在2.0ppm处检测到对应于如乙酸的副产物的低强度信号。
LCMS(APCI):286.0[M+H]+
实施例10:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备L-5-乙酰基硫烷基-α,N(L-丙氨酰基)-组氨酸(化合物7)
将α,N(L-丙氨酰基)-组氨酸(500mg,2.2mmol;1当量)溶解于 15mL含有37%浓盐酸溶液(370μL,4.4mmol;2当量)的脱矿物质水中,接着将所述溶液冷却至0℃。一次性添加N-溴琥珀酰亚胺(510mg, 2.9mmol;1.3当量):所述混合物在30秒后变为清澈橙色。3分钟之后,极快速地添加硫代乙酸(820μL,11.0mmol;5当量)。将剧烈搅拌在0℃下维持30分钟。
化合物7以65mol%的反应产率获得,如从样品的
将所述反应混合物用2×25mL乙酸乙酯洗涤,接着将所述化合物在二氧化硅柱(乙酸乙酯/乙醇/水2/2/1)上纯化。获得透明油状物形式的化合物7(410mg,54%,纯度88%)。
在2.68ppm处检测到对应于所述琥珀酰亚胺的单峰。
LCMS(APCI):301.1[M+H]+
实施例11:通过用N-溴琥珀酰亚胺活化和与硫代乙酸反应来制备5-乙酰基硫烷基-α,N(戊酰基)-组氨酸衍生物(化合物8)
将α,N(戊酰基)-组氨酸(450mg,1.43mmol;1当量)溶解于10mL 含有37%浓盐酸溶液(120μL,1.43mmol;1当量)的脱矿物质水中,接着将所述溶液冷却至0℃。维持极强烈搅拌。添加N-溴琥珀酰亚胺 (330mg,1.86mmol;1.3当量)。3分钟之后,极快速地添加硫代乙酸(530μL,7.15mmol;5当量)。将剧烈搅拌在0℃下维持30分钟。
化合物8以67mol%的反应产率获得,如从样品的
将产物在二氧化硅柱(90%乙酸乙酯/乙醇3/1和10%水的混合物) 上纯化。获得透明油状物的形式的5-乙酰基硫烷基α,N(戊酰基)-组氨酸(化合物8)(320mg,64%,纯度90%)。
LCMS(APCI):314.1[M+H]+
为了说明本发明,与前述实施例类似地制备化合物9-17(实施例 12-21)。结果以及光谱特征概述于下表1中。
II.1
为了以非限制性方式说明根据本发明的5-酰基硫烷基-组氨酸衍生物的应用,在这一段中给出作为5-硫烷基组氨酸和其衍生物的前体的一般原位制备的新型5-酰基硫烷基-组氨酸衍生物的应用实施例。
这些实施例说明了本发明中所述的新型5-酰基硫烷基衍生物用于容易地制备5-硫烷基组氨酸化合物和其衍生物(如二硫化物)的有用性,此外所述5-硫烷基组氨酸化合物和其衍生物极难制备并且需要多步骤合成。
为了获得5-硫烷基组氨酸衍生物的更佳产率,原位制备所述5- 酰基硫烷基化合物,接着其后通过搅拌反应介质,优选地同时加热所述反应介质而直接地水解。如巯基丙酸或二硫苏糖醇的硫醇的存在证明可用于所述5-硫烷基组氨酸衍生物的容易分离,但水解本身根据不需要所述硫醇,如后续实施例18d、19b和19c中证明。
实施例22:经由5-乙酰基硫烷基组氨酸的原位制备、随后水解来“一锅”制备L-5-硫烷基组氨酸(化合物18)
将单水合L-组氨酸的盐酸盐(10.48g;50mmol;1当量)溶解于 300mL脱矿物质水和37%浓盐酸(4.17mL;4.92g;50mmol;1当量) 中,接着将所述溶液冷却至0℃。维持极强烈搅拌。一次性添加N- 溴琥珀酰亚胺(11.56g;65mmol;1.3当量):所述混合物变为清澈橙色。一次性添加硫代乙酸(14.7mL;15.69g;200mmol;4当量)。将剧烈搅拌在0℃下维持1h。添加3-巯基丙酸(26mL;32.2g;300mmol; 6当量),接着将所述微黄色溶液在90℃下加热18h。将所述溶液用 300mL乙酸乙酯萃取三次。在二硫苏糖醇(231mg;1.5mmol;0.03 当量)存在下中和并且结晶之后,所需化合物18结晶。将所述固体在真空下过滤并且干燥以产生2.97g(31%;41%,相对于中间体SAc 的量)呈灰白色固体形式的L-5-硫烷基组氨酸(化合物18)。
LC-MS(AP-):186.0[M-H]
[α]
元素分析:C
实施例23:经由5-乙酰基硫烷基-组氨酸的原位制备、随后水解来“一锅”制备D-5-硫烷基组氨酸(化合物19)
将D-组氨酸(3.92g;25mmol;1当量)溶解于150mL脱矿物质水和37%浓盐酸溶液(4.17mL;4.92g;50mmol;2当量)中,接着将所述溶液冷却至0℃。维持极强烈搅拌。一次性添加N-溴琥珀酰亚胺 (5.78g;32.5mmol;1.3当量):所述溶液变为清澈橙色。一次性添加硫代乙酸(7.33mL;7.85g;200mmol;4当量)。将剧烈搅拌在0℃下维持1h。添加3-巯基丙酸(13mL;16.1g;150mmol;6当量),接着将所述溶液在100℃下加热18h。在冷却之后,将所述溶液用150 mL乙酸乙酯萃取三次。将二硫苏糖醇(13mL;16.1g;150mmol;6 当量)添加至水相。在活化炭存在下再结晶之后,产量由1.25g呈米黄色固体形式的D-5-硫烷基组氨酸(化合物19)(26%;35%,相对于中间体SAc的量)组成。
[α]
实施例24:经由5-酰基硫烷基-组氨酸的原位制备、随后水解来“一锅”制备D,L-5-硫烷基组氨酸(化合物20)
将单水合DL-组氨酸的盐酸盐(3.21g;15mmol;1当量)溶解于 100mL脱矿物质水和37%浓盐酸溶液(1.25mL;1.48g;15mmol;1 当量)中,接着将所述溶液冷却至0℃。在极强烈搅拌下,一次性添加 N-溴琥珀酰亚胺(3.47g;19.5mmol;1.3当量)。2分钟之后,一次性添加硫代乙酸(4.4mL;4.71g;60mmol;4当量)。将搅拌在0℃下持续1h。添加3-巯基丙酸(8.0mL;9.65g;90mmol;6当量),接着将所述溶液在100℃下加热18h。通过过滤消除对应于硫代乙酸的二硫化物和巯基丙酸的二硫化物的沉淀物。将滤液用100mL乙酸乙酯洗涤两次。在二硫苏糖醇(233mg;1.5mmol;0.1当量)存在下中和并且结晶之后,获得650mg呈白色固体形式的D,L-5-硫烷基组氨酸(化合物20)(23%,29%,相对于中间体SAc的量)。
II.2
实施例25:经由5-酰基硫烷基-组氨酸的原位制备、随后水解和氧化来“一锅”制备L-5-硫烷基组氨酸的二硫化物(化合物21)
将单水合L-组氨酸的盐酸盐(14.82g;70mmol;1当量)溶解于 126L脱矿物质水中,接着将所述溶液冷却至0℃。在强烈搅拌下,极快速地逐滴添加二溴(4.32mL;13.42g;84mmol;1.2当量)。所述溶液变红。极快速地添加硫代乙酸(18.0mL;19.2g;245mmol;3.5 当量)。将剧烈搅拌在0℃下维持20分钟。添加3-巯基丙酸(25mL; 29.71g;280mmol;4当量),并且将所述溶液在80℃下加热过夜。冷却所述溶液,接着用150mL乙酸乙酯萃取3次。在用30%充氧水溶液(3.5mL;3.97g;35mmol;0.5当量)氧化,随后在Dowex WX2 树脂上纯化之后,获得呈浅灰色粉末形式的L-5-硫烷基组氨酸水合盐酸盐的二硫化物(化合物21)(4.66g;24%;37%,相对于中间体SAc 的量)。
LCMS(APCI):373.0[M+H]
[α]
实施例26:
a)经由5-酰基硫烷基-组氨酸的原位制备、随后水解和氧化(化合物 22)来“一锅”制备L-5-硫烷基-α,N(甲基)-组氨酸的二硫化物(化合物 22)
将α,N(甲基)-L-组氨酸的盐酸盐(1.05g;5mmol;1当量)(V.N. Reinhold等人,J.Med.Chem.1968,11,258-260)溶解于35mL含有 37%浓盐酸溶液(420μL(5mmol;1当量))的脱矿物质水中,接着将所述溶液冷却至1℃。维持极强烈搅拌。快速地添加N-溴琥珀酰亚胺 (1.17g;6.5mmol;1.3当量)。接着极快速地添加硫代乙酸(2.57mL; 2.74g;35mmol;7当量)。将剧烈搅拌在0℃下维持30分钟。将所述溶液用40mL乙酸乙酯萃取,接着将3-巯基丙酸(2.2mL;2.65g; 25mmol;5当量)添加至水相。水解通过在100℃下加热20h来进行。在冷却所述溶液之后,将反应介质用35mL乙酸乙酯萃取4次。在氧化并且在DOWEX 50WX2-400树脂上纯化之后,获得呈棕色粉末形式的L-5-硫烷基-α,N(甲基)-组氨酸的二硫化物(化合物22)(620mg, 61%,75%,相对于中间体SAc的量)。
LCMS(APCI):401.0[M+H]
b)通过还原所述二硫化物制备L-5-硫烷基-α,N(甲基)-组氨酸(化合物 23)
将L-5-硫烷基-α,N(甲基)-组氨酸的二硫化物(620mg;1.52mmol, 1当量)(化合物22)溶解于50mL水中。添加二硫苏糖醇(473mg;3.03 mmol;2当量)和活化炭(300mg)。将所述混合物在环境温度下搅拌4 h。在过滤并且在无水乙醇中结晶之后,获得呈米黄色粉末形式的L-5- 硫烷基-α,N(甲基)-组氨酸(化合物23)(351mg,56%)。
LCMS(APCI):202.1[M+H]
实施例27:
a)经由5-酰基硫烷基-组氨酸的原位制备、随后水解和氧化来“一锅”
制备L-5-硫烷基-α,N,N(二甲基)-组氨酸的二硫化物(化合物24)
将单水合α,N,N(二甲基)-组氨酸的盐酸盐(2.43g;10mmol;1当量)溶解于54mL含有37%浓盐酸溶液(835μL;985mg;10mmol;1 当量)的脱矿物质水中,接着将所述溶液冷却至1℃。维持极强烈搅拌。快速地添加N-溴琥珀酰亚胺(2.31g;13mmol;1.3当量)。2分钟之后,极快速地添加硫代乙酸(3.0mL;3.14g;40mmol;4当量)。将剧烈搅拌在0℃下维持30分钟。将获得的微黄色溶液用120mL乙酸乙酯萃取2次。在热水解、氧化并且在DOWEX 50WX2-400树脂上纯化之后,获得呈米黄色粉末形式的L-5-硫烷基-α,N,N(二甲基)-组氨酸的二硫化物的水合盐酸盐(化合物24×4HCl×H2O),1.2g,41%)。
LCMS(APCI):429.2[M+H]
b)制备化合物24游离碱
将L-5-硫烷基-α,N,N(二甲基)-组氨酸的二硫化物的水合盐酸盐(3.6g;5.89mmol,1当量)溶解于53mL脱矿物质水中。添加呈碳酸氢盐形式的树脂
(D
c)通过还原化合物18×4HCl×H
将L-5-硫烷基-α,N,N(二甲基)-组氨酸的二硫化物的水合盐酸盐 (1.2g;2.07mmol;0.5当量)溶解于40mL脱矿物质水中。添加呈碳酸氢盐形式的树脂
LCMS(APCI):216.1[M+H]+
d)所述5-酰基硫烷基化合物(化合物2)水解为所述5-硫烷基组氨酸化合物25的分析监测
如实施例3中所述制备化合物2并且通过柱使用乙酸乙酯/乙醇梯度、随后用水洗脱进行纯化。将含有纯化合物2的水性级分放置于 40℃水浴中并且在搅拌下加热8h。每60分钟收集样品并且通过 HPLC分析所述混合物。
化合物2的水解在8h之后几乎完全,并且以70%产率获得化合物19。
表2:监测通过化合物2的水解形成化合物25:
实施例28:
a)经由5-酰基硫烷基-组氨酸的原位制备、随后水解来“一锅”制备 L-5-硫烷基-α,N,N,N(三甲基)-组氨酸(化合物26)
将L-组氨酸三甲基内盐(5.02g;25mmol;1当量)溶解于135mL 脱矿物质水中并且添加37%浓盐酸溶液(4.17mL;4.93g;50mmol; 2当量);接着将所述溶液冷却至0℃。在强烈搅拌下,添加N-溴琥珀酰亚胺(5.78g;32.5mmol;1.3当量)。5分钟之后,极快速地添加硫代乙酸(18.33mL;19.61g;250mmol;10当量)。将搅拌维持40分钟。将所述溶液用135mL乙酸乙酯萃取2次。将3-巯基丙酸(11.07ml: 13.4g;125mmol;5当量)添加至水相,接着将所述溶液在130℃下加热3h。在二硫苏糖醇(1.95g;12.5mmol;0.5当量)存在下萃取、中和并且结晶之后,获得呈白色粉末形式的L-5-硫烷基-α,N,N,N(三甲基)-组氨酸(化合物26)(2.22g;38%;58%,相对于中间体SAc的量) (待贮藏于惰性气氛下)。
LCMS(APCI):230.0[M+H]+
b)通过在硫醇存在下将所述5-酰基硫烷基化合物3水解为所述化合物L-5-硫烷基-α,N,N,N(三甲基)-组氨酸(化合物26)的
如实施例5所述制备化合物3并且通过柱进行纯化。将100mg (0.33mmol,1当量)化合物3溶解于2.4mL D2O中。添加172mg 3- 巯基丙酸(142μL,5当量),并且将所述溶液在40℃下加热。通过
c)通过5-酰基硫烷基化合物3的水解制备化合物L-5-硫烷基
-α,N,N,N(三甲基)-组氨酸(化合物26)
如实施例5所述制备化合物3并且通过柱进行纯化。将170mg (0.6mmol)化合物3溶解于10mL水中,并且将所述溶液在空气中在 90℃下加热7h。通过HPLC监测转化。化合物3的水解在7h之后完成。将所述溶液蒸发至干。将残留物溶解于5mL甲醇和93mg(0.6 mmol)二硫苏糖醇的混合物中。在惰性气氛下搅拌4h之后,添加2mL 乙醇。沉淀物立即形成,过滤并且用乙醇(2×2mL)洗涤,接着用乙醚 (2×2mL)洗涤。干燥之后,获得104mg(72%)呈米黄色粉末形式的 L-5-硫烷基-α,N,N,N(三甲基)-组氨酸。
d)制备L-5-硫烷基-α,N,N,N(三甲基)-组氨酸的二硫化物(化合物27)
将L-5-硫烷基-α,N,N,N(三甲基)-组氨酸(化合物26,300mg,1.29 mmol,1当量)溶解于50mL脱矿物质水中。将所述无色溶液在环境温度下搅拌4天。在滤液的过滤和冻干之后,获得呈黄色粉末形式的 L-5-硫烷基-α,N,N,N(三甲基)-组氨酸的二硫化物(化合物27)(263mg; 89%)。
LCMS(APCI):457.1[M+H]+。
e)通过所述5-酰基硫烷基化合物3水解并且原位氧化为化合物27的 HPLC进行的分析监测
如实施例5所述制备化合物3并且通过柱使用乙酸乙酯/乙醇梯度、随后用水洗脱进行纯化。将含有纯化合物3的水性级分放置于 40℃水浴中并且在搅拌下加热两天。每小时收集样品,并且通过HPLC 分析所述混合物。
化合物3的水解在2天之后几乎完全,并且以80%产率获得化合物27。
表3:化合物3的水解的监测:
f)通过所述5-酰基硫烷基化合物3水解并且原位氧化为化合物27的
如实施例5所述制备化合物3并且通过柱进行纯化。将30mg化合物3溶解于600μLD
表4:监测化合物3的水解:
实施例29:
a)经由5-酰基硫烷基-组氨酸的原位制备、随后水解和氧化来“一锅”制备L-5-硫烷基-α-N(乙酰基)-组氨酸的二硫化物(化合物28盐酸盐)
将单水合α-N(乙酰基)-L-组氨酸(2.15g,10mmol;1当量)溶解于63mL含有37%浓盐酸(1.67mL,1.97g;20mmol;2当量)的脱矿物质水中;接着将所述溶液冷却至0℃。添加二溴(668μL,2.07g; 13mmol;1.3当量)。一次性添加硫代乙酸(3.67mL;3.92g;50mmol;5当量)。将搅拌在0℃下维持45分钟。将所述溶液在环境温度下再加热。添加3-巯基丙酸(5.26mL,6.36g;60mmol;6当量),接着将所述溶液在80℃下加热过夜。在环境温度下冷却所述溶液,接着用 50mL乙酸乙酯萃取4次。将水相在二氧化硅上纯化以便获得呈橙色油状物形式的L-5-硫烷基-α,N(乙酰基)-组氨酸的二硫化物(化合物28) 的盐酸盐(520mg,17%;36%,相对于中间体SAc的量)。
LCMS(APCI):457.4[M+H]+
b)制备L-5-硫烷基-α,N(乙酰基)-组氨酸(化合物29)
将L-5-硫烷基-α,N(乙酰基)-组氨酸的二硫化物的盐酸盐(化合物 28)(520mg;834μmol,1当量)溶解于50mL水中,接着通过添加 NH
LCMS(APCI):230.0[M+H]
实施例30:经由5-酰基硫烷基-组氨酸的原位制备、随后水解来“一锅”制备L-5-硫烷基肌肽(化合物30)
将L-肌肽(425mg;1.88mmol;1当量)溶解于12mL含有37%浓盐酸溶液(370mg;3.75mmol;2当量)的脱矿物质水中,接着将所述溶液冷却至0℃。一次性添加N-溴琥珀酰亚胺(440mg;2.44mmol;1.3当量):所述溶液变为清澈橙色。添加硫代乙酸(960μL;1.03g,13.14mmol;7当量)。将所述混合物在0℃下搅拌1h。将所述溶液用 12mL乙酸乙酯萃取4次。在二硫苏糖醇(290mg;1.88mmol;1当量)存在下中和并且在二氧化硅上纯化之后,获得呈无色漆形式的 L-5-硫烷基肌肽(化合物30)(70mg;14%;22%,相对于中间体SAc 的量)。
LCMS(APCI):259.1[M+H]+
实施例31:制备化合物31和32
a)经由5-乙酰基硫烷基-1-甲基组氨酸的原位制备、随后水解和氧化来“一锅”制备异-卵硫醇A的二硫化物(化合物31)
将1-甲基-L-组氨酸(0.84g;5mmol;1当量)溶解于35mL脱矿物质水中,并且添加37%浓盐酸溶液(835μL(10mmol;2当量);接着将所述溶液冷却至1℃。维持极强烈搅拌。快速地添加N-溴琥珀酰亚胺(1.17g;6.5mmol;1.3当量)。3分钟之后,极快速地添加硫代乙酸(2.57mL;2.74g;35mmol;7当量)。将剧烈搅拌在0℃下维持 30分钟。将所述溶液用40mL乙酸乙酯萃取,接着3-巯基丙酸(2.2 mL;2.65g;25mmol;5当量)添加至水相中。水解通过在100℃下加热20h来进行。在冷却所述溶液之后,将反应介质用35mL乙酸乙酯萃取4次。在氧化并且用DOWEX 50WX2-400树脂纯化之后,获得呈棕色粉末形式的L-1-甲基-L-5-硫烷基组氨酸的二硫化物(化合物31)(740mg,65%,90%,相对于中间体SAc的量)。
LCMS(APCI):401.1[M+H]+
b)制备异-卵硫醇A(化合物32)
将L-5-硫烷基-1-甲基组氨酸的二硫化物(化合物25)(427mg; 0.52mmol,1当量)悬浮于25mL甲醇中。将所述混合物加热至50℃,接着添加二硫苏糖醇(299mg;1.92mmol;2当量)。在环境温度下搅拌1h并且用乙醚沉淀之后,获得呈微灰色粉末形式的L-5-硫烷基-1-甲基组氨酸(异-卵硫醇A,化合物32)(295mg;69%)。
LCMS(APCI):202.1[M+H]+
实施例32:经由5-乙酰基硫烷基-α,N,N(二甲基)-1-甲基组氨酸衍生物的水解、随后空气氧化来制备L-5-硫烷基-α,N,N(二甲基)-1-甲基组氨酸的二硫化物(化合物33)
如实施例8所述制备化合物5并且通过柱进行纯化。将180mg (0.63mmol,1当量)化合物5溶解于20mL水中。将所述清澈溶液在环境温度下在氧气存在下搅拌20h。在冻干之后,获得呈绿色无定形固体形式的L-5-硫烷基-α,N,N(二甲基)-1-甲基组氨酸的二硫化物(化合物33,98%)。
LCMS(APCI):457.2[M+H]+
实施例33:经由L-5-乙酰基硫烷基-α,N,N,N(三甲基)-1-甲基组氨酸的原位制备、随后水解和氧化来“一锅”制备L-5-硫烷基 -α,N,N,N(三甲基)-1-甲基组氨酸的二硫化物(化合物34二盐酸盐)
将1-甲基-组氨酸三甲基内盐(510mg,2mmol;1当量)溶解于 15mL含有37%浓盐酸溶液(170μL,2mmol;1当量)的脱矿物质水中,接着将所述溶液冷却至0℃。维持极强烈搅拌。快速地添加N- 溴琥珀酰亚胺(465mg,2.6mmol;1.3当量)。3分钟之后,极快速地添加硫代乙酸(740μL,10mmol;5.0当量)。将剧烈搅拌在0℃下维持30分钟。将所述混合物用2x 20mL乙酸乙酯萃取,接着稀释于 160mL乙酸乙酯/乙醇混合物(3/1)中用于在二氧化硅柱(乙酸乙酯/乙醇/水2/2/1)上纯化。将获得的微粉色油状物用冰乙酸溶液中的二甲亚砜(140μL,2mmol,1当量)氧化。将所述溶液在80℃下加热一小时。在二氧化硅柱(乙酸乙酯/乙醇/水2/2/1,随后用0.5M盐酸洗脱)上纯化之后获得呈微黄色油状物(110mg,10%)形式的L-5-硫烷基 -α,N,N,N(三甲基)-1-甲基组氨酸(化合物34)的二硫化物的二盐酸盐。
LCMS(APCI):485.1[M+H]+
实施例34:通过5-酰基硫烷基化合物的水解制备L-5-硫烷基-α,N(L-丙氨酰基)-组氨酸衍生物(化合物35)
如实施例10所述制备化合物7并且通过柱进行纯化。将340mg (1mmol,1当量)化合物7溶解于20mL水中。将所述清澈溶液在环境温度下在避氧下搅拌6天。在蒸发至干之后,获得呈米黄色无定形固体形式的L-5-硫烷基-α,N(L-丙氨酰基)-组氨酸(化合物35,92%)。
LCMS(APCI):258.9[M+H]+
实施例35:通过化合物5-乙酰基硫烷基-α,N(戊酰基)-组氨酸的水解和氧化来制备5-硫烷基-α,N(戊酰基)-组氨酸的二硫化物(化合物 36)
如实施例11中所述制备并且纯化5-乙酰基硫烷基-α,N(戊酰基)- 组氨酸衍生物(化合物8)纯化。将320mg(0.9mmol;1当量)化合物8 溶解于8.0mL脱矿物质水中。添加3-巯基丙酸(400μL,4.60mmol; 5当量)。将所述溶液在90℃下加热3h。将反应混合物用10mL乙酸乙酯萃取4次,接着将水相蒸发至干。将残留物溶解于10mL水中。将所述溶液在90℃下在搅拌下加热2小时,接着在环境温度下加热 18小时。在蒸发至干之后,获得呈橙色漆(44%)形式的L-5-硫烷基 -α,N(戊酰基)-组氨酸的二硫化物(化合物36)。
LCMS(APCI):541.2[M+H]+
表5:实施例的概述:
