抗MS4A6A抗体及其使用方法
文献发布时间:2023-06-19 09:29:07
相关申请的交叉引用
本申请要求2018年1月31日提交的美国临时申请号62/624,578和2018年3月22日提交的美国临时申请号62/646,846的权益,每个专利申请据此以引用的方式整体并入。
技术领域
本公开涉及抗MS4A6A抗体和此类抗体的治疗用途。
背景技术
跨膜4结构域亚家族A(MS4A)基因簇存在于染色体11q12上,并且包含十八个基因。MS4A基因家族编码通常具有四次跨膜拓扑结构的膜蛋白(Ishibashi等人,2001,Gene,265:87-93;Liang和Tedder,2001,Genomics,72:119-127;Efthymiou和Goate,2017,MolecularNeurodegeneration,12:43)。跨膜结构域通过一个胞内环和两个胞外环相互连接,并且N-末端和C-末端均位于胞质溶胶中。大多数MS4A蛋白与MS4A1(CD20)共有氨基酸序列同源性(20-30%相似性),并且在前三个跨膜结构域中存在最高程度的序列同一性。在不同的MS4A蛋白中,这些跨膜区域内的高度保守基序表明跨膜结构域在MS4A蛋白功能中具有重要的一般作用。MS4A蛋白之间变化最大的区域出现在它们的N-末端和C-末端胞质结构域和推定的第二胞外环内(Ishibashi等人,2001,Gene,265:87-93),这表明这些区域赋予了独特的功能性质。
虽然存在这种多样性,但是MS4A结构域具有一些共有的元件。例如,在MS4A蛋白(除MS4A8B和MS4A12之外)中保守的一个显著特征是在可以形成二硫键的推定的第二细胞外环中的两个半胱氨酸残基的保守性。MS4A蛋白的N-末端和C-末端结构域也富含脯氨酸残基,但是它的功能意义尚需阐明(Hulett等人,2001,Genomics,72:119-127)。然而,富含脯氨酸的区域通常参与各种细胞过程,诸如细胞骨架重排、转录的起始、信号传导级联以及与作为衔接子系统的一部分的SH3结构域的缔合,从而有利于蛋白质-蛋白质相互作用(Kay等人,2000,FASEB J,14:231-241)。
MS4A蛋白家族在功能上相对不明确,但有一些重要的例外:MS4A1(CD20)排他性地在B淋巴细胞中表达,在该处蛋白质通过B细胞抗原受体和钙内流而在信号传导中发挥功能。CD20是免疫治疗抗体的靶标,所述免疫治疗抗体可用于剔除慢性淋巴细胞性白血病、淋巴瘤、自身免疫疾病中和实体器官移植中的致病性B细胞。MS4A2(FcεRβ)是肥大细胞上的高亲和力IgE受体(FcγRI)和低亲和力IgG受体(FcγRIII)的信号传导亚基,在超敏性和变应性反应中具有关键作用。MS4A2是一种ITAM结构域蛋白,可通过4种蛋白质的高亲和力IgE受体复合物来放大信号。MS4A3(Htm4)在淋巴和骨髓细胞的胞内膜上表达,并且在细胞周期调控充当衔接蛋白。
虽然大多数MS4A家族成员尚未表征,但是报道表明MS4A蛋白可作为多种外源性和内源性配体(包括脂肪酸、肽和硫酸化类固醇)的化学传感器和化学感受器,并且涉及介导钙内流、调节内吞、运输,并且可以作为信号转导复合物的衔接子(Cruse等人,2015,MolBiol Cell,26:1711-1727;Greer等人,2016,Cell,165:1734-1748;Eon Kuek等人,2016,Cell,165:1734-1748;Koslowski等人,2008,Cancer Res,68:3458-3466;Bubien等人,1993;J Cell Biol,121:1121-1132)。
某些MS4A基因在遗传上与多种病症和疾病(尤其是神经退行性疾病)相关。例如,全基因组显著性关联分析已将定位于染色体11q12上的MS4A基因簇鉴定为最显著的阿尔茨海默氏病基因座之一。鉴定出的一种特别关注的基因是MS4A6A(Lambert等人,2013,NatGenet,45:1452-1458;Hollingworth等人,2011,Nat Genet,43:429-435;Naj等人,2011,Nat Genet,43:436-441)。MS4A6A基因座内的各种SNP和相关的等位基因可以有助于与疾病风险相关的MS4A6A蛋白的差异表达(例如,降低的表达或活性)(Ma等人,2015,MolNeurbiol,51:1240-1248;Lacher等人,2018,Redox Biology,14:686-693)。
因此,需要靶向MS4A6A的疗法,包括特异性结合至MS4A6A的抗体,和/或能够诸如通过增加MS4A6A蛋白水平或活性来调节(例如,活化或增加)MS4A6A的活性,以治疗与MS4A6A活性相关的各种疾病、病症和病状的疗法。
本文引用的所有参考文献,包括专利申请和出版物,据此以引用的方式整体并入。
发明内容
本公开总体涉及抗MS4A6A抗体和使用此类抗体的方法。本文提供的方法可用于预防神经退行性疾病、病症或病状,降低神经退行性疾病、病症或病状的风险或者治疗患有神经退行性疾病、病症或病状的个体。在一些实施方案中,本公开提供了一种预防神经退行性疾病、病症或病状,降低神经退行性疾病、病症或病状的风险或者治疗患有神经退行性疾病、病症或病状的个体的方法,所述疾病神经退行性疾病、病症或病状选自由以下各项组成的组:阿尔茨海默氏病、迟发性阿尔茨海默氏病、痴呆和认知缺损,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在一些实施方案中,本公开提供了一种用于预防MS4A6A的表达或活性降低相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。
在一些实施方案中,本公开提供了一种预防由MS4A6A的活性或表达降低引起的或与之相关的疾病、病症、病状或损伤,降低这些疾病、病症、病状或损伤的风险或者治疗患有这些疾病、病症、病状或损伤的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在一些实施方案中,本公开提供了一种预防由MS4A6A的功能丧失引起的或与之相关的疾病、病症、病状或损伤,降低这些疾病、病症、病状或损伤的风险或者治疗患有这些疾病、病症、病状或损伤的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在一些实施方案中,本公开提供了一种预防具有与阿尔茨海默氏病风险或易感性相关的至少一个遗传等位基因的个体中的神经退行性疾病、病症、病状或损伤,降低这些疾病、病症、病状或损伤的风险或者治疗这些疾病、病症、病状或损伤的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在一些实施方案中,与阿尔茨海默氏病风险或易感性相关的遗传等位基因选自由以下各项组成的组:rs583791(C)等位基因、rs7232(T)等位基因和rs610932(G)等位基因。
在可以与前述实施方案中的任一者组合的某些实施方案中,本公开的抗MS4A6A抗体结合不连续的MS4A6A表位。在可以与前述实施方案中的任一者组合的某些实施方案中,不连续的MS4A6A表位包含两个或更多个肽、三个或更多个肽、四个或更多个肽、五个或更多个肽、六个或更多个肽、七个或更多个肽、八个或更多个肽、九个或更多个肽或者10个或更多个肽。在可以与前述实施方案中的任一者组合的某些实施方案中,每个肽包含SEQ IDNO:1的氨基酸序列、SEQ ID NO:2的氨基酸序列或SEQ ID NO:3的氨基酸序列的五个或更多个、六个或更多个、七个或更多个、八个或更多个、九个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个、20个或更多个、21个或更多个、22个或更多个、23个或更多个、24个或更多个、25个或更多个、26个或更多个、27个或更多个、28个或更多个、29个或更多个或者30个或更多个氨基酸残基;或者对应于SEQ ID NO:1的氨基酸序列、SEQ IDNO:2的氨基酸序列或SEQ ID NO:3的氨基酸序列的哺乳动物MS4A6A蛋白上的五个或更多个、六个或更多个、七个或更多个、八个或更多个、九个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个、18个或更多个、19个或更多个、20个或更多个、21个或更多个、22个或更多个、23个或更多个、24个或更多个、25个或更多个、26个或更多个、27个或更多个、28个或更多个、29个或更多个或者30个或更多个氨基酸残基。
在可以与前述实施方案中的任一者组合的某些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的构象表位。在可以与前述实施方案中的任一者组合的某些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的线性表位。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体与一种或多种参考抗MS4A6A抗体竞争,所述参考抗MS4A6A抗体选自由以下各项组成的组:6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22、6A-23。在一些实施方案中,抗MS4A6A抗体包含选自由以下各项组成的组的抗体的V
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的表位,所述表位与至少一种选自由以下各项组成的组的参考抗体结合的MS4A6A表位相同或重叠:6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22、6A-23。在一些实施方案中,抗MS4A6A抗体包含选自由以下各项组成的组的抗体的V
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合与至少一种选自以下各项的参考抗体结合的表位基本上相同的MS4A6A表位:6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22、6A-23以及它们的任何组合。在一些实施方案中,抗MS4A6A抗体包含选自由以下各项组成的组的抗体的V
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A上的线性表位。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基1-46内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基47-67内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基68-84内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基85-105内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A结合至人类MS4A6A的氨基酸残基106-116内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基117-137内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A结合至人类MS4A6A的氨基酸残基138-185内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A结合至人类MS4A6A的氨基酸残基186-206内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A结合至人类MS4A6A的氨基酸残基207-248内的一个或多个氨基酸。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的第185位处的氨基酸残基。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的胞外结构域1(ECL1)。在一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的胞外结构域2(ECL2)。在一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的ECL1结构域和ECL2结构域。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A是一种结合至人类MS4A6A的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,其中所述重链可变区包含:HVR-H1,其包含选自由SEQ ID NO:4-16组成的组的氨基酸序列;HVR-H2,其包含选自由SEQ ID NO:17-31组成的组的氨基酸序列;以及HVR-H3,其包含选自由SEQID NO:32-45组成的组的氨基酸序列;并且所述轻链可变区包含:HVR-L1,其包含选自由SEQID NO:46-60组成的组的氨基酸序列;HVR-L2,其包含选自由SEQ ID NO:61-76组成的组的氨基酸序列;以及HVR-L3,其包含选自由SEQ ID NO:77-90组成的组的氨基酸序列。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A是一种结合至人类MS4A6A的分离的抗体,其中所述抗体包含重链可变区,其中所述重链可变区包含选自由SEQ ID NO:91-108组成的组的氨基酸序列。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A是一种结合至人类MS4A6A的分离的抗体,其中所述抗体包含轻链可变区,其中所述轻链可变区包含选自由SEQ ID NO:109-126组成的组的氨基酸序列。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A是一种结合至人类MS4A6A的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,其中所述重链可变区包含选自由SEQ ID NO:91-108组成的组的氨基酸序列;并且其中所述轻链可变区包含选自由SEQ ID NO:109-126组成的组的氨基酸序列。
在可以与前述实施方案中的任一者组合的某些实施方案中,MS4A6A蛋白是哺乳动物蛋白或人类蛋白。在可以与前述实施方案中的任一者组合的某些实施方案中,MS4A6A蛋白是野生型蛋白。在可以与前述实施方案中的任一者组合的某些实施方案中,MS4A6A蛋白是天然存在的变体。在可以与前述实施方案中的任一者组合的某些实施方案中,抗体是激动性抗体,其中所述抗体诱导、增加或增强一种或多种MS4A6A活性。在可以与前述实施方案中的任一者组合的某些实施方案中,所述分离的抗体诱导、增强或保持细胞表面上的MS4A6A簇。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体增加或增强MS4A6A和至少一种MS4A6A配体或结合配偶体的相互作用或结合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体增强或增加信号传导复合物的形成。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体增强或增加与编码ITAM的衔接蛋白相关的信号传导复合物的形成。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体增强或增加抑制性信号传导复合物的形成。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体增强或增加与编码ITIM的衔接蛋白相关的抑制性信号传导复合物的形成。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少信号传导复合物的形成。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少与编码ITAM的衔接蛋白相关的信号传导复合物的形成。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少抑制性信号传导复合物的形成。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少与编码ITIM的衔接蛋白相关的抑制性信号传导复合物的形成。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来抑制(例如,阻断)或减少MS4A6A同源寡聚体细胞表面蛋白复合物的形成:a)降低可用于MS4A6A同源寡聚体复合物形成的MS4A6A的有效水平;b)阻断MS4A6A同源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)防止MS4A6A同源寡聚体复合物形成以及/或者MS4A6A的正确加工和/或细胞定位所需的MS4A6A上的一个或多个翻译后事件;d)诱导MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来增加或增强MS4A6A同源寡聚体细胞表面蛋白复合物的形成:a)提高可用于MS4A6A同源寡聚体复合物形成的MS4A6A的有效水平;b)稳定MS4A6A同源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)维持MS4A6A的细胞表面表达,以允许同源寡聚体复合物形成以及/或者正确加工和/或维持MS4A6A的正确细胞定位;d)减少MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来抑制(例如,阻断)或减少与一种或多种信号转导衔接蛋白的MS4A6A异源寡聚体细胞表面蛋白复合物的形成:a)降低可用于MS4A6A异源寡聚体复合物形成的MS4A6A的有效水平;b);阻断MS4A6A异源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)防止MS4A6A异源寡聚体复合物形成以及/或者MS4A6A的正确加工和/或细胞定位所需的MS4A6A上的一个或多个翻译后事件;d)诱导MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来增加或增强与一种或多种信号转导衔接蛋白的MS4A6A异源寡聚体细胞表面蛋白复合物的形成:a)提高可用于MS4A6A异源寡聚体复合物形成的MS4A6A的有效水平;b)稳定MS4A6A异源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)维持MS4A6A的细胞表面表达,以允许MS4A6A异源寡聚体复合物形成以及/或者正确加工和/或维持MS4A6A的正确细胞定位;d)减少MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体是人类抗体、人源化抗体、双特异性抗体、单克隆抗体、多价抗体、缀合抗体或嵌合抗体。
在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体是识别第一抗原和第二抗原的双特异性抗体。在可以与前述实施方案中的任一者组合的某些实施方案中,第一抗原是MS4A6A,并且第二抗原是有利于跨血脑屏障运输的抗原。在可以与前述实施方案中的任一者组合的某些实施方案中,第二抗原选自由以下各项组成的组:MS4A6A、运铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体、CRM 197、美洲驼单结构域抗体、TMEM 30(A)、蛋白质转导结构域、TAT、Syn-B、穿膜肽、聚精氨酸肽、血管肽(angiopep)、基础免疫球蛋白(basigin)、Glut1和CD98hc和ANG1005。
在可以与前述实施方案中的任一者组合的一些实施方案中,抗体是单克隆抗体。在可以与前述实施方案中的任一者组合的一些实施方案中,抗体是人类抗体。在可以与前述实施方案中的任一者组合的一些实施方案中,抗体是人源化抗体。在可以与前述实施方案中的任一者组合的一些实施方案中,抗体是双特异性抗体。在可以与前述实施方案中的任一者组合的一些实施方案中,抗体是多价抗体。在可以与前述实施方案中的任一者组合的一些实施方案中,抗体是嵌合抗体。在可以与前述实施方案中的任一者组合的一些实施方案中,抗体属于IgG类、IgM类或IgA类。在一些实施方案中,抗体属于IgG类,并且具有IgG1、IgG2或IgG4同种型。在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体是结合至包含人类MS4A6A或哺乳动物MS4A6A蛋白上的氨基酸残基的表位的抗体片段。在可以与前述实施方案中的任一者组合的某些实施方案中,片段是Fab、Fab'、Fab'-SH、F(ab')2、Fv或scFv片段。
本公开的其他方面涉及一种分离的(例如,单克隆)抗MS4A6A抗体,其中所述抗MS4A6A抗体包含选自由以下各项组成的组的抗体的至少一个、两个、三个、四个、五个或六个HVR:6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23。在一些实施方案中,抗MS4A6A抗体包含选自由以下各项组成的组的抗体的六个HVR(例如,如下表4A所示):6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23。在一些实施方案中,抗MS4A6A抗体包含选自由以下各项组成的组的抗体的V
本公开的其他方面涉及一种分离的核酸,所述核酸包含编码前述实施方案中的任一者的抗MS4A6A抗体的核酸序列。本公开的其他方面涉及一种包含前述实施方案中的任一者的核酸的载体。本公开的其他方面涉及一种分离的宿主细胞,所述宿主细胞包含前述实施方案中的任一者的载体。本公开的其他方面涉及一种产生抗MS4A6A抗体的方法,所述方法包括培养前述实施方案中的任一者的宿主细胞,从而产生抗MS4A6A抗体。在某些实施方案中,所述方法还包括回收宿主细胞产生的抗MS4A6A抗体。本公开的其他方面涉及一种通过前述实施方案中的任一者的方法来产生的分离的抗MS4A6A抗体。本公开的其他方面涉及一种药物组合物,所述药物组合物包含前述实施方案中的任一者的抗MS4A6A抗体和药学上可接受的载剂。
在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体特异性结合至人类MS4A6A、小鼠MS4A6A、食蟹猴MS4A6A或它们的组合。
应当理解,本文所述的各种实施方案的一个、一些或全部性质可以组合以形成本公开的其他实施方案。本公开的这些和其他方面对于本领域的技术人员将是显而易见的。通过以下具体实施方式来进一步描述本公开的这些和其他实施方案。
附图说明
图1示出了用人类或食蟹猴MS4A6A或MS4A4A瞬时转染的并且使用两种商购获得的来自Abcam的抗MS4A6A抗体探测的细胞的免疫印迹。两种抗体都检测到人类和食蟹猴MS4A6A特异性条带,这表明所述细胞表达MS4A6A蛋白。
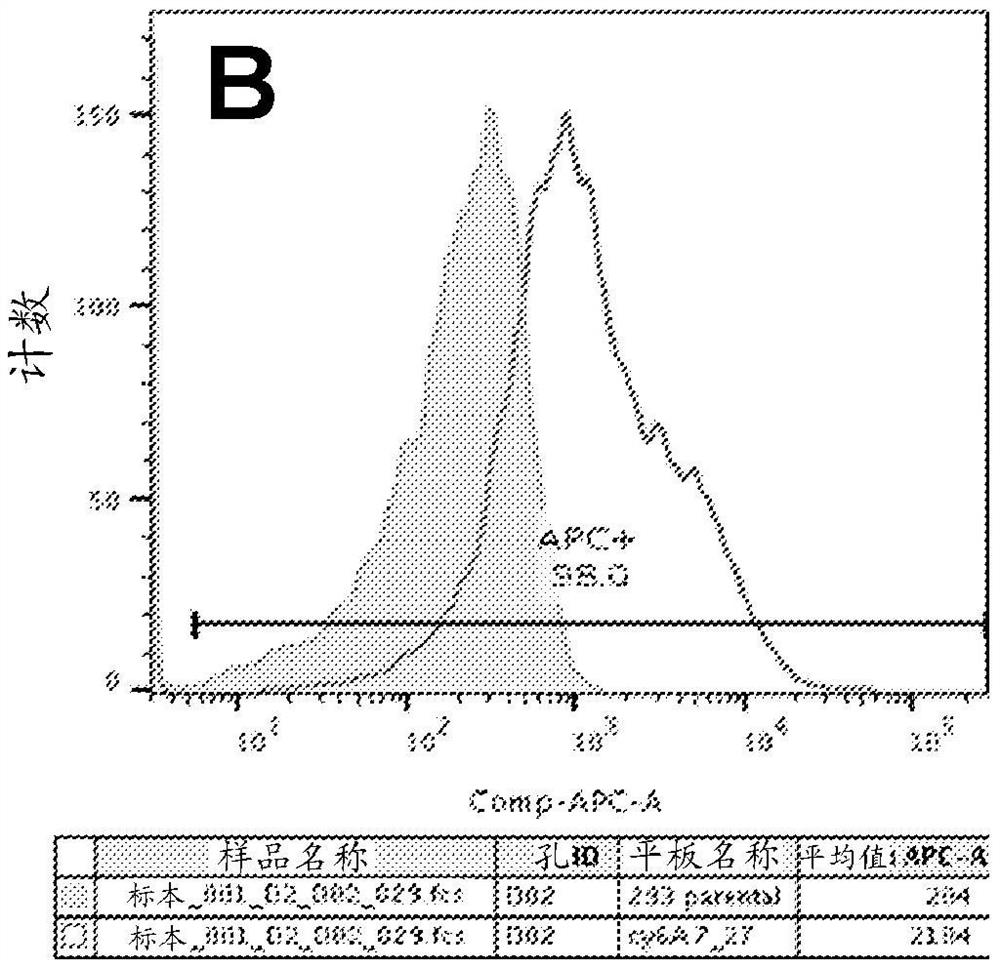
图2A和图2C示出了使用含有本公开的抗MS4A6A的杂交瘤上清液进行的用人类MS4A6A转染的HEK293细胞(图2A和2C中的透明迹线)和未转染的HEK293细胞(图2A和2C中的阴影迹线)的两个独立的FAC分析。图2B和图2D示出了使用含有本公开的抗MS4A6A的杂交瘤上清液进行的用食蟹猴MS4A6A转染的HEK293细胞(图2B和2D中的透明迹线)和未转染的HEK293细胞(图2B和2D中的阴影迹线)的两个独立的FAC分析。
图3A和3B示出了使用含有本公开的抗MS4A6A的杂交瘤上清液进行的与未转染的U937细胞(图3A中的左迹线)和未转染的K562细胞(图3B中的左迹线)相比,用食蟹猴MS4A6A转染的U937细胞(图3A中的右迹线)或K562细胞(图3B中的右迹线)中的食蟹猴MS4A6A的细胞表面表达。
具体实施方式
本公开涉及抗MS4A6A抗体(例如,单克隆抗体);以及制备和使用此类抗体的方法;包含此类抗体的药物组合物;编码此类抗体的核酸;以及包含编码此类抗体的核酸的宿主细胞。
本领域的技术人员使用常规方法可以很好地理解和一般地采用本文描述或参考的技术和程序,所述常规方法例如广泛采用的方法,诸如Sambrook等人MolecularCloning:A Laboratory Manual第3版(2001)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.;Current Protocols in Molecular Biology(F.M.Ausubel等人编,(2003);Monoclonal Antibodies:A Practical Approach(P.Shepherd和C.Dean编,Oxford University Press,2000)描述的那些。
I.定义
除非另外指明,否则术语“MS4A6A”或“MS4A6A多肽”在本文中可互换使用,是指来自任何脊椎动物来源的任何天然MS4A6A,所述脊椎动物来源包括哺乳动物(诸如灵长类动物(例如,人类和食蟹猴)和啮齿动物(例如,小鼠和大鼠))。在一些实施方案中,该术语涵盖野生型序列和天然存在的变体序列(例如,剪接变体或等位基因变体)二者。在一些实施方案中,该术语涵盖“全长”、未经加工的MS4A6A以及由细胞中的加工产生的任何形式的MS4A6A。在一些实施方案中,MS4A6A是人类MS4A6A。在一些实施方案中,示例性MS4A6A的氨基酸序列是截至2001年3月1日的Uniprot登录号Q9H2W1。在一些实施方案中,示例性人类MS4A6A的氨基酸序列是SEQ ID NO:1。
术语“抗MS4A6A抗体”、“结合至MS4A6A的抗体”和“特异性结合MS4A6A的抗体”是指能够以足够的亲和力结合MS4A6A的抗体,所述亲和力足以使得所述抗体可用作靶向MS4A6A的诊断和/或治疗剂。在一个实施方案中,抗MS4A6A抗体与不相关的非MS4A6A多肽的结合程度小于抗体与MS4A6A的结合的约10%,如例如通过放射免疫测定法(RIA)所测量。在某些实施方案中,结合至MS4A6A的抗体具有<1μM、<100nM、<10nM、<1nM、<0.1nM、<0.01nM或<0.001nM(例如,10
关于抗体与靶分子的结合,术语“特异性结合”特定多肽或特定多肽靶标上的表位或者“特异性地结合”特定多肽或特定多肽靶标上的表位或者对特定多肽或特定多肽靶标上的表位“具有特异性”意指可测量地不同于非特异性相互作用的结合。特异性结合可以例如通过测定与对照分子的结合相比的分子的结合来测量。例如,特异性结合可以通过与类似于靶标的对照分子(例如,过量的未标记的靶标)的竞争来测定。在这种情况下,如果标记的靶标与探针的结合被过量的未标记的靶标竞争性抑制,则表示特异性结合。如本文所用,术语“特异性结合”特定多肽或特定多肽靶标上的表位或者“特异性结合至”特定多肽或特定多肽靶标上的表位或者对特定多肽或特定多肽靶标上的表位“具有特异性”可以例如通过对靶标的KD为约10
术语“免疫球蛋白”(Ig)在本文中可与“抗体”互换使用。本文中的术语“抗体”以最广泛的意义使用,并且特别涵盖单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)(包括由至少两种完整抗体形成的那些)和抗体片段,只要它们表现出所期望的生物学活性即可。
“天然的抗体”通常是由两条相同的轻(“L”)链和两条相同的重(“H”)链组成的约150,000道尔顿的异源四聚体糖蛋白。每条轻链通过一个共价二硫键连接至重链,而二硫键的数量在不同的免疫球蛋白同种型的重链之间有所不同。每条重链和轻链还具有规律间隔的链内二硫桥。每条重链在一端具有可变结构域(V
关于不同类别抗体的结构和性质,参见例如Basic and Clinical Immunology,第8版,Daniel P.Stites,Abba I.Terr和Tristram G.Parslow(编),Appleton&Lange,Norwalk,CT,1994,第71页和第6章。
可以根据来自任何脊椎动物物种的轻链的恒定结构域的氨基酸序列,将轻链归类为两种明显不同的类型(称为卡帕(“κ”)和兰姆达(“λ”))中的一种。可以根据免疫球蛋白的重链(CH)的恒定结构域的氨基酸序列,将免疫球蛋白归类为不同的类别或同种型。免疫球蛋白有五种类别:IgA、IgD、IgE、IgG和IgM,它们具有的重链分别称为阿尔法(“α”)、德尔塔(“δ”)、艾普斯龙(“ε”)、伽马(“λ”)和缪(“μ”)。可以根据CH序列和功能的相对较小差异,将λ和α类进一步分为子类(同种型),例如人类表达以下子类:IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。不同类别的免疫球蛋白的亚基结构和三维构型是熟知的,并且通常在例如Abbas等人,Cellular and Molecular Immunology,第4版(W.B.Saunders Co.,2000)中有所描述。
抗体(诸如本公开的抗MS4A6A抗体)的“可变区”或“可变结构域”是指抗体的重链或轻链的氨基末端结构域。重链和轻链的可变结构域可以分别称为“V
术语“可变”是指下述事实:即在抗体(诸如本公开的抗MS4A6A抗体)间,可变结构域的某些区段在序列上广泛不同。可变结构域介导抗原结合,并且定义特定抗体对其特定抗原的特异性。然而,可变性不会均匀分布在整个可变结构域范围内。相反,在轻链和重链可变结构域中,可变性集中在三个称为高变区(HVR)的区段中。可变结构域的更加高度保守的部分称为框架区(FR)。天然重链和轻链的可变结构域各自包含四个FR区,它们大多采用β-折叠构型,通过三个HVR连接,这三个HVR形成连接β-折叠结构(在一些情况下形成β-折叠结构的一部分)的环。每条链中的HVR通过FR区紧密靠近地保持在一起,并且与另一条链的HVR一起,有助于抗体的抗原结合位点的形成(参见Kabat等人,Sequences ofImmunological Interest,第五版,National Institute of Health,Bethesda,MD(1991))。恒定结构域不直接涉及抗体与抗原的结合,但是表现出多种效应子功能,诸如抗体对抗体依赖性细胞毒性的参与。
如本文所用,术语“单克隆抗体”是指从一群基本上同质的抗体获得的抗体(诸如本公开的单克隆抗MS4A6A抗体),即构成该抗体群的各单独抗体,除了可以少量存在的可能天然存在的突变和/或翻译后修饰(例如,异构化、酰胺化等)之外,其他方面是相同的。单克隆抗体具有高度特异性(针对单个抗原位点)。与通常包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相比,每种单克隆抗体针对抗原上的单个决定簇。除特异性之外,单克隆抗体的优点在于它们通过杂交瘤培养来合成,未被其他免疫球蛋白污染。修饰语“单克隆”表示从基本上同质的抗体群获得的抗体特征,并且不应解释为需要通过任何特定方法来产生该抗体。例如,可以通过多种技术来制备根据本公开使用的单克隆抗体,所述技术包括例如杂交瘤方法、重组DNA方法以及用于在动物中产生人或人样抗体的技术,所述动物具有部分或全部的人类免疫球蛋白基因座或编码人类免疫球蛋白序列的基因。
术语“全长抗体”、“完整抗体”或“完全抗体”可互换使用,是指与抗体片段相比,基本上完整形式的抗体(诸如本公开的抗MS4A6A抗体)。具体而言,完全抗体包括具有包含Fc区的重链和轻链的那些。恒定结构域可以是天然序列恒定结构域(例如,人天然序列恒定结构域)或它们的氨基酸序列变体。在一些情况下,完整抗体可以具有一种或多种效应子功能。
“抗体片段”是指除完整抗体之外的分子,它包括完整抗体的一部分,所述完整抗体的一部分结合完整抗体所结合的抗原。抗体片段的实例包括Fab、Fab'、F(ab')2和Fv片段;双体;线性抗体(参见美国专利5641870,实施例2;Zapata等人,Protein Eng.8(10):1057-1062(1995));由抗体片段形成的单链抗体分子和多特异性抗体。
抗体(诸如本公开的抗MS4A6A抗体)的木瓜蛋白酶消化产生两个相同的称为“Fab”片段的抗原结合片段和残留的“Fc”片段(反映易于结晶的能力的名称)。Fab片段由整个轻链以及重链的可变区结构域(V
Fc片段包含通过二硫键保持在一起的两条重链的羧基末端部分。抗体的效应子功能由Fc区的序列确定,所述Fc区也由某些类型细胞上存在的Fc受体(FcR)识别。
抗体(诸如本公开的抗MS4A6A抗体)的“功能片段”包括完整抗体的一部分,通常包括完整抗体的抗原结合或可变区,或者保留或具有经修饰的FcR结合能力的抗体的Fc区。抗体片段的实例包括线性抗体、单链抗体分子以及由抗体片段形成的多特异性抗体。
术语“双体”是指通过使用V
如本文所用,“嵌合抗体”是指这样的抗体(免疫球蛋白)(诸如本公开的嵌合抗MS4A6A抗体):其中重链和/或轻链的一部分与来源于特定物种或属于特定抗体类别或子类的抗体中的对应序列相同或同源,而一条或多条链的其余部分与来源于另一个物种或属于另一个抗体类别或子类的抗体以及此类抗体的片段中的对应序列相同或同源,只要它们表现出所期望的生物学活性即可。本文关注的嵌合抗体包括
非人类(例如,鼠科动物)抗体的“人源化”形式(诸如本公开的抗MS4A6A抗体的人源化形式)是包含来自非人类HVR的氨基酸残基和来自人类FR的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含至少一个、通常两个可变结构域的基本上全部,其中全部或基本上全部HVR(例如,CDR)对应于非人类抗体的HVR,并且全部或基本上全部FR对应于人类抗体的FR。人源化抗体任选地可以包含来源于人类抗体的抗体恒定区的至少一部分。抗体(例如,非人类抗体)的“人源化形式”是指已经历人源化的抗体。
“人类抗体”是具有对应于人类产生的抗体(诸如本公开的抗MS4A6A抗体)的氨基酸序列和/或已经使用如本文公开的制备人类抗体的技术中的任一者来制备的抗体。人类抗体的此定义明确排除了包含非人类抗原结合残基的人源化抗体。人类抗体可以使用本领域已知的多种技术(包括噬菌体展示文库和酵母展示文库)来产生。人类抗体可以通过将抗原施用于转基因动物来制备,以及经由人类B细胞杂交瘤技术来产生,所述转基因动物已被修饰为响应于抗原挑战而产生此类抗体,但是转基因动物的内源性基因座已失能(例如,免疫化的xenomice)。
当在本文中使用时,术语“高变区”、“HVR”或“HV”是指抗体可变结构域(诸如本公开的抗MS4A6A抗体的可变结构域)的区域,所述区域的序列是高变的和/或形成在结构上定义的环。通常,抗体包含六个HVR;V
许多HVR描述正在使用中并且涵盖在本文中。在一些实施方案中,HVR可以是基于序列可变性的Kabat互补决定区(CDR),并且是最常用的(Kabat等人,同上)。在一些实施方案中,HVR可以是Chothia CDR。而Chothia是指结构环的位置(Chothia和LeskJ.Mol.Biol.196:901-917(1987))。在一些实施方案中,HVR可以是AbM HVR。AbM HVR代表Kabat CDR和Chothia结构环之间的折衷方案,并且由Oxford Molecular的AbM抗体建模软件使用。在一些实施方案中,HVR可以是“接触”HVR。“接触”HVR基于可用的复合物晶体结构的分析。来自这些HVR中的每个的残基注释如下。
HVR可以包含如下的“延伸HVR”:VL中的24-36或24-34(L1)、46-56或50-56(L2)和89-97或89-96(L3)以及VH中的26-35(H1)、50-65或49-65(优选的实施方案)(H2)和93-102、94-102或95-102(H3)。对于这些延伸HVR定义中的每个,可变结构域残基根据Kabat等人(同上)来编号。
“框架”或“FR”残基是除如本文定义的HVR残基之外的那些可变结构域残基。
如本文所用,“接受体人类框架”是包含来源于人类免疫球蛋白框架或人类共有框架的V
“人类共有框架”是在人类免疫球蛋白V
在例如本公开的抗MS4A6A抗体的指定位置处的“氨基酸修饰”是指指定残基的置换或缺失,或邻近指定残基的至少一个氨基酸残基的插入。“邻近”指定残基的插入意指在该指定残基的一个至两个残基内的插入。插入可以在指定残基的N-末端或C-末端。本文的优选氨基酸修饰是置换。
“亲和力成熟”抗体(诸如本公开的亲和力成熟抗MS4A6A抗体)是在该抗体的一个或多个HVR中具有一个或多个改变,从而与不具有一个或多个那些改变的亲本抗体相比,引起抗体对抗原的亲和力改善的抗体。在一个实施方案中,亲和力成熟抗体对靶抗原具有纳摩尔或甚至皮摩尔亲和力。通过本领域已知的程序来产生亲和力成熟抗体。例如,Marks等人,Bio/Technology 10:779-783(1992)描述了通过V
“Fv”是包含完全抗原识别和结合位点的最小抗体片段。该片段由紧密、非共价缔合的一个重链和一个轻链可变区结构域的二聚体组成。由这两个结构域的折叠产生六个高变环(各自来自H和L链的3个环),这六个高变环贡献了用于抗原结合的氨基酸残基,并且将抗原结合特异性赋予抗体。然而,即使单个可变结构域(或仅包含对抗原具有特异性的三个HVR的Fv的一半)也具有识别和结合抗原的能力,虽然亲和力小于整个结合位点。
“单链Fv”也缩写为“sFv”或“scFv”,是包含连接至单个多肽链的VH和VL抗体结构域的抗体片段。优选地,sFv多肽还包含V
抗体“效应子功能”是指可归因于抗体的Fc区(天然序列Fc区或氨基酸序列变体Fc区),并且随抗体同种型而变化的那些生物学活性。
本文的术语“Fc区”用于定义免疫球蛋白重链的C-末端区,包括天然序列Fc区和变体Fc区。虽然免疫球蛋白重链的Fc区的边界可以有所变化,但是人类IgG重链Fc区通常被定义为从第Cys226位或从第Pro230位的氨基酸残基至它们的羧基末端的序列段。可以例如在抗体的产生或纯化期间或通过对编码抗体的重链的核酸进行重组工程化改造来移除Fc区的C-末端赖氨酸(根据EU编号系统的残基447)。因此,完整抗体的组合物可以包括全部K447残基均被移除的抗体群、K447残基未被移除的抗体群以及具有和不具有K447残基的抗体混合物的抗体群。适用于本公开的抗体的天然序列Fc区包括人类IgG1、IgG2、IgG3和IgG4。
“天然序列Fc区”包含与自然界中存在的Fc区的氨基酸序列相同的氨基酸序列。天然序列人类Fc区包括天然序列人类IgG1 Fc区(非A和A同种异型);天然序列人类IgG2 Fc区;天然序列人类IgG3 Fc区;和天然序列人类IgG4 Fc区以及它们的天然存在的变体。
“变体Fc区”包含由于至少一种氨基酸修饰(优选地一个或多个氨基酸置换)而不同于天然序列Fc区的氨基酸序列。优选地,与天然序列Fc区或亲本多肽的Fc区相比,变体Fc区在天然序列的Fc区中或在亲本多肽的Fc区中具有至少一个氨基酸置换,例如约一个至约十个氨基酸置换,并且优选地约一个至约五个氨基酸置换。本文的变体Fc区优选地与天然序列Fc区和/或与亲本多肽的Fc区具有至少约80%的同源性,最优选地与它们具有至少约90%的同源性,更优选地至少约95%的同源性。
“Fc受体”或“FcR”描述结合至抗体的Fc区的受体。优选的FcR是天然序列人类FcR。此外,优选的FcR是结合IgG抗体(γ受体)的FcR,并且包括FcγRI、FcγRII和FcγRIII子类的受体,包括这些受体的等位基因变体和可变剪接形式,FcγRII受体包括FcγRIIA(“活化性受体”)和FcγRIIB(“抑制性受体”),它们具有相似的氨基酸序列,所述氨基酸序列的主要区别在于它们的胞质结构域。活化性受体FcγRIIA在其胞质结构域中含有基于免疫受体酪氨酸的活化基序(“ITAM”)。抑制性受体FcγRIIB在其胞质结构域中含有基于免疫受体酪氨酸的抑制基序(“ITIM”)。其他FcR(包括未来鉴定的那些FcR)也涵盖在本文的术语“FcR”中。FcR还可以增加抗体的血清半衰期。
如本文所用,就肽、多肽或抗体序列而言,“氨基酸序列同一性百分比(%)”和“同源性”是指在比对序列和引入空位(如果需要的话),以实现最大序列同一性百分比之后,并且不考虑作为序列同一性的一部分的任何保守置换的情况下,与特定肽或多肽序列中的氨基酸残基相同的候选序列中的氨基酸残基的百分比。为了测定氨基酸序列同一性百分比的比对可以通过本领域技术范围内的多种方式实现,例如,使用公开获得的计算机软件,诸如BLAST、BLAST-2、ALIGN或MEGALIGN
当在竞争相同表位的抗体(例如,中和抗体)的语境中使用时,术语“竞争”意指抗体之间的竞争,如通过所测试的抗体防止或抑制(例如,减少)参考分子(例如,配体或参考抗体)与共同抗原(例如,MS4A6A或它们的片段)的特异性结合的测定法所确定。多种类型的竞争性结合测定法可以用于确定抗体是否与另一种抗体竞争,例如:固相直接或间接放射免疫测定法(RIA)、固相直接或间接酶免疫测定法(EIA)、夹心竞争测定法(参见例如,Stahli等人,1983,Methods in Enzymology 9:242-253);固相直接生物素-亲和素EIA(参见例如,Kirkland等人,1986,J.Immunol.137:3614-3619)、固相直接标记测定法、固相直接标记夹心测定法(参见例如,Harlow和Lane,1988,Antibodies,A Laboratory Manual,ColdSpring Harbor Press);使用1-125标记的固相直接标记RIA(参见例如,Morel等人,1988,Molec.Immunol.25:7-15);固相直接生物素-亲和素EIA(参见例如,Cheung等人,1990,Virology 176:546-552);和直接标记RIA(Moldenhauer等人,1990,Scand.J.Immunol.32:77-82)。通常,这种测定法涉及使用结合至固体表面或携带这些未标记的测试抗体和标记的参考抗体中的任一者的细胞的纯化的抗原。竞争性抑制通过在存在测试抗体的情况下测定结合至固体表面或细胞的标记的量来测量。通常,测试抗体过量存在。通过竞争测定法鉴定的抗体(竞争性抗体)包括结合至与参考抗体相同的表位的抗体和结合至与参考抗体所结合的表位足够近的邻近表位以发生空间位阻的抗体。本文的实施例中提供了关于确定竞争性结合的方法的其他细节。通常,当竞争性抗体过量存在时,它将抑制(例如,减少)参考抗体与共同抗原的特异性结合至少20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97.5%和/或几乎100%。
如本文所用,MS4A6A多肽和第二多肽之间的“相互作用”涵盖但不限于蛋白质-蛋白质相互作用、物理相互作用、化学相互作用、结合、共价结合和离子结合。如本文所用,当抗体破坏、减少或完全消除两种多肽之间的相互作用时,所述抗体“抑制”两种多肽之间的“相互作用”。当多肽的抗体结合至两种多肽中的一种时,本公开的多肽的抗体“抑制”两种多肽之间的“相互作用”。在一些实施方案中,相互作用可以被抑制至少约20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97.5%和/或几乎100%中的任一者。
术语“表位”包括能够被抗体结合的任何决定簇。表位是被靶向抗原的抗体结合的抗原的区域,并且当抗原是多肽时,包括直接接触抗体的特定氨基酸。最常见的是,表位位于多肽上,但是在一些情况下,可以位于其他种类的分子(诸如核酸)上。表位决定簇可以包括分子的化学活性表面基团,诸如氨基酸、糖侧链、磷酰基或磺酰基基团,并且可以具有特定的三维结构特征和/或特定的电荷特征。通常,对特定靶抗原具有特异性的抗体将优先识别多肽和/或大分子的复杂混合物中的靶抗原上的表位。
“激动性”抗体或“活化性”抗体是在抗体结合抗原后诱导(例如,增加)抗原的一种或多种活性或功能的抗体。
“拮抗性”抗体或“阻断性”抗体或“抑制性”抗体是在抗体结合抗原后,减少、抑制和/或消除(例如,减少)抗原与一种或多种配体结合,以及/或者在抗体结合抗原后,减少、抑制和/或消除(例如,减少)抗原的一种或多种活性或功能的抗体。在一些实施方案中,拮抗性抗体或阻断性抗体或抑制性抗体基本上或完全抑制抗原与一种或多种配体的结合和/或抗原的一种或多种活性或功能。
“分离的”抗体(诸如本公开的分离的抗MS4A6A抗体)是已经从抗体的产生环境的组分(例如,天然的或重组的)鉴定、分离和/或回收的抗体。优选地,分离的抗体与抗体的产生环境的所有其他污染组分无关。抗体的产生环境的污染组分,诸如从重组转染细胞产生的那些污染组分,是通常会干扰抗体的研究、诊断或治疗用途的物质,并且可以包括酶、激素和其他蛋白质或非蛋白质溶质。在优选的实施方案中,抗体将被纯化为:(1)如通过例如Lowry方法所测定,抗体的大于95重量%,在一些实施方案中,大于99重量%;(2)通过使用旋转杯测序仪所测定,达到足以获得至少15个N-末端的残基或内部氨基酸序列的程度,或者(3)使用考马斯蓝或优选地银染色,在非还原或还原条件下通过SDS-PAGE所测定的均质性。因为抗体天然环境的至少一种组分将不存在,所以分离的抗体包括重组T细胞内的原位抗体。然而,通常,将通过至少一个纯化步骤来制备分离的多肽或抗体。
编码抗体(诸如本公开的抗MS4A6A抗体)的“分离的”核酸分子是从至少一种污染核酸分子鉴定和分离的核酸分子,所述污染核酸分子通常与分离的核酸分子产生的环境有关。优选地,分离的核酸与产生环境相关的所有组分无关。编码本文的多肽和抗体的分离的核酸分子的形式不同于所述核酸分子在自然界中存在的形式或背景。所以,分离的核酸分子不同于编码本文的天然存在于细胞中的多肽和抗体的核酸。
如本文所用,术语“载体”旨在指能够运输所连接的另一种核酸的核酸分子。载体的一种类型是“质粒”,它是指环状双链DNA,另外的DNA区段可以连接至所述环状双链DNA。载体的另一种类型是噬菌体载体。载体的另一种类型是病毒载体,其中另外的DNA区段可以连接至病毒基因组。某些载体能够在它们引入的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和附加型哺乳动物载体)。其他载体(例如,非附加型哺乳动物载体)可以在引入宿主细胞时被整合进宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够引导与它们可操作地连接的基因的表达。这些载体在本文中称为“重组表达载体”,或简称为“表达载体”。通常,在重组DNA技术中有用的表达载体通常是质粒的形式。在本说明书中,“质粒”和“载体”可以互换使用,因为质粒是最常用的载体形式。
如本文可互换使用的“多核苷酸”或“核酸”是指任何长度的核苷酸的聚合物,并且包括DNA和RNA。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、经修饰的核苷酸或碱基和/或它们的类似物或者可以通过DNA或RNA聚合酶或通过合成反应整合进聚合物的任何底物。
“宿主细胞”包括单个细胞或细胞培养物,它可以是或已经是用于掺入多核苷酸插入物的载体的接受者。宿主细胞包括单个宿主细胞的子代,并且由于天然、偶然或有意突变,子代不一定与原始亲代细胞完全相同(在形态或基因组DNA补体方面)。宿主细胞包括用一种或多种本公开的多核苷酸体内转染的细胞。
如本文所用,“载剂”包括在所采用的剂量和浓度下,对暴露于其中的细胞或哺乳动物无毒的药学上可接受的载剂、赋形剂或稳定剂。
如本文所用,术语“预防”包括提供针对个体中的特定疾病、病症或病状的发生或复发的预防。个体可以倾向于患上、易患特定疾病、病症或病状,或者具有患上这种疾病、病症或病状的风险,但是尚未被诊断为患有所述疾病、病症或病状。
如本文所用,具有患上特定疾病、病症或病状的“风险”的个体可以具有或可以不具有可检测的疾病或疾病的症状,并且在本文所述的治疗方法之前可以显示出或可以不显示出可检测的疾病或疾病的症状。如本领域所已知,“具有风险”表示个体具有一个或多个风险因素,它们是与特定疾病、病症或病状的产生相关联的可测量的参数。具有这些风险因素中的一个或多个的个体与不具有这些风险因素中的一个或多个的个体相比,具有更高的患上特定疾病、病症或病状的概率。
如本文所用,术语“治疗”是指被设计为在临床病理的过程中改变被治疗的个体的自然病程的临床干预。所期望的治疗效果包括降低进展率、改善或减轻病理状态以及缓解或改善特定疾病、病症或病状的预后。例如,如果与特定疾病、病症或病状相关的一种或多种症状得以减轻或消除,则个体得到成功“治疗”。
“有效量”是指至少在必要的剂量下和时间期内有效实现所期望的治疗或预防结果的量。有效量可以在一次或多次施用中提供。本文的有效量可以根据各种因素而变化,诸如个体的疾病状态、年龄、性别和体重以及治疗在个体中引起所期望的响应的能力。有效量也是治疗有益效果超过治疗的任何毒性或有害效果的量。对于预防用途,有益的或期望的结果包括诸如消除或降低风险、减轻严重度或延缓疾病的发病的结果,包括疾病的生物化学、组织学和/或行为症状、疾病的并发症以及在疾病的产生期间出现的中间病理表型。对于治疗用途,有益的或期望的结果包括诸如减少疾病引起的一个或多个症状、提高疾病患者的生活质量、减少治疗疾病所需的其他药物的剂量、增强另一种药物的效果的临床结果,所述临床结果诸如经由靶向、延缓疾病的进展和/或延长存活期来进行。药物、化合物或药物组合物的有效量是足以直接或间接达到预防性或治疗性处理的量。如在临床语境中所理解,有效量的药物、化合物或药物组合物可以或不可以与另一种药物、化合物或药物组合物联合实现。因此,“有效量”可以在施用一种或多种治疗剂的语境中考虑,并且如果单一药剂与一种或多种其他药剂联合可以实现或已实现所期望的结果,则所述单一药剂可以被认为以有效量给予。
对于治疗、预防或降低风险目的,“个体”是指被归类为哺乳动物的任何动物,包括人类、家畜和农场动物、动物园动物、运动动物或宠物,诸如狗、马、兔、牛、猪、仓鼠、沙鼠、小鼠、貂、大鼠、猫等等。在一些实施方案中,个体是人类。
如本文所用,与另一种化合物或组合物“联合”施用包括同时施用和/或在不同时间施用。联合施用还涵盖作为共制剂施用或作为单独的组合物施用,包括以不同的给药频率或间隔施用,并且使用相同的施用途径或不同的施用途径。在一些实施方案中,联合施用是作为相同的治疗方案的一部分施用。
如本文所用,短语“基本上相似”是指两个数值之间的足够高的相似性(通常一个数值与分子相关联而另一个数值与参考/比较分子相关联),以使得本领域的技术人员将认为在通过所述值(例如,Kd值、蛋白质表达水平)测量的生物学特征的情况下,这两个值之间的差异不具有统计学显著性。所述两个值之间的差异可以随着参考/比较值的变化而变化,为例如小于约20%、小于约10%和/或小于约5%。短语“基本上正常”是指基本上类似于参考(例如,正常参考)。
短语“基本上不同”是指两个数值之间的足够高的差异(通常一个数值与分子相关联而另一个数值与参考/比较分子相关联),以使得本领域的技术人员将认为在通过所述值(例如,Kd值、蛋白质表达水平)测量的生物学特征的情况下,这两个值之间的差异具有统计学显著性。所述两个值之间的差异可以随着参考/比较分子的值的变化而变化,为例如大于约10%、大于约20%、大于约30%、大于约40%和/或大于约50%。
与个体的临床益处增加相关的生物标志物的“存在”、“量”或“水平”是生物学样品中的可检测水平。这些可以通过本领域的技术人员已知的以及本文所公开的方法来测量。所评估的生物标志物的表达水平或量可以用于确定对治疗的反应。
术语“表达的水平”或“表达水平”通常可互换使用,通常是指生物学样品中生物标志物的量。“表达”通常是指将信息(例如,基因编码和/或表观遗传)转换为存在于细胞中以及在细胞中操作的结构的过程。因此,如本文所用,“表达”可以指转录成多核苷酸,翻译成多肽,或甚至多核苷酸和/或多肽修饰(例如,多肽的翻译后修饰)。转录的多核苷酸、翻译的多肽的片段或者多核苷酸和/或多肽修饰(例如,多肽的翻译后修饰)也应被视为表述它们来源于通过可变剪接产生的转录物或降解的转录物,还是来源于多肽的翻译后加工,例如通过蛋白水解。“表达的基因”包括转录成多核苷酸(即mRNA)然后翻译成多肽的那些基因,以及转录成RNA但不翻译成多肽的那些基因(例如,转运和核糖体RNA)。
“升高的表达”、“升高的表达水平”或“升高的水平”是指相对于对照(诸如未患有疾病或病症(例如,阿尔茨海默氏病)的一个或多个个体或内部对照(例如,管家生物标志物或多肽))而言,个体中的生物标志物或多肽的增加的表达或增加的水平。
“降低的表达”、“降低的表达水平”或“降低的水平”是指相对于对照(诸如未患有疾病或病症(例如,阿尔茨海默氏病)的一个或多个个体或内部对照(例如,管家生物标志物或多肽))而言,个体中的生物标志物或多肽的减少的表达或减少的水平。
术语“管家生物标志物”是指通常相似地存在于所有细胞类型中的生物标志物或一组生物标志物(例如,多核苷酸和/或多肽)。在一些实施方案中,管家生物标志物是“管家基因”。“管家基因”在本文中是指编码蛋白质的基因或一组基因,这些蛋白质的活性对于细胞功能的维持是必需的,并且通常相似地存在于所有细胞类型中。
如本文所用,术语“样品”是指从所关注的受试者和/或个体获得或来源于所关注的受试者和/或个体的组合物,所述组合物含有将要例如根据物理、生物化学、化学和/或生理学特征来表征和/或鉴定的细胞和/或其他分子实体。例如,短语“疾病样品”及其变化形式是指从所关注的受试者获得的任何样品,预期或已知所述受试者含有待表征的细胞和/或分子实体。样品包括但不限于原代或培养细胞或细胞系、细胞上清液、细胞裂解物、血小板、血清、血浆、玻璃体液、淋巴液、滑液、滤泡液、精液、羊水、乳、全血、血源性细胞、尿液、脑脊液、唾液、痰、泪液、汗液、粘液、肿瘤裂解物和组织培养基、组织提取物(诸如匀浆组织)、肿瘤组织、细胞提取物以及它们的组合。
所谓“组织样品”或“细胞样品”意指从受试者或个体的组织获得的相似细胞的集合。组织或细胞样品的来源可以是如来自新鲜、冷冻和/或保存的器官、组织样品、活检物和/或吸出物的固体组织;血液或任何血液成分(诸如血浆);体液,诸如脑脊液、羊水、腹膜液或间质液;来自受试者妊娠或发育的任何时间的细胞。组织样品也可以是原代或培养细胞或细胞系。任选地,组织或细胞样品从疾病组织/器官获得。组织样品可以含有性质上不与组织天然混杂的化合物,诸如防腐剂、抗凝血剂、缓冲剂、固定剂、营养素、抗生素等等。
如本文所用,“参考样品”、“参考细胞”、“参考组织”、“对照样品”、“对照细胞”或“对照组织”是指用于比较目的的样品、细胞、组织、标准品或水平。在一个实施方案中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织从相同受试者或个体的身体的健康和/或非患病部分(例如,组织或细胞)获得。例如,邻近患病细胞或组织的健康和/或非患病细胞或组织(例如,邻近肿瘤的细胞或组织)。在另一个实施方案中,参考样品从相同受试者或个体的身体的未治疗的组织和/或细胞获得。在又一个实施方案中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织从不是受试者或受试个体的个体的身体的健康和/或非患病部分(例如,组织或细胞)获得。在又一个实施方案中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织从不是受试者或受试个体的个体的身体的未治疗的组织和/或细胞获得。
所谓“关联”或“相关联”意指以任何方式将第一分析或方案的性能和/或结果与第二分析或方案的性能和/或结果进行比较。例如,可以在进行第二方案中使用第一分析或方案的结果,和/或可以使用第一分析或方案的结果来确定是否应当进行第二分析或方案。关于多核苷酸分析或方案的实施方案,可以使用多核苷酸表达分析或方案的结果来确定是否应当进行具体治疗方案。
如本文所用,术语“约”是指本技术领域的技术人员容易知道的相应值的常见误差范围。本文提及“约”某一值或参数包括(和描述)涉及该值或参数本身的实施方案。
除非上下文另外明确指明,否则如本文和所附权利要求中所用,单数形式“一个”、“一种”和“所述”包括复数指代物。例如,对“抗体”的提及是指对一种至多种抗体的提及,诸如摩尔量,并且包括本领域的技术人员已知的它们的等同物等等。
应当理解,本文所述的本公开的方面和实施方案包括“包括方面和实施方案”、“由方面和实施方案组成”和“基本上由方面和实施方案组成”。
II.抗MS4A6A抗体
本文提供了抗MS4A6A抗体。所提供的抗体可用于例如MS4A6A相关疾病的诊断或治疗。
在一个方面,本公开提供了结合至本公开的MS4A6A蛋白内的表位的分离的(例如,单克隆)抗体。本公开的MS4A6A蛋白包括但不限于哺乳动物MS4A6A蛋白、人类MS4A6A蛋白、小鼠MS4A6A蛋白和食蟹猴MS4A6A蛋白。
人类MS4A6A是一种编码膜糖蛋白的248个氨基酸的蛋白质。人类MS4A6A的氨基酸序列如SEQ ID NO:1所示:
MTSQPVPNETIIVLPSNVINFSQAEKPEPTNQGQDSLKKHLHAEIKVIGTIQILCGMMVLSLGIILASASFSPNFTQVTSTLLNSAYPFIGPFFFIISGSLSIATEKRLTKLLVHSSLVGSILSALSALVGFIILSVKQATLNPASLQCELDKNNIPTRSYVSYFYHDSLYTTDCYTAKASLAGTLSLMLICTLLEFCLAVLTAVLRWKQAYSDFPGSVLFLPHSYIGNSGMSSKMTHDCGYEELLTS。
另外,小鼠直系同源物MS4A6D的氨基酸序列如SEQ ID NO:2所示:
MTKPLVHSSLALSILSVLSALTGIAILSVSLAALEPALQQCKLAFTQLDTTQDAYHFFSPEPLNS
CFVAKAALTGVFSLMLISSVLELGLAVLTATLWWKQSSSAFSGNVIFLSQNSKNKSSVSSESL
CNPTYENILTS
另外,食蟹猴(cyno)MS4A6A的氨基酸序列如SEQ ID NO:3所示:
MTSQPVPNETMIVLPSNVINFSQAEKPEPTNQGQDSLKKRLQAEVKVIGTTQILCGVMVLSLGIMLASASFSPNFTQVTSTLLNSAYPFIGPFFFIISGSLSIATEKKLTKLLVHSSLVGSILSALSALVGFIILSVELAALNPASLQCELDKNNIPTRSYVSYYYHDSLYTMDCYTVKASLAGPLSLMLICTLLEFCLAVLTAVLRWKQTVSDFPGSVLFLPHSYIDNSGMSSKMTHGPGYEELLS
在一些实施方案中,MS4A6A在细胞中表达。在一些实施方案中,MS4A6A在骨髓细胞中表达。在一些实施方案中,MS4A6A在脑细胞中表达。在一些实施方案中,MS4A6A在星形胶质细胞中表达,所述星形胶质细胞包括但不限于成熟星形胶质细胞。在一些实施方案中,MS4A6A在少突胶质细胞中表达。在一些实施方案中,MS4A6A在小胶质细胞中表达。在一些实施方案中,MS4A6A在免疫细胞中表达,所述免疫细胞包括但不限于巨噬细胞、嗜酸性粒细胞、肥大细胞、树突细胞、自然杀伤细胞、中性粒细胞和T细胞。在一些实施方案中,MS4A6A在嗅觉细胞中表达。在一些实施方案中,MS4A6A在细胞表面上表达。
本公开的MS4A6A蛋白包括若干结构域,这些结构域包括但不限于胞质结构域(人类MS4A6A的的氨基酸残基1-46;参见SEQ ID NO:1);跨膜结构域(人类MS4A6A的氨基酸残基47-67);胞外结构域(胞外结构域1;ECL1),对应于人类MS4A6A的氨基酸残基68-84;跨膜结构域(人类MS4A6A的氨基酸残基85-105);胞质结构域(人类MS4A6A的氨基酸残基106-116);跨膜结构域(人类MS4A6A的氨基酸残基117-137);胞外结构域(胞外结构域2;ECL2),对应于人类MS4A6A的氨基酸残基138-185;跨膜结构域(人类MS4A6A的氨基酸残基186-206);和胞质结构域(人类MS4A6A的氨基酸残基207-248);另外,本公开的MS4A6A蛋白在许多组织和细胞中表达,这些组织和细胞包括但不限于大脑、神经元、神经胶质细胞、内皮细胞、血管周细胞、周细胞等。
MS4A6A结合配偶体和衔接蛋白
本文还提供了筛选结合MS4A6A并且阻断MS4A6A与一种或多种MS4A6A配体或结合配偶体之间的相互作用的抗MS4A6A抗体的方法。在一些实施方案中,可以合成肽文库,其中MS4A6A蛋白被切为由一个氨基酸残基分隔开的连续的15聚体和25聚体肽,随后将肽文库点样到滤膜上。然后可以通过SPOT结合分析来测试在存在或不存在抗MS4A6A抗体的情况下MS4A6A配体或结合配偶体的结合与MS4A6A肽或与多个肽相互作用的能力(例如,Frank,R和Overwin,H(1996)Methods.Mol.Biol.66,149-169;Reineke,U等人,(2002)J.Immunol.Methods 267,13-26;和Andersen,OS等人,(2010)J,BIOLOGICAL CHEMISTRY285,12210-12222)。在一些实施方案中,纤维素支持物可以被制备为N-修饰的纤维素-氨基羟基丙基醚膜,并且所有合成轮次都以通过9-芴基甲氧基羰基丙氨酸-五氟苯基酯(在肽和膜之间产生丙氨酸接头)进行的斑点定义开始。例如,通过不同氨基酸的逐步添加进行的自动化线性合成在N-末端由9-芴基-甲氧基羰基保护,并且对正在生长的肽链进行适当的侧链保护。在一些实施方案中,脱保护、活化和偶联的模式持续进行直到产生16聚体肽,从而在C-末端处产生共价锚定肽与纤维素支持物的均匀分布阵列,并且N-末端是游离末端(Scharn,D等人,(2000)J.Comb.Chem.2,361-369)。在一些实施方案中,侧保护基团的除去可以以两个步骤进行。首先,可以用90%三氟乙酸(溶于二氯甲烷,含有3%三异丁基硅烷和2%H2O)处理膜;其次,用例如60%三氟乙酸(溶于二氯甲烷,含有3%三异丁基硅烷和2%H2O)处理膜。为了除去三氟乙酸盐,可以用H
在一些实施方案中,MS4A6A与MS4A6A配体和结合配偶体之间的相互作用可以使用邻近连接测定法来表征(例如,Gustafsen等人,2013The Journal of Neuroscience,33:64-71)。例如,可以使用抗MS4A6A的一抗和针对结合配偶体的抗体对表达或暴露于MS4A6A及其配体或结合配偶体的细胞进行邻近连接测定法(PLA)(Duolinkll),然后用缀合至寡核苷酸的二抗温育,所述二抗杂交至随后添加的形成环的寡核苷酸,并且当抗原定位于附近40nM时引发滚环扩增。可以通过添加互补的荧光标记的寡核苷酸来显示扩增的DNA。
在一些实施方案中,可以在细胞结合测定法中使用碱性磷酸酶标记的配体来表征MS4A6A与MS4A6A配体和结合配偶体之间的相互作用(例如,Hu等人,2005,J.Neurosci.25,5298-5304;Fournier等人,2001,Nature 409,341-346;Lauren等人,2009,Nature 457,1128-1132;和Hu等人,2010,Neuron 68,654-667)。例如,可以制备碱性磷酸酶(AP)标记的配体,以评估与转染细胞或原代神经元上的MS4A6A的结合。为了检测AP标记的配体与表达MS4A6A的细胞的结合,可以用例如汉克斯平衡盐溶液(HBH)来洗涤培养物,所述汉克斯平衡盐溶液含有20mM HEPES钠pH7.05和1mg/ml牛血清白蛋白(BSA)。然后,可以在存在或不存在MS4A6A阻断性抗体的情况下,将平板与AP标记的配体一起温育,例如在23℃下的HBH中温育2h。可以根据本领域熟知的方法来检测和定量AP结合的配体。
在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体通过以下方式进一步抑制MS4A6A与它的配体、信号传导蛋白或结合蛋白之间的相互作用:a)降低可用于与一种或多种配体或结合蛋白相互作用的MS4A6A的有效水平;b);阻断与一种或多种配体或结合蛋白相互作用所需的MS4A6A上的位点中的一者或多者;c)防止与一种或多种配体或结合蛋白相互作用和/或校正MS4A6A的加工和/或亚细胞定位所需的MS4A6A上的一个或多个翻译后事件;d)诱导MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体通过以下方式进一步增加或增强MS4A6A与它的配体、信号传导蛋白或结合蛋白之间的相互作用:a)增加可用于与一种或多种配体或结合蛋白相互作用的MS4A6A的有效水平;b);增加与一种或多种配体或结合蛋白相互作用所需的MS4A6A上的位点中的一者或多者;c)增加与一种或多种配体或结合蛋白相互作用和/或校正MS4A6A的加工和/或亚细胞定位所需的MS4A6A上的一个或多个翻译后事件;d)防止MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体特异性结合至人类MS4A6A、小鼠MS4A6A、食蟹猴MS4A6A或它们的组合。在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体是人类抗体、人源化抗体、双特异性抗体、单克隆抗体、多价抗体、缀合抗体或嵌合抗体。在可以与前述实施方案中的任一者组合的某些实施方案中,抗MS4A6A抗体是识别第一抗原和第二抗原的双特异性抗体。在可以与前述实施方案中的任一者组合的某些实施方案中,第一抗原是MS4A6A,并且第二抗原是有利于跨血脑屏障运输的抗原。在可以与前述实施方案中的任一者组合的某些实施方案中,第二抗原选自由以下各项组成的组:MS4A6A、运铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体、CRM 197、美洲驼单结构域抗体、TMEM 30(A)、蛋白质转导结构域、TAT、Syn-B、穿膜肽、聚精氨酸肽、血管肽(angiopep)、基础免疫球蛋白(basigin)、Glut1和CD98hc和ANG1005。
信号转导衔接蛋白是但不限于与信号转导通路相关的其他蛋白质的辅助蛋白质。衔接蛋白含有各种蛋白质结合模块或基序,这些模块或基序将蛋白质结合配偶体连接在一起,有助于产生更大的信号传导复合物。衔接蛋白通常在它的结构内含有若干结构域,这些结构域允许与一种或多种其他特定蛋白质的特异性相互作用。例如,Src同源2(SH2)结构域识别含有磷酸酪氨酸残基的蛋白质内的特定氨基酸残基序列。衔接蛋白和其他信号传导蛋白的相互作用允许在信号转导期间和与信号转导相关地在细胞内发生多种特异性和协调蛋白质-蛋白质相互作用。
基于免疫受体酪氨酸的活化基序(ITAM)是四个氨基酸残基的保守序列,所述序列在免疫系统的某些细胞表面蛋白的胞质尾区中重复两次。在某些蛋白质的C-末端中,共有基序是YxxI/Lx
基于免疫受体酪氨酸的抑制基序(ITIM)是氨基酸的保守序列(S/I/V/LxYxxI/V/L(SEQ ID NO:127)),所述序列存在于免疫系统的某些抑制性受体的胞质尾区中。在含有ITIM的抑制性受体与它们的配体发生相互作用后,它们的ITIM基序就会被Src激酶家族的酶磷酸化,从而使它们能够募集其他酶(诸如各种磷酸酪氨酸磷酸酶),从而减少参与信号转导的分子的活化。(Barrow和Trowsdale,2006,Eur J Immunol,36:1646-1653)。
或者,一些受体没有固有的ITAM基序,而是编码带正电的跨膜氨基酸,诸如赖氨酸或精氨酸。这些带正电的氨基酸残基介导与对应的编码ITAM的衔接蛋白的带负电的跨膜氨基酸残基的缔合。在配体识别和受体聚类后,酪氨酸氨基酸残基被Src家族蛋白酪氨酸激酶(PTK)磷酸化。双磷酸化的ITAM基序充当Syk家族PTK(诸如ZAP-70或Syk)的串联SH2结构域的对接位点。Syk家族PTK使一系列胞内底物磷酸化,导致形成近膜端支架,从而导致重要效应分子(诸如磷脂酶C-c(PLCc))的募集,从而导致钙信号传导以及Ras活化,所述Ras活化刺激ERK通路和细胞活化。
研究支持MS4A蛋白在与其他细胞表面膜蛋白(调节或复制下游生物化学信号)形成信号传导复合物方面的重要性。虽然在大多数情况下,对于除MS4A1和MS4A2之外的MS4A蛋白,尚未明确确定结合配偶体,但是预测性蛋白质分析显示,Src同源2(SH2)和SH3结构域结合位点通常存在于MS4A蛋白的N-末端和C-末端区域上,这些位点可以作为其他信号传导分子的对接平台(Dinkel等人,2012,Nucl Acids Res,40:DD242-D251),SH结构域优先结合至富含脯氨酸的序列,这通常也存在于MS4A蛋白的胞质尾区中(Liang和Tedder,2001,Genomics,72:119-127;Kay等人,2000,FASEB J,14:231-241)。MS4A蛋白的该特征在存在或不存在抗MS4A6A抗体的情况下提供配体,例如在封闭缓冲液中在4℃下温育过夜,然后另外在封闭缓冲液中用1mg/ml HRP缀合的S蛋白进行第二次温育,但是在室温下进行3h。随后,可以用Tris缓冲盐水洗涤膜(例如洗涤三次10分钟),然后可以使用UptiLight化学发光底物和LumiImager仪器进行结合配体的定量表征,以提供斑点信号强度(勃林格(Boehringer)光单位)。或者,结合配体的检测可以通过免疫化学测定法来进行,所述免疫化学测定法用针对组氨酸标签的抗体和HRP缀合的抗小鼠二抗来进行。可以采用标准蛋白质印迹程序和斑点检测来进行温育。
本文还提供了筛选阻断MS4A6A与一种或多种MS4A6A配体或结合配偶体的相互作用(例如,结合)的抗MS4A6A抗体的方法。
在一些实施方案中,MS4A6A与MS4A6A配体或结合配偶体之间的相互作用可以使用表面等离子共振分析来表征(例如,Skeldal等人,2012J Biol Chem.,287:43798;和Andersen等人,201,J Biol Chem,285,12210-12222)。在存在或不存在封闭性抗MS4A6A抗体的情况下,可以例如在Biacore2000仪器(Biacore,Sweden)上使用CaHBS作为标准运行缓冲液(10mM HEPES pH7.4、140mM NaCl,2mM CaCl
在一些实施方案中,MS4A6A与MS4A6A配体和结合配偶体之间的相互作用可以使用沉降测定法来表征(例如,Andersen等人,2010,J Biol Chem,285,12210-12222)。例如,可以在不存在或存在MS4A6A阻断性抗体的情况下,可以将MS4A6A的表达的胞内或胞外结构域与标记的MS4A6A配体或结合配偶体一起温育,并且使用100μl谷胱甘肽(GSH)-琼脂糖珠粒(Amersham Biosciences,产品目录号17-0756-01)进行沉淀。可以使用Talon珠粒作为对照通过沉淀来测定所施加的受体结构域的量。结合蛋白质可以通过SDS-PAGE分析来分离,并且使用抗组氨酸抗体通过标准蛋白质印迹分析来显示。
它们密切参与蛋白质-蛋白质相互作用的坚实基础,也可以与彼此相关联以形成信号传导复合物。
因此,在一些实施方案中,本公开的抗MS4A6A抗体增强或增加信号传导复合物的形成。在一些实施方案中,本公开的抗MS4A6A抗体增强或增加与编码ITAM的衔接蛋白相关的信号传导复合物的形成。在一些实施方案中,本公开的抗MS4A6A抗体增强或增加抑制性信号传导复合物的形成。在一些实施方案中,本公开的抗MS4A6A抗体增强或增加与编码ITIM的衔接蛋白相关的抑制性信号传导复合物的形成。
在一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少信号传导复合物的形成。在一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少与编码ITAM的衔接蛋白相关的信号传导复合物的形成。在一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少抑制性信号传导复合物的形成。在一些实施方案中,本公开的抗MS4A6A抗体抑制(例如,阻断)或减少与编码ITIM的衔接蛋白相关的抑制性信号传导复合物的形成。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来抑制(例如,阻断)或减少MS4A6A同源寡聚体细胞表面蛋白复合物的形成:a)降低可用于MS4A6A同源寡聚体复合物形成的MS4A6A的有效水平;b)阻断MS4A6A同源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)防止MS4A6A同源寡聚体复合物形成以及/或者MS4A6A的正确加工和/或细胞定位所需的MS4A6A上的一个或多个翻译后事件;d)诱导MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来增加或增强MS4A6A同源寡聚体细胞表面蛋白复合物的形成:a)提高可用于MS4A6A同源寡聚体复合物形成的MS4A6A的有效水平;b)稳定MS4A6A同源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)维持MS4A6A的细胞表面表达,以允许同源寡聚体复合物形成以及/或者正确加工和/或维持MS4A6A的正确细胞定位;d)减少MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来抑制(例如,阻断)或减少与一种或多种信号转导衔接蛋白的MS4A6A异源寡聚体细胞表面蛋白复合物的形成:a)降低可用于MS4A6A异源寡聚体复合物形成的MS4A6A的有效水平;b);阻断MS4A6A异源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)防止MS4A6A异源寡聚体复合物形成以及/或者MS4A6A的正确加工和/或细胞定位所需的MS4A6A上的一个或多个翻译后事件;d)诱导MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体通过以下方式来增加或增强与一种或多种信号转导衔接蛋白的MS4A6A异源寡聚体细胞表面蛋白复合物的形成:a)提高可用于MS4A6A异源寡聚体复合物形成的MS4A6A的有效水平;b)稳定MS4A6A异源寡聚体复合物形成所需的MS4A6A上的位点中的一者或多者;c)维持MS4A6A的细胞表面表达,以允许MS4A6A异源寡聚体复合物形成以及/或者正确加工和/或维持MS4A6A的正确细胞定位;d)减少MS4A6A的降解;e)改变MS4A6A的构象,或它们的任何组合。
在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体增加或增强MS4A6A受体聚类。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开的抗MS4A6A抗体抑制或减少MS4A6A受体聚类。在一些实施方案中,MS4A6A受体聚类的增加或增强或者抑制或减少是在骨髓细胞中。
激动性抗体
本公开的抗MS4A6A抗体通常结合至在细胞中表达的一种或多种MS4A6A蛋白。本公开的一类抗体是激动性抗体。例如,MS4A6A受体可能需要在细胞表面上聚类以转导信号。因此,激动性抗体可以具有独特的特征来刺激例如MS4A6A受体。例如,它们可以具有与受体活化相容的正确的表位特异性,以及在细胞表面上诱导或保持受体聚类的能力。本公开的抗MS4A6A激动性抗体例如通过增加MS4A6A蛋白表达、通过增加MS4A6A蛋白水平、通过校正不正确的细胞定位、或通过增加或恢复细胞表面表达来增加或增强MS4A6A功能或活性。
在体内,抗体可以通过多种潜在机制来使受体聚类。人类抗体的一些同种型(诸如IgG2)由于独特的结构而具有使受体聚类或使受体保持聚类构型的内在能力,从而在不结合至Fc受体的情况下活化受体(诸如MS4A6A)(例如,White等人,(2015)Cancer Cell 27,138-148)。
其他抗体通过结合至邻近细胞上的Fcg受体而使受体(例如,MS4A6A)聚类。抗体的恒定IgG Fc部分与Fcg受体的结合导致抗体的聚集,而抗体又通过它们的可变区使与它们结合的受体聚集(Chu等人(2008)Mol Immunol,45:3926-3933;和Wilson等人,(2011)Cancer Cell 19,101-113)。不引发细胞因子分泌、氧化爆发、吞噬作用增加和抗体依赖性细胞介导的细胞毒性(ADCC)增强的与抑制性Fcg受体FcgR(FcgRIIB)的结合通常是使抗体在体内聚类的优选方式,因为与FcgRIIB的结合与免疫不良反应无关。
其他机制也可以用于使受体(例如,MS4A6A)聚类。例如,如上文所述,可以将交联在一起的抗体片段(例如,Fab片段)用于以类似于具有结合Fcg受体的Fc区的抗体的方式使受体(例如,MS4A6A)聚类。不希望受理论的束缚,据认为如果交联的抗体片段(例如,Fab片段)诱导细胞表面上的受体聚类并且结合靶标(例如,MS4A6A)上的适当表位,则它们可以充当激动性抗体。
因此,在一些实施方案中,结合MS4A6A蛋白的抗体可以包括由于它们的表位特异性而结合MS4A6A并且活化一种或多种MS4A6A活性的激动性抗体。不希望受理论的束缚,此类抗体可以结合至靶抗原(例如,MS4A6A)上的配体结合位点并且模拟天然配体的作用,或通过结合至一个或多个不是配体结合位点的结构域来刺激靶抗原转导信号。此类抗体不会干扰配体结合,并且可以与天然配体加合或协同作用。
在一些实施方案中,本公开的抗MS4A6A抗体是诱导或增加一种或多种MS4A6A活性的激动性抗体。在一些实施方案中,抗MS4A6A抗体诱导或增加细胞中表达的MS4A6A蛋白的一种或多种活性。在一些实施方案中,本公开的抗MS4A6A抗体是增加MS4A6A的细胞表面表达的激动性抗体。在一些实施方案中,本公开的抗MS4A6A抗体是校正MS4A6A的不当细胞定位的激动性抗体。在一些实施方案中,本公开的抗MS4A6A抗体是增加或恢复MS4A6A蛋白的细胞表面靶向或定位的激动性抗体。在一些实施方案中,本公开的抗MS4A6A抗体是增加或恢复MS4A6A蛋白的细胞表面表达的激动性抗体。
惰性抗体
本公开的另一类抗体包括惰性抗体。如本文所用,“惰性”抗体是指特异性结合它们的靶抗原但是不调节(例如,降低/抑制或活化/诱导)抗原功能的抗体。例如,就MS4A6A而言,惰性抗体不调节配体结合和/或MS4A6A活性。不希望受理论的束缚,据认为不具有使MS4A6A在细胞表面上聚类的能力的抗体可以是惰性抗体,即使它们具有与受体活化相容的表位特异性。
在一些实施方案中,结合MS4A6A蛋白的抗体可以包括结合MS4A6A但是由于它们的表位特异性而不调节蛋白质功能的抗体。此类功能惰性抗体可以用作运输毒素的货物,如针对CD33抗体吉妥珠单抗奥唑米星(Gemtuzumab zogamicin)(商品名Mylotarg)所述,吉妥珠单抗奥唑米星缀合至来自加利车霉素类别的细胞毒性剂,并且用于靶向和杀死急性粒细胞性白血病肿瘤(Naito等人,(2000),Leukemia,14,1436-1443;Ricart(2011)Clin CancerRes 17;6417-6436;Hamann等人,(2002)Journal:Bioconjugate Chemistry,13,47-58;和Beitz等人,(2001)Clin Cancer Res 7;1490-6.)。所以,在一些实施方案中,本公开的抗体是结合MS4A6A但是不能诱导一种或多种MS4A6A活性(例如,本文所述的MS4A6A活性)的惰性抗体。
钙内流
用MS4A1转染的细胞系显示出质膜间的钙电导增加,这表明MS4A1充当调节钙稳态的重要通道。(Parolini等人,2012,Int J Biochem Cell Biol,44:2095-2105;Li等人,2003,J Biol Chem,278:42427-42434)因此,MS4A蛋白通过调节(例如,增加)钙内流和/或通过从胞内储库动员钙来参与胞内游离钙浓度的控制(Ishibashi等人,2001,Gene,264:87-93)。由于MS4A家族中的蛋白质结构的保守性,其他MS4A蛋白(例如,MS4A4A和MS4A6A)可以共有重叠的钙调控功能(Ma等人,2015,Mol Neurobiol,51:1240-1248)。因此,在一些实施方案中,本公开的抗MS4A6A抗体调节细胞中的钙水平、钙内流和/或来自胞内储库的钙动员。在一些实施方案中,本公开的抗MS4A6A抗体增加细胞中的钙内流和/或增加来自胞内储库的细胞中的钙动员。在一些实施方案中,本公开的抗MS4A6A抗体减少细胞中的钙内流和/或减少来自胞内储库的细胞中的钙动员。
另外,MS4A蛋白家族的成员是项链嗅感觉神经元内表达的化学感受器。结果支持MS4A受体结合吸入的气味并且诱导向项链嗅感觉神经元的钙内流的模型,从而支持MS4A家族成员在调节各种细胞中的钙内流中的作用(Greer等人,2016,Cell,165:1734-1748)。
A.示例性抗体和某些其他抗体实施方案
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含选自以下各项的至少一个、两个、三个、四个、五个或六个HVR:(a)HVR-H1,其包含选自由SEQ ID NO:4、5、6、7、8、9、10、11、12、13、14、15和16组成的组的氨基酸序列;(b)HVR-H2,其包含选自由SEQ ID NO:17、18、19、20、21、22、23、24、25、26、27、28、29、30和31组成的组的氨基酸序列;(c)HVR-H3,其包含选自由SEQ ID NO:32、33、34、35、36、37、38、39、40、41、42、43、44和45组成的组的氨基酸序列;(d)HVR-L1,其包含选自由SEQ ID NO:46、47、48、49、50、51、52、53、54、55、56、57、58、59和60组成的组的氨基酸序列;(e)HVR-L2,其包含选自由SEQ ID NO:61、62、63、64、65、66、67、68、69、70、71、72、73、74、75和76组成的组的氨基酸序列;和(f)HVR-L3,其包含选自由SEQ ID NO:77、78、79、80、81、82、83、84、85、86、87、88、89和90组成的组的氨基酸序列。
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含选自以下各项的至少一个、两个、三个、四个、五个或六个HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:32的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:46的氨基酸序列;(e)HVR-L2,其包含SEQ IDNO:61的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:77的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:5的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:18的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:33的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:47的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:62的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:78的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:6的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:19的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:34的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:48的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:63的氨基酸序列;和(f)HVR-L3,其包含SEQ IDNO:79的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:7的氨基酸序列;(b)HVR-H2,其包含SEQID NO:20的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:35的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:49的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:64的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:80的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:8的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:21的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:36的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:50的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:65的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:81的氨基酸序列;(a)HVR-H1,其包含SEQ IDNO:9的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:22的氨基酸序列;(c)HVR-H3,其包含SEQID NO:37的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:51的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:66的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:82的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:23的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:38的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:52的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:67的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:83的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:11的氨基酸序列;(b)HVR-H2,其包含SEQ IDNO:24的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:39的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:53的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:68的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:84的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:8的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:25的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:40的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:54的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:69的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:85的氨基酸序列;(a)HVR-H1,其包含SEQ IDNO:11的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:26的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:39的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:53的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:70的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:84的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:32的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:46的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:61的氨基酸序列;和(f)HVR-L3,其包含SEQ IDNO:77的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:12的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:27的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:41的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:55的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:71的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:86的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:13的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:28的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:42的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:56的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:72的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:87的氨基酸序列;(a)HVR-H1,其包含SEQID NO:14的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:29的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:43的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:57的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:73的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:84的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:11的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:24的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:39的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:53的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:68的氨基酸序列;和(f)HVR-L3,其包含SEQ IDNO:84的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:15的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:30的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:44的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:58的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:74的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:88的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:6的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:19的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:34的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:59的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:75的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:89的氨基酸序列;(a)HVR-H1,其包含SEQID NO:6的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:19的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:34的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:48的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:63的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:79的氨基酸序列;(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:31的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:45的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:60的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:76的氨基酸序列;和(f)HVR-L3,其包含SEQ IDNO:90的氨基酸序列;以及(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:31的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:45的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:60的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:76的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:90的氨基酸序列。
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含选自以下各项的至少一个、至少两个或全部三个V
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含选自以下各项的至少一个、至少两个或全部三个V
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含(a)V
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含(a)V
在另一个方面,抗MS4A6A抗体包含重链可变结构域(V
在另一个方面,提供了抗MS4A6A抗体,其中所述抗体包含轻链可变结构域(V
在一些实施方案中,提供了抗MS4A6A抗体,其中所述抗体包含如上文提供的任何实施方案中的V
在一些实施方案中,本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体包含重链可变结构域(V
在一些实施方案中,本公开的抗MS4A6A抗体竞争性抑制至少一个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22、6A-23的参考抗体的结合。
在一些实施方案中,当与在不存在抗MS4A6A抗体的情况下与MS4A6A的结合相比,抗MS4A6A抗体减少一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体与MS4A6A的结合从约50%至100%的范围的量时,本公开的抗MS4A6A抗体与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体竞争与MS4A6A的结合。
在一些实施方案中,当与在不存在抗MS4A6A抗体的情况下与MS4A6A的结合相比,抗MS4A6A抗体减少一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体与MS4A6A的结合至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%时,本公开的抗MS4A6A抗体与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体竞争与MS4A6A的结合。在一些实施方案中,本公开的抗MS4A6A抗体减少一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体与MS4A6A的结合100%,表明抗MS4A6A抗体基本上完全阻断一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体与MS4A6A的结合。在一些实施方案中,抗MS4A6A抗体与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的抗体以对应于抗MS4A6A抗体与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体的10:1比率、9:1比率、8:1比率、7:1比率、6:1比率、5:1比率、4:1比率、3:1比率、2:1比率、1:1比率、0.75:1比率、0.5:1比率、0.25:1比率、0.1:1比率、0.075:1比率、0.050:1比率、0.025:1比率、0.01:1比率、0.0075:比率、0.0050:1比率、0.0025:1比率、0.001:比率、0.00075:1比率、0.00050:1比率、0.00025:1比率、0.0001:比率、1:10比率、1:9比率、1:8比率、1:7比率、1:6比率、1:5比率、1:4比率、1:3比率、1:2比率、1:0.75比率、1:0.5比率、1:0.25比率、1:0.1比率、1:0.075比率、1:0.050比率、1:0.025比率、1:0.01比率、1:0.0075比率、1:0.0050比率、1:0.0025比率、1:0.001比率、1:0.00075比率、1:0.00050比率、1:0.00025比率或1:0.0001比率的量存在。在一些实施方案中,与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的抗体的量相比,抗MS4A6A抗体以在约1.5倍至100倍、或大于100倍的范围内的量过量存在。在一些实施方案中,与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体的量相比,抗MS4A6A抗体以约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍或100倍过量的量存在。
在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的表位,所述表位与至少一个选自由以下各项的参考抗体结合的MS4A6A表位相同或重叠:6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23。
在一些实施方案中,本公开的抗MS4A6A抗体结合与至少一个选自以下各项的参考抗体结合的表位基本上相同的MS4A6A表位:6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23。用于绘制抗体结合的表位的详细示例性方法提供于Morris(1996)“EpitopeMapping Protocols”,载于Methods in Molecular Biology第66卷(Humana Press,Totowa,NJ)中。
在一些实施方案中,本公开的抗MS4A6A抗体与一个或多个选自6A-2、6A-3、6A-6、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-18、6A-19、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体竞争与MS4A6A的结合。在一些实施方案中,本公开的抗MS4A6A抗体与一个或多个选自6A-1、6A-4、6A-5、6A-7、6A-17和6A-20以及它们的任何组合的参考抗体竞争与MS4A6A的结合。
在一些实施方案中,本公开的抗MS4A6A抗体竞争性抑制至少一个选自6A-2、6A-3、6A-6、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-18、6A-19、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体与MS4A6A的结合。在一些实施方案中,本公开的抗MS4A6A抗体竞争性抑制至少一个选自6A-1、6A-4、6A-5、6A-7、6A-17和6A-20以及它们的任何组合的参考抗体与MS4A6A的结合。
在一些实施方案中,本公开的抗MS4A6A抗体对于与MS4A6A的结合具有与至少一个选自6A-2、6A-3、6A-6、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-18、6A-19、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体相同或重叠的MS4A6A上的表位。在一些实施方案中,本公开的抗MS4A6A抗体对于与MS4A6A的结合具有与至少一个选自6A-1、6A-4、6A-5、6A-7、6A-17和6A-20以及它们的任何组合的参考抗体相同或重叠的MS4A6A上的表位。
在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A(SEQ ID NO:1)的氨基酸残基1-46内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A(SEQ ID NO:1)的氨基酸残基47-67内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A(SEQ ID NO:1)的氨基酸残基68-84内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基85-105内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基106-116内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基117-137内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基138-185内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基186-206内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基207-248内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的胞外结构域1(ECL1)。在一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的胞外结构域2(ECL2)。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基180-190内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基181-189内、人类MS4A6A的氨基酸残基182-188内、人类MS4A6A的氨基酸残基183-187内、或人类MS4A6A的氨基酸残基184-186内的一个或多个氨基酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基185。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基185,其中人类MS4A6A的氨基酸残基185是苏氨酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至人类MS4A6A的氨基酸残基185,其中人类MS4A6A的氨基酸残基185是丝氨酸。在一些实施方案中,本公开的抗MS4A6A抗体结合至MS4A6A的氨基酸残基185,其中MS4A6A的氨基酸残基185是脯氨酸。
本领域已知的任何合适的竞争测定法或MS4A6A结合测定法(诸如BIAcore分析、ELISA测定法或流式细胞术)可以被用于确定抗MS4A6A抗体是否与一个或多个选自6A-1、6A-2、6A-3、6A-4、6A-5、6A-6、6A-7、6A-8、6A-9、6A-10、6A-11、6A-12、6A-13、6A-14、6A-15、6A-16、6A-17、6A-18、6A-20、6A-21、6A-22和6A-23以及它们的任何组合的参考抗体竞争与MS4A6A的结合(或者竞争性抑制这种结合)。在一种示例性竞争测定法中,将固定化的MS4A6A或在细胞表面上表达MS4A6A的细胞在溶液中温育,所述溶液包含结合至MS4A6A的第一标记抗体(例如,人类或非人类灵长类动物)和第二未标记抗体,所述第二未标记抗体与第一抗体竞争与MS4A6A结合的能力得到测试。第二抗体可以存在于杂交瘤上清液中。作为对照,将固定化的MS4A6A或表达MS4A6A的细胞在溶液中温育,所述溶液包含第一标记抗体,但是不包含第二未标记抗体。在允许第一抗体与MS4A6A结合的条件下温育后,除去过量的未结合的抗体,并且测量与固定化的MS4A6A或表达MS4A6A的细胞相关的标记的量。如果相对于对照样品,在测试样品中与固定化的MS4A6A或表达MS4A6A的细胞相关的标记的量实质上减少,则表示第二抗体正在与第一抗体竞争与MS4A6A的结合。参见,Harlow和Lane(1988)Antibodies:A Laboratory Manual第14章(Cold Spring Harbor Laboratory,ColdSpring Harbor,NY)。
本文还提供了竞争性抑制抗MS4A6A抗体的结合和/或竞争与抗MS4A6A抗体的结合的抗MS4A6A抗体,所述抗MS4A6A抗体包含(a)V
本文提供了抗MS4A6A抗体,所述抗MS4A6A抗体结合至与抗MS4A6A抗体结合的表位相同或重叠的人类MS4A6A的表位,包含(a)V
在一些实施方案中,根据上述实施方案中的任一者的抗MS4A6A抗体是单克隆抗体,包括人源化抗体和/或人类抗体。在一些实施方案中,抗MS4A6A抗体是抗体片段,例如Fv、Fab、Fab'、scFv、双体或F(ab')2片段。在一些实施方案中,抗MS4A6A抗体是基本上全长抗体,例如IgG1抗体、IgG2a抗体或者如本文定义的其他抗体类别或同种型。
在一些实施方案中,根据上述实施方案中的任一者的抗MS4A6A抗体可以单独地或组合地包括如下文第1-7节中所述的任何特征:
(1)抗MS4A6A抗体结合亲和力
在本文提供的抗体中的任一者的一些实施方案中,抗体具有的解离常数(Kd)<1μM、<100nM、<10nM、<1nM、<0.1nM、<0.01nM或<0.001nM(例如,10
(2)抗体片段
在本文提供的抗体中的任一者的一些实施方案中,抗体是抗体片段。抗体片段包括但不限于Fab、Fab'、Fab'-SH、F(ab')
双体是具有两个抗原结合位点的抗体片段,该抗体片段可以是二价的或双特异性的。参见例如EP404097;WO 1993/01161;Hudson等人Nat.Med.9:129-134(2003)。三体和四体也在Hudson等人,Nat.Med.9:129-134(2003)中有所描述。单结构域抗体是包含抗体的全部或一部分重链可变结构域或全部或一部分轻链可变结构域的抗体片段。在某些实施方案中,单结构域抗体是人类单结构域抗体(参见例如,美国专利号6248516)。
如本文所述,抗体片段可以通过各种技术来制备,包括但不限于完整抗体的蛋白水解消化以及通过重组宿主细胞(例如,大肠埃希氏菌(E.coli)或噬菌体)产生。
(3)嵌合和人源化抗体
在本文提供的抗体中的任一者的一些实施方案中,抗体是嵌合抗体。某些嵌合抗体例如在美国专利号4816567中有所描述。在一个实例中,嵌合抗体包含非人类可变区(例如,来源于小鼠、大鼠、仓鼠、兔或非人类灵长类动物(诸如猴)的可变区)和人类恒定区。在另一个实例中,嵌合抗体是“类别转换”抗体,其中类别或子类已从亲本抗体的类别或子类改变。嵌合抗体包括它们的抗原结合片段。
在本文提供的抗体中的任一者的一些实施方案中,抗体是人源化抗体。通常,非人类抗体被人源化以减少对人类的免疫原性,同时保留亲本非人类抗体的特异性和亲和力。在某些实施方案中,人源化抗体在人类中是基本上非免疫原性的。在某些实施方案中,人源化抗体对靶标的亲和力与来自衍生出人源化抗体的另一个物种的抗体基本上相同。参见例如,美国专利号5530101、5693761;5693762;和5585089。在某些实施方案中,鉴定了可以在不减少抗原结合结构域的天然亲和力而减少免疫原性的情况下修饰的抗体可变结构域的氨基酸。参见例如,美国专利号5766886和5869619。一般而言,人源化抗体包含一个或多个可变结构域,其中HVR(或它们的部分)来源于非人类抗体,并且FR(或它们的部分)来源于人类抗体序列。人源化抗体任选地还将包含人类恒定区的至少一部分。在一些实施方案中,人源化抗体中的一些FR残基被来自非人类抗体(例如,衍生出HVR残基的抗体)的对应残基置换,例如以恢复或改善抗体特异性或亲和力。
人源化抗体及其制备方法例如在Almagro等人Front.Biosci.13:161 9-1633(2008)中有所综述,并且例如在美国专利号5821337、7527791、6982321和7087409中进一步描述。可用于人源化的人类框架区包括但不限于:使用“最佳拟合”法选择的框架区(参见例如Sims等人,J.Immunol.151:2296(1993));来源于特定轻链可变区或重链可变区子组的人类抗体的共有序列的框架区(参见例如Carter等人,Proc.Natl.Acad.Sci.USA,89:4285(1992);以及Presta等人,J.Immunol.,151:2623(1993));人类成熟(体细胞突变)框架区或人类种系框架区(参见例如Almagro和Fransson,Front.Biosci.13:1619-1633(2008));以及来源于筛选FR文库的框架区(参加例如,Baca等人,J.Biol.Chem.272:10678-10684(1997)和Rosok等人,J.Biol.Chem.271:22611-22618(1996))。
(4)人类抗体
在本文提供的抗体中的任一者的一些实施方案中,抗体是人类抗体。人类抗体可以使用本领域已知的各种技术来产生。人类抗体通常在van Dijk等人,Curr.Opin.Pharmacol.5:368-74(2001)和Lonberg Curr.Opin.Immunol.20:450-459(2008)中有所描述。
可以通过将免疫原施用于转基因动物来制备人类抗体,所述转基因动物已被修饰为响应于抗原挑战而产生完整人类抗体或具有人类可变区的完整抗体。可以用大片段的人类Ig基因座来工程化改造小鼠抗体产生缺陷的小鼠品系,以期望这种小鼠可以在不存在小鼠抗体的情况下产生人类抗体。人类Ig大片段可以保留较大的可变基因多样性以及抗体产生和表达的适当调控。通过利用小鼠的抗体多样化和选择机制以及人类蛋白质的免疫耐受性缺乏,在这些小鼠品系中复制的人类抗体库可以产生针对任何所关注的抗原(包括人类抗原)的高亲和力完全人类抗体。使用杂交瘤技术,可以生产和选择具有所期望的特异性的抗原特异性人类mAb。某些示例性方法在美国专利号5545807、EP 546073和EP 546073中有所描述。另外参见,例如,描述XENOMOUSE
还可以通过基于杂交瘤的方法来制备人类抗体。用于产生人类单克隆抗体的人类骨髓瘤和小鼠-人类异源骨髓瘤细胞系已有所描述。(参加例如,Kozbor.J.Immunol.133:3001(1984)和Boemer等人,J.Immunol.147:86(1991))。经由人类B细胞杂交瘤技术产生的人类抗体还在Li等人,Proc.Natl.Acad.Sci.USA,1 03:3557-3562(2006)中有所描述。另外的方法包括例如在美国专利号7189826(描述从杂交瘤细胞系产生单克隆人类IgM抗体)中描述的那些方法。人类杂交瘤技术(三源杂交瘤技术)还在Vollmers等人,Histology andHistopathology 20(3):927-937(2005)和Vollmers等人,Methods and Findings inExperimental and Clinical Pharmacology 27(3):185-91(2005)中有所描述。还可以通过分离从人类衍生的噬菌体展示文库选择的Fv克隆可变结构域序列来产生人类抗体。然后,可以将此类可变结构域序列与所期望的人类恒定结构域组合。用于从抗体文库选择人类抗体的技术如下文所述。
在本文提供的抗体中的任一者的一些实施方案中,所述抗体是通过体外方法和/或筛选组合文库(以获得具有一个或多个所期望的活性的抗体)来分离的人类抗体。合适的实例包括但不限于噬菌体展示(CAT、Morphosys、Dyax、Biosite/Medarex、Xoma、Symphogen、Alexion(以前称为Proliferon)、Affimed)、核糖体展示(CAT)、酵母展示(Adimab)等等。在某些噬菌体展示方法中,通过聚合酶链式反应(PCR)分别克隆VH和VL基因库,并且在噬菌体文库中进行随机重组,然后可以筛选抗原结合噬菌体,如Winter等人,Ann.Rev.Immunol.12:433-455(1994)所述。例如,用于产生噬菌体展示文库以及从此类文库筛选具有所期望的结合特征的抗体的许多方法是本领域已知的。另外参见Sidhu等人,J.Mol.Biol.338(2):299-310,2004;Lee等人,J.Mol.Biol.340(5):1073-1093,2004;Fellouse Proc.Natl.Acad.Sci.USA 101(34):12467-12472(2004);和Lee等人,J.Immunol.Methods 284(-2):119-132(2004)。噬菌体通常以单链Fv(scFv)片段或以Fab片段来展示抗体片段。免疫来源的文库为免疫原提供了高亲和力抗体,而不需要构建杂交瘤。或者,可以克隆(例如,从人类)初始库以提供针对广泛的非自身抗原和自身抗原的单一来源的抗体,而无需进行任何免疫,如Griffiths等人,EMBOJ.12:725-734(1993)所述。最后,初始文库也可以通过以下方式合成制备:使用包含随机序列的PCR引物从干细胞克隆未重排的V基因区段,以编码高度可变的HVR3区并且在体外实现重排,如Hoogenboom等人,J.Mol.Biol.,227:381-388,1992所述。描述人类抗体噬菌体文库的专利公开包括例如:美国专利号5750373和美国专利公开号2007/0292936和2009/0002360。从人类抗体文库分离的抗体被视为本文的人类抗体或人类抗体片段。
(5)包含Fc区的恒定区
在本文提供的抗体中的任一者的一些实施方案中,抗体包含Fc。在一些实施方案中,Fc是人类IgG1、IgG2、IgG3和/或IgG4同种型。在一些实施方案中,抗体属于IgG类、IgM类或IgA类。
在本文提供的抗体中的任一者的某些实施方案中,抗体具有IgG2同种型。在一些实施方案中,抗体含有人类IgG2恒定区。在一些实施方案中,人类IgG2恒定区包含Fc区。在一些实施方案中,抗体诱导一种或多种MS4A6A活性或与Fc受体的结合无关。在一些实施方案中,抗体结合抑制性Fc受体。在某些实施方案中,抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
在本文提供的抗体中的任一者的某些实施方案中,抗体具有IgG1同种型。在一些实施方案中,抗体含有小鼠IgG1恒定区。在一些实施方案中,抗体含有人类IgG1恒定区。在一些实施方案中,人类IgG1恒定区包含Fc区。在一些实施方案中,抗体结合抑制性Fc受体。在某些实施方案中,抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
在本文提供的抗体中的任一者的某些实施方案中,抗体具有IgG4同种型。在一些实施方案中,抗体含有人类IgG4恒定区。在一些实施方案中,人类IgG4恒定区包含Fc区。在一些实施方案中,抗体结合抑制性Fc受体。在某些实施方案中,抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
在本文提供的抗体中的任一者的某些实施方案中,抗体具有杂合IgG2/4同种型。在一些实施方案中,抗体包含氨基酸序列,所述氨基酸序列包含根据人类IgG2的EU编号的氨基酸118至260和根据人类IgG4的EU编号的氨基酸261至447(WO 1997/11971;WO 2007/106585)。
在一些实施方案中,与包含Fc区(不包含氨基酸置换)的对应的抗体相比,Fc区增加聚类但不活化补体。在一些实施方案中,抗体诱导抗体特异性结合的靶标的一种或多种活性。在一些实施方案中,抗体结合至MS4A6A。
修饰本公开的抗MS4A6A抗体以修饰效应子功能和/或增加抗体的血清半衰期也是所期望的。例如,恒定区上的Fc受体结合位点可以被修饰或突变,以除去或减少对某些Fc受体(诸如FcγRI、FcγRII和/或FcγRIII)的结合亲和力,从而减少抗体依赖性细胞介导的细胞毒性。在一些实施方案中,通过除去抗体的Fc区(例如,在IgG的CH2结构域中)的N-糖基化来削弱效应子功能。在一些实施方案中,通过修饰诸如人类IgG的233-236、297和/或327-331的区域来削弱效应子功能,如WO 99/58572和Armour等人,Molecular Immunology 40:585-593(2003);Reddy等人,J.Immunology 164:1925-1933(2000)所述。在其他实施方案中,修饰本公开的抗MS4A6A抗体,以修饰效应子功能,从而在不活化体液应答的情况下,增加对含ITIM的FcgRIIb(CD32b)的发现选择性,增加邻近细胞上的MS4A6A抗体的聚类,包括抗体依赖性细胞介导的细胞毒性和抗体依赖性细胞吞噬作用也是所期望的。
例如,为了增加抗体的血清半衰期,可以将补救受体结合表位纳入抗体(尤其是抗体片段)中,如美国专利5739277所述。如本文所用,术语“补救受体结合表位”是指负责增加IgG分子的体内血清半衰期的IgG分子(例如,IgG
(6)多特异性抗体
多特异性是对至少两个不同的表位具有结合特异性的抗体,所述表位包括在相同的或另一个多肽(例如,本公开的一个或多个MS4A6A多肽)上的那些表位。在一些实施方案中,多特异性抗体可以是双特异性抗体。在一些实施方案中,多特异性抗体可以是三特异性抗体。在一些实施方案中,多特异性抗体可以是四特异性抗体。此类抗体可以衍生自全长抗体或抗体片段(例如,F(ab')
本文提供了包含第一抗原结合区和第二抗原结合区的多特异性抗体,其中所述第一抗原结合区包含本文所述的抗体的六个HVR,结合至MS4A6A,所述第二抗原结合区结合至第二多肽。在一些实施方案中,第一抗原结合区包含本文所述的抗体的V
在多特异性抗体中的任一者的一些实施方案中,第二多肽是:a)有利于跨血脑屏障运输的抗原;(b)有利于跨血脑屏障运输的抗原,所述抗原选自:运铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体、CRM197、美洲驼单结构域抗体、TMEM 30(A)、蛋白质转导结构域、TAT、Syn-B、穿膜肽、聚精氨酸肽、血管肽和ANG1005;(c)致病蛋白,所述致病蛋白选自淀粉样蛋白β、寡聚体淀粉样蛋白β、淀粉样蛋白β斑块、淀粉样蛋白前体蛋白或其片段、τ、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、C9orf72(9号染色体开放阅读框72)、c9RAN蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降钙素、超氧化物歧化酶、共济失调蛋白、共济失调蛋白1、共济失调蛋白2、共济失调蛋白3、共济失调蛋白7、共济失调蛋白8、共济失调蛋白10、路易体、心房利尿钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、麦丁蛋白、催乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、胱抑素、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复序列(DPR)肽、甘氨酸-丙氨酸(GA)重复序列肽、甘氨酸-脯氨酸(GP)重复序列肽、甘氨酸-精氨酸(GR)重复序列肽、脯氨酸-丙氨酸(PA)重复序列肽、泛素和脯氨酸-精氨酸(PR)重复序列肽;(d)在免疫细胞上表达的配体和/或蛋白质,其中所述配体和/或蛋白质选自:CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA-4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、BTLA、KIR、GAL9、TIM3、A2AR、LAG-3和磷脂酰丝氨酸;和/或(e)在一个或多个肿瘤细胞上表达的蛋白质、脂质、多糖或糖脂以及它们的任何组合。
许多有利于跨血脑屏障运输的抗原是本领域已知的(参见例如,GabathulerR.Neurobiol.Dis.37:48-57(2010))。此类第二抗原包括但不限于运铁蛋白受体(TR)、胰岛素受体(HIR)、胰岛素样生长因子受体(IGFR)、低密度脂蛋白受体相关蛋白1和2(LPR-1和2)、白喉毒素受体(包括CRM 197(白喉毒素的无毒突变体))、美洲驼单结构域抗体(诸如TMEM 30(A)(Flippase))、蛋白质转导结构域(诸如TAT)、Syn-B或穿膜肽、聚精氨酸或通常带正电的肽、血管肽(诸如ANG1005)(参见例如,Gabathuler,2010)和富集在血脑屏障内皮细胞上的其他细胞表面蛋白质(参见例如,Daneman等人,PLoS One 5(10):e13741(2010))。
多价抗体可以识别MS4A6A抗原,以及但不限于另外的抗原Aβ肽抗原、或α-突触核蛋白抗原、或τ蛋白抗原、或TDP-43蛋白抗原、或朊病毒蛋白抗原、或亨廷顿蛋白抗原、或RAN、翻译产物抗原(包括由甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)组成的二肽重复序列(DPR肽))、胰岛素受体、胰岛素样生长因子受体。运铁蛋白受体或有利于抗体跨血脑屏障转移的任何其他抗原。在一些实施方案中,第二多肽是运铁蛋白。在一些实施方案中,第二多肽是τ。在一些实施方案中,第二多肽是Aβ。在一些实施方案中,第二多肽是TREM2。在一些实施方案中,第二多肽是α-突触核蛋白。
多价抗体含有至少一条多肽链(并且优选地两条多肽链),其中一条或多条多肽链包含两个或更多个可变结构域。例如,一条或多条多肽链可以包含VD1-(X1)
用于制备多特异性抗体的技术包括但不限于具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(参见Milstein和Cuello Nature 305:537(1983),WO 93/08829和Traunecker等人,EMBO J.10:3655(1991)),和“钮入孔”工程(参见例如美国专利号5731168)。还可参见WO 2013/026833(CrossMab)。还可以通过以下技术来制备多特异性抗体:对用于制备抗体Fc异源二聚体分子的静电转向效应进行工程化改造(WO 2009/089004A1);使两个或更多个抗体交联(参见例如美国专利号4676980);使用亮氨酸;使用“双抗体”技术来制备双特异性抗体片段(参见例如,Hollinger等人,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993));以及使用单链Fv(scFv)二聚体(参见例如,Gruber等人,J.Immunol.152:5368(1994));以及制备三特异性抗体,如例如Tutt等人,J.Immunol.147:60(1991)所述。
本文还包括具有三个或更多个功能性抗原结合位点的工程化抗体,包括“章鱼抗体”(参见例如,US 2006/0025576)。本文的抗体还包括“双重作用性FAb”或“DAF”,它包含结合至多个MS4A6A的抗原结合位点(参见例如,US 2008/0069820)。
(7)抗体变体
在本文提供的抗体中的任一者的一些实施方案中,设想了抗体的氨基酸序列变体。例如,改善抗体的结合亲和力和/或其他生物学性质可以是所期望的。
(i)置换、插入和缺失变体
在本文提供的抗体中的任一者的一些实施方案中,提供了具有一个或多个氨基酸置换的抗体变体。可以通过将适当的修饰引入编码抗体的核苷酸序列中,或者通过肽合成来制备抗体的氨基酸序列变体。此类修饰包括例如抗体的氨基酸序列内的残基的缺失和/或插入和/或置换。
表1:氨基酸置换
抗体生物学性质的实质性修饰通过选择在维持以下性质的作用显著不同的置换来实现:(a)置换区域中的多肽主链的结构(例如,折叠或螺旋构象),(b)分子在靶位点处的电荷或疏水性,或(c)侧链体积。根据常见侧链性质将天然存在的残基分为几组:
(1)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)中性亲水性:Cys、Ser、Thr、Asn、Gln;
(3)酸性:Asp、Glu;
(4)碱性:His、Lys、Arg;
(5)影响链取向的残基:Gly、Pro;以及
(6)芳香族:Trp、Tyr、Phe。
例如,非保守置换可以涉及将这些类别之一的成员替换为另一个类别的成员。例如可以将此类置换的残基引入与非人类抗体同源的人类抗体的区域中,或引入分子的非同源区中。
根据某些实施方案,在改变本文所述的多肽或抗体时,可以考虑氨基酸的亲水指数。根据氨基酸的疏水性和电荷特征,已为每个氨基酸分配亲水指数。它们是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。
亲水氨基酸指数在赋予蛋白质相互作用生物学功能方面的重要性是本领域所理解的。Kyte等人,J.Mol.Biol.,157:105-131(1982)。已知某些氨基酸可以置换具有相似的亲水指数或得分的其他氨基酸,并且仍然保留相似的生物学活性。在根据亲水指数进行改变时,在某些实施方案中,亲水指数在±2以内的氨基酸的置换被包括在内。在某些实施方案中,在±1以内的那些氨基酸被包括在内,并且在某些实施方案中,在±0.5以内的那些氨基酸被包括在内。
在本领域中还应理解,可以根据亲水性有效地进行相似的氨基酸的置换,尤其是在打算将由此产生的生物学功能性蛋白质或肽用于免疫学实施方案的情况下,正如目前的情况那样。在某些实施方案中,蛋白质的最大局部平均亲水性,由蛋白质的邻近氨基酸的亲水性所支配,与蛋白质的免疫原性和抗原性,即与蛋白质的生物学性质相关联。
已为这些氨基酸残基分配以下亲水性值:精氨酸(+3.0);赖氨酸(+3.0±1);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);甲硫氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5)和色氨酸(-3.4)。在根据相似的亲水性值进行改变时,在某些实施方案中,亲水性值在±2以内的氨基酸的置换被包括在内,在某些实施方案中,在±1以内的那些氨基酸的置换被包括在内,并且在某些实施方案中,在±0.5以内的那些氨基酸的置换被包括在内。还可以根据亲水性从一级氨基酸序列鉴定出表位。这些区域也被称为“表位核心区”。
在某些实施方案中,置换、插入或缺失可以在一个或多个HVR内出现,只要这些改变基本上不降低抗体结合抗原的能力即可。例如,可以在HVR中作出不会基本上降低结合亲和力的保守改变(例如,如本文提供的保守置换)。此类改变可以例如在HVR中的抗原接触残基外部。在上文提供的变体VH和VL序列的某些实施方案中,每个HVR是未改变的,或含有不超过一个、两个或三个氨基酸置换。
氨基酸序列插入包括长度在一个残基至包含一百个或更多个残基的多肽的范围内的氨基和/或羧基末端融合体,以及单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N-末端甲硫氨酰基残基的抗体。抗体分子的其他插入变体包括抗体的N-末端或C-末端与酶(例如,对于ADEPT)或延长抗体的血清半衰期的多肽的融合体。
还可以通常用丝氨酸置换不涉及维持抗体的适当构象的任何半胱氨酸残基,以改善分子的氧化稳定性并且防止异常交联。相反,可以将一个或多个半胱氨酸键添加至抗体,以改善抗体的稳定性(尤其是在抗体是抗体片段(诸如Fv片段)的情况下)。
(ii)糖基化变体
在本文提供的抗体中的任一者的一些实施方案中,改变抗体以增加或减少抗体的糖基化程度。可以通过改变氨基酸序列以产生或除去一个或多个糖基化位点来方便地实现抗体的糖基化位点的添加或缺失。
抗体的糖基化通常是N-连接的或O-连接的。N-连接是指碳水化合物部分至天冬酰胺残基的侧链的附接。三肽序列天冬酰胺-X-丝氨酸和天冬酰胺-X-苏氨酸是用于将碳水化合物部分酶促附接至天冬酰胺侧链的识别序列,其中X为除脯氨酸之外的任何氨基酸。因此,这些三肽序列中的任一者存在于多肽中产生了潜在的糖基化位点。O-连接糖基化是指糖(即,N-乙酰半乳糖胺、半乳糖或木糖中的一者)与羟氨基酸(最常见地丝氨酸或苏氨酸,但是还可以使用5-羟脯氨酸或5-羟赖氨酸)的附接。
糖基化位点至抗体的添加通过改变氨基酸序列来方便地实现,以使得所述抗体含有上述三肽序列中的一者或多者(对于N-连接糖基化位点)。还可以通过一个或多个丝氨酸或苏氨酸残基至原始抗体的序列的添加或者被一个或多个丝氨酸或苏氨酸残基的置换来进行改变(对于O-连接糖基化位点)。
在抗体包含Fc区的情况下,可以改变与其连接的碳水化合物。哺乳动物细胞产生的天然抗体通常包含支链的双触角寡糖,所述寡糖通常通过N-连接来连接至Fc区的CH2结构域的Asn297(根据Kabat编号)。寡糖可以包括各种碳水化合物,例如甘露糖、N-乙酰基葡萄糖胺(GlcNAc)、半乳糖和唾液酸,以及附接至双触角寡糖结构的“茎”中的GlcNAc的岩藻糖。在一些实施方案中,可以对本公开的抗体中的寡糖进行修饰以产生具有某些改善的性质的抗体变体。
在一个实施方案中,提供具有缺乏(直接或间接)附接至Fc区的岩藻糖的碳水化合物结构的抗体变体。参见例如,美国专利公开号2003/0157108和2004/0093621。涉及“去岩藻糖基化”或“岩藻糖缺乏型”抗体变体的公开的实例包括:US 2003/0157108;US 2003/0115614;US 2002/0164328;US 2004/0093621;US 2004/0132140;US 2004/0110704;US2004/0110282;US 2004/0109865;Okazaki等人,J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等人,Biotech.Bioeng.87:614(2004)。能够产生去岩藻糖基化抗体的细胞系的实例包括蛋白质岩藻糖基化缺陷的Led 3CHO细胞(Ripka等人,Arch.Biochem.Biophys.249:533-545(1986);US 2003/0157108),以及敲除细胞系,诸如α-1,6-岩藻糖基转移酶基因、FUT8、敲除CHO细胞(参见例如,Yamane-Ohnuki等人,Biotech.Bioeng 87:614(2004)和Kanda等人,Biotechnol.Bioeng.94(4):680-688(2006))。
(iii)经修饰的恒定区
在本文提供的抗体中的任一者的一些实施方案中,抗体Fc是抗体Fc同种型和/或修饰。在一些实施方案中,抗体Fc同种型和/或修饰能够结合至Fcγ受体。
在本文提供的抗体中的任一者的一些实施方案中,经修饰的抗体Fc是IgG1修饰的Fc。在一些实施方案中,IgG1修饰的Fc包含一个或多个修饰。例如,在一些实施方案中,IgG1修饰的Fc包含一个或多个氨基酸置换(例如,相对于相同同种型的野生型Fc区)。在一些实施方案中,一个或多个氨基酸置换选自N297A(Bolt S等人,(1993)Eur J Immunol 23:403-411)、D265A(Shields等人,(2001)R.J.Biol.Chem.276,65916604)、L234A、L235A(Hutchins等人,(1995)Proc Natl Acad Sci USA,92:11980-11984;Alegre等人,(1994)Transplantation 57:1537-1543.31;Xu等人,(2000)Cell Immunol,200:16-26)、G237A(Alegre等人,(1994)Transplantation 57:1537--1543.31;Xu等人,(2000)Cell Immunol,200:16-26)、C226S、C229S、E233P、L234V、L234F、L235E(McEarchern等人,(2007)Blood,109:1185-1192)、P331S(Sazinsky等人,(2008)Proc Natl Acad Sci USA 2008,105:20167-20172)、S267E、L328F、A330L、M252Y、S254T和/或T256E,其中氨基酸位置根据EU编号惯例进行。
在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的N297A突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的D265A和N297A突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的D270A突变。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的L234A和L235A突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的L234A和G237A突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的L234A、L235A和G237A突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的P238D、L328E、E233、G237D、H268D、P271G和A330R突变中的一者或多者(包括全部突变)。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的S267E/L328F突变中的一者或多者。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的P238D、L328E、E233D、G237D、H268D、P271G和A330R突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的P238D、L328E、G237D、H268D、P271G和A330R突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的P238D、S267E、L328E、E233D、G237D、H268D、P271G和A330R突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的P238D、S267E、L328E、G237D、H268D、P271G和A330R突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的C226S、C229S、E233P、L234V和L235A突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的L234F、L235E和P331S突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的S267E和L328F突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的S267E突变。在IgG1修饰的Fc中的任一者的一些实施方案中,Fc包含用CH1进行的IgG1的恒定重链1(CH1)和铰链区的置换和用κ轻链进行的IgG2的铰链区(根据EU编号的IgG2的氨基酸118-230)的置换。
在IgG1修饰的Fc中的任一者的一些实施方案中,与具有Fc区(不包含两个或更多个氨基酸置换)的对应的抗体相比,Fc包含两个或更多个氨基酸置换,所述氨基酸置换增加抗体聚类但不活化补体。因此,在IgG1修饰的Fc中的任一者的一些实施方案中,IgG1修饰的Fc是包含Fc区的抗体,其中所述抗体包含在位置E430G处的氨基酸置换和在Fc区中的一个或多个氨基酸置换,所述氨基酸置换的残基位置选自:根据EU编号的L234F、L235A、L235E、S267E、K322A、L328F、A330S、P331S以及它们的任何组合。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G、L243A、L235A和P331S处的氨基酸置换。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G和P331S处的氨基酸置换。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G和K322A处的氨基酸置换。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G、A330S和P331S处的氨基酸置换。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G、K322A、A330S和P331S处的氨基酸置换。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G、K322A和A330S处的氨基酸置换。在一些实施方案中,IgG1修饰的Fc包含根据EU编号的位置E430G、K322A和P331S处的氨基酸置换。
在IgG1修饰的Fc中的任一者的一些实施方案中,IgG1修饰的Fc可以另外包含在本文中可以与根据EU编号惯例的A330L突变(Lazar等人,Proc Natl Acad Sci USA,103:4005-4010(2006)),或L234F、L235E和/或P331S突变中的一者或多者(Sazinsky等人,ProcNatl Acad Sci USA,105:20167-20172(2008))组合,以消除补体活化。在IgG1修饰的Fc中的任一者的一些实施方案中,IgG1修饰的Fc可以另外包含根据EU编号的A330L、A330S、L234F、L235E和/或P331S中的一者或多者。在IgG1修饰的Fc中的任一者的一些实施方案中,IgG1修饰的Fc可以另外包含一个或多个突变,以增强在人类血清中的抗体半衰期(例如,根据EU编号惯例的M252Y、S254T和T256E突变中的一者或多者(包括全部突变))。在IgG1修饰的Fc中的任一者的一些实施方案中,IgG1修饰的Fc可以另外包含根据EU编号的E430G、E430S、E430F、E430T、E345K、E345Q、E345R、E345Y、S440Y和/或S440W中的一者或多者。
本公开的其他方面涉及具有经修饰的恒定区(即,Fc区)的抗体。如果抗体被工程化改造为消除FcgR结合,则根据与FcgR受体的结合以活化被靶向受体的抗体可以丧失激动剂活性(参见例如,Wilson等人,Cancer Cell 19:101-113(2011);Armour等人,Immunology40:585-593(2003);和White等人,Cancer Cell 27:138-148(2015))。因此,据认为,当抗体具有来自人类IgG2同种型的Fc结构域(CH1和铰链区)或者能够优先地结合抑制性FcgRIIBr受体或它们的变异体的另一种类型的Fc结构域时,具有正确表位特异性的本公开的抗MS4A6A抗体可以活化靶抗原,而不良反应最小。
在本文提供的抗体中的任一者的一些实施方案中,经修饰的抗体Fc是IgG2修饰的Fc。在一些实施方案中,IgG2修饰的Fc包含一个或多个修饰。例如,在一些实施方案中,IgG2修饰的Fc包含一个或多个氨基酸置换(例如,相对于相同同种型的野生型Fc区)。在IgG2修饰的Fc中的任一者的一些实施方案中,一个或多个氨基酸置换选自根据EU编号惯例的V234A(Alegre等人,Transplantation 57:1537-1543(1994);Xu等人,Cell Immunol,200:16-26(2000));G237A(Cole等人,Transplantation,68:563-571(1999));H268Q、V309L、A330S、P331S(US 2007/0148167;Armour等人,Eur J Immunol 29:2613-2624(1999);Armour等人,The Haematology Journal 1(增刊1):27(2000);Armour等人,TheHaematology Journal 1(增刊1):27(2000))、C219S和/或C220S(White等人,Cancer Cell27,138-148(2015));S267E、L328F(Chu等人,Mol Immunol,45:3926-3933(2008));以及M252Y、S254T和/或T256E。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置V234A和G237A处的氨基酸置换。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置C219S或C220S处的氨基酸置换。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置A330S和P331S处的氨基酸置换。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置S267E和L328F处的氨基酸置换。
在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号惯例的C127S氨基酸置换(White等人,(2015)Cancer Cell 27,138-148;Lightle等人,Protein Sci.19:753-762(2010);和WO 2008/079246)。在IgG2修饰的Fc中的任一者的一些实施方案中,抗体具有IgG2同种型,所述IgG2同种型具有κ轻链恒定结构域,所述κ轻链恒定结构域包含根据EU编号惯例的C214S氨基酸置换(White等人,Cancer Cell 27:138-148(2015);Lightle等人,Protein Sci.19:753-762(2010);和WO 2008/079246)。
在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号惯例的C220S氨基酸置换。在IgG2修饰的Fc中的任一者的一些实施方案中,抗体具有IgG2同种型,所述IgG2同种型具有κ轻链恒定结构域,所述κ轻链恒定结构域包含根据EU编号惯例的C214S氨基酸置换。
在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号惯例的C219S氨基酸置换。在IgG2修饰的Fc中的任一者的一些实施方案中,抗体具有IgG2同种型,所述IgG2同种型具有κ轻链恒定结构域,所述κ轻链恒定结构域包含根据EU编号惯例的C214S氨基酸置换。
在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含IgG2同种型重链恒定结构域1(CH1)和铰链区(White等人,Cancer Cell 27:138-148(2015))。在IgG2修饰的Fc中的任一者的某些实施方案中,IgG2同种型CH1和铰链区包含根据EU编号的118-230的氨基酸序列。在IgG2修饰的Fc中的任一者的一些实施方案中,抗体Fc区包含根据EU编号惯例的S267E氨基酸置换、L328F氨基酸置换或它们二者,和/或N297A或N297Q氨基酸置换。
在IgG2修饰的Fc中的任一者的一些实施方案中,Fc还包含根据EU编号的位置E430G、E430S、E430F、E430T、E345K、E345Q、E345R、E345Y、S440Y和S440W处的一个或多个氨基酸置换。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc可以另外包含一个或多个突变,以增强在人类血清中的抗体半衰期(例如,根据EU编号惯例的M252Y、S254T和T256E突变中的一者或多者(包括全部突变))。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc可以另外包含A330S和P331S。
在IgG2修饰的Fc中的任一者的一些实施方案中,Fc是IgG2/4杂合Fc。在一些实施方案中,IgG2/4杂合Fc包含IgG2 aa 118至260和IgG4 aa 261至447。在IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置H268Q、V309L、A330S和P331S处的一个或多个氨基酸置换。
在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含一个或多个选自根据EU编号的A330L、L234F、L235E或P331S;以及它们的任何组合的另外的氨基酸置换。
在IgG1和/或IgG2修饰的Fc中的任一者的某些实施方案中,Fc包含选自根据EU编号的C127S、L234A、L234F、L235A、L235E、S267E、K322A、L328F、A330S、P331S、E345R、E430G、S440Y以及它们的任何组合的残基位置处的一个或多个氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G、L243A、L235A和P331S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G和P331S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G和K322A处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G、A330S和P331S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G、K322A、A330S和P331S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G、K322A和A330S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G、K322A和P331S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置S267E和L328F处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置C127S处的氨基酸置换。在IgG1和/或IgG2修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E345R、E430G和S440Y处的氨基酸置换。
在本文提供的抗体中的任一者的一些实施方案中,经修饰的抗体Fc是IgG4修饰的Fc。在一些实施方案中,IgG4修饰的Fc包含一个或多个修饰。例如,在一些实施方案中,IgG4修饰的Fc包含一个或多个氨基酸置换(例如,相对于相同同种型的野生型Fc区)。在IgG4修饰的Fc中的任一者的一些实施方案中,一个或多个氨基酸置换选自根据EU编号惯例的L235A、G237A、S229P、L236E(Reddy等人,J Immunol 164:1925-1933(2000))、S267E、E318A、L328F、M252Y、S254T和/或T256E。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc可以另外包含根据EU编号惯例的L235A、G237A和E318A。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc可以另外包含根据EU编号惯例的S228P和L235E。在IgG4修饰的Fc中的任一者的一些实施方案中,IgG4修饰的Fc可以另外包含根据EU编号惯例的S267E和L328F。
在IgG4修饰的Fc中的任一者的一些实施方案中,IgG4修饰的Fc包含可以与根据EU编号惯例的S228P突变(Angal等人,Mol Immunol.30:105-108(1993))和/或与(Peters等人,J Biol Chem.287(29):24525-33(2012))所述的一个或多个突变组合,以增强抗体稳定性。
在IgG4修饰的Fc中的任一者的一些实施方案中,IgG4修饰的Fc可以另外包含一个或多个突变,以增强在人类血清中的抗体半衰期(例如,根据EU编号惯例的M252Y、S254T和T256E突变中的一者或多者(包括全部突变))。
在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的L235E。在IgG4修饰的Fc中的任一者的某些实施方案中,Fc包含选自根据EU编号的C127S、F234A、L235A、L235E、S267E、K322A、L328F、E345R、E430G、S440Y以及它们的任何组合的残基位置处的一个或多个氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G、L243A、L235A和P331S处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G和P331S处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430G和K322A处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E430处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc区包含根据EU编号的位置E430G和K322A处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置S267E和L328F处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置C127S处的氨基酸置换。在IgG4修饰的Fc中的任一者的一些实施方案中,Fc包含根据EU编号的位置E345R、E430G和S440Y处的氨基酸置换。
(8)其他抗体修饰
在抗体中的任一者的一些实施方案中,抗体是衍生物。术语“衍生物”是指包含除氨基酸(或核酸)的插入、缺失或置换之外的化学修饰的分子。在某些实施方案中,衍生物包含共价修饰,包括但不限于与聚合物、脂质或者其他有机或无机部分的化学键合。在某些实施方案中,经化学修饰的抗原结合蛋白可以具有比未经化学修饰的抗原结合蛋白更长的循环半衰期。在某些实施方案中,经化学修饰的抗原结合蛋白可以具有针对所期望的细胞、组织和/或器官的改善的靶向能力。在一些实施方案中,衍生物抗原结合蛋白被共价修饰为包含一个或多个水溶性聚合物附接物,包括但不限于聚乙二醇、聚氧乙二醇或聚丙二醇。参见例如,美国专利号4640835、4496689、4301144、4670417、4791192和4179337。在某些实施方案中,衍生物抗原结合蛋白包含一种或多种聚合物,包括但不限于单甲氧基-聚乙二醇、葡聚糖、纤维素、乙二醇/丙二醇的共聚物、羧甲基纤维素、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三氧己环、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)、聚-(N-乙烯基吡咯烷酮)-聚乙二醇、丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙基化多元醇(例如,甘油)和聚乙烯醇,以及此类聚合物的混合物。
在某些实施方案中,衍生物被聚乙二醇(PEG)亚基共价修饰。在某些实施方案中,一种或多种水溶性聚合物在衍生物的一个或多个特定位置处(例如在氨基末端)键合。在某些实施方案中,一种或多种水溶性聚合物无规附接至衍生物的一个或多个侧链。在某些实施方案中,PEG被用于改善抗原结合蛋白的治疗能力。在某些实施方案中,PEG被用于改善人源化抗体的治疗能力。某些此类方法例如在美国专利号6133426中有所讨论,该专利据此以引用的方式并入用于任何目的。
肽类似物通常在制药行业中用作非肽药物,它的性质类似于模板肽的那些药物。这些类型的非肽化合物称为“肽模拟物(peptide mimetics或peptidomimetics)”。Fauchere,J.Adv.Drug Res.,15:29(1986);和Evans等人,J.Med.Chem.,30:1229(1987),这些文献以引用的方式并入本文用于任何目的。此类化合物通常借助于计算机化分子建模来开发。结构上类似于治疗使用的肽的肽模拟物可以用于产生类似的治疗或预防效果。通常,模拟物在结构上类似于范例多肽(即,具有生物化学性质或药理学活性的多肽),诸如人类抗体,但是具有一个或多个肽键,所述肽键任选地通过本领域熟知的方法被选自以下各项的键替换:-CH
药物缀合涉及将生物学活性细胞毒性(抗癌)有效负载或药物偶联至特异性靶向某种肿瘤标志物(例如,理想地仅存在于肿瘤细胞内或肿瘤细胞上的多肽)的抗体。抗体在体内追踪这些蛋白质并且使它们自身附接至癌细胞的表面。抗体和靶蛋白(抗原)之间的生物化学反应会触发肿瘤细胞中的信号,然后所述信号与细胞毒素一起吸收或内化抗体。在ADC内化后,细胞毒性药物被释放并且杀死癌症。由于这种靶向,理想地,药物与其他化学治疗剂相比,具有更低的副作用并且提供更广泛的治疗窗口。缀合抗体的技术已有所公开,是本领域已知的(参见例如,Jane de Lartigue OncLive 2012年7月5日;ADC Review onantibody-drug conjugates;和Ducry等人Bioconjugate Chemistry 21(1):5-13(2010)。
III.核酸、载体和宿主细胞
本公开的抗MS4A6A抗体可以使用重组方法和组合物来产生,例如如美国专利号4816567所述。在一些实施方案中,提供了具有编码本公开的抗MS4A6A抗体中的任一者的核苷酸序列的分离的核酸。此类核酸可以编码抗MS4A6A抗体的包含V
提供了制备本公开的抗MS4A6A抗体的方法。在一些实施方案中,所述方法包括在适用于抗体表达的条件下培养包含编码抗MS4A6A抗体的核酸的本公开的宿主细胞。在一些实施方案中,随后从宿主细胞(或宿主细胞培养基)回收抗体。
对于本公开的抗MS4A6A抗体的重组产生,将编码抗MS4A6A抗体的核酸分离并且插入一种或多种载体中,以在宿主细胞中进一步克隆和/或表达。这种核酸可以使用常规程序容易地分离和测序(例如,通过使用能够特异性结合至编码抗体的重链和轻链的基因的寡核苷酸探针)。
包含编码本公开的抗MS4A6A抗体中的任一者的核酸序列,或本文所述的细胞表面表达的片段或它们的多肽(包括抗体)的合适载体包括但不限于克隆载体和表达载体。合适的克隆载体可以根据标准技术来构建,或者可以选自本领域可用的大量克隆载体。虽然所选的克隆载体可以根据希望使用的宿主细胞而变化,但是有用的克隆载体通常具有自我复制能力,可以具有特定限制性核酸内切酶的单个靶标,和/或可以携带标志物的基因,所述标记物可以用于选择包含载体的克隆。合适的实例包括质粒和细菌病毒,例如pUC18、pUC19、Bluescript(例如,pBS SK+)及其衍生物、mpl8、mpl9、pBR322、pMB9、ColE1、pCR1、RP4、噬菌体DNA和穿梭载体(诸如pSA3和pAT28)。这些和很多其他克隆载体可以从商业供应商(诸如BioRad、Strategene和Invitrogen)获得。
用于克隆或表达抗体编码载体的合适的宿主细胞包括细胞原核或真核细胞。例如,本公开的抗MS4A6A抗体可以在细菌中产生,尤其是在不需要糖基化和Fc效应子功能时。关于抗体片段和多肽在细菌中的表达(例如,美国专利号5648237、5789199和5840523)。在表达后,抗体可以从细菌细胞浆以可溶性级分分离,并且可以进一步纯化。
除原核生物之外,真核微生物(诸如丝状真菌或酵母)也是抗体编码载体的合适的克隆或表达宿主,包括真菌和酵母菌株,这些菌株的糖基化通路已被“人源化”,从而产生具有部分或全部人类糖基化模式的抗体(例如,Gemgross Nat.Biotech.22:1409-1414(2004);和Li等人,Nat.Biotech.24:210-215(2006))。
用于表达糖基化抗体的合适的宿主细胞也可以来源于多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定出许多杆状病毒株,它们可以与昆虫细胞联合使用,尤其是用于草地贪夜蛾(Spodoptera frugiperda)细胞的转染。植物细胞培养物也可以用作宿主(例如,美国专利号5959177、6040498、6420548、7125978和6417429,它们描述了用于在转基因植物中产生抗体的PLANTIBODIES
脊椎动物细胞也可以用作宿主。例如,适用于在悬浮液中生长的哺乳动物细胞系可以是有用的。有用的哺乳动物宿主细胞系的其他实例是由SV40转化的猴肾CV1系(COS-7);人类胚肾细胞系(293或293细胞,如例如Graham等人J.Gen Virol.36:59(1977)所述);幼仓鼠肾细胞(BHK);小鼠塞尔托利氏细胞(TM4细胞,如例如Mather,Biol.Reprod.23:243-251(1980)所述);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人类宫颈癌细胞(HELA);犬肾细胞(MDCK);布法罗(buffalo)大鼠肝细胞(BRL 3A);人类肺细胞(W138);人类肝细胞(Hep G2);小鼠乳腺肿瘤(MMT 060562);TRI细胞,如例如Mather等人AnnalsN.Y.Acad.Sci.383:44-68(1982)所述;MRC 5细胞;以及FS4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub等人,Proc.Natl.Acad.Sci.USA 77:4216(1980));和骨髓瘤细胞系,诸如Y0、NS0和Sp2/0。关于适用于抗体产生的某些哺乳动物宿主细胞系的综述,参见例如,Yazaki和Wu,Methods inMolecular Biology,第248卷(B.K.C.Lo编,Humana Press,Totowa,NJ),第255-268页(2003)。
IV药物组合物/制剂
本文提供了包含本公开的抗MS4A6A抗体和药学上可接受的载剂的药物组合物和/或药物制剂。
在一些实施方案中,药学上可接受的载剂优选地在所采用的剂量和浓度下对接受者是无毒的。本文所述的抗体可以配制为固体、半固体、液体或气体形式的制备物。此类制剂的实例包括但不限于片剂、胶囊剂、粉末剂、颗粒剂、软膏剂、溶液剂、栓剂、注射剂、吸入剂、凝胶剂、微球剂和气雾剂。根据所需的制剂,药学上可接受的载剂可以包括稀释剂的药学上可接受的无毒载剂,所述载剂是通常用于配制针对动物或人类施用的药物组合物的媒介物。在某些实施方案中,药物组合物可包含用于改变、维持或保持例如组合物的pH、渗透压体积摩尔浓度、粘度、透明度、颜色、等渗性、气味、无菌性、稳定性、溶解或释放速率、吸附或渗透的制剂材料。
在某些实施方案中,药学上可接受的载剂包括但不限于氨基酸(诸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗微生物剂;抗氧化剂(诸如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(诸如硼酸盐、碳酸氢盐,Tris-HCl、柠檬酸盐、磷酸盐或其他有机酸);填充剂(诸如甘露糖醇或甘氨酸);螯合剂(诸如乙二胺四乙酸(EDTA))络合剂(诸如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精);填充剂;单糖;二糖;和其他碳水化合物(诸如葡萄糖、甘露糖或糊精);蛋白质(诸如血清白蛋白、明胶或免疫球蛋白);着色剂、矫味剂和稀释剂;乳化剂;亲水性聚合物(诸如聚乙烯吡咯烷酮);低分子量多肽;成盐抗衡离子(诸如钠);防腐剂(诸如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(诸如甘油、丙二醇或聚乙二醇);糖醇(诸如甘露糖醇或山梨糖醇);助悬剂;表面活性剂或湿润剂(诸如普朗尼克(pluronics)、PEG、脱水山梨糖醇酯、聚山梨醇酯(诸如聚山梨醇酯20、聚山梨醇酯80)、triton、三羟甲基氨基甲烷、卵磷脂、胆固醇、泰洛沙泊);稳定性增强剂(诸如蔗糖或山梨糖醇);张力增强剂(诸如碱金属卤化物,优选地氯化钠或氯化钾、甘露糖醇、山梨糖醇);递送媒介物;稀释剂;赋形剂和/或药物佐剂。适用于各种施用类型的制剂的另外的实例可见于Remington:The Scienceand Practice of Pharmacy,Pharmaceutical Press第22版(2013)。关于药物递送方法的简要综述,参见Langer,Science 249:1527-1533(1990)。
适用于肠胃外施用的制剂包括水性和非水性等渗无菌注射溶液,所述溶液可以包含抗氧化剂、缓冲剂、抑菌剂以及使该制剂与预期接受者的血液等渗的溶质;以及水性和非水性无菌混悬剂,所述混悬剂可以包含助悬剂、增溶剂、增稠剂、稳定剂和防腐剂。
可以优化制剂以便于在大脑或中枢神经系统中的保持和稳定。当将药剂施用于颅腔中时,使药剂保留在腔中,并且不扩散或者跨过血脑屏障是所期望的。稳定技术包括交联、多聚化或连接至诸如聚乙二醇、聚丙烯酰胺、中性蛋白质载体等的基团,以实现分子量的增加。
用于增加保留的其他策略包括在可生物降解或可生物蚀解的植入物中包埋抗体,诸如本公开的抗MS4A6A抗体。治疗活性剂的释放速率由通过聚合物基质的运输速率和植入物的生物降解来控制。植入物可以是颗粒、薄片、贴片、斑块、纤维、微胶囊等等,并且可以具有与所选的插入部位相容的任何大小或形状。可以使用的可生物降解的聚合物组合物可以是有机酯或醚,它们在降解时会产生生理学上可接受的降解产物(包括单体)。可以单独或与其他单体组合使用酸酐、酰胺、原酸酯等等。聚合物将是缩合聚合物。聚合物可以是交联的或非交联的。特别关注的是羟基脂族羧酸的聚合物、均聚物或共聚物以及多糖。在所关注的聚酯中,D-乳酸、L-乳酸、外消旋乳酸、乙醇酸、聚己内酯以及它们的组合的聚合物被包括在内。所关注的多糖是藻酸钙和功能化的纤维素,尤其是羧甲基纤维素酯,它的特征在于水不溶性,分子量为约5kD至500kD等。可生物降解的水凝胶也可以用于主题公开的植入物。水凝胶通常是共聚物材料,它的特征在于能够吸收液体。
V.治疗用途
如本文所公开,本公开的抗MS4A6A抗体可以用于预防疾病和病症,降低各种疾病和病症的风险,或者治疗疾病和病症。在一些实施方案中,本公开的抗MS4A6A抗体在预防阿尔茨海默氏病、迟发性阿尔茨海默氏病和认知缺损,降低阿尔茨海默氏病、迟发性阿尔茨海默氏病和认知缺损的风险或者治疗阿尔茨海默氏病、迟发性阿尔茨海默氏病和认知缺损方面有效。
作为疾病靶标的MS4A6A
全基因组关联研究已确定MS4A家族的各种成员与阿尔茨海默氏病相关。这些成员是MS4A2、MS4A3、MS4A4A、MS4A4E、MS4A6A和MS4A6E。某些与阿尔茨海默氏病风险相关的SNP定位于非编码区,包括rs610932、rs583791和rs667897;MS4A4E和MS4A6A之间的基因间区域(rs670139);以及定位于MS4A6A的编码区的rs7232。MS4A基因簇中的三个SNP与迟发性阿尔茨海默氏病的风险增加相关,这三个SNP包括MS4A4A中的rs4938933、MS4A4E中的rs670139和MS4A6A中的rs610932(Hollingworth等人,2011,Nat Genetics,43:429-435;Naj等人,2011,Nature Genetics,43:436-441;Antunez等人,2011,Genome Medicine,3,文章33;Ma等人,2015Mol Neurobiol 51:1240-1248)。另外,MS4A4A基因座SNP(rs2304933和rs2304935)与更高水平的MS4A4A和阿尔茨海默氏病风险增加(包括迟发性阿尔茨海默氏病(LOAD))相关(Allen等人,2012,Neurology,79:221-228)。SNP可以作为有价值的遗传生物标志物。例如,SNP可以与疾病风险或易感性相关,其中SNP的特定等位基因或多于一个特定等位基因与疾病风险或易感性增加相关(例如,易感性等位基因)。或者,SNP可以与疾病风险降低相关(例如,保护性等位基因)。
与阿尔茨海默氏病相关的三个SNP具有强连锁不平衡:rs583791(T)等位基因、rs7232(T)等位基因和rs610932(G)等位基因是相关的,并且是与阿尔茨海默氏病风险或易感性增加相关的主(最常见)等位基因;rs583791(C)等位基因、rs7232(A)等位基因和rs610932(T)等位基因是相关的,并且是与阿尔茨海默病风险减少相关的次(较不常见)等位基因。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开提供了一种预防具有与阿尔茨海默氏病风险或易感性相关的至少一个遗传等位基因的个体中的神经退行性疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗这些疾病、病症或病状的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在可以与前述实施方案中的任一者组合的一些实施方案中,与阿尔茨海默氏病风险或易感性增加相关的遗传等位基因是rs583791(C)等位基因。在可以与前述实施方案中的任一者组合的一些实施方案中,与阿尔茨海默氏病风险或易感性增加相关的遗传等位基因是rs7232(T)等位基因。在可以与前述实施方案中的任一者组合的一些实施方案中,与阿尔茨海默氏病风险或易感性增加相关的遗传等位基因是rs610932(G)等位基因。在可以与前述实施方案中的任一者组合的一些实施方案中,与阿尔茨海默氏病风险或易感性增加相关的遗传等位基因与MS4A6A的表达或活性减少或降低相关。在可以与前述实施方案中的任一者组合的一些实施方案中,与阿尔茨海默氏病风险或易感性增加相关的遗传等位基因与MS4A6A的细胞表面表达或活性减少或降低相关。在可以与前述实施方案中的任一者组合的一些实施方案中,与阿尔茨海默氏病风险或易感性增加相关的遗传等位基因与MS4A6A的功能丧失或功能降低相关。在可以与前述实施方案中的任一者组合的一些实施方案中,具有与神经退行性疾病、病症或病状相关的至少一个遗传等位基因的个体对于所述至少一个遗传等位基因是纯合的。在可以与前述实施方案中的任一者组合的一些实施方案中,具有与神经退行性疾病、病症或病状相关的至少一个遗传等位基因的个体对于所述至少一个遗传等位基因是杂合的。
在本公开的某些方面,本文提供的将抗MS4A6A抗体施用于有需要的个体的方法增加MS4A6A的表达或活性、增加或恢复MS4A6A的适当细胞表面表达或定位,或者校正与具有神经退行性风险等位基因(诸如rs583791(T)等位基因、rs7232(T)等位基因或rs610932(G)等位基因)的个体相关的生物化学或生理学缺陷。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开提供了一种用于增加有需要的个体中的MS4A6A表达或活性的方法,其中所述个体具有至少一个选自由以下各项组成的组的阿尔茨海默氏病风险或易感性等位基因:rs583791(T)、rs7232(T)或rs610932(G),所述方法包括将抗MS4A6A抗体施用于个体,从而增加MS4A6A表达或活性。在可以与前述实施方案中的任一者组合的一些实施方案中,本公开提供了一种用于增加或恢复有需要的个体中的MS4A6A的细胞表面表达或定位的方法,其中所述个体具有至少一个选自由以下各项组成的组的阿尔茨海默氏病风险或易感性等位基因:rs583791(T)、rs7232(T)和rs610932(G),所述方法包括将抗MS4A6A抗体施用于个体,从而增加或恢复MS4A6A的细胞表面表达或定位。
在一些实施方案中,本公开提供了一种选择用于用抗MS4A6A抗体治疗的个体的方法,所述方法包括:a)从个体获得样品(例如,血样);b)确定哪个与神经退行性疾病、病症或病状的风险增加相关的遗传等位基因存在于个体中;以及c)选择用于用抗MS4A6A抗体治疗的个体,其中所述个体具有一个或多个与神经退行性疾病、病症或病状的风险增加相关的遗传等位基因。在一些实施方案中,与神经退行性疾病、病症或病状的风险增加相关的遗传等位基因是rs583791(C)等位基因。在可以与前述实施方案中的任一者组合的一些实施方案中,与神经退行性疾病、病症或病状的风险增加相关的遗传等位基因是rs7232(T)等位基因。在可以与前述实施方案中的任一者组合的一些实施方案中,与神经退行性疾病、病症或病状的风险增加相关的遗传等位基因是rs610932(G)等位基因。可以使用本领域的技术人员已知的用于从个体获得样品(诸如血样)的任何合适的方法。此外,将理解的是,可以使用本领域的技术人员已知的用于例如通过SNP分析来确定个体具有哪个遗传风险或易感性等位基因的任何方法。
本文提供的方法可用于预防神经退行性疾病、病症或病状,降低神经退行性疾病、病症或病状的风险或者治疗患有神经退行性疾病、病症或病状的个体。在一些实施方案中,本公开提供了一种用于预防神经退行性病症、降低神经退行性病症的风险或者治疗患有神经退行性病症的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。
在一些实施方案中,本公开提供了一种用于预防阿尔茨海默氏病、降低阿尔茨海默氏病的风险或者治疗患有阿尔茨海默氏病的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。
在一些实施方案中,本公开提供了一种用于预防迟发性阿尔茨海默氏病、降低迟发性阿尔茨海默氏病的风险或者治疗患有迟发性阿尔茨海默氏病的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。
在一些实施方案中,本公开提供了一种用于预防轻度认知缺损、降低轻度认知缺损的风险或者治疗患有轻度认知缺损的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。
在一些实施方案中,本公开提供了一种用于预防与MS4A6A的表达或活性减少或降低相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在一些实施方案中,本公开提供了一种用于预防与MS4A6A的细胞表面表达或活性减少或降低相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于有需要的个体。在一些实施方案中,与MS4A6A的表达或活性减少或降低相关的疾病、病症或病状是神经退行性疾病、病症或病状,例如阿尔茨海默氏病。
在某些实施方案中,MS4A6A的功能丧失、MS4A6A的功能降低、MS4A6A的表达或活性减少或降低、或者MS4A6A的细胞表面表达减少或降低与患有或发展出神经退行性疾病、病症或病状(诸如阿尔茨海默氏病)的风险增加相关。
在一些实施方案中,本公开提供了一种用于预防与MS4A6A的活性减少或降低相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于MS4A6A的活性减少或降低的个体。在一些实施方案中,本公开提供了一种用于预防与MS4A6A的功能丧失相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于MS4A6A的活性减少或降低的个体。在一些实施方案中,本公开提供了一种用于预防与MS4A6A的表达减少或降低相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于MS4A6A的表达减少或降低的个体。在一些实施方案中,本公开提供了一种用于预防与MS4A6A的不当或不正确细胞定位相关的疾病、病症或病状,降低这些疾病、病症或病状的风险或者治疗患有这些疾病、病症或病状的个体的方法,所述方法包括将治疗有效量的抗MS4A6A抗体施用于具有MS4A6A的不当或不正确细胞定位的个体。在本公开的某些方面,将治疗有效量的抗MS4A6A施用于有需要的个体导致MS4A6AJ的表达增加,导致MS4A6A的活性增加,导致MS4A6A的适当或正确的细胞定位,导致MS4A6A的细胞表面表达增加,以及/或者导致个体中的MS4A6A的功能获得。
在一些方面,与MS4A6A的活性减少或降低相关、与MS4A6A的功能丧失相关、与MS4A6A的表达减少或降低相关、或者与MS4A6A的不当或不正确的细胞定位相关的疾病、病症或病状至少部分是与MS4A6A基因相关或关联的遗传缺陷或缺损的结果。
在一些方面,与MS4A6A的活性减少或降低相关、与MS4A6A的功能丧失相关、与MS4A6A的表达减少或降低相关、或者与MS4A6A的不当或不正确的细胞定位相关的疾病、病症或病状至少部分是正常老化的结果。
本公开的其他方面涉及一种预防疾病、病症或损伤,降低疾病、病症或损伤的风险或者治疗患有疾病、病症或损伤的个体的方法,所述疾病、病症或损伤选自由以下各项组成的组:额颞叶痴呆、阿尔茨海默氏病、轻度认知缺损、血管性痴呆、血管性痴呆、癫痫发作、视网膜营养不良、创伤性脑损伤、脊髓损伤、长期抑郁、动脉粥样硬化血管疾病、正常衰老的不良症状、痴呆、混合性痴呆、克罗伊茨费尔特-雅各布病、正常颅压脑积水、肌萎缩性侧索硬化、亨廷顿舞蹈症、τ蛋白病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、克罗恩病、炎性肠病、溃疡性结肠炎、疟疾、特发性震颤、中枢神经系统狼疮、贝赛特氏症、帕金森病、路易体痴呆、多系统萎缩、退行性椎间盘疾病、夏伊-德雷格综合征、进行性核上性麻痹、皮质基底神经节退化、急性播散性脑脊髓炎、肉芽肿病、结节病、衰老的疾病、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、炎性疾病、关节炎、多发性硬化、代谢紊乱、肥胖、胰岛素抵抗、2型糖尿病、组织或血管损伤、损伤、炎性细胞碎片或蛋白质聚集体、循环骨髓细胞异常、不健康的衰老、年龄相关的认知缺损、年龄相关的脑萎缩、年龄相关的性状(包括但不限于炎症)、神经元缺失和认知缺陷(诸如在不存在已知的脑疾病的情况下的认知缺陷,包括老年个体的额叶大脑皮质的认知缺陷以及正常衰老的一种或多种不良症状),所述方法包括将治疗有效量的前述实施方案中的任一者的抗MS4A6A抗体施用于个体。本公开的其他方面涉及一种用于预防疾病、病症或损伤,降低疾病、病症或损伤的风险或者治疗患有疾病、病症或损伤的个体的前述实施方案中的任一者的抗MS4A6A抗体,所述疾病、病症或损伤选自由以下各项组成的组:额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、癫痫发作、视网膜营养不良、创伤性脑损伤、脊髓损伤、长期抑郁、动脉粥样硬化血管疾病、正常衰老的不良症状、痴呆、混合性痴呆、克罗伊茨费尔特-雅各布病、正常颅压脑积水、肌萎缩性侧索硬化、亨廷顿舞蹈症、τ蛋白病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、克罗恩病、炎性肠病、溃疡性结肠炎、疟疾、特发性震颤、中枢神经系统狼疮、贝赛特氏症、帕金森病、路易体痴呆、多系统萎缩、退行性椎间盘疾病、夏伊-德雷格综合征、进行性核上性麻痹、皮质基底神经节退化、急性播散性脑脊髓炎、肉芽肿病、结节病、衰老的疾病、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、炎性疾病、关节炎、多发性硬化、代谢紊乱、肥胖、胰岛素抵抗、2型糖尿病、组织或血管损伤、损伤、炎性细胞碎片或蛋白质聚集体、循环骨髓细胞异常、不健康的衰老、年龄相关的认知缺损、年龄相关的脑萎缩、年龄相关的性状(包括但不限于炎症)、神经元缺失和认知缺陷(诸如在不存在已知的脑疾病的情况下的认知缺陷,包括老年个体的额叶大脑皮质的认知缺陷以及正常衰老的一种或多种不良症状)。本公开的其他方面涉及一种用于预防或减少转移的前述实施方案中的任一者的抗MS4A6A抗体。本公开的其他方面涉及一种用于预防癌症、降低癌症的风险或者治疗患有癌症的个体的前述实施方案中的任一者的抗MS4A6A抗体。
本公开的其他方面涉及前述实施方案中的任一者的抗MS4A6A抗体用于制造用于预防疾病、病症或损伤,降低疾病、病症或损伤的风险或者治疗患有疾病、病症或损伤的个体的药物的用途,所述疾病、病症或损伤选自由以下各项组成的组:额颞叶痴呆、阿尔茨海默氏病、迟发性阿尔茨海默氏病、血管性痴呆、癫痫发作、视网膜营养不良、创伤性脑损伤、脊髓损伤、长期抑郁、动脉粥样硬化血管疾病、正常衰老的不良症状、痴呆、混合性痴呆、克罗伊茨费尔特-雅各布病、正常颅压脑积水、肌萎缩性侧索硬化、亨廷顿舞蹈症、τ蛋白病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、克罗恩病、炎性肠病、溃疡性结肠炎、疟疾、特发性震颤、中枢神经系统狼疮、贝赛特氏症、帕金森病、路易体痴呆、多系统萎缩、退行性椎间盘疾病、夏伊-德雷格综合征、进行性核上性麻痹、皮质基底神经节退化、急性播散性脑脊髓炎、肉芽肿病、结节病、衰老的疾病、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、炎性疾病、关节炎、多发性硬化、代谢紊乱、肥胖、胰岛素抵抗、2型糖尿病、组织或血管损伤、损伤、炎性细胞碎片或蛋白质聚集体、循环骨髓细胞异常、不健康的衰老、年龄相关的认知缺损、年龄相关的脑萎缩、年龄相关的性状(包括但不限于炎症)、神经元缺失和认知缺陷(诸如在不存在已知的脑疾病的情况下的认知缺陷,包括老年个体的额叶大脑皮质的认知缺陷以及正常衰老的一种或多种不良症状)。本公开的其他方面涉及一种预防疾病、病症或损伤,降低疾病、病症或损伤的风险或者治疗患有疾病、病症或损伤的个体的方法,所述疾病、病症或损伤选自由以下各项组成的组:额颞叶痴呆、进行性核上性麻痹、阿尔茨海默氏病、迟发性阿尔茨海默氏病、轻度认知缺损、血管性痴呆、癫痫发作、视网膜营养不良、肌萎缩性侧索硬化、创伤性脑损伤、脊髓损伤、痴呆、中风、帕金森病、急性播散性脑脊髓炎、视网膜变性、年龄相关性黄斑变性、青光眼、多发性硬化、败血性休克、细菌感染、关节炎和骨关节炎,所述方法包括将治疗有效量的前述实施方案中的任一者的抗MS4A6A抗体施用于个体。本公开的其他方面涉及一种用于预防疾病、病症或损伤,降低疾病、病症或损伤的风险或者治疗患有疾病、病症或损伤的个体的前述实施方案中的任一者的抗MS4A6A抗体,所述疾病、病症或损伤选自由以下各项组成的组:额颞叶痴呆、进行性核上性麻痹、阿尔茨海默氏病、迟发性阿尔茨海默氏病、轻度认知缺损、血管性痴呆、癫痫发作、视网膜营养不良、肌萎缩性侧索硬化、创伤性脑损伤、脊髓损伤、痴呆、中风、帕金森病、急性播散性脑脊髓炎、视网膜变性、年龄相关性黄斑变性、青光眼、多发性硬化、败血性休克、细菌感染、关节炎和骨关节炎。本公开的其他方面涉及前述实施方案中的任一者的抗MS4A6A抗体用于制造用于预防疾病、病症或损伤,降低疾病、病症或损伤的风险或者治疗患有疾病、病症或损伤的个体的药物的用途,所述疾病、病症或损伤选自由以下各项组成的组:额颞叶痴呆、进行性核上性麻痹。阿尔茨海默氏病、血管性痴呆、癫痫发作、视网膜营养不良、肌萎缩性侧索硬化、创伤性脑损伤、脊髓损伤、痴呆、中风、帕金森病、急性播散性脑脊髓炎、视网膜变性、年龄相关性黄斑变性、青光眼、多发性硬化、败血性休克、细菌感染、关节炎和骨关节炎。
MS4A基因座中的若干基因与炎性反应相关,包括MS4A6A。(Karch和Goate,2015,Biol Psychiatry,77:43-51)。另外,MS4A家族基因的过表达增加T细胞的活化并且促进T细胞跨血脑屏障的运输。活化的T细胞与小胶质细胞相互作用,导致小胶质细胞活化,导致促炎性细胞因子释放,导致神经元损伤。MS4A4B的过表达减少T细胞凋亡,而MS4A4B的敲低则促进T细胞经历凋亡。(Ma等人,2015,Mol Neurobiol,51:1240-1248。)
自身炎性疾病是一组不同于自身免疫综合征的临床病状。自身炎性疾病的特征在于由于先天免疫系统失调、不存在自身反应性T淋巴细胞和自身抗体而引起的原因不明的炎症发作,因此不同于经典的自身免疫疾病。自身炎性疾病分为两组:单基因自身炎性疾病和多因素自身炎性疾病。在一些实施方案中,通过本公开的方法预防或治疗的自身炎性病症包括但不限于单基因自身炎性疾病(诸如家族性地中海热(FMF))、甲羟戊酸激酶缺乏相关的周期热(高免疫球蛋白D综合征)、TNF受体相关的周期性综合征(TRAPS)、冷炎素相关的周期性综合征(CAPS)、NLRP12相关的自身炎性病症(例如,NALP12相关的周期性热)、白介素-1受体拮抗剂缺陷(DIRA)、化脓性关节炎-坏疽性脓皮症和痤疮(PAPA)综合征、马吉德综合征、布劳综合征、高免疫球蛋白血症W伴周期性热综合征(HIDS)、家族性冷性自身炎性综合征(FCAS)、穆-韦综合征(MWS)和多系统炎性病症的新生儿发病(NOMID)。在一些实施方案中,通过本公开的方法预防或治疗的自身炎性病症包括但不限于多因素自身炎性疾病(诸如包括周期性热)、溃疡性口炎、咽炎和腺病综合征(PFAPA)、贝赛特氏症、系统性幼年特发性关节炎(sJIA)、斯蒂尔病、成人斯蒂尔病(AOSD)、克罗恩病、施尼茨勒综合征、斯威特综合征、慢性复发性多灶性骨髓炎(CRMO)、滑膜炎痤疮脓疱性骨质增生性骨炎综合征(SAPHO)和成人发作的斯蒂尔病。(参见Ciccarelli等人,2013,Curr Med Chem,21:261-269。)
虽然MS4A基因未充分特征,但是该聚类的若干成员(包括MS4A1、MS4A2和MS4A4B)已显示出在免疫中发挥重要作用(Zuccolo等人,2010,PLoS One;Zuccolo等人,2013,FrontImmmunol,4:195)。
自身免疫疾病来源于对正常人体组织的异常免疫应答。在一些实施方案中,通过本公开的方法预防或治疗的自身免疫疾病或病症包括但不限于阿狄森病、丙种球蛋白血症、斑秃、淀粉样变性、强直性脊柱炎、抗GBM/抗TBM肾炎、抗磷脂综合征、自身免疫血管性水肿、自身免疫性自主神经异常、自身免疫性脑脊髓炎、自身免疫性肝炎、自身免疫性内耳疾病(AIED)、自身免疫性心肌炎、自身免疫性胰腺炎、自身免疫性视网膜病、自身免疫性荨麻疹、轴突和神经元神经病(AMAN)、巴洛病、贝赛特氏症、良性粘膜天疱疮、大疱性类天疱疮、卡斯尔曼病(CD)、乳糜泻、恰加斯病、慢性炎性脱髓鞘性多发性神经病(CIDP)、慢性复发性多灶性骨髓炎(CRMO)、楚格-史特劳斯、瘢痕性天疱疮、寇甘综合征、冷凝集素病、先天性心脏传导阻滞、柯萨奇心肌炎、CREST综合征、克罗恩病、疱疹样皮炎、皮肌炎、迪维克氏病(视神经脊髓炎)、盘状狼疮、德莱西综合征、子宫内膜异位症、嗜酸性食管炎(EoE)、嗜酸性筋膜炎、结节性红斑、原发性混合性冷球蛋白血症、埃文斯综合征、纤维肌痛、纤维化性肺泡炎、巨细胞性动脉炎(颞动脉炎)、巨细胞心肌炎、肾小球肾炎、古巴斯捷综合征、韦格纳肉芽肿、格雷夫斯病、格林巴利综合征、桥本甲状腺炎、溶血性贫血、过敏性紫癜(HSP)、妊娠疱疹或天疱疮(PG)、低血球蛋白血症、IgA肾病、IgG4相关性硬化症、免疫性血小板减少性紫癜(ITP)、包涵体肌炎(IBM)、间质性膀胱炎(IC)、青少年关节炎、青少年糖尿病(1型糖尿病)、青少年肌炎(JM)、川崎病、兰伯特-伊顿综合征、白细胞碎裂性血管炎、扁平苔藓、地衣硬化、木质部结膜炎、线性IgA病(LAD)、狼疮、慢性莱姆病、梅尼埃病、显微多发性血管炎(MPA)、混合性结缔组织病(MCTD)、摩尔人的溃疡、Mucha-Habermann病、多发性硬化症、重症肌无力、肌炎、发作性睡病、视神经脊髓炎、中性粒细胞减少症、眼瘢痕性天疱疮、视神经炎、回文风湿病(PR)、潘达斯、副肿瘤性小脑变性(PCD)、阵发性夜间血红蛋白尿(PNH)、帕罗综合征、扁平部睫状体炎(周围葡萄膜炎)、帕森纳格-特纳综合征、天疱疮、周围神经病、静脉性脑脊髓炎、恶性贫血(PA)、POEMS综合征、结节性多发性动脉炎、I、II和III型多腺综合征、风湿性多肌痛、多发性肌炎、心肌梗塞后综合征、心包切开术后综合征、原发性胆汁性肝硬化、原发性硬化性胆管炎、黄体酮皮炎、银屑病、银屑病关节炎、纯红细胞发育不良(PRCA)、坏疽性脓皮病、雷诺现象、反应性关节炎、反射性交感神经营养不良、复发性多发性软骨炎、不安腿综合征(RLS)、腹膜后纤维化、风湿热、类风湿关节炎、结节病、施密特综合征、巩膜炎、硬皮病、干燥综合征、精子和睾丸自身免疫性、僵硬人综合征(SPS)、亚急性细菌性心内膜炎(SBE)、苏萨克氏综合征、交感性眼炎(SO)、高安的动脉炎、颞动脉炎/巨细胞性动脉炎、血小板减少性紫癜(TTP)、托洛萨-亨特综合征(THS)、横贯性脊髓炎、1型糖尿病、溃疡性结肠炎(UC)、未分化的结缔组织病(UCTD)、葡萄膜炎、血管炎、白癜风和韦格纳肉芽肿(或肉芽肿合并多血管炎(GPA))。
在一些实施方案中,受试者或个体是哺乳动物。哺乳动物包括但不限于家畜(例如,奶牛、绵羊、猫、狗和马)、灵长类动物(例如,人类和非人类灵长类动物(诸如猴))、兔和啮齿动物(例如,小鼠和大鼠)。在一些实施方案中,受试者或个体是人类。
本文提供的抗体(和任何其他治疗剂)可以通过任何合适的手段施用,包括肠胃外、肺内、鼻内、病灶内施用、脑脊柱内、颅内、脊柱内、滑膜内、鞘内、口服、局部或吸入途径。肠胃外输注包括肌肉内、以大丸剂静脉内施用或连续输注一段时间、动脉内、关节内、腹膜内或皮下施用。在一些实施方案中,施用是静脉内施用。在一些实施方案中,施用是皮下施用。给药可以通过任何合适的途径,例如通过注射,诸如静脉内或皮下注射进行,这部分地取决于施用是短暂的还是长期的。本文设想了各种给药时间表,包括但不限于单次施用或在各个时间点的多次施用、推注施用和脉冲输注。
本文提供的抗体将以与良好医学实践一致的方式配制、给药和施用。在此背景下考虑的因素包括所治疗的具体病症、所治疗的具体哺乳动物、个体患者的临床状况、病症的致因、药剂的递送部位、施用方法、施用时间表以及从业医生已知的其他因素。抗体无需但任选地与当前用于预防或治疗所讨论的病症的一种或多种药剂一起配制。此类其他药剂的有效量取决于制剂中存在的抗体的量、病症或治疗的类型以及上文讨论的其他因素。这些药剂通常以如本文所述的相同剂量以及通过如本文所述的施用途径,或以本文所述的剂量的约1%至99%、或以凭经验/临床上确定为适当的任何剂量以及通过凭经验/临床上确定为适当的任何途径使用。
对于疾病的预防或治疗,本公开的抗体的适当剂量(当单独使用或与一种或多种其他治疗剂组合使用时)将取决于待治疗的疾病的类型、抗体的类型、疾病的严重度和病程、是否出于预防性或治疗性目的而施用抗体、既往疗法、患者的病史和对抗体的反应以及主治医生的判断。抗体一次或通过一系列治疗合适地施用于患者。
根据疾病的类型和严重度,约1μg/kg至15mg/kg(例如,0.1mg/kg-10mg/kg)的抗体可以作为施用于患者的初始候选剂量,无论是例如通过一次或多次单独施用,还是通过连续输注。根据上文提及的因素,一种典型的每日剂量可以在约1μg/kg至100mg/kg或更多的范围内。对于几天或更长时间的重复施用,根据病状,治疗应通常持续直至出现对疾病症状的所需抑制为止。抗体的一个示例性剂量将在约0.05mg/kg至约10mg/kg的范围内。因此,可以将约0.5mg/kg、2.0mg/kg、4.0mg/kg或10mg/kg的一个或多个剂量(或它们的任何组合)施用于患者。这些剂量可以间歇地,例如每周或每三周施用(例如,使得患者接受约两剂至约二十剂,或例如约六剂抗体)。在某些实施方案中,给药频率是每日三次、每日两次、每日一次、隔日一次、每周一次、每两周一次、每四周一次、每五周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次或每月一次、每两月一次、每三月一次或更长时间。可以施用初始的较高负荷剂量,然后施用一个或多个较低剂量。然而,其他剂量方案也可以是可用的。通过常规技术和测定法可以容易地监测该疗法的进程。
VI.诊断用途
在抗体中的任一者的一些实施方案中,本文提供的抗MS4A6A抗体中的任一者可用于检测样品或个体中的MS4A6A的存在。如本文所用,术语“检测”涵盖定量或定性检测。本文提供了将本公开的抗体用于诊断目的(诸如个体或来源于个体的组织样品中的MS4A6A的检测)的方法。在一些实施方案中,个体是人类。
检测方法可以涉及抗原结合抗体的定量。生物学样品中的抗体检测可以通过本领域已知的任何方法进行,包括免疫荧光显微镜检查、免疫细胞化学、免疫组织化学、ELISA、FACS分析、免疫沉淀或微正电子发射断层扫描。在某些实施方案中,例如用
VII.制品
本文提供了包含本文所述的抗MS4A6A抗体的制品(例如,试剂盒)。制品可以包括一个或多个包含本文所述的抗体的容器。容器可以具有任何合适的包装,包括但不限于小瓶、瓶、广口瓶、软包装(例如,密封Mylar或塑料袋)等等。容器可以是单位剂量,散装包装(例如,多剂量包装)或亚单位剂量。
在一些实施方案中,试剂盒可以另外包括第二试剂。在一些实施方案中,第二试剂是药学上可接受的缓冲剂或稀释剂,包括但不限于诸如注射用抑菌水(BWFI)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。在一些实施方案中,第二试剂是药物活性剂。
在制品中的任一者的一些实施方案中,制品还包括根据本公开的方法的使用说明。说明通常包括关于预期治疗的剂量、给药时间表和给药途径的信息。在一些实施方案中,这些说明包括施用本公开的分离的抗体(例如,本文所述的抗MS4A6A抗体)以预防选自由以下各项组成的组的疾病、病症或损伤、降低这些疾病、病症或损伤的风险或者治疗患有这些疾病、病症或损伤的个体的描述:额颞叶痴呆、阿尔茨海默氏病、迟发性阿尔茨海默氏病、认知下降或损伤、轻度认知缺损、血管性痴呆、血管性痴呆、癫痫发作、视网膜营养不良、创伤性脑损伤、脊髓损伤、长期抑郁、动脉粥样硬化血管疾病、正常衰老的不良症状、痴呆、混合性痴呆、克罗伊茨费尔特-雅各布病、正常颅压脑积水、肌萎缩性侧索硬化、亨廷顿舞蹈症、τ蛋白病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、克罗恩病、炎性肠病、溃疡性结肠炎、疟疾、特发性震颤、中枢神经系统狼疮、贝赛特氏症、帕金森病、路易体痴呆、多系统萎缩、退行性椎间盘疾病、夏伊-德雷格综合征、进行性核上性麻痹、皮质基底神经节退化、急性播散性脑脊髓炎、肉芽肿病、结节病、衰老的疾病、年龄相关性黄斑变性、青光眼、色素性视网膜炎、视网膜变性、呼吸道感染、败血症、眼部感染、全身感染、炎性疾病、关节炎、多发性硬化、代谢紊乱、肥胖、胰岛素抵抗、2型糖尿病、组织或血管损伤、损伤、炎性细胞碎片或蛋白质聚集体、循环骨髓细胞异常、不健康的衰老、年龄相关的认知缺损、年龄相关的脑萎缩、年龄相关的性状(包括但不限于炎症)、神经元缺失和认知缺陷(诸如在不存在已知的脑疾病的情况下的认知缺陷,包括老年个体的额叶大脑皮质的认知缺陷以及正常衰老的一种或多种不良症状),所述描述包括将治疗有效量的前述实施方案中的任一者的抗MS4A6A抗体施用于个体。
在一些实施方案中,说明包括抗MS4A6A抗体和第二试剂(例如,第二药物活性剂)的使用说明。
参考以下实施例将更充分地理解本公开。然而,它们不应被解释为限制本公开的范围。整个本公开的所有引用据此明确地以引用的方式并入。
实施例
实施例1:用于DNA免疫的MS4A6A表达质粒的构建
DNA免疫方法被用于开发针对MS4A6A的抗体。将编码人类和食蟹猴(cyno)MS4A6A的cDNA序列(分别为SEQ ID NO:1和3)克隆至pCAGGS表达载体(KeraFAST EH1017)中以进行DNA免疫。MS4A6A蛋白的表达通过以下步骤来确认:将表达构建体瞬时转染至HEK293T细胞中,然后使用可商购获得的抗MS4A6A抗体(来自Abcam,Cat#156278和Cat#189983的兔多克隆抗体)进行蛋白质印迹。为此,将已转染24小时的细胞在裂解缓冲液(RIPA裂解缓冲液(ThermoFischerScientific Cat#89900)+1:100HALT蛋白酶抑制剂混合物(ThermoFischerScientific Cat#87786))中裂解,并且通过以14,000×g离心15分钟来清除不溶性碎片。用双辛可宁酸(BCA)试剂来测定可溶性级分,以进行蛋白质定量。将来自每个样品的等量蛋白质上样至4-12%Bis-Tris Plus聚丙烯酰胺凝胶(ThermoFisherScientific NW04120)上,并进行电泳分离,然后使用iBlot2(ThermoFisher ScientificIM21001)和转移层(ThermoFisher Scientific IB24002)将凝胶中的蛋白质转移至聚偏二氟乙烯(PVDF)膜上。用1%牛血清白蛋白或5%脱脂乳封闭膜,以防止非特异性结合。然后将膜与多克隆抗MS4A6A抗体(Abcam,Cat#156278和Cat#189983)一起温育,洗涤,然后与HRP缀合的二抗(兔,Abcam#205718;小鼠,Abcam#205719)一起温育。通过用SuperSignal WestPico Plus化学发光底物(ThermoFisher Scientific Cat#34577)对膜进行显影来可视化结合,并用iBright FL1000(ThermoFisher A32752)或其他兼容系统进行数字化记录。
如图1所示,如通过多克隆抗MS4A6A抗体所探测,用人类MS4A6A或食蟹猴MS4A6A的表达构建体转染的细胞在大约27kDa处显示出反应条带(上:Abcam#156278,下:Abcam#189983)。未转染的HEK293细胞或用无关的MS4A4A表达构建体转染的HEK293细胞显示出非常低的MS4A6A反应性水平,这可能是由某些内源性表达所致。
实施例2:抗MS4A6A杂交瘤抗体的产生
为了获得针对MS4A6A的抗体,使用以下程序来产生杂交瘤。每周用在乳酸林格氏溶液中稀释的50μg编码全长人类或食蟹猴MS4A6A的质粒DNA中的每者对Balb/c或SJL小鼠(Jackson Laboratory,Bar Harbor,ME)进行共免疫一次,所述质粒DNA含有或不含有mFlt3配体(DNA)和mGM-CSF(DNA)(Invitrogen,San Diego,CA)。每只小鼠进行总共8次MS4A6A表达质粒注射以进行DNA免疫。在最终DNA免疫后三天,从小鼠收获脾脏。使用过表达人类和/或食蟹猴MS4A6A的HEK293细胞通过FACS分析来分析来自小鼠的血清与MS4A6A的反应性。将血清通过FACS显示出与过表达人类和/或食蟹猴MS4A6A的HEK293细胞的强结合的小鼠的脾细胞与P3X63Ag8.653小鼠骨髓瘤细胞(CRL-1580,美国典型培养物保藏中心(AmericanType Culture Collection,Rockville,MD)经由电融合(ECM2001,BTX,Holliston,MA)来融合,并且在37℃、5%CO
第二天,将融合的细胞离心并且重悬于10ml具有抗小鼠IgG Fc-FITC的ClonaCell-HY培养基C(Jackson Immunoresearch,West Grove,PA)中,然后与90ml含有HAT组分的基于甲基纤维素的ClonaCell-HY培养基D(Stemcell Technologies)轻轻混合。将细胞涂铺至Nunc OmniTrays(Thermo Fisher Scientific,Rochester,NY)中,并且使细胞在37℃,5%CO
实施例3:用MS4A6A基因变体进行的HEK293细胞的转染
将HEK293细胞(ATCC CRL-1573)在达尔伯克改良伊格尔培养基(DMEM,Sigma)+10%FBS(Gibco)中培养直到>80%汇合。然后,在转染前24小时,将细胞用非酶细胞解离缓冲液(CellStripper,Corning)解离,并且以40-50%汇合涂铺在T150烧瓶(ThermoFischerScientific Cat#08-772-48)中。根据制造商的方案,用Lipofectamine3000(ThermoFischerScientific)进行转染。在转染后24小时收获细胞,以提前显示HEK293细胞中MS4A6A过表达的任何毒性作用。收获的细胞可以立即用于FACS分析,或冷冻在10%DMSO中以便后续使用。
产生了表达人类或食蟹猴MS4A6A的瞬时转染的HEK293细胞。如下通过蛋白质印迹确认细胞中的MS4A6A蛋白表达。将已转染24小时的HEK293细胞在裂解缓冲液(RIPA裂解缓冲液(ThermoFischerScientific Cat#89900)+1:100HALT蛋白酶抑制剂混合物(ThermoFischerScientific Cat#87786))中裂解,并且通过以14,000×g离心15分钟来清除不溶性碎片。用双辛可宁酸(BCA)试剂来测定可溶性级分,以进行蛋白质定量。将来自每个样品的等量蛋白质上样至4-12%Bis-Tris Plus聚丙烯酰胺凝胶(ThermoFisherScientific NW04120)上,并进行电泳分离,然后使用iBlot2(ThermoFisher ScientificIM21001)和转移层(ThermoFisher Scientific IB24002)将凝胶中的蛋白质转移至聚偏二氟乙烯(PVDF)膜上。用1%牛血清白蛋白或5%脱脂乳封闭膜,以防止非特异性结合。然后将膜与多克隆抗体(Abcam,Cat#156278和189983)一起温育,洗涤,然后与HRP缀合的二抗(兔,Abcam#205718;小鼠,Abcam#205719)一起温育。通过用SuperSignal West Pico Plus化学发光底物(ThermoFisher Scientific#34577)进行显影来可视化结合,并用iBrightFL1000(ThermoFisher Scientific#A32752)或其他兼容系统进行数字化记录。
由于不存在可用于流式细胞术的针对MS4A6A的可商购获得的试剂,因此将免疫小鼠的血清用于检测细胞上MS4A6A的表面表达。用活/死可固定Aqua死细胞染色试剂盒(ThermoFisher Scientific L34957)在冰上来标记瞬时转染的细胞30分钟。在用PBS洗涤后,将2×10
结果显示,用食蟹猴MS4A6A瞬时转染的细胞对于MS4A6A的细胞表面表达是阳性的。虽然使用蛋白质印迹分析在这些细胞中检测到MS4A6A蛋白,但是使用该方法用人类MS4A6A瞬时转染的细胞并未显示出MS4A6A的细胞表面表达(参见图1)。图2A和2C分别显示出两个独立的杂交瘤上清液的与人类MS4A6A转染的HEK293细胞的结合(透明迹线)和与未转染的HEK293细胞的结合(阴影迹线)的结果。图2B和2D分别显示出两个独立的杂交瘤上清液的与食蟹猴MS4A6A转染的HEK293细胞的结合(透明迹线)和与未转染的HEK293细胞的结合(阴影迹线)的结果。如图2B和2D所示,用食蟹猴MS4A6A转染的细胞显示出强烈的抗MS4A6A抗体结合。
由于食蟹猴MS4A6A氨基酸序列与人类MS4A6A氨基酸序列大约89%相同,因此可以预期大多数克隆具有人类和食蟹猴MS4A6A之间的交叉反应。下文所述的肽结合研究证实了这一点。因此,使用食蟹猴MS4A6A转染的细胞进行杂交瘤上清液的后续筛选。
实施例4:用MS4A6A表达质粒对其他细胞系进行的转染
考虑到产生表达人类MS4A6A或食蟹猴MS4A6A的稳定转染的HEK293细胞系的困难,测试了其他DNA载体和细胞系以确定它们是否与MS4A6A表达更相容。对于稳定转染,将MS4A6A编码序列引入表达载体pD2533-G418或pD3539-puro(Atum,Newark,CA,USA)中。
MS4A6A在体内骨髓细胞中天然表达。因此,为了克服使用上文所述的细胞观察到的毒性问题,将若干骨髓源性细胞系用于重组MS4A6A的瞬时表达。细胞系组包括THP-1细胞(ATCC TIB202)、U937细胞(ATCC CRL-1593.2)、K562细胞(ATCC CCL243)、HL60细胞(ATCCCCL240)和Kasumi-1细胞(ATCC CRL-2724)。还测试了小鼠前B细胞系300.19细胞(TuftsUniversity T000710),因为它们通常用于重组蛋白表达目的。筛选这些细胞系中的每者的抗生素易感性,以确定针对选择和转染效率的G418或嘌呤霉素的合适剂量。在MS4A6A表达质粒转染和抗生素选择后,发现来自U937细胞、K562细胞和300.19细胞的转染子是活的。在通过有限稀释进行克隆后,如上文所述,产生单个克隆并且通过蛋白质印迹来筛选人类MS4A6A蛋白表达。
另外,产生食蟹猴MS4A6A表达构建体并且将所述表达构建体转染至上文所述的细胞系中。由于可以通过流式细胞术来检测细胞表面上的食蟹猴MS4A6A蛋白,因此该方法被用于确认稳定的U937细胞和K562细胞转染子中的MS4A6A的表面表达。结果如图3A(U937细胞)和图3B(K562细胞)所示。图3A显示出食蟹猴MS4A6A转染的U937细胞的结合(右边迹线)与未转染的U937细胞的结合(左边迹线)的比较。图3B显示出食蟹猴MS4A6A转染的K562细胞的结合(右边迹线)与未转染的K562细胞的结合(左边迹线)的比较。这些结果显示,抗MS4A6A杂交瘤上清液能够结合转染细胞中的细胞表面表达的食蟹猴MS4A6A。
实施例5:抗MS4A6A杂交瘤的初步筛选
抗MS4A6A杂交瘤的初步筛选如下进行。通过与转染细胞进行亲本(未转染)HEK293细胞的结合程度比较,初步筛选从960个杂交瘤获得的组织培养上清液的差异结合食蟹猴MS4A6A转染的HEK293细胞的能力。根据制造商的方案(如上文所述进行修订),经由使用lipofectamine系统进行的HEK293细胞的瞬时转染来产生表达MS4A6A的细胞。为了确保整个筛选实验的再现性,在单轮瞬时转染中制备大转染细胞库(约1×10
为了筛选杂交瘤细胞培养上清液,将食蟹猴MS4A6A转染的HEK293细胞在96孔U型底平板中等分(每孔2×10
扩增阳性克隆,然后针对过表达食蟹猴MS4A6A的HEK293细胞和亲本HEK293细胞进行特异性再筛选。简而言之,用活/死可固定Aqua死细胞染色试剂盒(ThermoFisherScientific L34957)来在冰上标记此前制备的冷冻保存的瞬时转染的细胞30分钟。在用PBS洗涤后,将2×10
表2
实施例6:抗MS4A6A抗体ELISA筛选
使用酶联免疫吸附测定法(ELISA)来测试抗MS4A6A杂交瘤上清液与来源于ECL1(SEQ ID NO:1的人类MS4A6A的氨基酸残基68-85)和ECL2(SEQ ID NO:1的人类MS4A6A的氨基酸残基138-185)序列的MS4A6A肽的结合。简而言之,在4℃下用1-10μg/mL合成的游离或BSA缀合的肽(溶于涂覆缓冲液(0.05M碳酸盐缓冲液,pH9.6,Millipore Sigma C3041)中)涂覆96孔聚苯乙烯平板过夜。然后用ELISA稀释液(PBS+0.5%BSA+0.05%Tween20)封闭涂覆的平板1小时,在3×300μL PBST(PBS+0.05%Tween20,Thermo 28352)中洗涤,然后在ELISA稀释液中以各种稀释度(100-1000×)添加抗体。在30分钟温育(室温,振荡)后,用3×300μL的PBST洗涤平板。将抗小鼠HRP二抗(Jackson Immunoresearch Cat#115-035-003)以1:1000的稀释度添加至ELISA稀释剂(50μl/孔)中,并且在室温下振荡温育30分钟。在最后一组洗涤(3×300μL的PBST)后,添加50μL TMB底物(BioFx TMBW-1000-01),然后在5-10分钟后用50μL的终止溶液(BioFx BSTP-1000-01)来猝灭反应。使用GEN5 2.04软件,用BioTekSynergy微孔读板仪检测猝灭反应孔在650nm下的吸光度。
在鉴定的23个抗MS4A6A阳性杂交瘤克隆中,与无关对照肽BSA-小鼠DAP12相比,来自17个杂交瘤克隆的上清液显示出对BSA-MS4A6A-ELC2肽的强结合。虽然这些克隆最初是根据它们与细胞表面表达的食蟹猴MS4A6A蛋白结合的能力来选择的,但是很多克隆仍显示出与人类M4A6A ECL2肽的结合,这表明这些克隆在这两个紧密相关的MS4A6A序列之间具有一定的交叉反应性。未显示出结合的杂交瘤克隆可能是由多种因素造成的,例如,这些抗体可以结合至未通过该方法建模的构象表位,这些抗体可以识别由ECL1和ECL2二者构成的表位,或者这些抗体可能无法与人类MS4A6A蛋白发生交叉反应。
在另一个方面,对于筛选的杂交瘤克隆中的任一者,均未检测到与ECL1的结合。这可能是由于ECL1的大小较小,它的长度为18个氨基酸残基,而ECL2的长度则为48个氨基酸残基。如果MS4A6A形成类似于CD81的桶状结构,即类似地跨过细胞膜四次的分子,则较大的ECL2结构域可以占据可用于抗体结合的暴露的表面。本文鉴定的某些抗体识别定位于ECL1和ECL2中的氨基酸残基组合形成的表位是可能的,因此无法通过该方法检测。值得注意的是,人类MS4A6A和食蟹猴MS4A6A的ECL1的氨基酸是相同的。
ELISA结合实验的结果显示于下表3中。
表3
实施例7:抗MS4A6A杂交瘤抗体的分子克隆
从上文所述的杂交瘤获得的抗MS4A6A抗体如下进行克隆。将5×10
实施例8:重组抗MS4A6A抗体的产生
在低IgG或化学成分确定的培养基中培养杂交瘤后,使用来自杂交瘤上清液的蛋白A纯化杂交瘤来源的抗MS4A6A抗体。还经由从杂交瘤获得的可变基因区至重组表达质粒的直接克隆来产生一些抗MS4A6A抗体,从而产生含有人类Fc结构域的嵌合抗体(人类IgG1)。将表达质粒瞬时转染至Expi293细胞中,并且经由蛋白A纯化所得的抗MS4A6A抗体。
抗MS4A6A抗体的重组产生如下所述进行。表达质粒(含有编码抗MS4A6A抗体VH链和VL链的核酸)被用于在Expi293细胞中进行重组抗体表达。根据制造商的方案,使用Expifectamine-293系统(ThermoFischerScientific Cat#A14524)进行表达质粒的转染。简而言之,对于每种抗MS4A6A抗体,将12μg轻链质粒DNA和18μg重链质粒DNA稀释至1.5mLOptiMEM(ThermoFischerScientific Cat#31985070)中,并向其中添加80μLExpifectamine试剂。将所得溶液混合并且在室温下温育30分钟,然后添加至在125mL烧瓶(Fischer Scientific FIS#PBV12-5)中的Expi293表达培养基(ThermoFischerScientificCat#A1435101)中的30mL Expi293细胞(ThemoFischerScientific A14527)中。在转染之前,将细胞培养至大约3×10^
实施例9:抗体重链和轻链可变结构域序列
对于23个鉴定的抗体中的22个,使用标准技术,测定编码所产生的抗体的轻链可变区和重链可变区的氨基酸序列。抗体的Kabat轻链CDR序列和重链CDR序列如下表4A所示。抗体的轻链可变区和重链可变区序列如下表4B所示。
表4A:抗体CDR序列
表4B:V
实施例10:抗MS4A6A抗体的动力学表征
纯化的抗体与MS4A6A ECL1和ECL2肽的结合动力学特征如下由Carterra(SouthSan Francisco,CA)使用专有的阵列表面等离子共振(SPR)仪器(MX-96)进行。使用连续流动微量点样器(CFM)将抗体印刷在CMD500D芯片(Xantec#SPMX CMD500D lot#SCCMD500D0117.a Exp.31.12.18)上。首先,用100mM MES pH 5.5、100μL EDC(最终133mM)、100μL S-NHS(最终33.3mM)来活化芯片7分钟。注射抗小鼠IgG-Fc(JacksonImmunoResearch cat#115-005-071lot#130410)的菌苔15分钟,以建立10000-12000RU的表面密度,然后用1M乙醇胺在pH 8.5下使芯片表面失活10分钟。然后,将所讨论的抗MS4A6A抗体以用HBS-EP+缓冲液(Teknova Cat#H8022)2:1稀释的杂交瘤上清液的形式印刷,一式两份,分别从相同的样品溶液进行20分钟和5分钟印刷。将对照抗体稀释至20μg/ml以进行印刷。
为了进行动力学分析,所讨论的肽在具有1mg/ml BSA的HBS-EP+缓冲液中制备,最终测定浓度为2000nM、400nM、80nM、16nmM和3.2nM。然后将这些肽注射至芯片上五分钟,然后以8uL/s在非再生动力学系列中进行七分钟的解离。对每种抗MS4A6A抗体进行重复测量以确保再现性。
对于所测试的23种抗MS4A6A抗体中的每种,计算MS4A6A ECL-2肽的K
表5
23种抗MS4A6A抗体中的15种结合至MS4A6A ECL2肽,并产生小于10e-07的总KD值。这在很大程度上对应于上述实施例7中的ELISA数据,不同之处在于,两种抗MS4A6A抗体(6A-6和6A-11)如通过ELISA所测定为结合阳性,但是不显示出由Carterra测定的结合。在这两种抗体中,虽然过量信号较弱并且因此未确定KD值,但是6A-6在SPR迹线上显示出结合。所测试的抗体均未结合至无关的对照肽。使用同种型对照抗体、无关的杂交瘤克隆、抗HIS对照抗体和单独培养基对照确认了测定法的特异性。这些对照试剂均未显示出任何与细胞的结合。
与ECL1肽结合的缺乏在两种所用的方法中均一致。这可能是由于ECL1的大小较小,它的长度为18个氨基酸,相较之下,ECL2为48个氨基酸。如果MS4A6A形成类似于CD81的桶状结构,即类似地跨过细胞膜四次的分子,则预期大得多的ECL2可以占据可用于抗体结合的暴露的表面。此处鉴定的某些抗MS4A6A抗体识别由ECL1和ECL2氨基酸残基的组合形成的表位是可能的,并因此无法通过使用方法进行检测。值得注意的是,人类和食蟹猴MS4A6AECL1具有相同的氨基酸序列;因此,交叉反应性的缺乏无关紧要。
实施例11:MS4A6A抗体对瞬时和天然表达的细胞系的亲和力的测量
评价纯化的抗MS4A6A抗体与各种表达MS4A6A的细胞系的结合亲和力,所述细胞系包括用人类或食蟹猴MS4A6A表达质粒瞬时转染的HEK293,以及HeLa细胞和A549细胞。所测试的抗体是从杂交瘤上清液纯化的小鼠IgG或在Expi293细胞中重组产生的人类IgG1 Fc嵌合体。与细胞的亲和力结合如下进行测定。简而言之,收获细胞,洗涤并且用Aqua活/死进行标记以进行活力鉴别。在用PBS洗涤后,将2×10^
实施例12:通过肽结合进行的抗MS4A6A抗体的表位测定
抗MS4A6A抗体的另外的结合表征如下进行。具体而言,抗MS4A6A抗体的表位作图由Carterra使用预混合表位框并方法进行。抗MS4A6A抗体的表位结合特征通过两种互补方法来确定。首先,由JPT肽(Berlin,Germany)或Elim Biopharm(Hayward,CA,USA)合成一组来源于胞外环的重叠肽。然后将这些转移至Carterra(South San Francisco,CA,USA),如下所述,Carterra通过使用类似于上文所述的方案,使用专有的阵列表面等离子共振(SPR)仪器(MX-96)来确定结合特征。
使用连续流动微量点样器(CFM)将肽文库印刷至CMD500D芯片上。首先,用100mMMES pH 5.5、100μL EDC(最终浓度133mM)、100μL S-NHS(最终33.3mM)来活化芯片。将肽文库固定在芯片上,然后用1M乙醇胺在pH 8.5下使芯片表面失活10分钟。在含有1mg/ml BSA的HBS-EP+缓冲液中以各种最终测定浓度制备将要测试的抗MS4A6A抗体。然后将这些肽注射至芯片上五分钟,然后以8μL/s在非再生动力学系列中进行七分钟的解离。对每种抗MS4A6A抗体进行重复测量以确保再现性。确定每个肽-抗体组合的结合特征,从而允许对每种抗体相互作用的线性肽区域进行作图。
一些抗MS4A6A抗体结合至非连续表位。Pepscan(Lelstad,The Netherlands)已经开发出称为化学连接肽至支架上(CLIPS)的技术来解析此类表位。在这项技术中,三级结构模拟物文库被设计和合成到固体支持物上。这些模拟物可以模拟蛋白质中的二级结构元件,诸如环、α螺旋和β链。确定和定量抗体与每个肽构建体的结合。与文库的结合程度表示给定抗体相互作用的区域,从而表示其表位。
实施例13:通过细胞结合进行的抗MS4A6A抗体的表位框并
由于MS4A6A是一种多次跨膜蛋白,因此重组产生的可溶性蛋白质可能不是研究Ab:蛋白质相互作用的适当的试剂。使用经典夹心方法的基于细胞的变化形式对抗MS4A6A抗体进行框并。为了确定例如抗体A和B是否在相同的框中,首先将表达MS4A6A的细胞与饱和水平的抗体A一起温育。在用FACS缓冲液洗涤后,将用荧光团别藻蓝蛋白(APC)标记的抗体B添加至细胞中在冰上温育15分钟。通过FACS Canto系统(BD Biosciences)来分析细胞,并设置门控以排除死细胞。比较在存在或不存在抗体A的情况下抗体B结合的水平。在存在抗体A的情况下结合的减少或消失表示这两种抗体之间存在竞争。针对其他抗体重复该程序,从而框并整个组。
实施例14:通过细胞系中的抗MS4A6A抗体进行的MS4A6A的下调
如下评价抗MS4A6A抗体降低各种细胞系中的MS4A6A的细胞表面和总细胞蛋白水平的能力。每个区室中的MS4A6A蛋白的减少表示细胞中的MS4A6A活性降低。
将表达MS4A6A的细胞系与本公开的抗MS4A6A抗体一起温育各种时间期,然后通过FACS(细胞表面)或蛋白质印迹(总蛋白质水平)来测定与细胞相关的剩余的MS4A6A水平。对于FACS分析,使用直接别藻蓝蛋白(APC)缀合的非竞争性抗体进行剩余的MS4A6A的检测。对于蛋白质印迹检测,通过添加50uL裂解缓冲液(RIPA裂解缓冲液(ThermoFischerScientific Cat#89900)+1:100HALT蛋白酶抑制剂混合物(ThermoFischer ScientificCat#87786))来裂解细胞,并且通过以14,000×g离心15分钟来清除不溶性碎片。用双辛可宁酸(BCA)试剂来测定可溶性级分,以进行蛋白质定量。将来自每个样品的等量蛋白质上样至4-12%Bis-Tris Plus聚丙烯酰胺凝胶(ThermoFisher Scientific NW04120)上,并进行电泳分离,然后使用iBlot2(ThermoFisher Scientific IM21001)和转移层(ThermoFisherScientific IB24002)将凝胶中的蛋白质转移至聚偏二氟乙烯(PVDF)膜上。用1%牛血清白蛋白或5%脱脂乳封闭膜,以防止非特异性结合。然后将膜与内部或商购的检测抗体一起温育,洗涤,并且与HRP缀合的二抗(兔,Abcam#205718;小鼠,Abcam#205719)一起温育。通过用SuperSignal West Pico Plus化学发光底物(ThermoFisher Scientific#34577)进行显影来可视化结合,并用iBright FL1000(ThermoFisher Scientific A32752)或其他兼容系统进行数字化记录。
实施例15:通过原代细胞培养物中的抗MS4A6A抗体进行的MS4A6A的下调
如下评价本公开的抗MS4A6A抗体降低或下调原代细胞培养物中的细胞表面/细胞表达的能力。从出生后早期(第0-3天)收获小鼠原代皮质神经元,并且根据本领域的标准方法进行培养(Maximov等人,(2007),J.Neu.Meth.,161 75-87)。然后将培养的神经元与抗MS4A6A抗体一起在各种条件下(1-20ug/mL,2-48小时)温育,收获,并且通过FACS(对于细胞表面水平)或蛋白质印迹(对于总蛋白质水平)来对总MS4A6A水平进行定量。
原代皮层神经元如下分离。简而言之,通过在含有6mg/ml胰蛋白酶(Sigma,Cat#T1005-1G)、0.5mg/ml DNA酶(Sigma,Cat#D5025)和(以mM计)137NaCl、5KCl、7Na2HPO4和25HEPES-NaOH pH7.2的消化溶液中在37℃下温育7分钟来解离P0小鼠幼崽的皮质、海马或纹状体中的细胞。然后用含有20%胎牛血清(FBS)的Hank平衡盐溶液(HBS)来洗涤含有神经元的分离的细胞一次,然后在无血清的HBS中洗涤两次,并且通过在含有12mM MgSO4和0.5mg/ml DNA酶的HBS中轻轻吸取来进一步分离。将细胞悬浮液以160g离心10分钟,然后涂铺在MEM(Invitrogen)中的基质胶(Collaborative Biomedical Products,Cat#871-275-0004)涂覆的圆形玻璃盖玻片
然后将培养中的原代神经元与本公开的抗MS4A6A抗体一起温育各种时间期,然后通过FACS(细胞表面)或蛋白质印迹(总蛋白质水平)来测定与细胞相关的剩余的MS4A6A水平,如上文实施例14中所述。
实施例16:由抗MS4A6A抗体触发的胞内信号转导
作为膜结合分子,MS4A6A可以直接或间接参与细胞与胞外信号的相互作用。MS4A家族中的其他分子已显示出是表面受体复合物的组分并且调节信号转导。MS4A6A的拓扑结构表明,它具有通过形成跨质膜的成束桶状结构而充当离子通道的能力。钙是此类离子通道的常见第二信使。如下研究抗MS4A6A抗体在细胞系和原代细胞中诱导或增加钙通量的潜力。细胞中添加有钙敏感染料,诸如Fura-2、Indo-1或Fluo-4(ThermoFisher Scientific)。然后将细胞与抗MS4A6A抗体一起温育最多三十分钟,并且通过流式细胞仪、荧光显微镜或荧光光谱仪来监测荧光的水平。
MS4A6A还可以直接或间接调节其他信号传导事件。具体而言,蛋白质磷酸化/脱磷酸化是胞内信号转导的主要机制。虽然MS4A6A不含有与磷酸化活性相关的明确的蛋白质基序,但是MS4A6A确实在胞内C-末端区域中含有若干酪氨酸残基。这些酪氨酸残基的最远端类似于半ITAM的共有序列,所述共有序列是许多受体用来接合含有Src同源2(SH2)的衔接子分子以介导下游信号传导的基序。MS4A6A可以使用半ITAM基序来传输下游信号。或者,MS4A6A可以通过与其他信号传导分子的相互作用来调节下游磷酸化或脱磷酸化事件。
为了检查这一点,将表达MS4A6A的细胞系和原代细胞与抗MS4A6A抗体一起温育。在不同的处理时间点,收获细胞并且通过蛋白质印迹来分析它们的胞内蛋白质丝氨酸/苏氨酸磷酸化或酪氨酸磷酸化。对于蛋白质印迹检测,通过添加50uL裂解缓冲液(RIPA裂解缓冲液(ThermoFischerScientific Cat#89900)+1:100HALT蛋白酶抑制剂混合物(ThermoFischerScientific Cat#87786))来裂解细胞,并且通过以14,000×g离心15分钟来清除不溶性碎片。用双辛可宁酸(BCA)试剂来测定可溶性级分,以进行蛋白质定量。将来自每个样品的等量蛋白质上样至4-12%Bis-Tris Plus聚丙烯酰胺凝胶(ThermoFisherScientific NW04120)上,并进行电泳分离,然后使用iBlot2(ThermoFisher ScientificIM21001)和转移层(ThermoFisher Scientific IB24002)将凝胶中的蛋白质转移至聚偏二氟乙烯(PVDF)膜上。用1%牛血清白蛋白或5%脱脂乳封闭膜,以防止非特异性结合。然后将膜与针对丝氨酸/苏氨酸磷酸化或酪氨酸磷酸化的内部或商购的检测抗体一起温育。然后洗涤膜,并且与HRP缀合的二抗(兔,Abcam#205718;小鼠,Abcam#205719)一起温育。通过用SuperSignal West Pico Plus化学发光底物(ThermoFisher Scientific#34577)进行显影来可视化结合,并用iBright FL1000(ThermoFisher A32752)或其他兼容系统进行数字化记录。
MS4A6A不直接接合胞外配体,而是可以对质膜上的受体蛋白复合物中的其他细胞受体发挥作用是可能的。例如,MS4A6A可以与toll样受体(TLR)、细胞因子受体、趋化因子受体、清除剂受体、在骨髓细胞1或2上表达的触发受体、抑制性受体(诸如CD33、Siglec家族或CD200)、Fc受体或者调节骨髓细胞或小胶质细胞功能的其他细胞表面受体形成蛋白质复合物。为了检查这一点,将表达MS4A6A的细胞系和原代细胞与这些受体的同源配体和抗MS4A6A抗体二者共接合。如上文所述,检查下游信号传导事件,诸如钙动员和蛋白质磷酸化。此外,通过RT-PCR或整体谱分析方法(诸如RNASeq或微阵列)来分析基因表达的变化。
实施例17:MS4A6A和结合配偶体之间的相互作用的表征
可以测试抗MS4A6A抗体用于阻断MS4A6A与各种结合配偶体的相互作用的用途。关于哪种蛋白质在体内与MS4A6A相互作用的了解甚少。为了鉴定这种结合配偶体,从骨髓细胞系和原代细胞中免疫沉淀MS4A6A。然后对免疫沉淀的复合物进行串联质谱分析,以鉴定与MS4A6A共沉淀的蛋白质。一旦鉴定,即可通过蛋白质印迹或荧光共振能量转移(FRET)分析进一步证实这种相互作用。或者,可以将抗MS4A6A抗体施用于表达MS4A6A的细胞系,然后对MS4A6A和潜在的结合配偶体进行染色,读出为共定位或荧光共振能量转移(FRET)。
实施例18:抗MS4A6A抗体对骨髓细胞代谢、生物学和功能的作用的表征
使用骨髓细胞系和原代细胞(诸如例如单核细胞源性巨噬细胞和树突细胞)的培养物作为模型系统,详细检查结合至骨髓细胞(包括CNS中的小胶质细胞)上的它们的靶标的抗MS4A6A抗体的接合的下游后果。这些细胞被广泛用于研究骨髓细胞的生物学性质,因为它们的功能需要进行常规体外研究。这些功能包括但不限于能量代谢、细胞因子产生、吞噬作用、细胞表面分子表达、极化、迁移和抗原呈递。简而言之,将表达MS4A6A的细胞与以贴板、可溶性或预复合形式存在的抗MS4A6A抗体一起温育,这模拟了将抗体呈递给它们的体内细胞靶标的不同方式。温育条件和时间取决于待分析的读出,但通常在从约1小时至约7天的范围内。在温育后,收获细胞并且裂解以进行mRNA或蛋白质分析。还对细胞进行针对细胞表面分子表达的流式细胞术分析。
对于代谢研究,将细胞与CellTiter-Glo(Promega)或其他相容性试剂一起温育,这可以测量细胞内的ATP含量或细胞活力的其他参数。收获培养物上清液,并经受ELISA或其他类似方法,以测定抗MS4A6A抗体处理后细胞因子、趋化因子和其他分子的分泌。通过向细胞中添加荧光标记的底物(诸如乳胶珠、细菌或真菌颗粒以及蛋白质的聚集颗粒(例如A-β、τ或朊病毒分子))来确定经处理的细胞的吞噬能力。细胞迁移通过巨噬细胞划痕测定法(Liang等人,Nature Protocols 2007;2(2):329)或跨孔测定法(Coming,Corning,NY,USA)来确定。
实施例19:采用针对衰老、癫痫发作、脊髓损伤、视网膜营养不良、额颞叶痴呆和阿尔茨海默氏病的动物模型对抗MS4A6A抗体的作用进行表征
抗MS4A6A抗体的治疗效果还可在衰老、癫痫发作、脊髓损伤、视网膜营养不良、额颞叶痴呆和阿尔茨海默氏病的动物模型中进行测试,如上文所述(例如,Beattie,MS等人,(2002)Neuron 36,375-386;Volosin,M等人,(2006)J.Neurosci.26,7756-7766;Nykjaer,A等人,(2005)Curr.Opin.Neurobiol.15,49-57;Jansen,P等人,(2007)Nat.Neurosci.10,1449-1457;Volosin,M等人,(2008)J.Neurosci.28,9870-9879;Fahnestock,M等人,(2001)Mol.Cell Neurosci.18,210-220;Nakamura,K等人,(2007)Cell Death.Differ.14,1552-1554;Yune,T等人,(2007)Brain Res.1183,32-42;Wei,Y等人,(2007)Neurosci.Lett.429,169174;Provenzano,MJ等人,(2008)Laryngoscope 118,87-93;Nykjaer,A等人,(2004)Nature 427,843-848;Harrington,AW等人,(2004)Proc.Natl.Acad.Sci.U.S.A.101,6226-6230;Teng,HK等人,(2005)J.Neurosci.25,5455-5463;Jansen,P等人,(2007)Nat.Neurosci.10,1449-1457;Volosin,M等人,(2008)J.Neurosci.28,9870-9879;Fan,YJ等人,(2008)Eur.J.Neurosci.27,2380-2390;Al-Shawi,R等人,(2008)Eur.J.Neurosci.27,2103-2114;和Yano,H等人,(2009)J.Neurosci.29,14790-14802)。
实施例20:采用肿瘤学动物模型进行的抗MS4A6A抗体的作用的表征
骨髓细胞代表大多数实体瘤中存在的免疫细胞的主要组分。由于骨髓细胞的可塑性,它们在肿瘤生物学中的作用取决于环境-而它们在肿瘤的根除中可能发挥关键作用,它们最常见被宿主肿瘤所指定以协助提供促肿瘤表型。这可以例如通过使骨髓细胞向M2表型极化来实现,该表型通常是免疫抑制性的,并因此阻断了免疫系统接合和根除肿瘤。抗MS4A6A抗体通过骨髓细胞的复极化作用,可以逆转这种免疫抑制性表型并且促进抗肿瘤免疫应答。
存在许多动物肿瘤模型。与MS4A6A最相关的模型是人源化的小鼠模型,其中小鼠免疫系统是遗传缺失的,如由NSG小鼠(Jackson Laboratory,Bar Harbor,Maine)代表。这些小鼠充当人类免疫细胞的接受性宿主,导致人类适应性和先天免疫细胞的植入。然后,这些动物通常在侧面皮肤下接种肿瘤细胞。随时间推移的肿瘤大小表示肿瘤细胞的生长与它们被宿主免疫系统根除之间的平衡。在整个时间过程中,用抗MS4A6A抗体来治疗动物,与同种型治疗的动物相比时,所述抗体改变了肿瘤进展。在治疗期结束时,提取肿瘤并且对肿瘤进行各种分析以确定抗MS4A6A抗体对肿瘤细胞和浸润性免疫细胞的作用。可以对肿瘤进行切片,将它们固定在载玻片上,并在显微镜下分析组织学变化。可以通过RT-PCR、RNASeq或微阵列来分析mRNA,以确定基因表达的变化。可以制备肿瘤和浸润性免疫细胞的单细胞悬液,用针对各种细胞表面标志物的抗体进行染色并且通过流式细胞术进行分析,以描绘细胞表面表型的变化,尤其是免疫细胞(诸如巨噬细胞和T细胞)的变化。在这些分析中的任一者中观察到的作为抗MS4A6A处理的结果的变化表明这些抗体具有免疫调节功能。
