针对癌症的三特异性结合分子及其用途
文献发布时间:2023-06-19 09:29:07
1.相关申请的交叉引用
本申请要求2018年4月5日提交的美国临时申请号62/653,076的优先权益,所述美国临时申请的内容通过引用以其全文并入本文。
2.序列表
本申请含有已经以ASCII格式电子递交的序列表并且所述序列表特此通过引用以其全文并入。所述ASCII副本创建于2019年3月29日,名称为NOV-002WO_SL.txt,并且大小为502,903字节。
3.通过引用并入
本申请中引用的所有出版物、专利、专利申请和其他文献出于所有目的通过引用以其全文并入本文中,其程度如同每个单独的出版物、专利、专利申请或其他文献出于所有目的被单独指出以通过引用并入。在本文并入的一个或多个参考文献和本披露的教导之间存在不一致的情况下,预期的是本说明书的教导。
4.背景技术
重定向靶向T细胞裂解(RTCC)是用于一线治疗和难治性治疗的令人兴奋的机制。具有出色选择性的抗体和抗体片段已成功地以多种形式进行了工程化,以实现将T细胞交联到靶细胞上的单一受体所需的双重特异性。
需要改善的RTCC方法。
5.发明内容
本披露通过提供多特异性结合分子(“MBM”)来扩展RTCC原理,除了CD3或T细胞上TCR复合物的其他组分之外,所述多特异性结合分子接合在癌细胞(例如癌性B细胞)上表达的至少两种肿瘤相关抗原(“TAA”)。
本发明至少部分地基于以下发现:除了TCR复合物的组分之外,接合至少两种单独的TAA,将通过与使用仅靶向单个TAA和TCR复合物组分的双特异性接合子相比,靶向更多数量的癌性B细胞,改善癌症(例如B细胞恶性肿瘤)的RTCC疗法的临床结果。
因此,本披露提供了结合以下的MBM(例如三特异性结合分子(“TBM”)):(1)在癌性B细胞上表达的第一肿瘤相关抗原(“TAA1”),(2)在癌性B细胞上表达的第二肿瘤相关抗原(“TAA 2”),以及(3)CD3或TCR复合物的其他组分。因为TAA 1和TAA 2两者都是在癌性B细胞上表达的肿瘤相关抗原,所以将本披露的肿瘤相关抗原指定为TAA 1和TAA 2是任意的-因此,涉及TAA 1的任何披露适用于TAA 2并且反之亦然,除非上下文另有说明。
MBM(例如TBM)包含至少三个抗原结合模块(“ABM”),其可以结合TAA 1、TAA 2和TCR复合物的组分。每个ABM可以是基于免疫球蛋白的或基于非免疫球蛋白的,并且因此本披露的MBM(例如TBM)可以包括基于免疫球蛋白的ABM、基于非免疫球蛋白的ABM、或其组合。可以用于本披露的MBM(例如TBM)的基于免疫球蛋白的ABM描述于下文中的7.2.1节和具体实施例738-890、893-1045、和1048-1218中。可以用于本披露的MBM(例如TBM)的基于非免疫球蛋白的ABM描述于下文中的7.2.2节和具体实施例891-892和1046-1047中。结合至TCR复合物的组分的示例性ABM的其他特征描述于下文中的7.5节和具体实施例1048-1224和1272-1354中。结合至TAA 1和TAA2的示例性ABM的其他特征描述于下文中的7.6节和具体实施例2-737和1654-1663中。
本披露的MBM(例如TBM)的ABM(或其部分)可以相互连接,例如,通过短肽接头或通过Fc结构域相互连接。用于连接ABM以形成MBM的方法和组分描述于下文中的7.3节和具体实施例1219-1271和1355-1550中。
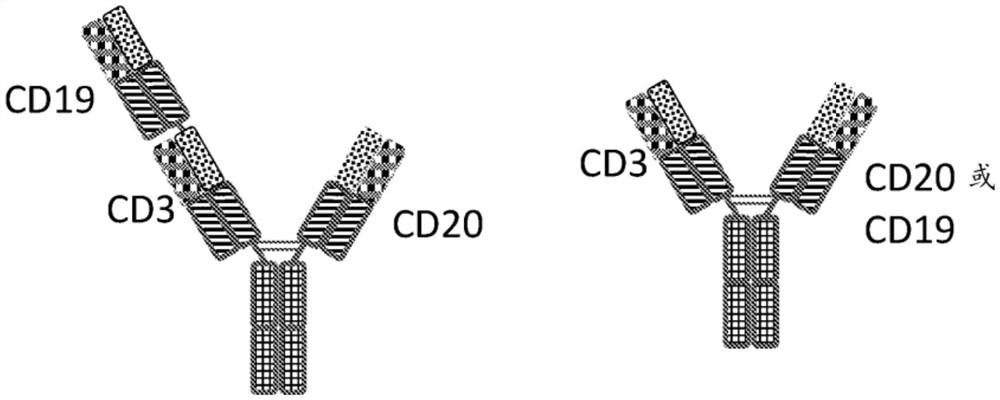
本披露的MBM(例如TBM)具有至少三个ABM(例如TBM至少是三价的),但还可以具有多于三个ABM。例如,MBM(例如TBM)可以具有四个ABM(即四价)、五个ABM(即五价)、或六个ABM(即六价),条件是所述MBM具有至少一个可以结合TAA 1的ABM,至少一个可以结合TAA 2的ABM,和至少一个可以结合TCR复合物的组分的ABM。示例性三价、四价、五价、和六价TBM构型示出于图1中并描述于下文中的7.4节和具体实施例1552-1572、1574-1602、1604-1615、和1617-1653中。
本披露进一步提供了编码本披露的MBM的核酸(以单个核酸或多个核酸的形式)和工程化以表达本披露的核酸和MBM的重组宿主细胞和细胞系。示例性核酸、宿主细胞、和细胞系描述于下文中的7.7节和具体实施例1784-1792中。
本披露进一步提供了包含本披露的MBM的药物缀合物。为了方便起见,此类缀合物在本文中被称为“抗体-药物缀合物”或“ADC”,尽管一些或全部ABM可能是非免疫球蛋白结构域。ADC的实例描述于下文中的7.8节和具体实施例1665-1704中。
还提供了包含本披露的MBM和ADC的药物组合物。药物组合物的实例描述于下文中的7.9节和具体实施例1705中。
本文进一步提供了使用本披露的MBM、ADC、和药物组合物的方法,例如用于治疗B细胞恶性肿瘤和自体免疫性障碍。示例性方法描述于下文中的7.10节和具体实施例1706-1729和1750-1783中。
本披露进一步提供了使用与其他药剂和疗法组合的本披露的MBM、ADC、和药物组合物的方法。组合疗法的示例性药剂、疗法、和方法描述于下文中的7.11节和具体实施例1730-1749中。
6.附图说明
图1A-1U:示例性TBM构型。图1A示出了图1B-1U中示出的示例性TBM构型的组分。并未示出连接每条链的不同结构域的全部区(例如,省略了连接scFv的VH结构域和VL结构域的接头、连接Fc的CH2结构域和CH3结构域的铰链等)。图1B-1O示出了三价TBM;图1P-1R示出了四价TBM;图1S示出了五价TBM,并且图1T-1U示出了六价TBM。
图2:实例1的双特异性和三特异性构建体的示意图。
图3A-G:实例2的双特异性和三特异性构建体的示意图。
图4:实例3的双特异性和三特异性构建体的示意图。
图5:细胞毒性测定结果(实例1)。
图6:在双特异性和三特异性抗体存在下,将靶细胞与人T细胞共培养时,肿瘤细胞裂解的百分比(实例2)。
图7:在双特异性和三特异性抗体存在下,将Ramos与人T细胞共培养时,肿瘤细胞裂解的百分比(实例2)。
图8:在三种不同细胞系中,使用RTCC测定,测量双特异性和三特异性抗体的EC50(实例2)。
图9A-9B:通过流式细胞术测量MM1细胞上BCMA(图9A)和CD138(图9B)的细胞表面表达(实例3)。
图10:在MM1S RTCC测定中,添加的可溶性BCMA ECD对BCMAxCD3双特异性和CD138xBCMAxCD3三特异性Ab的活性的影响(实例3)。
图11:比较可溶性BCMA对靶向不同MM的CD3多特异性抗体的活性的影响的MM细胞系MM1S中的RTCC测定EC50值(实例3)。
7.具体实施方式
7.1.定义
如本文所用的,以下术语旨在具有以下含义:
将轻链和重链两者分成结构同源性区和功能同源性区。所述术语“恒定”和“可变”是在功能上使用。在这点上,应当理解轻链(VL)和重链(VH)部分的可变结构域均决定抗原识别和特异性。相反地,轻链(CL)和重链(CH1、CH2或CH3)的恒定结构域赋予重要生物学特性例如分泌、经胎盘移动性(transplacentalmobility)、Fc受体结合、补体结合等。按照惯例,恒定区结构域离抗体的抗原结合位点或者氨基末端越远,它的编号越大。N-末端是可变区并且在C-末端是恒定区;CH3结构域和CL结构域实际上分别包含重链和轻链的羧基末端。
抗体片段还可以掺入到单结构域抗体、大型抗体(maxibody)、微型抗体(minibody)、胞内抗体、双体抗体、三体抗体、四体抗体、v-NAR和bis-scFv中(参见例如,Hollinger和Hudson,2005Nature Biotechnology[自然生物技术]23:1126-1136)。可以将抗体片段移植到基于多肽例如III型纤连蛋白(Fn3)的支架中(参见美国专利号6,703,199,其描述了纤连蛋白多肽单体)。
可以将抗体片段掺入包含一对串联Fv片段(例如,VH-CH1-VH-CH1)的单链分子中,与互补的轻链多肽(例如,VL-VC-VL-VC)一起形成一对抗原结合区(Zapata等人,1995,Protein Eng.[蛋白工程]8:1057-1062;和美国专利号5,641,870)。
半抗体的实例是包含抗体(例如,IgG抗体)的重链和轻链的分子。半抗体的另一实例是包含第一多肽和第二多肽的分子,所述第一多肽包含VL结构域和CL结构域,所述第二多肽包含VH结构域、CH1结构域、铰链结构域、CH2结构域、和CH3结构域,其中VL和VH结构域形成ABM。半抗体的又一实例是包含scFv结构域、CH2结构域和CH3结构域的多肽。
半抗体可能包括多于一个ABM,例如包含(以从N-末端至C-末端的顺序)scFv结构域、CH2结构域、CH3结构域、和另一scFv结构域的半抗体。
半抗体还可能包括ABM链,当与在另一个半抗体中的另一条ABM链缔合时,所述ABM链形成了完整的ABM。
因此,MBM(例如TBM)可以包含一个,更典型地两个,或甚至多于两个半抗体,并且半抗体可以包含一个或多个ABM或一条或多条ABM链。
在一些MBM中,第一半抗体将与第二半抗体缔合,例如,异源二聚体化。在其他的MBM中,第一半抗体将共价连接至第二半抗体,例如通过二硫桥或化学交联。在又其他的MBM中,第一半抗体将与第二半抗体通过共价附接和非共价相互作用,例如二硫桥和杵臼结构相互作用缔合。
所述术语“半抗体”仅旨在用于描述性目的并且不表示特定构型或生产方法。半抗体作为“第一”半抗体、“第二”半抗体、“左”半抗体、“右”半抗体等的描述仅仅是为了方便起见和描述性目的。
对于序列比较,典型地一个序列充当参考序列,将测试序列与该参考序列进行比较。当使用序列比较算法时,将测试序列和参考序列输入到计算机中,必要时指定子序列坐标,并且指定序列算法程序参数。可以使用默认程序参数,或者可以指定替代参数。然后,序列比较算法将基于程序参数计算测试序列相对于参考序列的序列同一性百分比。用于比较的序列比对方法是本领域熟知的。用于比较的序列的最佳比对可以通过以下来进行:例如,通过Smith和Waterman,1970,Adv.Appl.Math.[应用数学进展]2:482c的局部同源性算法;通过Needleman和Wunsch,1970,J.Mol.Biol.[分子生物学杂志]48:443的同源比对算法;通过搜索Pearson和Lipman,1988,Proc.Nat’l.Acad.Sci.USA[美国国家科学院院刊]85:2444的相似性方法;通过这些算法的计算机化实现(在威斯康星州麦迪逊市科学路575号(575Science Dr.,Madison,WI)的遗传学计算机组(Genetics Computer Group)的威斯康星遗传学软件包(Wisconsin Genetics Software Package)中的GAP、BESTFIT、FASTA、和TFASTA);或通过手动比对和目视检查(参见例如,Brent等人2003,Current Protocols inMolecular Biology[当代分子生物学实验指南])。
适用于确定序列同一性百分比和序列相似性的算法的两个实例是BLAST和BLAST2.0算法,它们分别描述于Altschul等人,1977,Nuc.Acids Res.[核酸研究]25:3389-3402;和Altschul等人,1990,J.Mol.Biol.[分子生物学杂志]215:403-410中。用于执行BLAST分析的软件可通过美国国家生物技术信息中心(National Center for BiotechnologyInformation)公开地获得。
也可以使用已并入ALIGN程序(2.0版)中的Meyers和Miller,1988,Comput.Appl.Biosci.[生物科学中的计算机应用]4:11-17的算法、使用PAM120权重残基表、12的空位长度罚分和4的空位罚分来确定两个氨基酸序列之间的同一性百分比。另外,两个氨基酸序列之间的百分比同一性可以使用已并入GCG软件包(在www.gcg.com上可获得)中的GAP程序中的Needleman和Wunsch,1970,J.Mol.Biol.[分子生物学杂志]48:444-453)算法,使用Blossum 62矩阵或PAM250矩阵以及缺口权重为16、14、12、10、8、6或4和长度权重为1、2、3、4、5或6来确定。
人抗体可以包括不是由人序列编码的氨基酸残基(例如,通过在体外随机诱变或位点特异性诱变、或通过在体内体细胞突变、或保守取代来引入突变以促进稳定性或生产)。然而,如本文所用的,所述术语“人抗体”不旨在包括其中衍生自另一种哺乳动物物种(例如小鼠)种系的CDR序列已被移植到人类框架序列中的抗体。
除非另外指出,否则特定的核酸序列还隐含地涵盖其保守修饰的变体(例如,简并密码子取代)和互补序列,以及明确指明的序列。具体地,如下文详述,简并密码子取代可以通过产生如下序列而实现,在这些序列中,一个或多个所选择的(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(Batzer等人,(1991)Nucleic Acid Res.[核酸研究]19:5081;Ohtsuka等人,(1985)J.Biol.Chem.[生物化学杂志]260:2605-2608;和Rossolini等人,(1994)Mol.Cell.Probes[分子与细胞探针]8:91-98)。
7.2.
典型地,本披露的MBM的一个或多个ABM包含基于免疫球蛋白的抗原结合结构域,例如抗体片段或衍生物的序列。这些抗体片段和衍生物典型地包括抗体的CDR并且可以包括更大的片段和其衍生物,例如,Fab、scFab、Fv、和scFv。
基于免疫球蛋白的ABM可以包含对VH和/或VL内的框架残基的修饰,例如,以改善含有ABM的MBM的特性。例如,可以进行框架修饰以降低MBM的免疫原性。用于进行此类框架修饰的一种方法是将ABM的一个或多个框架残基“回复突变”为相应的种系序列。可以通过将框架序列与衍生出所述ABM的种系序列进行比较来鉴定此类残基。为了使框架区序列“匹配”所希望的种系构型,可以通过例如定点诱变将残基“回复突变”成相应的种系序列。具有这种“回复突变的”ABM的MBM旨在为本披露所涵盖。
另一种类型的框架修饰包括使框架区内或甚至一个或多个CDR区内的一个或多个残基突变以去除T细胞表位,从而降低MBM的潜在免疫原性。该方法也称为“去免疫化”,并在Carr等人的美国专利公开号20030153043中进一步详细描述。
ABM也可以被修饰为具有改变的糖基化,这可以是有用的,例如增加MBM对其一种或多种抗原的亲和力。此类碳水化合物修饰可以通过例如改变ABM序列内的一个或多个糖基化位点来实现。例如,可以进行一个或多个氨基酸取代,这消除了一个或多个可变区框架糖基化位点,从而消除了所述位点的糖基化。这种无糖基化可以增加MBM对于抗原的亲和力。此种方法描述于例如Co等人的美国专利号5,714,350和6,350,861中。
7.2.1.基于免疫球蛋白的模块
7.2.1.1.Fab
在某些方面,本披露的ABM是Fab结构域。Fab结构域可以通过免疫球蛋白分子的蛋白水解切割,使用酶例如木瓜蛋白酶,或通过重组表达来产生。Fab结构域典型地包含附接至VH结构域的CH1结构域,所述CH1结构域与附接至VL结构域的CL结构域配对。
在野生型免疫球蛋白中,所述VH结构域与所述VL结构域配对以构成Fv区,并且所述CH1结构域与所述CL结构域配对以进一步稳定结合模块。两个恒定结构域之间的二硫键可以进一步稳定Fab结构域。
对于本披露的MBM(例如TBM),有利的是使用Fab异源二聚化策略以允许属于相同的ABM的Fab结构域的正确缔合并且最小化属于不同ABM的Fab结构域的异常配对。例如,可以使用下表1中所示的Fab异源二聚化策略:
因此,在某些实施例中,通过彼此交换Fab的VL和VH结构域或彼此交换CH1和CL结构域,例如,WO 2009/080251中所述,来促进Fab的两个多肽之间的正确缔合。
还可以通过在CH1结构域中引入一个或多个氨基酸修饰和在Fab的CL结构域中引入一个或多个氨基酸修饰和/或在VH结构域中引入一个或多个氨基酸修饰和在VL结构域中引入一个或多个氨基酸修饰,来促进正确的Fab配对。被修饰的氨基酸典型地是VH:VL和CH1:CL相互作用的一部分,使得Fab组分优先相互配对,而不是与其他Fab的组分配对。
在一个实施例中,所述一个或多个氨基酸修饰限于可变(VH、VL)和恒定(CH1、CL)结构域的保守框架残基,如通过残基的卡巴特编号所指示。Almagro,2008,Frontiers InBioscience[生物科学前沿]13:1619-1633提供了基于卡巴特、乔西亚和IMGT编号方案的框架残基的定义。
在一个实施例中,所述在VH和CH1和/或VL和CL结构域中引入的修饰是彼此互补的。可以基于空间和疏水性接触、静电/电荷相互作用或所述多种相互作用的组合来实现重链和轻链界面的互补性。蛋白质表面之间的互补性在文献中以如下术语:锁钥组合(lockand key fit)、杵臼结构、凸起和空腔、供体和受体等进行了广泛的描述,其全部暗示了两个接触表面之间的结构和化学匹配的本质。
在一个实施例中,所述一个或多个引入的修饰引入了跨越Fab组分的界面的新的氢键。在一个实施例中,所述一个或多个引入的修饰引入了跨越Fab组分的界面的新的盐桥。示例性取代描述于WO 2014/150973和WO 2014/082179中。
在一些实施例中,所述Fab结构域包含在CH1结构域中的192E取代和在CL结构域中的114A和137K取代,其中在CH1和CL结构域之间引入了盐桥(参见Golay等人,2016,JImmunol[免疫学杂志]196:3199-211)。
在一些实施例中,所述Fab结构域包含在CH1结构域中的143Q和188V取代和在CL结构域中的113T和176V取代,其作用是交换CH1和CL结构域之间的疏水性和极性接触区(参见Golay等人,2016,J Immunol[免疫学杂志]196:3199-211)。
在一些实施例中,所述Fab结构域在VH、CH1、VL、CL结构域的一些或全部中可以包含修饰以引入正交Fab界面,其促进Fab结构域的正确装配(Lewis等人,2014NatureBiotechnology[自然生物技术]32:191-198)。在实施例中,在VH结构域中引入39K、62E修饰,在CH1结构域中引入H172A、F174G修饰,在VL结构域中引入1R、38D、(36F)修饰,并且在CL结构域中引入L135Y、S176W修饰。在另一个实施例中,在VH结构域中引入39Y修饰并且在VL结构域中引入38R修饰。
Fab结构域也可以被修饰以用工程化二硫键置换天然CH1:CL二硫键,从而提高Fab组分配对的效率。例如,可以通过在CH1结构域中引入126C和在CL结构域中引入121C来引入工程化的二硫键(参见Mazor等人,2015,MAbs 7:377-89)。
还可以通过用促进正确装配的替代性结构域来置换CH1结构域和CL结构域来修饰Fab结构域。例如,Wu等人,2015,MAbs 7:364-76,描述了用αT细胞受体的恒定结构域置换CH1结构域并且用T细胞受体的β结构域取代CL结构域,并且通过在VL结构域中引入38D修饰并且在VH结构域中引入39K修饰,将这些结构域置换与VL和VH结构域之间的另外的电荷-电荷相互作用配对。
本披露的ABM可以包含单链Fab片段,其是由抗体重链可变结构域(VH)、抗体恒定结构域1(CH1)、抗体轻链可变结构域(VL)、抗体轻链恒定结构域(CL)和接头组成的多肽。在一些实施例中,抗体结构域和接头在N-末端至C-末端的方向上具有以下顺序之一:a)VH-CH1-接头-VL-CL,b)VL-CL-接头-VH-CH1,c)VH-CL-接头-VL-CH1或d)VL-CH1-接头-VH-CL。所述接头可以是具有至少30个氨基酸,例如,32个和50个之间的氨基酸的多肽。所述单链Fab结构域通过CL结构域与CH1结构域之间的天然二硫键稳定化。
在实施例中,单链Fab片段中的抗体结构域和接头在N-末端至C-末端的方向上具有以下顺序之一:a)VH-CH1-接头-VL-CL,或b)VL-CL-接头-VH-CH1。在一些情况下,使用了VL-CL-接头-VH-CH1。
在另一个实施例中,单链Fab片段中的抗体结构域和接头在N-末端至C-末端的方向上具有以下顺序之一:a)VH-CL-接头-VL-CH1或b)VL-CH1-接头-VH-CL。
任选地,在单链Fab片段中,除了CL结构域和CH1结构域之间的天然二硫键,抗体重链可变结构域(VH)和抗体轻链可变结构域(VL)也通过在以下位置间引入二硫键而进行二硫键稳定化:i)重链可变结构域位置44至轻链可变结构域位置100,ii)重链可变结构域位置105至轻链可变结构域位置43,或iii)重链可变结构域位置101至轻链可变结构域位置100(根据卡巴特的EU索引进行编号)。
单链Fab片段的此类进一步的二硫键稳定化通过在单链Fab片段的可变结构域VH和VL之间引入二硫键来实现。引入非天然二硫桥以稳定单链Fv的技术描述于以下文献中:例如,WO 94/029350,Rajagopal等人,1997,Prot.Engin.[蛋白质工程]10:1453-59;Kobayashi等人,1998,Nuclear Medicine&Biology[核医学和生物学],25:387-393;和Schmidt,等人,1999,Oncogene[致癌基因]18:1711-1721。在一个实施例中,单链Fab片段的可变结构域之间的任选的二硫键在重链可变结构域位置44与轻链可变结构域位置100之间。在一个实施例中,单链Fab片段的可变结构域之间的任选的二硫键在重链可变结构域位置105与轻链可变结构域位置43之间(根据卡巴特的EU索引进行编号)。
7.2.1.2.scFv
单链Fv或“scFv”抗体片段包含单一多肽链中的抗体的VH和VL结构域,能够作为单链多肽进行表达,并且保留了衍生其的完整抗体的特异性。通常,所述scFv多肽进一步包含VH和VL结构域之间的多肽接头,所述接头能够使scFv形成所希望的结构用于靶结合。适合用于连接scFV的VH和VL链的接头的实例是在7.3.3节中鉴定的ABM接头,例如指定为L1至L54的任何接头。
除非另有说明,否则如本文所用的,scFv可以例如相对于多肽的N-末端和C-末端以任何顺序具有VL和VH可变区,所述scFv可以包含VL-接头-VH或者可以包含VH-接头-VL。
为产生scFv编码核酸,所述VH和VL编码DNA片段可操作地连接至编码接头的另一片段,例如编码7.3.3节中所述的任何ABM接头(如氨基酸序列(Gly4~Ser)3(SEQ ID NO:724)),使得所述VH和VL序列可以作为连续单链蛋白质(其VL和VH区通过柔性接头连接)进行表达(参见例如,Bird等人,1988,Science[科学]242:423-426;Huston等人,1988,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]85:5879-5883;McCafferty等人,1990,Nature[自然]348:552-554)。
7.2.1.3.其他基于免疫球蛋白的模块
本披露的MBM还可以包含具有免疫球蛋白形式的ABM,所述免疫球蛋白形式除了Fab或scFv之外的例如Fv、dsFv、(Fab’)2、单结构域抗体(SDAB)、VH或VL结构域、或骆驼科动物VHH结构域(还称为纳米抗体)。
ABM可以是由单一VH或VL结构域构成的单一结构域抗体,所述单一VH或VL结构域表现出对靶标的充分的亲和力。在具体的实施例中,所述单结构域抗体是骆驼科动物VHH结构域(参见例如,Riechmann,1999,Journal of Immunological Methods[免疫学方法杂志]231:25-38;WO 94/04678)。
7.2.2.基于非免疫球蛋白的模块
在某些实施例中,本披露的ABM中的一种或多种衍生自非抗体支架蛋白质(包括但不限于:设计型锚蛋白重复序列蛋白(designed ankyrin repeat protein,DARPin)、Avimer(亲合力多聚体(avidity multimer)的简称)、抗运载蛋白(Anticalin)/脂质运载蛋白、Centyrin、库尼茨结构域(Kunitz domain)、Adnexin、Affilin、Affitin(也称为Nonfitin)、打结素(Knottin)、Pronectin、Versabody、Duocalin、和Fynomer)、配体、受体、细胞因子或趋化因子。
可以用于本披露的MBM的非免疫球蛋白支架包括在如下中列出的那些:Mintz和Crea,2013,Bioprocess International[生物工艺国际期刊]11(2):40-48的表3和4;Vazquez-Lombardi等人,2015,Drug Discovery Today[今日药物发现]20(10):1271-83的图1、表1和图I;Skrlec等人,2015,Trends in Biotechnology[生物技术趋势]33(7):408-18的表1和第2栏。Mintz和Crea,2013,Bioprocess International[生物工艺国际期刊]11(2):40-48的表3和4;Vazquez-Lombardi等人,2015,Drug Discovery Today[今日药物发现]20(10):1271-83的图1、表1和图I;Skrlec等人,2015,Trends in Biotechnology[生物技术趋势]33(7):408-18的表1和第2栏(统称为“支架披露”)。在具体的实施例中,披露内容涉及Adnexin的支架披露通过引用并入。在另一个实施例中,披露内容涉及Avimer的支架披露通过引用并入。在另一个实施例中,披露内容涉及Affibody的支架披露通过引用并入。在又另一个实施例中,披露内容涉及抗运载蛋白的支架披露通过引用并入。在又另一个实施例中,披露内容涉及DARPin的支架披露通过引用并入。在又另一个实施例中,披露内容涉及库尼茨结构域的支架披露通过引用并入。在又另一个实施例中,披露内容涉及打结素(Knottin)的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Pronectin的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Nanofitin的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Affilin的支架披露通过引用并入。在又另一个实施例中,披露内容涉及腺连蛋白(Adnectin)的支架披露通过引用并入。在又另一个实施例中,披露内容涉及ABD的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Adhiron的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Affimer的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Alphabody的支架披露通过引用并入。在又另一个实施例中,披露内容涉及犰狳重复蛋白(Armadillo Repeat Protein)的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Atrimer/四连接素(Tetranectin)的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Obody/OB-fold的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Centyrin的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Repebody的支架披露通过引用并入。在又另一个实施例中,披露内容涉及抗运载蛋白的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Atrimer的支架披露通过引用并入。在又另一个实施例中,披露内容涉及二环肽(bicyclic peptide)的支架披露通过引用并入。在又另一个实施例中,披露内容涉及cys-knot的支架披露通过引用并入。在又另一个实施例中,披露内容涉及Fn3支架(包括腺连蛋白、Centryrin、Pronectin、和Tn3)的支架披露通过引用并入。
在实施例中,本披露的ABM可以是设计型锚蛋白重复序列蛋白(“DARPin”)。DARPin是抗体模拟蛋白,其典型地表现出高特异性和高亲和力靶蛋白结合。它们一般经基因工程化并衍生自天然锚蛋白质并且由这些蛋白质中的至少三个、通常四个或五个重复基序组成。对于四重复或五重复DARPin,它们的分子质量分别是约14或18kDa(千道尔顿)。DARPin的实例可以见于例如美国专利号7,417,130中。包含DARPin结合模块和基于免疫球蛋白的结合模块的多特异性结合分子披露于,例如,美国公开号2015/0030596A1中。
在另一个实施例中,本披露的ABM可以是Affibody。Affibody是本领域熟知的并且是指衍生自葡萄球菌蛋白A的一个IgG结合结构域的基于58个氨基酸残基蛋白结构域的亲和蛋白。
在另一个实施例中,本披露的ABM可以是抗运载蛋白。抗运载蛋白是本领域熟知的并且是指另一抗体模拟技术,其中所述结合特异性衍生自脂质运载蛋白。抗运载蛋白还可以格式化为双重靶向蛋白,称为Duocalin。
在另一个实施例中,本披露的ABM可以是Versabody。Versabody是本领域熟知的并且是指另一抗体模拟技术。它们是具有>15%半胱氨酸的3-5kDa的小蛋白质,其形成高二硫键密度支架,置换了典型蛋白质的疏水核。
其他的非免疫球蛋白ABM包括“A”结构域寡聚物(也称为Avimer)(参见例如,美国专利申请公开号2005/0164301、2005/0048512、和2004/017576)、基于Fn3的蛋白质支架(参见例如,美国专利申请公开2003/0170753)、VASP多肽、禽类胰腺多肽(Avian pancreaticpolypeptide,aPP)、四连接素(基于CTLD3)、Affililin(基于γB-晶体蛋白/泛素)、打结素、SH3结构域、PDZ结构域、淀粉酶抑肽(Tendamistat)、新制癌菌素(Neocarzinostatin)、蛋白质A结构域、脂质运载蛋白、转铁蛋白、或库尼茨结构域。在一个方面,用于构建本披露的MBM的ABM包含如在WO 2011/130324中所示的基于纤连蛋白的支架。
7.3.连接子
预期的是,本披露的MBM可以在一些情况下包括直接互相连接的成对的ABM或ABM链(例如,Fab的VH-CH1或VL-CL组分),例如,作为没有接头的融合蛋白。例如,本披露的MBM包含连接单个ABM或ABM链的连接子部分。连接子部分的使用可以改善靶结合,例如通过提高MBM中ABM的柔性并且因此减少空间位阻。通过例如,Fc结构域(各Fc结构域代表一对缔合的Fc区)和/或ABM接头,ABM可以互相连接。Fc结构域的使用将典型地需要使用铰链区作为ABM或ABM链的连接子用于最佳的抗原结合。因此,所述术语“连接子”涵盖但不限于Fc区、Fc结构域、铰链区、和ABM接头。
可以选择或修饰连接子以,例如提高或降低本披露的MBM的生物半衰期。例如,为了降低生物半衰期,可以将一个或多个氨基酸突变引入Fc-铰链片段的CH2-CH3结构域界面区域中,使得包含所述片段的MBM相比于天然Fc-铰链结构域SpA结合,具有受损的葡萄球菌蛋白A(SpA)结合。该方法在Ward等人的美国专利号6,165,745中进一步详细描述。可替代地,可以修饰MBM以提高其生物半衰期。例如,可以引入以下突变中的一种或多种:如在美国专利号6,277,375中由Ward所述的T252L、T254S、T256F。可替代地,为了增加生物半衰期,可以在CH1或CL区内改变MBM,以含有取自IgG的Fc区的CH2结构域的两个环的补救受体结合表位,如Presta等人的美国专利号5,869,046和6,121,022中所述。
Fc结构域(由两个Fc区配对形成)、铰链区和ABM接头的实例分别描述于7.3.1节、7.3.2节、和7.3.3节中。
7.3.1.Fc结构域
本披露的MBM(例如TBM)可以包括衍生自任何合适物种的Fc结构域。在一个实施例中,所述Fc结构域衍生自人Fc结构域。
所述Fc结构域可以衍生自任何合适类型的抗体,包括IgA(包括亚类IgA1和IgA2)、IgD、IgE、IgG(包括亚类IgG1、IgG2、IgG3和IgG4)、和IgM。在一个实施例中,所述Fc结构域衍生自IgG1、IgG2、IgG3或IgG4。在一个实施例中,所述Fc结构域衍生自IgG1。在一个实施例中,所述Fc结构域衍生自IgG4。
所述Fc结构域包含两条多肽链,各自被称为重链Fc区。这两个重链Fc区二聚化以产生Fc结构域。所述Fc结构域中的这两个Fc区可以彼此相同或不同。在天然抗体中,所述Fc区典型地是同一的,但出于产生多特异性结合分子的目的,例如,本披露的TBM,所述Fc区可有利地不同以允许异源二聚化,如下文7.3.1.5节所述。
典型地,每个重链Fc区包含两个或三个重链恒定结构域或由其组成。
在天然抗体中,IgA、IgD和IgG的重链Fc区由两个重链恒定结构域(CH2和CH3)构成并且IgE和IgM的Fc区由三个重链恒定结构域(CH2、CH3和CH4)构成。这些抗体二聚化以产生Fc结构域。
在本披露中,所述重链Fc区可以包含来自一个或多个不同类型(例如一个、两个或三个不同类型)的抗体的重链恒定结构域。
在一个实施例中,所述重链Fc区包含衍生自IgG1的CH2和CH3结构域。
在一个实施例中,所述重链Fc区包含衍生自IgG2的CH2和CH3结构域。
在一个实施例中,所述重链Fc区包含衍生自IgG3的CH2和CH3结构域。
在一个实施例中,所述重链Fc区包含衍生自IgG4的CH2和CH3结构域。
在一个实施例中,所述重链Fc区包含来自IgM的CH4结构域。所述IgM CH4结构域典型地位于CH3结构域的C-末端。
在一个实施例中,所述重链Fc区包含衍生自IgG的CH2和CH3结构域和衍生自IgM的CH4结构域。
将认识到,用于产生针对本披露的MBM的重链Fc区的重链恒定结构域可以包括如上所述天然存在的恒定结构域的变体。此类变体相比于野生型恒定结构域可以包含一个或多个氨基酸变异。在一个实例中,本披露的所述重链Fc区包含至少一个恒定结构域,其在序列上与野生型恒定结构域不同。将认识到,所述变体恒定结构域可以比野生型恒定结构域更长或更短。例如,所述变体恒定结构域与野生型恒定结构域是至少60%同一或相似的。在另一个实例中,所述恒定结构域是至少70%同一或相似的。在另一个实例中,所述恒定结构域是至少75%同一或相似的。在另一个实例中,所述恒定结构域是至少80%同一或相似的。在另一个实例中,所述恒定结构域是至少85%同一或相似的。在另一个实例中,所述恒定结构域是至少90%同一或相似的。在另一个实例中,所述恒定结构域是至少95%同一或相似的。在另一个实例中,所述恒定结构域是至少99%同一或相似的。示例性Fc变体描述于下文中的7.3.1.1节至7.3.1.5节中。
IgM和IgA作为常见H2L2抗体单元的共价多聚物天然存在于人类中。当掺入J-链时,IgM作为五聚体存在,或者当缺乏J-链时,IgM作为六聚体存在。IgA作为单体和二聚体形式存在。IgM和IgA的重链具有至C-末端恒定结构域的18个氨基酸的延伸,其称为尾部(tailpiece)。所述尾部包括形成多聚物中的重链之间的二硫键的半胱氨酸残基,并且据信在聚合中具有重要作用。所述尾部还含有糖基化位点。在某些实施例中,本披露的MBM不包含尾部。
掺入本披露的MBM(例如TBM)中的所述Fc结构域可以包含改变蛋白质的一个或多个功能特性的一个或多个修饰,例如血清半衰期、补体固定、Fc受体结合、和/或抗原依赖性细胞毒性。此外,本披露的MBM可以经化学修饰(例如,一个或多个化学部分可以附接至MBM)或经修饰以改变其糖基化,从而再次改变MBM的一种或多种功能特性。
抗体分子的效应子功能包括补体介导的效应子功能,其是由例如所述补体的C1组分与所述抗体的结合介导的。补体的活化在病原体的调理作用和直接裂解中是重要的。另外,它通过募集和活化吞噬细胞至补体活化的位点刺激炎症响应。效应子功能包括Fc受体(FcR)介导的效应子功能,其可以由抗体的恒定结构域与Fc受体(FcR)的结合触发。效应细胞表面上Fc受体的抗原-抗体复合物介导的交联触发大量重要和不同的生物学响应,包括抗体包被的颗粒的吞噬和破坏、免疫复合物的清除、杀伤细胞裂解抗体包被的靶细胞(称为抗体依赖性细胞介导的细胞毒性、或ADCC)、炎性介质的释放、胎盘转运和免疫球蛋白产生的控制。
可以通过以下方式改变Fc区:将至少一个氨基酸残基置换为不同氨基酸残基以改变效应子功能。例如,一个或多个氨基酸可以用不同氨基酸残基置换,使得Fc区对效应配体具有改变的亲和力。改变亲和力的效应配体可以是例如Fc受体或补体的C1组分。例如,Winter等人在美国专利号5,624,821和5,648,260中均描述了这一方法。修饰的Fc区还可以改变C1q结合和/或减少或消除补体依赖性细胞毒性(CDC)。例如,Idusogie等人在美国专利号6,194,551中描述了这一方法。修饰的Fc区还可以改变Fc区固定补体的能力。例如,Bodmer等人在PCT公开WO94/29351中描述了这一方法。同种异型氨基酸残基包括但不限于:IgG1、IgG2、和IgG3亚类的重链的恒定区以及κ同种型的轻链的恒定区,如Jefferis等人,2009,MAbs,1:332-338所述。
还可以修饰Fc区以“沉默”所述效应子功能,例如,减少或消除MBM介导抗体依赖性细胞毒性(ADCC)和/或抗体依赖性细胞吞噬作用(ADCP)的能力。例如,可以通过在Fc区中引入突变来实现这一目标。本领域中已描述了此类突变:LALA和N297A(Strohl,2009,Curr.Opin.Biotechnol.[当前生物技术观点]20(6):685-691);和D265A(Baudino等人,2008,J.Immunol.[免疫学杂志]181:6664-69;Strohl,同上)。沉默Fc IgG1抗体的实例包含号称的LALA突变体,所述突变体在IgG1 Fc氨基酸序列中包含L234A和L235A突变。沉默IgG1抗体的另一个实例包含D265A突变。另一沉默IgG1抗体包含所谓的DAPA突变体,所述突变体包含IgG1 Fc氨基酸序列中的D265A和P329A突变。另一个沉默IgG1抗体包含N297A突变,所述突变导致无糖基化/非糖基化的抗体。
可以修饰Fc区以提高含有所述Fc区的MBM介导抗体依赖性细胞毒性(ADCC)和/或抗体依赖性细胞吞噬作用(ADCP)的能力,例如,通过修饰一个或多个氨基酸残基以提高MBM对活化Fcγ受体的亲和力,或降低MBM对抑制性Fcγ受体的亲和力。人激活性Fcγ受体包括FcγRIa、FcγRIIa、FcγRIIIa和FcγRIIIb,并且人抑制性Fcγ受体包括FcγRIIb。例如Presta在PCT公开WO 00/42072中描述了这一方法。此外,已经绘制了人IgG1上针对FcγRl、FcγRII、FcγRIII和FcRn的结合位点,并且已经描述了具有改善的结合的变体(参见Shields等人,J.Biol.Chem.[生物化学杂志]276:6591-6604,2001)。已经描述了单克隆抗体的Fc介导的效应子功能的优化例如提高的ADCC/ADCP功能(参见Strohl,2009,CurrentOpinion in Biotechnology[当前生物技术观点]20:685-691)。可以增强ADCC/ADCP功能的突变包括一个或多个选自以下的突变:G236A、S239D、F243L、P247I、D280H、K290S、R292P、S298A、S298D、S298V、Y300L、V305I、A330L、I332E、E333A、K334A、A339D、A339Q、A339T、和P396L(所有位置通过EU编号)。
还可以修饰Fc区以提高MBM介导ADCC和/或ADCP的能力,例如,通过修饰一个或多个氨基酸以提高MBM对活化受体的亲和力,所述活化受体典型地不识别所述亲本MBM,如FcαRI。这一方法描述于例如,Borrok等人,2015,mAbs.7(4):743-751。
因此,在某些方面,本披露的所述MBM可以包括具有改变的效应子功能(例如但不限于结合至Fc受体,例如FcRn或白细胞受体(例如,如上所述或在7.3.1.1节所述)、结合至补体(例如如上所述或在7.3.1.2节所述)、修饰的二硫键结构(例如如上所述或在7.3.1.3节所述)或改变的糖基化模式(例如如上所述或在7.3.1.4节所述))的Fc结构域。还可以改变Fc结构域以包括改善非对称MBM的可以制造性的修饰,例如通过允许异源二聚化(所述异源二聚化是不同Fc区相对同一Fc区的优先配对)。异源二聚化允许MBM的产生,其中不同ABM通过含有具有不同序列的Fc区的Fc结构域相互连接。异源二聚化策略的实例示例于7.3.1.5节(及其子节)中。
将认识到,可以按任何合适的方式组合7.3.1.1节至7.3.1.5节中所述的任何修饰以实现所希望的功能特性和/或将7.3.1.1节至7.3.1.5节中所述的任何修饰与其他的修饰组合以改变所述MBM的特性。
7.3.1.1.具有改变的FcR结合的Fc结构域
与对应天然免疫球蛋白相比,本披露的MBM(例如TBM)的Fc结构域可以示出改变的与一个或多个Fc受体(FcR)的结合。与任何具体Fc受体的结合可以被提高或降低。在一个实施例中,所述Fc结构域包含一个或多个修饰,所述修饰改变其Fc-受体结合谱。
人细胞可以表达大量膜结合FcR,其选自FcαR、FcεR、FcγR、FcRn和聚糖受体。一些细胞还能够表达可溶性(胞外结构域)FcR(Fridman等人,1993,J Leukocyte Biology[白细胞生物学杂志]54:504-512)。FcγR可以进一步通过IgG结合亲和力(高/低)和生物学作用(活化/抑制)划分。人FcγRI广泛地被认为是唯一的“高亲和力”受体,而所有其他的都被认为是中等至低等。由于其细胞内ITIM基序,FcγRIIb是具有“抑制性”功能性的唯一受体,而由于ITAM基序或与常见FcγR--γ链配对,所有其他的被认为是“活化的”。FcγRIIIb在以下方面也是独特的:尽管是活化的,但它与所述细胞通过GPI锚缔合。总之,人表达六种“标准”FcγR:FcγRI、FcγRIIa、FcγRIIb、FcγRIIc、FcγRIIIa、和FcγRIIIb。除了这些序列,还有大量序列或同种异型变体分散在这些家族中。这些序列中的一些据发现具有重要的功能后果并且因此有时被认为是它们自己的受体亚型。实例包括FcγRIIa
许多细胞类型表达多种类型的FcγR并且因此取决于生物学背景,IgG或抗体免疫复合物结合至携带FcγR的细胞可以具有多种的和复杂的结果。最简单的是,细胞可以接受活化的、抑制性的或混合的信号。这可以导致以下事件,如吞噬作用(例如,巨噬细胞和中性粒细胞)、抗原加工(例如,树突细胞)、减少的IgG产生(例如,B细胞)或脱粒(例如,中性粒细胞、肥大细胞)。有数据支持以下结论:来自FcγRIIb的抑制性信号可以主导活化信号(Proulx,2010,Clinical Immunology[临床免疫学]135:422-429)。
FcRn在维持成人和儿童的血清中的IgG的长期半衰期具有关键的作用。所述受体在酸化囊泡(pH<6.5)中结合IgG,保护IgG分子不被降解,并且然后将其在血液中在7.4的更高pH中释放。
FcRn不同于白细胞Fc受体,并且相反地,具有与MHC I类分子的结构相似性。由β
在一个实施例中,本披露的MBM包含结合至人FcRn的Fc结构域。
在一个实施例中,所述Fc结构域具有(例如一个或两个)Fc区,所述Fc区包含在位置310处,并且在一些情况下,还包含在位置435处的组氨酸残基。这些组氨酸残基对于人FcRn结合是重要的。在一个实施例中,在位置310和435处的组氨酸残基是天然残基,即位置310和435是未经修饰的。可替代地,这些组氨酸残基中的一个或两个可能由于修饰而存在。
本披露的MBM可以包含改变Fc结合至FcRn的一个或多个Fc区。所述改变的结合可以是提高的结合或降低的结合。
在一个实施例中,所述MBM包含Fc结构域,其中至少一个(和任选地两个)Fc区包含一个或多个修饰,使得它与相应的天然免疫球蛋白相比以更高的亲和力和亲合力结合至FcRn。
在一个实施例中,通过用谷氨酰胺残基取代位置250处的苏氨酸残基(T250Q)来修饰所述Fc区。
在一个实施例中,通过用酪氨酸残基取代位置252处的甲硫氨酸残基(M252Y)来修饰所述Fc区。
在一个实施例中,通过用苏氨酸残基取代位置254处的丝氨酸残基(S254T)来修饰所述Fc区。
在一个实施例中,通过用谷氨酸残基取代位置256处的苏氨酸残基(T256E)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置307处的苏氨酸残基(T307A)来修饰所述Fc区。
在一个实施例中,通过用脯氨酸残基取代位置307处的苏氨酸残基(T307P)来修饰所述Fc区。
在一个实施例中,通过用半胱氨酸残基取代位置308处的缬氨酸残基(V308C)来修饰所述Fc区。
在一个实施例中,通过用苯丙氨酸残基取代位置308处的缬氨酸残基(V308F)来修饰所述Fc区。
在一个实施例中,通过用脯氨酸残基取代位置308处的缬氨酸残基(V308P)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置311处的谷氨酰胺残基(Q311A)来修饰所述Fc区。
在一个实施例中,通过用精氨酸残基取代位置311处的谷氨酰胺残基(Q311R)来修饰所述Fc区。
在一个实施例中,通过用亮氨酸残基取代位置428处的甲硫氨酸残基(M428L)来修饰所述Fc区。
在一个实施例中,通过用赖氨酸残基取代位置433处的组氨酸残基(H433K)来修饰所述Fc区。
在一个实施例中,通过用苯丙氨酸残基取代位置434处的天冬酰胺残基(N434F)来修饰所述Fc区。
在一个实施例中,通过用酪氨酸残基取代位置434处的天冬酰胺残基(N434Y)来修饰所述Fc区。
在一个实施例中,通过用酪氨酸残基取代位置252处的甲硫氨酸残基,用苏氨酸残基取代位置254处的丝氨酸残基,和用谷氨酸残基取代位置256处的苏氨酸残基(M252Y/S254T/T256E)来修饰所述Fc区。
在一个实施例中,通过用脯氨酸残基取代位置308处的缬氨酸残基,和用酪氨酸残基取代位置434处的天冬酰胺残基(V308P/N434Y)来修饰所述Fc区。
在一个实施例中,通过用酪氨酸残基取代位置252处的甲硫氨酸残基,用苏氨酸残基取代位置254处的丝氨酸残基,用谷氨酸残基取代位置256处的苏氨酸残基,用赖氨酸残基取代位置433处的组氨酸残基和用苯丙氨酸残基取代位置434处的天冬酰胺残基(M252Y/S254T/T256E/H433K/N434F)来修饰所述Fc区。
将认识到,上述所列的任一修饰可以组合以改变FcRn结合。
在一个实施例中,所述MBM包含Fc结构域,其中一个或两个Fc区包含一个或多个修饰,使得所述Fc结构域与相应的天然免疫球蛋白相比以更低的亲和力和亲合力结合至FcRn。
在一个实施例中,除了在位置310处和/或位置435处的组氨酸,所述Fc区包含任何氨基酸残基。
本披露的MBM可以包含Fc结构域,其中一个或两个Fc区包含提高其与FcγRIIb结合的一个或多个修饰。FcγRIIb是人类中唯一的抑制性受体并且是在B细胞上发现的唯一的Fc受体。
在一个实施例中,通过用天冬氨酸残基取代位置238处的脯氨酸残基(P238D)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置258处的谷氨酸残基(E258A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置267处的丝氨酸残基(S267A)来修饰所述Fc区。
在一个实施例中,通过用谷氨酸残基取代位置267处的丝氨酸残基(S267E)来修饰所述Fc区。
在一个实施例中,通过用苯丙氨酸残基取代位置328处的亮氨酸残基(L328F)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置258处的谷氨酸残基并且用丙氨酸残基取代位置267处的丝氨酸残基(E258A/S267A)来修饰所述Fc区。
在一个实施例中,通过用谷氨酸残基取代位置267处的丝氨酸残基并且用苯丙氨酸残基取代位置328处的亮氨酸残基(S267E/L328F)来修饰所述Fc区。
将认识到,上述所列的任一修饰可以组合以提高FcγRIIb结合。
在一个实施例中,提供了包含Fc结构域的MBM,所述Fc结构域展示出与FcγR降低的结合。
在一个实施例中,MBM包含Fc结构域,其中一个或两个Fc区包含一个或多个降低与FcγR的Fc结合的修饰。
所述Fc结构域可以衍生自IgG1。
在一个实施例中,通过用丙氨酸残基取代位置234处的亮氨酸残基(L234A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置235处的亮氨酸残基(L235A)来修饰所述Fc区。
在一个实施例中,通过用精氨酸残基取代位置236处的甘氨酸残基(G236R)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基(N297A)或谷氨酰胺残基(N297Q)取代位置297处的天冬酰胺残基来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置298处的丝氨酸残基(S298A)来修饰所述Fc区。
在一个实施例中,通过用精氨酸残基取代位置328处的亮氨酸残基(L328R)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置234处的亮氨酸残基并且用丙氨酸残基取代位置235处的亮氨酸残基(L234A/L235A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置234处的苯丙氨酸残基并且用丙氨酸残基取代位置235处的亮氨酸残基(F234A/L235A)来修饰所述Fc区。
在一个实施例中,通过用精氨酸残基取代位置236处的甘氨酸残基并且用精氨酸残基取代位置328处的亮氨酸残基(G236R/L328R)来修饰所述Fc区。
将认识到,上述所列的任一修饰可以组合以降低FcγR结合。
在一个实施例中,MBM包含Fc结构域,其中一个或两个Fc区包含一个或多个修饰,所述修饰降低Fc结合至FcγRIIIa而不影响Fc结合至FcγRII。
在一个实施例中,通过用丙氨酸残基取代位置239处的丝氨酸残基(S239A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置269处的谷氨酸残基(E269A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置293处的谷氨酸残基(E293A)来修饰所述Fc区。
在一个实施例中,通过用苯丙氨酸残基取代位置296处的酪氨酸残基(Y296F)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置303处的缬氨酸残基(V303A)来修饰所述Fc区。
在一个实施例中,通过用甘氨酸残基取代位置327处的丙氨酸残基(A327G)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置338处的赖氨酸残基(K338A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置376处的天冬氨酸残基(D376A)来修饰所述Fc区。
将认识到,上述所列的任一修饰可以组合以降低FcγRIIIa结合。
7.3.1.2.具有改变的补体结合的Fc结构域
本披露的MBM(例如TBM)可以包含Fc结构域,其中一个或两个Fc区包含改变Fc与补体结合的一个或多个修饰。改变的补体结合可以是提高的结合或降低的结合。
在一个实施例中,所述Fc区包含降低其结合至C1q的一个或多个修饰。经典补体途径的引发以将六聚C1q蛋白质与抗原结合的IgG和IgM的CH2结构域结合开始。
在一个实施例中,本披露的MBM包含Fc结构域,其中一个或两个Fc区包含降低Fc与C1q结合的一个或多个修饰。
在一个实施例中,通过用丙氨酸残基取代位置234处的亮氨酸残基(L234A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置235处的亮氨酸残基(L235A)来修饰所述Fc区。
在一个实施例中,通过用谷氨酸残基取代位置235处的亮氨酸残基(L235E)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置237处的甘氨酸残基(G237A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置322处的赖氨酸残基(K322A)来修饰所述Fc区。
在一个实施例中,通过用丙氨酸残基取代位置331处的脯氨酸残基(P331A)来修饰所述Fc区。
在一个实施例中,通过用丝氨酸残基取代位置331处的脯氨酸残基(P331S)来修饰所述Fc区。
在一个实施例中,本披露的MBM包含衍生自IgG4的Fc结构域。IgG4比IgG1具有天然更低的补体活化谱,还具有与FcγR的更弱的结合。因此,在一个实施例中,所述MBM包含IgG4 Fc结构域并且还包含提高FcγR结合的一个或多个修饰。
将认识到,上述所列的任一修饰可以组合以降低C1q结合。
7.3.1.3.具有改变的二硫键结构的Fc结构域
本披露的MBM(例如TBM)可以包括包含一个或多个修饰以产生和/或除去半胱氨酸残基的Fc结构域。通过在单对的多肽单体之间形成二硫桥,半胱氨酸残基在基于Fc的多特异性结合分子的同时装配中具有重要作用。因此,通过改变半胱氨酸残基的数量和/或位置,修饰MBM结构以产生具有改善的治疗特性的蛋白质是可能的。
本披露的MBM可以包含Fc结构域,其中一个或两个Fc区(例如两个Fc区)包含在位置309处的半胱氨酸残基。在一个实施例中,通过修饰来产生在位置309处的半胱氨酸残基,例如,针对衍生自IgG1的Fc结构域,用半胱氨酸残基(L309C)取代在位置309处的亮氨酸残基,针对衍生自IgG2的Fc结构域,用半胱氨酸残基(V309C)取代在位置309处的缬氨酸残基。
在一个实施例中,通过用半胱氨酸残基取代位置308处的缬氨酸残基(V308C)来修饰所述Fc区。
在一个实施例中,通过将核心铰链序列CPPC突变为SPPS来除去铰链区中的两个二硫键。
7.3.1.4.具有改变的糖基化的Fc结构域
在某些方面,提供了具有改善的可制造性的MBM(例如TBM),所述TBM包含比相应的免疫球蛋白更少的糖基化位点。这些蛋白质具有较不复杂的翻译后糖基化模式并且因此对于制造商来说更简单并且花费更少。
在一个实施例中,通过用丙氨酸残基(N297A)或谷氨酰胺残基(N297Q)取代位置297处的天冬酰胺残基来除去CH2结构域中的糖基化位点。除了改善的可制造性,这些糖基化突变体还降低了如上在本文所述的FcγR结合。
在一些实施例中,可以制备如下的MBM,其具有改变的糖基化类型,如具有降低量的岩藻糖基残基的低岩藻糖基化的抗体或具有提高的二等分GlcNac结构的抗体。已经证明此类改变的糖基化模式增加了抗体的ADCC能力。此类碳水化合物修饰可以通过例如在具有改变的糖基化机制的宿主细胞中表达MBM来完成。具有改变的糖基化机制的细胞已在本领域中描述,并且可用作宿主细胞,在所述宿主细胞中表达本披露的MBM,从而产生具有改变的糖基化的MBM。例如,Hang等人的EP1,176,195描述了具有功能破坏的FUT8基因的细胞系,其编码岩藻糖基转移酶,使得在这种细胞系中表达的抗体表现出低岩藻糖基化。Presta在PCT公开WO 03/035835中描述了变体CHO细胞系Lecl3细胞,其将岩藻糖附接至Asn(297)连接的碳水化合物的能力降低,还导致在所述宿主细胞中表达的抗体的低岩藻糖基化(还参见Shields等人,2002,J.Biol.Chem.[生物化学杂志]277:26733-26740)。Umana等人在PCT公开WO 99/54342中描述了如下细胞系,所述细胞系被工程化以表达糖蛋白修饰性糖基转移酶(例如,β(1,4)-N乙酰基葡糖胺基转移酶III(GnTIII)),使得在工程化细胞系中表达的抗体表现出增加的二等分GlcNac结构,所述二等分GlcNac结构导致抗体的ADCC活性增加(还参见Umana等人,Nat.Biotech.[自然生物技术]17:176-180,1999)。
7.3.1.5.Fc异源二聚化
许多多特异性分子形式需要两个Fc区之间的二聚化,不同于天然免疫球蛋白,所述两个Fc区可操作地连接至非同一的抗原结合结构域(或其部分,例如,Fab的VH或VH-CH1)。形成Fc结构域的两个Fc区的不充分的异源二聚化一直是提高所希望的多特异性分子的产生的障碍并且代表了纯化的挑战。本领域可获得的多种方法可以用于增强可能存在于本披露的MBM(例如TBM)中的Fc区的二聚化,例如如在以下所披露的:EP 1870459A1;美国专利号5,582,996;美国专利号5,731,168;美国专利号5,910,573;美国专利号5,932,448;美国专利号6,833,441;美国专利号7,183,076;美国专利申请公开号2006204493A1;和PCT公开号WO 2009/089004A1。
本披露提供了包含Fc异源二聚体的MBM(例如TBM),即包含异源、非同一Fc区的Fc结构域。异源二聚化策略用于增强可操作地连接至不同的ABM(或其部分,例如,Fab的VH或VH-CH1)的Fc区的二聚化并降低可操作地连接至相同ABM或其部分的Fc区的二聚化。典型地,Fc异源二聚体中的每个Fc区包含抗体的CH3结构域。所述CH3结构域衍生自任何同种型、类型或亚类、和在IgG(IgG1、IgG2、IgG3和IgG4)类型的一些情况下的抗体的恒定区,如前述节中所述。
典型地,除了CH3结构域,所述MBM还包含其他抗体片段,如,本文所述的CH1结构域、CH2结构域、铰链结构域、一个或多个VH结构域、一个或多个VL结构域、一个或多个CDR、和/或抗原结合片段。在一些实施例中,所述两个杂多肽是形成双特异性或多特异性分子的两个重链。在CH3结构域处的两个不同的重链的异源二聚化产生了所希望的抗体或抗体样分子,而同一的重链的同型二聚化将降低所希望的抗体或分子的产生。在示例性实施例中,所述两条或更多条杂多肽链包含两条链,所述两条链包含CH3结构域并且形成了本披露以上所述的任何多特异性分子形式的分子。在实施例中,包含CH3结构域的所述两条杂多肽链包含有利于所述多肽的异源二聚体缔合的修饰(相对于未修饰的链)。在下表2和7.3.1.5.1节至7.3.1.5.3节中提供了修饰策略的多种实例。
7.3.1.5.1.杵臼结构(KIH)
本披露的MBM(例如TBM)可以包含一个或多个,例如,多个,对Fc结构域的一个或多个恒定结构域的修饰,例如,对CH3结构域的修饰。在一个实例中,本披露的MBM(例如TBM)包含两个多肽,每个多肽包含抗体的重链恒定结构域,例如,CH2或CH3结构域。在实例中,两个重链恒定结构域,例如,MBM(例如TBM)的CH2或CH3结构域包含一个或多个修饰,所述修饰允许两个链之间的异源二聚体缔合。在一个方面,所述一个或多个修饰布置在两条重链的CH2结构域上。在一个方面,所述一个或多个修饰布置在所述MBM的至少两个多肽的CH3结构域上。在一个方面,对包含重链恒定结构域的MBM的第一多肽的一个或多个修饰可以产生“杵”并且对MBM的第二多肽的一个或多个修饰产生了“臼”,使得包含重链恒定结构域的MBM的多肽的异源二聚化产生了“杵”以与“臼”界面接合(interface)(例如,相互作用,例如,第一多肽的CH2结构域与第二多肽的CH2结构域相互作用,或第一多肽的CH3结构域与第二多肽的CH3结构域相互作用)。如本文所用的术语,“杵”是指至少一个氨基酸侧链,所述氨基酸侧链从包含重链恒定结构域的MBM的第一多肽的界面上突出并且因此可定位于在与包含重链恒定结构域的MBM的第二多肽的界面中的互补性“臼”中以稳定异多聚物,并且从而有利于异多聚物形成(例如相对于同多聚物)。所述杵可以存在于最初的界面中或可以合成引入(例如,通过改变编码所述界面的核酸)。用于形成杵的输入残基通常是天然存在的氨基酸残基并且可以选自精氨酸(R)、苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W)。在一些情况下,选择了色氨酸和酪氨酸。在实施例中,用于形成突起的最初残基具有小侧链容积,例如丙氨酸、天冬酰胺、天冬氨酸、甘氨酸、丝氨酸、苏氨酸或缬氨酸。
“臼”是指至少一个氨基酸侧链,所述氨基酸侧链凹进包含重链恒定结构域的MBM的第二多肽的界面中并且因此容纳包含重链恒定结构域的MBM的第一多肽的相邻交界表面上的相应的杵。所述臼可以存在于最初的界面中或可以合成引入(例如,通过改变编码所述界面的核酸)。用于形成臼的输入残基通常是天然存在的氨基酸残基并且优选地选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)和缬氨酸(V)。在一个实施例中,所述氨基酸残基是丝氨酸、丙氨酸或苏氨酸。在另一个实施例中,用于形成臼的最初的残基具有大的侧链容积,例如酪氨酸、精氨酸、苯丙氨酸或色氨酸。
在实施例中,在残基366、405或407处修饰第一CH3结构域以产生“杵”或“臼”(如上所述),并且在以下处修饰与第一CH3结构域异源二聚体化的第二CH3结构域以产生与第一CH3结构域的“杵”或“臼”互补的“臼”或“杵”:残基407(如果修饰了在第一CH3结构域中的残基366)、残基394(如果修饰了在第一CH3结构域中的残基405)、或残基366(如果修饰了第一CH3结构域中的残基407)。
在另一个实施例中,在残基366处修饰第一CH3结构域,并且在残基366、368和/或407处修饰与第一CH3结构域异源二聚体化的第二CH3结构域,以产生与第一CH3结构域的“杵”或“臼”互补的“臼”或“杵”。在一个实施例中,对第一CH3结构域的修饰在位置366处引入了酪氨酸(Y)残基。在实施例中,对第一CH3的修饰是T366Y。在一个实施例中,对第一CH3结构域的修饰在位置366处引入色氨酸(W)残基。在实施例中,对第一CH3的修饰是T366W。在一些实施例中,对与第一CH3结构域(在位置366处进行了修饰(例如,具有在位置366处引入的酪氨酸(Y)或色氨酸(W),例如,包含修饰T366Y或T366W))异源二聚体化的第二CH3结构域的修饰包含在位置366处的修饰、在位置368处的修饰和在位置407处的修饰。在一些实施例中,在位置366处的修饰引入了丝氨酸(S)残基,在位置368处的修饰引入了丙氨酸(A),并且在位置407处的修饰引入了缬氨酸(V)。在一些实施例中,所述修饰包含T366S、L368A和Y407V。在一个实施例中,多特异性分子的第一CH3结构域包含修饰T366Y,并且与第一CH3结构域异源二聚体化的第二CH3结构域包含修饰T366S、L368A和Y407V,反之亦然。在一个实施例中,多特异性分子的第一CH3结构域包含修饰T366W,并且与第一CH3结构域异源二聚体化的第二CH3结构域包含修饰T366S、L368A和Y407V,反之亦然。
另外的空间或“偏移”(例如杵臼结构)修饰描述于PCT公开号WO 2014/145806(例如,WO 2014/145806的图3、图4和图12)、PCT公开号WO 2014/110601、和PCT公开号WO 2016/086186、WO 2016/086189、WO 2016/086196和WO 2016/182751中。KIH变体的实例包含含有L368D和K370S修饰的第一恒定链,其与包含S364K和E357Q修饰的第二恒定链配对。
适合用于任何本披露的多特异性分子中的另外的杵臼结构修饰对进一步描述于例如,WO 1996/027011、和Merchant等人,1998,Nat.Biotechnol.[自然生物技术],16:677-681中。
在进一步的实施例中,所述CH3结构域可以另外地经修饰以引入一对半胱氨酸残基。不受理论的束缚,据信,引入能够形成二硫键的一对半胱氨酸残基向包含配对的CH3结构域的异源二聚体化MBM(例如TBM)提供了稳定性。在一些实施例中,所述第一CH3结构域包含在位置354处的半胱氨酸,并且与第一CH3结构域异源二聚体化的第二CH3结构域包含在位置349处的半胱氨酸。在一些实施例中,所述第一CH3结构域包含在位置354处的半胱氨酸(例如,包含修饰S354C)和在位置366处的酪氨酸(Y)(例如,包含修饰T366Y),并且与第一CH3结构域异源二聚体化的第二CH3结构域包含在位置349处的半胱氨酸(例如,包含修饰Y349C)、在位置366处的丝氨酸(例如,包含修饰T366S)、在位置368处的丙氨酸(例如,包含修饰L368A)、和在位置407处的缬氨酸(例如,包含修饰Y407V)。在一些实施例中,所述第一CH3结构域包含在位置354处的半胱氨酸(例如,包含修饰S354C)和在位置366处的色氨酸(W)(例如,包含修饰T366W),并且与第一CH3结构域异源二聚体化的第二CH3结构域包含在位置349处的半胱氨酸(例如,包含修饰Y349C)、在位置366处的丝氨酸(例如,包含修饰T366S)、在位置368处的丙氨酸(例如,包含修饰L368A)、和在位置407处的缬氨酸(例如,包含修饰Y407V)。
7.3.1.5.2.可替代的杵臼(Knob and Hole):IgG异源二聚化
可以通过在衍生自IgG1抗体类型的CH3结构域中引入一个或多个修饰来提高包含配对的CH3结构域的MBM(例如TBM)的多肽链的异源二聚化。在实施例中,所述修饰包含对一个CH3结构域的K409R修饰,所述CH3结构域与第二CH3结构域中的F405L修饰配对。另外的修饰还可以,或可替代地,是在位置366、368、370、399、405、407、和409处。在一些情况下,包含此类修饰的多肽的异源二聚化在还原条件下,例如,在25℃-37℃,例如,25℃或37℃下,10-100mM 2-MEA(例如,25、50、或100mM 2-MEA)持续1-10,例如,1.5-5,例如,5小时实现。
本文所述的氨基酸置换可以使用本领域熟知的技术引入CH3结构域中(参见例如,McPherson,编辑,1991,Directed Mutagenesis:a Practical Approach[定向诱变:实用方法];Adelman等人,1983,DNA,2:183)。
所述IgG异源二聚化策略进一步描述于例如,WO 2008/119353、WO 2011/131746、和WO 2013/060867中。
在本节中所述的任一实施例中,所述CH3结构域可以另外地经修饰以引入一对半胱氨酸残基,如7.3.1.5.1节中所述。
7.3.1.5.3.极性桥
可以基于“极性桥”基本原理通过引入修饰来提高包含Fc结构域的MBM(例如TBM)的多肽链的异源二聚化,所述基本原理是将在两条多肽链的结合界面处制造残基以与异源二聚体构型中具有相似(或互补性)物理特性的残基相互作用,同时与同型二聚体构型中具有不同物理特性的残基相互作用。特别地,设计这些修饰从而在异源二聚体形成中,极性残基与极性残基相互作用,而疏水残基与疏水残基相互作用。相比之下,在同型二聚体形成中,修饰残基,从而极性残基与疏水残基相互作用。异源二聚体构型中有利的相互作用和同型二聚体构型中不利的相互作用一起作用使得Fc区形成异源二聚体比形成同型二聚体的可能性更大。
在示例性实施例中,上述修饰在CH3结构域的残基364、368、399、405、409、和411中的一个或多个位置处产生。
在一些实施例中,将选自由S364L、T366V、L368Q、N399K、F405S、K409F和R411K组成的组的一个或多个修饰引入两个CH3结构域之一中。可以将选自由Y407F、K409Q和T411N组成的组的一个或多个修饰引入第二CH3结构域中。
在另一个实施例中,将选自由S364L、T366V、L368Q、D399K、F405S、K409F和T411K组成的组的一个或多个修饰引入到一个CH3结构域中,而将选自由Y407F、K409Q和T411D组成的组的一个或多个修饰引入到第二CH3结构域中。
在一个示例性实施例中,一个CH3结构域的位置366处的苏氨酸的最初残基被缬氨酸置换,而另一个CH3结构域的位置407处的酪氨酸的最初残基被苯丙氨酸置换。
在另一个示例性实施例中,一个CH3结构域的位置364处的丝氨酸的最初残基被亮氨酸置换,而在相同CH3结构域的位置368处的亮氨酸的最初残基被谷氨酰胺置换。
在又另一个示例性实施例中,一个CH3结构域的位置405处的苯丙氨酸的最初残基被丝氨酸置换并且这一CH3结构域的位置409处的赖氨酸的最初残基被苯丙氨酸置换,而另一CH3结构域的位置409处的赖氨酸的最初残基被谷氨酰胺置换。
在又另一个示例性实施例中,一个CH3结构域的位置399处的天冬氨酸的最初残基被赖氨酸置换,并且相同CH3结构域的位置411处的苏氨酸的最初残基被赖氨酸置换,而另一CH3结构域的位置411处的苏氨酸的最初残基被天冬氨酸置换。
本文所述的氨基酸置换可以使用本领域熟知的技术引入CH3结构域中(参见例如,McPherson,编辑,1991,Directed Mutagenesis:a Practical Approach[定向诱变:实用方法];Adelman等人,1983,DNA,2:183)。所述极性桥策略描述于,例如,WO 2006/106905、WO2009/089004和K.Gunasekaran等人,(2010),JBC 285:19637-19646中。
另外的极性桥修饰描述于,例如,PCT公开号WO 2014/145806(例如,WO 2014/145806的图6),PCT公开号WO 2014/110601,和PCT公开号WO 2016/086186、WO 2016/086189、WO 2016/086196和WO 2016/182751中。极性桥变体的实例包含含有N208D、Q295E、N384D、Q418E和N421D修饰的恒定链。
在本文所述的任何实施例中,所述CH3结构域可以另外地经修饰以引入一对半胱氨酸残基,如7.3.1.5.1节中所述。
用于增强异源二聚化的另外的策略描述于,例如,WO 2016/105450、WO 2016/086186、WO 2016/086189、WO 2016/086196、WO 2016/141378、和WO 2014/145806、和WO2014/110601中。任何所述策略均可以用于本文所述的MBM。
7.3.2.铰链区
本披露的MBM(例如TBM)还可以包含铰链区,例如将抗原结合模块连接至Fc区的铰链区。所述铰链区可以是天然的或经修饰的铰链区。铰链区典型地发现于Fc区的N-末端。
天然铰链区是在天然存在的抗体中的Fab和Fc结构域之间通常可发现的铰链区。经修饰的铰链区是与天然铰链区在长度和/或组成上有差异的任何铰链。此类铰链可以包括来自其他物种的铰链区,例如人、小鼠、大鼠、兔、鲨鱼、猪、仓鼠、骆驼、羊驼或山羊铰链区。其他经修饰的铰链区可以包含衍生自来自与所述重链Fc区不同类型或亚类的抗体的完整铰链区。可替代地,所述经修饰的铰链区可以包含天然铰链或重复单元的部分,其中重复中的每个单元衍生自天然铰链区。在进一步的替代方案中,可以通过将一个或多个半胱氨酸或其他残基转化为中性残基,如丝氨酸或丙氨酸,或通过将合适放置的残基转化为半胱氨酸残基来改变所述天然铰链区。通过此类方式,可以提高或降低铰链区中半胱氨酸残基的数量。该方法在Bodmer等人的美国专利号5,677,425中进一步描述。改变铰链区中半胱氨酸残基的数量可以例如,促进轻链和重链的装配,或者提高或降低MBM的稳定性。其他经修饰的铰链区可以完全是合成的并且可以被设计以具有所希望的特性如长度、半胱氨酸组成和柔性。
以下文献中描述了许多经修饰的铰链区:例如,于美国专利号5,677,425、WO9915549、WO 2005003170、WO 2005003169、WO 2005003170、WO 9825971和WO 2005003171中。
合适的铰链序列的实例示出于表3中。
在一个实施例中,所述重链Fc区在其N-末端处具有完整的铰链区。
在一个实施例中,所述重链Fc区和铰链区衍生自IgG4并且所述铰链区包含经修饰的序列CPPC(SEQ ID NO:9)。与含有序列CPPC(SEQ ID NO:729)的IgG1相比,人IgG4的核心铰链区含有序列CPSC(SEQ ID NO:728)。存在于IgG4序列中的丝氨酸残基导致在这一区域中的柔性提高,并且因此一部分分子在相同蛋白质链中形成二硫键(链内二硫键)而不是桥接至IgG分子中的其他重链上以形成链间二硫键。(Angel等人,1993,Mol lmmunol[分子免疫学]30(1):105-108)。将丝氨酸残基改变为脯氨酸以给出与IgG1相同的核心序列允许链间二硫键在IgG4铰链区中完全形成,因此降低了纯化的产物中的异质性。这一改变的同种型被命名为IgG4P。
7.3.3.ABM接头
在某些方面,本披露提供了包含至少三个AMB的MBM(例如TBM),其中ABM的两个或更多个组分(例如,scFv的VH和VL)、两个或更多个ABM、或ABM和非ABM结构域(例如,二聚化结构域,如Fc区)通过肽接头互相连接。此类接头在本文中被称为“ABM接头”,与如在例如7.8.2节中所述的用于附接药物至MBM的ADC接头不同。
肽接头的范围可以是2个氨基酸至60个或更多个氨基酸,并且在某些方面,肽接头的范围是3个氨基酸至50个氨基酸、4至30个氨基酸、5至25个氨基酸、10至25个氨基酸或12至20个氨基酸。在具体的实施例中,肽接头的长度是2个氨基酸、3个氨基酸、4个氨基酸、5个氨基酸、6个氨基酸、7个氨基酸、8个氨基酸、9个氨基酸、10个氨基酸、11个氨基酸、12个氨基酸、13个氨基酸、14个氨基酸、15个氨基酸、16个氨基酸、17个氨基酸、18个氨基酸、19个氨基酸、20个氨基酸、21个氨基酸、22个氨基酸、23个氨基酸、24个氨基酸、25个氨基酸、26个氨基酸、27个氨基酸、28个氨基酸、29个氨基酸、30个氨基酸、31个氨基酸、32个氨基酸、33个氨基酸、34个氨基酸、35个氨基酸、36个氨基酸、37个氨基酸、38个氨基酸、39个氨基酸、40个氨基酸、41个氨基酸、42个氨基酸、43个氨基酸、44个氨基酸、45个氨基酸、46个氨基酸、47个氨基酸、48个氨基酸、49个氨基酸、或50个氨基酸。
可以使用带电荷的和/或柔性接头。
可以用于本披露的MBM的柔性ABM接头的实例包括如下中所披露的那些:Chen等人,2013,Adv Drug Deliv Rev.[先进药物递送综述]65(10):1357-1369和Klein等人,2014,Protein Engineering,Design&Selection[蛋白质工程化、设计和选择]27(10):325-330。特别有用的柔性接头是(GGGGS)n(也称为(G4S)n)(SEQ ID NO:44)。在一些实施例中,n是1和10之间的任何数字,即,1、2、3、4、5、6、7、8、9、和10,或以上述数字中的任意两个为端点的任何范围,例如,1至5、2至5、3至6、2至4、1至4等。
用于本披露的MBM的合适的ABM接头的其他实例示出于下表4中:
在各个方面,本披露提供了包含一个或多个ABM接头的MBM(例如TBM)。ABM接头中的每一个的长度范围可以是2个氨基酸至60个氨基酸,例如,4至30个氨基酸,5至25个氨基酸,10至25个氨基酸或12至20个氨基酸,任选地选自上述表4。在具体的实施例中,所述MBM包含两个、三个、四个、五个或六个ABM接头。所述ABM接头可以位于所述MBM的一条、两条、三条、四条或甚至更多条多肽链上。
7.4.示例性三特异性结合分子
示例性TBM构型示出于图1中。图1A示出了图1B-1U中所示TBM构型的组分。scFv、Fab、基于非免疫球蛋白的ABM、和Fc各自可以具有针对7.2节和7.3节中的这些组分所述的特征。图1示出的TBM构型的组分可以通过7.2节和7.3节中所述的任何方法(例如,通过直接键、ABM接头、二硫键、用杵臼结构相互作用修饰的Fc结构域等)彼此缔和。图1中示出的多种组分的方向和缔和仅仅为示例性的;如本领域技术人员将理解的,其他方向和缔合可以是合适的(例如,如7.2节和7.3节中所述)。
本披露的TBM不限于图1中所示的构型。可以使用的其他构型是本领域技术人员已知的。参见例如,WO 2014/145806;WO 2017/124002;Liu等人,2017,Front Immunol.[免疫学前沿]8:38;Brinkmann&Kontermann,2017,mAbs 9:2,182-212;US 2016/0355600;Klein等人,2016,MAbs 8(6):1010-20;和US 2017/0145116。
7.4.1.示例性三价TBM
本披露的TBM可以是三价的,即,它们具有三个抗原结合结构域,其中的每一个结合TAA 1、TAA 2、或TCR复合物的组分。
示例性三价TBM构型示出于图1B至1O中。
如图1B-1K中所描绘,TBM可以包含两个半抗体,其中一个包含两个ABM并且另一个包含一个ABM,所述两个半抗体通过Fc结构域配对。
在图1B的实施例中,所述第一(或左)半抗体包含scFv和Fc区,并且所述第二(或右)半抗体包含Fab、scFv和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1C的实施例中,所述第一(或左)半抗体包含两个Fab和Fc区,并且所述第二(或右)半抗体包含Fab和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1D的实施例中,所述第一(或左)半抗体包含Fab、scFv和Fc区,并且所述第二(或右)半抗体包含Fab和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1E的实施例中,所述第一(或左)半抗体包含scFv和Fc区,并且所述第二(或右)半抗体包含两个Fab和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1F的实施例中,所述第一(或左)半抗体包含scFv、Fc区、和Fab,并且所述第二(或右)半抗体包含Fab和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1G的实施例中,所述第一(或左)半抗体包含scFv和Fc区,并且所述第二(或右)半抗体包含Fab、Fc区、和scFV。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1H的实施例中,所述第一(或左)半抗体包含两个Fab和Fc区,并且所述第二(或右)半抗体包含基于非免疫球蛋白的ABM和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1I的实施例中,所述第一(或左)半抗体包含Fab、scFv、和Fc区,并且所述第二(或右)半抗体包含基于非免疫球蛋白的ABM和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1J的实施例中,所述第一(或左)半抗体包含Fab和Fc区,并且所述第二(或右)半抗体包含scFv、基于非免疫球蛋白的ABM和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1K的实施例中,所述第一(或左)半抗体包含scFv和Fc区,并且所述第二(或右)半抗体包含scFv、Fc区、和第二scFv。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1N的实施例中,所述第一(或左)半抗体包含Fab、Fc区、和scFv,并且所述第二(或右)半抗体包含Fab、和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1O的实施例中,所述第一(或左)半抗体包含Fab、Fc区、和scFab,并且所述第二(或右)半抗体包含Fab和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
可替代地,如图1L所描绘,三价TBM可以包含两个半抗体,其中每个包含一个完整的ABM和另一个ABM的一部分(一个是VH,另一个是VL)。所述两个半抗体通过Fc结构域配对,因此VH和VL缔和以形成完整的抗原结合Fv结构域。
所述TBM可以是单链,如图1M所示。图1M的TBM包含通过接头连接的三个scFv结构域。
在图1B-1O中所示的每种构型中,被指定为X、Y和Z的每个结构域代表TCR ABM、TAA1 ABM、或TAA 2 ABM,尽管不一定按该顺序。换句话说,X可以是TCR ABM、TAA 1 ABM、或TAA2 ABM,Y可以是TCR ABM、TAA 1 ABM、或TAA 2 ABM,并且Z可以是TAA 1ABM、TCR ABM、或TAA2 ABM,其条件是所述TBM包含至少一个TCR ABM、至少一个TAA 1 ABM、和至少一个TAA 2ABM。
因此,在本披露中提供了如图1B至1O中任一个所示的三价TBM,其中X是TAA 1ABM,Y是TCR ABM并且Z是TAA 2 ABM(为了方便起见,ABM的这一构型被指定为“T1”)。
本披露还提供了如图1B至1O中任一个所示的三价TBM,其中X是TAA 1 ABM,Y是TAA2 ABM,并且Z是TCR ABM(为了方便起见,ABM的这一构型被指定为“T2”)。
本披露进一步提供了如图1B至1O中任一个所示的三价TBM,其中X是TCR ABM,Y是TAA 1 ABM,并且Z是TAA 2 ABM(为了方便起见,ABM的这一构型被指定为“T3”)。
本披露又进一步提供了如图1B至1O中任一个所示的三价TBM,其中X是TCR ABM,Y是TAA 2 ABM,并且Z是TAA 1 ABM(为了方便起见,ABM的这一构型被指定为“T4”)。
本披露又进一步提供了如图1B至1O中任一个所示的三价TBM,其中X是TAA 2 ABM,Y是TAA 1 ABM,并且Z是TCR ABM(为了方便起见,ABM的这一构型被指定为“T5”)。
本披露又进一步提供了如图1B至1O中任一个所示的三价TBM,其中X是TAA 2 ABM,Y是TCR ABM,并且Z是TAA 1 ABM(为了方便起见,ABM的这一构型被指定为“T6”)。
7.4.2.示例性四价TBM
本披露的TBM可以是四价的,即,它们具有四个抗原结合结构域,其中一个或两个结合TAA 1,其中一个或两个结合TAA 2,并且其中一个或两个结合TCR复合物的组分。
示例性四价TBM构型示出于图1P-1R中。
如图1P-1R所描绘的,四价TBM可以包含两个半抗体,其中每个包含两个完整的ABM,所述两个半抗体通过Fc结构域配对。
在图1P的实施例中,所述第一(或左)半抗体包含Fab、Fc区、和第二Fab,并且所述第二(或右)半抗体包含Fab、Fc区、和第二Fab。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1Q的实施例中,所述第一(或左)半抗体包含Fab、Fc区、和scFv,并且所述第二(或右)半抗体包含Fab、Fc区、和scFv。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1R的实施例中,所述第一(或左)半抗体包含Fab、Fc区、和scFv,并且所述第二(或右)半抗体包含scFv、Fc区、和Fab。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1P-1R所示的构型中,X、Y、Z、和A中的每一个代表TCR ABM、TAA 1 ABM、或TAA2 ABM尽管不必须以这样的顺序),并且其条件是所述TBM包含至少一个TCR ABM、一个TAA 1ABM、和一个TAA 2 ABM。因此,本披露的四价ABM将包括针对TAA 1、TAA 2、和TCR复合物的组分之一的两个ABM。在一些情况下,四价TBM具有两个TAA 1或TAA 2 ABM。
因此,在本披露中提供了如图1P-1R中任一个所示的四价TBM,其中X、Y、Z、和A是针对TAA 1、TAA 2和TCR复合物的组分的ABM,如表5所示。
7.4.3.示例性五价TBM
本披露的TBM可以是五价的,即,它们具有五个抗原结合结构域,其中一个、两个、或三个结合TAA 1,其中一个、两个、或三个结合TAA2,并且其中一个、两个或三个结合TCR复合物的组分。
示例性五价TBM构型示出于图1S中。
如图1S中所描绘,五价TBM可以包含两个半抗体,其中一个包含两个完整的ABM并且另一个包含一个完整的ABM,所述两个半抗体通过Fc结构域配对。
在图1S的实施例中,所述第一(或左)半抗体包含Fab、scFv和Fc区,并且所述第二(或右)半抗体包含Fab、Fc区、和scFv。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1S所示的构型中,X、Y、Z、A和B中的每一个代表TCR ABM、TAA 1 ABM、或TAA 2ABM(尽管不必须以这样的顺序),并且其条件是所述TBM包含至少一个TCR ABM、一个TAA 1ABM、和一个TAA2 ABM。因此,本披露的五价TBM可以包括针对TAA 1、TAA 2、和TCR复合物的组分中的两个的两个ABM,或针对TAA 1、TAA 2、和TCR复合物的组分之一的三个ABM。在一些情况下,五价TBM具有两个或三个TAA 1或TAA 2 ABM。在具体的实施例中,五价TBM具有三个TAA 1 ABM、一个TAA 2 ABM和一个TCR ABM。在另一个实施例中,五价TBM具有两个TAA 1ABM、两个TAA 2 ABM、和一个TCR ABM。
因此,本披露提供了如图1S所示的五价TBM,其中X、Y、Z、A、和B是针对TAA 1、TAA 2和TCR复合物的组分的ABM,如表6所示。
7.4.4.示例性六价TBM
本披露的TBM可以是六价的,即,它们具有六个抗原结合结构域,其中一个、两个、三个、或四个结合TAA 1,其中一个、两个、三个、或四个结合TAA 2,并且其中一个、两个、三个、或四个结合TCR复合物的组分。
示例性六价TBM构型示出于图1T-1U中。
如图1T-1U中所描绘,五价TBM可以包含两个半抗体,其中一个包含两个完整的ABM并且另一个包含一个完整的ABM,所述两个半抗体通过Fc结构域配对。
在图1T的实施例中,所述第一(或左)半抗体包含Fab、第二Fab、Fc区、和scFv,并且所述第二(或右)半抗体包含Fab、第二Fab、Fc区、和scFv。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1U的实施例中,所述第一(或左)半抗体包含第一Fv、第二Fv、第三Fv、和Fc区,并且所述第二(或右)半抗体包含第一Fv、第二Fv、第三Fv、和Fc区。所述第一和第二半抗体通过形成Fc结构域的Fc区缔和。
在图1T-1U所示的构型中,X、Y、Z、A、B、和C中的每一个代表TCR ABM、TAA 1 ABM、或TAA 2 ABM(尽管不必须以这样的顺序),并且其条件是所述TBM包含至少一个TCR ABM、一个TAA 1ABM、和一个TAA 2 ABM。因此,本披露的五价TBM可以包括(i)针对TAA 1、TAA 2、和TCR复合物的组分之一的两个ABM,(ii)针对TAA 1、TAA 2、和TCR复合物的组分之一的三个ABM,或(iii)针对TAA 1、TAA 2、和TCR复合物的组分之一的四个ABM。例如,六价ABM可以包括针对TAA 1的三个ABM、针对TAA 2的两个ABM以及针对TCR复合物的组分的一个ABM。又如,六价ABM可以包括针对TAA 1的三个ABM、针对TCR复合物的组分的两个ABM以及针对TAA2的一个ABM。在一些情况下,六价TBM具有两个、三个、或者四个TAA 1或TAA 2 ABM。在具体的实施例中,六价TBM具有三个TAA 1或TAA 2 ABM。在其他实施例中,六价TBM具有四个TAA 1或TAA2ABM。
因此,在本披露中提供了如图1T-1U中任一个所示的六价TBM,其中X、Y、Z、A、B、和C是针对TAA 1、TAA 2和TCR复合物的组分的ABM,如表7所示。
7.5.TCR ABM
本披露的MBM(例如TBM)含有特异性结合至TCR复合物的组分的ABM。所述TCR是二硫键连接的膜锚定异源二聚体蛋白,其通常由作为与不变CD3链分子的复合物的部分表达的高可变α和β链组成。表达这一受体的T细胞被称为α:β(或αβ)T细胞,尽管少数T细胞(称为γδT细胞)表达替代的受体(由可变γ和δ链形成)。
在实施例中,本披露的MBM含有特异性结合至CD3的ABM。
7.5.1.CD3 ABM
本披露的MBM(例如TBM)可以含有特异性结合至CD3的ABM。所述术语“CD3”是指T细胞受体的分化簇3共受体(或共受体复合物、或共受体复合物的多肽链)。NCBI登录P04234、P07766和P09693中提供了人CD3的多肽链的氨基酸序列。CD3蛋白质还可以包括变体。CD3蛋白质还可以包括片段。CD3蛋白质还包括CD3氨基酸序列的翻译后修饰。翻译后修饰包括但不限于N-连接的和O-连接的糖基化。
在一些实施例中,本披露的MBM(例如TBM)可以包含ABM,所述ABM是抗CD3抗体(例如,如在US 2016/0355600、WO 2014/110601、和WO 2014/145806中所述的)或其抗原结合结构域。表8A中提供了可以在本披露的MBM(例如TBM)中使用的示例性抗CD3 VH、VL、和scFV序列。
如由卡巴特编号方案(卡巴特等人,1991,Sequences of Proteins ofImmunological Interest[具有免疫学重要性的蛋白质序列],第5版,公共卫生事业部,美国国立卫生研究院,马里兰州贝塞斯达市)、乔西亚编号方案(Al-Lazikani等人,1997,J.Mol.Biol[分子生物学杂志]273:927-948),以及卡巴特和乔西亚编号的组合定义的许多CD3结合物的CDR序列分别在表8B-8D中提供。
在一些实施例中,本披露的MBM(例如TBM)可以包含CD3 ABM,所述CD3 ABM包含如由卡巴特编号定义的CD3-1至CD3-128中任一项的CDR(例如,如在表8B中所列出)。在其他实施例中,本披露的MBM(例如TBM)可以包含CD3 ABM,所述CD3 ABM包含如通过乔西亚编号定义的CD3-1至CD3-128中任一项的CDR(例如,如在表8C中所列出)。在又其他实施例中,本披露的MBM(例如TBM)可以包含CD3 ABM,所述CD3 ABM包含如由卡巴特和乔西亚编号的组合定义的CD3-1至CD3-128中任一项的CDR(例如,如在表8D中所列出)。
在一些实施例中,CD3 ABM包含CD3-1的CDR序列。在一些实施例中,CD3 ABM包含CD3-2的CDR序列。在一些实施例中,CD3 ABM包含CD3-3的CDR序列。在一些实施例中,CD3ABM包含CD3-4的CDR序列。在一些实施例中,CD3 ABM包含CD3-5的CDR序列。在一些实施例中,CD3 ABM包含CD3-6的CDR序列。在一些实施例中,CD3 ABM包含CD3-7的CDR序列。在一些实施例中,CD3 ABM包含CD3-8的CDR序列。在一些实施例中,CD3 ABM包含CD3-9的CDR序列。在一些实施例中,CD3 ABM包含CD3-10的CDR序列。在一些实施例中,CD3 ABM包含CD3-11的CDR序列。在一些实施例中,CD3ABM包含CD3-12的CDR序列。在一些实施例中,CD3 ABM包含CD3-13的CDR序列。在一些实施例中,CD3 ABM包含CD3-14的CDR序列。在一些实施例中,CD3ABM包含CD3-15的CDR序列。在一些实施例中,CD3 ABM包含CD3-16的CDR序列。在一些实施例中,CD3 ABM包含CD3-17的CDR序列。在一些实施例中,CD3 ABM包含CD3-18的CDR序列。在一些实施例中,CD3 ABM包含CD3-19的CDR序列。在一些实施例中,CD3 ABM包含CD3-20的CDR序列。在一些实施例中,CD3 ABM包含CD3-21的CDR序列。在一些实施例中,CD3 ABM包含CD3-22的CDR序列。在一些实施例中,CD3 ABM包含CD3-23的CDR序列。在一些实施例中,CD3 ABM包含CD3-24的CDR序列。在一些实施例中,CD3 ABM包含CD3-25的CDR序列。在一些实施例中,CD3 ABM包含CD3-26的CDR序列。在一些实施例中,CD3 ABM包含CD3-27的CDR序列。在一些实施例中,CD3 ABM包含CD3-28的CDR序列。在一些实施例中,CD3 ABM包含CD3-29的CDR序列。在一些实施例中,CD3 ABM包含CD3-30的CDR序列。在一些实施例中,CD3 ABM包含CD3-31的CDR序列。在一些实施例中,CD3 ABM包含CD3-32的CDR序列。在一些实施例中,CD3 ABM包含CD3-33的CDR序列。在一些实施例中,CD3 ABM包含CD3-34的CDR序列。在一些实施例中,CD3ABM包含CD3-35的CDR序列。在一些实施例中,CD3 ABM包含CD3-36的CDR序列。在一些实施例中,CD3 ABM包含CD3-37的CDR序列。在一些实施例中,CD3 ABM包含CD3-38的CDR序列。在一些实施例中,CD3 ABM包含CD3-39的CDR序列。在一些实施例中,CD3 ABM包含CD3-40的CDR序列。在一些实施例中,CD3 ABM包含CD3-41的CDR序列。在一些实施例中,CD3 ABM包含CD3-42的CDR序列。在一些实施例中,CD3 ABM包含CD3-43的CDR序列。在一些实施例中,CD3 ABM包含CD3-44的CDR序列。在一些实施例中,CD3 ABM包含CD3-45的CDR序列。在一些实施例中,CD3 ABM包含CD3-46的CDR序列。在一些实施例中,CD3 ABM包含CD3-47的CDR序列。在一些实施例中,CD3 ABM包含CD3-48的CDR序列。在一些实施例中,CD3 ABM包含CD3-49的CDR序列。在一些实施例中,CD3 ABM包含CD3-50的CDR序列。在一些实施例中,CD3 ABM包含CD3-51的CDR序列。在一些实施例中,CD3 ABM包含CD3-52的CDR序列。在一些实施例中,CD3 ABM包含CD3-53的CDR序列。在一些实施例中,CD3 ABM包含CD3-54的CDR序列。在一些实施例中,CD3ABM包含CD3-55的CDR序列。在一些实施例中,CD3 ABM包含CD3-56的CDR序列。在一些实施例中,CD3 ABM包含CD3-57的CDR序列。在一些实施例中,CD3 ABM包含CD3-58的CDR序列。在一些实施例中,CD3 ABM包含CD3-59的CDR序列。在一些实施例中,CD3 ABM包含CD3-60的CDR序列。在一些实施例中,CD3 ABM包含CD3-61的CDR序列。在一些实施例中,CD3 ABM包含CD3-62的CDR序列。在一些实施例中,CD3 ABM包含CD3-63的CDR序列。在一些实施例中,CD3 ABM包含CD3-64的CDR序列。在一些实施例中,CD3 ABM包含CD3-65的CDR序列。在一些实施例中,CD3 ABM包含CD3-66的CDR序列。在一些实施例中,CD3 ABM包含CD3-67的CDR序列。在一些实施例中,CD3 ABM包含CD3-68的CDR序列。在一些实施例中,CD3 ABM包含CD3-69的CDR序列。在一些实施例中,CD3 ABM包含CD3-70的CDR序列。在一些实施例中,CD3 ABM包含CD3-71的CDR序列。在一些实施例中,CD3 ABM包含CD3-72的CDR序列。在一些实施例中,CD3 ABM包含CD3-73的CDR序列。在一些实施例中,CD3 ABM包含CD3-74的CDR序列。在一些实施例中,CD3ABM包含CD3-75的CDR序列。在一些实施例中,CD3 ABM包含CD3-76的CDR序列。在一些实施例中,CD3 ABM包含CD3-77的CDR序列。在一些实施例中,CD3 ABM包含CD3-78的CDR序列。在一些实施例中,CD3 ABM包含CD3-79的CDR序列。在一些实施例中,CD3 ABM包含CD3-80的CDR序列。在一些实施例中,CD3 ABM包含CD3-81的CDR序列。在一些实施例中,CD3 ABM包含CD3-82的CDR序列。在一些实施例中,CD3 ABM包含CD3-83的CDR序列。在一些实施例中,CD3 ABM包含CD3-84的CDR序列。在一些实施例中,CD3 ABM包含CD3-85的CDR序列。在一些实施例中,CD3 ABM包含CD3-86的CDR序列。在一些实施例中,CD3 ABM包含CD3-87的CDR序列。在一些实施例中,CD3 ABM包含CD3-88的CDR序列。在一些实施例中,CD3 ABM包含CD3-89的CDR序列。在一些实施例中,CD3 ABM包含CD3-90的CDR序列。在一些实施例中,CD3 ABM包含CD3-91的CDR序列。在一些实施例中,CD3 ABM包含CD3-92的CDR序列。在一些实施例中,CD3 ABM包含CD3-93的CDR序列。在一些实施例中,CD3 ABM包含CD3-94的CDR序列。在一些实施例中,CD3ABM包含CD3-95的CDR序列。在一些实施例中,CD3 ABM包含CD3-96的CDR序列。在一些实施例中,CD3 ABM包含CD3-97的CDR序列。在一些实施例中,CD3 ABM包含CD3-98的CDR序列。在一些实施例中,CD3 ABM包含CD3-99的CDR序列。在一些实施例中,CD3 ABM包含CD3-100的CDR序列。在一些实施例中,CD3 ABM包含CD3-101的CDR序列。在一些实施例中,CD3 ABM包含CD3-102的CDR序列。在一些实施例中,CD3 ABM包含CD3-103的CDR序列。在一些实施例中,CD3 ABM包含CD3-104的CDR序列。在一些实施例中,CD3 ABM包含CD3-105的CDR序列。在一些实施例中,CD3 ABM包含CD3-106的CDR序列。在一些实施例中,CD3 ABM包含CD3-107的CDR序列。在一些实施例中,CD3 ABM包含CD3-108的CDR序列。在一些实施例中,CD3 ABM包含CD3-109的CDR序列。在一些实施例中,CD3 ABM包含CD3-110的CDR序列。在一些实施例中,CD3ABM包含CD3-111的CDR序列。在一些实施例中,CD3 ABM包含CD3-112的CDR序列。在一些实施例中,CD3 ABM包含CD3-113的CDR序列。在一些实施例中,CD3 ABM包含CD3-114的CDR序列。在一些实施例中,CD3 ABM包含CD3-115的CDR序列。在一些实施例中,CD3 ABM包含CD3-116的CDR序列。在一些实施例中,CD3 ABM包含CD3-117的CDR序列。在一些实施例中,CD3 ABM包含CD3-118的CDR序列。在一些实施例中,CD3 ABM包含CD3-119的CDR序列。在一些实施例中,CD3 ABM包含CD3-120的CDR序列。在一些实施例中,CD3 ABM包含CD3-121的CDR序列。在一些实施例中,CD3 ABM包含CD3-122的CDR序列。在一些实施例中,CD3 ABM包含CD3-123的CDR序列。在一些实施例中,CD3 ABM包含CD3-124的CDR序列。在一些实施例中,CD3 ABM包含CD3-125的CDR序列。在一些实施例中,CD3 ABM包含CD3-126的CDR序列。在一些实施例中,CD3ABM包含CD3-127的CDR序列。在一些实施例中,CD3 ABM包含CD3-128的CDR序列。
本披露的MBM(例如TBM)可以包含CD3-1至CD3-128中任一项的完整重和轻可变序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-1的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-1的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-2的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-3的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-4的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-5的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-6的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-7的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-8的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-9的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-10的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-11的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-12的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-13的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-14的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-15的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-16的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-17的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-18的VH和VL序列。在一些实施例中,本披露的MBM包含CD3ABM,其包含CD3-19的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-20的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-21的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-22的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-23的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-24的VH和VL序列。在一些实施例中,本披露的MBM包含CD3ABM,其包含CD3-25的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-26的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-27的VH和VL序列。在一些实施例中,本披露的MBM包含CD3 ABM,其包含CD3-28的VH和VL序列。
7.5.2.TCR-α/βABM
本披露的MBM(例如TBM)可以含有特异性结合至TCR-α链、TCR-β链、或TCR-αβ二聚体的ABM。示例性抗TCR-α/β抗体是本领域已知的(参见例如,US 2012/0034221;Borst等人,1990,Hum Immunol.[人类免疫学]29(3):175-88(描述了抗体BMA031))。表9中提供了抗体BMA031的VH、VL、和卡巴特CDR序列。
在实施例中,TCR ABM可以包含抗体BMA031的CDR序列。在其他实施例中,TCR ABM可以包含抗体BMA031的VH和VL序列。
7.5.3.TCR-γ/δABM
本披露的MBM(例如TBM)可以含有特异性结合至TCR-γ链、TCR-δ链、或TCR-γδ二聚体的ABM。示例性抗TCR-γ/δ抗体是本领域已知的(参见例如,美国专利号5,980,892(描述了δTCS1,其通过以登录号HB 9578保藏于ATCC的杂交瘤产生))。
7.6.TAA 1和TAA 2 ABM
本披露的MBM(例如TBM)包含特异性结合在癌性B细胞上表达的不同肿瘤相关抗原(TAA,其中第一TAA称为TAA 1并且第二TAA称为TAA 2)的至少两个ABM。在一些情况下,每个TAA是人TAA。所述抗原可能存在或不存在于正常细胞上。在某些实施例中,与正常B细胞相比,所述TAA在癌性B细胞上表达或上调。在其他实施例中,所述TAA是B细胞谱系标记物。每个TAA可以在相同癌性B细胞上表达或可以在不同癌性B细胞上表达。
预期任何类型的B细胞恶性肿瘤都可以被本披露的MBM靶向。可以被靶向的典型类型的B细胞恶性肿瘤包括霍奇金淋巴瘤、非霍奇金淋巴瘤(NHL)、和多发性骨髓瘤。NHL的实例包括弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤、慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤、伯基特淋巴瘤、淋巴浆细胞性淋巴瘤(瓦尔登斯特伦巨球蛋白血症)、毛细胞白血病、原发性中枢神经系统(CNS)淋巴瘤、原发性纵隔大B细胞淋巴瘤、纵隔灰区淋巴瘤(MGZL)、脾边缘区B细胞淋巴瘤、MALT的结外边缘区B细胞淋巴瘤、结节边缘区B细胞淋巴瘤、和原发性渗出性淋巴瘤。
可以被本披露的MBM(例如TBM)靶向的TAA的实例包括CD19、CD20、CD22、CD123、BCMA、CD33、CLL1、CD138(也称为Syndecan-1、SDC1)、CS1、CD38、CD133、FLT3、CD52、TNFRSF13C(TNF受体超家族成员13C,在本领域中也称为BAFFR:B细胞活化因子受体)、TNFRSF13B(TNF受体超家族成员13B,在本领域中也称为TACI:跨膜活化因子和CAML交互因子)、CXCR4(C-X-C基序趋化因子受体4)、PD-L1(程序性死亡配体1)、LY9(淋巴细胞抗原9,在本领域中也称为CD229)、CD200、FCGR2B(IgG受体IIb的Fc片段,在本领域中也称为CD32b)、CD21、CD23、CD24、CD40L、CD72、CD79a、和CD79b。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD20(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD22(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD123(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是BCMA(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD33(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CLL1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD19并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD22(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD123(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是BCMA(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD33(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CLL1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD20并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD123(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是BCMA(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD33(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CLL1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD22并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是BCMA(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD33(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CLL1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD123并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD33(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CLL1(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是BCMA并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CLL1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD33并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD138(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CLL1并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CS1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD138并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD38(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CS1并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD133(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD38并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是FLT3(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD133并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD52(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是FLT3并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是TNFRSF13C(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD52并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是TNFRSF13B(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13C并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CXCR4(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是TNFRSF13B并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是PD-L1(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CXCR4并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是LY9(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是PD-L1并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD200(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是LY9并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是FCGR2B(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD21(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD200并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD21并且TAA 2是CD23(反之亦然)。
在本披露的一些实施例中,TAA 1是CD21并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD21并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD21并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD21并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD21并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD23并且TAA 2是CD24(反之亦然)。
在本披露的一些实施例中,TAA 1是CD23并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD23并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD23并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD23并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD24并且TAA 2是CD40L(反之亦然)。
在本披露的一些实施例中,TAA 1是CD24并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD24并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD24并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD40L并且TAA 2是CD72(反之亦然)。
在本披露的一些实施例中,TAA 1是CD40L并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD40L并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD72并且TAA 2是CD79a(反之亦然)。
在本披露的一些实施例中,TAA 1是CD72并且TAA 2是CD79b(反之亦然)。
在本披露的一些实施例中,TAA 1是CD79a并且TAA 2是CD79b(反之亦然)。
TAA 2 ABM可以包含例如抗TAA抗体或其抗原结合片段。所述抗TAA抗体或抗原结合片段可以包含例如表10中所列出抗体的CDR序列。在一些实施例中,所述抗TAA抗体或其抗原结合结构域具有表10中所列出抗体的重链和轻链可变区序列。
在某些实施例中,TAA 1和TAA 2选自CD19、CD20和BCMA。在其他实施例中,TAA 1和TAA 2选自BCMA和CD19。示例性BCMA和CD19结合序列在下文中的7.6.1和7.6.2节中列出。
7.6.1.BCMA
在某些方面,本披露提供了MBM(例如TBM),其中TAA 1或TAA 2是BCMA。BCMA是在B细胞谱系的细胞上表达的肿瘤坏死家族受体(TNFR)成员。BCMA表达在具有长寿的浆细胞命运的终末分化的B细胞(包括浆细胞、浆母细胞以及活化的B细胞和记忆B细胞的亚群)上是最高的。BCMA参与介导浆细胞的存活以维持长期体液免疫。BCMA的表达最近已与许多癌症、自体免疫性障碍和传染病有关。BCMA表达增加的癌症包括一些血液学癌症,如多发性骨髓瘤、霍奇金氏淋巴瘤和非霍奇金氏淋巴瘤、各种白血病和胶质母细胞瘤。
包含结合至BCMA的TAA 1或TAA 2 ABM的MBM(例如TBM)可以包含例如抗BCMA抗体或其抗原结合结构域。所述抗BCMA抗体或其抗原结合结构域可以包含例如表11A-11G中所列出的CDR、VH、VL、或scFV序列。
在一些实施例中,所述ABM包含BCMA-1的CDR序列。在一些实施例中,所述ABM包含BCMA-2的CDR序列。在一些实施例中,所述ABM包含BCMA-3的CDR序列。在一些实施例中,所述ABM包含BCMA-4的CDR序列。在一些实施例中,所述ABM包含BCMA-5的CDR序列。在一些实施例中,所述ABM包含BCMA-6的CDR序列。在一些实施例中,所述ABM包含BCMA-7的CDR序列。在一些实施例中,所述ABM包含BCMA-8的CDR序列。在一些实施例中,所述ABM包含BCMA-9的CDR序列。在一些实施例中,所述ABM包含BCMA-10的CDR序列。在一些实施例中,所述ABM包含BCMA-11的CDR序列。在一些实施例中,所述ABM包含BCMA-12的CDR序列。在一些实施例中,所述ABM包含BCMA-13的CDR序列。在一些实施例中,所述ABM包含BCMA-14的CDR序列。在一些实施例中,所述ABM包含BCMA-15的CDR序列。在一些实施例中,所述ABM包含BCMA-16的CDR序列。在一些实施例中,所述ABM包含BCMA-17的CDR序列。在一些实施例中,所述ABM包含BCMA-18的CDR序列。在一些实施例中,所述ABM包含BCMA-19的CDR序列。在一些实施例中,所述ABM包含BCMA-20的CDR序列。在一些实施例中,所述ABM包含BCMA-21的CDR序列。在一些实施例中,所述ABM包含BCMA-22的CDR序列。在一些实施例中,所述ABM包含BCMA-23的CDR序列。在一些实施例中,所述ABM包含BCMA-24的CDR序列。在一些实施例中,所述ABM包含BCMA-25的CDR序列。在一些实施例中,所述ABM包含BCMA-26的CDR序列。在一些实施例中,所述ABM包含BCMA-27的CDR序列。在一些实施例中,所述ABM包含BCMA-28的CDR序列。在一些实施例中,所述ABM包含BCMA-29的CDR序列。在一些实施例中,所述ABM包含BCMA-30的CDR序列。在一些实施例中,所述ABM包含BCMA-31的CDR序列。在一些实施例中,所述ABM包含BCMA-32的CDR序列。在一些实施例中,所述ABM包含BCMA-33的CDR序列。在一些实施例中,所述ABM包含BCMA-34的CDR序列。在一些实施例中,所述ABM包含BCMA-35的CDR序列。在一些实施例中,所述ABM包含BCMA-36的CDR序列。在一些实施例中,所述ABM包含BCMA-37的CDR序列。在一些实施例中,所述ABM包含BCMA-38的CDR序列。在一些实施例中,所述ABM包含BCMA-39的CDR序列。在一些实施例中,所述ABM包含BCMA-40的CDR序列。
在一些实施例中,所述CDR由卡巴特编号定义,如在表11B和11E中所列出。在其他实施例中,所述CDR由乔西亚编号定义,如在表11C和11F中所列出。在又其他实施例中,所述CDR由卡巴特和乔西亚编号的组合定义,如在表11D和11G中所列出。
在一些实施例中,包含结合至BCMA的ABM的MBM(例如TBM)可以包含BCMA-1至BCMA-40中任一个的重链和轻链可变序列。
在一些实施例中,所述ABM包含BCMA-1的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-2的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-3的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-4的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-5的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-6的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-7的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-8的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-9的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-10的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-11的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-12的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-13的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-14的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-15的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-16的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-17的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-18的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-19的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-20的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-21的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-22的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-23的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-24的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-25的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-26的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-27的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-28的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-29的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-30的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-31的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-32的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-33的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-34的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-35的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-36的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-37的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-38的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-39的重链和轻链可变序列,如在表11A中所列出。在一些实施例中,所述ABM包含BCMA-40的重链和轻链可变序列,如在表11A中所列出。
7.6.2.CD19
B细胞表达可以用作分化和鉴定标记物的细胞表面蛋白。一种这样的人B细胞标记物是CD19抗原,并且在成熟B细胞上发现,但在浆细胞上没有发现。CD19在早期前B细胞发育过程中表达,并持续直到浆细胞分化。CD19在正常B细胞和其异常生长可能导致B细胞淋巴瘤的癌性B细胞两者上表达。例如,CD19在B细胞系癌症上表达,包括但不限于非霍奇金淋巴瘤(B-NHL)、慢性淋巴细胞性白血病、和急性淋巴细胞性白血病。
在某些方面,本披露的MBM(例如TBM)包含特异性结合至CD19的TAA 1ABM或TAA 2ABM。下表12列出了可以掺入特异性结合至CD19的TAA 1ABM或TAA 2 ABM中的示例性CDR和可变结构域序列
在某些方面,所述ABM包含重链CDR,其具有如在表12中所列出的CD19-H1、CD19-H2A、和CD19-H3的氨基酸序列;和轻链CDR,其具有如在表12中所列出的CD19-L1、CD19-L2、和CD19-L3的氨基酸序列。在具体的实施例中,所述ABM包含重链可变区,其具有如在表12中所列出的VHA的氨基酸序列;和轻链可变区,其具有如在表12中所列出的VLA的氨基酸序列。
在其他方面,所述ABM包含重链CDR,其具有如在表12中所列出的CD19-H1、CD19-H2B、和CD19-H3的氨基酸序列;和轻链CDR,其具有如在表12中所列出的CD19-L1、CD19-L2、和CD19-L3的氨基酸序列。在具体的实施例中,所述ABM包含重链可变区,其具有如在表12中所列出的VHB的氨基酸序列;和轻链可变区,其具有如在表12中所列出的VLB的氨基酸序列。
在另外的方面,所述ABM包含重链CDR,其具有如在表12中所列出的CD19-H1、CD19-H2C、和CD19-H3的氨基酸序列;和轻链CDR,其具有如在表12中所列出的CD19-L1、CD19-L2、和CD19-L3的氨基酸序列。在具体的实施例中,ABM包含重链可变区,其具有如在表12中所列出的VHC的氨基酸序列;和轻链可变区,其具有如在表12中所列出的VLB的氨基酸序列。
在另外的方面,所述ABM包含重链CDR,其具有如在表12中所列出的CD19-H1、CD19-H2D、和CD19-H3的氨基酸序列;和轻链CDR,其具有如在表12中所列出的CD19-L1、CD19-L2、和CD19-L3的氨基酸序列。在具体的实施例中,所述ABM包含重链可变区,其具有如在表12中所列出的VHD的氨基酸序列;和轻链可变区,其具有如在表12中所列出的VLB的氨基酸序列。
在又其他方面,所述ABM呈scFV的形式。示例性抗CD19 scFv包含如在表12中所列出的CD19-scFv1至CD19-scFv12中任一种的氨基酸序列。
7.7.核酸和宿主细胞
在另一方面,本披露提供了编码本披露的MBM(例如TBM)的核酸。在一些实施例中,所述MBM由单个核酸编码。在其他实施例中,所述MBM由多个(例如两个、三个、四个或更多个)核酸编码。
单个核酸可以编码包含单一多肽链的MBM、包含两条或更多条多肽链的MBM、或包含多于两条多肽链的MBM的一部分(例如,单个核酸可以编码包含三条、四条或更多条多肽链的MBM的两条多肽链,或包含四条或更多条多肽链的MBM的三条多肽链)。对于表达的单独控制,编码两条或更多条多肽链的可以读框可以在单独的转录调节元件(例如,启动子和/或增强子)的控制下。编码两个或更多个多肽的可以读框还可以通过相同的转录调节元件控制,并且通过内部核糖体进入位点(IRES)序列分离,以允许翻译进不同多肽中。
在一些实施例中,包含两条或更多条多肽链的MBM由两种或更多种核酸编码。编码MBM的核酸的数量可以等于或小于MBM中多肽链的数量(例如,当多于一条多肽链被单个核酸编码时)。
本披露的核酸可以是DNA或RNA(例如,mRNA)。
在另一方面,本披露提供了宿主细胞和含有本披露的核酸的载体。所述核酸可以存在于单一载体或不同载体中,所述载体存在于相同宿主细胞或不同宿主细胞中,如下文中更详细地所述的。
7.7.1.载体
本披露提供了包含核苷酸序列的载体,所述核苷酸序列编码本文所述的MBM(例如TBM)或MBM组分。在一个实施例中,所述载体包含编码本文所述的基于免疫球蛋白的ABM的核苷酸。在一个实施例中,所述载体包含编码本文所述的Fc结构域的核苷酸。在一个实施例中,所述载体包含编码本文所述的基于重组非免疫球蛋白的ABM的核苷酸。本披露的载体可以编码一个或多个ABM、一个或多个Fc结构域、一个或多个基于非免疫球蛋白的ABM、或其组合(例如,当多种组分或子组分被编码为单一多肽链时)。在一个实施例中,载体包含本文所述的核苷酸序列。所述载体包括但不限于病毒、质粒、粘粒、λ噬菌体或酵母人工染色体(YAC)。
可以使用多种载体系统。例如,一类载体利用衍生自动物病毒的DNA元件,例如牛乳头瘤病毒、多瘤病毒、腺病毒、牛痘病毒、杆状病毒、逆转录酶病毒(劳氏肉瘤病毒、MMTV或MOMLV)或SV40病毒。另一类载体利用衍生自RNA病毒的RNA元件,例如塞姆利基森林病毒(Semliki Forest virus)、东部马脑炎病毒(Eastern Equine Encephalitis virus)和黄病毒。
另外,将DNA稳定地整合进其染色体中的细胞可通过引入一个或多个标记物(其允许对转染的宿主细胞进行选择)进行选择。所述标记物可以向例如营养缺陷型宿主提供质子移变,可以提供杀微生物剂抗性(例如,抗生素)、或对重金属如铜等的抗性。所述可以选择的标记物基因可以直接连接至待表达的DNA序列,或通过共转化引入相同的细胞。mRNA的最佳合成也可能需要另外的元件。这些元件可以包括拼接信号,以及转录启动子、增强子、和终止信号。
一旦含有构建体的表达载体或DNA序列被制备用于表达,则所述表达载体可以被转染或引入适宜的宿主细胞中。可以采用各种技术,例如像,原生质体融合、磷酸钙沉淀、电穿孔、逆转录病毒转导、病毒转染、基因枪、基于脂质的转染或其他的常规技术,来实现这一目标。用于培养所得转染细胞和回收表达的多肽的方法和条件是本领域技术人员已知的,并且可以根据基于本说明书中所用的特定表达载体和哺乳动物宿主细胞进行改变或优化。
7.7.2.细胞
本披露还提供了包含本披露的核酸的宿主细胞。
在一个实施例中,所述宿主细胞被基因工程化以包含本文所述的一个或多个核酸。
在一个实施例中,通过使用表达盒使宿主细胞基因工程化。短语“表达盒”是指核苷酸序列,其能够影响在与此类序列相容的宿主中的基因的表达。此类盒可以包括启动子,具有或不具有内含子的开放阅读框和终止信号。还可以使用在实现表达中必需或有帮助的其他因子,例如诱导型启动子。
本披露还提供了包含本文所述的载体的宿主细胞。
所述细胞可以是但不限于真核细胞、细菌细胞、昆虫细胞、或人细胞。合适的真核细胞包括,但不限于Vero细胞、HeLa细胞、COS细胞、CHO细胞、HEK293细胞、BHK细胞、和MDCKII细胞。合适的昆虫细胞包括,但不限于Sf9细胞。
7.8.抗体-药物缀合物
本披露的MBM(例如TBM)可以例如经由接头与药物部分缀合。为了方便起见,此类缀合物在本文中被称为抗体-药物缀合物(或“ADC”),尽管事实是所述ABM中的一种或多种(或全部)可能基于非免疫球蛋白支架。
在某些方面,所述药物部分发挥细胞毒性或细胞抑制活性。在一个实施例中,所述药物部分选自美登木素生物碱、驱动蛋白样蛋白KIF11抑制剂、V-ATP酶(液泡型H+-ATP酶)抑制剂、促凋亡剂、Bcl2(B细胞淋巴瘤2)抑制剂、MCL1(髓细胞白血病1)抑制剂、HSP90(热休克蛋白90)抑制剂、IAP(细胞凋亡抑制剂)抑制剂、mTOR(雷帕霉素机制性靶标)抑制剂、微管稳定剂、微管去稳定剂、奥瑞斯他汀、多拉司他汀、MetAP(甲硫氨酸氨基肽酶)、CRM1(染色体维持1)抑制剂、DPPIV(二肽基肽酶IV)抑制剂、蛋白酶体抑制剂、线粒体中磷酰基转移反应的抑制剂、蛋白质合成抑制剂、激酶抑制剂、CDK2(细胞周期蛋白依赖性激酶2)抑制剂、CDK9(细胞周期蛋白依赖性激酶9)抑制剂、驱动蛋白抑制剂、HDAC(组蛋白脱乙酰酶)抑制剂、DNA损伤剂、DNA烷基化剂、DNA嵌入剂、DNA小沟结合物、RNA聚合酶抑制剂、拓扑异构酶抑制剂、或DHFR(二氢叶酸还原酶)抑制剂。
在一个实施例中,所述接头选自可切割接头、不可切割接头、亲水接头、原带电荷(procharged)接头、或基于二羧酸的接头。
在具体的实施例中,所述ADC是根据结构式(I)的化合物:
[D-L-XY]
或其盐,其中每个“D”彼此独立地代表细胞毒性剂和/或细胞抑制剂(“药物”);每个“L”彼此独立地代表接头;“Ab”代表本文所述的MBM;每个“XY”代表在接头上的官能团R
可以包含ADC的各种抗体(Ab)的具体实施例包括上述MBM的各种实施例。
在结构式(I)的ADC和/或盐的一些具体实施例中,每个D是相同的和/或每个L是相同的。
可以包含本披露ADC的细胞毒性剂和/或细胞抑制剂(D)和接头(L)的具体实施例,以及与ADC连接的细胞毒性剂和/或细胞抑制剂的数量,在下面更详细地描述。
7.8.1.细胞毒性剂和/或细胞抑制剂
所述细胞毒性剂和/或细胞抑制剂可以是已知抑制细胞生长和/或细胞复制和/或杀死细胞的任何药剂,特别是癌细胞和/或肿瘤细胞。许多具有细胞毒性和/或细胞抑制特性的药剂在文献中是已知的。多种类型的细胞毒性剂和/或细胞抑制剂的非限制性实例包括,例如但不限于,放射性核素、烷基化剂、拓扑异构酶I抑制剂、拓扑异构酶II抑制剂、DNA嵌入剂(例如,沟结合剂,如小沟结合物)、RNA/DNA抗代谢物、细胞周期调节剂、激酶抑制剂、蛋白质合成抑制剂、组蛋白脱乙酰酶抑制剂、线粒体抑制剂、和抗有丝分裂剂。
以下提供这些多种类型中的某些内的药剂的具体非限制性实例。
包括或可以被修饰以包括与MBM的附接位点的任何这些药剂可以包括在本文披露的ADC中。
在具体的实施例中,所述细胞毒性剂和/或细胞抑制剂是抗有丝分裂剂。
在另一个具体的实施例中,所述细胞毒性剂和/或细胞抑制剂是奥瑞斯他汀,例如,单甲基奥瑞斯他汀E(“MMAE:)或单甲基奥瑞斯他汀F(“MMAF”)。
7.8.2.ADC接头
在本披露的ADC中,所述细胞毒性剂和/或细胞抑制剂通过ADC接头的方式与MBM连接。将细胞毒性剂和/或细胞抑制剂与ADC的MBM连接的ADC接头可以是短的、长的、疏水的、亲水的、柔性的或刚性的,或者可以由各自独立地具有上述提及特性中的一种或多种的片段组成,使得所述接头可以包括具有不同特性的片段。所述接头可以是多价的,使得它们将多于一种药剂共价连接至MBM上的单个位点,或者所述接头可以是单价的,使得它们将单一药剂共价连接至MBM上的单个位点。
如本领域技术人员将理解的,所述ADC接头通过在一个位置处与细胞毒性剂和/或细胞抑制剂形成共价连接并在另一个位置处与MBM形成共价连接将细胞毒性剂和/或细胞抑制剂与MBM连接。通过ADC接头上的官能团与药剂和MBM上的官能团之间的反应形成共价连接。如本文所用的,所述表述“ADC接头”旨在包括(i)ADC接头的未缀合形式,其包括能够将ADC接头与细胞毒性剂和/或细胞抑制剂共价连接的官能团和能够将ADC接头与MBM共价连接的官能团;(ii)ADC接头的部分缀合形式,其包括官能团,所述官能团能够将ADC接头与MBM共价连接,并且所述ADC接头与细胞毒性剂和/或细胞抑制剂共价连接,或反之亦然;以及(iii)ADC接头的完全缀合形式,其与细胞毒性剂和/或细胞抑制剂和MBM两者共价连接。在本披露的ADC接头和ADC,以及用于将接头-药剂与MBM缀合的合成子的一些具体实施例中,包含ADC接头上的官能团的部分和在ADC接头与MBM之间形成的共价连接具体地分别表示为R
所述ADC接头(但不必)对细胞外的条件具有化学稳定性,并且可以设计成在细胞内裂解、死亡和/或以其他方式特异性降解。可替代地,可以使用不被设计为在细胞内特异性切割或降解的ADC接头。选择稳定或不稳定的ADC接头可以取决于细胞毒性剂和/或细胞抑制剂的毒性。对于对正常细胞有毒的药剂,可以使用稳定的接头。可以使用选择性或靶向的且对正常细胞具有较低毒性的药剂,ADC接头对细胞外环境的化学稳定性不太重要。多种可用于在ADC的上下文中将药物与MBM连接的ADC接头是本领域已知的。这些ADC接头以及其他ADC接头中的任一个可以用于将细胞毒性剂和/或细胞抑制剂与本披露ADC的MBM连接。
可以用于将许多细胞毒性剂和/或细胞抑制剂与单个MBM分子连接的示例性多价ADC接头描述于例如WO 2009/073445;WO 2010/068795;WO 2010/138719;WO 2011/120053;WO 2011/171020;WO 2013/096901;WO 2014/008375;WO 2014/093379;WO 2014/093394;WO2014/093640中。例如,Mersana等人开发的Fleximer接头技术具有使具有良好的物理化学特性的高DAR ADC成为可能的潜力。如下所示,Mersana技术基于经由一系列酯键将药物分子掺入增溶的聚乙缩醛主链中。所述方法可提供高负载的ADC(DAR高达20),同时保持良好的物理化学特性。
树突型接头的另外的实例可以在以下文献中找到:US 2006/116422;US 2005/271615;de Groot等人,2003,Angew.Chem.Int.Ed.[应用化学-国际版]42:4490-4494;Amir等人,2003,Angew.Chem.Int.Ed.[应用化学-国际版]42:4494-4499;Shamis等人,2004,J.Am.Chem.Soc.[美国化学学会杂志]126:1726-1731;Sun等人,2002,Bioorganic&Medicinal Chemistry Letters[生物有机化学与药物化学通讯]12:2213-2215;Sun等人,2003,Bioorganic&Medicinal Chemistry[生物有机化学和药物化学快报]11:1761-1768;King等人,2002,Tetrahedron Letters[四面体快报]43:1987-1990。
可以使用的示例性单价ADC接头描述于,例如,Nolting,2013,Antibody-DrugConjugates[抗体-药物缀合物],Methods in Molecular Biology[分子生物学中的方法]1045:71-100;Kitson等人,2013,CROs-Mos-Chemica-ggi--Chemistry Today[CROs-Mos-Chemica-ggi--今日化学]31(4):30-38;Ducry等人,2010,Bioconjugate Chem.[生物缀合化学]21:5-13;Zhao等人,2011,J.Med.Chem.[药物化学杂志]54:3606-3623;美国专利号7,223,837;美国专利号8,568,728;美国专利号8,535,678;和WO 2004010957。
例如但不限于,可以包括在本披露ADC中的一些可切割和不可切割的ADC接头描述如下。
7.8.2.1.可切割的ADC接头
在某些实施例中,所述选择的ADC接头在体内是可切割的。可切割的ADC接头可以包括化学或酶促不稳定的或者可降解的连接。可切割的ADC接头通常依赖于细胞内的过程来释放药物,例如细胞质的减少、暴露于溶酶体中的酸性条件、或通过细胞内特定蛋白酶或其他酶的切割。可切割的ADC接头通常掺入一个或多个化学键,所述化学键是可化学切割的或可酶切的,而ADC接头的其余部分是不可切割的。在某些实施例中,ADC接头包含化学不稳定基团,例如腙和/或二硫化物基团。包含化学不稳定基团的接头利用血浆和一些细胞质区室之间的差异特性。促进含有腙的ADC接头的药物释放的细胞内条件是内体和溶酶体的酸性环境,而含有二硫化物的ADC接头在含有高硫醇浓度的细胞溶质中还原,例如谷胱甘肽。在某些实施例中,通过使用化学不稳定基团附近的取代基引入空间位阻,可以提高包含化学不稳定基团的ADC接头的血浆稳定性。
酸性不稳定基团,例如腙,在血液中性pH环境(pH 7.3-7.5)的全身循环过程中保持完整,并且一旦ADC内化为细胞的轻度酸性内体的区室(pH 5.0-6.5)和溶酶体的隔室(pH4.5-5.0)则进行水解并释放药物。这种pH依赖性释放机制与药物的非特异性释放有关。为了提高ADC接头的腙基团的稳定性,可以通过化学修饰(例如取代)改变ADC接头,从而允许调节以在溶酶体中实现更有效的释放,同时使循环损失最小化。
含腙的ADC接头可以含有另外的切割位点,如另外的酸不稳定切割位点和/或酶促不稳定切割位点。包括示例性含腙的ADC接头的ADC包括以下结构:
其中D和Ab分别代表细胞毒性剂和/或细胞抑制剂(药物)和Ab,并且n代表与MBM连接的药物-ADC接头的数量。在某些ADC接头如接头(Ig)中,所述ADC接头包含两个可切割的基团-二硫化物和腙部分。对于此类ADC接头,未经修饰的游离药物的有效释放需要酸性pH或二硫化物还原和酸性pH。例如(Ih)和(Ii)的接头已经显示出对单个腙切割位点有效。
当ADC内化到酸性细胞区室中时,在体循环期间保持完整并经历水解并释放药物的另外的ADC接头包括碳酸盐。此类ADC接头可以用于细胞毒性剂和/或细胞抑制剂可以通过氧共价附接的情况。
可以包括在ADC接头中的其他酸不稳定基团包括含有顺式-乌头酰基的ADC接头。顺式-乌头酰基化学物质使用与酰胺键并置的羧酸以加速酰胺在酸性条件下的水解。
可切割的ADC接头也可以包括二硫化物基团。二硫化物在生理pH下是热力学稳定的并且被设计成在细胞内内化时释放药物,其中与细胞外环境相比细胞质提供显著更多的还原环境。二硫键的断裂通常需要细胞质硫醇辅因子的存在,例如(还原的)谷胱甘肽(GSH),使得含二硫化物的ADC接头在循环中相当稳定,选择性地释放细胞溶质中的药物。细胞内酶蛋白二硫化物异构酶或能够切割二硫键的类似酶也可以促进细胞内二硫键的优先切割。据报道,相比于在大约5种肿瘤细胞的循环中的GSH或半胱氨酸(最丰富的低分子量硫醇)的显著更低浓度,GSH以范围为0.5-10mM的浓度存在于细胞中,其中不规律的血流导致缺氧状态,导致还原酶的活性增强,并且因此导致甚至更高的谷胱甘肽浓度。在某些实施例中,含有二硫化物的ADC接头的体内稳定性可以通过ADC接头的化学修饰来增强,例如,使用与二硫键相邻的空间位阻。
包括含有二硫化物的示例性ADC接头的ADC包括以下结构:
其中D和Ab分别代表药物和MBM,n代表与MBM连接的药物-ADC接头的数量,并且R在每次出现时独立地选自例如氢或烷基。在某些实施例中,增加与二硫键相邻的空间位阻增加了ADC接头的稳定性。当一个或多个R基团选自低级烷基如甲基时,例如(Ij)和(Il)的结构显示出增加的体内稳定性。
可以使用的另一种类型的可切割ADC接头是ADC接头,其被酶特异性切割。此类ADC接头通常是基于肽的或包括充当酶的底物的肽区域。与化学不稳定的ADC接头相比,基于肽的ADC接头在血浆和细胞外环境中往往更稳定。肽键通常具有良好的血清稳定性,因为溶酶体蛋白水解酶由于内源性抑制剂而在血液中具有非常低的活性,并且具有与溶酶体相比不利的高血液pH值。从MBM释放药物特别是由于溶酶体蛋白酶(例如组织蛋白酶和纤溶酶)的作用而发生。这些蛋白酶可以在某些肿瘤细胞中以升高的水平存在。
在示例性实施例中,所述可切割的肽选自四肽,如Gly-Phe-Leu-Gly(SEQ ID NO:725)、Ala-Leu-Ala-Leu(SEQ ID NO:726);或二肽,如Val-Cit、Val-Ala、Met-(D)Lys、Asn-(D)Lys、Val-(D)Asp、Phe-Lys、Ile-Val、Asp-Val、His-Val、NorVal-(D)Asp、Ala-(D)Asp 5、Met-Lys、Asn-Lys、Ile-Pro、Me3Lys-Pro、苯基Gly-(D)Lys、Met-(D)Lys、Asn-(D)Lys、Pro-(D)Lys、Met-(D)Lys、Asn-(D)Lys、AM Met-(D)Lys、Asn-(D)Lys、AW Met-(D)Lys、和Asn-(D)Lys。在某些实施例中,由于较长肽的疏水性,可以在较长的多肽上选择二肽。
已经描述了多种基于二肽的可切割ADC接头,其用于将如多柔比星、丝裂霉素、喜树碱、吡咯并苯并二氮杂卓、他利霉素和奥瑞斯他汀/奥瑞斯他汀家族成员的药物与MBM连接(参见,Dubowchik等人,1998,J.Org.Chem.[生物缀合化学]67:1866-1872;Dubowchik等人,1998,Bioorg.Med.Chem.Lett.[生物有机化学与医药化学通讯]8(21):3341-3346;Walker等人,2002,Bioorg.Med.Chem.Lett.[生物有机化学与医药化学通讯]12:217-219;Walker等人,2004,Bioorg.Med.Chem.Lett.[生物有机化学与医药化学通讯]14:4323-4327;Sutherland等人,2013,Blood[血液]122:1455-1463;和Francisco等人,2003,Blood[血液]102:1458-1465)。所有这些二肽ADC接头或这些二肽ADC接头的修饰形式都可以用于本披露的ADC中。可以使用的其他二肽ADC接头包括在ADC中发现的那些,如西雅图遗传学公司(Seattle Genetics)的本妥昔单抗SGN-35(Adcetris
可酶切的ADC接头可以包括自杀式间隔子,以在空间上将药物与酶切位点分开。药物与肽ADC接头的直接附接可以导致药物的氨基酸加合物的蛋白水解释放,从而损害其活性。使用自杀式间隔子允许在酰胺键水解时消除完全活性的未经化学修饰的药物。
一种自杀式间隔子是双功能的对氨基苄醇基团,其通过氨基基团与肽连接,形成酰胺键,而含胺的药物可以通过氨基甲酸酯官能团附接至ADC接头的苄羟基基团(PABC)。所得的前药在蛋白酶介导的切割后被活化,导致1,6-消除反应,释放未修饰的药物、二氧化碳和ADC接头基团的残余物。以下方案描述了对氨基苄基醚的片段化和药物的释放:
其中X-D代表未修饰的药物。
还描述了这种自杀式基团的杂环变体。参见例如,美国专利号7,989,434。
在一些实施例中,所述可酶切的ADC接头是基于β-葡糖醛酸的ADC接头。通过溶酶体酶β-葡糖醛酸糖苷酶切割β-葡糖苷酸糖苷键可以实现药物的简易释放。该酶大量存在于溶酶体内,并且在一些肿瘤类型中过表达,而细胞外的酶活性低。基于β-葡萄糖醛酸的ADC接头可以用于避免由于β-葡糖苷酸的亲水性而导致ADC发生聚集的趋势。在一些实施例中,基于β-葡萄糖醛酸的ADC接头可以用作与疏水性药物连接的ADC的ADC接头。以下方案描述了从含有基于β-葡萄糖醛酸的ADC接头的ADC释放药物:
已经描述了多种基于β-葡萄糖醛酸的可切割的ADC接头,其用于将如奥瑞斯他汀、喜树碱和多柔比星类似物、CBI小沟结合物、和psymberin的药物连接至MBM(参见,Nolting,第5章“Linker Technology in Antibody-Drug Conjugates,[抗体-药物缀合物中的接头技术]”于:Antibody-Drug Conjugates:Methods in Molecular Biology[抗体-药物缀合物:分子生物学方法]中,第1045卷,第71-100页,Laurent Ducry(编辑),斯普林格科学与商业医学公司(Springer Science&Business Medica,LLC,2013;Jeffrey等人,2006,Bioconjug.Chem.[生物缀合化学]17:831-840;Jeffrey等人,2007,Bioorg.Med.Chem.Lett.[生物有机化学与医药化学通讯]17:2278-2280;和Jiang等人,2005,J.Am.Chem.Soc.[美国化学学会杂志]127:11254-11255)。所有这些基于β-葡萄糖醛酸的ADC接头均可以用于本披露的ADC中。
另外,含有苯酚基团的细胞毒性剂和/或细胞抑制剂可以通过苯酚氧与ADC接头共价键合。WO 2007/089149中描述的一种此类ADC接头依赖于如下方法,其中二氨基-乙烷“SpaceLink”与传统的基于“PABO”自杀式基团一起使用以递送苯酚。下文示意性地描绘了ADC接头的切割,其中D代表具有苯酚羟基基团的细胞毒性剂和/或细胞抑制剂。
可切割的ADC接头可以包括不可切割的部分或区段,和/或可切割的区段或部分可以包括在另外的不可切割的ADC接头中以使其可切割。仅举例来说,聚乙二醇(PEG)和相关聚合物可以包括聚合物主链中的可切割基团。例如,聚乙二醇或聚合物ADC接头可以包括一个或多个可切割的基团,如二硫化物、腙或二肽。
其他可以包括在ADC接头中的可降解连接包括通过PEG羧酸或活化的PEG羧酸与生物活性剂上的醇基反应形成的酯键,其中此类酯基通常在生理条件下水解以释放生物活性剂。可水解降解的连接包括但不限于碳酸酯连接;由胺和醛反应得到的亚胺键;通过醇与磷酸基团反应形成的磷酸酯键;作为醛和醇的反应产物的缩醛键;作为甲酸酯和醇的反应产物的原酸酯键;以及由亚磷酰胺基团形成的寡核苷酸键,包括但不限于位于聚合物末端和寡核苷酸的5'羟基基团。
在某些实施例中,所述ADC接头包含可酶切肽部分,例如,包含结构式(IVa)或(IVb)的ADC接头:
或其盐,其中:肽代表可被溶酶体酶切割的肽(图示为C→N且未显示羧基和氨基“末端”);T代表包含一个或多个乙二醇单元或亚烷基链或其组合的聚合物;R
在某些实施例中,所述肽选自三肽或二肽。在具体的实施例中,所述二肽选自:Val-Cit;Cit-Val;Ala-Ala;Ala-Cit;Cit-Ala;Asn-Cit;Cit-Asn;Cit-Cit;Val-Glu;Glu-Val;Ser-Cit;Cit-Ser;Lys-Cit;Cit-Lys;Asp-Cit;Cit-Asp;Ala-Val;Val-Ala;Phe-Lys;Val-Lys;Ala-Lys;Phe-Cit;Leu-Cit;Ile-Cit;Phe-Arg;和Trp-Cit。在某些实施例中,所述二肽选自:Cit-Val;和Ala-Val。
可以包括在本披露ADC中的根据结构式(IVa)的ADC接头的具体示例性实施例包括下面所示的ADC接头(如图所示,所述ADC接头包括适合于将ADC接头与MBM共价连接的基团):
可以包括在本披露ADC中的根据结构式(IVb)的ADC接头的具体示例性实施例包括下面所示的ADC接头(如图所示,所述ADC接头包括适合于将ADC接头与MBM共价连接的基团):
在某些实施例中,所述ADC接头包含可酶切肽部分,例如,包含结构式(IVc)或(IVd)的ADC接头:
或其盐,其中:肽代表可被溶酶体酶切割的肽(图示为C→N且未显示羧基和氨基“末端”);T代表包含一个或多个乙二醇单元或亚烷基链或其组合的聚合物;R
可以包括在本披露ADC中的根据结构式(IVc)的ADC接头的具体示例性实施例包括下面所示的ADC接头(如图所示,所述ADC接头包括适合于将ADC接头与MBM共价连接的基团):
可以包括在本披露ADC中的根据结构式(IVd)的ADC接头的具体示例性实施例包括下面所示的ADC接头(如图所示,所述ADC接头包括适合于将ADC接头与MBM共价连接的基团):
在某些实施例中,包含结构式(IVa)、(IVb)、(IVc)、或(IVd)的ADC接头进一步包含通过暴露于酸性介质而可切割的碳酸酯部分。在具体的实施例中,所述ADC接头通过氧附接至细胞毒性剂和/或细胞抑制剂。
7.8.2.2.不可切割的接头
虽然可切割的ADC接头可以提供某些优势,但包含本披露ADC的ADC接头不需要是可切割的。对于不可切割的ADC接头,药物的释放不依赖于血浆和一些细胞质区室之间的差异特性。假定药物的释放在ADC经由抗原介导的胞吞作用内化并递送至溶酶体区室后发生,其中所述MBM通过细胞内蛋白水解降解而降解至氨基酸水平。该过程释放药物衍生物,所述药物衍生物由药物、ADC接头和与ADC接头共价附接的氨基酸残基形成。来自具有不可切割的ADC接头的缀合物的氨基酸药物代谢物更亲水并且通常膜可渗透性更低,这导致更少的旁邻效应(bystander effects)和更少的非特异性毒性(与具有可切割的ADC接头的缀合物相比)。通常,具有不可切割ADC接头的ADC在循环中具有比具有可切割ADC接头的ADC更高的稳定性。不可切割的ADC接头可以是亚烷基链,或者本质上可以是聚合的,例如像基于聚亚烷基二醇聚合物、酰胺聚合物,或可以包括亚烷基链、聚亚烷基二醇和/或酰胺聚合物的区段。
已经描述了用于将药物与MBM连接的多种不可切割的ADC接头。参见,Jeffrey等人,2006,Bioconjug.Chem.[生物缀合化学]17;831-840;Jeffrey等人,2007,Bioorg.Med.Chem.Lett.[生物有机化学与医药化学通讯]17:2278-2280;和Jiang等人,2005,J.Am.Chem.Soc.[美国化学学会杂志]127:11254-11255。所有这些ADC接头可以包括在本披露的ADC中。
在某些实施例中,所述ADC接头在体内是不可切割的,例如根据结构式(VIa)、(VIb)、(VIc)或(VId)的ADC接头(如图所示,所述ADC接头包括适合于将ADC接头与MBM共价连接的基团:
或其盐,其中:R
可以包括在本披露ADC中的根据结构式(VIa)-(VId)的ADC接头的具体示例性实施例包括下面所示的ADC接头(如图所示,所述ADC接头包括适合于将ADC接头与MBM共价连接的基团,并且
7.8.2.3.用于将接头附接到MBM的基团
可以使用多种基团将ADC接头-药物合成子附接至MBM(例如TBM)以产生ADC。附接基团本质上可以是亲电子的,并且包括:马来酰亚胺基团、活化的二硫化物、活性酯(例如NHS酯和HOBt酯)、卤代甲酸酯、酰基卤、烷基和苄基卤化物(例如卤代乙酰胺)。如下所讨论的,还存在与“自稳定性”马来酰亚胺和“桥接二硫化物”相关的新兴技术,其可以根据本披露使用。使用的具体基团将部分取决于与MBM的附接位点。
在下面的示意图中描绘了在MBM缀合条件下自发水解以给出具有改善稳定性的ADC物质的“自稳定性”马来酰亚胺基团的一个实例。参见US 20130309256A1;还参见Lyon等人,Nature Biotech published online[网上出版的自然生物科技],doi:10.1038/nbt.2968。
正常系统:
导致随时间的“DAR降低”
SGN MaIDPR(马来酰亚胺二丙氨基)系统:
Polytherics公司披露了一种桥接一对巯基基团的方法,所述基团衍生自天然铰链二硫键的还原。参见,Badescu等人,2014,Bioconjugate Chem.[生物缀合化学]25:1124-1136。所述反应描绘于下面的示意图中。该方法的一个优点是能够通过完全还原IgG(以给出4对巯基)然后与4当量的烷基化剂反应来合成富集的DAR4 ADC。含有“桥连二硫化物”的ADC具有增加的稳定性。
类似地,如下所描绘,已经开发了能够桥接一对巯基基团的马来酰亚胺衍生物(下面的1)。参见WO 2013/085925。
7.8.2.4.ADC接头选择考虑
如本领域技术人员所知,为特定ADC选择的ADC接头可以受多种因素影响,包括但不限于与MBM的附接位点(例如,lys、cys或其他氨基酸残基)、药物药效团的结构限制和药物的亲脂性。为ADC选择的具体ADC接头应寻求平衡针对特定MBM/药物组合的这些不同因子。关于受ADC中ADC接头选择影响的因素的综述,参见Nolting,第5章“Linker Technologyin Antibody-Drug Conjugates,[抗体-药物缀合物中的接头技]”于:Antibody-DrugConjugates:Methods in Molecular Biology[抗体-药物偶联物:分子生物学方法]中,第1045卷,第71-100页,Laurent Ducry(编辑),斯普林格科学与商业医学公司(SpringerScience&Business Medica,LLC),2013。
例如,已观察到ADC影响对存在于抗原阳性肿瘤细胞附近的旁邻抗原阴性细胞的杀伤。ADC对旁邻细胞的杀伤机制表明,在ADC的细胞内加工过程中形成的代谢产物可以发挥作用。通过抗原阳性细胞中的ADC代谢产生的中性细胞毒性代谢物似乎在旁邻细胞杀伤中起作用,同时可以防止带电荷的代谢物穿过膜扩散进入介质,因此不会影响旁邻杀伤。在某些实施例中,选择ADC接头以减弱由ADC的细胞代谢物引起的旁邻杀伤效应。在某些实施例中,选择ADC接头以增加旁邻杀伤效应。
ADC接头的特性还可以在使用和/或存储条件下影响ADC的聚集。典型地,文献中报道的ADC含有不超过3-4个药物分子/抗体分子(参见例如,Chari,2008,Acc Chem Res[化学研究报告]41:98-107)。由于ADC的聚集,尝试获得更高的药物-抗体比(“DAR”)通常是失败的,特别是如果药物和ADC接头都是疏水的(King等人,2002,J Med Chem[药物化学杂志]45:4336-4343;Hollander等人,2008,Bioconjugate Chem[生物缀合化学]19:358-361;Burke等人,2009Bioconjugate Chem[生物缀合化学]20:1242-1250)。在许多情况下,高于3-4的DAR作为增加效力的手段可以是有益的。在细胞毒性剂和/或细胞抑制剂本质上是疏水性的情况下,可能希望选择相对亲水的ADC接头作为减少ADC聚集的手段,尤其是在希望大于3-4的DARS的情况下。因此,在某些实施例中,ADC接头掺入化学部分,所述化学部分在储存和/或使用期间减少ADC的聚集。ADC接头可以掺入极性或亲水基团,如带电荷基团或在生理pH下变为带电荷的基团,以减少ADC的聚集。例如,ADC接头可以掺入带电荷的基团,如在生理pH下使例如羧酸盐或质子化物(例如胺)去质子化的盐或基团。
已报道可产生高达20的DAR、可以用于将多种细胞毒性剂和/或细胞抑制剂与MBM连接的示例性多价ADC接头描述于WO 2009/073445;WO 2010/068795;WO 2010/138719;WO2011/120053;WO 2011/171020;WO 2013/096901;WO 2014/008375;WO 2014/093379;WO2014/093394;WO 2014/093640中。
在具体的实施例中,如通过尺寸排阻色谱法(SEC)测定,ADC在储存或使用期间的聚集小于约10%。在具体的实施例中,如通过尺寸排阻色谱法(SEC)测定的,ADC在储存或使用期间的聚集小于10%,例如小于约5%、小于约4%、小于约3%、小于约2%、小于约1%、小于约0.5%、小于约0.1%、或甚至更低。
7.8.3.制造ADC的方法
可以使用熟知的化学物质合成本披露的ADC。所选择的化学物质尤其将取决于一种或多种细胞毒性剂和/或细胞抑制剂、ADC接头和用于将ADC接头附接至MBM的基团的特性。通常,根据式(I)的ADC可以根据以下方案制备:
D-L-R
其中D、L、Ab、XY和n是如前所定义的,并且R
基团R
用于将合成子连接到可接近的赖氨酸残基上的许多官能团R
用于将合成子连接到半胱氨酸残基的可接近的游离巯基上的许多官能团R
然而,缀合化学物质不限于可用的侧链基团。通过将适当的小分子与胺连接,可以将如胺的侧链转化为其他有用的基团,如羟基。该策略可以用于通过将多功能小分子与MBM的可接近的氨基酸残基的侧链缀合来增加抗体上可用的连接位点的数量。然后将适合于将合成子共价连接到这些“转化的”官能团的官能团R
还可以将MBM工程化以包括用于缀合的氨基酸残基。用于工程化MBM以包括可用于在ADC的上下文中缀合药物的非遗传编码的氨基酸残基的方法描述于Axup等人,2012,ProcNatl Acad Sci USA.[美国国家科学院院刊]109(40):16101-16106中,用于将合成子连接到非编码氨基酸的化学物质和官能团也是如此。
典型地,合成子与MBM的氨基酸残基的侧链连接,包括例如可接近的赖氨酸残基的伯氨基基团或可接近的半胱氨酸残基的巯基基团。通过还原链间二硫键可以获得游离的巯基基团。
对于其中R
不参与二硫桥的半胱氨酸残基可以通过修饰一个或多个密码子而工程化成MBM。还原这些未配对的半胱氨酸产生适于缀合的巯基基团。在一些实施例中,本披露的MBM经工程化以引入一个或多个半胱氨酸残基作为与药物部分缀合的位点(参见,Junutula等人,2008,Nat Biotechnol[自然生物技术],26:925-932)。
可以在恒定区中选择半胱氨酸取代的位点以提供稳定且均一的缀合物。本披露的MBM可以具有,例如,两个或更多个半胱氨酸取代,并且这些取代可以与如本文所述的其他修饰和缀合方法组合使用。用于将半胱氨酸插入在抗体的特定位置处的方法是本领域已知的,参见例如Lyons等人,1990Protein Eng.[蛋白质工程],3:703-708、WO 2011/005481、WO2014/124316、WO 2015/138615。在某些实施例中,本披露的MBM包含用在选自重链的以下位置的恒定区上的半胱氨酸对一个或多个氨基酸的取代:位置117、119、121、124、139、152、153、155、157、164、169、171、174、189、205、207、246、258、269、274、286、288、290、292、293、320、322、326、333、334、335、337、344、355、360、375、382、390、392、398、400和422,其中所述位置是根据EU系统编号的。在一些实施例中,MBM包含用在选自轻链的以下位置的恒定区上的半胱氨酸对一个或多个氨基酸的取代:位置107、108、109、114、129、142、143、145、152、154、156、159、161、165、168、169、170、182、183、197、199、和203,其中所述位置是根据EU系统编号的,并且其中轻链是人κ轻链。在某些实施例中,MBM包含用在恒定区上的半胱氨酸对两个或更多个氨基酸的取代的组合,其中所述组合包含在重链的位置375处、重链的位置152处、重链的位置360处、或轻链的位置107处的取代,并且其中所述位置是根据EU系统编号的。在某些实施例中,MBM包含用在恒定区上的半胱氨酸对一个氨基酸的取代,其中所述取代在重链的位置375处、重链的位置152处、重链的位置360处、轻链的位置107处、轻链的位置165处、或轻链的位置159处,并且其中所述位置是根据EU系统编号的,并且其中轻链是κ链。
在具体的实施例中,本披露的MBM包含用在恒定区上的半胱氨酸对两个氨基酸的取代的组合,其中所述MBM在重链的位置152和375处包含半胱氨酸,其中所述位置是根据EU系统编号的。
在其他具体的实施例中,本披露的MBM包含在重链的位置360处用半胱氨酸对一个氨基酸的取代,其中所述位置是根据EU系统编号的。
在其他具体的实施例中,本披露的MBM包含在轻链的位置107处用半胱氨酸对一个氨基酸的取代,其中所述位置是根据EU系统编号的,并且其中轻链是κ链。
用于掺入工程化半胱氨酸的其他位置可以包括,例如但不限于:人IgG
可以另外地或可替代地修饰可以用于本文披露的ADC中的MBM以引入一种或多种其他反应性氨基酸(除半胱氨酸外),包括Pcl、吡咯赖氨酸、肽标签(如S6、A1和ybbR标签)、和非天然氨基酸,代替天然序列的至少一个氨基酸,因此在所述MBM上提供反应位点用于与药物部分缀合。例如,可以修饰MBM以掺入Pcl或吡咯赖氨酸(W.Ou等人,2011,PNAS,108(26):10437-10442;WO 2014124258)或非天然氨基酸(Axup等人,2012,PNAS,109:16101-16106;审查参见C.C.Liu和P.G.Schultz,2010,Annu Rev Biochem[生物化学年鉴]79:413-444;Kim等人,2013,Curr Opin Chem Biol.[化学生物学研究现状]17:412-419)作为与药物缀合的位点。类似地,可以将用于酶促缀合方法的肽标签引入MBM中(参见,Strop等人2013,Chem Biol.[化学生物学]20(2):161-7;Rabuka,2010,Curr Opin Chem Biol.[化学生物学研究现状]14(6):790-6;Rabuka等人,2012,Nat Protoc.[自然实验手册]7(6):1052-67)。另一个例子是使用4’-磷酸泛酰巯基乙胺基转移酶(PPTase)用于辅酶A类似物的缀合(WO 2013184514)。根据本领域已知的方法,此类经修饰或工程化的MBM可以与有效负载或接头-有效负载组合缀合。
如本领域技术人员将理解的,与MBM分子连接的药剂(例如,细胞毒性剂和/或细胞抑制剂)的数量可以变化,使得ADC的集合在本质上可以是异质的,其中一些MBM含有一种连接的药剂,一些含有两种连接的药剂,一些含有三种连接的药剂等(并且有些不含连接的药剂)。异质性程度尤其将取决于用于连接药剂的化学物质。例如,在所述MBM被还原以产生用于附接的巯基基团的情况下,通常产生每分子具有0、2、4、6或8种连接的药剂的MBM的异质混合物。此外,通过限制附接化合物的摩尔比,通常产生每分子具有0、1、2、3、4、5、6、7或8种连接的药剂的MBM。因此,应理解,根据上下文,所述药物MBM比(DTR)可以是MBM的集合的平均值。例如,“DTR4”可以指未进行纯化分离特定DTR峰的ADC制剂,并且可以包含具有不同数量的附接的细胞抑制剂和/或细胞毒性剂/MBM的ADC分子的异质混合物(例如,0、2、4、6、8种试剂/MBM),但平均药物与MBM比为4。类似地,在一些实施例中,“DTR2”是指异质ADC制剂,其中平均药物与MBM比为2。
当希望富集的制剂时,可以经由纯化异质混合物,例如经由柱色谱法,例如疏水相互作用色谱法,获得具有确定数量的连接的药剂(例如,细胞毒性剂和/或细胞抑制剂)的MBM。
纯度可以通过本领域已知的多种方法评估。作为具体实例,可以经由HPLC或其他色谱法分析ADC制剂,并通过分析所得峰的曲线下面积来评估纯度。
7.9.药物组合物
本披露的MBM(例如TBM)(以及它们的缀合物;除非上下文另有说明,否则本披露中对MBM的引用也指包含MBM的缀合物,如ADC)可以配制为包含所述MBM的药物组合物,例如含有一种或多种药学上可以接受的赋形剂或载体。为了制备包含本披露的MBM的药物或无菌组合物,可以将MBM制剂与一种或多种药学上可接受的赋形剂或载体组合。
例如,MBM的配制品可以通过将MBM与生理上可接受的载体、赋形剂、或稳定剂以例如冻干粉剂、浆液、水溶液、洗剂或悬浮液的形式混合来制备(参见例如,Hardman等人,2001,Goodman and Gilman’s The Pharmacological Basis of Therapeutics[Goodman和Gilman的治疗的药理学基础],McGraw-Hill(麦格劳-希尔集团),纽约,纽约州;Gennaro,2000,Remington:The Science and Practice of Pharmacy[雷明顿:药学科学与实践],利平科特·威廉斯和威尔金斯出版公司(Lippincott,Williams,and Wilkins),纽约,纽约州;Avis等人(编辑),1993,Pharmaceutical Dosage Forms:General Medications[药物剂型:一般药物],马塞尔·德克尔公司,纽约;Lieberman等人(编辑),1990,PharmaceuticalDosage Forms:Tablets[药物剂型:片剂],马塞尔·德克尔公司,纽约;Lieberman等人(编辑),1990,Pharmaceutical Dosage Forms:Disperse Systems[药物剂型:分散系统],马塞尔·德克尔公司(Marcel Dekker),纽约;Weiner和Kotkoskie,2000,Excipient Toxicityand Safety[赋形剂毒性和安全性],马塞尔德克尔公司(Marcel Dekker,Inc.),纽约,纽约州)。
为MBM选择施用方案取决于若干种因素,包括MBM的血清或组织周转速率、症状水平、MBM的免疫原性、以及靶细胞的可及性。在某些实施例中,施用方案使递送至受试者的TBM的量最大化,与可接受水平的副作用一致。因此,递送的MBM的量部分地取决于具体MBM和正在治疗的病症的严重程度。选择适当剂量的抗体和小分子的指南是可获得的(参见例如,Wawrzynczak,1996,Antibody Therapy[抗体疗法],Bios Scientific Pub.Ltd(Bios科学出版社有限公司),牛津郡,英国;Kresina(编辑),1991,Monoclonal Antibodies,Cytokines and Arthritis[单克隆抗体、细胞因子和关节炎],马塞尔德克尔公司(MarcelDekker),纽约,纽约州;Bach(编辑),1993,Monoclonal Antibodies and Peptide Therapyin Autoimmune Diseases[自免疫疾病中的单克隆抗体和肽疗法],马塞尔德克尔公司(Marcel Dekker),纽约,纽约州;Baert等人,2003,New Engl.J.Med.[新英格兰医学杂志]348:601-608;Milgrom等人,1999,New Engl.J.Med.[新英格兰医学杂志]341:1966-1973;Slamon等人,2001,New Engl.J.Med.[新英格兰医学杂志]344:783-792;Beniaminovitz等人,2000,New Engl.J.Med.[新英格兰医学杂志]342:613-619;Ghosh等人,2003,NewEngl.J.Med.[新英格兰医学杂志]348:24-32;Lipsky等人,2000,New Engl.J.Med.[新英格兰医学杂志]343:1594-1602)。
由临床医生,例如,使用本领域已知或疑似影响治疗或预计影响治疗的参数或因素确定适当的剂量。通常,剂量始于略小于最佳剂量的量并此后将其以小增量增加,直至相对于任何不利副作用,实现所希望的或最佳的效果。重要的诊断量值包括症状(例如炎症)的那些量值或产生的炎性细胞因子的水平。
可以改变本披露药物组合物中MBM的实际剂量水平,以便获得一定量的MBM,其有效地实现对于特定的受试者、组合物和施用方式的所希望的治疗反应,而对所述受试者没有毒性。所选择的剂量水平将取决于多种药代动力学因素,包括特定MBM的活性,施用途径,施用时间,所采用的特定MBM的排泄速率,治疗持续时间,与所采用的特定MBM组合的其他药剂(例如活性药剂,如治疗药物或化合物和/或用作载体的惰性材料),所治疗受试者的年龄、性别、体重、状况、一般健康状况和先前病史,以及医学领域中已知的类似因素。
包含本披露的MBM的组合物可以通过连续输注,或以例如一天、一周的间隔或每周1-7次按剂量提供。可以通过静脉内、皮下、局部、口服、经鼻、经直肠、肌肉内、脑内或通过吸入来提供剂量。特定剂量方案是涉及避免明显不希望的副作用的最大剂量或给药频率的方案。
特定受试者的有效量可以根据如以下的因素改变:所治疗的病症、受试者的总体健康状况、施用的方法、途径和剂量和副作用的严重程度(参见,例如,Maynard等人,(1996),A Handbook of SOPs for Good Clinical Practice[用于良好临床实践的SOP指南],国际药物出版社(Interpharm Press),佛罗里达州波卡拉顿(Boca Raton,Fla.);Dent(2001)Good Laboratory and Good Clinical Practice[良好实验和良好临床实践],厄奇出版社(Urch Publ.),伦敦,英国)。
施用途径可以是通过例如局部或皮肤应用,通过静脉内、腹膜内、脑内、肌内、眼内、动脉内、脑脊内、病灶内进行的注射或输注,或通过缓释系统或植入物(参见例如,Sidman等人,1983,Biopolymers[生物聚合物]22:547-556;Langer等人,1981,J.Biomed.Mater.Res.[生物医学材料研究杂志]15:167-277;Langer,1982,Chem.Tech.[化学技术]12:98-105;Epstein等人,1985Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]82:3688-3692;Hwang等人,1980Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]77:4030-4034;美国专利号6,350,466和6,316,024)。必要时,组合物还可以包含增溶剂和局部麻醉剂(如利多卡因)以减轻注射部位的疼痛。此外,也可以采用肺部施用,例如通过使用吸入器或雾化器以及具有雾化剂的配制品。参见例如,美国专利号6,019,968、5,985,320、5,985,309、5,934,272、5,874,064、5,855,913、5,290,540、和4,880,078;以及PCT公开号WO 92/19244、WO 97/32572、WO 97/44013、WO 98/31346、和WO 99/66903。
本披露的组合物还可以经由一种或多种施用途径使用本领域中已知的多种方法中的一种或多种施用。如本领域技术人员将理解的,施用途经和/或模式将根据所希望结果而变化。选择的MBM的施用途径包括静脉内、肌肉内、皮内、腹膜内、皮下、脊柱或其他一般施用途径,例如通过注射或输注。一般施用可以代表除了肠道和局部施用之外的施用方式,通常通过注射,并且包括但不限于静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬脑膜外以及胸骨内注射和输注。可替代地,本披露的组合物可以经由非一般途径施用,例如局部、表皮或粘膜施用途径,例如,鼻内、口服、阴道、直肠、舌下或局部施用。在一个实施例中,所述MBM通过输注施用。在另一个实施例中,皮下施用本披露的多特异性表位结合蛋白。
如果MBM以控释或缓释系统施用,则可以使用泵来实现控释或缓释(参见Langer,同上;Sefton,1987,CRC Crit.Ref Biomed.Eng.[CRC在生物医学工程中的参考评论]14:20;Buchwald等人,1980,Surgery[外科手术]88:507;Saudek等人,1989,N.Engl.J.Med.[新英格兰医学杂志]321:574)。聚合物材料可以用于实现本披露治疗剂的控释或缓释(参见例如,Medical Applications of Controlled Release[控释药物的医学应用],Langer和Wise(编辑),CRC Pres.[CRC出版社],Boca Raton,Fla.[佛罗里达州波卡拉顿](1974);Controlled Drug Bioavailability,Drug Product Design and Performance[受控的药物生物利用率、药物产物设计以及性能],Smolen和Ball(编),Wiley[威利出版公司],NewYork[纽约市](1984);Ranger和Peppas,1983,J.,Macromol.Sci.Rev.Macromol.Chem.[高分子科学杂志-高分子化学评论]23:61;还参见Levy等人,1985,Science[科学]228:190;During等人,1989,Ann.Neurol.[神经病学记事]25:351;Howard等人,1989,J.Neurosurg.[神经外科杂志]71:105);美国专利号5,679,377;美国专利号5,916,597;美国专利号5,912,015;美国专利号5,989,463;美国专利号5,128,326;PCT公开号WO 99/15154;以及PCT公开号WO 99/20253)。用于缓释配制品中的聚合物的实例包括但不限于聚(甲基丙烯酸2-羟乙酯)、聚(丙烯酸甲酯)、聚(丙烯酸)、聚(乙烯-共-乙酸乙烯)、聚(甲基丙烯酸)、聚乙交酯(PLG)、聚酸酐、聚(N-乙烯基吡咯烷酮)、聚(乙烯醇)、聚丙烯酰胺、聚(乙二醇)、聚丙交酯(PLA)、聚(丙交酯-共-乙交酯)(PLGA)以及聚原酸酯。在一个实施例中,用于缓释配制品的聚合物是惰性的,不含可浸出的杂质,在储存时稳定,无菌并且可生物降解。可以将控释或缓释系统置于预防或治疗靶标附近,因此仅需要全身剂量的一部分(参见例如,Goodson,于Medical Applications of Controlled Release[控释的医学应用],同上,第2卷,第115-138页(1984))。
控释系统在Langer的综述中讨论(1990,Science[科学]249:1527-1533)。可以使用本领域技术人员已知的任何技术来产生包含本披露的一种或多种MBM的持续释放配制品。参见,例如,美国专利号4,526,938;PCT公开WO 91/05548;PCT公开WO 96/20698;Ning等人,1996,Radiotherapy&Oncology[放射疗法和肿瘤学]39:179-189;Song等人,1995,PDAJournal of Pharmaceutical Science&Technology[PDA药学科学与技术]50:372-397;Cleek等人,1997,Pro.Int'l.Symp.Control.Rel.Bioact.Mater.[控释生物活性材料国际研讨会学报]24:853-854;和Lam等人,1997,Proc.Int'l.Symp.ControlRel.Bioact.Mater.[控释生物活性材料国际研讨会学报]24:759-760。
如果局部施用MBM,则它们可以以软膏剂、乳膏剂、透皮贴剂、洗剂、凝胶、洗发剂、喷雾剂、气溶胶、溶液、乳油剂、或本领域技术人员熟知的其他形式配制。参见例如,Remington's Pharmaceutical Sciences and Introduction to Pharmaceutical DosageForms[雷明顿制药科学和药物剂型简介],第19版,Mack Pub.Co.(马克出版公司),伊斯顿,宾夕法尼亚州(1995)。对于不可喷雾的局部剂型,通常使用粘性至半固体或固体形式,其包含载剂或一种或多种与局部施用相容并且具有动态粘度的赋形剂,在一些情况下,其具有大于水的动态粘度。合适的配制品包括但不限于溶液、悬浮液、乳油剂、乳膏剂、软膏剂、粉剂、搽剂、油膏剂等,如果希望,可以是灭菌的或与辅助剂(例如,防腐剂、稳定剂、润湿剂、缓冲液、或盐)混合,用于影响各种特性,例如像渗透压。其他合适的局部剂型包括可喷雾气溶胶制剂,其中在一些情况下将活性成分与固体或液体惰性载体组合包装在具有加压的挥发性物质(例如,气体推进剂,如氟利昂(Freon))的混合物中或挤瓶中。如果希望,还可以将保湿剂或湿润剂添加到药物组合物和剂型中。此类其他成分的实例是本领域熟知的。
如果鼻内施用包含MBM的组合物,则可以将所述MBM以气溶胶形式、喷雾剂、雾化剂或以滴剂形式配制。特别地,用于根据本披露使用的预防剂和治疗剂可以使用一种合适的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体)以从加压式包装或喷雾器的气溶胶喷雾展现的形式方便地进行递送。在加压的气溶胶的情况下,可以通过提供阀门来确定剂量单位,以递送经计量的量。在吸入器或吹入器中使用的胶囊剂和药筒(由例如明胶组成)可以配制成含有化合物和合适散剂基料(如乳糖或淀粉)的粉末混合物。
本披露的MBM(例如TBM)可以以组合疗法方案施用,如下文中的7.11节中所述。
在某些实施例中,可以配制MBM以确保体内适当分布。例如,血脑屏障(BBB)排除许多高度亲水性化合物。为确保本披露的治疗性化合物穿过BBB(如果希望),可以将它们以例如脂质体配制。对于制备脂质体的方法,参见例如,美国专利号4,522,811;5,374,548;和5,399,331。脂质体可以包括被选择性运输至特定细胞或器官中,由此增强靶向药物递送的一个或多个部分(参见例如,Ranade,1989,J.Clin.Pharmacol.[临床药理学杂志]29:685)。示例性靶向部分包括叶酸或生物素(参见例如,Low等人的美国专利号5,416,016);甘露糖苷(Umezawa等人,1988,Biochem.Biophys.Res.Commun.[生物化学与生物物理研究通讯]153:1038);抗体(Bloeman等人,1995,FEBS Lett.[欧洲生化学会联合会快报]357:140;Owais等人,1995,Antimicrob.Agents Chemother.[抗微生物剂化学疗法]39:180);表面活性剂蛋白质A受体(Briscoe等人,1995,Am.J.Physiol.[美国生理学杂志]1233:134);p 120(Schreier等人,1994,J.Biol.Chem.[生物化学杂志]269:9090);还参见Keinanen和Laukkanen,1994,FEBS Lett.[欧洲生化学会联合会快报]346:123;Killion和Fidler,1994,Immunomethods[免疫方法]4:273。
当用于组合疗法时,例如,如下文中的7.11节中所述,可以将本披露的MBM和一种或多种另外的药剂以相同药物组合物施用至受试者。可替代地,组合疗法的MBM和一种或多种另外的药剂可以以单独的药物组合物并行施用至受试者。
本文所述的治疗方法可以进一步包括进行“伴随诊断”测试,由此测试来自作为本披露的MBM疗法候选者的受试者的样品由ABM1或ABM2靶向的TAA表达。伴随诊断测试可以在本披露的MBM疗法启动之前和/或在本披露的MBM治疗方案期间进行,以监测受试者对MBM疗法的持续适用性。伴随诊断中使用的药剂可以是MBM本身或另一种诊断剂,例如针对由ABM1或ABM2识别的TAA的标记的单特异性抗体或用于检测TAA RNA的核酸探针。可以在伴随诊断测定中测试的样品可以是其中可以存在由MBM靶向的细胞的任何样品,例如肿瘤(例如,实体瘤)活组织切片、淋巴、粪便、尿液、血液或可能含有循环肿瘤细胞的任何其他体液。
7.10.治疗适应症
7.10.1.癌症
本披露的MBM(例如TBM)可以用于治疗任何增殖性障碍(例如癌症),所述增殖性障碍表达7.6节中所述的TAA或7.6节中所述的TAA的组合,(例如,特征在于表达相同癌性细胞上的两种TAA的癌性细胞的癌症,或特征在于表达不同癌性细胞上的第一TAA和第二TAA的癌性细胞的癌症)。在具体的实施例中,所述癌症是B细胞恶性肿瘤。可以被靶向的典型类型的B细胞恶性肿瘤包括霍奇金淋巴瘤、非霍奇金淋巴瘤(NHL)、和多发性骨髓瘤。NHL的实例包括弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤、慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤、伯基特淋巴瘤、淋巴浆细胞性淋巴瘤(瓦尔登斯特伦巨球蛋白血症)、毛细胞白血病、原发性中枢神经系统(CNS)淋巴瘤、原发性纵隔大B细胞淋巴瘤、纵隔灰区淋巴瘤(MGZL)、脾边缘区B细胞淋巴瘤、MALT的结外边缘区B细胞淋巴瘤、结节边缘区B细胞淋巴瘤、和原发性渗出性淋巴瘤。
在一些实施例中,本披露的MBM用于治疗霍奇金淋巴瘤。
在一些实施例中,本披露的MBM用于治疗非霍奇金淋巴瘤。
在一些实施例中,本披露的MBM用于治疗弥漫性大B细胞淋巴瘤(DLBCL)。
在一些实施例中,本披露的MBM用于治疗滤泡性淋巴瘤。
在一些实施例中,本披露的MBM用于治疗慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)。
在一些实施例中,本披露的MBM用于治疗套细胞淋巴瘤(MCL)。
在一些实施例中,本披露的MBM用于治疗边缘区淋巴瘤。
在一些实施例中,本披露的MBM用于治疗伯基特淋巴瘤。
在一些实施例中,本披露的MBM用于治疗淋巴浆细胞性淋巴瘤(瓦尔登斯特伦巨球蛋白血症)。
在一些实施例中,本披露的MBM用于治疗毛细胞白血病。
在一些实施例中,本披露的MBM用于治疗原发性中枢神经系统(CNS)淋巴瘤。
在一些实施例中,本披露的MBM用于治疗原发性纵隔大B细胞淋巴瘤。
在一些实施例中,本披露的MBM用于治疗纵隔灰区淋巴瘤(MGZL)。
在一些实施例中,本披露的MBM用于治疗脾边缘区B细胞淋巴瘤。
在一些实施例中,本披露的MBM用于治疗MALT的结外边缘区B细胞淋巴瘤。
在一些实施例中,本披露的MBM用于治疗结节边缘区B细胞淋巴瘤。
在一些实施例中,本披露的MBM用于治疗原发性渗出性淋巴瘤。
在一些实施例中,本披露的MBM用于治疗浆细胞样树突状细胞瘤。
在一些实施例中,本披露的MBM用于治疗多发性骨髓瘤。
7.10.2.自体免疫性障碍
本披露的MBM(例如TBM)可以用于治疗自体免疫性障碍,所述自体免疫性障碍可以源自B细胞耐受性的损失和自身抗体的不适当产生。可以用本披露的MBM治疗的自体免疫性障碍包括系统性红斑狼疮(SLE)、干燥综合征、硬皮病、类风湿性关节炎(RA)、幼年特发性关节炎、移植物抗宿主病、皮肌炎、I型糖尿病、桥本氏甲状腺炎、格雷夫斯病、爱迪生氏病、乳糜泻、克罗恩病、恶性贫血、寻常型天疱疮、白癜风、自身免疫性溶血性贫血、特发性血小板减少性紫癜、巨细胞动脉炎、重症肌无力、多发性硬化症(MS)(例如复发缓解型多发性硬化症(RRMS))、肾小球肾炎、肺出血肾炎综合征、大疱性类天疱疮、溃疡性结肠炎、格巴二氏综合征、慢性炎性脱髓鞘性多发性神经病、抗磷脂综合征、发作性睡病、结节病、或韦格纳氏肉芽肿病。
在一些实施例中,本披露的MBM用于治疗系统性红斑狼疮(SLE)。
在一些实施例中,本披露的MBM用于治疗干燥综合征。
在一些实施例中,本披露的MBM用于治疗硬皮病。
在一些实施例中,本披露的MBM用于治疗类风湿性关节炎(RA)。
在一些实施例中,本披露的MBM用于治疗幼年特发性关节炎。
在一些实施例中,本披露的MBM用于治疗移植物抗宿主病。
在一些实施例中,本披露的MBM用于治疗皮肌炎。
在一些实施例中,本披露的MBM用于治疗I型糖尿病。
在一些实施例中,本披露的MBM用于治疗桥本氏甲状腺炎。
在一些实施例中,本披露的MBM用于治疗格雷夫斯病。
在一些实施例中,本披露的MBM用于治疗爱迪生氏病。
在一些实施例中,本披露的MBM用于治疗乳糜泻。
在一些实施例中,本披露的MBM用于治疗克罗恩病。
在一些实施例中,本披露的MBM用于治疗恶性贫血。
在一些实施例中,本披露的MBM用于治疗寻常型天疱疮。
在一些实施例中,本披露的MBM用于治疗白癜风。
在一些实施例中,本披露的MBM用于治疗自身免疫性溶血性贫血。
在一些实施例中,本披露的MBM用于治疗特发性血小板减少性紫癜。
在一些实施例中,本披露的MBM用于治疗巨细胞动脉炎。
在一些实施例中,本披露的MBM用于治疗重症肌无力。
在一些实施例中,本披露的MBM用于治疗多发性硬化症(MS)。在一些实施例中,所述MS是复发缓解型多发性硬化症(RRMS)。
在一些实施例中,本披露的MBM用于治疗肾小球肾炎。
在一些实施例中,本披露的MBM用于治疗肺出血肾炎综合征。
在一些实施例中,本披露的MBM用于治疗大疱性类天疱疮。
在一些实施例中,本披露的MBM用于治疗溃疡性结肠炎。
在一些实施例中,本披露的MBM用于治疗格巴二氏综合征。
在一些实施例中,本披露的MBM用于治疗慢性炎性脱髓鞘性多发性神经病。
在一些实施例中,本披露的MBM用于治疗抗磷脂综合征。
在一些实施例中,本披露的MBM用于治疗发作性睡病。
在一些实施例中,本披露的MBM用于治疗结节病。
在一些实施例中,本披露的MBM用于治疗韦格纳氏肉芽肿病。
7.11.组合疗法
本披露的MBM(例如TBM)可以与其他已知的药剂和疗法组合使用。例如,本披露的MBM可用于治疗方案,所述治疗方案与手术、化疗、抗体、放射、肽疫苗、类固醇、细胞毒素、蛋白酶体抑制剂、免疫调节药物(例如IMiD)、BH3模拟物、细胞因子疗法、干细胞移植或其任何组合进行组合。不受理论的束缚,据信,本披露的MBM的优点之一是它们可以避免向患有B细胞恶性肿瘤的受试者施用单独的抗体的需要。因此,在某些实施例中,所述一种或多种另外的药剂并不包括抗体(例如利妥昔单抗)。
为了方便起见,与本披露的MBM组合使用的药剂在本文中被称为“另外的”药剂。
如本文所用的,“组合”施用意指在受试者患病期间将两种(或更多种)不同的治疗递送至受试者,例如在受试者被诊断患有障碍后并且在所述障碍被治愈或清除前或者在由于其他原因终止治疗前递送两种或更多种治疗。在一些实施例中,第一治疗的递送在第二治疗的递送开始时仍在进行,所以就施用而言存在重叠。这在本文中有时被称为“同时递送”或“并行递送”。所述术语“并行”不限于在完全相同的时间施用疗法(例如,MBM和另外的药剂),而是意指将包含本披露的MBM的药物组合物以一种顺序并在一定时间间隔内施用至受试者,使得本披露的MBM可以与一种或多种另外的疗法一起发挥作用,以提供增加的益处(与如果以其他方式施用它们时相比)。例如,可以将每种疗法在相同的时间或以任何次序依序在不同的时间点施用至受试者;然而,如果不在相同的时间施用,则它们应当在时间上充分接近地施用,从而以提供所希望的治疗效果。
本披露的MBM和一种或多种另外的药剂可以以相同或分开的组合物同时或依序施用。对于依序施用,可以首先施用所述MBM,并且可以其次施用另外的药剂,或者可以颠倒施用顺序。
所述MBM和一种或多种另外的药剂可以以任何适当的形式和通过任何合适的途径施用至受试者。在一些实施例中,所述施用途径是相同的。在其他实施例中,所述施用途径是不同的。
在其他实施例中,一种治疗的递送在另一种治疗的递送开始前结束。
在每一种情况的一些实施例中,治疗因组合施用而更有效。例如,与不存在第一治疗的条件下施用第二治疗所观察到的结果相比,第二治疗更有效,例如使用更少的第二治疗观察到等效的作用,或者第二治疗将症状减少更大的程度,或者观察到对第一治疗而言类似的情况。在一些实施例中,与一种治疗不存在的情况下递送另一种治疗所观察到的结果相比,递送使得症状或与所述障碍相关的其他参数减少更多。两种治疗的作用可以部分累加、完全累加或大于累加。所述递送可以使得当递送第二治疗时,递送的第一治疗的作用仍然是可以检测的。
本披露的MBM和/或另外的药剂可以在活性障碍期间,或在缓解或活性较低的疾病期间施用。MBM可以在用一种或多种另外的药剂治疗之前施用,与用一种或多种另外的药剂治疗并行施用,在用一种或多种另外的药剂治疗后施用,或在障碍缓解期间施用。
当组合施用时,可以将MBM和/或一种或多种另外的药剂以比单独使用(例如,作为单一疗法)的每种药剂的量或剂量更高、更低或相同的量或剂量施用。
本披露的组合疗法的一种或多种另外的药剂可以并行施用至受试者。所述术语“并行”不限于在完全相同的时间施用疗法(例如,预防剂或治疗剂),而是意指将包含本披露的MBM的药物组合物以一种顺序并在一定时间间隔内施用至受试者,使得本披露的分子可以与一种或多种另外的疗法一起发挥作用,以提供增加的益处(与如果以其他方式施用它们时相比)。例如,可以将每种疗法在相同的时间或以任何次序依序在不同的时间点施用至受试者;然而,如果不在相同的时间施用,则应当在时间上充分接近地施用所述疗法,以提供所希望的治疗或预防作用。可以将每种疗法以任何适当的形式并且通过任何合适的途径分别施用至受试者。
所述MBM和一种或多种另外的药剂可以通过相同或不同施用途径施用至受试者。
可以循环施用所述MBM和一种或多种另外的药剂。循环疗法涉及施用第一疗法(例如,第一预防剂或治疗剂)一段时间,随后施用第二疗法(例如,第二预防剂或治疗剂)一段时间,任选地,随后施用第三疗法(例如,预防剂或治疗剂)一段时间等,并重复这种依序施用,即循环,以减少对所述疗法之一的抗性的发展,以避免或减少所述疗法之一的副作用,和/或以改善所述疗法的功效。
在某些情况下,所述一种或多种另外的药剂是其他抗癌剂、抗过敏剂、抗恶心剂(或抗呕剂)、镇痛药、细胞保护剂及其组合。
在一个实施例中,本披露的MBM可以与抗癌剂组合施用。尤其受关注的用于与本披露的MBM组合的抗癌剂包括:蒽环霉素;烷基化剂;抗代谢物;抑制钙依赖性磷酸酶钙调磷酸酶或p70S6激酶FK506)或抑制p70S6激酶的药物;mTOR抑制剂;免疫调节剂;蒽环霉素;长春花生物碱;蛋白酶体抑制剂;GITR激动剂;蛋白酪氨酸磷酸酶抑制剂;CDK4激酶抑制剂;BTK抑制剂;MKN激酶抑制剂;DGK激酶抑制剂;溶瘤病毒;BH3模拟物,和细胞因子疗法。
本披露的MBM可以与一种或多种抗癌剂组合施用,所述抗癌剂防止或减缓由MBM的ABM中的一个或多个靶向的抗原的脱落,由此减少可溶性TAA的量,和/或增加细胞表面结合的TAA的量。例如,MBM可以与ADAM10/17抑制剂(例如INCB7839)组合施用,例如用来阻断通过ADAM10/17的从癌细胞释放的抗原的脱落,或可以与磷脂酶抑制剂组合施用,例如用来阻断通过磷脂酶的从癌细胞释放的抗原的脱落。对于与具有靶向BCMA的ABM的本披露的MBM组合,还特别感兴趣的是γ分泌酶调节剂,例如γ分泌酶抑制剂(GSI)。
示例性的烷化剂包括但不限于氮芥、乙烯亚胺衍生物、烷基磺酸盐、亚硝基脲和三氮烯):乌拉莫司汀(Aminouracil
示例性mTOR抑制剂包含例如坦罗莫司;地磷莫司(正式地称为deferolimus,(1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-二羟基-19,30-二甲氧基-15,17,21,23,29,35-六甲基-2,3,10,14,20-五氧杂-11,36-二氧杂-4-氮杂三环[30.3.1.04,9]三十六碳-16,24,26,28-四烯-12-基]丙基]-2-甲氧基环己基二甲基次膦酸酯,也称为AP23573和MK8669,并且描述于PCT公开号WO 03/064383中);依维莫司(
示例性免疫调节剂包括例如阿托珠单抗(可购自
示例性蒽环霉素包括例如,多柔比星(
示例性长春花生物碱包括例如,酒石酸长春瑞滨
示例性蛋白酶体抑制剂包括硼替佐米
示例性BH3模拟物包括维尼托克莱克斯(venetoclax)(ABT-737,4-{4-[(4’-氯-2-二苯基基)甲基]-1-哌嗪基}-N-[(4-{[(2R)-4-(二甲基氨基)-1-(苯基硫烷基)-2-丁基]氨基}-3-硝基苯基)磺酰基]苯甲酰胺和那维托克莱克斯(navitoclax)(以前称为ABT-263)。
示例性γ-分泌酶抑制剂包括具有式(I)的化合物或其药学上可接受的盐;
其中环A是芳基或杂芳基;R
在实施例中,具有式(I)的化合物是美国专利号7,468,365中描述的化合物。在又另一个实施例中,所述化合物是
或其药学上可接受的盐。
所述GSI可以是具有式(II)的化合物或其药学上可接受的盐;
其中环B是芳基或杂芳基;L是键、C
在另外的实施例中,具有式(II)的化合物是美国专利号7,687,666中描述的化合物。在又另一个实施例中,所述化合物是
或其药学上可接受的盐。
在一些实施例中,所述GSI是具有式(III)的化合物,或其药学上可接受的盐:
其中环C和环D中的每个独立地是芳基或杂芳基;
每个R
在另外的实施例中,所述GSI是美国专利号8,084,477中描述的化合物。在又另一个实施例中,所述GSI是
或其药学上可接受的盐。
在一些实施例中,所述GSI是美国专利号7,160,875中描述的化合物。在一些实施例中,所述γ分泌酶抑制剂是具有式(IV)的化合物,或其药学上可接受的盐:
其中R
a.
b.
c.
d.
R
在一些实施例中,所述GSI是
或其药学上可接受的盐。
在一些实施例中,所述GSI是美国专利号6,984,663中描述的化合物。在一些实施例中,所述GSI是具有式(V)的化合物或其药学上可接受的盐:
其中
q是0或1;Z代表卤素、-CN、-NO
在一些实施例中,所述GSI是
或其药学上可接受的盐。
在一些实施例中,所述GSI是美国专利号7,795,447中描述的化合物。在一些实施例中,所述GSI是具有式(VI)的化合物或其药学上可接受的盐。
其中A’不存在或选自
和-S(O)
Z选自-CH
-C(=O)R
在一些实施例中,所述GSI是
或其药学上可接受的盐。
在一些实施例中,所述GSI是降低γ分泌酶的表达和/或功能的抗体分子。在一些实施例中,所述GSI是靶向γ分泌酶亚单元的抗体分子。在一些实施例中,所述GSI选自抗早老素抗体分子、抗呆蛋白(nicastrin)抗体分子、抗APH-1抗体分子、或抗PEN-2抗体分子。
靶向γ分泌酶亚单元(例如,例如,早老素、呆蛋白、APH-1、或PEN-2)的示例性抗体分子描述于US 8,394,376、US 8,637,274、和US 5,942,400中。
也可以使用WO 2017/019496中描述的γ分泌酶调节剂。在一些实施例中,所述γ分泌酶调节剂是γ-分泌酶抑制剂I(GSI I)Z-Leu-Leu-正亮氨酸;γ-分泌酶抑制剂II(GSIII);γ-分泌酶抑制剂III(GSI III),N-苄氧羰基-Leu-亮氨酸、N-(2-萘甲酰基)-Val-苯丙氨醛;γ-分泌酶抑制剂IV(GSI IV);γ-分泌酶抑制剂V(GSI V),N-苄氧羰基-Leu-苯丙氨醛;γ-分泌酶抑制剂VI(GSI VI),1-(S)-内切-N-(1,3,3)-三甲基二环[2.2.1]庚-2-基)-4-氟苯基磺胺;γ-分泌酶抑制剂VII(GSI VII),薄荷基氧基羰基-LL-CHO;γ-分泌酶抑制剂IX(GSI IX),(DAPT),N-[N-(3,5-二氟苯乙酰基-L-丙氨酰基)]-S-苯基甘氨酸叔丁基酯;γ-分泌酶抑制剂X(GSI X),{1S-苄基-4R-[1-(1S-氨基甲酰基-2-苯乙基氨基甲酰基)-1S-3-甲基丁基氨基甲酰基]-2R-羟基-5-苯基戊基}氨基甲酸叔丁基酯;γ-分泌酶抑制剂XI(GSI XI),7-氨基-4-氯-3-甲氧基异香豆素;γ-分泌酶抑制剂XII(GSI XII),Z-Ile-Leu-CHO;γ-分泌酶抑制剂XIII(GSI XIII),Z-Tyr-Ile-Leu-CHO;γ-分泌酶抑制剂XIV(GSIXIV),Z-Cys(t-Bu)-Ile-Leu-CHO;γ-分泌酶抑制剂XVI(GSI XVI),N-[N-3,5-二氟苯乙酰基]-L-丙氨酰基-S-苯基甘氨酸甲基酯;γ-分泌酶抑制剂XVII(GSI XVII);γ-分泌酶抑制剂XIX(GSI XIX),苯并[e][l,4]二氮杂卓-3-基)-丁酰胺;γ-分泌酶抑制剂XX(GSI XX),(S,S)-2-[2-(3,5-二氟苯基)乙酰基氨基]-N-(5-甲基-6-氧代-6,7-二氢-5H-二苯并[b,d]氮杂卓-7-基)丙酰胺;γ-分泌酶抑制剂XXI(GSI XXI),(S,S)-2-[2-(3,5-二氟苯基)-乙酰基氨基]-N-(l-甲基-2-氧代-5-苯基-2-,3-二氢-lH-苯并[e][l,4]二氮杂卓-3-基)-丙酰胺;γ40分泌酶抑制剂I,N-反式-3,5-二甲氧基肉桂酰基-Ile-亮氨酸;γ40分泌酶抑制剂II,N-叔-丁氧基羰基-Gly-Val-缬氨醇异戊酰-V V-Sta-A-Sta-OCH3;MK-0752(默克公司);MRK-003(默克公司);司马西特/LY450139(礼来公司(Eli Lilly));RO4929097;PF-03084014;BMS-708163;MPC-7869(γ-分泌酶改性剂)、YO-01027(二苯并氮杂卓);LY411575(礼来公司(Eli Lilly and Co.));L-685458(西格玛奥德里奇公司(Sigma-Aldrich));BMS-289948(4-氯-N-(2,5-二氟苯基)-N-((lR)-{4-氟-2-[3-(lH-咪唑-l-基)丙基]苯基}乙基)苯磺胺盐酸盐);或BMS-299897(4-[2-((lR)-l-{[(4-氯苯基)磺酰基]-2,5-二氟苯胺基}乙基)-5-氟苯基丁酸)(百时美施贵宝公司(Bristol Myers Squibb))。
示例性细胞因子疗法包括白介素2(IL-2)和干扰素-α(IFN-α)。
在某些方面,不同的化学治疗剂的“混合物”作为一种或多种另外的药剂施用。
在一些实施例中,要与本披露的MBM组合施用的一种或多种另外的药剂是一种或多种标准护理剂或疗法和/或实验治疗。
对于霍奇金淋巴瘤,组合药剂/疗法包括放射和/或化疗(例如ABVD(多柔比星、博莱霉素、长春碱、和达卡巴嗪)、BEACOPP(博莱霉素、依托泊苷、多柔比星、环磷酰胺、长春新碱、丙卡巴肼和强的松)、或斯坦福(Stanford)V(多柔比星、二氯甲基二乙胺(氮芥)、长春新碱、长春碱、博莱霉素、依托泊苷、和强的松))、抗体(例如本妥昔单抗(brentuximabvedotin)、利妥昔单抗、或检查点抑制剂,例如纳武单抗或派姆单抗)。
对于DLBCL,组合药剂/疗法包括单克隆抗体(例如利妥昔单抗(Rituxan))、化疗和/或放射。
对于滤泡性淋巴瘤,组合药剂/疗法包括化疗(例如苯达莫司汀(Treanda));单克隆抗体(例如利妥昔单抗)、标靶疗法(例如来那度胺(Revlimid))和/或放射。
对于套细胞淋巴瘤,组合药剂/疗法包括化疗(包括高剂量化疗)、单克隆抗体(例如利妥昔单抗)、标靶疗法(例如硼替佐米(Velcade)、依鲁替尼(Imbruvica)、和来那度胺(Revlimid))、干细胞移植和/或放射疗法。
对于小淋巴细胞性淋巴瘤,组合药剂/疗法包括化疗、单克隆抗体、干细胞移植、标靶疗法(例如依鲁替尼)、和/或肿瘤疫苗。
对于原发性纵隔大B细胞淋巴瘤和纵隔灰区淋巴瘤(MGZL),组合药剂/疗法包括基于蒽环类的化疗、利妥昔单抗和/或针对胸部的放射疗法。
对于脾边缘区B细胞淋巴瘤,组合药剂/疗法包括与滤泡性淋巴瘤相同的治疗,并且另外在一些情况下,切除脾脏。
对于MALT的结外边缘区B细胞淋巴瘤,组合药剂/疗法包括抗生素(用来治疗幽门螺杆菌的常见因果感染)、放射疗法、手术、化疗、和/或单克隆抗体。
对于结节边缘区B细胞淋巴瘤,组合药剂/疗法包括与滤泡性淋巴瘤相同的治疗。
对于淋巴浆细胞性淋巴瘤和瓦尔登斯特伦巨球蛋白血症(WM)变体,组合药剂/疗法包括可用于慢性淋巴细胞性白血病或滤泡性淋巴瘤的那些组合药剂/疗法(参见上文)。
对于原发性渗出性淋巴瘤,组合药剂/疗法包括可用于其他弥漫性大细胞淋巴瘤的那些组合药剂/疗法。
对于伯基特淋巴瘤/伯基特细胞淋巴瘤,组合药剂/疗法包括强化化疗。
对于多发性骨髓瘤,组合药剂/疗法包括地塞米松、泊马度胺(具有或不具有地塞米松)、来那度胺(具有或不具有地塞米松)、和硼替佐米(具有或不具有地塞米松)。
8.实例
8.1.实例1:抗CD19-抗CD20-抗CD3人IgG1双特异性和三特异性结合分子的产生和表征
8.1.1.材料和方法
8.1.1.1.双特异性和三特异性结合分子的基因构建、表达和纯化
外部合成所有构建体的基因合成,并针对哺乳动物细胞中的表达进行密码子优化。对于含有单一特异性的抗CD3、抗CD19和抗CD3臂,通过编码与传统抗体类似的可变重链区随后是全Fc序列的核苷酸序列,合成这些抗体。还合成了相应的全轻链质粒。对于含有抗CD19和抗CD3特异性的多特异性构建体,其是通过编码融合至CL的CD19的VL、随后是接头、随后是CD3抗体的全重链序列和Fc合成的。还合成了编码抗CD3臂的轻链和抗CD19臂的重链可变序列和CH1序列的质粒。恒定人IgG1序列含有沉默抗体依赖性细胞毒性的另外的突变,和在表达后促进双特异性抗体的产生的突变。所述构建体编码的氨基酸序列示出于表13中。
使抗CD19、抗CD20和抗CD3抗体在人胚胎肾(HEK293)细胞中瞬时表达。简而言之,使用PEI Max(聚乙烯亚胺,MW 40.000线性,Polysciences,USA目录号24765-2)作为转染试剂进行转染。对于小规模(<5L)转染,使细胞在加湿的培养箱(85%)中、在5%CO2下、在定轨振荡器(115rpm)上的摇瓶中生长。将轻链和重链质粒与PEI组合,最终比率为1DNA:3PEI。将1mg/L的质粒培养物用于按50万个细胞/mL血清介质进行转染。表达7天后,经由离心和过滤将培养基澄清来收获抗体。经由FPLC上的蛋白A亲和力色谱法(HiTrap-
使用纯化的抗体,如Labrijin等人,2014中所述,产生双特异性和三特异性抗体。按1:1比率混合含有靶向臂的所希望的组合的抗体,并且在2-巯基乙胺存在下孵育,从而减少重链间二硫键。将蛋白进行缓冲液交换,从而除去2-MEA还原剂,并且允许蛋白二硫键再氧化,从而形成稳定的异源二聚体。如果双特异性或三特异性抗体含有聚集体,使用HiLoad 16/60Superdex 200级柱(GE医疗生命科学公司集团,乌普萨拉,瑞典)进行制备型尺寸排阻色谱作为最终的精修步骤。
为了确认所表达的蛋白质的同一性与示出于表13中的初级氨基酸序列的预测质量相匹配,通过高效液相色谱结合质谱分析双特异性和多特异性蛋白。
8.1.1.2.体外功能活性
使用ALL细胞系NALM-6(DSMZ,不伦瑞克,德国)(将其转导从而稳定表达荧光素酶),用基于荧光素酶的细胞毒性测定,评估双特异性和三特异性抗体的体外功能活性。将分离自低温保存的PBMC的人T细胞与NALM-6靶细胞,按5:1的效应子:靶比率共培养。按不同浓度添加双特异性或三特异性抗体,并且孵育20小时,此后添加ONE-Glo荧光素酶测定底物(普洛麦格公司(Promega),麦迪逊,威斯康星州,美国)。针对处理的和未处理的(用来提供最大发光信号)孔,测量发光,并且将特异性裂解(%)确定为100-(样品发光/平均最大发光)*100
8.1.2.结果
双特异性和三特异性构建体的细胞毒性测定的结果示出于图5中。所有构建体示出了针对CD19
8.2.实例2:处于杵臼形式的抗CD19-抗BCMA-抗CD3人IgG1双特异性和三特异性结合分子的产生和表征
8.2.1.双特异性和三特异性结合分子的基因构建、表达和纯化
如实例1中所述进行基因合成。对于双特异性构建体,将抗BCMA或抗CD19重链合成为可变结构域与恒定hIgG1结构域的融合物,所述恒定hIgG1结构域含有针对臼的突变以促进异源二聚化以及N297A沉默突变。还合成了轻链质粒。对于抗CD3臂,将其作为与恒定hIgG1结构域融合的单链片段可变结构域产生,所述恒定hIgG1结构域含有针对杵的突变,以促进异源二聚化以及N297A沉默突变。还合成了含有多特异性的臂的质粒。另外,对于这些臂,还合成了抗BCMA臂的重链可变序列和CH1序列的质粒。所述构建体编码的氨基酸序列示出于表14中。
将双特异性和三特异性抗体在HEK293细胞中瞬时共表达。简而言之,使用PEI作为转染试剂进行转染。对于小规模(<5L)转染,使细胞在加湿的培养箱(85%)中、在5%CO2下、在定轨振荡器(115rpm)上的摇瓶中生长。将肿瘤抗原臂的轻链和重链质粒以及抗CD3质粒与PEI组合,最终比率为1DNA:3PEI。将1mg/L的质粒培养物用于按200万个细胞/mL血清介质进行转染。表达5天后,经由离心和过滤将培养基澄清来收获抗体。使用1ml树脂/100mL上清液,经由抗CH1亲和力批量结合(CaptureSelect IgG-CH1亲和力基质,美国马萨诸塞州沃尔瑟姆市的赛默飞世尔科技公司)或蛋白A(rProteinA Sepharose,快速流动,瑞典乌普萨拉的GE医疗公司)批量结合进行纯化。在温和混合的情况下,使蛋白质结合至少2小时,并将上清液装载到重力过滤柱上。用20-50个CV的PBS洗涤树脂。将抗体用20个CV的50mM柠檬酸盐、90mM NaCl(pH 3.2)、50mM蔗糖洗脱。将洗脱的IgG蛋白用1M柠檬酸钠、50mM蔗糖调节至pH5.5。如果抗体含有聚集体,使用Hi Load16/60Superdex 200级柱(GE医疗生命科学公司集团,乌普萨拉,瑞典)进行制备型尺寸排阻色谱作为最终的精修步骤。为了确认所表达的蛋白质的同一性与示出于表14中的初级氨基酸序列的预测质量相匹配,通过高效液相色谱结合质谱分析双特异性和多特异性蛋白。
8.2.2.体外功能活性
使用具有BCMA或CD19表达的癌细胞系,用基于荧光素酶的细胞毒性测定评估体外功能活性。将MM细胞系MM1和B-ALL细胞系Nalm-6用作靶细胞。将两种细胞系都转导为稳定表达荧光素酶。简而言之,收获靶细胞,并且按10,000个细胞/孔,与384孔平底微量滴定板上的连续稀释的抗体一起孵育。按6:1的效应子与靶的比率,将分离自人PBMC的扩展的T细胞添加至板。包括同种型对照双特异性Ab(具有不结合至肿瘤细胞的“模拟物”肿瘤-Ag臂)作为阴性对照。在共孵育后,将亮Glo(普洛麦格公司(Promega))添加到所有孔中,并且随后在Envision(珀金埃尔默公司(Perkin Elmer))上测量发光信号。使用以下公式计算靶细胞的RTCC百分比:(100-(样品/最大信号)*100%]。从单独的靶细胞(没有添加的Ab或T细胞)测量最大发光信号。
所有三特异性抗体均示出了针对BCMA
然后测试了双特异性和三特异性抗体靶向表达BCMA和CD19两者的恶性B细胞的能力。将非霍奇金淋巴瘤细胞系Ramos用作靶细胞,并且在测定之前,首先通过流式细胞术验证BCMA和CD19表达。在双特异性和三特异性抗体存在下,通过按指示的效应子与靶的比率,将Ramos细胞与扩展的T细胞一起孵育来测量细胞毒性。所有双特异性和三特异性抗体有效介导了Ramos细胞的裂解,其中三特异性抗体示出优越活性(图7)。特别地,BCMA-CD3-CD19三特异性抗体3b和3c示出了肿瘤细胞裂解显著增强(如EC50变化所证明的具有高>1000倍的效力),这指示了同时靶向两种抗原的协同效应(图8)。
8.3.实例3:抗CD138-抗BCMA-抗CD3人IgG1双特异性和三特异性抗体的产生和表征
8.3.1.双特异性和三特异性结合分子的基因构建、表达和纯化
如实例1中所述进行基因合成。对于双特异性构建体,将抗BCMA或抗CD138重链合成为可变结构域与恒定hIgG1结构域的融合物,所述恒定hIgG1结构域含有针对臼的突变以促进异源二聚化以及N297A沉默突变。合成了轻链质粒。对于抗CD3臂,将其作为与恒定hIgG1结构域融合的单链片段可变结构域产生,所述恒定hIgG1结构域含有针对杵的突变,以促进异源二聚化以及N297A沉默突变。合成了含有多特异性的臂的质粒,由此将抗BCMA的轻链融合至CD3结合物的scFv,其中肽接头随后是人Fc结构域。另外,对于此臂,还合成了抗BCMA臂的重链可变序列和CH1序列的质粒。所述构建体编码的氨基酸序列示出于表15中。
如实例1中所述,将双特异性和三特异性抗体在HEK293细胞中瞬时共表达。为了确认所表达的蛋白质的同一性与示出于表15中的初级氨基酸序列的预测质量相匹配,通过高效液相色谱结合质谱分析双特异性和多特异性蛋白。
8.3.1.体外功能活性
8.3.1.1.概述
目前评估的几乎所有MM细胞和细胞系也表达CD138,这提供了用于APRIL(BCMA的配体)的支架,并且促进APRIL-BCMA结合,从而活化生长和存活信号传导途径。产生CD138 xBCMA x CD3三特异性抗体,目标在于同时结合MM细胞上的BCMA和CD138,并且更稳健地交联T细胞上的TCR复合物,以便T细胞活化。
已知在跨膜结构域,由γ-分泌酶切割BCMA,这导致BCMA的细胞外结构域(ECD)的脱落。脱落的BCMA ECD的血清浓度与患者中的肿瘤负荷正相关,并且已经报道处于以下范围的水平:在100ng/mL和上至3,000ng/mL(中位水平约500ng/mL;Ghermezi等人,Haematologica.[血液学]2017.102(4))之间。脱落的BCMA ECD可以充当患者中靶向施用的BCMA的Ab的中和槽。不受理论的束缚,认为可以同时接合CD138和BCMA的CD138 x BCMA xCD3三特异性抗体可以提供与细胞表面BCMA的更高结合亲和力,在高血清水平的脱落的BCMA存在下,这将转化为更大活性。为了测试此假设,使用MM1,BCMA
8.3.1.2.材料和方法
使用BV421标记的抗BCMA(克隆19F2,博奇公司(Biolegend)357520),和BV711标记的抗CD138(克隆MI15,博奇公司(Biolegend)356522),通过流式细胞术确定MM1上的CD138和BCMA细胞表面表达。在BD LSR Fortessa上获取数据,并使用FlowJo(版本10)进行分析。通过用抗BCMA-BV421、或抗CD138-BV510染色的细胞的MFI减去未染色的细胞的MFI来确定Δ平均荧光强度(ΔMFI)。
从健康人供者的周围血液中分离人T细胞。第一,使用Ficoll-Paque PLUS(GE医疗集团(GE Healthcare)#17-1440-02)密度梯度仪对供者血液的外周血单核细胞(PBMC)分级。然后根据制造商推荐的方案(美天旎公司#130-096-535)通过阴性选择从PBMC中分离T细胞。使用人T-Activator CD3/CD28戴诺磁珠(Gibco公司#11132D)将分离的T细胞进一步扩展9天,然后以磁力方式去除珠并作为存活的冷冻等分试样储存在液氮中。在RTCC测定中将扩展的T细胞用作效应T细胞,其中将这些细胞从冷冻等分试样中解冻,计数并按效应细胞:靶细胞(E:T)比率为3:1立即使用。
体外RTCC测定:将靶MM细胞系MM1转导以组成型表达荧光素酶,所述荧光色酶被用于测量细胞活力/存活率。将靶细胞按7,500个细胞/孔与22,500个细胞/孔效应细胞(扩展的T细胞)一起铺板于TCM中的384孔板(科斯塔尔公司3765)上。TCM是基于RPMI/1640的,其中添加有10%FBS、2mM L-谷氨酰胺、0.1mM非必需氨基酸、1mM丙酮酸钠、10mM HEPES、0.055mM 2-巯基乙醇(分别是Gibco公司22400089、16140、25030-081、11140-050、11360-070、15630-080、21985-023)。将抗体连续稀释,然后添加至孔。将测定在37℃/5%CO2下孵育20小时,随后根据制造商的方案测量荧光素酶活性以指示靶细胞活力(BrightGlo,普洛麦格(Promega)#E2650)。将仅不具有T细胞或抗体的靶细胞用作100%荧光素酶活性(100%活力)的对照。使用Spotfire分析数据,其中使用逻辑回归曲线拟合计算EC50值。
8.3.1.3.结果和讨论
BCMA和CD138两者都在MM1细胞的表面表达(图9)。在RTCC测定中,针对MM1细胞,CD138 x BCMA x CD3三特异性Ab示出了与BCMA x CD3双特异性Ab类似的活性(参见图10,左分图,没有添加的可溶性BCMA)。将可溶性BCMA ECD添加至测定培养基,减小了抗体的效力,由以下所指示:需要更高浓度来介导MM细胞裂解(参见图10,中和右分图),以及EC50变化至更高值(图11)。作为对照测试CD138 x CD3双特异性抗体,其介导MM1的RTCC,尽管在低水平下;并且添加可溶性BCMA不影响其活性。不受理论的束缚,据信与BCMA x CD3双特异性相比,CD138 x BCMA x CD3三特异性对可溶性BCMA ECD的相对不敏感性示出,双重靶向三特异性Ab可以提供靶向显著从细胞表面切割并且脱落的细胞表面蛋白的更好策略。再次不受理论的束缚,在靶向BCM的TCR接合性多特异性Ab的情况下,认为具有结合至MM细胞的表面上的另一靶标的另外的ABM,在具有高血清水平的脱落的BCMA的患者中转化为更大临床活性。
9.具体实施例、参考文献的引用
虽然已经说明和描述了多种具体的实施例,但应当理解,在不脱离一种或多种本披露的精神和范围的情况下,可以进行多种改变。本披露通过以下列出的编号的实施例来例证。
1.一种多特异性结合分子(MBM),所述多特异性结合分子包含:
(a)特异性结合至在癌性B细胞上表达的第一人肿瘤相关抗原(TAA 1)的抗原结合模块1(ABM1);
(b)特异性结合至在癌性B细胞上表达的第二人肿瘤相关抗原(TAA 2)的抗原结合模块2(ABM2);以及
(c)特异性结合至人T细胞受体(TCR)复合物的组分的抗原结合模块3(ABM3)。
2.如实施例1所述的MBM,其中TAA 1是在作为B细胞来源浆细胞的癌性B细胞上表达。
3.如实施例1或实施例2所述的MBM,其中TAA 2是在作为B细胞来源浆细胞的癌性B细胞上表达。
4.如实施例1所述的MBM,其中TAA 1是在非浆细胞的癌性B细胞上表达。
5.如实施例1或实施例4所述的MBM,其中所TAA 2是在非浆细胞的癌性B细胞上表达。
6.如实施例1至5中任一项所述的MBM,其中TAA 1和TAA 2在相同癌性B细胞上表达。
7.如实施例1至5中任一项所述的MBM,其中TAA 1和TAA 2在不同癌性B细胞上表达。
8.如实施例1至7中任一项所述的MBM,其中每个抗原结合模块能够在其他抗原结合模块中的每一个与其各自的靶结合的同时结合其各自的靶。
9.如实施例1至8中任一项所述的MBM,其中TAA 1和TAA 2各自独立地选自CD19、CD20、CD22、CD123、BCMA、CD33、CLL1、CD138、CS1、CD38、CD133、FLT3、CD52、TNFRSF13C、TNFRSF13B、CXCR4、PD-L1、LY9、CD200、FCGR2B、CD21、CD23、CD24、CD40L、CD72、CD79a、和CD79b。
10.如实施例1至9中任一项所述的MBM,其中TAA 1是CD19。
11.如实施例10所述的MBM,其中TAA 2是CD20。
12.如实施例10所述的MBM,其中TAA 2是CD22。
13.如实施例10所述的MBM,其中TAA 2是CD123。
14.如实施例10所述的MBM,其中TAA 2是BCMA。
15.如实施例10所述的MBM,其中TAA 2是CD33。
16.如实施例10所述的MBM,其中TAA 2是CLL1。
17.如实施例10所述的MBM,其中TAA 2是CD138。
18.如实施例10所述的MBM,其中TAA 2是CS1。
19.如实施例10所述的MBM,其中TAA 2是CD38。
20.如实施例10所述的MBM,其中TAA 2是CD133。
21.如实施例10所述的MBM,其中TAA 2是FLT3。
22.如实施例10所述的MBM,其中TAA 2是CD52。
23.如实施例10所述的MBM,其中TAA 2是TNFRSF13C。
24.如实施例10所述的MBM,其中TAA 2是TNFRSF13B。
25.如实施例10所述的MBM,其中TAA 2是CXCR4。
26.如实施例10所述的MBM,其中TAA 2是PD-L1。
27.如实施例10所述的MBM,其中TAA 2是LY9。
28.如实施例10所述的MBM,其中TAA 2是CD200。
29.如实施例10所述的MBM,其中TAA 2是FCGR2B。
30.如实施例10所述的MBM,其中TAA 2是CD21。
31.如实施例10所述的MBM,其中TAA 2是CD23。
32.如实施例10所述的MBM,其中TAA 2是CD24。
33.如实施例10所述的MBM,其中TAA 2是CD40L。
34.如实施例10所述的MBM,其中TAA 2是CD72。
35.如实施例10所述的MBM,其中TAA 2是CD79a。
36.如实施例10所述的MBM,其中TAA 2是CD79b。
37.如实施例1至9中任一项所述的MBM,其中TAA 1是CD20。
38.如实施例37所述的MBM,其中TAA 2是CD22。
39.如实施例37所述的MBM,其中TAA 2是CD123。
40.如实施例37所述的MBM,其中TAA 2是BCMA。
41.如实施例37所述的MBM,其中TAA 2是CD33。
42.如实施例37所述的MBM,其中TAA 2是CLL1。
43.如实施例37所述的MBM,其中TAA 2是CD138。
44.如实施例37所述的MBM,其中TAA 2是CS1。
45.如实施例37所述的MBM,其中TAA 2是CD38。
46.如实施例37所述的MBM,其中TAA 2是CD133。
47.如实施例37所述的MBM,其中TAA 2是FLT3。
48.如实施例37所述的MBM,其中TAA 2是CD52。
49.如实施例37所述的MBM,其中TAA 2是TNFRSF13C。
50.如实施例37所述的MBM,其中TAA 2是TNFRSF13B。
51.如实施例37所述的MBM,其中TAA 2是CXCR4。
52.如实施例37所述的MBM,其中TAA 2是PD-L1。
53.如实施例37所述的MBM,其中TAA 2是LY9。
54.如实施例37所述的MBM,其中TAA 2是CD200。
55.如实施例37所述的MBM,其中TAA 2是FCGR2B。
56.如实施例37所述的MBM,其中TAA 2是CD21。
57.如实施例37所述的MBM,其中TAA 2是CD23。
58.如实施例37所述的MBM,其中TAA 2是CD24。
59.如实施例37所述的MBM,其中TAA 2是CD40L。
60.如实施例37所述的MBM,其中TAA 2是CD72。
61.如实施例37所述的MBM,其中TAA 2是CD79a。
62.如实施例37所述的MBM,其中TAA 2是CD79b。
63.如实施例1至9中任一项所述的MBM,其中TAA 1是CD22。
64.如实施例63所述的MBM,其中TAA 2是CD123。
65.如实施例63所述的MBM,其中TAA 2是BCMA。
66.如实施例63所述的MBM,其中TAA 2是CD33。
67.如实施例63所述的MBM,其中TAA 2是CLL1。
68.如实施例63所述的MBM,其中TAA 2是CD138。
69.如实施例63所述的MBM,其中TAA 2是CS1。
70.如实施例63所述的MBM,其中TAA 2是CD38。
71.如实施例63所述的MBM,其中TAA 2是CD133。
72.如实施例63所述的MBM,其中TAA 2是FLT3。
73.如实施例63所述的MBM,其中TAA 2是CD52。
74.如实施例63所述的MBM,其中TAA 2是TNFRSF13C。
75.如实施例63所述的MBM,其中TAA 2是TNFRSF13B。
76.如实施例63所述的MBM,其中TAA 2是CXCR4。
77.如实施例63所述的MBM,其中TAA 2是PD-L1。
78.如实施例63所述的MBM,其中TAA 2是LY9。
79.如实施例63所述的MBM,其中TAA 2是CD200。
80.如实施例63所述的MBM,其中TAA 2是FCGR2B。
81.如实施例63所述的MBM,其中TAA 2是CD21。
82.如实施例63所述的MBM,其中TAA 2是CD23。
83.如实施例63所述的MBM,其中TAA 2是CD24。
84.如实施例63所述的MBM,其中TAA 2是CD40L。
85.如实施例63所述的MBM,其中TAA 2是CD72。
86.如实施例63所述的MBM,其中TAA 2是CD79a。
87.如实施例63所述的MBM,其中TAA 2是CD79b。
88.如实施例1至9中任一项所述的MBM,其中TAA 1是CD123。
89.如实施例88所述的MBM,其中TAA 2是BCMA。
90.如实施例88所述的MBM,其中TAA 2是CD33。
91.如实施例88所述的MBM,其中TAA 2是CLL1。
92.如实施例88所述的MBM,其中TAA 2是CD138。
93.如实施例88所述的MBM,其中TAA 2是CS1。
94.如实施例88所述的MBM,其中TAA 2是CD38。
95.如实施例88所述的MBM,其中TAA 2是CD133。
96.如实施例88所述的MBM,其中TAA 2是FLT3。
97.如实施例88所述的MBM,其中TAA 2是CD52。
98.如实施例88所述的MBM,其中TAA 2是TNFRSF13C。
99.如实施例88所述的MBM,其中TAA 2是TNFRSF13B。
100.如实施例88所述的MBM,其中TAA 2是CXCR4。
101.如实施例88所述的MBM,其中TAA 2是PD-L1。
102.如实施例88所述的MBM,其中TAA 2是LY9。
103.如实施例88所述的MBM,其中TAA 2是CD200。
104.如实施例88所述的MBM,其中TAA 2是FCGR2B。
105.如实施例88所述的MBM,其中TAA 2是CD21。
106.如实施例88所述的MBM,其中TAA 2是CD23。
107.如实施例88所述的MBM,其中TAA 2是CD24。
108.如实施例86所述的MBM,其中TAA 2是CD40L。
109.如实施例88所述的MBM,其中TAA 2是CD72。
110.如实施例88所述的MBM,其中TAA 2是CD79a。
111.如实施例88所述的MBM,其中TAA 2是CD79b。
112.如实施例1至9中任一项所述的MBM,其中TAA 1是BCMA。
113.如实施例112所述的MBM,其中TAA 2是CD33。
114.如实施例112所述的MBM,其中TAA 2是CLL1。
115.如实施例112所述的MBM,其中TAA 2是CD138。
116.如实施例112所述的MBM,其中TAA 2是CS1。
117.如实施例112所述的MBM,其中TAA 2是CD38。
118.如实施例112所述的MBM,其中TAA 2是CD133。
119.如实施例112所述的MBM,其中TAA 2是FLT3。
120.如实施例112所述的MBM,其中TAA 2是CD52。
121.如实施例112所述的MBM,其中TAA 2是TNFRSF13C。
122.如实施例112所述的MBM,其中TAA 2是TNFRSF13B。
123.如实施例112所述的MBM,其中TAA 2是CXCR4。
124.如实施例112所述的MBM,其中TAA 2是PD-L1。
125.如实施例112所述的MBM,其中TAA 2是LY9。
126.如实施例112所述的MBM,其中TAA 2是CD200。
127.如实施例112所述的MBM,其中TAA 2是FCGR2B。
128.如实施例112所述的MBM,其中TAA 2是CD21。
129.如实施例112所述的MBM,其中TAA 2是CD23。
130.如实施例112所述的MBM,其中TAA 2是CD24。
131.如实施例112所述的MBM,其中TAA 2是CD40L。
132.如实施例112所述的MBM,其中TAA 2是CD72。
133.如实施例112所述的MBM,其中TAA 2是CD79a。
134.如实施例112所述的MBM,其中TAA 2是CD79b。
135.如实施例1至9中任一项所述的MBM,其中TAA 1是CD33。
136.如实施例135所述的MBM,其中TAA 2是CLL1。
137.如实施例135所述的MBM,其中TAA 2是CD138。
138.如实施例135所述的MBM,其中TAA 2是CS1。
139.如实施例135所述的MBM,其中TAA 2是CD38。
140.如实施例135所述的MBM,其中TAA 2是CD133。
141.如实施例135所述的MBM,其中TAA 2是FLT3。
142.如实施例135所述的MBM,其中TAA 2是CD52。
143.如实施例135所述的MBM,其中TAA 2是TNFRSF13C。
144.如实施例135所述的MBM,其中TAA 2是TNFRSF13B。
145.如实施例135所述的MBM,其中TAA 2是CXCR4。
146.如实施例135所述的MBM,其中TAA 2是PD-L1。
147.如实施例135所述的MBM,其中TAA 2是LY9。
148.如实施例135所述的MBM,其中TAA 2是CD200。
149.如实施例135所述的MBM,其中TAA 2是FCGR2B。
150.如实施例135所述的MBM,其中TAA 2是CD21。
151.如实施例135所述的MBM,其中TAA 2是CD23。
152.如实施例135所述的MBM,其中TAA 2是CD24。
153.如实施例135所述的MBM,其中TAA 2是CD40L。
154.如实施例135所述的MBM,其中TAA 2是CD72。
155.如实施例135所述的MBM,其中TAA 2是CD79a。
156.如实施例135所述的MBM,其中TAA 2是CD79b。
157.如实施例1至9中任一项所述的MBM,其中TAA 1是CLL1。
158.如实施例157所述的MBM,其中TAA 2是CD138。
159.如实施例157所述的MBM,其中TAA 2是CS1。
160.如实施例157所述的MBM,其中TAA 2是CD38。
161.如实施例157所述的MBM,其中TAA 2是CD133。
162.如实施例157所述的MBM,其中TAA 2是FLT3。
163.如实施例157所述的MBM,其中TAA 2是CD52。
164.如实施例157所述的MBM,其中TAA 2是TNFRSF13C。
165.如实施例157所述的MBM,其中TAA 2是TNFRSF13B。
166.如实施例157所述的MBM,其中TAA 2是CXCR4。
167.如实施例157所述的MBM,其中TAA 2是PD-L1。
168.如实施例157所述的MBM,其中TAA 2是LY9。
169.如实施例157所述的MBM,其中TAA 2是CD200。
170.如实施例157所述的MBM,其中TAA 2是FCGR2B。
171.如实施例157所述的MBM,其中TAA 2是CD21。
172.如实施例157所述的MBM,其中TAA 2是CD23。
173.如实施例157所述的MBM,其中TAA 2是CD24。
174.如实施例157所述的MBM,其中TAA 2是CD40L。
175.如实施例157所述的MBM,其中TAA 2是CD72。
176.如实施例157所述的MBM,其中TAA 2是CD79a。
177.如实施例157所述的MBM,其中TAA 2是CD79b。
178.如实施例1至9中任一项所述的MBM,其中TAA 1是CD138。
179.如实施例178所述的MBM,其中TAA 2是CS1。
180.如实施例178所述的MBM,其中TAA 2是CD38。
181.如实施例178所述的MBM,其中TAA 2是CD133。
182.如实施例178所述的MBM,其中TAA 2是FLT3。
183.如实施例178所述的MBM,其中TAA 2是CD52。
184.如实施例178所述的MBM,其中TAA 2是TNFRSF13C。
185.如实施例178所述的MBM,其中TAA 2是TNFRSF13B。
186.如实施例178所述的MBM,其中TAA 2是CXCR4。
187.如实施例178所述的MBM,其中TAA 2是PD-L1。
188.如实施例178所述的MBM,其中TAA 2是LY9。
189.如实施例178所述的MBM,其中TAA 2是CD200。
190.如实施例178所述的MBM,其中TAA 2是FCGR2B。
191.如实施例178所述的MBM,其中TAA 2是CD21。
192.如实施例178所述的MBM,其中TAA 2是CD23。
193.如实施例178所述的MBM,其中TAA 2是CD24。
194.如实施例178所述的MBM,其中TAA 2是CD40L。
195.如实施例178所述的MBM,其中TAA 2是CD72。
196.如实施例178所述的MBM,其中TAA 2是CD79a。
197.如实施例178所述的MBM,其中TAA 2是CD79b。
198.如实施例1至9中任一项所述的MBM,其中TAA 1是CS1。
199.如实施例198所述的MBM,其中TAA 2是CD38。
200.如实施例198所述的MBM,其中TAA 2是CD133。
201.如实施例198所述的MBM,其中TAA 2是FLT3。
202.如实施例198所述的MBM,其中TAA 2是CD52。
203.如实施例198所述的MBM,其中TAA 2是TNFRSF13C。
204.如实施例198所述的MBM,其中TAA 2是TNFRSF13B。
205.如实施例198所述的MBM,其中TAA 2是CXCR4。
206.如实施例198所述的MBM,其中TAA 2是PD-L1。
207.如实施例198所述的MBM,其中TAA 2是LY9。
208.如实施例198所述的MBM,其中TAA 2是CD200。
209.如实施例198所述的MBM,其中TAA 2是FCGR2B。
210.如实施例198所述的MBM,其中TAA 2是CD21。
211.如实施例198所述的MBM,其中TAA 2是CD23。
212.如实施例198所述的MBM,其中TAA 2是CD24。
213.如实施例198所述的MBM,其中TAA 2是CD40L。
214.如实施例198所述的MBM,其中TAA 2是CD72。
215.如实施例198所述的MBM,其中TAA 2是CD79a。
216.如实施例198所述的MBM,其中TAA 2是CD79b。
217.如实施例1至9中任一项所述的MBM,其中TAA 1是CD38。
218.如实施例217所述的MBM,其中TAA 2是CD133。
219.如实施例217所述的MBM,其中TAA 2是FLT3。
220.如实施例217所述的MBM,其中TAA 2是CD52。
221.如实施例217所述的MBM,其中TAA 2是TNFRSF13C。
222.如实施例217所述的MBM,其中TAA 2是TNFRSF13B。
223.如实施例217所述的MBM,其中TAA 2是CXCR4。
224.如实施例217所述的MBM,其中TAA 2是PD-L1。
225.如实施例217所述的MBM,其中TAA 2是LY9。
226.如实施例217所述的MBM,其中TAA 2是CD200。
227.如实施例217所述的MBM,其中TAA 2是FCGR2B。
228.如实施例217所述的MBM,其中TAA 2是CD21。
229.如实施例217所述的MBM,其中TAA 2是CD23。
230.如实施例217所述的MBM,其中TAA 2是CD24。
231.如实施例217所述的MBM,其中TAA 2是CD40L。
232.如实施例217所述的MBM,其中TAA 2是CD72。
233.如实施例217所述的MBM,其中TAA 2是CD79a。
234.如实施例217所述的MBM,其中TAA 2是CD79b。
235.如实施例1至9中任一项所述的MBM,其中TAA 1是CD133。
236.如实施例235所述的MBM,其中TAA 2是FLT3。
237.如实施例235所述的MBM,其中TAA 2是CD52。
238.如实施例235所述的MBM,其中TAA 2是TNFRSF13C。
239.如实施例235所述的MBM,其中TAA 2是TNFRSF13B。
240.如实施例235所述的MBM,其中TAA 2是CXCR4。
241.如实施例235所述的MBM,其中TAA 2是PD-L1。
242.如实施例235所述的MBM,其中TAA 2是LY9。
243.如实施例235所述的MBM,其中TAA 2是CD200。
244.如实施例235所述的MBM,其中TAA 2是FCGR2B。
245.如实施例235所述的MBM,其中TAA 2是CD21。
246.如实施例235所述的MBM,其中TAA 2是CD23。
247.如实施例235所述的MBM,其中TAA 2是CD24。
248.如实施例235所述的MBM,其中TAA 2是CD40L。
249.如实施例235所述的MBM,其中TAA 2是CD72。
250.如实施例235所述的MBM,其中TAA 2是CD79a。
251.如实施例235所述的MBM,其中TAA 2是CD79b。
252.如实施例1至9中任一项所述的MBM,其中TAA 1是FLT3。
253.如实施例252所述的MBM,其中TAA 2是CD52。
254.如实施例252所述的MBM,其中TAA 2是TNFRSF13C。
255.如实施例252所述的MBM,其中TAA 2是TNFRSF13B。
256.如实施例252所述的MBM,其中TAA 2是CXCR4。
257.如实施例252所述的MBM,其中TAA 2是PD-L1。
258.如实施例252所述的MBM,其中TAA 2是LY9。
259.如实施例252所述的MBM,其中TAA 2是CD200。
260.如实施例252所述的MBM,其中TAA 2是FCGR2B。
261.如实施例252所述的MBM,其中TAA 2是CD21。
262.如实施例252所述的MBM,其中TAA 2是CD23。
263.如实施例252所述的MBM,其中TAA 2是CD24。
264.如实施例252所述的MBM,其中TAA 2是CD40L。
265.如实施例252所述的MBM,其中TAA 2是CD72。
266.如实施例252所述的MBM,其中TAA 2是CD79a。
267.如实施例252所述的MBM,其中TAA 2是CD79b。
268.如实施例1至9中任一项所述的MBM,其中TAA 1是CD52。
269.如实施例268所述的MBM,其中TAA 2是TNFRSF13C。
270.如实施例268所述的MBM,其中TAA 2是TNFRSF13B。
271.如实施例268所述的MBM,其中TAA 2是CXCR4。
272.如实施例268所述的MBM,其中TAA 2是PD-L1。
273.如实施例268所述的MBM,其中TAA 2是LY9。
274.如实施例268所述的MBM,其中TAA 2是CD200。
275.如实施例268所述的MBM,其中TAA 2是FCGR2B。
276.如实施例268所述的MBM,其中TAA 2是CD21。
277.如实施例268所述的MBM,其中TAA 2是CD23。
278.如实施例268所述的MBM,其中TAA 2是CD24。
279.如实施例268所述的MBM,其中TAA 2是CD40L。
280.如实施例268所述的MBM,其中TAA 2是CD72。
281.如实施例268所述的MBM,其中TAA 2是CD79a。
282.如实施例268所述的MBM,其中TAA 2是CD79b。
283.如实施例1至9中任一项所述的MBM,其中TAA 1是TNFRSF13C。
284.如实施例283所述的MBM,其中TAA 2是TNFRSF13B。
285.如实施例283所述的MBM,其中TAA 2是CXCR4。
286.如实施例283所述的MBM,其中TAA 2是PD-L1。
287.如实施例283所述的MBM,其中TAA 2是LY9。
288.如实施例283所述的MBM,其中TAA 2是CD200。
289.如实施例283所述的MBM,其中TAA 2是FCGR2B。
290.如实施例283所述的MBM,其中TAA 2是CD21。
291.如实施例283所述的MBM,其中TAA 2是CD23。
292.如实施例283所述的MBM,其中TAA 2是CD24。
293.如实施例283所述的MBM,其中TAA 2是CD40L。
294.如实施例283所述的MBM,其中TAA 2是CD72。
295.如实施例283所述的MBM,其中TAA 2是CD79a。
296.如实施例283所述的MBM,其中TAA 2是CD79b。
297.如实施例1至9中任一项所述的MBM,其中TAA 1是CXCR4。
298.如实施例297所述的MBM,其中TAA 2是PD-L1。
299.如实施例297所述的MBM,其中TAA 2是LY9。
300.如实施例297所述的MBM,其中TAA 2是CD200。
301.如实施例297所述的MBM,其中TAA 2是FCGR2B。
302.如实施例297所述的MBM,其中TAA 2是CD21。
303.如实施例297所述的MBM,其中TAA 2是CD23。
304.如实施例297所述的MBM,其中TAA 2是CD24。
305.如实施例297所述的MBM,其中TAA 2是CD40L。
306.如实施例297所述的MBM,其中TAA 2是CD72。
307.如实施例297所述的MBM,其中TAA 2是CD79a。
308.如实施例297所述的MBM,其中TAA 2是CD79b。
309.如实施例1至9中任一项所述的MBM,其中TAA 1是PD-L1。
310.如实施例309所述的MBM,其中TAA 2是LY9。
311.如实施例309所述的MBM,其中TAA 2是CD200。
312.如实施例309所述的MBM,其中TAA 2是FCGR2B。
313.如实施例309所述的MBM,其中TAA 2是CD21。
314.如实施例309所述的MBM,其中TAA 2是CD23。
315.如实施例309所述的MBM,其中TAA 2是CD24。
316.如实施例309所述的MBM,其中TAA 2是CD40L。
317.如实施例309所述的MBM,其中TAA 2是CD72。
318.如实施例309所述的MBM,其中TAA 2是CD79a。
319.如实施例309所述的MBM,其中TAA 2是CD79b。
320.如实施例1至9中任一项所述的MBM,其中TAA 1是LY9。
321.如实施例320所述的MBM,其中TAA 2是CD200。
322.如实施例320所述的MBM,其中TAA 2是FCGR2B。
323.如实施例320所述的MBM,其中TAA 2是CD21。
324.如实施例320所述的MBM,其中TAA 2是CD23。
325.如实施例320所述的MBM,其中TAA 2是CD24。
326.如实施例320所述的MBM,其中TAA 2是CD40L。
327.如实施例320所述的MBM,其中TAA 2是CD72。
328.如实施例320所述的MBM,其中TAA 2是CD79a。
329.如实施例320所述的MBM,其中TAA 2是CD79b。
330.如实施例1至9中任一项所述的MBM,其中TAA 1是CD200。
331.如实施例330所述的MBM,其中TAA 2是FCGR2B。
332.如实施例330所述的MBM,其中TAA 2是CD21。
333.如实施例330所述的MBM,其中TAA 2是CD23。
334.如实施例330所述的MBM,其中TAA 2是CD24。
335.如实施例330所述的MBM,其中TAA 2是CD40L。
336.如实施例330所述的MBM,其中TAA 2是CD72。
337.如实施例330所述的MBM,其中TAA 2是CD79a。
338.如实施例330所述的MBM,其中TAA 2是CD79b。
339.如实施例1至9中任一项所述的MBM,其中TAA 1是FCGR2B。
340.如实施例339所述的MBM,其中TAA 2是CD21。
341.如实施例339所述的MBM,其中TAA 2是CD23。
342.如实施例339所述的MBM,其中TAA 2是CD24。
343.如实施例339所述的MBM,其中TAA 2是CD40L。
344.如实施例339所述的MBM,其中TAA 2是CD72。
345.如实施例339所述的MBM,其中TAA 2是CD79a。
346.如实施例339所述的MBM,其中TAA 2是CD79b。
347.如实施例1至9中任一项所述的MBM,其中TAA 1是CD21。
348.如实施例347所述的MBM,其中TAA 2是CD23。
349.如实施例347所述的MBM,其中TAA 2是CD24。
350.如实施例347所述的MBM,其中TAA 2是CD40L。
351.如实施例347所述的MBM,其中TAA 2是CD72。
352.如实施例347所述的MBM,其中TAA 2是CD79a。
353.如实施例347所述的MBM,其中TAA 2是CD79b。
354.如实施例1至9中任一项所述的MBM,其中TAA 1是CD23。
355.如实施例354所述的MBM,其中TAA 2是CD24。
356.如实施例354所述的MBM,其中TAA 2是CD40L。
357.如实施例354所述的MBM,其中TAA 2是CD72。
358.如实施例354所述的MBM,其中TAA 2是CD79a。
359.如实施例354所述的MBM,其中TAA 2是CD79b。
360.如实施例1至9中任一项所述的MBM,其中TAA 1是CD24。
361.如实施例360所述的MBM,其中TAA 2是CD40L。
362.如实施例360所述的MBM,其中TAA 2是CD72。
363.如实施例360所述的MBM,其中TAA 2是CD79a。
364.如实施例360所述的MBM,其中TAA 2是CD79b。
365.如实施例1至9中任一项所述的MBM,其中TAA 1是CD40L。
366.如实施例365所述的MBM,其中TAA 2是CD72。
367.如实施例365所述的MBM,其中TAA 2是CD79a。
368.如实施例365所述的MBM,其中TAA 2是CD79b。
369.如实施例1至9中任一项所述的MBM,其中TAA 1是CD72。
370.如实施例369所述的MBM,其中TAA 2是CD79a。
371.如实施例369所述的MBM,其中TAA 2是CD79b。
372.如实施例1至9中任一项所述的MBM,其中TAA 1是CD79a。
373.如实施例372所述的MBM,其中TAA 2是CD79b。
374.如实施例1至9中任一项所述的MBM,其中TAA 2是CD19。
375.如实施例374所述的MBM,其中TAA 1是CD20。
376.如实施例374所述的MBM,其中TAA 1是CD22。
377.如实施例374所述的MBM,其中TAA 1是CD123。
378.如实施例374所述的MBM,其中TAA 1是BCMA。
379.如实施例374所述的MBM,其中TAA 1是CD33。
380.如实施例374所述的MBM,其中TAA 1是CLL1。
381.如实施例374所述的MBM,其中TAA 1是CD138。
382.如实施例374所述的MBM,其中TAA 1是CS1。
383.如实施例374所述的MBM,其中TAA 1是CD38。
384.如实施例374所述的MBM,其中TAA 1是CD133。
385.如实施例374所述的MBM,其中TAA 1是FLT3。
386.如实施例374所述的MBM,其中TAA 1是CD52。
387.如实施例374所述的MBM,其中TAA 1是TNFRSF13C。
388.如实施例374所述的MBM,其中TAA 1是TNFRSF13B。
389.如实施例374所述的MBM,其中TAA 1是CXCR4。
390.如实施例374所述的MBM,其中TAA 1是PD-L1。
391.如实施例374所述的MBM,其中TAA 1是LY9。
392.如实施例374所述的MBM,其中TAA 1是CD200。
393.如实施例374所述的MBM,其中TAA 1是FCGR2B。
394.如实施例374所述的MBM,其中TAA 1是CD21。
395.如实施例374所述的MBM,其中TAA 1是CD23。
396.如实施例374所述的MBM,其中TAA 1是CD24。
397.如实施例374所述的MBM,其中TAA 1是CD40L。
398.如实施例374所述的MBM,其中TAA 1是CD72。
399.如实施例374所述的MBM,其中TAA 1是CD79a。
400.如实施例374所述的MBM,其中TAA 1是CD79b。
401.如实施例1至9中任一项所述的MBM,其中TAA 2是CD20。
402.如实施例401所述的MBM,其中TAA 1是CD22。
403.如实施例401所述的MBM,其中TAA 1是CD123。
404.如实施例401所述的MBM,其中TAA 1是BCMA。
405.如实施例401所述的MBM,其中TAA 1是CD33。
406.如实施例401所述的MBM,其中TAA 1是CLL1。
407.如实施例401所述的MBM,其中TAA 1是CD138。
408.如实施例401所述的MBM,其中TAA 1是CS1。
409.如实施例401所述的MBM,其中TAA 1是CD38。
410.如实施例401所述的MBM,其中TAA 1是CD133。
411.如实施例401所述的MBM,其中TAA 1是FLT3。
412.如实施例401所述的MBM,其中TAA 1是CD52。
413.如实施例401所述的MBM,其中TAA 1是TNFRSF13C。
414.如实施例401所述的MBM,其中TAA 1是TNFRSF13B。
415.如实施例401所述的MBM,其中TAA 1是CXCR4。
416.如实施例401所述的MBM,其中TAA 1是PD-L1。
417.如实施例401所述的MBM,其中TAA 1是LY9。
418.如实施例401所述的MBM,其中TAA 1是CD200。
419.如实施例401所述的MBM,其中TAA 1是FCGR2B。
420.如实施例401所述的MBM,其中TAA 1是CD21。
421.如实施例401所述的MBM,其中TAA 1是CD23。
422.如实施例401所述的MBM,其中TAA 1是CD24。
423.如实施例401所述的MBM,其中TAA 1是CD40L。
424.如实施例401所述的MBM,其中TAA 1是CD72。
425.如实施例401所述的MBM,其中TAA 1是CD79a。
426.如实施例401所述的MBM,其中TAA 1是CD79b。
427.如实施例1至9中任一项所述的MBM,其中TAA 2是CD22。
428.如实施例427所述的MBM,其中TAA 1是CD123。
429.如实施例427所述的MBM,其中TAA 1是BCMA。
430.如实施例427所述的MBM,其中TAA 1是CD33。
431.如实施例427所述的MBM,其中TAA 1是CLL1。
432.如实施例427所述的MBM,其中TAA 1是CD138。
433.如实施例427所述的MBM,其中TAA 1是CS1。
434.如实施例427所述的MBM,其中TAA 1是CD38。
435.如实施例427所述的MBM,其中TAA 1是CD133。
436.如实施例427所述的MBM,其中TAA 1是FLT3。
437.如实施例427所述的MBM,其中TAA 1是CD52。
438.如实施例427所述的MBM,其中TAA 1是TNFRSF13C。
439.如实施例427所述的MBM,其中TAA 1是TNFRSF13B。
440.如实施例427所述的MBM,其中TAA 1是CXCR4。
441.如实施例427所述的MBM,其中TAA 1是PD-L1。
442.如实施例427所述的MBM,其中TAA 1是LY9。
443.如实施例427所述的MBM,其中TAA 1是CD200。
444.如实施例427所述的MBM,其中TAA 1是FCGR2B。
445.如实施例427所述的MBM,其中TAA 1是CD21。
446.如实施例427所述的MBM,其中TAA 1是CD23。
447.如实施例427所述的MBM,其中TAA 1是CD24。
448.如实施例427所述的MBM,其中TAA 1是CD40L。
449.如实施例427所述的MBM,其中TAA 1是CD72。
450.如实施例427所述的MBM,其中TAA 1是CD79a。
451.如实施例427所述的MBM,其中TAA 1是CD79b。
452.如实施例1至9中任一项所述的MBM,其中TAA 2是CD123。
453.如实施例452所述的MBM,其中TAA 1是BCMA。
454.如实施例452所述的MBM,其中TAA 1是CD33。
455.如实施例452所述的MBM,其中TAA 1是CLL1。
456.如实施例452所述的MBM,其中TAA 1是CD138。
457.如实施例452所述的MBM,其中TAA 1是CS1。
458.如实施例452所述的MBM,其中TAA 1是CD38。
459.如实施例452所述的MBM,其中TAA 1是CD133。
460.如实施例452所述的MBM,其中TAA 1是FLT3。
461.如实施例452所述的MBM,其中TAA 1是CD52。
462.如实施例452所述的MBM,其中TAA 1是TNFRSF13C。
463.如实施例452所述的MBM,其中TAA 1是TNFRSF13B。
464.如实施例452所述的MBM,其中TAA 1是CXCR4。
465.如实施例452所述的MBM,其中TAA 1是PD-L1。
466.如实施例452所述的MBM,其中TAA 1是LY9。
467.如实施例452所述的MBM,其中TAA 1是CD200。
468.如实施例452所述的MBM,其中TAA 1是FCGR2B。
469.如实施例452所述的MBM,其中TAA 1是CD21。
470.如实施例452所述的MBM,其中TAA 1是CD23。
471.如实施例452所述的MBM,其中TAA 1是CD24。
472.如实施例452所述的MBM,其中TAA 1是CD40L。
473.如实施例452所述的MBM,其中TAA 1是CD72。
474.如实施例452所述的MBM,其中TAA 1是CD79a。
475.如实施例452所述的MBM,其中TAA 1是CD79b。
476.如实施例1至9中任一项所述的MBM,其中TAA 2是BCMA。
477.如实施例476所述的MBM,其中TAA 1是CD33。
478.如实施例476所述的MBM,其中TAA 1是CLL1。
479.如实施例476所述的MBM,其中TAA 1是CD138。
480.如实施例476所述的MBM,其中TAA 1是CS1。
481.如实施例476所述的MBM,其中TAA 1是CD38。
482.如实施例476所述的MBM,其中TAA 1是CD133。
483.如实施例476所述的MBM,其中TAA 1是FLT3。
484.如实施例476所述的MBM,其中TAA 1是CD52。
485.如实施例476所述的MBM,其中TAA 1是TNFRSF13C。
486.如实施例476所述的MBM,其中TAA 1是TNFRSF13B。
487.如实施例476所述的MBM,其中TAA 1是CXCR4。
488.如实施例476所述的MBM,其中TAA 1是PD-L1。
489.如实施例476所述的MBM,其中TAA 1是LY9。
490.如实施例476所述的MBM,其中TAA 1是CD200。
491.如实施例476所述的MBM,其中TAA 1是FCGR2B。
492.如实施例476所述的MBM,其中TAA 1是CD21。
493.如实施例476所述的MBM,其中TAA 1是CD23。
494.如实施例476所述的MBM,其中TAA 1是CD24。
495.如实施例476所述的MBM,其中TAA 1是CD40L。
496.如实施例476所述的MBM,其中TAA 1是CD72。
497.如实施例476所述的MBM,其中TAA 1是CD79a。
498.如实施例476所述的MBM,其中TAA 1是CD79b。
499.如实施例1至9中任一项所述的MBM,其中TAA 2是CD33。
500.如实施例499所述的MBM,其中TAA 1是CLL1。
501.如实施例499所述的MBM,其中TAA 1是CD138。
502.如实施例499所述的MBM,其中TAA 1是CS1。
503.如实施例499所述的MBM,其中TAA 1是CD38。
504.如实施例499所述的MBM,其中TAA 1是CD133。
505.如实施例499所述的MBM,其中TAA 1是FLT3。
506.如实施例499所述的MBM,其中TAA 1是CD52。
507.如实施例499所述的MBM,其中TAA 1是TNFRSF13C。
508.如实施例499所述的MBM,其中TAA 1是TNFRSF13B。
509.如实施例499所述的MBM,其中TAA 1是CXCR4。
510.如实施例499所述的MBM,其中TAA 1是PD-L1。
511.如实施例499所述的MBM,其中TAA 1是LY9。
512.如实施例499所述的MBM,其中TAA 1是CD200。
513.如实施例499所述的MBM,其中TAA 1是FCGR2B。
514.如实施例499所述的MBM,其中TAA 1是CD21。
515.如实施例499所述的MBM,其中TAA 1是CD23。
516.如实施例499所述的MBM,其中TAA 1是CD24。
517.如实施例499所述的MBM,其中TAA 1是CD40L。
518.如实施例499所述的MBM,其中TAA 1是CD72。
519.如实施例499所述的MBM,其中TAA 1是CD79a。
520.如实施例499所述的MBM,其中TAA 1是CD79b。
521.如实施例1至9中任一项所述的MBM,其中TAA 2是CLL1。
522.如实施例521所述的MBM,其中TAA 1是CD138。
523.如实施例521所述的MBM,其中TAA 1是CS1。
524.如实施例521所述的MBM,其中TAA 1是CD38。
525.如实施例521所述的MBM,其中TAA 1是CD133。
526.如实施例521所述的MBM,其中TAA 1是FLT3。
527.如实施例521所述的MBM,其中TAA 1是CD52。
528.如实施例521所述的MBM,其中TAA 1是TNFRSF13C。
529.如实施例521所述的MBM,其中TAA 1是TNFRSF13B。
530.如实施例521所述的MBM,其中TAA 1是CXCR4。
531.如实施例521所述的MBM,其中TAA 1是PD-L1。
532.如实施例521所述的MBM,其中TAA 1是LY9。
533.如实施例521所述的MBM,其中TAA 1是CD200。
534.如实施例521所述的MBM,其中TAA 1是FCGR2B。
535.如实施例521所述的MBM,其中TAA 1是CD21。
536.如实施例521所述的MBM,其中TAA 1是CD23。
537.如实施例521所述的MBM,其中TAA 1是CD24。
538.如实施例521所述的MBM,其中TAA 1是CD40L。
539.如实施例521所述的MBM,其中TAA 1是CD72。
540.如实施例521所述的MBM,其中TAA 1是CD79a。
541.如实施例521所述的MBM,其中TAA 1是CD79b。
542.如实施例1至9中任一项所述的MBM,其中TAA 2是CD138。
543.如实施例542所述的MBM,其中TAA 1是CS1。
544.如实施例542所述的MBM,其中TAA 1是CD38。
545.如实施例542所述的MBM,其中TAA 1是CD133。
546.如实施例542所述的MBM,其中TAA 1是FLT3。
547.如实施例542所述的MBM,其中TAA 1是CD52。
548.如实施例542所述的MBM,其中TAA 1是TNFRSF13C。
549.如实施例542所述的MBM,其中TAA 1是TNFRSF13B。
550.如实施例542所述的MBM,其中TAA 1是CXCR4。
551.如实施例542所述的MBM,其中TAA 1是PD-L1。
552.如实施例542所述的MBM,其中TAA 1是LY9。
553.如实施例542所述的MBM,其中TAA 1是CD200。
554.如实施例542所述的MBM,其中TAA 1是FCGR2B。
555.如实施例542所述的MBM,其中TAA 1是CD21。
556.如实施例542所述的MBM,其中TAA 1是CD23。
557.如实施例542所述的MBM,其中TAA 1是CD24。
558.如实施例542所述的MBM,其中TAA 1是CD40L。
559.如实施例542所述的MBM,其中TAA 1是CD72。
560.如实施例542所述的MBM,其中TAA 1是CD79a。
561.如实施例542所述的MBM,其中TAA 1是CD79b。
562.如实施例1至9中任一项所述的MBM,其中TAA 2是CS1。
563.如实施例562所述的MBM,其中TAA 1是CD38。
564.如实施例562所述的MBM,其中TAA 1是CD133。
565.如实施例562所述的MBM,其中TAA 1是FLT3。
566.如实施例562所述的MBM,其中TAA 1是CD52。
567.如实施例562所述的MBM,其中TAA 1是TNFRSF13C。
568.如实施例562所述的MBM,其中TAA 1是TNFRSF13B。
569.如实施例562所述的MBM,其中TAA 1是CXCR4。
570.如实施例562所述的MBM,其中TAA 1是PD-L1。
571.如实施例562所述的MBM,其中TAA 1是LY9。
572.如实施例562所述的MBM,其中TAA 1是CD200。
573.如实施例562所述的MBM,其中TAA 1是FCGR2B。
574.如实施例562所述的MBM,其中TAA 1是CD21。
575.如实施例562所述的MBM,其中TAA 1是CD23。
576.如实施例562所述的MBM,其中TAA 1是CD24。
577.如实施例562所述的MBM,其中TAA 1是CD40L。
578.如实施例562所述的MBM,其中TAA 1是CD72。
579.如实施例562所述的MBM,其中TAA 1是CD79a。
580.如实施例562所述的MBM,其中TAA 1是CD79b。
581.如实施例1至9中任一项所述的MBM,其中TAA 2是CD38。
582.如实施例581所述的MBM,其中TAA 1是CD133。
583.如实施例581所述的MBM,其中TAA 1是FLT3。
584.如实施例581所述的MBM,其中TAA 1是CD52。
585.如实施例581所述的MBM,其中TAA 1是TNFRSF13C。
586.如实施例581所述的MBM,其中TAA 1是TNFRSF13B。
587.如实施例581所述的MBM,其中TAA 1是CXCR4。
588.如实施例581所述的MBM,其中TAA 1是PD-L1。
589.如实施例581所述的MBM,其中TAA 1是LY9。
590.如实施例581所述的MBM,其中TAA 1是CD200。
591.如实施例581所述的MBM,其中TAA 1是FCGR2B。
592.如实施例581所述的MBM,其中TAA 1是CD21。
593.如实施例581所述的MBM,其中TAA 1是CD23。
594.如实施例581所述的MBM,其中TAA 1是CD24。
595.如实施例581所述的MBM,其中TAA 1是CD40L。
596.如实施例581所述的MBM,其中TAA 1是CD72。
597.如实施例581所述的MBM,其中TAA 1是CD79a。
598.如实施例581所述的MBM,其中TAA 1是CD79b。
599.如实施例1至9中任一项所述的MBM,其中TAA 2是CD133。
600.如实施例599所述的MBM,其中TAA 1是FLT3。
601.如实施例599所述的MBM,其中TAA 1是CD52。
602.如实施例599所述的MBM,其中TAA 1是TNFRSF13C。
603.如实施例599所述的MBM,其中TAA 1是TNFRSF13B。
604.如实施例599所述的MBM,其中TAA 1是CXCR4。
605.如实施例599所述的MBM,其中TAA 1是PD-L1。
606.如实施例599所述的MBM,其中TAA 1是LY9。
607.如实施例599所述的MBM,其中TAA 1是CD200。
608.如实施例599所述的MBM,其中TAA 1是FCGR2B。
609.如实施例599所述的MBM,其中TAA 1是CD21。
610.如实施例599所述的MBM,其中TAA 1是CD23。
611.如实施例599所述的MBM,其中TAA 1是CD24。
612.如实施例599所述的MBM,其中TAA 1是CD40L。
613.如实施例599所述的MBM,其中TAA 1是CD72。
614.如实施例599所述的MBM,其中TAA 1是CD79a。
615.如实施例599所述的MBM,其中TAA 1是CD79b。
616.如实施例1至9中任一项所述的MBM,其中TAA 2是FLT3。
617.如实施例616所述的MBM,其中TAA 1是CD52。
618.如实施例616所述的MBM,其中TAA 1是TNFRSF13C。
619.如实施例616所述的MBM,其中TAA 1是TNFRSF13B。
620.如实施例616所述的MBM,其中TAA 1是CXCR4。
621.如实施例616所述的MBM,其中TAA 1是PD-L1。
622.如实施例616所述的MBM,其中TAA 1是LY9。
623.如实施例616所述的MBM,其中TAA 1是CD200。
624.如实施例616所述的MBM,其中TAA 1是FCGR2B。
625.如实施例616所述的MBM,其中TAA 1是CD21。
626.如实施例616所述的MBM,其中TAA 1是CD23。
627.如实施例616所述的MBM,其中TAA 1是CD24。
628.如实施例616所述的MBM,其中TAA 1是CD40L。
629.如实施例616所述的MBM,其中TAA 1是CD72。
630.如实施例616所述的MBM,其中TAA 1是CD79a。
631.如实施例616所述的MBM,其中TAA 1是CD79b。
632.如实施例1至9中任一项所述的MBM,其中TAA 2是CD52。
633.如实施例632所述的MBM,其中TAA 1是TNFRSF13C。
634.如实施例632所述的MBM,其中TAA 1是TNFRSF13B。
635.如实施例632所述的MBM,其中TAA 1是CXCR4。
636.如实施例632所述的MBM,其中TAA 1是PD-L1。
637.如实施例632所述的MBM,其中TAA 1是LY9。
638.如实施例632所述的MBM,其中TAA 1是CD200。
639.如实施例632所述的MBM,其中TAA 1是FCGR2B。
640.如实施例632所述的MBM,其中TAA 1是CD21。
641.如实施例632所述的MBM,其中TAA 1是CD23。
642.如实施例632所述的MBM,其中TAA 1是CD24。
643.如实施例632所述的MBM,其中TAA 1是CD40L。
644.如实施例632所述的MBM,其中TAA 1是CD72。
645.如实施例632所述的MBM,其中TAA 1是CD79a。
646.如实施例632所述的MBM,其中TAA 1是CD79b。
647.如实施例1至9中任一项所述的MBM,其中TAA 2是TNFRSF13C。
648.如实施例647所述的MBM,其中TAA 1是TNFRSF13B。
649.如实施例647所述的MBM,其中TAA 1是CXCR4。
650.如实施例647所述的MBM,其中TAA 1是PD-L1。
651.如实施例647所述的MBM,其中TAA 1是LY9。
652.如实施例647所述的MBM,其中TAA 1是CD200。
653.如实施例647所述的MBM,其中TAA 1是FCGR2B。
654.如实施例647所述的MBM,其中TAA 1是CD21。
655.如实施例647所述的MBM,其中TAA 1是CD23。
656.如实施例647所述的MBM,其中TAA 1是CD24。
657.如实施例647所述的MBM,其中TAA 1是CD40L。
658.如实施例647所述的MBM,其中TAA 1是CD72。
659.如实施例647所述的MBM,其中TAA 1是CD79a。
660.如实施例647所述的MBM,其中TAA 1是CD79b。
661.如实施例1至9中任一项所述的MBM,其中TAA 2是CXCR4。
662.如实施例661所述的MBM,其中TAA 1是PD-L1。
663.如实施例661所述的MBM,其中TAA 1是LY9。
664.如实施例661所述的MBM,其中TAA 1是CD200。
665.如实施例661所述的MBM,其中TAA 1是FCGR2B。
666.如实施例661所述的MBM,其中TAA 1是CD21。
667.如实施例661所述的MBM,其中TAA 1是CD23。
668.如实施例661所述的MBM,其中TAA 1是CD24。
669.如实施例661所述的MBM,其中TAA 1是CD40L。
670.如实施例661所述的MBM,其中TAA 1是CD72。
671.如实施例661所述的MBM,其中TAA 1是CD79a。
672.如实施例661所述的MBM,其中TAA 1是CD79b。
673.如实施例1至9中任一项所述的MBM,其中TAA 2是PD-L1。
674.如实施例673所述的MBM,其中TAA 1是LY9。
675.如实施例673所述的MBM,其中TAA 1是CD200。
676.如实施例673所述的MBM,其中TAA 1是FCGR2B。
677.如实施例673所述的MBM,其中TAA 1是CD21。
678.如实施例673所述的MBM,其中TAA 1是CD23。
679.如实施例673所述的MBM,其中TAA 1是CD24。
680.如实施例673所述的MBM,其中TAA 1是CD40L。
681.如实施例673所述的MBM,其中TAA 1是CD72。
682.如实施例673所述的MBM,其中TAA 1是CD79a。
683.如实施例673所述的MBM,其中TAA 1是CD79b。
684.如实施例1至9中任一项所述的MBM,其中TAA 2是LY9。
685.如实施例684所述的MBM,其中TAA 1是CD200。
686.如实施例684所述的MBM,其中TAA 1是FCGR2B。
687.如实施例684所述的MBM,其中TAA 1是CD21。
688.如实施例684所述的MBM,其中TAA 1是CD23。
689.如实施例684所述的MBM,其中TAA 1是CD24。
690.如实施例684所述的MBM,其中TAA 1是CD40L。
691.如实施例684所述的MBM,其中TAA 1是CD72。
692.如实施例684所述的MBM,其中TAA 1是CD79a。
693.如实施例684所述的MBM,其中TAA 1是CD79b。
694.如实施例1至9中任一项所述的MBM,其中TAA 2是CD200。
695.如实施例694所述的MBM,其中TAA 1是FCGR2B。
696.如实施例694所述的MBM,其中TAA 1是CD21。
697.如实施例694所述的MBM,其中TAA 1是CD23。
698.如实施例694所述的MBM,其中TAA 1是CD24。
699.如实施例694所述的MBM,其中TAA 1是CD40L。
700.如实施例694所述的MBM,其中TAA 1是CD72。
701.如实施例694所述的MBM,其中TAA 1是CD79a。
702.如实施例694所述的MBM,其中TAA 1是CD79b。
703.如实施例1至9中任一项所述的MBM,其中TAA 2是FCGR2B。
704.如实施例703所述的MBM,其中TAA 1是CD21。
705.如实施例703所述的MBM,其中TAA 1是CD23。
706.如实施例703所述的MBM,其中TAA 1是CD24。
707.如实施例703所述的MBM,其中TAA 1是CD40L。
708.如实施例703所述的MBM,其中TAA 1是CD72。
709.如实施例703所述的MBM,其中TAA 1是CD79a。
710.如实施例703所述的MBM,其中TAA 1是CD79b。
711.如实施例1至9中任一项所述的MBM,其中TAA 2是CD21。
712.如实施例711所述的MBM,其中TAA 1是CD23。
713.如实施例711所述的MBM,其中TAA 1是CD24。
714.如实施例711所述的MBM,其中TAA 1是CD40L。
715.如实施例711所述的MBM,其中TAA 1是CD72。
716.如实施例711所述的MBM,其中TAA 1是CD79a。
717.如实施例711所述的MBM,其中TAA 1是CD79b。
718.如实施例1至9中任一项所述的MBM,其中TAA 2是CD23。
719.如实施例718所述的MBM,其中TAA 1是CD24。
720.如实施例718所述的MBM,其中TAA 1是CD40L。
721.如实施例718所述的MBM,其中TAA 1是CD72。
722.如实施例718所述的MBM,其中TAA 1是CD79a。
723.如实施例718所述的MBM,其中TAA 1是CD79b。
724.如实施例1至9中任一项所述的MBM,其中TAA 2是CD24。
725.如实施例724所述的MBM,其中TAA 1是CD40L。
726.如实施例724所述的MBM,其中TAA 1是CD72。
727.如实施例724所述的MBM,其中TAA 1是CD79a。
728.如实施例724所述的MBM,其中TAA 1是CD79b。
729.如实施例1至9中任一项所述的MBM,其中TAA 2是CD40L。
730.如实施例729所述的MBM,其中TAA 1是CD72。
731.如实施例729所述的MBM,其中TAA 1是CD79a。
732.如实施例729所述的MBM,其中TAA 1是CD79b。
733.如实施例1至9中任一项所述的MBM,其中TAA 2是CD72。
734.如实施例733所述的MBM,其中TAA 1是CD79a。
735.如实施例733所述的MBM,其中TAA 1是CD79b。
736.如实施例1至9中任一项所述的MBM,其中TAA 2是CD79a。
737.如实施例736所述的MBM,其中TAA 1是CD79b。
738.如实施例1至737中任一项所述的MBM,其中ABM1是基于免疫球蛋白支架的ABM。
739.如实施例738所述的MBM,其中ABM1是抗TAA 1抗体、抗体片段、scFv、dsFv、Fv、Fab、scFab、(Fab’)2、单结构域抗体(SDAB)、VH或VL结构域、或骆驼科动物VHH结构域。
740.如实施例739所述的MBM,其中ABM1是scFv。
741.如实施例739所述的MBM,其中ABM1是Fab。
742.如实施例741所述的MBM,其中所述Fab是Fab异源二聚体。
743.如实施例738至742中任一项所述的MBM,其中ABM1包含表10中描述的结合序列。
744.如实施例743所述的MBM,其中ABM1包含表10中列出的抗体的CDR或可变区序列。
745.如实施例738至742中任一项所述的MBM,其中:
(a)如果TAA 1是BCMA,则ABM1任选地包含表11中描述的结合序列;以及
(b)如果TAA 1是CD19,则ABM1任选地包含表12中描述的结合序列。
746.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-1的CDR序列。
747.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-2的CDR序列。
748.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-3的CDR序列。
749.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-4的CDR序列。
750.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-5的CDR序列。
751.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-6的CDR序列。
752.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-7的CDR序列。
753.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-8的CDR序列。
754.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-9的CDR序列。
755.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-10的CDR序列。
756.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-11的CDR序列。
757.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-12的CDR序列。
758.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-13的CDR序列。
759.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-14的CDR序列。
760.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-15的CDR序列。
761.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-16的CDR序列。
762.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-17的CDR序列。
763.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-18的CDR序列。
764.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-19的CDR序列。
765.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-20的CDR序列。
766.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-21的CDR序列。
767.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-22的CDR序列。
768.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-23的CDR序列。
769.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-24的CDR序列。
770.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-25的CDR序列。
771.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-26的CDR序列。
772.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-27的CDR序列。
773.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-28的CDR序列。
774.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-29的CDR序列。
775.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-30的CDR序列。
776.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-31的CDR序列。
777.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-32的CDR序列。
778.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-33的CDR序列。
779.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-34的CDR序列。
780.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-35的CDR序列。
781.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-36的CDR序列。
782.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-37的CDR序列。
783.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-38的CDR序列。
784.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-39的CDR序列。
785.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-40的CDR序列。
786.如实施例746至785中任一项所述的MBM,其中所述CDR由卡巴特编号定义,如在表11B和11E中所列出。
787.如实施例746至785中任一项所述的MBM,其中所述CDR由乔西亚编号定义,如在表11C和11F中所列出。
788.如实施例746至785中任一项所述的MBM,其中所述CDR由卡巴特编号和乔西亚编号的组合定义,如在表11D和11G中所列出。
789.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-1的重链和轻链可变序列,如在表11A中所列出。
790.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-2的重链和轻链可变序列,如在表11A中所列出。
791.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-3的重链和轻链可变序列,如在表11A中所列出。
792.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-4的重链和轻链可变序列,如在表11A中所列出。
793.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-5的重链和轻链可变序列,如在表11A中所列出。
794.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-6的重链和轻链可变序列,如在表11A中所列出。
795.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-7的重链和轻链可变序列,如在表11A中所列出。
796.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-8的重链和轻链可变序列,如在表11A中所列出。
797.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-9的重链和轻链可变序列,如在表11A中所列出。
798.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-10的重链和轻链可变序列,如在表11A中所列出。
799.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-11的重链和轻链可变序列,如在表11A中所列出。
800.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-12的重链和轻链可变序列,如在表11A中所列出。
801.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-13的重链和轻链可变序列,如在表11A中所列出。
802.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-14的重链和轻链可变序列,如在表11A中所列出。
803.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-15的重链和轻链可变序列,如在表11A中所列出。
804.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-16的重链和轻链可变序列,如在表11A中所列出。
805.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-17的重链和轻链可变序列,如在表11A中所列出。
806.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-18的重链和轻链可变序列,如在表11A中所列出。
807.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-19的重链和轻链可变序列,如在表11A中所列出。
808.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-20的重链和轻链可变序列,如在表11A中所列出。
809.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-21的重链和轻链可变序列,如在表11A中所列出。
810.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-22的重链和轻链可变序列,如在表11A中所列出。
811.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-23的重链和轻链可变序列,如在表11A中所列出。
812.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-24的重链和轻链可变序列,如在表11A中所列出。
813.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-25的重链和轻链可变序列,如在表11A中所列出。
814.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-26的重链和轻链可变序列,如在表11A中所列出。
815.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-27的重链和轻链可变序列,如在表11A中所列出。
816.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-28的重链和轻链可变序列,如在表11A中所列出。
817.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-29的重链和轻链可变序列,如在表11A中所列出。
818.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-30的重链和轻链可变序列,如在表11A中所列出。
819.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-31的重链和轻链可变序列,如在表11A中所列出。
820.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-32的重链和轻链可变序列,如在表11A中所列出。
821.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-33的重链和轻链可变序列,如在表11A中所列出。
822.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-34的重链和轻链可变序列,如在表11A中所列出。
823.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-35的重链和轻链可变序列,如在表11A中所列出。
824.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-36的重链和轻链可变序列,如在表11A中所列出。
825.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-37的重链和轻链可变序列,如在表11A中所列出。
826.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-38的重链和轻链可变序列,如在表11A中所列出。
827.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-39的重链和轻链可变序列,如在表11A中所列出。
828.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含BCMA-40的重链和轻链可变序列,如在表11A中所列出。
829.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-1的scFv的氨基酸序列,如在表11A中所列出。
830.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-2的scFv的氨基酸序列,如在表11A中所列出。
831.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-3的scFv的氨基酸序列,如在表11A中所列出。
832.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-4的scFv的氨基酸序列,如在表11A中所列出。
833.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-5的scFv的氨基酸序列,如在表11A中所列出。
834.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-6的scFv的氨基酸序列,如在表11A中所列出。
835.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-7的scFv的氨基酸序列,如在表11A中所列出。
836.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-8的scFv的氨基酸序列,如在表11A中所列出。
837.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-9的scFv的氨基酸序列,如在表11A中所列出。
838.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-10的scFv的氨基酸序列,如在表11A中所列出。
839.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-11的scFv的氨基酸序列,如在表11A中所列出。
840.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-12的scFv的氨基酸序列,如在表11A中所列出。
841.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-13的scFv的氨基酸序列,如在表11A中所列出。
842.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-14的scFv的氨基酸序列,如在表11A中所列出。
843.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-15的scFv的氨基酸序列,如在表11A中所列出。
844.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-16的scFv的氨基酸序列,如在表11A中所列出。
845.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-17的scFv的氨基酸序列,如在表11A中所列出。
846.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-18的scFv的氨基酸序列,如在表11A中所列出。
847.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-19的scFv的氨基酸序列,如在表11A中所列出。
848.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-20的scFv的氨基酸序列,如在表11A中所列出。
849.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-21的scFv的氨基酸序列,如在表11A中所列出。
850.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-22的scFv的氨基酸序列,如在表11A中所列出。
851.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-23的scFv的氨基酸序列,如在表11A中所列出。
852.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-24的scFv的氨基酸序列,如在表11A中所列出。
853.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-25的scFv的氨基酸序列,如在表11A中所列出。
854.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-26的scFv的氨基酸序列,如在表11A中所列出。
855.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-27的scFv的氨基酸序列,如在表11A中所列出。
856.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-28的scFv的氨基酸序列,如在表11A中所列出。
857.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-29的scFv的氨基酸序列,如在表11A中所列出。
858.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-30的scFv的氨基酸序列,如在表11A中所列出。
859.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-31的scFv的氨基酸序列,如在表11A中所列出。
860.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-32的scFv的氨基酸序列,如在表11A中所列出。
861.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-33的scFv的氨基酸序列,如在表11A中所列出。
862.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-34的scFv的氨基酸序列,如在表11A中所列出。
863.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-35的scFv的氨基酸序列,如在表11A中所列出。
864.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-36的scFv的氨基酸序列,如在表11A中所列出。
865.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-37的scFv的氨基酸序列,如在表11A中所列出。
866.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-38的scFv的氨基酸序列,如在表11A中所列出。
867.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-39的scFv的氨基酸序列,如在表11A中所列出。
868.如实施例745所述的MBM,其中如果TAA 1是BCMA,则ABM1包含scFv,所述scFv包含对应于BCMA-40的scFv的氨基酸序列,如在表11A中所列出。
869.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含:
(a)具有指定为CD19-H1的CDR的氨基酸序列的CDR-H1;
(b)具有指定为CD19-H2A、HD19-H2B、CD19-H2C和CD19-H2D的CDR中任一种的氨基酸序列的CDR-H2;
(c)具有指定为CD19-H3的CDR的氨基酸序列的CDR-H3;
(d)具有指定为CD19-L1的CDR的氨基酸序列的CDR-L1;
(e)具有指定为CD19-L2的CDR的氨基酸序列的CDR-L2;以及
(f)具有指定为CD19-L23的CDR的氨基酸序列的CDR-L3。
870.如实施例869所述的MBM,其中ABM1包含:
(a)具有指定为CD19-VHA、CD19-VHB、CD19-VHC、和CD19-VHD的VH中任一种的氨基酸序列的VH;以及
(b)具有指定为CD19-VLA和CD19-VLB的VL中任一种的氨基酸序列的VL。
871.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2A、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
872.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链可变区,其具有VHA的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLA的氨基酸序列,如在表12中所列出。
873.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2B、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
874.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链可变区,其具有VHB的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLB的氨基酸序列,如在表12中所列出。
875.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2C、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
876.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链可变区,其具有VHC的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLB的氨基酸序列,如在表2中所列出。
877.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2D、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
878.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含重链可变区,其具有VHD的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLB的氨基酸序列,如在表12中所列出。
879.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv1的氨基酸序列,如在表12中所列出。
880.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv2的氨基酸序列,如在表12中所列出。
881.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv3的氨基酸序列,如在表12中所列出。
882.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv4的氨基酸序列,如在表12中所列出。
883.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv5的氨基酸序列,如在表12中所列出。
884.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv6的氨基酸序列,如在表12中所列出。
885.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv7的氨基酸序列,如在表12中所列出。
886.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv8的氨基酸序列,如在表12中所列出。
887.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv9的氨基酸序列,如在表12中所列出。
888.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv10的氨基酸序列,如在表12中所列出。
889.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv11的氨基酸序列,如在表12中所列出。
890.如实施例745所述的MBM,其中如果TAA 1是CD19,则ABM1包含scFv,所述scFv包含CD19-scFv12的氨基酸序列,如在表12中所列出。
891.如实施例1至737中任一项所述的MBM,其中ABM1是基于非免疫球蛋白支架的ABM。
892.如实施例891所述的MBM,其中ABM1是Kunitz结构域、Adnexin、亲合体、DARPin、Avimer、Anticalin、脂质运载蛋白、Centyrin、Versabody、Knottin、Adnectin、Pronectin、Affitin/Nanofitin、Affilin、Atrimer/四连接素、二环肽、cys-knot、Fn3支架、Obody、Tn3、Affimer、BD、Adhiron、Duocalin、Alphabody、Armadillo重复蛋白质、Repebody、或Fynomer。
893.如实施例1至892中任一项所述的MBM,其中ABM2是基于免疫球蛋白支架的ABM。
894.如实施例893所述的MBM,其中ABM2是抗TAA 2抗体、抗体片段、scFv、dsFv、Fv、Fab、scFab、(Fab’)2、单结构域抗体(SDAB)、VH或VL结构域、或骆驼科动物VHH结构域。
895.如实施例894所述的MBM,其中ABM2是scFv。
896.如实施例894所述的MBM,其中ABM2是Fab。
897.如实施例896所述的MBM,其中所述Fab是Fab异源二聚体。
898.如实施例893至897中任一项所述的MBM,其中ABM2包含表10中描述的结合序列。
899.如实施例898所述的MBM,其中ABM2包含表10中列出的抗体的CDR或可变区序列。
900.如实施例893至897中任一项所述的MBM,其中:
(a)如果TAA 2是BCMA,则ABM2任选地包含表11中描述的结合序列;以及
(b)如果TAA 2是CD19,则ABM2任选地包含表12中描述的结合序列。
901.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-1的CDR序列。
902.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-2的CDR序列。
903.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-3的CDR序列。
904.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-4的CDR序列。
905.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-5的CDR序列。
906.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-6的CDR序列。
907.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-7的CDR序列。
908.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-8的CDR序列。
909.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-9的CDR序列。
910.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-10的CDR序列。
911.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-11的CDR序列。
912.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-12的CDR序列。
913.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-13的CDR序列。
914.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-14的CDR序列。
915.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-15的CDR序列。
916.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-16的CDR序列。
917.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-17的CDR序列。
918.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-18的CDR序列。
919.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-19的CDR序列。
920.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-20的CDR序列。
921.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-21的CDR序列。
922.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-22的CDR序列。
923.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-23的CDR序列。
924.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-24的CDR序列。
925.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-25的CDR序列。
926.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-26的CDR序列。
927.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-27的CDR序列。
928.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-28的CDR序列。
929.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-29的CDR序列。
930.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-30的CDR序列。
931.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-31的CDR序列。
932.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-32的CDR序列。
933.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-33的CDR序列。
934.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-34的CDR序列。
935.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-35的CDR序列。
936.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-36的CDR序列。
937.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-37的CDR序列。
938.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-38的CDR序列。
939.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-39的CDR序列。
940.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-40的CDR序列。
941.如实施例901至940中任一项所述的MBM,其中所述CDR由卡巴特编号定义,如在表11B和11E中所列出。
942.如实施例901至940中任一项所述的MBM,其中所述CDR由乔西亚编号定义,如在表11C和11F中所列出。
943.如实施例901至940中任一项所述的MBM,其中所述CDR由卡巴特编号和乔西亚编号的组合定义,如在表11D和11G中所列出。
944.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-1的重链和轻链可变序列,如在表11A中所列出。
945.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-2的重链和轻链可变序列,如在表11A中所列出。
946.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-3的重链和轻链可变序列,如在表11A中所列出。
947.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-4的重链和轻链可变序列,如在表11A中所列出。
948.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-5的重链和轻链可变序列,如在表11A中所列出。
949.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-6的重链和轻链可变序列,如在表11A中所列出。
950.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-7的重链和轻链可变序列,如在表11A中所列出。
951.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-8的重链和轻链可变序列,如在表11A中所列出。
952.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-9的重链和轻链可变序列,如在表11A中所列出。
953.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-10的重链和轻链可变序列,如在表11A中所列出。
954.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-11的重链和轻链可变序列,如在表11A中所列出。
955.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-12的重链和轻链可变序列,如在表11A中所列出。
956.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-13的重链和轻链可变序列,如在表11A中所列出。
957.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-14的重链和轻链可变序列,如在表11A中所列出。
958.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-15的重链和轻链可变序列,如在表11A中所列出。
959.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-16的重链和轻链可变序列,如在表11A中所列出。
960.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-17的重链和轻链可变序列,如在表11A中所列出。
961.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-18的重链和轻链可变序列,如在表11A中所列出。
962.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-19的重链和轻链可变序列,如在表11A中所列出。
963.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-20的重链和轻链可变序列,如在表11A中所列出。
964.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-21的重链和轻链可变序列,如在表11A中所列出。
965.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-22的重链和轻链可变序列,如在表11A中所列出。
966.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-23的重链和轻链可变序列,如在表11A中所列出。
967.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-24的重链和轻链可变序列,如在表11A中所列出。
968.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-25的重链和轻链可变序列,如在表11A中所列出。
969.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-26的重链和轻链可变序列,如在表11A中所列出。
970.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-27的重链和轻链可变序列,如在表11A中所列出。
971.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-28的重链和轻链可变序列,如在表11A中所列出。
972.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-29的重链和轻链可变序列,如在表11A中所列出。
973.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-30的重链和轻链可变序列,如在表11A中所列出。
974.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-31的重链和轻链可变序列,如在表11A中所列出。
975.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-32的重链和轻链可变序列,如在表11A中所列出。
976.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-33的重链和轻链可变序列,如在表11A中所列出。
977.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-34的重链和轻链可变序列,如在表11A中所列出。
978.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-35的重链和轻链可变序列,如在表11A中所列出。
979.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-36的重链和轻链可变序列,如在表11A中所列出。
980.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-37的重链和轻链可变序列,如在表11A中所列出。
981.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-38的重链和轻链可变序列,如在表11A中所列出。
982.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-39的重链和轻链可变序列,如在表11A中所列出。
983.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含BCMA-40的重链和轻链可变序列,如在表11A中所列出。
984.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-1的scFv的氨基酸序列,如在表11A中所列出。
985.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-2的scFv的氨基酸序列,如在表11A中所列出。
986.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-3的scFv的氨基酸序列,如在表11A中所列出。
987.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-4的scFv的氨基酸序列,如在表11A中所列出。
988.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-5的scFv的氨基酸序列,如在表11A中所列出。
989.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-6的scFv的氨基酸序列,如在表11A中所列出。
990.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-7的scFv的氨基酸序列,如在表11A中所列出。
991.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-8的scFv的氨基酸序列,如在表11A中所列出。
992.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-9的scFv的氨基酸序列,如在表11A中所列出。
993.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-10的scFv的氨基酸序列,如在表11A中所列出。
994.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-11的scFv的氨基酸序列,如在表11A中所列出。
995.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-12的scFv的氨基酸序列,如在表11A中所列出。
996.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-13的scFv的氨基酸序列,如在表11A中所列出。
997.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-14的scFv的氨基酸序列,如在表11A中所列出。
998.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-15的scFv的氨基酸序列,如在表11A中所列出。
999.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-16的scFv的氨基酸序列,如在表11A中所列出。
1000.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-17的scFv的氨基酸序列,如在表11A中所列出。
1001.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-18的scFv的氨基酸序列,如在表11A中所列出。
1002.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-19的scFv的氨基酸序列,如在表11A中所列出。
1003.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-20的scFv的氨基酸序列,如在表11A中所列出。
1004.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-21的scFv的氨基酸序列,如在表11A中所列出。
1005.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-22的scFv的氨基酸序列,如在表11A中所列出。
1006.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-23的scFv的氨基酸序列,如在表11A中所列出。
1007.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-24的scFv的氨基酸序列,如在表11A中所列出。
1008.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-25的scFv的氨基酸序列,如在表11A中所列出。
1009.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-26的scFv的氨基酸序列,如在表11A中所列出。
1010.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-27的scFv的氨基酸序列,如在表11A中所列出。
1011.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-28的scFv的氨基酸序列,如在表11A中所列出。
1012.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-29的scFv的氨基酸序列,如在表11A中所列出。
1013.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-30的scFv的氨基酸序列,如在表11A中所列出。
1014.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-31的scFv的氨基酸序列,如在表11A中所列出。
1015.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-32的scFv的氨基酸序列,如在表11A中所列出。
1016.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-33的scFv的氨基酸序列,如在表11A中所列出。
1017.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-34的scFv的氨基酸序列,如在表11A中所列出。
1018.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-35的scFv的氨基酸序列,如在表11A中所列出。
1019.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-36的scFv的氨基酸序列,如在表11A中所列出。
1020.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-37的scFv的氨基酸序列,如在表11A中所列出。
1021.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-38的scFv的氨基酸序列,如在表11A中所列出。
1022.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-39的scFv的氨基酸序列,如在表11A中所列出。
1023.如实施例900所述的MBM,其中如果TAA 2是BCMA,则ABM2包含scFv,所述scFv包含对应于BCMA-40的scFv的氨基酸序列,如在表11A中所列出。
1024.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含:
(a)具有指定为CD19-H1的CDR的氨基酸序列的CDR-H1;
(b)具有指定为CD19-H2A、HD19-H2B、CD19-H2C和CD19-H2D的CDR中任一种的氨基酸序列的CDR-H2;
(c)具有指定为CD19-H3的CDR的氨基酸序列的CDR-H3;
(d)具有指定为CD19-L1的CDR的氨基酸序列的CDR-L1;
(e)具有指定为CD19-L2的CDR的氨基酸序列的CDR-L2;以及
(f)具有指定为CD19-L23的CDR的氨基酸序列的CDR-L3。
1025.如实施例1024所述的MBM,其中ABM2包含:
(a)具有指定为CD19-VHA、CD19-VHB、CD19-VHC、和CD19-VHD的VH中任一种的氨基酸序列的VH;以及
(b)具有指定为CD19-VLA和CD19-VLB的VL中任一种的氨基酸序列的VL。
1026.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2A、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
1027.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链可变区,其具有VHA的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLA的氨基酸序列,如在表12中所列出。
1028.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2B、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
1029.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链可变区,其具有VHB的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLB的氨基酸序列,如在表12中所列出。
1030.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2C、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
1031.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链可变区,其具有VHC的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLB的氨基酸序列,如在表2中所列出。
1032.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链CDR,其具有CD19-H1、CD19-H2D、和CD19-H3的氨基酸序列,如在表12中所列出;和轻链CDR,其具有CD19-L1、CD19-L2、和CD19-L3的氨基酸序列,如在表12中所列出。
1033.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM1包含重链可变区,其具有VHD的氨基酸序列,如在表12中所列出;和轻链可变区,其具有VLB的氨基酸序列,如在表12中所列出。
1034.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv1的氨基酸序列,如在表12中所列出。
1035.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv2的氨基酸序列,如在表12中所列出。
1036.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv3的氨基酸序列,如在表12中所列出。
1037.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv4的氨基酸序列,如在表12中所列出。
1038.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv5的氨基酸序列,如在表12中所列出。
1039.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv6的氨基酸序列,如在表12中所列出。
1040.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv7的氨基酸序列,如在表12中所列出。
1041.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv8的氨基酸序列,如在表12中所列出。
1042.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv9的氨基酸序列,如在表12中所列出。
1043.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv10的氨基酸序列,如在表12中所列出。
1044.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv11的氨基酸序列,如在表12中所列出。
1045.如实施例900所述的MBM,其中如果TAA 2是CD19,则ABM2包含scFv,所述scFv包含CD19-scFv12的氨基酸序列,如在表12中所列出。
1046.如实施例1至892中任一项所述的MBM,其中ABM2是基于非免疫球蛋白支架的ABM。
1047.如实施例1046所述的MBM,其中ABM2是Kunitz结构域、Adnexin、亲合体、DARPin、Avimer、Anticalin、脂质运载蛋白、Centyrin、Versabody、Knottin、Adnectin、Pronectin、Affitin/Nanofitin、Affilin、Atrimer/四连接素、二环肽、cys-knot、Fn3支架、Obody、Tn3、Affimer、BD、Adhiron、Duocalin、Alphabody、Armadillo重复蛋白质、Repebody、或Fynomer。
1048.如实施例1至1047中任一项所述的MBM,其中所述TCR复合物的组分是CD3。
1049.如实施例1048所述的MBM,其中ABM3是抗CD3抗体或其抗原结合结构域。
1050.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-1的CDR序列。
1051.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-2的CDR序列。
1052.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-3的CDR序列。
1053.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-4的CDR序列。
1054.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-5的CDR序列。
1055.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-6的CDR序列。
1056.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-7的CDR序列。
1057.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-8的CDR序列。
1058.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-9的CDR序列。
1059.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-10的CDR序列。
1060.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-11的CDR序列。
1061.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-12的CDR序列。
1062.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-13的CDR序列。
1063.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-14的CDR序列。
1064.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-15的CDR序列。
1065.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-16的CDR序列。
1066.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-17的CDR序列。
1067.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-18的CDR序列。
1068.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-19的CDR序列。
1069.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-20的CDR序列。
1070.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-21的CDR序列。
1071.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-22的CDR序列。
1072.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-23的CDR序列。
1073.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-24的CDR序列。
1074.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-25的CDR序列。
1075.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-26的CDR序列。
1076.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-27的CDR序列。
1077.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-28的CDR序列。
1078.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-29的CDR序列。
1079.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-30的CDR序列。
1080.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-31的CDR序列。
1081.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-32的CDR序列。
1082.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-33的CDR序列。
1083.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-34的CDR序列。
1084.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-35的CDR序列。
1085.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-36的CDR序列。
1086.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-37的CDR序列。
1087.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-38的CDR序列。
1088.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-39的CDR序列。
1089.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-40的CDR序列。
1090.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-41的CDR序列。
1091.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-42的CDR序列。
1092.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-43的CDR序列。
1093.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-44的CDR序列。
1094.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-45的CDR序列。
1095.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-46的CDR序列。
1096.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-47的CDR序列。
1097.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-48的CDR序列。
1098.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-49的CDR序列。
1099.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-50的CDR序列。
1100.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-51的CDR序列。
1101.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-52的CDR序列。
1102.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-53的CDR序列。
1103.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-54的CDR序列。
1104.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-55的CDR序列。
1105.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-56的CDR序列。
1106.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-57的CDR序列。
1107.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-58的CDR序列。
1108.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-59的CDR序列。
1109.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-60的CDR序列。
1110.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-61的CDR序列。
1111.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-62的CDR序列。
1112.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-63的CDR序列。
1113.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-64的CDR序列。
1114.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-65的CDR序列。
1115.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-66的CDR序列。
1116.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-67的CDR序列。
1117.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-68的CDR序列。
1118.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-69的CDR序列。
1119.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-70的CDR序列。
1120.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-71的CDR序列。
1121.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-72的CDR序列。
1122.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-73的CDR序列。
1123.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-74的CDR序列。
1124.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-75的CDR序列。
1125.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-76的CDR序列。
1126.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-77的CDR序列。
1127.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-78的CDR序列。
1128.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-79的CDR序列。
1129.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-80的CDR序列。
1130.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-81的CDR序列。
1131.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-82的CDR序列。
1132.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-83的CDR序列。
1133.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-84的CDR序列。
1134.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-85的CDR序列。
1135.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-86的CDR序列。
1136.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-87的CDR序列。
1137.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-88的CDR序列。
1138.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-89的CDR序列。
1139.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-90的CDR序列。
1140.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-91的CDR序列。
1141.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-92的CDR序列。
1142.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-93的CDR序列。
1143.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-94的CDR序列。
1144.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-95的CDR序列。
1145.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-96的CDR序列。
1146.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-97的CDR序列。
1147.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-98的CDR序列。
1148.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-99的CDR序列。
1149.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-100的CDR序列。
1150.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-101的CDR序列。
1151.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-102的CDR序列。
1152.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-103的CDR序列。
1153.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-104的CDR序列。
1154.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-105的CDR序列。
1155.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-106的CDR序列。
1156.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-107的CDR序列。
1157.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-108的CDR序列。
1158.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-109的CDR序列。
1159.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-110的CDR序列。
1160.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-111的CDR序列。
1161.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-112的CDR序列。
1162.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-113的CDR序列。
1163.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-114的CDR序列。
1164.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-115的CDR序列。
1165.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-116的CDR序列。
1166.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-117的CDR序列。
1167.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-118的CDR序列。
1168.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-119的CDR序列。
1169.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-120的CDR序列。
1170.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-121的CDR序列。
1171.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-122的CDR序列。
1172.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-123的CDR序列。
1173.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-124的CDR序列。
1174.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-125的CDR序列。
1175.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-126的CDR序列。
1176.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-127的CDR序列。
1177.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-128的CDR序列。
1178.如实施例1050至1177中任一项所述的MBM,其中所述CDR由卡巴特编号定义,如在表8B中所列出。
1179.如实施例1050至1070中任一项所述的MBM,其中所述CDR由乔西亚编号定义,如在表8C中所列出。
1180.如实施例1050至1069中任一项所述的MBM,其中所述CDR由卡巴特编号和乔西亚编号的组合所定义,如在表8D中所列出。
1181.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-1的重链和轻链可变序列,如在表8A中所列出。
1182.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-2的重链和轻链可变序列,如在表8A中所列出。
1183.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-3的重链和轻链可变序列,如在表8A中所列出。
1184.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-4的重链和轻链可变序列,如在表8A中所列出。
1185.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-5的重链和轻链可变序列,如在表8A中所列出。
1186.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-6的重链和轻链可变序列,如在表8A中所列出。
1187.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-7的重链和轻链可变序列,如在表8A中所列出。
1188.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-8的重链和轻链可变序列,如在表8A中所列出。
1189.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-9的重链和轻链可变序列,如在表8A中所列出。
1190.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-10的重链和轻链可变序列,如在表8A中所列出。
1191.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-11的重链和轻链可变序列,如在表8A中所列出。
1192.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-12的重链和轻链可变序列,如在表8A中所列出。
1193.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-13的重链和轻链可变序列,如在表8A中所列出。
1194.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-14的重链和轻链可变序列,如在表8A中所列出。
1195.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-15的重链和轻链可变序列,如在表8A中所列出。
1196.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-16的重链和轻链可变序列,如在表8A中所列出。
1197.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-17的重链和轻链可变序列,如在表8A中所列出。
1198.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-18的重链和轻链可变序列,如在表8A中所列出。
1199.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-19的重链和轻链可变序列,如在表8A中所列出。
1200.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-20的重链和轻链可变序列,如在表8A中所列出。
1201.如实施例1048或实施例1049所述的MBM,其中ABM3包含CD3-21的重链和轻链可变序列,如在表8A中所列出。
1202.如实施例1至1047中任一项所述的MBM,其中所述TCR复合物的组分是TCR-α、TCR-β、或TCR-α/β二聚体。
1203.如实施例1202所述的MBM,其中ABM3是抗体或其抗原结合结构域。
1204.如实施例1203所述的MBM,其中ABM3包含BMA031的CDR序列。
1205.如实施例1204所述的MBM,其中所述CDR序列由卡巴特编号定义。
1206.如实施例1204所述的MBM,其中所述CDR序列由乔西亚编号定义。
1207.如实施例1204所述的MBM,其中所述CDR序列由卡巴特编号和乔西亚编号的组合定义。
1208.如实施例1204所述的MBM,其中ABM3包含BMA031的重链和轻链可变序列。
1209.如实施例1至1047中任一项所述的MBM,其中所述TCR复合物的组分是TCR-γ、TCR-δ、或TCR-γ/δ二聚体。
1210.如实施例1209所述的MBM,其中ABM3是抗体或其抗原结合结构域。
1211.如实施例1210所述的MBM,其中ABM3包含δTCS1的CDR序列。
1212.如实施例1211所述的MBM,其中所述CDR序列由卡巴特编号定义。
1213.如实施例1211所述的MBM,其中所述CDR序列由乔西亚编号定义。
1214.如实施例1211所述的MBM,其中所述CDR序列由卡巴特编号和乔西亚编号的组合定义。
1215.如实施例1211所述的MBM,其中ABM3包含δTCS1的重链和轻链可变序列。
1216.如实施例1至1215中任一项所述的MBM,其中ABM3是抗体、抗体片段、scFv、dsFv、Fv、Fab、scFab、(Fab’)2、单结构域抗体(SDAB)、VH或VL结构域、或骆驼科动物VHH结构域。
1217.如实施例1216所述的MBM,其中ABM3是scFv。
1218.如实施例1216所述的MBM,其中ABM3是Fab。
1219.如实施例1至1218中任一项所述的MBM,其包含:
(a)第一单体或半抗体,其包含:
(i)包含第一变体Fc区和第一重链可变结构域的第一链;
(ii)第一scFv结构域;以及
(b)第二单体或半抗体,其包含:
(i)包含第二变体Fc区和第一重链可变结构域的第二链;
(ii)第二scFv结构域;以及
(c)包含轻链恒定结构域和轻链可变结构域的第三链;其中:
(1)所述第一和第二变体Fc区形成异源二聚体,
(2)所述第一重链可变结构域和所述轻链可变结构域形成ABM1,
(3)所述第一scFv结构域形成ABM2,并且
(4)所述第二scFv结构域形成ABM3。
1220.如实施例1至1218中任一项所述的MBM,其包含:
(a)第一单体或半抗体,其包含:
(i)包含第一变体Fc区和第一重链可变结构域的第一链;
(ii)第一scFv结构域;以及
(b)第二单体或半抗体,其包含:
(i)包含第二变体Fc区和第一重链可变结构域的第二链;
(ii)第二scFv结构域;以及
(c)包含轻链恒定结构域和轻链可变结构域的第三链;其中:
(1)所述第一和第二变体Fc区形成异源二聚体,
(2)所述第一重链可变结构域和所述轻链可变结构域形成ABM1,
(3)所述第一scFv结构域形成ABM3,并且
(4)所述第二scFv结构域形成ABM2。
1221.如实施例1至1218中任一项所述的MBM,其包含:
(a)第一单体或半抗体,其包含:
(i)包含第一变体Fc区和第一重链可变结构域的第一链;
(ii)第一scFv结构域;以及
(b)第二单体或半抗体,其包含:
(i)包含第二变体Fc区和第一重链可变结构域的第二链;
(ii)第二scFv结构域;以及
(c)包含轻链恒定结构域和轻链可变结构域的第三链;其中
(1)所述第一和第二变体Fc区形成异源二聚体,
(2)所述第一重链可变结构域和所述轻链可变结构域形成ABM2,
(3)所述第一scFv结构域形成ABM1,并且
(4)所述第二scFv结构域形成ABM3。
1222.如实施例1至1218中任一项所述的MBM,其包含:
(a)第一单体或半抗体,其包含:
(i)包含第一变体Fc区和第一重链可变结构域的第一链;
(ii)第一scFv结构域;以及
(b)第二单体或半抗体,其包含:
(i)包含第二变体Fc区和第一重链可变结构域的第二链;
(ii)第二scFv结构域;以及
(c)包含轻链恒定结构域和轻链可变结构域的第三链;其中
(1)所述第一和第二变体Fc区形成异源二聚体,
(2)所述第一重链可变结构域和所述轻链可变结构域形成ABM2,
(3)所述第一scFv结构域形成ABM3,并且
(4)所述第二scFv结构域形成ABM1。
1223.如实施例1至1218中任一项所述的MBM,其包含:
(a)第一单体或半抗体,其包含:
(i)包含第一变体Fc区和第一重链可变结构域的第一链;
(ii)第一scFv结构域;以及
(b)第二单体或半抗体,其包含:
(i)包含第二变体Fc区和第一重链可变结构域的第二链;
(ii)第二scFv结构域;以及
包含轻链恒定结构域和轻链可变结构域的第三链;其中:
(1)所述第一和第二变体Fc区形成异源二聚体,
(2)所述第一重链可变结构域和所述轻链可变结构域形成ABM3,
(3)所述第一scFv结构域形成ABM2,并且
(4)所述第二scFv结构域形成ABM1。
1224.如实施例1至1218中任一项所述的MBM,其包含:
(a)第一单体或半抗体,其包含:
(i)包含第一变体Fc区和第一重链可变结构域的第一链;
(ii)第一scFv结构域;以及
(b)第二单体或半抗体,其包含:
(i)包含第二变体Fc区和第一重链可变结构域的第二链;
(ii)第二scFv结构域;以及
(c)包含轻链恒定结构域和轻链可变结构域的第三链;其中
(1)所述第一和第二变体Fc区形成异源二聚体,
(2)所述第一重链可变结构域和所述轻链可变结构域形成ABM3,
(3)所述第一scFv结构域形成ABM1,并且
(4)所述第二scFv结构域形成ABM2。
1225.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含氨基酸取代S364K/E357Q:L368D/K370S。
1226.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含氨基酸取代L368D/K370S:S364。
1227.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含氨基酸取代L368E/K370S:S364K。
1228.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含氨基酸取代T411T/E360E/Q362E:D401K。
1229.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含氨基酸取代L368D370S:S364/E357L。
1230.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含氨基酸取代370S:S364K/E357Q。
1231.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含在WO 2014/110601的图4中列出的任何空间变体的氨基酸取代(转载于表2中)。
1232.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含在WO 2014/110601的图5中列出的任何变体的氨基酸取代(转载于表2中)。
1233.如实施例1219至1224中任一项所述的MBM,其中所述第一和第二变体Fc区包含在WO 2014/110601的图6中列出的任何变体的氨基酸取代(转载于表2中)。
1234.如实施例1219至1233中任一项所述的MBM,其中所述单体或半抗体中的至少一个进一步包含pI变体取代。
1235.如实施例1234所述的MBM,其中所述pI变体取代选自表2。
1236.如实施例1235所述的MBM,其中所述pI变体取代包含pl_ISO(-)中存在的取代。
1237.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(-)_等电_A中存在的取代。
1238.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(-)_等电_B中存在的取代。
1239.如实施例1235所述的MBM,其中所述pI变体取代包含Pl_ISO(+RR)中存在的取代。
1240.如实施例1235所述的MBM,其中所述pI变体取代包含pl_ISO(+)中存在的取代。
1241.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(+)_等电_A中存在的取代。
1242.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(+)_等电_B中存在的取代。
1243.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(+)等电_E269Q/E272Q中存在的取代。
1244.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(+)等电_E269Q/E283Q中存在的取代。
1245.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(+)_等电_E2720/E283Q中存在的取代。
1246.如实施例1235所述的MBM,其中所述pI变体取代包含pl_(+)_等电_E269Q中存在的取代。
1247.如实施例1219至1246中任一项所述的MBM,其中所述第一和第二scFv结构域分别共价附接至所述第一和第二链的C-末端。
1248.如实施例1219至1246中任一项所述的MBM,其中所述第一和第二scFv结构域分别共价附接至所述第一和第二链的N-末端。
1249.如实施例1219至1246中任一项所述的MBM,其中所述scFv结构域中的每一个均附接在所述链的所述Fc区与所述CH结构域之间。
1250.如实施例1219至1249中任一项所述的MBM,其中所述scFv结构域使用一个或多个结构域接头共价附接。
1251.如实施例1219至1250中任一项所述的MBM,其中所述scFv结构域包含至少一个scFv接头。
1252.如实施例1251所述的MBM,其中至少一个scFv接头是带电的。
1253.如实施例1252所述的MBM,其中所述带电的接头选自L1至L54。
1254.如实施例1219至1253中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含选自434A、434S、428L、308F、259I、428L/434S、259I/308F、436I/428L、4361或V/434S、436V/428L、252Y、252Y/254T/256E、259I/308F/428L、236A、239D、239E、332E、332D、239D/332E、267D、267E、328F、267E/328F、236A/332E、239D/332E/330Y、239D、332E/330L、236R、328R、236R/328R、236N/267E、243L、298A和299T中的一个或多个氨基酸取代。
1255.如实施例1219至1253中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代434A、434S或434V的一个或多个氨基酸取代。
1256.如实施例1255所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代428L的一个或多个氨基酸取代。
1257.如实施例1255至1256中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代308F的一个或多个氨基酸取代。
1258.如实施例1255至1257中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代259I的一个或多个氨基酸取代。
1259.如实施例1255至1258中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代436I的一个或多个氨基酸取代。
1260.如实施例1255至1259中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代252Y的一个或多个氨基酸取代。
1261.如实施例1255至1260中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代254T的一个或多个氨基酸取代。
1262.如实施例1255至1261中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代256E的一个或多个氨基酸取代。
1263.如实施例1255至1262中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代239D或239E的一个或多个氨基酸取代。
1264.如实施例1255至1263中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代332E或332D的一个或多个氨基酸取代。
1265.如实施例1255至1264中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代267D或267E的一个或多个氨基酸取代。
1266.如实施例1255至1265中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代330L的一个或多个氨基酸取代。
1267.如实施例1255至1266中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代236R或236N的一个或多个氨基酸取代。
1268.如实施例1255至1267中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代328R的一个或多个氨基酸取代。
1269.如实施例1255至1268中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代243L的一个或多个氨基酸取代。
1270.如实施例1255至1269中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代298A的一个或多个氨基酸取代。
1271.如实施例1255至1270中任一项所述的MBM,其中所述第一和/或第二Fc区进一步包含含有氨基酸取代299T的一个或多个氨基酸取代。
1272.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分是CD3。
1273.如实施例1272所述的MBM,其中ABM3是:
(a)基于免疫球蛋白支架的ABM,其任选地是抗CD3抗体、抗体片段、scFv、dsFv、Fv、Fab、scFab、(Fab’)2、单结构域抗体(SDAB)、VH或VL结构域、或骆驼科动物VHH结构域;或
(b)基于非免疫球蛋白支架的ABM,其任选地是Kunitz结构域、Adnexin、亲合体、DARPin、Avimer、Anticalin、脂质运载蛋白、Centyrin、Versabody、Knottin、Adnectin、Pronectin、Affitin/Nanofitin、Affilin、Atrimer/四连接素、二环肽、cys-knot、Fn3支架、Obody、Tn3、Aan Affimer、BD、Adhiron、Duocalin、Alphabody、Armadillo重复蛋白质、Repebody、或Fynomer。
1274.如实施例1272或实施例1273所述的MBM,其中ABM3包含表8A至8D中任一个中列出的任何结合序列。
1275.如实施例1274所述的MBM,其中ABM3包含指定为CD3-1至CD3-28的结合结构域中任一个的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1276.如实施例1275所述的MBM,其中ABM3包含指定为CD3-1的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1277.如实施例1275所述的MBM,其中ABM3包含指定为CD3-1的结合结构域的VH和/或VL序列。
1278.如实施例1275所述的MBM,其中ABM3包含指定为CD3-2的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1279.如实施例1275所述的MBM,其中ABM3包含指定为CD3-2的结合结构域的VH和/或VL序列。
1280.如实施例1275所述的MBM,其中ABM3包含指定为CD3-3的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1281.如实施例1275所述的MBM,其中ABM3包含指定为CD3-3的结合结构域的VH和/或VL序列。
1282.如实施例1275所述的MBM,其中ABM3包含指定为CD3-4的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1283.如实施例1275所述的MBM,其中ABM3包含指定为CD3-4的结合结构域的VH和/或VL序列。
1284.如实施例1275所述的MBM,其中ABM3包含指定为CD3-5的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1285.如实施例1275所述的MBM,其中ABM3包含指定为CD3-5的结合结构域的VH和/或VL序列。
1286.如实施例1275所述的MBM,其中ABM3包含指定为CD3-6的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1287.如实施例1275所述的MBM,其中ABM3包含指定为CD3-6的结合结构域的VH和/或VL序列。
1288.如实施例1275所述的MBM,其中ABM3包含指定为CD3-7的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1289.如实施例1275所述的MBM,其中ABM3包含指定为CD3-7的结合结构域的VH和/或VL序列。
1290.如实施例1275所述的MBM,其中ABM3包含指定为CD3-8的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1291.如实施例1275所述的MBM,其中ABM3包含指定为CD3-8的结合结构域的VH和/或VL序列。
1292.如实施例1275所述的MBM,其中ABM3包含指定为CD3-9的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1293.如实施例1275所述的MBM,其中ABM3包含指定为CD3-9的结合结构域的VH和/或VL序列。
1294.如实施例1275所述的MBM,其中ABM3包含指定为CD3-10的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1295.如实施例1275所述的MBM,其中ABM3包含指定为CD3-10的结合结构域的VH和/或VL序列。
1296.如实施例1275所述的MBM,其中ABM3包含指定为CD3-11的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1297.如实施例1275所述的MBM,其中ABM3包含指定为CD3-11的结合结构域的VH和/或VL序列。
1298.如实施例1275所述的MBM,其中ABM3包含指定为CD3-12的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1299.如实施例1275所述的MBM,其中ABM3包含指定为CD3-12的结合结构域的VH和/或VL序列。
1300.如实施例1275所述的MBM,其中ABM3包含指定为CD3-13的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1301.如实施例1275所述的MBM,其中ABM3包含指定为CD3-13的结合结构域的VH和/或VL序列。
1302.如实施例1275所述的MBM,其中ABM3包含指定为CD3-14的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1303.如实施例1275所述的MBM,其中ABM3包含指定为CD3-14的结合结构域的VH和/或VL序列。
1304.如实施例1275所述的MBM,其中ABM3包含指定为CD3-15的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1305.如实施例1275所述的MBM,其中ABM3包含指定为CD3-15的结合结构域的VH和/或VL序列。
1306.如实施例1275所述的MBM,其中ABM3包含指定为CD3-16的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1307.如实施例1275所述的MBM,其中ABM3包含指定为CD3-16的结合结构域的VH和/或VL序列。
1308.如实施例1275所述的MBM,其中ABM3包含指定为CD3-17的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1309.如实施例1275所述的MBM,其中ABM3包含指定为CD3-17的结合结构域的VH和/或VL序列。
1310.如实施例1275所述的MBM,其中ABM3包含指定为CD3-18的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1311.如实施例1275所述的MBM,其中ABM3包含指定为CD3-18的结合结构域的VH和/或VL序列。
1312.如实施例1275所述的MBM,其中ABM3包含指定为CD3-19的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1313.如实施例1275所述的MBM,其中ABM3包含指定为CD3-19的结合结构域的VH和/或VL序列。
1314.如实施例1275所述的MBM,其中ABM3包含指定为CD3-20的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1315.如实施例1275所述的MBM,其中ABM3包含指定为CD3-20的结合结构域的VH和/或VL序列。
1316.如实施例1275所述的MBM,其中ABM3包含指定为CD3-21的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1317.如实施例1275所述的MBM,其中ABM3包含指定为CD3-21的结合结构域的VH和/或VL序列。
1318.如实施例1275所述的MBM,其中ABM3包含指定为CD3-22的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1319.如实施例1275所述的MBM,其中ABM3包含指定为CD3-22的结合结构域的VH和/或VL序列。
1320.如实施例1275所述的MBM,其中ABM3包含指定为CD3-23的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1321.如实施例1275所述的MBM,其中ABM3包含指定为CD3-23的结合结构域的VH和/或VL序列。
1322.如实施例1275所述的MBM,其中ABM3包含指定为CD3-24的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1323.如实施例1275所述的MBM,其中ABM3包含指定为CD3-24的结合结构域的VH和/或VL序列。
1324.如实施例1275所述的MBM,其中ABM3包含指定为CD3-25的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1325.如实施例1275所述的MBM,其中ABM3包含指定为CD3-25的结合结构域的VH和/或VL序列。
1326.如实施例1275所述的MBM,其中ABM3包含指定为CD3-26的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1327.如实施例1275所述的MBM,其中ABM3包含指定为CD3-26的结合结构域的VH和/或VL序列。
1328.如实施例1275所述的MBM,其中ABM3包含指定为CD3-27的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1329.如实施例1275所述的MBM,其中ABM3包含指定为CD3-27的结合结构域的VH和/或VL序列。
1330.如实施例1275所述的MBM,其中ABM3包含指定为CD3-28的结合结构域的重链和轻链CDR(如由卡巴特、乔西亚或其组合所定义)。
1331.如实施例1275所述的MBM,其中ABM3包含指定为CD3-28的结合结构域的VH和/或VL序列。
1332.如实施例1274所述的MBM,其中ABM3包含指定为CD3-29至CD3-128的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1333.如实施例1332所述的MBM,其中ABM3包含指定为CD3-29至CD3-38的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1334.如实施例1332所述的MBM,其中ABM3包含指定为CD3-39至CD3-48的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1335.如实施例1332所述的MBM,其中ABM3包含指定为CD3-49至CD3-58的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1336.如实施例1332所述的MBM,其中ABM3包含指定为CD3-59至CD3-68的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1337.如实施例1332所述的MBM,其中ABM3包含指定为CD3-69至CD3-78的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1338.如实施例1332所述的MBM,其中ABM3包含指定为CD3-79至CD3-88的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1339.如实施例1332所述的MBM,其中ABM3包含指定为CD3-89至CD3-98的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1340.如实施例1332所述的MBM,其中ABM3包含指定为CD3-99至CD3-108的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1341.如实施例1332所述的MBM,其中ABM3包含指定为CD3-109至CD3-118的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1342.如实施例1332所述的MBM,其中ABM3包含指定为CD3-119至CD3-128的结合结构域中任一个的重链和轻链CDR(如由卡巴特所定义)。
1343.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分是所述TCR的α亚基。
1344.如实施例1343所述的MBM,其中ABM3是:
(a)基于免疫球蛋白支架的ABM,其任选地是抗体、抗体片段、scFv、dsFv、Fv、Fab、scFab、(Fab’)2、单结构域抗体(SDAB)、VH或VL结构域、或骆驼科动物VHH结构域;或
(b)基于非免疫球蛋白支架的ABM,其任选地是Kunitz结构域、Adnexin、亲合体、DARPin、Avimer、Anticalin、脂质运载蛋白、Centyrin、Versabody、Knottin、Adnectin、Pronectin、Affitin/Nanofitin、Affilin、Atrimer/四连接素、二环肽、cys-knot、Fn3支架、Obody、Tn3、Aan Affimer、BD、Adhiron、Duocalin、Alphabody、Armadillo重复蛋白质、Repebody、或Fynomer。
1345.如实施例1344所述的MBM,其中ABM3包含对应于抗体BMA031的重链和轻链CDR的CDR。
1346.如实施例1344所述的MBM,其中ABM3包含对应于抗体BMA031的VH和VL的可变区。
1347.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分是所述TCR的β亚基。
1348.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分是所述TCR的δ亚基。
1349.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分是所述TCR的γ亚基。
1350.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分包含所述TCR的α和β亚基。
1351.如实施例1至1271中任一项所述的MBM,其中所述人TCR复合物的组分包含所述TCR的γ和δ亚基。
1352.如实施例1344至1351中任一项所述的MBM,其中ABM3是scFv。
1353.如实施例1344至1346中任一项所述的MBM,其中ABM3是Fab。
1354.如实施例1353所述的MBM,其中所述Fab是Fab异源二聚体。
1355.如实施例1至1354中任一项所述的MBM,其包含Fc结构域。
1356.如实施例1355所述的MBM,其中所述Fc结构域是Fc异源二聚体。
1357.如实施例1356所述的MBM,其中所述Fc异源二聚体包含在表2中列出的任何Fc修饰。
1358.如实施例1356所述的MBM,其中所述Fc异源二聚体包含杵臼结构(“KIH”)修饰。
1359.如实施例1358所述的MBM,其中所述KIH修饰是在7.3.1.5.1节或表2中所述的KIH修饰中的任一种。
1360.如实施例1358所述的MBM,其中所述KIH修饰是在7.3.1.5.2节或表2中所述的替代KIH修饰中的任一种。
1361.如实施例1356至1360中任一项所述的MBM,其包含极性桥修饰。
1362.如实施例1361所述的MBM,其中所述极性桥修饰是在7.3.1.5.3节或表2中所述的极性桥修饰中的任一种。
1363.如实施例1356至1362中任一项所述的MBM,其包含指定为Fc 1至Fc 150的Fc修饰中的至少一种。
1364.如实施例1363所述的MBM,其包含指定为Fc 1至Fc 5的Fc修饰中的至少一种。
1365.如实施例1363所述的MBM,其包含指定为Fc 6至Fc 10的Fc修饰中的至少一种。
1366.如实施例1363所述的MBM,其包含指定为Fc 11至Fc 15的Fc修饰中的至少一种。
1367.如实施例1363所述的MBM,其包含指定为Fc 16至Fc 20的Fc修饰中的至少一种。
1368.如实施例1363所述的MBM,其包含指定为Fc 21至Fc 25的Fc修饰中的至少一种。
1369.如实施例1363所述的MBM,其包含指定为Fc 26至Fc 30的Fc修饰中的至少一种。
1370.如实施例1363所述的MBM,其包含指定为Fc 31至Fc 35的Fc修饰中的至少一种。
1371.如实施例1363所述的MBM,其包含指定为Fc 36至Fc 40的Fc修饰中的至少一种。
1372.如实施例1363所述的MBM,其包含指定为Fc 41至Fc 45的Fc修饰中的至少一种。
1373.如实施例1363所述的MBM,其包含指定为Fc 46至Fc 50的Fc修饰中的至少一种。
1374.如实施例1363所述的MBM,其包含指定为Fc 51至Fc 55的Fc修饰中的至少一种。
1375.如实施例1363所述的MBM,其包含指定为Fc 56至Fc 60的Fc修饰中的至少一种。
1376.如实施例1363所述的MBM,其包含指定为Fc 61至Fc 65的Fc修饰中的至少一种。
1377.如实施例1363所述的MBM,其包含指定为Fc 66至Fc 70的Fc修饰中的至少一种。
1378.如实施例1363所述的MBM,其包含指定为Fc 71至Fc 75的Fc修饰中的至少一种。
1379.如实施例1363所述的MBM,其包含指定为Fc 76至Fc 80的Fc修饰中的至少一种。
1380.如实施例1363所述的MBM,其包含指定为Fc 81至Fc 85的Fc修饰中的至少一种。
1381.如实施例1363所述的MBM,其包含指定为Fc 86至Fc 90的Fc修饰中的至少一种。
1382.如实施例1363所述的MBM,其包含指定为Fc 91至Fc 95的Fc修饰中的至少一种。
1383.如实施例1363所述的MBM,其包含指定为Fc 96至Fc 100的Fc修饰中的至少一种。
1384.如实施例1363所述的MBM,其包含指定为Fc 101至Fc 105的Fc修饰中的至少一种。
1385.如实施例1363所述的MBM,其包含指定为Fc 106至Fc 110的Fc修饰中的至少一种。
1386.如实施例1363所述的MBM,其包含指定为Fc 111至Fc 115的Fc修饰中的至少一种。
1387.如实施例1363所述的MBM,其包含指定为Fc 116至Fc 120的Fc修饰中的至少一种。
1388.如实施例1363所述的MBM,其包含指定为Fc 121至Fc 125的Fc修饰中的至少一种。
1389.如实施例1363所述的MBM,其包含指定为Fc 126至Fc 130的Fc修饰中的至少一种。
1390.如实施例1363所述的MBM,其包含指定为Fc 131至Fc 135的Fc修饰中的至少一种。
1391.如实施例1363所述的MBM,其包含指定为Fc 136至Fc 140的Fc修饰中的至少一种。
1392.如实施例1363所述的MBM,其包含指定为Fc 141至Fc 145的Fc修饰中的至少一种。
1393.如实施例1363所述的MBM,其包含指定为Fc 146至Fc 150的Fc修饰中的至少一种。
1394.如实施例1355至1393中任一项所述的MBM,其中所述Fc结构域具有改变的效应子功能。
1395.如实施例1394所述的MBM,其中所述Fc结构域具有与一种或多种Fc受体的改变的结合。
1396.如实施例1395所述的MBM,其中所述一种或多种Fc受体包含FcRN。
1397.如实施例1395或实施例1396所述的MBM,其中所述一种或多种Fc受体包含白细胞受体。
1398.如实施例1355至1397中任一项所述的MBM,其中所述Fc具有经修饰的二硫键架构。
1399.如实施例1355至1398中任一项所述的MBM,其中所述Fc具有改变的糖基化模式。
1400.如实施例1355至1399中任一项所述的MBM,其中所述Fc包含铰链区。
1401.如实施例1400所述的MBM,其中所述铰链区包含在7.3.2节中所述的任何铰链区。
1402.如实施例1401所述的MBM,其中所述铰链区包含指定为H1的铰链区的氨基酸序列。
1403.如实施例1401所述的MBM,其中所述铰链区包含指定为H2的铰链区的氨基酸序列。
1404.如实施例1401所述的MBM,其中所述铰链区包含指定为H3的铰链区的氨基酸序列。
1405.如实施例1401所述的MBM,其中所述铰链区包含指定为H4的铰链区的氨基酸序列。
1406.如实施例1401所述的MBM,其中所述铰链区包含指定为H5的铰链区的氨基酸序列。
1407.如实施例1401所述的MBM,其中所述铰链区包含指定为H6的铰链区的氨基酸序列。
1408.如实施例1401所述的MBM,其中所述铰链区包含指定为H7的铰链区的氨基酸序列。
1409.如实施例1401所述的MBM,其中所述铰链区包含指定为H8的铰链区的氨基酸序列。
1410.如实施例1401所述的MBM,其中所述铰链区包含指定为H9的铰链区的氨基酸序列。
1411.如实施例1401所述的MBM,其中所述铰链区包含指定为H10的铰链区的氨基酸序列。
1412.如实施例1401所述的MBM,其中所述铰链区包含指定为H11的铰链区的氨基酸序列。
1413.如实施例1401所述的MBM,其中所述铰链区包含指定为H12的铰链区的氨基酸序列。
1414.如实施例1401所述的MBM,其中所述铰链区包含指定为H13的铰链区的氨基酸序列。
1415.如实施例1401所述的MBM,其中所述铰链区包含指定为H14的铰链区的氨基酸序列。
1416.如实施例1401所述的MBM,其中所述铰链区包含指定为H15的铰链区的氨基酸序列。
1417.如实施例1401所述的MBM,其中所述铰链区包含指定为H16的铰链区的氨基酸序列。
1418.如实施例1401所述的MBM,其中所述铰链区包含指定为H17的铰链区的氨基酸序列。
1419.如实施例1401所述的MBM,其中所述铰链区包含指定为H18的铰链区的氨基酸序列。
1420.如实施例1401所述的MBM,其中所述铰链区包含指定为H19的铰链区的氨基酸序列。
1421.如实施例1401所述的MBM,其中所述铰链区包含指定为H20的铰链区的氨基酸序列。
1422.如实施例1401所述的MBM,其中所述铰链区包含指定为H21的铰链区的氨基酸序列。
1423.如实施例1至1422中任一项所述的MBM,其包含至少一个scFv结构域。
1424.如实施例1423所述的MBM,其中至少一个scFv包含连接所述VH和VL结构域的接头。
1425.如实施例1424所述的MBM,其中所述接头的长度为5至25个氨基酸。
1426.如实施例1425所述的MBM,其中所述接头的长度为12至20个氨基酸。
1427.如实施例1424至1426中任一项所述的MBM,其中所述接头是带电荷的接头和/或柔性接头。
1428.如实施例1424至1427中任一项所述的MBM,其中所述接头选自接头L1至L54中的任一个。
1429.如实施例1428所述的MBM,其中所述接头区包含指定为L1的接头的氨基酸序列。
1430.如实施例1428所述的MBM,其中所述接头区包含指定为L2的接头的氨基酸序列。
1431.如实施例1428所述的MBM,其中所述接头区包含指定为L3的接头的氨基酸序列。
1432.如实施例1428所述的MBM,其中所述接头区包含指定为L4的接头的氨基酸序列。
1433.如实施例1428所述的MBM,其中所述接头区包含指定为L5的接头的氨基酸序列。
1434.如实施例1428所述的MBM,其中所述接头区包含指定为L6的接头的氨基酸序列。
1435.如实施例1428所述的MBM,其中所述接头区包含指定为L7的接头的氨基酸序列。
1436.如实施例1428所述的MBM,其中所述接头区包含指定为L8的接头的氨基酸序列。
1437.如实施例1428所述的MBM,其中所述接头区包含指定为L9的接头的氨基酸序列。
1438.如实施例1428所述的MBM,其中所述接头区包含指定为L10的接头的氨基酸序列。
1439.如实施例1428所述的MBM,其中所述接头区包含指定为L11的接头的氨基酸序列。
1440.如实施例1428所述的MBM,其中所述接头区包含指定为L12的接头的氨基酸序列。
1441.如实施例1428所述的MBM,其中所述接头区包含指定为L13的接头的氨基酸序列。
1442.如实施例1428所述的MBM,其中所述接头区包含指定为L14的接头的氨基酸序列。
1443.如实施例1428所述的MBM,其中所述接头区包含指定为L15的接头的氨基酸序列。
1444.如实施例1428所述的MBM,其中所述接头区包含指定为L16的接头的氨基酸序列。
1445.如实施例1428所述的MBM,其中所述接头区包含指定为L17的接头的氨基酸序列。
1446.如实施例1428所述的MBM,其中所述接头区包含指定为L18的接头的氨基酸序列。
1447.如实施例1428所述的MBM,其中所述接头区包含指定为L19的接头的氨基酸序列。
1448.如实施例1428所述的MBM,其中所述接头区包含指定为L20的接头的氨基酸序列。
1449.如实施例1428所述的MBM,其中所述接头区包含指定为L21的接头的氨基酸序列。
1450.如实施例1428所述的MBM,其中所述接头区包含指定为L22的接头的氨基酸序列。
1451.如实施例1428所述的MBM,其中所述接头区包含指定为L23的接头的氨基酸序列。
1452.如实施例1428所述的MBM,其中所述接头区包含指定为L24的接头的氨基酸序列。
1453.如实施例1428所述的MBM,其中所述接头区包含指定为L25的接头的氨基酸序列。
1454.如实施例1428所述的MBM,其中所述接头区包含指定为L26的接头的氨基酸序列。
1455.如实施例1428所述的MBM,其中所述接头区包含指定为L27的接头的氨基酸序列。
1456.如实施例1428所述的MBM,其中所述接头区包含指定为L28的接头的氨基酸序列。
1457.如实施例1428所述的MBM,其中所述接头区包含指定为L29的接头的氨基酸序列。
1458.如实施例1428所述的MBM,其中所述接头区包含指定为L30的接头的氨基酸序列。
1459.如实施例1428所述的MBM,其中所述接头区包含指定为L31的接头的氨基酸序列。
1460.如实施例1428所述的MBM,其中所述接头区包含指定为L32的接头的氨基酸序列。
1461.如实施例1428所述的MBM,其中所述接头区包含指定为L33的接头的氨基酸序列。
1462.如实施例1428所述的MBM,其中所述接头区包含指定为L34的接头的氨基酸序列。
1463.如实施例1428所述的MBM,其中所述接头区包含指定为L35的接头的氨基酸序列。
1464.如实施例1428所述的MBM,其中所述接头区包含指定为L36的接头的氨基酸序列。
1465.如实施例1428所述的MBM,其中所述接头区包含指定为L37的接头的氨基酸序列。
1466.如实施例1428所述的MBM,其中所述接头区包含指定为L38的接头的氨基酸序列。
1467.如实施例1428所述的MBM,其中所述接头区包含指定为L39的接头的氨基酸序列。
1468.如实施例1428所述的MBM,其中所述接头区包含指定为L40的接头的氨基酸序列。
1469.如实施例1428所述的MBM,其中所述接头区包含指定为L41的接头的氨基酸序列。
1470.如实施例1428所述的MBM,其中所述接头区包含指定为L42的接头的氨基酸序列。
1471.如实施例1428所述的MBM,其中所述接头区包含指定为L43的接头的氨基酸序列。
1472.如实施例1428所述的MBM,其中所述接头区包含指定为L44的接头的氨基酸序列。
1473.如实施例1428所述的MBM,其中所述接头区包含指定为L45的接头的氨基酸序列。
1474.如实施例1428所述的MBM,其中所述接头区包含指定为L46的接头的氨基酸序列。
1475.如实施例1428所述的MBM,其中所述接头区包含指定为L47的接头的氨基酸序列。
1476.如实施例1428所述的MBM,其中所述接头区包含指定为L48的接头的氨基酸序列。
1477.如实施例1428所述的MBM,其中所述接头区包含指定为L49的接头的氨基酸序列。
1478.如实施例1428所述的MBM,其中所述接头区包含指定为L50的接头的氨基酸序列。
1479.如实施例1428所述的MBM,其中所述接头区包含指定为L51的接头的氨基酸序列。
1480.如实施例1428所述的MBM,其中所述接头区包含指定为L52的接头的氨基酸序列。
1481.如实施例1428所述的MBM,其中所述接头区包含指定为L53的接头的氨基酸序列。
1482.如实施例1428所述的MBM,其中所述接头区包含指定为L54的接头的氨基酸序列。
1483.如实施例1至1482中任一项所述的MBM,其包含至少一个Fab结构域。
1484.如实施例1483所述的MBM,其中至少一个Fab结构域包含在表1中列出的Fab异源二聚化修饰中的任一种。
1485.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F1的Fab异源二聚化修饰。
1486.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F2的Fab异源二聚化修饰。
1487.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F3的Fab异源二聚化修饰。
1488.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F4的Fab异源二聚化修饰。
1489.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F5的Fab异源二聚化修饰。
1490.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F6的Fab异源二聚化修饰。
1491.如实施例1484所述的MBM,其中至少一个Fab结构域包含指定为F7的Fab异源二聚化修饰。
1492.如实施例1至1491中任一项所述的MBM,其包含至少两个ABM:ABM和ABM链,或经由接头相互连接的两条ABM链。
1493.如实施例1492所述的MBM,其中所述接头的长度为5至25个氨基酸。
1494.如实施例1493所述的MBM,其中所述接头的长度为12至20个氨基酸。
1495.如实施例1492至1494中任一项所述的MBM,其中所述接头是带电荷的接头和/或柔性接头。
1496.如实施例1492至1495中任一项所述的MBM,其中所述接头选自接头L1至L54中的任一个。
1497.如实施例1496所述的MBM,其中所述接头区包含指定为L1的接头的氨基酸序列。
1498.如实施例1496所述的MBM,其中所述接头区包含指定为L2的接头的氨基酸序列。
1499.如实施例1496所述的MBM,其中所述接头区包含指定为L3的接头的氨基酸序列。
1500.如实施例1496所述的MBM,其中所述接头区包含指定为L4的接头的氨基酸序列。
1501.如实施例1496所述的MBM,其中所述接头区包含指定为L5的接头的氨基酸序列。
1502.如实施例1496所述的MBM,其中所述接头区包含指定为L6的接头的氨基酸序列。
1503.如实施例1496所述的MBM,其中所述接头区包含指定为L7的接头的氨基酸序列。
1504.如实施例1496所述的MBM,其中所述接头区包含指定为L8的接头的氨基酸序列。
1505.如实施例1496所述的MBM,其中所述接头区包含指定为L9的接头的氨基酸序列。
1506.如实施例1496所述的MBM,其中所述接头区包含指定为L10的接头的氨基酸序列。
1507.如实施例1496所述的MBM,其中所述接头区包含指定为L11的接头的氨基酸序列。
1508.如实施例1496所述的MBM,其中所述接头区包含指定为L12的接头的氨基酸序列。
1509.如实施例1496所述的MBM,其中所述接头区包含指定为L13的接头的氨基酸序列。
1510.如实施例1496所述的MBM,其中所述接头区包含指定为L14的接头的氨基酸序列。
1511.如实施例1496所述的MBM,其中所述接头区包含指定为L15的接头的氨基酸序列。
1512.如实施例1496所述的MBM,其中所述接头区包含指定为L16的接头的氨基酸序列。
1513.如实施例1496所述的MBM,其中所述接头区包含指定为L17的接头的氨基酸序列。
1514.如实施例1496所述的MBM,其中所述接头区包含指定为L18的接头的氨基酸序列。
1515.如实施例1496所述的MBM,其中所述接头区包含指定为L19的接头的氨基酸序列。
1516.如实施例1496所述的MBM,其中所述接头区包含指定为L20的接头的氨基酸序列。
1517.如实施例1496所述的MBM,其中所述接头区包含指定为L21的接头的氨基酸序列。
1518.如实施例1496所述的MBM,其中所述接头区包含指定为L22的接头的氨基酸序列。
1519.如实施例1496所述的MBM,其中所述接头区包含指定为L23的接头的氨基酸序列。
1520.如实施例1496所述的MBM,其中所述接头区包含指定为L24的接头的氨基酸序列。
1521.如实施例1496所述的MBM,其中所述接头区包含指定为L25的接头的氨基酸序列。
1522.如实施例1496所述的MBM,其中所述接头区包含指定为L26的接头的氨基酸序列。
1523.如实施例1496所述的MBM,其中所述接头区包含指定为L27的接头的氨基酸序列。
1524.如实施例1496所述的MBM,其中所述接头区包含指定为L28的接头的氨基酸序列。
1525.如实施例1496所述的MBM,其中所述接头区包含指定为L29的接头的氨基酸序列。
1526.如实施例1496所述的MBM,其中所述接头区包含指定为L30的接头的氨基酸序列。
1527.如实施例1496所述的MBM,其中所述接头区包含指定为L31的接头的氨基酸序列。
1528.如实施例1496所述的MBM,其中所述接头区包含指定为L32的接头的氨基酸序列。
1529.如实施例1496所述的MBM,其中所述接头区包含指定为L33的接头的氨基酸序列。
1530.如实施例1496所述的MBM,其中所述接头区包含指定为L34的接头的氨基酸序列。
1531.如实施例1496所述的MBM,其中所述接头区包含指定为L35的接头的氨基酸序列。
1532.如实施例1496所述的MBM,其中所述接头区包含指定为L36的接头的氨基酸序列。
1533.如实施例1496所述的MBM,其中所述接头区包含指定为L37的接头的氨基酸序列。
1534.如实施例1496所述的MBM,其中所述接头区包含指定为L38的接头的氨基酸序列。
1535.如实施例1496所述的MBM,其中所述接头区包含指定为L39的接头的氨基酸序列。
1536.如实施例1496所述的MBM,其中所述接头区包含指定为L40的接头的氨基酸序列。
1537.如实施例1496所述的MBM,其中所述接头区包含指定为L41的接头的氨基酸序列。
1538.如实施例1496所述的MBM,其中所述接头区包含指定为L42的接头的氨基酸序列。
1539.如实施例1496所述的MBM,其中所述接头区包含指定为L43的接头的氨基酸序列。
1540.如实施例1496所述的MBM,其中所述接头区包含指定为L44的接头的氨基酸序列。
1541.如实施例1496所述的MBM,其中所述接头区包含指定为L45的接头的氨基酸序列。
1542.如实施例1496所述的MBM,其中所述接头区包含指定为L46的接头的氨基酸序列。
1543.如实施例1496所述的MBM,其中所述接头区包含指定为L47的接头的氨基酸序列。
1544.如实施例1496所述的MBM,其中所述接头区包含指定为L48的接头的氨基酸序列。
1545.如实施例1496所述的MBM,其中所述接头区包含指定为L49的接头的氨基酸序列。
1546.如实施例1428所述的MBM,其中所述接头区包含指定为L50的接头的氨基酸序列。
1547.如实施例1428所述的MBM,其中所述接头区包含指定为L51的接头的氨基酸序列。
1548.如实施例1428所述的MBM,其中所述接头区包含指定为L52的接头的氨基酸序列。
1549.如实施例1428所述的MBM,其中所述接头区包含指定为L53的接头的氨基酸序列。
1550.如实施例1496所述的MBM,其中所述接头区包含指定为L54的接头的氨基酸序列。
1551.如实施例1至1550中任一项所述的MBM,其是三价MBM。
1552.如实施例1551所述的MBM,其中所述三价MBM具有在图1B-1O中描绘的构型中的任一种。
1553.如实施例1552所述的MBM,其中所述三价MBM具有图1B中所描绘的构型。
1554.如实施例1552所述的MBM,其中所述三价MBM具有图1C中所描绘的构型。
1555.如实施例1552所述的MBM,其中所述三价MBM具有图1D中所描绘的构型。
1556.如实施例1552所述的MBM,其中所述三价MBM具有图1E中所描绘的构型。
1557.如实施例1552所述的MBM,其中所述三价MBM具有图1F中所描绘的构型。
1558.如实施例1552所述的MBM,其中所述三价MBM具有图1G中所描绘的构型。
1559.如实施例1552所述的MBM,其中所述三价MBM具有图1H中所描绘的构型。
1560.如实施例1552所述的MBM,其中所述三价MBM具有图1I中所描绘的构型。
1561.如实施例1552所述的MBM,其中所述三价MBM具有图1J中所描绘的构型。
1562.如实施例1552所述的MBM,其中所述三价MBM具有图1K中所描绘的构型。
1563.如实施例1552所述的MBM,其中所述三价MBM具有图1L中所描绘的构型。
1564.如实施例1552所述的MBM,其中所述三价MBM具有图1M中所描绘的构型。
1565.如实施例1552所述的MBM,其中所述三价MBM具有图1N中所描绘的构型。
1566.如实施例1552所述的MBM,其中所述三价MBM具有图1O中所描绘的构型。
1567.如实施例1552至1566中任一项所述的MBM,其中所述ABM具有指定为T1的构型。
1568.如实施例1552至1566中任一项所述的MBM,其中所述ABM具有指定为T2的构型。
1569.如实施例1552至1566中任一项所述的MBM,其中所述ABM具有指定为T3的构型。
1570.如实施例1552至1566中任一项所述的MBM,其中所述ABM具有指定为T4的构型。
1571.如实施例1552至1566中任一项所述的MBM,其中所述ABM具有指定为T5的构型。
1572.如实施例1552至1566中任一项所述的MBM,其中所述ABM具有指定为T6的构型。
1573.如实施例1至1550中任一项所述的MBM,其是四价MBM。
1574.如实施例1573所述的MBM,其中所述四价MBM具有在图1P-1R中描绘的构型中的任一种。
1575.如实施例1574所述的MBM,其中所述四价MBM具有图1P中所描绘的构型。
1576.如实施例1574所述的MBM,其中所述四价MBM具有图1Q中所描绘的构型。
1577.如实施例1574所述的MBM,其中所述四价MBM具有图1R中所描绘的构型。
1578.如实施例1574至1577中任一项所述的MBM,其中所述ABM具有指定为Tv 1至Tv 24的构型中的任一种。
1579.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 1的构型。
1580.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 2的构型。
1581.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 3的构型。
1582.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 4的构型。
1583.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 5的构型。
1584.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 6的构型。
1585.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 7的构型。
1586.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 8的构型。
1587.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 9的构型。
1588.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 10的构型。
1589.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 11的构型。
1590.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 12的构型。
1591.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 13的构型。
1592.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 14的构型。
1593.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 15的构型。
1594.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 16的构型。
1595.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 17的构型。
1596.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 18的构型。
1597.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 19的构型。
1598.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 20的构型。
1599.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 21的构型。
1600.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 22的构型。
1601.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 23的构型。
1602.如实施例1578所述的MBM,其中所述ABM具有指定为Tv 24的构型。
1603.如实施例1至1550中任一项所述的MBM,其是五价MBM。
1604.如实施例1603所述的MBM,其中所述五价MBM具有图1S中所描绘的构型。
1605.如实施例1604所述的MBM,其中所述ABM具有指定为Pv 1至Pv 80的构型中的任一种。
1606.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 1至Pv 10的构型中的任一种的构型。
1607.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 11至Pv 20的构型中的任一种的构型。
1608.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 21至Pv 30的构型中的任一种的构型。
1609.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 31至Pv 40的构型中的任一种的构型。
1610.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 41至Pv 50的构型中的任一种的构型。
1611.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 51至Pv 60的构型中的任一种的构型。
1612.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 61至Pv 70的构型中的任一种的构型。
1613.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 71至Pv 80的构型中的任一种的构型。
1614.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 81至Pv 90的构型中的任一种的构型。
1615.如实施例1605所述的MBM,其中所述ABM具有选自指定为Pv 91至Pv 100的构型中的任一种的构型。
1616.如实施例1至1550中任一项所述的MBM,其是六价MBM。
1617.如实施例1616所述的MBM,其中所述六价MBM具有图1T或图1U中所描绘的构型。
1618.如实施例1617所述的MBM,其中所述六价MBM具有图1T中所描绘的构型。
1619.如实施例1617所述的MBM,其中所述六价MBM具有图1U中所描绘的构型。
1620.如实施例1617至1619中任一项所述的MBM,其中所述ABM具有指定为Hv 1至Hv 330的构型中的任一种。
1621.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 1至Hv 10的构型中的任一种的构型。
1622.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 11至Hv 20的构型中的任一种的构型。
1623.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 21至Hv 30的构型中的任一种的构型。
1624.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 31至Hv 40的构型中的任一种的构型。
1625.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 41至Hv 50的构型中的任一种的构型。
1626.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 51至Hv 60的构型中的任一种的构型。
1627.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 61至Hv 70的构型中的任一种的构型。
1628.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 71至Hv 80的构型中的任一种的构型。
1629.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 81至Hv 90的构型中的任一种的构型。
1630.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 91至Hv 100的构型中的任一种的构型。
1631.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 101至Hv 110的构型中的任一种的构型。
1632.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 111至Hv 120的构型中的任一种的构型。
1633.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 121至Hv 130的构型中的任一种的构型。
1634.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 131至Hv 140的构型中的任一种的构型。
1635.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 141至Hv 150的构型中的任一种的构型。
1636.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 151至Hv 160的构型中的任一种的构型。
1637.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 161至Hv 70的构型中的任一种的构型。
1638.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 171至Hv 80的构型中的任一种的构型。
1639.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 181至Hv 90的构型中的任一种的构型。
1640.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 191至Hv 200的构型中的任一种的构型。
1641.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 201至Hv 210的构型中的任一种的构型。
1642.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 211至Hv 220的构型中的任一种的构型。
1643.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 221至Hv 230的构型中的任一种的构型。
1644.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 231至Hv 240的构型中的任一种的构型。
1645.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 241至Hv 250的构型中的任一种的构型。
1646.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 251至Hv 260的构型中的任一种的构型。
1647.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 261至Hv 270的构型中的任一种的构型。
1648.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 271至Hv 280的构型中的任一种的构型。
1649.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 281至Hv 290的构型中的任一种的构型。
1650.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 291至Hv 300的构型中的任一种的构型。
1651.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 301至Hv 310的构型中的任一种的构型。
1652.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 311至Hv 320的构型中的任一种的构型。
1653.如实施例1620所述的MBM,其中所述ABM具有选自指定为Hv 321至Hv 330的构型中的任一种的构型。
1654.如实施例1至1653中任一项所述的MBM,其中ABM1、ABM2和ABM3中的任一个、任两个、或全部三个具有跨物种反应性。
1655.如实施例1654所述的MBM,其中ABM1在一种或多种非人哺乳动物物种中进一步特异性结合至TAA 1。
1656.如实施例1654或实施例1655所述的MBM,其中ABM2在一种或多种非人哺乳动物物种中进一步特异性结合至TAA 2。
1657.如实施例1654至1656中任一项所述的MBM,其中ABM3在一种或多种非人哺乳动物物种中进一步特异性结合至所述TCR复合物的组分。
1658.如实施例1654至1657中任一项所述的MBM,其中所述一种或多种非人哺乳动物物种包含一种或多种非人灵长类物种。
1659.如实施例1658所述的MBM,其中所述一种或多种非人灵长类物种包含食蟹猴。
1660.如实施例1658所述的MBM,其中所述一种或多种非人灵长类物种包含猕猴。
1661.如实施例1658所述的MBM,其中所述一种或多种非人灵长类物种包含豚尾猴。
1662.如实施例1654至1661中任一项所述的MBM,其中所述一种或多种非人哺乳动物物种包含小家鼠。
1663.如实施例1至1662中任一项所述的MBM,其中ABM1、ABM2和ABM3中的任一个、任两个、或全部三个不具有跨物种反应性。
1664.如实施例1至1663中任一项所述的MBM,其中MBM是三特异性结合分子(TBM)。
1665.一种缀合物,其包含如实施例1至1664中任一项所述的MBM,以及药剂,任选地是治疗剂、诊断剂、掩盖部分、可切割的部分、或其任何组合。
1666.如实施例1665所述的缀合物,其中所述药剂是细胞毒性剂或细胞抑制剂。
1667.如实施例1666所述的缀合物,其中所述药剂是在7.8节中所述的任何药剂。
1668.如实施例1666或1667所述的缀合物,其中所述药剂是7.8.1节所述的药剂中的任一种。
1669.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至放射性核素。
1670.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至烷基化剂。
1671.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至拓扑异构酶抑制剂,所述拓扑异构酶抑制剂任选地是拓扑异构酶I抑制剂或拓扑异构酶II抑制剂。
1672.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至DNA损伤剂。
1673.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至DNA嵌入剂,任选地是凹槽结合剂,如小凹槽结合剂。
1674.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至RNA/DNA抗代谢物。
1675.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至激酶抑制剂。
1676.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至蛋白质合成抑制剂。
1677.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至组蛋白脱乙酰酶(HDAC)抑制剂。
1678.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至线粒体抑制剂,所述线粒体抑制剂任选地是线粒体中磷酰基转移反应的抑制剂。
1679.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至抗有丝分裂剂。
1680.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至美登木素生物碱。
1681.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至驱动蛋白抑制剂。
1682.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至驱动蛋白样蛋白质KIF11抑制剂。
1683.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至V-ATP酶(液泡型H+-ATP酶)抑制剂。
1684.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至促凋亡剂。
1685.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至Bcl2(B细胞淋巴瘤2)抑制剂。
1686.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至MCL1(骨髓细胞白血病1)抑制剂。
1687.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至HSP90(热休克蛋白90)抑制剂。
1688.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至IAP(细胞凋亡抑制剂)抑制剂。
1689.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至mTOR(雷帕霉素的机制靶标)抑制剂。
1690.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至微管稳定剂。
1691.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至微管去稳定剂。
1692.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至澳瑞斯他汀。
1693.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至多拉司他汀。
1694.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至MetAP(甲硫氨酸氨基肽酶)。
1695.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至CRM1(染色体维持蛋白1)抑制剂。
1696.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至DPPIV(二肽基肽酶IV)抑制剂。
1697.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至蛋白酶体抑制剂。
1698.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至蛋白质合成抑制剂。
1699.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至CDK2(细胞周期蛋白依赖性激酶2)抑制剂。
1700.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至CDK9(细胞周期蛋白依赖性激酶9)抑制剂。
1701.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至RNA聚合酶抑制剂。
1702.如实施例1665至1668中任一项所述的缀合物,其中所述MBM缀合至DHFR(二氢叶酸还原酶)抑制剂。
1703.如实施例1665至1702中任一项所述的缀合物,其中将所述药剂用接头附接至所述MBM,所述接头任选地是可切割的接头或不可切割的接头,例如在7.8.2节中所述的接头。
1704.如实施例1666至1703中任一项所述的缀合物,其中所述细胞毒性或细胞抑制剂经由如7.8.2节中所述的接头缀合至所述MBM。
1705.一种药物组合物,其包含如实施例1至1664中任一项所述的MBM或如实施例1665至1704中任一项所述的缀合物,和赋形剂。
1706.一种治疗患有B细胞恶性肿瘤的受试者的方法,所述方法包括向患有B细胞恶性肿瘤的受试者施用有效量的如实施例1至1664中任一项所述的MBM、如实施例1665至1704中任一项所述的缀合物、或如实施例1705所述的药物组合物。
1707.如实施例1706所述的方法,其中所述B细胞恶性肿瘤包含表达TAA 1和TAA 2两者的癌性B细胞。
1708.如实施例1706所述的方法,其中所述B细胞恶性肿瘤包含表达TAA 1但是不表达TAA 2的癌性B细胞、和表达TAA 2但是不表达TAA 1的癌性B细胞。
1709.如实施例1706至1708中任一项所述的方法,其中所述B细胞恶性肿瘤选自霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤和多发性骨髓瘤。
1710.如实施例1709所述的方法,其中所述B细胞恶性肿瘤是霍奇金氏淋巴瘤。
1711.如实施例1709所述的方法,其中所述B细胞恶性肿瘤是非霍奇金氏淋巴瘤。
1712.如实施例1711所述的方法,其中所述非霍奇金氏淋巴瘤是弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤、慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤、伯基特淋巴瘤、淋巴浆细胞性淋巴瘤(瓦尔登斯特伦巨球蛋白血症)、毛细胞白血病、或原发性中枢神经系统(CNS)淋巴瘤。
1713.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是弥漫性大B细胞淋巴瘤(DLBCL)。
1714.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是滤泡性淋巴瘤。
1715.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)。
1716.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是套细胞淋巴瘤(MCL)。
1717.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是边缘区淋巴瘤。
1718.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是伯基特淋巴瘤。
1719.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是淋巴浆细胞性淋巴瘤(瓦尔登斯特伦巨球蛋白血症)。
1720.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是毛细胞白血病。
1721.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是原发性中枢神经系统(CNS)淋巴瘤。
1722.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是原发性纵隔大B细胞淋巴瘤。
1723.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是纵隔灰区淋巴瘤(MGZL)。
1724.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是脾边缘区B细胞淋巴瘤。
1725.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是MALT的结外边缘区B细胞淋巴瘤。
1726.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是结节边缘区B细胞淋巴瘤。
1727.如实施例1712所述的方法,其中所述非霍奇金氏淋巴瘤是原发性渗出性淋巴瘤。
1728.如实施例1709所述的方法,其中所述B细胞恶性肿瘤是多发性骨髓瘤。
1729.如实施例1709所述的方法,其中所述B细胞恶性肿瘤是浆细胞样树突状细胞瘤。
1730.如实施例1706至1729中任一项所述的方法,其进一步包括向所述受试者施用至少一种另外的药剂。
1731.如实施例1730所述的方法,其中所述另外的药剂是化学治疗剂。
1732.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是蒽环霉素。
1733.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是长春花生物碱。
1734.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是烷基化剂。
1735.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是免疫细胞抗体。
1736.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是抗代谢物。
1737.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是腺苷脱氨酶抑制剂。
1738.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是mTOR抑制剂。
1739.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是TNFR糖皮质激素诱导的TNFR相关的蛋白质(GITR)激动剂。
1740.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是蛋白酶体抑制剂。
1741.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是BH3模拟物。
1742.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是细胞因子。
1743.如实施例1730或实施例1731所述的方法,其中所述另外的药剂防止或减缓TAA1和/或TAA2从癌细胞脱落。
1744.如实施例1743所述的方法,其中所述另外的药剂包含ADAM10抑制剂和/或ADAM 17抑制剂。
1745.如实施例1743所述的方法,其中所述另外的药剂包含磷脂酶抑制剂。
1746.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是γ分泌酶抑制剂。
1747.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是免疫调节剂。
1748.如实施例1730或实施例1731所述的方法,其中所述另外的药剂是沙利度胺衍生物。
1749.如实施例1730至1748中任一项所述的方法,其中所述另外的药剂不是抗体。
1750.一种治疗患有自体免疫性障碍的受试者的方法,所述方法包括向患有自体免疫性障碍的受试者施用有效量的如实施例1至1664中任一项所述的MBM、如实施例1665至1704中任一项所述的缀合物、或如实施例1705所述的药物组合物。
1751.如实施例1750所述的方法,其中所述自体免疫性障碍选自系统性红斑狼疮(SLE)、干燥综合征、硬皮病、类风湿性关节炎(RA)、幼年特发性关节炎、移植物抗宿主病、皮肌炎、I型糖尿病、桥本氏甲状腺炎、格雷夫斯病、爱迪生氏病、乳糜泻、克罗恩病、恶性贫血、寻常型天疱疮、白癜风、自身免疫性溶血性贫血、特发性血小板减少性紫癜、巨细胞动脉炎、重症肌无力、多发性硬化症(MS)(例如复发缓解型多发性硬化症(RRMS))、肾小球肾炎、肺出血肾炎综合征、大疱性类天疱疮、溃疡性结肠炎、格巴二氏综合征、慢性炎性脱髓鞘性多发性神经病、抗磷脂综合征、发作性睡病、结节病、和韦格纳氏肉芽肿病。
1752.如实施例1751所述的方法,其中所述自体免疫性障碍是系统性红斑狼疮(SLE)。
1753.如实施例1751所述的方法,其中所述自体免疫性障碍是干燥综合征。
1754.如实施例1751所述的方法,其中所述自体免疫性障碍是硬皮病。
1755.如实施例1751所述的方法,其中所述自体免疫性障碍是类风湿性关节炎(RA)。
1756.如实施例1751所述的方法,其中所述自体免疫性障碍是幼年特发性关节炎。
1757.如实施例1751所述的方法,其中所述自体免疫性障碍是移植物抗宿主病。
1758.如实施例1751所述的方法,其中所述自体免疫性障碍是皮肌炎。
1759.如实施例1751所述的方法,其中所述自体免疫性障碍是I型糖尿病。
1760.如实施例1751所述的方法,其中所述自体免疫性障碍是桥本氏甲状腺炎。
1761.如实施例1751所述的方法,其中所述自体免疫性障碍是格雷夫斯病。
1762.如实施例1751所述的方法,其中所述自体免疫性障碍是爱迪生氏病。
1763.如实施例1751所述的方法,其中所述自体免疫性障碍是乳糜泻。
1764.如实施例1751所述的方法,其中所述自体免疫性障碍是克罗恩病。
1765.如实施例1751所述的方法,其中所述自体免疫性障碍是恶性贫血。
1766.如实施例1751所述的方法,其中所述自体免疫性障碍是寻常型天疱疮。
1767.如实施例1751所述的方法,其中所述自体免疫性障碍是白癜风。
1768.如实施例1751所述的方法,其中所述自体免疫性障碍是自身免疫性溶血性贫血。
1769.如实施例1751所述的方法,其中所述自体免疫性障碍是特发性血小板减少性紫癜。
1770.如实施例1751所述的方法,其中所述自体免疫性障碍是巨细胞动脉炎。
1771.如实施例1751所述的方法,其中所述自体免疫性障碍是重症肌无力。
1772.如实施例1751所述的方法,其中所述自体免疫性障碍是多发性硬化症(MS)。
1773.如实施例1772所述的方法,其中所述MS是复发缓解型多发性硬化症(RRMS)。
1774.如实施例1751所述的方法,其中所述自体免疫性障碍是肾小球肾炎。
1775.如实施例1751所述的方法,其中所述自体免疫性障碍是肺出血肾炎综合征。
1776.如实施例1751所述的方法,其中所述自体免疫性障碍是大疱性类天疱疮。
1777.如实施例1751所述的方法,其中所述自体免疫性障碍是溃疡性结肠炎。
1778.如实施例1751所述的方法,其中所述自体免疫性障碍是格巴二氏综合征。
1779.如实施例1751所述的方法,其中所述自体免疫性障碍是慢性炎性脱髓鞘性多发性神经病。
1780.如实施例1751所述的方法,其中所述自体免疫性障碍是抗磷脂综合征。
1781.如实施例1751所述的方法,其中所述自体免疫性障碍是发作性睡病。
1782.如实施例1751所述的方法,其中所述自体免疫性障碍是结节病。
1783.如实施例1751所述的方法,其中所述自体免疫性障碍是韦格纳氏肉芽肿病。
1784.一种或多种核酸,所述一种或多种核酸编码如实施例1至1664中任一项所述的MBM。
1785.如实施例1784所述的一种或多种核酸,所述一种或多种核酸是DNA。
1786.如实施例1785所述的一种或多种核酸,所述一种或多种核酸呈一种或多种载体的形式,任选地为表达载体。
1787.如实施例1784所述的一种或多种核酸,所述一种或多种核酸是mRNA。
1788.一种细胞,所述细胞被工程化以表达如实施例1至1664中任一项所述的MBM。
1789.一种细胞,所述细胞在一种或多种启动子的控制下经一种或多种表达载体转染,所述表达载体包含一种或多种编码如实施例1至1664中任一项所述的MBM的核酸序列。
1790.如实施例1788或实施例1789所述的细胞,其中所述MBM的表达处于一种或多种诱导型启动子的控制之下。
1791.如实施例1788至1790中任一项所述的细胞,其中所述MBM以可分泌的形式产生。
1792.一种产生MBM的方法,所述方法包括:
(a)在所述MBM表达的条件下将如实施例1788至1791中任一项所述的细胞进行培养;以及
(b)从细胞培养物中回收所述MBM。
