一种强心苷类化合物及其合成方法与应用
文献发布时间:2023-06-19 09:29:07
技术领域
本发明属于医药领域,特别涉及一种强心苷类化合物及其合成方法与应用。
背景技术
强心苷是一类选择性作用于心脏,加强心肌收缩力的药物,又称强心甙或强心配糖体。已有相关研究表明,某些强心苷可抑制人类肿瘤细胞的生长,并诱导其凋亡(如地高辛digoxin等)。而许多强心苷类化合物在具有抗肿瘤效应的同时,同样会对正常细胞产生较大的不良反应,安全性难以得到保证,因此成为其投入抗癌临床应用的最大阻碍,当前仅有少数强心苷类化合物能够进入抗肿瘤药物的临床阶段,故还需要对强心苷类抗肿瘤药物进行更多的研究和开发。
因此,本发明希望提供一种抗肿瘤效果显著,且对正常细胞毒性较小的强心苷类化合物,从而推动强心苷类抗肿瘤药物的发展,并为今后肿瘤治疗提供一种更好的选择。
发明内容
本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种强心苷类化合物,能够达到更好的肿瘤抑制效果和对正常细胞更小的毒性。
一种强心苷类化合物,为式(I)所示的化合物或其在药学上可接受的盐;
所述强心苷类化合物命名为19-dihydrocalotoxin。所述强心苷类化合物可通过提取分离或人工合成的方法获得,其中提取分离的来源可为牛角瓜叶。
上述强心苷类化合物的合成方法,包括以下步骤:
将牛角瓜毒素(calotoxin)用溶剂溶解,加入还原剂,室温和搅拌条件下进行反应,合成所述强心苷类化合物。
优选的,所述溶剂选自甲醇、乙醇、二甘醇、四氢呋喃或N,N-二甲基甲酰胺中的至少一种。
优选的,所述还原剂选自硼氢化钠、四氢铝锂、钯碳或兰尼镍中的至少一种。
牛角瓜毒素是一种强心苷类成分,本发明以牛角瓜毒素为原料合成一种新的强心苷类化合物,从而实现对牛角瓜毒素性能的改良。
优选的,所述合成方法中还包括使用NH
上述强心苷类化合物在制备抗肿瘤药物中的应用。
一种抗肿瘤药物,包括上述强心苷类化合物。与现有强心苷相比,本发明所述强心苷类化合物具备更好的肿瘤抑制效果和更好的安全性,可作为抗肿瘤药物进行使用。
优选的,所述抗肿瘤药物中还包括药学上可接受的辅料。所述药学上可接受的辅料包括但不限于溶剂、填充剂、润滑剂、崩解剂、缓冲剂、助溶剂、抗氧剂、抑菌剂、乳化剂、粘合剂或助悬剂。
优选的,所述肿瘤包括结肠癌、宫颈癌、肝癌、肺癌、乳腺癌和卵巢癌。
更优选的,所述肿瘤包括结肠癌、肺癌和乳腺癌。
上述强心苷类化合物在制备HIF-1抑制剂中的应用。
HIF-1(hypoxia-inducible factor-1,低氧诱导因子)广泛存在于各种实体瘤细胞中,对肿瘤的低氧信号转导途径发挥主导作用。HIF-1是由对氧敏感的α调节亚基和稳定表达的β结构亚基组成的异源二聚体。HIF-1α严格受氧浓度的精细调控,是实现HIF-1生物效应的关键活性亚基。而β亚基属构建型表达,不受氧调控和影响,其功能与保持HIF-1结构稳定性和二聚化引起活性构象转变有关。HIF-1α是肿瘤细胞应对低氧微环境进行自身调节从而使机体对微环境低氧产生适应性反应的中心调控子,也是肿瘤新生血管生成、能量代谢、细胞增殖、浸润和转移等相关基因的上游转录调节蛋白。作为机体适应缺氧危机的主要基因转录调节因子,HIF-1在肿瘤(尤其是恶性肿瘤)的细胞增殖和存活、血管新生、代谢模式重组、干细胞维持、自分泌生长因子信号通路、上皮-间质转化、浸润、转移以及放化疗耐受等很多关键领域都发挥着至关重要的作用,是肿瘤细胞快速适应低氧微环境,并不断获取能量赖以生存的关键性调控元件。临床研究已证实90%以上的实体瘤细胞都高表达HIF-1α蛋白,而在正常组织细胞中几乎检测不到HIF-1α。因此,HIF-1α被认为是一个极具特异性和选择性的抗癌靶标。作为化学结构上属于经典强心苷类成分的地高辛(digoxin)已被报道通过抑制HIF-1α蛋白的合成而发挥抗肿瘤作用。
经试验表明,本发明所述强心苷类化合物19-dihydrocalotoxin对HIF-1α的蛋白表达具有显著的抑制作用,因此具备用于制备HIF-1抑制剂的突出潜力。
相对于现有技术,本发明的有益效果如下:
实验表明,本发明所述强心苷类化合物19-dihydrocalotoxin可通过抑制HIF-1表达发挥抗肿瘤作用。所述强心苷类化合物对多种肿瘤细胞具有杀灭作用,其中对结肠癌、肺癌和乳腺癌的抗肿瘤效应尤为突出,并且具有比紫杉醇更强的体内抗肿瘤作用。同时所述强心苷类化合物的安全性良好,对正常细胞的毒性较小,因此更具有实际临床应用价值和开发前景。
附图说明
图1表示实施例3中蛋白免疫印迹实验的结果,地高辛(D组)、19-dihydrocalotoxin(1组)、uscharin(2组)、calotoxin(3组)、19-dihydrocalactin(4组);
图2表示实施例4中免疫细胞化学实验的结果,地高辛(D组)、19-dihydrocalotoxin(1组)、uscharin(2组)、calotoxin(3组)、19-dihydrocalactin(4组);
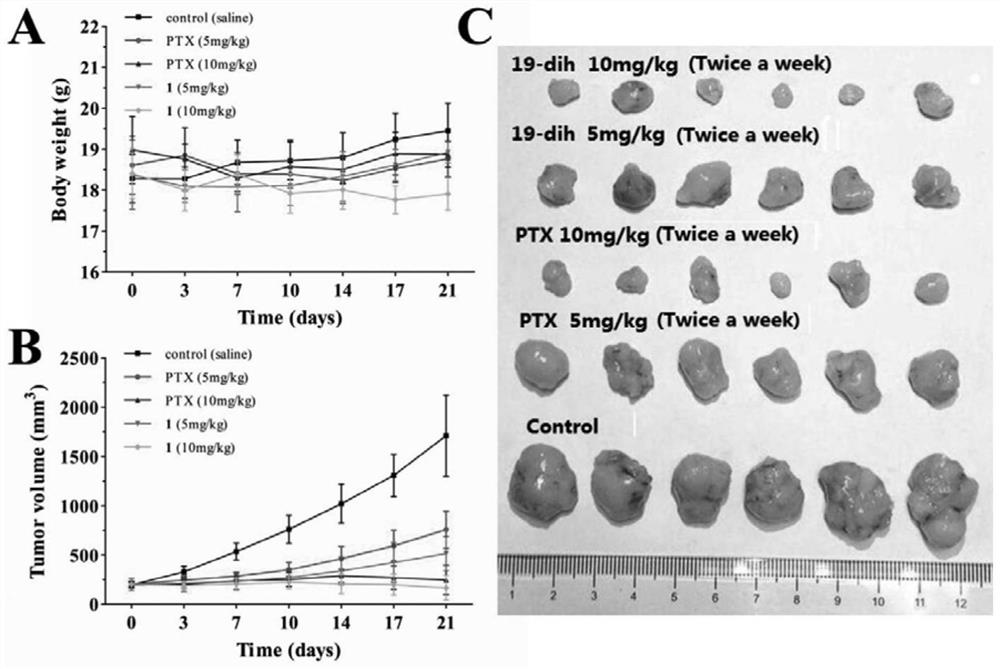
图3表示实施例7中19-dihydrocalotoxin在小鼠体内的抗肿瘤活性,紫杉醇(PTX组)、19-dihydrocalotoxin(1组);
图4表示实施例8中19-dihydrocalotoxin对裸鼠移植瘤组织形态学及HIF-1α表达的影响,紫杉醇(PTX组)、19-dihydrocalotoxin(1组)。
具体实施方式
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
以下实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有已知方法得到。
实施例1
本实施例提供一种强心苷类化合物19-dihydrocalotoxin,为式(I)所示的化合物或其在药学上可接受的盐;
该强心苷类化合物(19-dihydrocalotoxin)的合成方法为:
将牛角瓜毒素calotoxin(215mg,0.39mmol)溶于在冰浴中预冷的甲醇(20mL)溶液中,分批加入硼氢化钠固体(52mg,1.3mmol),将上述溶液室温搅拌2小时。通过TLC(层析色谱)检测反应原料完全消失后,加入饱和的NH
其中初始原料牛角瓜毒素calotoxin可从牛角瓜乳汁中经分离纯化取得,牛角瓜毒素calotoxin的结构如下所示:
实施例2
强心苷类化合物19-dihydrocalotoxin对肿瘤细胞T47D的细胞毒性
将人乳腺导管癌细胞T47D培养在DMEM完全培养基中,采用MTT实验检测实施例1中强心苷类化合物19-dihydrocalotoxin对T47D肿瘤细胞的生长抑制作用,具体实验流程如下:
将处于对数生长期的细胞种植于96孔板中,每孔5×10
上述测试结果如表1所示。
表1 19-dihydrocalotoxin对T47D细胞的细胞毒活性和HIF-1转录抑制活性的IC
注:ND为未测定
如表1所示,紫杉醇虽然是一种临床应用广泛的典型抗肿瘤药物,但紫杉醇对人乳腺导管癌细胞T47D的细胞毒性较差,且无抑制HIF-1转录的作用,表明并非所有抗肿瘤药物均具有抑制HIF-1转录的作用。实施例1中制得的强心苷类化合物19-dihydrocalotoxin具有与经典强心苷类成分地高辛相近的HIF-1转录抑制活性,而地高辛已有作为HIF-1抑制剂的报道,因此强心苷类化合物19-dihydrocalotoxin也可作为一种新型的HIF-1抑制剂。
实施例3
强心苷类化合物19-dihydrocalotoxin对HIF-1α蛋白表达的抑制作用(蛋白免疫印迹实验)
为了确认实施例1中强心苷类化合物(19-dihydrocalotoxin)对HIF-1转录活性的抑制作用是通过其抑制HIF-1活性还是降低HIF-1蛋白表达引起,采用蛋白质免疫印迹实验来检测代表性强心苷在缺氧条件下对肿瘤细胞中HIF-1α蛋白表达的影响。将T47D细胞种植于6孔板中,贴壁后用不同浓度的含强心苷培养基处理细胞,并将细胞置于缺氧条件下24小时,同时设置常氧条件(氧浓度21%)和缺氧条件(氧浓度1%)下的空白对照孔。细胞处理结束后,提取细胞蛋白质,进行电泳实验和免疫印迹实验,通过比较不同处理条件下细胞中蛋白条带的灰度来表征HIF-1α蛋白表达。
实验结果如图1所示,地高辛(D组)、19-dihydrocalotoxin(1组)、uscharin(2组)、calotoxin(3组)和19-dihydrocalactin(4组)均呈剂量依赖性地抑制缺氧条件下T47D细胞中HIF-1α蛋白的表达。其中uscharin、calotoxin和19-dihydrocalactin均为已知的强心苷成分,其中uscharin和19-dihydrocalactin的结构式如下所示:
实施例4
强心苷类化合物19-dihydrocalotoxin对HIF-1α蛋白表达的抑制作用(免疫细胞化学实验)
为了进一步研究HIF-1α在癌细胞内的分布以及实施例1中强心苷类化合物(19-dihydrocalotoxin)对HIF-1α表达的抑制作用,采用免疫细胞化学实验来对HIF-1α进行原位分析,具体实验流程和结果如下:
将无菌的盖玻片置于6孔板中,然后向每孔加入2×10
从图2中可以看出,与常氧条件(氧浓度21%)相比,缺氧(氧浓度1%)可以诱导HIF-1α蛋白快速大量聚集,并主要分布于细胞核内。地高辛(D组)、19-dihydrocalotoxin(1组)、uscharin(2组)、calotoxin(3组)和19-dihydrocalactin(4组)均能剂量依赖性抑制缺氧培养的T47D细胞中HIF-1α蛋白表达。这些结果与前面的双荧光素酶报告基因实验和蛋白质免疫印迹实验一致,进一步证实了强心苷类化合物19-dihydrocalotoxin对HIF-1α蛋白表达的抑制作用。
实施例5
实施例1中强心苷类化合物(19-dihydrocalotoxin)对肿瘤细胞和正常细胞的生长抑制作用
将人结肠癌细胞HCT 116,人宫颈癌细胞HeLa,人肝癌细胞HepG2,人非小细胞肺癌细胞A549和大鼠心肌细胞H9c2培养在DMEM完全培养基中。人乳腺上皮癌细胞MCF-7培养在MEM完全培养基中。人卵巢癌细胞A2780、人三阴性乳腺癌细胞MDA-MB-231和人肝细胞LO2培养在RPMI 1640完全培养基中。
采用MTT实验检测强心苷类化合物(19-dihydrocalotoxin)对多种肿瘤细胞的生长抑制作用,具体实验流程和结果如下:
将处于对数生长期的细胞种植于96孔板中,每孔5×10
表2 19-dihydrocalotoxin对多种肿瘤细胞和正常细胞的细胞毒活性(IC
如表2所示,实施例1制得的强心苷类化合物19-dihydrocalotoxin对多种肿瘤细胞的毒性(IC
实施例6
强心苷类化合物的体内毒性研究
为了进一步评估强心苷类成分的成药性,并优选出兼具抗肿瘤活性和安全性的强心苷类药物,我们采用了最大耐受剂量实验来检测强心苷类药物的体内毒性,具体实验流程为:将饲养的30只6周龄的雌性BALB/c-nu裸鼠随机分成5组,每组6只,向每组裸鼠分别腹腔注射以下药物:19-dihydrocalotoxin 40mg/kg,uscharin 2.5mg/kg,uscharin 5mg/kg,19-dihydrocalactin 2.5mg/kg,19-dihydrocalactin 5mg/kg,每周给药两次,持续给药三周,并持续监测小鼠体重、精神和生活状态。
测试的结果为:uscharin和19-dihydrocalactin高低剂量组的裸鼠在初次给药后一天内均全部死亡,19-dihydrocalotoxin 40mg/kg组裸鼠在整个实验期间状态良好,但是体重有所降低。上述结果表明,uscharin和19-dihydrocalactin具有较强的体内毒性,19-dihydrocalotoxin无明显体内毒性,19-dihydrocalotoxin具有更好的成药性。
实施例7
强心苷类化合物19-dihydrocalotoxin在小鼠体内的抗肿瘤活性
通过裸鼠移植瘤实验测定强心苷类化合物的体内抗肿瘤活性,具体实验流程和结果如下。饲养30只6周龄的雌性BALB/c-nu裸鼠,向每只裸鼠左侧腋下注射100μL含5×10
实验结果表明,整个实验期间,紫杉醇PTX 5mg/kg,紫杉醇PTX 10mg/kg,19-dihydrocalotoxin 5mg/kg,19-dihydrocalotoxin 10mg/kg和空白对照组裸鼠未出现死亡,上述四个给药组和空白对照组裸鼠的平均体重基本维持在18g至20g之间,表明19-dihydrocalotoxin与紫杉醇一样,没有明显的体内毒性。通过分析实验过程中各组的肿瘤体积(图3C),可以看出19-dihydrocalotoxin(即19-dih)与紫杉醇均能剂量依赖性地抑制肿瘤的生长,并且同等剂量的19-dihydrocalotoxin抑瘤作用强于紫杉醇,这表明19-dihydrocalotoxin具有比紫杉醇更强的体内抗肿瘤活性。
实施例8
裸鼠移植瘤的组织形态学分析及HIF-1α免疫组织化学分析
在实施例7的裸鼠移植瘤实验结束后,通过H&E染色和免疫组织化学实验来分析19-dihydrocalotoxin(1组)和紫杉醇(PTX组)对肿瘤组织形态以及HIF-1α蛋白表达的影响,具体实验流程为:将裸鼠移植瘤取出置于10%的中性福尔马林溶液中固定12小时,石蜡包埋后切成5μm厚的薄片,经过脱蜡、水化后分别按照标准操作流程进行H&E染色和免疫组织化学实验,最后用相差显微镜进行观察和拍照。
实验结果如图4所示,通过H&E染色可以看出,空白组中细胞质和细胞核形态正常、结构饱满、排列紧密,而19-dihydrocalotoxin(1组)和紫杉醇(PTX组)能够剂量依赖性地诱导肿瘤细胞坏死,具体表现为细胞膜破坏、细胞边界消失、细胞核固缩、细胞质和细胞和染色加深,甚至出现细胞溶解。而通过免疫组织化学实验可以发现,HIF-1α在空白组肿瘤中高表达,而19-dihydrocalotoxin能剂量依赖性地抑制肿瘤组织中的HIF-1α的表达,但是紫杉醇对HIF-1α的表达无明显影响。这些结果从一定程度上解释了19-dihydrocalotoxin的体内抗肿瘤机制。
