用于有效免疫治疗的免疫效应细胞和具有抗原-细胞因子复合物的分子衔接子
文献发布时间:2023-06-19 09:30:39
本申请要求于2018年4月26日提交的欧洲申请序列号18169600.6的优先权,其全部内容通过引用并入本文。
技术领域
本公开的实施方案至少涉及细胞生物学、分子生物学、免疫学和医学领域。
背景
尽管用表达CD19特异性嵌合抗原受体(CAR19)的T细胞对B细胞恶性肿瘤进行免疫治疗已经产生了高的完全应答率,但是使用识别其他抗原的CAR或工程化T细胞受体(TCR)对实体瘤进行的免疫治疗仅使少数患者受益(1、2)。CAR19和/或其与CD19抗原的相互作用是否具有有助于CAR T细胞疗法在B细胞恶性肿瘤中的功效的独特性质仍是未知的。
负面影响实体瘤对过继免疫疗法(包括CAR和TCR重定向的免疫疗法)的敏感性的主要已知因素包括治疗性效应细胞到肿瘤部位和免疫抑制肿瘤微环境(TME)的定位不良(3)。成神经细胞瘤(NB)是不表达CD19且具有高度免疫抑制性TME的典型实体瘤。在NB患者中使用CAR重定向T细胞的早期临床研究已靶向GD2神经节苷脂,该神经节苷脂在NB细胞中过表达(4、5)。使用CARGD2 T细胞的免疫治疗在NB患者中耐受性好,并产生了许多目标临床应答,但与B细胞恶性肿瘤中使用CAR19 T细胞的免疫治疗相比,这种应答率要低得多(6)。
与T和CARGD2 T细胞相比,Va24不变的NKT和CARGD2 NKT细胞更好地定位于小鼠的成神经细胞瘤异种移植物中(7)。与T细胞不同,NKT细胞能够杀死或重编程免疫抑制性肿瘤相关巨噬细胞(8)。因此,更好地定位于肿瘤部位和中和抑制性TAM使得NKT比实体瘤中用于CAR重定向免疫疗法的作为效应群体的T细胞有优势。
尽管有效地定位于肿瘤部位,但是低氧TME抑制了NKT细胞的功能和治疗功效。可以由IL-15从低氧介导的抑制中拯救NKT细胞,因而经工程化以表达IL15的NKT细胞在小鼠的NB模型中显示出增强的抗肿瘤活性(9)。此外,与单独表达CARGD2或IL15的NKT相比,在同一构建体(CARGD2.IL15)中共表达CARGD2和IL15的NKT细胞在荷有NB的小鼠中体内扩增,并具有更高的抗肿瘤活性。另外,在IL15Ra、IL15和载脂蛋白(apolipoprotein)的sushi结构域的嵌合蛋白的存在下,能够增加NK细胞增殖、存活和抗体介导的细胞毒性(10)。
本公开提供了用于满足治疗癌症的过继免疫疗法领域中长期需要的解决方案。
概述
本公开涉及扩展具有靶向抗原的受体的工程化免疫细胞的应用的系统、组合物和方法。在特定的实施方案中,本公开涉及癌症免疫疗法和用模块化分子衔接子配置免疫疗法,所述模块化分子衔接子取决于待治疗的癌症及其肿瘤抗原的特定表达而允许互换使用。在一些实施方案中,本公开涉及癌症免疫疗法和分子衔接子,其至少在一些情况下允许利用靶向第一抗原的已经存在的免疫效应细胞来同样靶向第二(或更多)抗原。
本公开的实施方案包括免疫效应细胞的工程化以表达工程化的抗原受体并分泌具有抗原-细胞因子复合物的分子衔接子,以进行有效的癌症免疫治疗。在特定实施方案中,包含细胞因子结构域(细胞因子、细胞因子受体和/或细胞因子及其受体)的分子衔接子允许将免疫疗法用于实体瘤的抑制性微环境中。
在某个实施方案中,存在免疫效应细胞,其中该细胞产生分子衔接子,该分子衔接子包含:(a)肿瘤细胞结合结构域,和(b)细胞因子结构域,该细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合;(c)可选地进一步包含抗原受体靶结构域;可选地,其中所述细胞包含针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体。由此,所述免疫效应细胞是工程化的,因此是非天然的。
在某个实施方案中,存在免疫效应细胞,其中该细胞产生分子衔接子,该分子衔接子包含:(a)靶细胞结合结构域,和(b)细胞因子结构域,该细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合;(c)可选地进一步包含抗原受体靶结构域;可选地,其中所述细胞包含针对一种或多种靶抗原的一种或多种工程化抗原受体。由此,所述免疫效应细胞是工程化的,因此是非天然的。
在一个实施方案中,提供了分子衔接子,其包含(a)肿瘤细胞结合结构域,(b)细胞因子结构域,该细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合,以及可选地(c)抗原受体靶结构域。此类分子衔接子可以与包含针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体的工程化免疫效应细胞组合提供,以提高免疫疗法的功效。
本公开的实施方案包括免疫效应细胞,其中所述细胞产生分子衔接子,所述分子衔接子包含:(a)肿瘤细胞结合结构域,和(b)细胞因子结构域,该细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合;(c)可选地(或没有)进一步包含抗原受体靶结构域;可选地(或没有),其中所述细胞包含针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体。在特定的实施方案中,所述肿瘤细胞结合结构域包含抗体、抗体片段或非抗体骨架。所述肿瘤细胞结合结构域可包含scFv。所述肿瘤细胞结合结构域可靶向在肿瘤细胞表面表达的抗原,例如GD2、CD56、CD24、L1CAM、GPC2、GPC3、CSPG4、HER2、CD19、CD22、CD30、CD71、B7-H3、B7-H4、BCMA、PD-L1或PDL-2。在一些情况下,所述细胞因子选自IL7、IL12、IL15、IL18、IL27、IL33、IL21及其组合。在特定情况下,所述细胞因子是IL15和/或细胞因子受体是IL15R或其α亚基(IL15RA)。所述抗原受体靶结构域可包含肿瘤抗原或其功能片段,或者所述抗原受体靶结构域也可以是不被认为是肿瘤抗原的抗原(或其功能片段)。
在特定的实施方案中,所述分子衔接子包含靶向肿瘤细胞上第一抗原的肿瘤细胞结合结构域和包含第二肿瘤抗原或其功能片段的抗原受体靶结构域。在特定的实施方案中,所述抗原受体靶结构域包含CD19。本公开的任何细胞可包含一种或多种工程化抗原受体,其是重组T细胞受体(TCR)或嵌合抗原受体(CAR)。所述细胞可以通过用编码TCR、包括编码来自天然来源的TCR的载体进行转导而包含工程化TCR。
在特定的实施方案中,本公开的细胞产生靶向第一肿瘤抗原的分子衔接子,并且包含靶向第一肿瘤抗原的抗原受体;产生靶向第二肿瘤抗原的分子衔接子,并且包含靶向第一肿瘤抗原的抗原受体;或产生靶向第一肿瘤抗原的分子衔接子,所述分子衔接子包含被细胞表面上表达的抗原受体靶向的抗原受体靶结构域。在特定的实施方案中,所述肿瘤细胞结合结构域和所述抗原受体靶结构域通过铰链区和/或接头连接。所述铰链区可以来自IgG1、IgG2、IgG3、IgG4或CD8。在特定的实施方案中,所述细胞包含编码所述分子衔接子和可选地所述工程化抗原受体的表达载体(病毒载体或非病毒载体)或RNA。病毒载体的实例包括逆转录病毒、慢病毒、腺病毒或腺相关病毒载体。非病毒载体的实例包括质粒和转座子。在特定的实施方案中,所述细胞是NK细胞、NKT细胞、T细胞、γδT细胞、粘膜相关不变T(MAIT)细胞、先天性淋巴(IL)细胞、细胞因子诱导的杀伤(CIK)细胞、巨噬细胞、干细胞或其混合物。
在一个实施方案中,存在用于使表达工程化抗原受体的细胞重定向的分子衔接子,其包含:(a)肿瘤细胞结合结构域,(b)细胞因子结构域,该细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合,以及(c)抗原受体靶结构域。在特定的实施方案中,所述分子衔接子中的所述细胞因子结构域位于所述肿瘤细胞结合结构域和所述抗原受体结构域之间。
在一个实施方案中,存在用于使表达工程化抗原受体的细胞重定向的分子衔接子,其包含:(a)靶细胞结合结构域,(b)细胞因子结构域,该细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合以及(c)抗原受体靶结构域。在特定的实施方案中,所述分子衔接子中的所述细胞因子结构域位于所述靶细胞结合结构域和所述抗原受体结构域之间。
本公开的实施方案包括被导向针对本公开涵盖的分子衔接子的非天然抗原受体。
在一个实施方案中,存在编码本公开的分子衔接子的表达载体。在某些情况下,所述表达载体包含编码抗原受体的序列。特定的实施方案包括表达载体,其编码:分子衔接子,其包含:(i)肿瘤细胞结合结构域,和(ii)细胞因子结构域;和(b)抗原受体。在特定的实施方案中,IRES元件或2A序列位于所述分子衔接子和所述抗原受体之间。这样的表达载体可以是病毒载体(逆转录病毒、慢病毒、腺病毒或腺相关病毒载体)或非病毒载体。
在一个实施方案中,存在编码本公开的分子衔接子的表达载体。在某些情况下,所述表达载体包含编码抗原受体的序列。特定的实施方案包括表达载体,其编码:分子衔接子,其包含:(i)靶细胞结合结构域,和(ii)细胞因子结构域;和(b)抗原受体。在特定的实施方案中,IRES元件或2A序列位于所述分子衔接子和所述抗原受体之间。这样的表达载体可以是病毒载体(逆转录病毒、慢病毒、腺病毒或腺相关病毒载体)或非病毒载体。
本公开的实施方案涵盖包含本公开涵盖的表达载体的细胞。
在一个实施方案中,存在治疗个体中的癌症或其他疾病(例如自身免疫性疾病)的方法,其包括向所述个体施用治疗有效量的本公开的细胞的步骤。在疾病不是癌症的情况下,该疾病可能具有以下情况:其中杀死一群可通过一种或多种与所述疾病相关的抗原而被靶向的细胞是可取的。
在特定的实施方案中,存在治疗个体中的癌症或其他疾病的方法,其包括施用治疗有效量的本公开的分子衔接子和/或治疗有效量的表达本公开的抗原受体的细胞。
在某个实施方案中,存在治疗个体中的癌症的方法,其包括向所述个体施用治疗有效量的:分子衔接子,其包含靶向肿瘤细胞上的第一或第二抗原的肿瘤细胞结合结构域和细胞因子结构域,以及表达针对肿瘤细胞上的第一抗原的抗原受体的细胞。在特定的实施方案中,通过腹腔内或静脉内注射将所述分子衔接子和/或所述细胞施用给所述个体。在某些情况下,在初始剂量后再施用第二剂分子衔接子。所述个体可正在接受、已经接受和/或将接受额外的癌症疗法。额外的癌症疗法可以是手术、放射疗法、化学疗法、免疫疗法、激素疗法或其组合。
在某个实施方案中,存在治疗个体中的疾病的方法,其包括向所述个体施用治疗有效量的:分子衔接子,其包含靶向靶细胞上的第一或第二抗原的靶标细胞结合结构域和细胞因子结构域,以及表达针对靶细胞上第一抗原的抗原受体的细胞。在特定的实施方案中,通过腹腔内或静脉内注射将所述分子衔接子和/或所述细胞施用给所述个体。在一些情况下,在初始剂量后再施用第二剂分子衔接子。所述个体可正在接受、已经接受和/或将接受针对该疾病的额外疗法。
在一些实施方案中,存在药物组合物,其包含本文涵盖的免疫效应细胞和/或本文涵盖的分子衔接子。
在一个实施方案中,存在使癌症疗法适应表达第一肿瘤抗原的癌症的方法,该方法包括以下步骤:(a)提供或获得包含靶向第二种肿瘤抗原的非天然抗原受体的免疫效应细胞或多个免疫效应细胞;和(b)提供或获得分子衔接子,其包含结合第一肿瘤抗原的肿瘤细胞结合结构域和结合靶向第二肿瘤抗原的抗原受体的抗原受体靶结构域,可选地(或没有),其中所述分子衔接子包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合,其中步骤(b)中所述分子衔接子的提供或获得由所述第一抗原在被治疗的癌症的癌细胞中的表达的存在确定。
在某个实施方案中,存在使癌症疗法适应表达第一肿瘤抗原的癌症的方法,该方法包括以下步骤:(a)提供或获得包含靶向第二肿瘤抗原的非天然抗原受体的免疫效应细胞或多个免疫效应细胞;和(b)用编码分子衔接子的多核苷酸转染所述细胞,该分子衔接子包含:(1)靶向所述第一抗原的肿瘤细胞结合结构域,和(2)细胞因子结构域,所述细胞因子结构域包含:(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合。
在一个实施方案中,存在使疾病疗法适应表达第一靶细胞抗原(也可以是发生病变的细胞抗原)的发生病变的细胞的方法,其包括以下步骤:(a)提供或获得包含靶向第二抗原的非天然抗原受体的免疫效应细胞或多个免疫效应细胞;和(b)提供或获得分子衔接子,所述分子衔接子包含结合第一抗原的靶细胞结合结构域和结合靶向第二抗原的抗原受体的抗原受体靶结构域,可选地(或没有),其中所述分子衔接子包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合,并且其中步骤(b)中所述分子衔接子的提供或获得由所述第一抗原在被治疗的疾病的靶细胞中的表达的存在确定。
在某个实施方案中,存在使疾病疗法适应表达第一抗原的癌症的方法,其包括以下步骤:(a)提供或获得包含靶向第二抗原的非天然抗原受体的免疫效应细胞或多个免疫效应细胞;和(b)用编码分子衔接子的多核苷酸转染所述细胞,该分子衔接子包含:(1)靶向第一抗原的靶细胞结合结构域,和(2)细胞因子结构域,该细胞因子结构域包含:(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合。
本公开的实施方案包括免疫效应细胞及其使用方法,其中所述细胞分别产生或表达重组细胞因子、细胞因子受体或针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体,或其中任何的组合。在这些细胞中,产生的细胞因子和细胞因子受体可表达为单独的蛋白质或蛋白质片段或表达为单个蛋白质。这样的细胞可用于治疗个体的癌症的方法,所述癌症包括具有表达所述一种或多种肿瘤靶抗原的细胞的癌症。
前面已经相当广泛地概述了本发明的特征和技术优点,以便可以更好地理解以下对本发明的详述。在下文中将描述构成本发明权利要求书的主题的本发明的附加特征和优点。本领域技术人员应该理解,所公开的概念和特定实施方案可以容易地用作修改或设计用于实现本发明相同目的的其他结构的基础。本领域技术人员还应当理解,这种等效构造不脱离所附权利要求书中所阐述的本发明的精神和范围。当结合附图考虑时,从以下描述中将更好地理解被认为是本发明的特征的新颖特征,涉及其组织和操作方法,以及进一步的目的和优点。但是,应该清楚地理解,提供每个附图仅是出于说明和描述的目的,而不旨在作为对本发明的限制的定义。
附图的简要说明
为了更完整地理解本公开,现结合附图参考下述说明,其中:
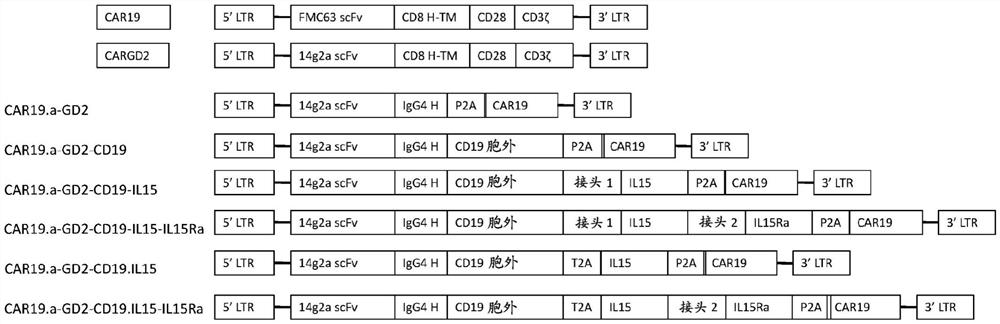
图1、分子衔接子构建体实例的示意图:“FMC63 scFv”是抗CD19scFv结构域,“CD8H-TM”是人CD8铰链区和CD8跨膜结构域,“CD28”是来自CD28的共刺激结构域,“CD3ζ”是CD3ζT细胞活化结构域,“14g2a scFv”是抗GD2 scFv结构域,“IgG4 H”是来自人IgG4的铰链区,“P2A”是自切割病毒P2A序列,“CAR19”是全长CD19 CAR构建体(该图顶部所示),“CD19胞外”是人CD19胞外结构域或针对CAR19的抗原,“接头1”是20个氨基酸的接头,“IL15”是人IL15,“接头2”是26个氨基酸的接头,“IL15Ra”是人IL15受体α亚基,“T2A”是自切割病毒T2A序列,“5'LTR”是5'长末端重复;“3'LTR”是3'长末端重复;
图2A和2B、具有或不具有细胞因子复合物的抗GD2-CD19分子衔接子的表达和特异性:(图2A)使用抗CAR19抗体染色通过流式细胞术确定转导的NKT细胞的CAR19的表达。其中,(1)是指非转导的;(2)是指CAR19.抗GD2;(3)是指CAR19.抗GD2-CD19;(4)是指CAR19.抗GD2-CD19-IL15;(5)是指CAR19.抗GD2-CD19-IL15-IL15Ra;(6)是指CAR19.抗GD2-CD19.IL15;并且(7)是指CAR19.抗GD2-CD19.IL15-IL15Ra;百分比表示表达CAR19的NKT细胞的百分比;(图2B)通过将来自CAR19.抗GD2-CD19或CAR19.抗GD2转导的NKT细胞的上清液与CD19阴性/GD2阳性CHLA-255或CD19阴性/GD2阴性LA-N-6成神经细胞瘤细胞孵育来确定所述分子衔接子的特异性。用抗CD19抗体染色后通过流式细胞术来分析抗GD2-CD19与成神经细胞瘤细胞的结合。结果来自三次实验的代表;
图3、分子衔接子介导体外对NB细胞的有效杀伤:在孵育用指示的构建体转导的效应NKT细胞和稳定表达萤光素酶的靶CHLA255NB细胞后,分析细胞介导的细胞毒性。以不同的效应细胞与靶细胞(E:T)的比率共培养4小时后,测量萤光素酶活性(活细胞)。将结果表示为来自四次实验的代表的细胞毒性百分比。
图4、具有IL15/IL15R复合物的分子衔接子介导针对NSG小鼠中NB肿瘤异种移植物的有效抗肿瘤活性。在转移性成神经细胞瘤模型中测量了用指示的构建体转导的NKT细胞的抗肿瘤活性。将10
图5、附加分子衔接子和细胞因子构建体的示意图:“14g2a scFv”是抗GD2 scFv结构域,“IgG4 H”是来自IgG4的铰链区,“P2A”是自切割病毒P2A序列,“CAR19”是全长抗CD19CAR构建体(图1顶部所示)。“CD19胞外”是人CD19胞外结构域或针对抗CD19 CAR的抗原,“接头1”是20个氨基酸的接头,“IL15”是人IL15,“接头2”是26个氨基酸的接头,“IL15Ra”是人IL15Ra,“T2A”是自切割病毒T2A序列,“5'LTR”是5'长末端重复,“3'LTR”是3'长末端重复;
图6A和6B、由附加GD2分子衔接子介导的表达和体外细胞毒性:(图6A)用指示的分子衔接子构建体转导体外刺激的NKT细胞。用抗CD19 CAR抗体染色后,通过流式细胞术分析CAR表达。百分比代表表达CAR19的NKT细胞。(图6B)通过将用指示的构建体转导的效应NKT细胞与靶成神经细胞瘤细胞以各种效应细胞与靶细胞的比率进行孵育来分析细胞介导的细胞毒性。结果来自两次实验的代表;
图7、具有限定的IL15/IL15R复合物方向的分子衔接子介导针对NSG小鼠中NB肿瘤异种移植物的有效抗肿瘤活性。在转移性成神经细胞瘤模型中测量了用指示的构建体转导的NKT细胞的抗肿瘤活性(如图4中所述)。结果来自两次实验的代表;
图8、编码CARGD2和抗原-细胞因子复合物IL15/IL15Ra(连接到抗成神经细胞瘤细胞表面上GD2、CD24或CD56的scFv)的逆转录病毒构建体的示意图。示意性地描述了被设计通过靶向GD2、CD24或CD56来在成神经细胞瘤上呈递IL15/IL15Ra的构建体。表达CARGD2的细胞(带有或不带有IL15转基因表达),共表达具有融合至IL15、IL15Ra或两者的抗GD2(GD2scFv)、抗CD24(CD24scFv)或抗CD56(CD56 scFv)的分子衔接子。两个对照包括:i)靶向CD19抗原的CARGD2与IL15-IL15Ra的复合物,在成神经细胞瘤中不表达;ii)靶向CD19抗原的没有CAR有IL15-IL15Ra的复合物;“E2A”是自切割病毒E2A序列;其他标签为如图1和图5中所述;
图9、NKT纯度检查。通过流式细胞术确定NKT细胞纯度,其中使用对不变iNKT TCRVα24Jα18特异的BV421小鼠抗人不变NKT细胞抗体(BD Bioscience,克隆6B11)和BV421小鼠IgG1,k同种型对照抗体(Bioscience,克隆X40)分别对细胞进行染色;
图10、编码CARGD2和不同抗原-细胞因子复合物的构建体允许在NKT细胞中的有效的CAR表达。用抗小鼠F(ab')
图11、对数轶(Mantel-Cox)测试显示,与分泌IL15的CARGD2细胞相比,通过IL15Ra或IL15-IL15Ra分子衔接子显著增强了抗肿瘤活性。使用表达不同衔接子的CARGD2 iNKT细胞治疗的组中的小鼠日存活百分比来生成存活图。通过Kaplan Meier法分析数据。然后使用对数轶检验比较生存差异。P值为A、B或C组与D组相比;
图12、具有抗原-细胞因子复合物的CAR分子衔接子的模型实例。一种示例性分子衔接子包含CD19胞外结构域和衍生自对GD2特异的单克隆抗体(mAb)的scFv的融合体(抗GD2-CD19)。用含有CAR19和抗GD2-CD19衔接子的构建体转导的NKT细胞在细胞表面表达CAR19并分泌这种分子衔接子。所述分子衔接子的抗原部分(例如,CD19胞外)与活化细胞因子结构域(例如,IL15-IL15Ra)融合,从而在肿瘤细胞表面形成抗原-细胞因子复合物,其同时被CAR和相应的细胞因子受体(由免疫效应细胞表达)识别。在图12中,(1)是指GD2;(2)是指抗GD2 scFv(抗GD2)(3)是指CD19胞外结构域;(4)是指CAR19;(5)是指IL15-IL15Ra;(6)是指IL-2Rβ/γ。注意,(2)、(3)和(5)通过氨基酸接头(蓝线)连接;
图13A-13C、免疫效应细胞修饰和与肿瘤细胞相互作用的实施方案。(图13A)免疫效应细胞产生并分泌靶向第一肿瘤抗原(抗原1)的分子衔接子,并且包含靶向第一肿瘤抗原的抗原受体。(图13B)免疫效应细胞产生靶向第二肿瘤抗原(抗原2)的分子衔接子,并包含靶向第一肿瘤抗原的抗原受体。(图13C)免疫效应细胞产生靶向第一肿瘤抗原的分子衔接子,所述分子衔接子具有被细胞表面表达的抗原受体靶向的抗原受体靶结构域。在图13A-C中,(1)是指针对第一肿瘤靶抗原的抗原受体(TCR、CAR等);(2)是指肿瘤细胞结合结构域;(3)是指细胞因子结构域;(4)是指细胞因子受体;(5)是指抗原受体靶结构域;和(6)是指针对第二肿瘤靶抗原的抗原受体。在特定情况下,如图13C例证的,元件(6)不是TCR,因为该抗原是可溶的;
图14、具有或不具有IL15或/和IL15Ra的嵌合抗原受体构建体CAR.GD2的实例的示意图:“5'LTR”是5'长末端重复,“14G2a”是抗GD2 scFv结构域,“CD8 H-TM”是人CD8铰链区和CD8跨膜结构域,“CD28”和“4-1BB”是共刺激结构域,“CD3ζ”是CD3ζT细胞活化结构域,“2A”是自切割病毒T2A序列,“IL15”是人IL15,“IL15Ra”是人IL15受体α亚基,“3'LTR”是3'长末端重复序列。对不同的构建体进行编号,如在图15A和图15B的图例中所描述的;
图15A和15B、由具有或不具有IL15或/和IL15Ra的CAR.GD2构建体转导的NKT细胞的CAR.GD2或IL15的细胞表面表达:(图15A)使用抗CAR.GD2抗体染色通过流式细胞术确定NKT细胞的CAR.GD2的表达。其中,(1)是指非转导的;(2)是指CAR.GD2.28z;(3)是指CAR.GD2.28z.15;(4)是指CAR.GD2.28z.15.15Ra;(5)是指CAR.GD2.BBz;(6)是指CAR.GD2.BBz.15;和(7)是指CAR.GD2.BBz.15.15Ra。百分比代表在一群NKT细胞中表达CAR.GD2的NKT细胞的百分比。(图15B)使用抗IL15抗体染色通过流式细胞术来确定NKT细胞表面上IL15的表达。用与图15A中所述相同的构建体转导NKT细胞。百分比代表在细胞表面上表达IL15的NKT细胞的百分比;
图16、CAR.GD2 IL15.IL15Ra构建体介导转导的NKT细胞对NB细胞的有效和特异的体外细胞毒性:将用指示的构建体转导的效应NKT细胞和稳定表达萤光素酶的靶CHLA255(GD2阳性)、LA-N-1(GD2阳性)或LA-N-6(GD2阴性)NB细胞孵育后,分析了细胞介导的细胞毒性。以不同的效应细胞与靶细胞(E:T)比率共培养6小时后,测量了萤光素酶活性(活细胞)。将结果表示为来自3次实验的代表的细胞毒性百分比;
图17A-17B、在低剂量(4×10
图18A-18B、在高剂量(12×10
图19、在免疫效应细胞表面上CAR.IL15.IL15Ra介导的信号转导的模型。用CAR.IL15.IL15Ra构建体转导的免疫效应细胞分别表达CAR构建体、分泌的IL15和膜结合的IL15Ra。CAR构建体的scFv与目标肿瘤抗原结合,并在效应细胞内传递活化和共刺激信号。膜结合的IL15Ra在免疫效应细胞表面捕获分泌的IL15,并且IL15.IL15Ra复合物共同参与IL2Rβ/γ细胞因子信号转导复合物。(1)目标肿瘤抗原,(2)CAR的肿瘤抗原特异性scFV部分,(3)CAR的跨膜结构域,(4)CAR的至少一个共刺激结构域,(5)CAR的CD3ζ信号转导结构域,(6)IL2Rβ/γ,(7)IL15,和(8)IL15Ra。
详述
如本文说明书中所使用的,“一个(a)”或“一个(an)”可以表示一个或多个。如本文权利要求中所使用的,当与词“包括(comprising)”结合使用时,词“一个(a)”或“一个(an)”可以表示一个或多于一个。如本文所用,“另一个(another)”可以表示至少第二或更多。在特定的实施方案中,例如,本发明的方面可以“基本上由……组成”或“由……构成”本发明的一个或多个序列。本发明的一些实施方案可以由一个或多个本发明的元件、方法步骤和/或方法组成或基本上由其组成。预期可以相对于本文描述的任何其他方法或组合物实施本文描述的任何方法或组合物。本申请的范围不旨在限于如说明书中描述的过程、机器、制造、物质组成、手段、方法和步骤的特定实施方案。
在某些实施方案中,本公开涉及免疫效应细胞、优选NKT细胞,其被工程化以表达针对第一肿瘤抗原的抗原受体如CAR,其可以针对表达第二抗原的肿瘤细胞而有效地重定向(使用本文描述的某些分子衔接子方法)。在至少特定情况下,将IL15-IL15R复合物或类似的促存活细胞因子-细胞因子受体复合物与分子衔接子递送的靶抗原共同呈递在肿瘤细胞表面上。这允许表达抗原受体的免疫效应细胞在肿瘤细胞表面上紧密分子接近度识别靶抗原和细胞因子。
在其他实施方案中,本发明涉及免疫效应细胞、优选为NKT细胞,其被工程化以表达针对第一肿瘤抗原的抗原受体如CAR,其中所述细胞共表达包含肿瘤细胞结合结构域和细胞因子结构域的分子衔接子。经由肿瘤细胞结合结构域,所述分子衔接子可以结合至肿瘤细胞,并且免疫效应细胞可以进而结合(例如,通过细胞因子受体)到所述分子衔接子,从而在相同免疫效应细胞中结合活化信号和存活信号,最大化其抗肿瘤活性。
在一些实施方案中,本公开涉及免疫效应细胞、优选为NKT细胞,其被工程化以表达针对第一肿瘤抗原的抗原受体如CAR,其针对表达第二抗原的肿瘤细胞而有效地重定向(使用本文描述的某分子衔接子方法)。在至少特定情况下,将IL15-IL15R复合物或类似的促存活细胞因子-细胞因子受体复合物与分子衔接子递送的靶抗原共同呈递在肿瘤细胞表面上。这允许表达抗原受体的免疫效应细胞在肿瘤细胞表面上紧密分子接近度识别靶抗原和细胞因子。
如本文所示,工程化免疫效应细胞以表达肿瘤特异性抗原受体并递送具有融合的细胞因子的靶肿瘤抗原的概念是新颖的,在成神经细胞瘤的体内模型中有效,并且广泛适用于所有癌症的免疫疗法。
I.细胞和相关组分和组合物
本公开的实施方案涵盖自然界中未发现的由人手工操作的细胞。由此,细胞是工程化的(或合成的),因此是非天然的。所述细胞可以是分离的细胞。所述细胞包含至少一种实体,比如重组、外源提供给细胞、合成的和/或转基因的核酸实体或蛋白质实体。
本文涵盖的细胞包括任何类型的免疫效应细胞。在某些实施方案中,这样的细胞可以是NK细胞、NKT细胞、T细胞、γδT细胞、粘膜相关不变T(MAIT)细胞、先天性淋巴(IL)细胞、细胞因子诱导的杀伤(CIK)细胞、巨噬细胞、干细胞、其混合物等。在优选的实施方案中,NKT细胞是CD1d限制性的并且优选是不变的NKT(iNKT;也称为I型NKT)(11),例如Vα24i NKT或Vα24-Jα18NKT。在特定实施方案中,所述免疫效应细胞被工程化以产生(包括在至少一些情况下分泌)一种或多种对细胞来说是非天然的组合物。在另外的或替代的实施方案中,将细胞工程化以表达一种或多种不是从细胞分泌的组合物。优选地,所述免疫效应细胞是人的。
特定的实施方案包括产生一种或多种本文称为“分子衔接子”的可溶性融合蛋白的免疫效应细胞(参见图13)。在特定实施方案中,此类分子衔接子包含(a)肿瘤细胞结合结构域;(b)细胞因子结构域,细胞因子结构域包含(i)细胞因子或其功能片段;(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合;和(c)任选地进一步包含抗原受体靶结构域。
在特定实施方案中,分子衔接子包含至少一个肿瘤细胞结合结构域,肿瘤细胞结合结构域靶向在肿瘤细胞(或非实体癌细胞,例如血液系统恶性肿瘤的癌细胞)的表面上表达的抗原。在免疫效应细胞产生包含肿瘤细胞结合结构域的分子衔接子的情况下,所述肿瘤细胞结合结构域可以是任何合适的类型。在特定的实施方案中,肿瘤细胞结合结构域包含任何类型的抗体(包括其功能片段)和/或非抗体骨架。所述包含抗体的肿瘤细胞结合结构域可以包含全长抗体。在一些情况下,抗体是嵌合抗体。在肿瘤细胞结合结构域是功能性抗体片段的情况下,该抗体片段可以是Fab;Fab';F(ab)'
在特定实施方案中,所述分子衔接子包含抗原受体靶结构域。在某些实施方案中,这样的构建体允许免疫效应细胞向不同的肿瘤靶抗原重定向(图13C)。所述分子衔接子的所述抗原受体靶结构域可包含一种或多种肿瘤抗原或其功能片段。肿瘤细胞抗原的实例至少包括5T4、8H9、α
所述分子衔接子包含细胞因子结构域,并且在特定实施方案中,所述细胞因子结构域包含(i)细胞因子或其功能片段;(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合。在特定方面,细胞因子是促存活细胞因子。特定细胞因子的实例包括选自IL7、IL15、IL21、IL12、IL18、IL27及其混合物的细胞因子。在特定的实施方案中,所述细胞因子是IL-15和/或所述细胞因子受体是IL15R或其α亚基(IL15Ra)。在特定的实施方案中,使用IL15Ra的sushi结构域。在至少一些情况下,所述细胞因子不是IL2、IL4、IL6、IL10和/或IL13。在一些实施方案中,所述细胞因子结构域包含IL-2Rβ/γ。由此,在其特定实施方案中,所述细胞因子结构域包含IL15、IL15Ra和IL-2Rβ/γ。
在一些实施方案中,所述免疫效应细胞包含针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体。在特定的实施方案中,所述针对一种或多种肿瘤靶抗原的抗原受体不是分子衔接子的一部分,而是作为单独的分子由细胞表达。所述抗原受体可以是任何种类的工程化受体,例如嵌合抗原受体(CAR)、嵌合细胞因子受体、αβ受体、γδ受体、T细胞受体(TCR)等。在优选的实施方案中,所述抗原受体是TCR或CAR。抗原受体可以被导向至的肿瘤靶抗原的实例至少包括5T4、8H9、α
在特定实施方案中,所述分子衔接子包含靶向肿瘤细胞上第一抗原的肿瘤细胞结合结构域和包含第二肿瘤抗原或其功能片段的抗原受体靶结构域。
在特定的实施方案中,所述抗原受体靶结构域的抗原可以与针对一种或多种肿瘤靶抗原的抗原受体被导向至的抗原相同。在抗原受体靶结构域的抗原是与抗原受体被导向至的抗原不同的抗原的情况下,其中一个抗原可以称为第一抗原,另一个抗原可以称为第二抗原。
在特定的实施方案中,所述免疫效应细胞表达针对一种或多种肿瘤靶标抗原的一种或多种抗原受体。在特定的实施方案中,所述受体对于细胞是非天然的。所述抗原受体可以是任何种类,至少包括T细胞受体(TCR)或嵌合抗原受体(CAR)。当受体是CAR时,CAR可以是第一代、第二代或第三代或更多代。相应地,CAR可以包含或可以不包含一个或多个共刺激结构域。单个CAR可以靶向一种、两种、三种或更多种肿瘤靶抗原。在特定情况下,工程化CAR具有一种、两种、三种、四种或更多种组分,并且在一些实施方案中,所述一种或多种组分促进细胞靶向或结合至包含癌抗原的癌细胞。在特定的实施方案中,CAR包含针对癌抗原的抗体、细胞质信号转导结构域的部分或全部和/或一种或多种共刺激分子的部分或全部(例如共刺激分子的胞内结构域(endodomain))。在特定的实施方案中,所述抗体是单链可变片段(scFv)。在某些方面,所述抗体被导向至癌细胞(例如表达目标抗原的癌细胞)的细胞表面上的癌抗原。在某些实施方案中,胞质信号转导结构域(例如衍生自T细胞受体ζ链的那些)被用作嵌合受体的至少一部分,以便在嵌合受体与靶抗原结合后产生免疫效应细胞增殖和效应子功能的刺激信号。实例将包括但不限于来自共刺激分子(诸如CD27、CD28、4-1BB、ICOS和/或OX40)的胞内结构域或细胞因子受体(诸如IL7和IL15)的信号转导组分。在特定的实施方案中,使用共刺激分子来增强抗原结合后由CAR产生的NKT细胞的活化、增殖和细胞毒性。在特定的实施方案中,所述共刺激分子是CD28、OX40和4-1BB。在一些实施方案中,CD3-ζ与CD28、4-1BB和/或OX40组合使用。通常,CAR的胞外结构域包含信号肽,抗原识别结构域和将抗原识别结构域连接至跨膜结构域的间隔子(spacer)。抗原识别结构域可包含对特定癌抗原具有特异性的scFv。但是,在相同细胞中有两个或更多CAR的情况下,第二CAR可能包含对另一特定抗原具有特异性的scFv。胞外结构域的铰链区的例子包括免疫球蛋白的CH2CH3区,IgG1的铰链区和CD8的部分。所述跨膜区域可以是任何种类,尽管在一些情况下是CD4或CD28。通常,在抗原识别和受体聚簇后,将本公开的CAR的胞内结构域用于在细胞中的信号传递。最常用的胞内结构域组分是CD3-ζ。CD3-ζ包含3个ITAM,在抗原结合后可将活化信号传递至T细胞。
转向图12,描绘了表达肿瘤抗原((1),在此实例中指GD2)的肿瘤细胞与免疫效应细胞之间的特异性相互作用。在特定的实施方案中,示例性分子衔接子包含CD19胞外结构域(图12的元件(3))和衍生自对GD2具有特异性的mAb的scFv(图12的元件(2))的融合体(抗GD2CD19)。用含有CAR19和抗GD2CD19衔接子的构建体转导的免疫效应细胞在细胞表面表达CAR19(元件(4))并分泌分子衔接子。在此特定实例中,分子衔接子的抗原组分与活化细胞因子结构域(例如,IL-15/IL-15Ra,元件(5))融合。这在肿瘤细胞表面上形成抗原-细胞因子复合物,其同时被CAR和免疫效应细胞表达的各个细胞因子受体识别。在此特定实例中,图12的元件(6)描绘了IL-2Rβ/γ。
参考图13,在特定实施方案中,免疫效应细胞及其与肿瘤细胞的相互作用可具有多种配置中的一种。在图13A中,所述免疫效应细胞产生称为分子衔接子的可溶性融合蛋白,所述分子衔接子靶向第一肿瘤抗原并且还具有靶向第一肿瘤抗原的抗原受体。所述分子衔接子包括与细胞因子结构域(包含细胞因子和/或细胞因子受体)融合的肿瘤细胞结合结构域。这种配置确保免疫效应细胞接收相同靶细胞上的活化和存活信号,从而获得最大的抗肿瘤功效。在图13B中,所述免疫效应细胞产生靶向第二肿瘤抗原的称为分子衔接子的可溶性融合蛋白,并且该细胞包含靶向第一肿瘤抗原的抗原受体。所述分子衔接子包括与细胞因子结构域(细胞因子和/或细胞因子受体)融合的肿瘤细胞结合结构域。在这种配置中,免疫效应细胞仍接收来自共表达两种肿瘤抗原的肿瘤细胞的活化和存活信号。由于只有表达第一抗原和第二抗原的细胞才能完全活化免疫效应细胞,所以这种配置可以提供增强的特异性。在图13C中,免疫效应细胞产生靶向第一肿瘤抗原的分子衔接子,并且该细胞还具有抗原受体。所述分子衔接子的抗原受体靶结构域被细胞表面表达的抗原受体靶向。所述分子衔接子包括靶向肿瘤细胞的第一抗原的肿瘤细胞结合结构域、抗原受体靶结构域和细胞因子结构域。这种配置允许使用一种在免疫效应细胞中表达的抗原受体来靶向多种类型的癌症,同时仍接收来自靶细胞表面的活化和存活信号。
关于分子衔接子,其组分可以处于或可以不处于特定配置。例如,在N末端至C末端的方向上,分子衔接子的组分中的一个组分可位于另一组分的N末端或C末端。在分子衔接子的特定实施方案中,肿瘤细胞结合结构域和抗原受体靶结构域可以通过铰链区和/或(GGGGS)
本公开内容涵盖产生某些非天然蛋白的工程化免疫效应细胞。在特定情况下,免疫效应细胞产生(1)靶向第一肿瘤抗原或第二肿瘤抗原的抗体或其功能片段,其中该抗体连接至(a)细胞因子、(b)细胞因子受体或(c)与其受体连接的细胞因子。在其他情况下,免疫效应细胞产生靶向第一肿瘤抗原的抗体或其功能片段,其中抗体连接至第二肿瘤抗原,其又连接至(a)细胞因子、(b)细胞因子受体或(c)与其受体相连的细胞因子。在任何情况下,对于本文涵盖的免疫效应细胞,细胞可包含靶向第一肿瘤抗原或第二肿瘤抗原的CAR或工程化TCR(或天然TCR)。
在特定的实施方案中,免疫效应细胞带有一种或多种经工程化以编码一种或多种基因产物的非天然(可以是重组的)核酸。在特定实施方案中,细胞包含一种或多种非天然(可以是重组的)表达载体,并且所述一种或多种载体可以包含编码一种或多种特定基因产物的一种或多种表达构建体。所述表达载体可以是病毒载体或非病毒载体。在载体是病毒载体的情况下,所述病毒载体可以是逆转录病毒、慢病毒、腺病毒或腺相关病毒载体。在所述载体是非病毒载体的情况下,载体可以是质粒、分离的DNA或RNA、转座子或其他可移动的遗传元件。在特定方面,免疫效应细胞中的一种载体编码分子衔接子和抗原受体,尽管在其他情况下,所述分子衔接子和抗原受体由不同的载体表达。当所述分子衔接子和抗原受体从不同的载体表达时,这些载体可以是或可以不是相同类型。
在一个实施方案中,存在用于重定向表达抗原受体的细胞的分子衔接子,其包含(a)肿瘤细胞结合结构域,(b)细胞因子结构域,细胞因子结构域包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合,以及(c)抗原受体靶结构域。在特定配置中,所述分子衔接子中的所述细胞因子结构域位于肿瘤细胞结合结构域和抗原受体结构域之间。如上所述,所述肿瘤细胞结合结构域可以是例如包含抗体、抗体片段或非抗体骨架,并且在优选的实施方案中,抗体片段是scFv。在特定情况下,所述肿瘤细胞结合结构域靶向任何种类的肿瘤细胞表面上表达的抗原。如上所述,细胞因子结构域可以包含任何细胞因子,例如包括促存活细胞因子,例如IL7、IL15或IL21。在分子适衔接子的特定实例中,所述细胞因子是IL15和/或细胞因子受体是IL15R或其α亚基(IL15Ra)。可溶性蛋白的抗原受体靶结构域可以包含肿瘤抗原或其功能片段,例如CD19。在特定的实施方案中,所述分子衔接子包含靶向肿瘤细胞上第一抗原的肿瘤细胞结合结构域和包含第二肿瘤抗原或其功能片段的抗原受体靶结构域。所述分子衔接子的所述肿瘤细胞结合结构域和所述抗原受体靶结构域可以通过铰链区连接,例如来自IgG1、IgG2、IgG3或IgG4中的一个,优选来自IgG4。
在一个实施方案中,存在被导向针对本公开涵盖的分子衔接子的抗原受体。在特定情况下,所述抗原受体是例如TCR(例如,对于与细胞表面上MHC抗原相关的分子)或CAR,并且包含结合分子衔接子的组分的部分。在特定情况下,所述抗原受体结合分子衔接子的抗原受体靶结构域,例如肿瘤抗原或其功能片段。在替代情况下,所述抗原受体结合不是抗原受体靶结构域的分子衔接子的组分。
本公开的实施方案包括表达载体,其编码本公开涵盖的分子衔接子,包括包含下述的分子衔接子:(a)肿瘤细胞结合结构域;(b)细胞因子结构域;和(c)抗原受体靶结构域。表达载体可以是病毒的或非病毒的。在编码可溶性蛋白质的表达载体是病毒的情况下,其可以是逆转录病毒、慢病毒、腺病毒或腺相关病毒。在表达载体是非病毒的情况下,所述表达载体可以是质粒、分离的DNA或RNA、转座子或其他可移动的遗传元件。在特定的实施方案中,存在编码包含下述的分子衔接子的表达载体:(i)肿瘤细胞结合结构域和(ii)细胞因子结构域;并且所述表达载体编码(b)抗原受体。在一些情况下,所述表达载体编码分子衔接子,并在相同载体上编码抗原受体。在这种情况下,所述分子衔接子的表达和所述抗原受体的表达可以或可以不由相同的调节区(例如启动子)指导。在分子衔接子和抗原受体的表达由不同的调节区调节的情况下,其表达可以由内部核糖体进入位点(IRES)或2A序列控制。在特定情况下,IRES元件或2A序列位于所述分子衔接子和所述抗原受体之间。在至少一些情况下,可以使用双顺反子或三顺反子载体,例如逆转录病毒载体,在免疫效应细胞中有效表达CAR(和/或工程化TCR)和分子衔接子分子。
在特定的实施方案中,某些2A序列元件可以用于在本公开提供的构建体中产生基因的连锁表达或共表达。例如,通过连接开放阅读框以形成单个顺反子,切割序列可用于共表达基因。示例性的切割序列是马甲型鼻炎病毒(E2A)或F2A(口蹄疫病毒2A)或“2A样”序列(例如,Thosea asigna病毒2A;T2A)或猪捷申病毒-1(P2A)。在特定实施方案中,在单个载体中,所述多个2A序列是不同的,尽管在替代实施方案中,同一载体利用两个或更多相同的2A序列。2A序列的实例提供于US 2011/0065779中,其通过引用整体并入本文。
本公开的实施方案还包括免疫效应细胞,其分别表达针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体;一种或多种重组细胞因子(IL7、IL12、IL15、IL18、IL27、IL33和/或IL21)或其功能片段;和(c)一种或多种重组细胞因子受体或其功能片段。如本文所用,术语“重组”是指不是存在于自然界中的对于细胞是内源的和天然的分子;在特定情况下,其相对于细胞是转基因的,并且其可以在细胞中瞬时表达或可以不在细胞中瞬时表达。这样的细胞产生重组的细胞因子和细胞因子受体,作为各自之间缺少物理连接(例如接头)的分开的分子。在特定的实施方案中,所述细胞中的所述一种或多种工程化抗原受体是非天然T细胞受体(TCR)和/或嵌合抗原受体(CAR),其中的任何一种都可以靶向任何肿瘤靶抗原,诸如GD2、BCMA、CD56、CD24、L1CAM、GPC2、GPC3、CSPG4、HER2、CD19、CD22、CD30、CD71、B7-H3、B7-H4、PD-L1、PDL-2或其组合。CAR可以包含或可以不包含CD27、CD28、4-1BB、ICOS和/或OX40共刺激结构域。在特定情况下,所述细胞因子是IL15和/或细胞因子受体是IL15R或其α亚基(IL15Ra)。
在分别产生或表达一种或多种重组细胞因子和一种或多种重组细胞因子受体的这些类型的细胞中,所述一种或多种组分可以在表达载体或RNA上,包括在相同或不同的载体或RNA上。当其在相同载体上时,其可以被2A自切割位点或IRES元件隔开。与所述细胞一起使用的任何载体可以是病毒载体(逆转录病毒、慢病毒、腺病毒或腺相关病毒载体)或非病毒载体(质粒、转座子等)。
表达不连接的一种或多种重组细胞因子和一种或多种重组细胞因子受体的免疫效应细胞可以是任何类型的免疫效应细胞,包括NK细胞、NKT细胞、T细胞、γδ细胞、粘膜相关不变T(MAIT)细胞、巨噬细胞、先天性淋巴(IL)细胞、细胞因子诱导的杀伤(CIK)细胞或其混合物。
在个体中治疗癌症的方法可以利用免疫效应细胞,其中细胞因子和细胞因子受体是分开产生或表达的,其中向所述个体施用治疗有效量的细胞。递送可以通过任何方法进行,但是在特定情况下是通过注射,包括腹腔内或静脉内注射。所述个体可以正在接受、已经接受和/或将接受额外的癌症治疗,例如手术、放射疗法、化学疗法、免疫疗法、激素疗法或其组合。
在特定实施方案中,存在包含所述表达载体的细胞,或包含所述表达载体的多个细胞。如上所述,所述细胞可以是任何种类,但是在特定的实施方案中,所述细胞是免疫效应细胞,优选T细胞、NKT细胞或NK细胞或其混合物。对于特定个体的所述细胞可以是自体的或同种异基因的。
本公开的实施方案包括一种或多种包含本公开的一种或多种组合物的药物组合物。在特定的实施方案中,所述药物组合物包含本公开涵盖的免疫效应细胞(或多个免疫效应细胞)。在特定的实施方案中,所述药物组合物包含本公开涵盖的分子衔接子。在一些实施方案中,所述药物组合物包含免疫效应细胞和分子衔接子。在至少一种情况下,存在包含免疫效应细胞的药物组合物,该免疫效应细胞包含编码针对靶抗原的分子衔接子和/或抗原受体的表达载体。在药物组合物包含多个本文所述的免疫效应细胞的情况下,所述药物组合物可包含一定量的所述免疫效应细胞,比如1×10
在一个实施方案中,存在免疫效应细胞,其中该细胞产生(1)靶向第一肿瘤抗原或第二肿瘤抗原的抗体(例如scFv)或其功能片段,其中该抗体被连接至(a)一种或多种细胞因子,或(b)一种或多种细胞因子受体,或(c)与其受体相连的细胞因子;或(2)靶向第一肿瘤抗原的抗体或其功能片段,其中该抗体或其功能片段作为抗体-第二肿瘤抗原复合物与第二肿瘤抗原连接,其中所述复合物被连接至(a)细胞因子或(b)细胞因子受体或(c)与其受体连接的细胞因子。在至少一些情况下,所述细胞包含靶向第一肿瘤抗原或第二肿瘤抗原的TCR和/或CAR。在特定的实施方案中,(1)或(2)由其中的表达载体产生。在某些情况下,表达载体是病毒载体(至少包括逆转录病毒、慢病毒、腺病毒或腺相关病毒载体)或非病毒载体。在免疫效应细胞表达CAR的情况下,所述CAR可以包含一个、两个、三个或更多个共刺激结构域。在(2)中的实施方案的一些情况下,第二肿瘤抗原的全部或功能部分包含第二肿瘤抗原的胞外结构域。在(2)中的实施方案的某些情况下,靶向第一肿瘤抗原和第二肿瘤抗原的抗体或其功能片段通过铰链区(例如来自CD8α、IgG1、IgG2、IgG3或IgG4)连接。在特定免疫效应细胞实施方案的一些情况下,所述细胞因子是促存活细胞因子,例如IL15、IL7或IL21。
在一个实施方案中,存在免疫效应细胞,其中该细胞分别产生(a)针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体;(b)一种或多种重组细胞因子或其功能片段;和(c)一种或多种重组细胞因子受体或其功能片段。如本文所定义,“分别产生”是指以下之一,例如:(1)将(a)、(b)和(c)中的每一个编码为单独的转录本,然后分别翻译;(2)例如,将(a)、(b)和(c)编码为单个转录本,从中(a)、(b)和(c)的蛋白质作为单独的蛋白质产生(由于在所述单个转录本上的将(a)、(b)和(c)彼此分隔开的IRES元件);或(3)例如,将(a)、(b)和(c)编码为翻译成单个蛋白质的单个转录本,但其中(a)、(b)和(c)分别被2A自切割肽分隔开,切割使得(a)、(b)和(c)作为单独的蛋白质被产生。例如,当(a)、(b)或(c)中只有两个在相同载体上时,可以利用相同的机制。在特定的实施方案中,免疫效应细胞的重组细胞因子从细胞中分泌出来。在某些实施方案中,重组细胞因子受体被膜结合在细胞上。在某些情况下,用分别表达CAR、可分泌细胞因子和相应的膜结合细胞因子受体的构建体转导细胞。所述CAR构建体的scFv可与目标肿瘤抗原结合,并在免疫效应细胞内传送活化和共刺激信号。膜结合的细胞因子受体可以在免疫效应细胞表面捕获分泌的细胞因子,并且细胞因子-细胞因子受体复合物共同产生作用,例如吸引IL2Rβ/γ细胞因子信号转导复合物。当IL-15与IL-15Ra形成复合物时,IL2Rβ/γ介导的信号转导的活化要比IL-15单独存在时的活化有效得多。
在一个实施方案中,存在系统,其包含一个或多个多核苷酸,所述多核苷酸包含:(1)第一序列,其编码靶向第一肿瘤抗原的CAR;(2)第二序列,其编码一种或多种促存活细胞因子(例如,IL15、IL7或IL21)、促存活细胞因子受体、一种或多种促存活细胞因子与所述促存活细胞因子的受体之间的融合体,或这些与以下之一的组合:(a)靶向第一或第二肿瘤抗原的抗体或其功能片段(例如scFv);或(b)与靶向第二肿瘤抗原的抗体或功能片段融合的第一肿瘤抗原的全部或功能部分。在实施方案(2)的分子衔接子中,元件(b)可与元件(c)的融合体接近。在实施方案(2)的分子衔接子中,元件(b)与融合元件(c)相邻。在特定实施方案中,所述多核苷酸进一步定义为表达载体,其包括病毒载体(逆转录病毒、慢病毒、腺病毒或腺相关病毒载体)或非病毒载体。所述CAR可以包含一个、两个或三个或更多个共刺激结构域。在一些情况下,第一肿瘤抗原的全部或功能部分包含所述第一肿瘤抗原的胞外结构域。在一些情况下,(a)靶向第二肿瘤抗原的抗体或其功能片段和(b)第一肿瘤抗原的全部或功能部分通过铰链区(例如来自CD8、IgG1、IgG2、IgG3或IgG4)连接。在一些情况下,所述多核苷酸在免疫效应细胞如NK细胞、NKT细胞或T细胞中表达。
在某个实施方案中,存在包含一种或多种多核苷酸的系统,所述多核苷酸包含:(1)编码针对一种或多种肿瘤靶抗原的一种或多种工程化抗原受体的第一序列;(2)编码一种或多种重组细胞因子或其功能片段的第二序列;(3)编码一种或多种重组细胞因子受体或其功能片段的第三序列。在这样的系统中,在所述第一、第二和第三序列在相同多核苷酸分子上的情况下,当它们的表达被分开调节时,它们相对于彼此的位置可以是任何配置。在所述第一、第二和第三序列在相同多核苷酸分子上并且其中两个或更多个序列的表达由相同元件调节的情况下,它们相对于彼此的位置可以具有特定的配置。例如,当在相同的多核苷酸载体上时,至少第二和第三序列的表达可以由相同的调控元件调控,以增加产生基本上相等比例的分子的可能性。在系统的特定实施方案中,无论所述第一、第二和第三序列是否在相同多核苷酸分子上,所述多核苷酸被进一步定义为表达载体,包括病毒载体(逆转录病毒、慢病毒、腺病毒或腺相关病毒载体)或非病毒载体。在工程化抗原受体是CAR的情况下,所述CAR可以包含一个、两个或三个或更多个共刺激结构域。尽管任何共刺激结构域都是有用的,但在特定情况下,所述共刺激结构域是4-1BB。在特定情况下,所述系统的所述多核苷酸在免疫效应细胞如NK细胞、NKT细胞或T细胞中表达。
作为说明性的实施方案,用在细胞表面表达CAR19并分泌GD2.CD19衔接子的构建体转导NKT细胞。所述分泌的分子衔接子足以将CD19阴性GD2阳性但不是GD2阴性的肿瘤细胞转化为CD19阳性的肿瘤细胞。所述CAR19结合抗GD2.CD19衔接子,后者又与肿瘤细胞上表达的GD2结合。这样,表达CAR19和抗GD2.CD19衔接子的NKT细胞可以在体外或体内有效并特异性地杀死GD2阳性肿瘤细胞。在某些情况下,表达CAR19和抗GD2.CD19衔接子的NKT细胞在体外杀死GD2阳性肿瘤细胞不需要IL15或IL15R,尽管在其他情况下,也使用IL15和/或IL15R。然而,在特定的实施方案中,表达CAR19和抗GD2.CD19衔接子与融合的IL15和IL15R的NKT细胞具有对GD2阳性癌症(包括例如小鼠中的GD2阳性成神经细胞瘤)的有效治疗活性。在至少一些情况下,不含IL15和/或IL15R的分子衔接子在体内无效。
在其他说明性的实施方案中,IL-15和IL-15R通过接头以限定的方向连接,并与分子衔接子构建体中的靶抗原(例如,CD19)融合,因此CAR19 NKT细胞将通过CAR识别CD19,通过在肿瘤细胞表面上紧密分子接近度共同的IL-2/IL-15Rβγ受体识别IL-15/IL-15R复合物。类似地,所述IL15-IL15R可以表达为单独的分子。
作为一个实例,用在细胞表面表达CARGD2和IL15Ra并分泌IL15的构建体转导NKT细胞。CAR的scFv(在特定情况下具有4-1BB作为共刺激结构域)与GD2结合,从而在NKT细胞内传递活化和共刺激信号,导致杀死GD2阳性癌细胞。所述膜结合的IL15Ra结合可溶性IL15,并且作为复合物,其吸引IL2Rβ/γ细胞因子信号转导复合物。在其他实施方案中,利用其他细胞因子-细胞因子受体,并用CAR靶向其他癌抗原。
在一些实施方案中,所述分子衔接子包含靶向CD19的肿瘤细胞结合结构域和作为细胞因子结构域的IL15。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD19的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD19的肿瘤细胞结合结构域和作为细胞因子结构域的IL15R、更优选IL15Ra。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD19的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。在一些实施方案中,所述分子衔接子包含靶向CD19的肿瘤细胞结合结构域和作为细胞因子结构域的IL15(连接至IL15R、更优选IL15Ra)。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD19的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD24的肿瘤细胞结合结构域和作为细胞因子结构域的IL15。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD24的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD24的肿瘤细胞结合结构域和作为细胞因子结构域的IL15R、更优选IL15Ra。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD24的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD24的肿瘤细胞结合结构域和作为细胞因子结构域的IL15(连接至IL15R、更优选IL15Ra)。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD24的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD56肿瘤细胞结合结构域和作为细胞因子结构域的IL15。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD56的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD56的肿瘤细胞结合结构域和作为细胞因子结构域的IL15R、更优选IL15Ra。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD56的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD56的肿瘤细胞结合结构域和作为细胞因子结构域的IL15(连接至IL15R、更优选IL15Ra)。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD56的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD22的肿瘤细胞结合结构域和作为细胞因子结构域的IL15。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD22的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD22的肿瘤细胞结合结构域和作为细胞因子结构域的IL15R、更优选IL15Ra。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD22的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向CD22的肿瘤细胞结合结构域和作为细胞因子结构域的IL15(连接至IL15R、更优选IL15Rα)。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向CD22的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向BCMA的肿瘤细胞结合结构域和作为细胞因子结构域的IL15。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向BCMA的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向BCMA的肿瘤细胞结合结构域和作为细胞因子结构域的IL15R、更优选IL15Ra。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向BCMA的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向BCMA的肿瘤细胞结合结构域和作为细胞因子结构域的IL15(连接至IL15R、更优选IL15Ra)。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向BCMA的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向GD2的肿瘤细胞结合结构域和作为细胞因子结构域的IL15。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向GD2的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向GD2的肿瘤细胞结合结构域和作为细胞因子结构域的IL15R、更优选IL15Ra。在其优选的实施方案中,肿瘤细胞结合结构域是靶向GD2的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
在一些实施方案中,所述分子衔接子包含靶向GD2的肿瘤细胞结合结构域和作为细胞因子结构域的IL15(连接至IL15R、更优选IL15Ra)。在其优选的实施方案中,所述肿瘤细胞结合结构域是靶向GD2的scFv。在一些实施方案中,此类分子衔接子进一步包含如本文所述的抗原受体靶结构域。
一般实施方案
本文证明,使用分子衔接子方法,经工程化以表达针对一种肿瘤抗原CD19的有效CAR的免疫效应细胞(作为示例,NKT细胞)可以有效地被重定向针对表达另一种抗原GD2的肿瘤细胞。所述分子衔接子包含CD19胞外结构域和衍生自对GD2特异的mAb的scFv的融合体(抗GD2.CD19)。用含有CAR19和抗GD2.CD19衔接子的构建体转导的NKT细胞在细胞表面表达CAR19并分泌所述分子衔接子。所述分泌的分子衔接子足以将CD19阴性GD2阳性但不是GD2阴性的成神经细胞瘤细胞转化为CD19阳性细胞,并使CAR19NKT细胞对GD2阳性肿瘤细胞具有体外细胞毒性。通过将所述分子衔接子(CD19)的抗原部分与IL15和IL15Ra融合在一起(通过接头以限定的方向连接,形成抗原-细胞因子复合物),在体内获得了甚至更强的抗肿瘤活性。此外,与单独的分子衔接子相比,与抗GD2.CD19衔接子分开的、由CAR19 NKT细胞分泌的IL-15或IL15-IL15Ra复合物并没有显著增强体内抗肿瘤活性。因此,为了使所述分子衔接子在体内有效,在至少一些实施方案中,IL15、IL15Ra或IL15-IL15Ra复合物或类似的促存活细胞因子(分子)必须与抗原结合结构域连接,以使其可以与靶抗原在肿瘤细胞表面上共同呈递。这使得表达CAR的效应细胞能够在肿瘤细胞表面上紧密分子接近度识别靶抗原和细胞因子。工程化免疫效应细胞以表达肿瘤特异性CAR并呈递靶肿瘤抗原与融合的细胞因子的这一实施方案在成神经细胞瘤的体内模型中是新颖且有效的,并且广泛适用于实体瘤和其他癌症和疾病(包括非癌性疾病)的免疫治疗。
这些结果证实,使用本文所述的分子衔接子方法,经工程化以表达针对一种抗原(诸如CD19)的抗原受体(诸如CAR)的免疫效应细胞(诸如NKT细胞)可以被有效地重定向针对另一种抗原(例如,诸如GD2的肿瘤抗原)。
证据表明,用于CAR识别的靶抗原(提供信号-1和-2)和对于效应细胞的促存活细胞因子(信号-3)的共同呈递(其中呈递可以发生于相同肿瘤细胞表面),可用于实现有效的CAR介导的实体瘤免疫治疗。尽管本发明人使用特异性抗GD2.CD19衔接子作为递送载体并用IL-15.IL15R作为细胞因子实现了在肿瘤细胞表面上的这种呈递,但认为可以通过以下方式在肿瘤细胞表面上达到相似甚至更有效的结果:
1)抗GD2.CD19衔接子作为递送载体可以用直接靶向肿瘤细胞上高表达的抗原的scFv代替,即使它也表达于某些正常组织中(识别细胞因子(没有CAR/TCR靶标)预计不会触发细胞毒性)。在成神经细胞瘤的情况下,此类抗原包括例如CD56、CD24、CD171和/或H7-B3。此类scFv将与IL15、IL15Rα或IL15.IL-15Rα(作为示例)融合,或与它们的组合融合,从而获得类似的分子衔接子,所述分子衔接子将被CAR(例如CARGD2)重定向的免疫细胞识别(在相同肿瘤细胞上)。例如,用于在NKT细胞中表达的此类构建体可用于成神经细胞瘤模型。
2)IL15或IL15Rα可以用其他促存活细胞因子或细胞因子受体例如IL-7、IL-12、IL-18、IL-27、IL-33或IL-21以及它们各自的受体代替。
3)在一些实施方案中,不同于将分子衔接子工程化以由表达抗原受体的免疫效应细胞表达和分泌,可以将此类分子衔接子预先制备为融合蛋白,以用于与任何CAR/TCR细胞疗法组合进行全身递送。例如,可以将靶向与上述第1条所述相同抗原的mAb与IL15、IL15Ra或IL15-IL15-Ra(或如第2条所述的另一种细胞因子)融合,并用作与任何癌症(包括实体瘤)的过继免疫疗法联合的常备(off-the-shelf)疗法。
II.产生免疫效应细胞和适应癌症疗法的方法
本文所涵盖的免疫效应细胞是非天然的,至少是因为它们被工程化以表达靶向特定抗原的工程化抗原受体(例如TCR或CAR)和/或因为它们被工程化以产生如上所述的分子衔接子。至少在一些情况下,可以通过标准重组技术对免疫效应细胞进行工程化。
在特定实施方案中,可以在递送给有需要的个体之前对免疫效应细胞进行遗传修饰。在TCR刺激和共刺激后,免疫效应细胞可被修饰;在特定实施方案中,遗传修饰发生在刺激后1、2、3、4、5、7、8、9、10、11、12或更多天内(这可能取决于转导的类型和所用效应细胞的类型;例如,使用逆转录病毒载体,T细胞可能在2天之内,NKT细胞可能在7-9天之内)。
所述免疫效应细胞的所述遗传修饰可以通过人手工进行,并且在特定的实施方案中,所述遗传修饰使得细胞能够特异性地靶向一种或多种癌细胞,例如表达特定抗原的癌细胞。在特定的实施方案中,所述修饰为免疫效应细胞提供了针对某癌抗原的特定的非天然受体。
在特定情况下,免疫效应细胞包括嵌合的和/或非天然的,至少部分地由人手工工程化并定向至特定目标癌抗原的CAR或TCR。
在本公开的任何治疗方法中,癌细胞可能缺乏特定肿瘤抗原的表达,例如缺乏免疫效应细胞上的某抗原受体可以被定向至的抗原的表达。在这种情况下,分子衔接子将肿瘤细胞与免疫效应细胞桥接,因为所述分子衔接子包含可结合肿瘤细胞的组分和可结合免疫效应细胞的组分。因此,所述分子衔接子可以允许某些免疫效应细胞被普遍使用,只要该分子衔接子对应于某些免疫效应细胞(具有结合所述某些免疫效应细胞的组分)即可。在一个实例中,可以产生表达与第一肿瘤抗原结合的抗原受体的免疫效应细胞并普遍用于任何类型的癌症,因为它们与许多可互换的分子衔接子一起使用,该分子衔接子具有至少一种结合所述免疫效应细胞的所述抗原受体的组分;在这种情况下,所述分子衔接子具有与目标癌症的第二抗原结合的第二组分。
本公开包括使一种类型的过继免疫疗法适应普遍应用于任何和所有类型的癌症的方法,不管在目标接受者癌细胞上表达的抗原是何类型。这样的方法利用现有的、准备好的表达如上所述的人工抗原受体的免疫效应细胞,该人工抗原受体靶向特定抗原,并修饰那些细胞以产生分子衔接子,允许免疫效应细胞用于表达除该特定抗原之外的抗原的癌症。实际上,由免疫效应细胞产生并具有双特异性靶向部分的分子衔接子被用来桥接被工程化以靶向第一抗原的细胞与表达第二、不同的抗原的肿瘤细胞。在替代情况下,将制备的表达靶向第一抗原的人工抗原受体(例如,CAR或TCR)免疫效应细胞与重组蛋白(即不是由免疫效应细胞本身产生的)结合使用,该重组蛋白具有双特异性靶向部分,所述双特异性靶向部分桥接经工程化以靶向第一抗原的免疫效应细胞与表达第二、不同的抗原的肿瘤细胞。
因此,本公开的实施方案包括使癌症疗法适应表达第一肿瘤抗原的癌症的方法,该方法包括以下步骤:(a)提供或获得包含非天然抗原受体(靶向第二肿瘤抗原)的免疫效应细胞或多个免疫效应细胞;和(b)提供或获得分子衔接子,其包含结合第一肿瘤抗原的肿瘤细胞结合结构域和结合靶向第二肿瘤抗原的抗原受体的抗原受体靶结构域,任选地,其中所述分子衔接子包含(i)细胞因子或其功能片段;或(ii)细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合,并且其中步骤(b)中所述分子衔接子的提供或获得由所述第一抗原在被治疗的癌症的癌细胞中的表达的存在确定。
在一些实施方案中,本公开的方法包括向个体施用如上所述的纯化的分子衔接子的步骤。
本公开的实施方案包括使癌症疗法适应表达第一肿瘤抗原的癌症的方法,其包括以下步骤:(a)提供或获得免疫效应细胞或多个免疫效应细胞,所述免疫效应细胞包含靶向第二肿瘤抗原的非天然抗原受体;和(b)用编码分子衔接子的多核苷酸转染所述细胞,该分子衔接子包含:(1)靶向所述第一抗原的一个或多个肿瘤细胞结合结构域,和(2)一个或多个细胞因子结构域,所述细胞因子结构域包含:(i)一种或多种细胞因子或其功能片段;(ii)一种或多种细胞因子受体或其功能片段;或(iii)(i)和(ii)的组合。
III.使用免疫效应细胞的方法
作为说明,可以如本文所述治疗患有癌症的个体或对癌症易感的或怀疑患有癌症的个体,以及患有除癌症之外的疾病或易感于或怀疑患有癌症以外的疾病的个体。可以将如本文所述修饰的免疫效应细胞施用于个体并保持延长的时间。所述个体可以接受一次或多次细胞施用。在一些实施方案中,将经遗传修饰的细胞封装以抑制免疫识别,并将其置于肿瘤的部位或受影响区域。
在各种实施方案中,表达构建体、核酸序列、载体、宿主细胞和/或包含相同的药物组合物用于预防、治疗或改善疾病,包括癌性疾病,例如肿瘤性疾病。在特定的实施方案中,本公开的药物组合物可特别用于预防、改善和/或治疗疾病,例如癌症,包括具有实体瘤的癌症。
如本文所用,“治疗”(“treatment”)或“治疗”(“treating”)包括对疾病或病理病况的症状或病理的任何有益的或期望的作用,并且可以包括甚至正在治疗的疾病或病况(例如癌症)的一种或多种可测量标志物的微小减少。治疗可以任选地涉及减轻或改善疾病或病况的症状,或延迟疾病或病况的进展。“治疗”不必然表示完全根除或治愈了该疾病或病况或其相关症状。
如本文所用,“预防”(“prevent”)和类似词如“预防”(“prevented”)、“预防”(“preventing”)等表示预防、抑制或减少疾病或病况(例如癌症)的发生或复发的可能性的方法。它还指延迟疾病或病况的发作或复发或延迟疾病或病况的症状的发生或复发。如本文所用,“预防”和类似词语还包括在疾病或病况的发作或复发之前减轻疾病或病况的强度、影响、症状和/或负担。
在特定的实施方案中,本公开部分地考虑了具有表达构建体、核酸分子和/或载体和/或纯化的分子衔接子的细胞,其可以单独施用或与另一种疗法以任何组合施用,并且至少在一些方面,与药学上可接受的载体或赋形剂一起。在某些实施方案中,在施用细胞之前,可以将所述核酸分子、载体稳定地整合到细胞的基因组中(例如,使用CRISPR方法)。在特定的实施方案中,可以使用对某些细胞或组织具有特异性并在所述细胞中持续存在的病毒载体。合适的药物载体和赋形剂是本领域众所周知的。根据本发明制备的组合物可用于预防或治疗或延缓上述确认的疾病。
此外,本公开涉及用于预防、治疗或改善诸如癌性(包括肿瘤性)疾病的疾病的方法,该方法包括向有此需要的受试者施用有效量的工程化细胞的步骤,该工程化细胞带有抗原受体和任选的本文描述的分子衔接子,以及化疗抗性分子,编码它们的核酸序列,编码它们的载体,如本文所考虑的和/或如本文所考虑的方法产生。
施用示例性修饰的免疫细胞的组合物的可能适应证是疾病,例如癌性疾病,包括肿瘤性疾病。特定实例是但不限于成神经细胞瘤、髓母细胞瘤、乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、黑素瘤、膀胱癌、肺癌、胰腺癌、结肠癌、前列腺癌、淋巴谱系的血液系统肿瘤、白血病、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、B细胞淋巴瘤、伯基特氏淋巴瘤、多发性骨髓瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、骨髓性白血病、急性骨髓性白血病(AML)、慢性骨髓性白血病、甲状腺癌、甲状腺滤泡状癌、骨髓增生异常综合征(MDS)、间叶细胞起源的肿瘤、纤维肉瘤、横纹肌肉瘤、黑素瘤、葡萄膜黑素瘤、畸胎瘤、成神经细胞瘤、神经胶质瘤、胶质母细胞瘤、皮肤良性肿瘤、肾癌、间变性大细胞淋巴瘤、食管鳞状细胞癌、肝细胞癌、滤泡树突状细胞癌、胆管癌、胆囊癌、肠癌、肌肉浸润癌、精囊肿瘤、表皮癌、脾癌、膀胱癌、头颈癌、泌尿生殖道癌、肾癌、胃癌(gastric cancer)、小肠癌、胃癌(stomach cancer)、肝癌、骨癌、脑癌、视网膜癌、胆道癌、小肠癌(small bowel cancer)、唾液腺癌、子宫癌、睾丸癌、结缔组织癌、前列腺肥大、骨髓增生异常、沃尔丹斯特伦巨球蛋白血症(Waldenstrom'smacroglobinaemia)、鼻咽癌、神经内分泌癌、骨髓增生异常综合征、间皮瘤、血管肉瘤、卡波西肉瘤、类癌、食管胃、输卵管癌、腹膜癌、乳头浆液性缪勒氏癌、恶性腹水、胃肠道间质瘤(GIST)和选自利-弗劳梅尼综合征和冯希佩尔-林道综合征(VHL)的遗传性癌症综合征。
用于施用细胞组合物的示例性适应证是任何疾病,例如癌性疾病,包括例如表达特定抗原的任何恶性肿瘤。此外,它包括异常表达其他肿瘤抗原的恶性肿瘤,那些也可能被靶向。本公开的组合物的施用对于癌症的所有阶段和类型都是有用的,例如包括微小残留病、早期癌症、晚期癌症和/或转移性癌症和/或难治性癌症。
本公开还包括与其他化合物例如双特异性抗体构建体,靶向毒素或其他化合物(其通过免疫细胞起作用)的共同施用方案。用于共同施用本发明化合物的临床方案可以涵盖在施用另一组分的同时、之前和/或之后共同施用。特别的组合疗法包括化学疗法、放射疗法、手术、激素疗法或其他类型的免疫疗法。
实施方案涉及试剂盒,其包含一个或多个如本文所述的免疫效应细胞,如本文所述的核酸序列,如本文所述的载体,如本文所述的纯化的分子衔接子和/或如本文所述的宿主。还考虑到,本公开的所述试剂盒包含如上所述的药物组合物,其单独或与其他药物组合,以施用于需要药物治疗或干预的个体。
已经用构建体修饰的免疫效应细胞可以在选择性条件下在培养物中生长,被选择为具有构建体的细胞可以随后被扩增和进一步分析,用例如聚合酶链反应或流式细胞术以确定宿主细胞中构建体的存在。一旦鉴定出修饰的宿主细胞,就可以按计划使用它们,例如在培养物中扩增或引入宿主生物中。
取决于细胞的性质,可以以各种各样的方式将细胞引入宿主生物,例如哺乳动物。在特定实施方案中,可将细胞在肿瘤部位引入,尽管在替代实施方案中,细胞归巢于癌症或被修饰成归巢于癌症。所用细胞的数量将取决于多种情况,引入的目的、细胞的寿命、所使用的方案,例如施用次数、细胞增殖的能力、重组构建体的稳定性等。可以将细胞以分散体的形式应用,通常在目标部位或附近注射,或者可以将它们注射或输注入血流、或腹膜腔(作为示例)或任何其他合适的部位。所述细胞可以在生理可接受的介质中。
DNA导入不必在每种情况下都导致整合。在某些情况下,短暂维持导入的DNA可能就足够了。以此方式,可能具有短期效果,其中可以将细胞引入宿主,然后在预定时间后(例如在细胞已经能够归巢到特定部位之后)启动。
可以根据需要施用细胞。取决于所需的应答、施用方式、细胞的寿命、存在的细胞的数量,可以采用各种方案。施用次数将至少部分取决于上述因素。
本公开的实施方案涵盖通过向个体提供有效量的本公开涵盖的任何一种或多种组合物来治疗个体的任何种类、阶段和类型的癌症的方法。癌症可能是原发性、转移性、难治性、复发性等。在特定的实施方案中,所述癌症是乳腺癌、脑癌、肺癌、结肠癌、皮肤癌、肝癌、肾癌、胃癌、脾癌、胰腺癌、前列腺癌、卵巢癌、子宫内膜癌、睾丸癌、血癌、骨癌等。用本文涵盖的一种或多种组合物治疗的个体在暴露于本公开的治疗之前可以接受或可以不接受一种或多种治疗。在特定的实施方案中,向患有癌症的个体提供治疗有效量的免疫效应细胞。可以通过任何合适类型的方法(例如细胞学、组织学等,并且可以包括分析来自该个体的一个或多个样品的DNA、RNA和/或蛋白质)将该个体诊断为患有癌症。在特定情况下,诊断可包括一种或多种方法来分析液体或组织(例如血液、尿液、精液和/或脑脊髓液中)的一种或多种特定化合物:影像学检查、CT扫描、PET扫描和/或活检,在特定情况下包括骨髓穿刺。
在本公开的一些情况下,免疫效应细胞的施用是全身性的,并且在某些情况下,施用可以是肠胃外的。在特定的实施方案中,将免疫效应细胞局部施用于肿瘤。
本公开的实施方案包括抗原阴性肿瘤,其通过分子衔接子变得对抗原重定向的免疫效应细胞敏感,所述分子衔接子包含所述抗原的胞外结构域和对肿瘤细胞表达的抗原特异的scFv的融合体。
在抵消实体瘤的抑制性微环境的一个实施方案中,分子衔接子可以与IL15单独连接和/或共表达和/或与IL15Ra一起连接和/或共表达(作为细胞因子的例子,还包括IL7、IL12、IL18、IL21、IL27或IL33)以支持肿瘤组织中所述免疫效应细胞的存活和功能。
在一个实施方案中,存在治疗个体中癌症的方法,其中将治疗有效量的本发明的免疫效应细胞施用于患有癌症的个体。在这样的实施方案中,所述免疫效应细胞分泌如本文所述的分子衔接子。所述免疫效应细胞可以一次或多次施用于个体。如果将免疫效应细胞多次施用于个体,则两次施用之间的持续时间可以是任何合适的时间,包括大约1-24小时、1-7天、1-4周、1-12个月或1年或更多年。在一些情况下,将表达相同分子衔接子和/或抗原受体的免疫效应细胞通过多于一次施用来施用给个体。在其他情况下,在一次施用中施用表达第一分子衔接子和/或第一抗原受体的免疫效应细胞,并在随后的细胞施用中施用表达第二分子衔接子和/或第二抗原受体的免疫效应细胞。
在一个实施方案中,存在治疗个体中癌症的方法,其包括施用治疗有效量的如本文所述的分子衔接子,其包括一个或更多个肿瘤细胞结合结构域,一个或更多个细胞因子结构域以及一个或更多个抗原受体靶结构域(例如抗原的部分或全部),并且还施用治疗有效量的表达一种或多种抗原受体的细胞,例如表达本发明的抗原受体的免疫效应细胞。在这样的情况下,所述分子衔接子被提供给所述个体,而不是由被给予个体的细胞在体内产生分子衔接子。因此,本公开的方法包括过继免疫疗法与包含所述分子衔接子的药物组合物的施用的结合。在某些情况下,所述分子衔接子的施用和表达一种或多种抗原受体的细胞的施用是同时发生的,尽管在其他情况下,施用的发生在不同的时间。当施用所述分子衔接子和施用表达一种或多种抗原受体的细胞同时发生时,所述施用可以具有或可以不具有相同的施用途径。当施用所述分子衔接子和施用表达一种或多种抗原受体的细胞在不同的时间发生时,所述施用可以具有或可以不具有相同的施用途径。当施用所述分子衔接子和施用表达一种或多种抗原受体的细胞在不同的时间发生时,两次施用之间的持续时间可以是大约1-60秒、1-60分钟、1-24小时、1-7天、1-4周、1-12个月或1年或更多年。在至少一些情况下,一种或多种抗原受体靶向的抗原是与抗原受体靶结构域相同的抗原。在特定的实施方案中,抗原受体靶向的抗原是与待治疗的肿瘤细胞上的抗原不同的抗原。
在一些实施方案中,存在治疗个体中癌症的方法,其包括施用治疗有效量的分子衔接子,所述分子衔接子包含(a)靶向肿瘤细胞上的第一或第二抗原的一个或多个肿瘤细胞结合结构域(例如抗体片段,包括scFv)和(b)一个或多个细胞因子结构域,并施用治疗有效量的表达针对至少肿瘤细胞上的第一抗原的一种或多种抗原受体的细胞。在这种情况下,本公开的方法包括过继免疫疗法与一种或多种分子衔接子(不由提供给个体的细胞在体内产生)的施用相结合。
在向有需要的个体施用分子衔接子,而该分子衔接子不在个体体内产生的情况下,所述分子衔接子可以通过例如皮下、腹腔内或静脉内注射施用。在向个体提供免疫效应细胞的情况下,可以通过例如腹腔内或静脉内注射来施用细胞。可溶性蛋白可以一次或多次递送给个体。当对个体进行可溶性蛋白的多次施用时,后续施用可与早期施用中的可溶性蛋白相同或不同。
在本公开的任何治疗方法中,接受治疗的个体可正在接受、可已经接受和/或可接受额外的癌症疗法,例如手术、放射疗法、化学疗法、免疫疗法、激素疗法或其组合。
IV.细胞概述
如上所述,本公开的免疫效应细胞至少包括NK细胞、NKT细胞、T细胞、γδT细胞、巨噬细胞、干细胞、粘膜相关不变T(MAIT)细胞、IL细胞、细胞因子诱导的杀伤(CIK)细胞或其混合物。在一些情况下,本文所述的免疫效应细胞已被一种或多种共刺激剂以及本身是人工抗原呈递细胞(其可称为非天然细胞(具有抗原呈递细胞活性))的特定共刺激剂共刺激。在将免疫效应细胞用于个体之前以及在对其工程化以产生所述分子衔接子或表达一种或多种工程化抗原受体之前,可以对其进行TCR刺激和共刺激。
在本公开的特定实施方案中,所述免疫效应细胞衍生自来自被治疗个体的细胞(是自体的),尽管细胞可以来自另一个或更多个个体(同种异基因的)。
在表达异源核酸序列的情况下,“宿主细胞”可以指原核或真核细胞,并且其包括能够复制载体和/或表达由载体编码的异源基因的任何可转化生物。宿主细胞可以并且已经用作载体的接受者。宿主细胞可以被“转染”、“转导”、“转化”、“电穿孔”,或经历外源核酸被转移或引入宿主细胞的任何其他过程。工程化细胞包括原代受试者细胞及其后代。如本文所用,术语“工程化”和“重组”细胞或宿主细胞是指其中已引入外源核酸序列(比如,例如载体)的细胞。因此,重组细胞与不包含重组引入的核酸的天然存在的细胞可区分开。
在某些实施方案中,考虑了RNA或蛋白质序列可以与相同宿主细胞中的其他选择的RNA或蛋白质序列共表达。共表达可以通过将两种或更多种不同的重组载体引入宿主细胞中来实现。替代地,可以构建单个重组载体以包括RNA的多个不同的编码区,然后可以在用该单个载体修饰的宿主细胞中表达它们。
一些载体可以使用允许其在原核和真核细胞中复制和/或表达的控制序列。本领域技术人员将进一步理解孵育所有上述宿主细胞以维持它们并允许载体复制的条件。将允许大规模生产载体以及生产由载体编码的核酸及其同源多肽、蛋白质或肽的技术和条件也被理解和知晓。
在本公开中使用的免疫效应细胞和宿主细胞是真核细胞,包括哺乳动物细胞,但是原核细胞可用于载体重组工程化或DNA整合入载体的操作。所述细胞尤其是人的,但是可以例如与任何目标动物相关,特别是驯养的动物,例如马、牛、鼠、羊、犬、猫等,以用于它们各自的动物中。在其他实施方案中,所述细胞是细胞系,例如市售细胞系。
所述免疫效应细胞可以是自体细胞、同基因细胞、同种异基因细胞,甚至在某些情况下是异种细胞,例如相对于接受细胞的个体而言。可以这样修饰细胞:通过改变主要组织相容性复合物(“MHC”)谱,通过失活β
可以将编码抗原受体如CAR和/或分子衔接子的表达载体作为一种或多种DNA分子或构建体引入细胞,其中可以存在至少一种允许选择包含构建体的宿主细胞的标志物。可以以常规方式制备构建体,其中可以适当地将基因和调控区分离、连接、克隆在合适的克隆宿主中,通过限制性酶切或测序或其他方便的方法进行分析。特别地,使用PCR,可以分离单个片段(包括全部或部分功能单元),其中可以适当地使用“引物修补”、连接、体外诱变等引入一个或多个突变。一旦完成并证明具有适当的序列,构建体就可以通过任何方便的方式引入细胞中。可以将构建体整合并包装入非复制的、有缺陷的病毒基因组,例如腺病毒、腺相关病毒(AAV)或单纯疱疹病毒(HSV)或其他,包括逆转录病毒或慢病毒载体,以进行感染或转导到细胞中。如果需要,构建体可以包括病毒序列用于转染。替代地,可通过融合、电穿孔、基因枪法、转染、脂质体转染等引入构建体。可以在引入构建体之前使宿主细胞在培养中生长并扩增,然后进行适当的处理以引入构建体和整合构建体。然后借助构建体中存在的标志物扩增和筛选细胞。可以成功使用的各种标志物包括hprt、新霉素抗性、胸苷激酶、潮霉素抗性等。
在许多情况下,可能希望能够杀死经过修饰的细胞,例如,在希望终止治疗的、细胞变成赘生的、研究中关注细胞在存在之后消失的或其他的情况下。为此目的,可以提供某些基因产物的表达,其中可以在受控条件下杀死修饰的细胞。自杀基因产物,例如胱天蛋白酶9,是此类产物的实例。
作为说明,可以如下治疗癌症患者或易患癌症或怀疑患有癌症的患者。可以将如本文所述修饰的细胞施用于患者并保持延长的时间。个体可以接受一次或多次细胞施用。所述细胞将被修饰并提供给有需要的个体。
V.多核苷酸
本公开还涵盖组合物,其包含编码如本文定义的分子衔接子和抗原受体的核酸序列以及具有该核酸序列的细胞。在特定方面,该核酸分子是重组核酸分子,并且可以是合成的。它可包含DNA、RNA以及PNA(肽核酸),或者可以是其杂合体。
此外,出于进一步的目的,考虑了核酸分子可包含例如硫酯键和/或核苷酸类似物。修饰可用于稳定核酸分子(针对细胞中的内切和/或外切核酸酶)。所述核酸分子可以通过包含嵌合基因的合适载体转录,所述嵌合基因允许所述核酸分子在细胞中转录。在这方面,还应理解,此类多核苷酸可用于“基因靶向”或“基因治疗”方法。在另一个实施方案中,所述核酸分子被标记。检测核酸的方法是本领域众所周知的,例如Southern和Northern印迹、PCR或引物延伸。该实施方案可用于在基因治疗方法中用于验证上述核酸分子的成功引入的筛选方法。
所述核酸分子可以是重组产生的嵌合核酸分子,其包含任何上述核酸分子(单独或组合)。在特定方面,所述核酸分子是载体的一部分。
因此,本公开还涉及包含载体的组合物,所述载体包含本公开中描述的核酸分子。
分子生物学领域的技术人员已知许多合适的载体,其选择取决于所需的功能并且包括质粒、粘粒、病毒、噬菌体和其他在基因工程中常规使用的载体。本领域技术人员众所周知的方法可用于构建各种质粒和载体;参见,例如,Sambrook等人(1989)和Ausubel,Current Protocols in Molecular Biology,Green Publishing Associates and WileyInterscience,N.Y.(1989),(1994)。替代地,可以将本公开的多核苷酸和载体重构入脂质体,以递送至靶细胞。克隆载体可用于分离DNA单个序列。可以将相关序列转移到需要特定多肽表达的表达载体中。典型的克隆载体包括pBluescript SK、pGEM、pUC9、pBR322和pGBT9。典型的表达载体包括pTRE、pCAL-n-EK、pESP-1、pOP13CAT。
在特定的实施方案中,存在包含核酸序列的载体,该核酸序列是可操作地连接至编码如本文所定义的抗原受体(优选为CAR或TCR)和/或分子衔接子的核酸序列的调控序列。这样的调控序列(控制元件)是本领域技术人员已知的,并且可以包括用于将插入物引入载体的启动子、剪接盒、翻译起始密码子、翻译和插入位点。在特定的实施方案中,所述核酸分子可操作地连接至所述表达控制序列,从而允许在真核或原核细胞中表达。
术语“调控序列”是指实现与它们连接的编码序列的表达所必需的DNA序列。这些控制序列的性质取决于宿主生物而不同。在原核生物中,控制序列通常包括启动子、核糖体结合位点和终止子。在真核生物中,控制序列通常包括启动子、终止子,在某些情况下包括增强子、反式激活子或转录因子。术语“控制序列”旨在至少包括表达所必需的所有组分,并且还可以包括其他有利的组分。
术语“可操作地连接”是指并列(juxtaposition),其中所描述的组分处于允许它们以其预期方式发挥功能的关系。“可操作地连接”至编码序列的控制序列以编码序列的表达在与控制序列相容的条件下实现的方式连接。在控制序列是启动子的情况下,对于本领域技术人员显而易见的是,优选使用双链核酸。
如本文所用,术语“融合的”或其衍生词是指两个或更多个实体连接为单个分子。作为示例,在一些情况下,IL15与IL15Ra融合为单个分子,而不是如自然界中存在的作为分开的分子。
考虑了在某些实施方案中,载体是表达载体,其包含编码如本文定义的抗原受体的核酸分子。在特定方面,所述载体是病毒载体,例如慢病毒或逆转录病毒载体。慢病毒和逆转录病毒载体可商购,包括例如购自Clontech(Mountain View,CA)或GeneCopoeia(Rockville,MD)。
用于确保在原核生物和/或真核细胞中表达的表达载体的调控元件是本领域技术人员众所周知的。就真核细胞而言,它们通常包含确保转录起始的启动子和任选的确保转录终止和转录本稳定的多聚腺苷酸信号。允许在原核宿主细胞中表达的可能的调控元件包括,例如,大肠杆菌中的P
除了负责转录起始的元件之外,此类调控元件还可在多核苷酸下游包含转录终止信号,例如SV40-多聚腺苷酸位点或tk-多聚腺苷酸位点。此外,取决于所使用的表达系统,可以将能够将多肽引导至细胞区室或将其分泌至培养基中的前导序列添加至所述核酸序列的编码序列中,并且是本领域众所周知的。所述前导序列在适当的阶段与翻译、起始和终止序列组装在一起,优选地,前导序列能够将翻译的蛋白质或其一部分的分泌引导到周质空间或胞外介质中。任选地,异源序列可以编码分子衔接子,该分子衔接子包括N末端识别肽,其赋予所需特性,例如使表达的重组产物稳定或使表达的重组产物的纯化简化;参见同上。在这种情况下,合适的表达载体是本领域已知的,例如冈山-伯格(Okayama-Berg)cDNA表达载体pcDV1(Pharmacia)、pEF-Neo、pCDM8、pRc/CMV、pcDNA1、pcDNA3(Invitrogen)、pEF-DHFR和pEF-ADA(Raum等人Cancer Immunol Immunother(2001)50(3),141-150)或pSPORT1(GIBCO BRL)。
在一些实施方案中,所述表达控制序列是能够转化转染真核宿主细胞的载体中的真核启动子系统,但是也可以使用原核宿主的控制序列。一旦将载体掺入合适的宿主中,就将所述宿主维持在适合核苷酸序列高水平表达的条件下,并且根据需要,可以随后收集和纯化本公开的多肽。在特定实施方案中,一个或多个可编码序列由对低氧环境有响应的表达控制序列所调控。
其他调控元件可包括转录增强子和翻译增强子。有利地,本发明的上述载体包含可选择的和/或可评分的标记。用于选择转化细胞的选择标记基因是本领域技术人员众所周知的,并且包括例如抗代谢物抗性作为dhfr选择的基础,其赋予了对氨甲蝶呤的抗性(Reiss,Plant Physiol.(Life-Sci.Adv.)13(1994),143-149);npt,其赋予对氨基糖苷类新霉素、卡那霉素和巴龙霉素的抗性(Herrera-Estrella,EMBO J.2(1983),987-995)和hygro,其赋予其对潮霉素的抗性(Marsh,Gene 32(1984),481-485)。另外的选择基因已被描述,即trpB,其允许细胞利用吲哚代替色氨酸;hisD,其允许细胞利用histinol代替组氨酸(Hartman,Proc.Natl.Acad.Sci.USA 85(1988),8047);甘露糖6磷酸异构酶,其允许细胞利用甘露糖(WO 94/20627)和ODC(鸟氨酸脱羧酶),其赋予对鸟氨酸脱羧酶抑制剂2-(二氟甲基)-DL-鸟氨酸(2-(difluoromethyl)-DL-ornithine)DFMO的抗性(McConlogue,1987,In:Current Communications in Molecular Biology,Cold Spring Harbor Laboratoryed.)或来自土曲霉(Aspergillus terreus)的脱氨酶,其赋予对灰瘟素S(Blasticidin S)的抗性(Tamura,Biosci.Biotechnol.Biochem.59(1995),2336-2338)。
有用的可评分标志物也是本领域技术人员已知的并且可商购。有利地,所述标志物是编码萤光素酶(Giacomin,Pl.Sci.116(1996),59-72;Scikantha,J.Bact.178(1996),121)、绿色荧光蛋白(Gerdes,FEBS Lett.389(1996),44-47)或β-葡萄糖醛酸酶(Jefferson,EMBO J.6(1987),3901-3907)的基因。该实施方案对于简单快速筛选含有所述载体的细胞、组织和生物特别有用。
如上所述,所述核酸分子可单独或作为载体的一部分在细胞中使用以在细胞中表达编码的多肽。将包含编码任一种所述特异性抗原受体和/或分子衔接子构建体中的DNA或RNA序列的核酸分子或载体引入细胞,所述细胞随即产生目的多肽。所述核酸分子和载体可被设计用于直接导入或通过脂质体导入,或通过病毒载体(例如腺病毒、逆转录病毒)导入细胞。
根据上述,本公开涉及衍生载体的方法,特别是在遗传工程中常规使用的质粒、粘粒、病毒和噬菌体,其包含编码本文定义的构建体的多肽序列的核酸分子。在至少一些情况下,所述载体是表达载体和/或基因转移或靶向载体。衍生自诸如逆转录病毒、慢病毒、牛痘病毒、腺相关病毒、疱疹病毒或牛乳头瘤病毒的病毒的表达载体可用于将所述多核苷酸或载体递送至靶细胞群中。本领域技术人员熟知的方法可用于构建重组载体;参见,例如,Sambrook等人(loc cit.),Ausubel(1989,loc cit.)或其他标准教科书中描述的技术。替代地,可以将所述的核酸分子和载体重构入脂质体,以递送至靶细胞。可以通过众所周知的方法将含有本公开的核酸分子的载体转移到宿主细胞中,所述方法取决于细胞宿主的类型而变化。例如,氯化钙转染通常用于原核细胞,而磷酸钙处理或电穿孔可用于其他细胞宿主;参见Sambrook(同上)。
VI.药物组合物
根据本公开,术语“药物组合物”涉及向个体施用的组合物。在本公开的特定方面,所述药物组合物包含多个如本文所述的免疫效应细胞。在本公开的某些方面,所述药物组合物包含纯化的本文所述的分子衔接子。在特定的实施方案中,所述药物组合物包含用于肠胃外、经皮、腔内、动脉内、鞘内或静脉内施用或直接注射入癌症的组合物。特别设想通过输注或注射将所述药物组合物施用于所述个体。合适的组合物的施用可以通过不同的方式进行,例如通过静脉内、皮下、腹腔内、肌肉内、表面和/或皮内施用。所述免疫效应细胞可以全身或局部施用于所述个体。
本公开的药物组合物可以进一步包含药学上可接受的运载体。合适的药物运载体的实例是本领域众所周知的,包括磷酸盐缓冲盐溶液、水、乳剂例如油/水乳剂、各种类型的润湿剂、无菌溶液、冷冻保存剂等。可以通过众所周知的常规方法配制包含此类载体的组合物。这些药物组合物可以合适的剂量施用于受试者。
剂量方案将由主治医师和临床因素确定。如医学领域众所周知的,对于任何一名患者的剂量取决于许多因素,包括患者的体型、体表面积、年龄、要施用的特定化合物、性别、施用时间和途径、总体健康状况以及其他同时施用的药物。可以通过定期评估来监控进展。本公开涵盖的免疫效应细胞可以通过静脉内输注施用。本文所述的免疫效应细胞的剂量范围可以从1×10
本公开的组合物可以局部或全身施用。施用通常是肠胃外的,例如静脉内;DNA也可以直接施用至靶位点,例如,通过基因枪递送至内部或外部靶位点或通过导管至动脉中的位点。在优选的实施方案中,所述药物组合物是皮下施用的,在甚至更优选的实施方案中是静脉内施用的。用于肠胃外施用的制剂包括无菌水溶液或非水溶液、悬浮液和乳剂。非水溶剂的实例是丙二醇、聚乙二醇,植物油例如橄榄油和可注射的有机酯例如油酸乙酯。水性载体包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外载体包括氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏液或不挥发性油。静脉内媒介物包括液体和营养补充剂、电解质补充剂(例如基于林格氏葡萄糖的补充剂)等。也可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂、冷冻保存剂和惰性气体等。另外,本发明的药物组合物可包含蛋白质载体,例如血清白蛋白或免疫球蛋白,优选人源的。可以考虑,根据所述药物组合物的预期用途,本公开的药物组合物除了可包含CAR构建体或编码它们的核酸分子或载体(如本公开所述)外,还可包含其他生物活性剂。
VII.本公开试剂盒
本文所述的任何免疫效应细胞组合物和/或产生免疫效应细胞的试剂可包含在试剂盒中。在非限制性实例中,试剂盒中可包含细胞或操作细胞的试剂。在某些实施方案中,试剂盒中可以包含NKT细胞或包含NKT细胞的细胞群。这样的试剂盒可以具有或可以不具有一种或多种用于操作细胞的试剂。这样的试剂包括例如小分子、蛋白质、核酸、抗体、缓冲液、引物、核苷酸、盐和/或其组合。试剂盒中可包含编码一种或多种细胞因子的核酸或细胞因子本身。试剂盒中可包含蛋白质,例如细胞因子或抗体,包括激动性单克隆抗体。包含抗体的基底,或裸露的基底本身,可以包含在试剂盒中,在一些实施方案中,试剂盒中包含产生带有抗体的基底的试剂。所述基底可以是任何类型,包括珠或板。试剂盒中可以包含具有抗原呈递细胞活性的细胞或产生其的试剂。试剂盒中可能包含编码嵌合抗原受体(CAR)和/或T细胞受体的核酸,包括产生其的试剂。
在特定方面,所述试剂盒包含本文所述的免疫效应细胞和/或纯化的分子衔接子,以及还包括另一种癌症疗法。在一些情况下,除了细胞疗法的实施方案外,所述试剂盒还包括第二种癌症疗法,例如化学疗法、激素疗法和/或免疫疗法,例如检查点抑制剂。所述试剂盒可以针对个体的特定癌症而定制,并且包括针对个体的相应的第二癌症疗法。
所述试剂盒可包含适当等分的本发明的组合物。所述试剂盒的组分可以包装在水性介质中或以冻干形式包装。所述试剂盒的容器装置通常将至少包括一个小瓶(vial)、试管、培养瓶、瓶(bottle)、注射器或其他容器装置,组分可以被放置在其中,并且优选适当地等分。如果试剂盒中有多个组分,则试剂盒通常还可以包含第二、第三或其他额外的容器,可以在其中分别放置另外的成分。然而,在一个小瓶中可以包含各种组分的组合。本发明的试剂盒通常还将包括密闭保存用于容纳组合物的装置和任何其他试剂容器以用于商业销售。这样的容器可包括将所需的小瓶保留在其中的注塑或吹塑容器。
当试剂盒的组分以一种和/或多种液体溶液提供时,所述液体溶液是水溶液,特别优选无菌水溶液。在这种情况下,容器装置本身可以是袋、注射器、移液管和/或其他类似的装置,从中可以将制剂施加至身体的患处,注射到动物中,和/或甚至施加至和/或与试剂盒的其他组分混合。当免疫效应细胞是所述试剂盒的组分时,可以以冷冻形式提供它们,并添加一种或多种冷冻保存剂。在这种情况下,所述试剂盒可包含用维持细胞生存力的方式解冻冷冻细胞的组分。但是,试剂盒的组分或其部分可以以干粉的形式提供。当试剂和/或组分以干粉形式提供时,所述粉末可通过添加合适的溶剂来重构。可以考虑,也可在另一个容器装置中提供所述溶剂。
VIII.联合治疗
在本发明的某些实施方案中,用于临床方面的本公开的方法与可有效治疗过度增殖性疾病的其他试剂例如抗癌试剂组合。“抗癌”剂能够例如通过杀死癌细胞、诱导癌细胞的凋亡、降低癌细胞的生长速率、降低转移的发生率或数量、减小肿瘤大小、抑制肿瘤生长、减少向肿瘤或癌细胞的血液供应、促进针对癌细胞或肿瘤的免疫应答、预防或抑制癌症的进展或延长患有癌症的受试者的寿命来负面影响受试者中癌症。更一般地,将以有效杀死或抑制细胞增殖的组合量提供这些其他组合物。该过程可能涉及癌细胞与表达构建体和试剂或多种因子同时接触。这可以通过使细胞与包含两种试剂的单一组合物或药理制剂接触,或使细胞与两种不同的组合物或制剂(其中一种组合物包含所述表达构建体,另一种包含表达第二试剂)同时接触来实现。
肿瘤细胞对化疗剂和放疗剂的抵抗性代表了临床肿瘤学中的主要问题。当前癌症研究的一个目标是找到方法以改善化疗和放疗的功效(通过将其与细胞疗法结合)。在本发明的上下文中,考虑细胞疗法可以类似地使用,与例如化学疗法、放射疗法或免疫疗法干预结合。
本公开的疗法可以在其他药剂治疗之前或之后,间隔从几分钟到几周。在将其他药剂和本发明方法分别应用于个体的实施方案中,通常将确保在每次递送之间没有明显的时间间隔,以使该药剂和本发明的疗法仍将能够对细胞发挥有利地组合的作用。在这样的情况下,考虑可以在彼此的约12-24h之内,并且在至少一些情况下在彼此的约6-12h之内,将细胞与两种用药程式接触。然而,在一些情况下,可能希望将治疗时间段显著延长,其中各自施用之间的间隔为几天(2、3、4、5、6或7)到几周(1、2、3、4、5、6、7或8)。预期将根据需要重复治疗周期。还考虑可将各种标准疗法(以及手术干预)与本发明的细胞疗法组合应用。
A.化学疗法
在一些实施方案中,本公开的方法与化学疗法一起、或在化学疗法之前、或在化学疗法之后使用。所述化学疗法可以是任何种类的。在特定的实施方案中,所述化学疗法包括阿霉素PFS(盐酸阿霉素);阿霉素RDF(盐酸阿霉素);克拉芬(环磷酰胺);环磷酰胺;环磷酰胺(Cytoxan)(环磷酰胺(Cyclophosphamide));盐酸阿霉素;Neosar(环磷酰胺);VincasarPFS(硫酸长春新碱);和/或硫酸长春新碱类。癌症疗法还包括多种组合疗法(与化学疗法和放射疗法)。组合化学疗法包括,例如,abraxane、altretamine、多西他赛、赫赛汀、氨甲蝶呤、novantrone、zoladex、顺铂(CDDP)、卡铂、前卡巴嗪、氮芥(mechlorethamine)、环磷酰胺、喜树碱、异环磷酰胺、美法仑、苯丁酸氮芥(chlorambucil)、白消安、亚硝基脲、更生霉素、道诺霉素、阿霉素、博来霉素、plicomycin、丝裂霉素、依托泊苷(VP16)、他莫昔芬、雷洛昔芬、雌激素受体结合剂、紫杉醇、吉西他滨、那韦尔滨、法呢基蛋白转移酶抑制剂、反铂、5-氟尿嘧啶、长春新碱、长春花碱和氨甲蝶呤,或前述的任何类似物或衍生变体。
B.放射疗法
引起DNA损伤并已被广泛使用的其他因素包括通常被称为γ射线、X射线、质子束、电子束和/或放射性同位素向肿瘤细胞的定向递送。也可以考虑其他形式的DNA损伤因子,例如微波和UV辐射。所有这些因素很可能对DNA、DNA前体、DNA复制和修复以及染色体组装和维持造成广泛的损害。
当施加于细胞时,术语“接触的”和“暴露的”在本文中用于描述将治疗性构建体和化学治疗剂或放射治疗剂递送至靶细胞或与之直接并列放置的过程。为了实现细胞杀伤或停滞(stasis),两种药剂以有效杀死细胞或阻止其分裂的组合量递送至细胞。
C.免疫疗法
免疫治疗剂通常依赖于使用免疫效应细胞和分子来靶向和破坏癌细胞,并且在此特定实施方案中,所述免疫治疗剂不同于本公开的免疫治疗剂。免疫效应剂可以是,例如,对肿瘤细胞表面的一些标记具有特异性的抗体。所述抗体单独可以充当治疗的效应子,或其可以募集其他细胞来实际实现细胞杀伤。该抗体可以是检查点抑制剂,例如伊匹单抗(ipilimumab)、纳武单抗(nivolumab)或派姆单抗(pembrolizumab)。所述抗体也可以与药物或毒素(化学治疗剂、放射性核素、蓖麻毒蛋白A链、霍乱毒素、百日咳毒素等)缀合,而仅用作靶向剂。可替代地,可以使用非抗体分子来调节免疫系统。可替代地,所述效应剂可以是带有表面分子的淋巴细胞,该表面分子与肿瘤细胞靶标直接或间接相互作用。各种免疫效应细胞包括细胞毒性T细胞和NK细胞。在优选的实施方案中,所述免疫效应细胞是或包含NKT细胞。
因此,免疫疗法可以用作联合疗法的一部分,与本发明的细胞疗法结合。联合疗法的一般方法通常是肿瘤细胞带有一些适合靶向的标志物,即不存在于一些或大多数其他细胞上。存在许多肿瘤标志物,并且在与本公开的那些一起使用的免疫疗法的背景下,这些肿瘤标志物中的任何一个都可能适于靶向。常见的肿瘤标志物包括癌胚抗原、前列腺特异性抗原、泌尿肿瘤相关抗原、胎儿抗原、酪氨酸酶(p97)、gp68、TAG-72、HMFG、Sialyl Lewis抗原、MucA、MucB、PLAP、雌激素受体、层粘连蛋白受体、erb B和p155。
D.基因
在另一个实施方案中,第二治疗是基因疗法,其中在本发明临床实施方案之前、之后或同时施用治疗性多核苷酸。本发明涵盖多种表达产物,包括细胞增殖的诱导剂、细胞增殖的抑制剂或程序性细胞死亡的调节剂。
E.手术
大约60%的癌症患者将接受某种类型的手术,包括预防性、诊断性或分期、治疗性和姑息性手术。治疗性手术是可以与其他疗法(例如本发明的治疗、化学疗法、放射疗法、激素疗法、基因疗法、免疫疗法和/或替代疗法)结合使用的癌症治疗。
手术包括切除,其中全部或部分癌组织被物理去除、切除和/或破坏。肿瘤切除是指至少部分肿瘤的物理去除。除肿瘤切除外,手术治疗还包括激光手术、冷冻手术、电外科手术和显微控制手术(莫氏手术)。还考虑本发明可以与浅表癌、癌前病变或附带的正常组织的去除结合使用。
在切除部分或全部癌细胞、组织或肿瘤后,体内可形成腔。可以通过灌注、直接注射或对该区域进行局部施用来完成治疗(与额外的抗癌疗法)。这种治疗可以重复,例如,可以每1、2、3、4、5、6或7天,或者每1、2、3、4和5周或每1、2、3、4、5、6、7、8、9、10、11或12个月。这些治疗也可以具有不同的剂量。
F.其他试剂
考虑了其他试剂可以与本发明的方法和组合物组合使用以改善治疗的疗效。这些额外的试剂包括免疫调节剂,影响细胞表面受体和GAP连接的上调的试剂,细胞生长抑制和分化试剂,细胞粘附抑制剂或增加过度增殖细胞对凋亡诱导剂敏感性的试剂。免疫调节剂包括肿瘤坏死因子;干扰素α、β和γ;IL-2和其他细胞因子;F42K和其他细胞因子类似物;或MIP-1、MIP-1β、MCP-1、RANTES和其他趋化因子。还考虑了细胞表面受体或其配体例如Fas/Fas配体、DR4或DR5/TRAIL的上调将通过建立对过度增殖细胞的自分泌或旁分泌作用来增强对本发明的细胞或组合物的凋亡诱导。通过增加GAP连接数增加细胞间信号转导可增加对邻近的过度增殖细胞群的抗过度增殖作用。在其他实施方案中,细胞抑制剂或分化剂可以与本发明组合使用以改善治疗的抗过度增殖功效。考虑了细胞粘附抑制剂可改善本发明的功效。细胞粘附抑制剂的实例是粘着斑激酶(FAK)抑制剂和洛伐他汀。还考虑了可以将增加过度增殖细胞对凋亡的敏感性的其他试剂,例如抗体c225,与本发明组合使用,以改善治疗功效。
实施例
包括以下实施例以说明本发明的优选实施方案。本领域技术人员应该理解,以下实施例中公开的技术代表本发明人发现的在本发明的实践中发挥良好作用的技术,因此可以认为构成其实践的优选方式。然而,根据本公开,本领域技术人员应当理解,可以在所公开的特定实施方案中进行许多改变,并且在不脱离本发明的精神和范围的情况下仍可获得同样或相似的结果。
实施例1
分子衔接子实例的设计和测试
为了测试本公开的特定实施方案,构建了逆转录病毒载体,其表达1)CAR19,其由源自鼠单克隆抗体FMC-63的抗CD19单链可变片段(scFv)(通过短间隔子连接)和来自人CD8的跨膜结构域、CD28共刺激结构域和CD3ζT细胞活化结构域组成;2)分子衔接子构建体,其编码CD19截断的胞外结构域(CD19胞外),衍生自对GD2神经节苷脂具有特异性(抗GD2)的14g2a mAb的scFv,有或没有人IL15(IL15)、人IL15Ra(IL15Ra)或IL15RA-IL15复合物。IL-15或IL15RA-IL15与CD19的胞外一起被表达为融合蛋白(例如抗GD2-CD19-IL15),或被表达为单独分泌的蛋白(例如抗GD2-CD19.IL15)。具有14g2a scFv、CD28共刺激结构域和CD3ζT细胞活化结构域的抗GD2 CAR(CARGD2)用作阳性对照(图1)。在FMC63和14g2a scFv的开头包含了来自人IgG重链的信号肽序列,以确保表达的CAR蛋白插入细胞膜中,并且表达的分子衔接子蛋白从细胞中分泌出去。本领域技术人员将理解,可以使用其他信号肽序列。
实施例2
NKT中分子衔接子的表达及体外功能活性测试
用分子衔接子构建体逆转录病毒转导人NKT细胞导致CAR19在细胞表面上的有效表达(图2A)和此类衔接子的分泌。如流式细胞术测定,用抗GD2-CD19分子衔接子转导的淋巴细胞上清液处理后,CD19阴性/GD2阳性的CHLA-255成神经细胞瘤细胞变为CD19阳性。仅用抗GD2(无CD19胞外)转导的淋巴细胞的上清液不会导致CHLA-255细胞变为CD19阳性。在相同的处理后,CD19阴性/GD2阴性的LAN-6成神经细胞瘤细胞仍保持CD19阴性(图2B)。表达包括CD19胞外在内的所有受检分子衔接子构建体的CAR19NKT细胞证明了对CHLA-255成神经细胞瘤细胞的剂量依赖性体外细胞毒性,该毒性与表达CARGD2的NKT细胞介导的细胞毒性(作为阳性对照)相当。相反,没有CD19结构域的分子衔接子阴性对照(CAR19.抗GD2)不能诱导CAR19 NKT细胞对CHLA-255细胞的细胞毒性(图3)。
实施例3
表达分子衔接子构建体的NKT细胞的体内抗肿瘤活性测试
为了测试表达分子衔接子构建体的NKT细胞的体内抗肿瘤活性,我们使用了先前描述的NSG小鼠中转移性成神经细胞瘤的模型(9)。给小鼠注射10
实施例4
基于前导候选物设计的附加分子衔接子构建体的产生
与非活性类似物相比,具有治疗活性的构建体(CAR19.抗GD2-CD19-IL15-IL15Ra)的独特特征如下:1)IL15和IL15Rα都存在,而不是仅IL15或仅IL15Ra存在;2)IL15和IL15Rα与CD19融合,因此在肿瘤细胞表面上以与CD19(靶抗原)紧密分子接近度的形式呈递给CAR19 NKT,而不是以可溶性形式呈递给CAR19NKT。为了进一步探索对分子衔接子活性的关键要求,我们探寻了前导构建体的活性将如何受到以下因素的影响:1)IL15融合到IL15R的方向的逆转;2)使IL15Ra与CD19融合,同时使IL15作为可溶性蛋白分泌。为了解决这些问题,本发明人设计了以下构建体:CAR19.抗GD2-CD19-IL15Rα、CAR19.抗GD2-CD19-IL15RA.IL15、CAR19.抗GD2-CD19-IL15Rα-IL15(图5)。
实施例5
表达前导分子衔接子类似物的NKT细胞的表达及体外功能活性
在产生图5中描述的构建体之后,测试了它们在NKT细胞中的表达,并且使用GD2阳性和GD2阴性的成神经细胞瘤细胞系作为靶标进行了体外细胞毒性测试(图6)。新的构建体可以在NKT中有效表达(图6A),并介导与原始前导构建体相似水平的GD2特异性细胞毒性(图6B)。
实施例6
表达前导分子衔接子类似物的NKT细胞的体内抗肿瘤活性测试
为了测试表达前导分子衔接子和新类似物的NKT细胞的体内抗肿瘤活性,使用与图4中描述的相同的模型进行体内治疗实验。原始前导构建体可再现地介导有效的治疗活性(图7)。相反,新类似物均未显示出显著的抗肿瘤活性。这些结果表明,至少在一些实施方案中,优选使IL15和IL15Rα两者以一种限定的方向融合并且与靶抗原在肿瘤细胞表面上共呈递。然而,本领域技术人员将认识到,组分的不同排列对于不同的分子衔接子可能是有用的,并且将意识到可以通过普通实验确定特定的排列。
实施例7
工程化反式表达IL15增强GD2特异性CAR NKT细胞在成神经细胞瘤异种模型中的治疗功效
Vα24不变的自然杀伤T细胞(NKT)是对于肿瘤特异性嵌合抗原受体(CAR)的表达有吸引力的效应剂(由于它们的天然抗肿瘤性质和在成神经细胞瘤(NB)和其他实体瘤中优先定位于肿瘤部位的能力)。先前已证明,在NOD/SCID/IL-2Rγ
序列实例
MEFGLSWLFLVAILKGVQCSRDIQMTQTTSSLSASLGDRVTISCRASQDISKYLNWYQQKPDGTVKLLIYHTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPYTFGGGTKLELKRGGGGSGGGGSGGGGSGGGGSEVQLQQSGPGLVAPSQSLSVTCTVSGVSLPDYGVSWIRQPPRKGLEWLGVIWGSETTYYNSALKSRLTIIKDNSKSQVFLKMNSLQTDDTAIYYCAKHYYYGGSYAMDYWGQGTTVTVSSTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR(SEQ ID NO:1)
MEFGLSWLFLVAILKGVQCSRDILLTQTPLSLPVSLGDQASISCRSSQSLVHRNGNTYLHWYLQKPGQSPKLLIHKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYFCSQSTHVPPLTFGAGTKLELKRADAAPTVSIFPGSGGGGSGGEVKLQQSGPSLVEPGASVMISCKASGSSFTGYNMNWVRQNIGKSLEWIGAIDPYYGGTSYNQKFKGRATLTVDKSSSTAYMHLKSLTSEDSAVYYCVSGMEYWGQGTSVTVSSTRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR(SEQ ID NO:2)
ESKYGPPCPSCP(SEQ ID NO:3)
CD19胞外:
PEEPLVVKVEEGDNAVLQCLKGTSDGPTQQLTWSRESPLKPFLKLSLGLPGLGIHMRPLAIWLFIFNVSQQMGGFYLCQPGPPSEKAWQPGWTVNVEGSGELFRWNVSDLGGLGCGLKNRSSEGPSSPSGKLMSPKLYVWAKDRPEIWEGEPPCLPPRDSLNQSLSQDLTMAPGSTLWLSCGVPPDSVSRGPLSWTHVHPKGPKSLLSLELKDDRPARDMWVMETGLLLPRATAQDAGKYYCHRGNLTMSFHLEITARPVLWHWLLRTGGWK(SEQ ID NO:4)
RAEGRGSLLTCGDVEENPGP(SEQ ID NO:5)
ATNFSLLKQAGDVEENPGP(SEQ ID NO:6)
GGGGSGGGGSGGGSLQGTTC(SEQ ID NO:7)
SGGGSGGGGSGGGGSGGGGSGGGSLQ(SEQ ID NO:8)
MRISKPHLRSISIQCYLCLLLNSHFLTEAGIHVFILGCFSAGLPKTEANWVNVISDLKKIEDLIQSMHIDATLYTESDVHPSCKVTAMKCFLLELQVISLESGDASIHDTVENLIILANNSLSSNGNVTESGCKECEELEEKNIKEFLQSFVHIVQMFINTS(SEQ ID NO:9)
MAPRRARGCRTLGLPALLLLLLLRPPATRGITCPPPMSVEHADIWVKSYSLYSRERYICNSGFKRKAGTSSLTECVLNKATNVAHWTTPSLKCIRDPALVHQRPAPPSTVTTAGVTPQPESLSPSGKEPAASSPSSNNTAATTAAIVPGSQLMPSKSPSTGTTEISSHESSHGTPSQTTAKNWELTASASHQPPGVYPQGHSDTT(SEQ ID NO:10)
MEFGLSWLFLVAILKGVQCDVHLQESGPDLVKPSQSLSLTCTVTGYSITSGYTWHWIRQFPGNTVEWMetGYIQYTGSTRYNPALRGRLSISRDTSKNQFFLQLISVTTADTGTYFCARGTTASFDYWGQGTTLTVASAGSAGGGGSGGGGSGGGGSDIVMSQSPSSLNVSVGEKVTMRCRSSQSLLYSSDQKNYLTWYQQKPGQSPKLLISWASTRASGVPDRFTGSGSGTDFTLTISSVKAEDLGVYYCQQYFIYPLTFGVGTKLGLKAAA(SEQ ID NO:11)
MEFGLSWLFLVAILKGVQCSRQVQLVESGGGVVQPGRSLRLSCAASGFTFSSFGMHWVRQAPGKGLEWVAYISSGSFTIYYADSVKGRFTISRDNSKNTLYLQMNSLRSEDTAMYYCARMRKGYAMDYWGQGTLVTVSSGGGGSGGGGSGGGGSGGGGSDVLMTQTPLSLPVTLGQPASISCRSSQIIIHSDGNTYLEWFQQRPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPHTFGGGTKVEIKP(SEQ ID NO:12)
MEFGLSWLFLVAILKGVQCSRDILLTQTPLSLPVSLGDQASISCRSSQSLVHRNGNTYLHWYLQKPGQSPKLLIHKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYFCSQSTHVPPLTFGAGTKLELKRADAAPTVSIFPGSGGGGSGGEVKLQQSGPSLVEPGASVMISCKASGSSFTGYNMNWVRQNIGKSLEWIGAIDPYYGGTSYNQKFKGRATLTVDKSSSTAYMHLKSLTSEDSAVYYCVSGMEYWGQGTSVTVSSAKTTPPSVYGRVTVSSA(SEQ ID NO:13)
QCTNYALLKLAGDVESNPGP(SEQ ID NO:14)
实施例8
IL15与IL-15Ra共表达
尽管在本公开的特定方面,细胞因子及其受体连接为单个分子,但是本实施例还包括其中细胞因子及其受体最终作为分开的分子产生的实施方案。这包括表达为分开的转录本(无论是否来自相同载体)或表达为单个转录本,然后分开,例如使用间插自切割2A元件。
产生编码具有共刺激结构域(CD28或41BB)的变体的GD2CAR的构建体,其包括IL15;IL15与IL15Rα(作为分开的蛋白质或蛋白质片段共表达);或都不包括。图14示出了这样的构建体的示例。转导至NKT细胞后,使用抗CAR.GD2抗体染色通过流式细胞术确定其表达。图15A显示了对于各个构建体的CAR.GD2的表达,图15B显示了与CAR.GD2.28z和未转导的细胞(均作为对照)相比,CAR.GD2.28z.15(3)的IL.15的表达。
当与IL15Ra共表达时,IL15积聚在NKT细胞表面而不是溶液中,这与本文中分子衔接子实施方案(其中IL15被递送至肿瘤细胞表面)相反(参见至少图12)。当IL15.IL15Rα被保留在NKT细胞表面,所有这些都可用于CAR NKT细胞。当在分泌的衔接子中表达时,仅一部分IL15或IL15.IL15Rα在肿瘤细胞表面被捕获并呈递回NKT细胞。
图16提供了对于三种不同的成神经细胞瘤的细胞介导的细胞毒性,包括GD2阳性(CHLA1255和LA-N-1)或GD2阴性(LA-N-6)。这些图表明了转导的NKT细胞(带有相应构建体)的有效体外细胞毒性。所有构建体以相似的功效介导对GD2阳性肿瘤细胞的特异性剂量依赖性体外杀伤。
还在转移性成神经细胞瘤的小鼠模型中体内测试了不同的构建体。用低剂量的细胞感染小鼠(4×10
参考文献
说明书中提到的所有专利和出版物均指示了本发明所属领域的技术人员的水平。所有专利和出版物都以其全文并入本文作为参考,其程度与每个单独的出版物被明确地和单独地指出以通过引用并入本文相同。
1.Kalos M,June CH.Adoptive T cell transfer for cancer immunotherapyin the era of synthetic biology.Immunity2013;39(1):49-60.
2.Dotti G,Gottschalk S,Savoldo B,Brenner MK.Design and development oftherapies using chimeric antigen receptor-expressing Tcells.Immunol.Rev.2014;257(1):107-126.
3.Scarfo I,Maus MV.Current approaches to increase CAR T cell potencyin solid tumors:targeting the tumor microenvironment.J Immunother Cancer2017;5:28.
4.Pule MA,等人,Virus-specific T cells engineered to coexpress tumor-specific receptors:persistence and antitumor activity in individuals withneuroblastoma.Nat.Med.2008;14(11):1264-1270.
5.Louis CU,等人,Antitumor activity and long-term fate of chimericantigen receptorpositive T cells in patients with neuroblastoma.Blood 2011;118(23):6050-6056.
6.Pegram HJ,Smith EL,Rafiq S,Brentjens RJ.CAR therapy forhematological cancers:can success seen in the treatment of B-cell acutelymphoblastic leukemia be applied to other hematological malignancies?Immunotherapy.2015;7(5):545-561.
7.Heczey A,等人,Invariant NKT cells with chimeric antigen receptorprovide a novel platform for safe and effective cancer immunotherapy.Blood2014;124(18):2824-2833.
8.Song L,等人,Valpha24-invariant NKT cells mediateantitumor activityvia killing of tumor-associated macrophages.J.Clin.Invest 2009;119(6):1524-1536.
9.Liu D,等人,IL-15protects NKT cells from inhibition bytumor-associated macrophages and enhances antimetastatic activity.J.Clin.Invest2012;122:2221-2233.
10.Ochoa MC,等人,Enhancement of antibody-dependent cellularcytotoxicity of cetuximab by a chimeric protein encompassing interleukin-15.Oncoimmunology 1017;7(2):eprint.
11.Godfrey,D.I.,等人,Raising the NKT cell family.Nat Immunol.2010Mar;11(3):197-206.
尽管已经详细描述了本发明及其优点,但是应该理解,在不脱离由所附权利要求书限定的本发明的精神和范围的情况下,可以在此进行各种改变、替换和变更。而且,本申请的范围不旨在限于说明书中描述的过程、机器、制造、物质组成、手段、方法和步骤的特定实施方案。如本领域的普通技术人员将从本发明的公开内容中容易地理解的是,目前存在或将要开发的,执行与本文所述相应实施方案基本上相同的功能或实现与本文所述相应实施方案基本上相同的结果的机器、制造、物质组成、手段、方法或步骤可根据本发明而使用。因此,所附权利要求书旨在将这样的过程、机器、制造、物质组成、手段、方法或步骤包括在其范围内。
- 用于有效免疫治疗的免疫效应细胞和具有抗原-细胞因子复合物的分子衔接子
- 移植了肿瘤细胞的卵用于不存在除移植卵中的免疫效应细胞以外的免疫效应细胞时研究免疫疗法的抗癌有效性的用途
