双功能血脑疗法
文献发布时间:2023-06-19 09:41:38
关于序列表的声明
与本申请相关联的序列表以文本格式代替纸质副本提供,并且在此通过引用并入到本说明书中。包含序列表的文本文件的名称为20056PCT_ST25.txt。该文本文件约为7KB,其创建于2019年3月21日,并将通过EFS-Web电子提交。
技术领域
本发明涉及用于治疗疾病的化合物,包括渗透血脑屏障的化合物。本发明还提供了包含本发明化合物的药物组合物,以及使用所述组合物治疗各种疾病的方法。
背景技术
克服将治疗剂递送到脑部的特定区域的困难对许多中枢神经系统(CNS)疾病(包括脑部的那些)的治疗或诊断提出了重大挑战。在其神经保护作用中,血脑屏障(BBB)起到阻止许多潜在的重要治疗剂递送到脑部的作用。
此外,在诊断和治疗中可能有效的足够量的治疗剂不能穿过BBB。据报道,所有治疗分子中超过95%的治疗分子不能穿过血脑屏障。因此,期望递送治疗剂穿过BBB以治疗疾病。
另外,可以有效治疗脑部疾病的治疗剂也可以用于治疗除了脑部以外的疾病。因此,期望提供治疗受试者的脑部以及脑部以外的疾病(例如,实体瘤或血液系统恶性肿瘤)的方法。
发明内容
根据本发明,提供了通过施用治疗性有效载荷(payload)治疗受试者的脑部疾病的方法,所述治疗性有效载荷包含与某个p97片段偶联的活性剂,所述p97片段使所述活性剂能够穿过BBB。根据本发明,治疗性有效载荷具有与形式为与p97片段非偶联的活性剂相似的药代动力学性质。
借助于本发明,现在可以治疗受试者的脑部疾病,并且还可以治疗受试者的身体(除脑部以外)或血液中的疾病。
在本发明的一个方面,提供了递送治疗性有效载荷穿过受试者的血脑屏障的方法,包括向受试者施用所述治疗性有效载荷,其中所述治疗性有效载荷:(i)包含与p97片段偶联的活性剂,该p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少80%一致的氨基酸序列;以及(ii)提供比非偶联形式的活性剂的AUC
在一方面,治疗性有效载荷提供的AUC
在一方面,p97片段具有一个或多个末端半胱氨酸和/或酪氨酸。
在一方面,p97片段基本上由具有C-末端酪氨酸的DSSHAFTLDELR(SEQ ID NO:2)组成,并且其中p97片段和活性剂由长度为约1-10个氨基酸的肽接头隔开。
在一方面,p97片段基本上由具有C-末端半胱氨酸的DSSHAFTLDELR(SEQ ID NO:2)组成,并且其中p97片段和活性剂由长度为约1-10个氨基酸的肽接头隔开。
在一方面,p97片段基本上由具有N-末端酪氨酸的DSSHAFTLDELR(SEQ ID NO:2)组成,并且其中p97片段和活性剂由长度为约1-10个氨基酸的肽接头隔开。
在一方面,p97片段基本上由具有N-末端半胱氨酸的DSSHAFTLDELR(SEQ ID NO:2)组成,并且其中p97片段和活性剂由长度为约1-10个氨基酸的肽接头隔开。
在一方面,活性剂是小分子、多肽、肽模拟物、类肽、适体,或可检测的实体。
在一方面,小分子是细胞毒性剂或化学治疗剂或抗血管生成剂,其选自烷基化剂、抗代谢物、蒽环类、抗肿瘤抗生素、铂、I型拓扑异构酶抑制剂、II型拓扑异构酶抑制剂、长春花生物碱和紫杉烷中的一种或多种。
在一方面,多肽是抗体或其抗原结合片段。
在一方面,抗体或其抗原结合片段特异性地结合癌症相关的抗原。
在本发明的一个方面,提供了递送治疗性有效载荷穿过受试者的血脑屏障的方法,其包括向受试者施用所述治疗性有效载荷,其中所述治疗性有效载荷:(i)包含与p97片段偶联的活性剂,该p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少80%一致的氨基酸序列;以及(ii)提供比非偶联形式的活性剂的Vz的约173%更小的Vz(ml/kg)。
在一方面,治疗性有效载荷提供的Vz(ml/kg)为非偶联形式的活性剂的Vz的约50%至150%。
在一方面,治疗性有效载荷提供的Vz(ml/kg)为非偶联形式的活性剂的Vz的约80%至125%。
在本发明的一个方面,提供了递送治疗性有效载荷穿过受试者的血脑屏障的方法,其包括向受试者施用所述治疗性有效载荷,其中所述治疗性有效载荷;(i)包含与p97片段偶联的活性剂,该p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少80%一致的氨基酸序列;以及(ii)提供比非偶联形式的活性剂的CL的178%更小的CL(ml/天/kg)。
在一方面,治疗性有效载荷提供的CL(ml/天/kg)为非偶联形式的活性剂的CL的约50%至176%。
在一方面,治疗性有效载荷提供的CL(ml/天/kg)为非偶联形式的活性剂的CL的约80%至125%。
在本发明的一个方面,提供了将治疗性有效载荷与受试者的LRP1受体结合的方法,该方法包括使LRP1受体与所述治疗性有效载荷接触,其中所述治疗性有效载荷;(i)包含与基本上由DSSHAFTLDELR(SEQ D NO:2)组成的p97片段偶联的活性剂;以及(ii)提供比非偶联形式的活性剂的AUC
在本发明的一个方面,提供了通过递送治疗性有效载荷穿过受试者的血脑屏障治疗受试者的脑部第一种疾病的方法,其包括向受试者施用所述治疗性有效载荷,其中所述治疗性有效载荷;(i)包含与p97片段偶联的活性剂,所述p97片段包含与DSSHAFTLDELR(SEQID NO:2)具有至少80%一致性的氨基酸序列;(ii)提供比非偶联形式的活性剂的AUC
在一方面,治疗性有效载荷提供的AUC
在一方面,治疗性有效载荷提供的AUC
在一方面,本发明还包括治疗除了受试者的脑部以外的第二种疾病。
在一方面,治疗性有效载荷施用于所述受试者的颅内以外。
在一方面,治疗性有效载荷通过口服、静脉内、肌内、皮下、注射或输注施用。
在一方面,第一种疾病和第二种疾病是相同的。
在一方面,第一种疾病和第二种疾病是不同的。
在一方面,第一种疾病在受试者脑中以肿瘤或异常的形式存在。
在一方面,第二种疾病在受试者的身体或血液中而非脑中以肿瘤或异常的形式存在。
在一方面,p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少80%一致的氨基酸序列。
在一方面,p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少85%一致的氨基酸序列。
在一方面,p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少90%一致的氨基酸序列。
在一方面,p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少95%一致的氨基酸序列。
在一方面,p97片段包含与DSSHAFTLDELR(SEQ ID NO:2)至少100%一致的氨基酸序列。
在一方面,p97片段包含氨基酸序列,其中的一个氨基酸残基与序列DSSHAFTLDELR(SEQ ID NO:2)不同。
在一方面,p97片段包含氨基酸序列,其中的两个氨基酸残基与序列DSSHAFTLDELR(SEQ ID NO:2)不同。
附图说明
图1A和1B示出了所研究的不同分子的示意图。图1A示出了仅具有NIP228 hIgG1TM抗体的构建体,并作为基因融合体与柔性接头或化学缀合MTf和MTfpep结合。图1B示出了具有NIP228hIgGTM抗体或抗体的Fc片段的构建体,该抗体含有具有止痛作用的治疗分子IL-1RA(阿那白滞素(Kineret)),并在基因融合后与柔性接头MTf或MTfpep结合。
图2A-2D示出了在CD-1雌性小鼠中静脉注射(IV administration)2小时后,基于mAb NIP228的hIgG1TM,不同构建体的脑分布的代表性3D共聚焦图像。图2A示出了用AlexaF647标记的NIP228的分布(红色)。图2B示出了化学缀合至用Alexa F647标记的NIP228的MTf的分布(红色)。图2C示出了化学缀合至用Alexa F647标记的NIP228的MTfpep的分布(红色)。图2D示出了经过渲染(量化)的德克萨斯红(Texas Red)标记的毛细血管(绿色)和化学缀合至用Alexa F647标记的NIP228的MTfpep(红色)的放大表面。
图3示出了在脑软细胞组织中共聚焦荧光显微镜分析和不同分子分布的半定量。
图4A-4C示出了在小鼠PK测试中MTf或MTfpep靶向的IgG的血浆和脑暴露。图4A示出了在两周时间内与非靶向同型对照(NIP228)相比,MTf或MTfpep靶向的hIgG1TM的血浆PK。图4B示出了脑暴露,以每克脑注射剂量%作为量度。图4C示出了脑:血浆比例的比较。
图5A和5B示出了在小鼠PK测试中MTf和MTfpep靶向的IgG-IL-1RA的血浆和脑暴露。图5A示出了在两周时间内与非靶向同型对照(NIP228)相比,靶向融合至IL-1RA的hIgG的MTf和MTfpep的血浆PK。图5B示出了脑暴露,以每克脑注射剂量%作为量度。
图6A和6B示出了MTf-IL-1RA融合对小鼠部分神经结扎模型的镇痛作用。图6A示出了包括MTf和MTfpep的IL-1RA融合构建体与同型对照(NIP228)、载体对照和未结扎的(假手术)对照组的镇痛效果的比较。图6B示出了MTfpep靶向的NIP228 hIgGITM-IL-1RA融合,对部分神经结扎诱导的机械性痛觉过敏的逆转的给药反应。
图7A和7B示出了在SEQ ID NO:2(称为“xB
具体实施方式
提供以下详细描述以帮助本领域技术人员实施本发明。在不脱离本公开的精神或范围的情况下,本领域普通技术人员可以对本文描述的实施方案进行修改和变化。除非另有定义,否则本文使用的所有技术术语和科学术语,具有与本公开所属领域的普通技术人员通常所理解的相同含义。本说明书中使用的术语仅用于描述特定的实施方案,并不意图进行限制。
如在本申请中使用的,除非本文另有明确规定,否则以下每个术语应具有以下阐述的含义。在整个申请中阐述了附加的定义。在本文中未明确定义术语的情况下,本领域普通技术人员将该术语赋予本领域公认的含义,在上下文中将其应用到描述本发明中。
除非上下文另外明确指出,否则冠词“一个(a)”和“一个(an)”是指一个或多于一个(即至少一个)该冠词的语法对象。举例来说,“一个元素”是指一个元素或多于一个元素。
术语“约”是指如本领域普通技术人员所确定的在特定值或组成的可接受误差范围内的值或组成,其将部分取决于如何测量或确定值或组成,即测量系统的局限性。例如,根据本领域的实践,“约”可以表示在1个或大于1个标准偏差内。可替代地,“约”可以意指高达10%或20%(即,±10%或±20%)的范围。例如,约3mg可包括在2.7mg至3.3mg之间(对于10%),或在2.4mg至3.6mg之间(对于20%)的任何数字。此外,特别是关于生物系统或过程,这些术语可以表示一个数量级或一个数值的最多5倍。当在本申请和权利要求书中提供特定值或组成时,除非另有说明,否则“约”的含义应被认为在该特定值或组成的可接受误差范围内。
术语“施用”是指使用本领域技术人员已知的各种方法和递送系统,将包含治疗剂的组合物物理地引入受试者。例如,施用途径可包括颊、鼻内、眼、口、渗透、肠胃外、直肠、舌、局部、透皮、阴道静脉内、肌内、皮下、腹膜内、脊柱或其他肠胃外施用途径,例如通过注射或输注。如本文所用,短语“肠胃外施用”是指除肠内以外并且局部施用的施用方式,通常通过注射,并且包括但不限于静脉内、肌内、动脉内、鞘内、淋巴管内、病灶内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下腔、脊柱内、硬膜外和胸骨内注射和输注,以及体内电穿孔。施用也可以以例如一次、多次,和/或在一个或多个延长的时期内进行,并且可以是治疗有效剂量或亚治疗剂量。
术语“AUC”(曲线下的面积)是指吸收或暴露于受试者的药物总量。通常,AUC可以通过数学方法在受试者的药物浓度随时间变化直到该浓度可忽略不计为止的曲线图中获得。术语“AUC”(曲线下的面积)也可以指在指定时间间隔的部分AUC(如舌下吸收可能会在更早的时间间隔增加AUC)。
如本文所用,术语“氨基酸”旨在表示天然存在和非天然存在的氨基酸,以及氨基酸类似物和模拟物。天然存在的氨基酸包括在蛋白生物合成过程中使用的20(L)-氨基酸以及其他氨基酸,例如4-羟基脯氨酸、羟赖氨酸、锁链素、异锁链素、同型半胱氨酸、瓜氨酸和鸟氨酸。非天然存在的氨基酸包括,例如,(D)-氨基酸、正亮氨酸、正缬氨酸、对-氟苯基丙氨酸、乙硫氨酸等,它们均是本领域技术人员已知的。氨基酸类似物包括修饰形式的天然和非天然存在的氨基酸。这样的修饰可以包括,例如,氨基酸上的化学基团和部分的取代或替换,或通过氨基酸的衍生化。氨基酸模拟物包括,例如,有机结构,其表现出功能上相似的特性,例如参照氨基酸的电荷和电荷间距特征。例如,模仿精氨酸(Arg或R)的有机结构,将在相似的分子空间中具有正电荷部分,并且具有与天然存在的Arg氨基酸的侧链的三个氨基相同的迁移率。模拟物还包括受约束的结构,以便维持氨基酸或氨基酸官能团的最佳间距和电荷相互作用。本领域技术人员知道或可以确定什么结构构成功能上等效的氨基酸类似物和氨基酸模拟物。
术语“癌症”是指各种疾病,其特征在于体内异常细胞的不受控制的生长。不受控制的细胞分裂和生长导致恶性肿瘤的形成,其侵袭邻近组织,并且还可以通过淋巴系统或血液转移到身体的远处。“癌症”包括原发性、转移性和复发性癌症,以及癌前症状,即与癌症风险增加相关的细胞形态异常的状态。术语“癌症”包括但不限于以下增生性疾病:急性淋巴细胞白血病(ALL)、急性髓性白血病(AML)、肾上腺皮质癌、儿童期癌症、与艾滋病(AIDS)有关的癌症,卡波西(Kaposi)肉瘤、与艾滋病有关的淋巴瘤、原发性CNS淋巴瘤、肛门癌、星形细胞瘤、非典型畸胎样瘤/横纹肌样瘤(Atypical Teratoid/Rhabdoid Tumor)、基底细胞癌、皮肤癌(非黑色素瘤)、胆管癌、膀胱癌、骨癌、尤文氏肿瘤族、骨肉瘤和恶性纤维组织细胞瘤、脑干胶质瘤、非典型畸胎样瘤/横纹肌样瘤、胚胎肿瘤、生殖细胞肿瘤、颅咽管瘤、室管膜瘤、乳腺癌、支气管肿瘤、伯基特(Burkitt)淋巴瘤、非霍奇金(Non-Hodgkin)淋巴瘤、类癌瘤、胃肠道癌、心脏(心)肿瘤、原发性淋巴瘤、子宫颈癌、胆管细胞型肝癌、脊索瘤、慢性淋巴细胞性白血病(CLL)、慢性骨髓性白血病(CML)、慢性骨髓增生性肿瘤、结肠癌、结直肠癌、颅咽管瘤、皮肤T细胞淋巴瘤、蕈样肉芽肿和Sézary综合征、导管原位癌(DCIS)、胚胎肿瘤、子宫内膜癌、室膜瘤、食道癌、鼻腔神经胶质瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、眼癌、眼内黑色素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、恶性和骨肉瘤、胆囊癌、胃(胃)癌、胃肠道类癌肿瘤、胃肠道间质瘤(GIST)、生殖细胞肿瘤、卵巢、睾丸、妊娠滋养细胞疾病、胶质瘤、毛细胞白血病、头颈癌、肝细胞(肝)癌、组织细胞增生症、朗格汉斯(Langerhans)细胞、霍奇金淋巴瘤、下咽癌、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、卡波西肉瘤、肾脏、肾细胞、朗格汉斯细胞组织细胞增生症、喉癌、白血病、急性淋巴细胞(ALL)、急性髓样(AML)、慢性淋巴细胞(CLL)、慢性粒细胞(CML)、毛细胞、唇和口腔癌、肝癌(原发性)、肺癌、非小细胞、小细胞、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、巨球蛋白血症、华氏巨球蛋白血症
术语“Cmax”是指药物在施用第一剂量和施用第二剂量之间的受试者的血液、血清、指定的隔室或测试区域的最大浓度。如果指定,术语Cmax也可以指剂量的归一化比率。
在整个说明书中,除非上下文另外要求,否则词语“包括(comprise)”、“包括(comprises)”和“包括(comprising)”将被理解为意指包括陈述的步骤或元素,或步骤或元素的组,但不排除任何其他步骤或元素,或步骤或元素组。“由……组成”是指包括但不限于短语“由……组成”。因此,短语“由……组成”表示所列出的元素是必需的或强制性的,并且没有其他元素可以存在。“基本上由……组成”是指包括在短语之后列出的任何元素,并且限于不干扰或不影响本公开中针对所列要素所指定的活动或动作的其他要素。因此,短语“基本上由……组成”表示所列元素是必需的或强制性的,但其他元素是可选的,并且可以存在或者可以不存在,这取决于它们是否对所列要素的活动或动作产生重大影响。
术语“缀合物”旨在指由于试剂或其他分子例如生物活性分子,与p97多肽共价或非共价附接或连接而形成的实体。缀合物多肽的一个示例是“融合蛋白”或“融合多肽”,即通过连接两个或更多个编码序列而产生的多肽,该编码序列最初编码单独的多肽;连接的编码序列的翻译产生单个融合多肽,通常具有衍生自每个单独多肽的功能特性。
如本文所用,术语“功能”和“功能的”等是指生物学的、酶的或治疗的功能。
“同源性”是指相同或构成保守取代的氨基酸的百分比。同源性可以使用序列比较程序,例如GAP(Deveraux et al.,Nucleic Acids Research.12,387-395,1984)来确定,其通过引用并入本文。以这种方式,与本文引用的序列具有相似或基本不同长度的序列,可以通过将空位插入到比对中进行比较,例如,可以通过GAP使用比较算法确定这些空位。
“分离的”是指材料基本上或实质上不含在其天然状态下通常伴随其的组分。例如,如本文所用,“分离的肽”或“分离的多肽”等,包括从其天然细胞环境以及与细胞其他成分的结合中体外分离和/或纯化肽或多肽分子;即它与体内物质没有明显结合。
本文使用的术语“连接键(linkage)”、“接头”,“接头部分”或“L”是指可用于将p97多肽片段与目标试剂分离,或者将第一试剂与另一试剂分离的接头,例如其中将两种或更多种试剂连接形成p97缀合物。所述接头可以是生理稳定的,或者可以包括可释放的接头,例如可酶降解的接头(例如,蛋白水解可裂解的接头)。在某些方面,接头可以是肽接头,例如作为p97融合蛋白的一部分。在一些方面,接头可以是非肽接头或非蛋白接头。在一些方面,接头可以是颗粒,例如纳米颗粒。
术语“调节”和“改变”包括“增加”、“增强”或“刺激”,以及“减少”或“降低”,通常相对于对照具有统计学上显著或生理上显著的量或程度。“增加”、“刺激”或“增强”的量通常是“统计上显著”的量,并且可以包括为1.1、1.2、2、3、4、5、6、7、8、9、10、15、20、30或更多倍于(例如500、1000倍)(包括介于和大于1之间的所有整数和小数,例如1.5、1.6、1.7、1.8等)不是通过组合物(例如,不存在本发明缀合物的多肽)或对照组合物、样品或测试受试者产生的量。“减少”或“降低”的量通常是“统计上显著”的量,并且可以包括1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%减少量,其不是由组合物或对照组合物(包括之间的所有整数)产生。作为一个非限制性示例,对照可以比较活性,例如穿过血脑屏障的输送/递送的量或速率,分布到中枢神经系统组织的速率和/或水平,和/或用于血浆、中枢神经系统组织的Cmax,或相对于单独的药物,p97-试剂缀合物的任何其他全身或外周非中枢神经系统组织的量或速率。在本文中描述了其他实施例的比较和“统计上显著”的量。
在某些实施方式中,可以具体地定义组合物中任何给定试剂(例如,p97缀合物,例如融合蛋白)的“纯度”。例如,某些组合物可以包括至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯的试剂,包括介于之间的所有小数,通过例如但不限于高压液相色谱(HPLC)进行测量,所述高压液相色谱是一种众所周知的柱色谱形式,其经常用于生物化学和分析化学中分离、识别和定量化合物。
术语“多肽”和“蛋白”在本文中可互换使用,是指氨基酸残基的聚合物及其变体和合成类似物。因此,这些术语适用于氨基酸聚合物,其中一个或多个氨基酸残基为合成的非天然存在的氨基酸,例如相应的天然存在的氨基酸的化学类似物,以及天然存在的氨基酸聚合物。本文所述的多肽不限于产物的具体的长度;因此,多肽的定义中包括肽、寡肽和蛋白,并且除非另外特别指出,否则这些术语在本文中可以互换使用。本文所述的多肽还可包括天然存在和非天然存在的表达后修饰,例如糖基化、乙酰化、磷酸化等,以及本领域已知的其他修饰。多肽可以是完整蛋白,或其子序列、片段、变体或衍生物。
“生理上可裂解的”或“可水解的”或“可降解的”键是在生理条件下与水反应(即被水解)的键。键在水中水解的趋势,不仅取决于连接两个中心原子的连接键的一般类型,还取决于与这些中心原子相连的取代基。适当的水解不稳定或弱连接键包括但不限于:羧酸酯、磷酸酯、酸酐、缩醛、缩酮、酰氧基烷基醚、亚胺、原酸酯、硫代酯、硫醇酯(thiol ester)、碳酸酯,以及腙、肽和寡核苷酸。
“可释放的接头”包括但不限于生理上可裂解的接头和可酶降解的接头。因此,“可释放的接头”是可能经历在生理条件下自发水解,或通过某些其他机制(例如酶催化、酸催化、碱催化等)裂解的接头。例如,“可释放的接头”可以涉及具有质子的碱提取的消除反应(例如,可电离的氢原子、Ha)作为驱动力。为了本文的目的,“可释放的接头”与“可降解的接头”同义。“可酶降解的连接键”包括连接键,例如被一种或多种酶(例如肽酶或蛋白酶)降解的氨基酸序列。在特定的实施方式中,可释放的接头在pH 7.4、25℃(例如生理的pH,人体温度(例如体内))下具有约30分钟、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约12小时、约18小时、约24小时、约36小时、约48小时、约72小时或约96小时或更短的半衰期。
术语“参考序列”通常是指与另一个序列进行比较的核酸编码序列或氨基酸序列。本文所述的所有多肽和多核苷酸序列均作为参考序列包括在内,包括按名称所描述的那些以及在表和序列表中描述的那些。
如本文所用,术语“序列一致性”,或例如包括“与……50%一致的序列”,是指在比较窗口中,序列在逐个核苷酸,或逐个氨基酸上一致的程度。因此,“序列一致性百分比”可以通过在比较窗口中比较两个最佳比对的序列,确定相同的核酸碱基(例如,A、T、C、G、I)或相同的氨基酸残基(例如,Ala、Pro、Ser、Thr、Gly、Val、Leu、lie、Phe、Tyr、Trp、Lys、Arg、His、Asp、Glu、Asn、Gin、Cys和Met)均出现在两个序列中的数目,以产生匹配的位置的数量,并将匹配位置的数量除以比较窗口中的位置总数(即窗口大小),然后将结果乘以100,得出序列一致性的百分比。
包括具有与本文所述任何参考序列的序列(例如参见序列表)具有至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%的序列一致性的核苷酸和多肽,通常在其中多肽变体维持参考多肽的至少一种生物学活性。
用于描述两个或更多个多核苷酸或多肽之间的序列关系的术语包括“参考序列”、“比较窗口”、“序列一致性”、“序列一致性百分比”和“基本上一致性”。“参考序列”的长度为至少12个,但通常为15至18个,并且通常至少为25个单体单元,包括核苷酸和氨基酸残基。
由于两个多核苷酸可以各自包括(1)两个多核苷酸之间相似的序列(即,仅完整的多核苷酸序列的一部分),以及(2)两个多核苷酸之间存在差异的序列,因此通常通过在“比较窗口”上比较两个多核苷酸的序列,以识别和比较序列相似性的局部区域来进行两个(或更多个)多核苷酸之间的序列比较。“比较窗口”是指至少6个连续位置的概念性片段,通常约50至约100个,更通常约100至约150个,其中在将两个序列可选地比对后,将序列与相同数目的连续位置的参考序列进行比较。与参考序列(不包括添加或缺失)相比,比较窗口可包括约20%或更少的添加或缺失(即空位),以使两个序列最优比对。与所述参考序列(不包括添加或缺失)相比,比较窗口可包括约20%或更少的添加或缺失(即空位),以使两个序列最优比对。用于比对比较窗口的序列的最优比对,可以例如通过算法(威斯康星遗传学软件包7.0版中的GAP、BESTFIT、FASTA和TFASTA,遗传学计算机组,科学大道575号,麦迪逊,威斯康星,美国(GAP,BESTFIT,FASTA,and TFASTA in the Wisconsin Genetics SoftwarePackage Release 7.0,Genetics Computer Group,575 Science Drive Madison,WI,USA))的计算机化实施,或通过检查和各种所选方法中的任何一种生成的最优比对(即在比较窗口中导致最高的同源性百分比)得出。还可以参考,例如,Altschul等人,Nucl.AcidsRes.25:3389,1997公开的BLAST程序家族。序列分析的详细讨论可以在Ausubel等人,"Current Protocols in Molecular Biology,"John Wiley&Sons Inc,1994-1998第15章的19.3单元中找到。
“统计上显著”是指结果不太可能是偶然发生的。统计的显著性可以通过本领域已知的任何方法确定。常用的显著性度量包括p值,如果零假设为真,则是观察到的事件发生的频率或概率。如果获得的p值小于显著性水平,则拒绝零假设。在简单情况下,显著性水平定义为p值等于或小于0.05。
术语“溶解度”是指p97多肽片段或缀合物溶解在液体溶剂中并形成均质溶液的性质。溶解度通常表示为浓度,以单位体积溶剂中的溶质质量(每kg溶剂中的溶质g,每dL(100ml)中的g,mg/ml等)、摩尔浓度、重量摩尔浓度、摩尔分数或其他类似浓度描述表示。每溶剂量可溶解的最大溶质平衡量,是该溶质在指定条件下(包括温度、压力、pH值和溶剂性质)在该溶剂中的溶解度。在某些实施方式中,溶解度是在生理pH或其他pH,例如在pH 5.0、pH 6.0、pH 7.0或pH 7.4下测量的。在某些实施方式中,溶解度是在水或生理缓冲液(例如PBS或NaCl(有或没有NaP))中测量的。在具体的实施方式中,溶解度是在相对较低的pH(例如pH 6.0)和相对较高的盐(例如500mM NaCl和10mM NaP)下测量的。在某些实施方式中,溶解度是在诸如血液或血清的生物流体(溶剂)中测量的。在某些实施方式中,温度可以是大约室温(例如,约20、21、22、23、24、25℃)或约体温(-37℃)。在某些实施方式中,p97多肽或缀合物在室温下,或约37℃下,溶解度至少约为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25或30mg/ml。
如本文所用,“受试者”包括可以用本发明的p97缀合物治疗或诊断的,表现出症状,或有表现出症状风险的任何动物。合适的受试者(患者)包括实验动物(例如小鼠、大鼠、兔子或豚鼠)、农场动物和家畜或宠物(例如猫或狗)。包括非人类灵长类动物,并且优选包括人类患者。
“基本上”或“实质上”是指几乎全部地或完全地,例如,一些给定数量的95%、96%、97%、98%、99%或更高。
“基本上不含”是指给定数量的几乎完全或完全不存在,例如,小于给定数量的约10%、5%、4%、3%、2%、1%、0.5%或更低。例如,某些组合物可以“基本上不含”细胞蛋白、膜、核酸、内毒素或其他污染物。
如本文所用,“治疗(treatment)”或“治疗(treating)”包括对疾病或病症的症状或病理的任何期望的效果,并且可以包括对所治疗的疾病或病症的一种或多种可测量标志物的甚至最小的改变或改善。“治疗”或“治疗”不一定表示已完全根除或治愈了该疾病或状况,或其相关症状。接受该治疗的受试者是需要其的任何受试者。临床改善的示例性的标志物对本领域技术人员将是显而易见的。
术语“野生型”是指当从天然来源分离时,具有该基因或基因产物的特征的基因或基因产物。野生型基因或基因产物(例如多肽)是在种群中最常见的基因或基因产物,因此被任意设计为基因的“正常的”或“野生型”形式。
p97多肽序列及其缀合物
本发明的实施方式通常涉及人p97的多肽片段(黑素转铁蛋白;MTf),包括此类片段的组合物及其缀合物。在某些情况下,本文所述的p97多肽片段具有转运活性,即它们具有转运穿过血脑屏障(BBB)的能力。在特定的实施方式中,p97片段与目标试剂共价地、非共价地或可操作地偶联,例如治疗剂、诊断剂或可检测剂,以形成p97-试剂缀合物。试剂的具体实例包括小分子和多肽,例如抗体,以及本文所述和本领域已知的其他试剂。示例性的p97多肽序列和试剂描述如下。还描述了示例性方法和组分,例如接头基团,用于将p97多肽偶联至目标试剂。
在下文更加详细描述的其他具体实施方式中,p97多肽序列包括与SEQ ID NO 2所示的人p97序列沿着其长度具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的一致性或同源性的序列。通常,p97多肽包括与DSSHAFTLDELR(SEQ.ID NO:2)具有至少80%,更通常至少85%,甚至更通常至少90%,甚至更通常至少95%一致的氨基酸序列。通常,p97多肽包括与DSSHAFTLDELR(SEQ ID NO:2)具有100%一致的氨基酸序列。通常,p97多肽包括氨基酸序列,其中0、1或2个氨基酸不同于DSSHAFTLDELR(SEQ ID NO:2),例如DSSYSFTLDELR(SEQ ID NO:3)。
在特定的实施方式中,p97片段或其变体具有穿过BBB的能力,并且可选地将目标试剂转运穿过BBB并进入中枢神经系统。在某些实施方式中,p97片段或其变体能够与p97受体、LRPI受体和/或LRPIB受体特异性结合。
在一些实施方式中,p97片段具有一个或多个末端(例如,N-末端、C-末端)半胱氨酸和/或酪氨酸,它们可以分别被添加用于缀合和碘化。
下面更详细地描述了参照p97多肽和其他参照多肽的变体和片段。
共价连接键是优选的,但是,也可以使用非共价连接键,包括利用相对强的非共价蛋白-配体相互作用,例如生物素和抗生物素蛋白之间的相互作用的那些。p97片段与试剂的融合是特别优选的。还包括操作性连接键,其不一定要求p97片段和目标试剂之间存在直接共价的或非共价的相互作用;这些连接键的例子包括脂质体混合物,其包括p97多肽和目标试剂。本文描述了产生蛋白缀合物的示例性方法,并且其他方法是本领域众所周知的。
在某些实施方式中,小分子的分子量小于约1000-2000道尔顿,通常在约300至700道尔顿之间,并且包括约50、100、150、200、250、300、350、400、450、500,550、500、650、600、750、700、850、800、950、1000或2000道尔顿。
某些小分子可以具有针对抗体所描述的“特异性结合”特性(下文)。例如,小分子可以与本文所描述的靶标特异性结合,结合亲和力(Kd)至少为约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40或50nM。在某些实施方式中,小分子特异性结合细胞表面受体或其他细胞表面蛋白。在一些实施方式中,小分子特异性结合本文所描述的至少一种癌症相关抗原。在特定的实施方式中,小分子特异性结合本文所描述的至少一种神经系统相关、疼痛相关和/或自身免疫相关的抗原。
示例性的小分子包括细胞毒性剂、化学治疗剂和抗血管生成剂,例如,被认为对治疗各种癌症有用的那些,包括中枢神经系统的癌症和转移至中枢神经系统的癌症。
小分子的特定类别包括但不限于,烷基化试剂、抗代谢物、蒽环类、抗肿瘤抗生素、铂、I型拓扑异构酶抑制剂、II型拓扑异构酶抑制剂、长春花生物碱和紫杉烷类。
小分子的具体实例包括苯丁酸氮芥、环磷酰胺、西仑吉肽、洛莫司汀(CCNU)、马法兰、甲基苄肼、噻替派(thiotepa)、卡莫斯汀(BCNU)、恩扎他林、白消安、柔红霉素、阿霉素、吉非替尼、厄洛替尼、伊达比星、替莫唑胺、表柔比星、米托蒽醌、博来霉素、顺铂、卡铂、奥沙利铂、喜树碱、伊立替康、托泊替康、氨苄青霉素、依托泊苷、磷酸依托泊苷、替尼泊苷、替西罗莫司、依维莫司、长春新碱、长春碱、长春瑞滨、长春地辛、CT52923和紫杉醇,以及以上任何一种的药学上可接受的盐、酸或衍生物。
小分子的其他实例包括靶向蛋白激酶用于治疗神经系统疾病(例如CNS)的那些,包括伊马替尼、达沙替尼、索拉非尼、帕唑帕尼、舒尼替尼、瓦他拉尼、吉非替尼、厄洛替尼、AEE-788、双氯乙酸盐、他莫昔芬、法舒地尔、SB-681323和塞马西尼(SU5416)(参见Chico etal.,Nat Rev Drug Discov.8:829-909,2009)。小分子的实例还包括多奈哌齐、加兰他敏、美金刚、卡巴拉汀、他克林、雷西吉林、纳曲酮、鲁比前列酮、沙芬酰胺、异麦草碱、匹马西林、匹他莫司坦、伊拉地平、普利多匹定(ACR16)、丁苯那嗪和贝沙罗汀(例如,用于治疗阿尔茨海默氏病、帕金森氏病、亨廷顿氏病(Huntington’s Disease));和乙酸加替利莫、芬戈莫德、米托蒽醌(例如,用于治疗MS)。还包括以上任何一种的药学上可接受的盐、酸或衍生物。
小分子的其他实例包括烷基化试剂,例如噻替派、环磷酰胺(CYTOXAN
还包括调节或抑制荷尔蒙对肿瘤的作用的抗激素剂,例如抗雌激素,包括例如他莫昔芬、雷洛昔芬、抑制4(5)-咪唑的芳香化酶、4-羟基他莫昔芬、曲沃昔芬、雷洛西芬(keoxifene)、LY117018、奥那斯酮和托瑞米芬(法乐通);以及抗雄激素,例如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林和戈舍瑞林;以及上述任何一种的药学上可接受的盐、酸或衍生物。
如上所述,在某些方面,小分子是另外的心脏毒性试剂。
心脏毒性小分子的具体实例包括但不限于,蒽环类/蒽醌类、环磷酰胺、抗代谢物、抗微管剂和酪氨酸激酶抑制剂。心脏毒性试剂的具体实例包括环戊烯基胞嘧啶、5-氟脲嘧啶、卡培他滨、紫杉醇、多卡他赛(docataxel)、阿霉素、亚德里亚霉素(doxorubucin)、表柔比星、依米丁、异苯氧基乙酰胺(isotamide)、丝裂霉素C、厄洛替尼、吉非替尼、伊马替尼、索拉非尼、舒尼替尼、顺铂、沙利度胺、白消安、长春碱、博来霉素、长春新碱、三氧化二砷、甲氨蝶呤、罗格列酮和米托蒽醌,以及本文所描述的和本领域已知的其他小分子中。
示例性的多肽试剂包括与溶酶体贮积疾病相关的多肽。此类多肽的实例包括天冬氨酰氨基葡糖苷酶、酸性脂肪酶、半胱氨酸转运蛋白、溶酶体相关膜蛋白2(Lamp-2)、a-半乳糖苷酶A、酸性神经酰胺酶、a-L-岩藻糖苷酶、-己糖胺酶A、GM2-神经节苷脂激活剂(GM2A)、a-D-甘露糖苷酶、-D-甘露糖苷酶、芳基硫酸酯酶A、鞘脂激活蛋白B、神经氨酸酶、a-N-乙酰氨基葡萄糖苷磷酸转移酶、磷酸转移酶、磷酸转移酶y-亚基、L-艾杜糖醛酸酶、艾杜糖醛酸-2-硫酸酯酶、乙酰肝素-N-硫酸酯酶、a-N-乙酰氨基葡萄糖苷酶、乙酰辅酶A:N-乙酰基转移酶、N-乙酰氨基葡萄糖6-硫酸酯酶、半乳糖6-硫酸酯酶、-半乳糖苷酶、N-乙酰半乳糖胺4-硫酸酯酶、透明质酸氨基葡萄糖苷酶、硫酸酯酶、棕榈酰蛋白硫酯酶、三肽基肽酶I、酸性鞘磷脂酶、组织蛋白酶A、组织蛋白酶K、a-半乳糖苷酶B、NPC1、NPC2、唾液酸转运蛋白(sialin),以及唾液酸转运体,包括其片段、变体和衍生物。
某些实施方式包括多肽,例如干扰素-多肽,例如干扰素-la(例如,干扰素β-1a粉针剂(AVONEX)、利比(REBIF))和干扰素-lb(例如,倍泰龙(Betaseron)),其通常用于治疗多发性硬化症(MS)。
如上所述,在一些实施方式中,多肽试剂是抗体或其抗原结合片段。用于本发明的缀合物或组合物中的抗体或抗原结合片段可以基本上是任何类型。具体实例包括治疗抗体和诊断抗体。如本领域众所周知的,抗体是能够与靶标(例如碳水化合物、多核苷酸、脂质、多肽等)特异性结合的免疫球蛋白分子,通过至少一个位于免疫球蛋白分子可变结构域的表位识别位点。
如本文所用,术语“抗体”不仅包括完整的多克隆抗体或单克隆抗体,还包括其片段(例如dAb、Fab、Fab’、F(ab'h、Fv)、单链(ScFv)、其合成的变体、天然存在的变体、包含具有所需特异性的抗原结合片段的抗体部分的融合蛋白、人源化抗体、嵌合抗体,和免疫球蛋白分子的任何其他修饰构型,所述免疫球蛋白分子的任何其他修饰构型包括所需特异性的抗原结合位点或片段(表位识别位点)。
如本文所用,术语“抗原结合片段”是指含有至少一个免疫球蛋白重链和/或轻链的CDR的多肽片段,其与目标抗原结合。在这方面,本文描述的抗体的抗原结合片段可以包括来自与治疗目标或诊断目标结合的抗体的VH和VL序列的1、2、3、4、5或全部6个CDR。
术语“抗原”是指能够被选择性结合剂(例如抗体)结合的分子或分子的一部分,并且还能够用于在动物中产生能够结合该抗原的表位的抗体。抗原可以具有一个或多个表位。
术语“表位”包括能够与免疫球蛋白或T细胞受体特异性结合的任何决定簇,优选多肽决定簇。表位是被抗体结合的抗原区域。在某些实施方式中,表位决定簇包括分子的化学活性表面基团,例如氨基酸、糖侧链、磷酸或磺酰基,并且在某些实施方式中可以具有特定的三维结构特征和/或特定的电荷特征。表位相对于抗原的一级结构可以是连续的或非连续的。
如果分子(例如抗体)与特定细胞或物质比它与替代细胞或物质发生反应或缔合更频繁、更快速,持续时间更长和/或具有更高的亲和力,则认为所述分子表现出“特异性结合”或“优先结合”。如果抗体以比其结合其他物质具有更大的亲和力(affinity)、亲和性(avidity),更容易和/或更长的持续时间结合,则所述抗体与靶标“特异性结合”或“优先结合”。例如,特异性或优先结合特定表位的抗体是比它结合其他表位具有更大的亲和力、亲和性,更容易和/或持续时间更长的结合特定表位的抗体。通过阅读该定义还应理解,例如,特异性或优先结合至第一靶标的抗体(或部分或表位)可以特异性地或优先地或可以不特异性地或优先地结合于第二靶标。这样,“特异性结合”或“优先结合”并不一定要求(尽管它可以包括)排他结合。通常,但并不一定,提到结合是指优先结合。
免疫学结合通常是指在免疫球蛋白分子与对免疫球蛋白具有特异性的抗原之间发生的非共价相互作用,例如通过举例而非限制的方式,是由于静电的、离子的、亲水的和/或疏水的吸引力或排斥力、空间力、氢键、范德华力和其他相互作用导致的。免疫结合相互作用的强度或亲和力可以以相互作用的解离常数(Kd)的形式表示,其中更小的Kd代表更大的亲和力。
所选的多肽的免疫结合特性可以使用本领域众所周知的方法来定量。一种这样的方法需要测量抗原结合位点/抗原复合物形成和解离的速率,其中那些速率取决于复合物配偶体的浓度,相互作用的亲和力以及在两个方向上均等地影响速率的几何参数。因此,“结合速率常数(on rate constant)”(Kon)和“解离速率常数(off rate constant)”(Koff)都可以通过计算浓度以及结合和解离的实际速率来确定。Koff/Kon的比率使得能够消除与亲和力无关的所有参数,因此等于解离常数Kd。
所选的抗体和多肽的免疫结合特性可以使用本领域众所周知的方法进行定量(参见Davies et al.,Annual Rev Biochem.59:439-473,1990)。在一些实施方式中,当平衡解离常数为约≤10
在一些实施方式中,抗体或抗原结合片段或其他多肽与细胞表面受体或其他细胞表面蛋白特异性结合。在一些实施方式中,抗体或抗原结合片段或其他多肽特异性结合细胞表面受体或其他细胞表面蛋白的配体。在一些实施方式中,抗体或抗原结合片段或其他多肽特异性结合细胞内蛋白。
在某些实施方式中,抗体或其抗原结合片段或其他多肽特异性结合癌症相关抗原或癌症抗原。示例性的癌症抗原包括细胞表面蛋白,例如细胞表面受体。与癌症相关的抗原还包括与此类细胞表面蛋白或受体结合的配体。在特定的实施方式中,抗体或抗原结合片段特异性结合细胞内癌症抗原。在一些实施方式中,与癌症抗原相关的癌症是乳腺癌、转移性脑癌、前列腺癌、胃肠癌、肺癌、卵巢癌、睾丸癌、头颈癌、胃癌、膀胱癌、胰腺癌、肝癌、肾癌、鳞状细胞癌、CNS或脑癌、黑色素瘤、非黑色素瘤癌、甲状腺癌、子宫内膜癌、上皮肿瘤、骨癌或造血癌中的一种或多种。
在特定的实施方式中,抗体或抗原结合片段或其他多肽特异性结合至少一种癌症相关抗原或癌症抗原,例如人Her2/neu、Herl/EGF受体(EGFR)、Her3、A33抗原、B7H3、CDS、CD19、CD20、CD22、CD23(IgE受体)、C242抗原、ST4、IL-6、IL-13、血管内皮生长因子VEGF(例如VEGF-A)VEGFR-1、VEGFR-2、CD30、CD33、CD37、CD40、CD44、CDSl、CD52、CD56、CD74、CD80、CD152、CD200、CD221、CCR4、HLA-DR、CTLA-4、NPC-IC、腱生蛋白、波形蛋白、胰岛素样生长因子1受体(IGF-IR)、甲胎蛋白、胰岛素样生长因子1(IGF-1)、碳酸酐酶9(CA-IX)、癌胚抗原(CEA)、整联蛋白av 3、整联蛋白a5 1、叶酸受体1、跨膜糖蛋白NMB、成纤维细胞活化蛋白α(FAP)、糖蛋白75、TAG-72、MUCI、MUC16(或CA-125)、磷脂酰丝氨酸、前列腺特异性膜抗原(PMSA)、NR-LU-13抗原、TRAIL-RI、肿瘤坏死因子受体超家族成员10b(TNFRSFIOB或TRAIL-R2)、SLAM家族成员7(SLAMF7)、EGP40胰腺癌抗原、B细胞活化因子(BAFF)、血小板衍生的生长因子受体、糖蛋白EpCAM(17-IA)、程序性死亡-1、蛋白二硫键异构酶(POI)、促肝细胞再生磷酸酶3(PRL-3)、前列腺酸磷酸酶、路易斯-Y抗原(Lewis-Y antigen)、GD2(在神经外胚层起源的肿瘤中表达的双唾液酸神经节苷脂)、磷脂酰肌醇蛋白聚糖-3(GPC3),和/或间皮素。
在具体的实施方式中,抗体或其抗原结合片段或其他多肽与人Her2/neu蛋白特异性结合。基本上任何抗-Her2/neu抗体、抗原结合片段或其他Her2/neu-特异性结合剂均可用于生产本发明的p97-抗体缀合物。例如,在美国专利号5,677,171;5,720,937;5,720,954;5,725,856;5,770,195;5,772,997;6,165,464;6,387,371;和6,399,063中,描述了示例性的抗-Her2/neu抗体,它们的内容通过整体引用并入本文。
在一些实施方式中,抗体或其抗原结合片段或其他多肽,与人Herl/EGFR(表皮生长因子受体)特异性结合。基本上任何抗Herl/EGFR抗体、抗原结合片段或其他Herl-EGFR特异性结合剂,均可用于产生本发明的p97-抗体缀合物。例如,在美国专利号5,844,093;7,132,511;7,247,301;7,595,378;7,723,484;7,939,072;和7,960,516中,描述了示例性的抗Herl/EGFR抗体,它们的内容通过整体引用并入本文。
在某些实施方式中,抗体是治疗性抗体,例如抗癌治疗性的抗体,包括的抗体例如3F8、8H9、阿巴伏单抗(abagovomab)、阿德木单抗(adecatumumab)、阿夫土珠单抗(afutuzumab)、阿仑单抗、培化阿珠单抗(alacizumab)(佩戈(pegol))、阿莫昔单抗(amatuximab)、阿泊珠单抗(apolizumab)、巴土昔单抗(bavituximab)、贝妥莫单抗、贝利木单抗、贝伐单抗(bevacizumab)、比伐珠单抗(bivatuzumab)(美登素(mertansine))、本妥昔单抗、莫坎妥珠单抗(cantuzumab)(美登素)、莫坎妥珠单抗(瑞伐坦(ravtansine))、卡罗单抗(喷地肽)、卡妥索单抗(catumaxomab)、西妥昔单抗、西他土珠单抗(citatuzumab)(伯格(bogatox))、西妥木单抗(cixutumumab)、克伐他单抗(clivatuzumab)(轮环藤宁四乙酸(tetraxetan))、卡那妥单抗(conatumumab)、达西珠单抗(dacetuzumab)、达塞珠单抗(dalotuzumab)、地莫单抗(detumomab)、屈西他单抗(drozitumab)、依美昔单抗(ecromeximab)、依决洛单抗(edrecolomab)、依洛珠单抗(elotuzumab)、恩伐珠单抗(enavatuzumab)、恩妥西单抗(ensituximab)、依帕珠单抗(epratuzumab)、厄马索单抗(ertumaxomab)、依他珠单抗(etaracizumab)、法鲁珠单抗(farletuzumab)、FBTA05、菲妥木单抗(figitumumab)、法兰妥单抗(flanvotumab)、加利昔单抗(galiximab)、吉妥单抗(gemtuzumab)、甘露单抗(ganitumab)、吉妥单抗(奥佐米星(ozogamicin))、吉伦妥昔单抗(girentuximab)、格列巴单抗(glembatumumab)(澳瑞他汀(vedotin))、替坦异贝莫单抗(ibritumomab tiuxetan)、伊库鲁单抗(icrucumab)、伊戈伏单抗(igovomab)、吲妥昔单抗瑞伐坦(indatuximab ravtansine)、英特单抗(intetumumab)、奥妥珠格图单抗奥佐米星(inotuzumab ozogamicin)、伊匹单抗(ipilimumab)(MDX-101)、伊拉单抗(iratumumab)、拉托唑单抗(labetuzumab)、来沙木单抗(lexatumumab)、林妥珠单抗、洛伐妥单抗(lorvotuzumab)(美登素)、卢卡珠单抗(lucatumumab)、鲁米昔单抗(lumiliximab)、马塔单抗(mapatumumab)、马妥珠单抗(matuzumab)、米拉珠单抗(milatuzumab)、米托单抗(mitumomab)、莫加利单抗(mogamulizumab)、莫昔单抗(moxetumomab)(帕多毒素(pasudotox))、纳可洛单抗(nacolomab)(他那托(tafenatox))、萘妥莫单抗(naptumomab)(衣塔芬毒素(estafenatox))、纳那妥单抗(narnatumab)、奈米单抗(necitumumab)、尼妥珠单抗(nimotuzumab)、纳武利尤单抗(nivolumab)、
在特定的实施方式中,抗体是心脏毒性抗体,即,当以非缀合形式施用时表现出心脏毒性的抗体。表现出心脏毒性的抗体的具体实例包括曲妥珠单抗和贝伐单抗。
在具体的实施方式中,用于p97缀合物的抗Her2/neu抗体是曲妥珠单抗
在其他具体的实施方式中,用于本发明的缀合物的抗Herl/EGFR抗体是西妥昔单抗
在一些实施方式中,抗体或抗原结合片段或其他多肽特异性结合于与至少一种神经系统疾病相关例如,治疗)的抗原(,所述神经系统疾病包括周围和/或中枢神经系统(CNS)疾病。在某些实施方式中,抗体或抗原结合片段或其他多肽特异性结合于与疼痛相关(例如,治疗)的抗原,所述疼痛包括急性疼痛、慢性疼痛和神经性疼痛。在一些实施方式中,抗体或抗原结合片段或其他多肽特异性结合于与自身免疫性疾病相关(例如,治疗)的抗原,所述自身免疫性疾病包括神经系统或CNS的自身免疫性疾病。
神经系统-、疼痛-和/或自身免疫-相关抗原的实例包括但不限于,α-4(a4)整联蛋白、CD20、CD52、IL-12、IL-23、IL-12和IL-23的p40亚基,以及轴突再生和髓鞘再生抑制剂Noga-A和LINGO、IL-23、淀粉样蛋白-β(例如Aβ
在具体的实施方式中,用于p97缀合物的抗CD25抗体是达克珠单抗(daclizumab)(即赛尼哌
在具体的实施方式中,缀合物中使用的抗NGF抗体是他尼珠单抗(tanezumab)或其片段、变体或衍生物。他尼珠单抗特异性结合NGF并阻止NGF结合其高亲和力、膜结合的催化受体原肌球蛋白相关的激酶A(TrkA),其存在于交感神经元和感觉神经元中;认为NGF对TrkA减少的刺激抑制了这种神经元的疼痛传递活性。
在一些实施方式中,抗体或其抗原结合片段或其他多肽(例如,免疫球蛋白样分子、可溶性受体、配体)特异性结合促炎分子,例如促炎细胞因子或趋化因子。在这些和相关实施方式中,如本文所描述的,p97缀合物可用于治疗多种炎性病症。
促炎分子的实例包括肿瘤坏死因子(TNF),例如TNF-a和TNF-,TNF超家族分子,例如FasL、CD27L、CD30L、CD40L、Ox40L、4-IBBL、TRAIL、TWEAK和Apo3L、白介素-1(IL-1),包括IL-1a和IL-1、IL-2、干扰素-y(IFN-y)、IFN-a/、IL-6、IL-8、IL-12、IL-15、IL-17、IL-18、IL-21、LIF、CCL5、GROa、MCP-1、MIP-la、MIP-1、巨噬细胞集落刺激因子(MCSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF)、CXCL2、CCL2等。在一些实施方式中,抗体或其抗原结合片段特异性结合一种或多种前述促炎分子的受体,例如TNF受体(TNFR)、IL-1受体(IL-1R),或IL-6受体(IL-6R)等。
在具体的实施方式中,如上所述,抗体或抗原结合片段或其他多肽,特异性结合TNF-a或TNF-。在特定实施方式中,抗TNF抗体或其他TNF结合的多肽是阿达木单抗
在特定的实施方式中,如上所述,抗体或抗原结合片段特异性结合IL-Ia或IL-1。在特定的实施方式中,抗IL-1抗体是康纳单抗(canakinumab)或格伐克单抗(gevokizumab),或其变体或片段,其特异性结合IL-1。在本文所述的其他炎性病症中,包括抗IL-1抗体的p97缀合物可用于治疗与冷吡啉相关周期性综合征(cryopyrin-associatedperiodic syndromes)(CAPS),包括家族性寒冷性自身炎症性综合征、穆-韦二氏综合征(Muckle-Wells syndrome)和新生儿发作多系统炎性病症。
可以通过本领域普通技术人员已知的多种技术中的任何一种来制备抗体。参见,例如,Harlow and Lane,Antibodies:Laboratory Manual,Cold Spring HarborLaboratory,1988。对目标多肽具有特异性的单克隆抗体可以例如使用Kohler andMilstein,Eur.J.lmmunol.6:511-519,1976中的技术制备,并对其进行改进。还包括利用转基因动物例如小鼠表达人抗体的方法。参见,例如,Neuberger et al.,NatureBiotechnology 14:826,1996;Lonberg et al.,Handbook of ExperimentalPharmacology 113:49-101,1994;和Lonberg et al.,Internal Review of immunology13:65-93,1995。
特定的实施例包括通过
还可通过使用噬菌体展示或酵母展示文库产生或识别抗体(参见,例如,美国专利号7,244,592;Chao et al.,Nature Protocols.1:755-768,2006)。可用的文库的非限制性实例包括克隆的或合成的文库,例如人组合抗体文库(HuCAL),其中人抗体库的结构多样性由七个重链和七个轻链可变区基因表示。这些基因的组合在主库(master library)中产生了49个框架。通过在这些框架上叠加高度可变的基因盒(CDR=互补决定区),可以复制大量的人抗体。还包括由人类供体来源的片段设计的人文库,所述片段编码轻链可变区、重链CDR-3,在重链CDR-1中编码多样性的合成DNA,以及在重链CDR-2中编码多样性的合成DNA。
适合使用的其他文库对于本领域技术人员将是显而易见的。本文所述和本领域已知的p97多肽可用于纯化过程中,例如亲和层析步骤。
在某些实施方式中,本文所述的抗体及其抗原结合片段,包括分别插入重链和轻链框架区(FR)组之间的重链和轻链CDR组,所述重链和轻链框架区(FR)组提供对CDR的支持并限定了CDR相对于彼此的空间关系。如本文所用,术语“CDR组”是指重链或轻链V区的三个高变区域。从重链或轻链的N-末端开始,这些区域分别表示为“CDR1”、“CDR2”和“CDR3”。因此,抗原结合位点包括六个CDR,其包括来自重链和轻链V区中每一个的CDR组。包括单个CDR(例如,CDR1、CDR2或CDR3)的多肽在本文中称为“分子识别单元”。对许多抗原-抗体复合物的晶体学分析表明,CDR的氨基酸残基与结合的抗原形成广泛的接触,其中最广泛的抗原接触是与重链CDR3。因此,分子识别单元主要负责抗原结合位点的特异性。
如本文所用,术语“FR组”是指构成重链或轻链V区的CDR组的CDR的四个侧翼氨基酸序列。一些FR残基可以接触结合的抗原;然而,FR主要负责将V区折叠到抗原结合位点,特别是直接地与CDR相邻的FR残基,在FR中,某些氨基残基和某些结构特征非常保守。在这方面,所有的V区序列都包括一个内部的约90个氨基酸残基的二硫环。当V区折叠成结合位点时,CDR显示为形成抗原结合表面的突出环基序。通常认为存在FR的保守结构区,其影响CDR环折叠成某些“正则(canonical)”结构的折叠形状,而不管精确的CDR氨基酸序列如何。此外,已知某些FR残基可参与非共价域间接触,从而稳定抗体重链和轻链的相互作用。
免疫球蛋白可变结构域的结构和位置可以通过参考Kabat,E.A.et.al.,Sequences of Proteins of Immunological Interest.4th Edition.US Department ofHealth and Human Services.1987,及其更新内容来确定。
“单克隆抗体”是指同质的抗体群,其中单克隆抗体由参与表位的选择性结合的氨基酸(天然存在和非天然存在)组成。单克隆抗体针对单个表位具有高度特异性。术语“单克隆抗体”不仅包括完整的单克隆抗体和全长单克隆抗体,还包括其片段(例如Fab、Fab’、F(ab’h、Fv)、单链(ScFv)、其变体、包含抗原结合部分的融合蛋白、人源化单克隆抗体、嵌合单克隆抗体,和免疫球蛋白分子的任何其他修饰构型,其包括所需的特异性和与表位结合的能力的抗原结合片段(表位识别位点)。抗体的来源或制备方式不受限制(例如,通过杂交瘤、噬菌体选择、重组表达、转基因动物)。该术语包括完整的免疫球蛋白,以及上述在“抗体”定义下的片段等。
蛋白水解酶木瓜蛋白酶优先切割IgG分子以产生几个片段,其中两个F(ab)片段各自包括包含完整抗原结合位点的共价异二聚体。胃蛋白酶能够切割IgG分子以提供几个片段,包括包含两个抗原结合位点的F(ab'h片段。根据本发明某些实施方式使用的Fv片段可以通过优先进行IgM蛋白水解切割产生,并且在极少的情况下可以通过IgG或IgA免疫球蛋白分子产生。然而,Fv片段更普遍地是使用本领域已知的重组技术衍生的。Fv片段包括非抗原性的VH::VL异源二聚体,其包括抗原结合位点,该位点保留了天然抗体分子的许多抗原识别和结合能力。参见Inbar et al.,PNAS USA.69:2659-2662,1972;Hochman et al.,Biochem.15:2706-2710,1976;以及Ehrlich et al.,Biochem.19:4091-4096,1980。
在某些实施方式中,考虑了单链Fv或scFV抗体。例如,可以根据本申请关于选择具有所需特异性的抗体的教导使用标准分子生物学技术制备卡帕体(Ill et al.,,Prat.Eng.10:949-57,1997);迷你抗体(Martin et al.,EMBO J 13:5305-9,1994);双抗体(Holliger et al.,PNAS 90:6444-8,1993);或Janusins(Traunecker et al.,EMBO J 10:3655-59,1991;以及Traunecker et al.,Int.J.Cancer Suppl.7:51-52,1992)。
单链Fv(sFv)多肽是共价连接的VH::VL异二聚体,其由包括通过肽编码接头连接的Vw和VL编码基因的基因融合体表达而成。Huston等人(PNAS USA.85(16):5879-5883,1988)已经描述了许多方法识别用于将天然聚集但化学分离的轻和重多肽链,从抗体V区转化为sFv分子的化学结构,其将折叠成基本上类似于抗原结合位点的结构的三维结构。参见,例如Huston等人的美国专利号5,091,513和5,132,405,以及Ladner等人的美国专利号4,946,778。
在某些实施方式中,本文所述的抗体为“双抗体(diabody)”的形式。
双抗体是多肽的多聚体,每个多肽包括包含免疫球蛋白轻链结合结构域的第一结构域,和包括免疫球蛋白重链结合区的第二结构域,这两个结构域是连接的(例如通过肽接头),但不能彼此结合形成抗原结合位点:抗原结合位点是通过多聚体中一个多肽的第一结构域与多聚体中另一个多肽的第二结构域的缔合而形成的(WO94/13804)。抗体的dAb片段由VH结构域组成(Ward et al.,Nature 341:544-546,1989)。双抗体和其他多价或多特异性片段可以例如通过基因融合来构建(参见WO94/13804;和Holliger et.al.,PNASUSA.90:6444-6448,1993))。
也包括包含与CH3结构域连接的scFv的迷你抗体(参见Hu et.al.,CancerRes.56:3055-3061,1996)。另参见Ward et.al.,Nature.341:544-546,1989;Bird et al.,Science.242:423-426,1988;Huston et al.,PNAS USA.85:5879-5883,1988);PCT/US92/09965;WO94/13804;以及Reiter et.al.,Nature Biotech.14:1239-1245,1996。
当使用双特异性抗体时,它们可以是常规的双特异性抗体,其可以以多种方式制造(Holliger and Winter,Current Opinion Biotechnol.4:446-449,1993),例如可以用化学方法制备或由杂交杂交瘤制备,或者可以是上述任何双特异性抗体片段。仅使用可变结构域就可以构建没有Fe区的双抗体和scFv,从而可能降低抗独特型反应的影响。
与双特异性全抗体相反,双特异性双抗体也可能特别有用,因为它们可以很容易地构建,并且可以使用噬菌体展示(WO94/13804)从文库中容易地选择具有适当结合特异性的表达的信息大肠杆菌双抗体(以及许多其他多肽,例如抗体片段)。如果双抗体的一个臂要保持恒定,例如针对抗原X的特异性,那么可以制作一个文库,其中另一臂可以变化,并选择适当特异性的抗体。双特异性全抗体可以通过隆突-入-穴(knobs-into-holes)工程制备(Ridgeway et al.,Protein Eng.,9:616-621,1996)。
在某些实施方式中,本文描述的抗体可以
在某些实施方式中,本文提供的抗体可以采用纳米抗体的形式。迷你抗体由单个基因编码,并在几乎所有原核和真核宿主中有效地产生,例如,大肠杆菌(参见美国专利号6,765,087)、霉菌(例如曲霉菌或木霉)和酵母菌(例如酵母、克鲁维酵母菌属、汉逊酵母或毕赤酵母属(参见美国专利号6,838,254))。生产工艺是可扩展的并且已经生产了多千克数量的纳米抗体。纳米抗体可配制成具有长期保存期限的即用溶液。纳米克隆方法(参见WO06/079372)是可基于B细胞的自动化高通量选择,针对所需靶标生成纳米抗体的专有方法。
在某些实施方式中,抗体或其抗原结合片段是人源化的。这些实施方式涉及嵌合分子,通常使用重组技术制备,其具有来源于非人类物种的免疫球蛋白的抗原结合位点和基于人类免疫球蛋白的结构和/或序列的分子的剩余免疫球蛋白结构。抗原结合位点可包括融合到恒定结构域上的完整可变结构域,或仅包括嫁接到可变结构域中适当框架区上的CDR。表位结合位点可以是野生型,或被一个或多个氨基酸取代修饰。这消除了恒定区作为人类个体中的免疫原,但是仍然存在对外来可变区的免疫应答的可能性(LoBuglio et al,PNAS USA 86:4220-4224,1989;Queen et al.,PNAS USA.86:10029-10033,1988;Riechmann et al.,Nature.332:323-327,1988)。
抗体人源化的说明性方法包括美国专利号7,462,697中描述的方法。
另一种方法不仅聚焦于提供人类衍生的恒定区,而且还修饰可变区,以使其尽可能接近人类形态。众所周知,重链和轻链的可变区均包括三个互补决定区(CDR),它们根据所讨论的表位而变化并确定结合能力,其侧翼是四个框架区(FR),这四个框架区在给定物种中相对保守,并假定为CDR提供了支架。当针对特定表位制备非人抗体时,可通过将源自非人抗体的CDR移植到待修饰的人抗体中存在的FR上来“重塑”或“人源化”可变区。这种方法对各种抗体的应用已经被Sato et al.,Cancer Res.53:851-856,1993;Riechmarm etal.,Nature 332:323-327,1988;Verhoeyen et al.,Science 239:1534-1536,1988;Kettleborough et al.,Protein Engineering.4:773-3783,1991;Maeda et al.,HumanAntibodies Hybridoma 2:12.4-134,1991;Gorman et al.,PNAS USA.88:4181-4185,1991;Tempest et al.,Bio/Technology 9:266-271,1991;Co et al.,PNAS USA.88:2869-2873,1991;Carter et al.,PNAS USA.89:4285-4289,1992;以及Co et al.,JImmunol.148:1149-1154,1992。在其他实施方式中,人源化抗体保留所有CDR序列(例如,包括来自小鼠抗体的全部六个CDR的人源化小鼠抗体),在其他实施方式中,人源化抗体具有一个或多个CDR(一个、两个、三个、四个、五个、六个),其相对于原始抗体是改变的,也称为一个或多个“源自于”原始抗体的一个或多个CDR的CDR。
在某些实施方式中,本发明的抗体可以是嵌合抗体。在这方面,嵌合抗体由与不同抗体的异源Fe部分可操作地连接或融合的抗体的抗原结合片段组成。在某些实施方式中,异源Fe结构域是人源的。在其他实施方式中,异源Fe结构域可以来自与亲本抗体不同的Ig类别,包括IgA(包括亚类IgA1和IgA2)、IgD、IgE、IgG(包括亚类IgG1、IgG2、IgG3和IgG4),以及IgM。在进一步的实施方式中,异源Fe结构域可以包括来自一种或多种不同Ig类别的CH2和CH3结构域。如上文关于人源化抗体所述,嵌合抗体的抗原结合片段可仅包括本文所述抗体的一个或多个CDR(例如,本文所述抗体的1、2、3、4、5或6个CDR),或可以包括完整的可变结构域(VL、VH或两者)。
肽模拟物可以具有针对抗体所述的“特异性结合”特征(同上)。例如,肽模拟物可以特异性结合本文所述的靶标,其亲和力(Kd)至少为约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40或50nM。在一些实施方式中,肽模拟物特异性结合细胞表面受体或其他细胞表面蛋白,在一些实施方式中,肽模拟物特异性结合至少一种本文所述的癌症相关抗原。在特定实施方式中,肽模拟物特异性结合本文所述的至少一种神经系统相关、疼痛相关和/或自身免疫相关的抗原。
类肽可以具有针对抗体所述的“特异性结合”特征(同上)。例如,类肽可以与本文所述的靶标特异性结合,其亲和力(Kd)至少为约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40或50nM。在某些实施方式中,类肽特异性结合细胞表面受体或其他细胞表面蛋白。在一些实施方式中,类肽特异性结合本文所述的至少一种癌症相关抗原。在特定的实施方式中,类肽特异性结合本文所述的至少一种神经系统相关、疼痛相关和/或自身免疫相关的抗原。
肽适体通常包括在两端连接到蛋白支架的可变肽环,这是双重结构约束,通常使肽适体的结合亲和力增加到与抗体相当的水平(例如,在纳摩尔范围内)。在某些实施方式中,可变环长度可以由约10-20个氨基酸(包括其间的所有整数)组成,并且支架可以包括具有良好溶解性和相容性的任何蛋白。某些示例性实施方式可以利用细菌蛋白硫氧还蛋白-A作为支架蛋白,将可变环插入还原活性位点(野生蛋白中的-Cys-Gly-Pro-Cys-环),两个半胱氨酸侧链为能够形成二硫键。识别肽适体的方法描述于例如美国申请号2003/0108532。
适体可具有针对抗体所述的“特异性结合”特征(同上)。例如,适体可以与本文所述的靶标特异性结合,其亲和力(Kd)至少为约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3,4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40或50nM。在特定的实施例中,适体特异性结合细胞表面受体或其他细胞表面蛋白。在一些实施方式中,适体特异性结合本文所述的至少一种癌症相关抗原。在特定的实施方式中,适体特异性结合本文所述的至少一种神经系统相关、疼痛相关和/或自身免疫相关的抗原。
示例性的基于碘的标记包括泛影酸(
可用作可检测实体的示例性的放射性同位素包括
可以用作直接检测的实体的荧光团或荧光染料的实例包括荧光素、四甲基罗丹明、德克萨斯红、
纳米颗粒的尺寸通常在约1-1000nm范围内,并且包括各种化学结构,例如金和银颗粒以及量子点。当用成角度的入射白光照射时,约40-120nm范围内的银或金纳米颗粒会散射高强度的单色光。散射光的波长取决于颗粒的尺寸。彼此接近的四到五个不同的颗粒将散射单色光,当它们叠加时,将给出特定的、唯一的颜色。衍生化的纳米颗粒(例如银或金颗粒)可以连接到各种各样的分子,包括蛋白、抗体、小分子、受体配体和核酸。纳米颗粒的具体实例包括金属纳米颗粒和金属纳米壳,例如金颗粒、银颗粒、铜颗粒、铂颗粒、镉颗粒、复合颗粒、金空心球、金涂覆的二氧化硅纳米壳和硅涂覆的金壳。还包括二氧化硅、胶乳、聚苯乙烯、聚碳酸酯、聚丙烯酸酯、PVDF纳米颗粒,和任何这些材料的有色颗粒。
量子点是直径约1-5nm的发荧光晶体,可被大范围波长的光激发。在被具有适当波长的光激发后,这些晶体发射光,例如单色光,其波长取决于它们的化学组成和尺寸。诸如CdSe、ZnSe、InP或InAs的量子点,具有独特的光学特性;这些量子点和类似的量子点可从许多商业来源(例如NN-实验室(NN-Labs),费耶特维尔,阿拉斯加;美国大洋纳米科技公司(Ocean Nanotech),费耶特维尔,阿拉斯加;Nanoco技术公司(Nanoco Technologies),曼彻斯特,英国;西格玛奥德里奇公司(Sigma-Aldrich),圣路易斯,密苏里)获得。
本文使用的术语“变体”是通常与本文具体公开的多肽不同的一个或多个取代、缺失、添加和/或插入的多肽。变体多肽具有生物学活性,也就是说,它们继续具有参考多肽的酶促或结合活性。这样的变体可以源自,例如遗传多态性和/或源自人为操纵。
在许多实施例中,具有生物活性的变体将包括一个或多个保守取代。“保守取代”是其中一个氨基酸被具有相似特性的另一种氨基酸取代,以使肽化学领域的技术人员可以预期该多肽的二级结构和亲水性质基本上不变。如上所述,可以对本发明的多核苷酸和多肽的结构进行修饰,并且仍然获得编码具有所需特性的变体或衍生多肽的功能分子。当期望改变多肽的氨基酸序列以产生本发明的多肽的等同或甚至改进的变体或部分时,本领域技术人员通常将根据下表A,改变编码DNA序列的一个或多个密码子。
例如,某些氨基酸可以代替蛋白结构中的其他氨基酸,而不会明显损失与结构(例如抗体的抗原结合区,或底物分子上的结合位点等)的相互作用结合能力。由于蛋白的相互作用能力和性质决定了蛋白的生物学功能活性,因此可以在蛋白序列当然以及其潜在的DNA编码序列中进行某些氨基酸序列取代,但仍获得具有类似特性的蛋白。因此,预期可以在所公开的组合物的肽序列,或者编码所述肽的相应DNA序列中进行各种改变,而不会明显损失它们的效用。
在进行这种改变时,可以考虑氨基酸的亲水指数。在本领域中通常理解亲水氨基酸指数在赋予蛋白相互作用生物学功能中的重要性(Kyte&Doolittle,1982,通过引用将其并入本文)。公认的是,氨基酸的相对亲水特性有助于所得蛋白的二级结构,继而定义了蛋白与其他分子(例如酶、底物、受体、DNA、抗体、抗原,等等)的相互作用。每种氨基酸都根据其疏水性和电荷特性而指定亲水指数(Kyte&Doolittle,1982),这些值为:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸(+2.5);蛋氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);果仁糖(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。本领域中已知某些氨基酸可以被具有相似的亲水指数或分数的其他氨基酸取代,并且仍然产生具有相似生物学活性的蛋白,即,仍然获得生物学功能上等同的蛋白。在进行这种改变时,亲水指数在±2之内的氨基酸的取代是优选的,在±1之内的那些氨基酸是特别优选的,而在±0.5之内的那些氨基酸甚至是更特别优选的。
在本领域中还应理解,可以基于亲水性有效地进行相似氨基酸的取代。美国专利4,554,101(特别地通过引用将其整体并入本文)指出,蛋白的最大局部平均亲水性(由其相邻氨基酸的亲水性决定)与蛋白的生物学特性相关。如美国专利4,554,101中所详述的,以下亲水性值已指定给氨基酸残基:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);果仁糖(-0.5±1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);蛋氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);色氨酸(-3.4)。可以理解,氨基酸可以替代具有相似亲水性值的另一种氨基酸,并且仍然获得生物学上等效的蛋白,特别是免疫学上等效的蛋白。在这种变化中,亲水性值在±2之内的氨基酸的取代是优选的,在±1之内的那些氨基酸是特别优选的,并且在±0.5之内的那些氨基酸甚至是更特别优选的。
如上所述,因此氨基酸取代通常基于氨基酸侧链取代基的相对相似性,例如它们的疏水性、亲水性、电荷、尺寸等。考虑了上述各种特征的示例性取代是本领域技术人员众所周知的,并且包括:精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。
可以基于残基的极性、电荷、溶解性、疏水性、亲水性和/或两亲性质的相似性,进一步进行氨基酸取代。例如,带负电荷的氨基酸包括天冬氨酸和谷氨酸;带正电荷的氨基酸包括赖氨酸和精氨酸;具有亲水性值相似的不带电荷的极性头基的氨基酸包括亮氨酸、异亮氨酸和缬氨酸;甘氨酸和丙氨酸;天冬酰胺和谷氨酰胺;以及丝氨酸、苏氨酸、苯丙氨酸和酪氨酸。其他可以代表保守变化的氨基酸的组包括:(1)ala、pro、gly、glu、asp、gin、asn、ser、thr;(2)cys、ser、tyr、thr;(3)val、ile、leu、met、ala、phe;(4)lys、arg、his;以及(5)phe、tyr、trp、his。
变体也可以或可替代地含有非保守改变。在优选的实施方式中,变体多肽与天然序列的区别在于取代、删除或添加少于约10、9、8、7、6、5、4、3、2个氨基酸,或甚至1个氨基酸。变体还可以(或可替代地)通过例如删除或添加对多肽的免疫原性、二级结构、酶活性,和/或亲水性质具有最小影响的氨基酸来实现。
在某些实施方式中,DSSHAFTLDELR的变体(SEQ ID NO:2)可以基于来自其他生物的p97序列的序列,如2016年6月14日公开的美国专利9364567的表B所示,该专利的全部内容通过引用并入本文,如同全文列出一样。
通常,变体将表现出与参考多肽序列至少约30%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的相似性,或序列一致性,或序列同源性。此外,与天然序列或亲本序列的区别在于,通过加成(例如(-末端加成、N-末端加成,或两者)、删除、截短、插入或取代约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100或更多个氨基酸,但考虑其保留亲本或参考多肽序列的性质或活性。
在一些实施方式中,变体多肽与参考序列的区别在于,至少一个但少于50、40、30、20、15、10、8、6、5、4、3或2个氨基酸残基。在其他实施方式中,变体多肽与参考序列的区别在于,残基至少为1%但小于20%、15%、10%或5%。(如果此比较需要比对,则应该对序列进行比对,以实现最大的相似性。来自删除或插入或错配中“圈出”(Looped out)的序列,则被视为差异。)
序列之间的序列相似性或序列一致性(这些术语在本文中可互换使用)的计算如下进行。为了确定两个氨基酸序列或两个核酸序列的一致性百分比,将序列进行比对,以达到最佳比较目的(例如,可以在第一和第二氨基酸或核酸序列中的一个或两个中引入空位以实现最佳比对,出于比较目的,可以忽略非同源序列)。在某些实施方式中,为了比较目的而设置的参考序列的长度为参考序列长度的至少30%,优选至少40%,更优选至少50%、60%,甚至更优选至少70%、80%、90%、100%。然后比较相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一序列中的位置被与第二序列中相应位置相同的氨基酸残基或核苷酸占据时,则分子在该位置是相同的。
这两个序列之间的一致性百分比是该序列共享的相同位置数的函数,考虑到空位的数量和每个空位的长度,需要引入这些空位才能实现两个序列的最佳比对。
序列的比较和两个序列之间一致性百分比的确定可以使用数学算法来完成。在一个优选的实施方式中,使用Needleman和Wunsch(J.Mo/.Biol.48:444-453,1970)算法,该算法已被并入到GCG软件的GAP程序中,使用Blossum 62矩阵或PAM250矩阵,空位权重为16、14、12、10、8、6或4,以及长度权重为1、2、3、4、5或6,来确定两个氨基酸序列之间的一致性的百分比。在又一个优选的实施方式中,使用GCG软件包中的GAP程序,使用NWSgapdna.CMP矩阵,其空位权重为40、50、60、70或80,长度权重为1、2、3、4、5或6时,来确定两个核苷酸序列之间的同一性百分比。一组特别优选的参数(除非另有说明,否则是应使用的一组参数)是Blossum 62评分矩阵,其具有的空位罚分为12,空位延伸罚分为4,移码空位罚分为5。
两个氨基酸或核苷酸序列之间的一致性百分比可以使用E.Meyers和W.Miller(Cabios.4:11-17,1989)的算法确定,其已使用PAM 120重量残基表、空位长度罚分为12,以及空位罚分为4,并入了ALIGN程序(2.0版)中。
本文所述的核酸和蛋白序列可以用作“查询序列”以对公共数据库进行搜索,例如,识别其他家族成员或相关序列。可以使用Altschul等人(1990,J.Mo/.Biol,215:403-10)的NBLAST和XBLAST程序(2.0版)进行这样的搜索。BLAST核苷酸搜索可以用NBLAST程序进行,分数=100,字长=12,以获得与本发明的核酸分子同源的核苷酸序列。BLAST蛋白搜索可以用XBLAST程序进行,分数=50,字长=3,以获得与本发明的蛋白分子同源的氨基酸序列。为了获得用于比较目的的空位比对,可以如Altschul等人(Nucleic Acids Res.25:3389-3402,1997)中所述,使用空位的BLAST。当使用BLAST和空位的BLAST程序时,可以使用各个程序的默认参数(例如XBLAST和NBLAST)。
在一个实施方式中,如上所述,可以使用BLAST比对工具评估多核苷酸和/或多肽。局部比对仅由一对序列片段组成,每个序列中的一个被比较。对史密斯-沃特曼(Smith-Waterman)或塞勒斯(Sellers)算法的修改将找到所有分数对,这些分数对不能通过扩展或修整来改善,称为高分细分对(HSP)。BLAST比对的结果包括统计量,以指示仅凭偶然就可以预期获得BLAST分数的可能性。
原始分数S,是根据与每个分数相关的空白和替换的数量计算得出的比对序列,其中较高的相似性分数表示更显著的比对。取代分数由查找表给出(参见PAM、BLOSUM)。
空位分数通常计算为G、空位开放罚分和L,空位扩展罚分之和。对于长度为n的空位,空位成本为G+Ln。空位成本的选择是G和Lis的经验值,但通常选择G(10-15)的高值(例如11,和用于L(1-2)的低值(例如1)。
比特分数S',是从原始比对分数S中得出的,其中已经考虑了所使用的评分系统的统计特性。相对于评分系统,位分数(bit score)进行了归一化,因此可以将它们用于比较来自不同搜索的比对分数。术语“位分数”和“相似性分数”可互换使用。位分数表明比对的程度;分数越高,比对越好。
E值,或期望值,描述了具有相似分数的序列偶然出现在数据库中的可能性。它是对分数比等于或好于S的不同比对的数量的预测,其可能偶然在数据库搜索中发生。E值越小,比对就越重要。例如,具有E-117的E值的比对,意味着具有相似分数的序列非常不可能仅仅是偶然地发生。另外,用于排列随机氨基酸对的预期分数必须是负的,否则长的比对将倾向于具有高分数,而与所排列的区段是否相关无关。此外,BLAST算法使用适当的取代矩阵、核苷酸或氨基酸添加,对于空位比对使用空位产生和延伸罚分。例如,BLAST比对和多肽序列的比较通常使用BLOSUM62矩阵、空位存在罚分为11,以及空位延伸罚分为1进行。
在一个实施方式中,从使用BLOSUM62矩阵进行的BLAST分析报告序列相似性分数,空位存在罚分为11,以及空位延伸罚分为1。
在特定实施方式中,本文提供的序列一致性/相似性评分的值,是通过:使用GAP版本10(GCG,Accelrys,圣地亚哥,加利福尼亚),其使用以下参数:使用GAP权重为50和长度权重为3的用于核苷酸序列的%一致性和%相似性,以及nwsgapdna.cmp评分矩阵;使用GAP权重为8和长度权重为2的用于氨基酸序列的%一致性和%相似性,以及BLOSUM62评分矩阵(Henikoff and Henikoff,PNAS USA.89:10915-10919,1992)。GAP使用Needleman和Wunsch的算法(J Mo/Biol.48:443-453,1970)来找到两个完整序列的比对,其使匹配数最大化,并且使空位数最小化。
如上所述,参考多肽可以以各种方式改变,包括氨基酸取代、删除、截短、添加和插入。用于这种操作的方法是本领域公知的。例如,参考多肽的氨基酸序列变体可以通过DNA中的突变来制备。诱变和核苷酸序列改变的方法是本领域众所周知的。参见,例如,Kunkel(PNAS USA.82:488-492,1985)。Kunkel等人(Methods in Enzymol.154:367-382,1987),美国专利号4,873,192,Watson.J.D.等人("Molecular Biology of the Gene,"FourthEdition,Benjamin/Cummings,Menlo Park,Calif.,1987)及其中引用的参考文献。关于不影响目的蛋白生物学活性的适当氨基酸取代的指南可以在Dayhoff et al.,(1978)Atlasof Protein Sequence and Structure(Natl.Biomed.Res.Found.,Washington,D.C.)中找到。
筛选通过这种修饰制成的组合文库的基因产物,以及筛选cDNA文库中具有选定特性的基因产物的方法是本领域已知的。这样的方法适用于快速筛选由参考多肽的组合诱变产生的基因库。作为一个实施例,递归集合诱变(REM)是一种提高文库中功能性突变体频率的技术,可以与筛选试验结合使用,以识别多肽变体((Arkin and Yourvan,PNAS USA 89:7811-7815,1992;Delgrave et al.,Protein Engineering.6:327-331,1993)。
所采用的特定偶联化学将取决于生物活性剂(例如,小分子、多肽)的结构,生物活性剂中多个官能团的潜在存在,保护/去保护步骤的需要,该试剂的化学稳定性,等等,并且本领域技术人员将容易确定。可用于制备本发明的p97缀合物的示例性的偶联化学,可以在例如Wong(1991),“Chemistry of Protein Conjugation and Crosslinking”,CRC Press,Boca Raton,Fla;以及Brinkley“A Brief Survey of Methods for Preparing ProteinConjugates with Dyes,Haptens,and Crosslinking Reagents”,Bioconjug.Chem.,3:2013,1992.中找到。优选地,由于所使用的缀合技术,例如相对于未缀合试剂或未缀合p97多肽,缀合物的结合能力和/或活性基本上没有降低。
在某些实施方式中,p97多肽序列可以直接或间接地偶联至目标试剂。当p97多肽序列和目标试剂各自具有能够彼此反应的取代基时,它们之间的直接反应是可能的。例如,亲核基团,例如氨基或巯基,在其上可能能够与含羰基的基团(例如酸酐或酰基卤),或与含有良好离去基团(例如,卤化物)的烷基进行反应。
可替代地,期望通过接头基团(包括非肽接头和肽接头)将p97多肽序列和目标氨基酸间接偶联。接头基团还可以充当间隔子,以使目标试剂与p97多肽序列间隔开,以避免干扰结合能力,靶向能力或其他功能。接头基团还可用于增加试剂上取代基的化学反应性,从而提高偶联效率。化学反应性的增加也可以促进试剂或试剂上的官能团的使用,而其他(方法)则是不可能的。也可以采用可释放或稳定的接头的选择来改变p97缀合物和目标附着剂的药代动力学。示例性的接头基团包括,例如,二硫基、硫醚基、酸不稳定基团、光不稳定基团、肽酶不稳定基团和酯酶不稳定基团。在其他说明性的实施方式中,缀合物包括接头基团,例如美国专利号5,208,020或欧洲专利O 425 235BI,以及Chari et al.,CancerResearch.52:127-131,1992。另外的示例性的接头描述如下。
在一些实施方式中,将一个以上的p97多肽序列偶联至试剂是所期望的,反之亦然。例如,在某些实施方式中,多个p97多肽序列与一种试剂偶联,或者可替代地,一种或多种p97多肽与多种试剂缀合。p97多肽序列可以相同或不同。不管具体的实施方式如何,包括多种p97多肽序列的结合物可以多种方式制备。例如,可以将一种以上的多肽直接地偶联到试剂上,或者可以使用提供多个连接位点的接头。可以使用多种已知的异双功能交联策略中的任一种来制备本发明的缀合物。应该理解,可以通过控制在缀合/交联过程中使用的材料的化学计量,来实现许多这些实施方式。
在某些示例性的实施方式中,在包含琥珀酰亚胺基酯官能团的试剂与包含氨基的p97多肽之间的反应形成酰胺连接键;在包含氧羰基咪唑官能团的试剂与包含氨基的P97多肽之间的反应形成氨基甲酸酯连接键;在包含对硝基苯碳酸根官能团的试剂与包含氨基的P97多肽之间的反应形成氨基甲酸酯连接键;在包含碳酸三氯苯基酯官能团的试剂与包含氨基的P97多肽之间的反应形成氨基甲酸酯连接键;在包含硫酯基官能团的试剂与包含n-末端氨基的P97多肽之间的反应形成酰胺连接键;在包含丙醛官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键。
在一些示例性实施方式中,在包含丁醛官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含缩醛官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含哌啶酮官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含甲基酮官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含甲苯磺酸酯(tresylate)官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含马来酰亚胺官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含醛官能团的试剂与包含氨基的P97多肽之间的反应形成仲胺连接键;在包含肼官能团的试剂与包含羧酸基团的P97多肽之间的反应形成仲胺连接键。
在特定的示例性的实施方式中,在包含马来酰亚胺官能团的试剂与包含硫醇基的P97多肽之间的反应形成硫醚连接键;在包含乙烯基砜官能团的试剂与包含硫醇基的P97多肽之间的反应形成硫醚连接键;在包含巯基官能团的试剂与包含硫醇基的P97多肽之间的反应形成二硫连接键;在包含邻二硫吡啶官能团的试剂与包含硫醇基的P97多肽之间的反应形成二硫连接键;在包含碘乙酰胺官能团的试剂与包含硫醇基的P97多肽之间的反应形成硫醚连接键。
在具体的实施方式中,胺-至-巯基交联剂用于制备缀合物。
在一个优选的实施方式中,例如,交联剂是琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-羧酸酯(SMCC)(赛默科技(Thermo Scientific)),其是在中等长度环己烷稳定的间隔臂(8.3埃)的相对端,包括NHS-酯和马来酰亚胺反应基团的巯基交联剂。SMCC是不可裂解的且可透过膜的交联剂,可用于产生巯基反应性的、马来酰亚胺活化的试剂(例如,多肽、抗体),用于随后与p97多肽序列反应。NHS酯与pH 7-9的伯胺反应形成稳定的酰胺键。马来酰亚胺与pH 6.5-7.5的巯基反应形成稳定的硫醚键。因此,SMCC的胺反应性NHS酯与试剂的伯胺迅速交联,然后所得的巯基反应性马来酰亚胺基团,可与p97的半胱氨酸残基反应,以产生具体的目标缀合物。
在某些具体的实施方式中,将p97多肽序列修饰为含有暴露的巯基基团以促进交联,例如,促进与马来酰亚胺活化剂的交联。在更具体的实施方式中,用修饰伯胺的试剂修饰p97多肽序列,以添加受保护的硫醇巯基。在甚至更具体的实施方式中,试剂N-琥珀酰亚胺-S-乙酰基硫代乙酸酯(SATA)(赛默科技)用于产生硫醇化的p97多肽。
在其他具体的实施方式中,马来酰亚胺活化剂在合适的条件下与硫醇化的p97多肽反应以产生本发明的缀合物。应当理解,通过在这些反应中控制SMCC、SATA、试剂和p97多肽的比例,可以产生具有不同化学计量、分子量和性质的缀合物。
在其他说明性实施方式中,通过使用双功能蛋白偶联剂制备缀合物,例如N-琥珀酰亚胺-3-(2-吡啶基二硫代)丙酸酯(SPDP)、琥珀酰亚胺-4-(N-酰亚胺基甲基)环己烷-1-羧酸酯、亚胺基硫醇烷(IT)、亚氨基酸酯的双官能衍生物(例如己二亚胺酸二甲酯HCL)、活性酯(例如辛二酸二琥珀酰亚胺基酯)、醛(例如戊二醛)、双叠氮基化合物(例如双(对-叠氮基苯甲酰基)己二胺)、双重氮衍生物(例如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(例如甲苯2,6-二异氰酸酯)和双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)。特定的偶联剂包括N-琥珀酰亚胺-3-(2-吡啶基二硫代)丙酸酯(SPDP)(Carlsson et al.,Biochem.J.173:723-737[1978])和N-琥珀酰亚胺基-4-(2-吡啶基硫基)戊酸酯(SPP),以提供二硫连接键。
本文讨论的具体交联策略,只是可用于生产本发明的缀合物的合适的缀合策略的许多实施例中的几个。对本领域技术人员显而易见的是,可以使用多种其他的双官能或多官能试剂,其均是同功能的和异功能的(例如目录中描述的那些(皮尔斯化学公司(PierceChemical Co.),罗克福德,伊利诺伊)),可以作为接头组。可以通过例如氨基、羧基、巯基,或氧化的碳水化合物残基来实现偶联。有许多参考文献描述了这种方法,例如,Rodwell等人的美国专利号4,671,958。
特定的实施方式可以采用一种或多种醛标记,以促进p97多肽与试剂之间的缀合(参见美国专利号8,097,701和7,985,783,通过引用并入)。在此,通过甲酰基甘氨酸生成酶(FGE)的作用,对醛标记的硫酸酯酶基序进行酶修饰,生成甲酰甘氨酸(FGly)残基。然后可以将FGly残基的醛部分随后可被用作化学处理,用于将目标部分定位于多肽上。在一些方面,目标部分是小分子、类肽、适体或肽模拟物。在一些方面,目标部分是另一种多肽,例如抗体。
具有上述基序的多肽可以通过FGE酶修饰以产生具有FGly残基的基序,如上所述,该基序可用于,例如通过连接体部分的第二多肽等试剂的位点特异性连接。例如,可以通过在表达FGE酶的哺乳动物、酵母或细菌细胞中表达含硫酸酯酶基序的多肽(例如p97,抗体),或通过用分离的FGE酶对分离的多肽进行体外修饰,来执行此类修饰(参见Wu et al.,PNAS.106:3000-3005,2009;Rush and Bertozzi,J.Am Chem Soc.130:12240-1,2008;以及Carlson et al.,J Biol Chem.283:20117-25,2008)。
试剂或不含醛标记的多肽(例如,抗体、p97多肽)可与一个或多个醛反应基团(例如氨基氧基、酰肼和氨基硫脲)官能化,然后通过所述至少一个FGly残基共价地连接到所述含醛标记的多肽上,形成醛反应连接键。氨氧基官能化试剂(或不含醛标记的多肽)的附着在FGly残基和官能化试剂(或不含醛标记的多肽)之间,形成肟连接键;酰肼官能化试剂(或不含醛标记的多肽)的附着在FGly残基和官能化试剂(或不含醛标记的多肽)之间,形成了肼连接键;以及硫代氨基甲酰氨基官能化试剂(或不含醛标记的多肽)的附着在FGly残基和官能化试剂(或不含醛标记的多肽)之间,形成肼甲酰胺连接键。因此,在这些和相关的实施方式中,R1可以是包括席夫碱的连接键,例如肟连接键、肼连接键或肼甲酰胺连接键。
某些实施方式包括以下缀合物:(i)含硫酸酯酶基序(或醛标记)的p97多肽,以及(ii)含硫酸酯酶基序(或醛标记)的多肽试剂(A),其中(i)和(ii)通过它们各自的FGly残基(可选地通过双官能化的接头部分或基团)共价连接。
在一些实施方式中,含p97多肽的醛标记,和含试剂的醛标记,通过多功能接头(例如,双功能接头)连接(例如,共价地连接),后者被相同或不同的醛反应性基团官能化。在这些相关的实施方式中,醛反应性基团允许接头通过它们各自的FGly残基,在p97多肽和试剂之间形成共价桥。接头部分包括可以任何部分或化学物质,其可以被一个或多个醛反应性基团官能化,优选地,被双官能化或多官能化。特定的实例包括肽、水溶性聚合物、可检测的实体、其他治疗化合物(例如,细胞毒性化合物),生物素/链霉亲和素部分和聚糖(参见Hudak et.al.,J Am Chem Soc.133:16127-35,2011)。
聚糖(或糖苷)的具体实例包括氨氧基聚糖,例如由糖基N-戊烯酰基异羟肟酸酯中间体构成的高阶聚糖(同上)。示例性的接头在本文中描述,并且可以根据本领域的常规技术用醛反应性基团官能化(参见,例如,Carrico et al.,Nat Chem Biol.3:321-322,2007;以及美国专利号8,097,701和7,985,783)。
p97缀合物也可以通过多种“点击化学”技术制备,包括模块化、范围广、产率高、主要产生无害副产物的反应,这些副产物可以通过非色谱法去除,并且可以立体定向但不一定是具有对映选择性的(参见Kolb et al.,Angew Chem Int Ed Engl.40:2004-2021,2001)。特定的实例包括使用叠氮化物和炔烃的Huisgen 1,3-偶极环加成反应(也称为“叠氮炔环加成(azide-alkyne cycloaddition)”反应)的缀合技术(参见Hein et al.,PharmRes.25:2216-2230,2008)。叠氮炔环加成反应的非限制性实施例,包括铜催化叠氮炔环加成(CuAAC)反应和钌催化叠氮炔环加成(RuAAC)反应。
CuAAC在较宽的温度范围内起作用,对水性条件不敏感并且pH在4至12范围内,并且可耐受较宽范围的官能团(参见Himo et al.,J Am Chem Soc.127:210-216,2005)。活性Cu(I)催化剂可以例如使用抗坏血酸钠作为还原剂,由Cu(I)盐或Cu(II)盐产生。此反应生成1,4-取代产物,使其具有区域特异性(参见Hein et al.,同上)。
RuAAC利用五甲基环戊二烯基氯化钌[Cp*RuCl]复合物,可选择性地产生1,5-二取代的1,2,3-三唑,该复合物能够催化叠氮化物与末端炔烃的环加成反应(参见Rasmussenet al.,Org.Lett.9:5337-5339,2007)。此外,与CuAAC相比,RuAAC还可以与内部炔烃一起使用,以提供完全取代的1,2,3-三唑。
因此,某些实施方式包括p97多肽,其包括至少一个具有叠氮化物侧链或炔烃侧链的非天然氨基酸,包括内部和末端的非天然氨基酸(例如,N-末端、(-末端)。某些p97多肽可通过在体内或体外(例如无细胞系统)与含有叠氮侧链或炔烃侧链的非天然氨基酸结合而形成。示例性的体内技术包括细胞培养技术,例如,使用修饰的大肠杆菌(参见Travis andSchultz,The Journal of Biological Chemistry.285:11039-44,2010;以及Deiters andSchultz,Bioorganic&Medicinal Chemistry Letters.15:1521-1524,2005),示例性的体外技术包括不含细胞的系统(参见Bundy,Bioconjug Chem.21:255-63,2010)。
在一些实施方式中,含有至少一种非天然氨基酸和叠氮侧链的p97多肽通过叠氮炔环加成与包括至少一个炔基的试剂(或接头)缀合,例如含有至少一种具有炔烃侧链的非天然氨基酸的多肽制剂。在其他实施方式中,通过叠氮炔烃环加成,将包括至少一种非天然氨基酸和炔烃侧链的p97多肽与包括至少一个叠氮基的试剂(或接头)缀合,例如包括至少一种具有叠氮侧链的非天然氨基酸的多肽试剂。因此,某些实施方式包括包含通过1,2,3-三唑连接键共价地连接到试剂的p97多肽的缀合物。
在某些实施方式中,具有叠氮化物侧链的非天然氨基酸和/或具有炔烃侧链的非天然氨基酸是末端氨基酸(N-末端,(-末端)。在某些实施例中,一种或多种非天然氨基酸为内部氨基酸。
例如,某些实施方式包括p97多肽,其包括N-末端非天然氨基酸,该叠氮化合物侧链与叠氮侧链缀合至包括炔基的试剂。一些实施方式包括p97多肽,其包括(-末端非天然氨基酸,其叠氮侧链与包括炔基的试剂缀合。特定的实施方式包括p97多肽,该p97多肽包括N-末端的非天然氨基酸,其炔基侧链与含有叠氮侧基的试剂缀合。进一步的实施方式包括p97多肽,其包括(-末端非天然氨基酸,其炔烃侧链与包括叠氮化物侧基的试剂缀合。一些实施例包括p97多肽,其包括至少一种内部非天然氨基酸,其具有的叠氮侧链与包括炔基的试剂缀合。额外的实施方式包括p97多肽,其包括至少一种内部非天然氨基酸,其具有炔烃侧链与包括叠氮侧基的试剂缀合。
特定的实施方式包括p97多肽,其包括具有叠氮化合物侧链的N-末端非天然氨基酸,与包括具有炔烃侧链的N-末端非天然氨基酸的多肽试剂缀合。其他实施方式包括p97多肽,其包括具有叠氮化物侧链的(-末端非天然氨基酸,与包括具有炔烃侧链的(-末端非天然氨基酸的多肽试剂缀合。还有其他实施方式包括p97多肽,其包括具有叠氮化合物侧链的叠氮化物侧链的N-末端非天然氨基酸,与包括具有炔烃侧链的(-末端非天然氨基酸的多肽试剂缀合。进一步的实施方式包括p97多肽,其包括具有叠氮化合物侧链的(-末端非天然氨基酸,与包括具有炔烃侧链的N-末端非天然氨基酸的多肽试剂缀合。
其他实施方式包括p97多肽,其包括具有炔烃侧链的N-末端非天然氨基酸,与包括具有叠氮侧链的N-端非天然氨基酸的多肽试剂缀合。还有进一步的实施方式包括p97多肽,其包括带有炔烃侧链的(-末端非天然氨基酸,与包括带有叠氮侧链的(-末端非天然氨基酸的多肽试剂缀合。其他实施方式包括p97多肽,其包括具有炔烃侧链的N-端非天然氨基酸,与包括具有叠氮侧链的(-末端非天然氨基酸的多肽试剂缀合。仍进一步的实施方式包括p97多肽,其包括具有炔烃侧链的(-末端非天然氨基酸,与包括具有叠氮侧链的N-端非天然氨基酸的多肽试剂缀合。
还包括生产p97缀合物的方法,其包括:(a)进行叠氮化物炔烃之间的环加成反应,所述环加成反应在(i)p97多肽,其包括至少一种具有叠氮侧链的非天然氨基酸,以及一种试剂,其包含至少一个炔基(例如,具有炔侧链的非天然氨基酸);或(ii)p97多肽,其包括至少一种具有炔侧链的非天然氨基酸,以及一种试剂,其和包括至少一个叠氮基团(例如,具有叠氮侧链的非天然氨基酸);以及(b)从反应中分离出p97缀合物,两者之间,从而产生p97缀合物。
在p97缀合物是融合多肽的情况下,通常可以使用标准技术来制备融合多肽。然而,优选地,融合多肽在本文所述和本领域已知的表达系统中表达为重组多肽。本发明的融合多肽可以包括一个或多个拷贝的p97多肽序列,并且可以包括目标的(例如抗体或其抗原结合片段)基于多肽的试剂,其以任何所期望的方式排列。
对于融合蛋白,可以分别组装编码p97多肽、多肽试剂(例如抗体),和可选的肽接头组分的DNA序列,然后连接到合适的表达载体中。编码一个多肽成分的DNA序列的3'端,其有或没有肽接头,连接到编码其他多肽成分的DNA序列的5'端,从而使序列的阅读框(reading frame)是同相的。连接的DNA序列与合适的转录或翻译调节元件可操作地连接。负责DNA表达的调控元素,仅位于编码第一多肽的DNA序列的5'。类似地,终止翻译和转录终止信号所需的终止密码子仅出现在编码最多(-末端)多肽的DNA序列的3'端。这允许翻译成单个融合多肽,并保留两种成分多肽的生物学活性。
类似的技术,主要是调控元素(例如启动子、终止密码子和转录终止信号)的排列,可用于重组重组非融合蛋白,例如,用于生产非融合缀合物的p97多肽和多肽试剂(例如抗体试剂)。
本发明的多核苷酸和融合多核苷酸,可以包括一个或多个拷贝的编码p97多肽序列的核酸,和/或可以包括一个或多个拷贝的编码多肽试剂的核酸。
在一些实施方式中,将编码受试者p97多肽、多肽试剂和/或p97-多肽融合体的核酸,直接引入宿主细胞,并在足以诱导编码的多肽表达的条件下孵育细胞。可以使用本领域技术人员熟知的标准技术,结合本文提供的多肽和核酸序列,来制备本公开的多肽序列。
因此,根据某些相关的实施方式,提供了重组宿主细胞,其包括编码本文所述多肽的多核苷酸或融合多核苷酸。p97多肽、多肽试剂或p97-多肽试剂融合在宿主细胞中的表达,可通过在适当条件下培养含有多核苷酸的重组宿主细胞来方便地实现。通过表达产生后,可以使用任何合适的技术分离和/或纯化多肽,然后根据需要使用。
在多种不同宿主细胞中克隆和表达多肽的系统是众所周知的。合适的宿主细胞包括细菌、哺乳动物细胞、酵母和杆状病毒系统。
本领域可用于表达异源多肽的哺乳动物细胞系,包括中国仓鼠卵巢(CHO)细胞、Hela细胞、幼仓鼠肾细胞、HEK-293细胞,NSO小鼠黑素瘤细胞等。常见的首选细菌宿主是f大肠杆菌(f.coli.)。多肽在本领域中,原核细胞例如f大肠杆菌中的表达是众所周知的。对于评论,参见例如Pluckthun,A.Bio/Technology.9:545-551(1991)。作为重组生产多肽的选择,本领域技术人员也可以在培养物中的真核细胞中表达(参见Ref,Curr.OpinionBiotech.4:573-576,1993;以及Trill et al.,Curr.Opinion Biotech.6:553-560,1995。
可以选择或构建合适的载体,其包括合适的调控序列,包括启动子序列、终止子序列、聚腺苷酸化序列、增强子序列、标记基因和其他合适的序列。载体可以是质粒、病毒,例如噬菌体或噬菌粒,视情况而定。有关更多细节,参见,例如,Molecular Cloning:aLaboratory Manual:2nd edition,Sambrook et al.,1989,冷泉港实验室出版社(ColdSpring Harbor Laboratory Press)。许多已知的核酸操作技术和方案,例如在制备核酸构建体、诱变、测序、将DNA导入细胞和基因表达以及蛋白质分析中,在Current Protocols inMolecular Biology,Second Edition,Ausubel et al.eds.,John Wiley&Sons,1992或其后续更新中有详细描述。
术语“宿主细胞”用于指已被导入或能够被导入编码本文所述的一种或多种多肽的核酸序列的细胞,并且其进一步表达或能够被表达所选目的基因,例如编码本文所述的任何多肽的基因的表达。该术语包括亲代细胞的后代,无论该后代的形态或遗传组成是否与原始亲代相同,只要存在所选基因即可。可以选择具有特定特征的宿主细胞,例如表达甲酰甘氨酸的酶(FGE)将硫酸酯酶基序中的半胱氨酸或丝氨酸残基转化为甲酰甘氨酸(FGly)残基,或者氨酰基tRNA合成酶的表达,其可以将非天然氨基酸并入多肽中,包括具有叠氮化物侧链、炔烃侧链或其他所需侧链的非天然氨基酸,以促进缀合。
因此,还考虑了包括将这样的核酸引入宿主细胞中的方法。核酸的引入可以采用任何可用的技术。对于真核细胞,合适的技术可包括磷酸钙转染、DEAE-葡聚糖、电穿孔、脂质体介导的转染和使用逆转录病毒或其他病毒(例如牛痘)或杆状病毒(对于昆虫细胞)进行转导。对于细菌细胞,合适的技术可能包括氯化钙转化、电穿孔和使用噬菌体的转染。引入之后可以引起或允许核酸表达,例如通过在表达基因的条件下培养宿主细胞。在一实施方式中,核酸被整合到宿主细胞的基因组(例如染色体)中。根据标准技术,可以通过包括促进与基因组重组的序列来促进整合。
在某些实施方式中,本发明还提供了一种方法,该方法包括在表达系统中使用本文所述的核酸构建体,以表达特定的多肽,例如p97多肽、多肽试剂或p97-多肽试剂融合蛋白,如本文所述。
如上所述,某些p97缀合物,例如融合蛋白,可以采用一个或多个接头基团,包括非肽接头(例如,非蛋白接头)和肽接头。这样的接头可以是稳定的接头或可释放的接头。
示例性的非肽稳定连接键包括琥珀酰亚胺、丙酸、羧甲基连接键、醚、氨基甲酸酯、酰胺、胺、碳酰二胺、酰亚胺、脂族C-C连接键、硫醚连接键、硫代氨基甲酸酯、硫代碳酰二胺等。通常,水解稳定的连接键是在生理条件下,每天表现出小于约1-2%至5%的水解速率的连接键。
示例性的非肽可释放的连接键包括羧酸酯、磷酸酯、酸酐、乙缩醛、缩酮、酰氧基烷基醚、亚胺、原酸酯、硫代酯、硫醇酯、碳酸酯和腙连接键。可释放的接头的其他示例性实施例可以是基于苄基消除的接头、基于三烷基锁的接头(或基于三烷基锁内酯化的基)、基于二甘氨酸的接头,和酸不稳定的接头。在酸不稳定的接头中可以是二硫键、含腙的接头和含硫代丙酸酯的接头。还包括在内化成细胞的过程中或之后可释放或可切割的接头。用于从这些接头基团向细胞内释放试剂的机制包括通过还原二硫键(例如,Spitier的美国专利号4,489,710),通过辐照对光不稳定的键(例如,Senter等人的美国专利号4,625,014),通过水解衍生化的氨基酸侧链(例如,Kohn等人的美国专利号4,638,045),通过血清补体介导的水解(例如,Rodwell等人的美国专利号4,671,958),以及酸催化水解(例如,Blattler等人的美国专利号4,569,789)。在一个实施方式中,可以使用酸不稳定的接头(CancerResearch52:127-131,1992;和美国专利号5,208,020)。进一步的细节是本领域技术人员已知的。参见,例如,美国专利号9364567。
在某些实施方式中,“水溶性聚合物”用于接头中以将p97多肽序列偶联至目标试剂。“水溶性聚合物”是指可溶于水并且通常基本上无免疫原性,并且通常具有大于约1,000道尔顿的原子分子量的聚合物。可能需要通过水溶性聚合物附着两个多肽,因为这样的修饰可以通过增加血清半衰期,例如通过增加蛋白水解稳定性和/或减少肾清除率来增加治疗指数。另外,通过一种或多种聚合物的附着,可以降低蛋白药物的免疫原性。
水溶性聚合物的特定的实例包括聚乙二醇、聚丙二醇、聚氧化烯,或聚乙二醇、聚丙二醇等的共聚物。
在一些实施方式中,水溶性聚合物的有效流体力学分子量大于约10,000Da,大于约20,000至500,000Da,大于约40,000至300,000Da,大于约50,000至70,000Da,通常大于约60,000Da。“有效流体力学分子量”是指通过水基尺寸排阻色谱法(SEC)测试的聚合物链的有效水溶尺寸。当水溶性聚合物包括具有聚环氧乙烷重复单元,例如环氧乙烷重复单元的聚合物链时,每条链的原子分子量可以在约200Da至约80,000Da之间,或约1,500Da至约42,000Da之间,其中2,000到约20,000Da特别令人感兴趣。还包括线性、分支型和末端带电荷的水溶性聚合物。
在作醛标记的多肽之间用作接头的聚合物可以具有宽范围的分子量和聚合物亚基。这些亚基可包括生物聚合物、合成的聚合物,或其组合。这样的水溶性聚合物的实例包括:葡聚糖和葡聚糖衍生物,包括硫酸葡聚糖、P-氨基交联糊精和羧甲基糊精、纤维素和纤维素衍生物,包括甲基纤维素和羧甲基纤维素、淀粉和糊精,以及淀粉的衍生物和羟基、聚亚烷基二醇及其衍生物,包括聚乙二醇(PEG)、甲氧基聚乙二醇、聚乙二醇均聚物、聚丙二醇均聚物、乙二醇与丙二醇的共聚物,其中所述均聚物和共聚物未被取代或在一个末端被烷基取代,肝素和肝素的片段、聚乙烯醇和聚乙烯基醚、聚乙烯吡咯烷酮、天冬酰胺和聚氧乙烯化多元醇,以及右旋糖酐和右旋糖酐衍生物、糊精和糊精衍生物。应当理解的是,还包括具体描述的水溶性聚合物的各种衍生物。
水溶性聚合物是本领域已知的,特别是基于聚氧化烯的聚合物,例如聚乙二醇“PEG”(参见(Poly(ethylene glycol)Chemistry:Biotechnical and BiomedicalApplications,J.M.Harris,Ed.,Plenum Press,New York,N.Y.(1992);和Poly(ethyleneglycol)Chemistry and Biological Applications,J.M.Harris and S.Zalipsky,Eds.,ACS(1997);以及国际专利申请:WO 90/13540、WO 92/00748、WO 92/16555、WO 94/04193、WO94/14758、WO94/17039、WO 94/18247、WO 94/28937、WO 95/11924、WO 96/00080、WO 96/23794、WO 98/07713、WO 98/41562、WO 98/48837、WO 99/30727、WO 99/32134、WO 99/33483、WO 99/53951、WO 01/26692、WO 95/13312、WO 96/21469、WO 97/03106、WO 99/45964,以及美国专利号4,179,337;5,075,046;5,089,261;5,100,992;5,134,192;5,166,309;5,171,264;5,213,891;5,219,564;5,275,838;5,281,698;5,298,643;5,312,808;5,321,095;5,324,844;5,349,001;5,352,756;5,405,877;5,455,027;5,446,090;5,470,829;5,478,805;5,567,422;5,605,976;5,612,460;5,614,549;5,618,528;5,672,662;5,637,749;5,643,575;5,650,388;5,681,567;5,686,110;5,730,990;5,739,208;5,756,593;5,808,096;5,824,778;5,824,784;5,840,900;5,874,500;5,880,131;5,900,461;5,902,588;5,919,442;5,919,455;5,932,462;5,965,119;5,965,566;5,985,263;5,990,237;6,011,042;6,013,283;6,077,939;6,113,906;6,127,355;6,177,087;6,180,095;6,194,580;6,214,966,通过引用并入)。
示例性的目标聚合物包括含有聚氧化烯、聚酰胺-氧化烯或其衍生物的那些,包括聚环氧烷和包括环氧烷重复单元的聚酰胺环氧烷。目标的其他示例性的聚合物包括分子量大于约1,000道尔顿的聚酰胺。其他示例性的水溶性重复单元包括环氧乙烷。此类水溶性重复单元的数目可以显著地变化,此类单元的通常数目为2至500,2至400,2至300,2至200,2至100,并且最通常为2至50。
在某些实施方式中,可以使用肽接头序列来分离或偶联p97缀合物的组分。例如,对于多肽-多肽缀合物,肽接头可以将组分分开足够的距离,以确保每个多肽折叠成其二级和三级结构。可以使用本文描述的和本领域熟知的标准技术将这样的肽接头序列掺入缀合物(例如融合蛋白)中。可以基于以下因素选择合适的肽接头序列:(1)它们采用柔性延伸构象的能力;(2)它们不能采用可以与第一和第二多肽上的功能性表位相互作用的二级结构;(3)缺乏可能与多肽功能性表位反应的疏水或带电残基。可用作接头的氨基酸序列包括在Maratea et al.,Gene 40:39-46,1985;Murphy et al.,Proc.Natl.Acad.Sci.USA 83:8258-8262,1986;美国专利号4,935,233和美国专利号4,751,180中所公开的那些。
在某些说明性实施方式中,肽接头为约1至5个氨基酸之间,5至10个氨基酸之间,5至25个氨基酸之间,5至50个氨基酸之间,10至25个氨基酸之间,10至50个氨基酸之间,10至100个氨基酸之间,或任何介于中间范围的氨基酸。在其他说明性实施方式中,肽接头包括长度约1、5、10、15、20、25、30、35、40、45、50或更多个氨基酸。特定的接头可具有约1-200个氨基酸、1-150个氨基酸、1-100个氨基酸、1-90个氨基酸、1-80个氨基酸、1-70个氨基酸、1-60个氨基酸、1-50个氨基酸、1-40个氨基酸、1-30个氨基酸、1-20个氨基酸、1-10个氨基酸、1-5个氨基酸、1-4个氨基酸、1-3个氨基酸的总长度,或约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、60、70、80、90、100,或更多的氨基酸。
肽接头可采用任何一种或多种天然存在的氨基酸、非天然存在的氨基酸、氨基酸类似物和/或氨基酸类似物,如本文其他地方所述和本领域已知的。可以有用地用作接头的某些氨基酸序列包括在Maratea et al.,Gene 40:39-46,1985;Murphy et al.,PNASUSA.83:8258-8262,1986;
美国专利号4,935,233和美国专利号4,751,180中公开的那些。特定的肽接头序列包括Gly、Ser和/或Asn残基。如果需要,还可以在肽接头序列中使用其他接近中性的氨基酸,例如Thr和Ala。这些和相关氨基酸的其他组合对于本领域技术人员将是显而易见的。
在具体的实施方式中,接头序列包括Gly3接头序列,其包括三个甘氨酸残基。在特定实施方式中,可以使用能够对DNA结合位点和肽本身建模的计算机程序,来合理设计柔性接头(Desjarlais&Berg,PNAS.90:2256-2260,1993;以及PNAS.91:11099-11103,1994)或通过噬菌体展示的方法。
肽接头可以是生理上稳定的,或者可以包括可释放的接头,例如生理上可降解的或酶可降解的接头(例如,蛋白水解可裂解的接头)。在某些实施方式中,一个或多个可释放的接头可以导致较短的半衰期和更快的缀合物清除。这些以及相关的实施方式,可以用于例如增强p97缀合物在血流中的溶解度和血液循环寿命,同时还可以将一种药物在接头降解后递送到血液中(或穿过BBB),基本上没有p97序列。这些方面在多肽或其他试剂,当其永久缀合至p97序列并且活性降低时,这一情况下是特别有用的。通过使用本文提供的接头,当以缀合形式使用时,此类抗体可以保持其治疗活性。以这些和其他方式,可以更有效地定制p97缀合物的特性,以平衡抗体的生物活性和随时间的循环半衰期。
适用于本发明特定实施方式的可酶降解的连接键包括但不限于:被丝氨酸蛋白酶(例如凝血酶、胰凝乳蛋白酶、胰蛋白酶、弹性蛋白酶、激肽释放酶或枯草杆菌蛋白酶)切割的氨基酸序列。
适用于本发明的特定实施方式的可酶降解的连接键还包括,可以被基质金属蛋白酶(例如大肠杆菌蛋白酶、溶血素和明胶酶)切割的氨基酸序列。
适用于本发明的特定实施方式的可酶降解的连接键还包括,可以被血管紧张素转化酶切割的氨基酸序列。
适用于本发明的特定实施方式的可酶降解的连接键还包括,可以被组织蛋白酶B降解的氨基酸序列。
然而,在某些实施方式中,非肽或肽接头中的任何一个或多个是可选的。例如,在第一和第二多肽具有非必需的N-末端和/或(-末端的氨基酸区域,可用于分离功能域并防止空间干扰的融合蛋白中,可能不需要接头序列。
可以使用本领域技术人员已知的多种方法,来评估本文所述的p97多肽和p97多肽缀合物的功能特性,包括例如亲和力/结合测试(例如,表面等离振子共振、竞争性抑制测试);以及使用体外或体内模型细胞毒性测试、细胞活力测试、细胞增殖或分化测试、癌症细胞和/或肿瘤生长抑制。例如,可以测试本文所述的缀合物对受体内在化、体外和体内功效等的影响,包括穿过血脑屏障的转运速率。可以使用本领域技术人员已知的完善的方案来进行这样的测试(参见,例如,Current Protocols in Molecular Biology(GreenePubl.Assoc.Inc.&John Wiley&Sons,Inc.,NY,NY);Current Protocols in Immunology(Edited by:John E.Coligan,Ada M.Kruisbeek,David H.Margulies,Ethan M.Shevach,Warren Strober 2001John Wiley&Sons,NY,NY);或市售试剂盒。
使用方法和药物组合物
本发明的某些实施方式涉及使用本文所述的p97多肽和p97缀合物的组合物的方法。这种方法的实例包括治疗方法和诊断方法,包括例如使用p97缀合物对某些器官/组织(例如神经系统的器官)进行医学成像。具体的实施方式包括诊断和/或治疗中枢神经系统(CNS)的疾病或病症,或具有CNS成分的疾病或病症的方法。
因此,某些实施方式包括治疗需要其的受试者的方法,其包括施用包括本文所述的p97缀合物的组合物。在这些和相关实施方式中的某些实施方式中,还包括将试剂递送至受试者的神经系统(例如中枢神经系统组织)的方法。在某些的这些和相关实施方式的中,相对于,例如,通过仅包括该试剂的组合物的递送,该方法增加了试剂向中枢神经系统组织的递送速度。
在一些情况下,受试者患有CNS的疾病、病症或症状,其中相对于周围组织,穿过血脑屏障到达CNS组织的治疗剂的增加的递送,可以改善治疗,例如通过减少与以下疾病有关的副作用。CNS的示例性的疾病、病症和症状包括各种癌症,包括原发性和转移性CNS癌症、溶酶体贮积病、神经退行性疾病,例如阿尔茨海默氏病,以及自身免疫性疾病如多发性硬化症。
因此,某些实施方式涉及用于治疗中枢神经系统(CNS)(可选脑)的癌症的方法,其中需要其受试者患有这种癌症,或处于发展这种症状的风险中。在一些实施方式中,癌症是CNS的原发癌,例如脑的原发癌。例如,这些方法可以用于治疗神经胶质瘤、脑膜瘤、垂体腺瘤、前庭神经鞘瘤、原发性CNS淋巴瘤,或原始神经外胚层肿瘤(髓母细胞瘤)。在一些实施方式中,神经胶质瘤是星形细胞瘤、少突胶质细胞瘤、室管膜瘤或脉络丛乳头状瘤,在某些实施方式中,原发性CNS或脑癌是多形胶质母细胞瘤,例如巨细胞胶质母细胞瘤或胶质肉瘤。
在特定的实施方式中,所述癌症是CNS的转移性癌症,例如已经转移至脑部的癌症。此类癌症的例子,包括但不限于,乳腺癌、肺癌、泌尿生殖道癌、胃肠道癌(例如大肠癌、胰腺癌)、骨肉瘤、黑色素瘤、头颈癌、前列腺癌(例如前列腺腺癌),和淋巴瘤。因此,某些实施方式包括通过向患者施用治疗的有效量的本文公开的缀合物(例如,在数量上,在施用后,以统计学上显著的方式抑制、预防或延迟癌症转移,即相对于本领域技术人员已知的适当的控制)。在特定实施方式中,受试者患有尚未转移至中枢神经系统的癌症,包括在已知的领域的一种或多种上述癌症。
在特定实施方式中,癌症(细胞)表达,或过表达Her2/neu、B7H3、CD20、Herl/EGF受体、VEGF受体、PDGF受体、CD30、CD52、CD33、CTLA-4或肌腱蛋白的一种或多种。
还包括其他癌症的治疗,包括乳腺癌、前列腺癌、胃肠癌、肺癌、卵巢癌、睾丸癌、头颈癌、胃癌、膀胱癌、胰腺癌、肝癌、肾癌、鳞状细胞癌癌、黑色素瘤、非黑色素瘤癌、甲状腺癌、子宫内膜癌、上皮肿瘤、骨癌或造血癌。因此,在某些实施方式中,用p97缀合物治疗的癌细胞过表达或与癌症抗原相关,例如人Her2/neu、Herl/EGF受体(EGFR)、Her3、A33抗原、B7H3、CDS、CD19、CD20、CD22、CD23(IgE受体)、C242抗原、ST4、IL-6、IL-13、血管内皮生长因子VEGF(例如VEGF-A)VEGFR-1、VEGFR-2、CD30、CD33、CD37、CD40、CD44、CD51、CD52、CD56、CD74、CD80、CD152、CD200、CD221、CCR4、HLA-DR、CTLA-4、NPC-IC、肌腱蛋白、波形蛋白、胰岛素样生长因子1受体(IGF-IR)、甲胎蛋白、胰岛素样生长因子1(IGF-1)、碳酸酐酶9(CA-IX)、癌胚抗原(CEA)、整联蛋白av 3、整联蛋白a5 1、叶酸受体1、跨膜糖蛋白NMB、成纤维细胞活化蛋白α(FAP)、糖蛋白75、TAG-72、MUCl、MUC16(或CA-125)、磷脂酰丝氨酸、前列腺特异性膜抗原(PMSA)、NR-LU-13抗原、TRAIL-RI、肿瘤坏死因子受体超家族成员10b(TIMFRSFIOB或TRAIL-R2)、SLAM家族成员7(SLAMF7)、EGP40胰腺癌抗原、B细胞活化因子(BAFF)、血小板衍生生长因子受体、糖蛋白EpCAM(17-IA)、程序性死亡-1、蛋白二硫键异构酶(POI)、促肝细胞再生磷酸酶3(PRL-3)、前列腺酸磷酸酶、路易斯-Y抗原、GD2(在神经外胚层起源的肿瘤中表达的双唾液酸神经节苷脂)、磷脂酰肌醇蛋白聚糖-3(GPC3)和/或间皮素。
p97缀合物用于治疗癌症(包括CNS癌症)的用途,可与其他治疗方式结合。例如,可以在其他治疗干预之前,之中或之后,向受试者施用包括p97缀合物的组合物,包括对症护理、放射疗法、外科手术、移植、免疫疗法、激素疗法、光动力疗法、抗生素疗法或其任何组合。对症护理包括施用皮质类固醇以减少脑水肿、头痛、认知功能障碍和呕吐,以及施用抗惊厥药以减少癫痫发作。放射疗法包括全脑照射、分段放射疗法和放射外科手术,例如立体定向放射外科手术,可以进一步与传统手术相结合。
在具体的联合疗法中,p97-抗体缀合物的抗体部分包括西妥昔单抗,并且p97-西妥昔单抗缀合物与放射疗法联合用于治疗患有局部或区域性头颈部鳞状细胞癌的受试者。在其他方面,p97-西妥昔单抗缀合物与基于铂的5-氟尿嘧啶(5-FU)疗法联合用于治疗复发性局部区域疾病或头部和颈部转移性鳞状细胞癌。在一些方面,p97-西妥昔单抗缀合物与伊立替康组合用于治疗患有表达EGFR的结肠直肠癌的患者,并且该患者对于基于伊立替康的化学疗法是难治的。
在某些情况下,受试者患有溶酶体贮积病或具有患溶酶体贮积病的风险。因此,某些方法涉及在有需要的受试者中溶酶体贮积病的治疗,可选地,是与中枢神经系统有关的那些溶酶体贮积病。示例性的溶酶体贮积病包括天冬氨酰葡糖胺尿症(aspartylglucosaminuria)、胆固醇酯贮积病、沃尔曼(Wolman)病、胱氨酸病、达农氏病(Danon disease)、法布里病(Fabry disease)、法勃氏脂质肉芽肿病(Farberlipogranulomatosis)、法勃氏病(Farber disease)、岩藻糖苷贮积症、半乳糖唾液酸贮积症1/11型、戈谢(Gaucher)病1/11/111型、戈谢病、球形细胞脑白质营养不良(globoid cellleucodystrophy)、克拉伯(Krabbe)病、糖原贮积病II、庞培氏(Pompe)病、GMl-神经节苷脂贮积病1/11/111型、GM2-神经节苷脂贮积病I型、泰-萨病(Tay Sachs disease)、GM2-神经节苷脂贮积病II型、桑德霍夫病(Sandhoff disease)、GM2-神经节苷脂贮积病、a-甘露糖苷贮积症1/11型、-甘露糖苷贮积症、异染性脑白质营养不良(metachromaticleucodystrophy)、粘脂质沉积病I型、唾液酸沉积症1/11型、粘脂质沉积病11/1111型细胞病、粘脂质沉积病IIIC型假性贺勒氏多种营养不良症(pseudo-Hurler polydystrophy)、黏多糖病I型、黏多糖病II型、亨特综合征(Hunter syndrome)、黏多糖病IIIA型、圣菲利波(Sanfilippo)综合征、黏多糖病IIIB型、黏多糖病IIIC型、黏多糖病IIID型、黏多糖病IVA型、莫基奥(Morquio)综合征、黏多糖病IVB型莫基奥综合征、黏多糖病VI型、黏多糖病VII型、斯赖综合征(Sly syndrome)、黏多糖病IX型、多种硫酸酯酶缺乏症、神经元蜡样脂褐质沉积症(neuronal ceroid lipofuscinosis)、CLNI巴腾(Batten)病、尼曼匹克(Niemann-Pick)病NB型、尼曼匹克病、尼曼匹克病C1型、尼曼匹克病C2型、致密性成骨不全症、辛德勒(Schindler)病1/11型、辛德勒病,以及唾液酸贮积病。在这些和相关的实施方式中,p97多肽可以与一种或多种与溶酶体贮积病相关的多肽缀合,如本文所述。
在某些情况下,受试者患有或具有患自身免疫性疾病和/或神经(可选的是CNS)退行性疾病的风险。因此,还包括在有此需要的受试者中治疗中枢神经系统(CNS)的变性或自身免疫性疾病的方法。例如,在具体的实施方式中,CNS的变性或自身免疫性疾病是阿尔茨海默氏病、亨廷顿氏病、帕金森氏病或多发性硬化症(MS)。因此,某些实施方式包括向患有阿尔茨海默氏病、亨廷顿氏病、帕金森氏病或MS的受试者施用p97缀合物。在特定的实施方式中,p97多肽与抗体或其他试剂缀合,该抗体或其他试剂可与用于阿尔茨海默氏病的淀粉样蛋白、用于亨廷顿氏病的亨廷顿蛋白、用于帕金森氏病的α-突触核蛋白,或a4整联蛋白、CD25或IL-23特异性结合。在一些实施方式中,p97多肽与干扰素多肽缀合,用于MS的治疗。在具体的实施方式中,p97多肽与达克珠单抗缀合,用于MS的治疗。
还包括在有此需要的受试者中治疗疼痛的方法。实例包括急性疼痛、慢性疼痛和神经性疼痛,包括其组合。在某些方面,所述疼痛具有中枢作用成分,例如中枢性疼痛综合症(CPS),其中所述疼痛与CNS(包括脑、脑干和/或脊髓)受损或功能障碍有关。在特定的实施方式中,p97多肽与特异性结合NGF或TrkA的抗体或其他试剂缀合。在特定实施方式中,p97多肽与他尼珠单抗缀合,用于治疗疼痛,可选地用于治疗膝盖或髋部骨关节炎、慢性腰背痛、骨癌痛或间质性膀胱炎。
还包括在有需要的受试者中治疗炎症或炎性病症的方法。“炎症”通常是指组织对有害刺激物,例如病原体、损坏的细胞(例如伤口)和刺激物的生物反应。术语“炎症反应”是指实现和调节炎症的具体机制,包括仅通过说明,本文所述和本领域已知的免疫细胞活化或迁移、细胞因子产生、血管舒张,包括激肽释放、纤维蛋白溶解和凝结。理想地,炎症是身体的一种保护性尝试,既可以消除有害的刺激,又可以引发受影响的一处组织或多处组织的愈合过程。在没有炎症的情况下,伤口和感染将永远无法治愈,从而导致组织的逐步破坏将威胁生存。另一方面,过度的或慢性的炎症可能与本文所述和本领域已知的多种疾病有关,例如花粉症、动脉粥样硬化和类风湿性关节炎。
本发明的p97缀合物可以调节急性炎症、慢性炎症,或两者。取决于受试者的需要,某些实施方式涉及减少急性炎症或炎症反应,并且某些实施方式涉及减少慢性炎症或慢性炎症反应。
急性炎症与机体对可能有害的刺激的初始反应有关,涉及血浆和白细胞从血液进入受伤组织的运动增加。这是一个短期过程,通常在几分钟或几小时内开始,并在移除有害刺激后结束。急性炎症的特征是发红、发热量增加、肿胀、疼痛和功能丧失中的任何一种或多种。发红和发热量主要是由于在体温下流向发炎部位的血流量增加,肿胀是由积液引起的,疼痛通常是由于刺激神经末梢的化学物质释放而引起的,并且功能丧失有多种原因。
急性炎症反应主要由局部免疫细胞引起,例如定居巨噬细胞、树突状细胞、组织细胞、枯否氏细胞(Kuppfer cells)和肥大细胞。在感染、烧伤或其他伤害发作时,这些细胞会被激活并释放引起炎症临床症状的炎症介质,例如血管活性胺和类花生酸。血管舒张及其导致的血流增加导致发红和热量增加。血管通透性增加导致血浆蛋白和液体渗出或渗入组织,从而引起肿胀。某些释放的介质(例如缓激肽)会增加对疼痛的敏感性,并改变血管以允许白细胞(例如嗜中性粒细胞)迁移或外渗,这些白细胞通常沿着局部免疫细胞产生的趋化梯度迁移。
急性炎症反应还包括一个或多个无细胞生化级联系统,该系统由预先调制的血浆蛋白组成,它们并行地起作用以引发和传播炎症反应。这些系统包括主要由细菌激活的补体系统,以及主要由坏死激活的凝血和纤维蛋白溶解系统,例如某些感染、烧伤或其他创伤导致的组织损伤类型。因此,p97缀合物可用于调节急性炎症或一种或多种个体急性炎症反应中的任何一种。
慢性炎症是一种延长且延迟的炎症反应,其特征在于存在于炎症部位的细胞类型逐渐改变,并经常导致组织从炎症过程中同时或接近同时破坏和愈合。在细胞水平上,慢性炎症反应涉及多种免疫细胞,例如单核细胞、巨噬细胞、淋巴细胞、浆细胞和成纤维细胞,尽管与主要由粒细胞介导的急性炎症相反,慢性炎症主要由单核细胞,例如单核细胞和淋巴细胞介导。慢性炎症还涉及多种炎症介质,例如IFN-γ和其他细胞因子、生长因子、活性氧和水解酶。慢性炎症可能持续数月或数年,并可能导致不良的组织破坏和纤维化。
慢性炎症的临床体征取决于疾病的持续时间、炎症性病变、病因和受影响的解剖区域,(参见例如Kumar et al.,Robbins Basic Pathology-8th Ed.,2009Elsevier,London;Miller,LM,Pathology Lecture Notes,Atlantic Veterinary College,Charlottetown,PEI,Canada)。慢性炎症与各种病理状况或疾病有关,包括例如,在本文中描述并且在本领域中是已知的过敏、阿尔茨海默氏病、贫血、主动脉瓣狭窄、关节炎(例如类风湿性关节炎和骨关节炎)、癌症、充血性心力衰竭、纤维肌痛、纤维化、心脏病、肾脏疾病、狼疮、胰腺炎、中风、外科手术并发症、炎性肺疾病、炎性肠病、动脉粥样硬化和牛皮癣等。因此,p97缀合物可用于治疗或控制慢性炎症、调节任何一种或多种个体慢性炎症反应,或治疗与慢性炎症有关的任何一种或多种疾病或病状。
在某些实施方式中,p97缀合物可以在细胞水平上调节炎症反应,例如通过调节参与炎症的各种细胞的活化、炎症分子分泌(例如,细胞因子或激肽的分泌)、增殖、活性、迁移或粘附。
这种细胞的实例包括免疫细胞和血管细胞。免疫细胞包括,例如粒细胞(例如嗜中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)、巨噬细胞/单核细胞、淋巴细胞(例如B细胞,杀伤性T细胞(即CD8+ T细胞)、辅助性T细胞(即,CD4+ T细胞,包括Th1和Th2细胞)、自然杀手细胞、yo T细胞、树突状细胞和肥大细胞)。血管细胞的实例包括平滑肌细胞、内皮细胞和成纤维细胞。还包括调节与一种或多种免疫细胞或血管细胞有关的炎性病症的方法,包括中性粒细胞介导的、巨噬细胞介导的和淋巴细胞介导的炎性病症。
在某些实施方式中,p97缀合物可调节炎性分子的水平或活性,其包括血浆来源的炎性分子和细胞来源的炎性分子。包括的是促炎分子和抗炎分子。血浆来源的炎性分子的实例包括但不限于,补体系统、激肽系统、凝血系统和纤维蛋白溶解系统中的任何一种或多种的蛋白或分子。补体系统成员的实例包括Cl,其中在血清中以分子复合物的形式存在,其包括约6个分子的Clq、2个分子的Clr,和2个分子的C1s、C2(a和b)、C3(a和B)、C4(a和b)、CS,以及CSa、CSb、C6、C7、C8和C9的膜攻击复合物。激肽系统的实例包括缓激肽、激肽释放酶、激肽释放酶、羧肽酶、血管紧张素转化酶和中性内肽酶。
细胞来源的炎性分子的实例包括但不限于溶酶体颗粒中所含的酶、血管活性胺、类花生酸、细胞因子、急性期蛋白和可溶性气体(例如一氧化氮)。血管活性胺含有至少一个氨基,并靶向血管以改变其渗透性或引起血管舒张。血管活性胺的实例包括组胺和5-羟色胺。类二十烷酸是指通过氧化二十个碳的必需脂肪酸而制得的信号分子,包括前列腺素、前列环素、血栓素和白三烯。
p97缀合物还可调节急性期蛋白的水平或活性。急性期蛋白的实例包括C-反应性的蛋白、血清淀粉样蛋白A、血清淀粉样蛋白P和加压素。在某些情况下,急性期蛋白的表达会引起一系列不良的全身作用,包括淀粉样变性、发烧、血压升高、出汗减少、不适、食欲不振和嗜睡。因此,p97缀合物可以调节急性期的水平或活性,它们的全身作用,或两者兼有。
在某些实施方式中,p97缀合物减轻局部炎症、全身炎症或两者。在某些实施方式中,p97缀合物可以减少或维持(即,防止进一步增加)局部炎症或局部炎症反应。在某些实施方式中,p97缀合物可以减少或维持(即,防止进一步增加)全身炎症或全身炎症反应。
在某些实施方式中,炎症或炎症反应的调节可与一种或多种组织或器官相关。这种组织或器官的非限制性实例包括皮肤(例如,真皮、表皮、皮下层)、毛囊、神经系统(例如,脑、脊髓、周围神经、包括硬脑膜的脑膜、蛛网膜和软脑膜)、听觉系统或平衡器官(例如内耳、中耳、外耳)、呼吸系统(例如鼻子、气管、肺)、食道组织、胃肠系统(例如嘴、食道、胃、小肠、大肠、直肠)、血管系统(例如心脏、血管和动脉)、肝脏、胆囊、淋巴/免疫系统(例如淋巴结、淋巴滤泡、脾脏、胸腺、骨髓)、泌尿生殖器系统(例如,肾脏、输尿管、膀胱、尿道、子宫颈、输卵管、卵巢、子宫、外阴、前列腺、肾小管腺、附睾、前列腺、精囊、睾丸)、肌肉骨骼系统(例如,骨骼肌、平滑肌、骨骼、软骨、肌腱、韧带)、脂肪组织、乳腺和内分泌系统(例如下丘脑、垂体、甲状腺、胰腺、肾上腺)。因此,p97缀合物可用于调节与任何这些组织或器官相关的炎症,例如治疗与这些组织或器官的炎症相关的病症或疾病。
在特定的实施方式中,炎性症状具有神经系统或中枢神经系统成分,包括脑、脊髓和/或脑膜的炎症。在特定的实施方式中,脑膜炎CNS的炎症症状(例如细菌、病毒)、脑炎(例如,由感染或自身免疫性炎症引起,例如急性弥漫性脑脊髓炎)、结节病、与肿瘤相关的非转移性疾病。神经系统或CNS相关的炎性病症的具体实例包括,但不限于,脑膜炎(即,覆盖脑和脊髓的保护膜的炎症)、脊髓炎、囊膜肌炎(例如,肌性脑脊髓炎、急性弥漫性脑脊髓炎、传播性或多发性硬化症、自身免疫性脑脊髓炎)、蛛网膜炎(即蛛网膜的炎症,是围绕并保护中枢神经系统神经的一种膜)、肉芽肿、药物引起的炎症或脑膜炎、神经退行性疾病(例如阿尔茨海默氏病、中风,HIV痴呆)、脑炎(例如病毒性脑炎和细菌性脑炎)、寄生虫感染、炎性脱髓鞘疾病和自身免疫性疾病(例如CD8+T细胞介导的CNS自身免疫性疾病)。其他例子包括帕金森氏病、重症肌无力、运动神经病、格林-巴利综合征(Guillain-Barre syndrome)、自身免疫性神经病、郎伯-伊顿肌无力综合征(Lambert-Eaton myasthenic syndrome)、副肿瘤性神经病、副肿瘤性小脑萎缩、非副肿瘤性僵人综合征(non-para neoplastic stiff mansyndrome)、进行性小脑萎缩、拉斯穆森氏脑炎(Rasmussen's encephalitis)、肌萎缩性侧索硬化症、Sydeham舞蹈病、抽动秽语综合征(Gilles de la Tourette syndrome)、自身免疫性多发性内分泌病、免疫异常神经病(dysimmune neuropathy)、获得性神经性肌强直、多发性关节挛缩症(arthrogryposis multiplex)、视神经炎、僵人综合征、中风、创伤性脑损伤(TBI)、脊柱狭窄、急性脊髓损伤和脊髓受压。
如上所述,还包括与神经系统或CNS感染相关的炎症。与神经系统的炎症有关的细菌感染的具体实施例包括但不限于,链球菌感染,例如B组链球菌(例如,亚型III)和肺炎链球菌(例如,血清型6、9、14、18和23)、大肠杆菌(例如,携带KI抗原)、单核细胞增生李斯特菌(例如,血清型IVb)、奈瑟氏菌感染,例如脑膜炎奈瑟氏菌(脑膜炎球菌)、葡萄球菌感染、嗜血杆菌感染(例如流感嗜血杆菌B型、克雷伯菌和结核分枝杆菌)。还包括葡萄球菌和假单胞菌以及其他革兰氏阴性杆菌的感染,主要涉及颅骨的创伤,这使鼻腔中的细菌或进入具有脑分流或相关装置的人(例如:脑室引流管、奥马耶贮器(Ommaya reservoir))。与神经系统炎症相关的病毒感染的具体实施例包括但不限于,肠病毒、单纯疱疹病毒1型和2型、人T淋巴营养性病毒、水痘带状疱疹病毒(水痘和带状疱疹)、腮腺炎病毒、人免疫缺陷病毒(HIV),和淋巴细胞性脉络膜脑膜炎病毒(LCMV)。脑膜炎也可能是由螺旋体如梅毒螺旋体和梅毒疏螺旋体(莱姆病)、疟疾等寄生虫如疟疾(例如脑性疟疾)、真菌(例如新隐球菌)和变形虫(例如福氏耐格里原虫(Naegleria fowleri))引起的。
脑膜炎或其他形式的神经系统炎症,也可能与癌症扩散到脑膜(恶性脑膜炎)、某些药物(例如非甾体抗炎药、抗生素和静脉内免疫球蛋白)、结节病(或神经结节病)、结缔组织疾病(例如系统性红斑狼疮),以及某些形式的血管炎(血管壁的炎症)(例如Beb<;;et氏病)有关。表皮样囊肿和皮样囊肿可通过将刺激性物质释放到蛛网膜下腔而引起脑膜炎。因此,p97缀合物可用于治疗或控制这些病症中的任何一种或多种。
如上所述,某些受试者将要接受、正在接受,或已经接受过其他心脏毒性药物的治疗,即一种以未结合形式表现出心脏毒性的药物(未与p97缀合的药物)。相对于单独施用试剂,此类受试者可受益于施用p97-试剂缀合物,部分原因是p97可通过一种被认为不同于BBB转运性质的机制,对其他心脏毒性剂发挥心脏保护作用。因此,可以用p97-心脏毒性剂缀合物治疗这类受试者的多种疾病,包括本文所述的CNS疾病,以及与周围的非CNS组织有关的疾病。
示例性的心脏毒性剂在本文其他地方描述,并且可以根据众所周知的体内诊断和体外筛选技术进行识别,参见Bovelli et al.,2010,同上;Inoue et al.,AATEX 14,Special Issue,457-462,2007;以及Dorr et al.,Cancer Research.48:5222-5227,1988。
例如,可以通过成像技术监测接受可疑心脏毒性药物治疗的受试者,以评估左心室(LV)收缩和舒张功能障碍、心脏瓣膜疾病、心包炎和心包积液以及颈动脉病变。左心室分数缩短和LVEF是评估心脏功能(例如,在化疗期间)时最常见的左心室收缩功能指标。此外,多普勒衍生的舒张指数代表接受治疗的患者左心室功能不全的早期征兆,因此对二尖瓣舒张流模式、早期峰值流速与心房峰值流速(E/A)的比例、E波减速时间和等容血流舒张时间的评估,对于在收缩功能障碍发生之前检测左室功能的舒张变化可能是有用的。可以在标准多普勒超声心动图检查期间执行脉冲组织多普勒检查;它可以可靠地提供有关心肌舒张弛豫和收缩功能(E’波,A’波和S波速度)的定量信息。左心室外侧二尖瓣环的组织多普勒具有公认的预后作用,并与二尖瓣流入的PW多普勒结合,可提供有关左心室充盈程度的准确信息。左心室心肌功能的早期变化已通过多个左心室部位的脉冲组织多普勒识别,并且可以作为心脏毒性的相关决定因素。
在特定的实施方式中,心脏毒性剂是化学治疗剂,并且受试者患有癌症。癌症的具体实例包括但不限于,乳腺癌、前列腺癌、胃肠癌、肺癌、卵巢癌、睾丸癌、头颈癌、胃癌、膀胱癌、胰腺癌、肝癌、肾癌、鳞状细胞癌、CNS或脑癌(本文所述)、黑色素瘤、非黑色素瘤癌症、甲状腺癌、子宫内膜癌、上皮肿瘤、骨癌和造血系统癌症。
在具体的实施方式中,所述受试者患有表达Her2/neu的癌症,例如乳腺癌、卵巢癌、胃癌、侵袭性子宫癌或转移性癌症,例如转移性CNS癌,并且所述p97多肽与曲妥珠单抗缀合。这样的患者不仅可以受益于由p97和曲妥珠单抗的组合产生的治疗协同作用,特别是对于CNS癌症,还可以受益于由于p97的潜在心脏保护作用而导致的曲妥珠单抗降低的心脏毒性。
用于识别患有本文所述的一种或多种疾病或病状的受试者的方法是本领域已知的。
还包括用于对受试者的器官或组织成分进行成像的方法,该方法包括(a)向受试者施用包括人p97(黑素转铁蛋白)多肽,或其变体的组合物,其中p97多肽与可检测实体缀合,以及(b)可视化受试者、器官或组织中的可检测实体。
在特定的实施方式中,器官或组织区室,包括中枢神经系统(例如,脑、脑干、脊髓)。在具体的实施方式中,器官或组织隔室包括脑或其一部分,例如,脑软细胞组织。
可以采用多种方法来可视化受试者、器官或组织中的可检测实体。示例性的非侵入性方法包括射线照相术,例如荧光透视和投影射线照相术、CT扫描或CAT扫描(计算机断层扫描(CT)或计算机轴向断层摄影(CAT)),无论是否采用X射线CT扫描、正电子发射断层扫描(PET),或单光子发射计算机断层扫描(SPECT),以及某些类型的磁共振成像(MRI),尤其是那些使用造影剂(包括其组合)的磁共振成像。仅举例来说,PET可以用发射正电子的造影剂或放射性同位素,例如18F来进行,SPECT可以用发射γ的造影剂或放射性同位素来进行,而MRI可以用造影剂或放射性同位素来进行。这些示例性的造影剂或放射性同位素中的任何一种或多种,可以与p97多肽缀合或以其他方式掺入p97多肽中,并给予受试者以用于成像目的。
例如,p97多肽可以直接地用一种或多种这些放射性同位素标记,或与包括一种或多种这些放射性同位素造影剂,或本文所述的任何其他物质的分子(例如小分子)缀合。
对于体内使用,例如,用于治疗人类疾病、医学成像或测试,通常在将本文所述的缀合物掺入药物组合物中后再施用。药物组合物包括一种或多种本文所述的p97多肽或缀合物,以及生理学上可接受的载体或赋形剂。
为了制备药物组合物,将有效或所需的量的一种或多种p97多肽或缀合物,与本领域技术人员已知适合于特定给药方式的任何药物载体或赋形剂,进行混合。药物载体可以是液体、半液体或固体。用于肠胃外、皮内、皮下或局部应用的溶液或混悬液,可以包括例如,无菌稀释剂(例如水)、盐溶液(例如磷酸盐缓冲盐水;PBS)、不挥发油、聚乙二醇、甘油、丙二醇或其他合成的溶剂;抗菌剂(例如苯甲醇和对羟基苯甲酸甲酯);抗氧化剂(例如抗坏血酸和亚硫酸氢钠)和螯合剂(例如乙二胺四乙酸(EDTA));缓冲液(例如醋酸盐、柠檬酸盐和磷酸盐)。如果静脉内施用,合适的载体包括生理盐水或磷酸盐缓冲盐水(PBS),以及含有增稠剂和增溶剂例如葡萄糖、聚乙二醇、聚丙二醇及其混合物的溶液。
以纯的形式或以合适的药物组合物形式的本文所述的多肽和缀合物的施用,可以通过用于类似用途的试剂的任何可接受的施用方式进行。药物组合物可以通过将多肽或缀合物或含缀合物的组合物与适当的生理上可接受的载体、稀释剂或赋形剂组合来制备,并且可以制成固体、半固体、液体或气体形式的制剂,例如片剂、胶囊、粉末、颗粒、软膏、溶液、栓剂、注射剂、吸入剂、凝胶、微球和气雾剂。另外,其他药物活性成分(包括本文其他地方描述的其他抗癌剂)和/或合适的赋形剂,例如盐,缓冲剂和稳定剂,在组合物中可以存在,但不是必需的。
施用可以通过多种不同途径来实现,包括口服、肠胃外、经鼻、静脉内、皮内、皮下或局部施用。优选的施用方式取决于要治疗或预防的疾病的性质。
载体可以包括例如,药学上可接受的载体、赋形剂,或稳定剂,其在所采用的剂量和浓度下对暴露于其上的细胞或哺乳动物无毒。生理上可接受的载体通常是pH缓冲水溶液。生理上可接受的载体的实例包括缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,其包括抗坏血酸;低分子量(少于约10个残基)多肽;蛋白,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如EDTA;糖醇,例如甘露醇或山梨糖醇;成盐的抗衡离子,例如钠;和/或非离子表面活性剂,例如聚山梨酯20(吐温
在某些方面,p97多肽序列和试剂各自单独地或作为预先存在的缀合物结合,或封装在颗粒,例如纳米颗粒、珠子、脂质制剂、脂质颗粒,或脂质体例如免疫脂质体内。例如,在特定的实施方式中,p97多肽序列结合至颗粒的表面,并且目标试剂结合至颗粒的表面和/或封装在颗粒内。在一些和相关的实施方式中,p97多肽和试剂仅通过颗粒本身(例如,纳米颗粒、脂质体)彼此共价或可操作地连接,而不以任何其他方式彼此共价连接;也就是说,它们分别绑定到相同颗粒。在其他实施方式中,p97多肽和试剂首先如本文所述(例如,通过接头分子)彼此共价或非共价地缀合,然后结合或封装在颗粒(例如,免疫脂质体,纳米颗粒)内。在具体的实施方式中,颗粒是脂质体,并且组合物包括一种或多种p97多肽、一种或多种目标试剂,以及形成脂质体的脂质混合物(例如,磷脂、具有表面活性剂性质的混合脂质链)。在一些方面,p97多肽和试剂分别与脂质/脂质体混合物混合,使得脂质体结构的形成可操作地连接p97多肽和试剂,而不需要共价缀合。在其他方面,如本文所述,p97多肽和试剂首先彼此共价地或非共价地缀合,然后与脂质混合以形成脂质体。可将p97多肽、试剂或p97-试剂缀合物包裹在微胶囊中,例如通过凝聚技术或通过界面聚合制备的微胶囊(例如分别为羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中,在胶体药物递送系统(例如脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊)中或在大乳剂中。这样的技术在Remington's Pharmaceutical Sciences,16th edition,Oslo,A.,Ed.,(1980)中公开。颗粒或脂质体可进一步包括其他治疗剂或诊断剂,例如细胞毒性剂。颗粒或脂质体可进一步包括其他治疗剂或诊断剂,例如细胞毒性剂。
精确的剂量和治疗持续时间是所治疗疾病的函数,可以使用已知的测试规程或通过在本领域已知的模型系统中测试组合物并据此推断以经验确定。也可以进行对照临床试验。剂量还可以随着要减轻的病症的严重性而变化。通常配制并施用药物组合物以发挥治疗有用的作用,同时使不良副作用最小化。所述组合物可以被施用一次,或者可以被分为多个较小的剂量,以每隔一定时间施用。对于任何特定受试者,可以根据个人需要随时间调整特定剂量方案。
因此,施用这些和相关药物组合物的典型的途径包括但不限于,口服、局部、经皮、吸入、肠胃外、舌下、颊、直肠、阴道和鼻内。本文所用的术语“肠胃外”包括皮下注射、静脉内、肌肉内、胸骨内注射或输注技术。配制根据本发明某些实施方式的药物组合物,以使得其中包括的活性成分在将组合物施用于患者时可被生物利用。将被施用于受试者或患者的组合物,可以采取一个或多个剂量单位的形式,其中例如,片剂可以是单个剂量单位,并且本文所述的气雾剂形式的缀合物的容器可以容纳多个剂量单位。制备这种剂型的实际方法对本领域技术人员而言是已知的或显而易见的。例如,参见Remington:The Science andPractice of Pharmacy,20th Edition(Philadelphia College of Pharmacy andScience,2000)。在任何情况下,待施用的组合物将包括治疗有效量的本文所述的p97多肽、试剂或缀合物,以用于治疗目标疾病或病症。
药物组合物可以是固体或液体形式。在一个实施方式中,一种或多种载体是颗粒状的,使得该组合物是,例如,片剂或粉末形式。载体可以是液体,组合物例如是口服油、可注射液体或气雾剂,其可用于,例如,吸入施用。当打算口服施用时,药物组合物优选为固体或液体形式,其中半固体、半液体、悬浮液和凝胶形式包括在本文认为是固体或液体形式内。
作为用于口服施用的固体组合物,可以将药物组合物配制成粉末、颗粒、压制片剂、胶囊、胶囊、口香糖、威化饼等。这种固体组合物通常将包括一种或多种惰性稀释剂或可食用载体。另外,可以存在以下一种或多种:粘合剂,例如羧甲基纤维素、乙基纤维素、微晶纤维素、黄芪胶或明胶;赋形剂,例如淀粉、乳糖或糊精;崩解剂,例如藻酸盐、藻酸钠、初凝胶(Primogel)、玉米淀粉等;润滑剂,例如硬脂酸镁或氢化植物油(Sterotex);助流剂,例如胶体二氧化硅;甜味剂,例如蔗糖或糖精;调味剂,例如薄荷、水杨酸甲酯或橙色调味剂;以及着色剂。当药物组合物为胶囊剂形式时,例如明胶胶囊剂,除了上述类型的材料外,它还可以包括液体载体,例如聚乙二醇或油。
药物组合物可以是液体的形式,例如酏剂(elixir)、糖浆、溶液、乳液或悬浊液。作为两个实施例,该液体可以用于口服施用或通过注射递送。当打算口服施用时,优选的组合物除了本发明的化合物外,还含有一种或多种甜味剂、防腐剂、染料/着色剂和增味剂。该组合物旨在通过注射给药,还含有一种或多种表面活性剂、防腐剂、湿润剂、分散剂、悬浮剂、缓冲剂、稳定剂和等渗剂。
液体药物组合物,无论是溶液、悬浊液还是其他类似形式,都可以包括一种或多种以下佐剂:无菌稀释剂,例如注射用水、盐溶液,优选地是生理盐水、林格氏(Ringer's)溶液、等渗氯化钠、固定油,例如可以用作溶剂或悬浮介质的合成甘油单酯或甘油二酯、聚乙二醇、甘油、丙二醇或其他溶剂;抗菌剂,例如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,例如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸;缓冲剂,例如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,例如氯化钠或葡萄糖。肠胃外制剂可以装入玻璃或塑料制成的安瓿瓶,一次性注射器或多剂量小瓶中。生理盐水是优选的佐剂。可注射药物组合物优选是无菌的。
用于肠胃外或口服施用的液体药物组合物,应包括如本文所公开的一定量的p97多肽或缀合物,从而将获得合适的剂量。通常,该量为组合物中目标试剂的至少0.01%。当打算口服施用时,该量可以在组合物重量的0.1至约70%之间变化。某些口服药物组合物包括约4%至约75%的目标试剂。在某些实施方式中,制备根据本发明的药物组合物和制剂,使得在稀释之前,肠胃外剂量单位包括0.01至10%重量的目标试剂。
药物组合物可以旨在局部施用,在这种情况下,载体可以适当地包括溶液、乳液、软膏或凝胶基质。碱,可以包括例如以下的一种或多种:凡士林、羊毛脂、聚乙二醇、蜂蜡、矿物油、稀释剂,例如水和酒精,以及乳化剂和稳定剂。增稠剂可以存在于用于局部施用的药物组合物中。如果打算用于经皮施用,则该组合物可以包括经皮贴剂或离子电渗疗法装置。
药物组合物可以例如以栓剂的形式,用于直肠施用,该栓剂将在直肠中融化并释放药物。用于直肠给药的组合物可包括油性基质,作为合适的非刺激性赋形剂。这样的碱包括但不限于羊毛脂、可可脂和聚乙二醇。
药物组合物可以包括各种材料,其改变了固体或液体剂量单位的物理形式。例如,组合物可以包括活性成分周围形成包衣壳的材料。形成包衣壳的材料通常是惰性的,并且可以选自例如糖、乳木果油和其他肠溶包衣试剂。或者,可以将活性成分装在明胶胶囊中。固体或液体形式的药物组合物可包括与缀合物或试剂结合的试剂,从而有助于化合物的递送。可以这种能力发挥作用的合适试剂包括单克隆或多克隆抗体、一种或多种蛋白或脂质体。
药物组合物可以基本上由可以由气雾剂形式给药的剂量单位组成。术语气雾剂用于表示各种系统,从胶体性质的系统到由加压包装组成的系统。可以通过液化或压缩气体或通过分配活性成分的合适的泵系统进行递送。气雾剂可以单相、两相或三相系统递送,以递送活性成分。
气雾剂的递送包括必需的容器、活化剂、阀、子容器等,它们一起可以形成套件。在不进行过度实验的情况下,本领域普通技术人员可以确定优选的气雾剂。
如本文所述的包括缀合物的组合物,可以与保护缀合物免于从体内快速消除的载体,一起进行制备,例如定时释放制剂或包衣。这样的载体包括控释制剂,例如但不限于植入物和微囊递送系统,以及可生物降解的生物相容性聚合物,例如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、聚原酸酯、聚乳酸和本领域普通技术人员已知的其他聚合物。
可以通过药学领域众所周知的方法来制备药物组合物。例如,打算通过注射给药的药物组合物,可以通过将包括本文所述的缀合物和任选的盐、缓冲剂和/或稳定剂中的一种或多种的组合物,与无菌蒸馏水混合以形成溶液。可以添加表面活性剂以促进均匀溶液或悬浮液的形成。表面活性剂是与缀合物非共价相互作用以促进缀合物在水性递送系统中的溶解或均匀悬浮的化合物。
所述组合物可以以治疗有效量施用,所述治疗有效量将取决于多种因素而变化,其包括所使用的特定化合物(例如缀合物)的活性;和该化合物的代谢稳定性和作用时间;患者的年龄、体重、总体健康状况、性别和饮食;管理方式和时间;排泄率;药物组合;特定疾病或状况的严重程度;以及正在接受治疗的受试者。
通常,治疗地有效的日剂量(对于70kg哺乳动物)为约0.001mg/kg(即~0.07mg)至约100mg/kg(即~7.0g);优选地,治疗地有效的剂量(对于70kg哺乳动物)优选为约0.01mg/kg(即~0.7mg)至约50mg/kg(即~3.5g);更优选地,治疗地有效的剂量(对于70kg的哺乳动物)为约1mg/kg(即~70mg)至约25mg/kg(即1.75g)。
包括本文所述缀合物的组合物还可与本文所述的一种或多种其他治疗剂的施用同时/之前或之后施用。例如,在一个实施方式中,将缀合物与抗炎剂一起施用。抗炎剂或药物,包括但不限于,类固醇和糖皮质激素(包括倍他米松、布地奈德、地塞米松、醋酸氢化可的松、氢化可的松、氢化可的松、甲基强的松龙、泼尼松龙、泼尼松、曲安西龙)、非甾体抗炎药(NSAIDS),包括阿司匹林、布洛芬、萘普生、甲氨蝶呤、柳氮磺胺吡啶、来氟米特(leflunomide)、抗TNF药物、环磷酰胺和霉酚酸酯。
这样的组合疗法可以包括施用包括本发明的化合物和一种或多种另外的活性剂的单一药物剂型,以及在其自身单独的药物剂型中施用包括本发明的缀合物和每种活性剂的组合物。例如,本文所述的缀合物和另一种活性剂,可以以单一口服剂型组合物(例如片剂或胶囊),或将每种试剂以单独的口服剂型施用的形式,一起施用于患者。类似地,本文所述的缀合物和另一种活性剂可以以单一的肠胃外剂量组合物(例如盐溶液或其他生理上可接受的溶液),或以单独的肠胃外剂量制剂的形式,施用于患者。当使用单独的剂量制剂时,包括缀合物和一种或多种另外的活性剂的组合物,可以基本上同时(即同时地)或在分开的时间(即依次地和以任何顺序)施用;联合疗法应理解为包括所有这些方案。
实施例
提供以下实施例以举例说明本发明,但并不意图限制权利要求的范围。
材料和方法
MTf肽
对应于成熟蛋白的441-452位氨基酸(DSSHAFTLDELR)的,来自MTf的胰蛋白酶消化物的肽片段(MTfpep),其先前被识别为与BBB的体外模型穿过,并在本研究中得到利用,MTf肽的识别细节在其他地方有描述。
NIP228 hIgG1对照抗体
NIP228 hIgG1是针对4-羟基-3-碘-5-硝基苯乙酸的小鼠IgG1卡帕的单克隆抗体,被用作穿越BBB的蛋白融合的阴性对照。当与IL-1RA结合时,它先前在神经性疼痛的小鼠模型中没有镇痛作用,因为它无法穿过BBB。
使用Alexa Fluor 647荧光标记物标记NIP228抗体和MTf肽用于共聚焦荧光显微镜检查
将MTfpep与Alexa Fluor 647(AF647)C2-酰亚胺(孕激素A20347)反应,并在反应后使用半制备性反相C18色谱法纯化。将NIP228小鼠IgG1抗体与Alexa Fluor 647 NHS酯(孕激素)反应,然后使用Sephadex G-25柱进行脱盐。
MTf或MTfpep与NIP228 mAb的化学缀合用于共聚焦荧光显微镜检查
Alexa Fluor标记和缀合由CellMosaic,Inc.进行。简而言之,将脱盐的NIP228hIgGl与/N-(
以类似方式制备MTfpep-NIP228 hIgG1缀合物,其中使含马来酰亚胺的NIP228hIgG1与含硫醇的MTfpep反应。用半胱氨酸淬灭反应并脱盐。所得的缀合物包括约4MTfpep/NIP P228抗体。
通过反相或尺寸排阻HPLC分析缀合产物以确定纯度和浓度,并且通过SDS-PAGE确定纯度和分子量。
MTf和MTfpep-NIP228融合构建体的克隆、表达和纯化
编码抗体V
通过从获自Source Bioscience的cDNA中PCR扩增IL-1RA基因,组装能够表达通过(G
MTfpep-NIP228 mAb构建体的化学缀合
MTfpep的合成是通过用C-末端聚乙二醇(PEG)
通过共聚焦荧光显微镜检测MTfpep、mAb和MTfpep/MTf-mAb化学缀合物的脑分布
生命期和共聚焦显微镜研究是在加拿大国家研究委员会(NRC)(渥太华,安大略)的委托下进行的。涉及本研究的动物护理和使用的规程和程序已由渥太华NRC动物护理委员会审查并批准。动物的护理和使用符合加拿大动物护理理事会(CCAC)的指南。已根据ARRIVE准则(动物研究:体内实验报告)报告了本研究中的实验。
向6-8周大的Balb/c雌性小鼠(n=3)注射(i.v.)mAbAF647(10mg/kg)、MTf-mAbAF647(15mg/kg)和MTfpep-mAbAF647(10.2mg/kg),由于三个分子的分子量不同,因此这些剂量代表的摩尔/kg剂量。对照组接受媒介物对照、磷酸盐缓冲盐水(PBS)或游离AF647(0.1mg/kg)。注射后2小时,在安乐死之前(10min)注射((i.v.)番茄凝集素德克萨斯红,以标记毛细血管(100μg/小鼠)。通过麻醉并灌注补充有2.7%的BSA、100U/mL的肝素,其pH为7.4的PBS,进行灌注。取出脑,冷冻并进行冰冻切片和免疫组织化学。组织切片用4',6-二脒基-2-苯基吲哚(DAPI蓝)染色以标记细胞核。
3D共聚焦成像是在宾州州立大学医学院的成像核心实验室进行的。使用高分辨率的Leica 63X/1.4或40C/1.3 Plan-Apochromat油浸物镜,使用Leica AOBS SP8激光扫描共聚焦显微镜(莱卡,海德堡,德国)获取荧光标记细胞的共聚焦图像。用于激发的激光线是DAPI的连续波405、德克萨斯红的80MHz脉冲595nm,和AF647的80MHz脉冲653nm。所有的图像和光谱数据(DAPI除外)均使用位于扫描头内部的高灵敏度Leica HyD混合探测器(带时间选通功能)生成。从组织体积中捕获光学切片厚度(z轴)约为0.3μm的3D堆栈图像。使用Imaris软件(Bitplane)执行3D图像恢复。对从脑组织样本的五个或更多不同区域重新编码的3D图像数据集执行体积估计。应用高斯噪声去除滤波器来定义前景和背景之间的边界,并设置较低的阈值水平以排除所有可能的背景体素值。高于此阈值水平的所有体素的总和被确定为体积。使用相似的成像条件系统地比较了组织的3D图像体积。将脑毛细血管和软细胞组织中测试物的分布定量为体积分数,确定为测试物的体积(AF647体素与毛细管或软细胞组织共定位)除以组织总体积。
ANOVA多重比较分析用于比较脑软细胞组织和毛细血管中与NIP228 hIgG1和MTfpep-NIP228 hIgG1或MTf-NIP22S hIgG1相关的AF647荧光的体积分数。所有差异均被认为具有统计学显著性,p<0.05。数据报告为平均±标准偏差(SD)。
外围动力学和脑暴露
在Quotient Biosciences(纽马克特,英国)进行了所有测量外周和脑抗体暴露的研究。向年龄为10-12周的雄性C57BI/6小鼠静脉内(i.v.)注射20mg/kg,或摩尔当量的MTf和MTfpep基因或化学缀合的对照IgG(NIP22S)变体。静脉内剂量以10ml/kg的恒定剂量体积施用于尾静脉。抗体以D-PBS(西格玛)提供。施用后,每个剂量组中分别在每个时间点(0.08、2、4、6、8、24、48、96、120、168、240和336小时),从六只动物中的每只中,将两个血浆样品收集到单独的肝素锂容器中。从每只动物的第一个样品(约200μL)从侧尾静脉收集到Li-Hep微型培养皿(BD诊断系统)中,而第二个样品(约600μL)在异氟烷麻醉下通过心脏穿刺收集到堆微型容器(BD诊断系统)。收集后,使血样凝结30分钟,并在40℃以10,000×g离心2min,并抽出所得血浆。将血浆样品在干冰上急冻,以进行后续分析。最后一次采血后,以2ml/min的速度向小鼠灌注D-PBS 10min,直到四肢出现白色。切除脑,一个半球立即处理,另一个半球速冻在液氮中。
将脑半球在含有0.5%的吐温20和
畜牧业和所使用的程序均符合阿斯利康动物保健委员会的指导原则,并符合1986年《动物(科学程序)法》。所有实验均按照动物研究报告:体内实验报告(ARRIVE)进行。
小鼠脑和血浆中抗体浓度的测量
通过MSD测试平台测量小鼠血浆和脑样品中的抗体浓度。MSD测试采用基于板的夹心免疫分析形式,其中抗人IgG捕获抗体与校准物或样品结合,并且用SULFO-TAG标记的特异性检测抗体在电化学刺激下发光。血浆和脑样品中单独的MTf-NIP228、MTfpep-NIP228和对照抗体+/-IL-1RA融合水平,通过参照使用带有四个参数的非线性回归模型的校准样品生成的标准曲线进行定量。
使用Phoenix WinNonlin Professional[6.3版;Pharsight(Certara),桑尼维尔,加利福尼亚]进行非房室药代动力学(PK)分析(NCA)。标称收集时间用于PK数据分析,将低于定量水平(BLQ)的值设置为“缺失”,以计算标称时间点的浓度平均值。在施用前,将BLQ值设置为“零”,在NCA分析的峰浓度后将BLQ值设置为“缺失”。
使用WinNonlin Phoenix中实施的线性梯形方法,针对血浆和脑计算了浓度-时间曲线下到最后一个可测量时间点的面积(AUC
部分神经结扎
如Chessell等人
数据分析
统计分析在GraphPad Prism中进行。分析中仅包括完成研究的动物。使用2次方差ANOVA分析结果。在适当的情况下,使用Tukey检验进行成对比较。
图1:
研究的不同分子的示意图。
在A中,仅具有NIP228 hIgG1TM抗体的构建体,并与柔性接头或化学缀合MTf和MTfpep作为基因融合体并入。
在B中,具有NIP228hIgGTM抗体或抗体的Fc片段的构建体,所述构建体包括具有止痛作用的治疗分子IL-1RA(阿那白滞素),并在基因融合后与柔性接头MTf或MTfpep结合。
图2:
在CD-1雌性小鼠中静脉注射2小时后,基于mAb NIP228的hIgG1TM的不同构建体的脑分布的代表性3D共聚焦图像。
细胞核为蓝色(DAPI),毛细血管为绿色(德克萨斯红)。(A)表示标有Alexa F647(红色)的NIP228的分布;(B)代表与Alexa F647标记的NIP228化学缀合的MTf的分布(红色);(C)代表化学缀合至用Alexa F647标记的NIP228的MTfpep的分布(红色);(D)示出了放大(量化)的德克萨斯红标记的毛细血管表面(绿色)和化学缀合至用Alexa F647标记的NIP228的MTfpep(红色)的放大表面。这些3D图像表明,与单独的NIP228相比,掺有全长MTf或MTfpep的标记NIP228的脑软细胞组织分布要高得多。有关定量程序的详细信息,请参见方法部分。比例尺代表20μm。
图3:
脑软细胞组织中不同分子的共聚焦荧光显微镜分析和半定量的分布。
静脉注射后2小时,发现脑中的MTf-mAb或MTfpep-mAb的大于95%位于软细胞组织而不是毛细血管。数据清楚地表明了分子,在Balb/c雌性小鼠中,含有MTf全长蛋白或MTfpep的蛋白可以非常有效地转运穿过脑毛细血管内皮到达脑软细胞组织。数据报告为平均值±标准差(SD)。
图4:
在小鼠PK分析中,MTf或MTfpep靶向IgG的血浆和脑暴露。
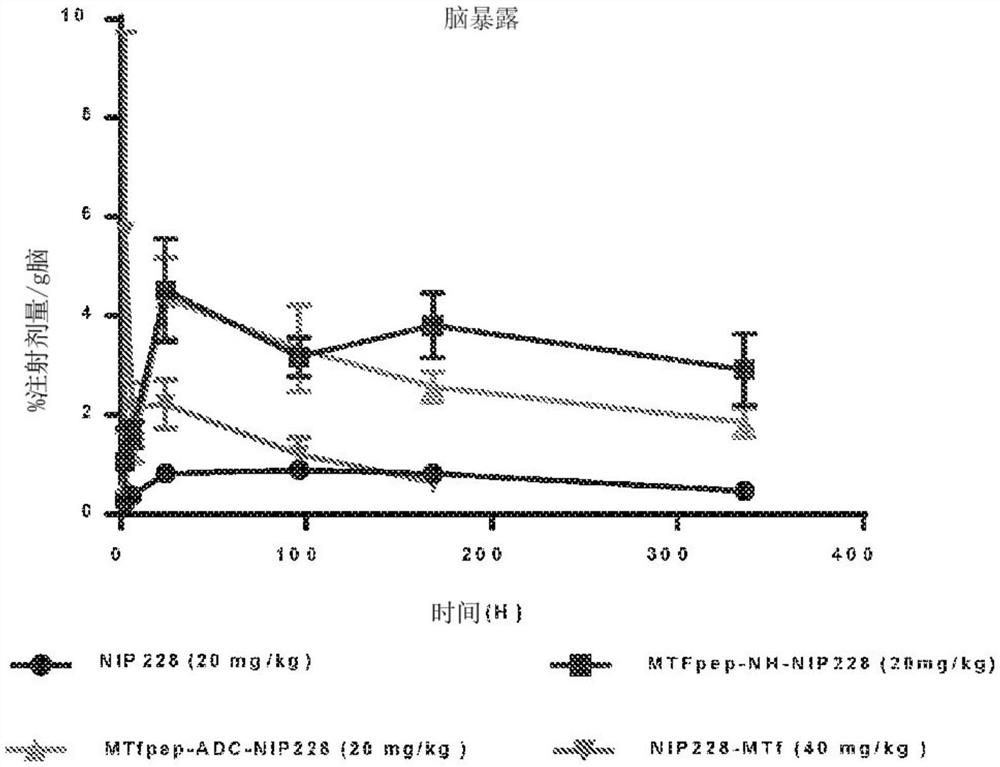
(A)在两周的时间内,与非靶向同型对照(NIP228)相比,MTf和MTfpep靶向的hIgG1TM的血浆PK。(B)脑暴露,以每克脑%注射剂量作为量度。(C)脑:血浆比例的比较。所有分子以相同的摩尔浓度给药。N=6/每组。PK,药代动力学。为指示的每个测量点提供S.E.M.。
图5:
在小鼠PK分析中,MTf和MTfpep靶向的IgG-IL-1RA融合分子的血浆和脑暴露。
(A)在两周内的时间内,与非靶向同型对照(NIP228)相比,MTf和MTfpep靶向的hIgG的血浆PK融合IL-1RA。(B)脑暴露,以每克脑%注射剂量作为量度。所有分子以相同的摩尔浓度给药。N=6/每组。PK,药代动力学;IL-1RA,白介素1受体拮抗剂。
图6:
MTf-IL-1RA融合对小鼠部分神经结扎模型的镇痛作用:
(A)比较含有MTf和MTfpep的IL-1RA融合构建体与同型对照(NIP228),溶媒对照和未连接(假手术)对照组的镇痛效果。N=8/每组。使用2次方差ANOVA分析数据,并以时间和处理作为相关因素。使用Tukey的事后检验获得后续统计显著性。++P<0.01;+++P<0.001-Op+NIP228-IL-1RA与Op+MTf-Fc-IL-1RA 135mg/kg;***P<0.001-Op+NIP228-IL-1RA与Op+MTfpep-NH-NIP228-I L-1RA 100mg/kg;@@@P<0.001-Op+NIP228与Op+MTfpep-ADC-NIP228IL-lRA 100mg/kg。(B)MTfpep靶向的NIP228 hIgGITM-IL-1RA融合对部分神经结扎诱导的机械性痛觉过敏的逆转的给药反应。N=7-10每组。使用2次方差ANOVA分析数据,并将时间和处理作为相关因素。随后使用Tukey的事后检验获得统计意义。*P<0.05;**P<0.01-NIP228与MTfpep 50mg/kg;+++P<0.001-NIP228与MTfpep 100mg/kg
图7
SEQ ID NO:2的肽的氨基酸序列的序列差异和肽穿过BBB的转运。
图7A示出了DSSHAFTLDELR(SEQ ID NO:2)和DSSYSFTLDELR(SEQ ID NO:3)的肽的氨基酸序列的序列差异;图7B显示了肽穿过BBB的转运的比较。令人惊讶地,将两个氨基酸HA替换为YS对本发明的肽片段xB
结果
MTf BBB转运肽
先前已经选择了最有效的转胞肽DSSHAFTLDELR(MTfpep或xB
与荧光标记的NIP228化学缀合的MTf和MTfpep的体内脑分布研究
为了证明使用MTf或MTfpep体内抗体在BBB中的递送,通过静脉注射,向野生型小鼠注射了对照mAb NIP228-AF647(图2A)、MTf-NIP228-AF647(图2B)或MTfpep-NIP228-AF647(图2C)的缀合物。注射后2小时后,处死小鼠,进行PBS灌注,评估脑穿透力,并使用3D共聚焦荧光显微镜进行半定量。与单独的NIP228-AF647相比,MTf-NIP228-AF647和MTfpep-NIP228-AF647缀合物在脑软细胞组织中测得的分数荧光约高出两倍(图3)。MTf-mAb和MTfpep-mAb缀合物的总AF647荧光信号中,有超过95%的定位于脑软细胞组织,其余的定位于脑毛细血管。分析和实验的第一步表明,MTf或MTfpep的掺入会增加mAb通过脑毛细血管内皮向脑软细胞组织的转运。
掺入MTf或MTfpep后融合抗体和结合抗体的药代动力学(PK)特性
为了确认MTf和MTfpep具有更好的脑靶向性,我们在C57BL/6J小鼠中进行了血浆PK和脑暴露研究。这些研究进行了2周,其中血浆样品(0.08、2、4、6、8、24、48、96、120、168、240和336小时)和毛细血管耗竭的脑匀浆样品定期采集(2、6、24、96、168和336小时)贯穿整个2周的时间内。在这项研究中的连续采样程序产生了在静脉内注射每种待测分子后血浆暴露的复合曲线。所有分子以相同的摩尔当量计量(NIP228、MTfpep-NH-NIP228、MTfpep-ADC-NIP228的计量剂量为20mg/kg,而NIP228-MTf的计量剂量为40mg/kg,以补偿较高的MTf分子量)。所有参数均使用每个数据点的平均值得出。图4A示出了在静脉内给药后的第一时间点(10min)达到的T
掺入MTf或MTfpep后基因融合和化学缀合抗体的脑暴露
进行脑匀浆中每个测试分子的测量以确定中央暴露。在静脉内给药后2、6、24、96、168和336小时从PBS灌注的动物中采集脑样本,并进行匀浆处理以通过MSD测试进行分析(图4B)。对于NIP288和缀合的MTfpep-NIP228 mAbs,在施用后24小时均发生T
MTf和MTfpep IL-1RA融合蛋白的药动学(PK)特性
在两周的时间内,对具有C-末端IL-1RA融合的MTfpep和MTf蛋白进行了外周PK分析。将MTfpep与柔性接头(Gly4Ser)x2基因缀合到NIP228重链的N-末端,将IL-1RA通过(Gly
在两周的时间内定期采集血浆样品,并如上所述进行处理。NIP228和MTfpep-NIP228-IL-1RA融合分别示出通过AUQ
脑暴露MTf和MTfpep IL-1RA融合蛋白
如上所述,测量了IL-1RA融合体的脑暴露,并产生了复合暴露曲线(图5B)。测试的每个分子的T
通过BBB迁移MTf-IL-1RA融合,逆转机械性痛觉过敏
如Seltzer等人
分别以135mg/kg或100mg/kg的剂量(等剂量给药)皮下注射MTf-hFc-IL-1RA或MTfpep(MH或ADC)-NIP228-IL-1RA,并测试mAb-IL-1RA融合是否能够逆转机械性痛觉过敏,并在给药后4天监测小鼠。媒介物、PBS和对照mAb-IL-1RA(NIP228-IL-1RA)处理的小鼠之间没有观察到效果差异,表明NIP228-IL-1RA无法访问中央区室的IL-1受体(图6A)。施用MTf-hFc-IL-1RA和MTfpep-NIP228-IL-1RA融合物,导致在给药后4小时至2天的时间点机械性痛觉过敏的逆转。给药后4天,只有MTfpep(ADC)-NIP228-IL-1RA逆转。对于测试的MTf-hFc-IL-1RA和MTfpep-IL-1RA融合,响应的幅度非常相似(图6A)。
为了研究剂量与机械性痛觉过敏逆转之间的关系,我们以25、50和100mg/kg的剂量施用MTfpep-NH-NIP228-IL-1RA。不同的剂量水平显示出反应幅度的差异,但持续时间没有差异。根据Tukey事后检验分析,与NIP228-IL-1RA相比,MTfpep-NH-NIP228-IL-1RA的50和100mg/kg剂量产生了统计上显著的镇痛效果(图6B)。
表1:
基于单克隆抗体NIP228 hIgG1TM的不同构建体的血浆药代动力学分析。图1A中示意性地表示了所分析分子的设计。
T
表2:
基于单克隆抗体NIP228 hIgG1TM-IL-1RA的不同构建体的血浆药代动力学分析。在图1B中示意性地表示了所分析的分子的设计。
T
最终消除半衰期(t1/2)使用浓度数据的回归计算得出,该数据至少包括最后三个采样时间点,所有剂量组的可测量浓度为:
t1/2=ln(2)/λz
其中λz是通过对数线性衰减相位的线性回归估算的一阶终速率常数。
静脉施用(CL)后的血浆清除率估计为:
CL=剂量/AUC
其中,通过梯形法计算外推到无穷大的AUC(AUC
Vz=剂量/λz AUCinf IV
施用后的稳态分布量(Vss)估计为:
Vss=MRTx CL
讨论
这些实施例证明,当通过化学缀合或通过基因融合掺入对照抗体(NIP228)的序列中时,黑素转铁蛋白(MTf)和衍生自MTf的12个氨基酸的肽(MTfpep)均可以诱导抗体穿过膜转运,达到脑软细胞组织中的治疗浓度。多种技术被用于确认被MTf或MTf肽修饰的抗体在脑中的渗透。使用共聚焦荧光显微镜,可以在脑软细胞组织中可视化缀合到用荧光标记物Alexa FG47标记的MTf或MTfpep的抗体。与未缀合的抗体相比,静脉注射施用于小鼠,MTf或MTfpep融合显示脑分布明显增加,所有荧光的95%位于脑软细胞组织内(图2和3)。通过分析来自静脉注射的动物的脑匀浆中掺入MTf和MTfpep的抗体的浓度,证实了该观察结果(图4B和4C)。在这项研究中,MTf通过遗传方式与抗体重链的C-末端融合,并且MTfpep通过与抗体重链的N-末端进行基因融合,或化学缀合至引入抗体Fc结构域的未配对半胱氨酸的巯基,而与抗体连接。经分析的不同分子的设计如图1所示。在对动物进行大量PBS灌注后,再进行脑均质,然后确定在静脉注射后不同分子的脑暴露。均质的毛细血管被耗尽,以便确定脑软细胞组织中存在的分子的更准确数量。与含有MTfpep的分子或单独的抗体相比,含有MTfpep的分子的脑暴露时间大大延长(图4B)。在24小时的时间点观察到峰值暴露为注射剂量的约4%,并且在2周的时间内观察到注射剂量的3-4%之间。与单独的NIP228对照抗体相比,MTfpep-或MTf-NIP228缀合或融合蛋白的脑-血浆比率也反映了这一点(图4C)。含有MTfpep或MTf的蛋白质在给药后168小时的脑-血浆比例在约1.5-3%达到峰值,而NIP228mAb则为0.5%(图4C)。这项研究还研究了这些抗体的血浆PK谱(图4A)。与包括MTf蛋白的mAb相比,抗体重链上MTfpep的存在不影响其血浆PK,MTf蛋白的外周半衰期缩短了3倍(表1附表)。这最可能是由于MTf蛋白导致该构建体的组织分布较高。
为了进一步验证MTf和MTfpep将分子递送至CNS的表观能力,在神经性疼痛的小鼠模型中进行了药效学研究。与IL-1RA的融合能够通过减少部分坐骨神经结扎后机械性超敏反应来测量镇痛作用。
以上实施例中注解的参考文献的引用如下:
13.Yang J,Tiong J,Kennard M,et al.Deletion of the GPI pre-anchorsequence in human p97-A general approach for generating the soluble form ofGPI-linked proteins.Protein Expr Purif 2004;34:28-48.
19.Karkan D,Pfeifer C,Vitalis TZ,et al.A unique carrier for deliveryof therapeutic compounds beyond the blood-brain barrier.PLoS One;3.Epub aheadof print 2008.DOI:10.1371/journal.pone.0002469.
21Eyford BA,Abraham T,Munro L,et al.A peptide vector delivers siRNAacross the blood-brain barrier resulting in attenuation of ischemic stroke.Inrevision:Nature Biomed Eng.2017
22.Hegedus DD,Pfeifer T a,Theilmann D a,et al.Differences in theexpression and localization of human melanotransferrin in lepidopteran anddipteran insect cell lines.Protein Expr Purif 1999;15:296-307.
23.Webster Cl,Hatcher J,Burrell M,et al.Enhanced delivery of IL-1receptor antagonist to the central nervous system as a novel anti-transferrinreceptor-II-1RA fusion reverses neuropathic mechanical hypersensitivity.Pain2017;158(4):660-668
24.Persic L,Roberts A,Wilton J,et al.An integrated vector system forthe eukaryotic expression of antibodies or their fragments after selectionfrom phage display libraries.Gene 1997;187:9-18.
25.Oganesyan V,Gao C,Shirinian L,et al.Structural characterization ofa human Fc fragment engineered for lack of effector functions.ActaCrystallogr Sect D Biol Crystallogr 2008;64:700-704.
26.Daramola O,Stevenson J,Dean G,et al.A high-yielding CHO transientsystem:Coexpression of genes encoding EBNA-1 and GS enhances transientprotein expression.Biotechnol Prog 2014;30:132-141.
27.Pace CN,Vajdos F,Fee L,et al.How to measure and predict the molarabsorption coefficient of a protein.Protein Sci 1995;4:2411-2423.
28.Thompson P,Fleming R,Bezabeh B,et al.Rational design,biophysicaland biological characterization of site-specific antibody-tubulysinconjugates with improved stability,efficacy and pharmacokinetics.J ControlRelease 2016;236:100-116.
29.Chessell IP,Hatcher JP,Bountra C,et al.Disruption of the P2X7purinoceptor gene abolishes chronic inflammatory and neuropathic pain.Pain2005;114:386-396.
30.Seltzer Z,Dubner R,Shir Y.A novel behavioral model of neuropathicpain disorders produced in rats by partial sciatic nerve injury.Pain 1990;43:205-218.
在整个申请中,通过作者姓名和日期,或者通过专利号或专利公开号来引用各种出版物。这些出版物的公开内容通过引用以其整体结合到本申请中,以便更全面地描述截至本文所述和要求保护的发明日期的本领域技术人员已知的现有技术水平。然而,本文引用的参考文献不应被理解为承认这种参考文献是本发明的现有技术。
仅使用常规实验,本领域技术人员将认识到或能够确定本文描述的具体过程的许多等同形式。这样的等同形式被认为是在本发明的范围之内,并由所附权利要求书覆盖。例如,根据本发明,意图是使用谷氨酸调节剂和免疫治疗剂的联合疗法可用于治疗除本文说明书和实施例中公开的特定癌症以外的癌症。此外,可以使用除说明书和本文实施例中公开的以外的谷氨酸调节剂和免疫治疗剂。此外,意图是可以将项目列表中的特定项目或较大项目组中的项目子集组与其他特定项目、项目子集组或较大项目集组合,无论本文是否有确定这种组合的具体公开。例如,在癌症治疗领域中,可以将本发明的具有或不具有本文所述类型的接头的CD3结合部分与靶向免疫学的抗癌剂结合,所述抗癌剂包括其他类型的抗体,例如多克隆抗体、抗体片段、肽、蛋白、小分子、佐剂、细胞因子、溶瘤病毒、疫苗、双特异性分子和细胞治疗剂。
序列表
<110> 比奥阿赛斯技术有限公司
<120> 双功能血脑疗法
<130> 20056-PCT
<150> US 62/646845
<151> 2018-03-22
<160> 3
<170> PatentIn 版本 3.5
<210> 1
<211> 738
<212> PRT
<213> 智人
<400> 1
Met Arg Gly Pro Ser Gly Ala Leu Trp Leu Leu Leu Ala Leu Arg Thr
1 5 10 15
Val Leu Gly Gly Met Glu Val Arg Trp Cys Ala Thr Ser Asp Pro Glu
20 25 30
Gln His Lys Cys Gly Asn Met Ser Glu Ala Phe Arg Glu Ala Gly Ile
35 40 45
Gln Pro Ser Leu Leu Cys Val Arg Gly Thr Ser Ala Asp His Cys Val
50 55 60
Gln Leu Ile Ala Ala Gln Glu Ala Asp Ala Ile Thr Leu Asp Gly Gly
65 70 75 80
Ala Ile Tyr Glu Ala Gly Lys Glu His Gly Leu Lys Pro Val Val Gly
85 90 95
Glu Val Tyr Asp Gln Glu Val Gly Thr Ser Tyr Tyr Ala Val Ala Val
100 105 110
Val Arg Arg Ser Ser His Val Thr Ile Asp Thr Leu Lys Gly Val Lys
115 120 125
Ser Cys His Thr Gly Ile Asn Arg Thr Val Gly Trp Asn Val Pro Val
130 135 140
Gly Tyr Leu Val Glu Ser Gly Arg Leu Ser Val Met Gly Cys Asp Val
145 150 155 160
Leu Lys Ala Val Ser Asp Tyr Phe Gly Gly Ser Cys Val Pro Gly Ala
165 170 175
Gly Glu Thr Ser Tyr Ser Glu Ser Leu Cys Arg Leu Cys Arg Gly Asp
180 185 190
Ser Ser Gly Glu Gly Val Cys Asp Lys Ser Pro Leu Glu Arg Tyr Tyr
195 200 205
Asp Tyr Ser Gly Ala Phe Arg Cys Leu Ala Glu Gly Ala Gly Asp Val
210 215 220
Ala Phe Val Lys His Ser Thr Val Leu Glu Asn Thr Asp Gly Lys Thr
225 230 235 240
Leu Pro Ser Trp Gly Gln Ala Leu Leu Ser Gln Asp Phe Glu Leu Leu
245 250 255
Cys Arg Asp Gly Ser Arg Ala Asp Val Thr Glu Trp Arg Gln Cys His
260 265 270
Leu Ala Arg Val Pro Ala His Ala Val Val Val Arg Ala Asp Thr Asp
275 280 285
Gly Gly Leu Ile Phe Arg Leu Leu Asn Glu Gly Gln Arg Leu Phe Ser
290 295 300
His Glu Gly Ser Ser Phe Gln Met Phe Ser Ser Glu Ala Tyr Gly Gln
305 310 315 320
Lys Asp Leu Leu Phe Lys Asp Ser Thr Ser Glu Leu Val Pro Ile Ala
325 330 335
Thr Gln Thr Tyr Glu Ala Trp Leu Gly His Glu Tyr Leu His Ala Met
340 345 350
Lys Gly Leu Leu Cys Asp Pro Asn Arg Leu Pro Pro Tyr Leu Arg Trp
355 360 365
Cys Val Leu Ser Thr Pro Glu Ile Gln Lys Cys Gly Asp Met Ala Val
370 375 380
Ala Phe Arg Arg Gln Arg Leu Lys Pro Glu Ile Gln Cys Val Ser Ala
385 390 395 400
Lys Ser Pro Gln His Cys Met Glu Arg Ile Gln Ala Glu Gln Val Asp
405 410 415
Ala Val Thr Leu Ser Gly Glu Asp Ile Tyr Thr Ala Gly Lys Thr Tyr
420 425 430
Gly Leu Val Pro Ala Ala Gly Glu His Tyr Ala Pro Glu Asp Ser Ser
435 440 445
Asn Ser Tyr Tyr Val Val Ala Val Val Arg Arg Asp Ser Ser His Ala
450 455 460
Phe Thr Leu Asp Glu Leu Arg Gly Lys Arg Ser Cys His Ala Gly Phe
465 470 475 480
Gly Ser Pro Ala Gly Trp Asp Val Pro Val Gly Ala Leu Ile Gln Arg
485 490 495
Gly Phe Ile Arg Pro Lys Asp Cys Asp Val Leu Thr Ala Val Ser Glu
500 505 510
Phe Phe Asn Ala Ser Cys Val Pro Val Asn Asn Pro Lys Asn Tyr Pro
515 520 525
Ser Ser Leu Cys Ala Leu Cys Val Gly Asp Glu Gln Gly Arg Asn Lys
530 535 540
Cys Val Gly Asn Ser Gln Glu Arg Tyr Tyr Gly Tyr Arg Gly Ala Phe
545 550 555 560
Arg Cys Leu Val Glu Asn Ala Gly Asp Val Ala Phe Val Arg His Thr
565 570 575
Thr Val Phe Asp Asn Thr Asn Gly His Asn Ser Glu Pro Trp Ala Ala
580 585 590
Glu Leu Arg Ser Glu Asp Tyr Glu Leu Leu Cys Pro Asn Gly Ala Arg
595 600 605
Ala Glu Val Ser Gln Phe Ala Ala Cys Asn Leu Ala Gln Ile Pro Pro
610 615 620
His Ala Val Met Val Arg Pro Asp Thr Asn Ile Phe Thr Val Tyr Gly
625 630 635 640
Leu Leu Asp Lys Ala Gln Asp Leu Phe Gly Asp Asp His Asn Lys Asn
645 650 655
Gly Phe Lys Met Phe Asp Ser Ser Asn Tyr His Gly Gln Asp Leu Leu
660 665 670
Phe Lys Asp Ala Thr Val Arg Ala Val Pro Val Gly Glu Lys Thr Thr
675 680 685
Tyr Arg Gly Trp Leu Gly Leu Asp Tyr Val Ala Ala Leu Glu Gly Met
690 695 700
Ser Ser Gln Gln Cys Ser Gly Ala Ala Ala Pro Ala Pro Gly Ala Pro
705 710 715 720
Leu Leu Pro Leu Leu Leu Pro Ala Leu Ala Ala Arg Leu Leu Pro Pro
725 730 735
Ala Leu
<210> 2
<211> 12
<212> PRT
<213> 智人
<400> 2
Asp Ser Ser His Ala Phe Thr Leu Asp Glu Leu Arg
1 5 10
<210> 3
<211> 12
<212> PRT
<213> 小家鼠
<400> 3
Asp Ser Ser Tyr Ser Phe Thr Leu Asp Glu Leu Arg
1 5 10
- 双功能血脑疗法
- 用于治疗脑癌的组合疗法
