利用人脐带组织来源的间充质基质细胞治疗自闭症谱系障碍的方法
文献发布时间:2023-06-19 09:49:27
优先权
本申请要求于2018年4月4日提交的美国临时申请系列号62/652,722的权益,其全部内容通过引用合并于此。
发明背景
技术领域
本公开提供了治疗自闭症谱系障碍的方法。更具体地,本公开涉及使用人脐带血组织来源的间充质基质细胞治疗自闭症谱系障碍的方法。
背景技术
自闭症,或自闭症谱系障碍(ASD),是一种异质性神经发育障碍,其指的是一系列特征在于社交沟通障碍以及存在重复性和局限范围的活动,并在生命的早期发生病症。ASD是一种基于存在特定行为症状的临床诊断,其可能由遗传和环境影响的不同组合引起。术语“谱系”反映了每个患自闭症的人所面临的挑战和优势的千差万别。
疾病控制与预防中心(CDC)估计美国68名儿童中就有1名ASD的发病率(MMWRSurveill Summ 2014;63:1-21)。这包括42个男孩中的1个和189个女孩中的1个。大部分患有ASD的个体不能独立生活,且需要终生的支持或收容。因此,支持一个自闭症个体的终生成本估计为140万美元。对于那些还有智力障碍的患者,估计费用增加到240万美元。估计每年有50,000名自闭症青少年成年,并失去基于学校的自闭症服务。自闭症人群中约三分之一保持是非语言的。自闭症人群中约40%患有智力障碍。自闭症经常伴有某些医学和心理健康问题。它们包括胃肠道(GI)障碍、癫痫发作、睡眠障碍、注意力缺陷和多动症(ADHD)、焦虑症和恐惧症。当前针对ASD的治疗方法包括药物治疗、行为治疗、职业和言语治疗以及专门的教育和职业支持。早期的强化行为干预与显著改善的结果相关联,但是即使进行这种干预,许多自闭症个体仍然受到严重损害。虽然目前的治疗是支持性的,但它们聚焦于通过物理疗法、药物和手术来控制后遗症。当前可用的医学疗法,如精神药物,旨在缓解相关的合并症症状,如烦躁不安,但不能解决核心的ASD症状。因此,迫切需要针对ASD核心症状的新的、有效的治疗方法。
遗传和环境因素均与ASD的病因有关(de la Torre Torre-Ubieta L等,Nat Med2016;22:345-361;Mandy W,Lai MC.J.Child Psychol Psychiatry 2016;57:271-292;Sahin M,Sur M.Science 2015;350)。近年来,尽管在基因测序和分析方面取得了进展,鉴定了与ASD风险增加相关的几个新发突变、拷贝数变体(CNV)和单核苷酸多态性(SNP),但估计不到20%的病例可归因于已知的遗传风险因素(Abrahams BS,Geschwind DH.ArchNeurol 2010;67(4):395-399)。数种环境因素也与ASD风险增加有关,包括母体致畸物暴露、环境毒素和亲辈高龄。最后,炎症和免疫功能障碍涉及到ASD的病因。
尽管确切的病理生理机制尚不清楚,但观察结果包括大脑区域的突触功能异常(Gao R,Penzes P.Curr Mol Med 2015;15:146-167;Volk L等,Annu Rev Neurosci 2015;38:127-149)、白质异常(Wolff JJ等,Am J Psychiatry 2012;169:589-600)和神经炎症(Young AMH等,Mol Autism 2016;7:1-8)。ASD患者大脑中免疫病理的发病机制可能是由于免疫相关基因网络的过度表达(Voineagu I等,Nature2011;474:380-384)、针对胎儿脑组织的母体抗体的存在(Braunschweig D等,Transl Psychiatry 2013;3:e277)、脑脊髓液中非典型水平的促炎细胞因子(IL-6,TNF-α)(Vargas DL等,Ann Neurol 2005;57:67-81)以及导致异常的神经连接途径的过度小胶质细胞激活(Morgan JT等,Biol Psychiatry2010;68:368-376;Suzuki K等,JAMA Psychiatry 2013;70:49-58)引起的。因此,影响免疫调节或神经连接调节的治疗方法是针对该人群的新疗法的逻辑目标。
几种不同的观察结果支持免疫激活和/或失调在ASD病因中的作用。多项流行病学研究证明了怀孕期间被感染的母亲所生的孩子的ASD发生率增加。这种关联在多个国家和时期之间是一致的,最早是在美国风疹大流行之后的1970年代报道的(Chess S.J AutismChild Schizophr 1971;1(1):33-47)以及在丹麦(Atladottir HO等,J Autism DevDisord 2010;40(12):1423-1430)、瑞典和其他国家几十年间报道。母体发烧、抗生素治疗、炎症标志物水平升高以及几种不同微生物的感染与儿童发生ASD的风险增加有关,这表明对感染的免疫反应可能比传染原自身更可能是原因。因此,动物模型通过在怀孕母体中诱导免疫激活而产生具有ASD表型的后代(Harvey L,Boksa P.Dev Neurobiol 2012;72(10):1335-1348;Malkova NV等,Brain Behav Immun 2012;26(4):607-616)。潜在的病理生理机制包括母体-胎儿免疫耐受性的改变(通过母体抗体和/或细胞免疫)和胎儿脑部炎症,这导致胎儿脑细胞因子谱和小胶质细胞激活的改变(这可能对神经发育有害)。通过尸检研究、正电子发射断层扫描(PET)脑成像和动物模型获得了ASD中小胶质细胞数量增加和小胶质细胞激活增加的证据。另外,已经描述了脑中免疫系统方面的异常功能(如负责为神经突触提供支持的小胶质细胞)(Takano T.Dev Neurosci 2015;37(3):195-202;Zantomio D等,Neurosci Biobehav Rev 2015;52:172-177)。ASD与血浆细胞因子水平升高、与小胶质细胞激活相关的上调基因、局部炎症和病理性星形细胞激活相关(Goines PE,Ashwood P.ClinRheumatol 2013;33(11):1611-1619)。值得注意的是,现在公认许多经典地与免疫调节相关的细胞因子和分子在正常的神经发育中也起着作用。这种双重功能性可能证明是ASD中免疫相关变化与异常神经发育的相关性中的重要联系。
小胶质细胞在中枢神经系统(CNS)损伤的传播和消退中起着关键但尚未完全了解的作用。这些细胞调节神经炎症,产生调节星形细胞、少突胶质细胞和神经元活性的因子,并清除碎屑以为少突胶质细胞开始使神经元再髓鞘化提供环境。在小鼠中,小胶质细胞产生自脑中独特的复制前体池,该池最初源自胎儿发育早期的胚外卵黄囊。骨髓衍生的循环血液单核细胞构成浸润吞噬细胞的另一潜在来源,其可加剧或减轻CNS损伤。尽管最近已描述了淋巴与脑实质之间单核细胞循环的途径,但大量循环单核细胞不进入未受伤的成年小鼠大脑,但可能在诸如脑部辐射、化疗或损伤、脱髓鞘病症或慢性压力这样的损害后浸润CNS。在某些模型中,这些浸润的血液单核细胞可能激活炎症并参与脱髓鞘事件。在其他情况下,血液单核细胞可能促进髓鞘再生。
突触是神经元之间通讯的点,从而允许通过电和化学信号传导进行有组织的信息传递。虽然在发育早期有一段时间突触发生增强,但突触在整个生命过程中保持可塑性,使得能够例如学习和记忆。正常的突触发育和维持对于适当的神经元功能至关重要,并且任一过程中的异常都与多种神经发育病症(包括ASD)相关。编码突触蛋白的基因中的突变与ASD有关。此外,人和动物研究证明了在ASD和自闭症相关障碍中,树突棘的大小、数量和形态的减少和未成熟的棘形态的增加(Phillips M,Pozzo-Miller L.Neurosci Lett 2015;601:30-40)。很可能的是,环境因素也可能影响突触变化。这些改变可能导致神经元连通性出现问题,如大范围连接性不足(large-range under-connectivity)和短程过度连接性(short-range over-connectivity)(Geschwind DH,Levitt P.Curr Opin Neurobiol2007;17(1):103-111;Maximo JO等,Neuropsychol Rev 2014;24(1):16-31)。
总之,这些观察结果表明了环境和遗传风险因素均可能通过引起免疫失调和/或异常的神经元连接性(其对正常的大脑发育产生不利影响)而促进ASD的发展。因此,免疫调节疗法可能在ASD儿童的治疗中起作用。已知间充质基质细胞(MSC)具有免疫调节能力,在临床上用于多种应用,并且具有良好的安全性特性。MSC可能还具有有效治疗ASD儿童的基础病理和产生的症状的潜力。
间充质基质细胞(MSC)是一组异质的未分化的多能细胞,其可以从包括骨髓、脂肪组织和分娩组织(脐带血、脐带组织、胎盘)的几种不同组织中分离出来。尽管MSC可以产生中胚层组织类型,包括骨骼、软骨和脂肪,但认为它们的主要作用机制是由免疫调节和旁分泌作用引起的。MSC证明了对体液和细胞介导的免疫反应的多种免疫调节作用。这些包括但不限于抑制B-、T-、NK、树突细胞和小胶质细胞增殖,减少促炎性细胞因子产生以及阻断嗜中性白细胞的募集。尽管MSC具有调节免疫反应的能力,但它们自身的免疫原性却很低。这使得MSC可以跨HLA屏障用于同种异体情况中,而无需其他类型细胞典型的供体-受体HLA匹配。实际上,在对13项静脉内同种异体MSC施用的人体研究的综述中,没有关于输注毒性的报道(Lalu MM等,PLoS One 2012;7(10):e47559),支持了MSC是“免疫-豁免的”这一观点,并可以避免免疫同种识别。当用作治疗细胞时,MSC通过营养信号传导发挥作用。MSC不植入接受者中。
ASD的治疗通常是支持性的,并且常常是多模式的。方法包括药物治疗、行为治疗、职业和言语治疗以及专门的教育和职业支持。当前所有可用的医学疗法,如精神药物,旨在缓解相关的合并症症状,如烦躁不安,但不是缓解疾病的。尽管在早期诊断和行为疗法方面取得了进步,但仍需要对ASD儿童更有效的治疗,并且对用于ASD的更好、更有效和缓解疾病的药物治疗仍然存在巨大的未满足需求。人脐带组织来源的间充质基质细胞(hCT-MSC)疗法可能具有通过调节脑的炎症过程来缓解ASD症状的潜力。
发明内容
本公开提供了通过施用人同种异体脐带组织来源的间充质基质细胞(“hCT-MSC”)来治疗怀疑患有自闭症谱系障碍的患者或患有自闭症谱系障碍的患者的方法。本公开提供了消除具有库存的自体脐带血单元或以其他方式可获得的自体脐带血单元的限制的益处。
在一个方面中,本公开包括治疗患有或怀疑患有自闭症谱系障碍的患者的方法,所述方法包括将治疗有效量的人同种异体脐带组织来源的间充质基质细胞(hCT-MSC)施用于患者。在某些实施方案中,全身性施用hCT-MSC。在一些实施方案中,hCT-MSC静脉内施用。在一些实施方案中,hCT-MSC通过在30分钟内的静脉输注来施用。在某些实施方案中,以单个剂量或多个剂量来施用hCT-MSC。在一些实施方案中,以一个剂量、两个剂量、三个剂量,或4个或更多个剂量来施用hCT-MSC。在某些实施方案中,每个剂量以约1个月至约6个月间隔来施用。
在某些实施方案中,以约1.0×10
在另一个方面中,本公开包括评估hCT-MSC治疗对自闭症谱系障碍患者的治疗有效性的方法,该方法包括:(a)对患者进行一项或多项适当的测试以建立行为和/或生物标志物基线评分;(b)将有效量的hCT-MSC施用于患者;(c)在施用hCT-MSC后的一个或多个时间点针对(a)中列出的相同的一项或多项行为和/或生物标志物测试重新评估患者;和(d)将(c)中的结果与(a)中建立的基线评分进行比较。在本公开的这个方面的某些实施方式中,(a)和(c)中进行的行为测试包括以下的一项或多项:Vineland适应行为量表-II(VABS-II)、Vineland适应行为量表-III(VABS-III)、临床总体印象量表(CGI)、广泛性发育障碍行为量表(PDDBI)、表达性单词图片词汇测试-4(EOWPVT-4)、异常行为清单、感官体验问卷、重复行为量表、智力量表(早期学习的Mullen量表或Stanford-Binet)、语言环境分析、ATN GI症状量表和亲职压力指数。在本公开的这个方面的某些实施方式中,(c)中患者的重新评估在包括以下的一个或多个时间点进行:施用后2个月、4个月、6个月、9个月、12个月和18个月、24个月、2年、3年、4年、5年、10年、15年、20年或不定期(indefinitely)。
附图说明
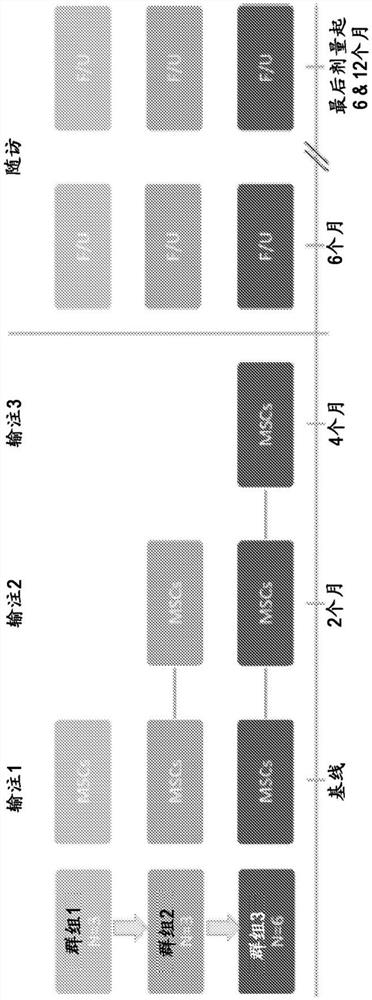
图1显示了ASD儿童中的hCT-MSC的I期研究的研究设计。
图2显示了I期hCT-MSC研究过程中观察到的不良事件的总结。总共3/53(5.7%)的事件与研究产品相关-低血压和输注相关反应。
图3A-3B显示了ASD儿童中hCT-MSC的II期研究的总体研究设计。
图4显示了用于输注的hCT-MSC群体的示例性流式细胞术分析。所述群体大于90%的CD73+和CD90+,及少于10%的CD45+、CD3+或CD31+。
具体实施方式
在描述所公开的方法和材料之前,应当理解本文描述的方面不限于特定的实施方式、装置或配置,并且因此当然可以变化。还应理解,本文所用的术语仅出于描述特定方面的目的,并且除非本文中特别定义,否则其不意图是限制性的。
还应理解,除非上下文另外明确指出,否则针对本发明的一个方面或实施方式公开的实施方案也可以用于本发明的其他方面或实施方式中,和/或与本发明的同一或其他方面中公开的实施方式组合。因此,本公开意图包括这样的组合,并且本发明包括这样的组合,即使在没有明确描述这种组合的情况下。
在整个说明书中,除非上下文另有要求,否则词语“包含”和“包括”及其变体(例如,“包含(comprises)”,“含有(comprising)”,“包括(includes)”,“包括有(including)”)应理解为暗示包含所述的组件、特征、元件或步骤或者组件、特征、元件或步骤的组,但不排除任何其他整体或步骤或者整体或步骤的组。
在说明书和所附权利要求书中使用的单数形式“一(a)”,“一个(an)”和“该(the)”包括复数指示物,除非上下文另有明确规定。
这里的范围可以表示为从“约”一个特定值和/或到“约”另一特定值。当表达这样的范围时,另一方面包括从一个特定值和/或至另一特定值。类似地,当通过使用先行词“约”将值表示为近似值时,将理解特定值形成另一方面。还将理解每个范围的端点相对于另一个端点以及独立于另一个端点都是显著的。
如本文使用的,术语“接触”包括至少一种物质与另一种物质的物理接触。
如本文使用的,“治疗(treatment)”、“疗法(therapy)”和/或“治疗方案”是指响应于患者表现出的或患者可能易感的疾病、障碍或生理状况(例如自闭症谱系病症)而进行的临床干预。治疗的目的包括减轻或预防症状,减慢或停止疾病、障碍或病症的发展或恶化和/或疾病、障碍或病症(例如自闭症谱系疾病)的缓解。
术语“有效量”或“治疗有效量”是指足以实现有益或期望的生物学和/或临床结果的量。“有效量”或“治疗有效量”可以由健康专业人员的熟练团队来确定,并且可以包括使用行为测试、生物标志物测试以及神经生理学或神经影像学测试。例如,行为测试可以包括,但不限于,DSM-5清单、Vineland适应行为量表-III(VABS-III)、临床总体印象量表(CGI)、广泛性发育障碍行为量表(PDDBI)、表达性单字图片词汇测试-4(EOWPVT-4)、儿童社交技能行为评价子量表、异常行为清单、感官体验问卷、重复性行为量表、智力量表(早期学习的Mullen量表或Stanford-Binet)、差异能力量表,第二版(DAS-II)、语言环境分析、学龄前精神病学评估、异常行为清单、ATN GI症状量表、表达性单字图片词汇测试4(EOWPVT-4)和亲职压力指数。其他临床评价可以包括,但不限于,自闭症诊断访谈修订版(ADI-R)、自闭症诊断观察时间表,第二版(ADOS-2)、使用Noldus EthoVision的亲子互动(PCI)、异常行为清单-社区(ABC-C)、执行功能的行为评估量表-学龄前版(BRIEF-P)、执行功能的行为评估量表(BRIEF)、感官体验问卷,2.1版(SEQ 2.1)、早期生活暴露评估工具(ELEAT)和儿童生活质量量表(PedsQL)胃肠道症状量表。进行的客观神经学测试可以包括但不限于社交刺激的眼神追踪(EGT)、脑电图(EEG)、计算机视觉分析(CVA)和脑磁共振成像(MRI)。在一些实施例中,测试可以包括当前可用或将来可用的等效或替代测试。
如本文使用的,术语“受试者”和“患者”在本文可互换使用并且是指人和非人动物。本公开的术语“非人动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,如非人灵长类动物、羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。在某些实施方式中,受试者是怀疑患有、患有或遭受自闭症谱系障碍的人患者。在一些实施方式中,人受试者是儿童。在某些实施方案中,人受试者是成人。
如本文使用的,术语“自闭症谱系障碍”和“自闭症”可互换使用并且是指通常从幼儿期开始出现的任何范围的精神状况,其特征是难以与他人沟通和形成关系以及难以使用语言和抽象概念。自闭症可以在任何年龄诊断;但是,症状通常出现在生命的头两年。根据《精神疾病诊断和统计手册》(Diagnostic and Statistical Manual of MentalDisorders)(DSM-5),患有自闭症的人可能难以与他人沟通和互动,兴趣受限和行为重复,并且症状会损害其在学校、工作以及其他生活领域中正常运作的能力。
间充质基质细胞(MSC)是一组异质的未分化的多能细胞,其可以从包括骨髓、脂肪组织和分娩组织(脐带血、脐带组织、胎盘)的几种不同组织中分离。尽管MSC可以产生中胚层组织类型,包括骨骼、软骨和脂肪,但认为它们的主要作用机制是由免疫调节和旁分泌作用引起的。MSC证明了对体液和细胞介导的免疫反应均表现出多种免疫调节作用。这些包括但不限于抑制B-、T-、NK、树突细胞和小胶质细胞增殖,减少促炎性细胞因子产生以及阻断嗜中性白细胞的募集。尽管MSC具有调节免疫反应的能力,但它们自身的免疫原性却很低。这使得MSC可以跨HLA屏障用于同种异体情况中,而无需其他类型细胞典型的供体-受体HLA匹配。实际上,在对13项关于静脉内同种异体MSC施用的人体研究的综述中,没有关于输注毒性的报道(Lalu MM等,PLoS One 2012;7(10):e47559),从而支持了MSC是“免疫-豁免的”这一观点,并可以避免免疫学同种识别。用作治疗细胞时,MSC通过营养信号传导发挥作用。MSC不会植入(engraft)接受者中。MSC在ASD中的确切作用机制是正在进行的研究的主题,但是MSC可通过几种潜在的手段发挥治疗作用,包括细胞介导的免疫调节、分子介导的神经保护和功能性神经回路的恢复。
如本文使用的,术语“同种异体”是指来自与施用的实体物种相同但在遗传上不同的另一个实体的施用实体的全部或部分(例如,细胞、组织、器官等)。由于同种异体实体在遗传上是不同的,因此同种异体的实体可能在施用同种实体的实体(接受者)中引发免疫反应。然而,MSC被认为是免疫豁免的,因此可以避免免疫学同种识别。这意味着接受者患者能够耐受同种异体的hCT-MSC的引入而不会引起炎性免疫反应,并且同种异体hCT-MSC可以存活较长时间段而不会发生排斥反应。
通过hCT-MSC治疗自闭症谱系障碍
鉴于本公开,本领域普通技术人员可以配置本文描述的方法以满足期望的需求。一般而言,所公开的材料、方法和装置提供了治疗怀疑患有自闭症谱系障碍的受试者或遭受自闭症谱系障碍的受试者的方法,所述方法包括向受试者施用治疗有效量的hCT-MSC和/或其组分或组分的混合物、由其组成或基本上由其组成,从而治疗自闭症谱系障碍。
应当理解,如本文所用的术语“hCT-MSC”,除非另有说明,旨在涵盖本文所述的任何形式和/或其组分或组分的混合物,无论是否特别指明。
患者可以是任何人或非人动物。在一些实施方案中,患者是人。在某些实施方案中,患者是18岁以下的人,或属于该较宽年龄范围内的任何年龄范围内的人。在非限制性实例中,患者可以是2岁至18岁大,2岁至17岁大,2岁至16岁大,2岁至15岁大,2岁至14岁大,2岁至13岁大,2岁至12岁大,2岁至11岁大,2岁至10岁大,2岁至9岁大,2岁至8岁大,2岁至7岁大,2岁至6岁大,2岁至5岁大,2岁至4岁大,2岁至3岁大,3岁至18岁大,3岁至17岁大,3岁至16岁大,3岁至15岁大,3岁至14岁大,3岁至13岁大,3岁至12岁大,3岁至11岁大,3岁至10岁大,3岁至9岁大,3岁至8岁大,3岁至7岁大,3岁至6岁大,3岁至5岁大,3岁至4岁大,4岁至18岁大,4岁至17岁大,4岁至16岁大,4岁至15岁大,4岁至14岁大,4岁至13岁大,4岁至12岁大,4岁至11岁大,4岁至10岁大,4岁至9岁大,4岁至8岁大,4岁至7岁大,4岁至6岁大,4岁至5岁大,5岁至18岁大,5岁至17岁大,5岁至16岁大,5岁至15岁大,5岁至14岁大,5岁至13岁大,5岁至12岁大,5岁至11岁大,5岁至10岁大,5岁至9岁大,5岁至8岁大,5岁至7岁大,5岁至6岁大,6岁至18岁大,6岁至17岁大,6岁至16岁大,6岁至15岁大,6岁至14岁大,6岁至13岁大,6岁至12岁大,6岁至11岁大,6岁至10岁大,6岁至9岁大,6岁至8岁大,6岁至7岁大,7岁至18岁大,7岁至17岁大,7岁至16岁大,7岁至15岁大,7岁至14岁大,7岁至13岁大,7岁至12岁大,7岁至11岁大,7岁至10岁大,7岁至9岁大,或7岁至8岁大。
在一些实施方式中,患者是高达约45岁年龄的人,或落入从约1岁大至约45岁大的较宽年龄范围中的任何年龄范围。例如,约18岁至约45岁大,约20岁至约45岁大,约25岁至约45岁大,约30岁至约45岁大,约35岁至约45岁大,或约40岁至约45岁大。在某些实施方式中,患者是1岁至45岁大的任何年龄的人。例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44或45岁大。
可以通过本领域已知的任何技术,包括全身递送,将hCT-MSC施用给患者。施用途径包括但不限于静脉内施用或输注技术。输注技术可涉及通过针或导管施用hCT-MSC。通常,输注是指hCT-MSC静脉内或皮下施用。在一些实施方案中,hCT-MSC是全身性施用的。在某些实施方案中,hCT-MSC静脉内施用(即,通过静脉内(IV)注射)。
该研究聚焦于(1)在ASD幼儿中一、二或三个静脉内剂量的hCT-MSC的安全性,和(2)ASD幼儿中的变化敏感性和使用几种不同评估工具的可行性。三(3)名患者的第一群组接受单剂量的hCT-MSC。三(3)名患者的第二群组接受两个剂量的hCT-MSC,相隔两(2)个月给予。六(6)名患者的第三群组施用三个剂量的hCT-MSC,每剂之间间隔两(2)个月。主要终点是安全性,为此在每次输注期间,每次输注后24小时内,每次输注后7-10天,每次输注后2个月、4个月和6个月以及最后一次hCT-MSC输注后6和12个月评估急性输注反应和感染发生率。在整个输液期间和最后一次输注后12个月对不良事件的评估表明治疗是安全的且耐受良好。报告了不良事件,12名患者中10名报告了至少一项不良事件。不良事件是轻微的,预见的,且与研究产品无关。没有严重不良事件的报道。次要终点评估了基线,初次输注hCT-MSC前和初次hCT-MSC输注6个月后的ASD特异性结果测量。在基线时非语言IQ较高的患者的社交沟通技能的父母报告测量(Vineland适应行为量表)上观察到患者行为的显著改善。
hCT-MSC的制备
人同种异体脐带来源的间充质基质细胞可以通过本领域已知的任何方法制备、保存和准备用于施用。在某些情况下,可通过在洁净室中将脐带组织切成块并切碎和用透明质酸酶、DNase、胶原酶和木瓜蛋白酶消化制备hCT-MSC。然后可以将所得的细胞悬浮液接种培养,生长至汇合以建立P0培养物,并冷冻保存。P1和P2培养物可以在相似的条件下生长并从培养器皿中移出。最终产物可以源自P2培养物,其被收集至含有5%人血清白蛋白的plasmalyte中,洗涤并冷冻保存在隔室冷冻袋中,所述冷冻袋含有终浓度为10%DMSO以及葡聚糖中的50-100百万个细胞。在施用当天,可将一个隔室解冻,在10-40mL的plasmalyteIV溶液中稀释,放入注射器或袋子中,并运送到床旁进行施用。
hCT-MSC的施用
本领域技术人员可以根据所治疗的疾病和期望的结果选择脐带血的施用途径。在某些实施方案中,hCT-MSC通过外周静脉内(IV)输注施用。
在一些实施方案中,本公开的hCT-MSC可以以单剂量施用。在某些实施方案中,hCT-MSC可以在一段时间(例如,几天,几周或几个月)内以多个剂量(例如,每次治疗两个,三个或四个或更多个单剂量)施用。在某些实施方案中,本公开的hCT-MSC可以以两个或更多个剂量施用,每个剂量间隔至少约1周,间隔约2周,间隔约3周,间隔约1个月至约2个月,间隔约1个月至约3个月,间隔约1个月至约4个月,间隔约1个月至约5个月,或间隔约1个月至约6个月或更长时间施用。在一些实施方案中,每个剂量间隔约1周施用。在一些实施方案中,每个剂量间隔约2周施用。在一些实施方案中,每个剂量间隔约3周施用。在一些实施方案中,每个剂量间隔约1个月施用。在一些实施方案中,每个剂量间隔约2个月施用。在一些实施方案中,每个剂量间隔约3个月施用。在一些实施方案中,每个剂量间隔约4个月施用。在一些实施方案中,每个剂量间隔约5个月施用。在一些实施方案中,每个剂量间隔约6个月施用。在一些实施方案中,每个剂量间隔约7个月施用。在一些实施方案中,每个剂量间隔约8个月施用。在一些实施方案中,每个剂量间隔约9个月施用。在一些实施方案中,每个剂量间隔约10个月施用。在一些实施方案中,每个剂量间隔约11个月施用。在一些实施方案中,每个剂量间隔约12个月施用。
在某些实施方式中,本公开的hCT-MSC的每个剂量可以在约20分钟至约75分钟范围的时间段内施用,例如,约20分钟至约60分钟,或约20分钟至约50分钟,或约20分钟至约40分钟,或约20分钟至约30分钟,或约25分钟至约70分钟,或约25分钟至约60分钟,或约25分钟至约50分钟,或约25分钟至约40分钟,或约30分钟至约70分钟,或约30分钟至约60分钟,或约30分钟至约50分钟,或约30分钟至约40分钟。在一些实施方案中,在约30分钟内施用所述剂量。
hCT-MSC可以以治疗有效剂量存在。在某些实施方式中,hCT-MSC的治疗有效剂量在施用时包括约1×10
在一些实施方式中,通过输注总共约6×10
在某些使用外周IV施用的实施方式中,IV液体可以约1.0至约2.0倍维持施用。例如,IV液体可以在输注后以约或1.0至约1.5倍维持,或约1.5至约2.0倍维持施用。可以在输注hCT-MSC后约30分钟至约60分钟内施用维持IV液体。例如,维持IV液体可以在输注后施用例如约30分钟至约60分钟,或约30分钟至约45分钟,或约45分钟至约60分钟。
任何合适的静脉内液体可以用于hCT-MSC输注后维持。在某些实施方式中,维持IV液体是盐水溶液或Ringer’s乳酸盐溶液。在某些实施方式中,维持IV液体是0.25%生理盐水溶液。在某些实施方式中,维持IV液体是0.5%生理盐水溶液。
利用多重评价来确定作为未来II和III期临床试验终点的施用可行性和功用。这些评价或测试包括行为测试、生物标记测试以及神经生理学或神经影像学测试。在一些实施例中,进行或施用的行为测试包括但不限于DSM-5清单、Vineland适应行为量表-II(VABS-II)、Vineland适应行为量表-III(VABS-III)、临床总体印象量表(CGI)、广泛性发育障碍行为量表(PDDBI)、表达性单词图片词汇测试4(EOWPVT-4)、儿童行为评估-社会技能子量表、异常行为清单,感官体验问卷、重复性行为量表、智力量表(早期学习的Mullen量表或Stanford-Binet)、差异能力量表,第二版(DAS-II)、语言环境分析、学龄前儿童精神病学评估、异常行为清单、ATN GI症状量表、表达性单词图片词汇测试4(EOWPVT-4)和亲职压力指数。其他临床评价可以包括但不限于自闭症诊断访谈-修订版(ADI-R)、自闭症诊断观察时间表,第二版(ADOS-2)、使用Noldus EthoVision的亲子互动(PCI)、异常行为清单-社区(ABC-C)、执行功能行为评估量表-学龄前版(BRIEF-P)、执行功能行为评估量表(BRIEF)、感官体验问卷,2.1版(SEQ 2.1)、早期生活暴露评估工具(ELEAT)和儿童生活质量量表(PedsQL)胃肠道症状量表。在一些实施方式中,所施用的客观神经学测试可以包括但不限于社交刺激的眼神追踪(EGT)、脑电图(EEG)、计算机视觉分析(CVA)和脑磁共振成像(MRI)。除上述测试外,评价和测试还可包括任何当前或将来的替代测试或等效测试。
在一些实施方式中,在施用有效量hCT-MSC前,对ASD患者进行一项或多项行为测试和客观生物标志物测试,以建立基线行为和生物标志物评分。在一些实施方式中,针对相同的一项或多项行为测试、客观生物标志物测试以及神经生理学或神经影像学测试,患者在施用有效量的hCT-MSC后重新评估。在一些实施方案中,将hCT-MSC施用后进行的测试的结果与施用hCT-MSC前进行的相同测试的基线结果进行比较。在一些实施方式中,VABS-III父母访谈是主要行为终点。在一些实施方式中,CGI、PDDBI和EOWPVT是关键的次要行为终点。在一些实施方案中,客观生物标志物测试是EGT。
在一些实施方式中,患者在施用有效量的hCT-MSC后的一个或多个时间点重新评估,包括,但不限于,施用hCT-MSC后3个月、6个月、9个月、12个月、18个月、24个月、3年、4年、5年、10年、20年或更长。在某些实施方式中,患者不定期地重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后3个月时重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后6个月时重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后9个月时重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后12个月时重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后18个月时重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后24个月时重新评估。在一些实施方式中,患者在施用有效量的hCT-MSC后3个月、6个月、9个月和12个月时重新评估。
现在将通过以下非限制性实施例进一步解释本公开的某些方面。
实施例
材料和方法
人脐带组织来源的间充质基质细胞(hCT-MSC)的制备
细胞来源
hCT-MSC是依据cGMP在洁净室ISO 7设施中从来自消化的脐带组织的同种异体细胞(其在培养中扩增)制造、冷冻保存和库藏。
收集/回收方法
hCT-MSC是从正常足月分娩的胎盘收获的脐带组织制造的,其中婴儿的脐带血在得到婴儿母亲的书面知情同意后捐献给了Carolinas脐带血库,这是杜克大学医学中心获得FDA许可的、FACT认证的公共脐带血库。脐带组织从正常足月妊娠后通过选择性剖腹产分娩的男婴胎盘收获。捐献者筛查问卷由母体捐献者完成,并且母体血液由北卡罗来纳州夏洛特市的美国红十字会的CLIA认证的捐献者筛查实验室进行了传染病检测。捐献者必须有资格捐献给公共脐带血库以用于同种异体使用。胎盘和脐带娩出后,将脐带血从胎盘中无菌排出。然后将脐带干燥并用chloropreps清洁,与胎盘基部分离,放入含有Plasmalyte A的无菌瓶中,并在经过验证的容器中运输到Robertson临床和转化细胞治疗(CT2)GMP细胞处理实验室。
捐献者筛选和测试
捐献者的筛选和测试是按照Carolinas脐带血库的标准操作程序进行的,以满足21C.F.R.第1271部分中的所有要求。筛查和测试符合最新推荐,并且已获得了依据生物许可号1870的FDA授权。对母体捐献者的脐带血进行了筛查并检测了HIV-1、HIV-2、乙肝病毒(HBV,表面和核心抗原)、丙肝病毒(HCV)、梅毒螺旋体(梅毒)、CJD(仅筛查)、1型和2型人嗜T淋巴病毒(HTLV-1、HTLV-2)、Chagas和CMV。还对母体血液进行了HIV-1/2/O、HBV、HCV和西尼罗河病毒的核酸检测。还进行了寨卡病毒的筛查。
因为脐带组织是来自同意捐献给Carolinas脐带血库的捐献者,所以他们按照这些Carolinas脐带血库的标准操作程序进行了捐献者筛选和传染病检测。脐带血相关的母体样品和脐带组织MSC样品将作为参考样品保留用于作为这个研究的一部分的未来测试。
细胞库系统
主细胞库(P0)
hCT-MSC的主细胞库(MCB)源自脐带组织,其经过消化,培养扩增7到14天以产生大约2×10
表1:用于包括在MCB(P0)和WCB(P1)中的规格
工作细胞库(P1)
工作细胞库(WCB)从MCB(P0)生成。将来自MCB的适当数量的小瓶解冻,并将其置于HYPERFlasks(Corning Life Sciences,Corning,NY)中,并扩增5-7天以产生约2.75×10
最终研究材料(P2)
最终研究材料从WCB(P1)生成。将来自WCB的适当数量的小瓶解冻,并放入20个HYPERFlask中,且扩增5-7天以产生约1.25×10
表2:P2培养物的hCT-MSC资格标准
表3:制备中使用的试剂
人脐带组织来源的间充质基质细胞(hCT-MSC)的制备
细胞收集的方法/处理/培养条件
所有制造在CT2 GMP设施中进行。保持对洁净室的监控,并根据方案进行清洁,并且所有工作人员均经过适当培训并穿着适当着装。按照SOP对培训进行了记录。人员遵循由MasterControl维护的批准实验方案,MasterControl是针对CT2 GMP设施验证的文档跟踪系统。以下SOP描述了更衣和清洁,并且可应要求提供:CT2-SOP-003,CT2设施的进入和使用;CT2-SOP-004,CT2 GMP设施的更衣程序;CT2-SOP-006,CT2 GMP设施中分类区域的清洁和卫生;CT2-SOP-009,进出CT2 GMP设施的材料、产品、设备和废物转移。
hCT-MSC起始材料是经知情同意后由母亲捐献的脐带组织。从来自手术室中简单的选择性剖腹产的足月胎盘中收集用于制造的脐带组织,并在收集时分配12位的ISBT条形码标识符。一旦脐带组织到达CT2 GMP设施,将为其分配一个专门针对CT2 GMP设施的新的12位ISBT条形码标识符,并在hCT-MSC的整个制造过程中进行追踪。这个新的条形码标识符与采集现场分配给组织的原始ISBT编号关联。捐献者筛查和测试必须符合待库存的hCT-MSC的脐带血许可的规范
脐带组织的处理(CT2-MSC-002)以产生P0(MCB)
在接收女性捐献者脐带组织时开始用于制造的第零天。通过训练的信使将脐带组织在含有Plasmalyte A的容器中运送到CT2设施。接收时进行目视检查以确保脐带组织符合处理要求。在收集时将12位条形码分配给脐带组织,并且一旦组织到达CT2设施则将上述条形码与分配的新的12位ISBT条形码标识符关联。在制造运行结束时,发布并核对用于所有批次记录、仪器打印输出、试管、小瓶等的足够数量的条形码标签。
在生物安全柜中,将脐带组织称重并切成约4克的小块。将脐带组织块与含有释放酶、Hylenex、木瓜蛋白酶和Benzonase的酶混合物置于无菌管中(见表3)。然后将组织块切碎并在Miltenyi Biotec Octo GentleMacs Dissociator上消化。解离后,将消化的组织过滤,离心并接种在一层含有补充1%的血小板裂解物的Prime XV MSC Expansion XSFM的CellSTACK(Corning Life Sciences,Corning,NY)中,并在37℃下用5%CO
培养基更换和收获(CT2-MSC-003)(MCB)
在培养的前三天内,将CellSTACK短暂地从培养箱中取出,并在显微镜下观察污染的任何视觉证据和/或任何异常形态或非典型生长。然后从烧瓶中移除全部培养基,并用等体积的新鲜Prime XV MSC Expansion XSFM和1%血小板裂解物代替。将烧瓶放回培养箱直到第7天。
在第7天,将CellSTACK短暂地从培养箱中取出,并在显微镜下观察污染的任何视觉证据和/或任何异常形态或非典型生长。如果未达到培养物的80-90%汇合,则将全部培养基从烧瓶中移除,并用等体积的新鲜Prime XV MSC Expansion培养基和1%血小板裂解的代替。将烧瓶返回培养箱。
一旦达到80-90%汇合,在第7至14天之间收获P0 CellSTACK。在收获当天,将CellSTACK从培养箱中取出,并在显微镜下观察污染的任何视觉证据和/或任何异常形态或非典型生长。使用1X TrypLE将细胞从CellSTACK中移出,计数并冷冻保存在Cryostor CS10中。使用可控速率的冷冻箱将细胞以1×10
P0的解冻和扩增以产生P1(CT2-MSC-005)(WCB)
将P0小瓶在37℃水浴中解冻,并且四个HYPERFlasks在Prime XV MSC扩增培养基中各自接种1.7×10
P1的收获(CT2-MSC-005)(WCB)
在收获当天,将HYPERFlasks从培养箱中取出,并在显微镜下观察污染的任何视觉证据和/或任何异常形态或非典型生长。使用1×TrypLE将细胞从HYPERFlasks中移除,计数并冷冻保存在Cryostor CS10的小瓶中。使用可控速率的冷冻将细胞以1×10
P1(WCB)的解冻和扩增以生成P2(研究产品)(CT2-MSC-005FRM4)
将P1小瓶解冻,并且二十个HYPERFlasks在Prime XV MSC扩增培养基中各自接种1.7×10
最终收获-P2(研究产品)的收获(CT2-MSC-005FRM5)
在收获当天,将HYPERFlasks从培养箱中取出,并在显微镜下观察污染的任何视觉证据和/或任何异常形态或非典型生长。用PBS洗涤烧瓶,并使用10×TrypLE从HYPERFlasks移除细胞。然后用Plasmalyte/5%HSA洗涤细胞,计数并在20mL的Plasmalyte/5%HSA中配制。SynGen CryoPRO(SynGen,Sacramento,CA)用于在Dextran-40(Akron Biotech,BocaRaton,FL)中添加55%DMSO,并转移到CryoPRO 5隔室袋组中。在25mL Plasmalyte/5%HSA/10%DMSO中,每袋添加大约2.5×10
对P2细胞样品进行了功能测试。预期hCT-MSC分化成骨、脂肪和软骨组织。通过骨钙素的表达检查细胞的骨分化,对于脂肪组织,使用脂肪酸结合蛋白4(FABP-4),且对于软骨,使用聚集蛋白聚糖。细胞还在有丝分裂原测定中测试以检查细胞抑制T细胞对有丝分裂原反应的能力。任何不符合测试规格的批次被丢弃。
处理时机和中间储存
hCT-MSC从脐带组织以一系列的三个步骤制造,其产生了主细胞库、工作细胞库和研究产品。将每个步骤的产物冷冻并储存在液氮冷冻箱的气相中。冷冻产品的稳定性程序是产品开发的部分。
最终制剂
在受试者治疗当天,将细胞解冻,在Plasmalyte A/5%HSA中以1:1稀释,并取出等份试样以进行细胞计数、存活力和无菌性测试。使用Nexcelom Cellometer Auto 2000获得细胞计数和存活力。如果细胞≥70%存活,则调整最终产物体积以向研究受试者递送2×10
hCT-MSC产品在室温下稳定最长4小时。最终赋形剂中解冻hCT-MSC产品的稳定性在CT2 GMP设施报告(CT2-2016-019-P)中记录在Manufacturing of Pilot ProcessingLots of MSCs中了。
将注射器包装在运输容器中以在室温下运输至现成用于施用于患者。在对生产批次记录和分析证书进行QA检查后,按照SOP将产品交付以运往诊所。hCT-MSC产品随附分析证书和监管链表格。到达诊所时,将含有hCT-MSC产品的注射器施用于研究受试者。
身份
通过使用一组针对CD73和CD90的荧光标记抗体进行免疫分型来确定hCT-MSC的细胞组成以确认MSC表型,及针对CD45、CD3和CD31的荧光标记抗体以证明几乎没有造血细胞或内皮细胞的污染。CD105和CD166仅用作参考。规格为>90%的CD73+和CD90+,和<10%的CD45+,CD3+或CD31+(见图4)。在配备DiVa软件的BD FACSCanto上获取数据。使用先前经过临床使用验证的FCS Express软件分析数据。表达每种标志物的细胞百分比在分析证书中报告。基于非临床数据、中试处理轮的结果以及医疗团队关于受试者安全性的输入针对CD73、CD90、CD45、CD3和CD31建立了交付规范。为了参考的目的,报道了组中的所有其他标志物的百分比。随着候选效能测定的出现,免疫分型数据将相互关联,使得可以在随后的IND阶段之前建立规范。
作为MSC,预期这些脐带组织来源的产品证明分化成骨、脂肪和软骨细胞的能力。使用明确定义的培养条件,体外监测每个细胞产品的分化能力。最终,使用荧光显微镜检查细胞。分化的骨细胞通过其骨钙素的表达来区分。分化的脂肪细胞通过脂肪酸结合蛋白4的表达来区分。最后,分化的软骨细胞通过聚集蛋白聚糖的表达来区分。
为了监测其免疫调节能力,测定了hCT-MSC抑制T细胞对有丝分裂原反应的能力。为了探索这种抑制背后的潜在机制,测量了细胞对干扰素-γ的反应。当它们暴露于这种促炎性信号时,hCT-MSC增加其吲哚胺2,3-双加氧酶1(IDO1)的表达。同时,hCT-MSC增加了其细胞表面上PD-L1和PD-L2蛋白的表达。这些研究表明,多种不同的机制可能与hCT-MSC介导的免疫调节相关(数据未显示)。
纯度
内毒素水平使用Charles River的Endosafe-PTS和FDA批准的Limulus AmebocyteLysate(LAL)药盒按照SOP来确定。该方法针对待测试的所有细胞/培养基组合进行了验证。用不含内毒素的去离子水稀释Plasmalyte/5%HAS中多达250μL的终产物,并根据SOP进行测试。为了交付,内毒素水平必须小于或等于5EU/kg体重/小时或5EU/mL。hCT-MSC产品的预期施用时间少于一小时。在测定验证期间确定最大有效稀释度和从单位/kg/时间至单位/mL的转换。在用于输注的产品交付前,使用每位受试者的体重计算内毒素的上限。
母体细胞测试
在最终选择用于制造P1和P2前,将选择用于临床试验的所有hCT-MSC产品对于高分辨率HLA 1类(ABC)和II类(DR)进行定型。该技术对于检测第三方(母体)HLA等位基因是高度灵敏的。仅选择不含母体细胞污染的单元进行P1和P2(WCB和最终产品)制造。
P53突变测试
由杜克大学临床分子诊断实验室对选择用于临床试验的全部批次P2培养物进行P53突变存在的测试。从细胞制备物提取的基因组DNA用于TP53外显子4至11的PCR扩增。然后,使用通用M13正向和反向引物以及Big Dye Terminator Cycle测序试剂盒对纯化的DNA扩增子进行测序。产品使用Big Dye XTerminator纯化试剂盒进行纯化,并使用ABI 3130xI基因分析仪进行解析。使用ABI数据收集软件、测序分析软件和SeqScape软件分析数据。
效力
效力可通过正在开发的体外表达分析来测定,结果报告为信息测试。根据FDAGuidance for Industry:Potency Tests for Cellular and Gene Therapy Products(January 2011)中的建议,效力测定的开发已在临床前开发中开始,并在整个临床阶段继续进行,目标在于提交BLA之前的验证效力分析或分析矩阵。除了交付所需的那些属性外,还将测量一系列的产品属性,同时研究其作用机理并表征产品的相关生物学活性。随着生产实践的发展,重新评估候选效力测定并鉴定为合适的。
存活力
按照SOP使用Nexcelom Cellometer Auto 2000测定存活力。交付需要hCT-MSC产品至少70%的存活力。
细胞数/剂量
在这项研究中有三个给药群组。该研究登记了十二名受试者。第一群组的三名患者接受了单剂量。如果没有安全性问题,第二群组的三名患者接受两个剂量,相隔两个月给予。第三群组由六名患者组成,每名患者接受三次hCT-MSC输注,剂量之间间隔两个月。基于解冻后计数,对受试者给予2×10
安全性评估标准
在每次输注期间观察患者,并在每次输注后24小时监测输注反应。在每次输注后的7-10天、2个月和4个月,以及最后一次输注hCT-MSC后的6个月和12个月,通过与患者的父母/监护人的电话访谈,以及在基线和6个月的诊所访问时的面对面访谈时确定了另外的不良事件(AE)。为了分析,逐字AE术语映射到Common Terminology Criteria for AdverseEvents(CTCAE)4.0版定义的标准术语上,并根据研究者判断的严重程度和与干预的关系进行总结。
临床评价
多项评价被用来确定施用的可行性和作为将来II和III期临床试验终点的效用。基于DSM-5清单进行了初步评估以确认ASD的诊断,其由自闭症诊断观察时间表,第二版(ADOS-2)和自闭症诊断访谈-修订版(ADI-R)-简化版获知。诊断评估由认证为研究可靠地实施ADOS-2和ADI-R的临床研究人员完成。进行了另外的评价以建立每位患者的基线并确定作为将来II和III期临床试验终点的效用。这些包括Vineland适应行为量表III(VABS-III)、临床总体印象量表(CGI)、广泛性发育障碍行为量表(PDDBI)、智力量表(早期学习的Mullen量表,AGS版,和差异能力量表,第二版(DAS-II)。其他常用的评价是表达性单词图片词汇测试4(EOWPVT-4)、评分、PDDBI评分和CGI-I评分)。
自闭症诊断访谈-修订版(ADI-R),简化版(Rutter M等,ADI-R.Torrence,CA:Western Psychological Services;2008)是全面的家长访谈,其评估了以下三个领域的早期功能:语言/沟通、相互的社交互动以及限制的、重复和刻板的行为和兴趣。研究可靠的访谈者遵循标准化的程序来获取信息和记录反应。访谈问题包括各种情境区域,包括患者的背景、行为、早期发育和里程碑、语言习得、当前的沟通功能、社会发展和娱乐、兴趣和行为以及任何其他与临床相关的行为。ADI-R简化版遵循与标准ADI-R相同的方案,但是省略了一些获得评分不需要的问题。ADI-R简化版需要90-150分钟,具体取决于儿童的年龄和行为的复杂性。ADI-R在每个患者的筛查过程中完成,并用于帮助告知ASD的DSM-5诊断。
自闭症诊断观察时间表,第二版(ADOS-2)(Lord C等,Autism DiagnosticObservation System.Los Angeles,CA:Western Psychological Services;1999)是对核心ASD症状学的标准化观察性评估。与年龄和语言相关的模块由一系列活动组成,这些活动由训练的、研究可靠的临床医生领导,以观察孩子的沟通、社交互动、玩乐以及限制的和重复的行为。ADOS-2方案设计用于引起直接映射到ASD DSM-5标准的行为。ADOS-2可以施用于小至12个月大的幼儿。使用年龄和语言能力来确定适当的模块(幼儿,1、2、3或4)。对于每个ADOS-2幼儿模块评估,使用Esler等(2015年)开发的幼儿模块校准的严重性评分来生成评分,以便于与其他模块进行比较。还对模块1-4生成严重性评分。ADOS-2需要大约45-60分钟来施行。该评估用于帮助告知ASD的DSM-5诊断,并在每位患者的基线访问时完成。
诊断统计手册-5清单(DSM-5)是根据精神疾病诊断与统计手册-5中有关ASD的诊断标准的临床医生清单。诊断标准取自DSM-5,并用于确认用于纳入研究中的适当的ASD诊断。这个清单由训练的临床医生利用临床医生的最佳判断来完成,并通过ADI-R,简化版和ADOS-2施行过程中收集的信息告知。每位患者在基线访问时完成了DSM-5。
早期学习的Mullen量表,AGS版(Mulle EM,Western Psychological Services;1995)是专门针对用于从出生到68个月的幼儿和学龄前儿童设计的认知功能评估。它测量认知功能的五个评分:粗大运动、视觉接收、精细运动、表达性语言和接受性语言(注意:对于本研究,将不施行粗大运动子量表)。每个量表单独测试,并且检测不是定时的。有些问题可能需要父母的输入才能评估孩子的能力。该检查是互动式的,并且包括供检查期间儿童使用的玩具和操作工具。测试施行时间从一岁的大约15分钟变化到5岁的一个小时。Mullen用于基线访问时4岁零个月以下的患者,并且仅在基线访问时进行。
差异能力量表,第二版(DAS-II)(Elliott CG.Differential Ability Scales,第2版,San Antonio,Tx:Harcourt Assessment;2007)是由训练的临床医生施行的评估,用于观察行为并计算评分以评估认知能力。此测试适用于2岁6个月至17岁11个月的年龄,并用于基线时4岁0个月及更大的患者。该评估大约需要45分钟,并且在基线访问时进行。
Vineland适应行为量表-III(VABS-III)(Sparrow S等,Vineland AdaptiveBehavior Scales:Interview Edition.Circle Pines,MN:American Guidance Service;1984)是护理者问卷,其用于评估儿童在广泛领域中的适应行为。VABS-III是充分标准化的测评,具有强的可信度和有效性(Balboni G等,J Autism Dev Disord 2016;46:42-52;Perry A等,J Autism Dev Disord 2009;39:1066-1078;Yang S等,J Autism Dev Disord2016;46:64-73;Sparrow S等,Vineland Survey Forms Manual.第2版,Minneapolis,MN;NCS Pearson Inc;2005),其在以下领域获得整体综合评分以及子量表标准评分:社交、沟通、日常生活技能和运动技能。VABS-III在基线和6个月访问时从每位患者的主要护理者收集。社交子量表评分用于测量社交行为的核心ASD症状的改善。
具有Noldus EthoVision的亲子互动(PCI):在亲子互动任务过程中,使用NoldusEthoVision。视频跟踪的目的是确定是否可以可靠地管理与社交方式或回避行为相关的儿童动作的自动跟踪,并为ASD儿童提供有效的社交交流的量度。这个范例设计为自动跟踪与ASD儿童与熟悉的成人的社交方式和回避行为有关的运动。主要因变量是花费在房间外围相对于靠近成人的时间。在同一房间内进行的两个连续期间过程中观察参与者,其由以下组成:(1)玩具可用的六分钟的自由玩乐期,在此期间护理者安静地坐在房间的角落,以及(2)六分钟的亲子互动,其中父母与孩子一起进行互动游戏以观察孩子如何与成年人玩耍,反之亦然。行为将通过安装在天花板上的摄像机记录下来,并使用软件自动跟踪孩子的运动。因变量包括在护理者目标区域(ROI)中花费的期间的百分比、接近护理者ROI的潜伏期以及在外围ROI中花费的时间的百分比。亲子互动任务在基线、6个月和12个月访问时进行。
临床总体印象(CGI)是常用的评定量表,其测量症状严重程度和治疗反应或时间点之间的行为变化。使用了两个版本的CGI:CGI-严重程度(CGI-S)和CGI-改善(CGI-I)。CGI-S是7点标度,其相对于专家评估者过去对具有相同诊断的患者的经验,指示评估时每位患者的ASD症状的严重程度。基于专家评估者的终生临床经验和所有可用的信息,每位患者分级为1:不存在(无ASD),2:几乎没有明显的ASD症状,3:轻度的ASD症状,4:中度的ASD症状,5:中等严重的ASD症状,6:严重的ASD症状或7:非常严重的ASD症状。每位患者在基线和6个月访问时赋予CGI-S评级。CGI-I是7点标度,其指示ASD症状相对于基线的改善或恶化的程度。基于所有可用信息,每位患者分级为1:改善非常多,2:改善多,3:改善极少,4:无变化,5:恶化极少,6:恶化多或7:恶化非常多。每位患者在6个月访问时赋予CGI-I分级,并且每位参照相对于基线CGI-S分级的改善或恶化程度。所有CGI-S和CGI-I分级由具有ASD专业知识的经验丰富的临床医生来进行。
CGI访谈:CGI护理者访谈由临床医生完成,并与主要护理者进行。访谈聚焦于参与者的社交沟通能力和挑战、有限的兴趣、重复的行为以及整体功能。临床医生获得有关不同情境下(如在家、在学校和在社区中)的行为频率和质量的详细信息,以及有关孩子在每种情况下发挥功能需要的支持水平的详细信息。访谈将在基线访问时完成,并在6个月和12个月访问时更新。基线访问时访谈需要约45分钟来完成,而6个月和12个月访问时访谈需要约30分钟来完成。该信息用于进行CGI-I和CGI-S分级。
广泛性发育障碍行为量表(PDDBI)(Cohen IL等,J Autism Dev Disord.33(1):31-45(2003))是护理者问卷,其设计用于评估ASD儿童对干预的反应。PDDBI是基于信息提供者的等级评定量表,其设计用于1岁6个月至12岁5个月年龄的儿童。它评估问题行为以及适当的社交、语言和学习/记忆技能。PDDBI评估通常与主动但奇怪的ASD亚型相关的社会障碍和与改善的相互社交行为整体的亲社会技能的发展。PDDBI基于与来自一系列人种、种族和社会经济背景的ASD儿童的标准化护理者和教师的ASD群体的比较得出原始评分和t-评分。(Cohen IL,Sudhalter V.PDD Behavioral Inventory Professional Manual.Lutz,FL:Psychological Assessment Resources Inc;2005)。PDDBI是在基线和6个月访问时从每位患者的主要护理者那里收集的。
表达性单词图片词汇测试-4(EOWPVT-4)(Martin NA,Brownell R.EOWPVT-4.第4版,Novator,CA:Academic Therapy Publication Inc;2011)是由临床医生施行的评估,其测量个体将说出的单词与对象、动作或概念的图像相匹配的能力。它测试个体在用彩色图示呈现时用单词命名对象、动作和概念的能力。这个测试适合2至80岁的年龄,且需要约10到30分钟来完成;完成时间取决于个体的语言能力。这项评估在基线、6个月和12个月访问时进行。
关于患者参与儿童接受的行为、说话-语言、职业和其他行为治疗以及教育服务的小时数的信息并未包括在本研究中,但可以通过与父母的结构性干预史访谈来包括。
父母护理者问卷
所有护理者问卷通过Duke批准的EDC系统在线完成或通过纸质完成。EDC调查工具可通过大学范围的站点许可证供Duke用户使用。EDC与Duke的NetID身份验证系统集成在一起,但允许与非Duke用户共享调查。
广泛性发育障碍行为量表(PDDBI)。开发PDDBI以评估ASD儿童对干预的反应。PDDBI是基于信息提供者的等级评定量表,其设计用于1岁6个月至12岁5个月的儿童。它评估问题行为以及适当的社交、语言和学习/记忆技能。PDDBI评估通常与主动但奇怪的ASD亚型相关的社会障碍和与改善的相互社交行为整体的亲社会技能的发展。PDDBI基于与标准化ASD群体的比较得出原始评分和t-评分。PDDBI已经在1至17岁大的311名儿童的PDDBI开发样本中进行了验证。这是188项的父母调查问卷,其需要约30-45分钟来完成。PDDBI在基线、6个月和12个月访问时施行,而在3个月和9个月时远程施行。
异常行为清单-社区(ABC-C)。这个父母完成的等级评定量表用于测量与ASD相关的异常行为,重点是社交退缩。ABC-C是经过验证的量表,其可以评估发育障碍个体的研究中药物和其他治疗的效果。来自机构化参与者样本的数据的独立因素分析(第一阶段n=418[平均年龄29.5岁],第二阶段n=509[平均年龄25.9岁])得出5因子量表,其包括58项。这些因素被标记为(1)烦躁、躁动、哭泣;(2)社会退缩;(3)定型行为;(4)过度活跃,不顺应;和(5)言论不当。ABC-SQW已被用于其他聚集于自闭症的核心社交和交流症状的临床试验。ABC-C有58项,且每项分级为0=完全没有问题,1=行为是有问题的,但程度轻微,2=问题是中度严重的,或3=问题是严重程度的。这个父母完成的分级量表需要大约10到15分钟来完成。ABC-C在基线、6个月和12个月访问时完成,并在3个月和9个月时远程进行。
干预史调查问卷。这个调查问卷由主要护理者来完成以获取有关儿童/家庭在过去3个月内或自上次进行调查问卷以来所参与的行为健康干预的详细信息。收集有关儿童正接受的干预、服务和治疗的类型和数量的信息。这个调查问卷每月进行一次。
执行功能的行为评估量表-学龄前版(BRIEF-P)。这个评估是针对学龄前儿童的父母的调查问卷,其使得专业人员能够评估家庭和学前班环境中的执行功能行为。它是为宽范围的学龄前儿童设计的,包括患有突发的学习障碍和注意力障碍、语言障碍、脑外伤、铅暴露、广泛性发育障碍以及其他发育性神经、精神和医学状况的那些。BRIEF-P包含63项,且需要约15分钟来完成。BRIEF-P用于基线时5岁以下的参与者。该调查问卷在基线、6个月和12个月访问时完成。
执行功能的行为评估量表(BRIEF)。这个评估是针对学龄儿童的父母的调查问卷,其使得专业人员能够评估家庭和学校环境中的执行功能行为。BRIEF的父母表格包含在八个理论和经验得出的临床量表内的86项,其测量执行功能的不同方面:抑制、转移、情绪控制、启动、工作记忆、计划/组织、材料的组织和监控。BRIEF需要约15分钟来完成,并用于基线时5岁及以上的参与者。该调查问卷在基线、6个月和12个月访问时完成。
感官体验调查问卷,2.1版(SEQ2.1)。SEQ 2.1要求父母在5点Likert量表上对45个关于儿童在日常活动和例行活动的情况中对感官刺激的反应频率的问题作为反应。这个研究使用修订的版本,其仅要求父母完成Likert量表的问题,并省略所有开放式问题。SEQ2.1针对2-12岁的自闭症儿童进行了验证,已显示出将ASD儿童与发育迟缓和通常发育控制区分开来,并且具有高的内部一致性(α=0.80)。总结评分对于高反应性(SOR)得出。SEQ2.1需要约10分钟来完成,并且仅在基线访问时完成。
早期生活暴露评估工具(ELEAT)。这是评估父母/儿童在儿童早期生活和发育过程中可能遭受的多种环境暴露的父母调查问卷。该调查问卷询问有关怀孕前、怀孕期间和孩子出生后第一年生活的各种问题,并对任何可能有害的可能食物或化学物质进行了非常详细的定量观察。本研究使用了仅包括相关变量的ELEAT的改进和简化版本。这个评估需要约10分钟来完成,并且仅在基线访问时完成。
儿科生活质量量表(PedsQL)胃肠道症状量表。PedsQL胃肠道症状量表是10分钟父母问卷,其测量儿童的胃肠道症状,因为超过50%的ASD儿童患有胃肠道不适。这个评估在基线、6个月和12个月访问时完成。
自闭症和脑发育中心(CABD)人口统计学表。CABD人口统计学表根据NIH报告标准收集人种和种族。另外的问题收集数据以帮助表征人群。这个父母调查问卷需要不到5分钟完成,并且仅在基线访问时完成。
神经生理学和神经影像学
脑电图(EEG):EEG是脑活动的非侵入性测量。将柔性密集电极阵列(EGI System400,Electro Geodesics Inc.,Eugene,Oregon)放置在头部上,并用下颚带固定。EEG信号被放大并发送到记录计算机以进行在线查看。这里使用EEG来研究社交和非社交刺激引起的大脑活动的模式。EEG需要约20分钟,并在基线、6个月和12个月访问时完成。
EEG用于评估基线状况期间以及观看社交和非社交刺激时皮层激活的变化(如通过α、θ和β节律的变化所反映的)和功能连接性的变化(如通过EEG相干的变化所反映的)。已经表明α-振荡是从丘脑-皮层网络的激活出现的,并且还被证明存在于皮层下区域(包括海马区)中。α频率是由兴奋性神经元和抑制性神经元之间的相互作用产生的,并受胆碱能、血清素能和谷氨酸能机制的影响。α活动在放松状态下增加,而在主动刺激处理中减少。θ振荡在海马区尤为突出,受到谷氨酸能和γ-氨基丁酸能(GABAergic)神经元之间相互作用的影响,并且可能与突触可塑性相关。
EEG是在静止的基线状态下以及在观看社交(唱童谣的女性)和非社交(活动的玩具)刺激的标准化录像片段时记录的。在一项学龄前ASD儿童的研究中,观看社交和非社交刺激过程中的α和θEEG功率作为行为治疗的函数而变化,并与社交行为的改善特别相关。在Duke进行的评估自体脐带血治疗自闭症的安全性和有效性的I期开放标签试验证明了EEG谱的正常化反映在治疗后α功率的增加。EEG数据从128通道密集电极阵列Geodesic传感器网络(相对于头顶在线记录)以500Hz记录,以0.1Hz进行高通过滤,并以200Hz进行低通过滤。通过自动的伪像检测软件(Net Station 4.4)和手动编辑来编辑EEG,不需要知识组成员。
光谱分析。使用Welch的方法(在Matlab,R2012b中实施的)对EEG数据进行傅里叶变换。功率估计值在电极组(右后和前,左后和前,中线枕骨电极)中平均,并进行自然对数转换以减少偏斜。在先前的评估自体脐带血改善自闭症症状的功效的开放标签试验中,输注后还发现了EEG谱特征的显著变化,其通过增加的α和β功率以及降低的EEGθ功率来表征。此外,较高的基线后EEGβ功率与社交沟通症状的更高程度改善相关,这突出强调了EEG生物标志物对预测结果变化的潜力。
眼动追踪(EGT)。EGT是15分钟的技术评估,其使用受控设置的专用设备而通过自闭症儿童的眼球运动跟踪视觉注意。已发现ASD儿童参与社交刺激少于正常发育的儿童。在VABS上报道了,在Duke进行的评估自体脐带血治疗自闭症的功效的I期开放标签试验证明了对社交刺激参与的增加,这与社交能力的提高相关。这一评估适合1岁儿童至成人。向儿童显示涉及社交和非社交刺激的场景的录像带。因变量包括儿童花多长时间观察录像带中的社交和非社交刺激,包括吸引和保持儿童注意力的社交刺激的特定方面。EGT在基线、第6和第12个月访问时进行。
计算机视觉分析(CVA)。CVA评估由一系列简短的动态刺激组成,其设计用于引发自闭症症状,包括注意反应、面部表情和运动反应。计算机视觉分析用于自动编码这些行为。研究表明,CVA可以客观、可靠且灵敏地量化自闭症症状。CVA在基线、6个月和12个月访问时进行。
神经成像。MRI用于评估细胞治疗前后大脑中潜在的结构/解剖学改变和功能变化。MRI图像用于将脑铁与ASD症状相关联。MRI图像的变化可能反映了星形胶质细胞活性、血液灌注、纤维束完整性、脑网络完整性、髓磷脂微结构完整性和脑功能连接性的改变。在一项评估自体脐带血用于治疗自闭症症状的功效的开放标签试验中,3种行为结果测量的改善与左颞极和左海马之间的连通性增加相关(VABS II p<0.001;EOWPVT-4p<0.05;CGI-1p<0.0001)。VABS II和EOWPVT-4的改善与梭状回和壳核之间(VABS II p<0.05;EOWPVT-4p=0.01)以及下颞回和海马之间(两者p<0.05)(两者都在左半球)的连通性增加相关。最后,VABS II和CGI-I两者的改善与左半球中下颞回和上颞回之间(VABS II p<0.05,CGI-Ip<0.01)及颞极和苍白球之间(VABS II p<0.01;CGI-I p<0.05)的连通性增加之间存在显著相关性。VABS II和CGI-I的改善还与右半球中额极和苍白球以及岛叶和壳核之间的连通性增加显著相关(全部p<0.05)。
使用GE Premier Performance 3T MRI扫描仪进行研究,其是GE的FDA批准的Premier系统的改进版本,但具有更好的高分辨率成像能力。此改进系统上的所有操作参数均在FDA指南中以满足相同的最低风险设备标准并确保人类受试者的安全。因此,不需要研究设备豁免(Investigational Device Exemption)(IDE)。依据这个实验方案进行的研究不是评估这个设备的安全性和有效性。
可以利用以下的成像:
·高分辨率T1成像,3D IR准备的FSPGR,1×1×1mm分辨率,估计成像时间3分钟。
·高分辨率灌注成像,带有动脉旋转标记的3D螺旋,目标分辨率1.5×1.5×1.5mm(如果SNR足够,将评估1×1×1),估计成像时间3分钟。
·高分辨率弥散张量成像,2D多次激发DW EPI基本序列,25个弥散编码方向,b因子800s/mm2,目标分辨率1.5×1.5×1.5mm(如果SNR足够,将评估1×1×1),估计成像时间10分钟。
·高分辨率fcMRI,2D单-或双-激发EPI基本序列,目标分辨率1.5×1.5×1.5mm(如果SNR足够,将评估1×1×1),估计成像时间10分钟。(每次运行5分钟,两次运行)。
·高分辨率定量磁敏感成像,基于多回波3D FSPGR采集,目标分辨率1×1×1mm,估计成像时间5分钟。
分析群体
完全分析群体。登记加入试验中的每位参与者。
安全性群体。接受至少一次研究产品施用的所有参与者。安全性终点的分析在这个群体中进行。
改良的意向性治疗(mITT)群体。在基线和6个月时观察到主要结果的所有参与者。在这个群体中进行主要和次要终点的分析。参与者根据分配的治疗进行分析。如果没有数据丢失,则这个群体等同于完全分析群体。但是,如果mITT和完全分析群体之间存在实质性差异,则考虑逆概率加权或其他适用于丢失数据情况的方法。
安全性和不良事件报告
不良事件(AE):不良事件是与使用研究产品相关的任何不合需要的医学发生,无论其是否被认为与研究产品相关联。
严重不良事件(SAE):如果在研究者或赞助者看来,不良事件或可疑不良反应导致以下任一种结果:死亡、危及生命的不良事件、患者住院或延长现在的住院、进行正常生活功能的能力持续或严重丧失或严重破坏或者先天性异常/出生缺陷,则其认为是“严重的”。可能不会导致死亡、危及生命或需要住院的重要医学事件在基于适当的医学判断可能会危害患者或受试者并且可能需要医学或外科手术干预以防止这个定义中列出的结果之一时,可以认为是严重的。
等级/严重性:等级/严重性将根据CTCAE v5.0指南进行评估。
可疑的不良反应:可疑的不良反应是存在研究产品引起不良事件的合理可能性的任何不良事件。“合理可能性”是指有证据表明研究产品与不良事件之间的因果关系。
因果性:研究人员在评估研究产品民不良事件的因果关系时将使用以下问题:“是否存在研究产品导致该事件的合理可能性?”肯定回答将事件指定为可疑不良反应。
不良事件报告
必须记录从hCT-MSC输注时开始的研究期间报告或观察到的所有不良事件。在5%登记入组的参与者中发生的AE在Clinicaltrials.gov.中报告。待报告的信息包括现场何时获知事件、研究者指定的严重程度评估以及与研究治疗的关系、是否存在可选的病因、严重性以及任何需要的治疗或评估,及结果。一般而言,研究人员应在可能的情况下将不良事件报告为疾病或综合症,而不是报告单个的组成症状、体征、实验室异常和后遗症。
在收到信息的七个日历日内报告严重的不良输注反应(致命、危及生命或需要住院)。按照FDA的指南,研究人员或其代表在收到信息后的七个日历日内通过电话或传真向FDA报告所有致命或危及生命的SAE。所有严重的和意外的AE将在收到信息的15天内通过书面报告向FDA报告(21CFR 312.32)。如果主要研究人员评估事件与研究无关,则该事件将不需要加急报告,但将包括在年度总结报告中。
h-CT-MSC输注的24小时内的以下事件也将记录在e-CRF中:过敏反应/超敏反应、窦性心动过缓、窦性心动过速、高血压、低血压、发烧、寒颤/发抖、恶心、呕吐、感染、呼吸困难、缺氧和血红蛋白尿。
严重不良事件报告
主要研究人员或其代表负责将任何意外的SAE电话或传真报告给FDA。主要研究人员或其代表尽可能快地将与研究疗法的使用相关的任何致命或危及生命的经历通过电话或传真通知FDA(加急报告),但不迟于收到信息后的七个日历日。最初的通知后,在15个日历日内提交书面报告。对于与研究疗法使用相关的SAE,主要研究人员应尽快将最初收到的信息通知FDA,但不迟于15天。主要研究人员或副研究人员负责将任何研究相关的和意外的SAE通知机构审查委员会(IRB)和DSMB。
停止准则
在研究期间,将监测以下停止准则。研究团队将监测停止准则,并将其用于指示需要研究人员和DSMB讨论的界限。如果发生以下情况,将停止研究以进行安全性审查:
·任何受试者在输注的48小时内经历4-5级输注反应;或
·出现由医疗安全性监测和/或DSMB确定为与研究产品在时间上相关的两个或更多个4-5级不良事件;或
·任何受试者在输注6个月内出现血流感染;或
·任何受试者产生II-IV级GvHD;或
·任何死亡。
实施例1:在自闭症谱系障碍幼儿中hCT-MSC输注是安全和可行的研究设计和概述
对12名ASD儿童一次、两次或三次人脐带组织来源的间充质基质细胞(hCT-MSC)静脉输注(每两个月施用)的I期、单中心、开放标签试验。所有儿童最初接受筛选方案以获得医疗记录而登记入组。所有患者的护理者通过电话完成了研究前的筛选访谈,并提供了医疗记录和视频供研究团队审查以确定是否符合该试验的资格。确诊为ASD的两(2)至十一(11)岁儿童有资格参加。在试验的筛选和治疗阶段均获得书面知情同意。该试验由依据IND#17313进行的杜克医院机构审查委员会批准。
作为其参与研究的一部分,取决于所施用的hCT-MSC输注的次数,患者(n=12)及其护理者到访杜克大学两次至四次。在基线访问时,对每位患者进行评估并接受了单次hCT-MSC静脉输注。第一群组的三名患者接受了单剂量。第二群组的三名患者接受了两个剂量,各自间隔两个月施用。第三群组的六名患者接受了三个剂量,每剂间隔两个月施用。在基线访问和最初hCT-MSC输注后六(6)个月,患者返回以进行追踪临床评估(研究方案见图1)。每位患者在每次输注后的7-10天、2个月和4个月以及最后一次hCT-MSC输注后6个月和12个月时收集另外的护理者访谈和调查。
患者
基于第五版精神障碍诊断和统计手册(Diagnostic and Statistical Manual ofMental Disorders)(DSM-5)(DSM-5.American Psychiatric Association 2013;Washington,D.C.),满足ASD临床诊断标准的2-11岁的患者有资格被纳入研究。十二个儿童登记入组,三个女孩,九个男孩,平均年龄为6.4岁(范围在4-9岁)。十一名受试者是白人,一名是亚裔;两个是西班牙裔或拉丁裔。从3个不同批次总共施用了27个hCT-MSC剂量。每次施用的目标剂量为2.0×10
研究基本原理
该临床研究的机理性原理假设了hCT-MSC可以通过旁分泌和多分泌(allocrine)机制起作用以调节大脑中正在进行的炎症和/或免疫病理,并可能保护神经元免受进一步损害。在许多情况下,MSC抑制而不是增强免疫和炎性反应。证明的机制包括效应T细胞的转变,例如调节性T细胞群体的产生,以及单核细胞/树突细胞细胞因子产生的变化,从而导致抗炎性细胞因子。多次给药方案可能改善总体反应速率和持续时间。
MSC已经显示出发挥免疫调节作用(参见,Vellasamy等,Cytotherapy 2016;18(10):1270-1283;Gesundheit等,Med Hypotheses2015;84(3):169-177;Koh等,J Neurosci2015:35(47):15649-15665;Jaimes等,Stem Cells 2016;doi:10.1002/stem.2541;和Ooi等,Neuroimmunomodulation 2015;22(4):233-242)。尚不清楚这些现象是由MSC的直接作用引起还是通过另一种机制介导的。杜克大学的研究使用RayBiotech(Norcross,GA)的细胞因子阵列证明了hCT-MSC产生并分泌多种细胞因子和趋化因子。使用Bioplex分析和ELISA,测量的所选细胞因子/趋化因子的水平显示于表4中。
表4.hCT-MSC的细胞因子和趋化因子产生
程序:hCT-MSC输注
如上所述,最终产品衍生自P2培养物,其被收集至含有5%人血清白蛋白(HSA)(Grifols,巴塞罗那,西班牙)的plasmalyte(Baxter Healthcare,Deerfield,IL)中,洗涤并以5毫升冷冻保存于5隔室冷冻袋(Syngen)中,在10%的DMSO和葡聚糖(AkronScientific,Boca Raton,FL)中以终浓度含有5千万-1亿个细胞。在施用当天,将一个隔室解冻,在10-40mL的plasmalyte IV溶液中稀释,放入注射器或袋中,然后运送到床旁进行30-60分钟的施用。
选择三批次hCT-MSC用于这个临床试验。根据表5,每批次以每个剂量水平在1-2位患者中进行测试。总共12位患者接受3次给药方案的治疗。对于接受多个剂量的患者,每剂量由2×10
表5:患者给药和给予的hCT-MSC细胞批次。
所有受试者接受至少一次同种异体hCT-MSC细胞输注。输注当天,由CT2 GMP实验室按照标准操作程序对hCT-MSC细胞进行解冻和制备,并在研究团队和儿科血液与骨髓移植项目人员的监督下,在诊所为患者提供输注。获得基线生命体征(心率、血压、温度、呼吸频率)。在整个输注过程中以及输注后至少5分钟内连续监测脉搏血氧仪。由临床人员、麻醉人员或研究团队成员放置外周IV。用苯那君(Benadryl)(0.5mg/kg IV)和索洛美特罗(Solumedrol)(0.5mg/kg IV)预先用药后,患者接受了剂量为2×10
hCT-MSC输注的安全性
该开放标签的I期试验的主要终点是安全性。结果表明hCT-MSC输注的耐受性良好。十二(12)名患者登记参与该研究来接受一、二或三次hCT-MSC输注。所有12名患者均完成了他们的hCT-MSC输注。在整个输注期间和最后一次输注后12个月对不良事件的评估表明了治疗是安全的且耐受性良好。不良事件是轻微的,预期的,和与研究产品无关的。没有报道严重不良反应。更具体地,在输注24小时内有2名患者报告了三种反应。群组2中的一名患者在输注2后出现了过敏反应和中度低血压。由于在初次输注过程中对IV苯那君的极度躁动的不良反应,这名患者接受了口服安泰乐(Atarax)作为第二次输注的替代预先用药。在第二次hCT-MSC输注开始后不久,患者发生弥散性红皮病和咳嗽,随后出现轻度低血压和缺氧。输注立即停止,且患者通过液体推注和额外剂量的IV索洛美特罗完全回复。一剂IV苯那君后,剩余hCT-MSC输注成功完成。群组3中的一名患者在输注3后出现了中度低血压并接受了额外的IV输液。
在12名登记参与患者的11名中,总共报告了53个非严重不良事件(AE)(53个轻度和1个中度)(图2)。最频繁发生的事件是躁动(13个事件,或总报告事件的26%),其次是其他精神症状(7个事件,或总报告事件的13%)。躁动占群组1中事件的三分之一,群组2中事件的1/2,和群组3中事件的~1/5。大多数躁动的报告是在第一次输注后(8个事件),然后是第二次输注(4个事件)和第3次输注(1个事件)。所有躁动事件均在输液的同一天报告,并且也在同一天缓解。在5名不同的受试者中报告了8个其他的精神症状:群组1中1个受试者/1个事件,群组3中4个受试者/7个事件。第一次输注后发生了6个精神症状,并且第3次输注后发生了2个事件。输注后出现精神症状的平均时间为20天(sd=15.2;范围:2-44天)。最初的hCT-MSC剂量后六个月,在没有进行可检测的HLA抗体预处理的5名参与者中观察到HLA抗体的发生(数据未显示)。这些仍在继续监测中,并且尚未有临床意义。
行为测试
还测试了施用的可行性,并描述了通常用于评估ASD儿童行为结果的几种量度的结果。评价了多项家长分级评定的和临床医师分级评定的量度。对前10名患者的分析表明10名患者中有6名分级评定为临床总体印象(CGI)评分有所改善,且10名患者中有7名显示了Vineland适应行为(VAB)量度的社交或沟通子评分的改善。对于在基线时非语言IQ较高的患者,在社交沟通技巧的家长报告测评(Vineland适应行为量表)上观察到患者行为的显著改善。
行为结果评估的结果如表6所示。以下报告的量度包括对社交沟通能力的评估(VABS)(3个点或以上的提高表明改善),自闭症症状的严重程度(PDD-BI)(降低表明改善),和专家临床判断(CGI)(范围从无改善到很大改善)。58%(7/12)的患者显示出至少2/3量度的改善,42%(5/12)的患者显示所有三项量度上改善,和16%(2/12)的患者显示2/3量度改善。在结果量度2/3改善的八名儿童中,有两名接受一个剂量,两名接受两个剂量,和三名接受三个剂量。
表6:行为评价,ASD儿童中hCT-MSC的I期研究
讨论
在这个I期开放标签研究中,评估了在ASD幼儿中一次、两次和三次静脉内输注hCT-MSC的安全性和可行性。还描述了各种行为和功能结果测量的变化以确定哪种最适合用作未来细胞治疗试验的终点。输注后12个月内的不良事件评估表明了hCT-MSC输注是安全的且耐受性良好。所有相关事件均被认为是预期的,与hCT-MSC(研究产物)无关,和无后遗症地消解。
实施例2.II期研究:ASD儿童中单一和重复静脉内hCT-MSC剂量的功效和安全性
这个研究是II期、前瞻性、随机试验,设计来评估ASD幼儿中hCT-MSC静脉内给药的功效。患有ASD的4至8岁儿童有资格参与。所有受试者用hCT-MSC治疗。随机分配到组A的受试者接受两个静脉内剂量的2×10
研究目标
主要目标:确定hCT-MSC改善ASD儿童的社交能力的功效。
次要目标:描述自闭症症状的严重程度、hCT-MSC治疗后临床医生评估的整体改善和语言能力的变化。
探索性目标:(1)描述这个研究中用hCT-MSC治疗的受试者与NIMH发起的对ASD自然病史的纵向研究中观察的相似年龄范围的ASD儿童之间社交沟通能力的差异。(2)描述hCT-ASD治疗后适应性行为和运动技能的变化。(3)描述hCT-MSC治疗后MRI、EEG、注意力的眼动追踪测量和自闭症症状的计算机视觉分析的变化。
研究设计
总体设计
这是对60名4-8岁的ASD儿童进行静脉内hCT-MSC输注的单位点、II期、前瞻性、随机研究。所有受试者用hCT-MSC治疗,使用1:1随机方案测试不同的给药方案(见图3A和图3B)。主要终点是初次hCT-MSC输注后从基线到六个月的社交沟通技能(自闭症的核心症状)的变化,如通过Vineland适应行为量表(VABS)-3调查访谈表,社会化子量表标准评分进行测量的。从首次hCT-MSC输注开始,研究参与持续时间为12个月。
研究终点
主要终点:这项研究的主要终点是最初的hCT-MSC输注后从基线到六个月的社交能力(自闭症的核心症状)的变化,如通过VABS-3社会化标准评分测量的。组A&B(单剂量中总暴露量为6×10
次要终点:比较组A&B、C&D和DukeACT安慰剂组在以下终点从基线到六个月的变化:
1.VABS-3沟通标准评分。
2.CGI-S和CGI-I。
3.表达性单词图片词汇测试。
探索性终点:基于以下结果测量评估了从基线到十二个月测量的变化。组A、B、C和D彼此进行比较,并与来自DukeACT试验的安慰剂组进行比较。
1.VABS-3社会化标准评分。
2.VABS-3沟通标准评分。
3.VABS-3适应行为综合指数及日常生活技能、沟通及运动技能子量表的评分。
4.MRI测量。
5.EEG测量。
6.通过眼动追踪评估的注意力。
7.通过计算机视觉分析(CVA)评估的自闭症症状。
安全性终点:通过以下来评估ASD儿童中的hCT-MSC输注的安全性:
1.输注反应的发生率和严重程度。
2.产品相关感染的发生率和严重程度。
3.通过抗HLA和抗RBC抗体的同种免疫的证据以及全身性炎症的非特异性标志物(ESR,CRP)。
4.移植物抗宿主病的发生率和严重程度。
5.通过与研究产品的关系,意外的不良事件的发生率和严重程度。
研究参与者选择和退出
研究群体
确认ASD诊断的4-8岁年龄的六十名儿童。
入组标准
1.在同意时年龄≥4岁至≤9岁(8岁364天)。
2.使用DSM-5确认的自闭症谱系障碍的临床DSM-5诊断。检查清单如自闭症诊断观察量表-2所知。
3.进行脆性X染色体测试且是阴性的;进行了CMA和/或全外显子组测序并且结果与自闭症诊断无关联。
4.在输注研究产品前至少2个月内,稳定进行目前的精神药物治疗方案(剂量和给药方案)。
5.正常的绝对淋巴细胞计数(≥1500/uL)。
6.参与者和父母/监护人是讲英语的。
7.能够到访杜克大学三次(基线,三个月,六个月),并且父母/监护者能够参与中期调查和访谈。
8.父母同意。
排除标准
1.总体:
a.医疗记录的审查表明ASD诊断不太可能。
b.下列任何一种并存的精神病症的已知诊断:抑郁症、双相障碍、精神分裂症、与双相障碍相关的强迫症、Tourette综合征。
c.筛选数据表明参与者不能遵守研究程序要求,如研究团队评估的。
d.家庭不愿意或不能承诺参与所有与研究相关的评估,包括方案随访。
e.兄弟姐妹登记参与了这个(Duke hCT-MSC)研究。
2.遗传:
a.记录表明儿童患有已知的遗传综合征,如(但不限于)脆性X染色体综合征、神经纤维瘤病、Rett综合征、结节性硬化症、PTEN突变、囊性纤维化、肌营养不良症或已知肯定与ASD相关的遗传缺陷。
b.与ASD相关的已知致病性突变或拷贝数变化(CNV)(例如,16p11.2、15q13.2、2q13.3)。
3.感染:
a.已知的活动性CNS感染。
b.基于记录或临床评估的不受控感染的证据。
c.已知的HIV阳性。
4.医学
a.已知的代谢障碍。
b.已知的线粒体功能障碍。
c.不稳定性癫痫或不受控制的癫痫发作、婴儿痉挛、Lennox Gastaut综合征、Dravet综合征或其他类似的慢性癫痫发作障碍的病史。
d.活动性恶性肿瘤或先前用化疗治疗的恶性肿瘤
e.原发性免疫缺陷障碍的病史。
f.自身性免疫性血细胞减少症(即,ITP、AIHA)的病史。
g.可能使儿童面临研究程序并发症的增加风险的共存医学状况。
h.可能将来需要干细胞移植的同时发生的遗传性或获得性疾病或共病。
i.严重的感觉障碍(例如失明、耳聋、听觉失调)或运动障碍(例如脑瘫)。
j.如通过血清肌酐>1.5mg/dL或总胆红素>1.3mg/dL确定的肾或肝功能受损,已知吉尔伯特病的患者除外。
k.重大血液系统异常,定义为:血红蛋白<10.0g/dL,白细胞<3,000细胞/mL,ALC<1000/uL,血小板<150×10e9/uL。
i.由PI或其他研究人员(包括医学遗传学家和精神病学家,他们受过训练以识别与神经发育状况相关的畸形特征)评估的,表明遗传综合征的临床相关身体畸形的证据。
5.当前/先前的治疗:
a.库存的合格自体脐血单元的可用性。
b.先前细胞疗法的历史。
c.当前或先前使用IVIG或其他抗炎药物治疗,NSAID除外。
d.当前或先前的免疫抑制治疗:
i.没有持续>2周的全身性类固醇治疗,且登记入组前3个月内没有全身性类固醇疗法。允许局部和吸入型类固醇。
研究参与者的提前退出
方案治疗中移除的标准:(a)在评估或研究中诊断遗传疾病。(b)排除研究参与的医学状况的变化。
脱离方案治疗的患者应跟踪直到他们满足脱离研究的标准(见下文)。除非撤回同意,否则获取脱离方案的参与者的随访数据。在输注hCT-MSC之前脱离研究的受试者将被视为不可评估的,且可以另一受试者替换。
脱离研究标准
1.死亡。
2.失访。
3.对于任何进一步的数据收集撤回同意。
4.完成最终研究访问。
人脐带组织来源的间充质基质细胞(hCT-MSC)
hCT-MSC是从消化的脐带组织制造的同种异体细胞的产物,其在培养物中扩增、冷冻保存和库存。经婴儿母亲书面知情同意后,从捐献给Carolinas脐带血库的脐带血组织制造hCT-MSC,所述脐带血库是杜克大学医学中心的FDA许可的、FACT认证的公共脐带血库。脐带组织从在正常的足月妊娠后通过选择性剖腹产分娩的男婴的胎盘中收获。捐献者筛查问卷由母体捐献者完成,并且母体血液通过美国北卡罗来纳州夏洛特市美国红十字会的经CLIA认证的捐献者筛查实验室进行传染病检测。捐献者必须有资格向公共脐带血库捐献用于同种异体使用。胎盘和脐带分娩后,脐带血从胎盘中无菌排出。然后将脐带干燥并用cloropres清洗,与胎盘底部分离,放入含有Plasmalyte A的无菌瓶中,并在室温下在经过验证的容器中运输到Robertson CT2GMP细胞加工实验室。
在清洁室生产套装中,将脐带组织在生物安全柜中从培养基中取出,放入无菌皿中,切成小块,并随后切碎和在含有GMP级酶:透明质酸酶、DNase、胶原酶、木瓜蛋白酶的Miltenyi Biotec GentleMacs Octo Dissociator中消化。将得到的细胞悬浮液置于含有1%血小板裂解物的Prime XV MSC Expansion XSFM(Irvine Scientific)培养基中培养,并生长至汇合(~7-14天)以建立P0培养物。为了建立主细胞库,收集P0并用Cryostor 10培养基(BioLife)冷冻保存在冷冻小瓶中,并储存在液氮的气相中。P1和P2培养物在相似的条件下在没有血小板裂解物的hyperflask或hyperstack中生长,分别按照需要生成工作细胞库和用于施用的产品。使用TrypLE(Gibco)从塑料培养器皿中移除P1和P2的细胞。最终产品源自P2培养物,其收集到含有5%人血清白蛋白的plasmalyte中,洗涤并以5mL冷冻保存在5隔层冷冻袋中(Syngen),其在含有葡聚糖的10%DMSO(Akron Scientific)中终浓度含有5千万-1亿个细胞。在施用当天,解冻一个隔室,稀释在10-40mL的plasmalyte IV溶液中,放入注射器或袋子中,并运送到床旁进行30-60分钟的施用。
在每次传代,通过流式细胞术以及经由T细胞增殖和小胶质细胞激活的器官型模型的功能测定来评估细胞表面表型而表征细胞产品。冷冻保存P2之前,还将对每批产品进行无菌、内毒素和支原体测试,这些测试必须符合规范。对于给药,解冻和稀释后的交付测试包括TNCC和通过细胞仪测定的存活力。还开始了无菌培养(14天),但在输注时尚无可用的结果。基于解冻后的计数,患者接受2×10
捐献者筛查和测试
捐献者的筛查和测试是按照Carolinas脐带血库的标准操作程序进行的,以满足21C.F.R.第1271部分中的所有要求。筛选和测试符合最新推荐,并且已获得了依据生物许可号1870的FDA批准。对脐带血的母体捐献者进行了筛查并检测了HIV-1、HIV-2、乙肝病毒(HBV,表面和核心抗原)、丙肝病毒(HCV)、梅毒螺旋体(梅毒)、CJD(仅筛查)、Chagas、1型和2型人嗜T淋巴细胞病毒(HTLV-1、HTLV-2)和CMV。还对母体血液进行了HIV-1/2/O、HBV、WNV和HCV的核酸检测。还进行了寨卡病毒的筛查。
处理和最终制剂
hCT-MSC是按一系列的三个步骤从单个脐带组织制造的,这些步骤生成主细胞库、工作细胞库和研究产品。将每一步的产物冷冻,并在液氮冷冻箱的气相中储存。在P2,在用该批次产品治疗任何患者之前,将代表性的冷冻袋解冻并确认合格。测试包括细胞计数、存活力、表型、功能测定、内毒素、支原体、革兰氏染色和无菌性。
在治疗当天,按照SOP CT2-MSC-006将细胞解冻,稀释于10-40mL的plasmalyte-A+5%HSA中,并取出等份试样以用于细胞计数、存活力和无菌性培养。如果细胞符合交付标准,则调整最终产品体积以向研究受试者递送适当剂量(2或6×10
在测试解冻后细胞计数和存活力之后,将hCT-MSC最终产品有条件地交付以施用于患者。最终交付在研究产品的14天无菌培养期后进行。如果在产品施用后无菌培养转变为阳性,则鉴定出生物体并进行抗生素敏感性试验。与患者家属联系以确定他们是否有症状(即发烧)。无症状的患者不接受抗生素治疗。对有症状的患者进行评估并相应地用血液培养物和抗生素治疗。在注意到阳性无菌性测试后,接受随后无菌性测试阳性的产品的所有患者均由研究护士每日接触进行追踪阳性无菌性测试后14天。
安慰剂产品
由于冷冻保存中使用了DMSO,已经解冻的用于施用的冷冻保存的hCT-MSC具有独特的气味。为了使患者和家属对所接受的输注类型完全不知情,安慰剂产品在外观和气味上必须相似。因此,安慰剂产品是无细胞的,由plasmalyte-A和1%DMSO组成,这是细胞产品中的标准成分。安慰剂产品的体积为10-40mL,与hCT-MSC产品使用的范围相同。安慰剂溶液放置在相同的最终容器中,因此在六个月输注时,临床人员、患者和家属对研究产品或安慰剂仍然不知情。
产品的施用
患者在预定的输注日进入输注中心。如果患者无法保持静止或不合作,则可能需要在进行IV处置前进行一些镇静。外周IV由临床或研究人员放置。给患者预先施用苯那君0.5mg/kg/剂量IV和索洛美特罗0.5-1mg/kg IV。hCT-MSC或安慰剂产品在30-60分钟内静脉内施用。到达诊所后,尝试测量生命体征(心率、血压、体温、呼吸频率),并按照临床指示进行监测。在整个输注过程中以及输注后至少5分钟连续监测脉搏血氧仪。输注后应观察患者至少15-30分钟。
安全性随访
在每次输注后的第1天,参与者与研究人员见面以评估任何与输注相关的不良反应或并发症。每次输注后7-10天,研究团队的成员通过电话或电子邮件与父母或监护人联系以评估患者状态和任何不良事件。在随后的每次访问以及6个月和12个月时都会进行问卷调查以针对严重不良事件进行评估。在治疗前以及在MSC给药后6和12个月时获得PRA。
研究计划
概述
一旦完成所有筛查并且患者可能符合研究标准,患者将前往Duke进行首次访问。在第1天,获得知情同意并通过身体观察和按照DSM-5标准的ASD诊断验证确定患者的适格性。如果认为该儿童符合条件,则将他/她登记参与研究并随机分配至hCT-MSC给药群组之一。在他/她第一次访问期间,他/她还接受了另外的临床和神经心理学评估、EEG测试、眼动追踪和CVA评估,以及MRI。在每次输注后第二天亲自或通过电话评估参与者,并在每次输注后7-10天联系父母以进行安全性评估随访。参与者返回Duke进行预定的hCT-MSC输注和监测,并在其初始剂量后的6个月和12个月时进行重复的临床、神经心理学、EEG、眼动追踪、CVA和安全性随访。
患者筛查
对于研究的筛查在单独的、IRB批准的筛查方案(Pro00063563)下进行。根据该方案,在获得父母/监护人的书面知情同意后,将获得患者的医疗和心理学记录、学校记录、照片、行为视频以及所有遗传学测试的结果,并由两个团队进行审查。医学审查由儿科护士、护士从业人员和医师的小组进行,以识别是否存在任何代谢、免疫、神经、感官、遗传或实验室排除标准。如果未确定此类排除标准,则由具有诊断和治疗ASD儿童专长的心理学家、精神科医生和社会工作者的组合进行精神病学审查。他们会对患者的心理记录以及任何可用的学校和治疗记录进行广泛的审查。精神病学筛查团队将进行ADI-R评估。两个团队都检查患者的照片和记录以评估畸形特征。然后,由具有ASD相关的遗传病症的专业知识的医疗遗传学家对具有可疑的面部特征或遗传学测试发现的任何患者进行审查。患者必须经过医学和精神病学筛查团队的批准才能进行进一步的实验室或者电话或面对面的筛查和研究入组。如果在筛查过程中出现以前未诊断的病症或遗传发现的问题,将与患者的父母/监护人进行讨论,并将转介给合适的医学或精神科医师以进行评估和治疗(如果有指示)。
研究输注
所有受试者接受至少一次同种异体hCT-MSC细胞输注。在输注当天,由CT2 GMP实验室和/或杜克干细胞实验室按照标准操作程序解冻和制备hCT-MSC细胞或安慰剂产品,并在研究团队以及儿科血液和骨髓移植项目人员的监督下为患者提供输注。获得基线生命体征(心率、血压、温度、呼吸率)。外周IV将由临床人员、麻醉或研究团队的成员放置。在输注前,给予预先用药(苯那君,索洛美特罗)。将研究产品在30分钟内输注。输注后,在诊所观察儿童至少15-30分钟。尝试1.5维持的IV液体(D51/2NS)。如果所有生命体征均处于基线,并且无症状且无毒性证据,则患者在至少1个小时后出院。输注后第二天由研究人员对患者评估是否有任何与输注相关的不良反应或并发症。输注后7-10天,研究人员打电话给父母/监护人以评估输注的安全性。
如果患者在计划输注的当天有疾病迹象,包括但不限于发烧>38.5℃、呕吐、腹泻或呼吸窘迫,则推迟输注。
意外事件期间的护理
如果患者在他/她的研究输注过程中出现过敏反应的体征或症状,包括荨麻疹、呼吸困难、咳嗽、喘息或呕吐,则终止输注并开始适当的医学治疗。
评价
表7:医疗和安全性评估
表8.诊断、行为、神经认知和神经生理学评估
统计考虑因素
这是对60名2-7岁的ASD儿童进行静脉内hCT-MSC输注的单位点II期前瞻性研究。所有受试者均用hCT-MSC治疗。使用均匀分配将受试者随机分配到四种给药方案中的一种。从首次hCT-MSC输注起,研究参与持续时间为12个月。使用外部对照组来评估疗效。
研究持续时间:研究参与者将参加研究施用第一剂hCT-MSC后的12个月。
人口统计和基线特征:汇总了所有研究参与者的人口统计和基线特征。检查的特征包括年龄、性别、种族/民族和基线行为状态。
主要终点:这项研究的主要终点是最初的hCT-MSC输注后从基线到六个月的社交沟通技能(自闭症的核心症状)的变化,如通过Vineland适应行为量表(VABS)-3调查访谈表,社会化子量表标准评分测量的。将组A&B(单剂量,总暴露量为6×10
样本大小和功效计算:以下假设来自DukeACT的患者水平数据与来自本研究的数据合并进行分析。统计功效的评估设想通用线性模型(GLM)拟合以使用基线评分、年龄、非语言发育商(NVDQ)和研究指标(DukeACT或目前的模型)作为连续协变量预测第6个月VABS-3社会化标准评分。基于来自DukeACT研究的中期分析(N=119)的施盲数据,并在基于本研究和DukeACT中相似资格标准的有限研究间变异性的假设下,在协变量与第6个月评分之间假设r=0.85的多重相关性(R平方=0.7291)。
假设从GLM得出的对比(contrasts)以比较组A&B(单剂量,总暴露量为6×10
表9.与研究有关的统计学假设
使用标准化效应大小来表示三个可能的替代假设,由此采用组A、B、C和D中各自15名患者的样本和DukeACT安慰剂组的60名样本来计算功效。功效计算采取.0125的逐检验(test-wise)alpha(在4个假设检验中分割.05的逐试验(experiment-wise)alpha,如以下表10中所示),并假定上述连续协变量和多重相关性。所有分析使用SAS v9.4(SASInstitute,Cary,NC)中的PROC GLMPOWER来进行。
表10.统计分析
该表显示了总共120名参与者(组A&B和C&D中各30名,60名来自DukeACT中)提供至少90%的功效来检测hCT-MSC的中等、共同治疗效果或仅hCT-MSC单次给药方案的治疗效果,具有严格的I型误差控制和协变量调整。该研究具有较小的检测小至中等大小线性剂量反应的功效。具体而言,在该替代方案下,区分1或3个剂量的效果的功效降低。
应该理解以上统计功效的估计对协变量和响应之间的关联强度高度敏感。低于~0.8的相关性将导致该研究不足以采用传统标准。
本公开证明了在ASD幼儿中静脉内输注同种异体hCT-MSC是安全和可行的。本公开支持在输注后头六(6)个月中观察到行为显著改善的结论,并且这些显著改善在输注后12个月时持续。较高的基线非语言IQ与较高的改善程度相关。本公开确定了可行的、对变化敏感的并且在发育上适当的并因此适于在未来的临床试验和治疗环境中测试hCT-MSC疗法对ASD幼儿的治疗功效的结果量度。
应理解本文描述的实施例和实施方案仅用于说明性目的,并且鉴于其的各种修改或改变对于本领域技术人员是可以想到的,并且将被并入本申请的精神和范围以及所附权利要求的范围之内。本文引用的所有公开出版物、专利和专利申请出于所有目的按引用并入本文中。
- 利用人脐带组织来源的间充质基质细胞治疗自闭症谱系障碍的方法
- 使用人脐带组织来源的间充质基质细胞治疗脑性瘫痪和缺氧缺血性脑病的方法
