蝎毒苯醌衍生物及其用途
文献发布时间:2023-06-19 10:14:56
相关申请的交叉引用
本申请要求于2018年5月30日提交的标题为“SCORPION VENOM BENZOQUINONEDERIVATIVES AND USES THEREOF”的美国临时申请号62/678156的权益,其全部内容通过引用纳入本文。
关于联邦资助研究的声明
本发明是在美国空军授予的编号为AFOSR FA9550-16-1-0113的政府资助下完成的。政府拥有本发明的某些权利。
技术领域
本公开总体上涉及由蝎毒(scorpion venom)前体合成的1,4-苯醌。本公开总体上还涉及合成1,4-苯醌的方法的用途。本公开进一步涉及1,4-苯醌作为抗微生物剂和抗癌剂的用途。
背景技术
在全世界范围内,蝎螫伤是发病率和死亡率的重要来源,每年使约150万人致残(Chippaux J.P.(2012)Drug design,Develop.Therapy 6:165-173)。对蝎毒的初步研究集中在有毒化合物的分离和结构表征上。这样的研究激发了有效的抗蛇毒疗法(antivenomtherapies)的发展,主要是在超免疫马中产生的抗体(Espino-Solis等人,(2009)J.Proteomics 72:183-199)。这些毒素化合物的大多数是干扰目标组织中的Na
并非蝎毒中所有化合物都对人体健康有害。实际上,近年来,已经分离出具有多种有益特性(包括抗菌活性(Torres-Larios等人,(2000)Euro.J.Biochem.267:5023-5031)、抗疟活性(Conde等人,(2000)FEBS Letts 471:165-168)和抗炎活性(Gurrola等人,(2012)Biochem.51:4049-4061))的化合物(Ortiz等人,(2015)Toxicon 93:125-135)。迄今为止记载的大多数毒液成分是小肽和大蛋白。非蛋白质成分的分离是一个新兴研究领域(Banerjee等人,(2018)J.Natural Prods.81:1899-1904)。
在全球范围内,有超过2300种不同的蝎子。尽管仅表征了约1%的毒液(Santibanez-Lopez等人,(2015)Toxins 8(1))。仅在墨西哥内,就至少有281种不同的蝎子。钳蝎科(Buthidae family)的Centurouroides属的蝎子对人类是危险的,并且已经被充分研究。在已知的20种蝎子科中,有一些科(包括Diplocentridae科)没有毒液分析。
发明内容
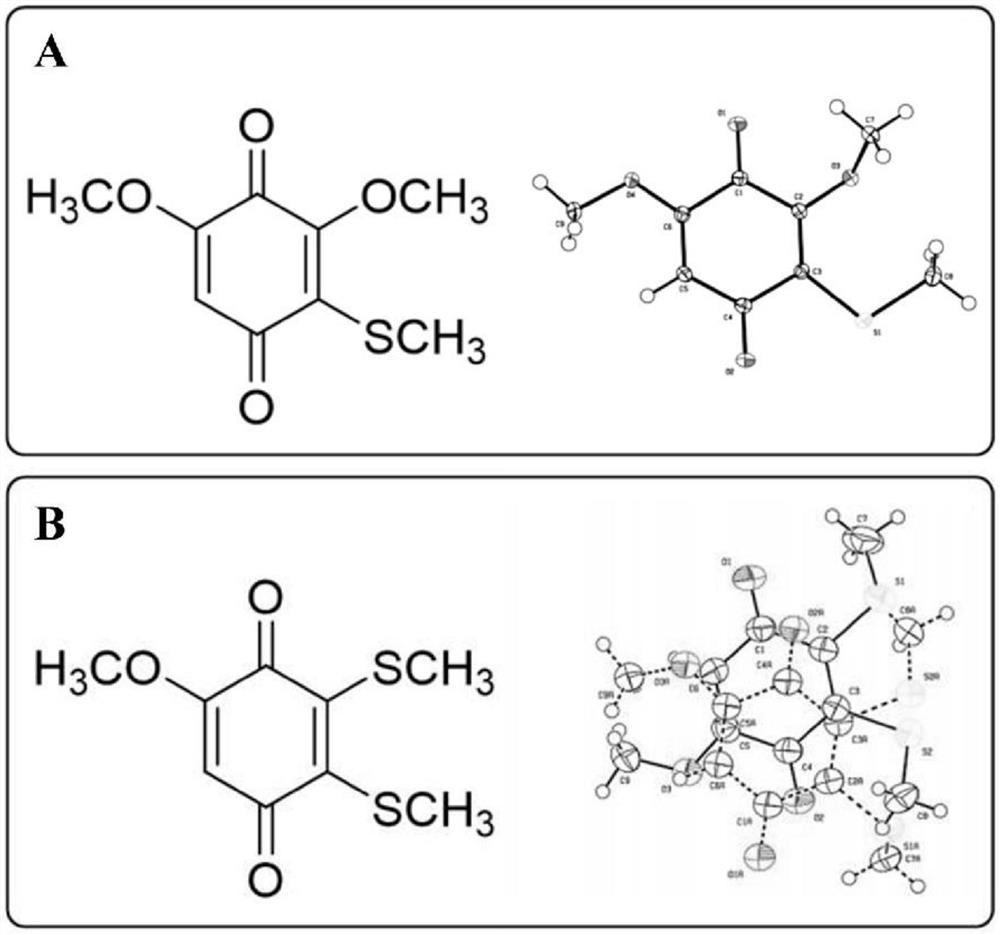
本公开内容包括通过氧化在Diplocentrus melici蝎的毒液中发现的前体分子而获得的非天然存在的1,4-苯醌。提取的毒液最初是粘稠的无色液体,在环境条件下可在数分钟内变色。从该有色混合物中,分离出两种化合物,一种为红色,另一种为蓝色。红色化合物A为3,5-二甲氧基-2-(甲硫基)环己-2,5-二烯-1,4-二酮(3,5-dimethoxy-2-(methylthio)cyclohexa-2,5-diene-1,4-dione),蓝色化合物B为5-甲氧基-2,3-双(甲硫基)环己-2,5-二烯-1,4-二酮(5-methoxy-2,3-bis(methylthio)cyclohexa-2,5-diene-1,4-dione)。本公开还提供了化合物A和B的合成方案。在体外,红色1,4-苯醌和蓝色1,4-苯醌是对金黄色葡萄球菌(Staphylococcus aureus)有效的抗增殖剂,而蓝色1,4-苯醌对结核分枝杆菌(Mycobacterium tuberculosis)(包括多重耐药性(MDR)菌株)的活性更好。两种1,4-苯醌对这些病原体的杀菌活性与现有抗生素相当。蓝色1,4-苯醌在MDR结核感染的小鼠模型体内也有效。本公开的两种1,4-苯醌均对多种哺乳动物肿瘤细胞系具有细胞毒性。
因此,本公开的一个方面包括具有以下结构的1,4-苯醌的实施方案:
其中R
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式A所示的结构或其衍生物:
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式B所示的结构或其衍生物:
本公开的另一方面包括一种药物制剂的实施方案,所述药物制剂包含1,4-苯醌和药学上可接受的载体,所述1,4-苯醌具有以下结构:
其中R
本公开的另一方面还包括一种合成1,4-苯醌的方法的实施方案,其中1,4-苯醌可具有式A所示的结构:
并且,其中1,4-苯醌可以根据方案A合成:
本公开的另一方面还包括一种合成1,4-苯醌的方法的实施方案,其中1,4-苯醌可具有式B所示的结构:
并且,其中1,4-苯醌是根据方案B合成的:
本公开的另一方面还包括一种减少菌种增殖的方法的实施方案,所述方法包括以下步骤:将菌种群与一定量的1,4-苯醌接触,并持续足以减少菌种增殖的时间,所述1,4-苯醌具有以下结构:
其中R
在本公开的这个方面的一些实施方案中,菌种可以是葡萄球菌属(Staphylococcus)或分枝杆菌属(Mycobacterium)。
在本公开的这个方面的一些实施方案中,菌种可以是金黄色葡萄球菌或结核分枝杆菌。
在本公开的这个方面的一些实施方案中,可以向患有细菌感染的动物或人类受试者给药1,4-苯醌。
在本公开的这个方面的一些实施方案中,可以以药学上可接受的制剂的形式向动物或人类受试者给药1,4-苯醌,所述药学上可接受的制剂包含1,4-苯醌和药学上可接受的载体。
本公开的另一方面还包括一种治疗动物或人类受试者细菌感染的方法的实施方案,所述方法包括:向动物或人类受试者给药一种药学上可接受的制剂,所述药学上可接受的制剂包含1,4-苯醌和药学上可接受的载体,所述1,4-苯醌具有以下结构:
其中R
在本公开的这个方面的一些实施方案中,1,4-苯醌具有式A所示的结构或其衍生物:
在本公开的这个方面的一些实施方案中,细菌感染可以是葡萄球菌感染。
在本公开的这个方面的一些实施方案中,细菌感染可以是金黄色葡萄球菌感染。
在本发明的这个方面的一些实施方案中,1,4-苯醌可以具有式B所示的结构或其衍生物:
在本公开的这个方面的一些实施方案中,细菌感染可以是分枝杆菌感染。
在本公开的这个方面的一些实施方案中,细菌感染可以是结核分枝杆菌感染。
本公开的另一个方面包括一种减少癌细胞群增殖的方法的实施方案,所述方法包括以下步骤:将癌细胞群与一定量的1,4-苯醌接触,并持续足以减少癌细胞增殖的时间,所述1,4-苯醌具有以下结构:
其中R
在本公开的这个方面的一些实施方案中,癌细胞群是肿瘤癌或非肿瘤癌。
在本公开的这个方面的一些实施方案中,癌细胞群可以是非肿瘤癌,其中所述非肿瘤癌是白血病。
在本公开的这个方面的一些实施方案中,可以以药学上可接受的制剂的形式向动物或人类受试者给药1,4-苯醌,所述药学上可接受的制剂包含1,4-苯醌和药学上可接受的载体。
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式A或式B所示的结构或其衍生物:
附图说明
当结合附图阅读下面记载的本公开的各种实施方案的详细描述时,将容易理解本公开的其他方面。
图1示出了Diplocentrus melici毒液的衍生化。将新鲜提取的毒液(左)暴露在空气中约10分钟,在此期间颜色变为深红色(右)。
图2A和图2B示出了从Diplocentrus melici的氧化毒液中色谱纯化红色化合物和蓝色化合物。首先,在Sephadex G50中通过凝胶过滤将红色可溶毒液分为3个部分(图2A)。FI部分含有毒液的大部分蛋白质物质。通过RP-HPLC分离红色部分FII和FIII(图2B)。进一步纯化FII部分和FIII部分产生红色化合物和蓝色化合物的纯样品。对应于感兴趣的化合物的峰用星号表示。
图3A示出了将蝎子产生的前体纯化为有色化合物。将来自Diplocentrus melici的新鲜毒液重悬在丙酮中,并通过RP-HPLC分离所得提取物。由此确定了六个主要峰。峰4和峰6分别对应于红色化合物和蓝色化合物。收集所有其他峰并在空气中鼓泡2小时。在此时间结束时,峰2和峰5对应的化合物分别完全转化为红色化合物和蓝色化合物。
图3B示出了前体化合物在圆盘扩散试验中不抑制金黄色葡萄球菌的生长。在培养(incubation)期间,圆盘或琼脂上没有出现彩色。
图3C示出了红色1,4-苯醌和蓝色1,4-苯醌的圆盘扩散试验,显示出了对金黄色葡萄球菌的抑制活性。氨苄西林(ampicillin)(5μg)用作阳性对照。
图3D示出了红色1,4-苯醌和蓝色1,4-苯醌对金黄色葡萄球菌的最小抑制浓度(MIC)的确定。通过微量肉汤稀释法(broth microdilution assay)测定的红色1,4-苯醌的MIC为4μg/mL,蓝色1,4-苯醌的MIC为6μg/mL。氨苄西林用作阳性对照。每个结果均记录为平均值±SD。
图4A和图4B示出了在将对应于峰2和峰5的部分用空气鼓泡之后,它们的内容物被转化为具有与红色1,4-苯醌和蓝色1,4-苯醌相同的保留时间和吸收光谱(插图)的化合物。
图5示出了红色化合物的高分辨率正离子模式ESI质谱,其显示:(图A)质子化、钠化和钾化离子信号;(图B)质子化离子信号的同位素分布。(B)插图给出了经验式C
图6示出了蓝色化合物的高分辨率正离子模式ESI质谱,其显示:(图A)质子化、钠化和钾化离子信号;(图B)质子化离子信号的同位素分布。(B)插图给出了经验式C
图7用红色化合物质子化物质的(CID-MS/MS)数据(m/z 215.0368)示出了碰撞诱导的解离串联质谱,其显示了CO、CH
图8示出了蓝色化合物质子化物质的CID-MS/MS数据(m/z 231.0142),显示了CO、CH
图9示出了碳和质子之间的异核多碳相关(Heteronuclear Multiple BondCorrelation)(HMBC)谱(上方的图),提出了如插图中所示的红色化合物的结构。主要的HMBC相关性在结构中用红色箭头表示。下方的图列出了从
图10示出了碳和质子之间的HMBC谱(上方的图),提出了如插图中所示的蓝色化合物的结构。主要的HMBC相关性在结构中用红色箭头表示。下方的图列出了从
图11示出了在峰2和峰5中发现的前体化合物可能是氢醌(hydroquinone)。
图12示出了使用分析型C18柱对天然的(N)和合成的(S)蓝色(A)和红色(B)1,4-苯醌进行RP-HPLC的保留时间的对比。合成苯醌和天然苯醌的样品表现出相同的色谱行为,蓝色苯醌和红色苯醌的保留时间分别为32.6min和25.2min。合成苯醌和天然苯醌的混合物仅显示了一个主峰。
图13A示出了红色化合物对肿瘤细胞系的细胞毒性作用。用1,4-苯醌处理细胞12小时,并通过稳定的胞质酶乳酸脱氢酶(cytosolic enzyme lactate dehydrogenase)的释放来评估细胞死亡率。每个结果均记录为平均值±SD。
图13B示出了蓝色化合物对肿瘤细胞系的细胞毒性作用。用1,4-苯醌处理细胞12小时,并通过稳定的胞质酶乳酸脱氢酶的释放来评估细胞死亡率。每个结果均记录为平均值±SD。
图14A示出了红色1,4-苯醌和蓝色1,4-苯醌的细胞毒性活性测试。使用新鲜的人红细胞评估溶血率(hemolysis)。通过使用不同浓度的1,4-苯醌培养2小时后的上清液在415nm处的吸光度来评估溶解性(lysis)。TritonX-100用作阳性对照。在所有测试浓度下,1,4-苯醌均未显示溶血活性。
图14B示出了本公开的1,4-苯醌对外周血单核细胞(PBMC)的细胞毒性作用。将PBMC用红色1,4-苯醌和蓝色1,4-苯醌在25μM浓度下培养12小时,并通过稳定的胞质酶乳酸脱氢酶的释放来评估细胞死亡率。发现两种1,4-苯醌均对PBMC具有细胞毒性。每个结果均记录为平均值±SD。
图15示出了在蓝色1,4-苯醌和红色1,4-苯醌存在下谷胱甘肽氧化试验。将不同浓度的1,4-苯醌(在磷酸盐缓冲液中)与120μM GSH的溶液反应。反应1小时后,加入200μM的Ellman试剂(5,5′-二硫代双-(2-硝基苯甲酸),DTNB),并在412nm下观察到了所得的谷胱甘肽-DTNB缀合物(glutathione-DTNB conjugate)。
图16A示出了使用氧化剂传感探针二氯二氢荧光素二乙酸酯(dichloro-dihydro-fluorescein diacetate)(DCFH-DA)检测细胞内活性氧自由基(reactive oxygenspecies)(ROS)。使用了TE671肌肉细胞。根据ATCC指南培养细胞。处理之前,将细胞在10μMDCFH-DA溶液中培养1小时。将细胞用磷酸盐缓冲液(PBS)洗涤3次后,以25μM的浓度给予红色1,4-苯醌或蓝色1,4-苯醌。然后将细胞在5%CO
图16B示出了用红色或蓝色1,4-苯醌培养引发了Jurkat细胞的细胞凋亡(apoptosis)。在该测试中,将Jurkat细胞用红色或蓝色1,4-苯醌在25μM的浓度下培养0、4、8和12h。然后将细胞用FixableViability Dye eFIuor 780和FITC Annexin V染色,并使用流式细胞术(flow cytometry)进行分析。Annexin V的阳性染色是早期细胞凋亡的标志,AnnexinV和viability染料两者均阳性染色是晚期细胞凋亡/坏死(necrosis)的标志。双阴性是活细胞。细胞分为三类(活细胞、早期细胞凋亡和晚期细胞凋亡/坏死)。来自三个独立实验的数据显示为平均值±SEM(平均值的标准误差)。
图17示意性地示出了合成红色苯醌的过程。
图18示意性地示出了合成蓝色苯醌的过程。
图19示出了从Diplocentrus melici的毒液中提取的红色化合物的结构(图A)和蓝色化合物的结构(图B)。右图示出了合成分子的相应X射线晶体学数据(CCDCNo.0001001197099)。
图20A-图20H示出了蓝色苯醌和红色苯醌对结核分枝杆菌(H37Rv和MDR菌株)的抑制活性(体外)。
图20A为示出了通过微量肉汤稀释法测定的最小抑菌浓度(MIC)和通过使用CellTiter 96.RTM Aqueous的比色法评估的细菌增殖的图。对于两种菌株,蓝色苯醌对结核分枝杆菌的MIC为4μg/mL。红色苯醌的MIC为160μg/mL。
图20B为示出了通过计数在MIC值处处理后得到的菌落形成单元而评估的细菌生存力的图。每个结果是平均值±SD。
图20C-图20F是数字电子显微镜图像,显示了结核分枝杆菌响应蓝色苯醌而发生的超微结构变化。
图20C示出了对照的未处理的细菌,其显示出界限清楚的、均质的且略微电子透明的细胞壁,而细胞质通常为电子透明的,并具有一些脂质中等大小的液泡。
图20D示出了在用苯醌培养后产生了实质性的异常,例如细胞壁的大量消失(effacement)(箭头)和细胞质提取(星号)。
图20E和图20F示出了位于细胞质中心区域的电子致密网状细丝的聚集体(conglomerates)。
图20G和图20H示出了由异烟肼培养诱导的相似的亚细胞变化。
图21A-图21F示出了蓝色1,4-苯醌对结核分枝杆菌的抑制活性(体内)。使用由多重耐药性(MDR)CIBIN99菌株感染的BALB/c小鼠组成的进行性肺结核实验模型。用蓝色1,4-苯醌对小鼠进行两个月的治疗,每隔一天通过气管内途径给药8μg的剂量。
两个月后,与未经治疗的组相比(图21B),用蓝色1,4-苯醌治疗的小鼠组的病状明显改善(图21A),肺杆菌载量(lung bacillary load)减少了90%以上(通过计数菌落形成单元进行评估)。在治疗组的肺中观察到受肺炎影响的肺表面(LSAP)百分比降低。通过自动化组织形态计量学(automated histomorphometry)证实了这种差异,该自动化组织形态计量学表明治疗后肺炎减少了50%。
图21C-图21F示出了来自未治疗组的肺的代表性显微照片(苏木精-伊红(hematoxylin-eosin)染色,放大250倍)(图21C),其示出了大范围的肺炎(星号)。治疗组的肺中的肺炎较少(图21D)。图21E示出了用8μg的蓝色1,4-苯醌经气管内治疗一个月的健康小鼠的代表性显微照片。除了在小静脉周围偶发轻度炎性浸润(箭头)外,肺组织学正常。图21F示出了在健康对照小鼠的肺中没有纤维化(马松三色染色(trichrome Massonstaining),放大200倍)。
具体实施方案
在更详细地描述本公开之前,应理解,本公开不限于所描述的特定实施方案,并且当然因此可以改变。还应理解,本文所使用的术语仅出于描述特定实施方案的目的,而无意于进行限制。
在提供数值范围的情况下,应理解为,除非上下文另有明确规定,否则在该范围的上限和下限以及该范围内的任何其它所述值或中间值之间的每一个中间值,直到下限单元的十分之一,都包含在本公开中。这些较小范围的上限和下限可以独立地包含在较小范围中,并且也应包括在本公开之内,但要遵守所述范围内任何明确排除的限制。在所述范围包括一个或两个极限的情况下,排除那些包括的极限中的一个或两个的范围也包括在本公开中。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的含义相同的含义。尽管类似于或等同于本文描述的那些方法和材料的任何方法和材料也可以用于本公开的实践或测试中,但是现在描述的是优选的方法和材料。
引用本说明书中引用的所有出版物和专利以公开和描述与所引用出版物有关的方法和/或材料。所有这些出版物和专利都通过引用纳入本文,就好像每个单独的出版物或专利都被具体地和单独地指出通过引用纳入本文。通过引用的这种纳入明确地限于所引用的出版物和专利中描述的方法和/或材料,并且不扩展到所引用的出版物和专利中的任何词典释义。在本申请中没有明确重复的在所引用的出版物和专利中的任何词典释义不应被视为是词典释义,并且不应被理解为限定出现在所附权利要求中的任何术语。引用任何出版物都是为了在申请日之前披露该出版物,不应解释为承认本公开因在先公开而对于早于申请日的这类出版物无权。此外,提供的公开日期可能与需要独立确认的实际公开日期不同。
对本领域技术人员而言,在阅读本公开后将显而易见的是,本文描述和示出的每个单独的实施方案具有离散的组成和特征,其可以容易地与任何其他几个实施方案的特征分离或组合,而不脱离本公开的范围或精神。任何记载的方法可以按照记载的事件的顺序或逻辑上可能的任何其他顺序进行。
除非另有说明,否则本公开的实施方案将采用本领域技术范围内的分子生物学、微生物学、有机化学、生物化学、生理学、细胞生物学、癌症生物学等技术。文献中对这种技术进行了充分的解释。
定义
如本文所用,当与数值变量结合使用时,“约(about)”、“近似(approximately)”等通常可以指代变量的值以及在实验误差内的变量的所有值(例如,在平均值的95%置信区间内)或在指示值的+/-10%以内,以较大者为准。
如本文所用,术语“给药(administering)”可指通过下述方式给药:口服、局部、静脉内、皮下、经皮(transcutaneous)、经皮肤(transdermal)、肌内、关节内(intra-joint)、胃肠外、小动脉内、真皮内(intradermal)、心室内(intraventricular)、骨内、眼内、颅内、腹膜内、病灶内(intralesional)、鼻内、心内、关节内(intraarticular)、海绵窦内、鞘内(intrathecal)、玻璃体腔内(intravireal)、脑内(intracerebral)和脑室内、鼓室内、耳蜗内、直肠、阴道、通过吸入、通过导管、支架或通过植入的储器(reservoir)或者主动或被动(例如通过扩散)在血管周围和外膜给药组合物的其它装置。例如,诸如支架的医疗装置可以包含置于其表面上的组合物或制剂,然后该组合物或制剂可以溶解或以其他方式分布到周围的组织和细胞。术语“胃肠外”可以包括皮下、静脉内、肌内、关节内(intra-articular)、滑膜内、胸骨内、肺内鞘内、肝内、病灶内和颅内注射或输注技术。在一些实施方案中,化合物和/或其制剂可以直接递送至肺。
如本文所用,术语“药剂(agent)”是指可以是生物活性的或可以诱导对其给药的受试者的生物学和/或生理作用的任何物质、化合物、分子等。药剂可以是主要活性剂,或者换句话说,是组合物这样的组分,即组合物的全部或部分作用归因于该组分。药剂可以是辅助药剂,或者换句话说,是组合物这样的组分,即附加部分和/或组合物的其他作用归因于该组分。
如本文所用,术语“烷氧基”是指具有一个至约十个碳原子的烷基部分的直链或支链含氧基团(radical)(例如甲氧基),其可以被取代。在本公开的方面,烷氧基可含有约1–10、1–8、1–6或1–3个碳原子。在本公开的实施方案中,烷氧基含有约1–6个碳原子,并且包括C
术语“抗生素(antibiotic)”是指降低微生物的生存力或抑制微生物的生长或增殖的化合物或组合物。短语“抑制生长或增殖”是指将生产时间(即细菌细胞分裂或种群增加一倍所需的时间)增加至少约2倍。
如本文所用,术语“抗感染药(anti-infective)”是指可以杀死传染剂或抑制其扩散的化合物或分子。抗感染药包括但不限于抗生素、抗菌剂、抗真菌药、抗病毒药和抗原生动物药。
如本文所用,短语“细菌感染”是指定植在受试者的组织或器官中的细菌,其中定植对受试者造成伤害。伤害可能直接由细菌和/或细菌产生的毒素引起。提及细菌感染还包括细菌性疾病。抗生素药剂,例如本文所述的那些,可以杀死细菌,防止细菌生长和/或辅助受试者杀死或防止细菌生长的能力。
引起细菌感染的细菌称为病原菌。术语“细菌”包括但不限于革兰氏阳性(Grampositive)和革兰氏阴性(Gram negative)细菌。细菌可以包括但不限于:贫养菌(Abiotrophia)、无色杆菌属(Achromobacter)、氨基酸球菌属(Acidaminococcus)、食酸菌属(Acidovorax)、不动杆菌属(Acinetobacter)、放线杆菌属(Actinobacillus)、Actinobaculum、马杜拉放线菌属(Actinomadura)、放线菌属(Actinomyces)、气球菌属(Aerococcus)、气单胞菌属(Aeromonas)、阿菲波菌属(Afipia)、土壤杆菌属(Agrobacterium)、产碱杆菌属(Alcaligenes)、差异球菌属(Alloiococcus)、交替单胞菌属(Alteromonas)、无枝酸菌属(Amycolata)、拟无枝酸菌属(Amycolatopsis)、厌氧螺菌(Anaerobospirillum)、近亲鱼腥藻(Anabaena affinis)及其他蓝藻细菌(包括鱼腥藻属(Anabaena)、项圈藻属(Anabaenopsis)、丝囊藻属(Aphanizomenon)、Camesiphon、拟柱胞藻属(Cylindrospermopsis)、粘杆菌属软管藻属(GloeobacterHapalosiphon)、林氏藻属(Lyngbya)、微胞藻属(Microcystis)、节球藻属(Nodularia)、念珠藻属(Nostoc)、席藻属(Phormidium)、浮丝藻属(Planktothrix)、假鱼腥藻属(Pseudoanabaena)、裂须藻属(Schizothrix)、螺旋藻属(Spirulina)、束毛藻属(Trichodesmium)、和Umezakia属)、棍状厌氧菌属(Anaerorhabdus)、蛛菌属(Arachnia)、隐蔽杆菌属(Arcanobacterium)、弓形菌属(Arcobacter)、节杆菌属(Arthrobacter)、阿托波氏菌属(Atopobium)、金杆菌属(Aureobacterium)、拟杆菌属(Bacteroides)、巴氏丝菌属(Balneatrix)、巴尔通氏体属(Bartonella)、伯杰氏菌属(Bergeyella)、双歧杆菌属(Bifidobacterium)、嗜胆菌属(Bilophila)、布兰汉氏球菌属(Branhamella)、疏螺旋体属(Borrelia)、博德特氏菌属(Bordetella)、短螺旋体属(Brachyspira)、短芽孢杆菌属(Brevibacillus)、短杆菌属(Brevibacterium)、短波单胞菌属(Brevundimonas)、布鲁氏菌属(Brucella)、伯克霍尔德氏菌属(Burkholderia)、布丘氏菌属(Buttiauxella)、丁酸弧菌属(Butyrivibrio)、鞘杆菌属(Calymmatobacterium)、弯曲杆菌属(Campylobacter)、二氧化碳嗜纤维菌属(Capnocytophaga)、心杆菌属(Cardiobacterium)、卡托氏菌属(Catonella)、西地西菌属(Cedecea)、纤维单胞菌属(Cellulomonas)、蜈蚣菌属(Centipeda)、衣原体属(Chlamydia)、嗜衣原体属(Chlamydophila)、色杆菌属(Chromobacterium)、金黄杆菌属(Chyseobacterium)、金色单胞菌属(Chryseomonas)、柠檬酸杆菌属(Citrobacter)、梭菌属(Clostridium)、柯林斯氏菌属(Collinsella)、丛毛单胞菌属(Comamonas)、棒杆菌属(Corynebacterium)、考克斯氏体属(Coxiella)、神秘杆菌属(Cryptobacterium)、代尔夫特菌(Delftia)、皮杆菌属(Dermabacter)、嗜皮菌属(Dermatophilus)、脱硫单胞菌(Desulfomonas)、脱硫弧菌属(Desulfovibrio)、戴阿利斯特杆菌属(Dialister)、偶蹄形菌属(Dichelobacter)、狡诈球菌属(Dolosicoccus)、狡诈菌属(Dolosigranulum)、爱德华菌属(Edwardsiella)、埃格特菌属(Eggerthella)、埃里希氏体属(Ehrlichia)、艾肯氏菌属(Eikenella)、稳杆菌属(Empedobacter)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)、欧文氏菌属(Erwinia)、丹毒丝菌属(Erysipelothrix)、埃希氏杆菌属(Escherichia)、真杆菌属(Eubacterium)、爱文氏菌属(Ewingella)、微小杆菌属(Exiguobacterium)、费克蓝姆菌属(Facklamia)、产线菌属(Filifactor)、黄色单胞菌(Flavimonas)、黄杆菌属(Flavobacterium)、弗朗西斯氏菌属(Francisella)、梭杆菌属(Fusobacterium)、加德纳菌属(Gardnerella)、孪生球菌属(Gemella)、球链菌属(Globicatella)、戈登氏菌属(Gordona)、嗜血菌属(Haemophilus)、哈夫尼亚菌属(Hafnia)、螺杆菌属(Helicobacter)、盐球菌属(Helococcus)、霍尔德曼氏菌属(Holdemania)、不活动粒菌属(Ignavigranum)、约翰森氏菌属(Johnsonella)、金氏菌属(Kingella)、克雷伯氏菌属(Klebsiella)、考克斯菌属(Kocuria)、科泽氏菌属(Koserella)、库特氏菌属(Kurthia)、盖球菌属(Kytococcus)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、劳特洛普氏菌属(Lautropia)、勒克氏菌属(Leclercia)、军团菌属(Legionella)、勒米诺氏菌属(Leminorella)、钩端螺旋体属(Leptospira)、纤毛菌属(Leptotrichia)、明串珠菌属(Leuconostoc)、利斯特氏菌属(Listeria)、利斯顿氏菌属(Listonella)、巨球形菌属(Megasphaera)、甲基杆菌属(Methylobacterium)、微杆菌属(Microbacterium)、微球菌属(Micrococcus)、光岗菌属(Mitsuokella)、动弯杆菌属(Mobiluncus)、米勒氏菌属(Moellerella)、莫拉氏菌属(Moraxella)、摩根氏菌属(Morganella)、分枝杆菌属(Mycobacterium)、支原体属(Mycoplasma)、香味菌属(Myroides)、奈瑟氏球菌属(Neisseria)、诺卡氏菌属(Nocardia)、拟诺卡氏菌属(Nocardiopsis)、苍白杆菌属(Ochrobactrum)、厄氏菌属(Oeskovia)、寡源杆菌属(Oligella)、东方体属(Orientia)、类芽孢杆菌属(Paenibacillus)、泛菌属(Pantoea)、副衣原体属(Parachlamydia)、巴斯德氏菌属(Pasteurella)、片球菌属(Pediococcus)、消化球菌属(Peptococcus)、消化球菌属(Peptostreptococcus)、发光杆菌属(Photobacterium)、光杆状菌属(Photorhabdus)、植原体属(Phytoplasma)、邻单胞菌属(Plesiomonas)、卟啉单胞菌属(Porphyrimonas)、普雷沃氏菌属(Prevotella)、丙酸杆菌属(Propionibacterium)、变形菌属(Proteus)、普罗维登斯菌属(Providencia)、假单胞菌属(Pseudomonas)、假诺卡氏菌属(Pseudonocardia)、假支杆菌属(Pseudoramibacter)、嗜冷杆菌属(Psychrobacter)、拉恩氏菌属(Rahnella)、劳尔氏菌属(Ralstonia)、红球菌属(Rhodococcus)、立克次氏体属(Rickettsia)、罗卡利马氏体属(Rochalimaea)、玫瑰单胞菌属(Roseomonas)、罗氏菌属(Rothia)、瘤胃球菌属(Ruminococcus)、沙门氏菌属(Salmonella)、月形单胞菌属(Selenomonas)、小蛇菌属(Serpulina)、沙雷氏菌属(Serratia)、希瓦氏菌属(Shewenella)、志贺氏菌属(Shigella)、芯卡体属(Simkania)、史雷克氏菌属(Slackia)、鞘氨醇杆菌属(Sphingobacterium)、鞘氨醇单胞菌属(Sphingomonas)、螺菌属(Spirillum)、螺源体属(Spiroplasma)、葡萄球菌属(Staphylococcus)、寡养单胞菌属(Stenotrophomonas)、口腔球菌属(Stomatococcus)、链杆菌属(Streptobacillus)、链球菌属(Streptococcus)、链霉菌属(Streptomyces)、琥珀酸弧菌属(Succinivibrio)、萨特氏菌属(Sutterella)、萨顿氏菌属(Suttonella)、塔特姆氏菌属(Tatumella)、替策氏菌属(Tissierella)、特拉布斯氏菌属(Trabulsiella)、密螺旋体属(Treponema)、Tropheryma、束村氏菌属(Tsakamurella)、苏黎世菌属(Turicella)、脲原体属(Ureaplasma)、漫游球菌属(Vagococcus)、韦荣氏球菌属(Veillonella)、弧菌属(Vibrio)、威克斯氏菌属(Weeksella)、沃林氏菌属(Wolinella)、黄单胞菌属(Xanthomonas)、致病杆菌属(Xenorhabdus)、耶尔森氏菌属(Yersinia)和预研菌属(Yokenella)。细菌的其他实例包括结核分枝杆菌(Mycobacterium tuberculosis)、牛分枝杆菌(M.bovis)、鼠伤寒分枝杆菌(M.typhimurium)、牛分枝杆菌BCG菌株(M.bovisstrainBCG)、BCG亚菌株(BCGsubstrains)、鸟分枝杆菌(M.avium)、胞内分枝杆菌(M.intracellulare)、非洲分枝杆菌(M.africanum)、堪萨斯分枝杆菌(M.kansasii)、海洋分枝杆菌(M.marinum)、溃疡分枝杆菌(M.ulcerans)、鸟分枝杆菌副结核分枝杆菌亚种(M.avium subspeciesparatuberculosis)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、马葡萄球菌(Staphylococcus equi)、酿脓链球菌(Streptococcus pyogenes)、无乳链球菌(Streptococcus agalactiae)、单核细胞增生利斯特氏菌(Listeria monocytogenes)、伊氏利斯特氏菌(Listeria ivanovii)、炭疽芽孢杆菌(Bacillus anthracis)、枯草芽孢杆菌(B.subtilis)、星状诺卡氏菌(Nocardiaasteroides)和其他诺卡氏菌属(Nocardia)物种、草绿色链球菌群(Streptococcusviridans group)、消化球菌属(Peptococcus)物种、消化链球菌属(Peptostreptococcus)物种、衣氏放线菌(Actinomyces israelii)以及其他放线菌(Actinomyces)物种和痤疮丙酸杆菌(Propionibacterium acnes)、破伤风梭菌(Clostridium tetani)、肉毒梭菌(Clostridium botulinum)、其他梭菌属(Clostridium)物种、铜绿假单胞菌(Pseudomonasaeruginosa)、其他假单胞菌(Pseudomonas)物种、弯曲菌属(Campylobacter)物种、霍乱弧菌(Vibrio cholera)、埃立克体属(Ehrlichia)物种、大叶性肺炎放线杆菌(Actinobacillus pleuropneumoniae)、溶血巴斯德氏菌(Pasteurella haemolytica)、多杀性巴斯德氏菌(Pasteurella multocida)、其他巴斯德氏菌属(Pasteurella)物种、嗜肺军团菌(Legionellapneumophila)、其他军团菌属(Legionella)物种、伤寒沙门氏菌(Salmonella typhi)、其他沙门氏菌(Salmonella)物种、志贺氏杆菌(Shigella)物种、流产布鲁氏菌(Brucella abortus)、其他布鲁氏菌(Brucella)物种、沙眼衣原体(Chlamyditrachomatis)、鹦鹉热衣原体(Chlamydiapsittaci)、伯氏考克斯氏体(Coxiellaburnetti)、大肠埃希氏菌(Escherichia coli)、脑膜炎奈瑟氏球菌(Neiserriameningitidis)、淋病奈瑟氏球菌(Neiserriagonorrhea)、流感嗜血杆菌(Haemophilusinfluenzae)、杜氏嗜血菌(Haemophilus ducreyi)、其他嗜血杆菌(Hemophilus)物种、鼠疫耶尔森氏菌(Yersiniapestis)、小肠结肠炎耶尔森氏菌(Yersinia enterolitica)、其他耶尔森氏菌(Yersinia)物种、大肠埃希氏菌(Escherichia coli)、希拉肠球菌(E.hirae)和其他埃希氏菌属(Escherichia)物种,以及其他肠道菌(Enterobacteria)、洋葱伯克霍尔德氏菌(Burkholderia cepacia)、类鼻疽伯克霍尔德氏菌(Burkholderiapseudomallei)、土拉弗朗西丝氏菌(Francisella tularensis)、脆弱拟杆菌(Bacteroidesfragilis)、具核梭杆菌(Fudobascterium nucleatum)、普雷沃氏菌属(Provetella)物种和考德里氏体(Cowdriaruminantium),或其任何菌株或变体。革兰氏阳性菌(Gram-positive bacteria)可包括但不限于革兰氏阳性球菌(Grampositive cocci)(例如链球菌(Streptococcus)、葡萄球菌(Staphylococcus)和肠球菌(Enterococcus))。革兰氏阴性菌(Gram-negative bacteria)可以包括但不限于革兰阴性杆菌(Gramnegative rods)(例如,拟杆菌科(Bacteroidaceae)、肠杆菌科(Enterobacteriaceae)、弧菌科(Vibrionaceae)、巴斯德氏菌科(Pasteurellae)和假单胞菌科(Pseudomonadaceae))。
如本文所用,术语“癌症”应被赋予其普通含义,作为异常细胞分裂而不受控制的疾病的通用术语。特别地,癌症是指与血管生成有关的癌症。癌细胞可以侵入邻近的组织,并可以通过血流(bloodstream)和淋巴系统扩散到身体的其他部位。
有几种主要类型的癌症,例如,肿瘤是始于皮肤或或者排列或覆盖内部器官的组织中的癌症。肉瘤是始于骨骼、软骨、脂肪、肌肉、血管或其他结缔组织或支持性组织的癌症。白血病是始于形成血液的组织(如骨髓)并引起大量异常血细胞产生并进入血流的癌症。淋巴瘤是始于免疫系统细胞的癌症。
当正常细胞丧失其作为特定的、受控的和协调的单元的表现能力时,就会形成肿瘤。通常,实体瘤是通常不包含囊肿或液体区域的异常组织块(某些脑肿瘤确实具有囊肿和充满液体的中央坏死区域)。单个肿瘤甚至可能在其中具有不同的细胞群,而不同的过程已经出错了。实体瘤可能是良性的(非癌性)或恶性的(癌性)。不同类型的实体瘤以形成它们的细胞类型命名。实体瘤的实例是肉瘤、癌和淋巴瘤。白血病(血癌)通常不会形成实体瘤。
代表性癌症包括但不限于膀胱癌、乳腺癌、结直肠癌、子宫内膜癌、头颈癌、白血病、肺癌、淋巴瘤、黑色素瘤、非小细胞肺癌、卵巢癌、前列腺癌、睾丸癌、子宫癌、宫颈癌、甲状腺癌、胃癌、脑干胶质瘤、小脑星形细胞瘤、脑星形细胞瘤、胶质母细胞瘤、室管膜瘤、尤因氏肉瘤家族肿瘤(Ewing’s sarcoma family oftumors)、生殖细胞肿瘤、颅外癌、霍奇金病白血病(Hodgkin’s disease leukemia)、急性淋巴细胞白血病、急性髓细胞性白血病、肝癌、髓母细胞瘤、神经母细胞瘤、一般脑肿瘤、非霍奇金淋巴瘤、骨肉瘤、骨恶性纤维组织细胞瘤、视网膜母细胞瘤、横纹肌肉瘤、一般软组织肉瘤、幕上原始神经外胚层(supratentorial primitive neuroectodermal)和松果体肿瘤(pineal tumors)、视通路和下丘脑胶质瘤(visualpathway andhypothalamic glioma)、威尔姆斯肿瘤(Wilms'tumor)、急性淋巴细胞白血病、成人急性髓细胞性白血病、成人非霍奇金淋巴瘤、慢性淋巴细胞白血病、慢性骨髓性白血病、食管癌、毛细胞白血病、肾癌、多发性骨髓瘤、口腔癌、胰腺癌、原发性中枢神经系统淋巴瘤、皮肤癌、小细胞肺癌等。
肿瘤可以分类为恶性或良性的。在这两种情况下,都有异常的细胞聚集和增殖。在恶性肿瘤的情况下,这些细胞表现出更强的侵袭性,获得了侵袭性增强的特性。最终,肿瘤细胞甚至有能力脱离其起源的微观环境,扩散到身体的另一个区域(非常不同的环境,通常不利于它们的生长),并在这个新位置继续快速生长并分裂。这称为转移。一旦恶性细胞转移,就更加难以实现治愈。
良性肿瘤侵袭的倾向性较小,并且转移的可能性较小。脑肿瘤在脑内广泛扩散,但通常不会在脑外转移。神经胶质瘤在大脑内部具有很强的侵入性,甚至跨越半球。但是,它们确实以不受控制的方式分裂。根据它们的位置,它们可能像恶性病变一样危及生命。这方面的一个实例是一种大脑内的良性肿瘤,其可以生长并占据头骨内的空间,从而导致大脑压力增加。
如本文所用,术语“细胞或细胞群”是指从组织切除的或通过组织培养技术在体外生长的分离的细胞或多个细胞。最特别地,细胞群是指动物或人类组织中的体内细胞。该术语还可以应用于体外培养的或在动物或人类受试者中感染的细菌群。
如本文所用,术语“组合物”是指包含特定量的特定成分的产品,以及直接或间接地由特定量的特定成分的组合产生的任何产品。与药物组合物有关的该术语旨在涵盖包含活性成分和构成载体的惰性成分的产品,以及直接或间接由任意两种或更多种成分组合、络合或聚集,或由一种或多种成分的解离,或由一种或多种成分的其他类型的反应或相互作用产生的任何产品。因此,本公开的药物组合物包括通过将本公开的化合物与药学上可接受的载体混合制成的任何组合物。
如本文所用,术语“化合物”特别是指通过在蝎子物种的毒液中氧化前体分子而合成的1,4-苯醌。可以使用本领域普通技术人员通常已知的反应和方法并且考虑到该知识和包括实施例的本申请的公开内容来制备本公开的化合物。反应在适合于所用试剂和材料并且适合于进行反应的溶剂中进行。有机合成领域的技术人员将理解,存在于化合物上的官能度应与提出的反应步骤一致。为了获得本公开所需的化合物,这可能需要修改合成步骤的顺序或相对于另一步骤选择一种特定的工艺方案。还应认识到,在开发合成路径中的另一个主要考虑因素是选择用于保护本公开所述化合物中存在的反应性官能团的任何保护基团。描述技术人员的许多替代方案的权威人士是Greene和Wuts(Protective Groups InOrganic Synthesis,Wiley and Sons,1991)。
本公开的化合物可以包含一个或多个不对称中心,并且可以产生对映异构体、非对映异构体以及可以根据绝对立体化学定义为(R)-或(S)-的其他立体异构形式。因此,本公开的化合物包括所有可能的非对映异构体和对映异构体以及它们的外消旋和光学纯形式。光学活性的(R)-和(S)-异构体可以使用手性合成子或手性试剂或使用常规技术拆分制备。当本公开的化合物包含几何不对称中心时,除非另有说明,否则该化合物意图包括E和A两种几何异构体。所有互变异构形式也包括在本公开化合物的范围内。
除非特别指出特定的立体化学或异构形式,否则是指结构的所有手性形式、非对映异构形式、外消旋形式。本发明中使用的化合物可以包括在任何或所有不对称原子上富集或拆分的光学异构体,如从图中显而易见的那样,在任何富集程度下。外消旋混合物和非对映异构体混合物以及单独的光学异构体都可以被分离或合成,从而基本不含它们的对映异构体或非对映异构体,这些都在本发明的范围内。
关于本文描述的包含一个或多个取代基的任何基团,应理解,此类基团不包含任何在空间上不切实际和/或在合成上不可行的取代或取代形式。另外,该公开主题的化合物包括由这些化合物的取代产生的所有立体化学异构体。
本文所述化合物内的选定取代基可以递归(recursive)程度存在。在本文中,“递归取代基”是指取代基可以列举其自身的另一种情况。由于此类取代基的递归性质,理论上,任何给定的权利要求中都可能存在大量的此类取代基。药物化学和有机化学领域的普通技术人员可理解此类取代基的总数在一定程度上受到所期望化合物的所需性能的合理限制。此类性质包括但不限于例如物理性能(如分子量、溶解度或log P)、应用性能(如对预期目标物的活性)以及实用性能(如易于合成)。递归取代基是所公开主题的预期方面。药物和有机化学领域的普通技术人员了解这种取代基的多功能性。就所公开的主题的权利要求中存在递归取代基的程度而言,总数应如上所述确定。
当提及基团(例如“烷基”基团)而对基团中的原子数没有任何限制时,应理解,对于烷基基团的大小,按照定义和功能而言,权利要求书都是确定的并且受到限制,所述按照定义即烷基等基团所具有的大小(碳原子数)是有限数,小于全域中的碳原子总数,并且受本领域普通技术人员关于分子实体而言合理的基团大小的理解的限制;所述按照功能即烷基等基团的大小受基团赋予含有该基团的分子的功能特性(如在水性或有机液体介质中的溶解度)的限制。因此,限定“烷基”或其他化学基团或部分的权利要求是明确的和有界的,因为该基团中的原子数不能是无限的。
本发明的化合物和中间体可以从它们的反应混合物中分离并通过标准技术(例如过滤、液-液萃取、固相萃取、蒸馏、重结晶或色谱法(包括快速柱色谱法或HPLC))纯化。
如本文所用,术语“接触细胞或细胞群”是指将根据本公开的化合物或组合物递送至分离的或培养的细胞或细胞群、细菌或分离的细菌群、培养的或感染动物或人类受试者,或将化合物以合适的药学上可接受的载体向动物或人类的目标组织给药。给药可以是但不限于静脉内递送、腹膜内递送、肌内、皮下或通过本领域已知的任何其他方法。一种有利的方法是直接递送到血管中,该血管通向被感染或癌变的组织或器官。
如本文所用,术语“衍生物”是指具有与该化合物相同或相似的核心结构但具有至少一个结构差异(包括取代、缺失和/或添加一个或多个原子或官能团)的任何化合物。术语“衍生物”并不意味着该衍生物是由母体化合物作为原料或中间体合成的,尽管可能是这种情况。术语“衍生物”可包括母体化合物的前药或代谢产物。衍生物可包括母体化合物的氧化产物。如本文所用,“剂量(dose)”、“单元剂量(unit dose)”或“用量(dosage)”可指适用于受试者的物理上离散的单元,每个单元包含预定量的本文所述的化合物和/或计算以产生与其给药相关的期望的一种或多种响应的其药物制剂。
如本文所用,术语“有效量”是指提供足以对细胞、组织、系统、动物或人类有益或期望的生物学、情绪、医学或临床反应的本文提供的化合物的量。有效量可以以一次或多次给药、应用或施用给予。该术语在其范围内还可包括有效增强或恢复基本正常的生理功能的量。“有效量”可以指可以杀死或抑制细菌的本文所述的化合物(例如1,4-苯醌和/或其衍生物)的量。
如本文所用,术语“药学上可接受的载体(carrier)”是指稀释剂、佐剂、赋形剂或媒介物(vehicle),本发明的探针与之一起施用并且其经联邦或州政府监管机构批准或列在《U.S.Pharmacopeia》或其他公认的可用于动物且尤其用于人类的药典中。这样的药物载体可以是液体,例如水和油,包括石油(petroleum)、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。药物载体可以是盐水、阿拉伯胶、明胶、淀粉糊、滑石粉、角蛋白、胶体二氧化硅、尿素等。当向患者给药时,探针和药学上可接受的载体可以是无菌的。当探针静脉内给药时,水是有用的载体。盐溶液以及葡萄糖水溶液和甘油溶液也可以用作液体载体,特别是用于注射溶液。合适的药物载体还包括赋形剂,例如葡萄糖、乳糖、蔗糖、单硬脂酸甘油酯、氯化钠、甘油、丙烯、乙二醇、水、乙醇等。如果需要,本发明的组合物还可包含少量的湿润剂或乳化剂或pH缓冲剂。本发明的组合物可以有利地采取溶液剂、乳剂、缓释制剂的形式或任何其他适合使用的形式。
如本文所用,术语“药学上可接受的”是指在合理的医学判断范围内,适合用于与人和动物的组织接触而没有过度毒性、刺激、过敏反应或其他问题或并发症,与合理的益处/风险比相称的那些化合物、材料、组合物和/或剂型。
如本文所用,术语“药物功能衍生物”是指本公开的化合物的任何药学上可接受的衍生物,例如酯或酰胺,其在向受试者给药时能够提供(直接或间接)本公开的化合物或其活性代谢物或残基。这样的衍生物是本领域技术人员可识别的,而无需进行过度的实验(参见例如Burger’s Medicinal Chemistry and Drug Discovery,第5版,第1卷,PrinciplesandPractice,其含有示例性的药物功能衍生物)。
如本文所用,术语“受试者(subject)”、“个体(individual)”或“患者(patient)”可互换地使用并且是指动物,优选为温血动物,例如哺乳动物。哺乳动物包括但不限于哺乳纲(Mammalia)的任何成员。作为本公开中的受试者或患者,哺乳动物可以来自灵长类(Primates)、食肉类(Carnivora)、长鼻类(Proboscidea)、奇蹄类(Perissodactyla)、偶蹄类(Artiodactyla)、啮齿类(Rodentia)和兔类(Lagomorpha)家族。在一个特定的实施方案中,哺乳动物是人。在其他实施方案中,可以治疗动物。动物可以是脊椎动物,包括鸟类和哺乳动物。在本公开的方面中,该术语包括作为食物或宠物饲养的家畜,包括马、牛、绵羊(sheep)、家禽、鱼、猪、狗、猫和动物园动物、山羊(goat)、猿(例如大猩猩或黑猩猩)和啮齿动物(例如大鼠和小鼠)。
如本文所用,术语“基本上纯的”可以表示目标物质是存在的主要物质(即,以摩尔计,其比组合物中的任何其他单个物质更多),并且优选地,基本上纯化的部分是目标物质占存在的所有物质约50%的组合物。通常,基本上纯的组合物将占组合物中存在的所有物质的约80%以上,更优选约85%以上、90%以上、95%以上和99%以上。最优选地,将目标物质纯化至基本均质(通过常规检测方法不能在组合物中检测出污染物),其中组合物基本上由单一物质组成。
如本文所用,术语“足够的”和“有效的”是指达到一个或多个期望结果所需的量(例如质量、体积、用量、浓度和/或时间段)。例如,治疗有效量是指达到一种或多种治疗效果所需的量。
如本文所用,术语“治疗效果”是指本发明的组合物的效果,特别是本文公开的制剂或剂型或方法的效果。治疗效果可以是持续的治疗效果,其与给药期间、特别是持续给药期间的本公开化合物的连续浓度相关。就本公开化合物的效果与没有该化合物的效果的统计分析而言,治疗效果可以是统计学上显著的效果。
术语“治疗有效量”涉及本公开的活性化合物或包含该活性化合物的组合物的量或剂量,其将导致一种或多种期望的效果,特别是一种或多种治疗效果或有益药代动力学特征。物质的治疗有效量根据诸如受试者的疾病状态、年龄、性别和体重以及该物质在受试者中引起期望的响应的能力等因素而变化。可以调整用量方案以提供最佳的治疗响应或药代动力学特征。例如,可以每天给药若干次分剂量或可以根据治疗情况的紧急程度所指示的按比例减少剂量。
术语“治疗(treating)”和“治疗(treatment)”通常可以指获得期望的药理和/或生理作用。就预防或部分预防疾病、症状或病症(例如细菌感染)而言,该作用可以是预防性的,但不一定是预防性的。就部分或完全治愈由于疾病、病症或病状引起的疾病、病状、症状或副作用而言,该作用可以是治疗性的。如本文所用的术语“治疗(treatment)”涵盖受试者、特别是人中细菌感染(包括但不限于葡萄球菌种感染(例如但不限于金黄色葡萄球菌感染))的任何治疗,且可以包括以下任何一种或多种:(a)预防该疾病在可能易患该疾病但尚未被诊断为患有该疾病的受试者中发生;(b)抑制疾病,即阻止其发展;和(c)缓解疾病,即减轻或改善疾病和/或其症状或病状。如本文所用的术语“治疗(treatment)”可指单独的治疗性治疗、单独的预防性治疗或治疗性治疗和预防性治疗两种。需要治疗的那些(需要其的受试者)可以包括已经患有该疾病的那些和/或其中要预防该疾病的那些。如本文所用,术语“治疗(treating)”可包括抑制疾病、病症或病状(例如癌症),例如阻碍其进展;和缓解疾病、病症或病状,例如引起疾病、病症和/或病状的消退。治疗疾病、病症或病状可包括改善特定疾病、病症或病状的至少一种症状,即使潜在的病理生理学不受影响,例如通过给药镇痛药来治疗受试者的疼痛,即使该药剂不能治疗疼痛的原因。
如本文所用,术语“单元剂型(unit dosage form)”是指适合作为人类患者和其他哺乳动物的单一用量的物理上离散的单元,其中每个单元包含预定量的活性物质,所述预定量的活性物质经计算可产生所需的治疗效果并与合适的药物载体或赋形剂结合。根据本公开的组合物可以被配制成单元剂型。每日单元剂量也可分为全天在不同时间服用的2或3单元剂量,或以控释形式服用,以尽可能减少不良副作用。
缩写
MDR,多重耐药性;RP-HPLC,反相HPLC;MIC,最低抑菌浓度;CID-MS/MS,碰撞诱导解离串联质谱;HMBC,异核多碳相关;PBMC,外周血单核细胞;DTNB;5,5′-二硫代双-(2-硝基苯甲酸)(5,5'-dithiobis-(2-nitrobenzoic acid));DCFH-DA,二氯二氢荧光素二乙酸酯;SEM,平均值标准误差;i.v.,静脉注射;i.m.,肌肉注射;s.c.,皮下注射;i.d.,皮内注射;ROS,活性氧自由基;HDX,氢-氘交换;NOE,核奥弗豪塞尔效应(nuclear Overhausereffect);CAN,硝酸铈铵;CFU,菌落形成单元;TFA,三氟乙酸。
讨论
具有1,4-苯醌基序(motif)的化合物是一大类高度反应性的分子,既充当氧化剂又是迈克尔受体(Michael acceptor),并且偶然发现许多具有抗微生物、抗肿瘤、抗凝和镇痛活性(Finley K.T.(2010)Quinonoid Compounds(1974);Brunmark&Cadenas(1988)Chemico-Biol.Interacts 68:273-298;Abraham等人,(2011)J.Brazilian Chem.Soc.22:385-421;Novais等人,(2017)RSCAdvances 7:18311-18320;Lana等人,(2006)J.Agricult.Food Chem.54:2053-2056;Schulz等人,(2011)J.Antibiotics 64:763-768;Zhang等人,(2016)Chem.Pharm.Bull.64:1036-1042)。本公开的两种1,4-苯醌化合物,一种为红色,另一种为蓝色,它们是从墨西哥本土很少研究的Diplocentrus melici的毒液中自然产生的前体衍生而来的。该天然存在的前体在暴露于空气后会迅速氧化。尽管无法确定性地确定它们的身份,但它们很可能是相应的氢醌(图11)(Hassan等人,(2017)J.Am.Soc.Mass Spect.28:270-277)。目前不知道为什么蝎子尾节含有如此丰富的氧化不稳定化合物。由于它们在注射到目标组织中之前未与O
为了获得足够量的两种1,4-苯醌用于生物学测试,使用了可商购试剂的合成路线。所得合成的1,4-苯醌具有与从提取的毒液中暴露于空气的前体中分离出来的非天然氧化化合物相同的结构、生物活性和理化性质。这些有色的1,4-苯醌是有利的先导化合物,用于开发抗金黄色葡萄球菌和结核分枝杆菌的抗微生物药剂。
本公开的1,4-苯醌或其药学上可接受的盐(或包含本公开的1,4-苯醌或其药学上可接受的盐的药物组合物)可以通过能够预防或缓解与特定神经系统病状有关的症状的任何途径向患者给药。例如,如下面更详细地描述的,可以胃肠外、静脉内注射(I.V.)、肌肉注射(I.M.)、皮下注射(S.C.)、皮内注射(I.D.)、口服、鼻内等给药本公开的1.4-苯醌或其药学上可接受的盐。鼻内给药的实例可以为喷雾剂、滴剂、粉剂或凝胶剂。然而,药物给药的其他方式也完全在本发明的范围内。
本公开的1,4-苯醌也可以胃肠外或腹膜内给药。以游离碱或药学上可接受的盐形式的活性化合物的溶液可以在水中适当地与表面活性剂(如羟丙基纤维素)混合而制备。分散液也可以在甘油、液体聚乙二醇及其混合物中和在油中制备。在常规的储存和使用条件下,这些制剂含有防腐剂以防止微生物生长。
两种化合物对抗金黄色葡萄球菌都具有高活性,其效能与市售抗生素相当。红色1,4-苯醌比蓝色1,4-苯醌的活性高一些(4μg/mL的MIC vs 6μg/mL的MIC)。两种化合物的抑制活性大于已知抑制金黄色葡萄球菌生长的天然存在的苯醌(Hassan等人,(2017)J.Am.Soc.Mass Spect.28:270-277;Kim等人,(2010)J.Microbiol.Biotech.20:1204-1209)。尽管对抗金黄色葡萄球菌(革兰氏阳性)具有如此显著的活性,但没有发现一种化合物对抗革兰氏阴性大肠杆菌(E.coli)具有明显的活性。先前的研究表明,在2,6-二甲氧基苯醌(2,6-dimethoxybenzoquinone)的3位取代会大大降低其对大肠杆菌的活性(Lana等人,(2006)J.Agricult.Food Chem.54:2053-2056)。硫代甲氧基可能是本申请的化合物具有选择性的原因。
除了对抗金黄色葡萄球菌的抗微生物活性外,两种1,4-苯醌均抑制结核分枝杆菌的生长,其中蓝色1,4-苯醌最有利用于临床应用(MIC为4μg/mL)(图20A)。然而,与分枝杆菌的初始接种浓度(2.5×10
在真核细胞中由苯醌产生的高活性氧自由基(ROS)产物也可能是抗分枝杆菌活性的机制。几种具有多种不同作用机制的杀菌抗生素通过芬顿(Fenton)反应增加细胞内ROS的产生(Kohanski等人,(2007)Cell 130:797-810;Wang&Zhao(2009)Antimicrob.AgentsChemotherapy 53:1395-1402)。许多ROS,特别是羟基自由基,通过DNA损伤诱导细菌死亡,这部分是由于鸟嘌呤核苷酸池的氧化所致(Foti等人,(2012)Science 336:315-319)。对抗MDR菌株的显著活性证明了蓝色1,4-苯醌作为先导分子在治疗由多重耐药性结核分枝杆菌引起的感染中的潜力。
这些化合物对T细胞白血病、横纹肌肉瘤和转移性神经母细胞瘤有细胞毒性,但在肺腺癌细胞系中没有细胞毒性(图13A和13B),表明对一些细胞系的抑制活性具有选择性。1,4-苯醌化合物的氧化不稳定;它们很容易被还原成半醌,然后被分子氧迅速再氧化。这种强烈的氧化还原活性会产生大量的副产物活性氧自由基(ROS),包括过氧化物、超氧化物和羟基自由基(Saibu等人,(2014)Anticancer Res.34:4077-4086;Gutierrez.PL.(2000)Frontiers Bioscience 5:D629-638)。通过将硫醇基团氧化成二硫键(disulfides),这些ROS耗尽了细胞内的谷胱甘肽并引起蛋白质聚集和功能障碍(Mytilineou等人,(2002)Parkinsonism Relat.Disord.8:385-387;Wilhelm等人,(1997)Mol.Cellular Biol.17:4792-4800)。ROS不可逆地破坏了对细胞存活必不可少的其他生物大分子,包括脂质和核酸(Wang等人,(2006)Proc.Nat.Acad.Sci.U.S.A.103:3604-3609;Green&Reed(1998)Science281:1309-1312)。一旦细胞损伤达到阈值,就会启动凋亡途径进行系统性细胞死亡。这是天然存在的临床上使用的化学治疗剂细胞毒性醌类阿霉素(quinones doxorubicin)、柔红霉素(daunorubicin)和丝裂霉素C(mitomycin C)的作用机制(Saibu等人,(2014)AnticancerRes.34:4077-4086)。
在此方面,由ROS调节的细胞凋亡活性可以增强对细胞内结核分枝杆菌的抗微生物活性,因为已知该病原体抑制感染的巨噬细胞凋亡(Briken&Miller(2008)FutureMicrobiol.3:415-422;Lam等人,(2017)Am.J.Physiol.-Lung Cell.Mol.Physiol.313:L218-L229)。诱导细胞凋亡以及蓝色1,4-苯醌的直接杀菌活性相加可在体内根除结核病方面具有协同作用。
从毒液中分离和纯化红色化合物和蓝色化合物
通过电刺激从Diplocentrus melici的尾节中提取总毒液。首先将提取的毒液暴露在空气中,直至其颜色从无色变为深红色(图1)。将该红色粘性液体溶于乙酸铵(20mM,pH4.7)中,并通过Sephadex G-50柱凝胶过滤分离成三个主要部分(在图2A中标记为FI、FII、FIII)。FI是无色的,并且在280nm处具有强吸收,表明主要由肽组成,如先前对蝎毒的研究所示(Possani等人,(2000)Biochimie 82:861-868)。相反,FII部分和FIII部分是红色的,并且在280nm和325nm处均具有强吸光度。冻干时,FII部分和FIII部分分别产生红色和蓝色粉末。
将FII和FIII通过反相HPLC(C18柱,0至60%的乙腈在水中的溶液,60min)进一步纯化,如图2B所示。色谱图中在25.2min洗脱时间处的一个强峰对应于单个红色化合物(在溶液中和在干燥状态下均呈红色),另一个在32.7min处对应于单个蓝色化合物(在溶液中呈红色,但在干燥状态下呈蓝色)。收集纯化的化合物并干燥以进行结构表征和生物活性评估。
有色化合物是通过氧化存在于Diplocentrus melici的毒液中的无色天然前体化合物形成的,该化合物未曾在毒液或蝎子的尾节中暴露于空气中(O
回收对应于峰的部分并用空气鼓泡以促进用溶解氧的氧化。处理后,峰2中的化合物的保留时间从13.06min转移到25.05min(图4A)。类似地,峰5中的化合物的保留时间从28.09min转移到32.63min(图4B)。长时间暴露于空气中之后,这些部分中的化合物与通过将提取的毒液暴露于空气而形成的红色化合物和蓝色化合物分别具有相同的紫外可见吸收光谱。因此,氧化之前峰4和峰6中包含的化合物是通过暴露于空气而合成的红色化合物和蓝色化合物的前体。当暴露于空气中时,对应于峰1和峰3的部分没有变色;目前,这些峰的组成是未知的。使用圆盘扩散法测定前体组分2和5(处于其未氧化状态)对金黄色葡萄球菌的可能抑制作用。如图3B所示,未观察到抑制作用。在培养期间,在圆盘上或在琼脂上没有出现颜色。
红色化合物和蓝色化合物的结构表征
从甲醇溶液中电喷雾红色化合物和蓝色化合物,产生质子化物质和金属化物质的离子信号(图5和图6)。高质量精度和同位素分布数据均表明红色化合物和蓝色化合物的分子式分别为C
在两个分子中均未观察到
红色苯醌和蓝色苯醌的化学合成
如方案S1(图17)中所示,以两步法合成红色化合物。在氯化铝存在下,在Friedel-Crafts型反应中,将3,4,5-三甲氧基苯酚1与二甲基二硫化物反应以形成3,4,5-三甲氧基-2-(甲硫基)苯酚2,中间产率为24%。将该中间体用硝酸铈铵(CAN)氧化,并从1:4EtOAc/己烷中重结晶,得到(35%)所需的1,4-苯醌化合物3的红色晶体(X射线晶体结构如图19所示,顶部右侧图)。
方案S2(图18)示出了蓝色化合物的合成。以几乎定量的反应用CAN将1,4-二甲氧基-2,3-二溴苯4氧化得到2,3-二溴-1,4-苯醌5。在5和过量的新蒸馏的环戊二烯之间的Diels-Alder环加成反应在室温下平稳进行,得到三环化合物6。使用通过引用全部纳入本文的优化的方案(Ferreira等人,(2003)Tetrahedron 59:1349-1357),在分液漏斗中进行的快速反应中,溴基(bromides)被硫代甲氧基取代。在THF/MeOH/H
红色苯醌和蓝色苯醌的生物活性
使用圆盘扩散法评估红色1,4-苯醌和蓝色1,4-苯醌对金黄色葡萄球菌的抑制活性。红色1,4-苯醌和蓝色1,4-苯醌的作用明显抑制了金黄色葡萄球菌的生长(图3C)。根据抑制的直径,红色1,4-苯醌比蓝色1,4-苯醌更具活性。使用微量肉汤稀释法证实了这种差异(图3D)。对于红色1,4-苯醌,金黄色葡萄球菌生长的最小抑制浓度(MIC)为4μg/mL,对于蓝色1,4-苯醌,其最小抑制浓度为6μg/mL(图3D,表1)。氨苄西林(MIC=0.5μg/mL)用作阳性对照(ESCMID Eo(2003)Clin.Microbiol.Infect.9:ix-xv;Pieterse等人,(2010)Brazil.J.Microbiol.41:133-145)。这些化合物在其MIC处具有杀菌作用,在6h内杀死90%的金黄色葡萄球菌,在24h内杀死99.9%的金黄色葡萄球菌(表2)。1,4-苯醌均未显示出对革兰氏阴性大肠杆菌和致病真菌白色念珠菌(pathogenic fungus Candida.albicans)的活性。
使用微量肉汤稀释法,对两种1,4-苯醌杀死结核分枝杆菌H37Rv(这种研究中常用的一种致病菌株(Bifani等人,(2000)J.Clin.Microbiol.38:3200-3204)),和来自临床分离株的多重耐药性(MDR)菌株的功效进行了测试。只有蓝色1,4-苯醌对结核分枝杆菌(H37Rv和MDR)表现出显著的抑制活性,其中两种菌株的MIC为4μg/mL(图20A),与报道的异烟肼、利福平(rifampicin)、乙胺丁醇、左氧氟沙星(levofloxacin)、莫西沙星(moxifloxacin)和卷曲霉素(capreomycin)对结核分枝杆菌敏感菌株的MIC相似(Chanwong等人,(2007)Tuberculosis 87:130-133;Kaniga等人,(2016)J.Clin.Microbiol 54:2963-2968;
在功效的独立测试中,确定了处理后生长的细菌的菌落形成单元(CFU)的浓度。用与其MIC相等剂量的1,4-苯醌处理后的CFU浓度降低(图20B),尤其是MDR菌株中用蓝色1,4-苯醌处理后,与接种细菌浓度相比,杀灭率超过90%。另外,在结核分枝杆菌中,蓝色1,4-苯醌起到了促进了超微结构的改变的作用(图20C-图20F)。这些类似于细菌暴露于异烟肼(一种有效的抗分枝杆菌抗生素,会干扰细胞壁的合成)时发生的情况(图20G-图20H)。失去了细长的芽孢杆菌细胞形态,形成了胞质电致密团块(cytoplasmic electro-denseconglomerate),并伴随有大量细胞壁的消失。
使用在BALB/c小鼠中的实验感染模型测试了蓝色化合物对进行性肺结核的杀菌活性。每隔一天通过气管内途径给药8μg的蓝色1,4-苯醌,持续两个月;在这段时间内,感染的小鼠通过体重不减轻和不竖毛(这是患有进行性肺结核的小鼠的常见体征)表现出改善。与阴性对照(仅用盐溶液治疗的感染的小鼠)相比,它们还显示出肺杆菌载量降低(大于90%)(图21A)。该结果与组织学变化相关;与对照动物相比,经治疗的小鼠显示出组织损伤(肺炎)减少了两倍(图21C-图21F)。向健康小鼠气管内给药相同剂量的药物治疗一个月,然后处死它们,并检查其肺部。他们的肺组织学表现为在小静脉周围仅发现少量炎性浸润。未见纤维化。
由于1,4-苯醌可以用作新抗生素的先导化合物,评估了它们对人细胞系的毒性。测试了肺腺癌细胞系A549的生存力,该细胞系已成为肺泡II型肺上皮细胞的模型(Foster等人,(1998)Exp.CellRes.243:359-366;Lin等人,(1998)Infect.Immunity 66:1121-1126)。在红色1,4-苯醌和蓝色1,4-苯醌以1、5和25μM的浓度存在的情况下,A549细胞保持相对不受影响(图13A和图13B),表明将这些1,4-苯醌直接应用于肺部治疗结核病是可能的。在相同的体外条件下,发现在培养12小时后,红色1,4-苯醌和蓝色1,4-苯醌具有相当强的诱导Jurkat(T细胞白血病细胞系)、TE 671(横纹肌肉瘤细胞系)和SH-SY5Y(骨髓神经母细胞瘤细胞系)死亡的能力(图13A和图13B)。
另外,在人类血液中常见的两种类型的细胞红细胞和外周血单个核细胞(PBMC)中测试了红色苯醌和蓝色苯醌。即使在高于100μg/mL的剂量下,2小时后也未观察到血球溶解(图14A)。然而,在浓度为25μM的情况下,在12小时后,蓝色1,4-苯醌和红色1,4-苯醌分别杀死了50%和60%的PBMC(图14B)。
进行体外谷胱甘肽氧化测定,作为研究这些1,4-苯醌化合物的明显细胞毒性机制的第一步。两种1,4-苯醌均以剂量依赖的方式将谷胱甘肽氧化为相应的衍生物(图15);这表明,重要的细胞抗氧化剂谷胱甘肽的耗竭可能在引发细胞死亡中起作用(Butler&Hoey(1992)Free Radical Biol.Med.12(5):337-345)。还发现用1,4-苯醌培养细胞导致形成活性氧自由基(ROS)(图16A)且细胞膜不对称性的时间依赖性丧失(图16B),表明细胞死亡的细胞凋亡模式。
制剂
本发明的组合物可以配制成中性或盐形式。药学上可接受的盐包括酸加成盐,其是与无机酸(例如盐酸或磷酸)或有机酸(例如乙酸、草酸、酒石酸、扁桃酸等)形成的。与游离羧基形成的盐也可以衍生自无机碱(例如钠、钾、铵、钙或铁的氢氧化物)以及有机碱(例如异丙胺、三甲胺、组氨酸、普鲁卡因(procaine)等)。配制后,以与剂型相容的方式和治疗有效量给药溶液。可以容易地以各种剂型例如可注射溶液、药物释放胶囊等来给药制剂。
本公开的组合物可以通过例如通过细菌保留过滤器(bacteria retainingfilter)的过滤、向组合物中添加灭菌剂、辐照组合物或加热组合物等来进行灭菌。可选择地,本公开的化合物或组合物可以以无菌固体制剂(例如冻干粉)的形式提供,其在使用前立即溶于无菌溶剂中。
可以通过本领域已知的适当方法将本公开的化合物配制成药物组合物以向受试者给药。本公开的药物组合物或其部分包含合适的药学上可接受的载体、赋形剂和媒介物,其基于预期的给药形式并与常规药学实践保持一致进行选择。在标准教科书“Remington:The Science and Practice of Pharmacy(21.sup.st Edition.2005,University oftheSciences in Philadelphia(Editor),Mack Publishing Company)”和1999年出版的“TheUnited States Pharmacopeia:The National Formulary(USP 24NF19)”中描述了合适的药物载体、赋形剂和媒介物。例如,对于胶囊或片剂形式的口服给药,可将活性成分与口服的、无毒的、药学上可接受的惰性载体(例如乳糖、淀粉、蔗糖、甲基纤维素、硬脂酸镁、葡萄糖、硫酸钙、磷酸二钙、甘露醇、山梨糖醇等)结合。对于液体形式的口服给药,片状成分(chug components)可以与任何口服的、无毒的、药学上可接受的惰性载体(如乙醇、甘油、水等)结合。合适的粘合剂(例如明胶、淀粉、玉米甜味剂、包括葡萄糖的天然糖;天然和合成树胶和蜡)、润滑剂(例如油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠和氯化钠)、崩解剂(例如淀粉、甲基纤维素、琼脂、膨润土和黄原胶)、调味剂和着色剂也可在组合物或其组分中结合。本文所述的组合物可进一步包含湿润剂或乳化剂或pH缓冲剂。
本公开的制剂或剂型可以是立即释放剂型或非立即释放递送系统,包括但不限于延迟释放剂型或持续释放剂型。
可以根据用于制备药学上有用的组合物的已知方法来配制本发明的药物组合物。此外,如本文所用,短语“药学上可接受的载体”是指任何标准药学上可接受的载体。药学上可接受的载体可包括稀释剂、佐剂和媒介物,以及植入物载体(implant carrier)和惰性的、无毒的固体或液体填充剂、稀释剂或不与本发明的活性成分反应的包囊材料(encapsulating material)。实例包括但不限于磷酸盐缓冲盐水、生理盐水、水和乳剂(例如油/水乳剂)。载体可以是溶剂或分散介质,其包含例如乙醇、多元醇(例如甘油、丙二醇、液态聚乙二醇等)、其合适的混合物和植物油。在许多本领域技术人员众所周知的并且容易获得的来源中描述了含有药学上可接受的载体的制剂。例如,Remington'sPharmaceutical Sciences(Martin E W,Remington's Pharmaceutical Sciences,EastonPa.,Mack Publishing Company,第19版,1995)记载了可用于本发明的制剂。适用于胃肠外给药的制剂包括例如无菌注射水溶液,其可以包含抗氧化剂、缓冲剂、抑菌剂和使制剂与预期接受者的血液等渗的溶质;水性和非水性无菌悬浮液,其可包含悬浮剂和增稠剂。所述制剂可以存在于单元剂量或多剂量容器(例如密封的安瓿瓶(ampoule)和小瓶(vial))中,并且在使用前可以在冷冻干燥(冻干)条件下储存,所述冷冻干燥条件仅需要无菌液体载体(例如注射用水)条件。临时注射溶液和悬浮液可以由无菌粉末、颗粒、片剂等制备。应该理解,除了上述特别提及的成分以外,考虑到所讨论的制剂类型,本发明的制剂还可以包括本领域常规的其他药剂。
本文公开的药物组合物可以与例如惰性稀释剂或与可吸收的可食用载体一起口服给药,或者可以将它们封装在硬壳或软壳明胶胶囊中,或者可以将其压制成片剂,或者可以直接与日常饮食中的食物混合。对于口服治疗性给药,可以将活性化合物与赋形剂混合并以可吸收片剂、口腔片、锭剂(troche)、胶囊、酏剂、悬浮液、糖浆、晶片(wafer)等的形式使用。这样的组合物和制剂应包含至少0.1%的活性化合物。当然,组合物和制剂的百分比可以变化,并且可以方便地在单元重量的约2%至约60%之间。在这样的治疗上有用的组合物中活性化合物的量使其能够获得合适的用量。
片剂、锭剂、丸剂、胶囊剂等还可以包含以下成分:粘合剂,例如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,例如磷酸二钙;崩解剂(disintegrating agent),例如玉米淀粉、马铃薯淀粉、海藻酸等;润滑剂,例如硬脂酸镁;可以加入甜味剂(例如蔗糖、乳糖或糖精),或调味剂(例如薄荷、冬青油或樱桃调味剂)。当剂量单元形式是胶囊时,除上述类型的材料外,它还可包含液体载体。各种其他材料可以作为包衣存在或以其他方式改变剂量单元的物理形式。例如片剂、丸剂或胶囊剂可以用虫胶、糖或虫胶和糖的混合物包衣。酏剂糖浆可包含活性化合物、作为甜味剂的蔗糖、作为防腐剂的对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、染料和调味剂(例如樱桃或橙色调味剂)。当然,用于制备任何剂量单元形式的任何材料应该是药学上纯的,并且在所使用的量上基本上是无毒的。另外,可以将本公开的1,4-苯醌或其药学上可接受的盐掺入缓释制剂和配方中。
适用于注射用途的药物形式包括无菌水溶液或分散液和用于临时制备无菌注射溶液或分散液的无菌粉末。在所有注射情况下,形式必须是无菌的,并且必须是达到易于注射的程度的流动性的。所述形式必须在生产和储存条件下稳定,并且必须保存以防微生物(如细菌和真菌)的污染。载体可以是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其合适的混合物和植物油。可以例如通过使用诸如卵磷脂的包衣、在分散液的情况下通过维持所需的粒度以及通过使用表面活性剂来维持适当的流动性。可以通过各种抗菌剂和抗真菌剂来预防微生物的作用,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等。在许多情况下,优选包括等渗剂,例如糖或氯化钠。通过在组合物中使用延迟吸收的药剂(例如单硬脂酸铝和明胶)可以延长可注射组合物的吸收。
通过将所需量的本公开的1,4-苯醌或其药学上可接受的盐根据需要与其他上述列举的各种成分掺入合适的溶剂中,然后过滤灭菌,从而制备无菌注射溶液。通常,通过将各种灭菌的活性成分掺入无菌媒介物中来制备分散液,所述无菌媒介物包含基本分散介质和来自上文列举的那些所需的其他成分。就用于制备无菌注射溶液的无菌粉末而言,优选的制备方法是真空干燥和冷冻干燥技术,这两种技术从其先前的无菌过滤溶液中得到了活性成分和任何其他所需成分的粉末。
对于口腔病预防(oral prophylaxis),本公开的1,4-苯醌或其药学上可接受的盐可与赋形剂混合并以不可食用的漱口水和洁齿剂(dentifrice)的形式使用。可以将所需量的活性成分掺入适当的溶剂(例如硼酸钠溶液(Dobell’s Solution))中制备漱口水。或者可以将本公开的1,4-苯醌或其药学上可接受的盐掺入含有硼酸钠、甘油和碳酸氢钾的防腐剂洗涤液中。本公开的1,4-苯醌或其药学上可接受的盐也可以分散在洁齿剂中,所述洁齿剂包括:凝胶、糊剂、粉末和浆液。可以将本公开的1,4-苯醌或其药学上可接受的盐以治疗有效量添加至糊状洁齿剂,所述糊状洁齿剂可包括水、粘合剂、磨料、调味剂、发泡剂和湿润剂。
使用化合物及其制剂的方法
本文所述的化合物和/或制剂可以向受试者给药。该受试者可以是需要其的受试者。受试者可以患有或怀疑患有细菌感染,例如但不限于葡萄球菌感染(例如金黄色葡萄球菌感染)或分枝杆菌感染(例如结核分枝杆菌感染)。本文所述的化合物和制剂可用于治疗需要其的受试者中的细菌感染。本文所述的化合物和制剂可以通过将活性化合物递送至所需组织或细胞目标的合适途径来给药。诸如但不限于口服和静脉内给药的方法对于递送是有利的。另一有利的递送途径是肺的气管内治疗,例如用于将蓝色化合物递送至小鼠的肺。有用的是,已经显示本公开的化合物和制剂对肺上皮细胞没有毒性,从而允许直接递送到肺中。其他合适的途径在本文其他地方描述。
因此,本公开的一个方面包括具有以下结构的1,4-苯醌的实施方案:
其中R
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式A所示的结构或其衍生物:
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式B所示的结构或其衍生物:
本公开内容的另一方面包括一种药物制剂的实施方案,所述药物制剂包含1,4-苯醌和药学上可接受的载体,所述1,4-苯醌具有以下结构:
其中R
本公开的另一方面还包括一种合成1,4-苯醌的方法的实施方案,其中1,4-苯醌可具有式A所示的结构:
其中1,4-苯醌可以根据方案A合成:
本公开的另一方面包括合成1,4-苯醌的方法的实施方案,其中1,4-苯醌可具有式B所示的结构:
其中1,4-苯醌是根据方案B合成的:
本公开的另一个方面还包括一种减少菌种增殖的方法的实施方案,所述方法包括以下步骤:将菌种群与一定量的1,4-苯醌接触,并持续足以减少菌种增殖的时间,所述1,4-苯醌具有以下结构:
其中R
在本公开的这个方面的一些实施方案中,菌种可以是葡萄球菌属或分枝杆菌属。
在本公开的这个方面的一些实施方案中,菌种可以是金黄色葡萄球菌或结核分枝杆菌。
在本公开的这个方面的一些实施方案中,可以向患有细菌感染的动物或人类受试者给药1,4-苯醌。
在本公开的这个方面的一些实施方案中,可以以药学上可接受的制剂的形式向动物或人类受试者给药1,4-苯醌,所述药学上可接受的制剂包含1,4-苯醌和药学上可接受的载体。
本公开的另一方面还包括一种治疗动物或人类受试者中细菌感染的方法的实施方案,所述方法包括:
向动物或人类受试者给药一种药学上可接受的制剂,所述制剂包含1,4-苯醌和药学上可接受的载体,所述1,4-苯醌具有以下结构:
其中R
在本公开的这个方面的一些实施方案中,1,4-苯醌具有式A所示的结构或其衍生物:
在本公开的这个方面的一些实施方案中,细菌感染可以是葡萄球菌感染。
在本公开的这个方面的一些实施方案中,细菌感染可以是金黄色葡萄球菌感染。
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式B所示的结构或其衍生物:
在本公开的这个方面的一些实施方案中,细菌感染可以是分枝杆菌感染。
在本公开的这个方面的一些实施方案中,细菌感染可以是结核分枝杆菌感染。
本公开的另一方面包括一种减少癌细胞群增殖的方法的实施方案,所述方法包括以下步骤:将癌细胞群与一定量的1,4-苯醌接触,并持续足以减少癌细胞增殖的时间,所述1,4-苯醌具有以下结构:
其中R
在本公开的这个方面的一些实施方案中,癌细胞群是肿瘤癌或非肿瘤癌。
在本公开的这个方面的一些实施方案中,癌细胞群可以是非肿瘤癌,其中所述非肿瘤癌是白血病。
在本公开的这个方面的一些实施方案中,可以以药学上可接受的制剂向动物或人受试者给药1,4-苯醌,所述药学上可接受的制剂包含1,4-苯醌和药学上可接受的载体。
在本公开的这个方面的一些实施方案中,1,4-苯醌可以具有式A或式B所示的结构或其衍生物:
现在已经一般地描述了本公开的实施方案,以下实施例描述了本公开的一些另外的实施方案。尽管结合以下实施例和相应的文字和附图描述了本公开的实施方案,但是无意将本公开的实施方案限制于此描述。相反,目的是覆盖包括在本公开的实施方案的精神和范围内的所有替代、修改和等同方案。
实施例
实施例1
从Diplocentrus melici的毒液制备红色1,4-苯醌和蓝色1,4-苯醌:通过用35V的两秒脉冲电刺激尾节的基部,并使用移液管尖端通过毛细作用回收粘性无色毒液,来提取Diplocentrus melici蝎的毒液。提取后立即将来自50个蝎子的毒液暴露在空气中,直到变成深红色。将该暴露于空气中的红色毒液悬浮于乙酸铵(20mM,pH=4.7)中,并以14000×g离心10分钟,以去除蛋白质聚集体和粘蛋白。然后使用Sephadex G-50色谱柱(L×I.D.,60cm×26mm)在乙酸铵(20mM,pH=4.7)中以1mL/min的恒定流速通过凝胶过滤色谱法分离上清液,并通过在280nm和325nm处的吸光度进行监测。将有色部分冻干,并使用C18分析型反相HPLC柱(Vydac,Hysperia,CA)进一步纯化,使用从100%的溶液A(0.12%三氟乙酸(TFA)在水中的溶液)到60%的溶液B(0.10%TFA在乙腈中的溶液)的线性梯度,在60分钟内以1mL/min的流速流动。将纯化的红色1,4-苯醌干燥并在-20℃下储存直至使用。
实施例2
从Diplocentrus melici的毒液制备蓝色的1,4-苯醌:在与空气接触最少的情况下,将新鲜提取的毒液立即重新悬浮在4℃的丙酮中,并通过超声处理30秒钟使其均质化。之后立即将溶液在4℃下以14000×g离心10分钟。分离上清液并冷冻干燥(Savant仪器)。将干燥的粉末重悬于0.1%TFA中,并在C18柱上进行分离(0%至60%乙腈,60分钟,流速=1mL/min)。回收无色部分并干燥。然后将它们重悬于水中,并用空气鼓泡两个小时,以使前体化合物氧化。通过RP-HPLC分析处理的部分,以分离蓝色1,4-苯醌。将纯化的蓝色1,4-苯醌干燥并保存在-20℃直至使用。
实施例3
红色苯醌和蓝色苯醌的结构表征:使用自制ESI源在高分辨率质谱仪(ThermoScientific LTQ Orbitrap XL Hybrid Ion Trap-Orbitrap mass spectrometer)进行电喷雾离子化质谱(ESI-MS)研究。使用氮气(120psi)作为屏蔽气(sheathgas)。分析物溶液的电喷雾以正(+5kV)或负(-5kV)离子模式进行。加热的毛细管(MS入口)的温度和电压分别保持在275℃和44V。在碰撞诱导解离池(CID池;离子阱)中,氦气用作碰撞气体。使用0.9m/z单元的隔离宽度,激活Q和激活时间分别设置为0.25和30ms获取CID光谱(MS/MS)。除非另有说明,否则所有实验在相同的条件下进行。调整离子光学器件以获得最大离子计数。使用XCalibur软件(Thermo Fisher Scientific)进行数据采集。
在600和150MHz下运行的Varian Inova-600、300和75MHz下运行的Varian lnova-300、400和100MHz下运行的Varian Mercury-400、或在500和125MHz下运行的Varianlnova-500上获得核磁共振(NMR)光谱,并根据残留溶剂信号在内部进行参考。NMR数据记录如下:化学位移(δ,ppm),多重性(s,单峰;br s,宽峰;d,双重峰;t,三重峰;q,四重峰;quint,五重峰;sext,六重峰;m,多重)、积分、耦合常数(Hz)。数据以化学位移(δ,ppm)表示。使用NaCl盐板将红外光谱记录在Thermo-Nicolet IR100光谱仪或Thermo-Nicolet IR300光谱仪上作为薄膜,并记录了吸收频率。
实施例4
红色1,4-苯醌和蓝色1,4-苯醌的化学合成:除非另有说明,否则所有试剂都是市售的。使用烘箱干燥的玻璃器皿进行反应。通过注射器或不锈钢套管转移对空气和湿气敏感的液体和溶液。通过旋转蒸发法在减压下(~15Torr)浓缩有机溶液。在12psi下,通过活性氧化铝柱来纯化溶剂。
在Silicycle Silia-P Silica Gel(40–63μm)上进行色谱分离。通常使用指定的溶剂条件将通过色谱法纯化的化合物施加至吸附剂床,并根据溶解性的需要添加最小量的二氯甲烷。在Whatman Partisil K6FSilica Gel
实施例5
对PBMC和肿瘤细胞的细胞毒性:本公开的1,4-苯醌的细胞毒性用以下外周血单核细胞(PBMC)和各种人类肿瘤细胞系进行了测试:A549(腺癌肺上皮细胞)、Jurkat(T细胞白血病)、TE 671(横纹肌肉瘤细胞)和SH-SY5Y(骨髓神经母细胞瘤细胞)。
由健康献血者获得PBMC,并通过Ficoll-Paque PLUS密度梯度离心法分离,并重悬于添加有10%胎牛血清的RPMI-1640培养基中。将细胞在5%CO
为了进行细胞毒性试验,将细胞重悬于不含酚红的DMEM中,添加2%的热灭活胎牛血清。将细胞接种在96孔聚苯乙烯细胞培养板中(2×10
实施例6
溶血试验:使用新鲜的人红细胞对两种1,4-苯醌的溶血活性进行了评估。将新鲜的人红细胞用磷酸盐缓冲盐水(PBS)洗涤四次,并在37℃下使用不同浓度的1,4-苯醌培养2h。使用TritonX-100梯度作为溶血的阳性对照。培养后,将红细胞悬浮液在400×g下离心10分钟,并回收上清液。通过415nm处上清液的吸光度确定溶血情况。
实施例7
谷胱甘肽氧化试验:为了说明两种苯醌的抑制作用机理,在比色测定中评价了与还原形式的L-谷胱甘肽(GSH)的反应性。首先,将两种组分在PBS(pH,7.4)中稀释至不同浓度(0-100μM),然后与120μM的谷胱甘肽反应。将反应在37℃下培养1h,然后将剩余的GSH(未氧化)与200μM巯基试剂5,5'-二硫代-双(2-硝基苯甲酸)(DTNB)反应,以形成可在421nm测量的黄色衍生物。通过HPLC-MS评估反应产物。
实施例8
表1.红色化合物和蓝色化合物对耐甲氧西林的金黄色葡萄球菌(MRSA)临床分离株的最小抑制浓度
S敏感性(没有细菌生长);R抗性(有细菌生长)
表2:来自Diplocentrus melici的1,4-苯醌(红色化合物和蓝色化合物)对金黄色葡萄球菌的时间-杀死率试验
实施例9
合成红色化合物A(3,5-二甲氧基-2-(甲硫基)环己-2,5-二烯-1,4-二酮)
i)合成化合物2
将化合物1(0.450g,2.47mmol)溶解于15mL的CH
ii)合成化合物3(红色化合物)
将化合物2(0.138g,0.600mmol)溶于10mL CH
实施例10
合成蓝色化合物B(5-甲氧基-2,3-双(甲硫基)环己-2,5-二烯-1,4-二酮)
i)合成化合物5
将4mL硝酸铈铵(3.70g,6.76mmol)水溶液滴加到剧烈搅拌的化合物4(0.500g,1.70mmol)在20mL CH
ii)合成化合物6
向化合物5(0.460g,1.73mmol)在10mLTHF中的溶液中添加2mL新蒸馏的环戊二烯。在室温下搅拌5小时后,将溶液减压浓缩,得到0.326g化合物6和二环戊二烯的不可分离的混合物。该混合物直接用于下一步。
iii)合成化合物7
通过Ferreira等人的方法制备化合物7((2003)Tetrahedron 59:1349-1357,通过引用纳入本文)。简而言之,将化合物6(0.326g,1.22mmol)溶解在10mL的CH
iv)合成化合物8
以与Wladislaw等人(Synthesis,1983:464-466)报道的类似的方法制备化合物8。简而言之,将化合物7溶解在THF、MeOH和H
v)合成化合物9
将化合物8(0.365g,1.37mol)溶于MeOH(20mL)和H
vi)合成化合物10
将化合物9(0.250g,0.843mmol)溶于二甲苯(10mL)中,并将该溶液在用针刺穿的隔膜密封的烧瓶中加热至120℃保温12h,该烧瓶向大气开放。通过硅胶色谱法纯化,得到化合物10(0.100g,0.434mmol),为蓝色固体。
- 蝎毒苯醌衍生物及其用途
- 对苯醌衍生物及其用途
