一种奥曲肽的合成方法
文献发布时间:2023-06-19 10:16:30
技术领域
本发明属于制药领域,具体涉及一种奥曲肽的合成方法。
背景技术
醋酸奥曲肽(Octreotide Acetate)是一种人生长抑素的类似物,分子量1019.3(按游离碱计),CAS号79517-01-4,是一个环状九肽药物,其肽序如式I所示,原研厂家是诺华制药(Novartis),在中国、美国和欧洲,上市产品是醋酸奥曲肽注射液和醋酸奥曲肽微球;同时在欧洲部分国家有混悬液上市。
Coy和Sarantakis等人于1973年同时用固相方法化学合成了生长抑素十四肽。Meinhofer实验室则采用改造的N-芴甲氧羰基(Fmoc)氨基酸,按逐个延伸的方法固相合成了还原型生长抑素。1982年Bauer等人合成了一种生长抑素的类似物,命名为奥曲肽(Octreotide)。奥曲肽的肽链短,跟生长抑素相比除去了SS中的6个氨基酸,8位为氨基L-苏氨醇,不易为蛋白酶迅速水解,容易人工合成。其在体内的半衰期长达2h,其抑制激素分泌的作用比生长抑素更强,因此奥曲肽是一种长效生长抑素的类似物,又叫生长抑素释放抑制素(SRIF或SS),奥曲肽广泛用于肢端肥大症、消化道内分泌肿瘤、消化道非分泌性肿瘤、上消化道出血、急性胰腺炎、系统性硬化症、肠易激综合症、癌瘤恶病质、倾倒综合症、银屑病、体位性低血压、手术中低血压等疾病的治疗。
一般地说,环肽的代谢稳定性和生物利用度远远高于直链肽。鉴于环肽的诸多优点,近年来对多肽研究的热点已转移到环肽的合成和生物评价上。
到目前为止,在合成方面,主要有固相合成法(如专利CN103351426和CN1923849)和液相合成法(CN1355173)合成奥曲肽。合成奥曲肽工艺思路由两部分组成:1)线性八肽的合成,主要采用固相依次接入氨基酸或片段拼合,2)对线性八肽进行环化,以精肽自然氧化,或使用氧化试剂氧化,或者在固相合成后期采用氧化试剂直接氧化。
现有的专利保护或正使用于合成奥曲肽工艺,在环化阶段工艺并不太理想,主要是使用氧化试剂大多带有一定化学毒性或使用时较危险,且不环保;空气自然氧化则不能很好地控制氧化位点,易产生多聚体。
本发明的目的是提供另外一种制备奥曲肽的合成方法。该方法避免使用氧化反应成环,且新颖、合成条件温和、工艺简单且工艺稳定。
发明内容
为了解决上述背景技术中所提出的问题,本发明的目的在于提供一种奥曲肽的合成方法。
为了达到上述目的,本发明所采用的技术方案为:一种奥曲肽的合成方法,包括以下步骤:
1)选择2-CTC树脂为合成起点,制备Fmoc-Thr(tBu)-OL-2CTC树脂;
2)按照Fmoc/tBu策略依次偶联正交保护的胱氨酸、Fmoc-Thr(tBu)-OH、Fmoc-Lys(Boc)-OH、Fmoc-D-Trp(Boc)-OH和Fmoc-Phe-OH,然后用pd(pph3)4和苯硅烷脱去胱氨酸正交保护的Alloc保护基后偶联Boc-D-Phe-OH,然后进行分子内酰胺反应成环;
3)裂解液切落肽片段,获得奥曲肽粗肽。
进一步地,Fmoc-Thr(tBu)-OL-2CTC树脂的制备方法为将2-CTC树脂放入反应容器中,将Fmoc-Thr(tBu)-OL用溶剂溶解后加入固相合成载体中,缓慢滴加DIPEA,搅拌反应一段时间即可得到Fmoc-Thr(tBu)-OL-2CTC树脂。
进一步地,溶解Fmoc-Thr(tBu)-OL的溶剂为能溶解本原料,且可用于固相合成反应的有机溶剂均可,比如二氯甲烷,DMF、NMP、DMSO、THF等,优选为二氯甲烷。
进一步地,2-CTC树脂优选为树脂替代度大于1.0mmol/g的2-CTC树脂。
进一步地,正交保护的胱氨酸保护结构如下:
进一步地,步骤2)具体包括:脱除Fmoc,洗涤树脂,直至完全脱除Fmoc为止;将合适量的正交保护的胱氨酸和偶联剂在溶剂中溶解并活化后,一起加入到固相反应柱中,直至用检测方法检测到反应终止为止;
脱除Fmoc,洗涤树脂,直至完全脱除Fmoc为止;将合适量的Fmoc-Thr(tBu)-OH和偶联剂在溶剂中溶解并活化后,一起加入到固相反应柱中,直至用检测方法检测到反应终止为止;
脱除Fmoc,洗涤树脂,直至完全脱除Fmoc为止;将合适量的Fmoc-Lys(Boc)-OH和偶联剂在溶剂中溶解并活化后,一起加入到固相反应柱中,直至用检测方法检测到反应终止为止;
脱除Fmoc,洗涤树脂,直至完全脱除Fmoc为止;将合适量的Fmoc-D-Trp(Boc)-OH和偶联剂在溶剂中溶解并活化后,一起加入到固相反应柱中,直至用检测方法检测到反应终止为止;
脱除Fmoc,洗涤树脂,直至完全脱除Fmoc为止;将合适量的Fmoc-Phe-OH和偶联剂在溶剂中溶解并活化后,一起加入到固相反应柱中,直至用检测方法检测到反应终止为止;
用pd(pph3)4和苯硅烷脱去胱氨酸正交保护的Alloc保护基后,将合适量的Boc-D-Phe-OH和偶联剂在溶剂中溶解并活化后,一起加入到固相反应柱中,直至用检测方法检测到反应终止为止;
脱除Fmoc,洗涤树脂,直至完全脱除Fmoc为止;将HBTU和DIPEA在溶剂中溶解后投入固相反应柱中,直至用检测方法检测到反应终止为止。
进一步地,步骤2)中溶解物质的溶剂采用一般固相合成使用的溶剂均可,如DMF、NMP、DMSO等。
进一步地,脱除Fmoc所用的试剂为20%的哌啶/DMF溶液(DBLK),即哌啶:DMF(体积比)为1:4的混合溶液。
进一步地,偶联剂为DIC+A或者DIPEA+A+B,其中A为HOBt或HOAt,B为PyBOP、PyAOP、HATU、HBTU、TBTU其中之一;优选为HBTU和化合物A及DIPEA的组合物。
进一步地,偶联剂中各成分与Fmoc-aa-OH的摩尔比为DIC:A:Fmoc-aa-OH=1.2:1.1:1或者DIPEA:A:B:Fmoc-aa-OH=2.0:1.1:1:0.9,其中Fmoc-aa-OH为Fmoc-Thr(tBu)-OH、Fmoc-Lys(Boc)-OH、Fmoc-D-Trp(Boc)-OH、Fmoc-Phe-OH。
进一步地,步骤2)的反应先将树脂在偶联之前进行溶胀,所述洗涤和溶胀的步骤采用的试剂为DMF、NMP或二氯甲烷,优选为DMF。
进一步地,检测方法为选用Kaiser试剂来判定反应终点,若树脂显色则说明多肽中有游离的胺,即胺上无保护基。
进一步地,步骤3)所述的裂解液为TFA、H
现有用于合成奥曲肽的工艺,在环化阶段工艺并不太理想,主要是使用氧化试剂大多带有一定化学毒性或使用时较危险,且不环保;空气自然氧化则不能很好地控制氧化位点,易产生多聚体。而使用液相合成则工艺操作繁琐,且获得粗肽纯度不高。本发明提供了一条避免氧化反应成环的固相合成方法,从而避免了现有方法带来的诸多问题,且本发明方法具有操作简单、工艺简化、环境友好等诸多优点。
附图说明
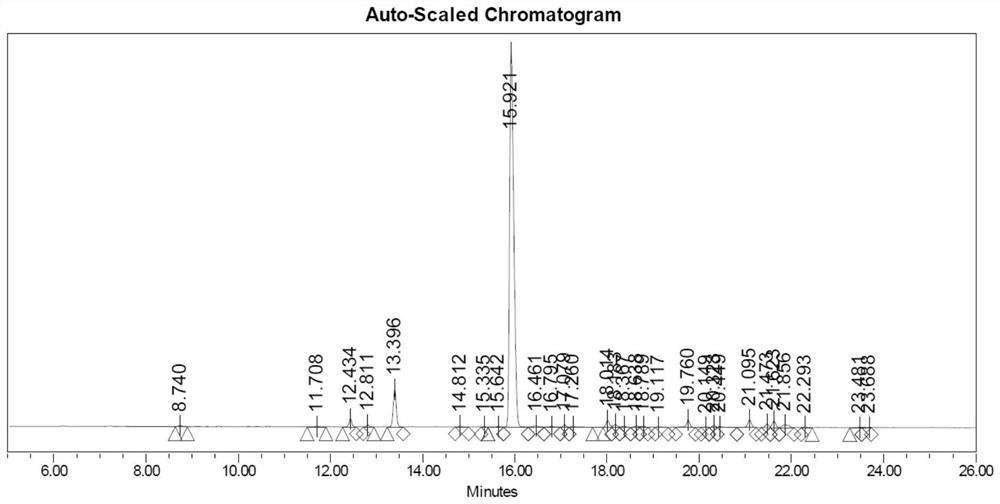
图1为奥曲肽粗肽的色谱图;
图2为奥曲肽粗肽的质谱图。
具体实施方式
为了更好地理解本发明的内容,下面结合具体实施方法对本发明内容作进一步说明,但本发明的保护内容不局限以下实施例。
说明书和权利要求书中所使用的缩写的含义列于下表中:
实施例1:制备Fmoc-Thr(tBu)-OL-2CTC树脂
称取1.12mmol/g2-CTC树脂20g(22.4mmol)投入合适的圆底烧瓶,称取8.61g(22.4mmol)的Fmoc-Thr(tBu)-OL用200ml干燥的二氯甲烷溶解,加入已有树脂的圆底烧瓶中,缓慢加入19.5ml(112mmol)的DIPEA,机械搅拌反应24h。反应完毕,转移至固相反应柱中抽干反应液,用DMF洗涤6次,每次2min,甲醇收缩2次(5min+10min),每次甲醇用量200ml,真空抽干。
实施例2:接入Cys-Cys
称取实例1中的0.5mmol/g的Fmoc-Thr(tBu)-OL-2CTC树脂10g投入固相反应柱中,加入100mlDMF,氮气鼓泡溶胀60分钟;然后用100mL DBLK脱保护两次(5min+7min),DMF和DCM交替洗涤7次(洗涤顺序和时间:2+4minDMF+4minDCM+4+4minDMF+2minDCM+2minDMF)。称取15mmol Cys-Cys、14.25mmol HBTU和15mmol HOBT用50ml DMF溶解,量取30mmol DIPEA加入并充分搅拌至物料完全溶解后投入反应柱中,氮气鼓泡反应2h,用DMF、DCM交替洗涤6次(洗涤顺序和时间:2+4minDMF+4minDCM+4minDMF+2minDCM+2minDMF)。取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。
实施例3:接入Fmoc-Thr(tBu)-OH
实施例2中Kaiser检测通过后,用100mL DBLK脱保护两次(5min+7min),DMF和DCM交替洗涤7次(洗涤顺序和时间:2+4minDMF+4minDCM+4+4minDMF+2minDCM+2minDMF)。称取15mmol Fmoc-Thr(tBu)-OH、14.25mmolHBTU和15mmol HOBT用50ml DMF溶解,量取30mmolDIPEA加入并充分搅拌至物料完全溶解后投入反应柱中,氮气鼓泡反应2h,用DMF、DCM交替洗涤6次(洗涤顺序和时间:2+4minDMF+4minDCM+4minDMF+2minDCM+2minDMF)。取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。
实施例4:接入Fmoc-Lys(Boc)-OH
实施例3中Kaiser检测通过后,用100mL DBLK脱保护两次(5min+7min),DMF和DCM交替洗涤7次(洗涤顺序和时间:2+4minDMF+4minDCM+4+4minDMF+2minDCM+2minDMF)。称取15mmol Fmoc-Lys(Boc)-OH、14.25mmol HBTU和15mmol HOBT用50ml DMF溶解,量取30mmolDIPEA加入并充分搅拌至物料完全溶解后投入反应柱中,氮气鼓泡反应2h,用DMF、DCM交替洗涤6次(洗涤顺序和时间:2+4minDMF+4minDCM+4minDMF+2minDCM+2minDMF)。取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。
实施例5:接入Fmoc-D-Trp(Boc)-OH
实施例4中Kaiser检测通过后,用100mL DBLK脱保护两次(5min+7min),DMF和DCM交替洗涤7次(洗涤顺序和时间:2+4minDMF+4minDCM+4+4minDMF+2minDCM+2minDMF)。称取15mmol Fmoc-D-Trp(Boc)-OH、14.25mmol HBTU和15mmol HOBT用50ml DMF溶解,量取30mmol DIPEA加入并充分搅拌至物料完全溶解后投入反应柱中,氮气鼓泡反应2h,用DMF、DCM交替洗涤6次(洗涤顺序和时间:2+4minDMF+4minDCM+4minDMF+2minDCM+2minDMF)。取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。
实施例6:接入Fmoc-Phe-OH
实施例5中Kaiser检测通过后,用100mL DBLK脱保护两次(5min+7min),DMF和DCM交替洗涤7次(洗涤顺序和时间:2+4minDMF+4minDCM+4+4minDMF+2minDCM+2minDMF)。称取15mmol Fmoc-Phe-OH、14.25mmol HBTU和15mmol HOBT用50ml DMF溶解,量取30mmol DIPEA加入并充分搅拌至物料完全溶解后投入反应柱中,氮气鼓泡反应2h,用DMF、DCM交替洗涤6次(洗涤顺序和时间:2+4minDMF+4minDCM+4minDMF+2minDCM+2minDMF)。取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。
实施例7:Boc-D-Phe-OH
实施例6中Kaiser检测通过后,称取2.5mmol pd(pph3)4和100mmol苯硅烷溶于40ml二氯甲烷中,加入反应柱,反应1h,脱除Alloc保护基,DMF和DCM洗涤6次(3+3+3minDCM+3+3+3minDMF),称取15mmol Boc-D-Phe-OH、14.25mmol HBTU和15mmol HOBT用50ml DMF溶解,量取30mmol DIPEA加入并充分搅拌至物料完全溶解后投入反应柱中,氮气鼓泡反应2h,用DMF、DCM交替洗涤6次(洗涤顺序和时间:2+4minDMF+4minDCM+4minDMF+2minDCM+2minDMF)。取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。
实施例8:分子内酰胺反应成环
实施例7中Kaiser检测通过后,用100mL DBLK脱保护两次(5min+7min),DMF和DCM交替洗涤7次(洗涤顺序和时间:2+4minDMF+4minDCM+4+4minDMF+2minDCM+2minDMF)。称取14.25mmol HBTU和30mmol DIPEA溶于NMP中,投入反应柱,反应2.5h,取样进行Kaiser检测,要求无色,表示反应完全;显色,表示反应不完全。若显色,延长反应30分钟。若仍显色,进行重复偶联。反应完全后,200ml甲醇分两次收缩(5+10min),收得肽树脂17.2g。
实施例9:肽树脂的裂解
将实施例8得到的树脂17.2g加入到250ml三口瓶中,加入预先配置好的裂解液(TFA:H
以上所述仅为本发明的具体实施方式,不是全部的实施方式,本领域普通技术人员通过阅读本发明说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
- 一种奥曲肽的合成方法
- 一种醋酸奥曲肽的多肽合成方法
