多特异性WNT替代分子和其用途
文献发布时间:2023-06-19 10:22:47
本申请要求于2018年7月5日提交的美国临时申请第62/694,339号、于2018年12月19日提交的美国临时申请第62/782,122号和于2019年1月28日提交的美国临时申请第62/797,772号的优先权,所述美国临时申请中的每个美国临时申请通过全文引用的方式并入本文。
与本申请相关的序列表以文本形式提供以代替纸质副本,并且特此通过引用并入本说明书中。含有序列表的文本文件的名称为SRZN_008_03WO_ST25.txt。文本文件为878KB,创建于2019年7月5日并且通过EFS-Web以电子方式提交。
技术领域
本公开总体上涉及Wnt信号传导通路激动剂分子、组合物以及所述Wnt信号传导通路激动剂分子、组合物的使用方法。此类分子可用于例如调节Wnt信号传导通路。
背景技术
Wnt(“无翅相关整合位点”或“无翅和Int-1”或“无翅-Int”)配体和其信号在控制许多基本器官和组织(包含骨、肝、皮肤、胃、肠、肾、中枢神经系统、乳腺、味蕾、卵巢、耳蜗和许多其它组织)的发育、内稳态和再生中发挥了关键作用(例如,由Clevers、Loh和Nusse综述,2014;346:1248012)。对Wnt信号传导通路的调节具有治疗变性疾病和组织损伤的潜力。
将调节Wnt信号传导作为治疗的挑战之一是存在多种Wnt配体和Wnt受体、卷曲蛋白1-10(Fzd1-10),其中许多组织表达多种Fzd和重叠的Fzd。典型的Wnt信号还涉及作为共受体的低密度脂蛋白(LDL)受体相关蛋白5(LRP5)或低密度脂蛋白(LDL)受体相关蛋白6(LRP6),除了Fzd之外,所述共受体也在各种组织中广泛表达。Fzd与LRP结合部分的比率先前没有被探索过,以调节信号传导水平并且赋予组织和/或功能特异性。
Wnt信号传导通路细分为典型(β-连环蛋白依赖性的)和非典型(β-连环蛋白非依赖性的)通路。非典型通路可以进一步分为两个不同的分支—平面细胞极性(PCP)通路和Wnt/Ca
因此,在本领域中显然需要与一种或多种Fzd、LRP5或LRP6特异性结合以调节不同的Wnt信号传导通路的结合部分。还需要产生具有一定比率的共受体(例如,Fzd和LRP受体)的结合部分,以调节信号传导水平并且赋予组织和/或功能特异性。本公开解决了这些需求。
发明内容
在各个实施例中,本公开提供了Wnt替代分子和其相关用途。
在一个方面,本公开提供了一种多特异性Wnt替代分子,其中所述Wnt替代分子包括:(i)各自与一个或多个Fzd受体表位的集合特异性结合的多个区(Fzd结合区),其中至少两个Fzd结合区与一个或多个Fzd受体表位的相同或不同集合结合;以及(ii)与低密度脂蛋白(LDL)受体相关蛋白5(LRP5)和/或LDL受体相关蛋白6(LRP6)特异性结合的一个或多个区(LRP5/6结合区)。
在一些实施例中,至少两个Fzd结合区与一种或多种Fzd受体的不同集合、一种或多种Fzd受体的同一集合内的一个或多个表位的不同集合或其组合结合。
在一些实施例中,每个Fzd结合区与以下中的一种或多种结合:卷曲蛋白1(Fzd1)、卷曲蛋白2(Fzd2)、卷曲蛋白3(Fzd3)、卷曲蛋白4(Fzd4)、卷曲蛋白5(Fzd5)、卷曲蛋白6(Fzd6)、卷曲蛋白7(Fzd7)、卷曲蛋白8(Fzd8)、卷曲蛋白9(Fzd9)和卷曲蛋白10(Fzd10)。
在一些实施例中,至少一个Fzd结合区与以下结合:(i)Fzd1、Fzd2、Fzd7和Fzd9;(ii)Fzd1、Fzd2和Fzd7;(iii)Fzd5和Fzd8;(iv)Fzd5、Fzd7和Fzd8;(v)Fzd1、Fzd4、Fzd5和Fzd8;(vi)Fzd1、Fzd2、Fzd5、Fzd7和Fzd8;(vii)Fzd4和Fzd9;(viii)Fzd9和Fzd10;(ix)Fzd5、Fzd8和Fzd10;(x)Fzd4、Fzd5和Fzd8;或者(xi)Fzd1、Fzd5、Fzd7和Fzd8。
在一些实施例中,所述多个Fzd结合区包括:(i)第一Fzd结合区,所述第一Fzd结合区与一种或多种Fzd受体的第一集合结合;以及(ii)第二Fzd结合区,所述第二Fzd结合区与一种或多种Fzd受体的第二不同集合结合。在一些实施例中,所述第一Fzd结合区与Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的一种或多种结合,并且所述第二Fzd结合区与Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的一种或多种结合。在一些实施例中,所述第一Fzd结合区与Fzd4结合,并且所述第二Fzd结合区与Fzd9结合。
在一些实施例中,所述多个Fzd结合区包括:(i)第一Fzd结合区,所述第一Fzd结合区与一种或多种Fzd受体的集合内的一个或多个表位的第一集合结合;以及(ii)第二Fzd结合区,所述第二Fzd结合区与一种或多种Fzd受体的同一集合内的一个或多个表位的第二不同集合结合。
在一些实施例中,Wnt替代物与诱导非典型Wnt信号传导的至少一种Fzd受体结合;并且所述第二Fzd结合区与诱导典型Wnt信号传导的至少一种Fzd受体结合。在另外的实施例中,与第一Fzd受体和第二Fzd受体结合的所述Wnt替代物引起典型Wnt信号传导;或非典型Wnt信号传导。
在一些实施例中,至少一个Fzd结合区与单个Fzd受体单特异性结合。在一些实施例中,所述至少一个Fzd结合区与Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9或Fzd10单特异性结合。
在一些实施例中,至少一个Fzd结合区与Fzd受体的区结合,所述区:(i)不包含所述Fzd受体的半胱氨酸富集结构域(CRD);或者(ii)包含少于所述FZD受体的整个CRD;或者(iii)与所述FZD受体的所述CRD部分重叠。
在一些实施例中,所述至少一个Fzd结合区与所述Fzd受体的铰链区结合。在一些实施例中,所述铰链区包括与SEQ ID NO:98-107中所示的任一个序列具有至少90%同一性、至少95%同一性或至少98%同一性的氨基酸序列。
在一些实施例中,所述至少一个Fzd结合区与所述Fzd受体的所述CRD上游的N端区结合。在一些实施例中,所述N端区包括与SEQ ID NO:108具有至少90%同一性、至少95%同一性或至少98%同一性的氨基酸序列。
在一些实施例中,所述Fzd结合区中的至少一个Fzd结合区包括抗体的一个或多个抗原结合片段。在一些实施例中,所述一个或多个抗原结合片段选自由以下组成的组:IgG、scFv、Fab和VHH或sdAb。在一些实施例中,所述一个或多个抗原结合片段是人源化的。
在一些实施例中,至少一个Fzd结合区包括与表1A、表1B、SEQ ID NO:1-73中所示的任一个序列具有至少90%同一性的氨基酸序列或其抗原结合片段。
在一些实施例中,一个或多个LRP5/6结合区包括抗体的一个或多个抗原结合片段。在一些实施例中,所述一个或多个抗原结合片段选自由以下组成的组:IgG、scFv、Fab和VHH或sdAb。在一些实施例中,所述一个或多个抗原结合片段是人源化的。
在一些实施例中,所述一个或多个LRP5/6结合区包括与表2A、表2B或SEQ ID NO:74-97中所示的任一个序列具有至少90%同一性的氨基酸序列或其抗原结合片段。
在一些实施例中,所述Wnt替代分子包括两个或更多个LRP5/6结合区。
在一些实施例中,所述Fzd结合区与所述LRP5/6结合区的比率以Fzd:LRP5/6表示。
在一些实施例中,所述Fzd结合区与所述LRP5/6结合区的比率以Fzd
在一些实施例中,所述Fzd结合区与所述LRP5/6结合区的以Fzd:LRP5/6表示的比率选自由以下组成的组:1:1、2:1、3:1、4:1、5:1、6:1、2:1、2:3、2:5、2:7、7:2、5:2、3:2、3:4、3:5、3:7、3:8、8:3、7:3、5:3、4:3、4:5、4:7、4:9、9:4、7:4、5:4、6:7、7:6、1:2、1:3、1:4、1:5、1:6、2:1(在具有两个Fzd结合体和一个LRP结合体的情况下)、1:2(在具有一个Fzd结合体和两个LRP结合体的情况下)、2:1:1(在具有两个不同的LRP结合体的情况下)、1:1:2(在具有两个不同的Fzd结合体的情况下)、1:1:1(在具有两个不同的Fzd结合体和一个LRP结合体或者一个Fzd结合体和两个不同的LRP结合体的情况下)以及1:1:1:1(在Fzd和LRP结合体全部不同的情况下)。
在一些实施例中,Fzd结合区与LRP5/6结合区的比率(Fzd:LRP5/6)包括2个Fzd结合区和2个LRP5/6结合区;2个Fzd结合区和1个LRP5/6结合区;或1个Fzd结合区和2个LRP5/6结合区。
在一些实施例中,Fzd结合区与LRP5/6结合区的比率(Fzd:LRP5/6)包括第一Fzd结合区、第二Fzd结合区和1个LRP5/6结合区;或第一Fzd结合区、第二Fzd结合区、第一LRP5/6结合区和第二LRP5/6结合区。在另外的实施例中,所述第一Fzd结合区和所述第二Fzd结合区与不同的Fzd受体结合或与不同区/表位上的同一Fzd受体结合,并且所述第一LRP5/6结合区和所述第二LRP5/6结合区与不同的表位或不同的LRP蛋白结合。
在一些实施例中,所述LRP结合区包括第一LRP结合区和第二LRP结合区,所述第一LRP结合区与一种或多种LRP受体的第一集合结合,所述第二LRP结合区与一种或多种LRP受体的第二不同集合结合。
在一些实施例中,所述Wnt替代分子包括选自由以下组成的组的结构形式:杂Ig、双功能抗体(DART)、串联双功能抗体(DART)、双功能抗体-Fc、串联Fab、串联Fab IgG(FIT-Ig)、Fv-IgG和串联scFv。
在一些实施例中,所述Wnt替代分子包括:(i)形成第一Fzd结合区的第一轻链和第一重链;以及(ii)形成第二Fzd结合区的第二轻链和第二重链,其中所述第一Fzd结合区和所述第二Fzd结合区与一个或多个Fzd受体表位的不同集合结合。
在一些实施例中,所述Wnt替代分子包括第一LRP5/6结合区,所述第一LRP5/6结合区与所述第一轻链的N端、所述第一轻链的C端、所述第一重链的N端或所述第一重链的C端融合。在一些实施例中,所述Wnt替代分子包括第二LRP5/6结合区,所述第二LRP5/6结合区与所述第二轻链的N端、所述第二轻链的C端、所述第二重链的N端或所述第二重链的C端融合。
在一些实施例中,所述第一重链和所述第二重链彼此连接。在一些实施例中,所述第一重链包括第一CH3结构域,所述第二重链包括第二CH3结构域,并且所述第一CH3结构域和所述第二CH3结构域彼此连接。在一些实施例中,所述第一CH3结构域和第二CH3结构域通过杵臼(knobs-into-holes)突变彼此连接。在一些实施例中,所述第一重链和/或所述第二重链包括与SEQ ID NO:110、112、114、116、118、120或122中所示(或如表5或表6A所示)的任一个序列具有至少90%同一性、至少95%同一性或至少98%同一性的氨基酸序列,并且(ii)所述第一轻链和/或所述第二轻链包括与SEQ ID NO:109、111、113、115、117、119或121中所示(或如表5或表6A所示)的任一个序列具有至少90%同一性的氨基酸序列。在一些实施例中,所述Wnt替代分子包括与表5或表6A中公开的序列具有至少90%、至少95%、至少98%或至少99%序列同一性的一个或多个序列(例如,两个或三个序列)。在特定实施例中,所述Wnt替代分子包括表5或表6A中公开的针对任何Wnt替代分子阐述的序列,或与此类序列具有至少90%、至少95%、至少98%或至少99%同一性的序列。
在另一个方面,所述Wnt替代分子具有如表6B中所示的结构。
在一些实施例中,所述Wnt替代分子调节细胞,任选地哺乳动物细胞中的Wnt信号传导通路。在一些实施例中,所述Wnt替代分子通过所述细胞中的所述Wnt信号传导通路增强信号传导。在一些实施例中,所述Wnt信号传导通路是典型的Wnt信号传导通路。在一些实施例中,所述Wnt信号传导通路是非典型的Wnt信号传导通路。
在另一个方面,本公开提供了一种药物组合物,其包括药学上可接受的赋形剂、稀释剂或载剂以及根据本文实施例中的任一个实施例的Wnt替代分子。
在另一个方面,本公开提供了一种用于激动细胞中的Wnt信号传导通路的方法,所述方法包括使所述细胞与根据本文实施例中的任一个实施例的Wnt替代分子接触,其中所述Wnt替代分子是Wnt信号传导通路的激动剂。
在另一个方面,本公开提供了一种用于治疗患有疾病或病症的受试者的方法,所述方法包括向所述受试者施用有效量的本文实施例中的任一个实施例的药物组合物,其中Wnt替代分子是Wnt信号传导通路的激动剂。
在一些实施例中,所述疾病或病症与Wnt信号传导减少或受损相关,和/或其中所述受试者将受益于Wnt信号传导增加。在一些实施例中,所述疾病或病症选自由以下组成的组:骨折、应力性骨折、椎体压缩性骨折、骨质疏松症、骨质疏松性骨折、未愈合性骨折、延迟愈合骨折、脊柱融合、脊柱外科手术的术前优化、骨坏死、植入物或矫形装置的骨整合、成骨不全症、骨移植、腱修复、腱-骨整合、牙齿生长和再生、颌面外科手术、牙种植、牙周病、颌面重建,颌、髋或股骨头坏死,无血管性坏死、脱发、听觉损失、前庭功能减退、黄斑变性、年龄相关性黄斑变性(AMD)、玻璃体视网膜病变、视网膜病变、糖尿病性视网膜病变、视网膜变性疾病、富克斯氏营养不良(Fuchs'dystrophy)、角膜疾病、中风、创伤性脑损伤、阿尔茨海默氏病(Alzheimer's disease)、多发性硬化症、肌肉萎缩症、由肌少症或恶病质引起的肌肉萎缩、影响血脑屏障(BBB)的疾病、脊髓损伤、脊髓疾病、口腔粘膜炎、短肠综合征、炎性肠病(IBD)、代谢综合征、糖尿病、血脂异常、胰腺炎、胰腺外分泌功能不全、伤口愈合、糖尿病足溃疡、褥疮、静脉性下肢溃疡、大疱表皮松解、皮肤发育不全、心肌梗塞、冠状动脉疾病、心力衰竭、造血细胞病症、免疫缺陷、移植物抗宿主病、急性肾损伤、慢性肾脏疾病、慢性阻塞性肺病(COPD)、特发性肺纤维化、所有原因的急性肝衰竭、药品诱导的急性肝衰竭、酒精性肝病、所有原因的慢性肝衰竭、肝硬化、所有原因的肝纤维化、门脉高压、所有原因的慢性肝功能不全、非酒精性脂肪性肝炎(NASH)、非酒精性脂肪肝病(NAFLD)(脂肪肝)、酒精性肝炎、丙型肝炎病毒诱导的肝病(HCV)、乙型肝炎病毒诱导的肝病(HBV)、其它病毒性肝炎(例如,甲型肝炎病毒诱导的肝病(HAV)和丁型肝炎病毒诱导的肝病(HDV))、原发性胆汁性肝硬化、自身免疫性肝炎、肝脏外科手术、肝损伤、肝移植、肝脏外科手术和移植中的“小肝(small forsize)”综合征、先天性肝脏疾病和病症,由遗传疾病、变性、老化、药品和损伤引起的任何其它肝脏病症或缺陷。
在一些实施例中,所述疾病或病症是骨骼疾病或病症。在一些实施例中,所述Wnt替代分子结合:(i)Fzd1、Fzd2和Fzd7;或者(ii)Fzd1、Fzd2、Fzd5、Fzd7和Fzd8。
附图说明
本专利或申请文件含有至少一幅彩色附图。在提出请求并支付必要费用后,将由专利局提供具有一或多张彩色附图的本专利或专利申请出版物的副本。
图1.Wnt替代分子的说明性形式的示意图。含有针对不同Fzd受体和Lrp受体的不同VL和VH区的不同VHH、Fv或scFv、双功能抗体或Fab以不同比率结合。不同的颜色表示不同的结合体(所述结合体可以结合到相同的目标或不同的目标)。
图2A.包含半胱氨酸富集结构域(CRD)、铰链区和N端区的Fzd受体的示意图。
图2B.对Fzd受体铰链区具有结合特异性的Wnt替代分子的示意图。
图2C.1791-3和1291-3Wnt替代分子的结合动力学。
图2D.1791-3和1291-3Wnt替代分子的体外活性。
图3A.单特异性和多特异性Wnt替代分子的示意图。
图3B.Wnt替代分子在293STF细胞中的体外活性。
图3C.Wnt替代分子在过度表达Fzd4的293STF细胞(293STF Fzd4OE)中的体外活性。
图3D.Wnt替代分子在过度表达Fzd9的293STF细胞(293STF Fzd9OE)中的体外活性。
图3C.Wnt替代分子在过度表达Fzd4和Fzd9的293STF细胞(293STF Fzd4OE+Fzd9OE)中的体外活性。
图4A-4E示出了不同Fzd的铰链区的序列比对(SEQ ID NO:2251-2260)。
图5A-5C示出了含有不同Fzd受体以及Lrp5的可溶性配体的异源分子的结构,以及其在293STF细胞中的体外活性。
图6A-6E示出了具有不同的Fzd与Lrp结合体比率的Wnt替代分子的结构,以及其对β-连环蛋白依赖性信号传导的Wnt3a激活的影响。
图7A-7D示出了含有两种不同Lrp结合体与Fzd结合体的异源二聚化(heterodimerizion)的结构以及其在293STF细胞中的体外活性。
图8A-8J示出了1:1二价双特异性L1/F1串联scFv分子未高效激活β-连环蛋白依赖性的WNT信号传导。(A)1:1二价双特异性L1/F1串联scFv构建体的图。每个圆圈表示scFv结构域,每个分子末端处的细黑线表示6xHis标签。(B)Ni树脂纯化的串联scFv分子在4-15%SDS-PAGE凝胶上分离。左图区,从左到右:在还原(R,泳道1-3)或非还原(NR,泳道4-6)条件下,具有5聚体、10聚体和15聚体接头的L1-F1串联scFv。右图区,从左到右,在还原(R,泳道1-3)或非还原(NR,泳道4-6)条件下,具有5聚体、10聚体和15聚体接头的F1-L1串联scFv。C)和D)Ni树脂纯化的串联scFv的剂量依赖性STF活性,其中L1与F1的N端融合(C),或F1与L1的N端融合(D)。E)来自尺寸排阻柱(SEC)精制的串联scFv的单体峰级分的剂量依赖性STF活性,其中L1与F1的N端融合。F)来自SEC精制的串联scFv的单体峰级分的剂量依赖性STF活性,其中F1与L1的N端融合。G)和H)不同串联scFv的SEC级分的STF活性。每个图区上的箭头指示单体串联scFv蛋白的位置。I)蛋白质标准品在SEC柱上的洗脱曲线,粗箭头指示串联scFv分子的单体形式的预期位置。J)向L1:5:F1添加抗His抗体诱导β-连环蛋白依赖性WNT信号传导的显著激活。
图9.1:1二价双特异性L1/F1串联scFv分子未高效激活β-连环蛋白依赖性WNT信号传导。与重组WNT3A和替代物WNT、18R5-DKK1c相比,串联scFv的剂量依赖性STF活性,所述串联scFv单独从Ni柱纯化或另外地从SEC柱纯化,其中L1与F1的N端融合并且F1与L1的N端融合。除了包含阳性对照分子数据之外,这些数据与图1C-1F相同。
图10A-10F.通过与Fc结构域融合来增加L1和F1串联scFv的化合价会显著增加Wnt信号的活性。A)F1和L1串联scFv与Fc结构域融合以产生2:2四价双特异性形式的图。B-C)串联scFv-Fc分子的SEC级分的STF活性。D)蛋白质标准品在SEC柱上的洗脱曲线,粗箭头指示串联scFv-Fc分子的单体形式的预期位置。E-F)来自蛋白质峰级分的串联scFv-Fc分子的剂量依赖性STF活性,所述蛋白质峰级分对应于来自SEC柱的分子的单体形式。
图11A-11B.2:2四价双特异性F1/L1分子的STF活性和Octet结合曲线。A)与重组WNT3A和18R5-DKK1c相比,来自与单体形式相对应的蛋白质峰级分的F1/L1双价串联scFv分子的剂量依赖性STF活性。除了包含阳性对照分子数据之外,这些数据与图2E和2F相同。B)在Octet上测量的各种2:2四价双特异性串联scFv分子对FZD1和LRP6E1E2的结合亲和力。
图12A-12E.由两个F1和两个L2结合臂组成的2:2四价双特异性分子在诱导Wnt信号传导方面高度强效。A)表示由FZD结合体F1和LRP6E3E4结合体L2组成的2:2四价双特异性分子形式的图。这些不同的2:2分子的SEC级分的STF活性在以下形式图示出。B-C)来自与来自SEC柱的每种分子的单体形式相对应的蛋白质峰级分、由在两个朝向上的F1和L2结合臂组成的2:2四价双特异性分子的剂量依赖性STF活性。D)来自F1与L2组合的2:2四价双特异性分子的活性需要FZD和LRP6结合臂的存在,因为任一结合臂被中性抗GFP scFv片段取代都会导致没有活性。E)通过Octet来确定来自D)的分子与其相应受体的相互作用。IgG1形式的结合体L1、L2和F1也作为比较物而包含在内。
图13A-13B.1:1二价双特异性L2/F1串联scFv分子不能有效激活β-连环蛋白依赖性的WNT信号传导。A)在两个朝向上的F1/L2之间的1:1二价双特异性串联scFv分子的SEC级分的STF活性。分子形式图也示出在顶部。每个图区中的箭头指示蛋白质的单体形式的位置。B)来自蛋白质峰级分的A)中所示的分子的剂量依赖性STF活性,所述蛋白质峰级分对应于来自SEC柱的每种分子的单体形式。
图14A-14I.由两个F2和两个L1或L2结合臂组成的2:2四价双特异性分子激活Wnt信号传导。A)由F2和L1结合臂组成的2:2四价双特异性分子的分子形式图,以及这些不同的WNT替代分子在整个SEC柱上的STF活性。每个图区中的箭头指示蛋白质的单体形式的位置。B)来自与来自SEC柱的每种分子的单体形式相对应的蛋白质峰级分、由在两个朝向上的F2和L1结合臂组成的2:2四价双特异性分子的剂量依赖性STF活性。与WNT3A相比,这些替代WNT激动剂在激活Wnt信号方面具有更高的效价,但功效较低。C)和D)由在两个朝向上的F2和L2组合组成的分子的SEC柱级分的1:1二价双特异性分子形式和STF活性。在1:1形式中,F2-L2朝向似乎无活性,而反向的L2-F2朝向似乎有活性。每个图区中的箭头指示蛋白质的单体形式的位置。E)来自蛋白质峰级分的1:1二价双特异性L2-F2分子的剂量依赖性STF活性,所述蛋白质峰级分对应于来自SEC柱的每种分子的单体形式。F)和H)由在两个朝向上的F2和L2组合组成的分子的SEC柱级分的2:2四价双特异性分子形式和STF活性。每个图区中的箭头指示蛋白质的单体形式的位置。G)和I)来自蛋白质峰级分的F)和H)的2:2四价双特异性L2/F2分子的剂量依赖性STF活性,所述蛋白质峰级分对应于来自SEC柱的每种分子的单体形式。
图15A-15B.F1、F2、F3的FZD特异性曲线以及1:1二价双特异性F2/L1分子的STF活性。A)在Octet上测量的F1、F2和F3对所有10个FZD的结合亲和力和特异性。B)在两个方向上的F2/L1之间的1:1二价双特异性串联scFv分子的SEC级分的STF活性。分子形式图也示出在顶部。每个图区中的箭头指示蛋白质的单体形式的位置。1:1二价双特异性形式在诱导Wnt/β-连环蛋白信号传导方面无效。
图16A-16D.由两个F3和两个L1或L2结合臂组成的2:2四价双特异性分子激活Wnt信号传导。A)表示由FZD结合体F3和LRP6结合体L1或L2组成的2:2四价双特异性分子形式的图,其中FZD结合体附接到LRP结合体的N端。这两种2:2分子的SEC级分的STF活性在以下形式图示出。B)表示由FZD结合体F3和LRP6结合体L1或L2组成的2:2四价双特异性分子形式的图,其中LRP结合体附接到FZD结合体的N端,分子的反向朝向在A)中示出。这两种2:2分子的SEC级分的STF活性在以下形式图示出。C、D)来自蛋白质峰级分的2:2四价双特异性分子的剂量依赖性STF活性,所述蛋白质峰级分对应于来自SEC柱的每种分子的单体形式。C)和D)分别对应于来自A)和B)的分子。
图17.1:1二价双特异性L1/F3或L2/F3串联scFv分子未高效激活β-连环蛋白依赖性WNT信号传导。在两个朝向上的F3/L1或F3/L2之间的1:1二价双特异性串联scFv分子的SEC级分的STF活性。分子形式图也示出在顶部。每个图区中的箭头指示蛋白质的单体形式的位置。1:1二价双特异性形式在诱导Wnt/β-连环蛋白信号传导方面无效。
图18A-18B.2:2四价双特异性哑铃形式与2:2四价双特异性串联scFv-Fc形式具有类似的活性。A)与来自SEC柱的每种分子的单体形式相对应的蛋白质峰级分的剂量依赖性STF活性。这里测试的替代WNT激动剂是2:2四价双特异性哑铃形式的F1与L1的组合。这种形式是有效的,然而与WNT3A相比,其功效要低得多。L1优选地在Fc的N端上。B)与来自SEC柱的每种分子的单体形式相对应的蛋白质峰级分的剂量依赖性STF活性。这里测试的替代WNT激动剂是2:2四价双特异性哑铃形式的F1与L2的组合。L2也优选地在Fc的N端上。
图19A-19C.各种1:1二价双特异性串联scFv分子几乎没有显示出活性。A)FZD8顺序结合,然后是1:1二价双特异性串联scFv分子F3:5:L2和L2:5:F3,然后在Octet上添加LRP6E3E4表明1:1串联scFv分子可以同时与FZD和LRP接合。B)FZD与LRP结合体之间化学计量为1:1的各种分子的图。C)B)中的各种分子的剂量应答显示没有STF信号的诱导。
图20A-20B.各种1:1双特异性scFv分子几乎没有显示出活性。F3/L2和F2/L2结合体对之间的1:1二价双特异性scFv分子的各种组合的图。B)A、B)中描绘的各种分子的剂量应答显示没有STF信号的诱导。
图21A-21K.探索FZD和LRP结合体的不同化学计量,并且以2:2四价多特异性形式来组合不同受体特异性的结合体或表位。A、D)FZD和LRP结合体之间具有不同化学计量的分子的图,如2个FZD结合体和1个LRP结合体(2:1)或1个FZD和2个LRP结合体(1:2)。B、C)在STF报告基因测定中A)中分子的剂量应答。E、F)在STF报告基因测定中D)中分子的剂量应答。G)2:2四价三特异性分子的分子形式,其中两个FZD结合体具有不同的FZD特异性(1:1:2)。H)在STF报告基因测定中G)中分子的剂量应答。I)2:2四价三特异性分子的分子形式,其中两个FZD结合体具有不同的FZD特异性,以及仅一个LRP结合体(1:1:1:0)。J)在STF报告基因测定中I)中分子的剂量应答。K)2:2四价三特异性分子的分子形式,其中两个FZD结合体和两个LRP结合体都具有不同的FZD或LRP特异性(1:1:1:1)。H)在STF报告基因测定中K)中分子的剂量应答。
具体实施方式
本公开涉及多特异性Wnt替代分子,所述多特异性Wnt替代分子与多个不同的Fzd受体和表位以及LRP5和/或LRP6特异性结合,以便调节Wnt信号传导通路。在特定实施例中,所述Wnt替代分子激活Wnt信号传导通路或增加通过Wnt信号传导通路的信号传导。在某些方面,本公开的Wnt替代分子具有:(i)多个区,所述多个区各自与一种或多种卷曲蛋白(Fzd)受体和/或一个或多个表位的集合特异性结合、在本文中称为“Fzd结合区”;以及(ii)一个或多个区,所述一个或多个区与LRP5和/或LRP6特异性结合、在本文中称为“LRP5/6结合区”。某些实施例涵盖Fzd结合区和LRP5/6结合区的特定结构形式或布置,所述特定结构形式或布置有利于调节Wnt信号传导通路和相关的生物学效应,例如,用于治疗与Wnt信号传导相关联的疾病和病症。
在特定实施例中,本文公开的Wnt替代分子包含对不同的Fzd受体和/或表位具有结合特异性的多个Fzd结合区。例如,Wnt替代分子可以包含至少两个Fzd结合区,所述至少两个Fzd结合区各自与一种或多种Fzd受体的不同集合、一种或多种Fzd受体的同一集合内的一个或多个表位的不同集合或其组合结合。对于不同的Fzd受体表位或多个Fzd受体表位,每个Fzd结合区可以是单特异性的、双特异性的、三特异性的等。这种多特异性Wnt替代分子能够选择性地激活Fzd受体的特定组合,同时减少或消除非靶向Fzd受体的激活。本公开的实施例有利于例如通过减少脱靶效应来选择性地调节靶细胞类型中的Wnt信号传导和/或治疗特定疾病或病症。
本发明的实施例涉及Wnt替代分子在诊断、评定和治疗与Wnt信号传导通路相关的疾病和病症中的用途。在某些实施例中,主题Wnt替代分子用于调节细胞或组织中的Wnt信号传导通路。在某些实施例中,主题Wnt替代分子用于治疗或预防与Wnt信号传导异常或失调(例如,减少)相关的疾病和病症或针对其调节(例如,增加)Wnt信号传导将提供治疗益处的疾病和病症。
除非特别相反地指出,否则本公开的实践将采用本领域的技术人员范围内的病毒学、免疫学、微生物学、分子生物学和重组DNA技术的常规方法,其中许多方法在下文中出于说明的目的而描述。此类技术在文献中得到充分解释。参见例如《当前分子生物学方案(Current Protocols in Molecular Biology)》或《当前免疫学方案(Current Protocolsin Immunology)》,约翰·威利父子公司(John Wiley&Sons),纽约,(2009);Ausubel等人,《精编分子生物学实验指南(Short Protocols in Molecular Biology)》,第3版,约翰·威利父子出版公司,1995;Sambrook和Russell,《分子克隆:实验室手册(Molecular Cloning:A Laboratory Manual)》(第3版,2001);Maniatis等人,《分子克隆:实验室手册》,(1982);《DNA克隆:一种实用方法(DNA Cloning:A Practical Approach)》,第I和II卷(D.Glover编辑);《寡核苷酸合成(Oligonucleotide Synthesis)》(N.Gait编辑,1984);《核酸杂交(Nucleic Acid Hybridization)》(B.Hames和S.Higgins编辑,1985);《转录和转译(Transcription and Translation)》(B.Hames和S.Higgins编辑,1984);《动物细胞培养(Animal Cell Culture)》(R.Freshney编辑,1986);Perbal,《分子克隆实用指南(APractical Guide to Molecular Cloning)》(1984)以及其它类似参考文献。
如在本说明书和所附权利要求中所使用的,除非文中另外明确指明,否则单数形式“一个/一种(a/an)”以及“所述(the)”包含复数指代。
如本文所用,“A和/或B”涵盖A或B中的一个或多个以及其组合,如A和B。
贯穿本说明书,除非上下文另外要求,否则词语“包括”或如“包括了”或“包括着”等变体应当理解为意指包含一个所述的要素或整体、或多个要素或整体的组,但不排除任何其它一个要素或整体、或多个要素或整体的组。
除非另外明确地说明,否则本说明书中的每个实施例在进行必要的修改后适用于所有其它实施例。
可以将标准技术用于重组DNA、寡核苷酸合成以及组织培养和转化(例如,电穿孔、脂质体转染)。可以根据制造商的说明书或者如本领域通常实现那样或如本文所描述那样执行酶促反应和纯化技术。这些技术和程序以及相关技术和程序通常可以根据本领域熟知的常规方法并且如在整个本说明书中引用和讨论的各种一般的和更具体的参考文献中所描述那样执行。除非提供具体的定义,否则与本文所描述的分子生物学、分析化学、合成有机化学以及药用和药物化学结合使用的命名以及所述分子生物学、分析化学、合成有机化学以及药用和药物化学的实验室程序和技术是本领域中熟知和常用的命名和实验室程序和技术。标准技术可以用于重组技术、分子生物学、微生物学、化学合成、化学分析、药物制备、配制和递送以及受试者的治疗。
本公开的实施例涉及与一种或多种Fzd受体结合的抗体和其抗原结合片段。SEQID NO:1-73、表1A和1B以及表5示出了说明性抗体或其抗原结合片段或其互补决定区(CDR)的序列。
本公开的实施例涉及与LRP5和/或LRP6结合的抗体和其抗原结合片段。SEQ IDNO:74-97、表2A和2B以及表5示出了说明性抗体或其抗原结合片段或其互补决定区(CDR)的序列。
如本领域众所周知的,抗体是能够通过位于免疫球蛋白分子的可变区中的至少一个表位识别位点特异性结合如碳水化合物、多核苷酸、脂质、多肽等靶标的免疫球蛋白分子。如本文所使用的,所述术语不仅涵盖完整多克隆或单克隆抗体,而且涵盖其片段(如dAb、Fab、Fab'、F(ab')
如本文所使用的术语“抗原结合片段”是指含有与关注的抗原,特别是一种或多种Fzd受体或LRP5或LRP6受体结合的免疫球蛋白重链和/或轻链或VHH或sdAb的至少一个CDR的多肽片段。在这方面,本文所描述的抗体的抗原结合片段可以包括本文所示的来自结合一种或多种Fzd受体或LRP5和/或LRP6的抗体的VH和VL序列的1个、2个、3个、4个、5个或所有6个CDR。在特定实施例中,抗原结合片段可以包括所有三个VH CDR或所有三个VL CDR。类似地,其抗原-结合片段可以包括VHH或sdAb的所有三个CDR。Fzd特异性抗体的抗原结合片段能够与Fzd受体结合。LRP5/6特异性抗体的抗原结合片段能够与LRP5和/或LRP6受体结合。如本文所使用的,所述术语不仅涵盖分离的片段,而且涵盖包括本文所公开的抗体的抗原结合片段的多肽,例如,包括本文所公开的抗体的抗原结合片段的融合蛋白,例如,包括结合一种或多种Fzd受体的VHH或sdAb和结合LRP5和/或LRP6的VHH或sdAb的融合蛋白。
术语“抗原”是指能够由如抗体等选择性结合体结合并且另外能够在动物中使用以产生能够结合所述抗原的表位的抗体的分子或分子的一部分。在某些实施例中,当结合体(例如,Wnt替代分子或其结合区)在蛋白质和/或大分子的复杂混合物中优先识别其靶抗原时,所述结合体被认为与抗原特异性结合。在某些实施例中,当平衡解离常数≤10
在某些实施例中,如本文所描述的抗体和其抗原结合片段包含分别插入重链框架区(FR)组与轻链FR组之间的重链和轻链CDR组,所述重链和轻链FR组向CDR提供支撑并且限定CDR相对于彼此的空间关系。如本文所使用的,术语“CDR组”是指重链或轻链V区的三个超变区。从重链或轻链的N端出发,这些区分别表示为“CDR1”、“CDR2”和“CDR3”。因此,抗原结合位点包含六个CDR,其包括来自重链和轻链V区中的每个的CDR组。包括单个CDR(例如,CDR1、CDR2或CDR3)的多肽在本文中被称为“分子识别单元”。对多种抗原-抗体复合物的晶体学分析已经表明,CDR的氨基酸残基形成与所结合抗原的广泛接触,其中最广泛的抗原接触是与重链CDR3的抗原接触。因此,分子识别单元主要负责抗原结合位点的特异性。
如本文所使用的,术语“FR组”是指框住重链或轻链V区的CDR组中的CDR的四个侧翼氨基酸序列。一些FR残基可以与所结合抗原接触;然而,FR主要负责将V区折叠成抗原结合位点,特别是直接邻近CDR的FR残基。在FR内,某些氨基酸残基和某些结构特征是非常高度保守的。在这方面,所有V区序列均含有由约90个氨基酸残基构成的内部二硫环。当V区折叠成结合位点时,CDR被展示为形成抗原结合表面的突出环基序。通常认识到存在FR的保守结构区,所述保守结构区将CDR环的折叠形状变成某些“典型”结构——无论精确的CDR氨基酸序列如何。进一步地,已知某些FR残基参与非共价域间接触,所述非共价域间接触使抗体重链和轻链的相互作用稳定。
免疫球蛋白CDR和可变结构域的结构和位置可通过参考目前可在因特网(immuno.bme.nwu.edu)上获得的Kabat,E.A.等人,《具有免疫学益处的蛋白质的序列(Sequences of Proteins of Immunological Interest)》.第4版.美国卫生与公众服务部(US Department of Health and Human Services).1987和其更新来确定。来自分布式生物公司(Distributed Bio)(加利福尼亚州南旧金山(South San Francisco,CA))的Abgenesis软件用于绘制本文所公开的抗体的特异性决定区,所述特异性决定区包含CDR的Kabat定义。(Padlan等人,《美国实验生物学会联合会期刊(FASEB J.)》9,133-139(1995))。
“单克隆抗体”是指均匀抗体群,其中单克隆抗体包括表位的选择性结合中涉及的氨基酸(天然存在的和非天然存在的)。单克隆抗体是高度特异性的,针对单一表位。术语“单克隆抗体”不仅涵盖完整单克隆抗体和全长单克隆抗体,而且涵盖其片段(如Fab、Fab'、F(ab')
蛋白水解酶木瓜蛋白酶优先切割IgG分子以产生若干片段,所述片段(F(ab)片段)中的两个各自包括包含完整抗原结合位点的共价异二聚体。胃蛋白酶能够切割IgG分子以提供若干片段,包含包括两个抗原结合位点的F(ab')
在某些实施例中,设想单链Fv或scFV抗体。例如,κ体(Ill等人,《蛋白质工程(Prot.Eng.)》10:949-57(1997));迷你抗体(Martin等人,《欧洲分子生物学组织杂志(EMBOJ)》13:5305-9(1994));双功能抗体(Holliger等人,《美国国家科学院院刊(PNAS)》90:6444-8(1993));或Janusins(Traunecker等人,《欧洲分子生物学组织杂志》10:3655-59(1991)以及Traunecker等人,《国际癌症杂志增刊(Int.J.Cancer Suppl.)》7:51-52(1992))可以使用标准分子生物学技术根据本申请中关于选择具有期望特异性的抗体的教导来制备。在其它实施例中,可以制备涵盖本公开的配体的双特异性或嵌合抗体。例如,嵌合抗体可以包括来自不同抗体的CDR和框架区,同时可以产生通过一个结合结构域与一种或多种Fzd受体特异性结合并通过第二结合结构域与第二分子特异性结合的双特异性抗体。这些抗体可以通过重组分子生物学技术来产生或者可以物理地缀合在一起。
单链Fv(scFv)多肽是共价连接的V
在某些实施例中,如本文所描述的抗体采用双功能抗体的形式。双功能抗体是由多肽形成的多聚体,每个多肽包括第一结构域和第二结构域,所述第一结构域包括免疫球蛋白轻链的结合结构域,所述第二结构域包括免疫球蛋白重链的结合结构域,所述两个结构域(例如,通过肽接头)连接但是不能彼此缔合以形成抗原结合位点:通过将多聚体内的一个多肽的第一结构域与多聚体内的另一个多肽的第二结构域缔合来形成抗原结合位点(WO94/13804)。
抗体的dAb片段由VH结构域组成(Ward,E.S.等人,《自然》341,544-546(1989))。
当要使用双特异性抗体时,所述抗体抗体可以是可以以各种方式(Holliger,P.和Winter G.,《生物技术新见(Current Opinion Biotechnol.)》4,446-449(1993))制造,例如以化学方法制备或由杂交杂交瘤制备的常规双特异性抗体,或者可以是上文提到的双特异性抗体片段中的任何双特异性抗体片段。可以仅使用可变结构域来构建没有Fc区的双功能抗体和scFv,从而潜在地减少抗独特型反应的影响。
与双特异性完整抗体形成对照,双特异性双功能抗体也可以是特别有用的,因为所述双特异性双功能抗体可以容易地构建并且表达于大肠杆菌(E.coli.)中。可以使用噬菌体展示(WO94/13804)来从文库中容易地选择具有合适结合特异性的双功能抗体(和许多其它多肽,如抗体片段)。如果要使双功能抗体的一个臂保持恒定,例如,对抗原X具有特异性,则可以产生另一个臂得以改变的文库并且选择具有合适特异性的抗体。双特异性完整抗体可以通过杵臼工程化方法来产生(J.B.B.Ridgeway等人,《蛋白质工程》,9,616-621(1996))。
在某些实施例中,本文所描述的抗体可以以
在某些实施例中,本公开的抗体可以采用VHH或sdAb的形式。VHH或sdAb技术最初是在发现和鉴定骆驼科(例如,骆驼和美洲驼)具有仅由重链组成并且因此缺乏轻链的全功能抗体后才开发的。这些仅有重链的抗体含有单个可变结构域(V
在某些实施例中,本文公开的抗体或其抗原结合片段是人源化的。这涉及通常使用重组技术制备的嵌合分子,所述嵌合分子具有衍生自来自非人类物种的免疫球蛋白的抗原结合位点以及分子的基于人类免疫球蛋白的结构和/或序列的剩余免疫球蛋白结构。抗原结合位点可以包括融合到恒定结构域上的完整可变结构域或者仅移植到可变结构域中的适当框架区上的CDR。表位结合位点可以是野生型的或可以由一个或多个氨基酸取代修饰。这消除了作为人类个体中的免疫原的恒定区,但是仍然存在对外源可变区产生的免疫应答的可能性(LoBuglio,A.F.等人,(1989)《美国国家科学院院刊》,86:4220-4224;Queen等人,《美国国家科学院院刊》(1988)86:10029-10033;Riechmann等人,《自然》,(1988)332:323-327)。用于人源化本文公开的抗Fzd抗体的说明性方法包含美国专利第7,462,697号中描述的方法。
另一种方法不仅着重于提供人源性恒定区,还着重于修饰可变区,以尽可能地将其重塑为人形式。已知的是,重链和轻链两者的可变区均含有侧翼是四个框架区(FR)的三个互补决定区(CDR),所述三个CDR响应于所讨论的表位而变化并且决定结合能力,所述四个FR区在给定物种中相对保守并且推定地为CDR提供支架。当关于特定表位制备非人类抗体时,可以通过将衍生自非人类抗体的CDR接枝到存在于待修饰的人类抗体中的FR上来对可变区进行“重塑”或“人源化”。已经通过以下报道了将此方法应用于各种抗体:Sato,K.等人,(1993)《癌症研究》53:851-856;Riechmann,L.等人,(1988)《自然》332:323-327;Verhoeyen,M.等人,(1988)《科学》239:1534-1536;Kettleborough,C.A.等人,(1991)《蛋白质工程》4:773-3783;Maeda,H.等人,(1991)《人类抗体杂交瘤(Human AntibodiesHybridoma)》2:124-134;Gorman,S.D.等人,(1991)《美国国家科学院院刊》88:4181-4185;Tempest,P.R.等人,(1991)《生物技术(Bio/Technology)》9:266-271;Co,M.S.等人,(1991)《美国国家科学院院刊》88:2869-2873;Carter,P.等人,(1992)《美国国家科学院院刊》89:4285-4289;以及Co,M.S.等人,(1992)《免疫学杂志(J Immunol)》148:1149-1154。在一些实施例中,人源化抗体保留所有CDR序列(例如,含有来自小鼠抗体的所有六个CDR的人源化小鼠抗体)。在其它实施例中,人源化抗体具有关于原始抗体改变的一个或多个CDR(一个、两个、三个、四个、五个、六个),也称为“衍生自”来自原始抗体的一个或多个CDR的一个或多个CDR。
在某些实施例中,本公开的抗体可以是嵌合抗体。在这方面,嵌合抗体包括抗体的可操作地连接或以其它方式融合到不同抗体的异源Fc部分的抗原结合片段。在某些实施例中,异源Fc结构域是人源的。在其它实施例中,异源Fc结构域可以来自来源于亲本抗体的不同Ig类别,包含IgA(包含子类别IgA1和IgA2)、IgD、IgE、IgG(包含子类别IgG1、IgG2、IgG3和IgG4)以及IgM。在另外的实施例中,异源Fc结构域可以包含来自不同Ig类中的一类或多类的CH2和CH3结构域。如上文关于人源化抗体所述,嵌合抗体的抗原结合片段可以仅包括本文所描述的抗体的CDR中的一个或多个CDR(例如,本文所描述的抗体的1个、2个、3个、4个、5个或6个CDR),或者可以包括整个可变结构域(VL、VH或两者)。
在某些方面,本公开提供了结合以下两者的Wnt替代分子:一种或多种Fzd受体;以及LRP5和/或LRP6中的一种或两种。Wnt替代分子也可以被称为“Wnt替代物”或“Wnt模拟物”。在特定实施例中,Wnt替代分子结合:一种或多种人Fzd受体;以及人LRP5和/或人LRP6中的一种或两种。
在某些实施例中,Wnt替代分子能够调节或调节与Wnt替代分子接触的细胞中的Wnt信号传导事件。在某些实施例中,Wnt替代分子增加例如通过典型的Wnt/β-连环蛋白通路的Wnt信号传导。在某些实施例中,Wnt替代分子特异性地调节人Wnt信号传导通路的生物学活性。
本公开的Wnt替代分子在与一种或多种Fzd受体以及LRP5和LRP6中的一种或多种结合方面以及在Wnt信号传导的激活方面具有生物学活性,即,Wnt替代分子是Wnt激动剂。术语“Wnt激动剂活性”是指激动剂模拟Wnt蛋白与Fzd受体和/或LRP5或LRP6结合的作用或活性的能力。本文公开的Wnt替代分子和其它Wnt激动剂模拟Wnt活性的能力可以通过多种测定法来证实。Wnt激动剂通常引发与受体的天然配体引发的反应或活性类似或相同的反应或活性。具体地,本文公开的Wnt激动剂激活、增强或增加典型的Wnt/β-连环蛋白信号传导通路。如本文所使用的,术语“增强”是指Wnt/β-连环蛋白信号传导的水平与不存在Wnt激动剂(例如,本文公开的Wnt替代分子)的情况下的水平相比的可测量增加。在特定实施例中,例如,在相同细胞类型中,与不存在Wnt激动剂的情况下的Wnt/β-连环蛋白信号传导的水平相比,Wnt/β-连环蛋白信号传导的水平的增加为至少10%、至少20%、至少50%、至少两倍、至少五倍、至少10倍、至少20倍、至少50倍或至少100倍。测量Wnt/β-连环蛋白信号传导的方法是本领域已知的并且包含本文所述的方法。本文公开的Wnt替代分子是多特异性的,即其特异性结合两个或更多个不同的表位。至少一个表位位于一个或多个Fzd受体内,并且至少一个表位与LRP5和/或LRP6结合。在特定实施例中,多特异性Wnt替代分子对Fzd受体结合具有多特异性,即其特异性结合两种或更多种不同类型的Fzd受体、单一类型Fzd受体内的两个或更多个不同表位或其组合。例如,多特异性Wnt替代分子可以结合Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的两种或更多种。在某些实施例中,多特异性Wnt替代分子与以下结合:(i)Fzd1、Fzd2、Fzd7和Fzd9;(ii)Fzd1、Fzd2和Fzd7;(iii)Fzd5和Fzd8;(iv)Fzd5、Fzd7和Fzd8;(v)Fzd1、Fzd4、Fzd5和Fzd8;(vi)Fzd1、Fzd2、Fzd5、Fzd7和Fzd8;(vii)Fzd4和Fzd9;(viii)Fzd9和Fzd10;(ix)Fzd5、Fzd8和Fzd10;(x)Fzd4、Fzd5和Fzd8;或者(xi)Fzd1、Fzd5、Fzd7和Fzd8。
在某些实施例中,对Fzd结合具有多特异性的Wnt替代分子包含至少一个Fzd结合区,所述至少一个Fzd结合区结合多个不同的Fzd受体表位,例如不同Fzd受体内的表位、同一Fzd受体内的不同表位或其组合。例如,Wnt替代分子可以包含至少一个Fzd结合区,所述至少一个Fzd结合区结合两种或更多种Fzd受体,例如Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的两种或更多种。作为另一个实例,Wnt替代分子可以包含至少一个Fzd结合区,所述至少一个Fzd结合区与以下结合:(i)Fzd1、Fzd2、Fzd7和Fzd9;(ii)Fzd1、Fzd2和Fzd7;(iii)Fzd5和Fzd8;(iv)Fzd5、Fzd7和Fzd8;(v)Fzd1、Fzd4、Fzd5和Fzd8;(vi)Fzd1、Fzd2、Fzd5、Fzd7和Fzd8;(vii)Fzd4和Fzd9;(viii)Fzd9和Fzd10;(ix)Fzd5、Fzd8和Fzd10;(x)Fzd4、Fzd5和Fzd8;或者(xi)Fzd1、Fzd5、Fzd7和Fzd8。
可替代地或组合地,在某些实施例中,对Fzd结合具有多特异性的Wnt替代物包含至少两个Fzd结合区,所述至少两个Fzd结合区各自与一个或多个Fzd受体表位的不同集合,例如不同Fzd受体内的表位、同一Fzd受体内的不同表位或其组合结合。一个或多个Fzd受体表位的集合可以包含一个、两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个Fzd受体表位,使得每个Fzd结合区可以是单特异性的、双特异性的、三特异性的、四特异性的等。
在某些实施例中,多特异性Wnt替代物包含两个或更多个Fzd结合区,其中这些Fzd结合区中的一个或多个Fzd结合区仅特异性结合一种Fzd受体或一个受体表位。在某些实施例中,多特异性Wnt替代物中的两个或更多、三个或更多个、或四个或更多个Fzd结合区各自仅特异性结合一种Fzd受体或一个受体表位,其中至少两个或更多个、至少三个或更多个、或至少四个或更多个Fzd结合区特异性结合不同的Fzd受体和/或受体表位。
在某些实施例中,Wnt替代分子包含与一个或多个Fzd受体表位的第一集合结合的第一Fzd结合区,以及与一个或多个Fzd受体表位的第二不同集合结合的第二Fzd结合区。例如,第一Fzd结合区可以与一种或多种Fzd受体的第一集合结合,并且第二Fzd结合区可以与一种或多种Fzd受体的第二不同集合结合。可替代地或组合地,第一Fzd结合区可以与一种或多种Fzd受体的集合内的一个或多个表位的第一集合结合,并且第二Fzd结合区可以与一种或多种Fzd受体的同一集合内的一个或多个表位的第二不同集合结合。在某些实施例中,第一Fzd结合区与Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的一种或多种结合。在某些实施例中,第二Fzd结合区与Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的一种或多种结合。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd2;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd3;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd4;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd5;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd6;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd7;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd1,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd3;第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd4;第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd5;第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd6;第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd7;第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd2,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd4;第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd5;第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd6;第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd7;第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd3,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd4,并且第二Fzd结合区结合Fzd5;第一Fzd结合区结合Fzd4,并且第二Fzd结合区结合Fzd6;第一Fzd结合区结合Fzd4,并且第二Fzd结合区结合Fzd7;第一Fzd结合区结合Fzd4,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd4,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd4,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd5,并且第二Fzd结合区结合Fzd6;第一Fzd结合区结合Fzd5,并且第二Fzd结合区结合Fzd7;第一Fzd结合区结合Fzd5,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd5,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd5,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd6,并且第二Fzd结合区结合Fzd7;第一Fzd结合区结合Fzd6,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd6,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd6,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd7,并且第二Fzd结合区结合Fzd8;第一Fzd结合区结合Fzd7,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd7,并且第二Fzd结合区结合Fzd10。
在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中:第一Fzd结合区结合Fzd8,并且第二Fzd结合区结合Fzd9;或者第一Fzd结合区结合Fzd8,并且第二Fzd结合区结合Fzd10。在某些实施例中,Wnt替代分子包含第一Fzd结合区和第二Fzd结合区,其中第一Fzd结合区结合Fzd9,并且第二Fzd结合区结合Fzd10。
对于以上公开的Fzd受体的组合中的每种组合,应当理解,在某些实施例中,第一结合区或第二结合区可以仅特异性结合指定的Fzd,或者其也可以结合另外的Fzd。例如,其中第一Fzd结合区与Fzd1结合,并且第二Fzd结合区与Fzd2结合,第一Fzd结合区可以仅特异性结合Fzd1,或者其也可以结合除Fzd1之外的一个或多个其它Fzd。类似地,第二Fzd结合区可以仅特异性结合Fzd2,或者其也可以结合除Fzd2之外的一个或多个其它Fzd。然而,第一Fzd结合区和第二Fzd结合区与Fzd受体的不同集合结合。
在某些实施例中,第一结合区和第二结合区可以特异性结合同一Fzd受体内的不同表位。例如,第一结合区可以结合Fzd1中的第一表位,并且第二结合区可以结合Fzd1中的不同的第二表位。第一结合区可以结合Fzd2中的第一表位,并且第二结合区可以结合Fzd2中的不同的第二表位。第一结合区可以结合Fzd3中的第一表位,并且第二结合区可以结合Fzd3中的不同的第二表位。第一结合区可以结合Fzd4中的第一表位,并且第二结合区可以结合Fzd4中的不同的第二表位。第一结合区可以结合Fzd5中的第一表位,并且第二结合区可以结合Fzd5中的不同的第二表位。第一结合区可以结合Fzd6中的第一表位,并且第二结合区可以结合Fzd6中的不同的第二表位。第一结合区可以结合Fzd7中的第一表位,并且第二结合区可以结合Fzd7中的不同的第二表位。第一结合区可以结合Fzd8中的第一表位,并且第二结合区可以结合Fzd8中的不同的第二表位。第一结合区可以结合Fzd9中的第一表位,并且第二结合区可以结合Fzd9中的不同的第二表位。第一结合区可以结合Fzd10中的第一表位,并且第二结合区可以结合Fzd10中的不同的第二表位。
对于以上公开的Fzd受体表位的组合中的每种组合,应当理解,在某些实施例中,第一结合区或第二结合区可以仅特异性结合指定的表位,或者也可以结合另外的表位。例如,其中第一结合区结合Fzd1中的第一表位,并且第二结合区结合Fzd1中的不同的第二表位,第一结合区可以仅特异性结合Fzd1中的第一表位,或者其也可以结合Fzd1或其它Fzd受体中的一个或多个其它表位。类似地,第二Fzd结合区可以仅特异性结合Fzd1中的第二表位,或者其也可以结合Fzd1或其它Fzd受体中的一个或多个其它表位。在其中第一结合区和第二结合区特异性结合一个或多个相同Fzd受体的实施例中,第一结合区和第二结合区结合一个或多个相同受体内的不同表位。
在特定实施例中,多特异性Wnt替代分子对LRP5/6结合具有多特异性,即其特异性结合LRP5和/或LRP6内的两个或更多个不同表位。在某些实施例中,多特异性Wnt替代分子包含与LRP5和/或LRP6内的第一表位结合的第一LRP5/6结合区,以及与LRP5和/或LRP6内的不同的第二表位结合的第二LRP5/6结合区。
对于LRP受体表位的组合中的每种组合,应当理解,在某些实施例中,第一结合区或第二结合区可以仅特异性结合指定的表位,或者也可以结合另外的表位。例如,其中第一结合区结合LRP5E1E2中的第一表位,并且第二结合区结合LRP5E1E2中的不同的第二表位,第一结合区可以仅特异性结合LRP5E1E2中的第一表位,或者其也可以结合LRP5E1E2或其它LRP受体中的一个或多个其它表位。类似地,第二LRP结合区可以仅特异性结合LRP5E1E2中的第二表位,或者其也可以结合LRP5E1E2或其它LRP受体中的一个或多个其它表位。在其中第一结合区和第二结合区特异性结合一个或多个相同LRP受体的实施例中,第一结合区和第二结合区结合一个或多个相同受体内的不同表位。对于LRP5E3E4、LRP6E1E2和LRP6E3E4,可能发生类似的表位结合。在特定实施例中,多特异性Wnt替代分子对Fzd结合和LRP5/6结合具有多特异性。例如,Wnt替代分子可以包含各自与一种或多种Fzd受体的不同集合结合的多个Fzd结合区以及各自与LRP5和/或LRP6内的不同表位特异性结合的多个LRP5/6结合区。应当理解,本文公开的Fzd结合区和LRP5/6结合区的各个实施例可以以许多方式组合,以产生具有Fzd和LRP5/6结合特异性的任何期望组合的多特异性Wnt替代分子。
在特定实施例中,本文公开的Wnt替代分子是多价的,例如,其包括各自与相同的表位特异性结合的两个或更多个区,例如,与一种或多种Fzd受体内的表位结合的两个或更多个区和/或与LRP5和/或LRP6内的表位结合的两个或更多个区。在特定实施例中,本文公开的Wnt替代分子包括与一种或多种Fzd受体内的表位结合的两个或更多个区以及与LRP5和/或LRP6内的表位结合的两个或更多个区。
在特定实施例中,Wnt替代分子包括Fzd结合区和LRP5/6结合区,其比率以Fzd
在某些实施例中,Wnt替代分子的结合一种或多种Fzd受体的区的数目与结合LRP5和/或LRP6的区的数目的比率为或约为:1:1、2:1、3:1、4:1、5:1、6:1、2:1、2:3、2:5、2:7、7:2、5:2、3:2、3:4、3:5、3:7、3:8、8:3、7:3、5:3、4:3、4:5、4:7、4:9、9:4、7:4、5:4、6:7、7:6、1:2、1:3、1:4、1:5、1:6、2:1(在具有两个Fzd结合体和一个LRP结合体的情况下)、1:2(在具有一个Fzd结合体和两个LRP结合体的情况下)、2:1:1(在具有两个不同的LRP结合体的情况下)、1:1:2(在具有两个不同的Fzd结合体的情况下)、1:1:1(在具有两个不同的Fzd结合体和一个LRP结合体或者一个Fzd结合体和两个不同的LRP结合体的情况下)以及1:1:1:1(在Fzd和LRP结合体全部不同的情况下)。改变Fzd结合部分与LRP5/6结合部分的比率可以赋予组织和/或功能特异性并调节信号传导水平。在某些实施例中,Wnt替代分子是多特异性且多价的。
本文公开的Wnt替代分子可以具有各种不同结构形式或构型中的任一种结构形式或构型。Wnt替代分子可以包括多肽和/或非多肽结合部分,例如小分子。在特定实施例中,Wnt替代分子包括多肽区和非多肽结合部分两者。在某些实施例中,Wnt替代分子可以包括单一多肽,或者Wnt替代分子可以包括两个或更多个、三个或更多个或四个或更多个多肽。在某些实施例中,Wnt替代物包括例如彼此连接或结合或彼此融合的一个、两个、三个或四个多肽。
当Wnt替代分子包括单个多肽时,其可以是包括一个或多个Fzd结合区(本文也称为“Fzd结合结构域”)和一个或多个LRP5/6结合区(本文也称为“LRP5/6结合结构域”)的融合蛋白。结合区可以直接融合,或者所述结合区通过接头(例如,多肽或化学接头,包含但不限于本文公开的多肽或化学接头中的任一种多肽或化学接头)连接。
当Wnt替代分子包括两个或更多个多肽时,多肽可以通过共价键(例如,二硫键)和/或非共价相互作用连接。例如,人免疫球蛋白IgG的重链直接在其CH3结构域的水平处相互作用,而在其CH2结构域的水平处,所述重链通过附接到DE弯曲部中的天冬酰胺(Asn)N84.4的碳水化合物相互作用。
可以工程化Wnt替代多肽以促进两个多肽之间的结合。例如,可以将杵臼氨基酸修饰引入两个不同多肽中以促进它们的结合。杵臼氨基酸(AA)变化是在抗体工程化中开发的用于双特异性IgG抗体生产中重链异源二聚化的合理设计策略。工程化AA变化,以便在第一抗体的重链的CH3上产生杵(knob),并且在第二抗体的重链的CH3上产生臼(hole)。杵可以由属于AA的‘非常大’IMGT体积类别的酪氨酸(Y)表示,而臼可以由属于‘小’IMGT体积类别的苏氨酸(T)表示。将修饰引入多肽中以促进其结合的其它手段是本领域已知的和可用的。例如,可以引入特定氨基酸并且将其用于交联,如引入半胱氨酸以形成分子间二硫键。
在特定实施例中,Wnt替代分子包括衍生自抗体或其抗原结合片段(例如,抗体重链或抗体轻链或其片段)的一个或多个结合区。在某些实施例中,Wnt替代分子的一个或多个多肽是抗体或其抗原结合片段。在某些实施例中,Wnt替代物包括两种抗体或其抗原结合片段,例如,一种抗体或其抗原结合片段结合一种或多种Fzd受体并且另一种抗体或其抗原结合片段结合LRP5和/或LRP6。在某些实施例中,Wnt替代物包括三种抗体或其抗原结合片段,例如,一种抗体或其抗原结合片段结合一个或多个Fzd受体表位的第一集合,一种抗体或其抗原结合片段结合一个或多个Fzd受体表位的第二不同集合,并且一种抗体或其抗原结合片段结合LRP5和/或LRP6。在某些实施例中,Wnt替代物包括四种抗体或其抗原结合片段,例如,一种抗体或其抗原结合片段结合一个或多个Fzd受体表位的第一集合,一种抗体或其抗原结合片段结合一个或多个Fzd受体表位的第二不同集合,一种抗体或其抗原结合片段结合LRP5和/或LRP6内的第一表位,并且一种抗体或其抗原结合片段结合LRP5和/或LRP6内的不同的第二表位。
在某些实施例中,Wnt替代分子包含多肽,所述多肽包括通过一个或多个二硫键结合在一起的两个抗体重链区(例如,铰链区)。在某些实施例中,Wnt替代分子包含多肽,所述多肽包括通过一个或多个二硫键结合在一起的抗体轻链区(例如,C
Wnt替代分子可以具有各种不同的结构形式,包含但不限于图1中所示出的结构形式。
在一个实施例中,Wnt替代分子包括与VHH或sdAb或其抗原结合片段融合的scFv或其抗原结合片段。在某些实施例中,scFv特异性结合一个或多个Fzd受体表位,并且VHH或sdAb特异性结合LRP5和/或LRP6。在某些实施例中,scFv特异性结合LRP5和/或LRP6,并且VHH或sdAb特异性结合一个或多个Fzd受体表位。在特定实施例中,scFv或其抗原结合片段与VHH或sdAb或其抗原结合片段直接融合,而在其它实施例中,两个结合区通过接头部分融合。在特定实施例中,VHH或sdAb与scFV的N端融合,而在其它实施例中,VHH或sdAb与scFv的C端融合。在特定实施例中,scFv在本文中描述或包括本文所述的CDR组中的任一个CDR组。在特定实施例中,VHH或sdAb在本文中描述或包括本文公开的CDR组中的任一个CDR组。
在各个实施例中,包含但不限于图1所描绘的那些,Wnt替代分子包括一个或多个Fab或其抗原结合片段以及一个或多个VHH或sdAb或其抗原结合片段(或可替代地,一个或多个scFv或其抗原结合片段)。在某些实施例中,Wnt替代物包括两个或更多个Fab,所述Fab中的每个特异性结合一个或多个Fzd受体表位的不同集合,并且VHH或sdAb(或scFv)特异性结合LRP5和/或LRP6。在某些实施例中,Wnt替代物包括特异性结合LRP5和/或LRP6的Fab以及各自特异性结合一个或多个Fzd受体表位的不同集合的两个或更多个VHH或sdAb(或scFv)。在某些实施例中,VHH或sdAb(或scFv)与Fab的N端融合,而在一些实施例中,VHH或sdAb(或scFv)与Fab的C端融合。在特定实施例中,Fab以完整IgG形式存在,并且VHH或sdAb(或scFv)与IgG轻链的N端和/或C端融合。在特定实施例中,Fab以完整IgG形式存在,并且VHH或sdAb(或scFv)与IgG重链的N端和/或C端融合。在特定实施例中,两个或更多个VHH或sdAb(或scFv)在这些位置的任何组合处与IgG融合,其中两个或更多个VHH或sdAb(或scFv)中的每一个结合Fzd的不同集合。
可以例如使用基因工程以产生包括与Fc区融合的Fab的融合多肽来将Fab转化成包含Fab和Fc片段两者的完整IgG形式,即,Fab以完整IgG形式存在。完整IgG形式的Fc区可以衍生自各种不同的Fc中的任一种,包含但不限于野生型或经修饰的IgG1、IgG2、IgG3、IgG4或其它同种型,例如野生型或经修饰的人IgG1、人IgG2、人IgG3、人IgG4、人IgG4Pro(包括防止IgG4半分子的形成的核心铰链区中的突变)、人IgA、人IgE、人IgM或被称为IgG1LALAPG的经修饰的IgG1。已经表明L234A、L235A、P329G(LALA-PG)变体消除鼠IgG2a和人IgG1两者中的补体结合和固定以及Fc-γ依赖性抗体依赖性细胞介导的细胞毒性(ADCC)。这些LALA-PG取代允许在小鼠和灵长类动物之间更准确地翻译用“无效应子”抗体框架支架产生的结果。在本文公开的IgG中的任一种的特定实施例中,IgG包括以下氨基酸取代中的一个或多个:N297G、N297A、N297E、L234A、L235A或P236G。
对一个或多个Fzd受体表位和LRP5和/或LRP6均为二价的二价和双特异性Wnt替代分子的非限制性实例被提供为图1所描绘的前四个结构,其中VHH或sdAb或scFv被描绘为红色、蓝色或黄色的单个实心椭圆形,并且Fab或IgG被描绘为蓝色。如所示出的,VHH或sdAb(或scFv)可以与两条轻链的N端、两条重链的N端、两条轻链的C端或两条重链的C端融合。进一步设想的是,例如,VHH或sdAb(或scFv)可以与重链和/或轻链的N端和C端、轻链和重链的N端、重链和轻链的C端、重链的N端和轻链的C端,或重链的C端和轻链的N端融合。在其它相关实施例中,两个或更多个VHH或sdAb(或scFv)可以任选地通过接头部分融合在一起,并且在这些位置中的一个或多个位置处与Fab或IgG融合。在特定实施例中,两个或更多个VHH或sdAb(或scFv)可以各自结合一个或多个Fzd受体表位的不同集合。
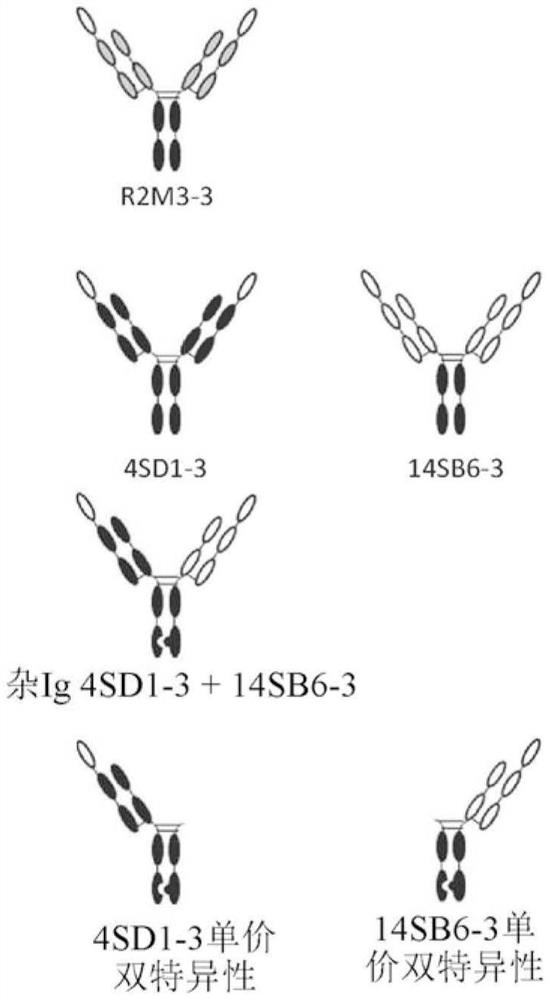
在相关实施例中,Wnt替代分子具有杂Ig形式,而Fab以半抗体的形式存在,并且一个或多个VHH或sdAb(或scFv)与Fc的N端、Fab的N端、Fc的C端或Fab的C端中的一个或多个融合。在特定实施例中,两个或更多个VHH或sdAb(或scFv)与Fc的N端、Fab的N端、Fc的C端或Fab的C端融合,其中VHH或sdAb(或scFv)中的每一个结合一个或多个Fzd受体表位的不同集合。在图1C、1D、1E、1F中描述了这种形式的对于每种受体具有双特异性但单价的版本,可以对所述版本进行修饰以包含两个或更多个Fzd结合区,其中Fzd结合区中的至少两个Fzd结合区结合一个或多个Fzd受体表位的不同集合。在某些实施例中,Fab或其抗原结合片段(或IgG)与VHH或sdAb(或scFv)或其抗原结合片段直接融合,而在其它实施例中,结合区通过接头部分融合。在特定实施例中,Fab在本文中描述或包括本文所述的CDR组中的任一个CDR组。在特定实施例中,VHH或sdAb或scFv在本文中描述或包括本文公开的CDR组中的任一个CDR组。
在各个实施例中,包含但不限于图1V、1W、1X、1AA中描绘的那些,Wnt替代分子包括结合一个或多个Fzd受体表位的一个或多个Fab或其抗原结合片段以及结合LRP5和/或LRP6的一个或多个Fab或其抗原结合片段。在某些实施例中,Wnt替代分子包括结合一个或多个Fzd受体表位的不同集合的两个Fab或其抗原结合片段和/或结合LRP5和/或LRP6的两个Fab或其抗原结合片段。在特定实施例中,Fab中的一个或多个以完整IgG形式存在,并且在某些实施例中,两个Fab均以完整IgG形式存在。在某些实施例中,完整IgG形式的Fab特异性结合一个或多个Fzd受体表位,而另一个Fab特异性结合LRP5和/或LRP6。在某些实施例中,Fab特异性结合一个或多个Fzd受体表位的不同集合,并且完整IgG形式的Fab特异性结合LRP5和/或LRP6。在某些实施例中,Fab特异性结合LRP5和/或LRP6,并且完整IgG形式的Fab特异性结合一个或多个Fzd受体表位的不同集合。在某些实施例中,Fab任选地通过接头与IgG的N端(例如,重链或轻链N端)融合。在某些实施例中,Fab与IgG的重链的N端融合并且不与轻链融合。在特定实施例中,两条重链可以直接融合或通过接头融合在一起。对两种受体具有这种双特异性且二价的实例在图1V、1W、1X和1AA中示出。在其它相关实施例中,两个或更多个VHH或sdAb可以任选地通过接头部分融合在一起,并且在这些位置中的一个或多个位置处与Fab或IgG融合。在相关实施例中,Wnt替代分子具有杂IgG形式,而Fab中的一个Fab以半抗体的形式存在,并且另一Fab与Fc的N端、Fab的N端、Fc的C端中的一个或多个融合。图1D中描述了这种形式的对于每种受体具有双特异性但单价的版本,可以对所述版本进行修饰以包含一个或多个另外的Fab,其中两个或更多个Fab结合Fzd受体表位的不同集合。在某些实施例中,Fab或其抗原结合片段与另一Fab或IgG或其抗原结合片段直接融合,而在其它实施例中,结合区通过接头部分融合。在特定实施例中,两个Fab中的一个或两个在本文中描述或包括本文描述的CDR组中的任一个CDR组。
在某些实施例中,Wnt替代分子具有PCT申请公布第WO2017/136820号中所述的形式,例如,串联Fab IgG(FIT-IG)形式。Shiyong Gong、Fang Ren、Danqing Wu、Xuan Wu&Chengbin Wu(2017)。FIT-IG还包含“串联Fab免疫球蛋白是一种用于接合多个治疗靶标的新颖且通用双特异性设计(Fabs-in-tandem immunoglobulin is a novel and versatilebispecific design for engaging multiple therapeutic targets)”《单克隆抗体(mAbs)》,9:7,1118-1128,DOI:10.1080/19420862.2017.1345401中所公开的形式。在某些实施例中,FIT-IG通过将两种亲本单克隆抗体的DNA序列重新排列成两种或三种构建体并将它们在哺乳动物细胞中共表达来将两种抗体的功能组合到一个分子中。在PCT申请公布第WO2017/136820号的图1A和1B以及图2A和2B中提供了FIT-IG形式和构建体的实例。在某些实施例中,FIT-IG不需要Fc突变,并且不需要scFv要素,并且不需要接头或肽连接体。每个臂中的Fab结构域“串联”工作,从而形成具有四个活性且独立的抗原结合位点的四价双特异性抗体,所述四个活性且独立的抗原结合位点保留了其亲本抗体的生物学功能。在特定实施例中,Wnt替代物包括Fab和IgG。在某些实施例中,Fab结合体LC例如通过其间各种长度的接头与IgG的HC融合。在各个实施例中,Fab结合体HC可以与IgG的LC融合或不融合。此形式的变体被称为串联Fab IgG(或FIT-Ig)。在某些实施例中,FIT-Ig包括两个或更多个Fzd结合结构域,其中至少两个或Fzd结合区结合一个或多个Fzd受体表位的不同集合,例如一种或多种Fzd受体的不同集合或一个或多个相同Fzd受体内的一个或多个表位的不同集合。
在特定实施例中,Wnt替代分子包括两个或更多个VHH或sdAb(或scFv),包含结合一个或多个Fzd受体表位的至少一个VHH或sdAb(或scFv)以及结合LRP5和/或LRP6的至少一个VHH或sdAb(或scFv)。在某些实施例中,结合区中的一个结合区是VHH或sdAb,并且另一个结合区是scFv。在特定实施例中,Wnt替代分子包括三个或更多个VHH或sdAb(或scFv),包含结合一个或多个Fzd受体表位的不同集合的至少两个VHH或sdAb(或scFv)以及结合LRP5和/或LRP6的至少一个VHH或sdAb(或scFv)。包括两个或更多个VHH或sdAb(或scFv)的Wnt替代分子可以以各种构型形式化,包含但不限于图1K、1L、1M、1N、1O、1P、1Q、1S、1T中所描绘的那些。在某些双特异性二价形式中,两个或更多个VHH或sdAb(或scFv)任选地通过一个或多个接头与Fc的两个不同端串联融合或融合。在存在接头的情况下,接头和其长度在VHH或sdAb(或scFv)与其它VHH或sdAb(或scFv)之间或在VHH或sdAb与Fc之间可以相同或不同。例如,在某些实施例中,VHH或sdAb与IgG重链的N端和/或C端融合。在特定实施例中,两个或更多个VHH或sdAb在这些位置的任何组合处与IgG融合。这种形式的二价和双特异性Wnt替代分子的非限制性实例被描绘为如图1K、1L、1M、1N、1O、1P、1Q中所描绘的结构,其中第一VHH或sdAb以蓝色描绘,Fc或IgG以蓝色描绘,并且第二VHH或sdAb被描绘为红色。在各个实施例中,VHH或sdAb均可以与Fc的N端、Fc的C端融合,或者一个或多个VHH或sdAb可以与Fc的N端或C端中的任一个或两个融合。在相关实施例中,Wnt替代分子具有杂IgG形式,而一个VHH或sdAb以半抗体的形式存在,并且另一VHH或sdAb与Fc的N端或Fc的C端融合。图1E中描绘了这种形式的对于每种受体具有双特异性但单价的版本。在某些实施例中,VHH或sdAb与另一VHH或sdAb直接融合,而在其它实施例中,结合区通过接头部分融合。在特定实施例中,VHH或sdAb在本文中描述或包括本文描述的CDR组中的任一个CDR组。在各个实施例中,这些形式中的任一种形式可以包括一个或多个scFv来代替一个或多个VHH或sdAb。
在某些实施例中,Wnt替代分子被形式化为双功能抗体。如图1R所示,针对Fzd和LRP的结合体也可以以双功能抗体(或DART)构型连接在一起。双功能抗体也可以呈单链构型。如果双功能抗体与Fc融合,则将产生二价双特异性形式。在不与Fc融合的情况下,这将是单价双特异性形式。在某些实施例中,双功能抗体是由通过小肽接头连接的重链可变区(VH)和轻链可变区(VL)组成的非共价二聚体scFv片段。双功能抗体的另一种形式是单链(Fv)2,其中两个scFv片段彼此共价连接。在特定实施例中,双功能抗体包括两个或更多个Fzd结合区,其中Fzd结合区中的至少两个结合一个或多个Fzd受体表位的不同集合。
在某些实施例中,两个或更多个双功能抗体、scFv和/或VHH或sdAb可以在与Fc融合或不与其融合的情况下以多价形式串联融合(图1A、1B、1F、1U)。在特定实施例中,双功能抗体、scFv和/或VHH或sdAb中的至少一个结合一个或多个Fzd受体表位,并且双功能抗体、scFv和/或VHH或sdAb中的至少一个结合LRP5和/或LRP6。
在各个实施例中,包含但不限于图1G或1H中描述的那些,Wnt替代分子包括各自结合一个或多个Fzd受体表位的不同集合的两个或更多个Fab或其抗原结合片段,以及例如结合LRP5/6的一个或多个VHH或sdAb或其抗原结合片段(或者,可替代地或组合地,一个或多个scFv或其抗原结合片段)。在某些实施例中,第一Fab特异性结合一个或多个Fzd受体表位的第一集合,第二Fab特异性结合一个或多个Fzd受体表位的第二不同集合,并且VHH或sdAb(或scFv)特异性结合LRP5和/或LRP6。在某些实施例中,VHH或sdAb(或scFv)与Fab的N端融合,而在一些实施例中,VHH或sdAb(或scFv)与Fab的C端融合。在特定实施例中,Wnt替代分子具有杂Ig形式,如图1G、1H、1AG所描绘的,其中第一和第二Fab各自作为半抗体存在,并且一个或多个VHH或sdAb(或scFv)与Fc的N端、Fab的N端、Fc的C端(例如,图1Y)或Fab的C端中的一个或多个融合。第一和第二Fab可以通过其相应Fc中(例如,CH3结构域内)的杵臼突变彼此连接。
如所讨论的,在各个实施例中,Wnt替代分子包括本文公开的一种或多种抗体或其抗原结合片段。因此,在特定实施例中,Wnt替代物包括两个多肽,其中每个多肽包括结合LRP5/6的VHH或sdAb或scFv以及结合一个或多个Fzd受体表位的VHH或sdAb或scFv,任选地,其中结合结构域中的一个结合结构域是scFv并且另一个结合结构域是VHH或sdAb。在特定实施例中,每个多肽包括结合一个或多个Fzd受体表位的不同集合的Fzd结合区。在某些实施例中,Wnt替代物包括三个多肽,其中第一多肽包括抗体重链并且第二多肽包括抗体轻链,其中抗体重链和轻链结合LRP5/6或一个或多个Fzd受体表位,并且其中第三多肽包括与重链Fc区融合的VHH或sdAb,其中VHH或sdAb与LRP5/6或一个或多个Fzd受体表位结合。在其它实施例中,Wnt多肽包括四个多肽,所述四个多肽包含两个重链多肽和两个轻链多肽,其中两个重链和两个轻链结合LRP5/6或一个或多个Fzd受体表位;并且进一步包括与重链和/或轻链中的一个或多个融合的一个或多个VHH或sdAb或scFv,其中VHH或sdAb或scFv与LRP5/6或一个或多个Fzd受体表位结合。在另一个说明性实施例中,Wnt替代物包括至少四个多肽,所述至少四个多肽包含结合LRP5/6或一个或多个Fzd受体表位的两个重链多肽和两个轻链多肽,其中Wnt替代物进一步包括结合LRP5/6或一个或多个Fzd受体表位的Fab。例如,Fab可以包括各自与两个重链多肽之一融合的两个多肽以及各自与两个轻链多肽之一融合的两个多肽,或者Fab可以包括各自与两个重链多肽之一融合的两个多肽以及各自结合与重链多肽融合的两个多肽之一的两个另外的多肽,从而形成第二Fab。其它构型可以用于产生本文公开的Wnt替代物。在这些形式中的任一种形式的特定实施例中,其包括各自结合Fzd受体表位的不同集合的至少两个或更多个Fzd结合区。
在一些实施例中,Fzd结合区与LRP结合区的不同比率(Fzd:LRP)在图1AB、1AC、1AD、1AE、1AF、1AG、1AH、1AI、1AJ、1AK、1AL、1AM中表示。在特定实施例中,一个或多个Fab与一种或多种Fzd受体或同一Fzd受体中的不同表位结合,并且一个或多个VHH或sdAb(或scFv)与一种或多种LRP受体或同一LRP受体中的不同表位结合。
在特定实施例中,Wnt替代分子包含形成第一Fzd结合区的第一轻链和第一重链,以及形成第二Fzd结合区的第二轻链和第二重链,其中第一Fzd结合区和第二Fzd结合区与一个或多个Fzd受体表位的不同集合结合。在某些实施例中,所述第一和第二重链彼此连接。例如,第一重链可以包含第一CH3结构域,第二重链可以包含第二CH3结构域,并且第一CH3结构域和第二CH3结构域可以例如通过杵臼突变彼此连接。在某些实施例中,第一重链和/或第二重链包括与SEQ ID NO:110、112、114、116、118、120和122中所示的任一个序列具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。在某些实施例中,第一轻链和/或第二轻链包括与SEQ ID NO:109、111、113、115、117、119和121中所示的任一个序列具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。在一些实施例中,一个或多个重链包括与表5中公开的任一个序列具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。在一些实施例中,一个或多个轻链包括与表5中公开的任一个序列具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。
在某些实施例中,Wnt替代分子包含第一LRP5/6结合区和/或第二LRP5/6结合区,所述结合区中的每一个结合区可以是或包含Fab或scFv。第一和第二LRP5/6结合区可以结合LRP5/6内的同一表位,或者可以结合LRP5/6内的不同表位。第一LRP5/6结合区可以与第一轻链的N端、第一轻链的C端、第一重链的N端或第一重链的C端融合。第二LRP5/6结合区可以与第二轻链的N端、第二轻链的C端、第二重链的N端或第二重链的C端融合。
在特定实施例中,Wnt替代分子包括与特异性结合一种或多种Fzd受体的多肽融合或结合的Fzd结合区,例如,抗Fzd抗体或其抗原结合片段。在特定实施例中,与一种或多种Fzd受体特异性结合的多肽是抗体或其抗原结合片段。在某些实施例中,其是本文公开的或在于2017年12月19日提交的题为“抗卷曲蛋白抗体和使用方法(Anti-Frizzledantibodies and Methods of Use)”、代理人案卷号为SRZN-004/00US的美国临时专利申请第62/607,877号中公开的抗体或其抗原结合片段,所述美国临时专利申请通过全文引用的方式并入本文。
在特定实施例中,Wnt替代分子的至少一个Fzd结合区包含抗体的一个或多个抗原结合片段。例如,一个或多个抗原结合片段可以是或衍生自IgG、scFv、Fab、VHH或sdAb。在某些实施例中,一个或多个抗原结合片段是人源化的。
在特定实施例中,Fzd结合区包括针对表1A中提供的与一种或多种Fzd受体结合的说明性抗体或其片段中的任一种抗体或其片段公开的三个重链CDR和/或三个轻链CDR。在特定实施例中,Fzd结合区包括针对表1A中提供的与一种或多种Fzd受体结合的说明性抗体或其片段中的任一种抗体或其片段公开的三个重链CDR和/或三个轻链CDR,其中CDR共同包括一个、两个、三个、四个、五个、六个、七个或八个氨基酸修饰,例如,取代、缺失或添加。在某些实施例中,Fzd结合区是VHH或sdAb或衍生自VHH或sdAb,因此表1A仅包含三个重链CDR。在特定实施例中,Fzd结合区包括表1A中提供的三个CDR HC序列或变体,其中CDR共同包括一个、两个、三个、四个、五个、六个、七个或八个氨基酸修饰。
在特定实施例中,Fzd结合区包括表1B或SEQ ID NO:1-73中提供的与一种或多种Fzd受体结合的说明性抗体或其片段中的任一种抗体或其片段的重链片段和/或轻链片段(或任一者的抗原结合片段或变体)。在某些实施例中,Fzd结合区是Fab或衍生自Fab,因此表1B的重链包含VH和CH1序列,但不包含CH2或CH3序列。在某些实施例中,Fzd结合区是VHH或sdAb或衍生自VHH或sdAb,因此表1B包含VHH结构域。在某些实施例中,Fzd结合区是与这些抗体中的任一种抗体竞争与一种或多种Fzd受体结合的多肽,例如,抗体或其抗原结合片段。
在特定实施例中,Fzd结合区包含与表1A、表1B或SEQ ID NO:1-73中所示的任一个序列具有至少90%、至少95%、至少98%、至少99%同一性的氨基酸序列或其抗原结合片段。测定了表1B中列出的克隆的结合特性,并在表1B中示出。重链CDR被指定为CDRH1、CDRH2和CDRH3,并且轻链CDR被指定为CDRL1、CDRL2和CDRL3。
表1A:抗Fzd抗体克隆ID和CDR序列
表1A,续
表1B:抗Fzd抗体克隆ID、重链(HC)和轻链(LC)Seq ID No以及结合特性
在某些实施例中,Fzd结合区可以选自以例如为以下的K
适合的Fzd结合区包含但不限于从头设计的Fzd结合蛋白、抗体衍生的结合蛋白(例如,scFv、Fab等)以及与一种或多种Fzd蛋白特异性结合的抗体的其它部分、VHH或sdAb衍生的结合结构域、基于打结素(knottin)的工程化支架、norrin和由其衍生的工程化结合片段、天然存在的Fzd结合结构域等。Fzd结合结构域可以是亲和力选择的,以增强与期望的Fzd蛋白或多种Fzd蛋白的结合以例如提供组织选择性。
在一些实施例中,Fzd结合区与一种、两种、三种、四种、五种或更多种不同的卷曲蛋白,例如人卷曲蛋白Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9和Fzd10中的一种或多种人卷曲蛋白结合。在一些实施例中,Fzd结合区与Fzd1、Fzd2和Fzd7结合。在一些实施例中,Fzd结合区与Fzd1、Fzd2、Fzd5、Fzd7和Fzd8结合。在其它实施例中,Fzd结合区对关注的一种或多种卷曲蛋白具有选择性,例如相对于其它卷曲蛋白,对一种或多种期望的卷曲蛋白具有至少10倍、25倍、50倍、100倍、200倍或更多倍的特异性。
在某些实施例中,Fzd结合区包括泛特异性卷曲蛋白抗体OMP-18R5(万替妥单抗(vantictumab))的六个CDR区。在某些实施例中,Fzd结合区是包括泛特异性卷曲蛋白抗体OMP-18R5(万替妥单抗)的六个CDR区的scFv。参见例如通过引用的方式具体并入本文中的美国专利第8,507,442号。例如,OMP-18R5的CDR序列包含:(i)包括GFTFSHYTLS(SEQ ID NO:270)的重链CDR1、包括VISGDGSYTYYADSVKG(SEQ ID NO:677)的重链CDR2和包括NFIKYVFAN(SEQ ID NO:1033)的重链CDR3;以及(ii)包括SGDKLGKKYAS(SEQ ID NO:1152)或SGDNIGSFYVH(SEQ ID NO:1153)的轻链CDR1、包括EKDNRPSG(SEQ ID NO:1200)或DKSNRPSG(SEQ ID NO:1201)的轻链CDR2和包括SSFAGNSLE(SEQ ID NO:1435)或QSYANTLSL(SEQ IDNO:1436)的轻链CDR3。在特定实施例中,Fzd结合区是抗体或其衍生物,包含但不限于scFv、迷你抗体、VHH或sdAb以及包括这些CDR序列中的任一个的各种抗体模拟物。在某些实施例中,这些CDR序列包括一个或多个氨基酸修饰。
在某些实施例中,Fzd结合区包括抗FZD7-1791或抗FZD7-1291的六个CDR区。抗FZD7-1791和抗FZD7-1291是结合Fzd7的铰链区内的不同表位的抗体,如PCT专利公布第WO2016/205551号和第WO2016/205566号中所述,所述专利公布通过引用具体并入本文。在某些实施例中,Fzd结合区是包括抗FZD7-1791或抗FZD7-1291的六个CDR区的scFv。例如,抗FZD7-1791的CDR序列包含:(i)包括TYAMH(SEQ ID NO:2190)的重链CDR1、包括RIRSKSNNYAKNYDDSVKD(SEQ ID NO:2193)的重链CDR2和包括ENYGGRFDY(SEQ ID NO:2196)的重链CDR3;以及(ii)包括KASENVLNYVS(SEQ ID NO:2199)的轻链CDR1、包括GASNRYT(SEQID NO:2202)的轻链CDR2和包括GQSYRYP(SEQ ID NO:2205)的轻链CDR3。抗FZD7-1791的重链序列包含SEQ ID NO:70,并且抗FZD7-1791的轻链序列包含SEQ ID NO:71。作为另一个实例,抗FZD7-1291的CDR序列包含(i)包括SYAMS(SEQ ID NO:2191)的重链CDR1、包括TISDGGSYTRYPDKLKG(SEQ ID NO:2194)的重链CDR2和包括VGGRRDYFDY(SEQ ID NO:2197)的重链CDR3,以及(ii)包括KSSQSLLYSSNQKNYLAW(SEQ ID NO:2200)的轻链CDR1、包括WASTRES(SEQ ID NO:2203)的轻链CDR2和包括QQYYSYP(SEQ ID NO:2206)的轻链CDR3。抗FZD7-1291的重链序列包含SEQ ID NO:72,并且抗FZD7-1291的轻链序列包含SEQ ID NO:73。在一些实施例中,在特定实施例中,Fzd结合区是抗体或其衍生物,包含但不限于scFv、迷你抗体、VHH或sdAb以及包括这些CDR序列中的任一个的各种抗体模拟物。在某些实施例中,这些CDR序列包括一个或多个氨基酸修饰。
在其它实施例中,Fzd结合区包括来自多种卷曲蛋白特异性抗体中的任一种卷曲蛋白特异性抗体的可变区序列或其CDR,所述多种卷曲蛋白特异性抗体是本领域中已知的并且可商购获得或者可以从头产生。卷曲蛋白多肽中的任一种卷曲蛋白多肽可以用作免疫原或在筛选测定法中用于开发抗体。卷曲蛋白结合结构域的非限制性实例包含:可从Biolegend公司获得的抗体,例如,对人卷曲蛋白4具有特异性的克隆CH3A4A7(CD344)、对人Fzd9具有特异性的克隆W3C4E11(CD349);可从艾博抗公司(Abcam)获得的抗体,例如对Fzd7具有特异性的ab64636;对人Fzd4具有特异性的ab83042;对人Fzd7具有特异性的ab77379;对人Fzd8具有特异性的ab75235;对人Fzd9具有特异性的ab102956;等。适合的抗体的其它实例尤其描述于以下中:美国专利申请第20140105917号;美国专利申请第20130230521号;美国专利申请第20080267955号;美国专利申请第20080038272号;美国专利申请第20030044409号;等,所述专利申请各自通过引用具体并入本文。
Wnt替代分子的Fzd结合区可以是被选择用于与Wnt蛋白的卷曲蛋白结合区的结构同源的工程化蛋白。此类蛋白质可以通过筛选结构数据库的同源性来鉴别。由此鉴别出初始蛋白,例如微生物Bh1478蛋白。然后,天然蛋白被工程化以提供增加亲和力的氨基酸取代,并且可以通过亲和力成熟进行进一步的选择以便在与期望的卷曲蛋白结合时具有增加的亲和力和选择性。卷曲蛋白结合部分的非限制性实例包含Fz27和Fz27-B12蛋白。
在特定实施例中,Wnt替代分子包括与特异性结合一个或多个Fzd受体表位的多肽融合的LRP5/6结合区,例如,抗LRP5/6抗体或其抗原结合片段。在特定实施例中,与LRP5/6特异性结合的多肽是抗体或其抗原结合片段。在某些实施例中,其是于2017年12月19日提交的题为“抗LR5/6抗体和使用方法(Anti-LR5/6Antibodies and Methods of Use)”、代理人案卷号为SRZN-005/00US的美国临时专利申请第62/607,879号中公开的抗体或其抗原结合片段,所述美国临时专利申请通过全文引用的方式并入本文。
在特定实施例中,Wnt替代分子的至少一个LRP5/6结合区包含抗体的一个或多个抗原结合片段。例如,一个或多个抗原结合片段可以是或衍生自IgG、scFv、Fab、VHH或sdAb。在某些实施例中,所述一个或多个抗原结合片段是人源化的。
在特定实施例中,LRP5/6结合区包括针对表2A中提供的与LRP5和/或LRP6结合的说明性抗体或其片段中的任一种抗体或其片段公开的三个重链CDR和/或三个轻链CDR。在特定实施例中,LRP5/6结合区包括针对表2A中提供的与LRP5和/或LRP6结合的说明性抗体或其片段中的任一种抗体或其片段公开的三个重链CDR和/或三个轻链CDR,其中CDR共同包括一个、两个、三个、四个、五个、六个、七个或八个氨基酸修饰,例如,取代、缺失或添加。在某些实施例中,LRP5/6结合区是VHH或sdAb或衍生自VHH或sdAb,因此表2A仅包含三个重链CDR。在某些实施例中,LRP5/6结合区包括表2A中所示的三个重链CDR或变体,其中CDR共同包括一个、两个、三个、四个、五个、六个、七个或八个氨基酸修饰。在特定实施例中,LRP5/6结合区包括表2B或SEQ ID NO:74-97中提供的与LRP5和/或LRP6结合的说明性抗体或其片段中任一种抗体或其片段的重链片段和/或轻链片段(或任一者的抗原结合片段或变体)。在某些实施例中,LRP5/6结合区是Fab或衍生自Fab,因此表2B包含VH和CH1序列,但不包含CH2或CH3序列。在某些实施例中,LRP5/6结合区是VHH或sdAb或衍生自VHH或sdAb,因此表2B包含VHH结构域。在某些实施例中,LRP5/6结合区是与这些抗体之一竞争与LRP5和/或LRP6结合的多肽,例如,抗体或其抗原结合片段。
在特定实施例中,LRP5/6结合区包含与表2A、表2B或SEQ ID NO:74-97中所示的任一个序列具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列或其抗原结合片段。测定了表2B中列出的克隆的结合特性,并在表2B中示出。
表2A:抗LRP5/6抗体克隆ID和CDR序列。
表2A,续
表2B.抗LRP5/6抗体克隆ID、重链(HC)Seq ID No以及结合特性。
在某些实施例中,在Wnt替代分子的上下文中,LRP5/6结合区可以选自以为以下的K
其它适合的LRP5/6结合区包含但不限于:重新设计的LRP5/6结合蛋白、抗体衍生的结合蛋白(例如scFv、Fab等)以及与一种或多种Fzd蛋白特异性地结合的抗体的其它部分;VHH或sdAb衍生的结合结构域;基于打结素的工程化支架;天然存在的LRP5/6,包含但不限于DKK1、DKK2、DKK3、DKK4、骨硬化蛋白;Wise;包括上述中的任何一种的融合蛋白;上述中任何一种的衍生物;上述中任何一种的变体;以及上述中任何一种的生物活性片段等。可以亲和选择LRP5/6结合区以增强结合。
Dickkopf(DKK)基因家族的成员(参见Krupnik等人(1999)《基因(Gene)》238(2):301-13)包含DKK-1、DKK-2、DKK-3和DKK-4以及DKK-3相关蛋白Soggy(Sgy)。hDKK 1-4含有两个不同的半胱氨酸富集结构域,其中10个半胱氨酸残基的位置在家族成员之间高度保守。人Dkk基因和蛋白质的示例性序列是可公开获得的,例如Genbank登录号:NM_014419(soggy-1);NM_014420(DKK4);AF177394(DKK-1);AF177395(DKK-2);NM_015881(DKK3);以及NM_014421(DKK2)。在本公开的一些实施例中,LRP6结合部分是DKK1肽,包含但不限于人DKK1的C端结构域。C端结构域可以包括以下序列:KMYHTKGQEGSVCLRSSDCASGLCCARHFWSKICKPVLKEGQVCTKHRRKGSHGLEIFQRCYCGEGLSCRIQKDHHQASNSSRLHTCQRH(SEQ ID NO:2249)(参见Genbank登录号NP_036374)或其生物活性片段。
例如在以下中讨论了DKK蛋白与LRP5/6的结合:Brott和Sokol《分子细胞生物学(Mol.Cell.Biol.)》22(17),6100-6110(2002);以及Li等人《生物化学期刊(J.Biol.Chem.)》277(8),5977-5981(2002),所述文献各自通过引用明确并入本文中。人DKK2(Genbank参考NP_055236)的对应区可以包括以下序列:KMSHIKGHEGDPCLRSSDCIEGFCCARHFWTKICKPVLHQGEVCTKQRKKGSHGLEIFQRCDCAKGLSCKVWKDATYSSKARLHVCQK(SEQ ID NO:2250)或其生物活性片段。
与LRP5或LRP6特异性地结合的抗体是本领域中已知的并且可商购获得或者可以从头产生。LRP5、LRP6或其片段可以用作免疫原或用于筛选测定法以开发抗体。已知抗体的实例包含但不限于以下中描述的那些:Gong等人(2010)《公共科学图书馆综合版(PLoSOne)》。5(9):e12682;Marvin等人(2010)《美国国家科学院院刊》107(35):15473-8;以及可从例如以下商购的那些:圣克鲁兹生物技术公司(Santa Cruz biotechnology)抗体克隆1A12,所述抗体克隆是针对人类来源的合成LRP5/6产生的并且与小鼠和人类来源的LRP6和LRP5的全长和蛋白水解片段两者结合;所述单克隆抗体2B11;对目录号为5731的LRP5(D80F2)具有特异性的信号传导技术公司(Cell Signaling Technology)抗体;等。
在某些实施例中,本文公开的Wnt替代分子包括一个或多个多肽,所示一个或多个多肽包括两个或更多个结合区。例如,两个或更多个结合区可以是两个或更多个Fzd结合区或两个或更多个LRP5/6结合区,或者所述两个或更多个结合区可以包括一个或多个Fzd结合区和一个或多个LRP5/6结合区。结合区可以直接连接或邻接或者可以被接头(例如,多肽接头或非肽接头等)分开。接头的长度以及因此结合结构域之间的间隔可以用于调节信号强度并且可以根据Wnt替代分子的期望用途进行选择。结合结构域之间的加强距离可以有所变化,但在某些实施例中可以小于约100埃、小于约90埃、小于约80埃、小于约70埃、小于约60埃或小于约50埃。在一些实施例中,接头是刚性接头,在其它实施例中,接头是柔性接头。在某些实施例中,在接头是肽接头的情况下,接头在长度上可以为约1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个氨基酸,并且具有足够的长度和氨基酸组成来加强结合结构域之间的距离。在一些实施例中,接头包括一个或多个甘氨酸和/或丝氨酸残基或由其组成。
在特定实施例中,Wnt替代分子包括与SEQ ID NO:109-124或125-157中任一个所公开的多肽序列具有至少90%、至少95%、至少98%或至少99%同一性或与SEQ ID NO:109-124或125-157中任一个所公开的多肽序列的抗原结合片段具有至少90%、至少95%、至少98%或至少99%同一性的多肽序列。在某些实施例中,Wnt替代分子包括SEQ ID NO:109-124或125-147中任一个所示的多肽序列或其抗原结合片段或由其组成。在特定实施例中,抗原结合片段结合一种或多种Fzd受体并且还结合LRP5和/或LRP6。
Wnt替代分子可以例如通过Fc结构域、借助于级联、卷曲螺旋、多肽拉链、生物素/抗生物素蛋白或抗生蛋白链菌素多聚化等来进行多聚化。Wnt替代分子还可以与本领域中已知的如PEG、Fc等部分连接以增强体内稳定性。
在某些实施例中,Wnt替代分子通过与一种或多种Fzd蛋白和LRP5/6结合,特别是通过与细胞表面(例如,人类细胞的表面)上的这些蛋白结合而直接激活典型的Wnt信号传导。Wnt替代分子对Wnt信号传导的直接激活与Wnt信号传导的加强相反,其仅在存在天然Wnt蛋白时才增强活性。
Wnt替代分子例如通过模拟Wnt蛋白与卷曲蛋白结合的作用或活性来激活Wnt信号传导。本公开的Wnt替代分子模拟Wnt活性的能力可以通过多种测定法来证实。Wnt替代分子通常引发与受体的天然配体引发的反应或活性类似或相同的反应或活性。具体地,本公开的Wnt替代分子增强了典型的Wnt/β-连环蛋白信号传导通路。如本文所使用的,术语“增强”是指Wnt/β-连环蛋白信号传导的水平与不存在本公开的Wnt替代分子的情况下的水平相比的可测量增加。
在本领域中已知多种用于测量典型的Wnt/β-连环蛋白信号传导水平的方法。这些方法包含但不限于测量以下的测定法:Wnt/β-连环蛋白靶基因表达;TCF报告基因基因表达;β-连环蛋白稳定;LRP磷酸化;Axin从细胞质向细胞膜转运并与LRP结合。典型的Wnt/β-连环蛋白信号传导通路最终通过转录因子TCF7、TCF7L1、TCF7L2和LEF引起基因表达的变化。在许多细胞和组织中已经表征了对Wnt激活的转录应答。由此,通过本领域众所周知的方法进行的全局转录谱可以用于评定Wnt/β-连环蛋白信号传导激活或抑制。
Wnt应答性基因表达的变化通常由TCF和LEF转录因子介导。TCF报告基因测定法评定TCF/LEF控制基因的转录变化以确定Wnt/β-连环蛋白信号传导的水平。TCF报告基因测定法最早由Korinek,V.等人,1997描述。此方法也称为TOP/FOP,其涉及使用位于最小c-Fos启动子驱动荧光素酶表达上游的最佳TCF基序CCTTTGATC的三个拷贝或突变基序CCTTTGGCC的三个拷贝(分别为pTOPFI_ASH和pFOPFI_ASH),以确定内源性p-连环蛋白/TCF4的反式激活活性。这两个报告基因活性的较高比率(TOP/FOP)指示较高的β-连环蛋白/TCF4活性,而这两个报告基因活性的较低比率指示较低的β-连环蛋白/TCF4活性。
对Wnt信号进行应答的各种其它报告基因转基因在动物中完整存在,并且因此有效地反映了内源性Wnt信号传导。这些报告基因基于多聚化的TCF结合位点,所述多聚的TCF结合位点驱动LacZ或GFP的表达,这可通过本领域已知的方法容易地检测。这些报告基因包含:TOP-GAL、BAT-GAL、ins-TOPEGFP、ins-TOPGAL、LEF-EGFP、Axin2-LacZ、Axin2-d2EGFP、Lgr5tm1(cre/ERT2)、TOPdGFP。
在某些情况下,由与TCF转录因子和TNIK形成复合物介导的去磷酸化β-连环蛋白向膜的募集、β-连环蛋白的稳定化和磷酸化状态以及β-连环蛋白向细胞核的易位(Klapholz-Brown Z等人,《公共科学图书馆期刊》2(9)e945,2007)是Wnt信号传导通路中的关键步骤。稳定化由抑制“破坏”复合物的Disheveled家族蛋白介导,因此减少了细胞内β-连环蛋白的降解,并且此后β-连环蛋白易位到细胞核。因此,测量细胞中β-连环蛋白的水平和位置很好地反映了Wnt/β-连环蛋白信号传导的水平。这种测定法的非限制性实例是“Biolmageβ-连环蛋白重分布测定法”(赛默科技(Thermo Scientific)),其提供稳定表达与增强型绿色荧光蛋白(EGFP)的C端融合的人β-连环蛋白的重组U20S细胞。利用荧光显微镜或HCS平台执行成像和分析,从而允许EGFP-β-连环蛋白的水平和分布可视化。
抑制破坏复合物的另一种方式是通过将Axin募集到Wnt共受体LRP的细胞质尾区来去除Axin。Axin已经表现出优先结合LRP尾区的磷酸化形式。因此,例如用GFP-Axin融合蛋白可视化Axin易位是用于评定Wnt/β-连环蛋白信号传导水平的另一种方法。
在某些实施例中,如在上述测定法中测量的,例如在TOPFIash测定法中测量的,与中性物质诱导的β-连环蛋白信号传导或阴性对照相比,Wnt替代分子将典型的Wnt通路信号传导(例如,β-连环蛋白信号传导)增强或增加至少30%、35%、40%、45%、50%、60%、70%、75%、80%、85%、90%、95%、100%、110%、150%、200%、250%、300%、400%或500%。阴性对照可以包含在这些测定法中。在特定实施例中,在上述测定法中测量时,例如在TOPFIash测定法或本文提及的其它测定法中的任一种测定法中测量时,与不存在Wnt替代分子的情况下的活性相比,Wnt替代分子可以将β-连环蛋白信号传导增强2倍、5倍、10倍、100倍、1000倍、10000倍或更多倍。
当在本文中使用时,“Wnt基因产物”或“Wnt多肽”涵盖天然序列Wnt多肽、Wnt多肽变体、Wnt多肽片段和嵌合Wnt多肽。在特定实施例中,Wnt多肽是天然人全长成熟Wnt蛋白。
例如,本申请中关注的人天然序列Wnt蛋白包含以下:Wnt-1(GenBank登录号NM_005430);Wnt-2(GenBank登录号NM_003391);Wnt-2B(Wnt-13)(GenBank登录号NM_004185(同种型1)、NM_024494.2(同种型2))、Wnt-3(RefSeq.:NM_030753)、Wnt3a(GenBank登录号NM_033131)、Wnt-4(GenBank登录号NM_030761)、Wnt-5A(GenBank登录号NM_003392)、Wnt-5B(GenBank登录号NM_032642)、Wnt-6(GenBank登录号NM_006522)、Wnt-7A(GenBank登录号NM_004625)、Wnt-7B(GenBank登录号NM_058238)、Wnt-8A(GenBank登录号NM_058244)、Wnt-8B(GenBank登录号NM_003393)、Wnt-9A(Wnt-14)(GenBank登录号NM_003395)、Wnt-9B(Wnt-15)(GenBank登录号NM_003396)、Wnt-1 OA(GenBank登录号NM_025216)、Wnt-10B(GenBank登录号NM_003394)、Wnt-11(GenBank登录号NM_004626)、Wnt-16(GenBank登录号NM_016087))。尽管每个成员与家族具有不同程度的序列同一性,但是所有成员均对含有间距高度保守的23-24个保守半胱氨酸残基的较小(即,39-46kD)、酰化、棕榈酰化、分泌的糖蛋白进行编码(McMahon,A P等人、《遗传学趋势(Trends Genet.)》1992;8:236-242;Miller,JR.,《基因组生物学(Genome Biol.)》2002;3(1):3001.1-3001.15)。关注的其它天然序列Wnt多肽包含来自任何哺乳动物的上述直系同源物,所述哺乳动物包含家养和农场动物以及动物园、实验室或宠物动物,如狗、猫、牛、马、绵羊、猪、山羊、兔、大鼠、小鼠、青蛙、斑马鱼、果蝇、蠕虫等。
本文使用的“Wnt通路信号传导”或“Wnt信号传导”指代生物活性Wnt通过其对细胞施加其作用以调节细胞的活性的机制。Wnt蛋白通过与Wnt受体结合来调节细胞活性,所述Wnt受体包含来自蛋白质的卷曲蛋白(Fzd)家族的蛋白质、来自蛋白质的ROR家族的蛋白质、来自蛋白质的LRP家族的蛋白LRP5、LRP6、蛋白FRL1/crypto和蛋白Derailed/Ryk。一旦通过Wnt结合激活,一种或多种Wnt受体就将激活一个或多个细胞内信号传导级联。这些包含典型的Wnt信号传导通路;Wnt/平面细胞极性(Wnt/PCP)通路;Wnt-钙(Wnt/Ca
例如,典型的Wnt信号传导通路的激活引起细胞内蛋白β-连环蛋白的磷酸化的抑制,从而导致β-连环蛋白在细胞溶质中积累,并随后易位到细胞核,在所述细胞核处,β-连环蛋白与转录因子(例如,TCF/LEF)相互作用以激活靶基因。Wnt/PCP通路的激活会激活RhoA、c-Jun N端激酶(JNK)和nemo样激酶(NLK)信号传导级联,以控制如组织极性和细胞运动等生物过程。通过结合Wnt-4、Wnt-5A或Wnt-11激活Wnt/Ca
在某些实施例中,Wnt替代分子的功能性质可以使用技术人员已知的多种方法来评定,所述多种方法包含例如使用体外或体内模型(包含但不限于本文所述的任何体外或体内模型)应答于Wnt、癌细胞和/或肿瘤生长抑制的亲和力/结合测定法(例如,表面等离子体共振、竞争性抑制测定法)、细胞毒性测定法、细胞活力测定法、细胞增殖或分化测定法。还可以测试本文所述的Wnt替代分子对Fzd受体内在化、体外和体内功效等的影响。可以使用技术人员已知的公认的方案或可商购的试剂盒执行此类测定(参见例如《现代分子生物学实验指南》(格林出版联合公司(Greene Publ.Assoc.Inc.)和纽约州纽约市约翰·威利父子公司(John Wiley&Sons,Inc.));《当前免疫学方案》(由纽约州纽约市约翰·威立父子公司的John E.Coligan、Ada M.Kruisbeek、David H.Margulies、Ethan M.Shevach、WarrenStrober 2001编辑);或商业上可获得的试剂盒。
在某些实施例中,Wnt替代分子的Fzd结合区(例如,抗Fzd抗体的抗原结合片段)包括本文所述的抗Fzd抗体的CDR中的一个或多个CDR。在某些实施例中,Wnt替代分子的LRP5/6结合区(例如,抗LRP5/6抗体的抗原结合片段)包括本文所述的抗LRP5/6抗体的CDR中的一个或多个CDR。在这方面,已经表明,在一些情况下,可以仅转移抗体的VHCDR3,同时仍保留所期望的特异性结合(Barbas等人,《美国国家科学院院刊》(1995)92:2529-2533)。还参见McLane等人,《美国国家科学院院刊》(1995)92:5214-5218、Barbas等人,《美国化学会志(J.Am.Chem.Soc)》(1994)116:2161-2162。
本文还公开了一种用于获得对Fzd受体具有特异性的抗体或抗原结合结构域的方法,所述方法包括通过氨基酸序列中的一个或多个氨基酸的添加、缺失、取代或插入来提供本文所示的VH结构域或作为VH结构域的氨基酸序列变体的VH结构域;任选地将由此提供的VH结构域与一个或多个VL结构域组合;以及测试VH结构域或一个或多个VH/VL组合以鉴定特异性结合成员或对一种或多种Fzd受体具有特异性并任选地具有一种或多种期望性质的抗体抗原结合结构域。VL结构域可以具有基本上如本文所示的氨基酸序列。可以采用类似的方法,其中将本文公开的VL结构域的一个或多个序列变体与一个或多个VH结构域组合。
在特定实施例中,Wnt替代分子是水溶性的。“水溶性”意指在不存在清洁剂的情况下可溶于水性缓冲液,通常以提供生物有效剂量的多肽的浓度可溶的组合物。水溶性的组合物形成基本上均质的组合物,所述基本上均质的组合物的比活性为所述基本上均质的组合物从其纯化的起始材料的比活性的至少约5%,通常为起始材料的比活性的至少约10%、20%或30%,更通常为起始材料的比活性的约40%、50%或60%,并且可以为约50%、约90%或更大。本文所公开的Wnt替代分子通常形成浓度为至少25μM或更高,例如,至少25μM、40μM或50μM,通常至少60μM、70μM、80μM或90μM,有时多达100μM、120μM或150μM的基本上均质的水溶液。换句话说,本文所公开的Wnt替代分子通常形成浓度为约0.1mg/ml、约0.5mg/ml、约1mg/ml或更大的基本上均质的水溶液。
与抗体或其抗原结合片段“特异性结合”或“优先结合”(在本文中可互换使用)的抗原或表位是本领域中公知的术语,并且用于确定这种特异性或优先结合的方法也是本领域中公知的。如果分子(例如,Wnt替代分子)与特定细胞或物质比其与替代性细胞或物质更频繁地、更快速地、持续时间更长地和/或亲和力更大地反应或缔合,则所述分子被称为展现出“特异性结合”或“优先结合”。如果分子或其结合区(例如,Wnt替代分子或其结合区)比其与其它物质亲和力更大地、亲合性更高地、更容易地和/或持续时间更长地结合,则所述分子或其结合区与靶抗原(例如,Fzd受体)“特异性结合”或“优先结合”。例如,与Fzd1受体特异性结合或优先结合的Wnt替代分子或其结合区是比其结合其它Fzd受体或非Fzd蛋白亲和力更大地、亲合性更高地、更容易地和/或持续时间更长地结合Fzd1受体的抗体。通过阅读此定义还应理解,例如特异性或优先结合第一靶标的Wnt替代分子或其结合区可以或可以不特异性或优先结合第二靶标。如此,“特异性结合”或“优先结合”不一定需要(尽管其可以包含)排他结合。通常,但不是必然地,提及结合意指优先结合。
在一些实施例中,Wnt替代分子的一个或多个Fzd结合区中的任一个Fzd结合区与一种、两种、三种、四种、五种或更多种不同的卷曲蛋白受体,例如人卷曲蛋白受体Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9、Fzd10中的一种或多种人卷曲蛋白受体结合。在一些实施例中,Fzd结合区中的任一个Fzd结合区与Fzd1、Fzd2、Fzd5、Fzd7和Fzd8结合。在各个实施例中,Fzd结合区中的任一个Fzd结合区与以下结合:(i)Fzd1、Fzd2、Fzd7和Fzd9;(ii)Fzd1、Fzd2和Fzd7;(iii)Fzd5和Fzd8;(iv)Fzd5、Fzd7和Fzd8;(v)Fzd1、Fzd4、Fzd5和Fzd8;(vi)Fzd1、Fzd2、Fzd5、Fzd7和Fzd8;(vii)Fzd4和Fzd9;(viii)Fzd9和Fzd10;(ix)Fzd5、Fzd8和Fzd10;(x)Fzd4、Fzd5和Fzd8;或者(xi)Fzd1、Fzd5、Fzd7和Fzd8。
在一些实施例中,Fzd结合区对关注的一种或多种Fzd受体具有选择性,例如相对于其它Fzd受体,针对一种或多种期望的Fzd受体具有至少10倍、25倍、50倍、100倍、200倍或更多倍的特异性。在一些实施例中,Wnt替代分子的一个或多个Fzd结合区中的任一个Fzd结合区是多特异性的并且与多种Fzd受体(例如,Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9或Fzd10中的两种或更多种)结合或特异性结合。例如,一个或多个Fzd结合区中的任一个可以是双特异性的、三特异性的、四特异性的等。在一些实施例中,Wnt替代分子的一个或多个Fzd结合区中的任一个Fzd结合区是单特异性的并且结合或特异性结合单一Fzd受体,例如仅与以下之一结合或特异性结合:Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9或Fzd10。
在一些实施例中,单特异性Fzd结合区与Fzd受体的区结合,所述区:不包含所述Fzd受体的半胱氨酸富集结构域(CRD);或者包含少于FZD受体的整个CRD。如图2A所展示的,CRD内的序列在10种Fzd受体之间显示出很强的同源性,其中亚家族成员之间的同源性甚至更高。因此,本文公开的单特异性Fzd结合区的某些实施例不结合CRD,或仅结合CRD的子集。
在一些实施例中,Fzd结合区(例如,单特异性Fzd结合区)与包括CRD后胞外结构域的至少一部分的表位结合,所述表位在本文中称为Fzd受体的“铰链区”(参见图2A)。在特定实施例中,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或100%的表位存在于Fzd受体的铰链区内。如图4A-4E所展示的,Fzd受体的胞外结构域的铰链区显示出高度趋异的序列。SEQ ID NO:98-107和下表3中示出了说明性Fzd受体铰链区的序列。在某些实施例中,所述铰链区包括与SEQ ID NO:98-107中所示的任一个序列具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。
表3:Fzd铰链区序列
在一些实施例中,单特异性Fzd结合区结合包括Fzd受体的CRD的上游的N端区的至少一部分的表位(图2A)。在特定实施例中,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或100%的表位存在于Fzd受体的N端区内。SEQ ID NO:108和下表4示出了说明性N端区的序列。在某些实施例中,N端区包含与SEQ ID NO:108具有至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。
表4:Fzd N端区序列
在一些实施例中,Wnt替代分子的一个或多个LRP5/6结合区中的任一个结合区与LRP5/6中的一个或两个结合。为了方便起见,术语“LRP5/6”用于共同地指代LRP5和/或LRP6中的任一个或两个。
免疫结合通常是指在免疫球蛋白分子与免疫球蛋白对其具有特异性的抗原之间例如举例来说但不限于由于静电、离子、亲水和/或疏水吸引或排斥、位阻力、氢键结合、范德华力和其它相互作用而发生的类型的非共价相互作用。可以在相互作用的解离常数(K
在某些实施例中,本文所述的Wnt替代分子或其结合区具有小于约10,000nM、小于约1000nM、小于约100nM、小于约10nM、小于约1nM、小于约0.1nM、小于约0.01nM、小于约0.001nM、小于约0.0001nM、小于约0.00001nM、或小于约0.000001nM的亲和力,并且在一些实施例中,抗体可以具有对一个或多个Fzd受体表位或LRP5或LRP6受体的甚至更高的亲和力。
免疫球蛋白的恒定区表现出比可变区少的序列多样性,并且负责结合许多天然蛋白以引发重要的生化事件。在人类中,存在五种不同类别的抗体,包含IgA(其包含亚类IgA1和IgA2)、IgD、IgE、IgG(其包含亚类IgG1、IgG2、IgG3和IgG4)和IgM。这些抗体类别之间的区别特征是其恒定区,但是V区可以存在细微差异。
抗体的Fc区与许多Fc受体和配体相互作用,从而赋予一系列重要的被称为效应子功能的功能能力。对于IgG,Fc区包括Ig结构域CH2和CH3以及通向CH2的N端铰链。IgG类别的Fc受体的重要家族是Fcγ受体(FcγR)。这些受体介导抗体与免疫系统的细胞免疫部分(cellular arm)之间的通讯(Raghavan等人,1996,《细胞和发育生物学年度评论(Annu RevCell Dev Biol)》12:181-220;Ravetch等人,2001,《免疫学年度评论(Annu Rev Immunol)》19:275-290)。在人类中,这种蛋白质家族包含:FcγRI(CD64),其包含同种型FcγRIa、FcγRIb和FcγRIc;FcγRII(CD32),其包含同种型FcγRIIa(包含同种异型H131和R131)、FcγRIIb(包含FcγRIIb-1和FcγRIIb-2)和FcγRIIc;以及FcγRIII(CD16),其包含同种型FcγRIIIa(包含同种异型V158和F158)和FcγRIIIb(包含同种异型FcγRIIIb-NA1和FcγRIIIb-NA2)(Jefferis等人,2002,《免疫学快报(Immunol Lett)》82:57-65)。这些受体通常具有介导与Fc结合的细胞外结构域、跨膜区和可以介导细胞内的一些信号传导事件的细胞内结构域。这些受体在各种免疫细胞中表达,所述免疫细胞包含单核细胞、巨噬细胞、嗜中性粒细胞、树突细胞、嗜酸性粒细胞、肥大细胞、血小板、B细胞、大颗粒淋巴细胞、朗格汉斯细胞、自然杀伤(NK)细胞和T细胞。Fc/FcγR复合物的形成将这些效应细胞募集到结合抗原的位点,从而通常产生细胞内的信号传导事件和重要的后续免疫应答,如炎症介质的释放、B细胞激活、内吞作用、吞噬作用和细胞毒性攻击。
介导细胞毒性和吞噬效应子功能的能力是抗体破坏靶细胞的潜在机制。其中表达FcγR的非特异性细胞毒性细胞识别靶细胞上的结合抗体并随后引起靶细胞裂解的细胞介导的反应被称为抗体依赖性细胞介导的细胞毒性(ADCC)(Raghavan等人,1996,《细胞和发育生物学年度评论》12:181-220;Ghetie等人,2000,《免疫学年度评论》18:739-766;Ravetch等人,2001,《免疫学年度评论》19:275-290)。其中表达FcγR的非特异性细胞毒性细胞识别靶细胞上的结合抗体并随后引起靶细胞吞噬作用的细胞介导的反应被称为抗体依赖性细胞介导的吞噬作用(ADCP)。所有FcγR在Cg2(CH2)结构域和之前的铰链的N端末端处结合Fc上的相同区。这种相互作用在结构上得到了很好的表征(Sondermann等人,2001,《分子生物学杂志》309:737-749),并且已经解决了与人FcγRIIIb细胞外结构域结合的人Fc的若干种结构(pdb登录码1E4K)(Sondermann等人,2000,《自然》406:267-273)。(pdb登录码1IIS和1IIX)(Radaev等人,2001,《生物化学杂志》276:16469-16477)。
不同的IgG亚类对FcγR具有不同的亲和力,与IgG2和IgG4相比,IgG1和IgG3通常明显更好地与受体结合(Jefferis等人,2002,《免疫学快报》82:57-65)。所有FcγR与IgGFc上的相同区结合,但亲和力不同:高亲和力结合体FcγRI对IgG1的K
Fc区也参与补体级联的激活。在经典的补体通路中,C1利用其C1q亚基结合已与一个或多个抗原形成复合物的IgG或IgM的Fc片段。在本公开的某些实施例中,对Fc区的修饰包括改变(增强或降低)本文所述的Fzd特异性抗体激活补体系统的能力的修饰(参见例如美国专利第7,740,847号)。为了评估补体活化,可以进行补体依赖性细胞毒性(CDC)测定(参见例如,Gazzano-Santoro等人,《免疫学方法杂志(J.Immunol.Methods)》,202:163(1996))。
因此,在某些实施例中,本公开提供了具有经修饰的Fc区的抗Fzd抗体,其具有改变的功能性质,如降低或增强的CDC、ADCC或ADCP活性或增强的对特定FcγR的结合亲和力或增加的血清半衰期。在以下中描述了本文设想的其它修饰的Fc区,例如,发布的美国专利第7,317,091号;第7,657,380号;第7,662,925号;第6,538,124号;第6,528,624号;第7,297,775号;第7,364,731号;公开的美国申请第US2009092599号;第US20080131435号;第US20080138344号;以及公开的国际申请第WO2006/105338号;第WO2004/063351号;第WO2006/088494号;第WO2007/024249号。
在某些实施例中,Wnt替代分子包括具有期望结合特异性的与免疫球蛋白恒定结构域序列融合的抗体可变结构域。在某些实施例中,融合是与包括铰链区、C
还可以修饰本文公开的Wnt替代分子以包含例如用于纯化或诊断应用的表位标签或标记。存在许多本领域已知的用于制备抗体缀合物的连接基团,包含例如在美国专利第5,208,020号或欧洲专利0 425 235 B1和Chari等人,《癌症研究》52:127-131(1992)中公开的连接基团。如上述专利中所公开的,连接基团包含二硫基、硫醚基、酸不稳定基团、光不稳定基团、肽酶不稳定基团或酯酶不稳定基团,优选二硫基和硫醚基。
在某些实施例中,存在于Wnt替代分子内的抗LRP5/6抗体和其抗原结合片段和/或抗Fzd抗体和其抗原结合片段是单克隆的。在某些实施例中,其是人源化的。
在某些实施例中,本公开进一步提供了一种对存在于本文公开的Wnt替代分子中的多肽进行编码的分离的核酸。核酸包含DNA和RNA。这些和相关的实施例可以包含对结合本文所述的一种或多种Fzd受体和/或LRP5或LRP6的抗体片段进行编码的多核苷酸。如本文所使用的术语“分离的多核苷酸”应意指基因组、cDNA或合成来源的多核苷酸或其某种组合,由于其来源,分离的多核苷酸:(1)不与多核苷酸的全部或一部分缔合,其中在自然界中发现所述分离的多核苷酸;(2)与其在自然界中不与之连接的多核苷酸连接;或者(3)在自然界中不作为更大序列的一部分出现。分离的多核苷酸可以包含天然存在的序列和/或人工序列。
术语“可操作地连接”意指所述术语所应用的组分处于允许它们在适当条件下执行其固有功能的关系。例如,将与蛋白质编码序列“可操作地连接”的转录控制序列连接到其上,从而在与控制序列的转录活性相容的条件下实现蛋白质编码序列的表达。
如本文所使用的术语“控制序列”是指可以影响与其连接或可操作地连接的编码序列的表达、加工或细胞内定位的多核苷酸序列。此类控制序列的性质可以取决于宿主生物体。在特定实施例中,原核生物的转录控制序列可以包含启动子、核糖体结合位点和转录终止序列。在其它特定实施例中,真核生物的转录控制序列可以包含启动子,所述启动子包括针对转录因子、转录增强子序列、转录终止序列和聚腺苷酸化序列的一个或多个识别位点。在某些实施例中,“控制序列”可以包含前导序列和/或融合配偶体序列。
本文所提及的术语“多核苷酸”意指单链或双链核酸聚合物。在某些实施例中,包括多核苷酸的核苷酸可以是核糖核苷酸或脱氧核糖核苷酸或任一种核苷酸类型的经修饰形式。所述修饰包含碱基修饰,如溴尿嘧啶核苷、核糖修饰,如阿拉伯糖苷和2',3'-二脱氧核糖以及核苷酸间键合修饰,如硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、硫代苯胺磷酸酯(phosphoroanilothioate)、苯胺磷酸酯(phoshoraniladate)和氨基磷酸酯。术语“多核苷酸”具体包含DNA的单链和双链形式。
术语“天然存在的核苷酸”包含脱氧核糖核苷酸和核糖核苷酸。术语“经修饰的核苷酸”包含具有经修饰的或取代的糖基等的核苷酸。术语“寡核苷酸键”包含寡核苷酸键,如硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、硫代苯胺磷酸酯、苯胺磷酸酯、氨基磷酸酯等。参见例如,LaPlanche等人,1986,《核酸研究(Nucl.Acids Res.)》,14:9081;Stec等人,1984,《美国化学会志》,106:6077;Stein等人,1988,《核酸研究》,16:3209;Zon等人,1991,《抗癌药物研制(Anti-Cancer Drug Design)》,6:539;Zon等人,1991,《寡核苷酸和类似物:实用方法(OLIGONUCLEOTIDES AND ANALOGUES:A PRACTICAL APPROACH)》,第87-108页(F.Eckstein编辑),英国牛津大学,牛津大学出版社;Stec等人,美国专利第5,151,510号;Uhlmann和Peyman,1990,《化学评论(Chemical Reviews)》,90:543,出于任何目的其公开内容通过引用并入本文中。寡核苷酸可以包含可检测的标记,以使得能够检测寡核苷酸或其杂化。
术语“载体”用于指代用于将编码信息转移到宿主细胞的任何分子(例如,核酸、质粒或病毒)。术语“表达载体”是指适合于转化宿主细胞并含有引导和/或控制插入的异源核酸序列的表达的核酸序列的载体。如果存在内含子,则表达包含但不限于如转录、翻译和RNA剪接等过程。
如本领域技术人员将理解的,多核苷酸可以包含表达或可以适于表达蛋白质、多肽、肽等的基因组序列、基因组外和质粒编码的序列以及较小的工程化基因节段。此类节段可以是天然分离的或者由本领域技术人员合成修饰。
如本领域技术人员还将认识到的,多核苷酸可以是单链(编码或反义)或双链的,并且可以是DNA(基因组、cDNA或合成的)或RNA分子。RNA分子可以包含含有内含子并以一对一方式对应于DNA分子的HnRNA分子,以及不含有内含子的mRNA分子。另外的编码或非编码序列可以但不必存在于根据本公开的多核苷酸内,并且多核苷酸可以但不必连接到其它分子和/或支持材料。多核苷酸可以包括天然序列或可以包括对此序列的变体或衍生物进行编码的序列。
本领域的普通技术人员应理解,由于遗传密码的简并性,存在许多对本文所述的抗体进行编码的核苷酸序列。这些多核苷酸中的一些多核苷酸与对Wnt替代分子内的多肽进行编码的天然或原始多核苷酸序列的核苷酸序列具有最小的序列同一性。然而,本公开明确设想了由于密码子使用的差异而变化的多核苷酸。在某些实施例中,具体设想了已经针对哺乳动物表达进行了密码子优化的序列。
因此,在本公开的另一个实施例中,如位点特异性诱变等诱变方法可以用于制备本文所述的多肽的变体和/或衍生物。通过这种方法,多肽序列的特异性修饰可以通过诱变对其进行编码的基础多核苷酸来进行。这些技术提供了一种用于通过将一个或多个核苷酸序列改变引入多核苷酸中来制备和测试序列变体(例如,包括了上述考虑因素中的一个或多个考虑因素)的直接方法。
位点特异性诱变允许通过以下来产生突变体:使用对期望突变的DNA序列进行编码的特异性寡核苷酸序列以及足够数量的相邻核苷酸,以提供具有足够大小和序列复杂性的引物序列,从而形成在遍历的缺失连接部两侧的稳定双链体。可以在所选的多核苷酸序列中采用突变以改善、改变、减少、修饰或以其它方式改变多核苷酸本身的性质和/或改变所编码多肽的性质、活性、组成、稳定性或一级序列。
在某些实施例中,本发明人设想了诱变对存在于Wnt替代分子中的多肽进行编码的多核苷酸序列,以改变编码的多肽的一种或多种性质,如结合亲和力或特定Fc区的功能或Fc区对特定FcγR的亲和力。位点特异性诱变技术是本领域中公知的,并且广泛用于产生多肽和多核苷酸的变体。例如,位点特异性诱变通常用于改变DNA分子的特定部分。在此类实施例中,采用在长度上通常包括约14个到约25个核苷酸左右的引物,其中在序列的连接部的两侧上约5个到约10个残基被改变。
如本领域技术人员将理解的,位点特异性诱变技术通常采用以单链和双链形式存在的噬菌体载体。可用于定点诱变的典型载体包含如M13噬菌体等载体。这些噬菌体可以容易地商购获得,并且其用途通常是本领域技术人员公知的。双链质粒还通常用于消除了将目的基因从质粒转移到噬菌体的步骤的定点诱变。
使用定点诱变制备所选的编码肽的DNA节段的序列变体提供了一种产生潜在有用物种的手段,但并不意味着进行限制,因为还存在可以获得肽和对其进行编码的DNA序列的序列变体的其它方法。例如,可以用如羟胺等诱变剂处理对期望肽序列进行编码的重组载体以获得序列变体。关于这些方法和方案的具体细节发现于以下的教导中:Maloy等人,1994;Segal,1976;Prokop和Bajpai,1991;Kuby,1994;以及Maniatis等人,1982,出于所述目的,每个通过引用并入本文中。
在许多实施例中,将对Wnt替代分子的多肽进行编码的一种或多种核酸直接引入宿主细胞种,并且在足以诱导编码的多肽的表达的条件下培育细胞。可以使用本领域技术人员熟知的标准技术并与本文提供的多肽和核酸序列组合来制备本公开的Wnt替代多肽。多肽序列可以用于确定对由此公开的特定多肽进行编码的适当核酸序列。根据本领域技术人员公知的标准方法,可以优化核酸序列以反映各种表达系统的特定密码子“偏好”。
根据某些相关实施例,提供了一种重组宿主细胞,所述重组宿主细胞包括一种或多种本文所述的构建体,例如,包括对Wnt替代分子或其多肽进行编码的核酸的载体;以及一种产生经过编码的产物的方法,所述方法包括由其编码核酸进行表达。可以通过在适当的条件下培养含有核酸的重组宿主细胞方便地实现表达。在通过表达产生后,抗体或其抗原结合片段可以使用任何适合的技术分离和/或纯化,并且然后根据需要使用。
多肽以及编码核酸分子和载体可以例如从其天然环境中分离和/或纯化,其呈基本上纯净或均质的形式,或者在核酸的情况下,不含或基本上不含除了对具有期望功能的多肽进行编码的序列以外的原始核酸或基因。核酸可以包括DNA或RNA,并且可以是全部或部分合成的。除非上下文另外要求,否则提及本文所示的核苷酸序列涵盖具有指定序列的DNA分子,并且涵盖具有其中U取代了T的指定序列的RNA分子。
用于在各种不同宿主细胞中克隆和表达多肽的系统是公知的。适合的宿主细胞包含细菌、哺乳动物细胞、酵母和杆状病毒系统。在本领域中可获得的用于表达异源多肽的哺乳动物细胞系包含中国仓鼠卵巢细胞、HeLa细胞、幼仓鼠肾细胞、NSO小鼠黑素瘤细胞等。常见的优选细菌宿主是大肠杆菌。
在本领域中已很好地建立了如大肠杆菌等原核细胞中的多肽(例如,抗体和其抗原结合片段)的表达。关于综述,参见例如Pluckthun,《生物技术》9:545-551(1991)。培养的真核细胞中的表达对于本领域技术人员而言也可用作为产生抗体或其抗原结合片段的选择,参见最近的综述,例如Ref,M.E.(1993)《生物技术当前评述(Curr.Opinion Biotech.)》4:573-576;Trill J.J.等人(1995)《生物技术当前评述》6:553-560。
适当时,可以选择或构建含有适当的调节序列(包含启动子序列、终止子序列、多腺苷酸化序列、增强子序列、标记基因)和其它序列的合适的载体。载体可以根据需要是质粒、病毒,例如噬菌体或噬菌粒。关于进一步细节,参见例如《分子克隆:实验室手册》第2版,Sambrook等人,1989,冷泉港实验室出版社(Cold Spring Harbor Laboratory Press)。《现代分子生物学实验指南》,第二版,Ausubel等人编辑,约翰威利父子公司,1992或其后续更新详细描述了用于例如在制备核酸构建体、诱变、测序、将DNA引入细胞中和基因表达以及蛋白质分析中操控核酸的许多已知技术和方案。
术语“宿主细胞”用于指代在其中已经引入或能够引入对本文所述多肽中的一种或多种多肽进行编码的核酸序列的细胞,并且所述细胞进一步表达或能够表达关注的所选基因,如对任何本文所述多肽进行编码的基因。所述术语包含亲本细胞的子代,无论所述子代是否在形态上或遗传构成上与原始亲本相同,只要存在所选基因即可。因此,还设想了包括将这种核酸引入宿主细胞中的方法。引入可以采用任何可用的技术。对于真核细胞,适合的技术可以包含磷酸钙转染、DEAE-葡聚糖、电穿孔、脂质体介导的转染和使用逆转录病毒或其它病毒(例如,牛痘或针对昆虫细胞的病毒、杆状病毒)的转导。对于细菌细胞,适合的技术可以包含氯化钙转化、电穿孔和使用噬菌体的转染。在引入之后,可以引起或允许例如通过在表达基因的条件下培养宿主细胞从核酸表达。在一个实施例中,核酸被整合到宿主细胞的基因组(例如,染色体)中。根据标准技术,可以通过包含促进与基因组重组的序列来促进整合。
在某些实施例中,本公开还提供了一种方法,所述方法包括在表达系统中使用如上所述的构建体以表达特定多肽,如本文所述的Wnt模拟分子。术语“转导”用于指代基因通常通过噬菌体从一种细菌转移到另一种细菌。“转导”还指代通过逆转录病毒获取和转移真核细胞序列。术语“转染”用于指代细胞对外来或外源DNA的摄取,并且当外源DNA已经被引入细胞膜内部时,细胞已经被“转染”。许多转染技术是本领域中公知的并且在本文中公开。参见例如Graham等人,1973,《病毒学(Virology)》52:456;Sambrook等人,2001,《分子克隆,实验室手册》,冷泉港实验室;Davis等人,1986,《分子生物学基础方法(BASIC METHODS INMOLECULAR BIOLOGY)》,爱思唯尔(Elsevier);以及Chu等人,1981,《基因》13:197。此类技术可以用于将一个或多个外源DNA部分引入适合的宿主细胞中。
如本文所使用的术语“转化”是指细胞遗传特性的改变,并且当细胞已经被修饰以含有新的DNA时,所述细胞已经被转化。例如,在将细胞从其天然状态进行遗传修饰的情况下,所述细胞被转化。在转染或转导后,转化DNA可以通过物理整合到细胞的染色体中而与细胞的DNA重组,或者可以作为附加型元件短暂地维持而不被复制,或者可以作为质粒独立复制。当DNA随着细胞分裂而复制时,认为细胞已经稳定转化。当与如核酸分子、多肽、宿主细胞等生物材料结合使用时,术语“天然存在的”或“天然的”是指在自然界发现并且未被人类操控的材料。类似地,如本文所使用的“非天然存在的”或“非天然的”是指在自然界中未发现或已被人类结构修饰或合成的材料。
术语“多肽”、“蛋白质”和“肽”以及“糖蛋白”可互换使用并且意指不限于任何特定长度的氨基酸的聚合物。所述术语不排除如豆蔻酰化、硫酸化、糖基化、磷酸化和信号序列的添加或缺失等修饰。术语“多肽”或“蛋白质”意指一个或多个氨基酸链,其中每个链包括通过肽键共价连接的氨基酸,并且其中所述多肽或蛋白质可以包括多个通过肽键非共价和/或共价连接且具有天然蛋白质序列的链,即,由天然存在的以及特别是非重组细胞、或基因工程或重组细胞产生的蛋白质,并且包括具有天然蛋白质的氨基酸序列的分子、或具有天然序列的一个或多个氨基酸的缺失、添加和/或取代的分子。术语“多肽”和“蛋白质”具体涵盖与本文公开的Fzd受体或LRP5或LRP6受体结合的Wnt替代分子、其Fzd结合区、其LRP5/6结合区、抗体和其抗原结合片段,或具有这些多肽中的任一种多肽的一个或多个氨基酸的缺失、添加和/或取代的序列。因此,“多肽”或“蛋白质”可以包括一个(称为“单体”)或多个(称为“多聚体”)氨基酸链。
本文提及的术语“分离的蛋白质”、“分离的Wnt替代分子”或“分离的抗体”意指主题蛋白质、Wnt替代分子或抗体:(1)不含至少一些通常在自然界中发现的其它蛋白质;(2)基本上不含来自相同来源,例如来自相同物种的其它蛋白质;(3)由来自不同物种的细胞表达;(4)已经从至少约50%的多核苷酸、脂类、碳水化合物或与其在自然界中缔合的其它物质中分离出来;(5)不在自然界中与“分离的蛋白质”缔合的蛋白质的部分缔合(通过共价或非共价相互作用);(6)与在自然界中不与其缔合的多肽可操作地缔合(通过共价或非共价相互作用);或者(7)不在自然界发生。此类分离的蛋白质可以由基因组DNA、cDNA、mRNA或其它RNA编码,或者可以具有合成来源,或其任何组合。在某些实施例中,分离的蛋白质可以包括天然存在的多肽序列和/或人工多肽序列。在某些实施例中,分离的蛋白质基本上不含在其天然环境中会发现的且会干扰其使用(治疗、诊断、预防、研究或其它)的蛋白质或多肽或其它污染物。
设想了本文描述的多肽(例如,Wnt替代分子或其Fzd结合区或LRP5/6结合区)中的任一种多肽的一个或多个氨基酸序列修饰。例如,可能期望改善Wnt替代分子的结合亲和力和/或其它生物学性质。例如,可以通过将适当的核苷酸改变引入对抗体或其链进行编码的多核苷酸中或通过肽合成来制备Wnt替代分子的氨基酸序列变体。此类修饰包含例如抗体的氨基酸序列内的残基的缺失和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以获得最终Wnt替代分子,条件是最终构建体具有期望特性(例如,与一种或多种Fzd和/或LRP5/6受体结合的高亲和力)。氨基酸变化还可以改变抗体的翻译后过程,如改变糖基化位点的数量或位置。上文描述的本公开的多肽的变体和修饰中的任一种可以包含在本公开的抗体中。
本公开提供了本文公开的多肽(例如,Wnt替代分子或其Fzd结合区或LRP5/6结合区,或抗体或其抗原结合片段)中的任一种多肽的变体。在某些实施例中,变体与本文公开的多肽具有至少90%、至少95%、至少98%或至少99%同一性。在某些实施例中,此类变体多肽与一种或多种Fzd受体和/或一种或多种LRP5/6受体的结合为相对于本文具体所示的Wnt替代分子与一种或多种Fzd受体和/或一种或多种LRP5/6受体的结合的至少约50%、至少约70%,并且在某些实施例中至少约90%。在另外的实施例中,此类变体Wnt替代分子以比本文所示的Wnt替代分子更大的亲和力与一种或多种Fzd受体和/或一种或多种LRP5/6受体结合,例如,其结合定量地为相对于本文具体所示的抗体序列的结合的至少约105%、106%、107%、108%、109%或110%。
在特定实施例中,Wnt替代分子或其结合区,例如Fab、scFv或VHH或sdAb可以包括:a)重链可变区,所述重链可变区包括:i.CDR1区,所述CDR1区的氨基酸序列与本文所述的所选抗体的重链CDR1区的氨基酸序列相同;ii.CDR2区,所述CDR2区的氨基酸序列与所选抗体的重链CDR2区的氨基酸序列相同;以及iii.CDR3区,所述CDR3区的氨基酸序列与所选抗体的重链CDR3区的氨基酸序列相同;和/或b)轻链可变结构域,所述轻链可变结构域包括:i.CDR1区,所述CDR1区的氨基酸序列与所选抗体的轻链CDR1区的氨基酸序列相同;ii.CDR2区,所述CDR2区的氨基酸序列与所选抗体的轻链CDR2区的氨基酸序列相同;以及iii.CDR3区,所述CDR3区的氨基酸序列与所选抗体的轻链CDR3区的氨基酸序列相同;其中抗体特异性结合选定的靶(例如,一个或多个Fzd受体表位或LRP5或LRP6受体)。在另外的实施例中,所述抗体或其抗原结合片段是变体抗体或其抗原结合片段,其中除了VH和VL区的CDR区中的至多8个、9个、10个、11个、12个、13个、14个、15个或更多个氨基酸取代之外,所述变体包括与所选抗体相同的重链和轻链。在这方面,在所选抗体的CDR区中可以存在1个、2个、3个、4个、5个、6个、7个、8个氨基酸取代,或在某些实施例中,9个、10个、11个、12个、13个、14个、15个或更多个氨基酸取代。取代可以在VH和/或VL区中的CDR中。(参见例如,Muller,1998,《结构》6:1153-1167)。
在特定实施例中,Wnt替代分子或其结合区,例如Fab、scFv或VHH或sdAb可以具有:a)重链可变区,所述重链可变区具有与本文所述的抗体或其抗原结合片段的重链可变区至少80%相同、至少95%相同、至少90%、至少95%或至少98%或99%相同的氨基酸序列;和/或b)轻链可变区,所述轻链可变区具有与本文所述的抗体或其抗原结合片段的轻链可变区至少80%相同、至少85%相同、至少90%、至少95%或至少98%或99%相同的氨基酸序列。其说明性抗原结合片段的氨基酸序列在SEQ ID NO:1-97和109-157中示出。
多肽与另一种多肽具有一定的“序列同一性”百分比,这意味着在进行比对时,当比较两个序列时,氨基酸的百分比是相同的。序列类似性可以通过多种不同的方式来确定。为了确定序列同一性,可以使用包含可通过万维网ncbi.nlm.nih.gov/BLAST/获得的BLAST在内的方法和计算机程序来比对序列。另一种比对算法是FASTA,可从牛津分子集团有限公司(Oxford Molecular Group,Inc.)的全资子公司、来自美国威斯康星州麦迪逊市(Madison,Wis.,USA)的遗传学计算机集团(Genetics Computing Group)(GCG)的软件包中获得。以下中描述了用于比对的其它技术:《酶学方法(Methods in Enzymology)》,第266卷:用于大分子序列分析的计算机方法(Computer Methods for MacromolecularSequence Analysis)(1996),Doolittle编,学术出版社有限公司(Academic Press,Inc.),美国加利福尼亚州圣地亚哥哈考特布瑞斯公司(Harcourt Brace&Co.,San Diego,Calif.,USA)的分公司。特别关注了允许序列中有空位的比对程序。Smith-Waterman是允许序列比对中有空位的一种类型的算法。参见《分子生物学方法(Meth.Mol.Biol.)70:173-187(1997)。而且,可以利用使用Needleman和Wunsch比对方法的GAP程序来比对序列。参见《分子生物学期刊(J.Mol.Biol.)》48:443-453(1970)。
关注了使用Smith和Waterman的局部同源性算法(《应用数学进展(Advances inApplied Mathematics)》2:482-489(1981))来确定序列一致性的BestFit程序。空位生成罚分的范围通常将为1到5,经常为2到4并且在许多实施例中将为3。空位生成罚分的范围通常将为0.01到0.20并且在许多情况下将为0.10。程序具有由输入以进行比较的序列确定的默认参数。优选地,序列同一性是使用由程序确定的默认参数来确定的。此程序也可从来自美国威斯康星州麦迪逊市的遗传学计算集团(GCG)的软件包获得。
关注的另一个程序是FastDB算法。以下中描述了FastDB:序列比较和分析的当前方法(Current Methods in Sequence Comparison and Analysis),《大分子测序与合成所选方法与应用(Macromolecule Sequencing and Synthesis,Selected Methods andApplications)》,第127-149页,1988,Alan R.Liss有限公司(Alan R.Liss,Inc.)。基于以下参数通过FastDB来计算序列同一性百分比:
不匹配罚分:1.00;空位罚分:1.00;空位大小罚分:0.33;以及连接罚分:30.0。
在特定实施例中,Wnt替代分子或其结合区,例如Fab、scFv或VHH或sdAb可以包括:a)重链可变区,所述重链可变区包括:i.CDR1区,所述CDR1区的氨基酸序列与本文所述的所选抗体的重链CDR1区的氨基酸序列相同;ii.CDR2区,所述CDR2区的氨基酸序列与所选抗体的重链CDR2区的氨基酸序列相同;以及iii.CDR3区,所述CDR3区的氨基酸序列与所选抗体的重链CDR3区的氨基酸序列相同;以及b)轻链可变结构域,所述轻链可变结构域包括:i.CDR1区,所述CDR1区的氨基酸序列与所选抗体的轻链CDR1区的氨基酸序列相同;ii.CDR2区,所述CDR2区的氨基酸序列与所选抗体的轻链CDR2区的氨基酸序列相同;以及iii.CDR3区,所述CDR3区的氨基酸序列与所选抗体的轻链CDR3区的氨基酸序列相同;其中所述抗体特异性结合所选靶标(例如,Fzd受体,如Fzd1)。在另外的实施例中,抗体或其抗原结合片段是变体抗体,其中除了VH和VL区的CDR区中的至多8个、9个、10个、11个、12个、13个、14个、15个或更多个氨基酸取代之外,所述变体包括与所选抗体相同的重链和轻链。在这方面,在所选抗体的CDR区中可以存在1个、2个、3个、4个、5个、6个、7个、8个氨基酸取代,或在某些实施例中,9个、10个、11个、12个、13个、14个、15个或更多个氨基酸取代。取代可以在VH和/或VL区中的CDR中。(参见例如,Muller,1998,《结构》6:1153-1167)。
代表性多肽(例如,本文提供的Wnt替代分子的变体Fzd结合区或LRP5/6结合区)的三维结构的确定可以通过常规方法进行,使得例如,利用所选的天然或非天然氨基酸进行的一个或多个氨基酸的取代、添加、缺失或插入可以出于确定如此衍生的结构变体是否保留当前公开的物种的空间填充性质的目的来虚拟地建模。参见例如Donate等人,1994,《保护科学(Prot.Sci.)》3:2378;Bird等人,《科学》309:1868-1871(2005);Schueler-Furman等人,《科学》310:638(2005);Dietz等人,《美国国家科学院院刊》103:1244(2006);Dodson等人,《自然》450:176(2007);Qian等人,《自然》450:259(2007);Raman等人,《科学》327:1014-1018(2010)。可以用于这些和相关实施例(如用于结合区的合理设计)的计算机算法的一些另外非限制性实例包含VMD,其是用于使用3-D图形和内置脚本显示、动画化并分析大生物分子系统的分子可视化程序,(参见伊利诺伊大学厄巴纳-香槟分校的理论和计算生物物理小组(the Theoretical and Computational Biophysics Group,University ofIllinois at Urbana-Champagne)的网站ks.uiuc.edu/Research/vmd/。许多其它计算机程序是本领域已知的并可供技术人员使用并且允许根据能量最小化构象的空间填充模型(范德华半径(van der Waals radii))确定原子尺度;试图确定针对不同化学基团的高亲和力区从而增强结合的GRID、计算数学比对的蒙特卡罗搜索(Monte Carlo searches)以及评估力场计算的CHARMM(Brooks等人(1983)《计算化学杂志(J.Comput.Chem.)》4:187-217)和AMBER(Weiner等人(1981)《计算化学杂志》106:765)以及分析(还参见Eisenfield等人(1991)《美国生理学杂志(Am.J.Physiol.)》261:C376-386;Lybrand(1991)《药学与生命科学杂志(J.Pharm.Belg.)》46:49-54;Froimowitz(1990)《生物技术(Biotechniques)》8:640-644;Burbam等人(1990)《蛋白质(Proteins)》7:99-111;Pedersen(1985)《环境健康视角(Environ.Health Perspect.)》61:185-190;以及Kini等人(1991)《生物分子结构与动力学杂志(J.Biomol.Struct.Dyn.)》9:475-488。各种合适的计算计算机程序也可以从例如
还公开了包括本文所描述的Wnt替代分子和一种或多种药学上可接受的稀释剂、载剂或赋形剂的药物组合物。在特定实施例中,所述药物组合物进一步包括一种或多种Wnt多肽或Norrin多肽。
在进一步的实施例中,还公开了包括多核苷酸和一种或多种药学上可接受的稀释剂、载剂或赋形剂的药物组合物,所述多核苷酸包括对本文所描述的Wnt替代分子进行编码的核酸序列。在特定实施例中,药物组合物进一步包括一种或多种多核苷,所述一种或多种多核苷酸包括对Wnt多肽或Norrin多肽进行编码的核酸序列。在某些实施例中,多核苷酸是DNA或mRNA,例如经修饰的mRNA。在特定实施例中,多核苷酸是进一步包括5'帽序列和/或3'拖尾序列(例如polyA尾)的经修饰的mRNA。在其它实施例中,多核苷酸是包括与编码序列操作性地连接的启动子的表达盒。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的多核苷酸中。
在进一步的实施例中,还公开了包括表达载体例如病毒载体和一种或多种药学上可接受的稀释剂、载剂或赋形剂的药物组合物,所述载体包括多核苷酸,所述多核苷酸包括对本文所描述的Wnt替代分子进行编码的核酸序列。在特定实施例中,药物组合物进一步包括表达载体(例如,病毒载体),所述表达载体包括多核苷酸,所述多核苷酸包括对Wnt多肽或Norrin多肽进行编码的核酸序列。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的多核苷酸(例如,表达盒)中。
本公开进一步设想了包括细胞和一种或多种药学上可接受的稀释剂、载剂或赋形剂的药物组合物,所述细胞包括表达载体,所述表达载体包括多核苷酸,所述多核苷酸包括与对Wnt替代分子进行编码的核酸操作性地连接的启动子。在特定实施例中,药物组合物进一步包括细胞,所述细胞包括表达载体,所述表达载体包括多核苷酸,所述多核苷酸包括与对Wnt多肽或Norrin多肽进行编码的核酸序列操作性地连接的启动子。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的多核苷酸(例如,表达盒)和/或相同细胞中。在特定实施例中,细胞是从待治疗受试者获得的异源细胞或自体细胞。在特定实施例中,细胞是干细胞,例如脂肪源干细胞或造血干细胞。
本公开设想了药物组合物,所述药物组合物包括用于递送作为第一活性剂的Wnt替代分子的第一分子和用于递送Wnt多肽或Norrin多肽的第二分子。第一分子和第二分子可以是相同类型的分子或不同类型的分子。例如,在某些实施例中,第一分子和第二分子可以各自独立地选自以下类型的分子:多肽、有机小分子、对第一活性剂或第二活性剂进行编码的核酸(任选地,DNA或mRNA,任选地,经过修饰的RNA)、包括对第一活性剂或第二活性剂进行编码的核酸序列的载体(任选地,表达载体或病毒载体)以及包括对第一活性剂或第二活性剂进行编码的核酸序列的细胞(任选地,表达盒)。
单独的或组合的主题分子可以与可用于制备通常安全、无毒且理想的调配物的药学上可接受的载剂、稀释剂、赋形剂和试剂进行组合,并且包含可接受以供哺乳动物例如人或灵长类动物使用的赋形剂。此类赋形剂可以是固体、液体、半固体或在气雾组合物的情况下为气态的。此类载剂、稀释剂和赋形剂的实例包含但不限于水、盐水、林格氏溶液、右旋糖溶液和5%人血清白蛋白。补充性活性化合物也可以并入调配物中。用于调配物的溶液或悬浮液可以包含:无菌稀释剂,如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌化合物,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合化合物,如乙二胺四乙酸(EDTA);缓冲剂,如乙酸盐、柠檬酸盐或磷酸盐;洗涤剂,如用于防止聚合的吐温(Tween)20;以及用于调节张力的化合物,如氯化钠或右旋糖。可以用如盐酸或氢氧化钠等酸或碱调节pH。在特定实施例中,药物组合物是无菌的。
药物组合物可以进一步包含无菌水溶液或分散液和用于临时制备无菌可注射溶液或分散液的无菌粉末。对于静脉内施用,适合的载剂包含生理盐水、抑菌水或磷酸盐缓冲盐水(PBS)。在某些情况下,组合物是无菌的,并且应该是流体,使得其可以被抽吸到注射器中并从注射器递送给受试者。在某些实施例中,组合物在制造和储存条件下是稳定的,并且抵抗如细菌和真菌等微生物的污染作用进行保存。载剂可以是例如溶剂或分散介质,其含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)以及其适合的混合物。可以例如通过使用如卵磷脂等包衣、通过在分散体的情况下维持所需粒度以及通过使用表面活性剂来维持恰当的流动性。可以通过各种抗细菌剂和抗真菌剂(例如,对羟苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等)来实现防止微生物的作用。在许多情况下,组合物中包含等渗剂(例如糖、如甘露醇、山梨醇等多元醇、氯化钠)是优选的。可以通过在组合物中包含延缓吸收的药剂(例如,单硬脂酸铝和明胶)来实现内部组合物的延长吸收。
无菌溶液可以通过根据需要将所需量的抗Fzd抗体或其抗原结合片段(或编码多核苷酸或包括其的细胞)与上文所列举的成分中的一种成分或其组合并入适当的溶剂中、随后过滤灭菌来制备。通常,通过将活性化合物掺入无菌媒剂中来制备分散液,所述无菌媒剂含有基础分散介质和来自以上列举的那些的其它所需成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法为真空干燥和冷冻干燥,这些干燥产生活性成分加上来自其先前无菌过滤溶液的任何另外的期望成分的粉末。
在一个实施例中,药物组合物与保护抗体或其抗原结合片段免于从体内快速消除的载剂一起制备,如控释调配物,包含植入物和微囊化递送系统。可以使用生物可降解的、生物相容的聚合物,如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备此类调配物的方法对本领域技术人员而言是显而易见的。材料也可以商购获得。脂质体悬浮液也可以用作药学上可接受的载剂。这些脂质体悬浮液可以根据本领域技术人员已知的方法制备。
以易于施用和实现剂量均匀性的剂量单位形式来配制药物组合物可以是有利的。如本文所用,剂量单位形式是指作为针对有待治疗的受试者的单一剂量适合的物理上离散的单位;每单位含有经计算以与所需的药物载剂的联合产生所期望的治疗效果的预定量的活性抗体或其抗原结合片段。剂量单位形式的规格由抗体或其抗原结合片段的独特特性和待实现的特定治疗效果以及本领域中在混配这种活性抗体或其抗原结合片段以用于治疗个体时固有的局限性决定并且直接依赖于此。
药物组合物可以与施用说明书一起包含在容器、包装或分配器(例如,注射器,例如载药注射器)中。
本公开的药物组合物涵盖任何药学上可接受的盐、酯或这种酯的盐、或在施用于包括人的动物时能够(直接或间接)提供生物活性抗体或其抗原结合片段的任何其它化合物。
本公开包含本文所描述的Wnt替代分子的药学上可接受的盐。术语“药学上可接受的盐”是指本公开的化合物的生理学上可接受的盐和药学上可接受的盐:即,保留了亲本化合物的期望生物活性并且不对亲本化合物产生不期望的毒理效果的盐。各种药学上可接受的盐是本领域已知的并且描述于例如以下中:《雷明顿药学大全(Remington'sPharmaceutical Sciences)》,第17版,Alfonso R.Gennaro(编),美国宾夕法尼亚州伊斯顿Mark出版公司(Mark Publishing Company,Easton,PA,USA),1985(以及其最近的版本);《制药技术百科全书(Encyclopaedia of Pharmaceutical Technology)》,第3版,JamesSwarbrick(编),美国纽约州美国英富曼卫生保健(有限公司)(Informa Healthcare USA(Inc.),NY,USA),2007;以及《药物科学杂志(J.Pharm.Sci.)》66:2(1977)。而且,有关适合的盐的综述,参见Stahl和Wermuth的《“药用盐手册:性质、选择和使用(Handbook ofPharmaceutical Salts:Properties,Selection,and Use)”》(Wiley-VCH,2002)。
用如碱金属和碱土金属或有机胺等金属或胺形成药学上可接受的碱加成盐。用作阳离子的金属包括钠、钾、镁、钙等。胺包括N-N'-二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、二环己胺、乙二胺、N-甲基葡糖胺和普鲁卡因(参见例如Berge等人,“药用盐(Pharmaceutical Salts)”,《药学杂志(J.Pharma Sci)》,1977,66,119)。酸性化合物的碱加成盐是通过使游离酸形式与足量的期望的碱相接触以常规方式产生盐来制备的。游离酸形式可以通过使盐形式与酸相接触并且以常规方式分离游离酸来再生。游离酸形式在某些物理性质方面如在极性溶剂中的溶解度与其各自的盐形式略有不同,但是出于本公开的目的,盐等同于其各自的游离酸。
在一些实施例中,本文所提供的药物组合物包括与药学上可接受的载剂、稀释剂和/或赋形剂混合的治疗有效量的Wnt替代分子或其药学上可接受的盐,所述药学上可接受的载剂、稀释剂和/或赋形剂例如盐水、磷酸盐缓冲盐水、磷酸盐和氨基酸、聚合物、多元醇、糖、缓冲剂、防腐剂和其它蛋白质。示例性氨基酸、聚合物和糖等是辛基苯氧基聚乙氧基乙醇化合物、聚乙二醇单硬脂酸酯化合物、聚氧乙烯脱水山梨糖醇脂肪酸酯、蔗糖、果糖、右旋糖、麦芽糖、葡萄糖、甘露醇、葡聚糖、山梨糖醇、肌醇、半乳糖醇、木糖醇、乳糖、海藻糖、牛或人血清白蛋白、柠檬酸盐、乙酸盐、林格氏和汉克氏(Hank's)溶液、半胱氨酸、精氨酸、肉毒碱、丙氨酸、甘氨酸、赖氨酸、缬氨酸、亮氨酸、聚乙烯吡咯烷酮、聚乙烯和乙二醇。优选地,此调配物在4℃下在至少六个月内是稳定的。
在一些实施例中,本文所提供的药物组合物包括缓冲液,如磷酸盐缓冲盐水(PBS)或磷酸钠/硫酸钠、tris缓冲液、甘氨酸缓冲液、无菌水以及本领域普通技术人员已知的其它缓冲液,如Good等人(1966)《生物化学(Biochemistry)》5:467中描述的那些缓冲液。所述缓冲液的pH值可以处于6.5到7.75的范围内,优选地7到7.5,并且最优选地7.2到7.4。
本公开还提供了用于使用本文公开的Wnt替代分子,例如来调节Wnt信号传导通路(例如,增加Wnt信号传导)的方法,以及用于施用本文在多种治疗设置中公开的Wnt替代分子的方法。本文提供了使用Wnt替代分子的治疗方法。在一个实施例中,Wnt替代分子被提供给患有涉及不适当或失调的Wnt信号传导(例如,Wnt信号传导减少)的疾病的受试者。
激动Wnt通路信号传导和相关治疗方法
在某些实施例中,Wnt替代分子可以用于激动组织或细胞中的Wnt信号传导通路。激动Wnt信号传导通路可以包含,例如,增加组织或细胞中的Wnt信号传导或增强Wnt信号传导。因此,在一些方面,本公开提供了一种用于激动细胞中的Wnt信号传导通路的方法,所述方法包括使组织或细胞与有效量的本文公开的Wnt替代分子或其药学上可接受的盐接触,其中Wnt替代分子是Wnt信号传导通路激动剂。在一些实施例中,接触发生在体外、离体或体内。在特定实施例中,细胞是培养细胞,并且接触发生在体外。在某些实施例中,所述方法包括进一步使组织或细胞与一种或多种Wnt多肽或Norrin多肽接触。
在相关方面,本公开提供了一种用于激动组织或细胞中的Wnt信号传导的方法,所述方法包括使组织或细胞与有效量的包括本文公开的Wnt替代分子的多核苷酸接触。在某些实施例中,还使靶组织或靶细胞与包括对Wnt多肽或Norrin多肽进行编码的核酸序列的多核苷酸接触。在某些实施例中,多核苷酸是DNA或mRNA,例如经修饰的mRNA。在特定实施例中,多核苷酸是进一步包括5'帽序列和/或3'拖尾序列(例如polyA尾)的经修饰的mRNA。在其它实施例中,多核苷酸是包括与编码序列操作性地连接的启动子的表达盒。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的多核苷酸中。
在相关方面,本公开提供了一种用于激动组织或细胞中的Wnt信号传导的方法,所述方法包括使组织或细胞与有效量的包括对Wnt替代分子进行编码的核酸序列的载体接触。在某些实施例中,还使组织或细胞与包括对Wnt多肽或Norrin多肽进行编码的核酸序列的载体接触。在某些实施例中,载体是表达载体并且可以包括与核酸序列操作性地连接的启动子序列。在特定实施例中,载体是病毒载体。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的载体(例如,相同表达盒)中。
在相关方面,本公开提供了一种用于激动组织中的Wnt信号传导的方法,所述方法包括使组织与有效量的包括对本公开的Wnt替代分子进行编码的核酸序列的细胞接触。在某些实施例中,还使组织与包括对Wnt多肽或Norrin多肽进行编码的核酸序列的细胞接触。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的细胞中。在特定实施例中,细胞是从待治疗受试者获得的异源细胞或自体细胞。在某些实施例中,用包括对Wnt替代分子或Wnt多肽或Norrin多肽进行编码的表达盒的载体对细胞进行转导。在特定实施例中,细胞是干细胞,例如脂肪源干细胞或造血干细胞。
本文公开的Wnt替代分子可以用于例如通过激动(例如,增加)靶向细胞、组织或器官中的Wnt信号传导来治疗疾病、病症或病状。因此,在一些方面,本公开提供了一种用于治疗有需要的受试者的疾病或病况(例如,与Wnt信号传导减少或受损相关的疾病或病症和/或针对其增加Wnt信号传导将提供治疗益处的疾病或病症)的方法,所述方法包括使受试者与有效量的本公开的组合物接触。在特定实施例中,所述组合物是药物组合物,所述药物组合物包括以下中的任一种:Wnt替代分子;多核苷酸,所述多核苷酸包括对Wnt替代分子进行编码的核酸序列,例如DNA或mRNA,任选地经过修饰的mRNA;载体,所述载体包括对Wnt替代分子进行编码的核酸序列,例如表达载体或病毒载体;或者细胞,所述细胞包括对Wnt替代分子进行编码的核酸序列,例如用对Wnt替代分子进行编码的表达载体或病毒载体转导的细胞。在特定实施例中,疾病或病况是病理性疾病或病症或者损伤,例如由伤口引起的损伤。在某些实施例中,伤口可能是另一种治疗性治疗的结果。在某些实施例中,疾病或病况包括受损组织修复、愈合或再生,或者会受益于增加的组织修复、愈合或再生。在一些实施例中,在体内发生接触,即,向受试者施用主题组合物。
在某些实施例中,所述方法包括进一步使受试者与药物组合物接触,所述药物组合物包括一种或多种Wnt多肽或Norrin多肽。本公开设想了使受试者与用于递送作为第一活性剂的Wnt替代分子的第一分子和用于递送Wnt多肽或Norrin多肽的第二分子接触。第一分子和第二分子可以是相同类型的分子或不同类型的分子。例如,在某些实施例中,第一分子和第二分子可以各自独立地选自以下类型的分子:多肽、有机小分子、对第一活性剂或第二活性剂进行编码的核酸(任选地,DNA或mRNA,任选地,经过修饰的RNA)、包括对第一活性剂或第二活性剂进行编码的核酸序列的载体(任选地,表达载体或病毒载体)以及包括对第一活性剂或第二活性剂进行编码的核酸序列的细胞(任选地,表达盒)。
在相关方面,本公开提供了一种用于治疗疾病或病况(例如,与Wnt信号传导减少相关的疾病或病症或者针对其增加Wnt信号传导将提供治疗益处的疾病或病症)的方法,所述方法包括使有需要的受试者与包括有效量的多核苷酸的药物组合物接触,所述多核苷酸包括对本文公开的Wnt替代分子进行编码的核酸序列。在某些实施例中,还使受试者与包括有效量的多核苷酸的药物组合物接触,所述多核苷酸包括对Wnt多肽或Norrin多肽进行编码的核酸序列。在某些实施例中,多核苷酸是DNA或mRNA,例如经修饰的mRNA。在特定实施例中,多核苷酸是进一步包括5'帽序列和/或3'拖尾序列(例如polyA尾)的经修饰的mRNA。在其它实施例中,多核苷酸是包括与编码序列操作性地连接的启动子的表达盒。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的多核苷酸中。
在相关方面,本公开提供了一种用于治疗疾病或病况(例如,与Wnt信号传导减少相关的疾病或病症或者针对其增加Wnt信号传导将提供治疗益处的疾病或病症)的方法,所述方法包括使有需要的受试者与包括有效量的载体的药物组合物接触,所述载体包括对Wnt替代分子进行编码的核酸序列。在某些实施例中,还使受试者与包括有效量的载体的药物组合物接触,所述载体包括对Wnt多肽或Norrin多肽进行编码的核酸序列。在某些实施例中,载体是表达载体并且可以包括与核酸序列操作性地连接的启动子序列。在特定实施例中,载体是病毒载体。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的载体(例如,相同表达盒)中。
在相关方面,本公开提供了一种用于治疗疾病或病况(例如,与Wnt信号传导减少相关的疾病或病症或者针对其增加Wnt信号传导将提供治疗益处的疾病或病症)的方法,所述方法包括使有需要的受试者与包括有效量的细胞的药物组合物接触,所述细胞包括对Wnt替代分子进行编码的核酸序列。在某些实施例中,还使受试者与包括对Wnt多肽或Norrin多肽进行编码的核酸序列的细胞接触。在某些实施例中,对Wnt替代分子进行编码的核酸序列和对Wnt多肽或Norrin多肽进行编码的核酸序列存在于相同的细胞中。在特定实施例中,细胞是从待治疗受试者获得的异源细胞或自体细胞。在某些实施例中,用包括对Wnt替代分子或Wnt多肽或Norrin多肽进行编码的表达盒的载体对细胞进行转导。在特定实施例中,细胞是干细胞,例如脂肪源干细胞或造血干细胞。
Wnt信号传导在干细胞的发育过程和维持中发挥着关键作用。Wnt信号的重新活化与损伤和疾病后大多数组织的再生和修复相关。预期Wnt替代分子响应于损伤和疾病而提供愈合和组织修复的益处。组织损害和损失的原因包含但不限于老化、变性、遗传性病况、感染和炎症、创伤性损伤、毒素/代谢诱导的毒性、或其它病理性病况。已经显示Wnt信号和Wnt信号的增强子使成年组织驻留干细胞活化。在一些实施例中,施用本公开的化合物以用于治疗患病组织或受损组织、用于组织再生以及用于细胞生长和增殖和/或用于组织工程化。
与Wnt通路的突变相关的人类疾病针对治疗和预防疾病中Wnt信号的增强提供了有力证据。临床前体内和体外研究提供了许多疾病病况中涉及Wnt信号的另外的证据,并且进一步支持将Wnt替代分子用于各种人类疾病。例如,本公开的组合物可以用于促进或增加骨生长或再生、骨移植、骨折愈合、应力性骨折、椎体压缩性骨折、骨质疏松症和骨质疏松性骨折的治疗、脊柱融合、矫形装置的骨整合、腱-骨整合、牙齿生长和再生、牙种植、牙周疾病、颌面重建和颌骨坏死。本发明的组合物还可以用于:治疗脱发;增强感觉器官的再生,例如治疗听力损失,治疗前庭功能减退,治疗黄斑变性,治疗玻璃体视网膜病变,其它视网膜变性疾病、福斯氏营养不良、其它角膜疾病等;治疗中风、创伤性脑损伤、阿尔茨海默症、多发性硬化、肌肉营养不良、由肌少症或恶病质引起的肌肉萎缩以及影响血脑屏障的其它病状;治疗脊髓损伤、其它脊髓疾病。本公开的组合物还可以用于:治疗口腔粘膜炎、治疗短肠综合征、炎性肠疾病(IBD)、其它胃肠道病症;治疗代谢综合征;治疗糖尿病、血脂异常、治疗胰腺炎、其中外分泌或内分泌胰腺组织受损的病状、其中期望增强的表皮再生例如表皮伤口愈合的病状;治疗糖尿病足溃疡、涉及牙齿、指甲或真皮发育不全等的综合征、其中血管生成有益的病状;治疗心肌梗死、冠状动脉疾病、心力衰竭、增强造血细胞的生长,例如增强来自骨髓的造血干细胞移植、动员外周血;治疗免疫缺陷、移植物抗宿主疾病等;治疗急性肾损伤、慢性肾病;治疗肺病、慢性阻塞性肺病(COPD)、特发性肺纤维化(IPF);增强肺组织的再生。本公开的组合物还可以用于增强肝细胞再生(NASH),例如肝再生、治疗肝硬化、增强肝移植、治疗急性肝衰竭、治疗经历丙型肝炎或乙型肝炎病毒感染或抗病毒后药物疗法的慢性肝病、酒精性肝病、酒精性肝炎、伴随脂肪变性或脂肪性肝炎的非酒精性肝病(NASH)等。本公开的组合物可以治疗疾病和病症,包含但不限于其中期望再生性细胞生长的病况。
涉及Wnt信号传导组分中的功能丧失突变或功能获得突变的人类遗传学显示了支持增强Wnt信号以用于骨生长的有力证据。其中期望增强的骨生长的病状可以包含但不限于骨折、移植、在假体装置周围向内生长、骨质疏松症、骨质疏松性骨折、脊柱融合、颌骨坏死、牙种植、牙周疾病、颌面重建等。Wnt替代分子增强和促进了对促进骨再生至关重要的Wnt信号。用于使骨组织再生的方法受益于施用本公开的化合物,所述施用可以是全身性的或局部化的。在一些实施例中,使骨髓细胞暴露于本公开的分子,从而使得所述骨髓内的干细胞活化。
在一些实施例中,通过使响应性细胞群(例如,骨髓、骨祖细胞、骨干细胞等)与有效剂量的本文公开的Wnt替代分子接触来增强骨再生。用于使骨组织再生的方法受益于施用Wnt替代分子,所述施用可以是全身性的或局部化的。在一些这种实施例中,在体内执行接触。在其它这种实施例中,离体地执行接触。分子可以例如通过加载到任选地可生物降解的基质上而定位到作用位点,并且任选地提供活性剂的缓释。基质载体包含但不限于可吸收的胶原海绵、陶瓷、水凝胶、高分子微球、纳米颗粒、骨水泥等。
在特定实施例中,包括本文公开的一种或多种Wnt替代分子(或对Wnt替代分子进行编码的多核苷酸,或包括对Wnt替代分子进行编码的多核苷酸的载体或细胞)的组合物用于治疗或预防包含但不限于以下中的任一种的骨骼疾病或病症,或治疗或预防与以下中的任一种相关但不限于其的损伤:骨质疏松症、骨质疏松性骨折、骨折、未愈合性骨折、延迟愈合骨折、脊柱融合、骨坏死,颌、髋或股骨头等的坏死,植入物的骨整合(例如,用于在部分或全部膝盖或髋置换后加速恢复)、成骨不全症、骨移植、腱修复、颌面外科手术、牙种植、由遗传疾病、变性、老化、药品或损伤引起的任何其它骨病症或缺陷。在一个实施例中,结合Fzd1、Fzd2和Fzd7以及LRP5和/或LRP6的Wnt替代分子用于治疗或预防任何骨骼疾病或病症。在一个实施例中,结合Fzd1、Fzd2、Fzd5、Fzd7和Fzd8以及LRP5和/或LRP6的Wnt替代分子用于治疗或预防任何骨骼疾病或病症。
在特定实施例中,本文公开的组合物和方法可以用于:增加受试者的骨矿物质密度、增加所述受试者的骨体积(例如,胫骨和/或股骨骨体积)、增加所述受试者的皮质厚度(例如,在骨小梁区或在股骨中骨干中)、增加所述受试者的矿物质沉积率、增加所述受试者的(例如,骨中的)成骨细胞的数量和/或减少所述受试者的(例如,骨中的)破骨细胞的数量、增加所述受试者的骨刚度、增加所述受试者的骨折点的极限负荷、改善所述受试者的骨的对骨折的抵抗力、减少所述受试者的与骨质疏松症相关的骨流失或增加所述受试者的骨的生物化学强度。在一个实施例中,结合Fzd1、Fzd2和Fzd7的Wnt替代分子用于这些指定用途中的任一种用途。在一个实施例中,结合Fzd1、Fzd2、Fzd5、Fzd7和Fzd8的Wnt替代分子用于这些指定用途中的任一种用途。
包括本文公开的一种或多种Wnt替代分子(或对Wnt替代分子进行编码的多核苷酸,或包括对Wnt替代分子进行编码的多核苷酸的载体或细胞)的组合物可以用于体内治疗骨骼组织缺陷。“骨骼组织缺陷”意指骨骼或其它骨骼结缔组织在期望恢复骨骼或结缔组织的任何位点处的缺陷,无论缺陷是如何引起的,例如无论是手术干预、肿瘤切除、溃疡、植入、骨折还是其它创伤性或变性病况的结果。本公开的组合物可以用作用于恢复结缔组织的软骨功能、用于修复软骨组织的缺损或损伤的方案的一部分,所述软骨组织的缺损或损伤如变性磨损和关节炎、组织创伤、半月板撕裂移位、半月板切除、由韧带撕裂、关节不齐、骨折或遗传性疾病引起的关节脱位。
Wnt替代分子还可以用于治疗牙周病。牙周病是牙齿脱落的主要原因并且与多种全身性病况有关。在一些实施例中,通过接触响应性细胞群来增强牙齿或下层骨再生。在一些这种实施例中,在体内执行接触。在其它这种实施例中,离体地执行接触,随后植入活化的干细胞或祖细胞。分子可以例如通过加载到任选地可生物降解的基质上而定位到作用位点,并且任选地提供活性剂的缓释。基质载体包含但不限于可吸收的胶原海绵、陶瓷、水凝胶、骨水泥、聚合物微球、纳米颗粒等。
研究已经表明,Wnt信号传导和R-脊椎蛋白的生物学能够在损伤、老化或变性后促进内耳中的感觉毛细胞再生。听力丧失或前庭功能减退所涉及的内耳中感觉毛细胞的损失也可以受益于本公开的组合物。在内耳中,听觉器官容纳将声音振动转化为电脉冲所需的机械敏感毛细胞。包括半规管(SSC)、椭圆囊和球囊的前庭器官还含有感觉毛细胞,以检测头部位置和头部运动。本公开的组合物可以用于例如:输注;基质或其它储库系统;或者到耳朵的其它局部应用以增强听觉再生。
Wnt替代分子还可以用于视网膜组织的再生。在成年哺乳动物视网膜中,穆勒神经胶质细胞(Muller glia cell)能够例如在体内神经毒性损伤后之后使视网膜细胞(包含光感受器)再生。Wnt信号传导和Wnt信号的增强子可以促进穆勒神经胶质源视网膜祖细胞在损害后或在变性期间增殖。本公开的组合物还可以用于使眼中的组织和其它细胞类型再生。例如,年龄相关性黄斑变性(AMD)、其它视网膜变性疾病、角膜病、富克斯氏营养不良、玻璃体视网膜病变、遗传性疾病等可以受益于本公开的组合物。AMD的特征在于渐进性降低的中心视觉和视敏度。富克斯氏营养不良症的特征在于角膜内皮细胞逐渐丧失。Wnt信号和Wnt信号的增强可以促进眼部组织中角膜内皮、视网膜上皮等的再生。在其它实施例中,本公开的组合物可以用于例如:输注;基质或其它储库系统;或者到眼睛的其它局部应用以使视网膜再生并治疗黄斑变性。
已经通过谱系示踪研究鉴别出用于肝细胞的稳态更新的特定增殖细胞群,例如中心周围区的Axin2阳性细胞。谱系示踪研究还鉴别出了另外可能的肝脏祖细胞,包含但不限于Lgr阳性细胞。包含Lgr5阳性细胞和Axin2阳性细胞在内的自我更新肝细胞和其它可能祖细胞群被鉴别为能够在损伤后响应于Wnt信号和/或R-脊椎蛋白进行再生。急性肝损伤和衰竭以及慢性肝病的许多临床前模型显示出肝细胞的恢复和再生受益于增强Wnt信号。
在某些实施例中,包括本文公开的Wnt替代分子(或对Wnt替代分子进行编码的多核苷酸,或包括对Wnt替代分子进行编码的多核苷酸的载体或细胞)的组合物用于促进肝再生、减少纤维化和/或改善肝功能。在某些实施例中,本文公开的组合物和方法被用于:增加肝重量、增加肝重量与体重的比率、增加肝中PCNA和pH3阳性细胞核的数目、增加肝中Ki67和/或细胞周期蛋白D1的表达、增加肝细胞增殖和/或有丝分裂、减少慢性肝损伤后的纤维化或增加肝细胞功能。
在特定实施例中,本公开的组合物可以用于:治疗急性肝衰竭、急性酒精性肝损伤;治疗经历丙型肝炎或乙型肝炎病毒感染或抗病毒后药物疗法的慢性肝疾病、慢性酒精性肝病、非酒精性脂肪肝疾病和非酒精性脂肪性肝炎(NASH);治疗肝硬化和所有原因的严重慢性肝病;以及增强肝细胞的再生。用于使肝组织再生的方法受益于施用本公开的化合物,所述施用可以是全身性的或局部化的。这些方法包含但不限于全身性施用方法和局部化施用方法,例如通过注射到肝组织中、通过注射到通向肝脏的静脉或血管中、通过植入缓释调配物等。
在特定实施例中,包括本文公开的Wnt替代分子(或对Wnt替代分子进行编码的多核苷酸,或包括对Wnt替代分子进行编码的多核苷酸的载体或细胞)的组合物用于治疗或预防肝疾病或病症,包含但不限于治疗或预防由以下中的任一种引起的肝损伤或病症:急性肝衰竭(所有原因)、慢性肝衰竭(所有原因)、肝硬化、肝纤维化(所有原因)、门脉高压、非酒精性脂肪性肝炎(NASH)、非酒精性脂肪肝病(NAFLD)(脂肪肝)、酒精性肝炎、丙型肝炎病毒诱导的肝病(HCV)、乙型肝炎病毒诱导的肝病(HBV)、其它病毒性肝炎(例如,甲型肝炎病毒诱导的肝病(HAV)和丁型肝炎病毒诱导的肝病(HDV))、原发性胆汁性肝硬化、自身免疫性肝炎、肝脏外科手术、肝损伤、肝移植、肝脏外科手术和移植中的“小肝”综合征、先天性肝脏疾病和病症,由遗传疾病、变性、老化、药品和损伤引起的任何其它肝脏病症或缺陷。
Wnt信号在各种上皮组织的再生中发挥着重要作用。各种表皮病况受益于用本公开的化合物进行的治疗。当附在胃肠道上的快速分开的上皮细胞破裂从而使粘膜组织易于溃疡和感染时,发生粘膜炎。上皮层(epithelial lining)的覆盖口腔的部分,被称为口腔粘膜,是身体最敏感的部位之一,并且特别容易受到化疗和放射的伤害。口腔粘膜炎可能是癌症治疗特别是化疗和放射中最常见的使人衰弱的并发症。另外,本公开的组合物还可以有益于治疗短肠综合征、炎性肠病(IBD)或其它胃肠病症。其它表皮病况包含表皮伤口愈合、糖尿病足溃疡、涉及牙齿、指甲或皮肤发育不全的综合征等。本公开的分子可以用于所有这些病况,其中再生性细胞与本公开的化合物接触。用于使上皮组织再生的方法受益于施用本公开的化合物,所述施用可以是全身性的或局部化的。接触可以是例如局部的,包含皮内、皮下,以施加在靶向位点等处的凝胶、洗剂、乳膏等形式。
除皮肤和胃肠道外,Wnt信号以及Wnt信号的增强和促进还在临床前模型中在包含胰腺、肾和肺在内的组织的修复和再生中发挥着重要作用。Wnt替代分子可以有益于涉及外分泌和内分泌胰腺、肾或肺的各种疾病病状。Wnt替代分子可以用于:治疗代谢综合征;治疗糖尿病;治疗急性或慢性胰腺炎、外分泌胰腺功能不全;治疗急性肾损伤、慢性肾病;治疗包含但不限于慢性阻塞性肺病(COPD)、导致肺上皮组织缺失的其它病状。用于使这些组织再生的方法受益于施用本公开的化合物,所述施用可以是全身性的或局部化的。
与经由其它发育因子进行的信号传导协调的表皮Wnt信号传导对成人毛囊再生至关重要。脱发是常见问题,并且雄激素性脱发,通常称为男性型秃发,是男性最常见的脱发形式。在一些实施例中,通过使响应性细胞群与本公开的分子接触来增强毛囊再生。在一些这种实施例中,在体内执行接触。在其它这种实施例中,离体地执行接触。分子可以定位到作用位点处,例如外用洗剂、凝胶、乳膏等。
可以用Wnt替代分子治疗中风、创伤性脑损伤、阿尔茨海默症、多发性硬化和影响血脑屏障(BBB)的其它病状。血管生成对确保向贯穿全身的许多组织供应氧气和营养物至关重要,并且对CNS而言尤其重要,因为神经组织对缺氧和缺血极其敏感。形成BBB的CNS内皮细胞与非神经组织中的内皮细胞的不同之处在于,CNS内皮细胞是通过紧密连接保持在一起的高度极化细胞并且表达特定转运蛋白。Wnt信号传导调节CNS血管形成和/或功能。BBB受损的病况可以受益于施用本公开的化合物,所述施用可以是全身性的或局部化的,例如通过直接注射、鞘内施用、植入缓释调配物等。另外,Wnt信号积极参与神经发生并且在损伤后发挥神经保护的作用。本公开的组合物还可以用于治疗脊髓损伤、其它脊髓疾病、中风、创伤性脑损伤等。
Wnt信号还在血管生成中发挥作用。Wnt替代分子可以有益于血管生成有利的病状、治疗心肌梗死、冠状动脉疾病、心力衰竭等,以及源自遗传性疾病的病状。用于使这些组织再生的方法受益于施用本公开的化合物,所述施用可以是全身性的或局部化的。
在某些实施例中,本公开的方法促进组织再生,例如在经受损害或者组织或细胞减少或损耗的组织中。损耗或损害可以是导致细胞数量减少的任何事物,包含疾病或损伤。例如,事故、自身免疫病症、治疗副作用或疾病况态可能会构成创伤。组织再生增加了组织内的细胞数量,并且优选地使组织的细胞之间能够重新建立连接,并且更优选地使组织能够重新获得功能。
如本文所使用的,术语“施用”或“引入”或“提供”是指向细胞、向受试者的细胞、组织和/或器官或者向受试者递送组合物。这种施用或引入可以在体内、在体外或离体地发生。
在特定实施例中,药物组合物是肠胃外施用的,例如,静脉内、口服、直肠或通过注射施用。在一些实施例中,局部(locally),例如局部地(topically)或肌内地施用药物组合物。在一些实施例中,组合物施用于靶组织,例如骨、关节、耳组织、眼组织、胃肠道、皮肤、伤口部位或脊髓。可以在体内或离体地实践本公开的方法。在一些实施例中,离体地执行靶细胞或靶组织与Wnt替代分子的接触,随后将细胞或组织例如活化的干细胞或祖细胞植入到受试者体内。技术人员可以基于正在治疗的疾病或病症确定适合的施用位点和施用途径。
剂量和剂量方案可以取决于医师容易确定的各种因素,如疾病或病症的性质、受试者的特性和受试者的病史。在特定实施例中,向受试者施用或提供的Wnt替代分子的量的范围为受试者体重的约0.01mg/kg到约50mg/kg、0.1mg/kg到约500mg/kg或约0.1mg/kg到约50mg/kg。
术语“治疗(treatment)”、“治疗(treating)”等在本文中用于通常意指获得期望的药理学和/或生理学效应。效果在完全或部分地预防疾病或其症状方面可以是预防性的,例如降低受试者体内发生疾病或其症状的可能性,和/或在部分或完全治愈疾病和/或由疾病引起的不良反应方面可以是治疗性的。如本文所使用的,“治疗”覆盖了对哺乳动物的疾病的任何治疗,并且包含:(a)防止疾病在可能倾向于患有疾病但尚未被诊断为患有疾病的受试者身上发生;(b)抑制疾病,即,中止疾病发展;或者(c)缓解疾病,即,使疾病消退。可以在疾病或损伤发作之前、期间或之后施用治疗剂(例如,Wnt替代分子)。特别关注了对发展中的疾病的治疗,其中所述治疗稳定或减少了患者的不期望的临床症状。理想的是,在受影响组织的功能完全丧失之前执行这种治疗。理想的是,将在疾病的症状期期间并且在一些情况下在疾病的症状期之后施用主题疗法。在一些实施例中,主题方法产生了治疗益处,例如预防病症的发展、停止病症的进展、逆转病症的进展等。在一些实施例中,主题方法包括检测到已经达到治疗益处的步骤。本领域内普通技术人员应了解,治疗功效的这种量度将适用于正被修饰的特定疾病,并且应认识到用于测量治疗功效的适当检测方法。
其它实施例部分涉及本文公开的Wnt替代分子用于例如通过使细胞或组织与任选地与Norrin或Rspondin多肽组合的一种或多种Wnt替代物接触来促进或增强细胞、组织和类器官的生长或增殖的用途。在某些实施例中,所述细胞或组织离体、体外或体内接触。此类方法可以用于产生细胞、组织或类器官以用于治疗用途,例如,将其植入或移植到受试者中。它们也可以用于产生细胞、组织或类器官以供研究使用。Wnt替代分子在非治疗方法,例如体外研究方法中具有广泛的应用。
本公开提供了一种用于受损组织(如上述组织)的组织再生的方法,所述方法包括向细胞施用Wnt替代分子。可以将Wnt替代分子直接体内施用到细胞,口服、静脉内或通过本领域已知的其它方法施用到受试者或施用到离体细胞。在将Wnt替代分子施用到离体细胞的一些实施例中,可以在施用Wnt替代分子之前、之后或期间将这些细胞移植入受试者中。
Wnt信号传导是干细胞培养的关键组成部分。例如,在WO2010/090513、WO2012/014076、Sato等人,2011(《肠胃病学(GASTROENTEROLOGY)》201 1;141:1762-1772)以及Sato等人,2009(《自然》459,262-5)。本文公开的Wnt替代分子是用于这些干细胞培养基的Rspondin的适合替代方案,或者可以与Rspondin组合。
因此,在一个实施例中,本公开提供了一种用于增强干细胞增殖的方法,所述方法包括使干细胞与本文公开的一种或多种Wnt替代分子接触。在一个实施例中,本公开提供了一种细胞培养基,所述细胞培养基包括一种或多种本文公开的Wnt替代分子。在一些实施例中,细胞培养基可以是通常包括Wnt或Rspondin,但是其中Wnt或Rspondin被本文公开的一种或多种Wnt替代分子(全部或部分)替代或补充的本领域已知的任何细胞培养基。例如,培养基可以如在WO2010/090513、WO2012/014076、Sato等人,2011(《肠胃病学》201 1;141:1762-1772)以及Sato等人,2009(《自然》459,262-5)中所描述的,所述文献由此通过引用以其整体并入本文。
干细胞培养基通常包括另外的生长因子。因此,此方法可以另外包括向干细胞供应生长因子。细胞培养基中常用的生长因子包含表皮生长因子(EGF,(派普泰克(Peprotech))、转化生长因子-α(TGF-α,派普泰克)、碱性成纤维细胞生长因子(bFGF,派普泰克)、脑源性神经营养因子(BDNF,R&D系统)、肝细胞生长因子(HGF)和角质形成细胞生长因子(KGF,派普泰克,也被称为FGF7)。EGF是各种培养的外胚层和中胚层细胞的强效促有丝分裂因子,并且对体内和体外特定细胞以及细胞培养中某些成纤维细胞的分化具有深远的影响。EGF前体以膜结合分子的形式存在,所述膜结合分子通过蛋白水解方式切割以产生刺激细胞的53个氨基酸的肽激素。因此,EGF或其它促有丝分裂生长因子可以供应给干细胞。在干细胞培养期间,可以每两天将促有丝分裂生长因子添加到培养基,同时培养基优选地每四天更新一次。通常,促有丝分裂因子选自由以下组成的组:i)EGF、TGF-α和KGF,ii)EGF、TGF-α和FGF7;iii)EGF、TGF-α和FGF;iv)EGF和KGF;v)EGF和FGF7;vi)EGF和FGF;vii)TGF-α和KGF;viii)TGF-α和FGF7;ix)或来自TGF-α和FGF。在某些实施例中,本公开包含干细胞培养基,所述干细胞培养基包括例如任选地与本文所述的生长因子中的一种或多种生长因子或其组合进行组合的本文公开的Wnt替代分子。
这些增强干细胞增殖的方法可以用于从干细胞中生长出新的类器官和组织,如例如在WO2010/090513、WO2012/014076、Sato等人,201 1(《肠胃病学》2011;141:1762-1772)以及Sato等人,2009(《自然》459,262-5)。
在一些实施例中,Wnt替代分子用于增强干细胞再生。关注的示例性干细胞包含但不限于:肌肉卫星细胞;造血干细胞和由其衍生的祖细胞(美国专利第5,061,620号);神经干细胞(见莫里森等人(1999)《细胞》96:737-749);胚胎干细胞;间质干细胞;中胚层干细胞;肝干细胞;脂肪组织来源的干细胞等。
本公开的其它实施例部分地涉及用于检测表达一种或多种Fzd受体或LRP5或LRP6受体的细胞或组织的存在的诊断应用。因此,本公开提供了检测样品中的一种或多种Fzd受体或LRP5或LRP6受体(如检测表达Fzd1的细胞或组织)的方法。此类方法可以例如通过检测Wnt替代分子的结合以多种已知的检测形式应用,包含但不限于免疫组织化学(IHC)、免疫细胞化学(ICC)、原位杂交(ISH)、整装原位杂交(WISH)、荧光DNA原位杂交(FISH)、流式细胞术、酶免疫测定法(EIA)和酶联免疫测定法(ELISA)。
ISH是一种杂交类型,其使用标记的互补DNA或RNA链(即,主要结合剂)将特定DNA或RNA序列定位在细胞或组织(原位)的一部分或区段中,或者如果组织是足够小,则定位在整个组织中(整装ISH)。本领域普通技术人员将认识到,这与使用抗体作为主要结合剂将蛋白质定位在组织切片中的免疫组织化学不同。DNA ISH可以针对基因组DNA用于确定染色体的结构。荧光DNA ISH(FISH)可以例如用于医学诊断以评定染色体完整性。RNA ISH(杂交组织化学)用于测量和定位组织切片或整装中的mRNA和其它转录物。
在各种实施例中,本文所述的Wnt替代分子与可以直接或间接检测的可检测标记缀合。在这方面,抗体“缀合物”是指与可检测标记共价连接的Wnt替代分子。在本公开中,DNA探针、RNA探针、单克隆抗体、其抗原结合片段和其抗体衍生物,如单链可变片段抗体或表位标记的抗体可以全部与可检测标记共价连接。在“直接检测”中,仅使用一种可检测抗体,即,第一可检测抗体。因此,直接检测意指可以检测本身与可检测标记缀合的抗体,而无需添加第二抗体(第二抗体)。
“可检测标记”是可以产生指示样品中标记的存在和/或浓度的可检测(如视觉上、以电子地方式或其它方式)信号的分子或材料。当与抗体缀合时,可检测标记可以用于定位和/或定量特异性抗体所针对的靶标。因此,可以通过检测由可检测标记产生的信号来检测样品中靶标的存在和/或浓度。可以直接或间接检测可检测标记,并且可以将与不同特异性抗体缀合的若干种不同可检测标记组合使用以检测一个或多个靶标。
可以直接检测的可检测标记的实例包含荧光染料和放射性物质以及金属颗粒。相反,间接检测需要在应用第一抗体后应用一种或多种另外的抗体,即,第二抗体。因此,通过检测第二抗体或结合剂与第一可检测抗体的结合来执行检测。需要添加第二结合剂或抗体的第一可检测结合剂或抗体的实例包含酶可检测结合剂和半抗原可检测结合剂或抗体。
在一些实施例中,可检测标记与包括第一结合剂的核酸聚合物缀合(例如,在ISH、WISH或FISH过程中)。在其它实施例中,可检测标记与包括第一结合剂的抗体缀合(例如,在IHC过程中)。
可以与本公开的方法中使用的Wnt替代分子缀合的可检测标记的实例包含荧光标记、酶标记、放射性同位素、化学发光标记、电化学发光标记、生物发光标记、聚合物、聚合物颗粒、金属颗粒、半抗原和染料。
荧光标记的实例包含5-(和6)-羧基荧光素、5-或6-羧基荧光素、6-(荧光素)-5-(和6)-甲酰氨基己酸、异硫氰酸荧光素、若丹明、四甲基若丹明和染料(如Cy2、Cy3和Cy5)、任选的取代的香豆素(包含AMCA、PerCP)、藻胆蛋白(包含R-藻红蛋白(RPE)和别藻红蛋白(APC))、德克萨斯红、普林斯顿红(Princeton Red)、绿色荧光蛋白(GFP)和其类似物,以及R-藻红蛋白或别藻红蛋白的缀合物、无机荧光标记,如基于半导体材料的颗粒,如经涂覆的CdSe纳米微晶。
聚合物颗粒标记的实例包含可以嵌入荧光染料或含有染料、酶或底物的聚合物胶束或胶囊的聚苯乙烯、PMMA或二氧化硅的微粒或胶乳颗粒。
金属颗粒标记的实例包含可以通过银染转化的金颗粒和经涂覆的金颗粒。半抗原的实例包含DNP、异硫氰酸荧光素(FITC)、生物素和洋地黄毒苷。酶标记的实例包含辣根过氧化物酶(HRP)、碱性磷酸酶(ALP或AP)、β-半乳糖苷酶(GAL)、葡萄糖-6-磷酸脱氢酶、β-N-乙酰葡糖胺糖苷酶、β-葡萄糖醛酸苷酶、转化酶、黄嘌呤氧化酶、萤火虫荧光素酶和葡萄糖氧化酶(GO)。辣根过氧化物酶的常用底物实例包含3,3'-二氨基联苯胺(DAB)、具有镍增强作用的二氨基联苯胺、3-氨基-9-乙基咔唑(AEC)、联苯胺二盐酸盐(BDHC)、汉克耶茨(Hanker-Yates)试剂(HYR)、靛蓝(IB)、四甲基联苯胺(TMB)、4-氯-1-萘酚(CN)、α-萘酚派洛宁(α-NP)、邻联茴香胺(OD)、5-溴-4-氯-3-吲哚磷酸酯(BCIP)、硝基蓝四唑(NBT)、2-(对碘苯基)-3-对硝基苯基-5-苯基氯化四唑(INT)、四硝基蓝四唑(TNBT)、5-溴-4-氯-3-吲哚基-β-D-半乳糖苷/铁-铁氰化物(BCIG/FF)。
碱性磷酸酶的常用底物的实例包含萘酚-AS-B1-磷酸酯/坚牢红TR(NABP/FR)、萘酚-AS-MX-磷酸酯/坚牢红TR(NAMP/FR)、萘酚-AS-B1-磷酸酯/-坚牢红TR(NABP/FR)、萘酚-AS-MX-磷酸酯/坚牢TR(NAMP/FR)、萘酚-AS-B1-磷酸酯/新品红(NABP/NF)、溴氯吲哚磷酸酯/硝基蓝四唑(BCIP/NBT)、5-溴-4-氯-3-吲哚基-b-d-吡喃半乳糖苷(BCIG)。
发光标记的实例包含鲁米诺、异鲁米诺、吖啶酯、1,2-二氧杂环丁烷和吡啶并哒嗪。电化学发光标记的实例包含钌衍生物。放射性标记的实例包含碘、钴、硒、氚、碳、硫和磷的放射性同位素。
可检测标记可以与本文所述的抗体或特异性结合关注的生物标志物的任何其它分子,例如抗体、核酸探针或聚合物连接。此外,本领域普通技术人员将理解,可以检测标记也可以与第二和/或第三和/或第四和/或第五和/或第五结合剂或抗体等缀合。此外,技术人员将理解用于表征目标生物学标记的每种其它结合剂或抗体都可以用作信号放大步骤。可以使用例如光学显微镜、荧光显微镜、电子显微镜在视觉上检测生物标记,其中可检测物质是例如染料、胶体金颗粒、发光试剂。还可以使用分光光度计检测结合到生物标志物的视觉上可检测物质。当可以检测物质是放射性同位素时,可以通过放射自显影在视觉上进行检测,或使用闪烁计数器在视觉上进行检测。参见例如Larsson,1988,《免疫细胞化学:理论与实践(Immunocytochemistry:Theory and Practice)》,(佛罗里达州波卡拉顿的CRC出版社(CRC Press,Boca Raton,Fla.));《分子生物学方法》,第80卷1998,John D.Pound(编)(新泽西州托托瓦的胡玛纳出版社(Humana Press,Totowa,N.J.))。
本公开进一步提供了用于检测样品中一种或多种Fzd或LRP5/6受体或表达一种或多种Fzd或LRP5/6受体的细胞或组织的试剂盒,其中试剂盒含有至少一种本文所述的抗体、多肽、多核苷酸、载体或宿主细胞。在某些实施例中,试剂盒可以包括与本公开的抗体关联的缓冲液、酶、标记、底物、珠或其它表面等以及使用说明书。
本说明书中提及的和/或在申请数据表中列出的所有上述美国专利、美国专利申请出版物、美国专利申请、外国专利、外国专利申请和非专利出版物均通过全文引用的方式并入本文中。
根据前述内容,应了解,尽管出于说明的目的已经描述了本公开的具体实施例,但是可以在不背离本公开的精神或范围的情况下作出各种修改。因此,除所附权利要求进行的限制之外,本公开不受限制。
实例1
多特异性Wnt替代分子
如以下实例中进一步描述的,产生了许多表示不同构型的多特异性Wnt替代分子。这些包含下表5中公开的Wnt替代分子,所述Wnt替代分子包括SEQ ID NO:109-157中所示的序列。表1A和1B以及2A和2B列出了这些实例中所呈现的用于Wnt替代分子的特定Fzd和LRP结合元件。
表5.Wnt替代分子序列
Lrp VHH或sdAb=斜体
抗Fzd轻链=下划线
抗Fzd重链=粗体
实例2
对Fzd受体铰链区具有结合特异性的Wnt替代分子的产生
产生了活性Wnt替代分子,所述活性Wnt替代分子包括结合Fzd受体铰链区的Fzd结合体(参见图2A)和LRP结合体的各种组合。WO2016/205551和WO2016/205566中描述了两种结合Fzd7的铰链区的抗体,抗FZD7-1791(SEQ ID NO:70-71)和抗FZD7-1291(SEQ ID NO:72-73)。这两种抗体被用来证明Fzd铰链区的结合体产生活性Wnt替代分子。
抗FZD7-1791和抗FZD7-1291都被克隆到人IgG1框架中,其中Fc中具有LALA-PG突变以减少效应子功能。LRP5结合体#3(008S-D01;SEQ ID NO:97)在框架中克隆到两种抗体轻链的N端,如图2B所描绘的。根据制造商的说明,分别命名为1791-3(SEQ ID NO:113-114)和1291-3(SEQ ID NO:111-112)的两种重组附接IgG蛋白是通过将相应的表达载体转染到Expi293F细胞(马萨诸塞州沃尔瑟姆赛默飞世尔科技公司(Thermo Fisher Scientific,Waltham,MA))中制备的。简言之,在转染后四天,在使细胞团块旋转减慢后收集细胞培养基。培养基与蛋白A树脂(马萨诸塞州沃尔瑟姆的REPLIGEN)一起温育,以收集含有人IgG-Fc部分的蛋白。用pH为3.5的10mM甘氨酸从蛋白A树脂中洗脱蛋白质。随后,将蛋白洗脱液分级,并且通过尺寸排阻色谱法(SEC)进一步纯化。通过快速蛋白质液相色谱法在HBS缓冲液(10mM HEPES,150mM NaCl,pH 7.4)中使用Superdex 200Increase 10/300GL(宾夕法尼亚州匹兹堡市通用电气医疗集团(GE Healthcare,Pittsburgh,PA))执行SEC。通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进一步分析峰级分以确认含量。
利用与Fzd1和Fzd2的铰链区结合的抗体来证明,除了Fzd7铰链之外,其它Fzd铰链区也产生活性Wnt替代分子。这些抗体的重组Fab片段是通过瞬时转染从Expi293F细胞(马萨诸塞州沃尔瑟姆的赛默飞世尔科技公司)产生的。用镍树脂从培养基中纯化Fab,并且用尺寸排阻色谱法(SEC)进一步精制。
抗FZD1铰链和抗FZD2铰链抗体都被克隆到人IgG1框架中,其中Fc中具有LALA-PG突变以减少效应子功能。LRP5结合体#3(008S-D01;SEQ ID NO:97)或LRP5/6结合体#36(013S-D05;SEQ ID NO:91和96)在框架中克隆到相应抗体的轻链的N端,如图2B所描绘的。根据制造商的说明书,通过将相应的表达载体转染到Expi293F细胞(马萨诸塞州沃尔瑟姆的赛默飞世尔科技)中来制备重组附接IgG蛋白。简言之,在转染后四天,在使细胞团块旋转减慢后收集细胞培养基。培养基与蛋白A树脂(马萨诸塞州沃尔瑟姆的REPLIGEN)一起温育,以收集含有人IgG-Fc部分的蛋白。用pH为3.5的10mM甘氨酸从蛋白A树脂中洗脱蛋白质。随后,将蛋白洗脱液分级,并且通过尺寸排阻色谱法(SEC)进一步纯化。通过快速蛋白质液相色谱法在HBS缓冲液(10mM HEPES,150mM NaCl,pH 7.4)中使用Superdex 200Increase 10/300GL(宾夕法尼亚州匹兹堡市通用电气医疗集团(GE Healthcare,Pittsburgh,PA))执行SEC。通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进一步分析峰级分以确认含量。结果指示,这些抗体也产生了活性Wnt替代分子。
实例3
铰链区特异性Wnt替代分子的结合动力学
通过生物层干涉测量法(BLI)、使用Octet Red 96(加利福尼亚州佛瑞蒙的PALLForteBio(PALL ForteBio,Fremont,CA))仪器、在30℃、1000rpm下利用链霉亲和素(SA)生物传感器来确定1791-3和1291-3与Fzd7 CRD或具有细胞外铰链区序列的Fzd7CRD(Fzd7CRD+铰链)的结合动力学。N端生物素化的Fzd7 CRD和Fzd7 CRD+铰链蛋白在SA生物传感器上被捕获。捕获生物素化Fzd7之后,将具有捕获的生物素化Fzd7的SA生物传感器浸入含有在处于运行缓冲液中的7种不同浓度下的相关抗体的孔以及仅将运行缓冲液作为参考通道的孔中。KD由全局拟合确定。如图2C所示,这两种抗体融合蛋白仅与具有铰链区的Fzd7蛋白结合,而不单独与Fzd7 CRD结构域结合。
实例4
铰链区特异性Wnt替代分子的体外活性
在293STF细胞系中评定了1791-3和1291-3激活Wnt信号传导的能力,其中稳定整合了β-连环蛋白荧光素酶报告基因质粒Super TOP Flash(STF)。如图2D所示,1791-3和1291-3都激活了Wnt信号传导,如通过在存在20nM R-脊椎蛋白2(RPSO)的情况下在这些细胞中诱导荧光素酶报告基因来判断的。尽管1291-3对Fzd7 CRD+铰链具有更高的亲和力,1791-3也显示出比1291-3更高的活性,这表明两种抗体之间几何形状的潜在差异可以引起活性的差异。对另一种Wnt替代分子R2M3-3(Fzd结合体001S-A04;Lrp结合体008S-D01;SEQID NO:109-110)也进行了测试,其可以接合Fzd1、Fzd2、Fzd7、Fzd5和Fzd8。如图2D所示,来自1791-3的最大效应接近多家族(multifamily)特异性R2M3-3的效应。
在过度表达Fzd1或Fzd2的293STF细胞系中评定了包括结合Fzd1或Fzd2铰链区的抗体的Wnt替代物激活Wnt信号传导的能力,其中稳定整合了β-连环蛋白荧光素酶报告基因质粒Super TOP Flash(STF)。针对荧光素酶报告基因测定,在每个96孔板中,接种1百万个细胞,以3μM的最终浓度添加IWP2(wnt信号传导抑制剂)。在接种后26小时,将化合物一式三份添加到96孔板中,其中从100nM开始10倍系列稀释,并且最高浓度为500nM。18小时之后,用100μl裂解缓冲液来裂解细胞。从上述裂解的细胞中,将20ul样品转移到不透明的96孔板中。向每个孔中添加10μl荧光素酶底物。立即将板放置在分子装置Lum96板读取器中,并且收集荧光素酶发光信号。数据用Prism7处理。这些抗体激活Wnt信号传导,如通过在存在20nM R-脊椎蛋白2(RPSO)的情况下具有Fzd1或Fzd 2过表达的这些细胞中诱导荧光素酶报告基因来判断的。这些结果表明,当与LRP结合体组装时,Fzd铰链结合抗体可以诱导Wnt信号传导激活。
实例5
多特异性Wnt替代分子的产生
将来自单特异性Wnt替代分子的序列组合以产生具有Fzd结合特异性的期望组合的多特异性Wnt替代分子。如图3A所描绘的,使用杵臼技术将两种单特异性Wnt替代分子:结合Fzd4的4SD1-3(Fzd结合体004S-D01;Lrp结合体008S-D01;SEQ ID NO:115-116)以及结合Fzd9的14SB6-3(Fzd结合体014S-B06;Lrp结合体008S-D01;SEQ ID NO:117-118),组合成杂Ig Wnt替代分子杂Ig 4SD1-3+14SB6-3(SEQ ID NO:120和122)。杂Ig分子的一半来自4SD1-3,其中在CH3结构域(SEQ ID NO:120)中引入了“臼”突变。分子的这一半含有到Fzd4的一个结合臂和到LRP5的一个结合臂。杂Ig分子的另一半来自14SB6-3,其中在CH3结构域(SEQ IDNO:122)中引入了“杵”突变。分子的这一半含有到Fzd9的一个结合臂和到LRP5的一个结合臂。最终的Wnt替代物(杂Ig 4SD1-3+14SB6-3)为四价三特异性分子,其含有到Fzd4的一个结合臂、到Fzd9的一个结合臂以及到LRP5的两个结合臂。
还产生了两种控制分子:4SD1-3单价双特异性(SEQ ID NO:120和123)和14SB6-3单价双特异性(图3A)(SEQ ID NO:122和124)。4SD1-3单价双特异性分子含有杂Ig的具有“臼”突变(SEQ ID NO:120)的4SD1-3半部,其与具有“杵”突变(SEQ ID NO:123)的Fc配对,但不具有Fab臂;因此,此分子对Fzd4和LRP5是双特异性但单价的。14SB6-3单价双特异性含有杂Ig的具有“杵”突变(SEQ ID NO:122)的14SB6-3半部,其与具有“臼”突变(SEQ ID NO:124)的Fc配对,但不具有Fab臂;因此,此分子对Fzd9和LRP5是双特异性但单价的。
通过4步纯化工艺对杂Ig 4SD1-3+14SB6-3、4SD1-3单价双特异性和14SB6-3单价双特异性进行纯化。由于含有“杵”突变的Fc也含有FLAG标签,并且含有“臼”突变的Fc也含有His标签,因此这些蛋白质首先通过蛋白质A和Ni-NTA亲和力纯化步骤纯化,之后是SEC步骤;抗FLAG M2珠用作最后的纯化步骤。
实例6
多特异性Wnt替代分子的表征
在存在或不存在20nM RPSO的情况下,在Wnt响应性293STF报告基因细胞中评定了杂Ig 4SD1-3+14SB6-3、4SD1-3单价双特异性和14SB6-3单价双特异性激活Wnt信号传导的能力(图3B-3E中仅显示了在存在RPSO的情况下的数据)。对可以结合Fzd1、Fzd2、Fzd7、Fzd5和Fzd8的R2M3-3也进行了测试。
293STF细胞系表达低水平的Fzd4,并且通过QPCR没有检测到Fzd9表达。除R2M3-3之外的所有分子在亲代293STF细胞中显示出非常少的活性或没有活性(图3B)。
产生了基于逆转录病毒的Fzd4过度表达293STF稳定细胞系(293STF Fzd4OE)。在此细胞系中,R2M3-3和4SD1-3(Fzd4单特异性)均强效激活Wnt信号传导,而杂Ig 4SD1-3+14SB6-3显示非常弱的活性,并且Fzd9单特异性分子14SB6-3是无活性的(图3C)。
通过瞬时转染将Fzd9引入亲代293STF细胞中,以产生293STF Fzd9OE细胞系。在此细胞系中,R2M3-3和14SB6-3(Fzd9单特异性)都能够激活Wnt信号传导,而杂Ig 4SD1-3+14SB6-3显示非常弱的活性,并且Fzd4单特异性分子4SD1-3是无活性的(图3D)。
通过逆转录病毒Fzd4递送和Fzd9瞬时转染的组合,将Fzd4和Fzd9共同引入293STF细胞中,以产生293STF Fzd4OE+Fzd9OE细胞系。在此细胞系中,R2M3-3、4SD1-3、14SB6-3和杂Ig 4SD1-3+14SB6-3都是完全活性的(图3E)
两种单价双特异性分子,4SD1-3单价双特异性和14SB6-3单价双特异性,在所有细胞中都是无活性的(图3B-3E)。这些结果表明,对于两种单特异性结合体,与LRP5结合体组合的单价双特异性不能诱导或不能有效诱导Wnt信号传导。因此,观察到的杂Ig 4SD1-3+14SB6-3的活性确实是Fzd4和Fzd9蛋白以及LRP接合的结果。这些结果进一步表明,此方法可以应用于两种或更多种不同特异性的Fzd结合体的任何组合,从而使得能够通过此工艺来产生任何期望的Fzd特异性组合。
此实例表明,两种不同特异性的Fzd结合体可以以杂Ig形式组合,以产生不同特异性的Wnt替代分子。此概念也可以扩展到在两种不同表位上将两种Fzd结合体用于同一Fzd。所得的杂Ig Wnt替代分子将是双互补位分子,这对于进一步的受体聚集和Wnt信号传导的激活可以是有利的。
实例7
典型和非典型信号传导Fzd受体以及LRP受体结合的异源二聚化引起β-连环蛋白依赖性信号传导的激活
Wnt信号传导可以通过β-连环蛋白依赖性(典型)和β-连环蛋白非依赖性(非典型)通路介导。据报道,存在激活β-连环蛋白非依赖性信号传导的Fzd受体,如Fzd6,而其它Fzd受体激活β-连环蛋白依赖性信号传导。先前没有考虑非典型Fzd受体与Lrp的强制二聚化或典型和非典型Fzd受体与Lrp的异源二聚化是否可以引起β-连环蛋白依赖性或β-连环蛋白非依赖性信号传导。为了测试这些想法,产生了以下实例。
首先,将由针对非典型受体Fzd6的二价结合臂(004S-C10)组成的多价分子与针对Lrp5的二价结合臂(3;004S-D01)组合。所述分子被命名为4SC10-3(图5A的上图区)。当Fzd结合体针对典型的Fzd受体时,这种形式已被证明能激活β-连环蛋白依赖性信号传导。然而,如图5A的下图区所示,与接合Fzd1、2、7、5、8的阳性对照分子R2M3-26(Fzd结合体001S-A04;Lrp结合体009S-E04)相比,4SC10-3在293STF报告基因细胞中(在存在20nM R-脊椎蛋白的情况下)不能有效激活β-连环蛋白依赖性信号传导。
接下来,将由4SC10和与Fzd1、2、7(典型的Fzd受体)结合的另一个Fzd结合臂1RC07(001S-B03)组成的多价分子与针对Lrp5的二价结合臂(3)组合。所述分子被命名为杂Ig4SC10-3+1RC07-3(图5B的上图区),并且其在293STF报告基因细胞中激活β-连环蛋白依赖性信号传导。为了排除1RC07-3臂单独能够激活信号传导的可能性,也测试了图5C上图区所示的1RC07-3单价双特异性分子。如图5C所示,1RC07-3单价双特异性分子不能有效激活信号传导。这些结果首次证明,将典型的和非典型的Fzd受体与Lrp组合可以引起β-连环蛋白依赖性信号传导。
实例8
探索Wnt替代分子中Fzd与Lrp结合体的不同比率对β-连环蛋白依赖性信号传导的影响
多价形式产生了强效且高度有效的Wnt信号传导激活剂。实验被设计用于测试所述形式对内源性Wnt信号传导的影响。为了理解二价/多价Lrp结合臂对内源性Wnt配体的影响,用R2M3、R2M3mut(Y9A)的无效突变体产生了无活性的替代分子,并且与Lrp结合体3或26融合,并且分别命名为R2M3mut-3或R2M3mut-26。如图6A所示,虽然在存在20nM R-脊椎蛋白的情况下,野生型R2M3替代物R2M3-3和R2M3-26在293STF Wnt报告基因细胞系中具有完全活性,但是R2M3mut-3和R2M3mut-26是无活性的。为了测试替代分子中二价Lrp臂对内源性Wnt信号传导的影响,在存在含有Wnt3A的20%条件培养基的情况下,在293STF Wnt报告基因细胞系中测试了这两种无活性的替代分子。如图6B所示,尽管R2M3mut-3和R2M3mut-26自身是无活性的,但是R2M3mut-3以剂量响应方式与Wnt3a协同作用,并且R2M3mut-26以剂量响应方式拮抗Wnt3a。这表明多价形式可能具有与内源性Wnt配体相互作用的潜力。
为了理解减少与内源性Wnt潜在相互作用的形式,并且进一步理解主动信号传导所需的受体结合体的数量,探索了多价替代分子中Fzd和Lrp结合体的不同数量和比率。
由于Lrp结合臂的二价性可能导致与内源性Wnt的协同作用,因此测试了去除一个Lrp结合臂,因此在最终分子中存在两个Fzd结合臂和一个Lrp结合体;此分子被称为2:1。最初的分子形式是2:2,因为存在两个Fzd结合体和两个Lrp结合臂。与2:2形式相比,2:1分子的一个实例1RC07-3(2:1)在图6C左图区中示出。如图6C右图区所示,1RC07-3(2:1)是活性的并且能够在293STF报告基因细胞中诱导Wnt信号传导。原则上,这种形式应该缺乏通过Lrp共受体的交联来与内源性Wnt配体协同作用的能力。还构建了反向比率,一个Fzd结合体和两个Lrp结合体,如图6D中的几个形式所举例说明的。通常,这些分子最多显示出适度的信号传导诱导(图6D)。
由于2:2形式的异源二聚化Fzd可以诱导Wnt信号传导(如图3和图5所示),因此构建了使两个不同的Fzd结合体与一个Lrp结合体(1:1:1)形式异源二聚化的分子,并且测试了所述分子赋予Wnt信号传导的能力。如图6E所示,1:1:1分子的几个实例都激活了293STF报告基因细胞中的Wnt信号传导。在此结构中测试的Fzd结合体包含R2M3(001S-A04)、1RC07(001S-B03)、R2M13(004S-G06)和5S-H5(005S-H05)。
实例9
Lrp结合体以及Fzd结合的异源二聚化引起Wnt信号传导的激活
除了异源二聚化/多聚化不同的Fzd受体结合体外,还测试了异源二聚化/多聚化不同的Lrp共受体结合体对Wnt信号传导的影响。如上所示,两个Fzd:一个Lrp形式减轻了与内源性Wnt配体的协同作用。为了确定针对Lrp上两个不同区的异源二聚化的/多聚化的Lrp结合体是否也可以减轻二价Lrp结合体形式对内源性Wnt配体的协同效应,进行了测试。如图7A所示,以2:1:1的比率构建了几个实例,其中两个不同的Lrp结合体(一个结合到Lrp5E1E2,另一个结合到Lrp6E3E4)各自与Fzd结合体1RC07的轻链的N端融合,作为1RC07-3-26NL(2:1:1);或者与1RC07重链的N端融合,作为1RC07-3-26NH(2:1:1)。这两种分子在诱导Wnt信号传导方面都是高度活性的,如在293STF Wnt响应性报告基因细胞中检测到的(图7B)。
最后,产生了具有两个不同Fzd结合臂和两个不同Lrp结合臂的多价分子,其被称为1:1:1:1形式,如图7C所示。1RC07-26+4SD1-3(1:1:1:1)和R2M9-26+1RC07-3(1:1:1:1)组合都引起Wnt信号传导的强诱导(图7D)。R2M9结构含有003S-E07 Fzd结合元件。
图5-7所示的实例说明了用于诱导典型或非典型的Wnt信号传导(或两者)的各种结构,以及通过靶组织内的内源性Wnt配体与信号传导协同作用、拮抗信号传导或留下不受影响的信号传导的能力。这种可溶性Wnt替代配体的通用集合可以用于具有定制Wnt信号传导的疗法,所述疗法可以允许最大的治疗效果和最小的副作用。
实例10
含有不同化学计量比率的Fzd和LRP结合体的Wnt替代分子的结构功能分析
通过将FZD结合体(scFv形式的18R5抗体)和Dickkopf(DKK1c)的C端部分连接成单个多肽链(18R5-DKK1c)产生的替代WNT激动剂表现出激活WNT/β-连环蛋白信号传导的能力(Janda等人,2017,《自然》,545(7653):234–237)。基于此概念产生了各种FZD和LRP结合抗体片段的组合。
Fzd结合scFv(被称为F1、F2和F3)和LRP scFv(被称为L1和L2)的序列以及用于组合其的接头序列在表6A中示出。由于这些分子具有到每个靶的单价结合臂,所以将这种形式称为二价双特异性形式(表示为1:1以表示结合一个FZD和一个LRP分子的化学计量)。
测试了串联scFv构建体的另外的化学计量。表6B示出了用于此分析的组合Wnt替代构建体的总结。
表6A:用于化学计量分析的Wnt替代组分
表6B:组合Wnt替代构建体
产生的分子集合用scFv形式的LRP结合抗体片段替换了18R5-DKK1c分子中的DKK1c组分(Janda等人,2017,《自然》,545(7653):234–237),以产生串联scFv分子,如图8A所描绘的。LRP结合体是LRP6 E1E2结构域结合体,1115.3(US 8,715,941B2),其在本文中被称为L1。为了测试几何形状对活性的影响,将L1与18R5 scFv(在本文中被称为F1)的N端或C端融合,其间具有5、10或15个氨基酸接头。通过Ni亲和柱(图8B)将此组六种蛋白质纯化到接近均质,并且在WNT应答性293STF报告基因细胞中进行测试。虽然接头长度似乎不会显著影响活性,但是将LRP6结合体与FZD结合体的N端融合会引起比其它朝向高得多的活性(比较图8C和图8D,注意y轴的差异)。与平行测试的WNT3A和18R5-DKK1c相比,所有这些新的替代分子显示出更低的Emax(最大应答)(图9)。
由于scFv片段具有形成更高分子量聚集体的趋势,为了确认替代WNT活性是否来自串联scFv分子的单体形式,这六种蛋白质在尺寸排阻色谱(SEC)上纯化,并在293STF报告基因细胞中测试对应于单体形式的峰级分。与SEC之前的Ni纯化材料相比,SEC纯化的蛋白质显著丧失活性(将图8E和8F与8C和8D进行比较)。在293STF报告基因细胞中测定了跨SEC运行的级分。鉴定了柱级分的峰活性;然而,STF活性峰与单体分子的蛋白质峰不一致。相反,在所有情况下,STF活性在较高分子量级分中达到峰值(图8G和8H,图8I所示的SEC分子量标准),从而表明1:1串联scFv分子在诱导β-连环蛋白依赖性信号传导方面无效。这些结果表明,WNT信号传导的有效激活需要受体复合物的多聚化。含有6 x His标签的串联scFv分子人工地与抗His抗体交联,并且在293STF报告基因测定中进行测试。如图8J所示,虽然在存在同种型对照(抗GFP)抗体的情况下,来自单体级分的L1:5:F1单独不能有效激活β-连环蛋白依赖性信号传导,但添加抗His抗体显著诱导了信号传导,从而支持了信号传导可能需要受体复合物多聚化的观点。
如图10A所描绘的,通过将L1和F1串联scFv融合附接到Fc片段的N端以产生四价双特异性形式来以更明确且容易产生的形式产生多价分子。在这种形式中,针对每个受体靶存在两个结合位点(在后面的章节中表示为2:2,表示两个FZD和两个LRP的化学计量比率)。这些蛋白质通过蛋白A亲和步骤、然后进行SEC来纯化。如图10B和10C所示,来自SEC级分的293STF测定的活性峰与对应于图10A所示分子的单体种类的蛋白质峰一致。SEC分子量标准如图10D所示。这些新的构型证明了STF与主要蛋白质峰之间的相关性。还进行了峰级分的剂量应答曲线,虽然接头长度似乎并未显著影响活性,但是两个结合体的相对朝向确实影响了活性。将L1与F1的N端融合是这两个结合体的组合的优选朝向(比较图10E和10F y轴)。与WNT3A和18R5-DKK1c相比,这些多价双特异性FZD/LRP结合分子的活性的相对Emax类似于图8(图11)所示的预SEC材料的活性。在此四价双特异性形式中,结合臂与其相应受体的亲和力是使用Octet仪器上的生物层干涉法测定的。如图11B所示,相对朝向和接头长度对相应臂与其靶受体的亲和力没有影响,从而表明朝向对报告基因活性的影响不是由于形式对结合的影响,而是由替代分子组装的受体的几何形状引起的。
DKK1c主要结合LRP E3E4结构域(Ahn等人,2011,Cheng等人,2011)。为了理解LRP表位对活性的影响,以1:1串联scFv形式测试了F1与LRP6E3E4结合体YW211.31.57(US 8,846,041 B2)(在本文中称为L2)的融合,其中L2与F1 scFv的N端或C端融合,其间具有5、10或15个氨基酸接头。虽然与L1/F1融合蛋白(图13A)相比,这些融合蛋白表现较差并以较低的水平表达,但是类似于图8所示的L1/F1融合蛋白,L2/F1融合的1:1串联scFv在293STF报告基因细胞中诱导β-连环蛋白依赖性信号传导方面也是无效的,如在跨SEC柱的活性测试(图13A)以及来自SEC柱的单体峰级分的滴定(图13B)中所见的。串联scFv L2/F1分子与Fc片段的融合产生2:2四价双特异性分子会有效激活典型的WNT信号传导。如图12A所示,来自SEC级分的293STF测定的峰与对应于单体物种的蛋白质峰一致。这些L2/F1融合分子比Emax范围类似于WNT3A的L1/F1融合分子具有更高的活性,并且显著改进了超过WNT3A和18R5-DKK1c的效价(图12B)。L2和F1组合对朝向的敏感性较小;两种朝向都产生类似的Emax,而在15聚体接头的情况下在F1的N端具有L2产生更高的效价(图12B和12C)。
作为用于验证2:2四价双特异性分子激活WNT信号传导需要结合FZD和LRP受体的对照,FZD结合体(F1)或LRP结合体(L1或L2)被以2:2四价双特异性形式结合GFP的scFv片段替换。这些分子被称为四价单特异性或2:0或0:2形式。如图12D和12E所示,虽然所有这些分子都结合到其相应的受体,但是这些四价单特异性分子均没有活性,从而表明激活WNT信号传导的能力需要FZD和LRP的接合。
为了产生具有不同FZD特异性的WNT替代分子并且理解针对WNT信号传导的多价性要求是否是FZD结合体F1(其结合FZD1、2、7、5、8,Gurney等人,2012)之外的总体要求,在两个LRP6结合体L1和L2的情况下,在另外的FZD结合体R2H1(US 2016/0194394 A1)(其结合到FZD1、2、7,在本文中被称为F2)与2919(WO 2017/127933 A1)(其结合到FZD5、8,在本文中被称为F3)之间产生融合蛋白。在Octet结合测定中验证了F2和F3的特异性(图15A)
1:1串联scFv形式的F2/L1组合由5聚体和15聚体接头构建。类似于图8中的F1融合数据,跨SEC柱的峰STF活性广泛分布在较高分子量级分中,并且与分子的单体形式的峰不一致(图15B)。相比之下,当串联scFv以2:2四价双特异性形式与Fc片段融合时,跨SEC柱的STF峰活性与单体形式一致(图14A)。在更高分子量级分中还观察到SEC柱上的第二STF活性峰,这在F1融合分子中未观察到(图14A)。来自293STF报告基因细胞的单体SEC峰级分的剂量应答曲线显示出对L1与F2的N端融合的轻微偏好,以获得类似于与F1的融合(图10)的更高的活性(图14B)。
F2与L2之间的融合也以各种形式构建(表6B)。虽然在SEC柱上,峰STF活性与以1:1形式与L2的N端融合的F2的单体形式不一致(图14C),但是似乎L2与F2的N端融合的反向朝向的单体1:1形式是活性的(图14D)。与优选5聚体接头的WNT3A相比,此朝向上的峰级分的剂量应答显示出较弱的活性(图14E)。来自这些串联scFv与Fc的N端融合的2:2四价双特异性形式产生了高度强效的分子。在SEC柱上,峰STF活性与蛋白质峰一致,所述蛋白质峰与单体形式一致(图14F和14H),并且293STF报告基因细胞中的剂量应答显示出强效且有效的分子,超过了图3所示的F1/L2融合的活性(图14G和14I)。
在F3与两个LRP结合体之间还构建了1:1二价双特异性串联scFv形式和2:2四价双特异性Fc融合。类似于图8所示的对F1融合的观察,对于F3与L1或L2之间的1:1串联scFv融合分子,没有观察到稳健的活性(图17)。相比之下,来自SEC柱级分的2:2的四价双特异性形式的F3、LRP结合体与Fc之间的融合分子的293STF报告基因活性与分子的单体形式的蛋白质峰一致(图16A和16B)。值得注意的是,类似于与F1和F2融合,SEC峰级分的剂量应答显示出L2-F3融合在两个朝向上都具有高度活性,而L1-F3融合活性较低,并且显示对L1在F3的N端上的偏好(图16C和16D)。所有这些结果共同表明,FZD和LRP结合的多价性以及两个FZD和两个LRP的化学计量是β-连环蛋白依赖性信号传导的一致且有效激活所必需的,至少在所测试的结合体中是如此。
在建立了对有效诱导典型的WNT信号传导的多价性要求后,探索了替代性2:2四价双特异性形式(称为哑铃形式),其中如图18A和18B所示,两个scFv结合体附接到Fc片段的两个末端。在报告基因测定中,F1与L1以此哑铃形式的融合最低限度地激活了WNT信号传导(图18A)。有趣的是,还存在对L1分子的朝向的偏好,其中其与Fc的C端的附接影响活性。F1和L2以此形式的融合还会激活WNT信号传导,其中在LRP结合臂的朝向上具有类似的偏好(图18B)。还测试了这些分子的跨SEC柱的活性,并且如图18C所示,峰STF报告基因活性与对应于蛋白质单价形式的蛋白质峰一致。
为了理解来自2:2四价双特异性形式的活性是由于同一替代分子同时结合多个FZD和LRP,还是由于由所述形式提供的独特几何结构不需要与受体的多价结合引起的,进行用于评定1:1串联scFv形式是否允许同时结合FZD和LRP的Octet结合研究。如图19A所示,通过向传感器表面顺序添加FZD8 CRD,之后是1:1串联scFv L2:5:F3或F3:5:L2,并且然后LRP6 E3E4,观察到结合信号的逐步增加。这表明1:1串联scFv分子能够同时与两种受体结合,并且因此,这些分子缺乏诱导WNT信号传导的活性不是由于不能交联FZD和LRP受体引起的。
然而,为了确定2:2四价双特异性形式是否仍然通过独特的几何结构以1:1的方式与受体接合,所述几何结构允许1:1串联scFv形式未提供的信号传导。如图19B和图20所描绘的,在2:2四价双特异性分子的框架上构建了可能的1:1几何结构的4种不同变体。这4种分子中没有一种分子诱导WNT信号传导(图19C和图20A),从而表明有效的信号传导需要受体的交联的多个拷贝。
为了进一步理解FZD受体与LRP受体的所需比率,如图21A和21D所描绘的,构建了2个FZD结合体与1个LRP结合体(2:1)或1个FZD结合体与2个LRP结合体的组合(1:2)。如图21所示,从2:2形式中去除1个FZD结合体或1个LRP结合体仍然激活β-连环蛋白依赖性信号传导。由于图19中所示的1:1形式没有激活信号传导,所以这些结果进一步支持了多个FZD和LRP的同时接合对于有效信号传导是必要的概念。由于与比去除1个FZD结合体相比,去除1个LRP结合体对活性的影响小得多,所以这些结果也表明FZD受体的二聚化对于信号传导复合物的形成更重要。
已经建立了对典型的WNT信号传导有效诱导的多价性要求,然而,由于替代分子中的FZD结合臂中的每一个对几种不同的FZD受体具有特异性,尚不清楚信号传导是否可以来自不同FZD受体的异源二聚化。为了解决此问题,将具有非重叠特异性的两个FZD结合体F2和F3组合成一个分子,如图21G所描绘的。尽管以1:2形式的F2或F3(1个FZD结合体与LRP结合体的2个拷贝相组合,图21B和21C)分别在293STF报告基因细胞中显示出低至非常低的活性,但是将F2和F3以及LRP结合体L2的2个拷贝组合形成一个分子(将此称为1:1:2形式,其中化学计量为一个FZD加一个不同的FZD加两个LRP)产生了高度强效且有效的替代分子(图21H)。为了进一步确认这一点,构建了具有F2和F3以及LRP结合体L2的一个拷贝的分子(1:1:1:0形式,其中化学计量为一个FZD加一个不同的FZD加一个LRP结合体,表6B和图21I)。此分子也是高度活性的(图21J),即使F2或F3单独与L2的一个拷贝没有显示出活性(图20)。由于F2和F3结合不同的FZD,所以这些结果表明FZD的异源二聚化引起β-连环蛋白依赖性信号传导。
作为最后的构型,还构建了具有两个不同FZD结合臂和两个不同LRP结合臂(1:1:1:1形式)的替代分子,如图21K所描绘的。值得注意的是,尽管与WNT3A相比,含有LRP结合体L1的替代分子始终产生低得多的Emax,但当在1:1:1:1形式的上下文中与L2组合时,产生了高度强效且有效的分子(图21L)。
所有的观察结果一起证明了新的替代WNT平台是灵活的,可以产生任何FZD/LRP特异性组合,并且可以产生高度强效且具有活性的分子。
上述各种实施例可以被组合以提供进一步的实施例。本说明书中提及的和/或在申请数据表中列出的所有美国专利、美国专利申请出版物、美国专利申请、外国专利、外国专利申请和非专利出版物均通过全文引用的方式并入本文中。如果需要,则可以修改实施例的方面以采用各个专利、申请和出版物的概念来提供又另外的实施例。鉴于以上详细描述,可以对实施例进行这些以和其它改变。
总之,在以下权利要求书中,所使用的术语不应当被解释为将权利要求书限制于本说明书和权利要求书中所公开的特定实施例,而是应当被解释为包含所有可能的实施例连同此类权利要求有权获得的等效物的整个范围。因此,权利要求书并不受本公开的限制。
- 多特异性WNT替代分子和其用途
- 组织特异性WNT信号增强分子和其用途
