一种麦芽糖结合蛋白、麦芽糖结合蛋白表达载体、重组工程菌及其应用
文献发布时间:2023-06-19 10:38:35
技术领域
本发明涉及麦芽糖结合蛋白制备技术领域,尤其涉及一种麦芽糖结合蛋白、麦芽糖结合蛋白表达载体、重组工程菌及其应用。
背景技术
大肠杆菌麦芽糖结合蛋白(maltose binding protein,MBP)由大肠杆菌malE基因编码,主要负责大肠杆菌的转运及糖代谢。以往被认为无生物学活性或生物学活性较低,在现代分子生物学研究经常作为标签蛋白使用。目前,关于MBP的免疫增强活性的研究越来越受到关注。
现有研究发现,MBP体外可诱导Th1的活化,增强NK细胞的杀伤活性及巨噬细胞的吞噬功能,提示MBP具有免疫增强作用。MBP联合BCG作为疫苗佐剂能够协同诱导Th1的活化,增加IFN-γ的分泌水平,进一步的研究证明,MBP联合BCG在体外可直接作用于CD4+T细胞,涉及的分子机制与TLR2/TLR4/TLR9及其它们之间的信号通路有关。而后续研究显示MBP联合BCG可以通过TLR2和TLR4诱导DC细胞活化和成熟,从而间接促进Th1细胞活化。基于上述研究结果,MBP有可能作为免疫增强剂用于疫苗的研发,而为了进一步研究MBP的免疫效应,需要简单而高效的制备麦芽糖结合蛋白的工艺。
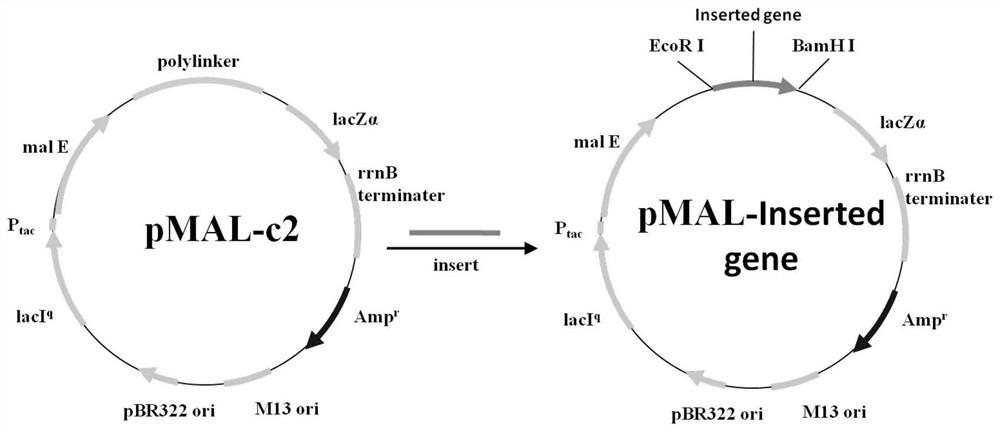
pMAL-C2系统是一种高效的蛋白融合表达及纯化系统。pMAL-C2载体含有编码MBP的大肠杆菌malE基因,其下游的多克隆位点便于目的基因插入,从而表达N端带有MBP的融合蛋白。该载体可通过"tac"强启动子和malE翻译起始信号使克隆基因获得高效表达,并进一步利用MBP对麦芽糖的亲和性达到用Amylose柱对融合蛋白的一步亲和纯化。该载体在malE和多酶切位点之间含有Xa因子酶切位点(IEGRIEF,在R与I间酶切),在Xa因子酶切位点后插入目的基因片段,可以通过酶切使MBP与目的蛋白得以分离。
pMAL-C2载体含有编码MBP的大肠杆菌malE基因,在不插入目的基因的情况,可用于表达和纯化MBP,但表达的蛋白会带有下游的LacZα序列,需要后续通过Xa因子酶切位点酶切去除LacZα,这一制备过程比较复杂。如在pMAL-C2载体malE基因后多克隆位点插入含终止密码的基因片段,则可避免LacZα基因的表达,从而通过亲和层析直接获得MBP(43.12KD)。
发明内容
本发明的目的在于提供一种麦芽糖结合蛋白、麦芽糖结合蛋白表达载体、重组工程菌及其应用。利用本发明的麦芽糖结合蛋白表达载体或重组工程菌能够简单、高效的制备得到麦芽糖结合蛋白。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种麦芽糖结合蛋白表达载体,所述麦芽糖结合蛋白表达载体以pMAL-C2作为原始载体,在malE基因后插入含有终止密码的基因。
优选的,所述含有终止密码的基因插入在pMAL-C2上的EcoRⅠ和BamHⅠ位点之间。
本发明还提供了一种包括上述方案所述麦芽糖结合蛋白表达载体的重组工程菌。
本发明还提供了上述方案所述麦芽糖结合蛋白表达载体或者所述重组工程菌在制备麦芽糖结合蛋白中的应用。
本发明还提供了一种基于上述方案所述麦芽糖结合蛋白表达载体或者所述重组工程菌制备得到的麦芽糖结合蛋白。
本发明还提供了一种疫苗免疫增强剂,所述免疫增强剂包括CPG-ODN和上述方案所述麦芽糖结合蛋白。
本发明还提供了上述方案所述免疫增强剂在制备免疫增强的药物中的应用。
优选的,所述免疫增强剂作为疫苗佐剂使用。
优选的,所述麦芽糖结合蛋白和CPG-ODN通过促进淋巴细胞增殖、诱导淋巴细胞向Th1细胞增殖分化、提高DC的比例、提高cDC1的比例、提高cDC2的比例和上调DC成熟来增强疫苗免疫效果。
本发明提供了一种麦芽糖结合蛋白表达载体,所述麦芽糖结合蛋白表达载体以pMAL-C2作为原始载体,在malE基因后插入含终止密码的基因。本发明所述麦芽糖结合蛋白表达载体以pMAL-C2作为原始载体,在malE基因后插入含有终止密码的基因。本发明在所述pMAL-C2载体malE基因后多酶切位点区插入含有终止密码的基因,能够避免下游LacZα基因的表达,在基于麦芽糖结合蛋白表达载体制备麦芽糖结合蛋白的过程中,无需酶切去除LacZα的工艺,通过亲和层析能够直接获得MBP(43.12KD),能够简化MBP(43.12KD)的制备过程。
附图说明
图1为pMAL-C2载体改造的示意图;
图2为改造后pMAL-inserted gene载体酶切电泳鉴定结果,其中1为marker,2为pMAL-C2载体,3为酶切pMAL-C2载体,4为改造后pMAL-inserted gene载体,5为酶切改造后pMAL-inserted gene载体;
图3为菌尘高压均质SDS鉴定结果;
图4为纯化蛋白SDS鉴定结果,其中1和16为Marker;2为流出液;3和4为洗杂液;5-15以及17-20为洗脱液;
图5为2次超滤离心后MBP蛋白中细菌内毒素含量检测结果,其中1号阴性结果为阴性,2号阳性结果为阳性,3号MBP蛋白为阴性,4号供试品阳性为阳性则内毒素合格;
图6为WST1检测小鼠脾淋巴细胞增殖结果(1.5h),*p<0.05,**p<0.01;
图7为ELISA检测小鼠脾淋巴细胞培养上清中IFN-γ结果,*p<0.05,**p<0.01;
图8表示MBP联合CpG2006体外刺激对脾细胞中DC亚群的影响,其中A为设门策略;B为小鼠脾细胞中DC各亚群的代表性流式散点图;C为DC总群和XCR1+DC亚群比例;D为cDC2和pDC亚群比例;*p<0.05,**p<0.01;
图9表示MBP联合CpG2006体外刺激对脾细胞中DC成熟的影响,其中A为小鼠脾细胞中DC上成熟标志物的代表性流式散点图;B为小鼠脾细胞中DC上成熟标志物的表达水平;*p<0.05,**p<0.01;
图10表示MBP联合CpG2006在小鼠体内的协同抗肿瘤作用,其中A为每组10只鼠的瘤重;B为肿瘤抑制率,肿瘤抑制率(%)=(1-实验组/对照组肿瘤重量)×100%;*p<0.05,**p<0.01。
图11表示MBP联合CpG2006作为疫苗免疫增强剂对小鼠dLN内DC亚群的影响,其中A为设门策略;B为小鼠dLN中DC各亚群的代表性流式散点图;C为小鼠dLN细胞中DC各亚群的比例;*p<0.05,**p<0.01;
图12表示MBP联合CpG2006作为疫苗免疫增强剂对小鼠dLN内DC成熟的影响,其中A为小鼠dLN中DC上成熟标志物的代表性流式散点图;B为小鼠dLN中DC上成熟标志物的表达水平;*p<0.05,**p<0.01。
图13表示MBP联合CpG2006作为疫苗佐剂对抑瘤率的影响;其中A为每组10只鼠的瘤重;B为肿瘤抑制率,肿瘤抑制率(%)=(1-实验组/对照组肿瘤重量)×100%;*p<0.05,**p<0.01。
图14表示MBP联合CpG2006作为疫苗佐剂对体液免疫及Th细胞免疫应答的影响,其中A为血清中MUC1特异性抗体水平;B为IgG2c/IgG1比例;C为ELISA检测MUC1特异性的脾细胞IFN-γ分泌;D为ELISA检测MUC1特异性的脾细胞IL-4分泌;*p<0.05,**p<0.01。
图15表示MBP(43.12KD)联合CpG2006协同提高CTL杀伤活性,其中A为RTCA方法监测CTL杀伤的动态曲线(E:T为50:1);B为MUC1特异性CTL杀伤活性(在加入效应细胞后72小时计算);MUC1特异性CTL杀伤活性(%)=[1-CI(实验组)/CI(NS组)]×100%;
具体实施方式
本发明提供了一种麦芽糖结合蛋白表达载体,所述麦芽糖结合蛋白表达载体以pMAL-C2作为原始载体,在malE基因后插入含有终止密码的基因;所述含有终止密码的基因的核苷酸序列优选的如SEQ ID NO:1所示,其中4~6为终止密码。
本发明在所述pMAL-C2载体malE基因后多酶切位点区插入含终止密码的基因,能够避免下游LacZα基因的表达,在基于麦芽糖结合蛋白表达载体制备麦芽糖结合蛋白的过程中,无需酶切去除LacZα的工艺,通过亲和层析能够直接获得MBP(43.12KD),能够简化MBP(43.12KD)的制备过程。
在本发明中,所述含有终止密码的基因插入在pMAL-C2上的EcoRⅠ和BamHⅠ位点之间;所述麦芽糖结合蛋白表达载体的核苷酸序列如SEQ ID NO:2所示,其中2695~2700是EcoRI序列,3103~3108是BamHI的序列;1528~2706是malE基因序列;2701~3702是插入的基因;2704~2706是终止密码tag。
本发明还提供了一种包括上述方案所述麦芽糖结合蛋白表达载体的重组工程菌。在本发明中,所述重组菌优选的以大肠杆菌作为原始菌。
本发明还提供了上述方案所述麦芽糖结合蛋白表达载体或者所述重组工程菌在制备麦芽糖结合蛋白中的应用。
在本发明中,当所述重组工程菌的原始菌为大肠杆菌时,所述应用优选的包括以下步骤:
1)将包括所重组载体的重组菌接种至LB液体培养基,进行扩增培养,得到菌液,在菌液中加入IPTG,进行诱导培养,得到诱导液,对所述诱导液离心,收集沉淀,得到菌尘;
2)将所述菌尘溶解于洗液buffer,进行均质破碎,得到均质液,对所述均质液进行离心,收集上清液;
3)对所述上清液进行Amylose亲和层析纯化,得到含麦芽糖结合蛋白的洗脱液。
本发明首先将包括所重组载体的重组菌接种至LB液体培养基,进行扩增培养,得到菌液,在菌液中加入IPTG,进行诱导培养,得到诱导液,对所述诱导液离心,收集沉淀,得到菌尘。
在本发明中,所述LB液体培养基中含有AMP;所述AMP的浓度优选为0.1mg/ml;所述扩增培养的温度优选为37℃;所述扩增培养的方式优选为振荡培养;所述振荡培养的转速为220rpm;所述扩增培养优选的分两次进行,第一次扩增培养的时间优选为12~16h,第一次扩增培养后,将培养的菌液转接至新的LB液体培养基进行第二次扩增培养,第二次扩增培养的时间优选为2~3h,优选的以菌液的OD值为0.8~1.2为准,进一步优选的以菌液的OD值为1为准,表明细菌生长处于对数生长期。在本发明中,所述IPTG的终浓度优选为1mol/mL;所述诱导培养的时间优选为4~5h;所述诱导培养的温度优选为37℃。在本发明中,所述离心的转速优选为8000~10000rpm;所述离心的时间优选为15~20min。
得到菌尘后,本发明将所述菌尘溶解于洗液buffer,进行均质破碎,得到均质液,对所述均质液进行离心,收集上清液;所述均质的次数优选为4次,第1次~第4次均质的压力分别优选为200bar、850bar、850bar和850ba;经四次均质,菌尘完全破裂,蛋白完全释放出来。在本发明中,所述洗液buffer以1L计,优选的包括以下组分:1M Tris-HCl 20ml,0.5MEDTA2ml,NaCl 11.6889g,β-巯基乙醇700μl和余量的超纯水。
得到上清液后,本发明对所述上清液进行Amylose亲和层析纯化,得到含麦芽糖结合蛋白的洗脱液。在本发明中,所述Amylose亲和层析的条件优选的包括:层析柱的直径为1.6cm;层析介质为Amylose resin;洗脱液为含有Maltose的洗液buffer,所述Maltose和洗液buffer的比例为0.18105g:50ml;所述洗脱液的流速为8s/滴。在本发明中,所述洗液buffer的配方如前述内容所述,此处不再赘述。
得到洗脱液后,本发明优选的还包括采用30kD超滤管对所述洗脱液进行第一超滤浓缩,得到第一浓缩液,采用100kD超滤管对所述第一浓缩液进行第二浓缩,得到含麦芽糖结合蛋白的浓缩液。在本发明具体实施过程中,100kD超滤管0.5M NaOH浸泡4h,双蒸水冲洗40次,4000rpm离心15min,去除MBP蛋白中内毒素;所述离心的次数优选为2次。
本发明还提供了一种基于上述方案所述麦芽糖结合蛋白表达载体或者所述重组工程菌制备得到的麦芽糖结合蛋白。
在本发明中,所述麦芽糖结合蛋白的氨基酸序列如SEQ ID NO3所示
本发明还提供了一种免疫增强剂,所述免疫增强剂包括CPG-ODN和上述方案所述麦芽糖结合蛋白。
在本发明中,所述CPG-ODN和麦芽糖结合蛋白在体外实验中,CpG-ODN的浓度优选为10μg/ml,MBP的浓度优选为10μg/ml,刺激培养时间优选为48h。
在本发明中,所述CPG-ODN和麦芽糖结合蛋白在小鼠体内实验中,CpG-ODN的浓度优选为6.25μg/只,MBP的浓度优选为50μg/只,免疫次数优选为5次,免疫时间间隔优选为1周。
在本发明中,所述麦芽糖结合蛋白和CPG-ODN优选的通过促进淋巴细胞增殖、诱导淋巴细胞向Th1细胞增殖分化、提高DC的比例、提高cDC1和cDC2的比例及上调DC成熟来实现免疫增强效果。
本发明还提供了上述方案所述免疫增强剂在制备免疫增强的药物中的应用。在本发明中,所述药物包括疫苗。
在本发明中,所述免疫增强剂作为疫苗佐剂使用。在本发明中,所述免疫增强剂作为疫苗佐剂在小鼠体内实验中,CpG-ODN的浓度优选为50μg/只,MBP的浓度优选为50μg/只,MUC1的浓度优选为50μg/只,免疫次数优选为5次,免疫时间间隔优选为1周。
在本发明中,所述免疫增强剂作为佐剂优选的通过提高小鼠体内Th1型免疫反应,提高小鼠体内CTL杀伤活性来增强疫苗的抑瘤作用。下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实验例1 pMAL-C2载体的改造
1.材料主要实验仪器及试剂:含有终止密码的基因(生工生物工程股份有限公司合成);pMAL-C2载体(长春康悦生物科技有限公司);DH5α感受态菌(长春康悦生物科技有限公司);EcoRⅠ(TAKARA,1040A);BamHⅠ(TAKARA,1010A);T4 DNALigase(TAKARA;2011A);质粒小提试剂盒(天根公司);DL2000 DNAmaker(TAKARA,D501A);GelGreen(凯基生物,KGMO25G-1);IPTG(Sigma,0.1mol/ml)
2.方法
2.1构建质粒
pMAL-C2载体经EcoRⅠ/BamHⅠ酶切后,通过T4 DNALigase与拟插入基因片段进行连接。
在本实施例中,pMAL-C2载体改造的示意图如图1所示。
(1)将pMAL-C2载体进行EcoRⅠ,BamHⅠ双酶切,酶切反应体系如下。
酶切条件:37℃水浴2h。
(2)琼脂糖凝胶电泳和DNA回收:1.5%琼脂糖凝胶上电泳分离DNA片段,用冻融法回收载体片段pMAL-C2和拟插入基因片段。
(3)插入片段与载体的连接:在T4连接酶的作用下,将插入基因片段与pMAL-C2载体连接在一起,连接体系如下。
连接条件:16℃反应过夜。
2.2重组质粒的转化及筛选:
将改造后的pMAL-C2质粒转化到大肠埃希菌DH5α的感受态细胞,并进行AMP耐药筛选。
(1)取3支本实验室制备的DH5α感受态细胞(100μl),冰上溶解。
(2)将提取的改造后的pMAL-C210μl加入到100μl DH5α感受态细胞中,混匀,冰浴30min。
(3)42℃水浴休克90s,冰浴3min,每管加900μl不含AMP的LB培养基,37℃摇床中振荡培养45min。
(4)4℃离心机3000rpm离心5min,弃600μl上清,剩余400μl重悬菌体。
(5)将剩余的菌液铺于含有AMP的LB培养板,静置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃培养24h。
(6)挑取单克隆菌落,接种于5ml含AMP的液体培养基中,摇菌16h,参数设置为:37℃,210rpm。
(7)摇菌结束后,提取质粒,进行重组质粒鉴定,并保存菌种。
2.3重组质粒的抽提及鉴定:
(1)质粒抽提:按照质粒抽提试剂盒说明书抽提重组质粒DNA,测定质粒浓度。
(2)抽取重组质粒1μg,进行DNA测序鉴定。
(3)酶切电泳鉴定重组质粒:用EcoRⅠ,BamHⅠ对重组表达载体进行双酶切,酶切产物进行1.5%琼脂糖凝胶电泳鉴定,结果如图2所示。
3、结果我们成功构建了pMAL-inserted gene载体。
实验例2MBP(43.12KD)的纯化工艺
1.材料主要实验仪器及试剂:高压均质机(AH-1500,ATS);AKTA(
2.方法
2.1 工程菌培养
吸取3.5ml工程菌(转化有改造后pMAL-C2质粒的大肠杆菌DH5α)菌液到350ml含有AMP的LB(AMP浓度为0.1mg/ml,1:1000)培养基中,于摇床内振摇,设置参数:温度为37℃,振荡次数为220rpm,时间12-16h。次日,350ml菌液平均分配到有500ml LB(含有AMP)培养基的七个大锥形瓶内,每瓶各50ml,总体积为550ml。然后放入恒温培养振荡器,振荡2.5h(振荡次数220rpm)。采用紫外分光光度计,检测菌液OD值达1.0。加入诱导剂IPTG(终浓度为0.1~1mol/mL)到LB培养基中,继续振摇5h。8000rpm离心20min得到菌尘。
2.2 高压均质破碎菌尘
将菌尘应用洗液buffer溶解,高压灭菌纱布四层过滤,均质机进行四次均质,压力分别为200bar,850bar,850bar,850bar,收集4次均质菌液,用SDS-PAGE电泳鉴定均质不同次数下菌尘破碎情况,第4次均质后电泳结果如图3所示。
2.2 Amylose亲和层析纯化蛋白
1.6cm直径层析柱,加入新的Amylose resin介质6ml,即3cm高,用灭菌超纯水冲洗10遍,满柱,全流速;用洗液buffer冲洗两遍,满柱,全流速。将介质吸出,介质与破碎离心后的菌液上清混匀,4℃(冰上)摇床混匀45min。将上清和介质的混合液体放入柱中,静置20min。待柱子中树脂完全沉淀后,收集流出液,流速为6s/滴。用洗液buffer 20ml(预先放在冰上准备好),洗3次,收集洗液,流速分别为为6s/滴,6s/滴和10s/滴。加入洗脱液(Maltose 0.18105g+洗液buffer 50ml)7ml,收集洗脱液(共15个西林瓶,1ml/个),流速为8s/滴。对每个接样瓶样本进行SDS-PAGE电泳蛋白鉴定(如图4所示)。
2.3 MBP蛋白浓缩及内毒素去除
采用30kD超滤管浓缩MBP蛋白离心15min,4000rpm。利用Lowry法测定MBP蛋白浓度。根据MBP蛋白浓度采用0.9%NACL稀释至0.2mg/ml左右。100kD超滤管0.5M NaOH浸泡4h,双蒸水冲洗40次,离心4000rpm,15min,去除MBP蛋白中内毒素,共离心2次。使用鲎试剂鉴定纯化MBP蛋白中的内毒素含量,小于0.125EU/ml,达到实验所需要的要求。
3.结果我们的结果发现,经四次均质,菌尘完全破裂,蛋白完全释放出来,菌尘破碎程度结果如图3所示。经Amylose亲和层析,纯化蛋白SDS-PAGE电泳鉴定结果如图4所示,洗脱液目的条带单一无杂带,且条带明显,证明纯化条件适合,得到目的蛋白。
100kD超滤管第一次超滤离心后MBP蛋白细菌内毒素含量检测结果(未给出):1号阴性结果为阴性;2号阳性结果为阳性;3号MBP蛋白为阳性,4号供试品阳性为阳性,说明则内毒素检测不合格,提示一次超滤无法去除内毒素。第二次超滤离心后细菌内毒素含量检测结果:1号阴性结果为阴性;2号阳性结果为阳性;3号MBP蛋白为阴性,4号供试品阳性为阳性(图5),提示2次超滤离心可保证纯化蛋白样品中内毒素检测合格。
实验例3 MBP(43.12KD)联合CPG-ODN协同促进淋巴细胞增殖
1.材料主要实验仪器、动物及试剂:酶标仪(Epoch,美国博腾仪器有限公司);C57BL/6小鼠(SPF级,雌性,6~8周龄,体重18~22g)购自沈阳长生生物技术有限公司;WST-1(Roche,30307600);CpG 2006(广州锐博生物科技有限公司,4.368mg/ml);MBP(长春康悦生物科技有限公司,0.147mg/ml);IMDM培养液(gibco)、胎牛血清(MRC)、青链霉素混合液100×(Solarbio)
2.方法
2.1 小鼠脾细胞悬液制备
小鼠处死,无菌取脾,将脾脏放入浸在5ml IMDM培养基的纱布中,进行研磨,制备脾细胞悬液,进行计数后,计算细胞浓度,并调整细胞浓度至7×10
2.2 脾细胞药物刺激培养
根据刺激药物分为6组,分别为阴性对照组(NC)、MBP组(10μg/ml)、CpG 2006(10μg/ml)、MBP(10μg/ml)+CpG 2006(10μg/ml)组,设置3复孔,铺96孔板,7×10
2.3 WST-1方法检测细胞增殖
脾细胞培养48h后吸取100μl/well上清,3复孔收集在一起用于后续细胞因子检测,向细胞中加入WST-110μl/well,分别于37℃,5%CO
3.结果CpG 2006、MBP+CpG 2006组刺激指数高于NC组(p<0.01),提示促进淋巴细胞增殖。而MBP+CpG 2006组刺激指数明显高于单独MBP或CpG2006组(p<0.01),提示MBP与CpG2006联合使用,具有协同促进淋巴细胞增殖的作用(图6)。
4.结论MBP与CpG 2006联合可以协同促进淋巴细胞增殖。
实验例3 MBP(43.12KD)联合CPG-ODN诱导淋巴细胞向Th1细胞增殖分化
1.材料 主要实验仪器、动物及试剂:酶标仪(Epoch,美国博腾仪器有限公司)。C57BL/6小鼠(SPF级,雌性,6~8周龄,体重18~22g)购自沈阳长生生物技术有限公司。IFN-γMouse Uncoated ELISAKit(invitrogen);CpG 2006(广州锐博生物科技有限公司,4.368mg/ml);MBP(长春康悦生物科技有限公司,0.147mg/ml)。
2.方法 按照invitrogen公司的ELISA检测试剂盒说明书进行操作。简而言之,首先用包被抗体(抗IFN-γ抗体)包被96孔酶标板,每个样本设3复孔,4℃过夜。采用PBS-0.05%Tween-20洗板5次,加入封闭液室温封闭1h后,洗涤2次,加入标准品(标准品浓度梯度:2000、1000、500、250、125、62.5、32.5、15.625pg/ml)和2倍稀释后的样品(样品为实验2药物刺激培养的脾细胞上清),100μl/孔,室温孵育2h。洗涤5次后,加入检测抗体100μl/孔室温孵育1h,洗涤5次,加入酶标抗体Avindin-HRP 100μl/孔,室温孵育30min。洗7次,加TMB100μl/孔,室温避光15min。加2N硫酸100μl/孔终止反应,用酶标仪检测450nm波长的吸光度。按照标准品绘制的标准曲线,计算各样本浓度。
3.结果 不同药物刺激小鼠脾脏淋巴细胞48h后,ELISA检测培养上清中IFN-γ的含量。结果如图7所示,CpG 2006组、MBP联合CpG 2006组培养上清中IFN-γ含量均明显高于对照组,且差异具有统计学意义。而MBP+CpG 2006组IFN-γ水平明显高于单独MBP或CpG2006组(p<0.01),提示MBP与CpG 2006联合应用具有协同促进淋巴细胞向Th1细胞极化的作用(图7)。
4.结论 MBP(43.12KD)与CPG-ODN联合可协同诱导淋巴细胞向Th1细胞极化。
实验例4 MBP(43.12KD)联合CPG-ODN协同提高DC及cDC1,cDC2比例并上调DC成熟
1.材料 主要实验仪器、动物及试剂:流式细胞仪(FACS ArialⅡ,BD)。C57 BL/6小鼠(SPF级,雌性,6~8周龄,体重18~22g)购自沈阳长生生物技术有限公司。流式抗体CD16/32、PE-PDCA1、APC-CD40、AF700-MHCⅠ、PE-cy7-CCR7购自eBioscience,BV510-FVS510、PE-CF594-CD80、PE-CD86购自BD,BV421-CD11C、FITC-MHCⅡ、APC/Cyanine7 XCR1、PerCP/Cyanine5.5CD172a、BV421-B220、FITC-CD86购自Biolegend。CpG 2006(广州锐博生物科技有限公司,4.368mg/ml);MBP(长春康悦生物科技有限公司,0.147mg/ml)。
2.方法
2.1 小鼠脾细胞悬液制备
小鼠处死,无菌取脾,将脾脏放入浸在5ml IMDM培养基的纱布中,进行研磨,收集脾细胞悬液,并进行红细胞裂解,裂解红细胞后PBS进行洗涤2次,加入IMDM培养基重悬细胞,300目滤网过滤后,进行细胞计数计算浓度,调整浓度至1×10
2.2 脾细胞刺激培养
根据刺激药物分为4组,分别为阴性对照组(NC)、MBP组(10μg/ml)、CpG 2006(10μg/ml)、MBP(10μg/ml)+CpG 2006(10μg/ml)组,设置5复孔,铺24孔板,5×10
2.3 流式细胞术检测DC细胞亚群以及DC细胞成熟marker表达水平
收集刺激培养48h的脾细胞,加入CD16/32抗体封闭Fc受体,洗涤,加入FVS 510活死细胞染料和表面抗体冰上避光孵育30min后,洗涤,加入500μl PBS重悬,用300目滤网过滤后,流式细胞仪进行检测。
3.结果 针对外源递送的疫苗抗原的抗原特异性CTL应答的诱导取决于这些抗原的提呈,特别是树突状细胞的交叉呈递。DC在功能上是异质的,可以分为两种主要的亚型:浆细胞样DC(pDC)主要参与抗病毒免疫,而经典DC(cDC)主要与抗原呈递有关。经典DC(cDC)又可以进一步分为两种不同的亚型:负责将抗原通过MHCⅠ提呈给CD8+T的1型经典DC(cDC1,CD11c
我们使用MBP与CpG2006联合在体外刺激小鼠脾细胞,并对其中DC亚群和成熟情况进行流式细胞术分析。结果显示,MBP与CpG2006联合可协同增加总DC,cDC1(XCR1+DC)和cDC2比例。而pDC也显示出相同的趋势,尽管无统计学意义(图8)。而对于DC细胞成熟标志的分析结果显示:MBP与CpG2006联合可上调DC上共刺激分子CD40,CD80,CD86的表达,同时可提高DC细胞表面MHCⅠ和MHCⅡ水平,而与DC细胞迁移相关的趋化因子CCR7未表现出明显差异(图9)。
4.结论 MBP联合CpG2006协同增加DC及cDC1和cDC2比例,促进DC细胞成熟,上调DC细胞MHC分子表达,从而增强DC抗原呈递的能力。
实验例5 MBP(43.12KD)联合CPG2006在小鼠体内的抗肿瘤活性研究
1.材料 主要实验仪器、动物及试剂:C57 BL/6小鼠(SPF级,雌性,6~8周龄,体重18~22g)购自沈阳长生生物技术有限公司。CpG 2006(广州锐博生物科技有限公司,4.368mg/ml);MBP(长春康悦生物科技有限公司,0.147mg/ml)。流式抗体CD16/32、PE-PDCA1、APC-CD40、AF700-MHCⅠ、PE-cy7-CCR7购自eBioscience,BV510-FVS510、PE-CF594-CD80、PE-CD86购自BD,BV421-CD11C、FITC-MHCⅡ、APC/Cyanine7 XCR1、PerCP/Cyanine5.5CD172a、BV421-B220、FITC-CD86购自Biolegend。
2.方法
2.1 小鼠疫苗免疫及荷瘤
将小鼠随机分为4组,每组10只鼠,分别为生理盐水对照(NC)、MBP(50μg/只)、CpG2006(CpG2006各6.25μg/只)、MBP+CpG2006(MBP 50μg/只和CpG20066.25μg/只)组,每周一次皮下免疫,共免疫5次。末次免疫后第4天荷瘤,右侧胁背部皮下注射B16黑色素瘤细胞5×10
2.2 MBP(43.12KD)联合CPG2006作为佐剂对小鼠B16黑色素瘤的抑制作用
荷瘤后14天处死小鼠,剥离皮下肿瘤并称重,计算各组瘤重和肿瘤抑制率。公式如下:肿瘤抑制率=(对照组瘤重-实验组瘤重)/对照组瘤重×100%。
2.3 流式细胞术检测小鼠dLN中DC细胞亚群比例及DC细胞成熟marker表达水平
小鼠荷瘤后14天处死,取引流区淋巴结,制备淋巴结细胞悬液,加入CD16/32抗体封闭Fc受体,洗涤,加入FVS 510活死细胞染料和表面抗体冰上避光孵育30min后,洗涤,加入500μl PBS重悬,用300目滤网过滤后,流式细胞仪进行检测。
3.结果
3.1 MBP与CpG2006在小鼠体内具有协同抗肿瘤作用
瘤重及抑瘤率结果显示,MBP,CpG2006及MBP+CpG2006组均表现出抑瘤效果,其中CpG2006及MBP+CpG2006组瘤重对比NC组具有统计学差异。MBP,CpG2006及MBP+CpG2006三个实验组组抑瘤率分别为3.87%,36.80%及58.17%,MBP+CpG2006组抑瘤率明显高于MBP及CpG2006,提示MBP和CpG2006在小鼠体内具有协同抗肿瘤作用(图10)。
3.2 MBP联合CpG2006可以协同提高小鼠dLN内cDC1,cDC2比例并上调DC细胞成熟
荷瘤后14天,我们对小鼠引流区淋巴结内DC亚群及成熟情况进行流式细胞术分析。结果显示,MBP,CpG2006及MBP+CpG2006免疫均可提高小鼠引流区淋巴结内总DC,cDC1(XCR1+DC)和cDC2比例,而MBP与CpG2006联合表现出协同作用(图11)。pDC各组间并未表现出相同趋势,结果未给出。而对于DC细胞成熟标志的分析结果显示:MBP,CpG2006及MBP+CpG2006免疫均可上调小鼠引流区淋巴结内DC上共刺激分子CD40,CD80,CD86的表达,并可提高DC细胞表面MHCⅡ水平,而各组所有DC均表达MHCⅠ,无差异。同时与DC细胞迁移相关的趋化因子CCR7也表现出相同趋势(图12)。
4.结论 MBP与CpG2006协同提高小鼠dLN中cDC1和cDC2,并上调DC细胞成熟,且在小鼠体内具有协同抗肿瘤作用。
实验例6 MBP(43.12KD)联合CPG-ODN作为佐剂体内增强疫苗效果
1.材料 主要实验仪器、动物及试剂:酶标仪(Epoch,美国博腾仪器有限公司),流式细胞仪(FACS Arial Ⅱ,BD)。C57 BL/6小鼠(SPF级,雌性,6~8周龄,体重18~22g)购自沈阳长生生物技术有限公司。CpG 2006(广州锐博生物科技有限公司,4.368mg/ml);MUC1多肽(上海紫域生物科技有限公司合成,531883,2mg/ml);MBP(长春康悦生物科技有限公司,0.147mg/ml)。GoatAnti-Mouse IgG2c-HRP(SouthernBiotech),HRP RatAnti-Mouse IgG1-HRP(Southern Biotech),Peroxidase-conjugatedAffiniPure GoatAnti-Mouse IgG(H+L)(Proteintech)。
2.方法
2.1 小鼠疫苗免疫及荷瘤
将小鼠随机分为4组,每组10只鼠,分别是生理盐水对照(NC)、MUC+MBP(MUC1和MBP各50μg/只)、MUC1+CpG2006(MUC1和CpG2006各50μg/只)、MUC1+MBP+CpG2006(MUC1,MBP和CpG2006各50μg/只)组,每周一次皮下免疫,共免疫5次。末次免疫后第4天荷瘤,右侧胁背部皮下注射MUC1过表达的黑色素瘤细胞B16-MUC15×10^5个/只。荷瘤后14天处死小鼠。
2.2 MBP(43.12KD)联合CPG2006作为佐剂对小鼠B16-MUC1黑色素瘤的抑制作用
荷瘤后第14天,处死小鼠,剥离皮下肿瘤并称重,计算各组瘤重和肿瘤抑制率。公式如下:肿瘤抑制率=(对照组瘤重-实验组瘤重)/对照组瘤重×100%。
2.3 MBP(43.12KD)联合CPG2006作为佐剂对小鼠体内MUC1特异性抗体亚型的影响
荷瘤后第14天,处死小鼠,摘眼球取血,提取血清,通过ELISA检测血清MUC1特异性抗体。具体方法是,将96孔板用0.5μg/孔MUC1多肽包被,4℃孵育过夜,然后用含2%牛血清白蛋白的PBS封闭。加入100μl 1:500稀释的血清样品,37℃孵育1.5小时。洗涤,与GoatAnti-Mouse IgG2c-HRP,HRP Rat Anti-Mouse IgG1-HRP,Peroxidase-conjμgatedAffinipure Goat Anti-Mouse IgG(H+L)37℃孵育2小时。然后洗涤,并在37℃下与底物OPD避光孵育10分钟,并加入2N H
2.4 MBP(43.12KD)联合CPG2006作为佐剂对MUC1特异性的脾细胞的增殖水平和细胞因子分泌水平的影响
根据细胞计数结果铺96孔板,设置3复孔,1×10^6个细胞/孔,MUC1多肽(20μg/ml)刺激培养,置于CO2孵箱中,5%CO2、37℃培养。铺板第三天,进行半量换液,继续培养。培养第五天时吸取100μl/well上清,3复孔收集在一起,通过夹心ELISA方法检测上述收集到的上清液的IFN-γ和IL-4水平。
2.5 CTL杀伤实验小鼠荷瘤后14天处死,取脾,制备脾细胞悬液,用MUC1多肽(20μg/ml)刺激培养5天,收集细胞作为效应细胞,培养B16-MUC1至第3-5代作为靶细胞,通过RTCA方法测量CTL杀伤活性。首先在E-Plate16中以5×10
3.结果
3.1 MBP(43.12KD)联合CpG2006可以提高小鼠体内MUC1癌症疫苗的抑瘤效果
瘤重及抑瘤率结果显示,MUC1+MBP,MUC1+CpG2006及MUC1+MBP+CpG2006组均表现出抑瘤效果,其中MUC1+CpG2006及MUC1+MBP+CpG2006组具有统计学意义。而MUC1+MBP+CpG2006组明显抑瘤率明显高于MUC1+MBP及MUC1+CpG2006,提示MBP和CpG2006在小鼠体内可以协同增强以MUC1为靶点的癌症疫苗的抑瘤作用(图13)。
3.2 MBP(43.12KD)联合CpG2006可以提高小鼠体内Th1型免疫反应
Th细胞产生的细胞因子参与诱导从IgM向其他Ab同种型的转换。Th1细胞分泌IFN-γ,该细胞因子可促进抗体转换为IgG2,而Th2细胞分泌IL-4,IL-4可促进抗体转换为IgG1。因此,IgG2c/IgG1间接反映了占主导地位的Th反应类型。本实验通过ELISA检测小鼠血清中MUC1特异性抗体的滴度和亚型,以NS组为对照组。与对照组相比,MUC1+CpG2006及MUC1+MBP+CpG2006免疫均诱导产生的抗MUC1特异性IgG,IgG1和IgG2c抗体(图14A)。从结果中我们发现,与对照组相比,IgG2c/IgG1增加,这表明MBP和CpG2006作为疫苗佐剂在小鼠中诱导的免疫反应倾向Th1型(图14B)。我们进一步分析了小鼠血清中代表性的Th1(IFN-γ)和Th2(IL-4)细胞因子。接种疫苗后获取小鼠脾脏,用MUC1刺激脾脏淋巴细胞,收集培养的上清液,用ELISA法检测,结果如图14C,D所示。与对照组相比,MUC1+CpG2006及MUC1+MBP+CpG2006免疫均上调小鼠脾淋巴细胞中IFN-γ分泌,下调IL-4分泌,同样支持MUC1+MBP+CpG2006疫苗在小鼠体内诱导的免疫反应倾向Th1型。而MUC1+MBP+CpG2006组IFN-γ的水平高于MUC1+MBP及MUC1+CpG2006组,提示MBP与CpG2006协同促进Th1细胞因子(IFN-γ)的分泌。
3.3 MBP(43.12KD)联合CpG2006可以提高疫苗免疫小鼠体内CTL杀伤活性
在这项研究中,我们使用RTCA技术动态监测疫苗免疫小鼠脾淋巴细胞的CTL杀伤活性。如图15所示,与NC组相比,三个疫苗组均显示出CTL杀伤活性,杀伤率与效靶比成正比。CTL杀伤活性:MUC1+MBP+CpG2006>MUC1+CpG2006>MUC1+MBP(图15),提示MBP与CpG2006作为疫苗佐剂时协同增强疫苗的CTL杀伤活性。
4.结论 MBP(43.12KD)联合CpG2006作为MUC1癌症疫苗的佐剂,预防性接种该癌症疫苗后构建过表达MUC1的B16黑色素瘤荷瘤鼠模型,检测小鼠体内免疫活性,观察疫苗的抑瘤效果。本实验各项结果支持MBP(43.12KD)联合CpG2006作为疫苗佐剂可以使小鼠体内免疫反应倾向Th1型,同时增强疫苗诱导的CTL杀伤活性,进而协同提高MUC1癌症疫苗的抑瘤效果。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110> 康九生物科技(长春)有限公司
<120> 一种麦芽糖结合蛋白、麦芽糖结合蛋白表达载体、重组工程菌及其应用
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 402
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
agttagtgtt gagatgatgc tttgacaaaa ggtaatccat ctgttcagaa attctacaat 60
ggttgctgtc tcatcagcat attcacacat gaatgttgtt tcagatccct ttagttccag 120
aactattacg ttgatattgc tgattaagtc cctgggtctt aagtgaaagt ttttgctttg 180
agctaaattt agcacttcct ccagaggttt gagttcttct tctagacact gaagatgttt 240
cagttctgtg gccttcttgg gcatgtaaaa cttaaatgtg agcatcctgg tgagtttggg 300
attcttgtaa ttattaattc cattcaaaat catctgtaaa tccagcagta aatgctccag 360
ttgtagctgt gttttctttg tagaacttga agtaggtgcc at 402
<210> 2
<211> 7046
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ccgacaccat cgaatggtgc aaaacctttc gcggtatggc atgatagcgc ccggaagaga 60
gtcaattcag ggtggtgaat gtgaaaccag taacgttata cgatgtcgca gagtatgccg 120
gtgtctctta tcagaccgtt tcccgcgtgg tgaaccaggc cagccacgtt tctgcgaaaa 180
cgcgggaaaa agtggaagcg gcgatggcgg agctgaatta cattcccaac cgcgtggcac 240
aacaactggc gggcaaacag tcgttgctga ttggcgttgc cacctccagt ctggccctgc 300
acgcgccgtc gcaaattgtc gcggcgatta aatctcgcgc cgatcaactg ggtgccagcg 360
tggtggtgtc gatggtagaa cgaagcggcg tcgaagcctg taaagcggcg gtgcacaatc 420
ttctcgcgca acgcgtcagt gggctgatca ttaactatcc gctggatgac caggatgcca 480
ttgctgtgga agctgcctgc actaatgttc cggcgttatt tcttgatgtc tctgaccaga 540
cacccatcaa cagtattatt ttctcccatg aagacggtac gcgactgggc gtggagcatc 600
tggtcgcatt gggtcaccag caaatcgcgc tgttagcggg cccattaagt tctgtctcgg 660
cgcgtctgcg tctggctggc tggcataaat atctcactcg caatcaaatt cagccgatag 720
cggaacggga aggcgactgg agtgccatgt ccggttttca acaaaccatg caaatgctga 780
atgagggcat cgttcccact gcgatgctgg ttgccaacga tcagatggcg ctgggcgcaa 840
tgcgcgccat taccgagtcc gggctgcgcg ttggtgcgga tatctcggta gtgggatacg 900
acgataccga agacagctca tgttatatcc cgccgttaac caccatcaaa caggattttc 960
gcctgctggg gcaaaccagc gtggaccgct tgctgcaact ctctcagggc caggcggtga 1020
agggcaatca gctgttgccc gtctcactgg tgaaaagaaa aaccaccctg gcgcccaata 1080
cgcaaaccgc ctctccccgc gcgttggccg attcattaat gcagctggca cgacaggttt 1140
cccgactgga aagcgggcag tgagcgcaac gcaattaatg taagttagct cactcattag 1200
gcacaattct catgtttgac agcttatcat cgactgcacg gtgcaccaat gcttctggcg 1260
tcaggcagcc atcggaagct gtggtatggc tgtgcaggtc gtaaatcact gcataattcg 1320
tgtcgctcaa ggcgcactcc cgttctggat aatgtttttt gcgccgacat cataacggtt 1380
ctggcaaata ttctgaaatg agctgttgac aattaatcat cggctcgtat aatgtgtgga 1440
attgtgagcg gataacaatt tcacacagga aacagccagt ccgtttaggt gttttcacga 1500
gcacttcacc aacaaggacc atagattatg aaaactcgaa gaaggtaaac tggtaatctg 1560
gattaacggc gataaaggct ataacggtct cgctgaagtc ggtaagaaat tcgagaaaga 1620
taccggaatt aaagtcaccg ttgagcatcc ggataaactg gaagagaaat tcccacaggt 1680
tgcggcaact ggcgatggcc ctgacattat cttctgggca cacgaccgct ttggtggcta 1740
cgctcaatct ggcctgttgg ctgaaatcac cccggacaaa gcgttccagg acaagctgta 1800
tccgtttacc tgggatgccg tacgttacaa cggcaagctg attgcttacc cgatcgctgt 1860
tgaagcgtta tcgctgattt ataacaaaga tctgctgccg aacccgccaa aaacctggga 1920
agagatcccg gcgctggata aagaactgaa agcgaaaggt aagagcgcgc tgatgttcaa 1980
cctgcaagaa ccgtacttca cctggccgct gattgctgct gacgggggtt atgcgttcaa 2040
gtatgaaaac ggcaagtacg acattaaaga cgtgggcgtg gataacgctg gcgcgaaagc 2100
gggtctgacc ttcctggttg acctgattaa aaacaaacac atgaatgcag acaccgatta 2160
ctccatcgca gaagctgcct ttaataaagg cgaaacagcg atgaccatca acggcccgtg 2220
ggcatggtcc aacatcgaca ccagcaaagt gaattatggt gtaacggtac tgccgacctt 2280
caagggtcaa ccatccaaac cgttcgttgg cgtgctgagc gcaggtatta acgccgccag 2340
tccgaacaaa gagctggcaa aagagttcct cgaaaactat ctgctgactg atgaaggtct 2400
ggaagcggtt aataaagaca aaccgctggg tgccgtagcg ctgaagtctt acgaggaaga 2460
gttggcgaaa gatccacgta ttgccgccac catggaaaac gcccagaaag gtgaaatcat 2520
gccgaacatc ccgcagatgt ccgctttctg gtatgccgtg cgtactgcgg tgatcaacgc 2580
cgccagcggt cgtcagactg tcgatgaagc cctgaaagac gcgcagacta attcgagctc 2640
gaacaacaac aacaataaca ataacaacaa cctcgggatc gagggaagga tttcagaatt 2700
cagttagtgt tgagatgatg ctttgacaaa aggtaatcca tctgttcaga aattctacaa 2760
tggttgctgt ctcatcagca tattcacaca tgaatgttgt ttcagatccc tttagttcca 2820
gaactattac gttgatattg ctgattaagt ccctgggtct taagtgaaag tttttgcttt 2880
gagctaaatt tagcacttcc tccagaggtt tgagttcttc ttctagacac tgaagatgtt 2940
tcagttctgt ggccttcttg ggcatgtaaa acttaaatgt gagcatcctg gtgagtttgg 3000
gattcttgta attattaatt ccattcaaaa tcatctgtaa atccagcagt aaatgctcca 3060
gttgtagctg tgttttcttt gtagaacttg aagtaggtgc catggatcct ctagagtcga 3120
cctgcaggca agcttggcac tggccgtcgt tttacaacgt cgtgactggg aaaaccctgg 3180
cgttacccaa cttaatcgcc ttgcagcaca tccccctttc gccagctggc gtaatagcga 3240
agaggcccgc accgatcgcc cttcccaaca gttgcgcagc ctgaatggcg aatggcagct 3300
tggctgtttt ggcggatgag ataagatttt cagcctgata cagattaaat cagaacgcag 3360
aagcggtctg ataaaacaga atttgcctgg cggcagtagc gcggtggtcc cacctgaccc 3420
catgccgaac tcagaagtga aacgccgtag cgccgatggt agtgtggggt ctccccatgc 3480
gagagtaggg aactgccagg catcaaataa aacgaaaggc tcagtcgaaa gactgggcct 3540
ttcgttttat ctgttgtttg tcggtgaacg ctctcctgag taggacaaat ccgccgggag 3600
cggatttgaa cgttgcgaag caacggcccg gagggtggcg ggcaggacgc ccgccataaa 3660
ctgccaggca tcaaattaag cagaaggcca tcctgacgga tggccttttt gcgtttctac 3720
aaactctttt gtttattttt ctaaatacat tcaaatatgt atccgctcat gagacaataa 3780
ccctgataaa tgcttcaata atattgaaaa aggaagagta tgagtattca acatttccgt 3840
gtcgccctta ttcccttttt tgcggcattt tgccttcctg tttttgctca cccagaaacg 3900
ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac gagtgggtta catcgaactg 3960
gatctcaaca gcggtaagat ccttgagagt tttcgccccg aagaacgttt cccaatgatg 4020
agcactttta aagttctgct atgtggcgcg gtattatccc gtgttgacgc cgggcaagag 4080
caactcggtc gccgcataca ctattctcag aatgacttgg ttgagtactc accagtcaca 4140
gaaaagcatc ttacggatgg catgacagta agagaattat gcagtgctgc cataaccatg 4200
agtgataaca ctgcggccaa cttacttctg acaacgatcg gaggaccgaa ggagctaacc 4260
gcttttttgc acaacatggg ggatcatgta actcgccttg atcgttggga accggagctg 4320
aatgaagcca taccaaacga cgagcgtgac accacgatgc ctgtagcaat ggcaacaacg 4380
ttgcgcaaac tattaactgg cgaactactt actctagctt cccggcaaca attaatagac 4440
tggatggagg cggataaagt tgcaggacca cttctgcgct cggcccttcc ggctggctgg 4500
tttattgctg ataaatctgg agccggtgag cgtgggtctc gcggtatcat tgcagcactg 4560
gggccagatg gtaagccctc ccgtatcgta gttatctaca cgacggggag tcaggcaact 4620
atggatgaac gaaatagaca gatcgctgag ataggtgcct cactgattaa gcattggtaa 4680
ctgtcagacc aagtttactc atatatactt tagattgatt taccccggtt gataatcaga 4740
aaagccccaa aaacaggaag attgtataag caaatattta aattgtaaac gttaatattt 4800
tgttaaaatt cgcgttaaat ttttgttaaa tcagctcatt ttttaaccaa taggccgaaa 4860
tcggcaaaat cccttataaa tcaaaagaat agcccgagat agggttgagt gttgttccag 4920
tttggaacaa gagtccacta ttaaagaacg tggactccaa cgtcaaaggg cgaaaaaccg 4980
tctatcaggg cgatggccca ctacgtgaac catcacccaa atcaagtttt ttggggtcga 5040
ggtgccgtaa agcactaaat cggaacccta aagggagccc ccgatttaga gcttgacggg 5100
gaaagccggc gaacgtggcg agaaaggaag ggaagaaagc gaaaggagcg ggcgctaggg 5160
cgctggcaag tgtagcggtc acgctgcgcg taaccaccac acccgccgcg cttaatgcgc 5220
cgctacaggg cgcgtaaaag gatctaggtg aagatccttt ttgataatct catgaccaaa 5280
atcccttaac gtgagttttc gttccactga gcgtcagacc ccgtagaaaa gatcaaagga 5340
tcttcttgag atcctttttt tctgcgcgta atctgctgct tgcaaacaaa aaaaccaccg 5400
ctaccagcgg tggtttgttt gccggatcaa gagctaccaa ctctttttcc gaaggtaact 5460
ggcttcagca gagcgcagat accaaatact gtccttctag tgtagccgta gttaggccac 5520
cacttcaaga actctgtagc accgcctaca tacctcgctc tgctaatcct gttaccagtg 5580
gctgctgcca gtggcgataa gtcgtgtctt accgggttgg actcaagacg atagttaccg 5640
gataaggcgc agcggtcggg ctgaacgggg ggttcgtgca cacagcccag cttggagcga 5700
acgacctaca ccgaactgag atacctacag cgtgagctat gagaaagcgc cacgcttccc 5760
gaagggagaa aggcggacag gtatccggta agcggcaggg tcggaacagg agagcgcacg 5820
agggagcttc cagggggaaa cgcctggtat ctttatagtc ctgtcgggtt tcgccacctc 5880
tgacttgagc gtcgattttt gtgatgctcg tcaggggggc ggagcctatg gaaaaacgcc 5940
agcaacgcgg cctttttacg gttcctggcc ttttgctggc cttttgctca catgttcttt 6000
cctgcgttat cccctgattc tgtggataac cgtattaccg cctttgagtg agctgatacc 6060
gctcgccgca gccgaacgac cgagcgcagc gagtcagtga gcgaggaagc ggaagagcgc 6120
ctgatgcggt attttctcct tacgcatctg tgcggtattt cacaccgcat atggtgcact 6180
ctcagtacaa tctgctctga tgccgcatag ttaagccagt atacactccg ctatcgctac 6240
gtgactgggt catggctgcg ccccgacacc cgccaacacc cgctgacgcg ccctgacggg 6300
cttgtctgct cccggcatcc gcttacagac aagctgtgac cgtctccggg agctgcatgt 6360
gtcagaggtt ttcaccgtca tcaccgaaac gcgcgaggca gctgcggtaa agctcatcag 6420
cgtggtcgtg cagcgattca cagatgtctg cctgttcatc cgcgtccagc tcgttgagtt 6480
tctccagaag cgttaatgtc tggcttctga taaagcgggc catgttaagg gcggtttttt 6540
cctgtttggt cactgatgcc tccgtgtaag ggggatttct gttcatgggg gtaatgatac 6600
cgatgaaacg agagaggatg ctcacgatac gggttactga tgatgaacat gcccggttac 6660
tggaacgttg tgagggtaaa caactggcgg tatggatgcg gcgggaccag agaaaaatca 6720
ctcagggtca atgccagcgc ttcgttaata cagatgtagg tgttccacag ggtagccagc 6780
agcatcctgc gatgcagatc cggaacataa tggtgcaggg cgctgacttc cgcgtttcca 6840
gactttacga aacacggaaa ccgaagacca ttcatgttgt tgctcaggtc gcagacgttt 6900
tgcagcagca gtcgcttcac gttcgctcgc gtatcggtga ttcattctgc taaccagtaa 6960
ggcaaccccg ccagcctagc cgggtcctca acgacaggag cacgatcatg cgcacccgtg 7020
gccaggaccc aacgctgccc gaaatt 7046
<210> 3
<211> 392
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 3
Met Lys Thr Glu Glu Gly Lys Leu Val Ile Trp Ile Asn Gly Asp Lys
1 5 10 15
Gly Tyr Asn Gly Leu Ala Glu Val Gly Lys Lys Phe Glu Lys Asp Thr
20 25 30
Gly Ile Lys Val Thr Val Glu His Pro Asp Lys Leu Glu Glu Lys Phe
35 40 45
Pro Gln Val Ala Ala Thr Gly Asp Gly Pro Asp Ile Ile Phe Trp Ala
50 55 60
His Asp Arg Phe Gly Gly Tyr Ala Gln Ser Gly Leu Leu Ala Glu Ile
65 70 75 80
Thr Pro Asp Lys Ala Phe Gln Asp Lys Leu Tyr Pro Phe Thr Trp Asp
85 90 95
Ala Val Arg Tyr Asn Gly Lys Leu Ile Ala Tyr Pro Ile Ala Val Glu
100 105 110
Ala Leu Ser Leu Ile Tyr Asn Lys Asp Leu Leu Pro Asn Pro Pro Lys
115 120 125
Thr Trp Glu Glu Ile Pro Ala Leu Asp Lys Glu Leu Lys Ala Lys Gly
130 135 140
Lys Ser Ala Leu Met Phe Asn Leu Gln Glu Pro Tyr Phe Thr Trp Pro
145 150 155 160
Leu Ile Ala Ala Asp Gly Gly Tyr Ala Phe Lys Tyr Glu Asn Gly Lys
165 170 175
Tyr Asp Ile Lys Asp Val Gly Val Asp Asn Ala Gly Ala Lys Ala Gly
180 185 190
Leu Thr Phe Leu Val Asp Leu Ile Lys Asn Lys His Met Asn Ala Asp
195 200 205
Thr Asp Tyr Ser Ile Ala Glu Ala Ala Phe Asn Lys Gly Glu Thr Ala
210 215 220
Met Thr Ile Asn Gly Pro Trp Ala Trp Ser Asn Ile Asp Thr Ser Lys
225 230 235 240
Val Asn Tyr Gly Val Thr Val Leu Pro Thr Phe Lys Gly Gln Pro Ser
245 250 255
Lys Pro Phe Val Gly Val Leu Ser Ala Gly Ile Asn Ala Ala Ser Pro
260 265 270
Asn Lys Glu Leu Ala Lys Glu Phe Leu Glu Asn Tyr Leu Leu Thr Asp
275 280 285
Glu Gly Leu Glu Ala Val Asn Lys Asp Lys Pro Leu Gly Ala Val Ala
290 295 300
Leu Lys Ser Tyr Glu Glu Glu Leu Ala Lys Asp Pro Arg Ile Ala Ala
305 310 315 320
Thr Met Glu Asn Ala Gln Lys Gly Glu Ile Met Pro Asn Ile Pro Gln
325 330 335
Met Ser Ala Phe Trp Tyr Ala Val Arg Thr Ala Val Ile Asn Ala Ala
340 345 350
Ser Gly Arg Gln Thr Val Asp Glu Ala Leu Lys Asp Ala Gln Thr Asn
355 360 365
Ser Ser Ser Asn Asn Asn Asn Asn Asn Asn Asn Asn Asn Leu Gly Ile
370 375 380
Glu Gly Arg Ile Ser Glu Phe Ser
385 390
- 一种麦芽糖结合蛋白、麦芽糖结合蛋白表达载体、重组工程菌及其应用
- 糖基化的麦芽糖结合蛋白及其制备方法与应用
