基于共表达分泌性荧光素酶快速滴定重组杆状病毒的方法
文献发布时间:2023-06-19 11:08:20
技术领域
本发明涉及一种简便快速定量重组杆状病毒的方法,具体而言,该方法是通过检测共表达的荧光素酶活性来定量测定重组昆虫杆状病毒滴度的方法。
背景技术
自上个世纪80年代建立以来,杆状病毒载体表达系统已经发展成基因工程领域常用的分子生物学工具,可以用来克隆目的基因高效表达重组蛋白制备蛋白药物或疫苗,或者用作DNA载体传递目的基因进行基因治疗。不管是重组表达还是基因治疗,构建的重组杆状病毒都必须评估病毒毒力,即病毒的感染能力,以便达到最佳的应用效果。
病毒毒力或毒价可以定义为单位体积中活病毒颗粒的数量,即病毒滴度,通常通过观察病毒感染产生的细胞病变效应来评价。常规测定病毒滴度的方法就是基于这个原理,主要有蚀斑法(plaque formation assay,PFA)和终点稀释法(end point dilutionassay,EPDA)。细胞病变是一个缓慢的病理过程,观察到重组杆状病毒感染引起的典型细胞病变可能需要5-7天,因而这两种方法非常耗时。同时,这两种方法的检测结果也易受样品孵育条件和操作者技能的影响。为了缩短观测/检测时间,简化操作,提高准确性,一些改良方法相继发展出来(
病毒滴度也可以通过测定单位体积中病毒基因组的拷贝数量来评价,如适时定量PCR法和流式分析。这两种方法通过检测与病毒基因组DNA或扩增的特异性DNA片段结合的荧光染料强度来定量重组病毒,但都不能区分样品中非感染性病毒颗粒(如感染缺陷病毒颗粒),因而所测滴度往往与实际感染性滴度偏高。
发明内容
本发明要解决的问题是提供一种基于共表达分泌性荧光素酶活性快速滴定重组杆状病毒的方法及相应的分泌性荧光素酶表达盒。
为了解决上述技术问题,本发明提供一种分泌性荧光素酶表达盒:hr5增强子-IE1启动子-L21-secrNluc-IE1终止子,即,hr5 enhancer-IE1 promoter-L21-secrNluc-IE1terminator;其核酸序列如SEQ ID NO:1所述。
作为的分泌性荧光素酶表达盒的改进:
hr5增强子-IE1启动子和IE1终止子序列均源于载体pIEx-1。
L21序列为:5’-AACTCCTAAAAAACCGCCACC-3’。
sercNluc(分泌性荧光素酶sercNluc)为N端融合杆状病毒gp64基因信号序列的nano-Luciferase,其氨基酸如SEQ ID NO:2所述,核酸序列如SEQ ID NO:3所述。
本发明还同时提供了一种基于共表达分泌性荧光素酶快速滴定重组杆状病毒的方法,包括以下步骤:
1.1)、制备sf9昆虫细胞悬液;
1.2)、制备重组杆状病毒标准样品:
利用如权利要求1所述的分泌性荧光素酶表达盒,构建获得分泌性荧光素酶共表达克隆载体pFastBac Dual-hr5IE1-L21-secrNluc,
再利用pFastBac Dual-hr5IE1-L21-secrNluc制备获得重组杆状病毒vAc-secrNluc,从而获得相应滴度的病毒标准样品;
1.3)、制备待测重组杆状病毒样品:
利用pFastBac Dual-hr5IE1-L21-secrNluc,构建EGFP基因的克隆载体pFastBacDual-hr5IE1-L21-secrNluc-EGFP;
再利用pFastBac Dual-hr5IE1-L21-secrNluc-EGFP制备获得待测病毒样品vAc-secrNluc-EGFP(EGFP
1.4)、病毒接种和酶活测定:
病毒标准样品接种于sf9的细胞悬液中,感染特定时间后进行酶活测定,得到该特定时间点的病毒标准样品的实际荧光素酶活性;
1.5)、以病毒标准样品病毒滴度的对数值作为横坐标,以其实际荧光素酶活性的对数值作为纵坐标,制作标准曲线和直线回归方程:
logE=a×logN+b
N:病毒滴度(pfu/mL)
E:荧光素酶活性值(RLU)
a,b:分别为直线回归方程的斜率和截距;
1.6)、以待测病毒样品替代病毒标准样品,进行步骤1.4),从而获得待测病毒样品的荧光素酶活性;代入步骤1.5)所得的直线回归方程中,从而获得待测病毒样品的病毒滴度。
作为本发明的基于共表达分泌性荧光素酶活性快速滴定重组杆状病毒的方法的改进:
步骤1.2)为:
参照Bac-to-Bac方法,将所构建质粒pFastBac Dual-hr5IE1-L21-secrNluc转化到DH10Bac感受态细胞,通过蓝白筛选重组克隆,抽提重组Bacmid DNA,转染sf9细胞,从而得到重组杆状病毒vAc-secrNluc,制备成特定滴度的病毒标准品;然后进行梯度稀释,从而获得相应滴度的病毒标准样品;
步骤1.3)为:
在pFastBac Dual-hr5IE1-L21-secrNluc基础上,克隆增强型绿色荧光蛋白基因EGFP(pEGFP-N1)到多角体基因启动子下游多克隆位点,构建EGFP基因的克隆载体pFastBacDual-hr5IE1-L21-secrNluc-EGFP;参照步骤1.2,将克隆载体pFastBac Dual-hr5IE1-L21-secrNluc-EGFP转化DH10Bac感受态细胞,通过蓝白筛选重组克隆,抽提重组Bacmid DNA,转染sf9细胞,从而获得待测病毒样品vAc-secrNluc-EGFP(EGFP
步骤1.4)为:
病毒标准样品接种于sf9的细胞悬液中,悬浮培养后,离心洗涤置换新鲜培养基,铺种于多孔板中静置培养至感染后特定时间点(2~6小时,优选6小时),取细胞培养上清测定病毒标准样品的荧光素酶活性,并扣除背景荧光素酶活性作为该时间点病毒标准样品的实际荧光素酶活性。
作为本发明的基于共表达分泌性荧光素酶活性快速滴定重组杆状病毒的方法的进一步改进:
步骤1.1)的sf9昆虫细胞悬液中,sf9的细胞密度为1×10
步骤1.2)中,病毒标准品中重组杆状病毒vAc-secrNluc的滴度为1×10
步骤1.3)中,待测病毒样品vAc-secrNluc-EGFP(EGFP
步骤1.4)中,
悬浮培养时间为0.5~1小时(优选1小时);
静置培养至感染后是指以病毒接种时的时间点为起始时间;
背景荧光素酶活性是指离心洗涤后用于多孔板铺种的细胞悬液荧光素酶活性;
病毒标准样品接种的感染复数最大不超过1。
本发明基于近期荧光素酶和昆虫增强子及相关顺式作用元件的研究进展,设计了一种通过测定共表达的分泌性荧光素酶活性快速滴定重组杆状病毒的方法(简称荧光素酶滴定法,sercNluc assay)。这种方法采用工程改造的深海从虾荧光素酶(nano-Luciferase,Nluc)基因作为报告基因,利用杆状病毒AcNPV hr5增强子-IE1启动子和龙虾原肌球蛋白基因前导序列L21串联组合(hr5IE1-L21)驱动Nluc分泌表达,通过检测重组病毒感染后细胞培养上清中的荧光素酶活性快速滴定病毒。所表达的从虾Nluc(19kDa)是一种不依赖ATP的高活性荧光素酶,其活性约是萤火虫荧光素酶Fluc和海肾荧光素酶Rluc的150倍,具有极宽的线性检测范围(10
本发明采用hr5增强子-IE1启动子-L21-secrNluc-IE1终止子表达盒设计构建重组病毒。这种设计综合了杆状病毒的极早期基因启动子效应、L21的表达增强作用、secrNluc的细胞分泌表达和高灵敏度,在重组病毒接种后只需适时取细胞上清与底物反应,数分钟内测定酶活,无需其他任何人工操作和观察,流程高度简化,这些特点使本发明具有操作简单、耗时短、结果稳定的技术优势。
因此,本发明的目的是提供定量重组昆虫杆状病毒毒力的方法,或者说测定重组昆虫杆状病毒滴度的方法。该方法利用重组昆虫杆状病毒感染昆虫细胞后在极早期阶段分泌表达荧光素酶,通过检测荧光素酶活性滴定感染昆虫细胞的病毒数量,从而实现病毒定量。其依据的原理是,昆虫杆状病毒感染宿主细胞后基因表达呈级联模式,即按照早期基因(感染后6小时内,含极早期和迟早期基因)->晚期基因->极晚期基因的时序表达。在病毒感染的早期阶段,病毒尚未复制,基因的表达水平与病毒数量成正比。基于本发明构建的重组昆虫杆状病毒感染后,hr5增强子-极早期基因IE1启动子驱动Nluc分泌表达到细胞培养上清中,上清中的荧光素酶活性可以通过化学发光检测仪测定,所测的化学发光强度即代表荧光素酶活性,间接反映了病毒数量。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
图1为分泌性荧光素酶表达盒示意图;
图2为分泌性荧光素酶共表达克隆载体图谱;
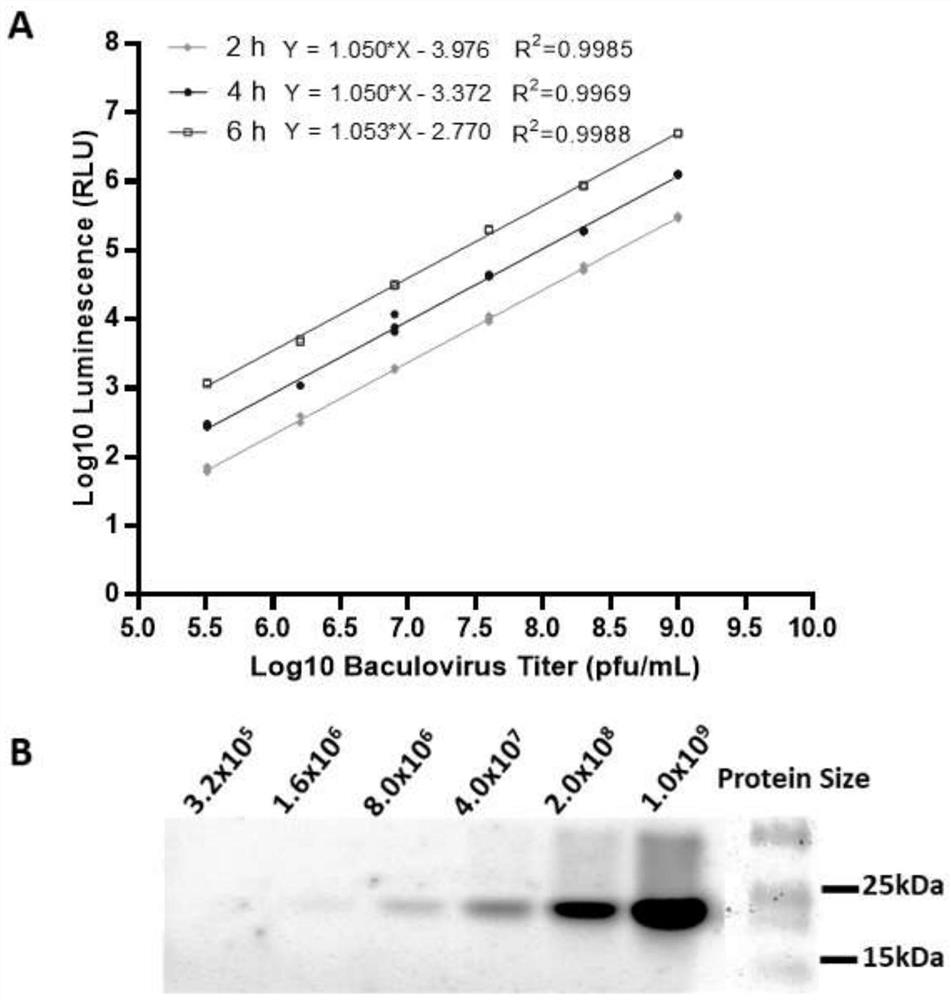
图3为分泌性荧光素酶的瞬时表达分析;
图4为重组杆状病毒荧光素酶活性-滴度的相关性分析;
图4中:
A,重组病毒感染后6小时的线性回归曲线;B,重组病毒感染后6小时的荧光素酶胶内化学发光检测分析。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1、
1.分泌性荧光素酶共表达克隆载体的构建
为了使重组杆状病毒感染后在极早期阶段分泌表达可检测强度的荧光素酶,设计分泌性荧光素酶表达盒,如图1,具体是hr5增强子-IE1启动子-L21-secrNluc-IE1终止子,即,hr5enhancer-IE1 promoter-L21-secrNluc-IE1 terminator;其核酸序列如SEQ IDNO:1所述。
hr5增强子-IE1启动子和IE1终止子序列均源于载体pIEx-1,L21序列为:5’-AACTCCTAAAAAACCGCCACC-3’。secrNluc为N端融合杆状病毒AcNPV gp64信号序列的Nluc荧光素酶序列,该序列为昆虫密码子优化的,具体序列如SEQ ID NO:3:
委托生物技术公司合成上述分泌性荧光素酶表达盒DNA并克隆到pFastBac Dual载体p10启动子多克隆位点中,构建成分泌性荧光素酶共表达克隆载体pFastBac Dual-hr5IE1-L21-secrNluc,其图谱如图2。并构建无L21的分泌性荧光素酶共表达克隆载体pFastBac Dual-hr5IE1-secrNluc。
在pFastBac Dual-hr5IE1-L21-secrNluc基础上,进一步克隆增强型绿色荧光蛋白基因EGFP(来源于pEGFP-N1)到多角体蛋白基因启动子下游多克隆位点,构建EGFP基因的转移载体pFastBac Dual-hr5IE1-L21-secrNluc-EGFP。
上述所有载体均通过Sanger测序鉴定构建成功。
注:上述构建克隆载体均参照常规的分子克隆方法进行。
2.分泌性荧光素酶共表达克隆载体的瞬时表达分析
为了确定L21与hr5IE1组合应用是否具有增强表达的作用,以pFastBac Dual-hr5IE1-L21-secrNluc和pFastBac Dual-hr5IE1-secrNluc分别转染昆虫细胞sf9,取细胞上清检测荧光素酶活性以分析其表达水平。具体操作参照常规的昆虫细胞瞬时表达,即以等量(1μg)的质粒DNA转染sf9细胞(6孔板中,2×10
3.重组杆状病毒的制备
重组杆状病毒的构建参照Bac-to-Bac实验程序,即将pFastBac Dual-hr5IE1-L21-secrNluc转化到DH10Bac感受态细胞,通过蓝白筛选重组克隆,抽提重组Bacmid DNA,转染sf9细胞,从而得到重组杆状病毒vAc-secrNluc。为了制备高滴度的病毒样品,vAc-secrNluc经放大培养后(重组病毒vAc-secrNluc以1:100体积比接种100mL密度为1×10
采用上述类似步骤制备EGFP基因的重组杆状病毒作为待测重组病毒,即,以pFastBac Dual-hr5IE1-L21-secrNluc-EGFP转化到DH10Bac感受态细胞,构建重组bacmidDNA转染sf9细胞,72小时后,取细胞培养上清作为待测病毒样品vAc-secrNluc-EGFP(EGFP
4.重组杆状病毒荧光素酶活性-滴度相关性分析以及待测病毒滴定
为了确定重组杆状病毒vAc-secrNluc感染后荧光素酶活性和病毒的滴度相关性,以滴度为1×10
采用如下步骤测定病毒样品的荧光素酶活性及滴度计算:
a)制备细胞悬液:取对数生长期的sf9细胞,于15mL细胞离心管中1000rpm离心5min收集细胞,弃上清,加入适量的新培养基重悬细胞,使细胞密度达到2x 10
所用培养基为无血清培养基Sf-900II SFM。说明:本发明中,如未特别指出,所用培养基均为无血清培养基Sf-900II SFM。
b)病毒接种:取上述密度的细胞悬液7mL于15mL细胞离心管中,加入7μL滴度为1x10
c)酶活测定:上述细胞静置培养至感染后2小时,4小时和6小时的时候(从接种病毒开始起算),每孔细胞分别取50μL上清(无需离心),按照标准方法测定荧光素酶活性,即参照荧光素酶检测试剂盒(
d)其他5个梯度的病毒标准样品以及EGFP的待测病毒样品(EGFP
具体为:以2×10
e)根据所得数据,以标准样品病毒滴度的对数值作为横坐标,以其荧光素酶活性的对数值作为纵坐标,制作标准曲线,并求直线回归方程(1)和相关系数,如图4A所示。将待测病毒样品的荧光素酶活性值代入方程(2),所求得数值即病毒滴度。具体换算等式如下:
logE=a×logN+b......(1)
N:病毒滴度(pfu/mL)
E:荧光素酶活性值(RLU)
a,b:分别为直线回归方程的斜率和截距;
本方法分别制作了重组病毒感染后2小时、4小时和6小时的标准曲线,其斜率(和回归系数R
为了进一步分析病毒滴度与荧光素酶活性的相关性,取上述6个梯度重组病毒感染后6小时的细胞培养上清做胶内化学发光检测分析。为了尽可能保持Nluc活性,采取非变性聚丙烯酰胺凝胶电泳分离蛋白。具体操作参照常规SDS-PAGE电泳方法,配制无SDS的5x载样缓冲液和电泳缓冲液,制备无SDS的12%分离胶和5%积层胶。电泳完成后,取下凝胶,参照胶内化学发光检测试剂盒(
5.重组杆状病毒荧光素酶滴定法与常规终点稀释法检测效果的比较
为了比较2种方法的检测效果,以EGFP的重组杆状病毒样品(EGFP
根据本发明所得6小时的标准曲线方程为Y=1.053*x-2.770;
即,logE=a×logN+b,a=1.053,b=-2.770:
EGFP
表1、重组杆状病毒荧光素酶滴定法与常规终点稀释法检测效果的比较
实施例2、将实施例1中目的基因EGFP替换为猪流行性腹泻病毒纤突蛋白S1、幽门螺旋杆菌铁蛋白Ferritin基因,构建S1和Ferritin的待测重组病毒样品,分别测定滴度,方法完全参照实施例1。
所得结果如下表2所述。
表2、S1和Ferritin重组病毒滴度的检测分析
结论:总而言之,本发明提供了一种通过检测共表达的荧光素酶活性来定量测定重组昆虫杆状病毒滴度的方法。比较而言,依据本发明方法构建的重组杆状病毒测定滴度时,(若未浓缩)病毒样品无需稀释,可在感染细胞后2-6小时内测定病毒滴度,滴度范围宽(达10
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
序列表
<110> 浙江理工大学
<120> 基于共表达分泌性荧光素酶快速滴定重组杆状病毒的方法
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 2011
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
cgcgtaaaac acaatcaagt atgagtcata agctgatgtc atgttttgca cacggctcat 60
aaccgaactg gctttacgag tagaattcta cttgtaacgc acgatcagtg gatgatgtca 120
tttgtttttc aaatcgagat gatgtcatgt tttgcacacg gctcataaac tcgctttacg 180
agtagaattc tacgtgtaac gcacgatcga ttgatgagtc atttgttttg caatatgata 240
tcatacaata tgactcattt gtttttcaaa accgaacttg atttacgggt agaattctac 300
ttgtaaagca caatcaaaaa gatgatgtca tttgtttttc aaaactgaac tcgctttacg 360
agtagaattc tacgtgtaaa acacaatcaa gaaatgatgt catttgttat aaaaataaaa 420
gctgatgtca tgttttgcac atggctcata actaaactcg ctttacgggt agaattctac 480
gcgcgtcgat gtctttgtga tgcgcgcgac atttttgtag gttattgata aaatgaacgg 540
atacgttgcc cgacattatc attaaatcct tggcgtagaa tttgtcgggt ccattgtccg 600
tgtgcgctag catgcccgta acggacctcg tacttttggc ttcaaaggtt ttgcgcacag 660
acaaaatgtg ccacacttgc agctctgcat gtgtgcgcgt taccacaaat cccaacggcg 720
cagtgtactt gttgtatgca aataaatctc gataaaggcg cggcgcgcga atgcagctga 780
tcacgtacgt ccctcgtgtt ccgttcaagg acggtgttat cgacctcaga ttaatgttta 840
tcggccgact gttttcgtat ccgctcacca aacgcgtttt tgcattaaca ttgtatgtcg 900
gcggatgttc tatatctaat ttgaataaat aaacgataac cgcgttggtt ttagagggca 960
taataaaaga aatattgtta tcgtgttcgc cattagggca gtataaattg acgttcatgt 1020
tggatattgt ttcagttgca agttgacact ggcggcgaca agatcgtgaa caaccaagtg 1080
aaactcctaa aaaaccgcca ccatggtaag cgctattgtt ttatatgtgc ttttggcggc 1140
ggcggcgcat tctgcctttg cggtgttcac tctggaggac ttcgtcggag actggcgcca 1200
gaccgctggt tacaacctgg accaggtgct ggaacagggt ggcgtctcca gcctgttcca 1260
gaacctgggt gtgtctgtca ctccaatcca gaggatcgtg ctgtcaggag aaaacggtct 1320
gaagatcgac atccacgtca tcatccctta cgagggcctg tccggagacc agatgggcca 1380
gatcgaaaag attttcaagg tggtctaccc cgtggacgac caccacttca aggtcatcct 1440
gcactacggt actctggtca tcgacggcgt cacccctaac atgatcgact acttcggacg 1500
cccctacgag ggtatcgctg tgttcgacgg caagaagatc accgtcactg gcaccctgtg 1560
gaacggaaac aagatcatcg acgaaaggct gatcaaccct gacggatctc tgctgttcag 1620
agtgactatc aacggtgtca ctggatggag gctgtgcgag cgtatcctgg cctaagctcg 1680
agcactaagt gattaacctc aggttataca tatattttga atttaattaa ttatacatat 1740
attttatatt atttttgtct tttattatcg aggggccgtt gttggtgtgg ggttttgcat 1800
agaaataaca atgggagttg gcgacgttgc tgcgccaaca ccacctccct tccctccttt 1860
catcatgtat ctgtagataa aataaaatat taaacctaaa aacaagaccg cgcctatcaa 1920
caaaatgata ggcattaact tgccgctgac gctgtcacta acgttggacg atttgccgac 1980
taaaccttca tcgcccagta accaatctag a 2011
<210> 2
<211> 190
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 2
Met Val Ser Ala Ile Val Leu Tyr Val Leu Leu Ala Ala Ala Ala His
1 5 10 15
Ser Ala Phe Ala Val Phe Thr Leu Glu Asp Phe Val Gly Asp Trp Arg
20 25 30
Gln Thr Ala Gly Tyr Asn Leu Asp Gln Val Leu Glu Gln Gly Gly Val
35 40 45
Ser Ser Leu Phe Gln Asn Leu Gly Val Ser Val Thr Pro Ile Gln Arg
50 55 60
Ile Val Leu Ser Gly Glu Asn Gly Leu Lys Ile Asp Ile His Val Ile
65 70 75 80
Ile Pro Tyr Glu Gly Leu Ser Gly Asp Gln Met Gly Gln Ile Glu Lys
85 90 95
Ile Phe Lys Val Val Tyr Pro Val Asp Asp His His Phe Lys Val Ile
100 105 110
Leu His Tyr Gly Thr Leu Val Ile Asp Gly Val Thr Pro Asn Met Ile
115 120 125
Asp Tyr Phe Gly Arg Pro Tyr Glu Gly Ile Ala Val Phe Asp Gly Lys
130 135 140
Lys Ile Thr Val Thr Gly Thr Leu Trp Asn Gly Asn Lys Ile Ile Asp
145 150 155 160
Glu Arg Leu Ile Asn Pro Asp Gly Ser Leu Leu Phe Arg Val Thr Ile
165 170 175
Asn Gly Val Thr Gly Trp Arg Leu Cys Glu Arg Ile Leu Ala
180 185 190
<210> 3
<211> 573
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
atggtaagcg ctattgtttt atatgtgctt ttggcggcgg cggcgcattc tgcctttgcg 60
gtgttcactc tggaggactt cgtcggagac tggcgccaga ccgctggtta caacctggac 120
caggtgctgg aacagggtgg cgtctccagc ctgttccaga acctgggtgt gtctgtcact 180
ccaatccaga ggatcgtgct gtcaggagaa aacggtctga agatcgacat ccacgtcatc 240
atcccttacg agggcctgtc cggagaccag atgggccaga tcgaaaagat tttcaaggtg 300
gtctaccccg tggacgacca ccacttcaag gtcatcctgc actacggtac tctggtcatc 360
gacggcgtca cccctaacat gatcgactac ttcggacgcc cctacgaggg tatcgctgtg 420
ttcgacggca agaagatcac cgtcactggc accctgtgga acggaaacaa gatcatcgac 480
gaaaggctga tcaaccctga cggatctctg ctgttcagag tgactatcaa cggtgtcact 540
ggatggaggc tgtgcgagcg tatcctggcc taa 573
- 基于共表达分泌性荧光素酶快速滴定重组杆状病毒的方法
- 一种共表达草鱼呼肠孤病毒外衣壳蛋白VP4和VP35的重组杆状病毒的制备方法和应用
