使用微通道对血液进行预处理以对血细胞进行分级
文献发布时间:2023-06-19 11:14:36
技术领域
本发明涉及血液的预处理,特别是涉及使用微通道对血液进行预处理以对血细胞进行分级。本发明还涉及用于血液预处理的评估方法。
背景技术
专利文献1描述了使用微通道对血细胞进行分级。
引文清单
专利文献
专利文献1:国际专利公开第WO2018/123220号。
发明内容
技术问题
当血液流过微通道时,微通道中可能会发生堵塞。本发明的目的是提供一种适合于消除这种堵塞的方法。
解决方案
<1>一种用于血液预处理的方法,包括:在使血液流过微通道以对血液中的细胞进行分级之前,使包含细胞的血液与多孔材料的多孔表面接触。
<2>根据<1>的预处理的方法,其中通过将多孔材料添加到包含细胞的血液中并使它们混合,使包含细胞的血液与多孔表面接触。
<3>根据<2>的预处理的方法,其中所述多孔材料具有多孔表面包含多糖的颗粒,并且作为在液体中的悬浮液添加到包含细胞的血液中。
<4>根据<3>的预处理的方法,其中所述颗粒具有粒度分布,其基于体积的累积分布的中值粒径d50V为25μm至280μm。
<5>根据<4>的预处理的方法,其中当所述多孔材料用于凝胶过滤色谱法时,所述多孔材料能够分级分离DNA,并且所述多孔材料对DNA的排除极限为45个碱基对或多于45个碱基对。
<6>根据<4>的预处理的方法,其中当所述多孔材料用于凝胶过滤色谱法并且满足所述多孔材料对蛋白质分级分离的下限为1×10
<7>根据<4>所述的预处理的方法,其中从所述颗粒中预先去除粒径小于或等于截止直径的小颗粒,和截止直径为25μm至100μm。
<8>根据<3>的预处理的方法,其中要与多孔材料的表面接触的血液是未用另一种液体稀释的全血,在与多孔材料的表面接触后,将全血用另一种液体稀释;或者要与多孔材料表面接触的血液是预先用另一种液体稀释的全血。
<9>一种用于对血液中的细胞进行分级的方法,其包括:根据<3>所述的预处理的方法对包含细胞的血液进行预处理;然后使经预处理的血液流过微通道,从而对血液中的细胞进行水力分级。
<10>根据<9>的分级方法,其中在预处理中,颗粒具有粒度分布,其基于体积的累积分布的中值粒径d50V为25μm至280μm,并且预先通过筛分将小于或等于截止直径的小颗粒从颗粒中去除,并且在分级中,在微通道中进行水力分级的点的上游设置有使血液平面流动的平坦进入通道,并且截止直径大于该进入通道的横截面的短边方向上的长度。
<11>根据<10>所述的分级方法,其中在所述进入通道中以穿过血液流的方式设置有柱密集区,沿短边方向设立柱密集区中的各个柱。
<12>根据<11>的分级方法,其中所述分级富集胎儿有核红细胞(fNRBC)、循环肿瘤细胞(CTC)和骨髓瘤细胞中的任一种。
<13>一种用于血液预处理的评估方法,包括:在对包含细胞的血液进行预处理之后,使血液流过微通道,其中在微通道中以横穿血液流的方式设置有柱密集区;在血液开始流动一定时间之后,观察在柱密集区及在柱密集区下游与之邻近的柱稀疏区段散布的碎屑。
<14>根据<13>所述的评估方法,其中所述区段被最上游的柱密集区、邻近于最上游的柱密集区的柱密集区和微通道的侧壁包围,当在平面图中看到该区段时,碎屑相对于该区段散布的比例被确定为面积比。
<15>根据<14>所述的评估方法,其中通过使包含细胞的血液与测试材料的表面接触来进行预处理。
<16>根据<14>所述的评估方法,其中通过将测试物质添加到包含细胞的血液中并混合来进行预处理。
发明的有益效果
本发明可以提供一种适合于消除微通道中的堵塞的方法。
附图的简要说明
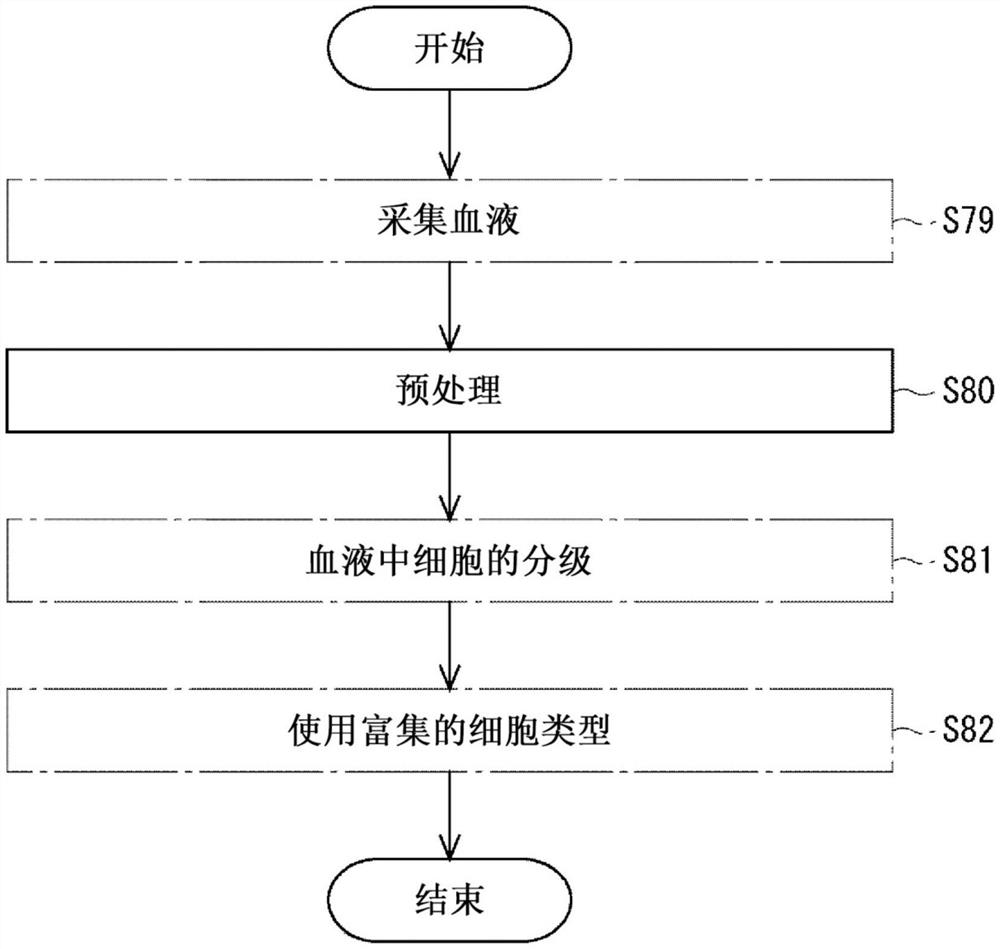
[图1]图1是包括预处理步骤的流程图。
[图2]图2是多孔颗粒的粒度分布。
[图3]图3是微通道的平面图。
[图4]图4是微通道的局部平面图。
[图5]图5是微通道的详细局部透视图。
[图6]图6是进入通道的透视图。
[图7]图7是微通道的观察图像1(上排)及其略图(下排)。
[图8]图8是评估预处理的操作的流程图。
[图9]图9是微通道的观察图像2(上排)及其略图(下排)。
[图10]图10是堵塞率的图表1。
[图11]图11是堵塞率的图表2。
具体实施方式
<1、血液预处理方法的定位>
本发明的一个方面涉及血液的预处理。在描述血液预处理的细节之前,将参考附图描述预处理的定位。在图中,示出了包括预处理血液的步骤S80的流程图。在执行步骤S80之前,在步骤S79中预先从活体采集血液。
在对血液中的细胞进行分级的步骤S81之前执行预处理步骤S80。对血液中的细胞进行分级意味着根据血液中细胞的大小对其进行分级分离。特别地,通过使血液流过微通道来执行步骤S81。步骤S81中的分级的示例是在微通道内执行的水力分级。微通道具有微米级的通道结构。这种微通道结构适合于血液分级(专利文献1)。具有用于血液分级的微通道的芯片可以特别地称为血细胞分离芯片。
在图1中,通过步骤S81的分级获得具有特定粒度分布的细胞群。在血液中的细胞中,混合了各种大小的细胞。每种细胞类型都具有与细胞大小有关的唯一粒度分布。因此,在通过分级获得的每个细胞群中都富集了特定的细胞类型。
在图1中,使用在步骤S82中富集的细胞类型。例如,从富集的细胞类型中,可以获得可用于医生诊断的数据。可以提及以下要诊断的对象和要富集的细胞类型的组合。这些是实施例。
图1中目标血液包括作为要富集的细胞类型的血细胞。血细胞可以是胎儿有核红细胞(fNRBC)。在步骤S79中获得的血液包括fNRBC。fNRBC是包含在母体血液中的。胎儿和孕妇是要诊断的对象。在步骤S80中,对母体血液进行预处理。在步骤S81中,通过分级富集fNRBC。在步骤S82中,获得对胎儿的诊断有用的数据。
图1中目标血液包含作为要富集的细胞类型的在血液中循环的不是血细胞的其他细胞。其他细胞可以是循环肿瘤细胞(CTC)。在步骤S79中获得的血液包括CTC。例如,在怀疑患有癌症的对象、癌症患者和已经接受过癌症治疗的对象的血液中可能包含CTC。这些人是要诊断的对象。在步骤S80中,对他们的血液进行预处理。在步骤S81中,通过分级富集CTC。无论血液中是否含有CTC,都必须执行富集CTC的步骤。在步骤S82中,获得对癌症的诊断有用的数据。
图1中的目标血液中所包括的要富集的细胞类型可以是骨髓瘤细胞。在步骤S79中获得的血液包含骨髓瘤细胞。骨髓瘤细胞可以被检测为微小残留病变(MRD),例如,来自被治疗骨髓瘤的患者。这些人是要诊断的对象。骨髓瘤的一个实例是多发性骨髓瘤。在步骤S80中,对从这类患者采集的血液进行预处理。在步骤S81中,通过分级富集骨髓瘤细胞。无论血液中是否含有骨髓瘤细胞,都必须执行富集骨髓瘤细胞的步骤。在步骤S82中,获得对MRD的诊断有用的数据。
在图1中,已经描述了步骤S79、步骤S81和步骤S82,以理解步骤S80的技术含义。因此,这些步骤在这方面不是必需的。此外,可以在这些步骤之间引入另外的步骤。可以在步骤S80之前或之后引入另外的步骤。
<2、血液预处理方法的详细信息>
将进一步详细描述图1所示的预处理步骤S80。在步骤S80中,使血液与多孔材料的多孔表面接触。血液包括血细胞和血液中循环的其他细胞。血液包括细胞和血浆。为了使血液与多孔表面接触,将多孔材料添加到血液中。可以将多孔材料添加到收集在容器中的血液中。可以将血液放入预先收集有多孔材料的容器中。此外,将多孔材料和血液混合在一起。优选将它们充分混合,以使多孔材料散布在整个血液中。
多孔材料可以是在血液中下沉的材料。多孔材料可以具有颗粒。颗粒可以是球形的。颗粒可以是珠。如本文所用,珠是指通过将每个颗粒形成球形的技术形成的一组颗粒。颗粒可以是悬浮在血液中的。当多孔材料具有颗粒时,多孔材料可以预先悬浮在血液以外的液体中。血液以外的液体可以是缓冲液或防腐液。可以将血清添加到血液以外的液体中。FBS可以用作血清。通过将多孔材料的颗粒的悬浮液添加到血液中,可以使血液和多孔材料彼此接触。
与多孔表面接触的血液可以是未用另一种液体稀释的全血。全血是指没有针对每种血液成分而分级分离的血液,其中包含所有成分,例如血细胞和血浆。
在图1所示的步骤S79中采集全血之后,可以将全血储存一定时间,直到在步骤S80中进行预处理。储存时间可以是1小时到72小时。储存温度可以在1℃至30℃的室温下(日本药典)。储存温度优选为4℃至25℃,特别优选为4℃。储存温度可以在±2℃的范围内波动。波动范围优选为±1℃。当在步骤S79中在采血之后将全血输送到采血设备之外并且然后在步骤S80中对其进行预处理时,优选在保持在4℃的同时输送全血。或者,在步骤S79中采集全血之后,可以在不插入储存步骤的情况下立即在步骤S80中对全血进行预处理。
在图1所示的预处理步骤S80中,优选在将多孔材料和血液混合在一起之后在预定温度下孵育预定的时间。时间可以是例如1分钟至60分钟。时间可以是30分钟±5分钟。孵育温度可以是1℃至30℃的室温(日本药典)。孵育温度可以是4℃至25℃。孵育温度没有特别限制,只要其不显著损害全血中的细胞或物质的状况即可。例如,在将全血储存在4℃的环境中之后,可以将已经冷却的全血在25℃的环境中孵育。
当多孔材料具有颗粒时,每1mL未稀释的血液中要添加的多孔材料的量为10μL至50μL。可以根据稀释血液的稀释比来调节多孔材料的添加量。在这种情况下,随着稀释比的增加,可以减少多孔材料的添加量。例如,当将1mL血液稀释5倍时,相对于5mL稀释血液,可以添加10μL多孔材料。当将1mL血液稀释2.5倍时,相对于2.5mL稀释血液,可以添加20μL多孔材料。
在前面的描述中,当指定多孔材料的体积时,假定多孔材料用水溶胀。当多孔材料是珠时,可以以珠溶液的形式处理多孔材料。通过将多孔材料混合到磷酸盐缓冲生理盐水(PBS)中获得珠溶液。在此,称量多孔材料的珠,为方便起见,假定珠之间的间隙包括在珠的体积中。例如,可以使用其中50%被多孔材料的珠占据而其余50%被PBS占据的珠溶液。
在前面的描述中,可以预先洗涤多孔材料。可以使用PBS进行洗涤。可以使用用于稀释血液的液体或蒸馏水进行洗涤。洗涤可以进行2次或3次或多于3次。
在图1中,例如,预处理步骤S80可以与血液采集步骤S79同时执行。例如,多孔材料预先设置在采血管内。由此,在采血的同时,采集的全血和多孔材料在采血管内相互接触。通过摇动采血管,可以使血液与多孔材料更好地接触。
在图1中,在预处理步骤S80中与多孔表面接触的血液也可以是用另一种液体稀释的全血。例如,在血液采集步骤S79之后并且在步骤S80使血液与多孔材料接触之前,用另一种液体稀释从活体采集的血液。在本说明书中,血液还包括稀释的全血。稀释比可以为大于1倍且10倍以下。即,对于体积为1的全血,可以添加体积大于0且体积9以下的另一种液体。稀释比可以是1.5倍、2.0倍、2.5倍、3.0倍、3.5倍、4.0倍、4.5倍和5.0倍中的任一个。稀释比可以是6倍、7倍、8倍和9倍中的任一个。
在一个实例中,相对于1mL全血添加50μL至100μL的珠溶液(50体积%的珠),并且将混合物在25℃的环境下旋转并混合30分钟。在旋转和混合过程中,对多孔材料的珠和血细胞进行孵育。将其用PBS稀释并进行血细胞分级。在另一个实例中,在用PBS稀释全血之后,可以向其中添加多孔材料。在这种情况下,无需孵育即可进行分级。或者,可以将多孔材料预先添加到大管中,并可以进一步向其中添加稀释的血液。此外,通过将多孔材料添加到预先制备的稀释溶液中并向其中添加全血,可以将全血稀释并同时与多孔材料接触。
多孔材料可以与血浆中包含的成分反应。例如,多孔材料可以吸附血浆中包含的成分。待吸附的成分可以是直接引起微通道堵塞的成分。待吸附的成分可以是间接促进微通道堵塞的成分。
在多孔材料的表面上形成多个微孔。多孔材料可以结合到另一种非多孔材料上。例如,涂覆有多孔材料的非多孔颗粒可以形成多孔颗粒。每个颗粒的中心可以是非多孔的。每个颗粒的中心可以是铁磁性的。
多孔材料的材料可以是多糖。多孔材料的微孔可以由多糖形成。多糖可以是交联的。多糖可以是琼脂糖、葡聚糖和烯丙基葡聚糖中的任一种。多糖可以被修饰。所述修饰可以是DEAE(二乙基乙醇胺)修饰。
颗粒状多孔材料可以是可用于凝胶过滤色谱法的材料。凝胶过滤色谱是其中流动相是水溶液的尺寸排阻色谱。此时,可以使用可以分级分离DNA的材料。用于DNA的多孔材料的排除极限优选为45个碱基对或多于45个碱基对。用于DNA的多孔材料的排除极限可以是165个碱基对或多于165个碱基对或165个碱基对或少于165个碱基对。用于DNA的多孔材料的排除极限可以是1078个碱基对以上或多于1078个碱基对或1078个碱基对或少于1078个碱基对。
颗粒状多孔材料可以是可以分级分离蛋白质的材料。多孔材料相对于蛋白质的级分范围的下限优选为1×10
图2示出了作为基于体积的累积分布的多孔颗粒的粒度分布。多孔材料的颗粒具有粒度分布。多孔材料的累积体积分布中的中值粒径d50V是基于体积的累积分布中的中值粒径。当颗粒是由多糖制成的时,以颗粒在缓冲液中溶胀状态的粒径作为参考。粒径的测量实例是通过激光衍射或光散射确定的有效尺寸或通过库尔特方法确定的球体积当量直径。
在图2中,中值粒径d50V优选小于500μm。中值粒径d50V优选为25μm至280μm,更优选为25μm至165μm,进一步优选为45μm至165μm。落在该范围内的中值粒径d50V使多孔材料的表面积适合与血液接触。
在图2中,根据需要,优选从多孔材料的颗粒中截止小颗粒。截止意味着从多孔材料的颗粒中除去小颗粒。在一方面,具有截止直径CF或更小的粒径的小颗粒被预先去除。截止直径CF的范围是25μm至100μm。截止直径CF可以为40μm至70μm。优选通过使用筛网筛分去除小颗粒。例如,可以使用细胞过滤器从多孔材料的颗粒群中去除小颗粒。小颗粒的去除可以抑制由于混合在血液中的小颗粒而引起的微通道堵塞。取决于微通道的类型,已经渗透到微通道中的小颗粒平安无事地从微通道中流出。对于这样的通道,无需考虑由于小颗粒而造成的堵塞。然而,即使在这样的微通道中,也可能由于血液中的某些化学成分发生堵塞(稍后描述的碎屑)。因此,使用未被截止的颗粒对于抑制堵塞是有效的。
当从原始颗粒去除小颗粒时,原始颗粒的粒度分布发生改变。即,截止具有尺寸选择的效果。尺寸选择后,中值粒径也会变化。为了方便起见,本说明书中的中值粒径d50V是基于在通过截止从原始颗粒中除去小颗粒之前的粒度分布。
<3、血液中细胞的分级方法>
再次参考图1。本发明的一个方面是一种用于对血液中的细胞进行分级的方法,其结合了步骤S80和步骤S81。首先,基于上述预处理方法处理含细胞的血液(步骤S80)。接下来,通过使经预处理的血液流过微通道而对血液中的细胞进行水力分级(步骤S81)。
在图1中,可以预先稀释血液,然后在步骤S81中对其进行分级。稀释可以在预处理步骤S80之前或之后进行。分级中相对于全血的稀释比可以为大于1倍且10倍以下。即,对于体积为1的全血,可以添加体积大于0且体积9以下的另一种液体。稀释比可以是1.5倍、2.0倍、2.5倍、3.0倍、3.5倍、4.0倍、4.5倍和5.0倍中的任一个。稀释可以在预处理之前和之后进行。例如,全血可以在预处理之前被稀释2倍至3倍,并且在预处理完成之后可以进一步稀释为相对于全血稀释5倍。
在图1中的对血液进行预处理的步骤S80之后,可以储存经预处理的血液,直到在步骤S81中进行分级。预处理后的储存温度范围可以是4℃±2℃。可以在预处理之后立即在步骤S81中执行分级,而无需插入储存步骤。
<4、分级装置>
此后,示出了用于水力分级的装置的实例。在图3中,以平面图示出了微通道20。微通道20是用于分级分离包括例如血细胞的浮细胞的通道芯片。为了便于描述,图中分别示出了X轴、Y轴和Z轴,以便理解微通道20的功能。这些轴没有具体限制微通道20的形状。
在图3中,微通道20具有主通道23。主通道23的一端作为入口21a。主通道23的另一端作为出口22c。微通道20还具有子通道24。子通道24的一端作为入口21b。子通道24的另一端在汇合处28处连通至主通道23。
在图3中,主通道23具有从入口21a朝向出口22c依次设置的通道部分25a至25d。通道部分25a至25d从入口21a到出口22c连通为一体。汇合处28介于通道部分25a与通道部分25b之间。
在图3中,微通道20具有分支通道26a和分支通道26b。分支通道26a和分支通道26b都是从主通道23分支的通道。分支通道26a和分支通道26b是以此顺序从上游侧依次从主通道23分支的。分支通道26a和分支通道26b的一端通过通道部分25c连通至主通道23。在通道部分25c中,分支通道26a和分支通道26b设置在子通道24的相对侧。在分支通道26a和分支通道26b的另一端处存在出口22a和出口22b。
在图3中,分支通道26a和分支通道26b各自具有从主通道23分支的多个小通道。小通道分别沿着从主通道23的上游到下游的方向排列。小通道分别到达出口22a和22b。小通道分别在出口22a和出口22b之前合并。通道部分25d位于通道部分25c的下游。通道部分25d到达出口22c。
在图3中,入口21a连通至包含经预处理的血液BL的注射器30。血液BL以预定的流速从注射器30输送到入口21a。血液BL通过入口21a进入通道部分25a。血液BL可以在注射器30内被预处理。在注射器30内对血液BL进行预处理之后,将血液BL从注射器30输送到微通道20。
在图3中,微通道20具有子通道24。子通道24连通至注射器35。将澄清的液体CL放入注射器35中。澄清的液体CL是没有浮细胞的液体。澄清的液体CL是不损害血细胞和其他细胞的液体。澄清的液体CL是缓冲液。澄清的液体CL也可以是PBS。通过对注射器35施加压力,澄清的液体CL通过入口21b进入子通道24。澄清的液体CL流过子通道24。澄清的液体CL流入通道部分25b。
一部分细胞悬浮液通过每个出口排出。分别获得出口22c处的级分F3、出口22b处的级分F2和出口22a处的级分F1。级分F1和级分F2各自包含在通道部分25c中分级的细胞。级分F3包含已经通过通道部分25c的血浆。
图4以平面图示出了微通道20。该图示意性地示出了使用微通道20分级分离浮细胞的过程。为了简单起见,分支通道26a示出了10个小通道,分支通道26b示出了3个小通道。
图4和图5引用自日本未审查专利申请公开第2007-175684号,并进行了部分更改。在日本未审查专利申请公开第2007-175684号中特别详细地描述了分级机制。
如图4所示,血液BL从通道部分25b的更上游连续地流动。血液BL包含大量的细胞。澄清的液体CL的流与血液BL的流从其侧面连续地接触。由此,流过主通道23的细胞被连续地推离主通道23的侧面。结果,血液BL的流被连续地推向澄清的液体CL的流的相反侧。在通道部分25b至通道部分25c中,浮细胞被连续地推向分支通道26a和分支通道26b的一侧,并且浮细胞连续地流入这些分支通道。
如图4所示,无核红细胞27连续流入分支通道26a。在通道部分25b中,血液BL中的无核红细胞27被水力分级。分级是在血液BL在不与澄清的液体CL的流接触的一侧的流中连续进行的。
如图4所示,分支通道26a用作去除无核红细胞27的通道。分支通道26a的每个小通道的内切圆直径为12μm至19μm。内切圆直径可以是13μm、14μm、15μm、16μm、17μm和18μm中的任一个。
如图4所示,有核细胞29a至29c连续流入分支通道26b。在通道部分25b下游的通道部分25c中,血液BL中的有核细胞29a至29c被水力分级。分级是在血液BL的不与澄清的液体CL的流接触的一侧的流中连续进行的。特别地,从分支通道26b连续获得有核细胞的细胞悬浮液。
如图4所示,分支通道26b用作收集有核细胞29a至29c的通道。分支通道26b的每个小通道的内切圆直径为20μm至30μm。内切圆直径可以是21μm、22μm、23μm、24μm、25μm、26μm、27μm、28μm和29μm中的任一个。包括有核红细胞的有核细胞的直径被认为是11μm至13μm。
图4中所示的分支通道26a和分支通道26b的每个小通道的内切圆直径是在与小通道正交的横截面中的内切圆的直径。小通道的横截面的形状可以是正方形、其他多边形或圆形。这同样适用于其他分支通道。未被引入分支通道26a和分支通道26b中的浮细胞和血浆作为流通FT连续通过通道部分25d。之后,它们到达图3中的出口22c。例如,流通FT包括聚集的血细胞等。
图5示出了聚焦在通道部分25c上的微通道的细节。在根据该实施例的水力分级中,小通道的内切圆直径的值不等于要分级的浮细胞的直径的最大值。因此,根据该实施例的水力分级不同于简单过滤。下面将描述根据该实施例的水力分级。
图5示出了通道部分25c。图5还示出了分支通道26a的小通道。为了简单起见,仅一个小通道构成分支通道26a。在图5的描述中,将构成分支通道26a的小通道简称为分支通道26a。
如图5所示,液流LF被连续地引入到通道部分25c中。液流LF包括上述的血液BL和澄清的液体CL。这些液体在液流LF的界面处部分混合。在液流LF中包含作为大细胞的有核细胞29a和作为小细胞的无核红细胞27。在图中,有核细胞29a被描绘为其他有核细胞的代表。
在图5中,被引入分支通道26a中的一部分液流LF被称为液流LE。没有引入分支通道26a并向下游流动的部分液流LF被称为液流LG。在液流中,仅液流LG被阴影线填充。在此,液流LE的流速与液流LE的横截面成比例。液流LE沿着通道部分25c的分支通道26a侧的内壁流动。液流LE的流速也与分支通道26a中的液流LE的流速成比例。
在图5中,在液流LE内流动的无核红细胞27被引入分支通道26a。同时,有核细胞29a的体积的一半以上属于液流LG侧。有核细胞29a仅部分接触液流LE。因此,有核细胞29a没有被引入分支通道26a。此时,有核细胞29a的直径可以小于分支通道26a的内切圆直径。如果液流LE的流速增加,则液流LE的横截面增大。在这种情况下,也可以想到,有核细胞29a被带入液流LE中并被引导至分支通道26a。
在图5中,有核细胞29a被液流LG带到更下游。因此,可以从分支通道26a收集不包含一定大小以上的浮细胞的流体。结果,无核红细胞27在此处被分级。此外,有核细胞29a和其他有核细胞在下游被分级。
<5、进入通道>
再次参考图3。微通道20中的通道部分25a位于进行水力分级的通道部分25c的上游。通道部分25a位于汇合处28的上游,在此处澄清的液体CL的流进一步汇合。通道部分25a连通至入口21a。此后,通道部分25a可以被称为进入通道。
图6示出了对应于进入通道的通道部分25a。血液通过入口21a进入通道部分25a。通道部分25a是平坦的。通道部分25a中的血液流动是平面的。将通道部分25a的横截面YZ的短边方向的长度表示为尺寸SD。
根据图6,尺寸SD对应于通道部分25a的高度。尺寸SD优选为25±5μm。为尺寸SD选择合适的值有利于血细胞中的细胞流动。此外,血细胞中的细胞可以在通道部分25a中沿Y方向扩散。此外,优选地,在所有其他通道部分中保持尺寸SD。利用这种构造,来自+Y方向的澄清的液体的流有助于将+X方向上的血液的流推向-Y方向(见图4)。
再次参考图2。如上所述,用于预处理的多孔颗粒具有粒度分布。一方面,中值粒径d50V小于500μm。中值粒径d50V优选为25μm至280μm,更优选为25μm至165μm,进一步优选为45μm至165μm。
在图2中,优选通过在如上所述的预处理中筛分而预先将具有截止直径CF或更小的小颗粒从颗粒中除去。截止直径CF的范围是25μm至70μm,优选地25μm至40μm。
图6示出了多孔颗粒PP。颗粒PP的粒径大于截止直径CF。在一个优选的方面,截止直径CF大于尺寸SD。换句话说,几乎所有的颗粒PP具有大于尺寸SD的粒径。在此,即使粒径小于尺寸SD的颗粒PP仍然存在,也认为这些颗粒是被偶然地混入,例如是由于筛分不完全。
在图6中,通过如上所述地设置颗粒PP的尺寸,可以防止颗粒PP进入通道部分25a。在一个优选的方面,在通道部分25a的过程中设置有柱密集区11。柱密集区11中的每个柱连接通道部分25a的上表面和下表面。通过如上所述设置颗粒PP的尺寸,可以防止颗粒PP阻塞柱密集区11。下面描述柱密集区11的构造和功能。
<6、柱密集区>
图7示出了通道部分25a的观察图像及其示意图。通道部分25a包括柱密集区11。柱密集区11被设置为横穿通道部分25a中的血液流。血液从图中左侧的上游流向右侧的下游。
在图7中,通道部分25a具有区段12。区段12在柱密集区11的下游与柱密集区11相邻。在区段12中,柱是稀疏的。通道部分25a还包括柱密集区13。从柱密集区11观察,柱密集区13是在下游方向上邻近柱密集区11的柱密集区。柱密集区13的构造可以与柱密集区11的构造相同。
在图7中,区段12被柱密集区11、柱密集区13和通道部分25a的侧壁包围,即被微通道的侧壁包围。通道部分25a还具有区段14。区段14在柱密集区13的下游与柱密集区13相邻。通道部分25a还在区段14的下游包括柱密集区。在实施例中将描述附图标记15至17。
在图7中,柱密集区11没有对血液流提供很大的阻力。此外,柱密集区11不会显著降低血液流速。柱密集区11起到过滤器的作用。柱密集区11防止血液中的杂质例如大于血细胞的不溶成分进入柱密集区11下游的通道部分。此外,如果存在聚集的血细胞,则柱密集区11起到将血细胞一一分开的作用。
<7、预处理的实施例>
在该实施例中,将基于图7至图11描述用于预处理血液的方法的实施例及其效果。下面将描述图7。图8是评估预处理的操作的流程图。在步骤S89中,从人体采集血液。在预处理步骤S90之前,将血液在4℃储存1小时至48小时。
在图8的步骤S90中,用多孔材料的多糖珠对血液进行预处理。为此,预先清洗珠。首先,将用PBS稀释2倍的珠添加到1.5mL试管中。将PBS与珠混合后,通过在室温(室温:25℃)下以500×g离心2分钟弃去上清液。此外,通过添加PBS来重复洗涤,以总共执行3次洗涤操作。洗涤后,将混合物用PBS稀释至在稀释2倍时的原始体积。PBS和珠的混合物作为珠溶液添加到血液中。
在图8中,在步骤S90中,通过将珠添加到血液中来对血液进行预处理。在实施例中,将多孔多糖珠B01、B02和B03各自添加到血液中并混合。每1mL稀释血液中添加的珠量为50μL。通过在25℃下旋转30分钟进行混合。经过30分钟后,停止旋转,并将混合物在室温下静置30分钟。珠的列表如下。
[表1]
珠均获自Merck(Sigma-Aldrich)。产品名称列中显示的Sepharose、Sephacryl和Sephadex均为商标。
DNA排除极限(级分范围[Mr]DNA排除极限)描述如下。即,从微孔中排除大于珠的最大孔径的溶质颗粒。当选择DNA作为溶质颗粒时,存在基于碱基数量的排除限制。Mr代表相对分子质量。
蛋白质级分范围是球状蛋白质的分子大小(Da)的级分范围(级分范围[Mr],球状蛋白质)。
珠B01的凝胶基质Sepharose CL-6B是由6%交联琼脂糖制成的球体。粒径为45μm至165μm。
珠B02的凝胶基质,Sephacryl 500-HR(产品号:S500HR,可从Sigma-Aldrich获得)由烯丙基葡聚糖和N,N′-亚甲基双丙烯酰胺的交联共聚物制成。累积体积分布中的中值粒径(粒径,d
珠B03的凝胶基质,Sephadex G-75,是由交联的葡聚糖制成的。湿润状态下的粒径为90μm至280μm。干燥状态下的粒径为40μm至120μm。基于葡聚糖(级分[Mp]葡聚糖)的级分范围为1×10
接下来,在图8所示的步骤S91中,用PBS稀释血液。稀释比为2倍至3倍。
接下来,在图8所示的步骤S92中,血液流过血细胞分离芯片(微通道)。没有进行任何处理以去除血液中的珠。
接下来,在图8所示的步骤S93中观察芯片。在步骤S92中血液开始流动之后30分钟至90分钟进行观察。在血液流过血细胞分离芯片时进行观察。
再次参考图7。观察区段12。芯片放置在USB摄像头(HOZAN TOOL IND.CO.,LTD)下。在平面图中观察芯片。用HOZAN USB cam软件捕获芯片,以获取图7上排所示的图像数据。将图像数据读入ImageJ软件并在同一软件上进行分析。
从图7中的图像数据中切出与区段12相对应的区域15。区域15中的像素总数被视为区段12的总面积。通过目视检查将区域15中的碎屑部分16与流动部分17区分开。碎屑部分16被从柱密集区11作为起点聚集的碎屑占据。散布到柱密集区11的碎屑导致在柱密集区11中的堵塞。血细胞的流动被碎屑部分16推开。相反,血细胞在流动部分17中平稳地流动。
在图7中,在碎屑部分16和流动部分17之间画出可视的线。确定由线限定的碎屑部分16内的像素的数量。确定区段12内的所有碎屑部分16的像素总数为碎屑面积。将碎屑面积相对于区段12总面积的比值确定为百分比。用该值作为堵塞率。
图9示出了比较例C01中的通道部分25a的观察图像及其示意图。在比较例C01中,除了不添加珠以外,以与上述实施例相同的方式制备血液。血液以与上述相同的方式流过血细胞分离芯片。由于也以相同的方式进行观察,所以碎屑部分16散布到区域15的大部分(70%或大于70%)。进一步地,碎屑被细分。
在图9所示的比较例C01中,改变了计算堵塞率的方法。获得从区域15中除去碎屑部分16的部分即流动部分17的像素总数。这被指定为流动部分17的面积。从区域15的总面积中减去流动部分17的面积,从而估算出碎屑部分16的面积。用该估计面积作为碎屑面积。
图9所示的区域15与区段12的整个范围一致。区域15可以是区段12的部分范围。
在图9中,碎屑在区段12和柱密集区11之间的边界上朝着柱密集区11的内部穿透。或者,还可以推断出,在柱密集区11内部产生的碎屑继续到达区段12。
图10是示出堵塞率的图表1。用珠B01和珠B03预处理的血液的堵塞率低于比较例C01的血液的堵塞率。因此,发现具有多孔表面的多糖珠具有防止堵塞的作用。
图11是示出堵塞率的图表2。用珠B02和珠B03预处理的血液的堵塞率低于比较例C02(对照)的血液的堵塞率。从图11的结果还可以证实,具有多孔表面的多糖珠具有防止堵塞的作用。在比较例C02的对照中,仅通过旋转将血液混合,而没有向血液中添加珠和PBS的混合物。
如图10和图11所示,珠B01和珠B02具有比珠B03更强的防止堵塞的作用。如表1所示,珠B01和珠B02具有比珠B03更高的DNA排除极限。此外,相对于珠03,珠B01和珠B02的蛋白质级分范围偏向于更大蛋白质的一侧。
作为比较例C03,通过将非多孔琼脂糖粉与血液混合,以与上述相同的方式进行预处理。作为比较例C04,通过使血液与通过溶解琼脂糖粉末形成的琼脂糖凝胶的倾斜型凝胶的表面接触来进行预处理。在两个比较例中,与未进行预处理的情况相比,均未发现防止堵塞的显著效果。已经发现,用于预处理的材料的多孔性比多糖的化学性质对获得防止堵塞的效果更重要。
作为另一实施例,在图8中的步骤S90中的预处理之前更早地执行步骤S91中的稀释。即,将步骤S90和步骤S91的顺序颠倒。使用珠B01(Sepharose CL-6B)。同样在这种情况下,可以确认防止堵塞的效果。
<8、预处理和分级相结合的实施例>
(1)截止和预处理
在该实例中,从多孔颗粒中将小颗粒截止以进行预处理。在这个实施例中,使用珠B01,Sepharose CL-6B。将1mL的珠放入尼龙细胞过滤器(FALCON,商标)中。在用搅拌器搅拌下,将珠过滤过夜。过滤时间可以是几小时至24小时。过滤是在蒸馏水中进行的。细胞过滤器的筛孔尺寸为40μm、70μm和100μm。对每种筛孔尺寸的细胞过滤器进行过滤。在此,将详细描述70μm筛孔细胞过滤器的使用实施例。筛孔尺寸对应于截止直径。由截止过滤的大颗粒用于预处理。随着筛孔尺寸的减小,大颗粒的产量增加。将珠用PBS洗涤两次。
每个珠悬浮在与珠相同体积的澄清的液体中。将20μL的珠悬浮液添加到2mL澄清的液体中,并充分混合。澄清的液体是预先补充有1%FBS的PBS。将珠和澄清的液体的混合溶液进一步添加到澄清的液体中。通过使一部分澄清的液体预先流过血细胞分离芯片,将血细胞分离芯片的内部预先浸入缓冲液中。血细胞分离芯片的浸泡进行40分钟。
(2)截止直径的评估
用显微镜观察分级后的血细胞分离芯片。如图6所示,在使用截止直径为70μm和100μm的珠进行预处理的情况下,在进入通道(通道部分25a)或入口21a附近观察到碎屑。通道被碎屑略微封闭。相反,在用截止直径为40μm的珠进行预处理的情况下,没有发现碎屑。此外,血液样品的分级持续2小时40分钟,但是没有观察到通道的封闭。已经发现,期望将截止直径调节为70μm或小于70μm,以便获得抑制由碎屑封闭通道的效果。截止直径可以是60μm或50μm。
在截止直径为40μm、70μm和100μm的任何情况下,均可通过血细胞分离芯片处理全部血液样品。没有多余的血液样品因为血细胞分离芯片被碎屑封闭而无法分离。在以下测试中,将使用70μm的截止直径。
(3)细胞加标
在此实施例中,将K562细胞加标入全血以形成CTC的模型。从健康的人那里采集全血,并储存在4℃。采集血液的一天后,将K562细胞的悬浮液添加到全血中,以获得血液样品。相对于2mL血液,添加量为865.4个细胞。K562细胞是来自患有慢性粒细胞白血病的患者的淋巴悬浮培养细胞。
预先估计要添加的K562细胞的数量如下。首先,将K562细胞进行Hoechst染色。染色后,用显微镜观察细胞以计数细胞数。如上所述,可以检查每体积的K562细胞悬浮液中K562细胞的数量。
用与上述珠混合的澄清的液体(1%FBS-PBS)将血液样品稀释5倍。通过使血液样品与珠接触来对其进行预处理。通过立即使稀释的血液样品流过血细胞分离芯片来对血细胞进行分级。作为分级的结果,参照图3和图4进行说明,在级分F2中得到大量含有淋巴细胞的白细胞。在级分F1中获得了大量无核成熟红细胞。流入血细胞分离芯片的细胞的大多数(>99.9%)流出至级分F1。F3中未获得大量血细胞。由于K562细胞是淋巴样的,因此预计它们将包含在级分F2中。
(4)分级的定量评估
表2示出了对分级进行量化的结果。上排代表未使珠与血液样品接触的情况(无珠)。下排表示以70μm截止的珠与血液样品接触的(截止)情况。开始分级后经过的时间(时间进程,分钟)分为三个时间间隔,分别为0分钟至15分钟、15分钟至45分钟和45分钟至75分钟。
[表2]
表2的左侧显示了全血中包含血细胞的血液样品中的细胞总数。流入血细胞分离芯片的细胞个数(输入细胞个数)是通过测量每单位体积(mL)的稀释血液中的血细胞个数而获得的。通过使用TC20自动细胞计数仪(BIO RAD)处理10μL用PBS以预定的稀释比稀释的全血来进行测量。进一步地,通过将稀释比和全血体积乘以所获得的测量值来进行计算。
表2的左侧显示了流入血细胞分离芯片的血液样品中的细胞个数(输入细胞个数)。此外,在那里示出了流入血细胞分离芯片的血液样品的体积(输入体积),其被转换为全血。
此外,表2中显示了流出到级分F1、级分F2和级分F3的细胞总数(输出细胞个数)(×10
全血中的细胞分级是在不与珠接触的情况下进行的。在这种情况下,在血细胞分离芯片内发生堵塞。因此,细胞分级在45分钟后难以继续进行。同时,与被截止的珠接触的全血中几乎所有的细胞都被收集。
(5)有核细胞收集率的评估
表2右侧显示了K562细胞加标的包含血细胞的血液样品中的细胞总数。实际测量了流到级分F2和级分F3的K562细胞的数量。在细胞数量的实际测量中,有必要将K562细胞与源自全血的其他有核细胞区分开。通过以下操作来进行:在预先加标之前用Hoechst33342(可从Sigma-Aldrich获得)对K562细胞进行染色,用可从KEYENCECORPORATION购得的多合一荧光显微镜BZ-X710观察分级分离后收集的分级细胞,并区分其中细胞核被荧光标记的细胞为K562细胞,没有这种标记的细胞为源自全血的其他有核细胞。
获得的值(输出细胞个数)用于计算收集率。在此,收集率是级分F2和级分F3内实际收集到的K562细胞数相对于流入血细胞分离芯片的K562细胞数(输入细胞个数)的百分比。
流入血细胞分离芯片的K562细胞数(输入细胞个数)如下所述。在不使用珠(无珠)的测试中,将用于制备血液样品的每1毫升含443个K562细胞的全血与血液样品混合。该值在表2中显示为流入细胞的浓度(输入细胞浓度)。分级开始后0分钟至15分钟,分级的血液样品体积(输入细胞体积)为0.075mL。但是,考虑到稀释度,该值已转换为全血的体积。在此时间间隔内的流入细胞个数(输入细胞个数)为443×0.075=33.23。假设在该时间间隔中,所有的K562细胞都收集在级分F2和级分F3中的任一个中,则收集了33.23个K562细胞。在不使用珠(无珠)的此时间间隔(时间范围,0分钟到15分钟)中,流出到级分F2和级分F3的K562细胞个数(输出细胞个数)为34。该值是所收集的K562细胞数的测量值。K562细胞的收集率为34/33.23×100=102.3%。
在表2中,分级开始后15分钟至45分钟,分级分离的血液样品的体积(输入细胞体积)为0.150mL。但是,考虑到稀释度,该值已转换为全血的体积。在此时间间隔内的流入细胞个数(输入细胞个数)为443×0.150=66.45。流出至级分F2和级分F3的K562细胞数(输出细胞个数,测量值)为91。K562细胞的收集率为91/66.45×100=136.9%。
当截止直径为70μm时,K562细胞的收集率还显示在表2的下方的行中。在各个时间间隔中,由级分F2和级分F3组成的级分中发现的K562细胞数(输出细胞个数)为26、57和54。在用截止直径为70μm的珠进行的预处理中,在任何时间间隔K562细胞的收集率为80%或大于80%,因此确定收集率是足够高的。
此实施例是作为富集CTC的模型实验进行的。上述结果表明,预处理对于富集CTC是有用的。具体而言,表明可以通过防止芯片堵塞来进行长期分级。通过使用本实施例的方法进行长期分级,可以处理大量的血液样品。这意味着每个过程获得的CTC数量很大。此外,这些也被认为有效地富集了血液中仅少量含有的细胞,例如,母体血液中的胎儿有核红细胞,如CTC。
<9、评估预处理的方法>
本发明的另一方面是一种评估血液预处理的方法。再次参考图8,并且将参考该图给出描述。在步骤S89中采集含细胞的血液。在步骤S90中预处理含细胞的血液。
在步骤S90的预处理中,使含细胞的血液与测试材料的表面接触。测试材料可以是粉末形式。所述测试材料可以是在容器的表面上形成的结构。或者,将测试材料添加到含细胞的血液中并与之混合。测试材料可以溶解在血液中。
如图8所示,在步骤S91中将血液稀释。稀释比优选为至少2倍。例如,稀释比为2倍至3倍。稀释例如用PBS进行。稀释可以在步骤S90之前进行。即,步骤S90和步骤S91的顺序可以相反。可以在步骤S90之前执行稀释,并且可以在步骤S91中执行进一步稀释。
在步骤S92中,使血液流过微通道。如图7所示,在微通道内以穿过血液流的方式设置有柱密集区11。观察到碎屑部分16出现在柱密集区11中以及在柱密集区11下游与至邻近的区段12中。在区段12中,没有柱或者柱稀疏。
在血液开始流动一定时间之后,观察到在图7所示的区段12中出现碎屑部分16。所述时间是例如30分钟至90分钟。将碎屑部分16在区域15中所占的面积比确定为面积比。确定方法可以是根据以上实施例进行的。
应当注意,本发明不限于上述实施方案,并且可以在不脱离要旨的情况下适当地改变。
本申请要求2018年10月25日提交的日本专利申请第2018-200712号的优先权,其公开内容全文以引用方式并入本文。
附图标记
11:柱密集区
12:区段
13:柱密集区
14:区段
15:区域
16:碎屑部分
17:流动部分
20:微通道
21a和21b:入口
22a至22c:出口
23:主通道
24:子通道
25a至25d:通道部分
26a和26b:分支通道
27:无核红细胞
28:汇合处
29a至29c:有核细胞
30:注射器
35:注射器
B01至B03:珠
BL:血液
C01至C04:比较例
CF:截止直径
CL:澄清的液体
d50V:中值粒径
LE:液流
LF:液流
LG:液流
PP:颗粒
S79至S82:步骤
S89至S93:步骤
SD:尺寸
- 使用微通道对血液进行预处理以对血细胞进行分级
- 使用微通道进行冷却的部件
