可抑制炎症反应的基因洗脱涂层材料及其制备方法
文献发布时间:2023-06-19 11:17:41
技术领域
本发明属于生物医学工程功能材料技术领域,具体涉及一种可抑制炎症反应的基因洗脱涂层材料及其制备方法,可用于心血管支架功能涂层的制备及应用,也可以拓展到其他心血管材料功能涂层的制备领域。
背景技术
血管支架植入术已成为治疗冠状动脉硬化性心脏病(冠心病)的主要手段,然而早期的金属裸支架(Bare Metal Stent,BMS)植入后易引发新生内膜过度增生,从而导致支架内再狭窄(In-stent Restenosis,ISR)发生概率较高(20%-30%);而药物洗脱支架(Drug-eluting Stent,DES)虽可以通过抗增生药物(如雷帕霉素、依维莫司等)的原位释放,有效抑制ISR的发生概率,但是随后的临床报道发现,DES在抑制血管平滑肌细胞过度增生的同时,也抑制了内皮细胞层的愈合延迟,导致了晚期血栓的发生(Late Stent Thrombosis,LST)(发生率约1.5%-2%),成为DES使用中的严重隐患。此外,DES释放药物后,支架本体材料长期暴露于血管之中,诱导血管内皮细胞(Vascular endothelial cells,ECs)的炎症反应,导致其正常功能失调(迁移及黏附能力下调),从而导致再内皮化(Re-endothelialization)延迟,最终导致晚期血栓(Late stent thrombosis,LST)。因此,研发具有抑制血管内皮细胞炎症反应的药物涂层是解决现有支架诱发晚期血栓的新思路。
由于基因治疗在靶向性和持久性上的特殊性,基因洗脱支架(Gene-elutingStent,GES)也应运而生,其核心是选择合适的基因,进行靶向递送、转染及表达,发挥调节血管组织修复进程的功能。miR-143具有良好的抗炎效果,结合支架涂层技术,将表达miR-143的基因载体导入血管内皮细胞,有望解决支架植入后引起的晚期血栓。
发明内容
针对现有支架药物涂层所面临的问题,本发明提供了一种可抑制炎症反应的基因洗脱涂层材料,可利用具有微纳拓扑结构的材料涂层将治疗基因导入受体细胞中,可降低支架植入后引起的血管内皮细胞炎症反应,并有望解决晚期血栓。
第一方面,本发明提供一种可抑制炎症反应的基因洗脱涂层材料的制备方法,包括以下步骤:
(1)对经清洗后的基底材料进行表面氨基官能化处理。
(2)将步骤(1)所得材料置于pH为3~5的富含强氧化剂的溶液中,加入浓度为0.1~20mg/mL的亲水性化合物,控制反应温度为55~65℃,进一步反应5~120min后,清洗1~3次后氮气干燥,获得具有微纳拓扑结构,同时富含反应性醌基和氨基的目标材料A;其中,亲水性化合物为单宁酸和聚乙烯亚胺的混合物。
(3)制备可增强表达miR-143表达的基因载体,载体为慢病毒载体,所得载体为目标材料B。
(4)将目标材料B固定在目标材料A表面,即获得目标具有氧化应激损伤修复的基因洗脱涂层材料。
进一步地,基底材料包括铁合金、镁合金、锌合金、钛合金及钴铬合金中的一种。
进一步地,基底材料表面氨基官能化包括氨基等离子体处理获得氨基表面、多巴胺溶液浸泡处理及多巴胺与多聚赖氨酸的混合溶液浸泡处理中的一种。
进一步地,强氧化剂包括过硫酸盐、硫酸铜、高碘酸盐以及芬顿试剂中的一种。
进一步地,目标材料B为慢病毒基因载体。
进一步地,目标材料B固定在目标材料A上的方法为共价固定法。
进一步地,共价固定法为B材料上的氨基(慢病毒载体上的氨基)和A材料上的醌基之间形成的迈克尔加成反应,迈克尔加成反应是在pH为7.5~9的溶液体系中进行;或B材料上的羧基(慢病毒载体上的羧基)和A材料上的氨基之间通过脱水缩合形成的酰胺键,脱水缩合形成的酰胺键是在反应体系为pH为5~7的溶液体系中进行。
进一步地,亲水化合物中,单宁酸和聚乙烯亚胺的相对质量浓度比范围为2:3~2:8。
进一步地,强氧化剂溶液的摩尔浓度为10uM~到1mM。
本发明提供的一种可抑制炎症反应的基因洗脱涂层材料、其制备方法及心血管支架的有益效果包括:
1)长期的抗血管内皮细胞炎性微环境的维持,基于miR-143在血管内皮细胞中的稳定表达,可持续性的降低血管内皮细胞在支架植入后引起的炎症反应,可保持血管内皮细胞的正常功能,为支架的再内皮化过程保驾护航;
(2)具有微纳拓扑结构的涂层可有效保护基因活性,并在物理层面(依赖粗糙表面增强对难转染细胞的转染效率)及生物层面(多酚可增强基因的吞噬效率)增强难转染细胞(如内皮细胞)的基因转染效率。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本申请的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图也属于本申请的保护范围。
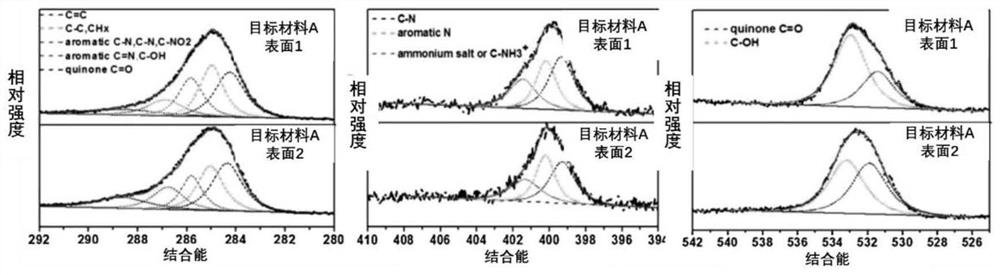
图1为目标材料A的XPS分析图;
图2为实施例5提供的涂层的亲疏水性评判图;
图3为实施例5提供的涂层的微纳拓扑结构图;
图4为实施例5提供的涂层的基因载体转染效率;
图5为实施例5提供的涂层的血管内皮细胞炎症因子表达情况图;
图6为对比例1提供的涂层的亲疏水性评判图;
图7为对比例2提供的涂层的亲疏水性评判图;
图8为对比例3提供的涂层的亲疏水性评判图。
具体实施方式
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
实施例1
一种可抑制炎症反应的基因洗脱涂层材料的制备方法,包括以下步骤:
(1)将1mg/mL多巴胺溶液和15mg/mL的聚乙烯亚胺溶液混合得到混合液,将经清洗后的铁合金基底材料浸泡在混合液中,在pH为9的溶液条件下共聚合2h得到氨基官能化表面;
(2)将步骤(1)所得材料置于pH为3的过硫酸盐溶液中,加入浓度为0.5mg/mL的单宁酸及聚乙烯亚胺的混合物(单宁酸的浓度为0.2mg/mL,聚乙烯亚胺的浓度为0.3mg/mL),控制反应温度为60℃,进一步反应50min后,清洗3次后氮气干燥,获得目标材料A;
(3)制备可增强表达miR-143的质粒DNA,载体为慢病毒载体,所得基因载体为目标材料B;所用核心质粒为pLenti-EF1α-miR-143-Flag-6His-CMV-GFP-P2A-Puro,包装质粒为pAXPS,pMD2.G,上述质粒以4:3:1的比例转染HEK293T细胞,48h/72h后分别收集细胞上清,过0.45μm滤器,以分子量8000的聚乙二醇(PEG8000)溶液过夜沉淀病毒,4000g离心,获得浓缩病毒。
(4)将目标材料A浸泡在pH为8.5的水溶液中,缓慢加入适量目标材料B(2μg/cm
实施例2
一种可抑制炎症反应的基因洗脱涂层材料的制备方法,包括以下步骤:
(1)将经清洗后的镁合金基底材料置于低温等离子体发生仪中,在0.5Pa真空度下,通入烯丙胺单体,辉光放电10min后得到氨基正电荷表面;
(2)将步骤(1)所得材料置于pH为3的硫酸铜溶液中,加入浓度为0.5mg/mL的单宁酸及聚乙烯亚胺的混合物(单宁酸的浓度为0.2mg/mL,聚乙烯亚胺的浓度为0.3mg/mL),控制反应温度为60℃,进一步反应50min后,清洗3次后氮气干燥,获得目标材料A;
(3)制备可增强表达miR-143的质粒DNA,载体为慢病毒载体,所得基因载体为目标材料B;所用核心质粒为pLenti-EF1α-miR-143-Flag-6His-CMV-GFP-P2A-Puro,包装质粒为pAXPS,pMD2.G,上述质粒以4:3:1的比例转染HEK293T细胞,48h/72h后分别收集细胞上清,过0.45μm滤器,以分子量8000的聚乙二醇(PEG8000)溶液过夜沉淀病毒,4000g离心,获得浓缩病毒。
(4)将目标材料A浸泡在pH为8.5的水溶液中,缓慢加入适量目标材料B(2μg/cm
实施例3
一种可抑制炎症反应的基因洗脱涂层材料的制备方法,包括以下步骤:
(1)将经清洗后的锌合金基底材料置于低温等离子体发生仪中,在0.5Pa真空度下,通入烯丙胺单体,辉光放电10min后得到氨基正电荷表面;
(2)将步骤(1)所得材料置于pH为3的高碘酸盐溶液中,加入浓度为2mg/mL的单宁酸及聚乙烯亚胺的混合物(单宁酸的浓度为0.5mg/mL,聚乙烯亚胺的浓度为1.5mg/mL),控制反应温度为60℃,进一步反应90min后,清洗3次后氮气干燥,获得目标材料A;
(3)制备可增强表达miR-143的质粒DNA,载体为慢病毒载体,所得基因载体为目标材料B;所用核心质粒为pLenti-EF1α-miR-143-Flag-6His-CMV-GFP-P2A-Puro,包装质粒为pAXPS,pMD2.G,上述质粒以4:3:1的比例转染HEK293T细胞,48h/72h后分别收集细胞上清,过0.45μm滤器,以分子量8000的聚乙二醇(PEG8000)溶液过夜沉淀病毒,4000g离心,获得浓缩病毒。
(4)将目标材料A浸泡在pH为8.5的水溶液中,缓慢加入适量目标材料B(2μg/cm
实施例4
一种可抑制炎症反应的基因洗脱涂层材料的制备方法,包括以下步骤:
(1)将1mg/mL多巴胺溶液和15mg/mL的聚乙烯亚胺溶液混合得到混合液,将经清洗后的钛合金基底材料浸泡在混合液中,在pH为8的溶液条件下共聚合2h得到氨基官能化表面;
(2)将步骤(1)所得材料置于pH为3的高碘酸盐溶液中,加入浓度为3mg/mL的单宁酸及聚乙烯亚胺的混合物(单宁酸的浓度为1mg/mL,聚乙烯亚胺的浓度为2mg/mL),控制反应温度为60℃,进一步反应120min后,清洗3次后氮气干燥,获得目标材料A;
(3)制备可增强表达miR-143的质粒DNA,载体为慢病毒载体,所得基因载体为目标材料B;所用核心质粒为pLenti-EF1α-miR-143-Flag-6His-CMV-GFP-P2A-Puro,包装质粒为pAXPS,pMD2.G,上述质粒以4:3:1的比例转染HEK293T细胞,48h/72h后分别收集细胞上清,过0.45μm滤器,以分子量8000的聚乙二醇(PEG8000)溶液过夜沉淀病毒,4000g离心,获得浓缩病毒。
(4)将目标材料A浸泡在pH为8.5的水溶液中,缓慢加入适量目标材料B(2μg/cm
实施例5
一种可抑制炎症反应的基因洗脱涂层材料的制备方法,包括以下步骤:
(1)使经清洗后的钴铬合金基底材料进行表面氨基官能化处理;通过0.5mg/mL单宁酸和2mg/mL赖氨酸,于pH为9的溶液条件下共聚合3h,得到富含氨基的表面;
(2)将步骤(1)所得材料置于pH为3的芬顿试剂溶液中,加入浓度为5mg/mL的单宁酸及聚乙烯亚胺的混合物(单宁酸的浓度为1mg/mL,聚乙烯亚胺的浓度为4mg/mL),控制反应温度为60℃,进一步反应120min后,清洗3次后氮气干燥,获得目标材料A;
(3)制备可增强表达miR-143的质粒DNA,载体为慢病毒载体,所得基因载体为目标材料B;所用核心质粒为pLenti-EF1α-miR-143-Flag-6His-CMV-GFP-P2A-Puro,包装质粒为pAXPS,pMD2.G,上述质粒以4:3:1的比例转染HEK293T细胞,48h/72h后分别收集细胞上清,过0.45μm滤器,以分子量8000的聚乙二醇(PEG8000)溶液过夜沉淀病毒,4000g离心,获得浓缩病毒。
(4)将目标材料A浸泡在pH为8.5的水溶液中,缓慢加入适量目标材料B(2μg/cm
对比例1
一种金属基底的表面氨基化处理方法,包括:
(1)使经清洗后的钴铬合金基底材料进行表面氨基官能化处理;通过0.5mg/mL单宁酸和2mg/mL赖氨酸,于pH为9的溶液条件下共聚合3h,得到富含氨基的表面。
对比例2
一种目标材料A的制备方法,包括如下步骤:
(1)使经清洗后的钴铬合金基底材料进行表面氨基官能化处理;通过0.5mg/mL单宁酸和2mg/mL赖氨酸,于pH为9的溶液条件下共聚合3h,得到富含氨基的表面。
(2)将步骤(1)所得材料置于pH为3的芬顿试剂溶液中,加入浓度为5mg/mL的单宁酸,控制反应温度为60℃,进一步反应120min后,清洗3次后氮气干燥,获得目标材料A。
对比例3
一种目标材料A的制备方法,包括如下步骤:
(1)使经清洗后的钴铬合金基底材料进行表面氨基官能化处理;通过0.5mg/mL单宁酸和2mg/mL赖氨酸,于pH为9的溶液条件下共聚合3h,得到富含氨基的表面。
(2)将步骤(1)所得材料置于pH为3的芬顿试剂溶液中,加入浓度为5mg/mL的聚乙烯亚胺的混合物,控制反应温度为60℃,进一步反应120min后,清洗3次后氮气干燥,获得目标材料A。
试验例1
以镁合金为基底材料,以实施列1,实施例5中的方法构建目标材料A,分别对两种目标材料A进行XPS分析,从图1可以看出(C、N、O的高分辨解谱图),目标材料A表面含有氨基、酚羟基、醌基等多种基团,可与目标材料B按不同反应方式结合)。如图2所示,该涂层具有很好的亲水性能,且涂层表面具有显著的维纳拓扑结构,如图3所示。
种植血管内皮细胞(1×10
从图6可以看出,如果合金基底仅经过氨基化处理,不添加单宁酸和聚乙烯亚胺进行亲水性处理,则得到的目标材料的亲水性效果不佳,不利于后续涂层的制备。
从图7和图8中可以看出,如果合金基底材料经过了氨基化处理以后,单独使用单宁酸或单独使用聚乙烯亚胺进行亲水性处理,其亲水效果均差于实施例5的亲水性处理方式,可以说明单宁酸和聚乙烯亚胺具有一定的协同效果,二者的结合可以使目标材料A亲水性效果最佳,以便后续涂层的制备,可以使涂层效果更佳。
- 可抑制炎症反应的基因洗脱涂层材料及其制备方法
- 具有氧化应激损伤修复的基因洗脱涂层材料及其制备方法
