三嗪类除草剂的前处理方法及定量检测方法
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及一种三嗪类除草剂的前处理方法,以及定量检测方法,属于农药残留的分析检测技术领域。
背景技术
三嗪类除草剂是一类抑制植物光合作用的高效选择性除草剂,在世界范围内广泛使用,对农业的发展做出了重要的贡献。但在大量使用甚至滥用的同时也带来了农药残留、环境污染、食品安全等问题,因此,研究、发展三嗪类除草剂的检测技术具有重要的意义。在三嗪类除草剂的检测技术中,采用前处理方法处理样品以快速、高效地分离、富集三嗪类除草剂是重要的环节。
现有技术中,三嗪类除草剂的前处理方法有液液萃取、液液微萃取、固相萃取、分散固相萃取、固相微萃取等方法。固相萃取、固相微萃取、分散固相萃取等所用吸附剂多为实验室自合成的分子印迹材料和其他如金属框架、碳纳米管等纳米材料。材料的合成需要大量的有机试剂,材料的表征需要特殊的设备,设备造价昂贵,而且整个萃取过程耗时长。因此,如能使用绿色、环保、高效的固相吸附剂来萃取环境基质中的三嗪类除草剂,并缩短整个前处理过程的时间,对于固相萃取、分散固相萃取和固相微萃取等前处理方法的发展意义重大。
发明内容
针对上述现有技术,本发明提供了一种三嗪类除草剂的前处理方法,以及定量检测方法。本发明的方法采用生物质废料椰壳制备的生物炭做固相微萃取方法的固相吸附剂来萃取三嗪类除草剂,并自制备了固相微萃取小装置,绿色、环保,快速且目标物回收率高;后端连接液相色谱进行检测,检测方法灵敏度高、准确性好。
本发明是通过以下技术方案实现的:
一种三嗪类除草剂的前处理方法:向待测样品中加入适量盐酸,混匀得待测样品溶液;将待测样品溶液加入至活化的自旋一体柱固相微萃取(Monolithic spin columns-solid phase microextraction,MSC-SPME)装置中,离心;弃去套管中的溶液;向上述装置中加入乙腈-乙酸混合溶液,离心;收集套管中的洗脱液,过滤,即得前处理样品,可用于三嗪类除草剂高效液相色谱(High performance liquid chromatography,HPLC-UV)检测。
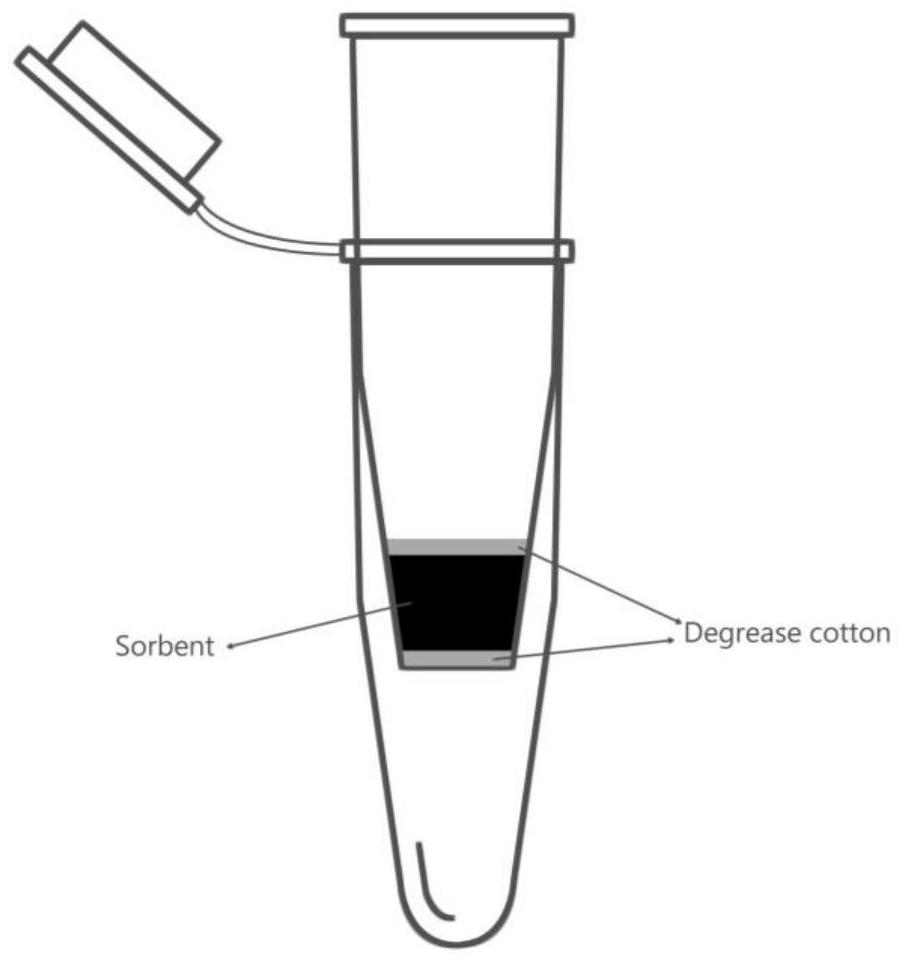
所述MSC-SPME装置的结构为:包括两个套在一起的管体,其中,位于外侧的管体的一端开口,另一端封闭;位于内侧的管体的两端均开口,两个管体套在一起,位于内侧的管体与位于外侧的管体相通;位于内侧的管体中由下到上依次填充有填充基质、椰壳生物炭和填充基质。
进一步地,具体制备时,可采用离心管(如规格为1.5mL的离心管)作为管体自行制备:用刀片将离心管的下端割断丢弃,作为位于内侧的管体。
进一步地,所述椰壳生物炭是通过以下方法制备得到的:将废弃椰壳风干后粉碎成小块(比如粉碎成1cm×1cm的小块),置于瓷坩埚中,加盖密封后于马弗炉内灼烧,以10℃/min的升温速率升到200℃,恒温2h预碳化;然后以10℃/min的升温速率升至700℃厌氧煅烧3h;冷却后研磨过100目筛,即得椰壳生物炭。
进一步地,所述椰壳生物炭的填充量为300mg。
进一步地,所述填充基质选自脱脂棉。
进一步地,活化的方法为:向MSC-SPME装置中加入1mL超纯水和1mL甲醇,3000r/min离心1min,活化椰壳生物炭。
进一步地,所述待测样品选自水样或生物样品。所述水样选自自来水、地下水、井水、河水、湖水或海水;所述生物样品选自尿液、血清或血浆,如人尿、兔血清、兔血浆。
进一步地,待测样品的用量为100μL,盐酸的pH为1,用量为900μL。
进一步地,萃取时的离心条件为:2500r/min离心1min。
进一步地,所述乙腈-乙酸混合溶液中,乙腈与乙酸的体积比为30:70。
进一步地,所述乙腈-乙酸混合溶液的加入量为2mL。
进一步地,洗脱时的离心条件为:1000r/min离心1min。
进一步地,过滤时采用0.22μm微孔滤膜。
一种三嗪类除草剂的定量检测方法,包括以下步骤:
(1)制作标准曲线:以甲醇为溶剂配制三嗪类除草剂的标准溶液,HPLC-UV测定三嗪类除草剂的标准溶液中各组分的色谱峰保留时间和色谱峰面积,绘制浓度-色谱峰面积的标准曲线(采用色谱峰保留时间定性,色谱峰峰面积定量;定量方法采用外标法,即以除草剂浓度为横坐标,以色谱峰面积为纵坐标绘制标准曲线)。
所述标准溶液中包含三种三嗪类除草剂:莠去津、莠灭净和扑草净,各成分浓度范围分别为:莠去津10~10000ng/mL,莠灭净200~10000ng/mL,扑草净200~10000ng/mL。
(2)HPLC-UV测定:对上述制备的前处理样品进行HPLC-UV测定,测定结果代入标准曲线,从而计算得到待测样品中三嗪类除草剂的浓度。
进一步地,所述HPLC-UV测定的条件为:液相色谱仪器型号:Agilent1260InfinityⅡ;色谱柱:型号为Pursuit 5 C18,规格为5μm粒径,4.6mm×150mm;进样量:20μL;柱温:25℃;检测器:二极管阵列检测器;检测器波长:222nm;流动相为甲醇/水=70/30(v/v)。
本发明的三嗪类除草剂的前处理方法,以及定量检测方法,具有以下优点:
(1)大大缩短了样品预处理时间,节约了实验成本:本方法采用自制备的离心管套管作为萃取设备,采用离心机驱动,在低转速的情况下仅用1分钟完成上样,1分钟完成样品洗脱,与传统的固相萃取相比,简单、快速;另外,采用离心机一次可以进行多个样品同时上样、同时洗脱,解决了大通量生物样品处理耗时的问题。
(2)绿色、环保:采用椰壳制备生物炭,达到了废物再利用的目的。现有技术所采用的固相吸附剂为常规吸附剂或者纳米材料,吸附剂造价昂贵,而且萃取重现性问题是吸附性能的瓶颈。本方法采用的椰壳生物炭是对生物质固体废料的再利用,材料来源于自然,减少了实验损耗。
(3)自制备固相微萃取小设备大大减少了人力和物力的损耗。本方法采用自制的离心套管,与传统的固相微萃取纤维相比,价格低廉,而且可以实现样品的批处理;更重要的是可以将小型离心机带到测试现场进行快速萃取。
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
附图说明
图1:本发明的自制备的离心萃取套管示意图。
图2:自来水空白及加标回收色谱图,其中3种三嗪类除草剂的加标浓度为2μg/mL;a为空白样品,b为加标样品。ATR:莠去津;AME:莠灭净;PROM:扑草净。
图3:湖水空白及加标回收色谱图,其中3种三嗪类除草剂的加标浓度分别为2μg/mL;a为空白样品,b为加标样品。ATR:莠去津;AME:莠灭净;PROM:扑草净。
图4:海水空白及加标回收色谱图,其中3种三嗪类除草剂的加标浓度分别为2μg/mL;a为空白样品,b为加标样品。ATR:莠去津;AME:莠灭净;PROM:扑草净。
图5:人尿空白及加标回收色谱图,其中3种三嗪类除草剂的加标浓度分别为2μg/mL;a为空白样品,b为加标样品。ATR:莠去津;AME:莠灭净;PROM:扑草净。
图6:兔血清空白及加标回收色谱图,其中3种三嗪类除草剂的加标浓度分别为2μg/mL;a为空白样品,b为加标样品。ATR:莠去津;AME:莠灭净;PROM:扑草净。
图7:兔血浆空白及加标回收色谱图,其中3种三嗪类除草剂的加标浓度分别为2μg/mL;a为空白样品,b为加标样品。ATR:莠去津;AME:莠灭净;PROM:扑草净。
图8:椰壳生物炭使用量对吸附容量(Q)的影响,其中3种三嗪类除草剂的加标浓度分别为10μg/mL;ATR:莠去津;AME:莠灭净;PROM:扑草净Q:吸附容量。
图9:洗脱剂种类对萃取回收率的影响,其中3种三嗪类除草剂的加标浓度分别为10μg/mL;ATR:莠去津;AME:莠灭净;PROM:扑草净R:回收率。
图10:洗脱转速对萃取回收率的影响,其中3种三嗪类除草剂的加标浓度分别为10μg/mL;ATR:莠去津;AME:莠灭净;PROM:扑草净R:回收率。
图11:上样转速对萃取回收率的影响,其中3种三嗪类除草剂的加标浓度分别为10μg/mL;ATR:莠去津;AME:莠灭净;PROM:扑草净R:回收率。
图12:洗脱剂体积对萃取回收率的影响,其中3种三嗪类除草剂的加标浓度分别为10μg/mL;ATR:莠去津;AME:莠灭净;PROM:扑草净R:回收率。
具体实施方式
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
具体实施例一
1、MSC-SPME小设备的制备
萃取装置如图1所示,取两个1.5mL离心管,用刀片将一个1.5mL离心管的下端割断丢弃,装填少量脱脂棉,将椰壳生物炭300mg装填于自制的1.5mL离心管中,上层再装填少量脱脂棉,此离心管套于另一个新的1.5mL离心管内部。将此装置置于离心机中,依次加入1mL超纯水和甲醇,3000r/min离心1min,活化椰壳生物炭。
所述椰壳生物炭是通过以下方法制备得到的:将废弃椰壳风干后粉碎成1cm×1cm的小块,置于瓷坩埚中,加盖密封后于马弗炉内灼烧,以10℃/min的升温速率升到200℃,恒温2h预碳化;然后以10℃/min的升温速率升至700℃厌氧煅烧3h;冷却后研磨过100目筛,即得椰壳生物炭。
2、MSC-SPME方法
各取100μL自来水、湖水、海水、人尿、兔血清和兔血浆,分别置于5mL玻璃离心管中,各加入900μL pH=1的HCl溶液,混匀,得均一溶液;将此1mL样品溶液加入至上述活化好的装置中,于2500r/min离心1min;弃去套管中的溶液;向上述装置中加入2mL乙腈/乙酸溶液(30:70,v/v),1000r/min离心1min。收集套管中的洗脱液,经0.22μm微孔滤膜过滤后进行HPLC-UV检测。
3、HPLC-UV检测方法
(1)用甲醇作溶剂配制三嗪类除草剂(包括莠去津、莠灭净和扑草净)的标准溶液,HPLC-UV测定三嗪类除草剂的标准溶液中各组分的色谱峰保留时间和色谱峰面积。三种除草剂采用色谱峰保留时间定性,色谱峰峰面积定量。定量方法采用外标法,即以除草剂浓度为横坐标,以色谱峰面积为纵坐标绘制出三嗪类除草剂的标准曲线,其中三嗪类除草剂包括莠去津、莠灭净和扑草净,各成分浓度范围分别为莠去津为10~10000ng/mL,莠灭净和扑草净200~10000ng/mL;各样品中三嗪类除草剂的浓度采用标准曲线求算。
(2)测定三嗪类除草剂的HPLC-UV条件为:
液相色谱仪器型号:Agilent 1260 InfinityⅡ;色谱柱:型号为Pursuit 5 C18,规格为5μm粒径,4.6mm×150mm;进样量:20μL;柱温:25℃;检测器:二极管阵列检测器;检测器波长:222nm;流动相为甲醇/水=70/30(v/v)。
采用上述HPLC-UV条件测定3种三嗪类除草剂混合标准溶液,标样分离效果较好,峰形对称,基线稳定,说明仪器条件适合。在此色谱条件下三嗪类除草剂保留时间分别为:莠去津5.4min,莠灭净6.9min,扑草净9.2min,如图2、图3、图4、图5、图6和图7。
(3)采用外标法对样品中三嗪类除草剂进行定量分析。
自来水、湖水、海水、人尿、兔血清和兔血浆样品中均未有3种三嗪类除草剂检出,其空白及加标色谱图见图2、图3、图4、图5、图6和图7。
本发明采用自制的离心萃取套管作为萃取小装置进行固相微萃取,与传统的固相萃取相比方法相比,简单、快速;与商品化的固相萃取、固相微萃取设备等相比,价格低廉、节能环保。表1对三嗪类除草剂的样品前处理方法的萃取填料、萃取时间、萃取方法、萃取设备等方面和本发明的前处理方法进行了比较,如表1所示。
表1三嗪类除草剂的样品前处理方法比较
从上面的对比、总结中不难看出,本发明与现有研究技术相比,有以下几个优势:
(1)采用的自制备的离心套管对于整个萃取过程上样1分钟,洗脱1分钟,大大缩短了样品前处理的时间;
(2)与现有技术中采用的价格较昂贵的多壁碳纳米管、石墨烯等相比,本发明采用生物质固体废料——椰壳制成的生物炭做吸附填料,大大节约了实验成本;另外,椰壳生物炭制备过程简单,也无需消耗大量的有机试剂,与分子印迹填料相比,绿色环保;本发明中采用椰壳生物炭做MSC-SPME的吸附填料,对多介质环境样品如水样、尿样和血液样品进行了应用,实验结果证明MSC-SPME方法回收率高,从附图2-7也不难看出萃取后的样品图中杂质极少,证明此方法也可以有效去除基质干扰,无需额外附加其他诸如固相萃取等净化方法。
(3)本发明的主要设备就是两个1.5mL的离心管,无需蠕动泵、固相萃取装置及固相微萃取装置,设备简单、易操作,适合日常的实验室操作及现场快速萃取及检测。
具体实施例二通过单因素轮换考察各实验条件获得最佳萃取条件
1、椰壳生物炭使用量的影响
分别准确称取10、20、50、100、150、200mg椰壳生物炭加入至5mL pH为1的3种三嗪类除草剂(莠去津、莠灭净和扑草净)的样品溶液(浓度均为10μg/mL)中。涡旋混匀后超声5min,3000r/min离心5min,上清液经过0.22μm滤膜过滤后转移至色谱进样瓶中并上机检测。测定结果表明(图8),当椰壳生物炭投加量在100mg时,三种除草剂的吸附容量(Q)变化趋于稳定,证明此条件下吸附效果很好,继续增加椰壳生物炭的量萃取效率差别不大,因此选择300mg作为最优投加量。
2、洗脱剂种类的影响
向活化好的离心套管中加入1mL样品溶液(莠去津、莠灭净和扑草净浓度均为10μg/mL),于2500r/min离心1min;弃去套管中的溶液;向上述装置中分别加入2mL甲醇、乙腈、甲醇/乙酸(30:70,v/v)、乙腈/乙酸溶液(30:70,v/v)和乙酸,1000r/min离心1min。收集套管中的洗脱液,经0.22μm微孔滤膜过滤后进行HPLC-UV检测。结果表明乙腈/乙酸溶液(30:70,v/v)对三种除草剂的洗脱效果最好,因此选择乙腈/乙酸溶液(30:70,v/v)作为后续实验的最优条件(图9)。
3、洗脱转速的影响
向活化好的离心套管中加入1mL样品溶液(莠去津、莠灭净和扑草净浓度均为10μg/mL),于2500r/min离心1min;弃去套管中的溶液;向上述装置中加入2mL乙腈/乙酸溶液(30:70,v/v),分别于500、1000、1500、2000和2500r/min离心1min。收集套管中的洗脱液,经0.22μm微孔滤膜过滤后进行HPLC-UV检测。结果表明当洗脱转速为1000r/min时萃取效果最好,因此洗脱转速为1000r/min(图10)。
4、上样转速的影响
向活化好的离心套管中加入1mL样品溶液(莠去津、莠灭净和扑草净浓度均为10μg/mL),分别于500、1000、1500、2000和2500r/min离心1min;弃去套管中的溶液;向上述装置中加入2mL乙腈/乙酸溶液(30:70,v/v),1000r/min离心1min。收集套管中的洗脱液,经0.22μm微孔滤膜过滤后进行HPLC-UV检测。结果表明当转速为2500r/min时萃取效果最好,因此上样转速为2500r/min(图11)。
5、洗脱剂体积的影响
向活化好的离心套管中加入1mL样品溶液(莠去津、莠灭净和扑草净浓度均为10μg/mL),于2500r/min离心1min;弃去套管中的溶液;向上述装置中分别加入0.3、0.5、1、1.5和2mL乙腈/乙酸溶液(30:70,v/v),1000r/min离心1min。收集套管中的洗脱液,经0.22μm微孔滤膜过滤后进行HPLC-UV检测。结果表明当洗脱溶液体积为2mL时,莠去津和扑草净的萃取效果最好;而洗脱溶液体积为1.5mL时莠灭净萃取效果最好,为了同时萃取三种除草剂,选择洗脱液体积为2mL(图12)。
具体实施例三具体实施例一方法的线性范围、回归方程与检出限
以浓度C为横坐标,峰面积A为纵坐标绘制标准曲线,3种除草剂在其浓度范围内线性良好,相关系数(R
表2三嗪类除草剂的线性范围、回归方程、相关系数和检出限
具体实施例四本发明方法的回收率与精密度
各取100μL自来水、湖水、海水、人尿、兔血清和兔血浆(均未检出除草剂),分别置于5mL玻璃离心管中,各加入900μL pH=1的HCl溶液,混匀,得均一溶液;分别加入3种不同浓度水平的除草剂混合标准溶液,三嗪类除草剂的添加水平为0.5~2μg/mL,每个浓度水平平行3份样品,按照上述具体实施例一方法进行样品前处理和色谱条件测定。采用外标法定量,计算各除草剂的平均回收率及其标准偏差(即SD),结果如表3所示,样品空白及加标色谱图如图2、图3、图4、图5、图6和图7所示。
表3除草剂在尿样、兔血清和兔血浆样品中的添加回收结果(n=3)
由表3可知,3种三嗪类除草剂莠去津、莠灭净和扑草净的平均回收率分别为73~119%、76~120%和70~112%,相应的SD分别为1.8~9.1%、0.6~9.8%和1.0~9.3%,说明本发明的方法具有良好的准确性和重复性。
以上实施例表明,MSC-SPME-HPLC-UV方法可用于水样和生物样品中三嗪类除草剂的检测,MSC-SPME方法简单、快速、低耗,无需大量有机试剂萃取,而且采用生物质固体废料——椰壳自制备固相吸附剂,实现了废物再利用。HPLC-UV方法为此类除草剂的检测提供了高的灵敏度。结果证明此方法灵敏、快速,可作为一种三嗪类除草剂测定的方法进行推广。
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。
参考文献:
[1]李小蒙,邵子纯,王旭坤,朱雅文,张雯宇,高仕谦,张占恩,磁性茶籽壳活性炭固相萃取-超高效液相色谱/质谱法测定环境水样中三嗪类除草剂,分析科学学报,2020,36(2),183-188.
[2]鲍秀敏,张占恩,邵子纯,解竞,徐劼,吴友谊,高仕谦,磁性离子液体石墨烯-固相萃取水中三嗪类除草剂,工业水处理,2020,40(11),106-110.
[3]徐尉力,朱清,王秀娟,李吉龙,冯吉,毕金龙,王志兵,动态基质固相分散-离子液体双水相微萃取结合高效液相色谱法检测粮谷中的三嗪类除草剂,食品科学,2020,https://kns.cnki.net/kcms/detail/11.2206.TS.20201015.1415.042.html.
[4]孔光辉,张梦晓,顾丽莉,师君丽,韩毅,烟叶中三嗪类除草剂的分子印迹固相萃取-高效液相色谱检测,化工科技,2018,26(6),17-21.
[5]Zucheng Qin,Yanxiao Jiang,Huilan Piao,Jingkang Li,Shuo Tao,PinyiMa,Xinghua Wang,Daqian Song,Ying Sun,MIL-101(Cr)/MWCNTs-functionalizedmelamine sponges for solid-phase extraction of triazines from corn samples,and their subsequent determination by HPLC-MS/MS,Talanta,2020,211,120676-120686.
[6]Diana Angélica Varela-Martínez,Miguel
[7]Xingqiang Wu,Shigang Shen,Hongyuan Yan,Yanan Yuan,Xi Chen,Efficient enrichment and analysis of atrazine and its degradation products inChinese Yam using accelerated solvent extraction and pipette tip solid-phaseextraction followed by UPLC–DAD,Food Chemistry,2021,337,127752-127760.
- 三嗪类除草剂的前处理方法及定量检测方法
- 一种贝类中三嗪类除草剂及其代谢产物的检测方法
