超声图像病灶描述方法、装置、计算机设备和存储介质
文献发布时间:2023-06-19 11:35:49
技术领域
本申请涉及医学图像处理技术领域,特别是涉及一种超声图像病灶描述方法、装置、计算机设备和存储介质。
背景技术
乳腺癌是女性疾病中常见的恶性肿瘤,已成为严重威胁女性健康的病症之一。早发现、早诊断、早治疗是目前医学上对防治乳腺癌采取的基本原则。超声成像凭借其无创伤、无辐射、费用低廉等优势,已成为乳腺肿瘤临床诊断的主要手段之一。
然而,由于受成像设备的影响,超声图像常常具有较大的噪声、低对比度、灰度不均匀、不同程度的衰减以及浸润效应等,使得乳腺肿瘤在表面上与周围正常组织较为相似,即超声图像对人体器官形态的表达能力较弱,或者说器官在图像中的呈现形式较为模糊与抽象;此外,不同个体间乳腺肿瘤差异也较大。因此,乳腺超声图像中对于病灶区域的判断和阅读需要临床医生具有较高的专业水平和较丰富的经验,一般医生较难在超声图像中用肉眼准确、快速地将乳腺肿瘤区域与其周围的正常组织区分开来并做出病灶描述结果。尤其是当需要对大批量的患者进行病灶分析时,医生既要对病灶进行分析,同时还要手动填写病灶分析结果。当患者人数较多时,医生的工作量会急剧加大。
发明内容
基于此,有必要针对上述医生对超声图像的病灶进行分析时工作量较大的问题,提供一种超声图像病灶描述方法、装置、计算机设备和存储介质。
为了实现上述目的,一方面,本申请实施例提供了一种超声图像病灶描述方法,所述方法包括:
识别超声图像中的病灶,以得到对应的感兴趣区域;
通过图像分割算法对感兴趣区域进行检测,得到病灶轮廓;
根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息。
另一方面,本申请实施例还提供了一种超声图像病灶描述装置,包括:感兴趣区域识别模块,用于识别超声图像中的病灶,以得到对应的感兴趣区域;病灶分割模块,用于通过图像分割算法对感兴趣区域进行检测,得到病灶轮廓;病灶描述信息生成模块,用于根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息。
又一方面,本申请实施例还提供了一种计算机设备,包括存储器和处理器,所述存储器存储有计算机程序,所述处理器执行所述计算机程序时实现如上所述方法的步骤。
再一方面,本申请实施例还提供了一种计算机可读存储介质,其上存储有计算机程序,所述计算机程序被处理器执行时实现如上所述方法的步骤。
上述超声图像病灶描述方法、装置、计算机设备和存储介质,通过对超声图像中的病灶进行识别,以定位对应的感兴趣区域,进而通过图像分割算法对感兴趣区域进行检测,以得到病灶轮廓,并根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征自动生成病灶描述信息,从而有效的减少了医生的工作量,且提高了诊断效率。
附图说明
图1为一个实施例中超声图像病灶描述方法的应用环境图;
图2为一个实施例中超声图像病灶描述方法的流程示意图;
图3为一个实施例中超声图像示意图;
图4为对图3进行目标检测得到的感兴趣区域的示意图;
图5为对图4采用图像分割算法进行分割后得到的病灶轮廓示意图;
图6为在原图上显示病灶轮廓的示意图;
图7为一个实施例中通过图像分割算法得到病灶轮廓步骤的流程示意图;
图8A为另一个实施例中超声图像示意图;
图8B为对图8A进行目标检测得到的感兴趣区域的示意图;
图8C为对图8B进行阈值分割后得到的初始二值图像的示意图;
图9为对图8C进行形态学开运算后得到的新的二值图像的示意图;
图10为对图9进行分析后粗略估计出病灶区域的示意图;
图11为创建的与图8B尺寸相同的二值图像的示意图;
图12为基于距离正则化分割后得到的病灶轮廓示意图;
图13为另一个实施例中通过图像分割算法得到病灶轮廓步骤的流程示意图;
图14A为又一个实施例中超声图像示意图;
图14B为对图14A进行目标检测得到的感兴趣区域的示意图;
图15为初始零水平集函数对应的二值化图像的示意图;
图16为像素点x及其邻域像素y的示意图;
图17为目标水平集函数对应的目标零水平集二值图像的示意图;
图18为对图17进行处理后得到的新的目标零水平集二值图像的示意图;
图19为对图18进行分析后确定的病灶区域的示意图;
图20A为低回声灰度直方图的示意图;
图20B为无回声灰度直方图的示意图;
图21为映射的复数平面示意图;
图22A为在图6中拟合椭圆的示意图;
图22B为图22A中椭圆长轴与水平坐标轴的夹角示意图;
图23为一个实施例中描述病灶是否钙化的步骤的流程示意图;
图24A为再一个实施例中超声图像示意图;
图24B为对图24A进行目标检测得到的感兴趣区域的示意图;
图24C为采用LBF病灶分割算法对图24B分割后得到的有关病灶轮廓的二值图像示意图;
图24D是基于图24B和图24C得到的示意图;
图24E是对图24D做形态学闭运算后得到的示意图;
图24F是对图24E进行种子生长后得到的二值图像的示意图;
图25为一个实施例中超声图像病灶描述装置的结构框图;
图26为一个实施例中计算机设备的内部结构图。
具体实施方式
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行进一步详细说明。应当理解,此处描述的具体实施例仅仅用以解释本申请,并不用于限定本申请。
本申请提供的超声图像病灶描述方法,可以应用于如图1所示的应用环境中。其中,终端102与服务器104通过网络进行通信,在本实施例中,终端102可以是具有超声图像采集功能的设备,也可以是对采集的超声图像进行存储的设备,服务器104可以用独立的服务器或者是多个服务器组成的服务器集群来实现。具体的,终端102用于采集或存储超声图像,并将采集或存储的超声图像通过网络发送至服务器104,服务器104则对超声图像中的病灶进行识别,以定位对应的感兴趣区域,进而通过图像分割算法对感兴趣区域进行检测,以得到病灶轮廓,并根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征自动生成病灶描述信息,从而有效的减少了医生的工作量,且提高了诊断效率。
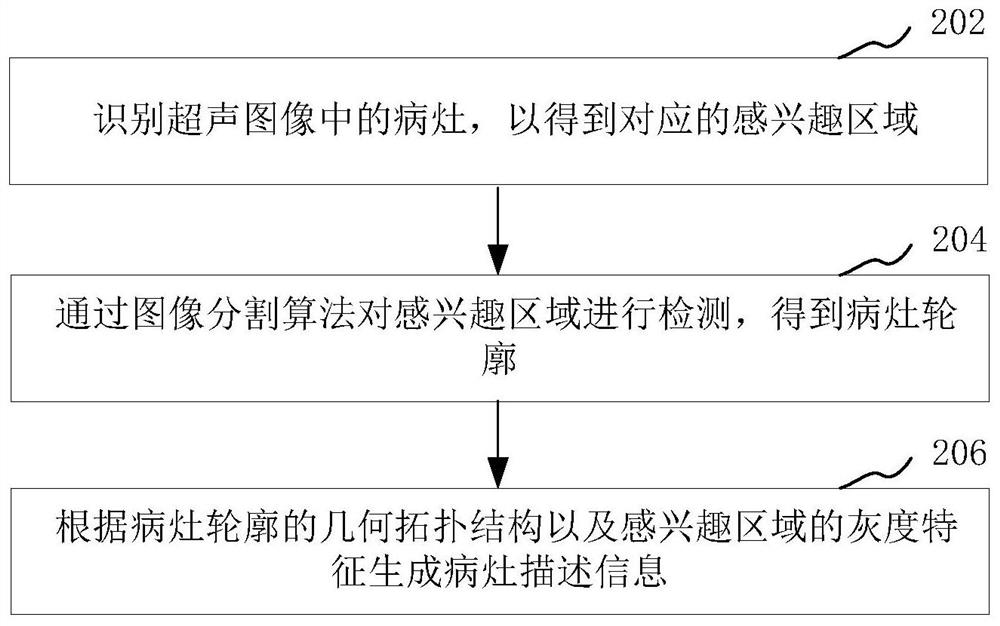
在一个实施例中,如图2所示,提供了一种超声图像病灶描述方法,以该方法应用于图1中的服务器为例进行说明,包括以下步骤:
步骤202,识别超声图像中的病灶,以得到对应的感兴趣区域。
其中,超声图像为临床上有关乳腺、甲状腺、肝脏、肾脏、脾脏等的超声图像。感兴趣区域(region of interest,简称ROI)是从超声图像中选择的一个需要处理的图像区域,这个区域是进行图像分析所关注的重点。具体的,可以通过目标检测对超声图像中的病灶进行自动识别、定位,从而得到超声图像中对应的感兴趣区域。其中,目标检测可以是基于图像识别算法的目标自动检测,也可以是基于人工框选的目标手动检测。如图3所示,为采集的超声图像示意图,图4则为对图3进行目标检测得到的感兴趣区域的示意图。
步骤204,通过图像分割算法对感兴趣区域进行检测,得到病灶轮廓。
其中,图像分割算法包括基于距离正则化水平集演化(Distance RegularizedLevel Set Evolution,简称DRLSE)的病灶分割算法以及基于局部二值拟合(Local BinaryFitting,简称LBF)演化的病灶分割算法。具体的,通过上述图像分割算法对如图4所示的感兴趣区域进行检测,从而得到对应的分割结果,即如图5所示所示的二值图像,该二值图像的白色区域就是分割出的病灶区域,即图像分割的结果。图3的医学图像术语是蒙板(mask),其表示了被分割目标物的边界轮廓,因此分割结果就是一系列图像点的坐标构成的集合。将这些点的坐标在原图像(即如图3所示的原始超声图像)中呈现,即得到病灶轮廓,如图6所示,图6中的矩形框表示ROI(即感兴趣区域),不规则曲线框则表示病灶轮廓,不规则曲线框内部则为病灶区域。
步骤206,根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息。
其中,病灶描述信息包括病灶的生长方向、回声类型、是否存在钙化现象以及病灶轮廓的形状、光整度、清晰度等。在本实施例中,基于上述步骤得到的病灶轮廓以及感兴趣区域,并根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征而自动生成病灶描述信息。
上述超声图像病灶描述方法,通过对超声图像中的病灶进行识别,以定位对应的感兴趣区域,进而通过图像分割算法对感兴趣区域进行检测,以得到病灶轮廓,并根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征自动生成病灶描述信息,从而有效的减少了医生的工作量,且提高了诊断效率。
在一个实施例中,如图7所示,以图像分割算法为基于距离正则化水平集演化的病灶分割算法为例,说明对感兴趣区域进行检测,得到病灶轮廓的具体实现方式,包括:
步骤702,对感兴趣区域进行阈值分割,以得到对应的初始二值图像,并根据初始二值图像估计病灶区域的质心。
具体的,对原超声图像(如图8A)进行目标检测,得到对应的感兴趣区域(如图8B),基于大津法(OTSU)对感兴趣区域进行阈值分割,从而得到对应的初始二值图像(如图8C所示),采用设定掩模尺寸对初始二值图像进行形态学开运算,得到运算后的新的二值图像(如图9所示)。根据邻域连通准则采用8邻域在新的二值图像中提取各邻域的连通分量,此时图9中有8个连通分量,即8个彼此独立的轮廓(每个白色区域为一个轮廓)。进而计算各连通分量所在区域的面积(即该连通分量区域所占的像素数)。将各连通分量所在区域的面积中面积最大的连通分量所在区域粗略估计为病灶区域(如图10所示)。并采用图像矩算法计算病灶区域的质心,其中,图像矩算法具体可以采用Hu矩算法,即通过Hu矩算法得到病灶区域的质心坐标O(X0,Y0)。
步骤704,根据感兴趣区域以及病灶区域的质心,构造初始零水平集函数。
具体的,根据ROI的尺寸创建一幅与ROI尺寸相同的初始图像,进而基于病灶区域的质心以及感兴趣区域的最小边长,在初始图像中确定水平集初始区域。即在初始图像中构造一个像素灰度值为-2(显示为黑色)的圆形区域,该圆形区域以外的像素灰度值为2(显示为白色),且圆形区域的圆心坐标为病灶区域的质心,半径为ROI较小一边的边长除以5,该圆形区域的圆形边界即水平集演化的初始轮廓,也即为水平集初始区域。
由于上述初始图像中水平集初始区域的像素灰度值为-2,而其他区域的像素灰度值为2,因此,得到初始图像的二值化图像,即图11所示的图像,该二值化图像即为初始零水平集图像,也是演化算法的初始对象。又由于数字图像可以通过二元函数表示,因此,对于图11所示的二值化图像可通过如下函数表示:
步骤706,利用距离正则化水平集演化算法基于感兴趣区域对初始零水平集函数进行迭代计算,得到演化终止时刻的目标水平集函数。
具体的,在DRLSE算法中,定义图像信息的能量泛函数为:
E(φ)=μR
具体的,E
式中,α是任意实数,即常数,λ为正实数,分别是式(1.3)中右侧长度项和面积项的权重,本实施例中可以取λ=4、α=3。▽φ是对目标水平集函数φ(x,y)求梯度,x,y为图像的横纵坐标;δ
g是边缘停止函数,定义
公式(1.2)中,定义R
将公式(1.3)、(1.6)代入公式(1.2)中,即可得到下式:
E(φ)=μ·∫
通过梯度下降法求解公式(1.9),以达到求解能量泛函的最小值的目的。将公式(1.9)中的偏微分方程近似转化为离散的有限差分形式,则得到水平集演化方程,即DRLSE模型:
其中,式(1.10)中的
步骤708,基于目标水平集函数得到对应的目标零水平集二值图像。
由于一幅数字图像可以理解为一个二元函数,则一个二元函数在笛卡尔三维坐标系中可以表示为一个连续的曲面。因此,在本实施例中,基于目标水平集函数可以得到对应的目标零水平集二值图像(如图12所示),其中,目标零水平集二值图像中前景与背景的边界像素则为病灶的轮廓数据。
在一个实施例中,如图13所示,以图像分割算法为基于局部二值拟合演化的病灶分割算法为例,说明对感兴趣区域进行检测,得到病灶轮廓的具体实现方式,包括:
步骤1302,根据感兴趣区域,构造初始零水平集函数。
具体的,对原超声图像(如图14A)进行目标检测,得到对应的感兴趣区域(如图14B),由于一幅数字图像可以理解为一个二元函数,在本实施例中,基于感兴趣区域的各顶点坐标,得到病灶区域的初始轮廓,如将感兴趣区域的各顶点坐标确定为参考点,根据设定的平移量对参考点进行平移,以得到相对于各参考点的新的顶点坐标,根据新的顶点坐标得到病灶区域的初始轮廓。
进而由感兴趣区域以及病灶区域的初始轮廓确定对应的初始零水平集函数,在本实施例中,初始零水平集函数用于表示病灶区域的初始轮廓,其也是演化算法的初始对象。其中,水平集方法的主要思想是将曲线作为零水平集嵌入到更高一维的曲面上,通过曲面的演化方程得到函数的演化方程。具体的,根据感兴趣区域(ROI)以及病灶区域的初始轮廓创建一幅与ROI尺寸相同的初始图像(如图15所示),其中,图15所示的黑色区域表示的是初始轮廓的内部,即为乳腺肿瘤病灶的初始区域,设定其像素值均为-2;白色区域表示的是初始轮廓的外部,设定其像素值均为2。
由于上述初始图像中水平集初始区域的像素灰度值为-2,而其他区域的像素灰度值为2,因此,该初始图像为二值化图像,该二值化图像即为初始零水平集图像,也是演化算法的初始对象。又由于数字图像可以通过二元函数表示,因此,对于图15所示的二值化图像可通过如下函数(即初始零水平集函数)表示:
式中r为图像中任意一个像素点的行坐标,c为列坐标,R0表示病灶的初始区域。
步骤1304,基于初始零水平集函数利用局部二值拟合演化算法定义能量泛函。
具体的,假设x是原图像中的任意一个像素点,y则是与像素点x相邻的任意一个像素点(称为x的邻域像素),如图16所示,其中,x和y均为二维向量,可表示为x(c,r),y(c,r)。则定义能量泛函为:
F(φ,f
其中,等式右侧的第一项是能量泛函的主体项,第二项中的P是惩罚项,第三项中的L是水平集函数的零水平曲线的长度,μ,υ则是正常数。
步骤1306,通过梯度下降法求解能量泛函的最小值,以得到演化终止时刻的目标水平集函数。
在本实施例中,通过梯度下降法使得能量泛函最小化,得到水平集活动轮廓演化方程。
具体的,上式(2.2)中:
L(φ)=∫
其中,式(2.3)中的H是Heaviside函数,本文中用正则化的Heaviside函数H
将方程式(2.2)右侧的第一项和第三项正则化,则可以近似表达为:
F
式(9)中f
通过梯度下降法计算能量泛函的最小值,具体的,保持f
式(2.12)中,
e
e
基于水平集活动轮廓演化方程采用设定的步长和迭代次数迭代计算,以得到演化终止时刻的目标水平集函数。具体的,将式(2.12)中的偏微分方程近似转化为离散的有限差分形式:
式中的
步骤1308,基于目标水平集函数得到对应的目标零水平集二值图像,对目标零水平集二值图像进行后处理,以得到病灶区域的目标轮廓。
具体的,对如图17所示的目标零水平集二值图像进行反色处理,以得到反色处理后的多个待筛选的前景区域,其中,反色处理后的前景区域的像素灰度值为255(即白色),背景像素灰度值为0(即黑色)。基于上述反色处理后的多个待筛选的前景区域,对多个待筛选的前景区域进行孔洞填充,从而得到填充后的新的目标零水平集二值图像,如图18所示。
进而根据邻域连通准则采用8邻域在新的目标零水平集二值图像中提取各邻域的连通分量,此时图18中有4个连通分量,很显然,图18中的各白色区域与其它白色区域没有连通,即4个彼此独立的白色区域。进而计算各连通分量所在区域的面积(即该连通分量区域所占的像素数)。将各连通分量所在区域的面积中面积最大的连通分量所在区域确定为病灶区域,如图19所示,则病灶区域的边界像素为对应的目标轮廓,即图19中前景与背景的边界像素为病灶区域的目标轮廓。
在一个实施例中,病灶描述信息包括病灶的回声类型,通常,回声类型包括低回声和无回声,如图20A和图20B所示,分别表示低回声和无回声的灰度直方图。其横轴表示0到255共256个区间(即灰度可能的取值),纵轴为每个灰度值出现的频数。很显然,无回声的直方图中出现频数最多的灰度值的频数与其它灰度值出现的平均频数相差很大。因此可用直方图的这种分布特征来区分病灶的回声类型。具体的,可以采用如下公式来定量表示:ratio=maxFrequency/mean_num,其中,maxFrequency是直方图中出现频数最多的灰度值的频数,mean_num是其它灰度值出现的平均频数。
因此,在本实施例中,根据感兴趣区域得到对应的直方图,进而采用上述公式计算直方图中出现频数最多的灰度值的频数与其他灰度值的平均频数的比值,其中,其他灰度值是指直方图中除出现频数最多的灰度值以外的灰度值,基于比值的大小生成病灶的回声类型,比值越大,则越可能是无回声病灶。具体的,当比值大于7时,则可以确定病灶为无回声病灶,当比值小于7时,则可以确定病灶为低回声病灶。
在一个实施例中,病灶描述信息还包括病灶的形状,通常包括椭圆形、类圆形以及不规则形。则根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息,包括:
采用Fitzgibbon提出的最小二乘拟合椭圆算法将病灶轮廓点集拟合为一个椭圆(如图22A),比较病灶轮廓与该椭圆的相似性,进而基于两者的相似性生成病灶的形状描述,如生成病灶为椭圆形、类圆形或不规则形的描述。
具体的,分别计算病灶轮廓的圆形度、凸包度、紧致度,其计算公式如下:
圆形度公式:
凸包度公式:
紧致度公式:
进而计算病灶轮廓的傅里叶描绘子(Fourier Descriptors),即将图像平面坐标系中的轮廓点集映射到复数平面中。如图21所示的,设病灶轮廓有K个点,以逆时针在该轮廓上行进时,轮廓上的像素点可以看做是坐标对(x
s(k)=x(k)+jy(k),k=0,1,2,...,K-1
则S(k)的离散傅里叶变换为:
其中,a(u)就是傅里叶描绘子,为了保持轮廓的平移、旋转、缩放的不变性,将其归一化为:
其中,a
a
先分别计算病灶轮廓与椭圆轮廓的傅里叶描绘子(这两个轮廓点的数量一般是不同的,所以需要分别在2个轮廓点集中做均匀采样,即每2个采样点的间隔相等,使得在2个轮廓中各采集K个点,然后采用欧氏距离计算两个轮廓的距离d:
式中,x、y即为复数a
若判断为不规则形,则可以直接生成不规则形的形状描述,若判断为“规则形”,则进一步判断具体形状(如椭圆形、类圆形都属于规则形)。具体的,计算上述拟合椭圆的长轴与短轴的比值ratio=w/h,若ratio>=1.5,则确定该病灶的形状为“椭圆形”,若ratio<1.5,则确定该病灶的形状为“类圆形”。
在一个实施例中,病灶描述信息包括病灶的生长方向,通常,生长方向包括平行和非平行。则根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息,包括:采用Fitzgibbon提出的最小二乘拟合椭圆算法将病灶轮廓点集拟合为一个椭圆(如图22A),计算椭圆长轴与图像水平坐标轴的夹角θ,其中,图22B中直线1表示图像坐标系的水平坐标轴的方向,直线2表示椭圆的长轴的方向,直线1与直线2的夹角即θ,根据该夹角θ的大小生成病灶的生长方向。具体的,当00≤θ≤200时,则病灶的生长方向为“平行”,当θ>200时,则病灶的生长方向“非平行”。
在一个实施例中,病灶描述信息包括病灶轮廓的光整度,通常,光整度包括光整和不光整。则根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息,包括:由轮廓点的夹角均值和边界粗糙度来衡量病灶轮廓的光整度。
具体的,令病灶轮廓的轮廓点集为n个像素点,则轮廓点的夹角均值的计算方法:计算病灶轮廓上每个像素点及其相邻像素点的夹角之和,再除以轮廓上像素点的个数,可通过如下公式进行计算:
式中θ
由于轮廓的质心到轮廓上某一点的距离称作该点的径向长度d(i),则在下式(2)中,令质心坐标为(x
则边界粗糙度的计算方法为:顺时针依次计算病灶轮廓上相邻像素点的归一化径向长度之差,然后对所有差值求和,再取平均数,具体可通过如下公式进行计算:
(1)和(3)的值越小,则轮廓越光整。利用轮廓点的夹角均值和边界粗糙度的加权值作为判断轮廓光整度的度量,可采用如下公式进行计算:
val=val
基于公式(4)的计算结果生成病灶轮廓的光整度,具体的,可以设定一个阈值与式(4)的值val进行比较,如果val小于该阈值,则确定病灶轮廓为“光整”,反之则确定病灶轮廓为“不光整”,其中,阈值可以设定为3.6,则val小于3.6时确定病灶轮廓光整。
在一个实施例中,病灶描述信息还包括病灶轮廓的清晰度,具体包括清晰和不清晰。则根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息,包括:根据病灶轮廓的边缘点锐度值判断病灶轮廓的清晰度。
具体的,针对病灶轮廓的像素点依次选取8个邻域点求差值,根据8个点的距离设置权重并计算权重和,例如45、135度权重设置为
其中,m、n表示图像的宽、高,df表示像素点的灰度值变化,dx表示像素点之间的距离,df/dx是灰度变化的幅度。
进而基于病灶轮廓的边缘点锐度值的大小生成病灶轮廓的清晰度,由于边缘点锐度值越小,边缘越模糊。因此,可以设定一个阈值,将上述计算的边缘点锐度值与该阈值比较,若边缘点锐度值小于阈值,则确定病灶轮廓为“不清晰”,反之则确定病灶轮廓为“清晰”。其中,该阈值可以设置为130,则若边缘点锐度值小于130,则表示病灶轮廓不清晰,若边缘点锐度值大于130,则表示病灶轮廓清晰。
在一个实施例中,如图23所示,病灶描述信息还包括病灶是否钙化,则根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息,包括如下步骤:
步骤2302,根据病灶轮廓对感兴趣区域进行图像处理,得到处理后的感兴趣区域。
具体的,设原超声图像为图24A,则图24B是对图24A进行目标检测后得到的ROI图像,图24C是采用上述LBF病灶分割算法分割后得到的有关病灶轮廓的二值图像。将图24C的白色区域作为模板(即病灶轮廓内部区域),在图24B中选取与图24C中白色区域坐标相对应的像素,其余坐标的像素灰度值均设置为0(即黑色),如图24D所示。目的是减少ROI图像中病灶区域以外的干扰,并且减少计算量,提升运算速度。对图24D做形态学闭运算,得到如图24E(即处理后的感兴趣区域),此时,病灶区域的像素灰度变得均匀,从而有利于后续的处理。
步骤2304,遍历处理后的感兴趣区域中所有像素的灰度值,确定灰度值最大的像素的坐标及对应的灰度值。
具体的,对于图24E,首先遍历图中所有灰度值非零的像素,并统计选取其灰度值最大的像素,包括该像素的灰度值val
步骤2306,当灰度值大于设定阈值时,则基于灰度值最大的像素的坐标并采用区域生长算法对处理后的感兴趣区域进行图像分割,以得到对应的二值图像。
具体的,判断val
步骤2308,计算二值图像中疑似钙化区域的像素数,基于疑似钙化区域的像素数确定病灶是否钙化。
计算二值图像如图24F中白色区域(即疑似钙化区域)的面积S(像素个数),并基于疑似钙化区域的像素数确定病灶是否钙化。具体的,如果S>=9,则该区域是钙化区域,从而确定病灶“钙化”;如果S<9,则该区域不是钙化区域,从而确定病灶“无钙化”,对于此种情况,可能是由于图像中的高灰度的噪音像素点作为种子点而生成的区域。
应该理解的是,虽然图1-24F的流程图中的各个步骤按照箭头的指示依次显示,但是这些步骤并不是必然按照箭头指示的顺序依次执行。除非本文中有明确的说明,这些步骤的执行并没有严格的顺序限制,这些步骤可以以其它的顺序执行。而且,图1-24F中的至少一部分步骤可以包括多个子步骤或者多个阶段,这些子步骤或者阶段并不必然是在同一时刻执行完成,而是可以在不同的时刻执行,这些子步骤或者阶段的执行顺序也不必然是依次进行,而是可以与其它步骤或者其它步骤的子步骤或者阶段的至少一部分轮流或者交替地执行。
在一个实施例中,如图25所示,提供了一种超声图像病灶描述装置,包括:感兴趣区域识别模块2501、病灶分割模块2502和病灶描述信息生成模块2503,其中:
感兴趣区域识别模块2501,用于识别超声图像中的病灶,以得到对应的感兴趣区域;
病灶分割模块2502,用于通过图像分割算法对感兴趣区域进行检测,得到病灶轮廓;
病灶描述信息生成模块2503,用于根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息。
在一个实施例中,病灶描述信息包括病灶的生长方向;则病灶描述信息生成模块2503具体用于:采用最小二乘拟合椭圆算法将病灶轮廓的轮廓点集拟合为椭圆;计算椭圆的长轴与水平坐标轴的夹角,根据夹角的大小生成病灶的生长方向。
在一个实施例中,病灶描述信息包括病灶的回声类型;则病灶描述信息生成模块2503具体用于:根据感兴趣区域得到对应的直方图;计算直方图中出现频数最多的灰度值的频数与其他灰度值的平均频数的比值,其他灰度值是指直方图中除出现频数最多的灰度值以外的灰度值;基于比值的大小生成病灶的回声类型。
在一个实施例中,病灶描述信息包括病灶轮廓的光整度;则病灶描述信息生成模块2503具体用于:基于病灶轮廓的轮廓点集分别计算轮廓点的夹角均值和边界粗糙度;根据轮廓点的夹角均值和边界粗糙度的加权值大小生成病灶轮廓的光整度。
在一个实施例中,病灶描述信息包括病灶轮廓的清晰度;则病灶描述信息生成模块2503具体用于:基于病灶轮廓的轮廓点集分别计算各轮廓点相对于邻域点的权重和;根据各轮廓点相对于邻域点的权重和计算病灶轮廓的边缘点锐度值;基于病灶轮廓的边缘点锐度值的大小生成病灶轮廓的清晰度。
在一个实施例中,病灶描述信息包括病灶是否钙化;则病灶描述信息生成模块2503具体用于:根据病灶轮廓对感兴趣区域进行图像处理,得到处理后的感兴趣区域;遍历处理后的感兴趣区域中所有像素的灰度值,确定灰度值最大的像素的坐标及对应的灰度值;当灰度值大于设定阈值时,则基于灰度值最大的像素的坐标并采用区域生长算法对处理后的感兴趣区域进行图像分割,以得到对应的二值图像;计算二值图像中疑似钙化区域的像素数,基于疑似钙化区域的像素数确定病灶是否钙化。
在一个实施例中,病灶描述信息还包括病灶的形状;则病灶描述信息生成模块2503具体用于:采用最小二乘拟合椭圆算法将病灶轮廓的轮廓点集拟合为椭圆;基于病灶轮廓与椭圆的相似性生成病灶的形状描述。
在一个实施例中,图像分割算法包括基于距离正则化水平集演化的病灶分割算法;则病灶分割模块2502具体用于:对感兴趣区域进行阈值分割,以得到对应的初始二值图像,并根据初始二值图像估计病灶区域的质心;根据感兴趣区域以及病灶区域的质心,构造初始零水平集函数;利用距离正则化水平集演化算法基于感兴趣区域对初始零水平集函数进行迭代计算,得到演化终止时刻的目标水平集函数;基于目标水平集函数得到对应的目标零水平集二值图像,其中,目标零水平集二值图像中前景与背景的边界像素为病灶轮廓。
在一个实施例中,图像分割算法包括基于局部二值拟合演化的病灶分割算法;则病灶分割模块2502具体用于:根据感兴趣区域,构造初始零水平集函数,其中,初始零水平集函数表示病灶区域的初始轮廓;基于初始零水平集函数利用局部二值拟合演化算法定义能量泛函;通过梯度下降法求解能量泛函的最小值,以得到演化终止时刻的目标水平集函数;基于目标水平集函数得到对应的目标零水平集二值图像,对目标零水平集二值图像进行后处理,以得到病灶区域的目标轮廓。
关于超声图像病灶描述装置的具体限定可以参见上文中对于超声图像病灶描述方法的限定,在此不再赘述。上述超声图像病灶描述装置中的各个模块可全部或部分通过软件、硬件及其组合来实现。上述各模块可以硬件形式内嵌于或独立于计算机设备中的处理器中,也可以以软件形式存储于计算机设备中的存储器中,以便于处理器调用执行以上各个模块对应的操作。
在一个实施例中,提供了一种计算机设备,该计算机设备可以是服务器,其内部结构图可以如图26所示。该计算机设备包括通过系统总线连接的处理器、存储器、网络接口和数据库。其中,该计算机设备的处理器用于提供计算和控制能力。该计算机设备的存储器包括非易失性存储介质、内存储器。该非易失性存储介质存储有操作系统、计算机程序和数据库。该内存储器为非易失性存储介质中的操作系统和计算机程序的运行提供环境。该计算机设备的数据库用于存储超声图像数据。该计算机设备的网络接口用于与外部的终端通过网络连接通信。该计算机程序被处理器执行时以实现一种超声图像病灶描述方法。
本领域技术人员可以理解,图26中示出的结构,仅仅是与本申请方案相关的部分结构的框图,并不构成对本申请方案所应用于其上的计算机设备的限定,具体的计算机设备可以包括比图中所示更多或更少的部件,或者组合某些部件,或者具有不同的部件布置。
在一个实施例中,提供了一种计算机设备,包括存储器和处理器,存储器中存储有计算机程序,该处理器执行计算机程序时实现以下步骤:
识别超声图像中的病灶,以得到对应的感兴趣区域;
通过图像分割算法对感兴趣区域进行检测,得到病灶轮廓;
根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息。
在一个实施例中,提供了一种计算机可读存储介质,其上存储有计算机程序,计算机程序被处理器执行时实现以下步骤:
识别超声图像中的病灶,以得到对应的感兴趣区域;
通过图像分割算法对感兴趣区域进行检测,得到病灶轮廓;
根据病灶轮廓的几何拓扑结构以及感兴趣区域的灰度特征生成病灶描述信息。
本领域普通技术人员可以理解实现上述实施例方法中的全部或部分流程,是可以通过计算机程序来指令相关的硬件来完成,所述的计算机程序可存储于一非易失性计算机可读取存储介质中,该计算机程序在执行时,可包括如上述各方法的实施例的流程。其中,本申请所提供的各实施例中所使用的对存储器、存储、数据库或其它介质的任何引用,均可包括非易失性和/或易失性存储器。非易失性存储器可包括只读存储器(ROM)、可编程ROM(PROM)、电可编程ROM(EPROM)、电可擦除可编程ROM(EEPROM)或闪存。易失性存储器可包括随机存取存储器(RAM)或者外部高速缓冲存储器。作为说明而非局限,RAM以多种形式可得,诸如静态RAM(SRAM)、动态RAM(DRAM)、同步DRAM(SDRAM)、双数据率SDRAM(DDRSDRAM)、增强型SDRAM(ESDRAM)、同步链路(Synchlink)DRAM(SLDRAM)、存储器总线(Rambus)直接RAM(RDRAM)、直接存储器总线动态RAM(DRDRAM)、以及存储器总线动态RAM(RDRAM)等。
以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。因此,本申请专利的保护范围应以所附权利要求为准。
- 超声图像病灶描述方法、装置、计算机设备和存储介质
- 超声图像病灶的分割方法、装置和计算机设备
