用于治疗海帕西啶介导的病症的方法
文献发布时间:2023-06-19 11:54:11
本申请是申请日为2016年7月28日、申请号为201680045105.6、名称为“用于治疗海帕西啶介导的病症的方法”的专利申请的分案申请。
1.相关申请的交叉参考
本申请主张2015年7月31日申请的美国临时申请第62/199,434号及2015年12月17日申请的美国临时申请第62/268,788号的优先权,其各自以全文引用的方式并入本文。
2.背景技术
肽激素海帕西啶(hepcidin)在全身铁恒定中起主要作用。Hentze等人,Cell 142:24-38(2010)。已知海帕西啶表达受TMPRSS6基因的产物间质蛋白酶-2影响,该间质蛋白酶-2为II型跨膜丝胺酸蛋白酶。已显示TMPRSS6基因的常见变体与铁状态相关,Benyamin等人,Nature Genetics 41(11):1173-1175(2009),其中已显示在海帕西啶表达及血液血红素含量方面,rs855791 SNP(2321G→A;A736V)与天然存在的变型相关。
海帕西啶表达也涉及于人类铁病症(Pietrangelo,J.Hepatology 54:173-181(2011))及慢性疾病贫血(ACD)(也称为炎性贫血(AI))中。ACD流行于患有慢性感染、自体免疫疾病、癌症及慢性肾病(CKD)的患者中。Sun等人,Am.J.Hematol.87(4):392-400(2012)。
在此项技术中需要治疗海帕西啶介导的病症的方法。
3.发明内容
已证实在患有海帕西啶介导的病症(包括慢性疾病贫血及海帕西啶介导的细胞毒性)的患者中,降低的IL-6信号转导提供临床效益,但仅在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者中,其中在具有升高的IL-6含量的患者中具有最大作用。
因此,在第一方面中,提供治疗海帕西啶介导的病症的方法。所述方法包含向患有海帕西啶介导的病症的患者给予治疗有效量的IL-6拮抗剂,该患者已经确定具有TMPRSS6rs855791 SNP处的主要等位基因的至少一个拷贝。在第一系列的实施方式中,先前已确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。在另一系列实施方式中,方法进一步包含确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的早前步骤。通常,患者具有升高的治疗前血清IL-6含量。在一些实施方式中,患者具有升高的治疗前血清CRP含量。
在各种实施方式中,海帕西啶介导的病症为慢性疾病贫血。
在一些贫血实施方式中,患者为男性且治疗前血红素(Hb)含量小于14g/dl;治疗前Hb含量小于13g/dl;治疗前Hb含量小于12g/dl;或治疗前Hb含量小于11g/dl。在一些贫血实施方式中,患者为女性且治疗前Hb含量小于12g/dl;治疗前Hb含量小于11g/dl;治疗前Hb含量小于10g/dl;或治疗前Hb含量小于9g/dl。
在一些贫血实施方式中,患者为男性且治疗前血细胞比容小于40%,小于35%或为30-34%。在一些实施方式中,患者为女性且治疗前血细胞比容小于36%、小于35%、小于34%、小于33%、小于32%或小于31%。在一些实施方式中,女性患者的治疗前血细胞比容为26-29%。
在各种贫血实施方式中,患者已接受至少一次红细胞生成刺激剂(ESA)的治疗前给予。在某些实施方式中,患者已接受至少一次ESA的治疗前给予且具有正常Hb含量或正常血细胞比容。在各种实施方式中,患者已接受至少一次铁补充剂的治疗前给予。在某些实施方式中,患者已接受至少一次铁补充剂的治疗前给予且具有正常Hb含量或正常血细胞比容。在各种实施方式中,患者已接受至少一次血液或红细胞浓集物的治疗前输注。在某些实施方式中,患者已接受至少一次血液或红细胞浓集物的治疗前输注且具有正常Hb含量或正常血细胞比容。
在各种贫血实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的Hb含量增加而高于治疗前含量的时间段。在各种实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的血细胞比容增加而高于治疗前含量的时间段。在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以在不降低患者的Hb含量的情况下使患者的ESA剂量减少而低于治疗前即刻存在的含量的时间段。在某些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以在不降低患者的血细胞比容的情况下使患者的ESA剂量减少而低于治疗前即刻存在的含量的时间段。
在各种实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续以下的时间段:足以使患者的ESA剂量相较于治疗前ESA剂量减少至少10%、使患者的ESA剂量相较于治疗前ESA剂量减少至少20%、使患者的ESA剂量相较于治疗前ESA剂量减少至少30%、使患者的ESA剂量相较于治疗前ESA剂量减少至少40%,或使患者的ESA剂量相较于治疗前ESA剂量减少至少50%。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以逆转功能性铁缺乏的时间段。
在一系列实施方式中,海帕西啶介导的病症为慢性疾病为慢性肾病(CKD)Z慢性疾病贫血。
在一些CKD实施方式中,患者具有KDOQI 1期慢性肾病、KDOQI 2期慢性肾病、KDOQI3期慢性肾病、KDOQI 4期慢性肾病或KDOQI 5期慢性肾病。在特定实施方式中,患者具有KDOQI 5期慢性肾病。
在一些CKD实施方式中,患者患有心肾综合征(CRS)。在特定实施方式中,患者患有4型CRS。在某些实施方式中,患者已接受至少一次治疗前透析治疗。
在一些CKD实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于年龄匹配且疾病匹配的历史对照足以降低心血管(CV)死亡率的时间段。
在各种实施方式中,海帕西啶介导的病症为慢性疾病为慢性炎性疾病的慢性疾病贫血。
在一些实施方式中,慢性炎性疾病为类风湿性关节炎(RA)。在某些实施方式中,患者的治疗前DAS28得分大于5.1。在一些实施方式中,患者的治疗前DAS28得分为3.2至5.1。在特定实施方式中,患者的治疗前DAS28得分小于2.6。在所选择实施方式中,患者的治疗前RA为中度活动性至重度活动性的。
在一些RA实施方式中,患者已接受至少一次甲胺喋呤的治疗前给予。在一些实施方式中,患者已接受至少一次TNFα拮抗剂的治疗前给予。在所选实施方式中,TNFα拮抗剂选自下组:依那西普(etanercept)、阿达木单抗(adalimumab)、英利昔单抗(infliximab)、赛妥珠单抗(certolizumab)及戈利木单抗(golimumab)。
在一些RA实施方式中,患者已接受至少一次IL-6拮抗剂的治疗前给予。在某些实施方式中,治疗前IL-6拮抗剂为托珠单抗(tocilizumab)或托法替尼(tofacitinib)。
在一较佳系列的实施方式中,治疗IL-6拮抗剂为MEDI5117。
在各种实施方式中,海帕西啶介导的病症慢性疾病选自下组的慢性疾病贫血:幼年期特发性关节炎、僵直性脊椎炎、斑状牛皮癣、牛皮癣性关节炎、炎性性肠病、克罗恩氏病及溃疡性结肠炎。
在一些实施方式中,海帕西啶介导的病症为慢性疾病为癌症的慢性疾病贫血。在某些实施方式中,癌症选自下组:实体肿瘤、小细胞肺癌、非小细胞肺癌、血液癌、多发性骨髓瘤、白血病、慢性淋巴细胞白血病(CLL)、慢性骨髓性白血病(CML)、淋巴瘤、霍奇金氏淋巴瘤及肝腺瘤。
在一些实施方式中,海帕西啶介导的病症为慢性疾病贫血,其中慢性疾病为慢性感染。
在一些实施方式中,海帕西啶介导的病症为慢性疾病贫血,其中慢性疾病为充血性心脏衰竭(CHF)。
在一些实施方式中,海帕西啶介导的病症为铁难治性缺铁性贫血(IRIDA)。
在一些实施方式中,海帕西啶介导的病症为急性冠状动脉综合征。在特定实施方式中,患者在第一次给予IL-6拮抗剂的前的60天内、在第一次给予IL-6拮抗剂的前的30天内、在第一次给予IL-6拮抗剂的前的48小时内或在第一次给予IL-6拮抗剂的前的24小时内已罹患心肌梗塞(MI)。
在一些急性冠状动脉综合征实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于治疗前程度足以改良心肌收缩性的时间段。在一些急性冠状动脉综合征实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于治疗前程度足以提高心脏射血分数的时间段。在一些急性冠状动脉综合征实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于治疗前程度足以降低心脏纤维化的时间段。
在一些实施方式中,海帕西啶介导的病症为卡斯尔曼氏病(Castleman'sDisease)。
在另一方面中,提供用于改良对海帕西啶介导的病症的治疗的方法。方法包含向患有海帕西啶介导的病症的患者中断IL-6拮抗剂的给予,其中已确定该患者针对TMPRSS6rs855791次要等位基因为纯合的。
在另一方面中,提供通过中断为低效的疗法而改良对海帕西啶介导的病症的治疗的方法,从而在不丧失治疗功效的情况下降低副作用且降低成本。所述方法包含向患有海帕西啶介导的病症的患者中断IL-6拮抗剂的给予,其中已确定该患者针对TMPRSS6rs855791次要等位基因为纯合的。在一系列实施方式中,先前已确定患者针对TMPRSS6rs855791次要等位基因为纯合的。在另一系列实施方式中,方法进一步包含确定患者针对TMPRSS6 rs855791次要等位基因为纯合的早前步骤。在典型实施方式中,患者具有升高的治疗前血清IL-6含量。在各种实施方式中,患者具有升高的治疗前血清CRP含量。在各种实施方式中,患者患有选自本文中部分5.4.1中所描述的那些病症的海帕西啶介导的病症。在某些实施方式中,患者患有慢性疾病贫血。
实施例2、3及5中所呈现的数据表明在具有升高的治疗前IL-6含量且具有TMPRSS6主要等位基因的至少一个拷贝、甚至不存在贫血的个体中,IL-6拮抗剂提供治疗效益。因此,在另一方面中,提供用于治疗无慢性炎性贫血的患者中的IL-6介导的炎性病症的方法。所述方法包含向患有IL-6介导的炎性病症的个体、通常人类患者给予治疗有效量的IL-6拮抗剂,其中该患者不患有贫血,且其中已确定该个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。在第一系列的实施方式中,先前已确定个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。在另一系列实施方式中,方法进一步包含确定个体具有TMPRSS6rs855791主要等位基因的至少一个拷贝的早前步骤。通常,方法肯定地排除治疗针对TMPRSS6 rs855791次要等位基因为纯合的个体。通常,患者具有升高的治疗前血清IL-6含量。
在治疗方法中的任一者的特定实施方式中,患者具有升高的治疗前血清IL-6含量。在某些实施方式中,患者的治疗前血清IL-6含量大于2.5pg/ml、大于5pg/ml、大于7.5pg/ml、大于10pg/ml或大于12.5pg/ml。
在各种实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者血清中的游离IL-6含量降低而低于治疗前含量的时间段。在特定实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使游离IL-6含量相较于治疗前含量降低至少10%、相较于治疗前含量降低至少20%或相较于治疗前含量降低至少50%的时间段。
在治疗方法中的任一者的特定实施方式中,患者具有升高的治疗前C反应蛋白(CRP)含量。在某些实施方式中,患者的治疗前CRP含量大于2mg/ml、大于3mg/ml、大于5mg/ml、大于7.5mg/ml或甚至大于10mg/ml。
在各种实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的CRP含量降低而低于治疗前含量的时间段。在特定实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的CRP含量相较于治疗前含量降低至少50%的时间段。
在治疗方法中的任一者的特定实施方式中,使用
在治疗方法中的任一者的实施方式中,IL-6拮抗剂为抗IL-6抗体或其抗原结合片段或衍生物。
在某些实施方式中,抗IL-6抗体或抗原结合片段或衍生物对人类IL-6的结合性具有小于100nM、小于50nM、小于10nM或小于1nM的K
在各种抗体实施方式中,IL-6拮抗剂为全长单株抗IL-6抗体,诸如IgG1或IgG4抗体。
在所选实施方式中,抗IL-6抗体或抗原结合片段或衍生物为完全人类的。在一些实施方式中,抗IL-6抗体或抗原结合片段或衍生物为人类化的。
在目前较佳的实施方式中,抗IL-6抗体或抗原结合片段或衍生物包含MED5117的所有六个可变区CDR。在一些这些实施方式中,抗体包含MED5117的VH及VL。且在特定实施方式中,抗体为MED5117。
在各种实施方式中,抗IL-6抗体或抗原结合片段或衍生物包含选自下组的抗体的所有六个可变区CDR:司妥昔单抗(siltuximab)、格里林祖单抗(gerilimzumab)、思鲁库单抗(sirukumab)、克拉杂奇单抗(clazakizumab)、奥诺奇单抗(olokizumab)、艾思莫单抗(elsilimomab)、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
在一些实施方式中,抗IL-6抗体或抗原结合片段或衍生物包含来自选自下组的抗体的重链V区及轻链V区:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(ElevenBio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。在特定实施方式中,抗IL-6抗体为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
在一些实施方式中,抗IL-6抗体或抗原结合片段或衍生物为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。在特定实施方式中,抗IL-6抗体为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(FemtaPharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(AlderBiopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
在各种实施方式中,IL-6拮抗剂为单域抗体、VHH纳米抗体、Fab或scFv。
在各种实施方式中,IL-6拮抗剂为抗IL-6R抗体或其抗原结合片段或衍生物。在某些实施方式中,抗IL-6R抗体、抗原结合片段或衍生物为托珠单抗或夫巴利珠单抗(vobarilizumab)。
在各种实施方式中,IL-6拮抗剂为JAK抑制剂。在特定实施方式中,JAK抑制剂选自下组:托法替尼(Xeljanz)、得森替尼(decernotinib)、卢佐替尼(ruxolitinib)、尤帕达替尼(upadacitinib)、巴瑞替尼(baricitinib)、斐哥替尼(filgotinib)、来妥替尼(lestaurtinib)、帕瑞替尼(pacritinib)、皮非替尼(peficitinib)、INCB-039110、ABT-494、INCB-047986及AC-410。
在各种实施方式中,IL-6拮抗剂为STAT3抑制剂。
在IL-6拮抗剂为抗体或抗原结合片段或衍生物的一些实施方式中,IL-6拮抗剂非经肠给予。在特定实施方式中,IL-6拮抗剂经皮下给予。
在IL-6拮抗剂为JAK抑制剂或STAT3抑制剂的一些实施方式中,其中经口给予IL-6拮抗剂。
4.附图简单说明
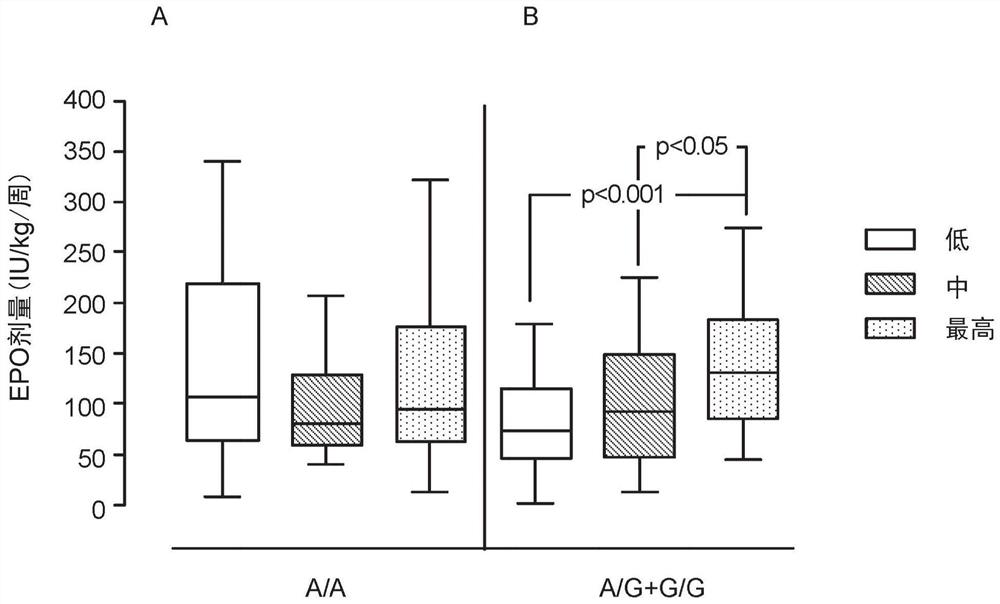
图1A及1B提供盒状图,其展示红细胞生成素(“EPO”)的增加量对于慢性肾病患者(CKD 5期透析个体)中的治疗为所需的,所述慢性肾病患者具有升高的血清IL-6含量,及在TMPRSS6基因中的已知SNP rs855791处的主要等位基因(核苷酸位置2321处的G或C,编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽;736A)的至少一个拷贝;但对于具有升高的IL-6含量且针对rs855791TMPRSS6次要等位基因(核苷酸位置2321处的T或A,编码在位置736处具有缬胺酸的TMPRSS6多肽;736V)为纯合的慢性肾病患者中的治疗不需要。来自针对次要等位基因为纯合(A/A)的患者的数据展示于图1A中;来自具有主要等位基因(纯合G/G及杂合G/A)的至少一个拷贝的患者的数据收集且展示于图1B中。基于血清IL-6含量的三分位:“低”位(IL-6<5pg/ml);“中”位(IL-6=5-15pg/ml);“最高”位(IL-6>15pg/ml),两个患者群体中的每一者的进一步分成组。具有误差棒的盒状图在原始数据上方覆迭。基于IL-6含量及基因型两者,各盒状图表示患者组。详情提供于实施例1中。
图2A及2B提供存活曲线,其表明响应于慢性肾病5期透析个体中的升高的IL-6含量,TMPRSS6 rs855791主要等位基因赋予更高的各种原因的死亡。图2A展示来自针对次要等位基因为纯合(A/A)的患者的数据。图2B展示来自具有主要等位基因(纯合G/G及杂合G/A)的至少一个拷贝的患者的数据。使用用于图1的IL-6含量将各组分成血清IL-6含量的三分位。详情提供于实施例1中。
图3为一图,其展示EPO的增加量对于慢性肾病患者(CKD 5期透析个体)中的疗法为所需的,所述慢性肾病患者具有升高的急性期反应物CRP的血清含量且具有TMPRSS6rs855791主要等位基因的至少一个拷贝;但对于具有升高的急性期反应物CRP的血清含量且针对rs855791次要等位基因为纯合的慢性肾病患者中的疗法不需要。相较于>2mg/L,各基因型组分成血清CRP含量<2mg/L。详情提供于实施例1中。
图4A及4B提供曲线图,其表明在心肌梗塞(“MI”)后的患者中,回应于升高的IL-6含量,TMPRSS6 rs855791主要等位基因赋予更高的各种原因的死亡。图4A描绘对于针对TMPRSS6 rs855791次要等位基因为纯合的群体,相较于MI后的天数(x轴),死亡事件随时间推移的累积几率(y轴)。图4B描绘对于具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的群体,死亡事件随时间推移的累积几率。如所指示,各组分成血清IL-6含量的三分位。在心肌梗塞后一个月测量IL-6含量。在心肌梗塞后一至12个月测量死亡率。详情提供于实施例2中。
图5A及5B提供曲线图,其表明响应于MI后患者中的升高的IL-6含量,TMPRSS6rs855791主要等位基因赋予更高的心脏衰竭(“HF”)风险。图5A描绘对于针对TMPRSS6rs855791次要等位基因为纯合的群体,相较于MI后的天数(x轴),HF随时间推移的累积几率(y轴)。图5B描绘对于具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的群体,HF事件随时间推移的累积几率。如所指示,各组分成血清IL-6含量的三分位。在心肌梗塞后一个月测量IL-6含量。在心肌梗塞后一至12个月测量HF。详情提供于实施例2中。
图6A及6B展示来自人类iPS细胞的分析的结果,所述细胞已经组成性表达TMPRSS6rs855791次要等位基因或主要等位基因的构筑体转染,且活体外暴露至BMP2+IL-6或仅BMP2时分化成心肌细胞,表明回应于IL-6,TMPRSS6 rs855791主要等位基因赋予更高的细胞死亡(台盼蓝(Trypan Blue)阳性)风险。图6A展示常氧环境中的结果。图6B展示暴露于低氧条件及再充氧后的结果。数据暗示降低的IL-6暴露应提高具有TMPRSS6 rs855791主要等位基因的患者中心肌细胞的存活率,但不提高具有TMPRSS6 rs855791次要等位基因的患者中心肌细胞的存活率。详情提供于实施例3中。
图7为展示实施例4中所描述的心肾综合征研究的实验设计的附图。在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的大鼠中诱导CRS4。该附图展示沿时间线的研究中的各种事件。在研究中,在第0周在大鼠中诱导心肌梗塞(“MI”)。在第2周,在各个体中进行单肾切除(“Nx”)。在肾切除后直至研究结束,在第1天(D1)开始,每3天一次地给予抗IL-6抗体(ab9770,艾博抗(Abcam Plc),英国)(Rx)或同种型对照抗体(“IgG”;ab171516,艾博抗(Abcam Plc),英国)。在Nx后直至研究结束,自第1天每天给予标准护理疗法(ACE抑制剂-培哚普利(perindopril))。在第6周,将啮齿动物处死。在“假”对照个体组中不进行MI及Nx。在通过箭头指示的时间点下进行啮齿动物的各种评估。
图8A-8D展示在概述于7图中且详细地描述于实施例4中的心肾综合征模型中,相较于对照(“同种型”)处理组及假手术动物,用抗IL-6抗体(“IL-6ab”)、标准护理ACE抑制剂(培哚普利或“Peri”)治疗的大鼠的心脏射血分数。图8A为展示心肌梗塞后两周但肾切除之前所有组的基线射血分数程度的绘图。图8B为展示肾切除后一周、治疗1周后,所有组的射血分数程度的绘图。图8C为展示肾切除后两周、治疗2周后,所有组的射血分数程度的绘图。图8D为展示肾切除后四周、治疗4周后,所有组的射血分数程度的绘图。结果表述为平均+/-SEM,且表明如通过心脏射血分数的变化所测量,抗IL-6疗法在心肾综合征模型中具有治疗功效,等效于标准护理疗法。
图9描绘一绘图,其展示在概述于图7中且详细地描述于实施例4中的心肾综合征模型中,相较于对照(“同种型”)处理组,用抗IL-6抗体(“IL-6ab”)、标准护理(培哚普利或“Peri”)治疗的大鼠的心肌收缩性。通过测量dP/dt最大(mmHb/毫秒),其为心脏内压力的量度,在结束研究时评估心肌收缩性。展示肾切除后四周、治疗4周后所有组的测量结果。结果表述为平均+/-SEM,且表明如通过用抗IL-6治疗的啮齿动物组中的增加的心肌收缩性所展示,抗IL-6疗法具有等效于标准护理疗法的治疗作用。
图10A-10C展示如通过来自用抗IL-6(“IL-6Ab”)、标准护理(培哚普利或“Peri”)及对照(“IgG”)治疗的啮齿动物组的心脏组织中纤维化程度所测量,抗IL-6疗法具有等效于标准护理疗法的抗心肾综合征作用。图10A为展示用苦味酸天狼星红(picrosirius-red)染色的心脏组织的组织学部分的显微图。分析组织的两个区:“正常”区及“纤维化界限”区。实施例“正常”区通过组织切片的划定部分指示。显微图中的插图展示“正常”区的放大视图,展示“正常”区的小部分具有纤维化组织。“纤维化界限”区为在纤维化组织周围的“正常”区中的组织区。图10B为展示来自所有组的组织样品中,指示为纤维化组织(也即染色/暗区)的“正常”区的面积百分比的绘图。图10C为展示来自所有组的组织样品中,指示为纤维化组织的“纤维化界限”区的面积百分比的绘图。结果表述为平均+/-SEM。详情提供于实施例4中。
图11A及11B展示来自活体内模型的数据,在该模型中,在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的小鼠中诱导心肌梗塞。对照组不接受疗法。实验组用抗鼠类IL-6抗体治疗。图11A展示用抗IL-6进行的治疗在射血分数方面提供统计学上显著的提高。图11B展示用抗IL-6进行的治疗在测量为心脏左心室缩短分数的收缩性方面提供统计学上显著的提高。数据表明在心肌梗塞后立即给出的抗IL-6疗法提高了模仿具有TMPRSS6 rs855791主要等位基因的人类患者的啮齿动物中左心室的功能恢复。详情提供于实施例5中。
仅出于说明的目的,附图描绘本发明的各种实施方式。熟习此项技术者将自以下论述容易认识到可在不偏离本文中所描述的本发明原则的情况下采用本文中所说明的结构及方法的替代实施方式。
5.具体实施方式
5.1实验结果的概述
肽激素海帕西啶在全身铁恒定中起主要作用。Hentze等人,Cell 142:24-38(2010)。已知海帕西啶表达受TMPRSS6基因的产物间质蛋白酶-2影响,该间质蛋白酶-2为II型跨膜丝胺酸蛋白酶。已显示TMPRSS6基因的常见变体与铁状态相关,Benyamin等人,Nature Genetics 41(11):1173-1175(2009),其中已显示在海帕西啶表达及血液血红素含量方面,rs855791 SNP(2321G→A;A736V)与天然存在的变型相关。海帕西啶表达也涉及于人类铁病症(Pietrangelo,J.Hepatology 54:173-181(2011))及慢性疾病贫血(ACD)(也称为炎性贫血(AI))中。ACD流行于患有慢性感染、自体免疫疾病、癌症及慢性肾病(CKD)的患者中。Sun等人,Am.J.Hematol.87(4):392-400(2012)。
为确定TMPRSS6 rs855791 SNP处的基因型是否预测末期肾病中的贫血程度,结合新确定的SNP基因分型来分析先前在患有慢性肾病的患者的临床研究中收集的数据。由于海帕西啶表达也由IL-6调节,Casanovas等人,PLOS Computational Biol.10(1):e1003421(2014),进一步分析数据以确定血清IL-6含量是否可预测末期肾病中的贫血程度。
如实施例1中所描述且如图1中所展示,在具有TMPRSS6 rs855791 SNP处的主要等位基因的至少一个拷贝的患者中,基础贫血程度-测量为临床上滴定的EPO剂量-仅与IL-6含量相关。在这些患者中,更高的血清IL-6含量与更高的所需EPO剂量相关(图1B)。相反,具有次要等位基因的两个拷贝的患者的贫血程度不与血清IL-6含量相关(图1A)。
类似地,在具有TMPRSS6 SNP rs855791处的主要等位基因的至少一个拷贝的患者中,总存活率仅与IL-6含量相关。在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的个体中,存活率成反比地与血清IL-6含量相关,其中血清IL-6含量的最高位中的患者比IL-6含量的最低位中的那些患者具有统计学上显著更坏的存活率(图2B)。相反,针对rs855791处的次要等位基因为纯合的患者的总存活率不受IL-6含量影响(图2A)。
不意在受理论束缚,在具有TMPRSS6主要等位基因的至少一个拷贝的患者中,血清IL-6的增加可促进海帕西啶表达增加,从而增加贫血。增加的死亡风险为失调的铁代谢、所得贫血及/或增加的红细胞生成刺激剂(诸如EPO,经给予以用于治疗)剂量的结果。这些相关性提升了以下可能性:降低的IL-6含量或IL-6信号转导可降低贫血,减少所需EPO剂量,且增加患有慢性肾病的患者的存活率,但仅在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者中,且在具有升高的血清IL-6含量的那些患者中具有最大作用。
为确定在患有急性而非慢性的疾病的患者中TMPRSS6 rs855791基因型是否影响IL-6敏感性,实施例2中吾人结合新确定的SNP基因分型来分析先前在因急性冠状动脉综合征住院的患者的临床研究中收集的数据。
针对TMPRSS6 rs855791 SNP次要等位基因(A)为纯合的个体的死亡不与IL-6的变型相关(图4A)。然而,回应于心肌梗塞后个体中的升高的IL-6含量,主要等位基因(G)的一或两个拷贝赋予更高的各种原因的死亡(图4B)。因此,TMPRSS6调节心肌梗塞后的IL-6介导的死亡风险。
还评估TMPRSS6基因型对IL-6介导的心脏衰竭风险的影响。在针对次要等位基因(A)为纯合的个体的心脏衰竭不与IL-6的变型相关(图5A)。然而,响应于心肌梗塞后个体中的升高的IL-6含量,TMPRSS6的G等位基因赋予更高的心脏衰竭速率(图5B)。因此,TMPRSS6调节心肌梗塞后的IL-6介导的心脏衰竭风险。
来自实施例2的数据表明TMPRSS6基因型、IL-6含量及不利临床结果之间的相关性不限于患有慢性肾病的患者。不意在受理论束缚,在具有TMPRSS6主要等位基因的至少一个拷贝的患者中,血清IL-6的增加可促进海帕西啶表达增加,随后心肌细胞中铁的螯合作用增加,继的以铁介导的细胞毒性。这些相关性提升了以下可能性:降低的IL-6含量或IL-6信号转导可降低患有急性冠状动脉综合征的患者的心脏衰竭及死亡,但仅在具有TMPRSS6rs855791主要等位基因的至少一个拷贝的那些患者中,且在具有升高的血清IL-6含量的那些患者中具有最大作用。
虽然实施例1及2中所观测的相关性强烈表明在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝、升高的IL-6含量及贫血或海帕西啶介导的细胞毒性的患者中,降低的IL-6介导的信号转导应提供临床效益,但所观测相关性不能证明因果关系。因此,在实施例3中,人类诱导型多能性干(iPS)细胞心肌细胞经工程化以仅表达TMPRSS6 rs855791主要等位基因或次要等位基因,且活体外经测试。
海帕西啶表达通过BMP6/SMAD及IL-6/STAT信号转导路径调节,其中BMP及IL-6两者经由其各别受体起作用以促进海帕西啶表达增加。Casanovas等人,PLOS Comp.Biol.10(1):e1003421(2014)。活体外用信号转导路径-重组BMP2及IL-6-的促效剂或单独用BMP2的促效剂处理主要等位基因及次要等位基因iPS心肌细胞,以模型化IL-6含量(或信号转导)降低的临床干预。不用促效剂处理对照iPS细胞。在正常氧张力(常氧)下且也在模拟低氧随后模拟再充氧(再灌注)的条件下测量细胞死亡率。
图6A展示当细胞在正常氧含量下处理时的结果。仅表达TMPRSS6 rs855791次要等位基因(“736V次要等位基因”)的iPS心肌细胞不显著受IL-6信号转导的消除影响(“n.s.”):相较于用BMP2+IL-6进行的处理,当用BMP2处理细胞时,测量为台盼蓝阳性细胞的百分比的细胞死亡率不显著降低。相反,当消除IL-6信号转导时,表达TMPRSS6 rs855791主要等位基因的iPS心肌细胞展示统计学上显著更低的细胞死亡。
图6B展示当细胞经历低氧随后经历再充氧时的结果。相较于常氧条件,低氧/再充氧对iPS心肌细胞有毒性,其中相较于在常氧条件下杀死的约20%对照细胞,约40百分比的主要及次要等位基因对照细胞经杀死(与图6A相比较)。相对于此增加的背景毒性,次要等位基因iPS心肌细胞不显著受IL-6信号转导的消除影响:相较于用BMP2+IL-6进行的处理,当单独用BMP2处理细胞时,细胞死亡率不显著降低。相反,当消除IL-6信号转导时,表达TMPRSS6 rs855791主要等位基因的iPS心肌细胞展示统计学上显著更低的细胞死亡。
这些数据增强了自实施例1及实施例2中的临床试验数据之后hoc分析所得出的推断:IL-6信号转导的降低有效地降低表达TMPRSS6 rs855791主要等位基因的心肌细胞中的IL-6介导的毒性,但在仅表达次要等位基因的心肌细胞中不如此。不意在受理论束缚,促进主要等位基因iPS心肌细胞中的毒性增加的IL-6可起因于海帕西啶表达的IL-6介导的增加,随后细胞中增加的铁螯合作用,继的以铁介导的细胞毒性。
患有慢性肾病的患者,诸如入选于在实施例1中分析的MIMICK研究中的那些患者,常常罹患减弱的心脏功能,其为总死亡率的主要促成者。初次慢性肾病后的此二次心脏损伤称为4型心肾综合征(4型CRS)。为直接测试抗IL-6疗法是否作为治疗在具有TMPRSS6rs855791主要等位基因的至少一个拷贝的CRS4患者中有效,如通过实施例1及3中的数据所表明,吾人使用基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的大鼠的CRS4模型。
治疗4周后,与同种型对照组相比,处理组-用抗IL-6抗体治疗的组及用标准护理ACE抑制剂疗法培哚普利治疗的组-展示统计学上显著增加的射血分数程度(图8D)(p<0.001)。在治疗4周后测量的抗IL-6及标准护理组中的类似射血分数程度展示抗IL-6疗法具有与ACE抑制剂等效的功效。图9展示在保持心肌收缩性方面,抗IL-6疗法也具有与ACE抑制剂等效的有效性。图10A-10C表明抗IL-6疗法同样在降低心脏纤维化方面有效。
这些数据表明在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的动物的心肾综合征活体内模型中,用抗IL-6剂进行的治疗有效地降低心脏损伤且恢复功能。
类似地,实施例2及3中的数据表明降低的IL-6含量或IL-6信号转导可降低患有急性冠状动脉综合征的患者的心脏衰竭及死亡,但仅在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者中,且在具有升高的血清IL-6含量的那些患者中具有最大作用。
进行研究以确定在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的小鼠中,急性心肌梗塞后抗IL-6疗法的作用。
图11A及11B展示来自活体内模型的数据,在该模型中,在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的小鼠中诱导心肌梗塞。对照组不接受疗法。实验组用抗鼠类IL-6抗体治疗。图11A展示相较于对照,用抗IL-6进行的治疗在射血分数方面提供统计学上显著的提高。图11B展示相较于对照,用抗IL-6进行的治疗在测量为心脏缩短分数的收缩性方面提供统计学上显著的提高。这些数据表明在心肌梗塞后立即给出的抗IL-6疗法提高了基因型地类似于具有TMPRSS6 rs855791主要等位基因的人类患者的啮齿动物中左心室的功能恢复。
总之,实验数据表明在患有海帕西啶介导的病症(诸如贫血或海帕西啶介导的细胞毒性)的患者中,降低IL-6信号转导的治疗干预将提供临床效益,但仅在具有TMPRSS6rs855791主要等位基因的至少一个拷贝的那些患者中,其中在具有升高的IL-6含量的患者中具有最大作用。
因此,如下文进一步描述,在第一方面中,提供治疗海帕西啶介导的病症的方法。所述方法包含向患有海帕西啶介导的病症的患者给予治疗有效量的IL-6拮抗剂,该患者已经确定具有TMPRSS6 rs855791 SNP处的主要等位基因的至少一个拷贝。在第二方面中,提供用于改良对海帕西啶介导的病症的治疗的方法,该方法包含向患有海帕西啶介导的病症的患者中断IL-6拮抗剂的给予,其中已确定该患者针对TMPRSS6 rs855791次要等位基因为纯合的。治疗通过中断为低效的疗法而改良,从而在不丧失治疗功效的情况下降低副作用且降低成本。在另一方面中,提供用于治疗无慢性炎性贫血的患者中的IL-6介导的炎性病症的方法,所述方法包含向患者给予治疗有效量的IL-6拮抗剂,该患者患有IL-6介导的炎性病症,不患有贫血,且已确定个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。
5.2定义
除非另外定义,否则本文所使用的所有技术及科学术语具有熟习本发明所属领域者通常理解的含义。如本文中所使用,以下术语具有下文中赋予其的含义。
“海帕西啶”意指与以NCBI保藏编号NP_066998(“海帕西啶前蛋白”)或其生物活性片段提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性的多肽。例示性海帕西啶生物活性包括结合且降低铁输出通道运铁素的含量、抑制铁转运、抑制肠道铁吸收且抑制铁自巨噬细胞及肝脏的释放。下文提供例示性海帕西啶前蛋白氨基酸序列:
参考上文序列,海帕西啶以各种形式存在,包括呈前激素原(preprohormone)(氨基酸25-84)、前激素(氨基酸25-84)形式,及称为海帕西啶-25(氨基酸60-84)、海帕西啶-22(氨基酸63-84)及海帕西啶-20(氨基酸65-84)的成熟形式。
“海帕西啶介导的病症”为海帕西啶表达促成病症或其症状中的任一者的病因的任何病症。自一观测可已知、可怀疑或可推断海帕西啶对病因的贡献,该观测为相较于针对TMPRSS6 rs855791 SNP次要等位基因为纯合的患有病症的患者,IL-6拮抗剂的给予在具有TMPRSS6 rs855791 SNP主要等位基因的至少一个拷贝的患有病症的患者中提供更大的治疗效益。海帕西啶介导的病症在下文进一步描述于部分5.4.1中。
“跨膜蛋白酶丝胺酸6(TMPRSS6)多肽”意指与以NCBI保藏编号NP_001275929提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性且具有丝胺酸蛋白酶活性的多肽或其片段。TMPRSS6多肽,也称为间质蛋白酶-2(MT2),分解铁调素调节蛋白且抑制骨形态生成蛋白信号转导。下文提供在位置736处具有丙胺酸(736A)的例示性TMPRSS6氨基酸序列:
下文提供在位置736处具有缬胺酸(736V)的例示性TMPRSS6氨基酸序列:
“TMPRSS6核酸分子”意指编码TMPRSS6多肽(间质蛋白酶-2;MT2)的聚核苷酸。例示性TMPRSS6核酸分子序列以NCBI保藏编号NM_001289000提供。下文提供在核苷酸位置2321处具有G(“G等位基因”;“主要等位基因”)的TMPRSS6核酸序列:
下文提供在核苷酸位置2321处具有A的TMPRSS6核酸序列:
“变体”意指因一或多个核苷酸或一或多个氨基酸而不同于参考序列的聚核苷酸或多肽序列。例示性TMPRSS6变体为TMPRSS6(A736V),由SNP rs855791(G→A)引起。
“单核苷酸多形现象”或“SNP”意指天然存在的DNA序列变体,其中基因组中的单核苷酸在生物物种的成员之间或在个体中的配对染色体之间不同。SNP可用作变异等位基因的遗传标记。在一个实施方式中,TMPRSS6 SNP为rs855791。
“rs855791”意指人类TMPRSS6基因中的单核苷酸多形现象(SNP),2321G→A,在由TMPRSS6基因编码的间质蛋白酶-2(MT2)的催化区中引起丙胺酸至缬胺酸的取代(A736V)。人类群体中具有最高频率的等位基因(主要等位基因)为2321G,编码736A。人类群体中具有最低频率的等位基因(次要等位基因)为2321A,编码736V。
“杂合”意指染色体基因座具有两个不同的等位基因。在本文中所描述的方法的一个实施方式中,杂合指以下基因型:在其中一个等位基因具有编码在氨基酸位置736处具有丙胺酸的TMPRSS6多肽的TMPRSS6核酸序列(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C)(rs855791主要等位基因),且另一等位基因具有编码在氨基酸位置736处包含缬胺酸的TMPRSS6多肽的变异TMPRSS6核酸序列(例如在TMPRSS6核酸分子的核苷酸位置2321处具有A或T)(rs855791次要等位基因)。
“纯合”意指染色体基因座具有两个相同的等位基因。在本文中所描述的方法的某些实施方式中,纯合指以下基因型:在其中两个等位基因具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的TMPRSS6核酸序列(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C)(rs855791纯合的主要等位基因)。在一些实施方式中,纯合指以下基因型:在其中两个等位基因具有编码在氨基酸位置736处包含缬胺酸的TMPRSS6多肽的TMPRSS6核酸序列(例如在TMPRSS6核酸分子的核苷酸位置2321处具有A或T)(rs855791纯合的次要等位基因)。
“确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝”包括(但不限于)进行分析以确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝;对分析排序以确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝;规定分析以确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝;以其他方式引导或控制分析经进行以确定患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝;及查阅TMRSS6基因型分析数据或蛋白质或核酸序列数据以确定患者具有TMPRSS6rs855791主要等位基因的至少一个拷贝。
“介白素6(IL-6)”或“IL-6多肽”意指与以NCBI保藏编号NP_000591提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性且具有IL-6生物活性的多肽或其片段。IL-6为具有多种生物功能的多效性细胞激素。例示性IL-6生物活性包括免疫刺激及促炎性活性。下文提供例示性IL-6氨基酸序列:
“介白素6(IL-6)核酸”意指编码介白素6(IL-6)多肽的聚核苷酸。例示性介白素6(IL-6)核酸序列以NCBI保藏编号NM_000600提供。下文提供以NCBI保藏编号NM_000600的例示性序列。
“介白素6受体(IL-6R)复合物”意指包含IL-6受体亚基α(IL-6Rα)及介白素6信号转导子糖蛋白130-也称为介白素6受体亚基β(IL-6Rβ)-的蛋白质复合物。
“介白素6受体亚基α(IL-6Rα)多肽”意指与以NCBI保藏编号NP_000556或NP_852004提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性且具有IL-6受体生物活性的多肽或其片段。例示性IL-6Rα生物活性包括结合至IL-6、结合至糖蛋白130(gp130)及调节细胞生长及分化。下文提供例示性IL-6R序列:
“介白素6受体亚基β(IL-6Rβ)多肽”意指与以NCBI保藏编号NP_002175、NP_786943或NP_001177910提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性且具有IL-6受体生物活性的多肽或其片段。例示性IL-6Rβ生物活性包括结合至IL-6Rα、IL-6受体信号转导活性,及调节细胞生长、分化、海帕西啶表达等。下文提供例示性IL-6Rβ序列:
“IL-6拮抗剂”意指能够降低IL-6的生物活性的药剂。IL-6拮抗剂包括降低血清中IL-6多肽的含量的药剂,包括降低IL-6多肽或核酸的表达的药剂;降低IL-6结合至IL-6R的能力的药剂;降低IL-6R的表达的药剂;及当经IL-6结合时通过IL-6R受体降低信号转导的药剂。在较佳实施方式中,IL-6拮抗剂使IL-6生物活性降低至少约10%、20%、30%、50%、70%、80%、90%、95%或甚至100%。如下文部分5.9中进一步描述,IL-6拮抗剂包括IL-6结合多肽,诸如抗IL-6抗体及其抗原结合片段或衍生物;IL-6R结合多肽,诸如抗IL-6R抗体及其抗原结合片段或衍生物;及合成化学分子,诸如JAK1及JAK3抑制剂。
“IL-6抗体”或“抗IL-6抗体”意指特异性结合IL-6的抗体。抗IL-6抗体包括对IL-6具有特异性的单株及多株抗体及其抗原结合片段或衍生物。IL-6抗体在下文部分5.9.1中更详细地描述。
“IL-6介导的炎性病症”意指已知或怀疑IL-6促成疾病或其症状中的任一者的病因的任何病症。
“红细胞生成素(EPO)”意指与以NCBI保藏编号NP_000790提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性且具有EPO生物活性的多肽或其片段。例示性EPO生物活性包括结合至红细胞生成素受体及所产生的红细胞系前驱体细胞的增殖及最终分化及/或增加红细胞生成(红细胞产生)。下文提供例示性EPO氨基酸序列:
“红细胞生成刺激剂(ESA)”意指刺激红细胞生成的药剂。ESA包括(但不限于)EPO;达贝泊汀(darbepoetin)(安然爱思普(Aranesp));倍他依泊汀(epoetin beta)(新莱考蒙(NeoRecormon));德耳塔依伯汀(epoetin delta)(对达因珀(Dynepo));奥米伽依伯汀(epoetin omega)(Epomax);泽塔依伯汀(epoetin zeta)。
“促红细胞形成因子”意指增加红细胞或其祖细胞(例如造血干细胞)的生长或增殖及/或降低红细胞或其祖细胞的细胞死亡的药剂。在各种实施方式中,促红细胞形成因子包括红细胞生成刺激剂、HIF安定剂及补充铁。
“C反应蛋白(CRP)多肽”意指与以NCBI保藏编号NP_000558提供的氨基酸序列具有至少约85%或大于85%的氨基酸一致性且具有补体活化活性的多肽或其片段。CRP含量回应于炎性而增加。下文提供例示性CRP序列:
“药剂(agent)”意指适合于以疗法给予的任何化合物或组合物,且明确地包括化学化合物;蛋白质,包括抗体或其抗原结合片段;肽;及核酸分子。
“个体”意指人类或非人类哺乳动物(包括(但不限于)牛、马、犬、绵羊、猫及啮齿动物,包括鼠类及家鼠属)个体。“患者”为人类个体。
如本文中所使用,术语“治疗”及其类似者指降低或改善病症及/或与其相关的迹象或症状,或减慢或停止其进程。应了解,虽然不排除,但治疗病症或病状并不需要完全消除该病症、病状或与其相关的症状。
“治疗前”意指根据本文中所描述的方法在第一次给予IL-6拮抗剂之前。治疗前不排除且常常包括先前给予IL-6拮抗剂以外的治疗。
在本发明中,“包含”、“含有”、“具有”、“包括”及其语言变化形式具有美国专利法律中赋予其的含义,允许明确叙述者以外其他组分的存在。
“生物样品”意指来源于生物体(例如人类个体)的任何组织、细胞、体液或其他物质。在某些实施方式中,生物样品为血清或血液。
“血管收缩素转化酶(ACE)抑制剂”意指抑制血管收缩素转化酶将血管收缩素I转化至血管收缩素II的生物功能的药剂。ACE抑制剂包括(但不限于)喹那普利(quinapril)、培哚普利、雷米普利(ramipril)、卡托普利(captopril)、贝那普利(benazepril)、群多普利(trandolapril)、福辛普利(fosinopril)、赖诺普利(lisinopril)、莫西普利(moexipril)及依那普利(enalapril)。在各种实施方式中,ACE抑制剂为培哚普利。
5.1其他说明性惯例
除非另外规定,否则抗体恒定区残基编号系根据Kabat中的EU索引。
本文中所提供的范围应理解为范围内所有值的简写,包括所述端点。举例而言,1至50的范围应理解为包括下组的任何数值、数值的组合或子范围:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49及50。
除非上下文有特别规定或显而易见,否则本文中所使用的术语“或”应理解为包括。除非上下文有特别规定或显而易见,否则本文中所使用的术语“一”及“该”应理解为单数或复数。
除非上下文有特别规定或显而易见,否则本文中所使用的术语“约”应理解为在此项技术中的正常容限范围内,例如在平均值的2个标准偏差内。约可理解为在陈述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非另外自上下文显而易见,否则本文中所提供的所有数值均由术语约修饰。
5.2治疗海帕西啶介导的病症的方法
在第一方面中,提供治疗海帕西啶介导的病症的方法。
所述方法包含向具有海帕西啶介导的病症的个体(通常人类患者)给予治疗有效量的IL-6拮抗剂,其中已确定该个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。在第一系列的实施方式中,先前已确定个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。在另一系列实施方式中,该方法进一步包含确定个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的早前步骤。通常,所述方法肯定地排除治疗对于TMPRSS6rs855791次要等位基因为纯合的个体。通常,患者具有升高的治疗前血清IL-6含量。
5.2.1海帕西啶介导的病症
5.2.1.1慢性疾病/慢性炎性贫血
在各种实施方式中,通过本文中所描述的方法治疗的海帕西啶介导的病症为慢性疾病贫血,也称为慢性炎性贫血。
在各种实施方式中,患者为男性且治疗前血红素(Hb)含量小于14g/dl。在一些实施方式中,男性患者的治疗前Hb含量为13.0-13.9g/dl、12.0-12.9g/dl、11.0-11.9g/dl、10.0-10.9g/dl或小于10g/dl。在各种实施方式中,患者为女性且治疗前Hb含量小于12g/dl。在一些实施方式中,女性患者的治疗前Hb含量为11.0-11.9g/dl、10.0-10.9g/dl、9.0-9.9g/dl、8.0-8.9g/dl或小于8g/dl。在一些这些实施方式中,之前患者已用ESA治疗。在一些实施方式中,患者已通过补铁治疗。在一些实施方式中,患者已用血液或红细胞浓集物的输注来治疗。
在各种实施方式中,患者为男性且治疗前血细胞比容小于40%。在一些实施方式中,男性患者的治疗前血细胞比容小于39%、小于38%、小于37%、小于36%或小于35%。在某些实施方式中,男性患者的治疗前血细胞比容为39%、38%、37%、36%、35%、34%、33%、32%、31%或30%。在各种实施方式中,患者为女性,且治疗前血细胞比容小于36%。在一些实施方式中,女性患者的治疗前血细胞比容小于35%、34%、33%、32%、31%、30%、29%、28%、27%或26%。在某些实施方式中,女性患者的治疗前血细胞比容为35%、34%、33%、32%、31%、30%、29%、28%、27%或26%。在一些这些实施方式中,患者已用ESA治疗。在一些实施方式中,患者已通过补铁治疗。在一些实施方式中,患者已用血液或红细胞浓集物的输注来治疗。
在一些实施方式中,患者已用ESA治疗且具有正常的治疗前Hb含量及/或正常的治疗前血细胞比容。在某些实施方式中,患者为男性且治疗前血红素(Hb)含量为至少14g/dl,及/或治疗前血细胞比容为至少40%。在某些实施方式中,患者为女性,且治疗前Hb含量为至少12g/dl及/或血细胞比容为至少36%。在具体实施方式中,ESA为EPO。在具体实施方式中,ESA为达贝泊汀α(darbepoetin alfa)。
在一些实施方式中,患者已通过补铁治疗,且具有正常的治疗前Hb含量及/或正常的治疗前血细胞比容。在某些实施方式中,患者为男性且治疗前血红素(Hb)含量为至少14g/dl,及/或治疗前血细胞比容为至少40%。在某些实施方式中,患者为女性,且治疗前Hb含量为至少12g/dl及/或血细胞比容为至少36%。
在一些实施方式中,患者已用全血或红细胞浓集物的输注来治疗,且具有正常的治疗前Hb含量及/或正常的治疗前血细胞比容。在某些实施方式中,患者为男性且治疗前血红素(Hb)含量为至少14g/dl,及/或治疗前血细胞比容为至少40%。在某些实施方式中,患者为女性,且治疗前Hb含量为至少12g/dl及/或血细胞比容为至少36%。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的Hb含量增加而高于治疗前含量的时间段。在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的血细胞比容增加而高于治疗前含量的时间段。在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使Hb含量及血细胞比容两者增加而高于治疗前含量的时间段。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以在不降低患者的Hb含量的情况下使得患者的ESA剂量减少而低于治疗前含量的时间段。在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以在不降低患者的血细胞比容的情况下使得患者的ESA剂量减少而低于治疗前含量的时间段。在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以在不降低患者的Hb含量及血细胞比容的情况下使得患者的ESA剂量减少的时间段。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使得患者的ESA剂量相较于治疗前ESA剂量减少至少10%的时间段。在某些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使得患者的ESA剂量相较于治疗前ESA剂量减少至少20%、30%、40%或50%的时间段。在特定实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使得患者的ESA剂量相较于治疗前ESA剂量减少至少60%或甚至至少75%的时间段。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以逆转功能性铁缺乏的时间段。
5.2.1.1.1慢性肾病
在各种实施方式中,慢性疾病为慢性肾病(CKD)。
在一些实施方式中,患者患有KDOQI 1期慢性肾病。在某些实施方式中,患者患有KDOQI 2期慢性肾病、KDOQI 3期慢性肾病、KDOQI 4期慢性肾病或KDOQI 5期慢性肾病。
在一些实施方式中,患者患有心肾综合征(CRS)。在某些实施方式中,患者患有4型CRS。
在一些实施方式中,患者已用透析治疗。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于年龄匹配且疾病匹配的历史群组足以降低心血管(CV)死亡率的时间段。
5.2.1.1.2慢性炎性疾病
在各种实施方式中,慢性疾病为慢性炎性疾病。
在一些实施方式中,慢性炎性疾病为类风湿性关节炎(RA)。
在具体实施方式中,患者的治疗前DAS28得分大于5.1。在一些实施方式中,患者的治疗前DAS28得分为3.2至5.1。在一些实施方式中,患者的治疗前DAS28得分小于2.6。在各种实施方式中,患者的治疗前RA为重度活动性的。在一些实施方式中,患者的治疗前RA为中度活动性的。
在某些实施方式中,患者已用甲胺喋呤治疗。在一些实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断甲胺喋呤。在一些实施方式中,当启动用IL-6拮抗剂进行的治疗时,继续用甲胺喋呤进行的治疗。
在某些实施方式中,患者已用抗TNFα剂治疗。在特定实施方式中,抗TNFα剂选自依那西普、阿达木单抗、英利昔单抗、赛妥珠单抗及戈利木单抗。在特定实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断抗TNFα剂。
在某些实施方式中,患者已用IL-1受体拮抗剂治疗。在具体实施方式中,IL-1受体拮抗剂为阿那白滞素(anakinra)。在特定实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断IL-1受体拮抗剂。
在某些实施方式中,患者已用阿巴西普(abatacept)治疗。在特定实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断阿巴西普。
在某些实施方式中,患者已用IL-6拮抗剂治疗,且方法进一步包含继续向经最新确定具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者仅给予IL-6拮抗剂。在具体实施方式中,IL-6拮抗剂为托珠单抗。在具体实施方式中,IL-6拮抗剂为托法替尼。
在各种实施方式中,慢性炎性疾病选自下组:幼年期特发性关节炎、僵直性脊椎炎、斑状牛皮癣、牛皮癣性关节炎、炎性性肠病、克罗恩氏病及溃疡性结肠炎。
5.2.1.1.3癌症
在各种实施方式中,慢性疾病为癌症。
在一些实施方式中,癌症选自下组:实体肿瘤、小细胞肺癌、非小细胞肺癌、血液癌、多发性骨髓瘤、白血病、慢性淋巴细胞白血病(CLL)、慢性骨髓性白血病(CML)、淋巴瘤及霍奇金氏淋巴瘤。
5.2.1.1.4慢性感染
在各种实施方式中,慢性疾病为慢性感染。
5.2.1.1.5充血性心脏衰竭
在各种实施方式中,慢性疾病为充血性心脏衰竭(CHF)。
5.2.1.2铁难治性缺铁性贫血(IRIDA)
在各种实施方式中,海帕西啶介导的病症为铁难治性缺铁性贫血(IRIDA)。
5.2.1.3与海帕西啶产生的肝腺瘤相关的贫血
在各种实施方式中,海帕西啶介导的病症为与海帕西啶产生的肝腺瘤相关的贫血。
5.2.1.4急性冠状动脉综合征
呈现于下文实施例2、3及5中的数据表明在急性心肌梗塞之后,IL-6拮抗剂在降低心脏衰竭及死亡的风险中有效,且在增加心脏功能及降低纤维化中有效。因此,在各种实施方式中,海帕西啶介导的病症急性冠状动脉综合征。
在某些实施方式中,患者在第一次给予IL-6拮抗剂之前的60天内已罹患心肌梗塞。在特定实施方式中,患者在第一次给予IL-6拮抗剂之前的30天、14天、7天、48小时或24小时内已罹患心肌梗塞。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于治疗前程度足以改良心肌收缩性的时间段。在某些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于治疗前程度足以提高心脏射血分数的时间段。在某些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续相较于治疗前程度足以降低心脏纤维化的时间段。
5.2.1.5卡斯尔曼氏病
在各种实施方式中,海帕西啶介导的病症为卡斯尔曼氏病。
5.3改良对海帕西啶介导的病症的治疗的方法
在另一方面中,提供通过中断为低效的疗法而改良对海帕西啶介导的病症的治疗的方法,从而在不丧失治疗功效的情况下降低副作用且降低成本。所述方法包含向患有海帕西啶介导的病症的患者中断IL-6拮抗剂的给予,其中已确定该患者针对TMPRSS6rs855791次要等位基因为纯合的。在一系列实施方式中,先前已确定患者针对TMPRSS6rs855791次要等位基因为纯合的。在另一系列实施方式中,方法进一步包含确定患者针对TMPRSS6 rs855791次要等位基因为纯合的早前步骤。在典型实施方式中,患者具有升高的治疗前血清IL-6含量。在各种实施方式中,患者具有升高的治疗前血清CRP含量。
在各种实施方式中,患者具有选自上文部分5.4.1中所描述的那些病症的海帕西啶介导的病症。在某些实施方式中,患者患有慢性疾病贫血。
5.4治疗IL-6介导的炎性病症的方法
实施例2、3及5中所呈现的数据表明在具有升高的治疗前IL-6含量且具有TMPRSS6主要等位基因的至少一个拷贝、甚至不存在贫血的个体中,IL-6拮抗剂提供治疗效益。因此,在另一方面中,提供方法以治疗无慢性炎性贫血的患者中的IL-6介导的炎性病症。
所述方法包含向患有IL-6介导的炎性病症的个体、通常人类患者给予治疗有效量的IL-6拮抗剂,其中该患者不患有贫血,且其中已确定该个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。在第一系列的实施方式中,先前已确定个体具有TMPRSS6rs855791主要等位基因的至少一个拷贝。在另一系列实施方式中,方法进一步包含确定个体具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的早前步骤。通常,方法肯定地排除治疗针对TMPRSS6 rs855791次要等位基因为纯合的个体。通常,患者具有升高的治疗前血清IL-6含量。
在一些实施方式中,IL-6介导的病症为类风湿性关节炎(RA)。
在具体实施方式中,患者的治疗前DAS28得分大于5.1。在一些实施方式中,患者的治疗前DAS28得分为3.2至5.1。在一些实施方式中,患者的治疗前DAS28得分小于2.6。在各种实施方式中,患者的治疗前RA为重度活动性的。在一些实施方式中,患者的治疗前RA为中度活动性的。
在某些实施方式中,患者已用甲胺喋呤治疗。在一些实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断甲胺喋呤。在一些实施方式中,当启动用IL-6拮抗剂进行的治疗时,继续甲胺喋呤。
在某些实施方式中,患者已用抗TNFα剂治疗。在特定实施方式中,抗TNFα剂选自依那西普、阿达木单抗、英利昔单抗、赛妥珠单抗及戈利木单抗。在特定实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断抗TNFα剂。
在某些实施方式中,患者已用IL-1受体拮抗剂治疗。在具体实施方式中,IL-1受体拮抗剂为阿那白滞素。在特定实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断IL-1受体拮抗剂。
在某些实施方式中,患者已用阿巴西普治疗。在特定实施方式中,当启动用IL-6拮抗剂进行的治疗时,中断阿巴西普。
在各种实施方式中,IL-6介导的病症选自下组:幼年期特发性关节炎、僵直性脊椎炎、斑状牛皮癣、牛皮癣性关节炎、炎性性肠病、克罗恩氏病及溃疡性结肠炎。
5.5治疗前血清IL-6及CRP含量
在本文中所描述的方法的典型实施方式中,患者具有升高的治疗前血清IL-6含量。
在一些实施方式中,患者的治疗前血清IL-6含量大于2.5pg/ml。在各种实施方式中,患者的治疗前血清IL-6含量大于5pg/ml、大于7.5pg/ml、大于10pg/ml、大于12.5pg/ml或大于15pg/ml。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的血清IL-6含量降低而低于治疗前含量的时间段。在某些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的血清IL-6含量相较于治疗前含量降低至少10%、20%、30%、40%或50%的时间段。
在各种实施方式中,患者具有升高的治疗前C反应蛋白(CRP)含量。在一些实施方式中,患者的治疗前CRP含量大于2mg/ml、2.5mg/ml、3mg/ml、3.5mg/ml、4mg/ml、4.5mg/ml或5mg/ml。在一些实施方式中,患者的治疗前CRP含量大于7.5mg/ml、10mg/ml、12.5mg/ml或15mg/ml。
在一些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的CRP含量降低而低于治疗前含量的时间段。在某些实施方式中,按时程给予一剂IL-6拮抗剂剂量,且持续足以使患者的CRP含量相较于治疗前含量降低至少10%、20%、30%、40%或50%的时间段。
5.6TMPRSS6 rs855791基因分型
本文中所描述的方法包含向已确定具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的个体给予治疗有效量的IL-6拮抗剂。较佳地,鉴别对应于相关基因的两个等位基因,因此允许鉴别且区分以下患者:针对TMPRSS6 rs855791主要等位基因为纯合的,针对主要及次要TMPRSS6 rs855791等位基因为杂合的,及针对TMPRSS6 rs855791次要等位基因为纯合的。
使用标准技术确定SNP rs855791(2321G→A)在TMPRSS6基因中的缺乏(主要等位基因)或存在(次要等位基因)。
通常,PCR用以扩增获自患者的生物样品。
在一些实施方式中,同时使用实时PCR(RT-PCR)在扩增下检测多形现象的缺乏或存在。在某些实施方式中,RT-PCR分析采用5'核酸酶(
在一些实施方式中,在扩增后使用用对SNP rs855791具有特异性的探针的杂交、限制性核酸内切酶消化、核酸测序、引物延伸、微阵列或基因芯片分析、质谱分析及/或DNA酶保护分析,来检测多形现象的缺乏或存在。在一些实施方式中,等位基因变体通过测序判读。在某些实施方式中,使用桑格测序(Sanger sequencing)。在某些实施方式中,使用各种下一代测序技术中之一者,包括例如选自下组的测序技术:微阵列测序、Solexa测序(Illumina)、离子急流(Life Technologies)、SOliD(Applied Biosystems)、焦磷酸测序、单分子实时测序(Pacific Bio)、纳米孔测序及隧道电流测序。
5.7IL-6拮抗剂
用于本文中所描述的方法的IL-6拮抗剂能够降低IL-6的生物活性。
5.7.1抗IL-6抗体
在各种实施方式中,IL-6拮抗剂为抗IL-6抗体或其抗原结合片段或衍生物。
在一些实施方式中,IL-6拮抗剂为全长抗IL-6单株抗体。在特定实施方式中,全长单株抗体为IgG抗体。在某些实施方式中,全长单株抗体为IgG1、IgG2、IgG3或IgG4抗体。在一些实施方式中,IL-6拮抗剂为多株组合物,其包含全长抗IL-6抗体的多种物质,该多种物中的每一者具有独特CDR。在一些实施方式中,IL-6拮抗剂为选自Fab、Fab'及F(ab')2片段的抗体片段。在一些实施方式中,IL-6拮抗剂为scFv、经二硫键连接的Fv(dsFv)或单域抗体,诸如源于骆驼的VHH单域纳米抗体。在一些实施方式中,IL-6拮抗剂为包含IL-6抗原结合片段的免疫结合物或融合物。在一些实施方式中,抗体为双特异性或多特异性的,其中抗原结合部分中的至少一者具有针对IL-6的特异性。
在一些实施方式中,抗体为完全人类的。在一些实施方式中,抗体为人类化的。在一些实施方式中,抗体为嵌合的且具有非人类V区及人类C区域。在一些实施方式中,抗体为鼠的。
在典型实施方式中,抗IL-6抗体对人类IL-6的结合性具有小于100nM的K
在典型实施方式中,抗IL-6抗体中和IL-6的生物活性。在一些实施方式中,中和抗体阻止IL-6结合至IL-6受体。
在典型实施方式中,抗IL-6抗体在静脉内给予后具有至少7天的消除半衰期。在某些实施方式中,抗IL-6抗体的消除半衰期为至少14天、至少21天或至少30天。
在一些实施方式中,相较于未经取代的人类IgG恒定域,抗IL-6抗体具有具至少一个氨基酸取代(延长血清半衰期)的人类IgG恒定区。
在某些实施方式中,IgG恒定域包含在残基252、254及256处的取代,其中氨基酸残基252处的氨基酸取代为经酪胺酸取代,氨基酸残基254处的氨基酸取代为经苏胺酸取代,且氨基酸残基256处的氨基酸取代为经麸胺酸取代(“YTE”)。参见美国专利第7,083,784号,其以全文引用的方式并入本文中。在某些延长半衰期实施方式中,IgG恒定域包含选自以下的取代:T250Q/M428L(Hinton等人,J.Immunology 176:346-356(2006));N434A(Yeung等人,J.Immunology 182:7663-7671(2009));或T307A/E380A/N434A(Petkova等人,International Immunology,18:1759-1769(2006))。
在一些实施方式中,抗IL-6抗体的消除半衰期通过利用人类血清白蛋白的FcRN结合特性来增加。在某些实施方式中,抗体结合至白蛋白(Smith等人,Bioconjug.Chem.,12:750-756(2001))。在一些实施方式中,抗IL-6抗体融合至细菌白蛋白结合域(Stork等人,Prot.Eng.Design Science 20:569-76(2007))。在一些实施方式中,抗IL-6抗体融合至白蛋白结合肽(Nguygen等人,Prot Eng Design Sel 19:291-297(2006))。在一些实施方式中,抗IL抗体为双特异性,其中一种特异性针对IL-6,且一种特异性针对人类血清白蛋白(Ablynx,WO 2006/122825(双特异性纳米抗体))。
在一些实施方式中,抗IL-6抗体的消除半衰期通过以下增加:PEG化(Melmed等人,Nature Reviews Drug Discovery 7:641-642(2008));HPMA共聚物结合(Lu等人,NatureBiotechnology 17:1101-1104(1999));聚葡萄糖结合(Nuclear MedicineCommunications,16:362-369(1995));与高氨基酸聚合物(HAP;HAP化)的结合(Schlapschy等人,Prot Eng Design Sel 20:273-284(2007));或聚唾液酸化(Constantinou等人,Bioconjug.Chem.20:924-931(2009))。
5.7.1.1.1 MED5117及衍生物
在某些实施方式中,抗IL-6抗体或其抗原结合部分包含MEDI5117的所有六个CDR。在特定实施方式中,抗体或其抗原结合部分包含MEDI5117重链V区及轻链V区。在具体实施方式中,抗体为全长MEDI5117抗体。MEDI5117抗体描述于揭示内容以全文引用的方式并入本文中的WO 2010/088444及US 2012/0034212中。MEDI5117抗体具有以下CDR及重链及轻链序列:
MEDI5117 VH CDR1
MEDI5117 VH CDR2
MEDI5117 VH CDR3
MEDI5117 VL CDR1
MEDI5117 VL CDR2
MEDI5117 VL CDR3
MEDI5117重链
MEDI5117轻链
在各种实施方式中,抗IL-6抗体为MED5117的衍生物。
在一些实施方式中,MED5117衍生物在MED5117重链及/或轻链V区中包括一或多个氨基酸取代。
在某些实施方式中,相对于MEDI5117抗IL-6抗体的最初V
在某些实施方式中,MED5117衍生物包含与MEDI5117的VH及VL域的氨基酸序列至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%一致的氨基酸序列。使用BLAST算法使用默认参数确测序列一致性百分比。
在某些实施方式中,MED5117衍生物包含以下氨基酸序列:其中CDR包含与MEDI5117的各别CDR的氨基酸序列至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%一致的氨基酸序列。使用BLAST算法使用默认参数确测序列一致性百分比。
在某些实施方式中,V
5.7.1.1.2其他抗IL-6抗体
在各种实施方式中,抗IL-6抗体包含来自选自下组的抗体的六个CDR:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、艾思莫单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。在某些实施方式中,抗IL-6抗体包含来自选自下组的抗体的重链V区及轻链V区:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。在特定实施方式中,抗IL-6抗体为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(AlderBiopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
在一些实施方式中,抗IL-6抗体包含来自选自以下各者中所描述的那些抗体的抗体的六个CDR:US 2016/0168243、US 2016/0130340、US 2015/0337036、US 2015/0203574、US 2015/0140011、US 2015/0125468、US 2014/0302058、US 2014/0141013、US 2013/0280266、US 2013/0017575、US 2010/0215654、US 2008/0075726、美国专利第5,856,135号、US 2006/0240012、US 2006/0257407或美国专利第7291721号,其揭示内容以全文引用的方式并入本文中。
5.7.2抗IL-6受体抗体
在各种实施方式中,IL-6拮抗剂为抗IL-6受体抗体或其抗原结合片段或衍生物。
在一些实施方式中,IL-6拮抗剂为全长抗IL-6受体单株抗体。在特定实施方式中,全长单株抗体为IgG抗体。在某些实施方式中,全长单株抗体为IgG1、IgG2、IgG3或IgG4抗体。在一些实施方式中,IL-6拮抗剂为多株组合物,其包含全长抗IL-6受体抗体的多种物质,该多种物质中的每一者具有独特CDR。在一些实施方式中,IL-6拮抗剂为选自Fab及Fab'片段的抗体片段。在一些实施方式中,IL-6拮抗剂为scFv、单域抗体,包括源于骆驼的VHH单域纳米抗体。在一些实施方式中,抗体为双特异性或多特异性的,其中抗原结合部分中的至少一者具有针对IL-6R的特异性。
在一些实施方式中,抗体为完全人类的。在一些实施方式中,抗体为人类化的。在一些实施方式中,抗体为嵌合的且具有非人类V区及人类C区域。在一些实施方式中,抗体为鼠的。
在典型实施方式中,抗IL-6受体抗体对人类IL-6R的结合性具有小于100nM的K
在典型实施方式中,抗IL-6R降低IL-6的生物活性。
在典型实施方式中,抗IL-6R抗体在静脉内给予后具有至少7天的消除半衰期。在某些实施方式中,抗IL-6R抗体的消除半衰期为至少14天、至少21天或至少30天。
在一些实施方式中,相较于未经取代的人类IgG恒定域,抗IL-6R抗体具有具至少一个氨基酸取代(延长血清半衰期)的人类IgG恒定区。
在某些实施方式中,IgG恒定域包含在残基252、254及256处的取代,其中氨基酸残基252处的氨基酸取代为经酪胺酸取代,氨基酸残基254处的氨基酸取代为经苏胺酸取代,且氨基酸残基256处的氨基酸取代为经麸胺酸取代(“YTE”)。参见美国专利第7,083,784号,其以全文引用的方式并入本文中。在某些延长半衰期实施方式中,IgG恒定域包含选自以下的取代:T250Q/M428L(Hinton等人,J.Immunology 176:346-356(2006));N434A(Yeung等人,J.Immunology 182:7663-7671(2009));或T307A/E380A/N434A(Petkova等人,International Immunology,18:1759-1769(2006))。
在一些实施方式中,抗IL-6R抗体的消除半衰期通过利用人类血清白蛋白的FcRN结合特性来增加。在某些实施方式中,抗体结合至白蛋白(Smith等人,Bioconjug.Chem.,12:750-756(2001))。在一些实施方式中,抗IL-6R抗体融合至细菌白蛋白结合域(Stork等人,Prot.Eng.Design Science 20:569-76(2007))。在一些实施方式中,抗IL-6抗体融合至白蛋白结合肽(Nguygen等人,Prot Eng Design Sel 19:291-297(2006))。在一些实施方式中,抗IL抗体为双特异性的,其中一种特异性针对IL-6R,且一种特异性针对人类血清白蛋白(Ablynx,WO 2006/122825(双特异性纳米抗体))。
在一些实施方式中,抗IL-6R抗体的消除半衰期通过以下增加:PEG化(Melmed等人,Nature Reviews Drug Discovery 7:641-642(2008));HPMA共聚物结合(Lu等人,Nature Biotechnology 17:1101-1104(1999));聚葡萄糖结合(Nuclear MedicineCommunications,16:362-369(1995));与高氨基酸聚合物(HAP;HAP化)的结合(Schlapschy等人,Prot Eng Design Sel 20:273-284(2007));或聚唾液酸化(Constantinou等人,Bioconjug.Chem.20:924-931(2009))。
在某些实施方式中,抗IL-6R抗体或其抗原结合部分包含托珠单抗的所有六个CDR。在特定实施方式中,抗体或其抗原结合部分包含托珠单抗重链V区及轻链V区。在具体实施方式中,抗体为全长托珠单抗抗体。
在某些实施方式中,抗IL-6R抗体或其抗原结合部分包含莎丽路单抗(sarilumab)的所有六个CDR。在特定实施方式中,抗体或其抗原结合部分包含莎丽路单抗重链V区及轻链V区。在具体实施方式中,抗体为全长莎丽路单抗抗体。
在某些实施方式中,抗IL-6R抗体或其抗原结合部分包含以下的所有六个CDR:VX30(Vaccinex)、ARGX-109(arGEN-X)、FM101(Formatech)、SA237(Roche)、NI-1201(NovImmune)或US 2012/0225060中所描述的抗体。
在某些实施方式中,抗IL-6R抗体或其抗原结合部分为单域抗体。在特定实施方式中,单域抗体为骆驼VHH单域抗体。在具体实施方式中,抗体为夫巴利珠单抗(ALX-0061)(Ablynx NV)。
5.7.3抗IL-6:IL-6R复合物抗体
在各种实施方式中,IL-6拮抗剂为对IL-6与IL-6R的复合物具有特异性的抗体。在某些实施方式中,抗体具有选自US 2011/0002936中所描述的那些抗体的抗体的六个CDR,该US 2011/0002936以全文引用的方式并入本文中。
5.7.4JAK及STAT抑制剂
已知IL-6经由JAK-STAT路径传信。
在各种实施方式中,IL-6拮抗剂为JAK信号转导路径的抑制剂。在一些实施方式中,JAK抑制剂为JAK1特异性抑制剂。在一些实施方式中,JAK抑制剂为JAK3特异性抑制剂。在一些实施方式中,JAK抑制剂为泛JAK抑制剂。
在某些实施方式中,JAK抑制剂选自下组:托法替尼(Xeljanz)、得森替尼、卢佐替尼、尤帕达替尼、巴瑞替尼、斐哥替尼、来妥替尼、帕瑞替尼、皮非替尼、INCB-039110、ABT-494、INCB-047986及AC-410。
在各种实施方式中,IL-6拮抗剂为STAT3抑制剂。在一具体实施方式中,抑制剂为AZD9150(AstraZeneca,Isis Pharmaceuticals)、STAT3反义分子。
5.7.5额外IL-6拮抗剂
在各种实施方式中,IL-6拮抗剂为拮抗剂肽。
在某些实施方式中,IL-6拮抗剂为C326(Avidia的IL-6抑制剂,也称为AMG220)或FE301,一种IL-6的重组蛋白抑制剂(Ferring International Center S.A.,ConarisResearch Institute AG)。在一些实施方式中,抗IL-6拮抗剂包含可溶性gp130、FE301(Conaris/Ferring)。
5.8给药方案
5.8.1抗体、抗原结合片段、肽
在典型实施方式中,抗体、抗原结合片段及肽IL-6拮抗剂非经肠给予。
在一些非经肠实施方式中,IL-6拮抗剂经静脉内给予。在某些静脉内实施方式中,IL-6拮抗剂以药团形式给予。在某些静脉内实施方式中,IL-6拮抗剂以输液形式给予。在某些静脉内实施方式中,IL-6拮抗剂以药团形式、随后以输液形式给予。在一些非经肠实施方式中,IL-6拮抗剂经皮下给予。
在各种实施方式中,抗体、抗原结合片段或肽IL-6拮抗剂以不依赖患者体重或表面积的剂量(均一剂量)给予。
在一些实施方式中,静脉内均一剂量为1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg或10mg。在一些实施方式中,静脉内均一剂量为11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg或20mg。在一些实施方式中,静脉内均一剂量为25mg、30mg、40mg或50mg。在一些实施方式中,静脉内均一剂量为60mg、70mg、80mg、90mg或100mg。在一些实施方式中,静脉内均一剂量为1-10mg、10-15mg、15-20mg、20-30mg、30-40mg或40-50mg。在一些实施方式中,静脉内均一剂量为1-40mg或50-100mg。
在一些实施方式中,皮下均一剂量为10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg或100mg。在一些实施方式中,皮下均一剂量为110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg或200mg。在一些实施方式中,皮下均一剂量为210mg、220mg、230mg、240mg或250mg。在一些实施方式中,皮下均一剂量为10-100mg、100-200mg或200-250mg。在一些实施方式中,皮下均一剂量为10-20mg、20-30mg、30-40mg、40-50mg、50-60mg、60-70mg、70-80mg、80-90mg或90-100mg。在一些实施方式中,皮下均一剂量为100-125mg、125-150mg、150-175mg、175-200mg或200-250mg。
在各种实施方式中,抗体、抗原结合片段或肽IL-6拮抗剂以基于患者体重的剂量给予。
在一些实施方式中,拮抗剂以0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg或1.0mg/kg的静脉内剂量给予。在一些实施方式中,拮抗剂以1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg或5mg/kg的剂量给予。
在一些实施方式中,皮下的基于体重的剂量为0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg或1.0mg/kg。在一些实施方式中,拮抗剂以1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg或5mg/kg的剂量给予。
在各种静脉内实施方式中,IL-6拮抗剂每7天给予一次、每14天给予一次、每21天给予一次、每28天给予一次或一月给予一次。在各种皮下实施方式中,IL-6拮抗剂每14天给予一次、每28天给予一次、一月给予一次、每两个月(每隔一个月)给予一次或每三个月给予一次。
在某些较佳实施方式中,IL-6拮抗剂为MEDI5117抗体。在各种实施方式中,MEDI5117以1-30mg的均一剂量每周一次IV给予。在某些实施方式中,MEDI5117抗体以1、2、3、4、5、7.5、10、15、20、25或30mg的均一剂量每周一次IV给予。在一些实施方式中,MEDI5117抗体以25-250mg的均一剂量每月一次至每三个月一次s.c.给予。在特定实施方式中,MEDI5117以30mg、45mg、60mg、75mg、100mg、120mg、125mg、150mg、175mg、200mg、225mg、240mg或250mg的剂量每月一次、每两个月一次或每3个月一次s.c.给予。
在一些实施方式中,IL-6拮抗剂为托珠单抗。在各种实施方式中,针对≥100kg的患者,托珠单抗以162mg的起始剂量每周一次s.c.给予。在一些实施方式中,基于临床反应,托珠单抗以4mg/kg剂量每4周一次、随后升高至8mg/kg每4周一次静脉内给予。
5.8.2JAK及STAT抑制剂
在典型实施方式中,小分子JAK抑制剂及STAT抑制剂经口给予。
在各种实施方式中,抑制剂以1-10mg、10-20mg、20-30mg、30-40mg或40-50mg的口服剂量一天一次或两次给予。在一些实施方式中,抑制剂以50-60mg、60-70mg、70-80mg、80-90mg或90-100mg的剂量一天一次或两次给予。在一些实施方式中,抑制剂以5、10、15、20、25、30、35、40、45或50mg的剂量一天一次或两次PO给予。在一些实施方式中,抑制剂以75mg剂量PO QD或BID给予,以100mg剂量PO QD或BID给予。
在某些实施方式中,JAK抑制剂为托法替尼,且以5mg剂量PO BID给予,或以11mg剂量PO QD给予。
在某些实施方式中,JAK抑制剂为得森替尼,且以25mg、50mg、100mg或150mg的剂量PO BID给予。
在某些实施方式中,抑制剂为卢佐替尼,且以25mg剂量PO BID给予,以20mg剂量POBID给予,以15mg剂量PO BID给予,以10mg剂量PO BID给予或以5mg剂量PO BID给予。
5.9其他治疗剂
在本文中所描述的方法的各种实施方式中,方法进一步包含给予除IL-6拮抗剂的外的治疗剂,其中第二治疗剂也能够降低海帕西啶表达。
在一些实施方式中,第二治疗剂为BMP拮抗剂。在某些实施方式中,BMP拮抗剂为抗BMP6抗体。在特定实施方式中,抗BMP6抗体具有US 2016/0176956或US 2016/0159896中所描述的抗体的六个CDR,所述案的揭示内容以全文引用的方式并入本文中。
在某些实施方式中,第二治疗剂为铁调素调节蛋白拮抗剂。在特定实施方式中,铁调素调节蛋白拮抗剂为抗铁调素调节蛋白抗体。在具体实施方式中,抗铁调素调节蛋白抗体具有Kovac等人,Haematologica(2016)doi:10.3324/haematol.2015.140772[印刷的前的电子版]中所揭示的抗体的六个CDR。
在某些实施方式中,第二治疗剂为海帕西啶拮抗剂。在特定实施方式中,海帕西啶拮抗剂为抗海帕西啶抗体。在具体实施方式中,抗体具有US2016/0017032中所描述的抗体的六个CDR,该案的揭示内容以全文引用的方式并入本文中。
5.10试剂盒
在另一方面中,提供试剂盒。
在典型实施方式中,试剂盒提供试剂以自获自患者的生物样品确定患者的TMPRSS6 SNP rs855791位置处的基因型。
5.11其他方面及实施方式
5.11.1治疗慢性肾病或心血管疾病中的炎性的方法
在其他方面及实施方式中,提供用于用IL-6拮抗剂表征且治疗慢性肾病或心血管疾病中的炎性的组合物及方法,以及用于表征患者对治疗的反应的方法。
这些方面及实施方式至少部分基于以下发现:具有在核苷酸位置2321处包含G或C的TMPRSS6的一或多个等位基因(编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽)的慢性肾病患者及心血管疾病患者的炎性使得这些患者具有较高死亡风险,且此类个体可用IL-6拮抗剂治疗以降低此风险。如下文更详细报导,将慢性肾病患者基因分型,分析IL-6及CRP的血清含量,且将这些诊断数据与所给予的EPO给药及死亡风险相比。具有在核苷酸位置2321处包含G或C的TMPRSS6的一或多个等位基因(编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽),及升高的IL-6及/或CRP含量的患者需要更高的EPO剂量来治疗,且具有较高死亡率。已显示在鉴别患有缺铁性贫血的患者中,此位置处的核苷酸很重要(参见Finberg等人,Nat.Genet.2008;40(5):569-571,将其提示且关于序列、变体、命名法等的全部内容特此以全文引用的方式并入)。这些数据强烈地支持基于TMPRSS6基因型鉴别患者子集,其需要较高的EPO剂量及/或具有较高死亡风险,且在存在或不存在用于治疗贫血(例如与慢性肾病相关)的标准疗法下将可能对IL-6抑制起反应。通过抑制炎性,可减少EPO给药,从而避免EPO的不利副作用(例如心血管风险)。
这些方面及实施方式进一步基于以下发现:具有在核苷酸位置2321处包含G或C的TMPRSS6的一或多个等位基因(编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽)的患者处于与心肌梗塞或心血管疾病相关的更高的死亡风险下。这些患者将也可能受益于IL-6抑制,其将降低炎性及增加的风险。
因此,提供以下治疗方法:通过抑制例如在通过SNP rs855791处的TMPRSS6基因分型而选择的患者中的IL-6生物活性,通过阻断IL-6或其受体(gp80)彼此结合,或阻断其信号转导或表达(例如通过抗IL-6抗体或通过抗IL-6R抗体或JAK1/STAT3抑制),来治疗与心血管疾病或慢性肾病(包括慢性肾病贫血)相关的炎性,及/或降低与此类病状相关的死亡风险。在一个实施方式中,慢性肾病的治疗在存在或不存在用于贫血的标准治疗以及以下方法下进行:例如通过对SNP rs855791处的TMPRSS6基因分型且检测炎性标志物的含量(例如增加的IL-6及/或CRP血清含量),来表征罹患慢性肾病的患者对用于贫血的治疗的反应。
提供通过给予抑制IL-6生物活性或表达的药剂来治疗心血管疾病或慢性肾病贫血及/或降低与此类患者的慢性炎性相关的死亡的方法。
在一些方面及实施方式中,提供用于治疗促进患有慢性肾病或心血管疾病的个体的死亡的慢性炎性,且用于表征患者对此类疗法的反应的组合物及方法。在特定实施方式中,提供用于表征且治疗慢性炎性贫血及死亡(例如在慢性肾病中)以及用于表征患者对用于贫血的治疗(例如给予红细胞生成素或红细胞生成刺激剂)的反应的方法。在一个方面中,提供治疗经选择个体的慢性炎性的方法,方法包含向个体给予IL-6拮抗剂,其中针对治疗,个体通过具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因经选择。
在另一方面中,提供用于治疗患有心血管疾病或慢性肾病的经选择个体的炎性或慢性炎性的方法,方法涉及向个体给予IL-6拮抗剂(例如抗IL-6抗体),其中针对治疗,个体通过具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因经选择。在一个实施方式中,方法降低个体的死亡风险。在一个实施方式中,个体具有心肌梗塞或心脏衰竭的病史。
在另一方面中,提供降低患有心血管疾病或肾病的经选择个体的炎性及死亡风险的方法,方法包含向个体给予IL-6拮抗剂(例如抗IL-6抗体),其中个体经选择为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因,且相对于参照患有增加的炎性。在一个实施方式中,个体具有心肌梗塞或心脏衰竭的病史。
在另一方面中,提供用于降低患有慢性肾病或心脏衰竭的个体的死亡风险的方法,方法包含向个体给予IL-6拮抗剂,其中个体经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因,且相对于参照患有增加的炎性。
在另一方面中,提供治疗个体的贫血的方法,方法涉及向个体给予单独或与用于贫血的疗法组合的IL-6拮抗剂,其中个体经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽(也称为间质蛋白酶-2;MT2)的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C),且相对于参照患有增加的炎性。
在另一方面中,提供治疗患有增加的炎性的个体的贫血的方法,方法涉及以有效地中和个体的炎性的量给予单独或与促红细胞形成因子组合的IL-6拮抗剂(例如IL-6抗体),该个体具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C)。
在再一方面中,提供在鉴别为有需要的个体中增强对EPO的反应的方法,方法包含以有效地中和个体的炎性的量给予IL-6拮抗剂(例如IL-6抗体),从而减少EPO剂量,该个体具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C)。
在另一方面中,提供降低患有增加的炎性的个体的死亡的方法,方法涉及以有效地中和个体的炎性的量给予IL-6拮抗剂,该个体具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C)。
在又一方面中,提供为鉴别为有需要的个体选择疗法的方法,方法涉及:表征以下个体:具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C);及检测一或多种炎性标志物IL-6或CRP的含量,其中表征指示IL-6拮抗剂应单独或与用于贫血的疗法组合给予。
在又一方面中,提供用于增加鉴别为有需要的个体中的红细胞或其祖细胞(例如造血干细胞、前红细胞母细胞、红细胞母细胞或网状红细胞)的增殖或存活的方法,方法包含向个体给予IL-6拮抗剂及促红细胞形成因子,其中个体经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C),且相对于参照患有增加的炎性。
在本文中所叙述方面中的任一者的各种实施方式中,个体患有或经鉴别为患有贫血,包括癌症贫血、慢性自体免疫疾病中的贫血、慢性炎性疾病中的贫血、心血管疾病中的贫血、代谢综合征中的贫血及其类似贫血。在本文中所叙述方面中的任一者的各种实施方式中,个体患有或经鉴别为患有慢性肾病。在本文中所叙述方面中的任一者的各种实施方式中,个体患有或经鉴别为患有炎性。在本文中所叙述方面中的任一者的各种实施方式中,个体具有或经鉴别为具有增加的与慢性炎性、慢性肾病或心血管疾病相关的死亡风险。在本文中所叙述方面中的任一者的各种实施方式中,个体经鉴别为需要治疗。在本文中所叙述方面中的任一者的各种实施方式中,个体患有或经鉴别为患有增加的炎性。在本文中所叙述方面中的任一者的各种实施方式中,个体具有或经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因(例如在TMPRSS6核酸分子的核苷酸位置2321处具有G或C),且相对于参照患有增加的炎性。在本文中所叙述方面中的任一者的各种实施方式中,方法包含向个体给予IL-6拮抗剂。在本文中所叙述方面中的任一者的各种实施方式中,方法包含向个体给予IL-6拮抗剂及用于贫血的疗法。在本文中所叙述方面中的任一者的各种实施方式中,个体为人类。
在本文中所叙述方面中的任一者的各种实施方式中,用于贫血的疗法包含给予促红细胞形成因子。在各种实施方式中,促红细胞形成因子为红细胞生成素、红细胞生成刺激剂、HIF安定剂及补充铁中的一或多种。
在各种实施方式中,增加的炎性的特征在于相对于参照组,增加的IL-6及/或CRP含量(例如如通过习知CRP分析或高敏感性分析(hsCRP)所测量,以上两者检测CRP,但在分析效能方面不同)。在各种实施方式中,增加的炎性表征为IL-6大于约5pg/ml。在各种实施方式中,增加的炎性表征为CRP大于约2mg/L。
在本文中所叙述方面中的任一者的各种实施方式中,IL-6拮抗剂以有效地中和炎性的量给予。在各种实施方式中,有效地中和炎性的量使IL-6降低至小于约15pg/ml、小于约10pg/ml或小于约5pg/ml。在各种实施方式中,有效地中和炎性的量使CRP降低至小于约2mg/L或小于约0.2mg/L。
在本文中所叙述方面中的任一者的各种实施方式中,给予IL-6拮抗剂或抗IL-6抗体减少EPO的剂量。在某些实施方式中,EPO的剂量减少约40IU/kg/周、约50IU/kg/周、约80IU/kg/周、约100IU/kg/周或大于100IU/kg/周。在各种实施方式中,给予IL-6拮抗剂或抗IL-6抗体降低经增加的EPO剂量的副作用。
在一个实施方式中,在存在或不存在用于贫血的标准治疗下治疗患有慢性肾病的患者。详言的,在存在或不存在用于贫血的治疗(例如给予EPO、ESA、HIF安定剂、补充铁或红细胞输注)下,向患有与慢性肾病相关的贫血的个体提供抑制IL-6生物活性或表达的药剂。用于贫血的治疗通过刺激红细胞生成或红细胞产生起作用。因此,也可给予增加红细胞或其祖细胞的生长或增殖及/或降低红细胞或其祖细胞的细胞死亡的药剂。红细胞祖细胞包括例如造血干细胞、常见骨髓祖细胞、前红细胞母细胞、红细胞母细胞、网状红细胞或能够分化或成熟化成红细胞的任何细胞。
通过阻断IL-6或其受体(gp80)彼此结合或阻断其信号转导或表达来抑制IL-6生物活性的药剂可以医药组合物形式提供至患有与慢性肾病相关的贫血的个体,其中医药组合物包含有效量的药剂、用于治疗贫血的药剂(例如EPO、ESA、HIF脯胺酰基-羟化酶抑制剂、补充铁)及适合的赋形剂。在一个实施方式中,药剂为降低个体中的IL-6多肽或核酸分子的含量或活性、或抑制通过IL-6受体活化触发的胞内信号转导的IL-6拮抗剂或抗IL-6抗体。抗IL-6抗体(例如MEDI5117)可与用于贫血的治疗(例如给予EPO、ESA、HIF安定剂、补充铁)组合而给予。用于贫血的治疗的方法视患者的TMPRSS6基因型及患者的炎性状态而变化。在用于贫血的治疗(例如给予EPO、ESA、HIF安定剂、补充铁)的情况下,针对在核苷酸位置2321处包含G或C的TMPRSS6的主要等位基因(编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽)为纯合或杂合的且具有升高的炎性标志物(例如IL-6及/或CRP)含量的患者经给予IL-6拮抗剂或抗IL-6抗体,其降低IL-6多肽的含量或活性。针对在核苷酸位置2321处包含A或T的TMPRSS6的次要等位基因(编码在氨基酸位置736处包含缬胺酸的TMPRSS6多肽)为纯合的患者不需要抗IL-6疗法来补充用于贫血的治疗。用于贫血的治疗的方法可视慢性肾病的阶段、患者年龄、健康状况及身体条件而变化。
在另一方面中,提供适用于表征患有与慢性炎性相关的贫血(例如在慢性肾病中)的个体的分析。炎性标志物IL-6及CRP可通过任何适合的方法检测。本文中所描述的方法可个别地或以组合形式使用以用于检测IL-6或CRP生物标志物及/或炎性病状。在一个实施方式中,相对于参照(例如来自健康对照个体的血清)的表达,炎性通过检测个体的生物样品(例如血清)中的IL-6及/或CRP多肽的含量来表征,其中IL-6及/或CRP表达的增加指示炎性。在另一实施方式中,IL-6及/或CRP表达的增加指示患有与慢性肾病相关的贫血的个体将不对用于贫血的治疗起反应,及/或当与IL-6拮抗剂(例如抗IL-6抗体)组合给予时,将对用于贫血的治疗起反应。
在一个实施方式中,IL-6及/或CRP多肽含量通过免疫分析来测量。免疫分析通常使用抗体(或特异性结合标志物的其他药剂)以检测生物标志物在样品中的存在或含量。抗体可通过此项技术中熟知的方法(例如通过使具有生物标志物或其片段的动物免疫)来制备。生物标志物可基于其结合特征自样品分离。或者,若多肽生物标志物的氨基酸序列为已知的,则多肽可经合成且用以通过此项技术中熟知的方法产生抗体。
在各种实施方式中,使用传统的免疫分析,包括例如Western印迹法;夹心免疫分析,包括ELISA及其他酶免疫分析;基于荧光的免疫分析及化学发光。浊度测定法为在液相中进行的分析,其中抗体在溶液中。抗原与抗体的结合导致吸亮度变化,测量该吸亮度。其他形式的免疫分析包括磁性免疫分析、放射免疫分析及实时免疫定量PCR(iqPCR)。其他检测方法包括液相层析及质谱分析。
可在固体基板(例如芯片、珠粒、微流体平台、膜)上或在任何支持抗体与标志物结合及后续检测的其他形式上进行免疫分析。可一次检测单一标志物或可使用多重格式。多重免疫分析可能涉及平面微阵列(蛋白质芯片)及基于珠粒的微阵列(悬浮阵列)。
选择患有鉴别为具有增加的IL-6及/或CRP多肽含量的贫血的慢性肾病患者用于使用降低IL-6表达或活性的药剂(例如抗IL-6抗体)的治疗与贫血的治疗组合。用本发明方法治疗的患者可通过检测治疗后血红素、血细胞比容、红细胞生成素剂量、IL-6及/或CRP表达的变化来监测。显示IL-6及/或CRP表达降低及/或炎性降低的患者经鉴别为对IL-6抑制起反应。
其他方面及实施方式提供于以下编号条项中。
1.一种治疗经选择个体的慢性炎性的方法,该方法包含向个体给予IL-6拮抗剂,其中选择治疗的个体具有一或多个编码包含丙胺酸在氨基酸位置736的TMPRSS6多肽的等位基因。
2.一种治疗患有心血管疾病、心脏衰竭及/或慢性肾病的经选择个体的炎性的方法,该方法包含向个体给予IL-6拮抗剂,其中选择治疗的个体具有一或多个编码包含丙胺酸在氨基酸位置736的TMP RSS6多肽的等位基因。
3.一种降低患有心血管疾病、心脏衰竭及/或慢性肾病的经选择个体的炎性及死亡风险的方法,该方法包含向个体给予IL-6拮抗剂,其中个体经选择为具有一或多个编码包含丙胺酸在氨基酸位置736的TMPRSS6多肽的等位基因,且相对于参照者患有增加的炎性。
4.一种治疗患有慢性肾病的个体的贫血的方法,该方法包含向个体给予IL-6拮抗剂,其中个体经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因,且相对于参照患有增加的炎性。
5.如条项1至4中任一项所述的方法,其中IL-6拮抗剂以有效地中和炎性的量给予。
6.如条项1至4中任一项所述的方法,其中IL-6拮抗剂为抗IL-6抗体。
7.如条项5所述的方法,其中该方法进一步包含向个体给予促红细胞形成因子。
8.如条项1至4中任一项所述的方法,其中该方法降低个体的死亡风险。
9.一种降低患有慢性肾病或心脏衰竭的个体的死亡风险的方法,该方法包含向个体给予IL-6拮抗剂,其中个体经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因,且相对于参照患有增加的炎性。
10.一种治疗患有增加的炎性的个体的贫血的方法,该方法包含:
以有效地中和个体的炎性的量给予促红细胞形成因子及抗IL-6抗体,该个体具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因。
11.如条项1至10中任一项所述的方法,其中增加的炎性的特征在于相对于参照增加的IL-6及/或CRP含量。
12.如条项11所述的方法,其中增加的炎性表征为IL-6大于约5pg/ml、约10pg/ml或约15pg/ml。
13.如条项10所述的方法,其中增加的炎性表征为CRP大于约2mg/L。
14.如条项10所述的方法,其中促红细胞形成因子为红细胞生成素、红细胞生成刺激剂、HIF安定剂及补充铁中的一或多种。
15.一种在鉴别为有需要的个体中增强对EPO的反应的方法,该方法包含以有效地中和个体的炎性的量给予IL-6拮抗剂或抗IL-6抗体,从而增强个体对EPO的反应,该个体具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因。
16.如条项15所述的方法,其中有效地中和炎性的抗IL-6抗体的量使IL-6降低至小于约15pg/ml、小于约10pg/ml或小于约5pg/ml。
17.如条项16所述的方法,其中有效地中和炎性的IL-6拮抗剂或抗IL-6抗体的量使CRP降低至小于约2mg/L。
18.如条项15所述的方法,其中给予IL-6拮抗剂或抗IL-6抗体减少EPO的剂量。
19.如条项17所述的方法,其中EPO的剂量减少约40IU/kg/周、约50IU/kg/周、约80IU/kg/周、约100IU/kg/周或大于100IU/kg/周。
20.如条项15所述的方法,其中给予IL-6拮抗剂或抗IL-6抗体降低经增加EPO的副作用。
21.一种为鉴别为有需要的个体选择疗法的方法,该方法包含:
a)将个体表征为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因;及
b)检测一或多种炎性标志物IL-6及CRP的含量,其中表征指示IL-6拮抗剂应与用于贫血的疗法组合给予。
22.如条项21所述的方法,其中该方法进一步包含向个体给予IL-6拮抗剂及用于贫血的疗法。
23.如条项21所述的方法,其中用于贫血的疗法包含给予促红细胞形成因子。
24.一种用于增加鉴别为有需要的个体中的红细胞或其祖细胞的增殖或存活的方法,该方法包含向个体给予IL-6拮抗剂及促红细胞形成因子,其中个体经鉴别为具有编码在氨基酸位置736处包含丙胺酸的TMPRSS6多肽的一或多个等位基因,且其中个体相对于参照患有增加的炎性。
25.如条项24所述的方法,其中该方法降低红细胞或其祖细胞的细胞死亡。
26.如条项24所述的方法,其中祖细胞为造血干细胞、前红细胞母细胞、红细胞母细胞或网状红细胞。
27.如条项15至24中任一项所述的方法,其中个体患有慢性肾病。
28.如条项15至24中任一项所述的方法,其中个体患有贫血。
29.如条项28所述的方法,其中贫血为癌症贫血、慢性自体免疫疾病中的贫血、慢性炎性疾病中的贫血或代谢综合征中的贫血。
30.如条项15至24中任一项所述的方法,其中IL-6拮抗剂以有效地中和炎性的量给予。
31.如条项15至24中任一项所述的方法,其中IL-6拮抗剂为抗IL-6抗体。
32.如条项15至24中任一项所述的方法,其中增加的炎性的特征在于相对于参照增加的IL-6及/或CRP含量。
33.如条项15至24中任一项所述的方法,其中增加的炎性表征为IL-6大于约5pg/ml、约10pg/ml或约15pg/ml。
34.如条项15至24中任一项所述的方法,其中增加的炎性表征为CRP大于约2mg/L。
35.如条项15至24中任一项所述的方法,其中有效地中和炎性的量使IL-6降低至小于约10pg/ml或小于约5pg/ml。
36.如条项15至24中任一项所述的方法,其中有效地中和炎性的量使CRP降低至小于约2mg/L。
37.如条项15至24中任一项所述的方法,其中促红细胞形成因子为红细胞生成素、红细胞生成刺激剂、HIF安定剂及补充铁中的一或多种。
38.如条项24所述的方法,其中给予IL-6拮抗剂减少EPO的剂量。
39.如条项38所述的方法,其中IL-6拮抗剂为抗IL-6抗体。
40.如条项38所述的方法,其中EPO的剂量减少约40IU/kg/周、约50IU/kg/周、约80IU/kg/周、约100IU/kg/周或大于100IU/kg/周。
41.如条项23所述的方法,其中给予IL-6拮抗剂降低经增加EPO的副作用。
42.如条项1至40中任一项所述的方法,其中等位基因在TMPRSS6聚核苷酸的2321位置处包含G。
43.如条项1至42中任一项所述的方法,其中IL-6拮抗剂为具有一或多个选自以下核酸序列的CDR的抗IL-6抗体:
SNYMI(SEQ ID NO:12);
DLYYYAGDTYYADSVKG(SEQ ID NO:13);
WADDHPPWIDL(SEQ ID NO:14);
RASQGISSWLA(SEQ ID NO:15);
KASTLES(SEQ ID NO:16);及
QQSWLGGS(SEQ ID NO:17)。
44.如条项42所述的方法,其中抗IL-6抗体具有包含序列SNYMI(SEQ ID NO:12)的重链CDR1;包含序列DLYYYAGDTYYADSVKG(SEQ ID NO:13)的重链CDR2;包含序列WADDHPPWIDL(SEQ ID NO:14)的重链CDR3;包含序列RASQGISSWLA(SEQ ID NO:15)的轻链CDR1;包含序列(SEQ ID NO:16)的轻链CDR2;及包含序列QQSWLGGS(SEQ ID NO 17)的轻链CDR3。
45.如条项42所述的方法,其中抗IL-6抗体具有包含以下序列的重链:
46.如条项42所述的方法,其中抗IL-6抗体具有包含以下序列的轻链:
47.如条项42所述的方法,其中抗IL-6抗体为MEDI5117。
48.如条项1至47中任一项所述的方法,其中个体为人类。
5.11.2用于治疗心肾综合征的方法
在其他方面及实施方式中,提供用于治疗心肾综合征的组合物及方法。
这些方面及实施方式至少部分地基于以下发现:心肾综合征的啮齿动物模型中心脏损伤的抗IL-6治疗具有与标准护理治疗等效的作用。如下文更详细报导,心肌梗塞后,心肾综合征的啮齿动物模型用抗IL-6或标准护理疗法(ACE抑制剂、培哚普利)治疗。治疗后,测量心脏组织中的射血分数、心肌收缩力及纤维化组织的百分比。与用对照治疗剂治疗的个体组中的含量相比,用抗IL-6治疗的个体组及用标准护理疗法治疗的个体组中的射血分数的程度均增加。与用对照治疗剂治疗的个体组中的含量相比,用抗IL-6治疗的组及用标准护理疗法治疗的组中的心肌收缩性均增加。与用对照治疗剂治疗的个体组中的量相比,用抗IL-6治疗的组及用标准护理疗法治疗的组中的纤维化组织的量均减少。此外,在用抗IL-6治疗的个体组及用标准护理疗法治疗的个体组中,射血分数的程度及纤维化组织的量类似。结果表明在治疗啮齿动物模型中的心肾综合征中,抗IL-6疗法具有与标准护理疗法等效的功效。
这些方面及实施方式进一步至少部分地基于以下发现:鉴别为在心肌梗塞后患有心肾综合征且具有升高的IL-6含量的患者尤其具有增加的心血管死亡(包括心脏衰竭)风险。不受理论束缚,IL-6可在心肾综合征的发展及/或进程中起病因作用。因此心肌梗塞后具有升高的IL-6含量的患者或患有心肾综合征及升高的IL-6含量的患者将可能受益于IL-6抑制。
因此,提供用于治疗患有心肾综合征的个体的心脏及/或肾损伤的治疗方法,其涉及向个体给予IL-6拮抗剂。在一些实施方式中,在存在或不存在用于心肾综合征的标准治疗下,为患有心肾综合征的个体的心脏及/或肾损伤进行治疗。也提供用于表征心肌梗塞后患者的心血管死亡风险的方法,该方法涉及在获自该患者的生物样品中检测IL-6含量的增加。
在一个方面中,提供治疗患有心肾综合征的个体的心脏及/或肾损伤的方法,该方法涉及向个体给予IL-6拮抗剂。
在另一方面中,提供增加患有心肾综合征的个体的心脏功能的方法,该方法涉及向个体给予IL-6拮抗剂。
在再一方面中,提供降低患有心肾综合征的个体的纤维化的方法,该方法涉及向个体给予IL-6拮抗剂。
在本文中所叙述方面中的任一者的各种实施方式中,该方法进一步涉及向个体给予标准护理疗法。在各种实施方式中,标准护理疗法为血管收缩素转化酶(ACE)抑制剂。
在本文中所叙述方面中的任一者的各种实施方式中,心脏功能增加的特征在于相对于参照组,个体的射血分数及/或心肌收缩力的增加。在本文中所叙述方面中的任一者的各种实施方式中,纤维化降低的特征在于相对于参照组,来自个体的组织样品中纤维化组织的百分比的降低。在各种实施方式中,纤维化系在心脏组织中。
在本文中所叙述方面中的任一者的各种实施方式中,个体患有心脏及/或肾损伤。在本文中所叙述方面中的任一者的各种实施方式中,个体患有心脏损伤,随后患有肾损伤。
在另一方面中,本发明提供一种在个体中鉴别心肌梗塞后个体的心血管死亡(例如心脏衰竭)风险增加的方法,该方法涉及相对于参照组,测量来自个体的样品中IL-6聚核苷酸或多肽中的一或多种的含量,其中IL-6聚核苷酸或多肽中的一或多种的含量增加时,指示心血管死亡风险增加。
在再一方面中,本发明提供一种在个体中表征心肌梗塞后个体的心血管死亡(例如心脏衰竭)风险的方法,该方法涉及测量相对于参照来自个体的样品中IL-6聚核苷酸或多肽中的一或多种的含量,其中增加的IL-6聚核苷酸或多肽中的一或多种的含量指示增加的心血管死亡风险。
在本文中所叙述方面中的任一者的各种实施方式中,个体患有心肾综合征、心脏衰竭、慢性肾病或无心肾病变。在本文中所叙述方面中的任一者的各种实施方式中,个体经鉴别为在心肌梗塞后约一个月患有心肾综合征、心脏衰竭、慢性肾病或无心肾病变。
在另一方面中,本发明提供一种治疗患有心肾综合征的经选择个体的心脏及/或肾损伤的方法,该方法涉及向个体给予IL-6拮抗剂,其中针对治疗,个体通过检测相对于参照来自个体的生物样品中增加的IL-6聚核苷酸或多肽中的一或多种的含量经选择。
在再一方面中,本发明提供一种降低患有心肾综合征的经选择个体的心血管死亡(例如心脏衰竭)风险的方法,该方法涉及向个体给予IL-6拮抗剂,其中个体通过检测相对于参照来自个体的生物样品中增加的IL-6聚核苷酸或多肽中的一或多种的含量来选择。在本文中所叙述方面中的任一者的各种实施方式中,个体患有心肌梗塞。
在本文中所叙述方面中的任一者的各种实施方式中,IL-6拮抗剂为抗IL-6抗体。在各种实施方式中,抗IL-6抗体为MEDI5117。
在本文中所叙述方面中的任一者的各种实施方式中,生物样品为血浆样品或血清样品。在本文中所叙述方面中的任一者的各种实施方式中,个体为人类。
在另一方面中,提供用于通过给予抑制IL-6生物活性或表达的药剂,来治疗患者的心肾综合征及/或降低此类患者的死亡或心脏衰竭风险的方法。在一个实施方式中,在存在或不存在用于心肾综合征的标准治疗(例如血管收缩素转化酶(ACE)抑制剂)下治疗患有心肾综合征的患者。详言的,将抑制IL-6生物活性或表达的药剂提供至患有心肾综合征的个体(例如给予抗IL-6抗体)。
在另一方面中,提供在患有心肾综合征的个体中增加心脏功能的方法及降低纤维化的方法。方法包含向个体给予抑制IL-6生物活性或表达的药剂。在一些实施方式中,心脏功能增加的特征在于相对于参照(例如健康对照个体的射血分数),个体射血分数的增加,或相对于参照(例如健康对照个体的心肌收缩性),心肌收缩性(例如dP/dt
通过阻断IL-6或其受体(gp80)彼此结合或阻断其信号转导或表达来抑制IL-6生物活性的药剂可以医药组合物形式提供至患有心肾综合征的个体,其中医药组合物包含有效量的药剂及适合的赋形剂。在一个实施方式中,药剂为降低个体中的IL-6多肽或聚核苷酸的含量或活性、或抑制通过IL-6受体活化触发的胞内信号转导的IL-6拮抗剂或抗IL-6抗体。可给予抗IL-6抗体(例如MEDI5117)。用于心肾综合征的治疗的方法可视心肾综合征的阶段、患者年龄、健康状况及物理条件而变化。
在各种实施方式中,用IL-6拮抗剂治疗患有心肾综合征的个体。此外,心肌梗塞后具有增加的心血管死亡及/或心脏衰竭的风险的个体可通过表征个体中的血浆IL-6含量来鉴别。具有升高的IL-6含量的个体具有增加的心血管死亡及/或心脏衰竭的风险。对于用IL-6拮抗剂进行的治疗,可选择此类个体。另外,可选择患有心肾综合征且具有增加的IL-6含量的个体,包括已罹患心肌梗塞的此类个体,以用于治疗。为治疗选择后,此类个体可经给予此项技术中已知的几乎任何的IL-6拮抗剂。适合的IL-6拮抗剂包括例如IL-6拮抗剂、商业上可获得的IL-6拮抗剂、使用此项技术中熟知的方法开发的IL-6拮抗剂,及针对与IL-6R相关的胞内信号转导系统的拮抗剂。
在另一方面中,提供用于表征心肌梗塞后个体的心血管死亡、心脏衰竭及/或死亡的风险的分析。分析提供对获自个体的生物样品中的IL-6的检测。IL-6可通过任何适合的方法检测。在一个实施方式中,心血管死亡或心脏衰竭的风险通过检测相对于参照(例如来自健康对照个体或来自不具有心-肾病变的对照个体的血清或血浆)中的表达,个体的生物样品(例如血清或血浆)中的IL-6多肽含量来表征,其中IL-6的增加指示增加的心血管死亡或心脏衰竭的风险。可选择鉴别为具有增加的心血管死亡、心脏衰竭或死亡的风险的个体以用于治疗。在另一实施方式中,对于用IL-6拮抗剂(例如抗IL-6抗体)进行的治疗,选择患有心肾综合征且具有增加的IL-6含量的个体。
在一个实施方式中,测量IL-6聚核苷酸含量。IL-6聚核苷酸的含量可通过标准方法测量,所述标准方法诸如定量PCR、Northern印迹法、微阵列、质谱分析及原位杂交。
在一个实施方式中,测量IL-6多肽含量。IL-6多肽的含量可通过标准方法(诸如通过免疫分析)测量。免疫分析通常使用抗体(或特异性结合标志物的其他药剂)以检测生物标志物在样品中的存在或含量。抗体可通过此项技术中熟知的方法(例如通过使具有生物标志物或其片段的动物免疫)来制备。生物标志物可基于其结合特征自样品分离。或者,若多肽生物标志物的氨基酸序列为已知的,则多肽可经合成且用以通过此项技术中熟知的方法产生抗体。
在各种实施方式中,分析采用传统的免疫分析,包括(例如)Western印迹法;夹心免疫分析,包括ELISA及其他酶免疫分析;基于荧光的免疫分析及化学发光。浊度测定法为在液相中完成的分析,其中抗体在溶液中。抗原与抗体的结合导致吸亮度的变化,该吸亮度经测量。其他形式的免疫分析包括磁性免疫分析、放射免疫分析及实时免疫定量PCR(iqPCR)。其他检测方法包括液相层析及质谱分析。
可在固体基板(例如芯片、珠粒、微流体平台、膜)上或在支持抗体与标志物的结合及后续检测的任何其他形式上进行免疫分析。可一次检测单标志物或可使用多重形式。多重免疫分析可涉及平面微阵列(蛋白质芯片)及基于珠粒的微阵列(悬浮阵列)。
对于用降低IL-6表达或活性的药剂(例如抗IL-6抗体)进行的治疗,选择经鉴别为具有增加的IL-6多肽含量的心肾综合征患者。治疗剂可与用于心肾综合征的标准治疗(例如ACE抑制剂)组合给予。用本发明方法治疗的患者可通过检测治疗后IL-6的变化来监测。
其他方面及实施方式提供于以下经编号条项中。
1.一种治疗患有心肾综合征的个体的心脏及/或肾损伤的方法,该方法包含向个体给予IL-6拮抗剂。
2.一种增加患有心肾综合征的个体的心脏功能的方法,该方法包含向个体给予IL-6拮抗剂。
3.一种降低患有心肾综合征的个体的纤维化的方法,该方法包含向个体给予IL-6拮抗剂。
4.如条项2所述的方法,其中心脏功能增加的特征在于相对于参照组,个体射血分数的增加。
5.如条项3所述的方法,其中纤维化系在心脏组织中。
6.如条项3或5所述的方法,其中纤维化降低的特征在于相对于参照组,来自个体的组织样品中纤维化组织的百分比的降低。
7.如条项1至6中任一项所述的方法,其中个体患有心脏及/或肾损伤。
8.如条项1至7中任一项所述的方法,其中个体患有心脏损伤,随后患有肾损伤。
9.如条项1至8中任一项所述的方法,其进一步包含向个体给予标准护理疗法。
10.如条项1至9中任一项所述的方法,其中标准护理疗法为血管收缩素转化酶(ACE)抑制剂。
11.一种在个体中鉴别心肌梗塞后个体的增加的心血管死亡风险的方法,该方法包含测量相对于参照来自个体的样品中IL-6聚核苷酸或多肽中的一或多种的含量,其中增加的IL-6聚核苷酸或多肽中的一或多种的含量指示增加的心血管死亡风险。
12.一种在个体中表征心肌梗塞后个体的心血管死亡风险的方法,该方法包含测量相对于参照来自个体的样品中IL-6聚核苷酸或多肽中的一或多种的含量,其中增加的IL-6聚核苷酸或多肽中的一或多种的含量指示增加的心血管死亡风险。
13.如条项11或12所述的方法,其中个体患有心肾综合征、心脏衰竭、慢性肾病或无心肾病变。
14.如条项11至13中任一项所述的方法,其中个体经鉴别为在心肌梗塞后约一个月患有心肾综合征、心脏衰竭、慢性肾病或无心肾病变。
15.一种治疗患有心肾综合征的经选择个体的心脏及/或肾损伤的方法,该方法包含向个体给予IL-6拮抗剂,其中针对治疗,个体通过检测相对于参照来自个体的生物样品中增加的IL-6聚核苷酸或多肽中的一或多种的含量经选择。
16.一种降低患有心肾综合征的经选择个体的心血管死亡风险的方法,该方法包含向个体给予IL-6拮抗剂,其中个体通过检测相对于参照来自个体的生物样品中增加的IL-6聚核苷酸或多肽中的一或多种的含量经选择。
17.如条项15或16所述的方法,其中个体已患有心肌梗塞。
18.如条项1至10或15至17中任一项所述的方法,其中IL-6拮抗剂为抗IL-6抗体。
19.如条项18所述的方法,其中抗IL-6抗体为MEDI5117。
20.如条项11至19中任一项所述的方法,其中生物样品为血浆样品。
21.如条项1至20中任一项所述的方法,其中个体为人类。
5.12实施例
以下实施例以说明而非限制方式提供。
5.12.1实施例1:慢性肾病患者中的EPO剂量及总存活率仅与具有TMPRSS6 SNPrs855791主要等位基因的至少一个拷贝的患者中的血清IL-6及CRP含量相关
肽激素海帕西啶在全身铁恒定中起主要作用。Hentze等人,Cell 142:24-38(2010)。已知海帕西啶表达受TMPRSS6基因的产物间质蛋白酶-2影响,该间质蛋白酶-2为II型跨膜丝胺酸蛋白酶。已显示TMPRSS6基因的常见变体与铁状态相关,Benyamin等人,Nature Genetics 41(11):1173-1175(2009),且已显示TMPRSS6基因的某些突变引起铁难治性缺铁性贫血IRIDA),Finberg等人,Nature Genetics 40(5):569-571(2008)。SNPrs855791(2321G→A;A736V)为TMPRSS6基因的天然存在的变型,其在海帕西啶表达及血液血红素含量方面与天然存在的变型相关。
为确定TMPRSS6 rs855791 SNP处的基因型是否预测末期肾病中的贫血程度,结合新确定的SNP基因分型来分析先前在患有慢性肾病的患者的临床研究中收集的数据。由于海帕西啶表达也由IL-6调节,Casanovas等人,PLOS Computational Biol.10(1):e1003421(2014),也分析数据以确定血清IL-6含量是否可预测末期肾病中的贫血程度。
方法
基于普遍的透析准则、铁蛋白>100ng/mL及Hb>10mg/dL,将来自入选于MIMICK1、MIMICK2(炎性标志物在慢性肾病中的定位)及MIA(营养不良、炎性及动脉粥样硬化)群组中的N=257患者的数据管理至N=208,以选择在无缺铁性贫血的情况下且在无经标记贫血的情况下血液透析稳定的患者,从而不包含具有可自血红素含量分离铁输送的因子的患者,所述群组在2003年10月-2004年9月的时间段期间在斯德哥尔摩-乌普萨拉(Stockholm-Uppsala)(瑞典)区在六个透析单元中招募。
将所有患者临床数据,包括以IU/kg/周为单位的红细胞生成素(EPO)剂量、以pg/ml为单位的IL-6血清含量、以mg/L为单位的CRP血清含量、以月为单位的存活及SNPrs855791处的TMPRSS6基因型校对且使用统计分析软件(SPSS统计桌上型;IBM)分析。所研究的TMPRSS6等位基因及其核苷酸及氨基酸指示在表1下。
将群组分成rs855791子组(纯合AA、杂合AG及纯合GG),且将各基因型组分成血清IL-6含量(例如相较于>10pg/ml,IL-6<5pg/ml,且相较于>15pg/ml,IL-6<5pg/ml)或血清CRP含量(相较于>2mg/L,CRP<2mg/L)的三分位或四分位。比较在顶部及底部三分位及四分位中的EPO剂量。进行在通过斯氏T测试(Students T-Test)的基因型组内及在通过ANOVA的组之间的统计学家分析。
结果
由于各患者的EPO剂量已由治疗医师滴定以获得正常血红素含量,因此EPO剂量可用作基础贫血程度的代理。发现针对次要等位基因为纯合(A/A)的个体中的EPO剂量对IL-6的变型相对不敏感(图1A;左图)。然而,具有主要等位基因的至少一个拷贝的个体-针对主要等位基因(G)为杂合(A/G)或纯合(G/G)的患者-中的EPO剂量对个体IL-6含量敏感(图1B;右图)。在这些后面个体中,增加的血清IL-6含量(例如>5pg/ml)与增加的EPO剂量相关。
不受特定理论束缚,次要等位基因下的纯合性移除IL-6对铁输送的影响。因此,与IL-6含量无关,这些患者(A/A)中的EPO剂量大致相同。
与IL-6含量无关,针对TMPRSS6 rs855791次要等位基因(A)为纯合的个体展示类似的死亡(图2A)。然而,具有主要等位基因的至少一个拷贝的个体-针对主要等位基因(G)为杂合或纯合的患者-的存活率根据IL-6含量变化(图2B)。实际上,回应于慢性肾病5期透析个体中的升高的IL-6含量,TMPRSS6的G等位基因赋予更高的各种原因的死亡。在具有主要等位基因(G)的至少一个拷贝的个体中,与<5pg/ml的IL-6含量(也即低位IL-6)相比,≥5pg/ml的IL-6含量(也即中位及最高位IL-6)与增加的死亡率相关(图2B)。
在针对主要等位基因(G)为杂合或纯合的个体中,急性期反应物CRP-炎性标志物-的含量也与增加的EPO剂量相关,但在针对次要等位基因为纯合的患者中不如此(图3)。
论述
如图1中所展示,在具有TMPRSS6 rs855791 SNP处的主要等位基因的至少一个拷贝的患者中,基础贫血程度-测量为临床上滴定的EPO剂量-仅与IL-6含量相关。在这些患者中,血清IL-6含量愈高,所需EPO剂量愈高(图1B)。相反,具有次要等位基因的两个拷贝的患者的贫血程度不与血清IL-6含量相关(图1A)。
类似地,在具有TMPRSS6 SNP rs855791处的主要等位基因的至少一个拷贝的患者中,总存活率仅与IL-6含量相关。在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的个体中,存活率成反比地与血清IL-6含量相关,其中血清IL-6含量的最高位中的患者比IL-6含量的最低位中的那些患者具有统计学上显著更坏的存活率(图2B)。相反,针对rs855791处的次要等位基因为纯合的患者的总存活率不受IL-6含量影响(图2A)。
不意在受理论束缚,在具有TMPRSS6主要等位基因的至少一个拷贝的患者中,血清IL-6的增加可促进海帕西啶表达增加,从而增加贫血。增加的死亡风险为失调的铁代谢、所得贫血及/或增加的红细胞生成刺激剂(诸如EPO)剂量的结果。若这些相关性反映因果关系,则其提升了以下可能性:在患有慢性肾病的患者中,降低的IL-6含量或IL-6信号转导可降低贫血,减少所需EPO剂量,且增加存活率,但仅在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者中,且在具有升高的血清IL-6含量的那些患者中具有最大作用。
5.12.2实施例2:急性心肌梗塞后的死亡风险及心脏衰竭风险仅与具有TMPRSS6SNP rs855791主要等位基因的至少一个拷贝的患者中的IL-6血清含量相关
为确定在患有急性疾病而非慢性疾病的患者中TMPRSS6 rs855791基因型是否影响IL-6敏感性,结合新确定的SNP基因分型来分析先前在因急性冠状动脉综合征住院的患者的临床研究中收集的数据。
方法
自先前入选于血小板抑制及患者结果(PLATO)的多中心研究中的个体分析数据。若患者因急性冠状动脉综合征(在先前24小时期间具有症状发作)住院,则其有资格入选于PLATO中。在心肌梗塞后30天开始的这些个体中测量死亡率及心脏衰竭的存在。
结果
针对TMPRSS6 rs855791 SNP次要等位基因(A)为纯合的个体的死亡不与IL-6的变型相关(图4A)。然而,回应于心肌梗塞后个体中的升高的IL-6含量,主要等位基因(G)的一或两个拷贝赋予更高的各种原因的死亡(图4B)。因此,TMPRSS6调节心肌梗塞后的IL-6介导的死亡风险。
也在心肌梗塞后30天开始的入选于PLATO中的个体中测量TMPRSS6基因型对IL-6介导的心脏衰竭风险的影响。在针对次要等位基因(A)为纯合的个体的心脏衰竭不与IL-6的变型相关(图5A)。然而,响应于心肌梗塞后个体中的升高的IL-6含量,TMPRSS6的G等位基因赋予更高的心脏衰竭速率(图5B)。因此,TMPRSS6调节心肌梗塞后的IL-6介导的心脏衰竭风险。
论述
这些数据表明TMPRSS6基因型、IL-6含量及不利临床结果之间的相关性不限于患有慢性肾病的患者。不意在受理论束缚,在具有TMPRSS6主要等位基因的至少一个拷贝的患者中,血清IL-6增加可驱使海帕西啶表达增加,随后心肌细胞中铁的螯合作用增加,继的以铁介导的细胞毒性。若这些相关性反映因果关系,则其提升了以下可能性:降低的IL-6含量或IL-6信号转导可降低患有急性冠状动脉综合征的患者的心脏衰竭及死亡,但仅在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者中,且在具有升高的血清IL-6含量的那些患者中具有最大作用。
5.12.3实施例3:关于源于iPS的人类心肌细胞的活体外研究确认TMPRSS6基因型与IL-6介导的细胞毒性之间的因果关系
虽然实施例1及2中所观测的相关性暗示在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝、升高的IL-6含量及贫血或海帕西啶介导的细胞毒性的患者中,降低的IL-6介导的信号转导应提供临床效益,但所观测相关性不能证明因果关系。因此,在源于人类诱导型多能性细胞的心肌细胞(iPS-CMs)中进行实验以查询BMP及BMP加IL-6对海帕西啶表达及细胞针对局部缺血损伤的易感性的作用,所述心肌细胞用TMPRSS6的变体转染。
5.12.3.1方法
源于人类iPS的心肌细胞的培养-将iCell心肌细胞(Cellular DynamicsInternational,CDI Inc.)涂于具有iCell心肌细胞接种培养基(CDI Inc.)的0.1%明胶涂布的6孔或96孔细胞培养盘上。接种后四十八小时,用维持培养基(CDI Inc.)替代接种培养基。每隔一天至进行实验的天数更换维持培养基。
经模拟的局部缺血/再充氧方案-如先前所报导,通过用“局部缺血缓冲液”替代细胞培养基,使iPS心肌细胞经历经模拟的局部缺血(SI)90分钟,该局部缺血缓冲液含有118mm NaCl、24mm NaHCO
细胞活力及细胞凋亡的评估-进行台盼蓝排除分析以分析如先前所报导的细胞坏死(Das,A.,Xi,L.,及Kukreja,K.C.(2005)J.Biol.Chem.280,12944-12955;Das A,Smolenski A,Lohmann SM,Kukreja RC.(2006)J.Biol.Chem.281(50):38644-52)。
iCell心肌细胞的转染-在接种后第8天,用新鲜的维持培养基替代培养基且将细胞培养4小时。根据制造商说明书(普洛麦格公司(Promega Corp.),威斯康星州麦迪逊)使用ViaFect
Western印迹法分析-如先前所描述进行Western印迹法(Das,A.,Xi,L.,及Kukreja,K.C.(2005)J.Biol.Chem.280,12944-12955;Das A,Smolenski A,Lohmann SM,Kukreja RC.(2006)J.Biol.Chem.281(50):38644-52)。用裂解缓冲液(Cell Signaling,MA)自细胞提取总可溶性蛋白。在4℃下以10,000×g离心匀浆5分钟,且回收清液层。由12%丙烯酰胺凝胶分离蛋白质(来自各样品的50μg)且将其转移至硝基纤维素膜,且接着在TBST(10mm Tris-HCl、pH 7.4,100mm NaCl及0.1%吐温20)中用5%脱脂乳粉阻断1小时。随后对于各别蛋白质中的每一者,将家兔单株/多株或山羊多株初级抗体以1:1000的稀释与膜一起培养过夜,所述各别蛋白质也即磷酸-苄氯素(Beclin)-1(Ser93)(D9A5G)家兔单抗、苄氯素-1、SQSTM1/p62、LC3A/B(D3U4C)
实时PCR-塔克曼分析(Taqman assay)-根据制造商的方案(凯杰科技(QIAGENSciences),美国马里兰州)使用miRNeasy微试剂盒来分离包括小RNA的总RNA。使用Nanodrop ND-1000分光亮度计(安捷伦技术公司(Agilent technologies),美国加利福尼亚州)测量经分离RNA的浓度及纯度。简言的,使用高容量cDNA合成试剂盒(应用生物系统公司(Applied Biosystems),美国加利福尼亚州)用随机六聚体将1μg总RNA转化成cDNA。使用以下PCR条件进行反转录反应:25℃持续10分钟;37℃持续120分钟且85℃持续5分钟。使用塔克曼扩增子特异性探针(应用生物系统公司(Applied Biosystems),美国加利福尼亚州)Hamp(CGGCTCTGCAGCCTTG)(SEQ ID NO:20)在以下PCR循环条件下进行实时PCR:95℃持续10分钟;95℃持续15秒且60℃持续60秒。将Hamp的表达标准化成GAPDH(CTTCCAGGAGCGAGATCCCGCTAA)(SEQ ID NO:21)管家基因。使用2-ΔΔCt方法分析相对基因表达。
iPS细胞的TMPRSS6突变诱发及转染-pCMV6-XL5 TMPRSS6购自奥瑞基因技术公司(Origene Technologies)(马里兰州罗克维尔),目录号SC306623,对应于基因银行(GenBank)保藏编号NM_153609。此克隆含有引起氨基酸改变的突变,K253A。进行定点突变诱发以将位置253处的氨基酸回复成典型赖氨酸(K)。确认回复后,进行定点突变诱发以引入V736A突变。使用Agilent Technologies QuikChange II XL定点突变诱发试剂盒(加利福尼亚州圣克拉拉;目录号200521)进行所有突变诱发反应。对所有载体测序以确认。所使用的引物序列为:反义(as)TMPRSS6 E253KGCATGAGGTCCTTGGGGCCCTGCAG(SEQ ID NO:22);正义(s)TMPRSS6 E253K CTGCAGGGCCCCAAGGACCTCATGC(SEQ ID NO:23);反义(as)TMPRSS6V736A CCTGGTAGCGATAGGCCTCGCTGCACAGG(SEQ ID NO:24);正义(s)TMPRSS6 V736ACCTGTGCAGCGAGGCCTATCGCTACCAGG(SEQ ID NO:25)。
5.12.3.2结果
在基线下人类iPS-CMs仅最低限度地表达间质蛋白酶-2。分别仿效纯合主要等位基因及纯合次要等位基因心肌细胞,将细胞用促进以下的组成性表达的构筑体转染:由TMPRSS6 rs855791SNP主要等位基因编码的间质蛋白酶-2 736A或由次要等位基因编码的间质蛋白酶-2 736V。
海帕西啶表达通过BMP6/SMAD及IL-6/STAT信号转导路径调节,其中BMP及IL-6两者经由其各别受体起作用以促进海帕西啶表达增加。Casanovas等人,PLOS Comp.Biol.10(1):e1003421(2014)。活体外用信号转导路径-重组BMP2及IL-6-的促效剂或单独用BMP2的促效剂处理主要等位基因及次要等位基因iPS心肌细胞,以模型化IL-6含量(或信号转导)降低的临床干预。不用促效剂处理对照iPS细胞。在正常氧张力(常氧)下且也在模拟低氧随后模拟再充氧(再灌注)的条件下测量细胞死亡率。
图6A展示当细胞在正常氧含量下处理时的结果。仅表达TMPRSS6 rs855791次要等位基因(“736V次要等位基因”)的iPS心肌细胞不显著受IL-6信号转导的消除影响(“n.s.”):相较于用BMP2+IL-6进行的处理,当用BMP2处理细胞时,测量为台盼蓝阳性细胞的百分比的细胞死亡率不显著降低。相反,当消除IL-6信号转导时,表达TMPRSS6 rs855791主要等位基因的iPS心肌细胞展示统计学上显著更低的细胞死亡。
图6B展示当细胞经历低氧随后经历再充氧时的结果。相较于常氧条件,低氧/再充氧对iPS心肌细胞显著有毒性,其中相较于在常氧条件下的约20%对照细胞,约40百分比的主要及次要等位基因对照细胞经杀死(将图6B与图6A相比较)。相对于此增加的背景毒性,次要等位基因iPS心肌细胞不显著受IL-6信号转导的消除影响:相较于用BMP2+IL-6进行的处理,当单独用BMP2处理细胞时,细胞死亡率不显著降低。相反,当消除IL-6信号转导时,表达TMPRSS6 rs855791主要等位基因的iPS心肌细胞展示统计学上显著更低的细胞死亡。
5.12.3.3论述
这些数据增强了自实施例1及实施例2中的临床试验数据之后hoc分析所得出的推断:IL-6信号转导的降低可有效地降低表达TMPRSS6 rs855791主要等位基因的心肌细胞中的IL-6介导的毒性,但在仅表达次要等位基因的心肌细胞中不如此。不意在受理论束缚,促进主要等位基因iPS心肌细胞中的毒性增加的IL-6可起因于海帕西啶表达的IL-6介导的增加,随后细胞中增加的铁螯合作用,继的以铁介导的细胞毒性。
5.12.4实施例4:在基因型地类似于人类TMPRSS6 rs855791主要等位基因纯合子的大鼠的心肾综合征模型中,抗IL-6疗法作为当前标准护理而有效
患有慢性肾病的患者,诸如入选于在实施例1中分析的MIMICK研究中的那些患者,常常罹患减弱的心脏功能,其为死亡率的主要促成者。初次慢性肾病后的此二次心脏损伤称为4型心肾综合征(4型CRS)。
为测试抗IL-6疗法是否作为治疗在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的CRS4患者中有效,如通过实施例1及3中的数据所表明,吾人使用基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的大鼠的CRS4模型。
图7概述了研究设计。
第0周,在CRS动物中诱导心肌梗塞。在第2周进行肾切除。取而代的使对照组经历假手术。肾切除的前,对个体进行各种评估。评估包括测量血清肌酸酐、肾小球滤过率、尿液中的24小时蛋白质含量、心脏超音波图、尾套血压,及血浆及尿液中的生物标志物。
肾切除后第1天开始治疗。将动物分成三组:(i)对照治疗剂,(ii)抗IL-6疗法及且(iii)标准护理疗法。抗IL-6疗法为适用于啮齿动物的抗IL-6抗体。标准护理疗法为给予培哚普利、ACE(血管收缩素转化酶)抑制剂。治疗开始时,对所有组中的个体进行评估。评估包括测量血清肌酸酐、肾小球滤过率、24小时蛋白质含量及血浆中的生物标志物。
在肾切除后第3天及第7天对所有组中的个体进行评估。评估包括在第3天测量血清肌酸酐及血浆中的生物标志物,及在第7天测量血清肌酸酐、肾小球滤过率、24小时蛋白质含量、心脏超音波图、血压及血浆中的生物标志物。
在第6周处死个体。处死的前,对所有组中的个体进行各种评估。评估包括测量血清肌酸酐、肾小球滤过率、24小时蛋白质含量、血压、血浆中的生物标志物、心脏超音波图及压力-容积回路分析。处死后,也自所有组中的个体收集组织以用于组织学评估(也即,心脏组织的天狼星红染色)。
图8A-8D展示在概述于图7中的心肾综合征模型中,以下各者的心脏射血分数:无CRS(“假”)的大鼠、用药理学上不相关的同种型对照抗体(“同种型”)治疗的CRS动物、用抗IL-6抗体(“IL-6ab”)治疗的CRS动物及用标准护理ACE抑制剂(“Peri”)治疗的CRS动物。
图8A展示心肌梗塞后两周但肾切除的前且治疗的前,所有组的基线射血分数程度,表明以实验方式诱导的心肌梗塞使得心脏射血分数显著降低。图8B为展示肾切除后一周、治疗1周后,所有组的射血分数程度的绘图。图8C为展示肾切除后两周、治疗2周后,所有组的射血分数程度的绘图。图8D为展示肾切除后四周、治疗4周后,所有组的射血分数程度的绘图。结果表述为平均+/-SEM。
治疗4周后,与同种型对照组相比,处理组-用抗IL-6治疗的组及用标准护理ACE抑制剂疗法治疗的组-均展示统计学上显著增加的射血分数程度(图8D)(p<0.001)。治疗4周后测量的抗IL-6及标准护理组中的类似射血分数程度展示抗IL-6疗法具有与ACE抑制剂培哚普利(标准护理疗法)等效的功效,表明如通过心脏射血分数的变化所测量,在保持心肾综合征模型的心脏功能方面,抗IL-6疗法具有等效于标准护理疗法的治疗功效。
心肌收缩性的测量结果(图9)展示抗IL-6疗法也具有等效于使用ACE抑制剂的标准护理疗法的作用。治疗4周后,用抗IL-6及标准护理疗法治疗的组的心肌收缩性显著增加,高于对照、同种型组的心肌收缩性。抗IL-6及标准护理组中的类似心肌收缩性表明如通过收缩性所测量,在保持心肾综合征模型的心脏功能方面,抗IL-6疗法具有等效于ACE抑制剂培哚普利(标准护理疗法)的功效。
自所有组中的动物收集的心脏组织的纤维化测量结果也证实抗IL-6疗法具有与标准护理疗法等效的作用(图10A-10C)。心脏组织中的纤维化通过测量以下两个区域中的纤维化组织面积百分比来定量:“正常”区及“纤维化界限”区。实施例“正常”区通过展示于图10A中的显微图中的组织切片的划定部分所指示。显微图中的插图展示“正常”区的放大视图,展示“正常”区的小部分具有纤维化组织。“纤维化界限”区为在纤维化组织周围的“正常”区中的组织区。
图10B及10C中的绘图展示当在“正常”区(图10B)或在“纤维化界限”区(图10C)中测量时,与同种型对照组相比,来自用抗IL-6或标准护理疗法治疗的组中的个体的心脏组织具有显著减少的纤维化组织面积百分比。另外,在抗IL-6及标准护理疗法组中测量的纤维化组织面积百分比为类似的(均在“正常”区及“纤维化界限”区中),指示抗IL-6具有与ACE抑制剂培哚普利(标准护理疗法)等效的抗纤维化作用。
这些数据表明在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的动物的心肾综合征活体内模型中,用抗IL-6剂进行的治疗有效地降低心脏损伤且恢复功能。
5.12.5实施例5:在基因型地类似于人类TMPRSS6 rs855791主要等位基因纯合子的小鼠的急性心肌梗塞模型中,抗IL-6疗法在保持心脏功能方面有效
实施例2及3中的数据表明降低的IL-6含量或IL-6信号转导可降低患有急性冠状动脉综合征的患者的心脏衰竭及死亡,但仅在具有TMPRSS6 rs855791主要等位基因的至少一个拷贝的那些患者中,且在具有升高的血清IL-6含量的那些患者中具有最大作用。
进行啮齿动物研究以确定在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的小鼠中,急性心肌梗塞后抗IL-6疗法的作用。
图11A及11B展示来自活体内模型的数据,在该模型中,在基因型地类似于针对TMPRSS6 rs855791主要等位基因为纯合的人类的小鼠中诱导心肌梗塞。对照组不接受疗法。实验组用抗鼠类IL-6抗体治疗。图11A展示用抗IL-6进行的治疗在射血分数方面提供统计学上显著的提高。图11B展示用抗IL-6进行的治疗在测量为心脏缩短分数的收缩性方面提供统计学上显著的提高。数据数据表明在心肌梗塞后立即给出的抗IL-6疗法提高了基因型地类似于具有TMPRSS6 rs855791主要等位基因的人类患者的啮齿动物中左心室的功能恢复。
6.以引用的方式并入
本申请中所引用的所有公开案、专利、专利申请及其他文献均出于所有目的特此以全文引用的方式并入,引用的程度就如同个别地指示将各个别公开案、专利、专利申请及其他文献以引用的方式并入以用于所有目的一样。
7.等效形式
虽然已说明且描述各种具体实施方式,但上文说明书不为限制性的。应了解,各种变化可在不偏离本发明的精神及范畴的情况下进行。在审阅本说明书时许多变型将对熟习此项技术者而言变得显而易见。
本申请还涉及以下项目。
1.一种治疗海帕西啶(hepcidin)介导的病症的方法,其包含:
向患有海帕西啶介导的病症的患者给予治疗有效量的IL-6拮抗剂,
其中已确定该患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。
2.如项目1所述的方法,其中先前已确定该患者具有该TMPRSS6rs855791主要等位基因的至少一个拷贝。
3.如项目1所述的方法,其进一步包含以下的早前步骤:
确定该患者具有该TMPRSS6 rs855791主要等位基因的至少一个拷贝。
4.如项目1至3中任一项所述的方法,其中该患者具有升高的治疗前血清IL-6含量。
5.如项目1至4中任一项所述的方法,其中该患者具有升高的治疗前血清CRP含量。
6.如项目1至5中任一项所述的方法,其中该海帕西啶介导的病症为慢性疾病贫血。
7.如项目6所述的方法,其中该患者为男性且治疗前血红素(Hb)含量小于14g/dl。
8.如项目7所述的方法,其中该患者的治疗前Hb含量小于13g/dl。
9.如项目8所述的方法,其中该患者的治疗前Hb含量小于12g/dl。
10.如项目9所述的方法,其中该患者的治疗前Hb含量小于11g/dl。
11.如项目6所述的方法,其中该患者为女性且治疗前Hb含量小于12g/dl。
12.如项目11所述的方法,其中该患者的治疗前Hb含量小于11g/dl。
13.如项目12所述的方法,其中该患者的治疗前Hb含量小于10g/dl。
14.如项目13所述的方法,其中该患者的治疗前Hb含量小于9g/dl。
15.如项目6至10中任一项所述的方法,其中该患者为男性且治疗前血细胞比容小于40%。
16.如项目15所述的方法,其中该患者的治疗前血细胞比容小于35%。
17.如项目16所述的方法,其中该患者的治疗前血细胞比容为30-34%。
18.如项目6、11至14中任一项所述的方法,其中该患者的治疗前血细胞比容小于36%。
19.如项目18所述的方法,其中该患者的治疗前血细胞比容小于30%。
20.如项目19所述的方法,其中该患者的治疗前血细胞比容为26-29%。
21.如项目6至20中任一项所述的方法,其中该患者已接受至少一次ESA的治疗前给予。
22.如项目6所述的方法,其中该患者已接受至少一次ESA的治疗前给予且具有正常Hb含量或正常血细胞比容。
23.如项目6至20中任一项所述的方法,其中该患者已接受至少一次铁补充剂的治疗前给予。
24.如项目6所述的方法,其中该患者已接受至少一次铁补充剂的治疗前给予且具有正常Hb含量或正常血细胞比容。
25.如项目6至20中任一项所述的方法,其中该患者已接受至少一次血液或红细胞浓集物(packed red blood cells)的治疗前输注。
26.如项目6所述的方法,其中该患者已接受至少一次血液或红细胞浓集物的治疗前输注且具有正常Hb含量或正常血细胞比容。
27.如项目6至26中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的Hb含量增加而高于治疗前含量的时间段。
28.如项目6至27中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的血细胞比容增加而高于治疗前含量的时间段。
29.如项目21或22所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的ESA剂量减少而不使该患者的Hb含量降低至低于接近治疗前存在的含量的时间段。
30.如项目21或22所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的ESA剂量减少而不使该患者的血细胞比容降低至低于接近治疗前存在的含量的时间段。
31.如项目21、22、29或30中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使得该患者的ESA剂量相较于治疗前ESA剂量减少至少10%的时间段。
32.如项目31所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使得该患者的ESA剂量相较于治疗前ESA剂量减少至少20%的时间段。
33.如项目32所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使得该患者的ESA剂量相较于治疗前ESA剂量减少至少50%的时间段。
34.如项目6至33中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以逆转功能性铁缺乏的时间段。
35.如项目6至34中任一项所述的方法,其中该慢性疾病为慢性肾病(CKD)。
36.如项目35所述的方法,其中该患者具有KDOQI 1期慢性肾病、KDOQI 2期慢性肾病、KDOQI 3期慢性肾病、KDOQI 4期慢性肾病或KDOQI 5期慢性肾病。
37.如项目36所述的方法,其中该患者具有KDOQI 5期慢性肾病。
38.如项目35所述的方法,其中该患者具有心肾综合征(CRS)。
39.如项目38所述的方法,其中该患者具有第4型CRS。
40.如项目35至39中任一项所述的方法,其中该患者已接受至少一次治疗前透析治疗。
41.如项目35至40中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使心血管(CV)死亡率相较于年龄匹配且疾病匹配的历史对照组降低的时间段。
42.如项目6至34中任一项所述的方法,其中该慢性疾病为慢性炎性疾病。
43.如项目42所述的方法,其中该慢性炎性疾病为类风湿性关节炎(RA)。
44.如项目43所述的方法,其中该患者的治疗前DAS28得分大于5.1。
45.如项目43所述的方法,其中该患者的治疗前DAS28得分为3.2至5.1。
46.如项目43所述的方法,其中该患者的治疗前DAS28得分小于2.6。
47.如项目43所述的方法,其中该患者的治疗前RA为中度活动性至重度活动性。
48.如项目43至47中任一项所述的方法,其中该患者已接受至少一次甲胺喋呤(methotrexate)的治疗前给予。
49.如项目43至48中任一项所述的方法,其中该患者已接受至少一次TNFα拮抗剂的治疗前给予。
50.如项目49所述的方法,其中该TNFα拮抗剂选自下组:依那西普(etanercept)、阿达木单抗(adalimumab)、英利昔单抗(infliximab)、赛妥珠单抗(certolizumab)及戈利木单抗(golimu-mab)。
51.如项目43至47中任一项所述的方法,其中该患者已接受至少一次IL-6拮抗剂的治疗前给予。
52.如项目51所述的方法,其中该治疗前IL-6拮抗剂为托珠单抗(tocilizumab)。
53.如项目51所述的方法,其中该治疗前IL-6拮抗剂为托法替尼(tofacitinib)。
54.如项目51至53中任一项所述的方法,其中该治疗IL-6拮抗剂为MEDI5117。
55.如项目42所述的方法,其中该慢性炎性疾病选自下组:幼年期特发性关节炎、僵直性脊椎炎、斑状牛皮癣、牛皮癣性关节炎、炎性性肠病、克罗恩氏病及溃疡性结肠炎。
56.如项目6至34中任一项所述的方法,其中该慢性疾病为癌症。
57.如项目56所述的方法,其中该癌症选自下组:实体肿瘤、小细胞肺癌、非小细胞肺癌、血液癌、多发性骨髓瘤、白血病、慢性淋巴细胞白血病(CLL)、慢性骨髓性白血病(CML)、淋巴瘤、霍奇金氏淋巴瘤及肝腺瘤。
58.如项目6至34中任一项所述的方法,其中该慢性疾病为慢性感染。
59.如项目6至34中任一项所述的方法,其中该慢性疾病为充血性心脏衰竭(CHF)。
60.如项目1至5中任一项所述的方法,其中该海帕西啶介导的病症为铁难治性缺铁性贫血(IRIDA)。
61.如项目1至5中任一项所述的方法,其中该海帕西啶介导的病症为急性冠状动脉综合征。
62.如项目61所述的方法,其中该患者在第一次给予IL-6拮抗剂的前60天内已罹患心肌梗塞(MI)。
63.如项目62所述的方法,其中该患者在第一次给予IL-6拮抗剂的前30天内已罹患MI。
64.如项目63所述的方法,其中该患者在第一次给予IL-6拮抗剂的前48小时内已罹患MI。
65.如项目64所述的方法,其中该患者在第一次给予IL-6拮抗剂的前24小时内已罹患MI。
66.如项目61至65中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以相较于治疗前程度改良心肌收缩性的时间段。
67.如项目61至66中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以相较于治疗前程度改良心脏射血分数的时间段。
68.如项目61至67中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以相较于治疗前程度降低心脏纤维化的时间段。
69.如项目1至5中任一项所述的方法,其中该海帕西啶介导的病症为卡斯尔曼氏病。
70.一种用于改良对海帕西啶介导的病症的治疗的方法,该方法包含:
中断给予IL-6拮抗剂给患有海帕西啶介导的病症的患者,
其中已确定该患者对于TMPRSS6 rs855791次要等位基因为纯合。
71.如项目70所述的方法,其中先前已确定该患者对于该TMPRSS6 rs855791次要等位基因为纯合。
72.如项目70所述的方法,其进一步包含确定该患者对于该TMPRSS6 rs855791次要等位基因为纯合的早前步骤。
73.一种治疗无慢性炎性贫血的患者的IL-6介导的炎性病症的方法,其包含:
向患有IL-6介导的炎性病症的无贫血患者给予治疗有效量的IL-6拮抗剂,
其中已确定该患者具有TMPRSS6 rs855791主要等位基因的至少一个拷贝。
74.如项目73所述的方法,其中先前已确定该患者具有该TMPRSS6 rs855791主要等位基因的至少一个拷贝。
75.如项目73所述的方法,其进一步包含确定该患者具有该TMPRSS6 rs855791主要等位基因的至少一个拷贝的早前步骤。
76.如项目1至75中任一项所述的方法,其中该患者具有升高的治疗前血清IL-6含量。
77.如项目76所述的方法,其中该患者的治疗前血清IL-6含量大于2.5pg/ml。
78.如项目77所述的方法,其中该患者的治疗前血清IL-6含量大于5pg/ml。
79.如项目78所述的方法,其中该患者的治疗前血清IL-6含量大于7.5pg/ml。
80.如项目79所述的方法,其中该患者的治疗前血清IL-6含量大于10pg/ml。
81.如项目80所述的方法,其中该患者的治疗前血清IL-6含量大于12.5pg/ml。
82.如项目76至81中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的血清中的游离IL-6含量降低而低于治疗前含量的时间段。
83.如项目82所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使游离IL-6含量相较于治疗前含量降低至少10%的时间段。
84.如项目83所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的血清中的游离IL-6含量相较于治疗前含量降低至少20%的时间段。
85.如项目84所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的血清中的游离IL-6含量相较于治疗前含量降低至少50%的时间段。
86.如项目1至85中任一项所述的方法,其中该患者具有升高的治疗前C反应蛋白(CRP)含量。
87.如项目86所述的方法,其中该患者的治疗前CRP含量大于2mg/ml。
88.如项目87所述的方法,其中该患者的治疗前CRP含量大于3mg/ml。
89.如项目88所述的方法,其中该患者的治疗前CRP含量大于5mg/ml。
90.如项目89所述的方法,其中该患者的治疗前CRP含量大于7.5mg/ml。
91.如项目90所述的方法,其中该患者的治疗前CRP含量大于10mg/ml。
92.如项目86至91中任一项所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的CRP含量降低而低于治疗前含量的时间段。
93.如项目92所述的方法,其中按时程给予一剂该IL-6拮抗剂剂量,且持续一段足以使该患者的CRP含量相较于治疗前含量降低至少50%的时间段。
94.如项目1至93中任一项所述的方法,其中使用
95.如项目1至94中任一项所述的方法,其中该IL-6拮抗剂为抗IL-6抗体或其抗原结合片段或衍生物。
96.如项目95所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物对人类IL-6的结合性具有小于100nM的K
97.如项目96所述的方法,其中该抗体或抗原结合片段或衍生物对人类IL-6的结合性具有小于50nM的K
98.如项目97所述的方法,其中该抗体或抗原结合片段或衍生物对人类IL-6的结合性具有小于10nM的K
99.如项目98所述的方法,其中该抗体或抗原结合片段或衍生物对人类IL-6的结合性具有小于1nM的K
100.如项目95至99中任一项所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物在静脉内给予后具有至少7天的消除半衰期。
101.如项目100所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物在静脉内给予后具有至少14天的消除半衰期。
102.如项目101所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物在静脉内给予后具有至少21天的消除半衰期。
103.如项目102所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物在静脉内给予后具有至少30天的消除半衰期。
104.如项目95至103中任一项所述的方法,其中该IL-6拮抗剂为全长单株抗IL-6抗体。
105.如项目104所述的方法,其中该抗体为IgG1或IgG4抗体。
106.如项目105所述的方法,其中该抗体为IgG1抗体。
107.如项目95至106中任一项所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物为完全人类的。
108.如项目95至106中任一项所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物为人类化的。
109.如项目95至108中任一项所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物包含MED5117的所有六个可变区CDR。
110.如项目109所述的方法,其中该抗体包含MED5117的VH及VL。
111.如项目110所述的方法,其中该抗体为MED5117。
112.如项目95至108中任一项所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物包含选自下组的抗体的所有六个可变区CDR:司妥昔单抗(siltuximab)、格里林祖单抗(gerilimzu-mab)、思鲁库单抗(sirukumab)、克拉杂奇单抗(clazakizumab)、奥诺奇单抗(olokizumab)、艾思莫单抗(elsilimomab)、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(FemtaPharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(AlderBiopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
113.如项目112所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物包含选自下组的抗体的重链V区及轻链V区:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。在特定实施方式中,该抗IL-6抗体为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
114.如项目113所述的方法,其中该抗IL-6抗体或抗原结合片段或衍生物为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(费塔制药(Femta Pharmaceuticals),龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。在特定实施方式中,该抗IL-6抗体为选自下组的抗体:司妥昔单抗、格里林祖单抗、思鲁库单抗、克拉杂奇单抗、奥诺奇单抗、VX30(VOP-R003;瓦西尼斯(Vaccinex))、EB-007(EBI-029;依莱文生物制药(Eleven Bio))、ARGX-109(ArGEN-X)、FM101(Femta Pharmaceu-ticals,龙沙(Lonza))及ALD518/BMS-945429(阿尔德生物制药(Alder Biopharmaceuticals),百时美施贵宝公司(Bristol-Myers Squibb))。
115.如项目95至103中任一项所述的方法,其中该IL-6拮抗剂为单域抗体、VHH纳米抗体(Nanobody)、Fab或scFv。
116.如项目1至94中任一项所述的方法,其中该IL-6拮抗剂为抗IL-6R抗体或其抗原结合片段或衍生物。
117.如项目116所述的方法,其中该抗IL-6R抗体、抗原结合片段或衍生物为托珠单抗。
118.如项目116所述的方法,其中该抗IL-6R抗体、抗原结合片段或衍生物为夫巴利珠单抗(vobarilizumab)。
119.如项目1至94中任一项所述的方法,其中该IL-6拮抗剂为JAK抑制剂。
120.如项目119所述的方法,其中该JAK抑制剂选自下组:托法替尼(tofacitinib)(Xeljanz)、得森替尼(decernotinib)、卢佐替尼(ruxolitinib)、尤帕达替尼(upadacitinib)、巴瑞替尼(barici-tinib)、斐哥替尼(filgotinib)、来妥替尼(lestaurtinib)、帕瑞替尼(pacritinib)、皮非替尼(peficitinib)、INCB-039110、ABT-494、INCB-047986及AC-410。
121.如项目1至94中任一项所述的方法,其中该IL-6拮抗剂为STAT3抑制剂。
122.如项目95至118中任一项所述的方法,其中该IL-6拮抗剂系非经肠给予。
123.如项目122所述的方法,其中该IL-6拮抗剂经皮下给予。
124.如项目119至120中任一项所述的方法,其中该IL-6拮抗剂经口给予。
- 用于治疗海帕西啶介导的病症的方法
- 用于治疗海帕西啶介导的病症的方法
