抗幽门螺杆菌卵黄抗体的制备方法
文献发布时间:2023-06-19 11:55:48
技术领域
本发明涉及抗幽门螺杆菌卵黄抗体的制备方法,更具体地,涉及如下的抗幽门螺杆菌卵黄抗体的制备方法,即,通过将幽门螺杆菌抗原接种于与鸡属于异种动物中来制备异源性抗体后,通过将由上述抗原与异源性抗体结合而成的复合物接种于产蛋鸡中,从而制备卵黄抗体。
背景技术
抗体(antibody)为在淋巴组织由B淋巴细胞或B细胞形成的球蛋白类蛋白质,其为干预特异性免疫识别的重要物质之一。抗体具有两种不同的功能,第一种为通过对产生免疫反应的抗原的特定部位进行特异性识别及结合来中和抗原的作用的功能,第二种为通过使抗体与抗原结合而收集用于去除抗原的多种物质和免疫细胞的功能。例如,抗体可以通过与毒素结合而使毒素的简单的化学组成发生变化以中和毒性,且通过附着于侵入的微生物来去除微生物的移动性并妨碍微生物侵入体细胞中。并且,由抗体包围的抗原与补体产生化学链式反应而直接分解侵入的微生物或者引诱吞噬细胞。通过应用这种抗原抗体反应的特异性和高度的亲和度以及可区分数千万种类的抗原的抗体的多样性来开发了如今的包含诊断剂和治疗剂等的多种抗体的医药品(Jim E.Eyles et al.,Vaccine,25,pp73017306,2007)。
另一方面,为了从感染性疾病保护自身或保护子孙而制备出的物质中包含抗体,这种对于疾病的防御机制不仅存在于人类中,而且还存在于多种哺乳类及鸟类中。大部分哺乳类生成约150Kd的IgG,这与人类相似。哺乳类除了生成IgG之外,还生成IgA、IgD、IgE及IgM。
以往,为了制备多种病原性细菌的抗体,广泛使用了由对兔、牛、山羊等哺乳动物进行免疫处理而获得的血清生产病原性细菌特异性抗体的方法。然而,这种方法存在从小的哺乳动物的少量血清中采集抗体的缺点,而且抗体的生产量也非常少。因此,作为容易生产病原性细菌的抗体的方法,当前,利用对产蛋鸡进行免疫处理而生成的抗体移动至产蛋鸡的鸡蛋来采集抗体的方法备受关注。尤其,将存在于产蛋鸡的卵黄中的特异性抗体称为卵黄免疫球蛋白(Immunoglobulin Yolk,IgY)或卵黄抗体,其是作为存在于产蛋鸡的血清中的特异性抗体的免疫球蛋白(IgG)移动至鸡蛋的卵黄而生成的抗体,且在鸡蛋的卵黄中以高浓度的形式堆积。就IgY而言,由于容易被分离,从而能够在各种领域中被利用,尤其,对多种疾病具有预防及治疗效果的IgY的开发及用作药学组合物的充分利用呈增大趋势。
正在活跃地进行将病原性细菌用作抗原从产蛋鸡的鸡蛋中获取卵黄抗体的方法及包含其的组合物的开发,并且活跃地进行利用抗原-抗体复合物的疫苗的制备或用于治疗多种疾病的组合物的开发。具体地,在韩国公开专利第2009-0088121号中记载了在利用抗原-抗体复合物作为疫苗的佐剂时可增强由抗原引起的免疫反应的内容,在论文Phase Itrial of a murine antibody to MUC1 in patients with metastatic cancer(转移性癌症患者对MUC1抗体的I期试验)中告知了在为了治疗癌细胞而利用抗原-异源性抗体复合物时在激活T细胞而治疗癌细胞方面可以显示优异效果的内容(Ann Oncol.2004Dec;15(12):1825-33)。然而,为了生产大量的卵黄抗体而利用抗原-异源性抗体复合物的方法至今尚未公开。
最近,现代人的由不规律的饮食生活和过重的压力导致的胃肠疾病发病率呈上升的趋势。尤其,摄取强刺激性的食物的人群相比于不摄取这种食物的人群,患上胃溃疡、胃炎、胃癌等胃肠疾病发生频率非常高。
据报道,在患有胃炎、胃溃疡、十二指肠溃疡的患者的卫生检查中检测出高比率的众所周知为这种胃肠疾病的发病因子的幽门螺杆菌(Helicobacter pylori)。幽门螺杆菌与食品等一起通过口服途径侵入并附着到胃黏膜、十二指肠黏膜,从而导致感染。幽门螺杆菌为了从在胃分泌的具有强酸性的胃液生存而分泌脲酶(urease)。脲酶将胃黏膜组织内的尿素分解为氨和二氧化碳来将菌体周围的环境从酸性转化为碱性,由此可以中和具有强酸性的胃液。
作为用于治疗由上述幽门螺杆菌的感染引起的疾病的方法,优先会考虑利用抗生素的化学疗法,但是,存在持续使用抗生素而产生的出现耐抗生素菌株等的副作用,从而是不优选的,因此,就开发用于预防及治疗由幽门螺杆菌感染的新型疫苗而言,是非常急迫的实际情况。
对此,本发明人为了克服上述现有技术的问题而不断努力的结果,通过将幽门螺杆菌抗原接种于与鸡属于异种动物中而制备异源性抗体后,将由上述抗原与异源性抗体结合而成的复合物接种于产蛋鸡中而制备了卵黄抗体,此时,确认了不仅可以大量地制备并生产对于由幽门螺杆菌引起的疾病的免疫反应增强的卵黄抗体,而且在利用其制备疫苗时可以大量地制备并生产对于幽门螺杆菌的免疫反应增强的卵黄抗体,从而完成了本发明。
现有技术文献
韩国KR 10-2009-0088121 A
J.S.de Bono JS et al.,Annals of Oncology.2004Dec;15(12):1825-33
发明内容
技术问题
因此,本发明的主要目的涉及可以大量地制备并生产对于幽门螺杆菌的免疫反应增强的卵黄抗体的抗幽门螺杆菌卵黄抗体的制备方法。
技术方案
根据本发明的一个实施方式,本发明提供抗幽门螺杆菌卵黄抗体的制备方法,包括:第一步骤,利用幽门螺杆菌(Helicobacter pylori)制备抗原;第二步骤,将上述第一步骤的抗原接种于与鸡属于异种动物的小鼠或兔中而制备异源性抗体;第三步骤,结合上述第一步骤的抗原与上述第二步骤的异源性抗体而制备抗原-异源性抗体复合物;第四步骤,将由第一步骤的抗原及第三步骤的复合物混合而成的混合物接种于产蛋鸡中;以及第五步骤,从上述第四步骤的产蛋鸡的卵(egg)中分离针对幽门螺杆菌的卵黄抗体。
卵黄抗体(Immunoglobulin Yolk,IgY)是作为存在于产蛋鸡的血清中的特异性抗体的免疫球蛋白(IgG)移动至鸡蛋的卵黄而生成的抗体,在鸡蛋的卵黄中以高浓度地堆积,且分离容易,从而正在各种领域中被利用。为了大量地制备并生产这种卵黄抗体而进行研究和努力的结果,当将抗原-抗体复合物被利用为佐剂且作为抗体利用异源性抗体时,可增强免疫反应,考虑到这种事实,在利用由抗原与异源性抗体结合而成的复合物来制备卵黄抗体的情况下,确认了可大量地制备并生产对于抗原的免疫反应增强的抗幽门螺杆菌卵黄抗体,从而完成了本发明。
本发明的卵黄抗体的制备方法的特征在于,在上述第二步骤中,作为异种动物,可利用以往为了制备抗体而使用的任何哺乳类,优选地,上述哺乳类为小鼠或兔。
本发明的卵黄抗体的制备方法中,在上述第四步骤中,优选地,抗原及复合物的混合比例为3:0.5~1:0.1。在复合物的比例大于上述比例的情况下,存在对复合物由过多免疫细胞的识别引起的问题,在小于上述比例的情况下,难以发挥根据适用复合物的充分效果。
本发明的卵黄抗体的制备方法的特征在于,在上述第四步骤中,混合物还包含佐剂(adjuvant)。作为上述佐剂,可以使用弗氏完全佐剂(complete Freund's adjuvant)、弗氏不完全佐剂、阳离子脂质体(lipofectin)、脂质体(lipotaxi)、CaPO
本发明的卵黄抗体的制备方法的特征在于,上述混合物及佐剂(adjuvant)的混合比例可以为2~3:7~9,优选地,混合比例为3:7。混合物的混合比例越高,产生作为乳化剂的佐剂的功能越下降的问题,从而在与抗原混合时产生水溶性层与脂溶性层分离的现象,因此,维持上述比例是非常重要的。
本发明的卵黄抗体的制备方法的特征在于,在上述第四步骤中,能够以0.1ml至3ml接种2次至5次,优选地,以0.5ml至1ml接种3次。
本发明的卵黄抗体的制备方法的特征在于,上述卵黄抗体的制备方法使卵黄抗体的生产收率增加。
根据本发明一实验例,确认了根据本发明的制备方法的卵黄抗体的生产收率的结果,可以确认,相比于向产蛋鸡中仅注入抗原而制备卵黄抗体(比较例),在向产蛋鸡中注入抗原及抗原-异源性抗体复合物而制备卵黄抗体(实施例)的情况下,在卵黄中的抗体含量增加。鉴于难以显著增加抗体的整体生产量的事实,这种结果可教导如下事实,即,在本发明的制备方法中,增加卵黄抗体的生产使抗原-异源性抗体复合物作为抗体生产的佐剂赋予协同效果,从而可大量地制备并生产卵黄抗体(参照实验例3及表4)。
并且,根据本发明一实验例,确认了根据本发明的制备方法生产的卵黄抗体的抗原结合力的结果,可以确认,相比于向产蛋鸡中仅注入抗原来生产的卵黄抗体(比较例),在向产蛋鸡中注入抗原-异源性抗体复合物来生产的卵黄抗体(实施例)的情况下,对抗原的凝聚力优秀。这种结果示出,在根据本发明的制备方法制备卵黄抗体的情况下,增加对特定抗原的特异性卵黄抗体的生成,且结论上对抗原的优秀的凝聚力可以教导增强对于幽门螺杆菌抗原的免疫反应。并且,上述凝聚力将注入在产蛋鸡中的抗原-异源性抗体复合物识别为最初抗原,即,将幽门螺杆菌识别为抗原,从而教导生成了对于上述抗原的IgY(参照实验例4、图4及图5)
通过上述本发明的抗幽门螺杆菌卵黄抗体的制备方法制备的卵黄抗体可以用作用于预防或治疗如胃炎、胃溃疡、胃十二指肠溃疡、消化性溃疡或胃炎等由幽门螺杆菌引起的疾病的疫苗组合物,上述疫苗可以与药剂学上可接受的载体、佐剂或赋形剂一起使用。
作为用于本发明的疫苗的载体,可以使用包含水化的蛋白质、乳糖等一种以上稳定剂的生理学上均衡定制的培养基,可以使用0.01M至0.1M的磷酸缓冲液或0.8%的生理盐水。作为药学上可接受的载体,还可以使用溶液或非溶液、悬浮液、乳液等形态。作为非溶液溶剂的实例,可以使用如丙二醇、聚乙二醇、橄榄油等植物油以及如油酸乙酯等注射用有机酯。作为溶液性载体,可以使用如水、醇类溶液、乳液或生理盐水及缓冲培养液等悬浮液。
作为用于本发明的疫苗的赋形剂及稀释剂,可以使用乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁、十六烷醇、硬脂醇、液状石蜡、硬脂酸山梨糖醇酐酯、聚山梨酯60、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯及矿物油。
本发明的疫苗可通过口服、直肠、局部、静脉内、腹腔内、肌肉内、动脉内、经皮、鼻侧内、吸入、眼球内或皮内路径以常规方式进行给药。非口服给药是指包括静脉内、肌肉内、腹腔内、胸骨内、经皮及动脉内注射及注入的方式。
本发明的疫苗的非口服给药中,优选地,在优选纯度条件下通过对药剂学上可接受的载体,即,在所使用的浓度和给药量中对受体无毒性且可与其他制剂成分化合的物质进行混合来配制成单位给药量的剂型。
并且,本发明的疫苗的剂型可以使用为任何剂型,所制备的剂型可用作口服用剂型、注射用剂型、涂覆用剂型。上述剂型可配制成片剂、胶囊剂、软质胶囊剂、输液剂、颗粒剂、丸剂或注射用形态(溶液、悬浮液或乳浊液),最优选地,配制成注射用。
发明的效果
如上所述,本发明的抗幽门螺杆菌卵黄抗体的制备方法可通过将抗原-异源性抗体复合物注入于产蛋鸡中来制备并生产大量的卵黄抗体,由此制备而成的卵黄抗体对幽门螺杆菌的特异性及结合性高,因此,可有效抑制上述菌的生长。
附图说明
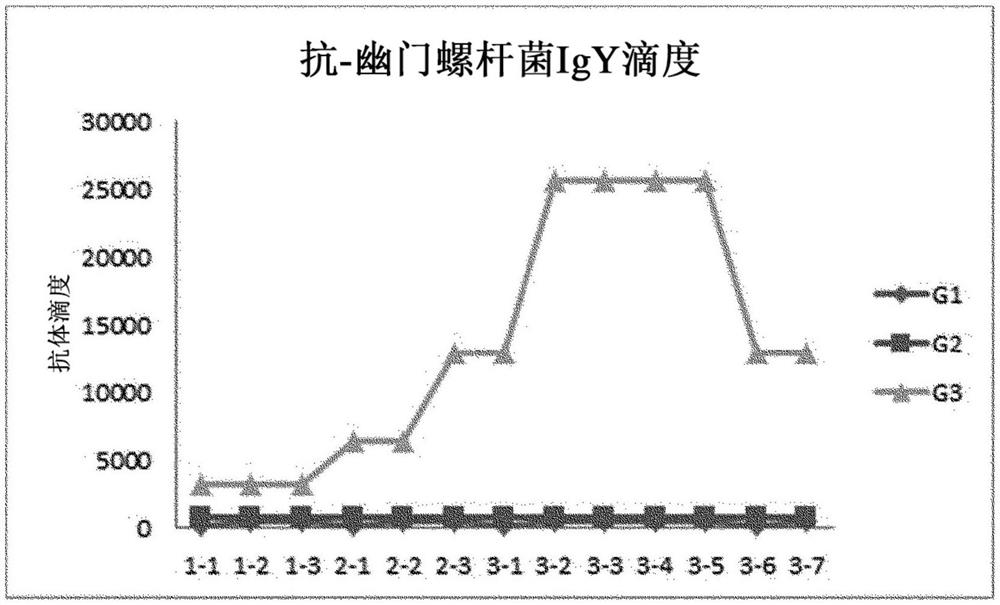
图1为示出根据实验例1的抗体滴度测定结果的图。
图2及图3为示出确认根据实验例2的卵黄抗体的结果的图(图2,十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)(12%的凝胶染色剂(gel staining));图3,蛋白质印迹法(Western-blot);1,天然鸡IgY蛋白(Natural-IgY protein)(cat#.ab119138);2,H.pylori-IgY;3,H.pylori+单克隆抗体复合IgY(mAB complex-IgY))。
图4及图5为示出确认根据实验例4的抗原结合力的结果的图(图4,比较例;图5,实施例)。
具体实施方式
以下,通过实施例更详细说明本发明。这些实施例仅用于例示本发明,因此,不应解释为本发明的范围限定于这些实施例。
1)幽门螺杆菌(Helicobacter pylori,H.pylori)
使用从ATCC购买的43504菌株作为幽门螺杆菌(Helicobacter pylori)。利用灭菌的棉棒将菌刮掉(scraping)到血琼脂(blood Agar)中而放置于装有气包(Gas-pak)的袋子中,在37℃的培养器中在CO
通过使在上述制备例1中生产的抗原失活来抑制毒性后,进行冷藏保管后使用。使用完全佐剂(complete adjuvant)制备了小鼠抗体制备用疫苗。制备抗原疫苗而根据常规的小鼠抗体制备方法制备了抗体。在生产完后回收的血清(Serum)中利用蛋白A柱(protein-A column)来纯化小鼠抗体。
为了结合在上述制备例1中生产的抗原与在制备例2中生产的小鼠抗体,进行了如下的试验。在失活的混合疫苗中混合100μg的针对每个抗原生成的小鼠抗体,以在4℃的温度下过夜(Over night)的方式诱导抗原抗体结合。将结合完的样品离心分离并回收后,作为产蛋鸡接种用样品来利用。
为了制备混合疫苗,将在制备例1中准备的每个抗原及单克隆抗体复合物(mAbcomplex)与佐剂(adjuvant)以3:7左右的比例混合后,利用均质机(Homogenizer)制备失活疫苗后,通过无菌检测和失活确认试验来准备用于生产特异性卵黄抗体的混合疫苗。
通过向25周龄的海兰褐鸡(Hyine-browen)类产蛋鸡中接种所制备的疫苗来完成产蛋鸡接种。在胸肌中接种1ml,以3周为间隔接种3次。接种组如下列表1所示。并且,疫苗的组成如表2所示。
表1
表2
1)ELISA包被的制备
在8000rpm的条件下离心分离在制备例1中所生产的抗原50分钟。离心分离后丢弃上层液,利用HEPES缓冲液使球团(pellet)再悬浮(suspension)后经过超声波破碎(sonication)进行溶解(Lysis)来获得上层液,并将获得的上清液在8000rpm、4℃的条件下进行离心30分钟来获得上层液。向所获得的上层液中添加1%的N-月桂酰肌氨酸(N-Lauroly sarcosine)(SIGMA,L-9150)以使最终浓度达到0.01%后,在室温下处理10分钟。经过处理后,在15000rpm、4℃的条件下实行离心50分钟来去除N-月桂酰肌氨酸(SIGMA,L-9150),再次利用50ml的HEPES缓冲液再次进行悬浮而在15000rpm、4℃的条件下离心分离50分钟来回收OMP。利用BCA法对蛋白质进行定量后,包被所回收的抗原以使浓度达到200ng/ml而使用于抗体滴度测定。
2)利用ELISA的抗体滴度测定
利用间接ELISA方法(Indirect ELISA method)测定了卵黄中的特异性卵黄抗体的滴度。首先,将抗原稀释于包被缓冲液(coating buffer)中并按照每个孔(well)为100μl包被(Coating)于96孔的聚苯乙烯板(96well polystyrene plate)且在4℃的温度下过夜(over night)(或者,在37℃的温度下放置1小时)。利用PBS-T(磷酸盐缓冲液(phosphatebuffer saline),0.05%的吐温20(Tween 20),pH 7.4)洗涤后利用含有BSA的PBS缓冲液在37℃的温度下封闭(blocking)1小时,并以如上述的方法进行洗涤。分别以2倍(2×)稀释阴性对照物、阳性对照组及样品并向每个孔(Well)中放入100μl,在37℃的温度下静置1小时。经过1小时后,洗涤3次,将适当量的第二抗体(anti-chicken:Sigma,U.S.A)稀释于PBS中并向每个孔(Well)中分株100μl后,在37℃的温度下进行反应1小时。之后,洗涤3次,向每个孔(Well)中分株100μl的底物(substrate)(OPD,sigma)后,在室温下进行反应约10分钟,分株50μl的终止液(Stop solution)来终止反应,在450nm的波长条件下利用酶联免疫检测仪(ELISA reader)测定每个孔(well)的吸光度,并用ELISA值(value)表示。在所测定的结果中将阴性的值乘以2后代入所处理的卵黄的测定值而在下列表3及图1中表示了分析数据(Data)的滴度。
表3
其结果,如上述表3所示,在将异源性抗体与抗原结合并将其与额外的抗原一起接种于产蛋鸡中的实施例中,在第一次至第三次的接种中抗体的滴度在整体上相比于比较例非常高。
为了从所接种的卵黄中利用硫酸铵(Ammonium sulfate)分离抗体后确认分离纯度,进行了试验。
具体地,通过回收在按每个组(对照组、比较例及实施例)生产的卵黄中显示最高抗体滴度的经过2~3周的鸡蛋来从卵黄中分离IgY。分离卵黄与卵白而仅收集卵黄后,在所回收的卵黄中用净化水(D.W)并搅拌30分钟。对与净化水一起搅拌的样品反复进行冷冻和解冻来分离脂质,且回收水溶性蛋白质样品。向所回收的样品中添加硫酸铵(Anmoniumsulfate)后,在4℃下冷藏保管以使卵黄抗体沉淀。回收在冷藏过程中沉淀18小时的样品,在4℃、6000rpm的条件下进行离心分离来回收后,利用PBS对于向回收的抗体样品中用PBS进行再悬浮的样品进行透析来获得最终样品。利用BCA蛋白质定量试剂盒(kit)对所获得的样品进行定量后,在12%的SDS-PAGE凝胶中确认分离纯度,并将其结果表示在图2、图3中。
其结果,如图2中可以确认,试验结果显示,分离结果与市售的经纯化的卵黄抗体并没有多大差异,而且,通过蛋白质印迹(Western-blot)试验确认的结果都是抗体蛋白,因此,认为抗体的纯分离进行得非常好。
利用高效液相色谱(HPLC)进行卵黄抗体定量试验。使用艾博抗(abcam)公司的普通鸡IgY(normal chicken IgY)作为用于定量的IgY标准物质(Abcam Cat No ad119138)。选取作为标准溶液的普通IgY(normal IgY)并在12000rpm的条件下进行离心20秒分离而使用上层液。利用蒸馏水将离心分离的标准溶液稀释为5种浓度来制作标准曲线。将标准溶液稀释为1mg/ml、0.5mg/ml、0.25mg/ml、0.125mg/ml、0.0625mg/ml的浓度来使用。将卵黄液稀释为0.2mg/ml的浓度后利用振荡机解冻5分钟。在3000rpm的条件下离心分离上述溶液5分钟选取上层液,并利用0.45μm的注射器式过滤器过滤上层液,之后利用HPLC对所过滤的上层液进行测量。将标准溶液按照浓度(1mg/mL、0.5mg/mL、0.25mg/mL、0.125mg/mL、0.0625mg/mL)在高效液相色谱中进行测量,从而绘制根据标准溶液的浓度的线性曲线图而求出绘制的线性曲线图的线性公式,将在高效液相色谱中测定的试验溶液的值导入线性公式来进行计算,并将其结果表示在表4中。
表4
其结果,如上述表4中可以确认,相比于疫苗未接种组(对照组),疫苗接种组的卵黄抗体的含量显示增加,且相比于比较例,实施例的卵黄内抗体含量显示增加。
为了确认本发明的抗体的抗原结合力,进行了比较例和实施例与H.pylori的凝聚反应试验。具体地,在96孔板(well plate)将H.pylori悬浊于PBS缓冲液(Buffer)(pH7.4)中而在每个OD=1.0(405nm)孔(Well)中包被(coating)100μl后,在室温下培养(incubation)2小时。将H.pylori IgY、H.pylori、单克隆抗体复合物的IgY样品(Sample)从15mg/ml的浓度开始(starting)稀释2倍并进行10个步骤来准备。向每个孔(well)中分株100μl,在室温下培养(incubation)2小时后,利用×200倍的光学显微镜观察凝聚程度,将其结果显示在图4及图5中。
其结果,如图4及图5中可以确认,在15mg/mL的浓度中H.pylori的凝聚反应,在实施例(图5)中相比于比较例(图4),显示出非常剧烈。并且,可以确认:比较例(图4)中的未产生凝聚反应的抗体的浓度为7.5mg/mL,与此相反,实施例(图5)中的未产生凝聚反应的抗体的浓度为0.47mg/mL。即,相比于对H.pylori抗原的卵黄抗体,本发明的卵黄抗体对H.pylori抗原的结合力更优秀,且在更低的浓度中抗原结合力也优秀。
- 抗幽门螺杆菌卵黄抗体的制备方法
- 一种抗幽门螺杆菌的卵黄抗体制备方法及应用
