三嗪化合物、有机电致发光元件用材料和有机电致发光元件
文献发布时间:2023-06-19 11:55:48
技术领域
本申请涉及三嗪化合物、有机电致发光元件用材料和有机电致发光元件。
背景技术
有机电致发光元件以小型移动用途为中心开始实用化。然而,对于进一步的用途扩大而言,必须提高性能,要求具有高的发光效率特性、长寿命特性的材料。另外,有机电致发光元件在用于气温高的地区、车载用途时需要设想在高温下使用,因此,作为有机电致发光元件用材料,要求具有高的玻璃化转变温度。
专利文献1公开了一种三嗪化合物,其为能够以高效率降低驱动电压的有机电致发光元件用材料。
专利文献2公开了一种三嗪化合物,其为具有高的耐热性、能够降低驱动电压的有机电致发光元件用材料。
现有技术文献
专利文献
专利文献1:日本特开2017-178931号公报
专利文献2:日本特开2011-63584号公报
发明内容
然而,市场对于用途扩大、可使用环境扩大的要求非常强烈,关于高的玻璃化转变温度、高的发光效率和长寿命特性这三个特性,专利文献1和2所述的三嗪化合物不能说充分满足了这些特性,寻求以更高水平实现前述三个特性。
于是,本申请的一个方式致力于提供有助于形成发挥高发光效率和长寿命特性的有机电致发光元件且具有高玻璃化转变温度的三嗪化合物。
另外,本申请的另一个方式致力于提供包含上述三嗪化合物的有机电致发光元件用材料。
进而,本申请的另一个方式致力于提供发挥高发光效率和长寿命特性且能够在各种用途或各种环境下利用的有机电致发光元件。
本申请的一个方式的三嗪化合物为式(1)所示的三嗪化合物:
式(1)中,
Ar
Ar
属于三环式稠环或四环式稠环的芳香族烃基、
属于三环式稠环或四环式稠环的仅由六元环组成的含氮芳香族基团、或
属于三环式稠环或四环式稠环的杂原子为第ⅥA族元素的杂芳香族基团;
Ar
Ar
X表示亚苯基、亚萘基、氮杂亚苯基、二氮杂亚苯基、氮杂亚萘基或二氮杂亚萘基;
p表示0、1或2;
其中,在p为2时,两个X任选彼此相同或不同。
本申请的另一个方式的有机电致发光元件用材料含有上述三嗪化合物。
本申请的另一个方式的有机电致发光元件含有上述三嗪化合物。
根据本申请的一个方式,能够提供有助于形成发挥高发光效率和长寿命特性的有机电致发光元件且具有高玻璃化转变温度的三嗪化合物。另外,根据本申请的另一个方式,能够提供包含上述三嗪化合物的有机电致发光元件用材料。进而,根据本申请的另一个方式,能够提供发挥高发光效率和长寿命特性且能够用于各种用途的有机电致发光元件。
附图说明
图1为示出本申请的一个方式的有机电致发光元件的层叠构成的一例的截面示意图。
图2为示出本申请的一个方式的有机电致发光元件的其它层叠构成的例子(元件实施例-1的构成)的截面示意图。
具体实施方式
以下,详细说明本申请的一个方式的三嗪化合物。
<三嗪化合物>
本申请的一个方式的三嗪化合物为式(1)所示的三嗪化合物:
式(1)中,
Ar
Ar
属于三环式稠环或四环式稠环的芳香族烃基、
属于三环式稠环或四环式稠环的仅由六元环组成的含氮芳香族基团、或
属于三环式稠环或四环式稠环的杂原子为第ⅥA族元素的杂芳香族基团;
Ar
Ar
X表示亚苯基、亚萘基、氮杂亚苯基、二氮杂亚苯基、氮杂亚萘基或二氮杂亚萘基;
p表示0、1或2;
其中,在p为2时,两个X任选彼此相同或不同。
以下,有时也将式(1)所示的三嗪化合物称为三嗪化合物(1)。三嗪化合物(1)中的取代基的定义及其优选具体例分别如下所述。
[关于Ar
Ar
Ar
关于三嗪化合物(1),从电子输送性材料特性优异的方面出发优选的是,Ar
作为Ar
[关于Ar
式(1)中,Ar
属于三环式稠环或四环式稠环的芳香族烃基、
属于三环式稠环或四环式稠环的仅由六元环组成的含氮芳香族基团、或
属于三环式稠环或四环式稠环的杂原子为第ⅥA族元素的杂芳香族基团。
Ar
作为属于三环式稠环或四环式稠环的芳香族烃基,可列举出例如菲基、蒽基、芘基、芴基、苯并芴基、苯并菲基或荧蒽基等。这些基团任选被选自由氟原子、甲基、苯基、氮杂苯基、二氮杂苯基、萘基、氮杂萘基和二氮杂萘基组成的组中的1个以上基团取代。
关于三嗪化合物(1),从更有助于形成高性能的有机电致发光元件的方面出发优选的是,Ar
另外,从容易合成三嗪化合物(1)的方面出发,Ar
作为属于三环式稠环或四环式稠环的仅由六元环组成的含氮芳香族基团,可列举出例如苯并[b]喹啉基、苯并[c]喹啉基、苯并[f]喹啉基、苯并[g]喹啉基、苯并[h]喹啉基、吩嗪基、氮杂芘基、二氮杂芘基、氮杂苯并菲基、二氮杂苯并菲基等。这些基团任选被选自由氟原子、甲基、苯基、萘基、氮杂苯基、二氮杂苯基、氮杂萘基和二氮杂萘基组成的组中的1个以上基团取代。
关于三嗪化合物(1),从更有助于形成高性能的有机电致发光元件的方面出发优选的是,Ar
作为属于三环式稠环或四环式稠环的杂原子为第ⅥA族元素的杂芳香族基团,可列举出例如二苯并噻吩基、二苯并呋喃基、苯并萘并呋喃基、苯并萘并噻吩基等。这些基团任选被选自由氟原子、甲基、苯基、萘基、氮杂苯基、二氮杂苯基、氮杂萘基和二氮杂萘基组成的组中的1个以上基团取代。
关于三嗪化合物(1),从更有助于形成高性能的有机电致发光元件的方面出发优选的是,Ar
[关于Ar
Ar
作为Ar
关于三嗪化合物(1),从更有助于形成高性能的有机电致发光元件的方面出发优选的是,Ar
[关于X]
X表示亚苯基、氮杂亚苯基、二氮杂亚苯基、亚萘基、氮杂亚萘基或二氮杂亚萘基。
作为X,例如可列举出1,2-亚苯基、1,3-亚苯基、1,4-亚苯基、2,3-亚吡啶基、2,4-亚吡啶基、2,5-亚吡啶基、2,6-亚吡啶基、2,4-亚嘧啶基、2,5-亚嘧啶基、2,5-亚吡嗪基、1,2-亚萘基、1,3-亚萘基、1,4-亚萘基、1,5-亚萘基、1,6-亚萘基、1,7-亚萘基、1,8-亚萘基、2,3-亚萘基、2,4-亚萘基、2,5-亚萘基、2,6-亚萘基、2,7-亚萘基、2,8-亚萘基、2,3-亚喹啉基、2,4-亚喹啉基、2,5-亚喹啉基、2,6-亚喹啉基、2,7-亚喹啉基、2,8-亚喹啉基、3,4-亚喹啉基、3,5-亚喹啉基、3,6-亚喹啉基、3,7-亚喹啉基、3,8-亚喹啉基、4,5-亚喹啉基、4,6-亚喹啉基、4,7-亚喹啉基、4,8-亚喹啉基、5,8-亚喹啉基、2,3-亚喹喔啉基、2,5-亚喹喔啉基、2,6-亚喹喔啉基、2,4-亚喹唑啉基、2,5-亚喹唑啉基、2,6-亚喹唑啉基等。
关于三嗪化合物(1),从更有助于形成高性能的有机电致发光元件的方面出发,X优选为亚苯基或氮杂亚苯基,更优选为1,2-亚苯基、1,3-亚苯基、1,4-亚苯基、2,3-亚吡啶基、2,4-亚吡啶基、2,5-亚吡啶基、2,6-亚吡啶基。
[关于p]
p表示0、1或2。p为2时,两个X任选彼此相同或不同。
关于三嗪化合物(1),从更有助于形成高性能的有机电致发光元件的方面出发,更优选p为0或1。
[三嗪化合物(1)的具体例]
作为三嗪化合物(1)的具体例,可例示出以下的(A-1)~(A-285),但本申请不限定于这些。从作为有机电致发光元件中的电子输送材料的性能良好的方面出发,作为三嗪化合物(1),优选(A-3)、(A-39)、(A-49)、(A-53)、(A-54)、(A-58)、(A-62)、(A-98)、(A-106)、(A-122)、(A-129)、(A-130)、(A-182)、(A-254)、(A-269)所示的化合物。
接着,说明三嗪化合物(1)的制造方法。
三嗪化合物(1)可通过以下的合成路线(i)~(vi)所示的方法来制造。
合成路线(i)
合成路线(ii)
合成路线(iii)
合成路线(iv)
合成路线(v)
合成路线(vi)
式(2)~(12)中,
Ar
Y
R
B(OR
两个R
作为Y
作为B(OR
作为两个R
合成路线(i)~(vi)中的偶联反应为使式(2)、(3)、(4)、(11)或(12)所示的芳基卤化物与式(5)、(6)、(7)、(8)、(9)或(10)所示的硼化合物在钯催化剂和碱的存在下进行反应的方法,可以应用通常的铃木-宫浦反应的反应条件。
硼化合物可以根据例如The Journal of Organic Chemistry,60卷,7508页,1995年或The Journal of Organic Chemistry,65卷,164页,2000年中公开的方法来制造。
芳基卤可以根据例如Journal of the American Chemical Society,74卷,6289页,1952年或Synlett,808页,2002年来制造。另外,也可以使用市售品。从反应收率良好的方面出发,芳基卤优选相对于硼化合物使用0.5~3.0摩尔当量。
合成路线(iii)~(vi)中的硼化反应为使式(2)、(3)或(4)所示的芳基卤化物在钯催化剂和碱的存在下与硼原料(例如频哪醇硼烷、双联频哪醇基二硼等)进行反应而制造式(5)、(6)、(7)或(8)所示的硼化合物的方法。这些硼化合物可以根据例如The Journal ofOrganic Chemistry,60卷,7508页,1995年或Tetrahedron Letters,38卷,3447页,1997年中公开的方法来制造。
作为前述偶联反应和硼化反应中使用的钯催化剂,可列举出例如氯化钯、乙酸钯、三氟乙酸钯、硝酸钯等钯盐。进而,可列举出π-烯丙基氯化钯二聚体、乙酰丙酮钯、三(二亚苄基丙酮)二钯、双(二亚苄基丙酮)钯、双(乙腈)二氯钯、双(苯甲腈)二氯钯等配位化合物;以及双(三苯基膦)二氯钯、四(三苯基膦)钯、(1,1’-双(二苯基膦)二茂铁)二氯钯、双(三叔丁基膦)钯、双(三环己基膦)钯、双(三环己基膦)二氯钯等具有叔膦作为配体的钯络合物。也可以在这些钯盐或配位化合物中添加叔膦,在反应体系中制备。
作为叔膦,可列举出例如三苯基膦、三甲基膦、三丁基膦、三(叔丁基)膦、三环己基膦、叔丁基二苯基膦、9,9-二甲基-4,5-双(二苯基膦)呫吨、2-(二苯基膦)-2’-(N,N-二甲基氨基)联苯、2-(二叔丁基膦)联苯、2-(二环己基膦)联苯、双(二苯基膦)甲烷、1,2-双(二苯基膦)乙烷、1,3-双(二苯基膦)丙烷、1,4-双(二苯基膦)丁烷、1,1’-双(二苯基膦)二茂铁、三(2-呋喃基)膦、三(邻甲苯基)膦、三(2,5-二甲苯基)膦、(±)-2,2’-双(二苯基膦)-1,1’-联萘、2-二环己基膦-2’,4’,6’-三异丙基联苯等。
其中,从收率良好的方面出发,优选具有叔膦作为配体的钯络合物,进一步优选具有2-二环己基膦-2’,4’,6’-三异丙基联苯或三环己基膦作为配体的钯络合物。
叔膦与钯盐或配位化合物的摩尔比优选为1:10~10:1的范围,从收率良好的方面出发,进一步优选为1:2~3:1的范围。前述偶联反应和硼化反应中使用的钯催化剂的量没有限制,从收率良好的方面出发,相对于硼化合物,钯催化剂的摩尔当量优选处于0.005~0.5摩尔当量的范围。
作为前述偶联反应和硼化反应中使用的碱,例如可列举出氢氧化钠、氢氧化钾、氢氧化钙等金属氢氧化物盐、碳酸钠、碳酸钾、碳酸锂、碳酸铯等金属碳酸盐、乙酸钾、乙酸钠等金属乙酸盐、磷酸钾、磷酸钠等金属磷酸盐、氟化钠、氟化钾、氟化铯等金属氟化物盐、甲醇钠、甲醇钾、乙醇钠、异丙醇钾、叔丁醇钾等金属醇盐等。其中,从反应收率良好的方面出发,优选金属碳酸盐或金属磷酸盐,进一步优选碳酸钾或磷酸钾。所用的碱的量没有特别限制。从反应收率良好的方面出发,碱与硼化合物的摩尔比优选为1:2~10:1的范围、进一步优选为1:1~4:1的范围。
用于前述偶联反应和硼化反应时,可以在溶剂中实施。
作为溶剂,可列举出水、二异丙基醚、二丁基醚、环戊基甲基醚(CPME)、四氢呋喃(THF)、2-甲基四氢呋喃、1,4-二噁烷、二甲氧基乙烷等醚;苯、甲苯、二甲苯、均三甲苯、四氢化萘等芳香族烃;碳酸亚乙酯、碳酸亚丙酯、碳酸二甲酯、碳酸二乙酯、碳酸甲乙酯、4-氟碳酸亚乙酯等碳酸酯;乙酸乙酯、乙酸丁酯、丙酸甲酯、丙酸乙酯、丁酸甲酯、γ-内酯等酯;N,N-二甲基甲酰胺(DMF)、二甲基乙酰胺(DMAc)、N-甲基吡咯烷酮(NMP)等酰胺;N,N,N’,N’-四甲基脲(TMU)、N,N’-二甲基亚丙基脲(DMPU)等脲;二甲基亚砜(DMSO)、甲醇、乙醇、异丙醇、丁醇、辛醇、苯甲醇、乙二醇、丙二醇、二乙二醇、三乙二醇、2,2,2-三氟乙醇等醇等。它们可以仅使用1种,也可以以任意的比例混合使用。溶剂的用量没有特别限制。它们之中,从反应收率良好的方面出发,优选水、醚、酰胺、醇和它们的混合溶剂,进一步优选THF与水的混合溶剂、或者甲苯与1-丁醇的混合溶剂。
前述偶联反应和硼化反应可以在从0℃~200℃中适当选择的温度下实施,从反应收率良好的方面出发,优选在从60℃~160℃中适当选择的温度下实施。
关于前述偶联反应和硼化反应,通过在反应结束后根据需要适当组合重结晶、柱层析、升华纯化、制备HPLC等通常的纯化处理,从而能够得到目标物。
三嗪化合物(1)例如可以用于有机电致发光元件、光电元件等有机电子元件用途。
<有机电致发光元件用材料>
本申请的一个方式的有机电致发光元件用材料含有前述三嗪化合物(1)。
三嗪化合物(1)例如可以用作有机电致发光元件用电子输送材料。包含三嗪化合物(1)的有机电致发光元件用材料有助于制作发挥高发光效率和长寿命特性且能够在各种用途或各种环境下利用的有机电致发光元件。
<有机电致发光元件>
以下说明包含三嗪化合物(1)的有机电致发光元件(以下有时简称为有机电致发光元件)。
本申请的一个方式的有机电致发光元件含有三嗪化合物(1)。
对有机电致发光元件的构成没有特别限定,例如可列举出以下所示的(i)~(v)的构成。
(i):阳极/发光层/阴极
(ii):阳极/空穴输送层/发光层/阴极
(iii):阳极/发光层/电子输送层/阴极
(iv):阳极/空穴输送层/发光层/电子输送层/阴极
(v):阳极/空穴注入层/空穴输送层/发光层/电子输送层/电子注入层/阴极
三嗪化合物(1)可以包含在上述任意层中,从有机电致发光元件的发光特性优异的方面出发,优选包含于选自由发光层、以及该发光层与阴极之间的层组成的组中的1层以上。因此,在上述(i)~(v)所示的构成的情况下,三嗪化合物(1)优选包含于选自由发光层、电子输送层和电子注入层组成的组中的1层以上。
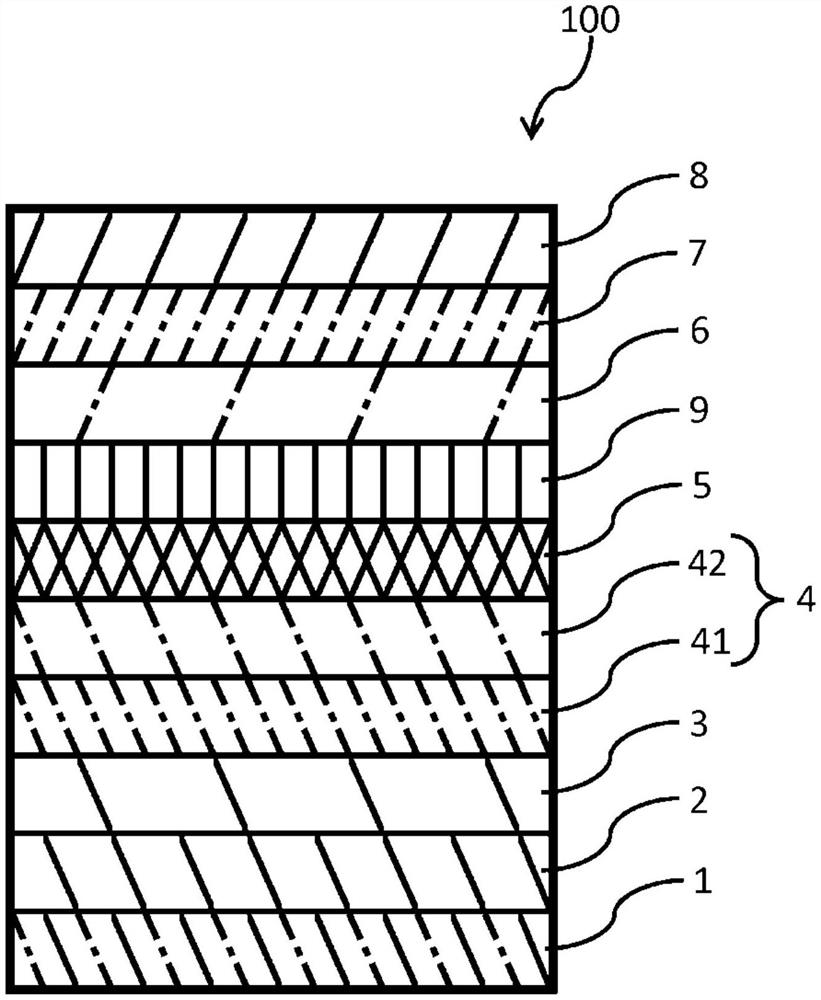
以下,举出上述(v)的构成作为例子,参照图1更详细地说明本申请的一个方式的有机电致发光元件。
需要说明的是,图1所示的有机电致发光元件具有所谓底部发射型的元件构成,本申请的一个方式的有机电致发光元件不限定于底部发射型的元件构成。即,本申请的一个方式的有机电致发光元件可以为顶部发射型等其它公知的元件构成。
图1为示出本申请的一个方式的包含三嗪化合物的有机电致发光元件的层叠构成的一例的截面示意图。
有机电致发光元件100依次具备基板1、阳极2、空穴注入层3、空穴输送层4、发光层5、电子输送层6、电子注入层7和阴极8。其中,这些层之中的一部分层可以被省略,反之,也可以追加其它层。例如,可以在发光层5与电子输送层6之间设有空穴阻挡层,也可以省略空穴注入层3而在阳极2上直接设有空穴输送层4。另外,也可以为例如具备以单一层兼具电子注入层的功能和电子输送层的功能的电子注入/输送层那样的、兼具多个层所具有的功能的单一层来代替该多个层的构成。进而,例如单层的空穴输送层4、单层的电子输送层6也可以分别由多层形成。
<<含有三嗪化合物(1)的层>>
图1所示的构成例中,有机电致发光元件100在选自由发光层5、电子输送层6和电子注入层7组成的组中的1层以上包含三嗪化合物(1)。特别优选电子输送层6包含三嗪化合物(1)。需要说明的是,三嗪化合物(1)可以包含在有机电致发光元件所具备的多个层中。
需要说明的是,以下说明电子输送层6包含三嗪化合物(1)的有机电致发光元件100。
[基板1]
作为基板1,没有特别限定,可列举出例如玻璃板、石英板、塑料板等。
作为基板1,可列举出例如玻璃板、石英板、塑料板、塑料薄膜等。它们之中,优选玻璃板、石英板、透光性塑料薄膜。
作为透光性塑料薄膜,例如可列举出由聚对苯二甲酸乙二醇酯(PET)、聚萘二甲酸乙二醇酯(PEN)、聚醚砜(PES)、聚醚酰亚胺、聚醚醚酮、聚苯硫醚、聚芳酯、聚酰亚胺、聚碳酸酯(PC)、三醋酸纤维素(TAC)、醋酸丙酸纤维素(CAP)等形成的薄膜。
需要说明的是,从基板1侧取出发光的构成的情况下,基板1对于光的波长是透明的。
[阳极2]
在基板1上(空穴注入层3侧)设有阳极2。
作为阳极的材料,可列举出功函数大(例如4eV以上)的金属、合金、导电性化合物和它们的混合物。作为阳极的材料的具体例,可列举出Au等金属;CuI、氧化铟锡(ITO;Indium Tin Oxide)、SnO
在透过阳极取出发光的构成的有机电致发光元件的情况下,阳极由使该发光通过或实质上通过的导电性透明材料形成。
[空穴注入层3、空穴输送层4]
在阳极2与后述发光层5之间,从阳极2侧起依次设有空穴注入层3、空穴输送层4。
空穴注入层、空穴输送层具有将由阳极注入的空穴传送至发光层的功能,通过将该空穴注入层、空穴输送层夹设在阳极与发光层之间,从而在更低的电场下向发光层中注入较多的空穴。
另外,空穴注入层、空穴输送层也作为电子势垒性的层发挥功能。即,利用在发光层与空穴注入层和/或空穴输送层的界面存在的电子的势垒,抑制从阴极注入且通过电子注入层和/或电子输送层向发光层输送的电子泄漏到空穴注入层和/或空穴输送层。其结果,该电子在发光层内的界面积蓄,带来提高发光效率等效果,得到发光性能优异的有机电致发光元件。
作为空穴注入层、空穴输送层的材料,具有空穴注入性、空穴输送性、电子势垒性中的至少任意者。空穴注入层、空穴输送层的材料可以为有机物、无机物中的任意者。
作为空穴注入层、空穴输送层的材料的具体例,可列举出三唑衍生物、噁二唑衍生物、咪唑衍生物、聚芳基烷烃衍生物、吡唑啉衍生物、吡唑啉酮衍生物、苯二胺衍生物、芳胺衍生物、氨基取代查尔酮衍生物、噁唑衍生物、苯乙烯基蒽衍生物、芴酮衍生物、腙衍生物、芪(stilbene)衍生物、硅氮烷衍生物、苯胺系共聚物、导电性高分子低聚物(特别是噻吩低聚物)、卟啉化合物、芳香族叔胺化合物、苯乙烯胺化合物等。它们之中,从有机电致发光元件的性能良好的方面出发,优选卟啉化合物、芳香族叔胺化合物、苯乙烯胺化合物,特别优选芳香族叔胺化合物。
作为芳香族叔胺化合物和苯乙烯胺化合物的具体例,可列举出N,N,N’,N’-四苯基-4,4’-二氨基苯基、N,N’-二苯基-N,N’-双(间甲苯基)-〔1,1’-联苯〕-4,4’-二胺(TPD)、2,2-双(4-二对甲苯基氨基苯基)丙烷、1,1-双(4-二对甲苯基氨基苯基)环己烷、N,N,N’,N’-四对甲苯基-4,4’-二氨基联苯、1,1-双(4-二对甲苯基氨基苯基)-4-苯基环己烷、双(4-二甲基氨基-2-甲基苯基)苯基甲烷、双(4-二对甲苯基氨基苯基)苯基甲烷、N,N’-二苯基-N,N’-二(4-甲氧基苯基)-4,4’-二氨基联苯、N,N,N’,N’-四苯基-4,4’-二氨基二苯基醚、4,4’-双(二苯基氨基)四联苯、N,N,N-三(对甲苯基)胺、4-(二对甲苯基氨基)-4’-〔4-(二对甲苯基氨基)苯乙烯基〕芪、4-N,N-二苯基氨基-(2-二苯基乙烯基)苯、3-甲氧基-4’-N,N-二苯基氨基苯乙烯基苯、N-苯基咔唑、4,4’-双〔N-(1-萘基)-N-苯基氨基〕联苯(NPD)、4,4’,4”-三〔N-(间甲苯基)-N-苯基氨基〕三苯基胺(MTDATA)等。
另外,p型-Si、p型-SiC等无机化合物也可作为空穴注入层的材料、空穴输送层的材料的一例而举出。
空穴注入层、空穴输送层可以为由一种或两种以上的材料形成的单结构,也可以是由相同组成或不同组成的多个层形成的层叠结构。
[发光层5]
在空穴输送层4与后述电子输送层6之间设有发光层5。
作为发光层的材料,可列举出磷光发光材料、荧光发光材料、热活化延迟荧光发光材料。发光层中,电子/空穴对发生再结合,其结果产生发光。
发光层可以由单一低分子材料或单一聚合物材料形成,更通常的是,由利用客体化合物进行掺杂而得到的主体材料形成。发光主要由掺杂物产生,可以具有任意的颜色。
作为主体材料,可列举出例如具有联苯基、芴基、三苯基甲硅烷基、咔唑基、芘基、蒽基的化合物。更具体而言,可列举出DPVBi(4,4’-双(2,2-二苯基乙烯基)-1,1’-联苯)、BCzVBi(4,4’-双(9-乙基-3-咔唑并亚乙烯基)-1,1’-联苯)、TBADN(2-叔丁基-9,10-二(2-萘基)蒽)、ADN(9,10-二(2-萘基)蒽)、CBP(4,4’-双(咔唑-9-基)联苯)、CDBP(4,4’-双(咔唑-9-基)-2,2’-二甲基联苯)、2-(9-苯基咔唑-3-基)-9-[4-(4-苯基苯基喹唑啉-2-基)咔唑、9,10-双(联苯基)蒽等。
作为荧光掺杂物,可列举出例如蒽、芘、并四苯、呫吨、苝、红荧烯、香豆素、罗丹明、喹吖啶酮、二氰基亚甲基吡喃化合物、噻喃化合物、聚甲炔化合物、吡喃鎓、噻喃鎓化合物、芴衍生物、二茚并芘衍生物、茚并苝衍生物、双(吖嗪基)胺硼化合物、双(吖嗪基)甲烷化合物、喹诺酮化合物等。荧光掺杂物也可以组合有从它们中选择的2种以上。
作为磷光掺杂物,可列举出例如铱、铂、钯、锇等过渡金属的有机金属络合物。
作为荧光掺杂物、磷光掺杂物的具体例,可列举出Alq3(三(8-羟基喹啉)铝)、DPAVBi(4,4’-双[4-(二对甲苯基氨基)苯乙烯基]联苯)、苝、双[2-(4-正己基苯基)喹啉](乙酰丙酮)合铱(III)、Ir(PPy)3(三(2-苯基吡啶)铱(III))和FIrPic(双(3,5-二氟-2-(2-吡啶基)苯基-(2-羧基吡啶基)铱(III)))等。
另外,发光材料不限定于仅含有在发光层中。例如,与发光层邻接的层(空穴输送层4或电子输送层6)也可以含有发光材料。由此能够进一步提高有机电致发光元件的电流效率。
发光层可以为由一种或两种以上的材料形成的单层结构,也可以为由相同组成或不同组成的多个层形成的层叠结构。
[电子输送层6]
在发光层5与后述电子注入层7之间设有电子输送层6。
电子输送层具有将由阴极注入的电子传送至发光层的功能。通过将电子输送层夹设在阴极与发光层之间,电子在更低的电场下被注入到发光层中。
电子输送层如前所述优选包含三嗪化合物(1)。另外,电子输送层除了包含三嗪化合物(1)之外,还可以进一步包含选自现有公知的电子输送材料中的1种以上。
需要说明的是,三嗪化合物(1)不包含在电子输送层中而是包含在其它层中的情况下,可以使用选自现有公知的电子输送材料中的1种以上作为构成电子输送层的电子输送材料。
作为现有公知的电子输送性材料,可列举出碱金属络合物、碱土金属络合物、土金属络合物等。作为碱金属络合物、碱土金属络合物、土金属络合物,可列举出例如8-羟基喹啉锂(Liq)、双(8-羟基喹啉)锌、双(8-羟基喹啉)铜、双(8-羟基喹啉)锰、三(8-羟基喹啉)铝、三(2-甲基-8-羟基喹啉)铝、三(8-羟基喹啉)镓、双(10-羟基苯并[h]喹啉)铍、双(10-羟基苯并[h]喹啉)锌、双(2-甲基-8-喹啉)氯镓、双(2-甲基-8-喹啉)(邻甲酚)镓、双(2-甲基-8-喹啉)-1-萘酚铝、双(2-甲基-8-喹啉)-2-萘酚镓等。
电子输送层可以为由一种或两种以上的材料形成的单层结构,也可以是由相同组成或不同组成的多个层形成的层叠结构。
本方式的有机电致发光元件中,为了提高电子注入性、提高元件特性(例如发光效率、恒压驱动或高耐久性),可以设置电子注入层。
[电子注入层7]
在电子输送层6与后述阴极8之间设有电子注入层7。
电子注入层具有将由阴极注入的电子传送至发光层的功能。通过将电子注入层夹设在阴极与发光层之间,电子在更低的电场下被注入到发光层中。
作为电子注入层的材料,可列举出芴酮、蒽醌二甲烷、联苯醌、二氧化噻喃、噁唑、噁二唑、三唑、咪唑、苝四羧酸、亚芴基甲烷、蒽醌二甲烷、蒽酮等有机化合物。另外,作为电子注入层的材料,也可列举出SiO
[阴极8]
在电子注入层7上设有阴极8。
仅取出透过阳极后的发光的构成的有机电致发光元件的情况下,阴极可以由任意的导电性材料形成。
作为阴极的材料,可列举出例如功函数小的金属(以下也称为电子注入性金属)、合金、导电性化合物和它们的混合物。此处,功函数小的金属是指例如4eV以下的金属。
作为阴极的材料的具体例,可列举出钠、钠-钾合金、镁、锂、镁/铜混合物、镁/银混合物、镁/铝混合物、镁/铟混合物、铝/氧化铝(Al
它们之中,从电子注入性和对氧化等的耐久性的方面出发,优选电子注入性金属与第二金属的混合物、例如镁/银混合物、镁/铝混合物、镁/铟混合物、铝/氧化铝(Al
[各层的形成方法]
以上说明的除电极(阳极、阴极)以外的各层例如可以通过真空蒸镀法、旋涂法、流延法、LB(Langmuir-Blodgett method)法等公知的方法进行薄膜化来形成。各层的材料可以单独使用,也可以根据需要与粘结树脂等材料、溶剂一起使用。
对如此形成的各层的膜厚没有特别限制,可以根据情况适当选择,通常为5nm~5μm的范围。
阳极和阴极可以通过利用蒸镀、溅镀等方法将电极材料进行薄膜化来形成。可以在蒸镀、溅镀时隔着期望形状的掩模形成图案,也可以在利用蒸镀、溅镀等形成薄膜后,通过光刻形成期望形状的图案。
阳极和阴极的膜厚优选为1μm以下、更优选为10nm以上且200nm以下。
需要说明的是,形成包含三嗪化合物(1)的层时,可以与上述现有公知的电子输送性材料组合使用。因此,例如可以将三嗪化合物(1)与现有公知的电子输送性材料共蒸镀,也可以在三嗪化合物(1)的层上层叠现有公知的电子输送性材料的层。
有机电致发光元件可以用作照明用、曝光光源那样的一种灯,也可以用作将图像投影到屏幕等的类型的投影装置、直接观看静态图像或动态图像的类型的显示装置(显示器)。使用有机电致发光元件作为视频播放用的显示装置时,作为驱动方式,可以为简单矩阵(无源矩阵)方式,也可以为有源矩阵方式。另外,通过使用2种以上的具有不同发光颜色的有机电致发光元件,能够制作全彩显示装置。
三嗪化合物(1)在用作电子输送层时,与现有公知的三嗪化合物相比,能够提供发光效率和长寿命特性显著优异的有机电致发光元件。进而,三嗪化合物(1)由于其空间位阻骨架而非晶性高,具有高的膜质稳定性。因此,可期待提高有机电致发光元件的驱动稳定性、提高发光效率等效果。此外,三嗪化合物(1)由于其特征性的骨架而化学稳定性高,能够有助于有机电致发光元件的长寿命化。
通过使用三嗪化合物(1)作为有机电致发光元件的电子输送层,可提供能够以高水平同时实现元件的低电压驱动、高效率化和长寿命化的三嗪化合物。进而,能够提供使用了三嗪化合物(1)的可发挥低电压驱动、高效率化和长寿命化的有机电致发光元件。
本申请的各方式包含下述[1]~[10]。
[1]:式(1)所示的三嗪化合物:
式(1)中,
Ar
Ar
属于三环式稠环或四环式稠环的芳香族烃基、
属于三环式稠环或四环式稠环的仅由六元环组成的含氮芳香族基团、或
属于三环式稠环或四环式稠环的杂原子为第ⅥA族元素的杂芳香族基团;
Ar
Ar
X表示亚苯基、亚萘基、氮杂亚苯基、二氮杂亚苯基、氮杂亚萘基或二氮杂亚萘基;
p表示0、1或2;
其中,在p为2时,两个X任选彼此相同或不同。
[2]:根据[1]所述的三嗪化合物,其中,Ar
[3]:根据[1]或[2]所述的三嗪化合物,其中,Ar
[4]:根据[1]~[3]中任一项所述的三嗪化合物,其中,Ar
[5]:根据[1]~[4]中任一项所述的三嗪化合物,其中,Ar
[6]:根据[1]~[5]中任一项所述的三嗪化合物,其中,Ar
[7]:根据[1]~[6]中任一项所述的三嗪化合物,其中,X为亚苯基或氮杂亚苯基。
[8]:根据[1]~[7]中任一项所述的三嗪化合物,其中,p为0或1。
[9]:一种有机电致发光元件用材料,其含有[1]~[8]中任一项所述的三嗪化合物。
[10]:一种有机电致发光元件,其含有[1]~[9]中任一项所述的三嗪化合物。
实施例
以下,基于实施例更详细地说明本发明,但本发明不受这些实施例的任何限定性解释。
[
[DSC测定(玻璃化转变温度、结晶温度、熔点)]
玻璃化转变温度、结晶温度和熔点的测定使用DSC(Differential scanningcalorimetry)装置DSC7020(产品名、Hitachi High-Tech Science Corporation.制)来进行。DSC测定中的参比使用氧化铝(Al
作为测定的前处理,对于试样,使温度以15℃/分钟的速度从30℃上升至熔点以上的温度而使其熔化后,用液态氮进行骤冷。接着,对于经前处理的试样,使温度以5℃/分钟的速度从30℃开始上升,测定玻璃化转变温度、结晶温度和熔点。
[FDMS测定]
FDMS测定使用日立制作所株式会社制的M-80B进行。
[发光特性测定]
关于有机电致发光元件的发光特性,在25℃的环境下对由各实施例(后述)制作的元件施加直流电流,使用亮度计BM-9(产品名、TOPCON TECHNOHOUSE CORPORATION制)进行评价。
合成实施例-1
在4-溴-3-氯苯甲酸(152g,650mmol)和DMF(2mL)中添加亚硫酰氯(295g,2.5mol),进行20小时加热回流。放冷至室温后,减压馏去低沸点馏分,得到4-溴-3-氯苯甲酰氯。该物质不经纯化地用于下一工序。
在氩气气氛下,使4-溴-3-氯苯甲酰氯(164g,650mmol)和苯甲腈(146g,1.4mol)在单氯苯中(1.3L)悬浊。边将该悬浊液用冰浴冷却,边滴加氯化锑(82mL,650mmol),在0℃下搅拌15分钟后,在70℃下搅拌12小时。反应后,边用冰浴冷却,边将反应混合物滴加到30%-氨水(2L)中,在室温下搅拌8小时。滤取所生成的固体,用水清洗。使得到的固体在甲苯(5L)中悬浊,在110℃下加热搅拌30分钟。将该悬浊液过滤,从滤液中减压馏去低沸点成分。将所得固体用甲醇和己烷清洗,将所得粗纯化物用甲苯重复进行重结晶,从而得到白色固体的2-(4-溴-3-氯苯基)-4,6-二苯基-1,3,5-三嗪(150g,55%)。
合成实施例-1
在氩气气氛下,使2-(4-溴-3-氯苯基)-4,6-二苯基-1,3,5-三嗪(10.1g,24mmol)、双联频哪醇基二硼(7.25g,29mmol)、双(三苯基膦)二氯化钯(842mg,1.2mmol)和乙酸钾(8.50g,86mmol)在THF中(48mL)悬浊,在80℃下进行21小时搅拌。放冷至室温后,在反应混合物中添加氯仿来提取有机层,进而将有机层用水、饱和碳酸氢钠水溶液、以及饱和食盐水进行清洗。在有机层中添加硫酸钠和活性炭并搅拌后,通过硅藻土过滤来去除固体成分,馏去溶剂。进而使该粗纯化物在己烷中悬浊并滤取,得到作为黄色固体的2-[3-氯-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基]-4,6-二苯基-1,3,5-三嗪(6.5g,52%)。
合成实施例-2
在氩气气氛下,使2-[3-氯-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基]-4,6-二苯基-1,3,5-三嗪(6.40g,14mmol)、3-溴-2,6-二甲基吡啶(2.1mL,16mmol)和双(三苯基膦)二氯化钯(295mg,0.42mmol)在THF中(28mL)悬浊。在该悬浊液中添加2.0M-磷酸钾水溶液(25mL),在80℃下搅拌16小时左右。放冷至室温后,在反应混合物中添加水和甲醇,将所析出的固体滤取,用水和甲醇清洗。将所得固体溶解于氯仿(600mL),用滤纸过滤不溶部后,在滤液中添加活性炭并搅拌一阵子。搅拌后,进行硅藻土过滤,从滤液中馏去低沸点成分,得到粗纯化物。将该粗纯化物用甲苯重复进行重结晶,从而得到作为目标物的2-[3-氯-4-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(2.8g,45%)。
合成实施例-3
在氩气气氛下,使2-[3-氯-4-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(2.53g,5.6mmol)和9-菲硼酸(1.88g,8.45mmol)在1-丁醇(56mL)和甲苯(51mL)的混合溶剂中悬浊。在该悬浊液中添加乙酸钯(126mg,0.56mmol)和2-二环己基膦-2’,4’,6’-三异丙基联苯(476mg,1.1mmol)的甲苯溶液(5mL)和5M-氢氧化钠水溶液(5mL),在120℃下搅拌41小时。放冷至室温后,在反应混合物中添加乙酸乙酯和氯仿来提取有机层,进而将有机层用水、接着用饱和食盐水进行清洗。在有机层中添加硫酸钠和活性炭并搅拌后,进行硅藻土过滤,馏去低沸点成分。将所得粗生成物通过利用甲苯的重结晶和硅胶柱层析(氯仿:乙酸乙酯=2:1)来进行纯化,从而得到作为目标物的2-[3-(菲-9-基)-4-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)(1.6g,48%)。
所得化合物A-39的玻璃化转变温度为135℃,熔点为292℃,未检测到结晶温度。
合成实施例-4
在氩气气氛下,使2-(4-溴-3-氯苯基)-4,6-二苯基-1,3,5-三嗪(8.03g,19mmol)、2-联苯硼酸(4.52g,23mmol)、双(三苯基膦)二氯化钯(667mg,1.0mmol)和2M-磷酸钾水溶液(34mL,68mmol)在THF中(190mL)悬浊,在80℃下进行21小时搅拌。放冷至室温后,在反应混合物中添加乙酸乙酯和水来提取有机层,进而将有机层用水、接着用饱和食盐水进行清洗。在有机层中添加硫酸钠和活性炭,进行搅拌。进而添加氯仿使其悬浊,通过硅藻土过滤来去除固体成分,从所得溶液中减压馏去低沸点成分。进而由该粗纯化物使用甲苯进行重结晶,从而得到作为白色固体的2-[2-氯-1,1’:2’,1”-三联苯-4-基]-4,6-二苯基-1,3,5-三嗪(收量为6.70g,收率为71%)。
合成实施例-5
在氩气气氛下,使所得2-[2-氯-1,1’:2’,1”-三联苯-4-基]-4,6-二苯基-1,3,5-三嗪(3.37g,6.8mmol)、9-菲硼酸(1.96g,8.8mmol)、乙酸钯(76mg,0.36mmol)、2-二环己基膦-2’,4’,6’-三异丙基联苯(324mg,0.68mmol)和5M-氢氧化钠水溶液(5.4mL,27mmol)在THF中(68mL)悬浊,在80℃下搅拌20小时。放冷至室温后,添加氯仿和水,提取有机层,进而将有机层用水、接着用饱和食盐水进行清洗。在有机层中添加硫酸钠和活性炭,进行搅拌。通过硅藻土过滤来去除固体成分,从溶液中减压馏去低沸点成分。进而由该粗纯化物使用甲苯进行重结晶,从而得到作为白色固体的4,6-二苯基-2-[2-(9-菲基)-1,1’:2’,1”-三联苯-4-基]-1,3,5-三嗪(化合物A-3)(收量为3.30g,收率为75%)。
合成实施例-6
在氩气气氛下,使2-[3”-氯-1,1’:2’,1”-三联苯-5”-基]-4,6-二苯基-1,3,5-三嗪(3.34g,6.7mmol)、9,9-二甲基-2-芴硼酸(2.40g,10mmol)、乙酸钯(76mg,0.34mmol)和2-二环己基膦-2’,4’,6’-三异丙基联苯(286mg,0.67mmol)在1,4-二噁烷(67mL)中悬浊。在该悬浊溶液中添加2M-氢氧化钠水溶液(6.1mL),在110℃下进行40小时搅拌。放冷至室温后,在反应混合物中添加水和氯仿,提取有机层,在抽出液中添加活性炭和硫酸钠并搅拌一阵子。搅拌后,进行硅藻土过滤,从滤液中馏去低沸点成分。将该粗纯化物从甲苯(115℃、5mL)重结晶,将所析出的固体过滤。进而将所得固体通过柱层析(己烷:氯仿=3:1)进行纯化,得到作为白色固体的2-[2-(9,9-二甲基-9H-芴-2-基)-1,1’:2’,1”-三联苯-4-基]-4,6-二苯基-1,3,5-三嗪(化合物A-98)(2.3g,52%)。
合成实施例-7
根据下述合成路线来合成4,6-二苯基-2-[2-(菲-9-基)-3’-(2,6-苯基吡啶-4-基)联苯-4-基]-1,3,5-三嗪(化合物A-49)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-49为FDMS=791。
合成实施例-8
根据下述合成路线来合成4,6-二苯基-2-[2-(菲-9-基)-4’-(2-吡啶基)联苯-4-基]-1,3,5-三嗪(化合物A-53)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-53为FDMS=791。
合成实施例-9
根据下述合成路线来合成4,6-二苯基-2-[2-(菲-9-基)-4’-(3-吡啶基)联苯-4-基]-1,3,5-三嗪(化合物A-54)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-54为FDMS=639。
合成实施例-10
根据下述合成路线来合成4,6-二苯基-2-[2-(菲-9-基)-3’-(3-吡啶基)联苯-4-基]-1,3,5-三嗪(化合物A-58)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-58为FDMS=639。
合成实施例-11
根据下述合成路线来合成4,6-二苯基-2-[2-(菲-9-基)-2’-(3-吡啶基)联苯-4-基]-1,3,5-三嗪(化合物A-62)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-62为FDMS=639。
合成实施例-12
根据下述合成路线来合成4,6-二苯基-2-[2-(蒽-9-基)-联苯-4-基]-1,3,5-三嗪(化合物A-129)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-129为FDMS=639。
合成实施例-13
根据下述合成路线来合成4,6-二苯基-2-[2-(蒽-9-基)-1,1’:2’,1”-三联苯-4-基]-1,3,5-三嗪(化合物A-130)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-130为FDMS=638。
合成实施例-14
根据下述合成路线来合成4,6-二苯基-2-[2-(二苯并呋喃-4-基)-4’-(3-吡啶基)联苯-4-基]-1,3,5-三嗪(化合物A-269)。通过合成条件与合成实施例1~6同样的方法来合成。所得化合物A-54为FDMS=629。
参考例-1
合成日文特开2017-178931号公报的合成实施例2中记载的化合物即2-[3-(4-甲基-3-吡啶基)-5-(9-菲基)苯基]-4,6-二苯基-1,3,5-三嗪(下述ETL-1),实施其DSC测定。本化合物的玻璃化转变温度为113℃,结晶温度为197℃,熔点为240℃。需要说明的是,本化合物通过日本特开2017-178931号公报中记载的方法合成,DSC测定在与本说明书中的合成实施例-1相同的条件(第[0090]段记载的条件)下进行。
参考例-2
在氮气气氛下,将2-[3-氯-5-(菲-9-基)苯基]-4,6-二苯基-1,3,5-三嗪(1.00g,1.9mmol)、苯基硼酸(282mg,2.3mmol)、乙酸钯(13.0mg,0.06mmol)、2-二环己基膦-2’,4’,6’-三异丙基联苯(55.0mg,0.12mmol)、1,4-二噁烷(50mL)和2M-磷酸三钾水溶液(2.9mL,5.8mmol)加入到300mL的4口烧瓶中,在95℃下进行6小时搅拌。将所得反应液放冷至室温后,在反应混合物中添加水(100mL),滤取析出物,用水、甲醇、接着用己烷进行清洗,得到灰色粉末。将所得灰色粉末用甲苯进行重结晶,从而进行纯化,得到作为目标物的4,6-二苯基-2-[5-(菲-9-基)-联苯-3-基]-1,3,5-三嗪(化合物ETL-2)的灰色粉末(收量为700mg,收率为65%)。
参考例-3
通过国际公开第2018/095390号的实施例7中记载的方法合成4,6-二苯基-2-[6-(苯并菲-1-基)-联苯-3-基]-1,3,5-三嗪(ETL-3)。
FDMS:611
所得化合物ETL-2的玻璃化转变温度为108℃,结晶温度为207℃,熔点为260℃。需要说明的是,DSC测定在与本申请的合成实施例-1相同的条件下进行。
根据以上的结果可知,合成实施例-3中得到的三嗪化合物与参考例-1和参考例-2中得到的现有公知的三嗪化合物相比具有更高的玻璃化转变温度。进而可知,合成实施例-3中得到的三嗪化合物由于其骨架的特征而结晶性低,未检测到结晶温度或具有高的结晶温度。因此,三嗪化合物(1)在薄膜形成时能够期待高的非晶性,推测在使用三嗪化合物(1)制作有机电致发光元件时发挥了高的驱动稳定性、高发光效率化。
接着,使用所得化合物实施元件评价。
[作为电子输送层6的评价]
元件实施例-1(参照图2)
(基板1、阳极2的准备)
作为在其表面具备阳极2的基板1,准备使2mm宽的氧化铟锡(ITO)膜(膜厚110nm)图案化成条纹状而得到的带ITO透明电极的玻璃基板。接着,将该基板用异丙醇清洗后,通过臭氧紫外线清洗进行表面处理。
(真空蒸镀的准备)
在清洗后的实施过表面处理的基板上,通过真空蒸镀法进行各层的真空蒸镀,层叠形成各层。
首先,在真空蒸镀槽内导入前述玻璃基板,减压至1.0×10
(空穴注入层3的制作)
将经升华纯化的N-[1,1’-联苯]-4-基-9,9-二甲基-N-[4-(9-苯基-9H-咔唑-3-基)苯基]-9H-芴-2-胺和1,2,3-三[(4-氰基-2,3,5,6-四氟苯基)亚甲基]环丙烷以99:1(质量比)的比例进行10nm成膜,制作空穴注入层3。成膜速度为0.1nm/秒的速度。
(第一空穴输送层41的制作)
将经升华纯化的N-[1,1’-联苯]-4-基-9,9-二甲基-N-[4-(9-苯基-9H-咔唑-3-基)苯基]-9H-芴-2-胺以0.2nm/秒的速度进行85nm成膜,制作第一空穴输送层41。
(第二空穴输送层42的制作)
将经升华纯化的N-苯基-N-(9,9-二苯基芴-2-基)-N-(1,1’-联苯-4-基)胺以0.15nm/秒的速度进行5nm成膜,制作第二空穴输送层42。
(发光层5的制作)
将经升华纯化的3-(10-苯基-9-蒽基)二苯并呋喃和2,7-双[N,N-二(4-叔丁基苯基)]氨基-双苯并呋喃基-9,9’-螺芴以95:5(质量比)的比例进行20nm成膜,制作发光层5。成膜速度为0.1nm/秒。
(空穴阻挡层9的制作)
将经升华纯化的2-[3’-(9,9-二甲基-9H-芴-2-基)[1,1’-联苯]-3-基]-4,6-二苯基-1,3,5-三嗪以0.05nm/秒的速度进行6nm成膜,制作空穴阻挡层9。
(电子输送层6的制作)
将合成实施例-3中合成的2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和8-羟基喹啉锂(以下称为Liq)以50:50(质量比)的比例进行25nm成膜,制作电子输送层6。成膜速度为0.15nm/秒。
(电子注入层7的制作)
将Liq以0.02nm/秒的速度进行1nm成膜,制作电子注入层7。
(阴极8的制作)
最后,以与基板1上的ITO条纹(阳极2)正交的方式配置金属掩模,将阴极8成膜。阴极通过将银/镁(质量比为1/10)和银依次分别以80nm和20nm进行成膜而制成2层结构。银/镁的成膜速度为0.5nm/秒,银的成膜速度为成膜速度0.2nm/秒。
通过以上操作,制作图2所示的发光面积为4mm
进而,将该元件在氧气和水分浓度为1ppm以下的氮气气氛手套箱内进行密封。使用双酚F型环氧树脂(长濑化学株式会社制),对玻璃制的密封盖和成膜基板(元件)进行密封。
元件实施例-2
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-49和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-3
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-53和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-4
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-54和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-5
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-58和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-6
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-62和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-7
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-182和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-8
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将化合物A-269和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件参考例-1
元件实施例-1中,对于电子输送层6,代替将2-[3-(菲-9-基)-(2,6-二甲基吡啶-3-基)苯基]-4,6-二苯基-1,3,5-三嗪(化合物A-39)和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),将ETL-1和Liq以50:50(质量比)的比例进行25nm成膜(成膜速度为0.15nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
对所制作的有机电致发光元件施加直流电流,根据上述发光特性测定中记载的方法评价发光特性。
作为发光特性,测定流通电流密度为10mA/cm
[表1]
[作为空穴阻挡层9的评价]
元件实施例-9
元件实施例-1中,对于空穴阻挡层9,代替将2-[3’-(9,9-二甲基-9H-芴-2-基)[1,1’-联苯]-3-基]-4,6-二苯基-1,3,5-三嗪进行6nm成膜(成膜速度为0.05nm/秒),将化合物A-3进行6nm成膜(成膜速度为0.05nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-10
元件实施例-1中,对于空穴阻挡层9,代替将2-[3’-(9,9-二甲基-9H-芴-2-基)[1,1’-联苯]-3-基]-4,6-二苯基-1,3,5-三嗪进行6nm成膜(成膜速度为0.05nm/秒),将化合物A-98进行6nm成膜(成膜速度为0.05nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-11
元件实施例-1中,对于空穴阻挡层9,代替将2-[3’-(9,9-二甲基-9H-芴-2-基)[1,1’-联苯]-3-基]-4,6-二苯基-1,3,5-三嗪进行6nm成膜(成膜速度为0.05nm/秒),将化合物A-129进行6nm成膜(成膜速度为0.05nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件实施例-12
元件实施例-1中,对于空穴阻挡层9,代替将2-[3’-(9,9-二甲基-9H-芴-2-基)[1,1’-联苯]-3-基]-4,6-二苯基-1,3,5-三嗪进行6nm成膜(成膜速度为0.05nm/秒),将化合物A-130进行6nm成膜(成膜速度为0.05nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
元件参考例-2
元件实施例-1中,对于空穴阻挡层9,代替将2-[3’-(9,9-二甲基-9H-芴-2-基)[1,1’-联苯]-3-基]-4,6-二苯基-1,3,5-三嗪进行6nm成膜(成膜速度为0.05nm/秒),将化合物ETL-3进行6nm成膜(成膜速度为0.05nm/秒),除此之外,通过与元件实施例-1相同的方法制作有机电致发光元件。
对所制作的有机电致发光元件施加直流电流,根据上述发光特性测定中记载的方法评价发光特性。
作为发光特性,测定流通电流密度10mA/cm
[表2]
根据表1和2发现,与参考例相比,使用三嗪化合物(1)的有机电致发光元件的电压、发光效率和元件寿命均以高水平优异。
需要说明的是,将2018年11月30日申请的日本专利申请2018-225358号的说明书、权利要求书、附图和摘要、以及2019年11月22日申请的日本专利申请2019-211421号的说明书、权利要求书、附图和摘要的全部内容引用于此,作为本发明的说明书的公开内容。
1.基板
2.阳极
3.空穴注入层
4.空穴输送层
5.发光层
6.电子输送层
7.电子注入层
8.阴极
9.空穴阻挡层
51.第一空穴输送层
52.第二空穴输送层
100.有机电致发光元件
- 三嗪化合物、有机电致发光元件用材料和有机电致发光元件
- 环状吖嗪化合物、有机电致发光元件用材料、有机电致发光元件用电子输送材料、以及有机电致发光元件
