一种基于微流控纸芯片的便携式葡萄球菌检测方法与装置
文献发布时间:2023-06-19 11:57:35
技术领域
本发明属于生物医学检测领域,具体是基于酶联免疫检测法技术(ELISA)与复合式微流控纸基芯片的金黄色葡萄球菌检测装置与方法,可用于任何溶液中金黄色葡萄球菌的浓度快速手持式检测。
背景技术
金黄色葡萄球菌 (Staphylococcus aureus) 是诱发人类和动物日常疾病较为常见的主要致病菌,属于革兰阳性球菌的一种,广泛分布于人体、动物体的皮肤及其与外界相通的腔道中,严重威胁食品安全,浓度超标时可导致人食物中毒,一直是食品中生物污染物监管的重点对象。金黄色葡萄球菌几乎可以污染所有食品,特别对肉类及其制品的威胁尤为严重,素有“嗜肉菌”的别称;其对食品质量安全的危害风险主要是扩增的时候产生大量的侵袭性物质,如肠毒素、杀白细胞素,然后通过食物链进入人体引起严重食物中毒。同时金黄色葡萄球菌也具有耐高盐,耐高温,可在极端情况下生长等性质,极大的影响了食品安全。
微流控技术是一种在微米尺度上操作,控制并进行检测的技术。可以通过分析仪器的集成化,微型化,把整个实验室的功能集成到微小的芯片上。微流控纸芯片通过各种微加工技术,在滤纸上构建流体通道网络及相关的控制分析器件,建立“纸上微型实验室”。微流控又因为其灵敏度高、滤纸成本极其低廉,故而纸基芯片特别适用于“用后即弃”的一次性精确分析传感器。
利用传统的培养基菌落观察法,存在着受环境影响因素大,浓度测量范围低,检测过程易被污染,检测精度低等缺陷,同时培养基使用后不妥善的处理非常容易出现生物污染的严重后果。如中国专利号为ZL200520120355.0、名称“食品中病原微生物的测试片”中采用的试纸速测纸片,成本高昂,且需配合恒温培养箱等外围设备使用,人工数菌落的方法来获得浓度,不适合快速便捷的家庭检测。而精度极高的实验室ELISA测量法,测量过程繁琐,仪器昂贵,需要专业的无菌环境,很明显不满足人们日常家庭使用的需求。微流控纸芯片在此方面便体现出了极大的优势,同时满足了成本低,检测范围大,精度高的要求。
发明内容
本发明的目的是针对家用的食品中金黄色葡萄球菌浓度的检测需求,提出一种基于微流控纸芯片的便携式葡萄球菌检测方法与装置,满足人们日常家庭使用的成本低,检测范围大,精度高的要求。
本发明所述的一种基于微流控纸芯片的便携式葡萄球菌检测方法采用的技术方案是包括以下步骤:
步骤1)向加样孔中加入待测样液,MCU模块控制进样单元对应通道的电润湿阀门打开,样液流入培养及显色单元中,再打开一抗存储单元对应通道的电润湿阀门,金黄色葡萄球菌上肠毒素A特异性抗体溶液流入培养及显色单元中,让肠毒素A特异性抗体溶液与金黄色葡萄球菌上的肠毒素A特异性位点结合;
步骤2)打开冲洗液存储单元与废液存储单元对应通道的电润湿阀门,PBS缓冲液流经培养及显色单元并滞留于废液存储单元中,冲洗培养及显色单元内未附着的多余一抗溶液;冲洗后关闭冲洗液存储单元与废液存储单元对应通道的电润湿阀门;
步骤3)打开二抗存储单元对应通道的电润湿阀门,过氧化物酶抗肠毒素A特异性抗体溶液流入培养及显色单元后关闭电润湿阀门,让过氧化物酶抗肠毒素A特异性抗体溶液与抗肠毒素A特异性抗体特异性位点结合;
步骤4)再次打开冲洗液存储单元与废液存储单元对应的通道电润湿阀门,PBS缓冲液流经培养及存储单元且滞留于废液存储单元中,PBS缓冲液冲洗培养及显色单元内未附着的多余二抗溶液,冲洗后关闭冲洗液存储单元与废液存储单元对应通道的电润湿阀门;
步骤4)打开酶联底物存储单元对应通道上的电润湿阀门,过氧化物底物OPD溶液流入培养及显色单元后关闭电润湿阀门,金黄色葡萄球菌表面结合的二抗表面的酶分解底物,产生有色的反应生成物,反应后打开终止液存储单元对应通道上的电润湿阀门,终止液流入培养及显色单元后关闭对应电润湿阀门,终止液破坏过氧化物酶,酶联底物不再分解,显色稳定;
步骤5):对反应及显色单元拍照,HSV颜色分析,与预存的颜色数据比较,得到样液中金黄色葡萄球菌的浓度。
本发明所述的一种基于微流控纸芯片的便携式葡萄球菌检测装置采用的技术方案是:其最底层为电路层,电路层正上方是纸基层,纸基层上表面覆盖塑料封膜,塑料封膜上开有一加样孔,所述的纸基层上设有一个进样单元、一个培养及显色单元和一抗存储单元、二抗存储单元、冲洗液存储单元、废液存储单元、终止液存储单元、酶联底物存储单元、细菌裂解液存储单元这七个样品存储单元,七个样品存储单元在培养及显色单元的四周呈放射状分布,进样单元、每个样品存储单元与培养及显色单元之间都通过对应的一个微通道连接,每个微通道上连接一个电润湿阀门,一个亲水电极与对应的一个疏水电极组成了所述的一个电润湿阀门;进样单元设在加样孔的正下方且连通加样孔,一抗存储单元存储金黄色葡萄球菌上肠毒素A特异性抗体溶液,二抗存储单元内存储过氧化物酶抗肠毒素A特异性抗体溶液,冲洗液存储单元内存储PBS缓冲液,终止液存储单元内存储终止液,酶联底物存储单元内存储过氧化物底物OPD溶液,细菌裂解液存储单元内存储RIPA细胞裂解液,培养及显色单元内存储NACL浓度为7.5%的肉汤培养基液体;所述的电路层上设有与每个电润湿阀门相连接的MCU模块,控制每个电润湿阀门的打开和关闭。
本发明与已有方法和技术相比,具有如下优点:
1、本发明采用微流控纸基芯片技术结合ELISA检测技术,解决了无法手持式测量和检测精度差的问题,检测光学背景低,精确度高,可测量线性范围广,抗干扰性强,成本低廉,只需手机对显色区域进行拍照后HSV分析即可得出浓度值。
2、本发明检测装置能通过修改程序中控制时间或更换样品可实现对不同生物样品的检测,可扩展性强。
3、本发明无需配合特定的检测仪器,且内嵌MCU控制,加样后无需人为干扰,全自动检测和进样,样品流动、控温均为自动控制,无需人为外界操作,操作简单。
4、本发明在完成浓度监测后,自动打开细胞裂解液通道,加入细胞裂解液杀灭所有通道内的金黄色葡萄球菌,有效地防止传统菌落观察法造成的生物污染。
5、纸基层中的电极与电路层采用特殊的连接方式,有效地防止了纸芯片受潮出现的导电性能不良引发的短路,控制时序错误等现象。
6、电路层特殊的凹槽结构能有效地实现防水与均匀加热的作用,改善了传统加热方法出现的反应受热不均的现象。
7、纸基层与覆铜箔环氧玻璃布层压板的复合结构,有效地解决了微流控纸基芯片的柔软易损坏的缺点。
8、采用USB一体化供电,不仅方便,而且从方法上代替了传统纸芯片内电池的使用,利于环境的保护。
附图说明
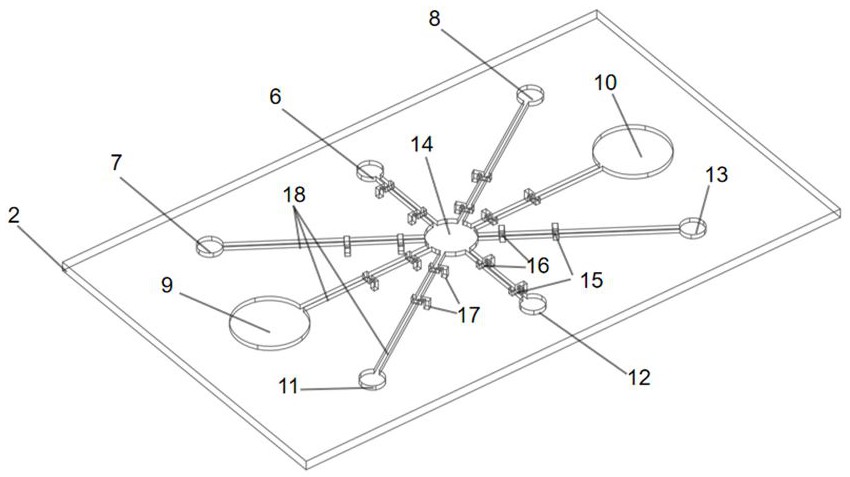
图1是本发明一种基于复合式微流控纸基芯片的便携式金黄色葡萄球菌的检测装置整体结构示意图
图2是图1中纸基层2的结构示意图;
图3是图2中亲水电极15结构放大剖面图;
图4是图1中电路层3的结构示意图;
图5是图1所示检测装置的控制原理框图;
图6是图1所示检测装置的控制流程图。
附图中各部件的序号和名称:1:塑料封膜;2:纸基层;3:电路层;4:加样孔;5:USB接口;6:进样单元;7:一抗存储单元;8:二抗存储单元 ;9:冲洗液存储单元;10:废液区存储单元;11:终止液存储单元;12:酶联底物存储单元;13:细菌裂解液存储单元;14:培养及显色单元;15:亲水电极;16:疏水电极凹;17:排针插入孔;18:微通道;19:排针;20:电极填充物;21电路层基板;22:电路凹槽。
具体实施方式
参见图1,本发明一种基于复合式微流控纸基芯片的便携式金黄色葡萄球菌的检测装置分为塑料封膜1、纸基层2及电路层3这三层,最底层为电路层3,其材料为覆铜箔环氧玻璃布层压板;其正上方是中间层,为纸基层2,纸基层2材料为滤纸,纸基层2的上表面覆盖着薄薄的一层塑料封膜1,为最上层的塑料封膜1。其中,在塑料封膜1上开有一加样孔4,待测样品可由此加入进行检测。在电路层3侧面设有一个USB接口5,供手机或其他可充电设备连接。
结合图2所示的纸基层2,纸基层2上设有一个进样单元6、一个培养及显色单元14和七个样品存储单元以及八个亲水电极15与八个疏水电极16。七个样品存储单元分别是一抗存储单元7、二抗存储单元8、冲洗液存储单元9、废液存储单元10、终止液存储单元11、酶联底物存储单元12以及细菌裂解液存储单元13。进样单元6、培养及显色单元14以及七个样品存储单元都是凹槽结构,一个亲水电极15与对应的一个疏水电极16组成了一个电润湿阀门。进样单元6设在加样孔4的正下方并且连通加样孔4,加样孔4略小于进样单元6,待测样液可通过加样孔4加入进样单元6中。培养及显色单元14设有纸基层2的正中间,七个样品存储单元在培养及显色单元14的四周,并且以培养及显色单元14为中心,呈放射状分布。进样单元6以及每个样品存储单元与培养及显色单元14之间都通过对应的一个微通道18连接,因此,一共八个微通道18,所有微通道18皆为同一深度。每个微通道18上安装一个电润湿阀门,因此,一共八个电润湿阀门,八个电润湿阀门的结构完全相同。培养及显色单元14的深度略低于微通道18的深度。
进样单元6通过对应的微通道18与培养及显色单元14相连,微通道18上连接对应的亲水电极15和疏水电极16,进样单元6的深度与微通道18的深度相同。一抗存储单元7通过对应的微通道18,且经对应的亲水电极15和疏水电极16与培养及显色单元14相连,一抗存储单元7的深度与微通道18的深度相同。二抗存储单元8通过对应的微通道18且经过对应的亲水电极15和疏水电极16与培养及显色单元14相连,二抗存储单元8的深度与微通道18的深度相同。冲洗液存储单元9通过对应的微通道18和对应的亲水电极15和疏水电极16与培养及显色单元14相连,冲洗液存储单元9的深度与微通道18的深度相同。废液存储单元10通过对应的微通道18和对应的亲水电极15和疏水电极16与培养及显色单元14相连,废液存储单元10的深度略深于微通道18的深度,能有效的将冲洗废液滞留在废液存储单元10中,且有效地防止了废液倒灌进培养及显色单元14中。终止液存储单元11通过对应的微通道18和对应的亲水电极15和疏水电极16与培养及显色单元14相连,终止液存储单元11的深度与微通道18的深度相同。酶联底物存储单元12通过对应的微通道18和对应的亲水电极15和疏水电极16与培养及显色单元14相连,酶联底物存储单元12的深度微通道18的深度相同。细菌裂解液存储单元13通过对应的微通道18和对应的亲水电极15和疏水电极16与培养及显色单元14相连。
未使用前,进样单元6内无任何液体填充,待测液体可通过加样孔4滴加进入样品区6。一抗存储单元7内存储金黄色葡萄球菌上肠毒素A特异性抗体溶液,二抗存储单元8内存储过氧化物酶抗肠毒素A特异性抗体溶液,冲洗液存储单元9内存储PBS缓冲液,终止液存储单元11内存储终止液,酶联底物存储单元12内存储过氧化物底物OPD溶液,细菌裂解液存储单元13内存储RIPA细胞裂解液。培养及显色单元14存储NACL浓度为7.5%的肉汤培养基液体。在浓度为7.5%的NACL浓度的高盐下,金黄色葡萄球菌仍可较好的繁殖,故可通过此种方法进行特异性扩增培养。
参见图2和图3,亲水电极15和疏水电极16的结构相同,以亲水电极15为例。亲水电极15和疏水电极16是由纸基层2上所开的凹槽以及凹槽内填充的电极填充物20组成,并且每个亲水电极15以及疏水电极16都设有一个排针插入通孔17,排针插入通孔17都垂直朝下。下方的电路层3向上凸出了排针19,每个排针19都插在对应的一个排针插入通孔17中。亲水电极15的电极填充物20的填充材料采用混有亲水材料的导电银浆即混有脱氧无水乙醇的导电银浆,疏水电极16的电极填充物20的填充材料采用混有疏水材料的导电银浆即混有全氟癸基硫醇(PFDT)的导电银浆。电极填充物20填充后恰好与微通道18的内壁齐平,并与微通道18横向契合。电极填充物20要尽可能地填满排针插入口17四周,以防止与下方的电路层3电路接触不良,同时电极填充物20要保证不能过饱和以致堵塞微通道18和排针插入口17。导电银浆填充固化后,可借助导电银浆的导电性控制亲水电极15与疏水电极16的电压。
参见图1和图4,电路层3的底面是电路层基板21,在电路层基板21上表面加工出电路凹槽22,在电路凹槽22内通过丝网印刷等一系列PCB加工工艺,构建PCB集成电路,并焊接好对应的电路模块。电路层基板21的材料采用覆铜箔环氧玻璃布层压板,在电路凹槽22其他空缺处填满导热且绝缘材料(导热凝胶),解决芯片的受热不均匀导致的测量精度问题与芯片无法应用于特殊温度环境下的测量问题。其中电路凹槽22内的排针19高度应当略高于电路层基板21上表面的高度,以便能向上插入对应的排针插入孔17中,同时也起到固定纸基层2与电路层3的相对位置的作用。电路层基板21的侧面设有USB接口5,供外部的连接。
参见图1、图2和图4,在纸基层2的下表面喷涂一层防水材料,电路层3上表面刷薄薄的一层粘合材料-硅胶,将纸基层2与电路层3热压合为一体。此压合芯片为纸基层2与覆铜箔环氧玻璃布层压板的复合结构,覆铜箔环氧玻璃布层压板的强度较大,故此复合结构较好的克服了纸芯片的柔软易损坏的缺陷。并在所有的样品存储单元内加入对应的样液后用透明塑料封膜1封合表面,留出加样孔4。可通过上位机对样品存储单元14拍照,由HSV色彩分析可得浓度值。
参见图4和图5,电路凹槽22内设有MCU模块、温度监控模块、加热模块、电源模块以及USB接口5。电源模块通过USB接口5与外界相联,给MCU模与其他各模块供电。MCU模块分别连接温度监控模块、加热模块、电源模块以及亲水电极15和疏水电极16,控制每个电润湿阀门的打开和关闭。温度监控模块提供实时的芯片温度数据给MCU模块,MCU模块读取数据分析当前温度是否为预设值,当温度低于预设温度时,MCU模块控制加热模块工作,给芯片加热。其中加热模块选用四个加热电阻分布于电路凹槽22四周,以便均匀供热。同时MCU模块通过排针19连接纸基层2,控制亲水电极15与疏水电极16的电压,当MCU模块控制亲水电极15与疏水电极16的电压都为0V时,微通道18断开,液体无法通过疏水电极16,当MCU模块对亲水电极15输出高电平对疏水电极16输出低电平时,疏水电极16亲水化,微通道18打开,液体自由流过疏水电极16。
参见图1-5以及图6所示,本发明检测装置工作时,在USB接口5后,MCU模块开始工作,按照时序依次打开各通道的电润湿阀门,当亲水电极15与疏水电极16的电位差为0时,微通道18关闭,液体无法通过疏水电极16,当亲水电极15与疏水电极16的电位差为5V时,疏水电极16亲水化,微通道18打开,液体自由流过疏水电极16,全过程由MCU模块自动控制反应温度与通道通断及反应时间。具体检测步骤如下:
步骤一:由人工向加样孔4中加入待测样液,直至滴满进样单元6,注意要将样品区静止填满,否则会影响测量精度。人工插入USB接口5开始供电,温度监控模块自动检测当前的温度值,并将温度值传送给MCU模块,MCU模块将当前温度值与理想细胞扩增温度45度相比,并控制加热模块开始工作,MCU模块输出高电平,令加热模块电阻产生热量,将温度调整到45度,此时各液体在其圆形的存储区域内可自由流动,但到无法通过与其对应的疏水电极。当加热至45度时,MCU模块控制进样单元6对应的疏水电极16的电压为5V,此时疏水电极16变为亲水状态,样液顺利流过疏水电极16,流入培养及显色单元14,然后MCU模块控制恢复疏水电极16电压为0V,疏水电极16恢复疏水状态。在后续步骤中,打开与关闭微通道18时,电润湿阀门的工作方法都相同,不再赘述。
对培养及显色单元14中流入的样液中细菌进行扩增,由于培养及显色单元14的氯化钠浓度为7.5%高盐环境,且温度为45,度较高温,此环境下常见菌种均无法大量扩增,而金黄色葡萄球菌可在此环境下大量繁殖,并附着于培养及显色单元14的底部。MCU模块计时培养,在设定的时间(30min)后打开一抗存储单元7对应通道的电润湿阀门,一抗存储单元7内的金黄色葡萄球菌上肠毒素A特异性抗体溶液流入培养及显色单元14中。让肠毒素A特异性抗体溶液与金黄色葡萄球菌上的肠毒素A特异性位点结合。MCU模块计时,在设定的时间(2min)后,打开冲洗液存储单元9与废液存储单元10对应通道的电润湿阀门,冲洗液存储单元9内预存的PBS缓冲液在纸的毛细作用下流过微通道18与疏水电极16,流经培养及显色单元14,流至废液存储单元10,废液存储单元10的深度低于微通道18的深度,故废液将滞留于废液存储单元10中,PBS缓冲液会冲洗培养及显色单元14内未附着的多余一抗溶液。冲洗设定的时间(2min)后关闭冲洗液存储单元9与废液存储单元10对应通道的电润湿阀门。MCU模块控制打开二抗存储单元8对应通道的电润湿阀门,二抗存储单元8内的过氧化物酶抗肠毒素A特异性抗体溶液,流入培养及显色单元14后关闭阀门,让过氧化物酶抗肠毒素A特异性抗体溶液与抗肠毒素A特异性抗体特异性位点结合。然后MCU模块再次打开冲洗液存储单元9与废液存储单元10对应的通道电润湿阀门,计时设定的时间(2min)后,冲洗液存储单元9内预存的PBS缓冲液在纸的毛细作用下流过微通道18与疏水电极16,流经培养及存储单元14,流至废液存储单元10。PBS缓冲液冲洗培养及显色单元14内未附着的多余二抗溶液,冲洗设定时间(2min)后关闭冲洗液存储单元9与废液存储单元10对应通道的电润湿阀门,酶附着完成。
步骤二:打开酶联底物存储单元12通道上的电润湿阀门,酶联底物存储单元12内的过氧化物底物OPD溶液流入培养及显色单元14后关闭阀门。培养及显色单元14内金黄色葡萄球菌表面结合的二抗表面的酶分解底物,产生有色的反应生成物,MCU模块控制反应到设定时间(5min)后, 打开终止液存储单元11通道上的电润湿阀门,酶联底物存储单元12内的终止液流入培养及显色单元14后关闭阀门,终止液破坏过氧化物酶,酶联底物不再分解,显色稳定。
步骤三:人工用手机对反应及显色单元14拍照,HSV颜色分析,与预存的颜色数据比较,即得到样液中金黄色葡萄球菌的浓度。之后,MCU模块控制打开所有的电润湿阀门,使得细菌裂解液存储单元13内的RIPA细胞裂解液与其他样品存储单元与微通道18内液体充分混合,杀灭微通道18内及各样品存储单元内金黄色葡萄球菌,避免污染。
- 一种基于微流控纸芯片的便携式葡萄球菌检测方法与装置
- 一种基于微流控芯片的便携式荧光检测装置及其检测方法
