在心脏消融期间控制食道温度
文献发布时间:2023-06-19 12:07:15
相关申请的交叉引用
本申请要求于2018年10月17日提交的名称为“在心脏消融期间控制食道温度”的临时申请号62/746,739的优先权和权益,通过引用将其全文并入本文。
技术领域
本公开涉及一种用于在心脏消融期间控制食道温度的系统和方法,并且具体地涉及改变食道内部的温度。
背景技术
进行肺静脉周围的组织的消融以干扰从静脉传输到左心房中的电信号,从而产生心房纤颤。一种用于产生这种消融的技术是会聚性手术(Convergent Procedure),其使用射频能量来产生热量,该热量被施加到心脏组织以产生消融并中断信号。
在患有症状性阵发性或持续性心房纤颤的患者中,射频消融(特别地左心房心内膜消融或肺静脉隔离)使用在肺静脉口处并且有时在后壁上施加到左心房的射频能量。心房食道瘘管是已知的并是使人虚弱的(如果不是致命的)并发症,导致心房和食道之间的瘘管形成,其中空气进入左心房。这可能引起脑血管发作和/或心肌梗塞。除了标准肺静脉隔离之外,通常在患有症状性持续心房纤颤的患者中进行会聚性手术。手术的初始部分利用射频(RF)探头或线圈,该射频(RF)探头或线圈经膈膜(transdiaphragmatically)放置在心脏的在心外膜后壁上的外表面上,以试图消融心外膜后壁。该装置利用了从发生器发射的RF能量,该发生器接地连接到患者。将线圈设备可伸缩地引入心外膜上,然后该心外膜在施加RF能量的同时使用真空抽吸。在施加RF时测量阻抗,以试图确认完成能量的施加,并且已经将足够的能量传输到心外膜以便引起消融。
为了在血管附近完成所希望的消融模式,使用电生理学在心脏内部另外执行消融。将装置穿过股动脉穿入心脏,并且RF能量再次用于完成消融模式在心脏外部不能完成的部分。
已经在心内膜上的心脏内部使用冷冻能量来消融肺静脉的孔口,包括例如通过使用美敦力公司(Medtronic,Inc)的球囊型冷冻消融导管(ARTIC FRONT)装置。该装置用圆形球囊状结构封闭该孔口,该圆形球囊状结构插入该孔口中以与身体组织接触,并且然后该圆形球囊状结构用冷却剂填充以引起在该孔口处的组织冻结。
激光消融还已经用于经由经隔膜引入左心房中的内窥镜球囊在有症状阵发性心房纤颤中隔离肺静脉。将探头放置到肺静脉中,并且展开球囊,使操作者在施加激光应用之前可看到肺静脉。激光施加可以增加左心房温度并且使食道倾向于经由热损伤而引起附带损害。
所有以上模态具有潜在的能量效应,即,当停止射频或激光时,在食道中所测量的温度继续上升到最低点之前的水平。冷冻疗法可以具有相同的效果,但是在相反方向上“冻结”。
发明内容
本公开的方面涉及用于在治疗过程中冷却或加热食道的内部区域的设备和方法。
在一个方面,其中,一种用于在治疗过程中冷却或加热食道的内部区域的装置包括:细长的柔性导管,其具有近侧端和远侧端;近侧球囊,该近侧球囊相对于导管的近侧端固定到导管的外表面,该近侧球囊被配置和被定尺寸为当膨胀时阻塞食道的近侧部分;远侧球囊,该远侧球囊固定到导管的远侧端的外表面,该远侧球囊被配置和被定尺寸为当膨胀时阻塞食道的第二部分;延伸穿过导管的至少一个球囊膨胀内腔,该至少一个球囊膨胀内腔具有与近侧球囊和远侧球囊的内部连通的至少一个膨胀入口;以及凝胶注射内腔,其延伸穿过导管,具有与凝胶出口流体连通的凝胶入口,该凝胶出口定位在导管的远侧端处并且在近侧球囊与远侧球囊之间。
在不同方面,该装置包括冷却剂管,该冷却剂管具有与冷却剂出口连通的冷却剂入口。该冷却剂管被固定到导管的表面,从导管的近侧端延伸到导管的远侧端、邻近远侧球囊并且然后延伸返回到导管的近侧端。在不同方面,冷却剂管盘绕在导管的外表面。
在不同方面,该冷却剂管填充有碳或金属中的至少一种。在不同方面,冷却剂管具有约1.7毫米的外径。在不同方面,冷却剂入口附接到泵,该泵被配置成泵送加热的或冷却的流体经过冷却剂管。在不同方面,更多的温度传感器连接到该管并且被配置成输出与食道的内部区域有关的温度信息。在不同方面,可操纵元件被插入到导管的内部中,并且被配置成当定位在体内和导管的内部中时被弯曲,从而引起导管在体内的取向的变化。
在其他方面,其中,一种试剂盒包括该装置和用于生产凝胶的聚合物材料。在其他方面,一种试剂盒包括该装置和凝胶。在不同方面,凝胶包括水和聚亚烷基二醇。在不同方面,聚亚烷基二醇包括聚乙二醇、聚丙二醇、单甲氧基聚乙二醇、泊洛沙姆或其任意组合。在不同方面,聚亚烷基二醇的分子量为约600Da至约6000Da。在不同方面,聚亚烷基二醇占凝胶的重量百分比为约0.1至5。在不同方面,凝胶具有小于20的介电常数。在不同方面,凝胶包括导热凝胶。
在其他方面,其中,一种用于在治疗过程中冷却或加热食道的内部区域的方法包括:将如权利要求1-8中任一项所述的装置插入食道中;将装置的近侧球囊和远侧球囊膨胀,以阻塞食道的近侧区段和远侧区段;以及将凝胶注射到装置的凝胶注射内腔中以便将凝胶沉积到食道中,该凝胶在近侧球囊下方和远侧球囊上方的区域中沉积到食道中。在不同方面,聚亚烷基二醇包括聚乙二醇、聚丙二醇、单甲氧基聚乙二醇、泊洛沙姆或其任意组合。在不同方面,聚亚烷基二醇的分子量为约600Da至约6000Da。在不同方面,聚亚烷基二醇占凝胶的重量百分比为约0.1至5。在不同方面,凝胶具有小于20的介电常数。在不同方面,凝胶包括导热凝胶。
在其他方面,其中,一种用于体外测试心房消融装置的装置包括:柔性管,该柔性管具有内腔,该内腔被配置和被定尺寸为模拟食道;定位在柔性管的表面上的水凝胶,其中,该水凝胶被定尺寸和被配置为模拟左心房壁;加热源,该加热源被配置成将该水凝胶加热至消融温度;以及第一温度探头和第二温度探头中的至少一个,该第一温度探头被定位在柔性管的内腔中,该第二温度探头定位在柔性管与水凝胶之间。在不同方面,加热源被配置成产生至少150℃的温度。在不同方面,柔性管具有约2cm的内径和约5mm的厚度。在不同方面,水凝胶具有至少5mm的厚度。在不同方面,第三温度探头定位在水凝胶中距离该柔性管至少3mm处。在不同方面,该装置悬浮于37℃盐水浴中。
在检查以下附图和详细描述时,本公开的其他系统、方法、特征和优点对于本领域的技术人员将是或变得明显的。旨在将所有这样的附加系统、方法、特征和优点包括在本说明书内、在本公开的范围内,并且受所附权利要求的保护。此外,所描述的实施例的所有任选和优选的特征和修改可用于本文所教导的本公开的所有方面。此外,从属权利要求的单独特征以及描述的实施例的所有任选和优选特征和修改是可以彼此组合和互换的。
附图说明
本公开的许多方面可以参考以下附图来更好地理解。附图中的部件不一定是按比例的,而是将重点放在清楚地展示本公开的原理。此外,在附图中,贯穿几个视图,相同的附图标记表示相应的部分。
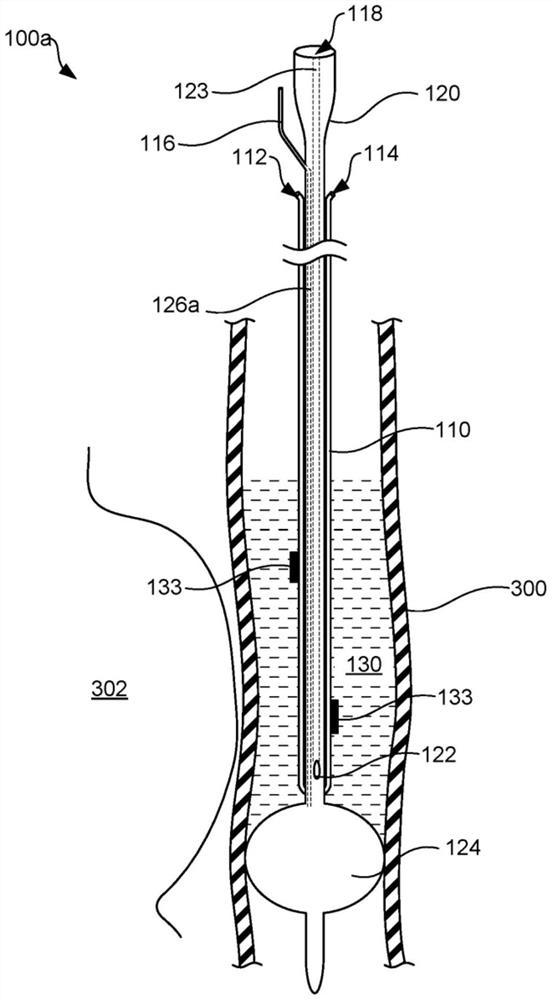
图1描绘了根据本公开的不同实施例的用于在心房消融期间冷却食道的装置的示例。
图2描绘了根据本公开的不同实施例的用于在心房消融期间冷却食道的装置的另一个示例。
图3描绘了根据本公开的不同实施例的用于在心房消融期间冷却食道的装置的另一个示例。
图4描绘了根据本公开的不同实施例的用于在心房消融期间冷却食道的装置的另一个示例。
图5描绘了根据本公开的各种实施例的用于模拟左心房和食道的空间关系和热导率的装置。
图6描绘了无线通信装置,无线通信装置中的一些或全部可以用于根据本公开的不同实施例来实施本公开。
图7是示出根据本公开的不同实施例在心房消融期间模拟食道温度的体外测试平台的食道壁处的温度变化的曲线图示例。
图8是示出根据本公开的不同实施例在心房消融期间使用用于冷却食道的装置在如图7中的食道壁处的温度变化的曲线图示例。
图9是根据本公开的不同实施例在心房消融期间用于冷却食道的装置的示例图像。
图10是根据本公开的不同实施例在心房消融期间用于冷却食道的装置的示例图像。
具体实施方式
根据需要,本文公开了详细的实施例;然而,应当理解的是,所公开的实施例仅是示例,并且以下描述的系统和方法可以用不同形式体现。因此,本文所公开的具体结构和功能细节不应被解释为限制性的,而应仅作为权利要求的基础,以及作为代表性基础,用于教导本领域技术人员以几乎任何适当详细的结构和功能不同地使用本主题。进一步,本文使用的术语和短语不旨在是限制性的,而是提供对概念的可理解的描述。
如本文所使用的,术语“一个(a)”或“一个(an)”被定义为一个或多于一个。如本文所使用的,术语多个定义为两个或两个以上。如本文所使用的,术语另一个(another)被定义为至少第二个或更多个。如本文所使用的术语“包括(including)”和“具有(having)”被定义为包括(即,开放语言)。如本文所使用的,术语“耦接(coupled)”被定义为“连接”,尽管不一定是直接地,而且不一定是机械地。
根据本公开,在向心脏施加热或冷的过程中,并且特别是在左心房302(图1)的最接近食道的区域中,将冷却或加热流体的开环或闭环灌洗施加到邻近心脏的食道的内表面。此类过程可以包括诸如在射频或激光消融期间使用热量消融心脏,或诸如在冷冻消融期间使用冷却消融心脏。本公开的温度控制装置用于在热消融期间将冷却物质施加至食道的内表面,并且在冷消融期间将加热物质施加至食道的内表面。所施加的物质充当介质以平衡食道产生的不希望的温度变化,否则该温度变化可能在心脏的治疗处理期间损害食道。这种损害可以包括例如溃疡或食道瘘管的形成。本公开提供了医疗装置,通过提供目标温度控制,这些医疗装置通过减少食道损伤的发生率和严重性来改进左心房消融的安全性。
根据本公开的不同实施例,温度控制装置还可以帮助电生理学家或心胸外科医生从导管获得损伤定向为哪种类型(滑动、平行或垂直可以提供透膜性损伤,同时保留食道的完整性)的信息。本公开提供了根据不同实施例的闭环、半闭环和开环灌洗装置和方法。
现在转向图1-图4,示出了根据本公开的不同实施例的用于在心房消融期间冷却食道的温度控制装置100(例如,100a、100b、100c、100d)的示例。温度控制装置包括导管120,导管120包括从近侧端延伸至远侧端的柔性细长主体。导管120被配置和被定尺寸为可以从身体外部通到食道300的内部区域。
根据不同实施例,温度控制装置100可以包括冷却剂管110,该冷却剂管110具有围绕导管120布置的入口112和出口114。冷却剂管110可以由任何生物相容性材料制成,该生物相容性材料是不透水的但是具有足够的热导率以便传递来自系统的热量。例如,冷却剂110可由硅树脂、PVC、天然橡胶、丁苯橡胶、聚异丁烯、聚乙烯乙酸乙烯酯、乙烯-丙烯二单体(EPDM)、尼龙、PET、含氟共聚物(诸如全氟乙烯-丙烯、聚丙烯、聚丙烯腈、聚乙烯醇等)和/或可理解的其他类型的材料制成。根据不同实施例,冷却剂管110可填充有碳、石墨烯和/或金属颗粒以增加热导率。在一些实施例中,冷却剂管110不必非常柔软,并且如果薄壁金属可以在不扭结的情况下弯曲,那么也可使用薄壁金属。
冷却剂管110的内径和外径可以基于用于提供足够流动和热导率的材料来选择。例如,在一些实施例中,冷却剂管110可以具有约0.5mm至8.0mm的外径。作为示例,冷却剂管110可以具有1.7mm的外径和0.76mm的内径。在一些实施例中,冷却剂入口附接到泵(未示出),该泵被配置成泵送加热的或冷却的流体穿过冷却剂管110。流体优选地具有高比热容。流体可以包括水、盐水,其能够被小心地摄取,诸如不损坏装置的材料的水中脂肪的乳液,和/或可理解的任何其他类型的流体等。
图1和图3展示了冷却剂管110的示例,该冷却剂管110沿着导管120的长度纵向地延伸,在沿着导管纵向向后延伸并且延伸出身体之前在远侧端处具有单一弯曲部。在其他示例中,如图2和图4所示,冷却剂管110可以围绕导管120的外表面盘绕成一个或更多个环。尽管图2和图4中的冷却剂管110示出了具有围绕导管120的多个环的线圈,但是冷却剂管110可包括围绕导管120的具有一个或更多个环的线圈。例如,冷却剂管110可以朝向导管120的远侧端延伸并且在朝向导管120的近侧端返回之前围绕导管120环绕至少一次。应当注意的是,虽然冷却剂管110被描述为具有围绕导管120的一个或更多个环的线圈或沿着导管120纵向延伸的管,但是冷却剂管110可以形成为具有可理解的最佳表面积的任何其他形状或图案。
导管120包括凝胶入口118和凝胶端口122,凝胶入口118在导管120近侧端处,该凝胶端口122经由延伸穿过导管120的凝胶内腔123流体连接到凝胶入口118。凝胶端口122围绕导管120定位,并且被配置为释放凝胶入口118中注射的凝胶130、穿过凝胶内腔123并且进入食道300以用作对流热量交换的介质。
根据不同实施例,如图1-图4所示,导管120还包括在导管120的远侧端处的远侧可膨胀球囊124。远侧可膨胀球囊124穿过球囊膨胀内腔126(例如,126a、126b)流体地连接到导管120的近侧端处的膨胀入口116(例如,116a、116b),该球囊膨胀内腔126(例如,126a、126b)延伸穿过导管120。膨胀入口116被配置成并耦接到远侧球囊124,使得将膨胀流体注射到膨胀入口116中将远侧球囊124膨胀至一尺寸,该尺寸足以阻塞食道300并将凝胶130捕获在远侧球囊124上方进而防止凝胶130进入胃。在将温度控制装置100插入和移除到食道或其他合适的区域中期间,远侧球囊124可以处于放气状态。
如图3和图4所示,温度控制装置100可以包括近侧球囊128,该近侧球囊128定位在导管120的凝胶端口122上方的导管120的近侧部分处。近侧球囊128流体连接到膨胀入口116,使得将膨胀流体注入膨胀入口116将近侧球囊128膨胀至一尺寸,该尺寸足以阻塞食道300并将凝胶130捕获在近侧球囊128下方进而防止凝胶130移动进入肺部。在将温度控制装置100插入和移除到食道300或其他合适的区域中期间,近侧球囊128可以处于放气状态。
根据不同实施例,近侧球囊128被布置围绕在导管120的外表面。在一些实施例中,近侧球囊128围绕导管120和冷却剂管110的至少一部分,冷却剂管110的至少一部分沿着导管120布置。虽然在图3和图4中分开示出,但是在一些实施例中,流体地耦接到近侧球囊128的膨胀入口116和流体地耦接到远侧球囊124的膨胀入口116是相同的,使得膨胀流体行进穿过导管120的相同球囊膨胀内腔126。在其他实施例中,流体耦接到近侧球囊128的膨胀入口116与流体耦接到远侧球囊124的膨胀入口116分开。例如,导管120可以包括第二球囊膨胀内腔126b,该第二球囊膨胀内腔126b延伸穿过导管到达近侧球囊128的进入点。在其他实施例中,膨胀入口116耦接到具有球囊膨胀内腔125的管(未示出),球囊膨胀内腔125耦接到近侧球囊128并且与导管120分开。
根据不同实施例,膨胀流体可以包括空气、盐水和/或能够被小心摄取的其他类型的膨胀流体,诸如可理解的不损坏装置的材料的水中脂肪乳液等。此外,虽然近侧球囊128被描述为可膨胀球囊,但是在一些实施例中,近侧球囊128可以包括可扩张海绵和/或其他材料,该可扩张海绵和/或其他材料可以用于将凝胶130捕获在近侧球囊128、海绵和/或其他适合的部件下方。
例如,尽管图3和图4展示了近侧球囊128,但近侧球囊128可以包括海绵。根据不同实施例,例如,可扩张海绵可以至少部分地干燥,使得其具有小于最大尺寸的尺寸,使得装置100能够更容易地插入到食道300中并且定位在治疗部位处,例如,靠近心脏处。可能希望将一些水分保留在海绵内例如以确保海绵的表面是软的并且有弹性的,从而保护身体组织。当插入时,海绵可以扩张以接触食道300的内表面并且将凝胶130捕获在海绵下方。在一些实施例中,冷却或加热的流体接着可循环穿过管110,如本文其他地方所描述的,以向海绵或近侧球囊128传递热量或从海绵或近侧球囊128移除热量。在一些实施例中,海绵内的可扩张的生物相容性材料接着可以将热或冷传递到食道300的内表面,从而提供预期的疗效。
根据不同实施例,装置100可以包括温度传感器133。如图1所示,温度传感器133还可以沿着导管120定位在一个或更多个位置处。这个传感器133可以传输与沿着食道300的相邻区域相对应的温度数据。多个传感器133可以为沿着食道300的多个区域提供温度信息,由此连接到传感器133的信号处理设备可识别食道的正在经历或预期经历不期望的温度变化的特定区域。传感器133可经由电线或通过无线通信(诸如WIFI、蓝牙或其他近场协议和任何其他无线协议等)来传输该数据。为了避免与RF消融相关联的射频对传感器的意外加热,在传感器中避免使用金属可能是有利的。这可以使用例如光纤传感器来实现。其他非金属或金属温度传感器技术可以用于传感器。
在实施例中,电子处理器802接收来自传感器133的温度信息,并且报告升高的温度。在一些情况下,电子处理器802控制通过冷却剂管110的流速。
在一些实施例中,装置100进一步包括插入导管120的内部中的可操纵元件(未示出),该可操纵元件被配置成当被定位在体内和导管120的内部中时被弯曲,从而引起导管120在体内的取向的变化。
如上所述,在某些方面中,一种或更多种凝胶130可以与本文描述的装置100一起使用,一种或更多种凝胶130可以根据需要容易地冷却或加热。凝胶130被配制使得它们可以经由如本文所描述的装置100注射到食道中。凝胶130由水和适于给予受试者的无毒聚合物材料组成。
聚合物材料的选择可以变化。在一个方面,聚合物材料是聚亚烷基二醇。如本文所使用的“聚亚烷基二醇”是指环氧乙烷或环氧丙烷与水的缩聚物。聚亚烷基二醇通常是具有高分子量的无色流体,并且可溶于水以及一些有机溶剂。在一个方面,聚亚烷基二醇为聚乙二醇和/或聚丙二醇。在另一方面,聚亚烷基二醇为单甲氧基聚乙二醇。在一个方面,聚亚烷基二醇是
在一个方面,聚亚烷基二醇为泊洛沙姆。泊洛沙姆是由聚氧丙烯的中心疏水链(例如,聚(环氧丙烷))侧接聚氧乙烯的两个亲水链(例如,聚(环氧乙烷))组成的非离子三嵌段共聚物。在一个方面,泊洛沙姆具有下式:
HO(C
其中a为从10至100、20至80、25至70、或25至70、或从50至70;b为从5至250、10至225、20至200、50至200、100至200、或150至200。在另一方面,泊洛沙姆具有从2,000Da至150,000Da、3,000Da至14,000Da、或4,000Da至12,000Da的分子量。本文有用的泊洛沙姆是由巴斯夫公司(BASF)制造的以商品名普朗尼克
当使用聚亚烷基二醇生产凝胶130时,凝胶130具有低介电常数。在一个方面,凝胶130的介电常数小于20,或者为约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、或小于约20,其中任何值可以是用来自安多电气公司(Ando Electric Co.)的TR-1A型臂式变压器电桥测量的一个范围(例如,约11至约18、约13至约16等)的下端点或上端点。在另一方面,聚亚烷基二醇具有约600Da至约6,000Da,或约600Da、约750Da、约1,000Da、约1,500Da,约2,500Da、约3,000Da、约3,500Da、约4,000Da,约4,500Da、约5,000Da、约5,500Da、约6,000Da的分子量,其中任何值可以是一个范围(例如,约600Da至约2,000Da、约3,000Da至约5,000Da等)的下端点或上端点。然而,应当注意的是,如可以理解的,可以使用分子量大于6,000Da的聚亚烷基二醇。根据不同实施例,纯聚乙烯聚合物具有约20的介电常数,并且它们的溶液与水的溶液将是一些平均值。
在其他方面,用于生产凝胶130的聚合物材料是导热凝胶。用于生产导热凝胶的聚合材料的示例包括但不限于藻酸盐、黄原胶或明胶。在另一方面,该导热凝胶是用于水或盐水的任何无毒增稠剂。在一个方面,用于生产导热凝胶的聚合物材料包括壳聚糖(chitosan)或阿拉伯胶(acacia)。在另一方面,用于生产导热凝胶的聚合材料包括竹芋、玉米淀粉、猪牙花(katakuri)淀粉、马铃薯淀粉、西米、木薯、或它们的淀粉衍生物。在另一方面,导热凝胶包括用作食品增稠剂的微生物和植物胶,包括但不限于藻胶、瓜尔豆胶、刺槐豆胶和黄原胶。在其他方面,导热凝胶包括无机增稠剂,诸如焦磷酸钠等。
凝胶130可以根据需要通过在水中将聚合物材料与一种或更多种任选组分混合来制备。该聚合物材料与水的混合可以在室温或在升高的温度下进行,这取决于所使用的聚合物材料的选择和用量。在一个方面,凝胶具有足够高的粘度以允许膨胀球囊将其固定在食道中,但又具有足够低的粘度以允许其被注射和吸出。为了微调凝胶的粘度,可以改变用于生产凝胶的聚合物材料的用量。在一个方面,聚合物材料占凝胶的重量百分比为约0.1至5,或是约0.1、约0.5、约1.0、约1.5,约2.0、约2.5、约3.0、约3.5、约4.0、约4.5、或约5.0,其中任何值可以是一个范围(例如,重量百分比约0.1至约4.0、约0.5至约2.0等)的下端点或上端点。
在某些方面中,凝胶130可以在到使用本文描述的装置的时候生产。在一个方面,包括本文所述的装置100的试剂盒可以包括生产凝胶130的组分。例如,该聚合物材料可以作为干燥材料提供在试剂盒中,该试剂盒具有将该聚合物材料与一定体积的水混合的说明书。在其他方面,试剂盒可以包括装置100,该装置100具有已经准备用于使用的凝胶130。本文所描述的试剂盒还可以包括一个或更多个注射器,该一个或更多个注射器用于将凝胶注入本文所描述的装置中。
本公开的装置100可以以本文所描述的不同方式使用,并且可以另外有利地用于心外膜中的流出道心动过速或右心室消融,特别是在心内膜较薄的地方。另外,根据不同实施例,温度控制装置100可以用于缓冲从消融导管引入的对流热量,从而在某些情况下与不使用装置100的情况下相比,能够以更低的穿孔可能性或对相邻心外膜动脉的旁侧损害可能性来传输全厚度损伤。
本公开的装置100可以具有可以有效地插入给定患者的食道中的任何尺寸,该尺寸根据人体解剖学广泛地变化。直径的示例非限制性范围包括约4mm至20mm,以及约250至500厘米(cm)的长度。根据患者体型,无论是否期望装置的冷却/加热区域与食道壁接触,以及方便地延伸到体外的长度,可以使用更小、更宽、更长或更短的尺寸。如本领域内所理解的,可以使用适当的生物相容性材料,尽管避免使用金属有利于避免食道300内不期望的RF能量重新传输。
如本领域内将理解的,柔性部件有利地用具有足够柔性、耐用性和润滑性的生物相容性聚合物制成。示例可以包括聚(乙烯)(PE)(HDPE、UHMWPE);聚(丙烯)(PP);聚(四氟乙烯)(PTFE)(Teflon),膨胀的PTFE;乙烯-共-乙酸乙烯酯(EVA);聚(二甲基硅氧烷)(PDMS);聚(醚-氨基甲酸酯)(PU);聚(对苯二甲酸乙二醇酯)(PET);以及聚(砜)(PS),尽管可以使用包括聚合的、合成的、以及天然的其他材料。
根据不同实施例,导管120可以被推进到受试者的食道300中,使得远侧球囊124被推进穿过心房。然后可以使远侧球囊124和近侧球囊128膨胀至其阻塞食道300的区域的程度。然后可以将凝胶130注射到食道300中,其中凝胶130由远侧球囊124和近侧球囊128固定。冷却剂可以被泵送穿过冷却剂管110以将热量从凝胶130传递走。此时,受试者准备进行心房消融。一旦完成,球囊124、128可以放气并且导管120缩回。在一些实施例中,装置100进一步包括用于在将球囊124、128放气之前将凝胶130从食道300吸出的装置。在一些情况下,这通过凝胶端口122完成。在其他实施例中,装置100包括抽吸内腔(未示出),该抽吸内腔延伸穿过导管120到达导管120的远侧端处、邻近远侧球囊124的抽吸入口(未示出)。
现在转到图5,描绘了测试装置500,该测试装置500用于测试本公开装置100在治疗过程中用于冷却或加热食道300的内部区域的能力。测试装置500包括柔性管510,该柔性管510具有内腔,该内腔被配置和被定尺寸为模拟食道300。测试装置500进一步包括定位在柔性管的表面上的水凝胶520,其中水凝胶520被定尺寸和被配置为模拟左心房壁。测试装置500可以进一步包括被配置为将水凝胶加热或冷却至消融温度的加热或冷却源540。测试装置500可以进一步包括第一温度探头530和第二温度探头532中的一个,该第一温度探头530定位在柔性管的内腔中,该第二温度探头532定位在柔性管和水凝胶之间。可以包括其他温度探头和传感器。例如,装置500可以进一步包括第三温度探头534,该第三温度探头534定位在距柔性管至少3mm处(例如,在水凝胶520的将被施加热量的表面或其附近处)的水凝胶520中。
加热源可以是被配置成产生消融效果的任何装置。在一些情况下,加热源涉及射频能量,该射频能量通常以高达35瓦的功率使用并且被递送穿过灌洗的消融导管。在一些情况下,加热源涉及激光器。在一些情况下,该加热源是低温的并且实际上移除热量。在这些实施例中,本公开的装置将热量传递到食道而不是远离食道。
柔性管510被定尺寸为模拟人类食道。因此,在一些实施例中,柔性管具有约2cm的内径和约5mm的厚度。
水凝胶520被定尺寸和被配置为模拟左心房壁。因此,在一些实施例中,水凝胶具有约5mm的厚度。水凝胶520可以由热导率接近心房壁热导率的任何材料制成。例如,在一些实施例中,该水凝胶是5%琼脂。其他合适的材料包括合成聚合物,诸如聚乙烯醇或聚甲基丙烯酸羟乙酯(pHEMA)等。
装置500还被配置使得它可以悬浮在37℃的盐水浴中。在一些情况下,柔性管510被固定到支架和/或放置在容器中以提供结构支撑。
在一些实施例中,装置500进一步包括一个或更多个温度传感器,该一个或更多个温度传感器连接到管510并且被配置成输出与内部有关的温度信息。
在一些实施例中,可操纵元件被插入导管内腔中,该可操纵元件被配置成当被定位在体内和导管内部时被弯曲,从而引起导管在体内的取向的变化。
图6是可用于执行本公开的电子装置和相关联的部件800的框图。在该示例中,电子装置852为具有语音和数据通信能力的无线双向通信装置。此类电子装置使用合适的无线通信协议与无线语音或数据网络850通信。使用模拟或数字无线通信信道来执行无线语音通信。数据通信允许电子装置852经由互联网与其他计算机系统通信。能够结合上述系统和方法的电子装置的示例包括例如数据通讯装置、双向呼叫器、具有数据通讯能力的蜂窝式电话、无线互联网器具或可包括或可不包括电话能力的数据通信装置。电子装置800可用于例如通过有线或无线手段从传感器133收集电子数据、用于显示该数据或以其他方式向执业医师传送该数据并且用于控制穿过装置100的冷流体或温流体的流动。
所展示的电子装置852是包括双向无线通信功能的示例电子装置。此类电子装置结合了通信子系统元件(诸如无线发射机810、无线接收机812等)和相关联的部件(诸如一个或更多个天线元件814和816等)。数字信号处理器(DSP)808执行处理以从接收的无线信号中提取数据并且生成要传输的信号。通信子系统的特定设计取决于通信网络和相关联的无线通信协议,该装置旨在运作该无线通信协议。
电子装置852包括控制电子装置852的总体操作的微处理器802。微处理器802与上述通信子系统元件交互,并且还与其他装置子系统交互,诸如快闪存储器806、随机存取存储器(RAM)804、辅助输入/输出(I/O)装置838、数据端口828、显示器834、键盘836、扬声器832、麦克风830、短程通信子系统820、电力子系统822以及任何其他装置子系统等。
电池824连接到电力子系统822以向电子装置852的电路提供电力。电力子系统822包括用于向电子装置852提供电力的配电电路,并且还包含电池充电电路以管理再充电电池824。电力子系统822包括电池监控电路,该电池监控电路可操作以向电子装置852的不同部件提供一个或更多个电池状态指示器的状态,诸如剩余电量、温度、电压、电流消耗等。
一个示例的数据端口828是插座连接器104或电气和光学数据通信电路连接器(未示出)接合并配合的连接器,如上所述。数据端口828能够通过数据通信的不同模式来支持电子装置852与其他装置之间的数据通信,诸如通过光学通信电路或通过电数据通信电路(诸如并入一些示例的数据端口828中的USB连接等)的高速数据传输等。数据端口828能够支持与例如外部计算机或其他装置的通信。
通过数据端口828的数据通信能够使用户通过外部装置或通过软件应用设定参数,并且通过以下方式扩展装置的能力:通过电子装置852与外部数据源之间的直接连接而非经由无线数据通信网络使信息或软件能够交换。除了数据通信之外,数据端口828向电力子系统822提供电力以对电池824充电或向电子装置852的电子电路(诸如微处理器802)提供电力。
微处理器802所使用的操作系统软件被存储在快闪存储器806中。进一步的示例能够使用电池备份RAM或其他非易失性存储数据元素以存储操作系统、其他可执行程序或两者。操作系统软件、装置应用软件或者其部分能够被临时加载到诸如RAM804等的易失性数据存储器中。经由无线通信信号或通过有线通信接收的数据也能够被存储到RAM804。
除了其操作系统功能之外,微处理器802还能够在电子装置852上执行软件应用。控制基本装置操作的预设定的应用集合(至少包括数据和话音通信应用)能够在制造期间安装在电子装置852上。能够被加载到装置上的应用的示例可以是个人信息管理器(PIM)应用,该个人信息管理器(PIM)应用具有组织和管理与装置用户有关的数据项(诸如但不限于电子邮件、日历事件、语音邮件、任命和任务项等)的能力。
进一步应用还可通过例如无线网络850、辅助I/O装置838、数据端口828、短程通信子系统820或这些接口的任意组合加载到电子装置852上。然后,这样的应用能够由用户安装在RAM804或非易失性存储器中以由微处理器802执行。
在数据通信模式中,接收到的诸如短信或网页下载等的信号由通信子系统进行处理,该通信子系统包括无线接收机812和无线发射机810,并且传送的数据被提供给微处理器802,其能够进一步处理接收到的数据以便输出到显示器834,或者可替代地,输出到辅助I/O装置838或数据端口828。电子装置852的用户还可以使用键盘836结合显示器834和可能的辅助I/O装置838撰写数据项,诸如电子邮件消息等,该键盘836能够包括完整的字母数字键盘或电话型小键盘。然后,此类撰写项能够通过通信子系统在通信网络上传输。
对于语音通信,电子装置852的总体操作基本上类似,除了所接收的信号通常被提供到扬声器832以及用于发射的信号通常由麦克风830产生。可替代的语音或音频I/O子系统(诸如语音消息记录子系统等)还可以实施于电子装置852上。尽管语音或音频信号输出通常主要通过扬声器832来完成,但显示器834还可用于提供例如呼叫方的身份、语音通话的持续时间或其他语音通话相关信息的指示。
根据电子装置852的条件或状态,可以停用与子系统电路相关联的一个或更多个特定功能,或可以停用整个子系统电路。例如,如果电池温度低,则可以停用语音功能,但仍可以通过通信子系统启用数据通信(诸如电子邮件等)。
短程通信子系统820提供电子装置852与不同系统或装置之间的数据通信,该系统或装置不一定需要是类似的装置。例如,短程通信子系统820包括红外装置以及相关联的电路和部件或基于射频的通信模块(诸如一种支持
介质读取器860能够连接到辅助I/O装置838以允许例如将计算机程序产品的计算机可读程序代码加载到电子装置852中以存储到快闪存储器806中。介质读取器860的一个示例是诸如CD/DVD驱动器等的光学驱动器,其可以被用来将数据存储到诸如计算机可读存储介质862等的计算机可读介质或存储产品,以及从诸如计算机可读存储介质862等的计算机可读介质或存储产品读取数据。合适的计算机可读存储介质的示例包括诸如CD或DVD等的光学存储介质、磁介质或任何其他合适的数据存储装置。介质读取器860可替代地能够通过数据端口828连接到电子装置,或者计算机可读程序代码可替代地能够通过无线网络850提供到电子装置852。
已经描述了本发明的多个实施例。然而,将理解的是,在不背离本发明的精神和范围的情况下,可以做出各种修改。因此,其他实施例在所附权利要求的范围内。
实施例
示例1:体外测试平台的开发
开发了用于原型测试的体外测试台,其目标是模拟左心房302和食道300的空间关系和热导率。食道300由柔性聚乙烯醇(PVA)泡沫管代表,具有约2(2)厘米(cm)的内径和约5(5)毫米(mm)的厚度。PVA管的内部涂覆有硅酮密封剂以限制管的孔隙率。将具有5mm的外部厚度的5%琼脂水凝胶用作左心房组织的模型。使用烙铁施加热量,并且将整个系统浸没在37℃、0.7%盐水浴中。琼脂组织模型浸没在盐水表面下1mm,以模拟血液的表面流动,同时还减少了在消融部位处的热量损失。进行测试以将琼脂组织模型和烙铁热量应用与先前开发的利用消融导管的体外模型进行比较,以验证测试平台。测试平台的最终版本在图5中示出。
示例2:原型的开发和测试
建立原型设计(图1和图2),该原型设计利用弗利导管(Foley catheter)的球囊作为用于阻塞粘性流体沿食道向下流动的机构。通过阻塞最低端口并且在远侧球囊124上方建立新端口来修改弗利导管。将硅酮管道附接到导管,利用入口和出口输送室温水穿过该装置。在使用期间,将导管插入食道模型中并且将远侧球囊124定位在消融部位下方以避免将食道推向左心房302。然后远侧球囊124用5毫升(mL)空气膨胀以阻塞食道并固定装置的位置。一旦该原型就位,将用于室温水的入口管附接到泵并且将出口管放置在废料烧杯中。该泵系统可以用蠕动泵代替。在建立穿过硅酮管道的流体流动之后,使用注射器将在室温下的8mL粘性流体(藻酸盐、黄原胶等)递送穿过弗利导管的大端口。粘性流体的目的是用作对流热量交换的介质并保持在膨胀的球囊上方。
进行实验以确定硅酮管道的适当尺寸和配置,硅酮管道用于由室温水循环促进的最佳对流。图1示出了单匝管道配置。使用具有1.2mm外径或1.7mm外径的硅酮管道,以单匝(图1、3和9)或盘绕(图2、4和10)配置进行实验,以比较琼脂组织模型(代表食道壁)表面下方5mm的温度变化。基于实验结果,选择外径为1.7mm的管道。当与较小尺寸的管道相比时,较大的管道尺寸被证明减小了消融部位下方5mm的加热。这被认为是由于1.7mm管道中的流速增加。在初步测试后,在单匝和盘绕配置之间没有观察到显著差异,但是由于盘绕配置在食道内能够产生更均匀的对流区域,最终选择了盘绕配置。
外径(OD)1.7mm的盘绕硅酮管道原型在最大宽度的点处具有0.85cm(25.5F)的直径。
图7和图8示出了将外径1.7mm的盘绕球囊原型(图8)与对照(图7)进行比较的结果。在这些实验期间,在150℃下在240秒用烙铁施加热量持续30秒。随时间测量在热量应用部位处、在热量应用部位下方5mm处、以及在PVA食道模型内的温度。所示出的结果指示5mm深度处随时间的温度变化,其由表面处的温度变化进行归一化。执行这种归一化以考虑由于热量应用部位上方的水深差异或使用烙铁的热量应用差异引起的表面加热的差异。
球囊原型导致在消融部位下方5mm的温度降低,这在该实验平台中用于指示食道壁。数据通过在消融部位处温度的升高进行归一化,因此体外模型声明,在相等的消融部位处的温度下,使用原型时食道壁的温度升高会更低。具体地,用于原型的5mm深度处的平均最高温度比对照的平均温度低1.2℃,其中平均最高温度分别为36.8℃和38℃。
该原型的一种修改将是用粘性流体的开环流动代替室温水的闭环对流流动。在这种情况下,随着时间的推移,大量粘性流体将被替换,可能会增加对流的热量传递。
粘性流体的候选物包括0.5%至2%浓度的黄原胶、藻酸盐和明胶。由于从凝胶到流体在27℃左右的相变,明胶最终被排除在外。由于易于制备(包括图6中的实验),黄原胶已被最广泛地用于这些研究中。黄原胶可以通过单独搅拌而结合至水中,而藻酸盐需要加热以使聚合物降解。仍在使用浓度分别为1%和2%的黄原胶和藻酸盐进行实验,以确定差异。
除非另有明确说明,否则诸如短语“X、Y或Z中的至少一个”等的析取语言应与通常用于表示项目、术语等的上下文一起理解,可以是X、Y或Z或其任意组合(例如X、Y和/或Z)。因此,此类析取语言通常不旨在并且不应该暗示某些实施例要求存在X中的至少一个,Y中的至少一个或Z中的至少一个。
可以根据以下款项描述本公开的实施例的示例:
款项1:一种用于在治疗过程中冷却或加热食道内部区域的装置,包括:细长的柔性导管,其具有近侧端和远侧端;近侧球囊,该近侧球囊相对于导管的近侧端固定到导管的外表面,近侧球囊被配置和被定尺寸为当膨胀时阻塞食道的近侧部分;远侧球囊,该远侧球囊固定到导管的远侧端的外表面,远侧球囊被配置和被定尺寸为当膨胀时阻塞食道的第二部分;至少一个球囊膨胀内腔,该至少一个球囊膨胀内腔延伸穿过导管,至少一个球囊膨胀内腔具有与近侧球囊和远侧球囊的内部连通的至少一个膨胀入口;以及凝胶注射内腔,该凝胶注射内腔延伸穿过导管,凝胶注射内腔具有与凝胶出口流体连通的凝胶入口,凝胶出口定位在导管的远侧端处并且在近侧球囊与所述远侧球囊之间。
款项2:根据款项1所述的装置,进一步包括冷却剂管,该冷却剂管具有与冷却剂出口连通的冷却剂入口,其中,冷却剂管固定到导管的表面,冷却剂管从导管的近侧端延伸到导管的远侧端、邻近远侧球囊并且然后延伸回到导管的近侧端。
款项3:根据款项1或2所述的装置,冷却剂管盘绕在导管的外表面。
款项4:根据款项2或3所述的装置,其中,冷却剂管由碳组成。
款项5:根据款项2至4中的任一项所述的装置,其中,冷却剂管具有约1.7毫米的外径。
款项6:根据款项1至6中的任一项所述的装置,进一步包括一个或更多个温度传感器,该一个或更多个温度传感器连接到管以及被配置成输出与食道的内部区域有关的温度信息。
款项7:根据款项1至7中的任一项所述的装置,进一步包括插入导管的内部的可操纵元件,可操纵元件被配置成当定位在体内和导管的内部中时被弯曲,从而引起导管在体内的取向的变化。
款项8:根据款项1至7中任一项所述的装置,进一步包括插入导管的内部的可操纵元件,可操纵元件被配置成当定位在体内和导管的内部中时被弯曲,从而引起导管在体内的取向的变化。
款项9:一种试剂盒,包括用于生产凝胶的聚合物材料和款项1-8中任一项所述的装置。
款项10:一种试剂盒,包括凝胶和款项1-8中任一项所述的装置。
款项11:根据款项9或10所述的试剂盒,其中,凝胶包括水和聚亚烷基二醇。
款项12:根据款项11所述的试剂盒,其中,聚亚烷基二醇包括聚乙二醇、聚丙二醇、单甲氧基聚乙二醇、泊洛沙姆或其任意组合。
款项13:根据款项10-12中任一项所述的试剂盒,其中,聚亚烷基二醇的分子量为约600Da至约6000Da。
款项14:根据款项11至13中任一项所述的试剂盒,其中,聚亚烷基二醇占所述凝胶的重量百分比为约0.1至5。
款项15:根据款项9-14中任一项所述的试剂盒,其中,凝胶具有小于20的介电常数。
款项16:根据款项10所述的试剂盒,其中,凝胶包括导热凝胶。
款项17:一种用于在治疗过程中冷却或加热食道内部区域的方法,包括:将如权利要求1-8中任一项所述的装置插入食道中;将该装置的近侧球囊和远侧球囊膨胀,以阻塞食道的近侧区段和远侧区段;以及将凝胶注射到装置的凝胶注射内腔中,以便将凝胶沉积到所述食道中,凝胶在近侧球囊下方和远侧球囊上方的区域中沉积到食道中。
款项18:根据款项17所述的方法,其中,凝胶包括水和聚亚烷基二醇。
款项19:根据款项18所述的方法,其中,聚亚烷基二醇包括聚乙二醇、聚丙二醇、单甲氧基聚乙二醇、泊洛沙姆或其任意组合。
款项20:根据款项18或19中任一项所述的方法,其中,聚亚烷基二醇的分子量为约600Da至约6000Da。
款项21:根据款项18-20中的任一项所述的方法,其中,聚亚烷基二醇占所述凝胶的重量百分比为约0.1至5。
款项22:根据款项17-21中任一项所述的方法,其中,凝胶具有小于20的介电常数。
款项23:根据款项17所述的方法,其中,凝胶包括导热凝胶。
款项24:一种用于体外测试心房消融装置的装置,包括:柔性管,该柔性管具有内腔,所述内腔被配置和被定尺寸为模拟食道;水凝胶,该水凝胶定位在柔性管的表面上,其中,水凝胶被定尺寸和被配置为模拟左心房壁;加热源,该加热源被配置成将水凝胶加热至消融温度;以及第一温度探头和第二温度探头中的至少一个,第一温度探头定位在柔性管的内腔中,第二温度探头定位在柔性管与水凝胶之间。
款项25:根据款项24所述的装置,其中,加热源被配置成产生至少150℃的温度。
款项26:根据款项24或25所述的装置,其中,柔性管具有约2cm的内径和约5mm的厚度。
款项27:根据款项24至26中任一项所述的装置,其中,水凝胶具有至少5mm的厚度。
款项28:根据款项24至27中任一项所述的装置,进一步包括第三温度探头,该第三温度探头定位在水凝胶中距离柔性管至少3mm处。
款项29:根据款项24至28中任一项所述的装置,该装置悬浮于37℃的盐水浴中。
术语“基本上”是指允许与描述性术语的偏差不会对预期目的产生负面影响。描述性术语被隐含地理解为基本上由词来修饰,即使该术语没有明确基本上由词来修饰。
应当注意,比率、浓度、数量和其他数值数据在本文中可以以范围格式表示。应当理解,这种范围格式是为了方便和简洁而使用的,并且因此应该以灵活的方式解释为不仅包括明确列举为范围限制的数值,而且包括所有单独的数值或子区间,该数值或子区间是涵盖在如这个范围内明确列举的每个数值和子区间。为了说明,“约0.1%至约5%”的浓度范围应解释为不仅包括重量百分比为约0.1至约5的明确列举的浓度,而且还包括单独的浓度(例如1%、2%、3%和4%)以及指定范围内的子区间(例如0.5%、1.1%、2.2%、3.3%和4.4%)。术语“约”可以包括常规的根据有效数值的舍入。此外
应该强调的是,本公开的上述实施例仅仅是为了清楚地理解本公开的原理而提出的实施方式的可能示例。可以在基本上不脱离本公开的精神和原理的情况下,对上述实施例进行许多变型和修改。所有这些修改和变型旨在被包括在本公开的范围内,并由所附权利要求书保护。
除非另有定义,否则本文所使用的所有技术和科学术语具有与所公开的发明所属领域的技术人员通常所理解的相同的含义。本文所引用的出版物及其所引用的材料通过引用具体结合到本文中。
本领域技术人员将仅使用常规实验就将认识到或能够确定本文所述的本发明的具体实施例的许多等同物。这些等同物旨在由所附权利要求书涵盖。
- 在心脏消融期间控制食道温度
- 心脏消融期间的呼吸控制
