新型CAS12B酶和系统
文献发布时间:2023-06-19 12:16:29
相关申请的交叉引用
本申请要求2018年8月7日提交的美国临时申请第62/715,640号、2018年10月10日提交的美国临时申请第62/744,080号、2018年10月26日提交的美国临时申请第62/751,196号、2019年1月21日提交的美国临时申请第62/794,929号和2019年4月8日提交的美国临时申请第62/831,028号的权益。上述申请的全部内容特此通过引用全部并入本文。
关于联邦政府资助研究的声明
本发明是在美国国立卫生研究院授予的拨款号MH110049和HL141201的政府支持下完成的。政府拥有本发明的某些权利。
对电子序列表的引用
电子序列表(“BROD-2670_ST25.txt”;大小为879,558字节并且其创建于2019年7月25日)的内容通过引用整体并入本文。
技术领域
本文公开的主题总体上涉及与成簇的规律间隔的短回文重复序列(CRISPR)及其组分有关的系统、方法和组合物。本发明总体上还涉及大型有效载荷(payload)的递送,并且包括新型递送粒子,特别是使用脂质和病毒粒子,以及新型病毒衣壳,两者均适于递送大型有效载荷,例如成簇的规律间隔的短回文重复序列(CRISPR)、CRISPR蛋白(例如Cas、C2c1)、CRISPR-Cas或CRISPR系统或CRISPR-Cas复合物、其组分、涉及其的核酸分子例如载体,以及所有前述物质的用途,以及其他方面。另外,本发明涉及用于开发或设计基于CRISPR-Cas系统的疗法或治疗剂的方法。
背景技术
基因组测序技术和分析方法的最新进展显著加速了对与范围广泛的生物学功能和疾病相关的遗传因子进行编目和映射的能力。需要精确的基因组靶向技术,以通过允许对单个遗传元件进行选择性扰动来实现因果遗传变异的系统逆向工程,以及推进合成生物学、生物技术和医学应用。尽管基因组编辑技术如设计者锌指、转录激活子样效应因子(TALE)或归巢大范围核酸酶可用于产生靶向基因组扰动,但是仍需要采用新型策略和分子机制并且价格可承受、易于建立、可扩展并且适合于靶向真核基因组内的多个位置的新的基因组工程技术。这将为基因组工程和生物技术的新应用提供主要资源。
细菌和古细菌适应性免疫的CRISPR-Cas系统显示出蛋白质组成和基因组基因座构造的极端多样性。CRISPR-Cas系统基因座具有超过50个基因家族并且没有严格通用的基因,这表明基因座构造的快速进化和极端多样性。到目前为止,采用多管齐下的方法,已对93种Cas蛋白的约395个图谱进行了全面的cas基因鉴定。分类包括签名基因图谱加上基因座构造签名。提出了一种新的CRISPR-Cas系统分类,其中将这些系统大致分为两类:具有多亚基效应子复合物的1类和具有单亚基效应子模块的2类(以Cas9蛋白为例)。与2类CRISPR-Cas系统相关的新型效应蛋白可作为强大的基因组工程工具开发,并且对推定的新型效应蛋白及其工程化和优化的预测是重要的。新型的Cas12b直系同源物及其用途是理想的。
在本申请中对任何文件的引用或标识均不承认所述文件可用作本发明的现有技术。
发明内容
在一个方面,本公开提供了一种非天然存在的或工程化的系统,所述系统包含:i)来自表1或表2的Cas12b效应蛋白,和ii)包含能够与靶序列杂交的指导序列的指导物。在一些实施方案中,所述系统还包含tracr RNA。
在一些实施方案中,Cas12b效应蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌(Alicyclobacillus kakegawensis)、芽孢杆菌属V3-13种、外村尚芽孢杆菌(Bacillus hisashii)、黏胶球形菌纲细菌(Lentisphaeria bacterium)和沉积物莱西氏菌(Laceyella sediminis)。在一些实施方案中,tracr RNA在正向重复序列的5'端与crRNA融合。在一些实施方案中,所述系统包含两个或更多个crRNA。在一些实施方案中,指导序列与原核细胞中的一个或多个靶序列杂交。在一些实施方案中,指导序列与真核细胞中的一个或多个靶序列杂交。在一些实施方案中,Cas12b效应蛋白包含一个或多个核定位信号(NLS)。在一些实施方案中,Cas12b效应蛋白是无催化活性的。在一些实施方案中,Cas12b效应蛋白与一个或多个功能结构域相缔合。在一些实施方案中,一个或多个功能结构域切割一个或多个靶序列。在一些实施方案中,功能结构域修饰一个或多个靶序列的转录或翻译。在一些实施方案中,Cas12b效应蛋白与一个或多个功能结构域相缔合;并且Cas12b效应蛋白在RuvC和/或Nuc结构域内包含一个或多个突变,由此形成的CRISPR复合物能够在靶序列处或其附近递送表观遗传修饰子或者转录或翻译激活或阻遏信号。在一些实施方案中,Cas12b效应蛋白与腺苷脱氨酶或胞苷脱氨酶相缔合。在一些实施方案中,所述系统还包含重组模板。在一些实施方案中,所述重组模板通过同源性定向修复(HDR)而被插入。
在另一方面,本公开提供了一种Cas12b载体系统,所述Cas12b载体系统包含一个或多个载体,所述载体包含:第一调控元件,所述第一调控元件可操作地连接至编码来自表1或表2的Cas12b效应蛋白的核苷酸序列,以及i)a)第二调控元件,所述第二调控元件可操作地连接至编码指导序列的核苷酸序列,和b)第三调控元件,所述第三调控元件可操作地连接至编码tracr RNA的核苷酸序列,或ii)第二调控元件,所述第二调控元件可操作地连接至编码指导序列和tracr RNA的核苷酸序列。
在一些实施方案中,对编码Cas12b效应蛋白的核苷酸序列进行密码子优化以在真核细胞中表达。在一些实施方案中,所述系统包含在单个载体中。在一些实施方案中,一个或多个载体包括病毒载体。在一些实施方案中,一个或多个载体包括一个或多个逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体或单纯疱疹病毒载体。
在另一方面,本公开提供了一种递送系统,所述递送系统被配置为递送非天然存在的或工程化的组合物的Cas12b效应蛋白和一个或多个核酸组分,所述组合物包含i)来自表1或表2的Cas12b效应蛋白,ii)能够与一个或多个靶序列杂交的3'指导序列,和iii)tracr RNA。
在一些实施方案中,所述递送系统包含一个或多个载体,或一个或多个多核苷酸分子,所述一个或多个载体或多核苷酸分子包含编码非天然存在的或工程化的组合物的Cas12b效应蛋白和一个或多个核酸组分的一个或多个多核苷酸分子。在一些实施方案中,所述递送系统包含包括脂质体、粒子、外泌体、微囊泡、基因枪或病毒载体的递送媒介物。
在另一方面,本公开提供了本文的非天然存在的或工程化的系统、本文的载体系统或本文的递送系统,其用于治疗性治疗方法中。
在另一方面,本公开提供了一种对一个或多个目标靶序列进行修饰的方法,所述方法包括使一个或多个靶序列与一种或多种非天然存在的或工程化的组合物接触,所述组合物包含i)来自表1或表2的Cas12b效应蛋白,ii)能够与靶DNA序列杂交的3'指导序列,和iii)tracr RNA,由此形成包含与crRNA和tracr RNA复合的Cas12b效应蛋白的CRISPR复合物,其中所述指导序列引导与细胞中的所述一个或多个靶序列的序列特异性结合,从而修饰所述一个或多个靶序列的表达。在一些实施方案中,修饰靶基因的表达包括切割一个或多个靶序列。在一些实施方案中,修饰靶基因的表达包括增加或减少一个或多个靶序列的表达。在一些实施方案中,组合物还包含重组模板,并且其中修饰一个或多个靶序列包括插入重组模板或其一部分。在一些实施方案中,一个或多个靶序列在原核细胞中。在一些实施方案中,一个或多个靶序列在真核细胞中。
在另一方面,本公开提供了包含一个或多个修饰的靶序列的细胞或其后代,其中所述一个或多个靶序列已经根据本文的方法进行修饰,任选地治疗性T细胞或产生抗体的B细胞或者其中所述细胞是植物细胞。在一些实施方案中,细胞是原核细胞。在一些实施方案中,细胞是真核细胞。在一些实施方案中,一个或多个靶序列的修饰导致:所述细胞包含至少一种基因产物的表达改变;所述细胞包含至少一种基因产物的表达改变,其中所述至少一种基因产物的表达增加;所述细胞包含至少一种基因产物的表达改变,其中所述至少一种基因产物的表达减少;产生和/或分泌内源性或非内源性生物产物或化学化合物的细胞或群体。在一些实施方案中,细胞是哺乳动物细胞或人类细胞。在另一方面,本公开提供了本文的细胞或其后代的细胞系,或包含本文的细胞或其后代的细胞系。
在另一方面,本公开提供了一种多细胞生物体,所述多细胞生物体包含一个或多个本文的细胞。
在另一方面,本公开提供了一种植物或动物模型,所述植物或动物模型包含一个或多个本文的细胞。
在另一方面,本公开提供了来自本文的细胞、细胞系、生物体、或植物或动物模型的基因产物。在一些实施方案中,所表达的基因产物的量大于或小于来自未改变表达的细胞的基因产物的量。
在另一方面,本公开提供了来自表1或表2的分离的Cas12b效应蛋白。
在另一方面,本公开提供了编码Cas12b效应蛋白的分离的核酸。在一些实施方案中,所述分离的核酸是DNA,并且还包含编码crRNA和tracr RNA的序列。
在另一方面,本公开提供了一种分离的真核细胞,所述分离的真核细胞包含本文的核酸或Cas12b蛋白。
在另一方面,本公开提供了非天然存在的或工程化的系统,所述系统包含:i)编码来自表1或表2的Cas12b效应蛋白的mRNA,ii)指导序列,和iii)tracr RNA。在一些实施方案中,所述tracr RNA在正向重复序列的5'端与crRNA融合。
在另一方面,本公开提供了一种用于定点碱基编辑的工程化系统,所述工程化系统包含靶向结构域和腺苷脱氨酶、胞苷脱氨酶或其催化结构域,其中所述靶向结构域包含Cas12b效应蛋白或其保留寡核苷酸结合活性的片段和指导分子。在一些实施方案中,所述Cas12b效应蛋白是无催化活性的。在一些实施方案中,所述Cas12b效应蛋白选自表1或表2。在一些实施方案中,所述Cas12b效应蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
在另一方面,本公开提供了一种对一个或多个目标靶寡核苷酸中的腺苷或胞苷进行修饰的方法,所述方法包括将本文的组合物递送至所述一个或多个靶寡核苷酸。在一些实施方案中,用于治疗或预防由含有致病性T→C或A→G点突变的转录物引起的疾病。在另一方面,本公开提供了从本文的方法获得和/或包含本文的组合物的分离的细胞。在一些实施方案中,所述真核细胞,优选地人类或非人类动物细胞,任选地治疗性T细胞或产生抗体的B细胞,或者其中所述细胞是植物细胞。
在另一方面,本公开提供了包含所述修饰的细胞或其后代的非人类动物。
在另一方面,本公开提供了包含本文的修饰的细胞的植物。
在另一方面,本发明提供了用于疗法、优选细胞疗法中的修饰的细胞。
在另一方面,本公开提供了一种对靶寡核苷酸中的腺嘌呤或胞嘧啶进行修饰的方法,所述方法包括将以下各物递送至所述靶寡核苷酸:无催化活性的Cas12b蛋白;指导分子,所述指导分子包含与正向重复序列连接的指导序列;和腺苷或胞苷脱氨酶蛋白或其催化结构域;其中所述腺苷或胞苷脱氨酶蛋白或其催化结构域与所述无催化活性的Cas12b蛋白或所述指导分子共价或非共价连接,或者所述腺苷或胞苷脱氨酶蛋白或其催化结构域与所述无催化活性的Cas12b蛋白或所述指导分子适于在递送后与所述无催化活性的Cas12b蛋白或所述指导分子连接;其中所述指导分子与所述无催化活性的Cas12b形成复合物并引导所述复合物结合所述靶寡核苷酸,其中所述指导序列能够与所述靶寡核苷酸内的靶序列杂交以形成寡核苷酸双链体。
在一些实施方案中,(A)所述胞嘧啶在形成所述寡核苷酸双链体的所述靶序列外部,其中所述胞苷脱氨酶蛋白或其催化结构域使所述RNA双链体外部的所述胞嘧啶脱氨基,或者(B)所述胞嘧啶在形成所述RNA双链体的所述靶序列内部,其中所述指导序列在对应于所述胞嘧啶的位置处包含非配对的腺嘌呤或尿嘧啶,导致所述寡核苷酸双链体中的C-A或C-U错配,并且其中所述胞苷脱氨酶蛋白或其催化结构域使寡核苷酸双链体中与非配对的腺嘌呤或尿嘧啶相对的胞嘧啶脱氨基。在一些实施方案中,所述腺苷脱氨酶蛋白或其催化结构域使寡核苷酸双链体中的所述腺嘌呤或胞嘧啶脱氨基。在一些实施方案中,Cas12b效应蛋白选自表1或表2。在一些实施方案中,Cas12b蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
在另一方面,本公开提供了用于检测一个或多个体外样品中核酸靶序列的存在的系统,所述系统包含:Cas12b蛋白;至少一个包含指导序列的指导多核苷酸,所述指导序列被设计成与所述靶序列具有一定程度的互补性,并设计成与所述Cas12b形成复合物;以及包含非靶序列的基于寡核苷酸的掩蔽构建体;其中所述Cas12b表现出附带核酸酶活性并且一旦被靶序列激活,就切割所述基于寡核苷酸的掩蔽构建体的非靶序列。
在另一方面,本公开提供了用于检测一个或多个体外样品中一种或多种靶多肽的存在的系统,所述系统包含:Cas12b蛋白;一个或多个检测适体,每个检测适体被设计成与所述一种或多种靶多肽中的一者结合,每个检测适体包含被掩蔽的提示结合位点或被掩蔽的引物结合位点和触发序列模板;以及包含非靶序列的基于寡核苷酸的掩蔽构建体。
在一些实施方案中,所述系统还包含核酸扩增试剂以扩增靶序列或触发序列。在一些实施方案中,所述核酸扩增试剂是等温扩增试剂。在一些实施方案中,所述Cas12b蛋白选自表1或表2。在一些实施方案中,所述Cas12b效应蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
在另一方面,本公开提供了用于检测一个或多个体外样品中的核酸序列的方法,所述方法包括:使一个或多个样品与以下各物接触:i)Cas12b蛋白;ii)至少一个包含指导序列的指导多核苷酸,所述指导序列被设计成与靶序列具有一定程度的互补性,并设计成与所述Cas12b蛋白形成复合物;以及iii)包含非靶序列的基于寡核苷酸的掩蔽构建体;并且其中所述Cas12蛋白表现出附带核酸酶活性并切割所述基于寡核苷酸的掩蔽构建体的非靶序列。
在一些实施方案中,所述Cas12b蛋白选自表1或表2。在一些实施方案中,所述Cas12b蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。在另一方面,本公开提供了一种非天然存在的或工程化的组合物,所述组合物包含与酶或报告部分的非活性第一部分连接的Cas12b蛋白,其中当接触所述酶或报告部分的互补部分时,所述酶或报告部分被重建。在一些实施方案中,所述酶或报告部分包含蛋白水解酶。在一些实施方案中,Cas12蛋白包含第一Cas12b蛋白和连接至酶或报告部分的互补部分的第二Cas12b蛋白。在一些实施方案中,所述组合物还包含:i)能够与所述第一Cas12b蛋白形成复合物并与靶核酸的第一靶序列杂交的第一指导物;和ii)能够与第二Cas12b蛋白形成复合物并与所述靶核酸上的第二靶序列杂交的第二指导物。在一些实施方案中,所述蛋白水解酶包括胱天蛋白酶(caspase)。在一些实施方案中,所述蛋白水解酶包括烟草蚀纹病毒(TEV)。
在另一方面,本公开提供了一种在包含靶寡核苷酸的细胞中提供蛋白水解活性的方法,所述方法包括:a)使细胞或细胞群体与以下各物接触:i)与蛋白水解酶的非活性部分连接的第一Cas12b效应蛋白;ii)与所述蛋白水解酶的互补部分连接的第二Cas12b效应蛋白,其中当接触所述蛋白水解酶的所述第一部分和所述互补部分时,所述蛋白水解酶的蛋白水解活性被重建;iii)与所述第一Cas12b效应蛋白结合并与所述靶寡核苷酸的第一靶序列杂交的第一指导物;以及iv)与所述第二Cas12b效应蛋白结合并与所述靶寡核苷酸的第二靶序列杂交的第二指导物,从而接触蛋白水解酶的第一部分和互补部分并且蛋白水解酶的蛋白水解活性被重建。
在一些实施方案中,蛋白水解酶是胱天蛋白酶。在一些实施方案中,蛋白水解酶是TEV蛋白酶,其中TEV蛋白酶的蛋白水解活性被重建,由此TEV底物被切割并激活。在一些实施方案中,TEV底物是被工程化而包含TEV靶序列的胱天蛋白酶原(procaspase),由此TEV蛋白酶进行的切割激活胱天蛋白酶原。
在另一方面,本发明提供了一种鉴定含有目标寡核苷酸的细胞的方法,所述方法包括使所述细胞中的所述寡核苷酸与包含以下各物的组合物接触:i)与蛋白水解酶的非活性第一部分连接的第一Cas12b效应蛋白;ii)与所述蛋白水解酶的互补部分连接的第二Cas12b效应蛋白,其中当接触所述蛋白水解酶的所述第一部分和所述互补部分时,所述蛋白水解酶的活性被重建;iii)与所述第一Cas12b效应蛋白结合并与所述寡核苷酸的第一靶序列杂交的第一指导物;iv)与所述第二Cas12b效应蛋白结合并与所述寡核苷酸的第二靶序列杂交的第二指导物;以及v)可检测地切割的报告物,其中当目标寡核苷酸存在于细胞中时,接触蛋白水解酶的第一部分和互补部分,从而蛋白水解酶的活性被重建并可检测地切割所述报告物。
在另一方面,本公开提供了一种鉴定含有目标寡核苷酸的细胞的方法,所述方法包括使所述细胞中的所述寡核苷酸与包含以下各物的组合物接触:i)与报告物的非活性第一部分连接的第一Cas12b效应蛋白;ii)与所述报告物的互补部分连接的第二Cas12b效应蛋白,其中当接触所述报告物的所述第一部分和所述互补部分时,所述报告物的活性被重建;iii)与所述第一Cas12b效应蛋白结合并与所述寡核苷酸的第一靶序列杂交的第一指导物;iv)与所述第二Cas12b效应蛋白结合并与所述寡核苷酸的第二靶序列杂交的第二指导物;以及v)所述报告物,其中当目标寡核苷酸存在于细胞中时,接触报告物的第一部分和互补部分,从而报告物的活性被重建。在一些实施方案中,报告物是荧光蛋白或发光蛋白。
在考虑到以下对所阐明的示例实施方案的详细说明之后,示例实施方案的这些和其他方面、目的、特征和优点对于本领域普通技术人员来说将变得显而易见。
附图说明
通过参考下面的详细说明和附图,将获得对本发明的特征和优点的理解,所述详细说明阐述了可利用本发明的原理的说明性实施方案,在所述附图中:
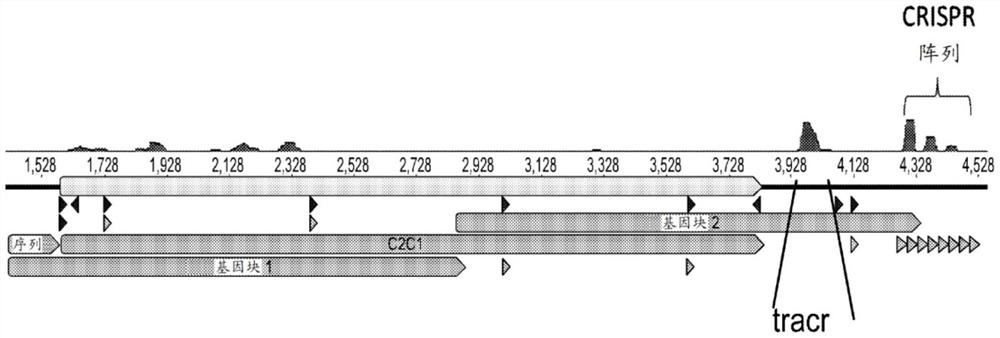
图1描绘了菲西芬氏菌纲(Phycisphaerae)细菌CRISPR-C2c1基因座。小RNAseq揭示了tracrRNA的位置和成熟crRNA的构造。
图2A-2C示出了预测的tracrRNA(图2A)(SEQ ID NO:1-11)以及Tracer#1(图2B)和Tracer#5(图2C)的tracer(绿色)与正向重复序列(红色)的双链体的倍数预测(SEQ ID NO:12、656和13)。
图3A示出了针对最宽松的预测PAM提供的用于Seqlogos的PAM筛选的结果,并且图3B示出了最严格的预测PAM。
图4示出了PhbC2c1 PAM为TTH(H=A、T或C)的体内确认。用编码位于可识别的原间隔子5'处的不同PAM序列的质粒DNA转化细胞。
图5描绘了使用Cpf1切口酶的序列特异性切口酶扩增。
图6说明了适体颜色的产生。
图7描绘了浮霉菌门(Planctomycetes)CRISPR-C2c1基因座。小RNAseq揭示了tracrRNA的位置和成熟crRNA的构造。
图8A示出了针对最宽松的预测PAM提供的用于Seqlogos的PAM筛选的结果并且图8B示出了最严格的预测PAM(B)。筛选显示,浮霉菌门的PAM为TTR(R=G或A)。
图9示出了浮霉菌门C2c1 PAM为TTR(R=G或A)的体内验证。用编码位于可识别的原间隔子5'处的不同PAM序列的质粒DNA转化细胞。
图10示出了用crRNA-tracrRNA复合物分离C2c1的质粒的实例。质粒包含PhyciC2c1和/或tracrRNA和/或CRISPR阵列。经加工的crRNA和tracrRNA将与C2c1形成复合物,并且可与C2c1蛋白(C2c1-RNA复合物)共纯化。
图11A示出了在蛋白质下拉测定中的PhyciC2c1和PlancC2c1的条带。进行了RNA酶和DNA酶消化实验,在图11B中表明PhysiC2c1蛋白中存在RNA(PhyC2c1蛋白对RNA酶消化敏感,而对DNA酶消化不敏感)。图11C进一步证实了PhysiC2c1蛋白中存在RNA。共纯化的RNA的大小与crRNA相匹配,但似乎大于118nt预测tracrRNA。
图12提供了体外切割实验的条件和结果,其证实PhysiC2c1-RNA复合物可切割含有与CRISPR阵列的第一指导物相匹配的原间隔子序列的DNA。
图13示出了不同的sgRNA。在大肠杆菌(E.coli)中表达的BhCas12b基因座的小RNA-seq揭示tracrRNA和crRNA。tracrRNA和crRNA融合形成sgRNA变体的图。(SEQ ID NO:14-29)
图14示出了质粒转染后针对不同靶位点用图13的不同sgRNA获得的插入/缺失百分比。使用的Cas12b来自外村尚芽孢杆菌菌株C4。BhCas12b和sgRNA变体在HEK293细胞中的表达在多个基因组位点产生插入/缺失突变。
图15A-15C分别示出了使用来自Ls、Ak和Bv的Cas12b直系同源物的PAM发现、利用纯化蛋白和RNA的体外切割。(图15A-SEQ ID NO:30和657;图15B–SEQ ID NO:31和658;图15C–SEQ ID NO:32和659)。图15D-15E分别示出了使用来自Phyci和Planc的Cas12B直系同源物的利用纯化蛋白和RNA的体外切割。
图16示出了纯化的AmCas12b(AmC2C1)蛋白和利用来自小RNAseq的不同预测tracrRNA的体外切割测定。
图17A-17E示出了AmC2C1的sgRNA设计。(图17A-SEQ ID NO:33和660;图17B–SEQID NO:34和661;图17C–SEQ ID NO:35;图17D–SEQ ID NO:36;图17E–SEQ ID NO:37)。
图18示出了用AmC2C1进行的体外切割,以比较sgRNA效率。
图19示出了AmC2C1 RuvC突变体的活性。
图20示出了通过体外PAM筛选确定Cas12b直系同源物的PAM。
图21A示出了小RNAseq tracr预测。图21B示出了来自体内筛选的BhC2C1(外村尚芽孢杆菌Cas12b)PAM。图21C示出了BhC2C1蛋白纯化。图21D示出了分别在37℃和48℃下用BhC2C1蛋白和预测tracr RNA进行的体外切割。
图22A-22D示出了BhC2C1的sgRNA设计。(图22A-SEQ ID NO:38和662;图22B–SEQID NO:39;图22C–SEQ ID NO:40;图22D–SEQ ID NO:41)
图23示出了含有BhC2C1的示例性构建体的质粒图谱。
图24示出了对于表12中的不同靶位点,在质粒转染后用表12中的不同sgRNA获得的插入/缺失百分比。所使用的Cas12b是BvCas12b。(SEQ ID NO:42-47)
图25示出了含有BvCas12b的示例性构建体的质粒图谱。
图26示出了含有BhCas12b的示例性构建体的质粒图谱。
图27示出了含有EbCas12b的示例性构建体的质粒图谱。
图28示出了含有AkCas12b的示例性构建体的质粒图谱。
图29示出了含有PhyciCas12b的示例性构建体的质粒图谱。
图30示出了含有PlancCas12b的示例性构建体的质粒图谱。
图31示出了含有BvCas12b的示例性构建体pZ143-pcDNA3-BvCas12b的质粒图谱。
图32示出了含有BvCas12b sgRNA支架的示例性构建体pZ147-BvCas12b-sgRNA-支架的质粒图谱。
图33示出了含有BhCas12b sgRNA支架的示例性构建体pZ148-BhCas12b-sgRNA-支架的质粒图谱。
图34示出了含有在S893、K846和E836处具有突变的BhCas12b的示例性构建体pZ149-BhCas12b-S893R-K846R-E836G的质粒图谱。
图35示出了含有在S893、K846和E836处具有突变的BhCas12b的示例性构建体pZ150-pCDNA3-BhCas12b-S893R-K846R-E836K的质粒图谱。
图36示出了在各种条件下BhCas12b的PAM发现结果。
图37示出了在各种条件下BvCas12b的PAM发现结果。
图38示出了BhCas12b变体在不同结合位点的插入/缺失百分比。
图39示出了其他BhCas12b变体在不同结合位点的插入/缺失百分比。
图40A示出了在DNMT1-1被BhCas12b(实施例20中的变体4)和BvCas12b切割的HDR。(SEQ ID NO:48-51)图40B示出了在VEGFA-2被BhCas12b(实施例20中的变体4)和BvCas12b切割的HDR(SEQ ID NO:52-55)。
图41A示出了AsCas12a在TTTV PAM以及BhCas12b变体4和BvCas12b在ATTN PAM的插入/缺失百分比的比较。图41B示出了BhCas12b变体4和BvCas12b活性在不同PAM序列下的细分。
图42A示出了VEGFA靶标的示意图,所述靶标包括有待与ssDNA供体一起引入的所需改变(SEQ ID NO:56-59)。图42B示出了每个核酸酶在VEGFA靶位点的插入/缺失活性。图42C示出了在VEGFA位点含有所需编辑(两个核苷酸取代)的细胞的百分比。图42D示出了DNMT1靶标的示意图,所述靶标包括有待与ssDNA供体一起引入的所需改变(SEQ ID NO:60-63)。图42E示出了每个核酸酶在DNMT1靶位点的插入/缺失活性。图42F示出了在DNMT1位点含有所需编辑(两个核苷酸取代)的细胞的百分比。
图43–左图分别示出了被BhCas12b(v4)和BvCas12b靶向的CXCR4靶向外显子和CXCR4序列(SEQ ID NO:64-77)。右图示出了插入/缺失百分比,其显示BhCas12b(v4)和BvCas12b对来自两个供体的T细胞中CXCR4的影响。
图44A-44E。嗜中温Cas12b核酸酶的鉴定。图44A)突出显示Cas9、Cas12a和Cas12b核酸酶之间的差异的基因座示意图和蛋白质结构域结构。SpCas9(PDB:4oo8)、AsCas12a(PDB:5b43)和AacCas12b(PDB:5u30)的晶体结构。图44B)利用纯化的Cas12b蛋白和通过RNA-Seq鉴定的合成crRNA和tracrRNA的Cas12b系统的体外重建。反应在指定的温度下进行90分钟,和250nM Cas12b蛋白。图44C、图44D)在六种sgRNA变体下AkCas12b和BhCas12b在293T细胞中的插入/缺失活性。误差条表示来自n=4个重复物的标准偏差。关于sgRNA序列,参见图50B和图50C。图44E)BhCas12b sgRNA结构和所测试变体(SEQ ID NO:78)的位置的示意图。
图45A-45H。BhCas12b的合理工程化。图45A)利用差异标记的DNA链的体外Cas12b反应。在天然PAGE分离过程中观察到较慢的迁移产物,并且通过变性PAGE分离揭示出AkCas12b和BhCas12b在较低温度下切割非靶链的偏好。图45B)在靶链与RuvC活性位点(紫色)之间的口袋中的12个测试残基中的10个测试残基的位置。BhCas12b残基在高度相似的BthCas12b(PDB:5wti)的结构中突出显示。图45C)相对于野生型(灰色符号)归一化的DNMT1靶标4和VEGFA靶标2上的268个BhCas12b突变的插入/缺失活性。误差条表示来自n=2个重复物的标准偏差。图45D)突变为甘氨酸的表面暴露残基的位置。图45E)相对于野生型(灰色符号)归一化的DNMT1靶标4和VEGFA靶标2上的66个BhCas12b突变的插入/缺失活性。误差条表示来自n=2个重复物的标准偏差。图45F)BhCas12b高活性变体的总结。图45G)BhCas12b变体在4个靶位点的插入/缺失活性。误差条表示来自n=3-6个重复物的标准偏差。图45H)利用递增浓度的BhCas12b WT和v4变体的体外切割。凝胶是来自n=2个实验的代表性图像。
图46A-46G。BhCas12b v4和BvCas12b介导的人类细胞系中的基因组编辑。图46A)在293T细胞中AsCpf1在28个TTTV靶标、BhCas12b v4在33个ATTN靶标和BvCas12b在37个ATTN靶标的插入/缺失活性。每个点代表单个靶位点,从n=4个重复物取平均值。图46B)从30个活性指导物取平均值的Cas12b基因组编辑的平均插入/缺失长度。图46C)可由SpCas9和Cas12a/b核酸酶靶向的DNMT1靶位点和含有TG至CA突变和PAM破坏突变的120nt ssODN供体的示意图(SEQ ID NO:79-83)。图46D)每个核酸酶在基因座处的插入/缺失活性。误差条表示来自n=8个重复物的标准偏差。图46E)使用靶链(T)或非靶链(NT)供体的同源性定向修复(HDR)的频率。灰色条表示TG至CA突变的频率,而红色条表示包含图c中的HDR序列并且无突变的完美编辑。误差条表示来自n=6个重复物的标准偏差。图46F)利用30个活性BhCas12b指导物、45个活性AsCas12a指导物和39个活性SpCas9指导物的基因组编辑期间的平均插入/缺失长度。图46G)BhCas12b v4 RNP递送后CD4+人类T细胞中的插入/缺失活性。每个点代表单独的电穿孔(n=2)。源数据以源数据文件形式提供。
图47A-47B。BhCas12b v4和BvCas12b是高度特异性的核酸酶。图47A)在293T细胞中在选择用于Guide-Seq分析的9个靶位点的插入/缺失活性。误差条表示来自n=4个重复物的标准偏差。图47B)Guide-Seq分析显示对于每个核酸酶检测到的切割位点的数量和相对比例。脱靶以浅灰色楔形显示,而在靶位点以蓝色突出显示,并且在靶读段分率显示于下。仅在使用SpCas9时检测到脱靶,关于完整分析参见图55。
图48A-48E Cas12b直系同源物的PAM发现。图48A)Cas12b直系同源物的比对。图48B)基于比对的V-B亚型效应子Cas12b蛋白的系统发育树。序列由Genbank蛋白登录号和物种名称表示。在这项工作中进行实验研究的蛋白质以粗体显示。在37C下表现出稳健编辑活性并已详细研究的四种蛋白质以下划线标出。图48C)大肠杆菌中PAM发现测定的示意图。图48D)在大肠杆菌的14个Cas12b系统中,只有4个检测到耗尽的PAM。耗尽阈值设置为-log
图49A-49F。Cas12b RNA-Seq和体外重建。图49A-49D)AkCas12b、BhCas12b、EbCas12b和LsCas12b的小RNA-Seq读段的比对。切割反应中使用的tracrRNA的位置以黄色突出显示。图49E)用于这项研究中的纯化Cas12b蛋白和商业生产的AsCas12a(IDT)的考马斯(Coomassie)染色SDS-PAGE凝胶。图49F)用AkCas12b和BhCas12b进行的体外切割反应,其将tracrRNA和crRNA与v1 sgRNA支架进行了比较。
图50A-50E。哺乳动物细胞中的Cas12b sgRNA优化。图50A)哺乳动物细胞中表达构建体和插入/缺失活性测定的示意图。图50B)AkCas12b sgRNA变体(SEQ ID NO:84-89)。图50C)BhCas12b sgRNA变体(SEQ ID NO:90-95)。图50D)AkCas12b sgRNA结构和测试变体(SEQ ID NO:96)的位置的示意图。图50E)在293T细胞中利用BhCas12b和不同间隔子长度的插入/缺失活性。误差条表示来自n=2个重复物的标准偏差。
图51A-51J。BhCas12b的合理工程化。图51A)BhCas12b与高度相似的BthCas12b在293T细胞中的插入/缺失活性的比较。误差条表示来自n=2个重复物的标准偏差。图51B-图51E)BhCas12b突变体组合在DNMT1靶标4和VEGFA靶标2上的插入/缺失活性。误差条表示来自最少n=2个重复物的标准偏差。图51F)使用Pymol(Schrodinger)建模到BthCas12b结构中的BhCas12bv4突变。图51G)纯化的BhCas12b WT和v4蛋白的考马斯染色SDS-PAGE凝胶。图51H)BhCas12b WT和v4变体的体外切割时程。凝胶是来自n=3个实验的代表性图像。图51I、图51J)从图h中显示的反应中定量dsDNA切割产物(图51I)和上部切刻产物(图51J)。误差条表示来自n=3个实验的标准偏差。
图52A-52J。BvCas12b的表征。图52A)如图48C和图48D中所述的PAM发现。图52B)BvCas12b的小RNA-Seq读段的比对。切割反应中使用的tracrRNA的位置以黄色突出显示。图52C-52D)利用纯化的蛋白质和合成的RNA进行BvCas12的体外重建。反应在指定的温度下反应90分钟,和250nM BvCas12b蛋白。图52E)纯化的BvCas12b的考马斯染色SDS-PAGE凝胶。图52F)BvCas12b sgRNA变体(SEQ ID NO:97-102)。图52G)BvCas12b sgRNA结构和测试变体(SEQ ID NO:103)的位置的示意图。图52H)在293T细胞中利用sgRNA变体的BvCas12b插入/缺失活性。误差条表示来自n=4个重复物的标准偏差。图52I)在293T细胞中在57个靶标的BvCas12b插入/缺失活性。每个点代表单个靶位点,从n=4个重复物取平均值。图52J)在匹配的靶位点处BhCas12b v4和BvCas12b活性的相关性。源数据以源数据文件形式提供。
图53A-53E。BvCas12b的诱变。图53A)在突出显示的位置识别的靶链中BhCas12b位置的比对及其在BvCas12b中的相应氨基酸。图53B)与如图45A中所述的差异标记的DNA链的体外BvCas12b反应。图53C)靶向残基Q635、D748、R849、H896、T909、I914和I919的79个BvCas12b突变的插入/缺失活性。在相对于野生型(灰色符号)归一化的DNMT1靶标6和VEGFA靶标5处测量插入/缺失。误差条表示来自n=2个重复物的标准偏差。图53D-53E)BhCas12b突变在DNMT1靶标6和VEGFA靶标5的插入/缺失活性。误差条表示来自n=2个重复物的标准偏差。
图54A-54F。BhCas12b v4和BvCas12b介导的人类细胞系中的基因组编辑。图54A)在293T细胞中BhCas12b v4在56个靶标和BvCas12b在57个靶标的插入/缺失活性。每个点代表单个靶位点,从n=4个重复物取平均值。图54B)在匹配的靶位点处BhCas12b v4和BvCas12b活性的相关性。图54C)2类CRISPR-Cas核酸酶的PAM流行率分析。从非掩蔽人类编码序列中的每个碱基到最近的Cas9或Cas12切割位点的距离的概率质量函数。图54D)可由SpCas9和Cas12b核酸酶靶向的VEGFA靶位点和含有TC至CA突变和PAM破坏突变的120ntssODN供体的示意图(SEQ ID NO:104-108)。图54E)每个核酸酶在基因座处的插入/缺失活性。误差条表示来自n=3个重复物的标准偏差。图54F)使用靶链(T)或非靶链(NT)供体的同源性定向修复(HDR)的频率。灰色条表示TC至CA突变的频率,而蓝色条表示包含图d中的HDR序列并且无突变的完美编辑。误差条表示来自n=3个重复物的标准偏差。
图55A-55C。BhCas12b v4和BvCas12b错配耐受性和特异性。图56A)对未匹配的靶标进行的Guide-Seq分析显示对于每个核酸酶检测到的切割位点的数量和相对比例。脱靶以浅灰色楔形显示,而在靶位点以蓝色突出显示,并且在靶读段分率显示于下。关于完整分析,参见图57。图55B-55C)当指导sgRNA与靶DNA之间存在错配时293T细胞中的Cas12b插入/缺失活性。错配插入到sgRNA中以匹配靶链(即C至G、A至T)。BhCas12b v4在DNMT1靶标6和VEGFA靶标2上测试,而BvCas12b在DNMT1靶标6和VEGFA靶标5上测试。误差条表示来自n=4个重复物的标准偏差。
图56。匹配的CRISPR-Cas核酸酶靶标的特异性分析。对图47B中检测到的脱靶的完整Guide-Seq分析。呈现了对于每个核酸酶检测到的切割位点(每个靶标至多20个)的列表,其中在靶位点用小框表示。与指导序列的错配突出显示。靶标1:EMX1(SEQ ID NO:109-130);靶标2:EMX1(SEQ ID NO:131-152);靶标3:DNMT1(SEQ ID NO:153-174);靶标4:CXCR4(SEQ ID NO:175-176);靶标5:CXCR4(SEQ ID NO:178-181);靶标6:CXCR4(SEQ ID NO:182-186);靶标7:VEGFA(SEQ ID NO:187-209);靶标8:GRIN2B(SEQ ID NO:210-215);靶标9:CXCR4(SEQ ID NO:216-221);靶标10:HPRT1(SEQ ID NO:222-225)。
图57。未匹配的CRISPR-Cas核酸酶靶标的特异性分析。对图56中检测到的脱靶的完整Guide-Seq分析。呈现了对于每个核酸酶检测到的切割位点(每个靶标至多20个)的列表,其中在靶位点用小框表示。与指导序列的错配突出显示。SpCas9未匹配1:DNMT1(SEQ IDNO:226);SpCas9未匹配2:EMX1(SEQ ID NO:227-246);SpCas9未匹配3:VEGFA(SEQ ID NO:247-248);SpCas9未匹配4:VEGFA(SEQ ID NO:249-268);SpCas9未匹配5:VEGFA(SEQ IDNO:269-288);SpCas9未匹配6:GRIN2B(SEQ ID NO:289-290);AsCas12a未匹配1:DNMT1(SEQID NO:291);AsCas12a未匹配2:VEGFA(SEQ ID NO:292-293);AsCas12a未匹配2:EMX1(SEQID NO:294);AsCas12a未匹配2:EMX1(SEQ ID NO:295);SpCas9未匹配7:VEGFA(SEQ ID NO:296-311);SpCas9未匹配8:EMX1(SEQ ID NO:312-320);SpCas9未匹配9:GRIN2B(SEQ IDNO:321-322);SpCas9未匹配10:TUBB(SEQ ID NO:323-334);BhCas12b v4未匹配1:DNMT1-BvCas12b未匹配8:DNMT1(SEQ ID NO:335-353);BhCas12b v4未匹配9:CXCR4-BvCas12b未匹配14:VEGFA(SEQ ID NO:354-367)。
图58。示出了Cas12中在结构上预测的ssDNA路径(基于PDB结构5U30)。
图59示出了在T基序上测试RESCUE突变体的剂量反应。
图60示出了在C和G基序上测试RESCUE突变体的剂量反应。
图61和图62示出了RESCUE v3、v6、v7和v8的内源性靶向。
图63示出了对RESCUE v9突变进行筛选。
图64示出了鉴定出RESCUEv9的潜在突变。
图65示出了进行碱基翻转和基序测试。
图66示出了在不同基序翻转下测试RESCUEv9的作用。
图67示出了B6和B12在RESPUE v1和v8下在50bp指导物下的比较。
图68示出了B6和B12在RESPUE v1和v8下在30bp指导物下的比较。
图69示出了筛选的RESCUE突变的总结。
图70是说明选择更好的β连环蛋白突变体的实验结果的图。
图71示出了说明RESCUE第12轮结果的图。
图72是说明β连环蛋白迁移测定的示意图。
图73是示出由β连环蛋白诱导的细胞迁移测定的结果的图。
图74示出了说明特异性突变消除A-I脱靶的图。
图75示出了说明靶向Stat1/3磷酸化位点减少信号传导的图。
图76示出了说明靶向Stat1/3磷酸化位点降低信号转导的图,其中图64A示出STAT1未处理的结果并且图64B示出STAT1 IFNγ处理的结果。
图77示出了说明靶向Stat1/3磷酸化位点降低信号传导的图,其中图65A示出STAT3 IL6激活的结果并且图65B示出STAT3未处理的结果。
图78示出了说明RESCUE第12轮结果的图。
图79示出了说明RESCUE第13轮结果的图。
图80是示出由β连环蛋白诱导的细胞迁移测定的结果的图。
图81–具有C至T碱基编辑能力的Bhv4截短。去除无催化活性的Bhv4的C末端142个氨基酸(dBhv4Δ143–使D574A突变失活,新的大小为966个氨基酸)并将接头和大鼠Apobec结构域融合至C末端的端部后,观察到C至T碱基编辑,在非靶链上的指导碱基对位置14处的频率高达10.95%。在指导物位置15处检测到6.97%的编辑效率。该活性具有指导物依赖性。通过与现有构建体融合或自由表达而添加尿嘧啶-DNA糖基化酶抑制剂(UGI)结构域,有望增加这种C至T的转化。所列的指导序列(大写字母)靶向HEK 293T细胞中GRIN2B内部的区域(SEQ ID NO:368)。
图82A-82C–图82A)在293T细胞中选择用于Guide-Seq分析的9个靶位点(Cas12a除外,Cas12a仅在三个TTTV PAM位点进行测试)的Cas9、Cas12b和Cas12a插入/缺失活性的比较。误差条表示来自n=4个重复物的标准偏差。图82B)Guide-Seq分析显示对于每个核酸酶检测到的切割位点的数量和相对比例。脱靶以浅灰色楔形显示,而在靶位点以紫色(对于SpCas9)、深蓝色(对于BhCas12b v4)或浅蓝色(对于AsCas12a)突出显示,其中在靶读段分率显示于下。仅使用SpCas9检测到脱靶。n.t.,未测试。图82C)当指导sgRNA与靶DNA之间存在错配时293T细胞中的BhCas12b插入/缺失活性。将错配插入到sgRNA中以匹配靶链(即C至G、A至T)。误差条表示来自n=4个重复物的标准偏差。
图83–提供了Cas12截短以及带有APOBEC的N末端和C末端融合物以及它们的碱基编辑活性的示意图。
图84–提供了根据某些示例实施方案(SEQ ID NO:369-375)的Cas12碱基编辑数据。
图85–提供了根据某些示例实施方案的Cas12碱基编辑数据。
图86–提供了根据某些示例实施方案(SEQ ID NO:376-377)的在指导物上的Cas12碱基编辑。
图87示出了使用全长BhCas12b(SEQ ID NO:378)的示例性碱基编辑方法。
图88A-88C-图88A示出了BhCas12b v4和另一个直系同源物AaCas12b的插入/缺失活性的比较。图88B和图88C说明了用表达AAV1/2的BhCas12bv4或BhCas12b转导大鼠神经元。
图89A-89B-图89A示出了px602-bh-优化-AAV的图谱。图89B显示了px602-bv-优化-AAV的图谱。
本文中的附图仅用于说明目的而不一定按比例绘制。
具体实施方式
一般定义
除非另有定义,否则本文所使用的技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同含义。分子生物学中常用术语和技术的定义可见于:MolecularCloning:A Laboratory Manual,第2版(1989)(Sambrook,Fritsch和Maniatis);MolecularCloning:A Laboratory Manual,第4版(2012)(Green和Sambrook);Current Protocols inMolecular Biology(1987)(F.M.Ausubel等人编辑);Methods in Enzymology系列(Academic Press,Inc.):PCR 2:A Practical Approach(1995)(M.J.MacPherson,B.D.Hames和G.R.Taylor编辑):Antibodies,A Laboratory Manual(1988)(Harlow和Lane,编辑):Antibodies ALaboratory Manual,第2版,2013(E.A.Greenfield编辑);AnimalCell Culture(1987)(R.I.Freshney编辑);Benjamin Lewin,Genes IX,由Jones和Bartlet出版,2008(ISBN 0763752223);Kendrew等人(编辑),The Encyclopedia of MolecularBiology,由Blackwell Science Ltd.出版,1994(ISBN 0632021829);Robert A.Meyers(编辑),Molecular Biology and Biotechnology:aComprehensive Desk Reference,由VCHPublishers,Inc.出版,1995(ISBN9780471185710);Singleton等人,Dictionary ofMicrobiology and Molecular Biology,第2版,J.Wiley&Sons(New York,N.Y.1994),March,Advanced Organic Chemistry Reactions,Mechanisms and Structure,第4版,John Wiley&Sons(New York,N.Y.1992);以及Marten H.Hofker和Jan van Deursen,Transgenic Mouse Methods and Protocols,第2版(2011)。
如本文所用,单数形式“一个”、“一种”和“所述”包括单数和复数个指代物,除非上下文另外明确指出。
术语“任选的”或“任选地”是指随后描述的事件、情况或取代基可能发生或可能不发生,并且该描述包括事件或情况发生的例子以及事件或情况没有发生的例子。
由端点对数值范围的叙述包括各个范围内包含的所有数字和分数,以及所列举的端点。
当指代例如参数、量、持续时间等的可测量值时,如本文所用的术语“约”或“大约”旨在涵盖指定值的变化和与指定值相比的变化,例如+/-10%或更少、+/-5%或更少、+/-1%或更少以及+/-0.1%或更少的指定值的变化或与指定值相比的变化,只要这样的变化适于在所公开的发明中进行即可。应当理解,修饰语“约”或“大约”所指的值本身也是特定地且优选地公开的。
术语“示例性”在本文中用来表示用作实例、例子或说明。本文中被描述为“示例性”的任何方面或设计不必被解释为相对于其他方面、实施方案或设计是优选的或有利的。
如本文所用,“生物样品”可含有全细胞和/或活细胞和/或细胞碎片。生物样品可包含(或源自)“体液”。本发明涵盖以下实施方案,其中体液选自羊水、房水、玻璃体液、胆汁、血清、乳汁、脑脊髓液、耵聍(耳垢)、乳糜、食糜、内淋巴液、周淋巴液、渗出液、粪便、女性射液、胃酸、胃液、淋巴液、粘液(包括鼻腔引流和粘痰)、心包液、腹膜液、胸膜液、脓液、稀粘液、唾液、皮脂(皮油)、精液、痰液、滑液、汗液、眼泪、尿液、阴道分泌物、呕吐物及其一种或多种的混合物。生物样品包括细胞培养物、体液、来自体液的细胞培养物。体液可例如通过穿刺或其他收集或采样程序从哺乳动物获得。
术语“受试者”、“个体”和“患者”在本文中可互换使用,是指脊椎动物,优选为哺乳动物,更优选为人类。哺乳动物包括但不限于鼠类、猿猴、人类、农场动物、运动动物和宠物。还涵盖体内获得或体外培养的生物实体的组织、细胞及其后代。
在下文中描述各种实施方案。应当注意,特定实施方案不旨在作为详尽的描述或作为对本文所讨论的更广泛方面的限制。结合特定实施方案描述的一个方面不必限于所述实施方案,并且可与任何其他实施方案一起实践。在整个说明书中,对“一个实施方案”、“实施方案”、“示例实施方案”的引用是指结合实施方案描述的特定特征、结构或特性包括在本发明的至少一个实施方案中。因此,在整个说明书中各处出现的短语“在一个实施方案中”、“在一实施方案中”或“一个示例实施方案”不一定全部指代同一实施方案,但有可能。此外,在一个或多个实施方案中,特定特征、结构或特性可以任何合适的方式组合,这对于本领域技术人员而言根据本公开将是显而易见的。此外,尽管本文描述的一些实施方案包括其他实施方案中包括的一些但不包括其他特征,但是不同实施方案的特征的组合意图在本发明的范围内。例如,在所附权利要求中,任何要求保护的实施方案都可以任何组合使用。
本文引用的所有出版物、公开的专利文件和专利申请均通过引用并入本文,其引用程度就如同每个单独的出版物、公开的专利文件或专利申请被明确地和单独地指出通过引用并入一样。
概述
在一个方面,本文公开的实施方案涉及工程化的或分离的CRISPR-Cas效应蛋白和直系同源物。特别是,本发明涉及Cas12b效应蛋白和直系同源物。如本文所用,术语Cas12b与C2c1可互换使用。本发明还涉及包含此类直系同源物的CRISPR-Cas系统,以及编码此类直系同源物或系统的多核苷酸序列,以及包含此类直系同源物的载体或载体系统和包含此类直系同源物的递送系统。本发明还涉及包含此类Cas12b蛋白、CRISPR-Cas系统、多核酸序列、载体、载体系统、递送系统的细胞或细胞系或生物体。本发明还涉及此类蛋白质、CRISPR-Cas系统、多核酸序列、载体、载体系统、递送系统、细胞、细胞系等的医学和非医学用途。在另一方面,本文公开的实施方案涉及工程化的CRISPR-Cas效应蛋白,其与未修饰的CRISPR-Cas效应蛋白相比,包含至少一个修饰,从而相比于野生型增强了CRISPR复合物与结合位点的结合和/或改变了编辑偏好。在某些实施方案中,CRISPR-Cas效应蛋白是V型效应蛋白,优选V-B型。在某些其他示例实施方案中,V-B型效应蛋白是C2c1。适用于本文公开的实施方案的示例C2c1蛋白在下面进一步详细讨论。在另一方面,所公开的实施方案涉及包含工程化指导物的工程化CRISPR-Cas系统。如本文所用,术语CRISPR效应子或CRISPR蛋白或Cas(蛋白质或效应子)与Cas12b蛋白或效应子可互换使用,并且可以是突变的(例如包含点突变和/或截短)或野生型蛋白。
在一些实施例中,本公开提供了一种非天然存在的或工程化的系统,所述系统包含:i)来自表1或表2的Cas12b效应蛋白;ii)crRNA,所述crRNA包含a)能够与一个或多个靶序列、在某些实施方案中一个或多个靶DNA序列杂交的3'指导序列,和b)5'正向重复序列;以及iii)tracr RNA,从而形成包含与crRNA和tracr RNA复合的Cas12b效应蛋白的CRISPR复合物。
在一些实施例中,本公开提供了一种非天然存在的或工程化的系统,所述系统包含:i)来自表1或表2的Cas12b效应蛋白,和ii)包含能够与靶序列杂交的指导序列的指导物。在一些情况下,所述系统还包含tracrRNA。
在另一方面,本文公开的实施方案涉及用于递送包括C2c1的CRISPR-Cas效应蛋白的载体。在某些示例实施方案中,将载体设计为允许将CRISPR-Cas效应蛋白包装在单个载体中。对用于包装并因此表达更大的转基因以用于靶向递送和组织特异性的紧凑型启动子的设计也引起了越来越多的关注。因此,在另一方面,本文公开的某些实施方案涉及递送载体、构建体和递送较大基因用于全身递送的方法。
在另一方面,本发明涉及用于开发或设计CRISPR-Cas系统的方法。在一个方面,本发明涉及用于开发或设计优化的CRISPR-Cas系统的方法,所述CRISPR-Cas系统具有范围广泛的应用,包括但不限于治疗剂开发、生物生产,以及植物和农业应用。在某些基于疗法或治疗剂中。本发明特别涉及用于改善CRISPR-Cas系统的方法,例如基于CRISPR-Cas系统的疗法或治疗剂。成功的CRISPR-Cas系统(例如基于CRISPR-Cas系统的疗法或治疗剂)的关键特性涉及高特异性、高功效和高安全性。通过降低脱靶效应,尤其可实现高特异性和高安全性。改善的特异性和功效同样可用于改善在植物和生物生产中的应用。
因此,在一个方面,本发明涉及用于增加CRISPR-Cas系统(例如基于CRISPR-Cas系统的疗法或治疗剂)的特异性的方法。在另一方面,本发明涉及用于提高CRISPR-Cas系统(例如基于CRISPR-Cas系统的疗法或治疗剂)的功效的方法。在另一方面,本发明涉及用于提高CRISPR-Cas系统(例如基于CRISPR-Cas系统的疗法或治疗剂)的安全性的方法。在另一方面,本发明涉及用于提高CRISPR-Cas系统(例如基于CRISPR-Cas系统的疗法或治疗剂)的特异性、功效和/或安全性(优选全部)的方法。
在某些实施方案中,CRISPR-Cas系统包含如本文其他地方所定义的CRISPR效应子。
本发明的方法尤其涉及与CRISPR-Cas系统和/或其功能性相关的所选参数或变量的优化,如本文其他地方所述。如本文所述的方法中CRISPR-Cas系统的优化可能取决于一个或多个靶标,例如一个或多个治疗靶标;CRISPR-Cas系统调节的模式或类型,例如基于CRISPR-Cas系统的治疗靶标调节、修饰或操纵;以及CRISPR-Cas系统组分的递送。取决于基因型和/或表型结果,可选择一个或多个靶标。例如,取决于(遗传)疾病病因或期望的治疗结果,可选择一个或多个治疗靶标。(治疗)靶标可以是单个基因、基因座或其他基因组位点,或者可以是多个基因、基因座或其他基因组位点。如本领域中已知的,单个基因、基因座或其他基因组位点可超过一次被靶向,例如通过使用多个gRNA。
CRISPR-Cas系统活性如CRISPR-Cas系统设计可能涉及靶标破坏,例如靶标突变,例如导致基因敲除。CRISPR-Cas系统活性如CRISPR-Cas系统设计可能涉及特定靶位点的替换,例如导致靶标校正。CISPR-Cas系统设计可能涉及去除特定靶位点,例如导致靶标缺失。CRISPR-Cas系统活性可能涉及靶位点功能性的调节,例如靶位点活性或可及性,导致例如(转录和/或表观遗传)基因或基因组区域激活或者基因或基因组区域沉默。技术人员将理解,靶位点功能性的调节可能涉及CRISPR效应子突变(例如产生无催化活性的CRISPR效应子)和/或官能化(例如CRISPR效应子与异源功能结构域融合,例如转录激活子或阻遏子),如本文其他地方所述。因此,在另一方面,本发明涉及用于定点碱基编辑的工程化组合物,其包含修饰的CRISPR效应蛋白和一个或多个功能结构域。在本发明的一个实施方案中,存在RNA碱基编辑。在本发明的一个实施方案中,存在DNA碱基编辑。在某些实施方案中,所述功能结构域包含脱氨酶或其催化结构域,包括胞苷和腺苷脱氨酶。适用于本文公开的实施方案的示例功能结构域在下面进一步详细讨论。
在某些示例实施方案中,工程化的CRISPR-Cas效应蛋白与包含指导序列的核酸复合以形成CRISPR复合物,并且其中在所述CRISPR复合物中,核酸分子靶向一个或多个多核苷酸基因座,并且所述蛋白质与未修饰的蛋白质相比包含至少一个修饰,从而与野生型相比增强了CRISPR复合物与结合位点的结合和/或改变了编辑偏好。编辑偏好可与插入/缺失形成有关。在某些示例实施方案中,至少一个修饰可增加在靶基因座处一个或多个特定插入/缺失的形成。CRISPR-Cas效应蛋白可以是V型CRISPR-Cas效应蛋白。在某些示例实施方案中,CRISPR-Cas蛋白是C2c1,也称为Cas12b,或其直系同源物。
本发明提供了基因组编辑或修饰与目标靶基因座相关或在目标靶基因座处的序列的方法,其中所述方法包括将C2c1效应蛋白复合物引入任何所需的细胞类型(原核或真核细胞)中,由此C2c1效应蛋白复合物有效地起作用以将DNA插入物整合到真核或原核细胞的基因组中。在优选的实施方案中,细胞是真核细胞并且基因组是哺乳动物基因组。在优选的实施方案中,通过基于非同源末端连接(NHEJ)的基因插入机制促进DNA插入物的整合。在优选的实施方案中,DNA插入物是外源引入的DNA模板或修复模板。在一个优选的实施方案中,外源引入的DNA模板或修复模板与C2c1效应蛋白复合物或一种组分或用于表达复合物组分的多核苷酸载体一起递送。在一个更优选的实施方案中,真核细胞是非分裂细胞(例如其中经由HDR进行基因组编辑特别具有挑战性的非分裂细胞)。
本发明还提供了一种对目标靶基因座进行修饰的方法,所述方法包括将包含C2c1基因座效应蛋白和一个或多个核酸组分的非天然存在的或工程化的组合物递送至所述基因座,其中所述C2c1效应蛋白与一个或多个核酸组分形成复合物,并且在所述复合物与目标基因座结合后,效应蛋白诱导目标靶基因座的修饰。在一个实施方案中,修饰是引入链断裂。链断裂之后可进行非同源末端连接。在另一个实施方案中,提供了修复模板,并且在断裂之后进行同源重组。
根据本发明,提供了修饰核酸的酶。在一个这样的实施方案中,存在DNA的碱基编辑。在另一个这样的实施方案中,存在RNA的碱基编辑。更具体地,本发明提供了能够修饰细胞中核碱基的脱氨酶和脱氨酶变体。在一个实施方案中,脱氨酶靶向DNA/RNA双链体中的错配并编辑靶标的错配DNA碱基。在另一个实施方案中,脱氨酶靶向RNA/RNA双链体中的错配并编辑靶RNA。
在此类方法中,目标靶基因座可包含在细胞内的核酸分子中。细胞可以是原核细胞或真核细胞。细胞可以是哺乳动物细胞。哺乳动物细胞可以是非人类的灵长类动物、牛、猪、啮齿动物或小鼠细胞。细胞可以是非哺乳动物的真核细胞,例如家禽、鱼或虾。细胞也可以是植物细胞。植物细胞可以是农作物,例如木薯、玉米、高粱、小麦或水稻。植物细胞也可以是藻类、树木或蔬菜。通过本发明引入细胞的修饰可使得改变细胞和细胞的后代以改善生物产物如抗体、淀粉、醇或其他所需细胞输出的产生。通过本发明引入细胞的修饰可使得细胞和细胞的后代包括改变所产生的生物产物的变化。
在任何描述的方法中,目标靶基因座可以是目标基因组或表观基因座。在任何所描述的方法中,复合物可与多个指导物一起递送以供多重用途。在任何所描述的方法中,可使用一种以上的蛋白质。
CRISPR-CAS系统
一般来说,CRISPR系统可如前述文件例如WO 2014/093622(PCT/US2013/074667)中所用,并且总体是指涉及CRISPR相关(“Cas”)基因的表达或引导CRISPR相关(“Cas”)基因的活性的转录物和其他元件,包括编码Cas基因(特别是C2c1基因)的序列,tracr(反式激活CRISPR)序列(例如tracrRNA或活性部分tracrRNA),tracr配对序列(涵盖“正向重复序列”和在内源性CRISPR系统的情形下经tracrRNA加工的部分正向重复序列),指导序列(在内源性CRISPR系统的情形下也称为“间隔子”),或“RNA”(当该术语在本文中使用时)(例如,用于指导C2c1的RNA,例如CRISPR RNA和反式激活(tracr)RNA或单指导RNA(sgRNA)(嵌合RNA))或来自CRISPR基因座的其他序列和转录物。
一般来说,CRISPR系统的特征在于促进在靶序列位点处形成CRISPR复合物的元件(在内源性CRISPR系统的情形下也称为原间隔子)。在形成CRISPR复合物的情形下,“靶序列”是指指导序列被设计成具有互补性的序列,其中靶序列与指导序列之间的杂交促进了CRISPR复合物的形成。在包含Cas12b蛋白的实施方案中形成的CRISPR复合物可包含与crRNA和tracrRNA的复合物,如本文其他地方所述。与靶序列的互补性对于切割活性重要的指导序列的部分在本文中称为种子序列。靶序列可包含任何多核苷酸,例如DNA或RNA多核苷酸。在一些实施方案中,靶序列位于细胞的核或细胞质中,并且可包括存在于细胞内的线粒体、细胞器、囊泡、脂质体或粒子中或来自其的核酸。在一些实施方案中,特别是对于非核用途,NLS不是优选的。在一些实施方案中,CRISPR系统包含一个或多个核输出信号(NES)。在一些实施方案中,CRISPR系统包含一个或多个NLS和一个或多个NES。在一些实施方案中,可在计算机上通过搜索满足任何或所有的以下标准的重复基序来鉴定正向重复序列:1.存在于II型CRISPR基因座侧翼的基因组序列的2Kb窗口中;2.跨度为20至50bp;以及3.间隔20至50bp。在一些实施方案中,可使用这些标准中的2个,例如1和2、2和3、或1和3。在一些实施方案中,可使用所有3个标准。
一般来说,CRISPR系统的特征在于促进靶序列位点处的CRISPR复合物形成的元件。在形成CRISPR复合物的情形下,“靶序列”是指将指导序列设计成与其具有互补性的序列,其中靶DNA序列与指导序列之间的杂交促进了CRISPR复合物的形成。
术语“指导分子”、“指导RNA”和“指导物”在本文中可互换使用,是指基于核酸的分子,包括但不限于能够与CRISPR-Cas蛋白质形成复合物的基于RNA的分子,并包含与靶核酸序列具有足够互补性以与靶核酸序列杂交并引导复合物与靶核酸序列的序列特异性结合的指导序列。指导分子或指导RNA具体涵盖具有一个或多个化学修饰的基于RNA的分子(例如,通过化学连接两个核糖核苷酸或通过用一个或多个脱氧核糖核苷酸代替一个或多个核糖核苷酸),如本文所述。
在某些实施方案中,靶序列应与PAM(原间隔子相邻基序)或PFS(原间隔子侧翼序列或位点)相缔合;也就是说,由CRISPR复合物识别的短序列。取决于CRISPR-Cas蛋白的性质,所述靶序列应当进行选择,使得其在DNA双链体中的互补序列(本文中也称为非靶序列)在PAM的上游或下游。在CRISPR-Cas蛋白为C2c1蛋白的本发明的实施方案中,靶序列的互补序列在PAM的下游或3'。PAM的精确序列和长度要求因所使用的C2c1蛋白而异,但PAM通常是与原间隔子相邻的2-5个碱基对序列(即靶序列)。下文提供了用于不同C2c1直系同源物的天然PAM序列的实例,并且技术人员将能够鉴定用于给定C2c1蛋白的其他PAM序列。
所述系统可用于修饰一个或多个靶序列(例如,在细胞或细胞群体中)。所述修饰可导致至少一种基因产物的表达改变。在一些实例中,至少一种基因产物的表达可增加。在一些实例中,至少一种基因产物的表达可降低。
在一些实例中,可在细胞或细胞群体中进行修饰,并且修饰可导致细胞或群体产生和/或分泌内源性或非内源性生物产物或化学化合物。所述化学化合物或生物产物可包括低分子量化合物,但也可以是较大的化合物,或在给定情况下有效的任何有机或无机分子,包括修饰的和未修饰的核酸,例如反义核酸、RNAi如siRNA或shRNA、CRISPR-Cas系统、肽、拟肽、受体、配体、和抗体、适体、多肽、核酸类似物或其变体。实例包括核酸、氨基酸或碳水化合物的低聚物,包括但不限于蛋白质、寡核苷酸、核酶、DNA酶、糖蛋白、siRNA、脂蛋白、适体,及其修饰和组合。剂可选自包括以下的组:化学品;小分子;核酸序列;核酸类似物;蛋白质;肽;适体;抗体;或其片段。核酸序列可以是RNA或DNA,并且可以是单链或双链的,并且可选自包括以下的组:编码目标蛋白质的核酸、寡核苷酸、核酸类似物,例如肽-核酸(PNA)、伪互补PNA(pc-PNA)、锁核酸(LNA)、修饰的RNA(mod-RNA)、单指导RNA等。这样的核酸序列包括例如但不限于编码蛋白质的核酸序列,例如其充当转录阻遏子、反义分子、核酶、小的抑制性核酸序列,例如但不限于RNAi、shRNAi、siRNA、微小RNAi(mRNAi)、反义寡核苷酸、CRISPR指导RNA,例如将CRISPR酶靶向特定的DNA靶序列等。蛋白质和/或肽或其片段可以是任何目标蛋白质,例如但不限于:突变蛋白;治疗蛋白和截短蛋白,其中所述蛋白质通常在细胞中不存在或以较低水平表达。蛋白质也可选自包括以下的组:突变蛋白、基因工程化蛋白、肽、合成肽、重组蛋白、嵌合蛋白、抗体、小抗体、人源化蛋白、人源化抗体、嵌合抗体、修饰蛋白及其片段。或者,由于将核酸序列引入细胞中以及其转录导致细胞内基因的核酸和/或蛋白质调节剂的产生,所述剂在细胞内可为细胞内的。在一些实施方案中,所述剂是任何化学品、实体或部分,包括但不限于合成的和天然存在的非蛋白质实体。在某些实施方案中,所述剂是具有化学部分的小分子。所述剂可已知具有期望的活性和/或性质,或者可选自多种化合物的文库。
PAM的测定
申请人将同时含有PAM和抗性基因的质粒引入异源大肠杆菌中,然后接种在相应的抗生素上。如果存在质粒的DNA切割,则申请人观察到没有活菌落。更详细地,对于DNA靶的测定如下。在该测定中使用两个大肠杆菌菌株。一个携带编码来自细菌菌株的内源性效应蛋白基因座的质粒。另一个菌株携带空质粒(例如pACYC184,对照菌株)。所有可能的7或8bp PAM序列均呈递在抗生素抗性质粒(具有氨苄青霉素抗性基因的pUC19)上。PAM位于原间隔子1的序列旁边(DNA靶向内源性效应蛋白基因座中的第一间隔子)。克隆了两个PAM文库。一个具有原间隔子的5'的8个随机bp(例如总共65536个不同的PAM序列=复杂度)。另一个文库具有原间隔子的3'的7个随机bp(例如总复杂度为16384个不同的PAM)。克隆两个文库,每个可能的PAM平均具有500个质粒。在单独的转化中用5'PAM和3'PAM文库转化测试菌株和对照菌株,并将转化的细胞分别接种在氨苄青霉素板上。对所述质粒的识别以及后续的切割/干扰使细胞容易受到氨苄青霉素的影响并阻止生长。转化后约12小时,收集由测试菌株和对照菌株形成的所有菌落并分离质粒DNA。质粒DNA用作PCR扩增和后续深度测序的模板。未转化文库中所有PAM的表示均显示了转化细胞中PAM的预期表示。对照菌株中发现的所有PAM的表示均显示了实际表示。测试菌株中所有PAM的表示显示了酶无法识别哪些PAM,并且与对照菌株进行比较允许提取出耗尽的PAM的序列。
对于迄今鉴定的C2c1直系同源物,已鉴定出以下PAM:酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)ATCC 49025C2c1p(AacC2c1)可切割5'TTN PAM之前的靶位点,其中N是A、C、G或T,更优选地其中N是A、G或T;热噬淀粉芽孢杆菌(Bacillusthermoamylovorans)菌株B4166 C2c1p(BthC2c1)可切割ATTN之前的位点,其中N是A/C/G或T。
密码子优化的核酸序列
在效应蛋白要作为核酸施用的情况下,本申请设想使用密码子优化的CRISPR-CasV型蛋白,更特别是编码C2c1的核酸序列(和任选地蛋白序列)。密码子优化序列的一个实例,在这种情况下是为在真核生物例如人类中表达而优化的序列(即,为在人类中表达而优化),或为如本文讨论的另一种真核生物、动物或哺乳动物而优化的序列;参见例如WO2014/093622(PCT/US2013/074667)中的SaCas9人类密码子优化序列作为密码子优化序列的一个实例(根据本领域的知识和本公开内容,密码子优化编码核酸分子,特别是关于效应蛋白(例如,C2c1)在技术人员的能力范围内)。尽管这是优选的,但应理解,其他实例也是可能的,并且用于除人类以外的宿主物种的密码子优化或用于特定器官的密码子优化是已知的。在一些实施方案中,对编码靶向DNA/RN A的Cas蛋白的酶编码序列进行密码子优化以在特定细胞如真核细胞中表达。真核细胞可以是特定生物体如植物或哺乳动物的真核细胞,或源自特定生物体如植物或哺乳动物的真核细胞,包括但不限于如本文所讨论的人类或非人类真核生物或动物或哺乳动物,例如小鼠、大鼠、兔、狗、牲畜或非人类的哺乳动物或灵长类动物。在一些实施方案中,用于修饰人类的种系遗传特性的方法和/或用于修饰可能导致人类遭受痛苦而对人类或动物没有任何实质性医学益处的动物的遗传特性的方法,以及由此类方法产生的动物,可能会被排除在外。一般来说,密码子优化是指通过用宿主细胞的基因中更频繁或最频繁使用的密码子代替天然序列的至少一个密码子(例如,约或大于约1、2、3、4、5、10、15、20、25、50个或更多个密码子)并同时保持天然氨基酸序列而在目标宿主细胞中修饰核酸序列以增强表达的方法。各种物种对特定氨基酸的某些密码子表现出特定的偏性。密码子偏性(生物体之间密码子使用的差异)通常与信使RNA(mRNA)的翻译效率相关,而信使RNA(mRNA)的翻译效率又被认为尤其取决于所翻译的密码子的特性和特定转移RNA(tRNA)分子的可用性。所选tRNA在细胞中的优势通常反映了肽合成中最常使用的密码子。因此,可基于密码子优化来定制基因以在给定生物中最佳基因表达。密码子使用表很容易获得,例如,可在www.kazusa.orjp/codon/的“密码子使用数据库”中获得,并且这些表格可通过多种方式进行修改。参见Nakamura,Y.等人,“Codon usage tabulated from theinternational DNA Sequence databas es:status for the year 2000”Nucl.AcidsRes.28:292(2000)。也可获得用于密码子优化特定序列以在特定宿主细胞中表达的计算机算法,例如Gene For ge(Aptagen;Jacobus,PA)。在一些实施方案中,编码靶向DNA/RNA的Cas蛋白的序列中的一个或多个密码子(例如1、2、3、4、5、10、15、20、25、50个或更多个或所有密码子)对应于特定氨基酸最常用的密码子。关于酵母中的密码子使用,参考可在www.yeastgenome.org/community/codon_usage.shtml获得的在线酵母基因组数据库,或Codon selection in yeast,Bennetzen和Ha ll,J Biol Chem.1982年3月25日;257(6):3026-31。关于在包括藻类的植物中的密码子使用,参考Codon usage in higher plants,green algae,and cyan obacteria,Campbell和Gowri,Plant Physiol.1990年1月;92(1):1-11.;以及Codon usage in plant genes,Murray等人,Nucleic Acids Res.1989年1月25日;17(2):477-98;或Selection on the codon bias of chloroplast and cyanell egenes in different plant and algal lineages,Morton BR,J Mol Evol.1998年4月;46(4):449-59。
指导分子
如本文所用,术语V型或VI型CRISPR-Cas基因座效应蛋白的“crRNA”或“指导RNA”或“单指导RNA”或“sgRNA”或“一个或多个核酸组分”包含与靶核酸序列具有充分互补性以与靶核酸序列杂交并引导核酸靶向复合物与靶核酸序列的直接序列特异性结合的任何多核苷酸序列,当使用合适的比对算法进行最佳比对时,互补程度为约或大于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高。可使用任何合适的用于比对序列的算法来确定最佳比对,其非限制性实例包括Smith-Waterman算法、Needleman-Wunsch算法、基于Burrows-Wheeler变换的算法(例如,Burrows Wheeler Aligner)、ClustalW、Clustal X、BLAT、Novoalign(Novocraft Technologies;可在www.novocraft.com获得)、ELAND(Illumina,San Diego,CA)、SOAP(可在soap.genomics.org.cn获得)和Maq(可在maq.sourceforge.net获得)。指导序列(在核酸靶向指导RNA内)引导核酸靶向复合物与靶核酸序列的序列特异性结合的能力可通过任何合适的测定来评估。例如,可例如通过用编码核酸靶向复合物的组分的载体转染,接着评估靶核酸序列内的优先靶向(例如切割),例如通过如本文所述的Surveyor测定,将足以形成核酸靶向复合物的核酸靶向CRISPR系统的组分,包括待测试的指导序列,提供给具有相应靶核酸序列的宿主细胞。类似地,可通过提供靶核酸序列,核酸靶向复合物的组分,包括待测试的指导序列和不同于所述测试指导序列的对照指导序列,并比较测试指导序列和对照指导序列反应之间在靶序列上的结合或切割速率,而在试管中评价靶核酸序列的切割。其他测定是可能的,并且对本领域技术人员而言是显而易见的。可选择指导序列,并因此选择核酸靶向指导物以靶向任何靶核酸序列。靶序列可以是DNA。靶序列可以是任何RNA序列。在一些实施方案中,靶序列可以是选自由以下组成的组的RNA分子内的序列:信使RNA(mRNA)、前mRNA、核糖体RNA(rRNA)、转移RNA(tRNA)、微小RNA(miRNA)、小干扰RNA(siRNA)、小核RNA(snRNA)、小核仁RNA(snoRNA)、双链RNA(dsRNA)、非编码RNA(ncRNA)、长非编码RNA(lncRNA)和小细胞质RNA(scRNA)。在一些优选的实施方案中,靶序列可以是选自由RNA、前mRNA和rRNA组成的组的RNA分子内的序列。在一些优选的实施方案中,靶序列可以是选自由ncRNA和lncRNA组成的组的RNA分子内的序列。在一些更优选的实施方案中,靶序列可以是mRNA分子或前mRNA分子内的序列。在脱氨酶缀合物的情形下,靶核酸序列或靶序列是包含待脱氨基的靶腺苷的序列,在本文中也称为“靶腺苷”。在一些实施方案中,上文描述的互补性排除了预期的错配,例如本文描述的dA-C错配。指导序列可与原核细胞中的靶DNA序列杂交。指导序列可与真核细胞中的靶DNA序列杂交。
在一些实施方案中,选择核酸靶向指导物以降低核酸靶向指导物内的二级结构的程度。在一些实施方案中,当最佳折叠时,核酸靶向指导物的核苷酸的约或少于约75%、50%、40%、30%、25%、20%、15%、10%、5%、1%或更少参与自互补碱基配对。最佳折叠可通过任何合适的多核苷酸折叠算法来确定。一些程序是基于计算最小吉布斯自由能。一种这样的算法的实例是mFold,如Zuker和Stiegler(Nucleic Acids Res.9(1981),133-148)所述。折叠算法的另一个实例是使用质心结构预测算法在维也纳大学理论化学研究所开发的在线网络服务器RNAfold(参见例如A.R.Gruber等人,2008,Cell 106(1):23-24;以及PACarr和GM Church,2009,Nature Biotechnology 27(12):1151-62)。
在某些实施方案中,指导RNA或crRNA可包含以下、基本上由以下组成或由以下组成:正向重复(DR)序列和指导序列或间隔子序列。在某些实施方案中,指导RNA或crRNA可包含以下、基本上由以下组成或由以下组成:与指导序列或间隔子序列融合或连接的正向重复序列。在某些实施方案中,正向重复序列可位于指导序列或间隔子序列的上游(即5')。在其他实施方案中,正向重复序列可位于指导序列或间隔子序列的下游(即3')。
在一些实施方案中,指导分子包含被设计为与靶序列具有至少一个错配的指导序列,使得在指导序列与靶序列之间形成的异源双链体在指导序列中包含与靶标A相对的非配对C以用于在靶序列上脱氨基。在一些实施方案中,除了该A-C错配以外,当使用合适的比对算法最佳比对时,互补程度为约或大于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高。
在某些实施方案中,指导分子的指导序列或间隔子长度为10至50nt,更特别地为15至35nt。在某些实施方案中,指导RNA的间隔子长度为至少15个核苷酸。在某些实施方案中,间隔子长度为10至15nt,例如10、11、12、13、14、14,15至17nt,例如15、16或17nt,17至20nt,例如17、18、19或20nt,20至24nt,例如20、21、22、23或24nt,23至25nt,例如23、24或25nt,24至27nt,例如24、25、26或27nt,27-30nt,例如27、28、29或30nt,30-35nt,例如30、31、32、33、34或35nt,或35nt或更长。在某些示例实施方案中,指导序列是15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100nt。
在CRISPR-Cas系统的一些实施方案中,指导序列与其相应的靶序列之间的互补程度可为约或大于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或100%;指导物或RNA或sgRNA的长度可为约或大于约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75个或更多个核苷酸;或者指导物或RNA或sgRNA的长度可小于约75、50、45、40、35、30、25、20、15、12个或更少个核苷酸;并且有利的是tracrRNA的长度为30或50个核苷酸。然而,本发明的一个方面是减少脱靶相互作用,例如减少与具有低互补性的靶序列相互作用的指导物。实际上,在实施例中,显示出本发明涉及突变,其导致CRISPR-Cas系统能够区分具有大于80%至约95%互补性、例如83%-84%或88-89%或94-95%互补性的靶序列和脱靶序列(例如,区分具有18个核苷酸的靶序列与具有1、2或3个错配的18个核苷酸的脱靶序列)。因此,在本发明的上下文中,指导序列与其相应的靶序列之间的互补程度大于94.5%或95%或95.5%或96%或96.5%或97%或97.5%或98%或98.5%或99%或99.5%或99.9%或100%。脱靶为序列与指导物之间的互补性小于100%或99.9%或99.5%或99%或99%或98.5%或98%或97.5%或97%或96.5%或96%或95.5%或95%或94.5%或94%或93%或92%或91%或90%或89%或88%或87%或86%或85%或84%或83%或82%或81%或80%,其中有利的是,脱靶为序列与指导物之间的互补性为100%或99.9%或99.5%或99%或99%或98.5%或98%或97.5%或97%或96.5%或96%或95.5%或95%或94.5%。
在根据本发明的特别优选的实施方案中,指导RNA(能够将Cas引导至靶基因座)可包含(1)能够与真核细胞中的基因组靶基因座杂交的指导序列;(2)tracr序列;和(3)tracr配对序列。所有(1)至(3)都可驻留在单个RNA中,即sgRNA(以5'至3'方向排列),或者tracrRNA可以是与含有指导物和tracr序列的RNA不同的RNA。tracr与tracr配对序列杂交,并将CRISPR/Cas复合物引导至靶序列。如果tracr RNA与含有指导物和tracr序列的RNA位于不同的RNA上,则可优化每个RNA的长度以使其各自的天然长度缩短,并且可对每个RNA进行独立的化学修饰以防止其被细胞RNA酶降解或以其他方式增加稳定性。
“tracrRNA”序列或类似术语包括与crRNA序列具有足够互补性以杂交的任何多核苷酸序列。在一些实施方案中,当最优比对时,tracrRNA序列和crRNA序列之间沿着两者中较短者的长度的互补程度为约或大于约25%、30%、40%、50%、60%、70%,80%、90%、95%、97.5%、99%或更高。在一些实施方案中,tracr序列的长度为约或大于约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50个或更多个核苷酸。在一些实施方案中,tracr序列和crRNA序列包含在单个转录物中,使得两者之间的杂交产生具有二级结构的转录物,例如发夹。在本发明的一个实施方案中,转录物或转录的多核苷酸序列具有至少两个或更多个发夹。在优选的实施方案中,转录物具有两个、三个、四个或五个发夹。在本发明的另一个实施方案中,转录物具有至多五个发夹。在发夹结构中,最后“N”的序列5'的一部分和环的上游对应于tracr配对序列,并且环的序列3'的部分对应于tracr序列。在一些实施方案中,系统包含一个或多个crRNA。例如,系统可包含两个或更多个crRNA。
一般来说,互补程度是关于指导序列和tracr序列之间沿着两个序列中较短者的长度的最佳比对。最佳比对可通过任何合适的比对算法来确定,并且可进一步考虑二级结构,例如sca序列或tracr序列内的自互补性。在一些实施方案中,当最佳比对时,tracr序列和crRNA序列之间沿着两者中较短者的长度的互补程度为约或大于约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%或更高。
在本发明的一个方面,所述指导物包含用于C2c1的修饰的crRNA,其具有5'柄和还包含种子区和3'末端的指导区段。在一些实施方案中,修饰的指导物可与表1和表2中列出的直系同源物中的任一者的C2c1一起使用。
修饰的指导物
在某些实施方案中,本发明的指导物包含非天然存在的核酸和/或非天然存在的核苷酸和/或核苷酸类似物和/或化学修饰。非天然存在的核酸可包括例如天然和非天然存在的核苷酸的混合物。非天然存在的核苷酸和/或核苷酸类似物可在核糖、磷酸和/或碱基部分被修饰。在本发明的一个实施方案中,指导核酸包含核糖核苷酸和非核糖核苷酸。在一个这样的实施方案中,指导物包含一个或多个核糖核苷酸和一个或多个脱氧核糖核苷酸。在本发明的一个实施方案中,指导物包含一个或多个非天然存在的核苷酸或核苷酸类似物,例如具有硫代磷酸酯键、硼酸磷酸酯键的核苷酸,包含核糖环的2'和4'碳之间的亚甲基桥的锁核酸(LNA)核苷酸,肽核酸(PNA)或桥接核酸(BNA)。修饰核苷酸的其他实例包括2'-O-甲基类似物、2'-脱氧类似物、2-硫尿苷类似物、N6-甲基腺苷类似物或2'-氟类似物。修饰的核苷酸的其他实例包括在2'位置的化学部分的连接,包括但不限于肽、核定位序列(NLS)、肽核酸(PNA)、聚乙二醇(PEG)、三甘醇或四甘醇(TEG)。修饰的碱基的其他实例包括但不限于2-氨基嘌呤、5-溴-尿苷、假尿苷(Ψ)、N1-甲基假尿苷(me1Ψ)、5-甲氧基尿苷(5moU)、肌苷、7-甲基鸟苷。指导RNA化学修饰的实例包括但不限于在一个或多个末端核苷酸处并入2'-O-甲基(M)、2'-O-甲基-3'-硫代磷酸酯(MS)、硫代磷酸酯(PS)、S限制乙基(cEt)、2'-O-甲基-3'-硫代PACE(MSP)或2'-O-甲基-3'-硫代乙酸酯(MP)。与未修饰的指导物相比,这种化学修饰的指导物可包括增加的稳定性和增加的活性,但在靶对脱靶特异性是不可预测的。(参见Hendel,2015,Nat Biotechnol.33(9):985-9,doi:10.1038/nbt.3290,在线出版于2015年6月29日;Ragdarm等人,0215,PNAS,E7110-E7111;Allerson等人,J.Med.Chem.2005,48:901-904;Bramsen等人,Front.Genet.,2012,3:154;Deng等人,PNAS,2015,112:11870-11875;Sharma等人,MedChemComm.,2014,5:1454-1471;Hendel等人,Nat.Biotechnol.(2015)33(9):985-989;Li等人,Nature Biomedical Engineering,2017,1,0066DOI:10.1038/s41551-017-0066;Ryan等人,Nucleic Acids Res.(2018)46(2):792-803)。
在一些实施方案中,对指导物的修饰是化学修饰、插入、缺失或分裂。在一些实施方案中,化学修饰包括但不限于并入2'-O-甲基(M)类似物、2'-脱氧类似物、2-硫尿苷类似物、N6-甲基腺苷类似物、2'-氟类似物、2-氨基嘌呤、5-溴-尿苷、假尿苷(Ψ)、N1-甲基假尿苷(me1Ψ)、5-甲氧基尿苷(5moU)、肌苷、7-甲基鸟苷、2'-O-甲基-3'-硫代磷酸酯(MS)、S限制乙基(cEt)、硫代磷酸酯(PS)、2'-O-甲基-3'-硫代PACE(MSP)或2'-O-甲基-3'-膦酰基乙酸酯(MP)。在一些实施方案中,指导物包含一个或多个硫代磷酸酯修饰。在某些实施方案中,指导物的至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或25个核苷酸被化学修饰。在一些实施方案中,所有核苷酸都被化学修饰。在某些实施方案中,种子区中的一个或多个核苷酸被化学修饰。在某些实施方案中,在3'末端的一个或多个核苷酸被化学修饰。在某些实施方案中,5'柄中的核苷酸均未被化学修饰。在一些实施方案中,种子区中的化学修饰是次要修饰,例如并入2'-氟类似物。在一个具体的实施方案中,种子区的一个核苷酸被2'-氟类似物代替。在一些实施方案中,在3'末端的5或10个核苷酸被化学修饰。Cpf1 CrRNA的3'末端的此类化学修饰提高了基因切割效率(参见Li等人,NatureBiomedical Engineering,2017,1:0066)。在一个具体的实施方案中,将3'末端的5个核苷酸用2'-氟类似物代替。在一个具体的实施方案中,将3'末端的10个核苷酸用2'-氟类似物代替。在一个具体的实施方案中,将3'末端的5个核苷酸用2'-O-甲基(M)类似物代替。在一些实施方案中,在3'端和5'端各自的3个核苷酸被化学修饰。在一个具体的实施方案中,修饰包含2'-O-甲基或硫代磷酸酯类似物。在一个具体的实施方案中,四环中的12个核苷酸和茎-环区域中的16个核苷酸被2'-O-甲基类似物代替。此类化学修饰改进了体内编辑和稳定性(参见Finn等人,Cell Reports(2018),22:2227-2235)。
在一些实施方案中,指导RNA的5'和/或3'端被包括荧光染料、聚乙二醇、胆固醇、蛋白质或检测标签在内的多种功能性部分修饰。(参见Kelly等人,2016,J.Biotech.233:74-83)。在某些实施方案中,指导物在与靶DNA结合的区域中包含核糖核苷酸,并且在与Cas9、Cpf1或C2c1结合的区域中包含一个或多个脱氧核糖核苷酸和/或核苷酸类似物。在本发明的一个实施方案中,将脱氧核糖核苷酸和/或核苷酸类似物并入工程化的指导物结构中,例如但不限于5'和/或3'端、茎环区和种子区。在某些实施方案中,修饰不在茎环区的5'柄中。指导物的茎环区的5'柄中的化学修饰可能会消除其功能(参见Li等人,NatureBiomedical Engineering,2017,1:0066)。在某些实施方案中,指导物的至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或75个核苷酸被化学修饰。在一些实施方案中,指导物的3'或5'端的3-5个核苷酸被化学修饰。在一些实施方案中,仅次要修饰被引入种子区,例如2'-F修饰。在一些实施方案中,在指导物的3'端引入2'-F修饰。在某些实施方案中,指导物的5'和/或3'端的三至五个核苷酸用2'-O-甲基(M)、2'-O-甲基-3'-硫代磷酸酯(MS)、S限制乙基(cEt)、2'-O-甲基-3'-硫代PACE(MSP)或2'-O-甲基-3'-膦酰基乙酸酯(MP)进行化学修饰。这样的修饰可增强基因组编辑效率(参见Hendel等人,Nat.Biotechnol.(2015)33(9):985-989;Ryan等人,NucleicAcids Res.(2018)46(2):792-803)。在某些实施方案中,指导物的所有磷酸二酯键被硫代磷酸酯(PS)取代以增强基因破坏的水平。在某些实施方案中,指导物的5'和/或3'端的五个以上的核苷酸用2'-O-Me、2'-F或S限制乙基(cEt)进行化学修饰。这种化学修饰的指导物可介导增强水平的基因破坏(参见Ragdarm等人,0215,PNAS,E7110-E7111)。在本发明的一个实施方案中,对指导物进行修饰以在其3'和/或5'端包含化学部分。此类部分包括但不限于胺、叠氮化物、炔烃、硫代基、二苯并环辛炔(DBCO)、若丹明、肽、核定位序列(NLS)、肽核酸(PNA)、聚乙二醇(PEG)、三甘醇或四甘醇(TEG)。在某些实施方案中,化学部分通过接头例如烷基链与指导物缀合。在某些实施方案中,修饰的指导物的化学部分可用于将指导物附接到另一分子,例如DNA、RNA、蛋白质或纳米粒子。这种化学修饰的指导物可用于鉴定或富集由CRISPR系统一般性编辑的细胞(参见Lee等人,eLife,2017,6:e25312,DOI:10.7554)。在一些实施方案中,3'端和5'端各自的3个核苷酸被化学修饰。在一个具体的实施方案中,修饰包括2'-O-甲基或硫代磷酸酯类似物。在一个具体的实施方案中,四环中的12个核苷酸和茎环区中的16个核苷酸被2'-O-甲基类似物代替。此类化学修饰改进了体内编辑和稳定性(参见Finn等人,Cell Reports(2018),22:2227-2235)。在一些实施方案中,指导物的超过60或70个核苷酸被化学修饰。在一些实施方案中,该修饰包括用2'-O-甲基或2'-氟核苷酸类似物代替核苷酸或磷酸二酯键的硫代磷酸酯(PS)修饰。在一些实施方案中,当形成CRISPR复合物时,化学修饰包括延伸至核酸酶蛋白外部的指导核苷酸的2'-O-甲基或2'-氟修饰,或指导物的3'末端的20至30个或更多个核苷酸的PS修饰。在一个特定的实施方案中,化学修饰还包括在指导物的5'端的2'-O-甲基类似物或在种子和尾部区域的2'-氟类似物。这样的化学修饰提高了对核酸酶降解的稳定性并维持或增强了基因组编辑活性或效率,但是所有核苷酸的修饰可消除指导物的功能(参见Yin等人,Nat.Biotech.(2018),35(12):1179-1187)。可通过对CRISPR复合物的结构的了解,包括对有限数量的核酸酶和RNA 2'-OH相互作用的了解,来指导此类化学修饰(参见Yin等人,Nat.Biotech.(2018),35(12):1179-1187)。在一些实施方案中,一个或多个指导RNA核苷酸可用DNA核苷酸代替。在一些实施方案中,将5'端尾部/种子指导区的至多2、4、6、8、10或12个RNA核苷酸用DNA核苷酸代替。在某些实施方案中,将3'端的大多数指导RNA核苷酸用DNA核苷酸代替。在特定的实施方案中,将3'端的16个指导RNA核苷酸用DNA核苷酸代替。在特定的实施方案中,将5'端尾部/种子区的8个指导RNA核苷酸和3'端处的16个RNA核苷酸用DNA核苷酸代替。在特定的实施方案中,当形成CRISPR复合物时,将延伸到核酸酶蛋白外部的指导RNA核苷酸用DNA核苷酸代替。与未修饰的指导物相比,这种用DNA核苷酸代替多个RNA核苷酸导致脱靶活性降低,但在靶活性相似;然而,在3'端替换所有RNA核苷酸可能会消除指导物的功能(参见Yin等人,Nat.Chem.Biol.(2018)14,311-316)。可通过对CRISPR复合物的结构的了解,包括对有限数量的核酸酶和RNA 2'-OH相互作用的了解,来指导此类修饰(参见Yin等人,Nat.Chem.Biol.(2018)14,311-316)。
可选择指导序列,并因此选择靶向核酸的指导RNA以靶向任何靶核酸序列。靶序列可以是DNA。靶序列可以是基因组DNA。靶序列可以是线粒体DNA。2类V型CRISPR-Cas蛋白的指导分子或指导RNA包含tracr配对序列(在内源性CRISPR系统的情形下涵盖“正向重复序列”)和指导序列(在内源性CRISPR系统的情形下也称为“间隔子”)。天然Cas12b CRISPR-Cas系统采用tracr序列。
在某些实施方案中,指导分子(能够将C2c1引导至靶基因座)包含(1)能够与靶基因座杂交的指导序列和(2)tracr配对或正向重复序列,其中正向重复序列位于指导序列的上游(即5')。在一个特定的实施方案中,C2c1指导序列的种子序列(即对于识别和/或杂交至靶基因座的序列而言至关重要的序列)大约在所述指导序列的前10个核苷酸内。在特定的实施方案中,种子序列大约在指导序列5'端的前5个核苷酸内。
在一些实施方案中,指导物的5'柄的环被修饰。在一些实施方案中,指导物的5'柄的环被修饰以具有缺失、插入、分裂或化学修饰。在某些实施方案中,修饰的环包含3、4或5个核苷酸。在某些实施方案中,环包含UCUU、UUUU、UAUU或UGUU的序列。在一些实施方案中,指导分子形成具有单独的非共价连接序列的茎环,其可以是DNA或RNA。
茎环和发夹
关于核酸靶向复合物或系统,优选地,crRNA序列和嵌合指导序列可包含一个或多个茎环或发夹。适体修饰的指导物的使用允许含衔接子的蛋白质与指导物结合。衔接子可与任何功能结构域融合,从而提供功能结构域与指导物的连接。使用两种不同的适体允许被两个指导物分别靶向。可同时使用大量此类修饰的靶向核酸的指导RNA,例如10或20或30个等,而仅需要递送一个(或至少最小数量)的效应蛋白分子,因为相对较小数量的com蛋白分子可与大量修饰的指导物一起使用。衔接子蛋白与功能结构域(例如激活子或阻遏子)之间的融合物可包含接头。例如,可使用GlySer接头GGGS。它们可以3个(GGGGS)
在特定的实施方案中,茎包含至少约4bp,其包含互补的X和Y序列,但是也考虑具有更多个例如5、6、7、8、9、10、11或12个或更少个例如3、2个碱基对的茎。因此,可考虑例如X2-10和Y2-10(其中X和Y代表核苷酸的任何互补集合)。在一个方面,由X和Y核苷酸构成的茎与环一起将在整个二级结构中形成完整的发夹;并且,这可能是有利的,并且碱基对的数量可以是形成完整发夹的任何数量。在一个方面,只要保留整个指导分子的二级结构,任何互补的X:Y碱基配对序列(例如,关于长度)都是容许的。在一个方面,连接由X:Y碱基对形成的茎的环可以是相同长度(例如4或5个核苷酸)或更长的任何序列,其不中断指导分子的整体二级结构。在一个方面,茎环还可包括例如MS2适体。在一个方面,茎包含约5-7bp,其包含互补的X和Y序列,但是也考虑具有更多或更少碱基对的茎。在一个方面,考虑了非WatsonCrick碱基配对,其中这种配对否则通常在该位置保留茎环的构造。
在特定的实施方案中,指导分子的天然发夹或茎环结构被延伸或被延伸的茎环代替。在某些情况下,已经证明茎的延伸可增强指导分子与CRISPR-Cas蛋白的组装(Chen等人,Cell.(2013);155(7):1479-1491)。在特定的实施方案中,茎环的茎延伸至少1、2、3、4、5个或更多个互补碱基对(即对应于在指导分子中添加2、4、6、8、10个或更多个核苷酸)。在特定的实施方案中,它们位于茎的末端,邻近茎环的环。
在一些实施方案中,指导分子形成具有单独的非共价连接序列的茎环,其可以是DNA或RNA。在特定的实施方案中,首先使用标准亚磷酰胺合成方案(Herdewijn,P.编辑,Methods in Molecular Biology Col 288,Oligonucleotide Synthesis:Methods andApplications,Humana Press,New Jersey(2012))来合成形成指导物的序列。在一些实施方案中,可使用本领域已知的标准方案将这些序列官能化以包含适于连接的官能团(Hermanson,G.T.,Bioconjugate Techniques,Academic Press(2013))。官能团的实例包括但不限于羟基、胺、羧酸、羧酸卤化物、羧酸活性酯、醛、羰基、氯羰基、咪唑基羰基、酰肼、氨基脲、硫代氨基脲、硫醇、马来酰亚胺、卤代烷基、磺酰基、烯丙基、炔丙基、二烯、炔烃和叠氮化物。一旦该序列被官能化,就可在该序列与正向重复序列之间形成共价化学键或键联。化学键的实例包括但不限于基于以下的那些:氨基甲酸酯,醚,酯,酰胺,亚胺,脒,氨基三嗪,腙,二硫化物,硫醚,硫酯,硫代磷酸酯,二硫代磷酸酯,磺酰胺,磺酸酯,砜,亚砜,脲,硫脲,酰肼,肟,三唑,光不稳定键,C-C键形成基团如Diels-Alder环加成对或闭环复分解对和Michael反应对。
在一些实施方案中,这些茎环形成序列可为化学合成的。在一些实施方案中,化学合成使用利用2'-乙酰氧基乙基原酸酯(2'-ACE)(Scaringe等人,J.Am.Chem.Soc.(1998)120:11820-11821;Scaringe,Methods Enzymol.(2000)317:3-18)或2'-硫代氨基甲酸酯(2'-TC)化学(Dellinger等人,J.Am.Chem.Soc.(2011)133:11540-11546;Hendel等人,Nat.Biotechnol.(2015)33:985-989)的自动化固相寡核苷酸合成机。
降低的RNA酶敏感性
在一些实施方案中,降低指导分子对RNA切割例如对Cas12b切割的敏感性是令人感兴趣的。因此,在特定的实施方案中,调节指导分子以避免被Cas12b或其他RNA切割酶切割。
在特定的实施方案中,可通过稍微修饰指导分子的序列而不影响其功能来降低指导分子对RNA酶的敏感性或对降低的表达的敏感性。例如,在特定的实施方案中,可通过修饰指导分子序列中的假定的Pol-III终止子(4个连续的U)来去除转录的过早终止,例如U6Pol-III的过早转录。当在指导分子的茎环中需要这种序列修饰时,优选通过碱基对翻转来确保。
降低的二级结构
在一些实施方案中,选择指导分子的序列(正向重复序列和/或间隔子)以降低指导分子内的二级结构程度。在一些实施方案中,在最佳折叠时,靶向核酸的指导RNA的约或少于约75%、50%、40%、30%、25%、20%、15%、10%、5%、1%或更少的核苷酸参与自互补碱基配对。最佳折叠可通过任何合适的多核苷酸折叠算法来确定。一些程序是基于计算最小吉布斯自由能。一种这样的算法的实例是mFold,如Zuker和Stiegler(Nucleic AcidsRes.9(1981),133-148)所述。折叠算法的另一个实例是使用质心结构预测算法在维也纳大学理论化学研究所开发的在线网络服务器RNAfold(参见例如A.R.Gruber等人,2008,Cell106(1):23-24;以及PA Carr和GM Church,2009,Nature Biotechnology 27(12):1151-62)。
缀合的tracr序列
在一些实施方案中,指导分子包含经由非磷酸二酯键化学连接或缀合的tracr序列和tracr配对序列。在一个方面,指导物包含经由非核苷酸环化学连接或缀合的tracr序列和tracr配对序列。在一些实施方案中,tracr和tracr配对序列经由非磷酸二酯共价接头接合。共价接头的实例包括但不限于选自由以下组成的组的化学部分:氨基甲酸酯,醚,酯,酰胺,亚胺,脒,氨基三嗪,腙,二硫化物,硫醚,硫酯,硫代磷酸酯,二硫代磷酸酯,磺酰胺,磺酸酯,砜,亚砜,脲,硫脲,酰肼,肟,三唑,光不稳定键,C-C键形成基团如Diels-Alder环加成对或闭环复分解对和Michael反应对。
在一些实施方案中,首先使用标准亚磷酰胺合成方案(Herdewijn,P.编辑,Methods in Molecular Biology Col 288,Oligonucleotide Synthesis:Methods andApplications,Humana Press,New Jersey(2012))来合成tracr和tracr配对序列。在一些实施方案中,可使用本领域已知的标准方案(Hermanson,G.T.,Bioconjugate Techniques,Academic Press(2013))将tracr或tracr配对序列官能化以包含适于连接的官能团。官能团的实例包括但不限于羟基、胺、羧酸、羧酸卤化物、羧酸活性酯、醛、羰基、氯羰基、咪唑基羰基、酰肼、氨基脲、硫代氨基脲、硫醇、马来酰亚胺、卤代烷基、磺酰基、烯丙基、炔丙基、二烯、炔烃和叠氮化物。一旦tracr和tracr配对序列被官能化,就可在两个寡核苷酸之间形成共价化学键或键联。化学键的实例包括但不限于基于以下的那些:氨基甲酸酯,醚,酯,酰胺,亚胺,脒,氨基三嗪,腙,二硫化物,硫醚,硫酯,硫代磷酸酯,二硫代磷酸酯,磺酰胺,磺酸酯,砜,亚砜,脲,硫脲,酰肼,肟,三唑,光不稳定键,C-C键形成基团如Diels-Alder环加成对或闭环复分解对和Michael反应对。
在一些实施方案中,tracr和tracr配对序列可为化学合成的。在一些实施方案中,化学合成使用利用2'-乙酰氧基乙基原酸酯(2'-ACE)(Scaringe等人,J.Am.Chem.Soc.(1998)120:11820-11821;Scaringe,Methods Enzymol.(2000)317:3-18)或2'-硫代氨基甲酸酯(2'-TC)化学(Dellinger等人,J.Am.Chem.Soc.(2011)133:11540-11546;Hendel等人,Nat.Biotechnol.(2015)33:985-989)的自动化固相寡核苷酸合成机。
在一些实施方案中,可经由糖、核苷酸间磷酸二酯键、嘌呤和嘧啶残基的修饰,使用各种生物缀合反应、环、桥和非核苷酸键将tracr和tracr配对序列共价连接。Sletten等人,Angew.Chem.Int.Ed.(2009)48:6974-6998;Manoharan,M.Curr.Opin.Chem.Biol.(2004)8:570-9;Behlke等人,Oligonucleotides(2008)18:305-19;Watts等人,Drug.Discov.Today(2008)13:842-55;Shukla等人,ChemMedChem(2010)5:328-49。
在一些实施方案中,可使用点击化学将tracr和tracr配对序列共价连接。在一些实施方案中,可使用三唑接头将tracr和tracr配对序列共价连接。在一些实施方案中,可使用涉及炔烃和叠氮化物的Huisgen 1,3-偶极环加成反应将tracr和tracr配对序列共价连接以产生高度稳定的三唑接头(He等人,ChemBioChem(2015)17:1809-1812;WO 2016/186745)。在一些实施方案中,通过连接5'-己炔tracrRNA和3'-叠氮crRNA来共价连接tracr和tracr配对序列。在一些实施方案中,可用2'-乙酰氧基乙基原酸酯(2'-ACE)基团保护5'-己炔tracrRNA和3'-叠氮crRNA中的任一者或两者,随后可使用Dharmacon方案将其除去(Scaringe等人,J.Am.Chem.Soc.(1998)120:11820-11821;Scaringe,Methods Enzymol.(2000)317:3-18)。
在一些实施方案中,tracr和tracr配对序列可经由接头(例如,非核苷酸环)共价连接,所述接头包含例如间隔子、附接物、生物缀合物、生色团、报告基团、染料标记的RNA和非天然存在的核苷酸类似物的部分。更具体地说,用于本发明目的的合适的间隔子包括但不限于聚醚(例如,聚乙二醇、多元醇、聚丙二醇、或乙烯和丙二醇的混合物),聚胺基团(例如,精胺、亚精胺及其聚合物衍生物),聚酯(例如,聚(丙烯酸乙酯)),聚磷酸二酯,亚烷基及其组合。合适的附接物包括可被添加到接头以向接头增加额外特性的任何部分,例如但不限于荧光标记。合适的生物缀合物包括但不限于肽、糖苷、脂质、胆固醇、磷脂、二酰基甘油和二烷基甘油、脂肪酸、烃、酶底物、类固醇、生物素、洋地黄毒苷、碳水化合物、多糖。合适的生色团、报告基团和染料标记的RNA包括但不限于荧光染料如荧光素和若丹明,化学发光、电化学发光和生物发光标志化合物。WO 2004/015075中也描述了缀合两个RNA组分的示例性接头的设计。
接头(例如,非核苷酸环)可具有任何长度。在一些实施方案中,接头具有等于约0-16个核苷酸的长度。在一些实施方案中,接头具有等于约0-8个核苷酸的长度。在一些实施方案中,接头具有等于约0-4个核苷酸的长度。在一些实施方案中,接头具有等于约2个核苷酸的长度。在WO2011/008730中也描述了示例性接头设计。
典型的Cas9 sgRNA包含(在5'至3'方向):指导序列,poly U束,第一互补伸长(“重复序列”),环(四环),第二互补伸长(“反重复序列”与重复序列互补),茎,和进一步的茎环和茎以及poly A(在RNA中通常为poly U)尾部(终止子)。典型的Cas12b sgRNA包含相似的组分,但方向相反,即3'至5'方向。正向重复序列(DR)与tracrRNA杂交形成crRNA:tracrRNA双链体,然后将其装载到Cas12b上以指导DNA识别和切割。Cas12b在原间隔子序列的5'端识别富含T的PAM,以介导DNA干扰。在某些实施方案中,tracr的5'端形成茎环。在某些实施方案中,tracrRNA和5'DR的核苷酸形成重复序列:反重复序列双链体。在某些实施方案中,sgRNA构造与Shmakov等人,2015,Molecular Cell 60,385-397预测的结构一致。在某些实施方案中,sgRNA构造与Liu等人,2017,Molecular Cell 65,310-322预测的结构一致。在优选的实施方案中,指导物构造的某些方面得以保留,指导物构造的某些方面可例如通过特征的添加、减去或取代来修饰,而指导物构造的某些其他方面得以保持。工程化的sgRNA修饰(包括但不限于插入、缺失和取代)的优选位置包括指导物末端和当与CRISPR蛋白和/或靶标复合时暴露的sgRNA的区域,例如四环和/或环2。
在某些实施方案中,本发明的指导物包含针对衔接子蛋白的特异性结合位点(例如适体),其可包含一个或多个功能结构域(例如经由融合蛋白)。当这样的指导物形成CRISPR复合物(即,CRISPR酶结合至指导物和靶标)时,衔接子蛋白结合,并且与衔接子蛋白相关的功能结构域定位在空间定向中,这有利于所赋予的功能有效。例如,如果功能结构域是转录激活子(例如VP64或p65),则将转录激活子置于空间定向中,使其能够影响靶标的转录。同样,转录阻遏子将有利地定位以影响靶标的转录,并且核酸酶(例如Fok1)将有利地定位以切割或部分切割靶标。
本领域技术人员将理解,对指导物的修饰,其允许结合衔接子+功能结构域,但不允许适当地定位衔接子+功能结构域(例如由于CRISPR复合物的三维结构内的空间位阻),是非预期的修饰。如本文所述,可在四环、茎环1、茎环2或茎环3处,优选在四环或茎环2处,并且最优选在四环和茎环2处,修饰一个或多个修饰的指导物。
重复序列:反重复序列双链体将从sgRNA的二级结构中显而易见。在典型的Cas9sgRNA中,通常可能是在poly U束之后(在5'至3'方向上)和在四环之前的第一互补伸长;以及在四环之后(在5'至3'方向上)和在poly A束之前的第二互补伸长。第一互补伸长(“重复序列”)与第二互补伸长(“反重复序列”)互补。在某些实施方案中,Cas12b sgRNA的构造与Shmakov等人,2015,Molecular Cell 60,385-397预测的结构一致。在某些实施方案中,Cas12bsgRNA构造的构造与Liu等人,2017,Molecular Cell 65,310-322预测的结构一致。因而,这些sgRNA包含Watson-Crick碱基对,以在彼此折叠后形成dsRNA的双链体。因而,反重复序列是重复序列的互补序列,并且就A-U或C-G碱基配对而言,以及因为反重复序列由于茎环或其他构造特征而处于相反方向。
在本发明的一个实施方案中,指导物构造的修饰包括替换茎环2中的碱基。例如,在一些实施方案中,茎环2中的“actt”(RNA中的“acuu”)和“aagt”(RNA中的“aagu”)碱基用“cgcc”和“gcgg”代替。在一些实施方案中,茎环2中的“actt”和“aagt”碱基用4个核苷酸的互补的富含GC的区域代替。在一些实施方案中,4个核苷酸的互补的富含GC的区域是“cgcc”和“gcgg”(均在5'至3'方向上)。在一些实施方案中,4个核苷酸的互补的富含GC的区域是“gcgg”和“cgcc”(均在5'至3'方向上)。在4个核苷酸的互补的富含GC的区域中的C和G的其他组合将是显而易见的,包括CCCC和GGGG。
在一个方面,茎环2,例如“ACTTgtttAAGT”(SEQ ID NO:397)可用任何“XXXXgtttYYYY”(SEQ ID NO:398)代替,例如,其中XXXX和YYYY代表在一起将彼此碱基配对以产生茎的任何互补组的核苷酸。
在一个方面,茎包含含有互补X和Y序列的至少约4bp,但还考虑具有更多个例如5、6、7、8、9、10、11或12个或更少个例如3、2个碱基对的茎。因此,可考虑例如X2-12和Y2-12(其中X和Y代表任何互补组的核苷酸)。在一个方面,由X和Y核苷酸构成的茎与“gttt”一起将在整个二级结构中形成完整的发夹;并且,这可能是有利的,并且碱基对的数量可以是形成完整发夹的任何数量。在一个方面,只要保留整个sgRNA的二级结构,任何互补的X:Y碱基配对序列(例如,关于长度)都是容许的。在一个方面,茎可以是X:Y碱基对的形式,其不破坏整个sgRNA的二级结构,因为它具有DR:tracr双链体和3个茎环。在一个方面,连接ACTT和AAGT(或由X:Y碱基对构成的任何替代茎)的“gttt”四环可以是相同长度(例如4个碱基对)或更长的任何序列,其不中断sgRNA的整体二级结构。在一个方面,茎环可以是进一步延长茎环2的某物,例如可以是MS2适体。在一个方面,茎环3“GGCACCGagtCGGTGC”(SEQ ID NO:399)可同样采取“XXXXXXXagtYYYYYYY”(SEQ ID NO:400)的形式,例如,其中X7和Y7代表将一起彼此碱基配对以产生茎的任何互补组的核苷酸。在一个方面,茎包括包含互补的X和Y序列的约7bp,但也考虑了更多或更少个碱基对的茎。在一个方面,由X和Y核苷酸构成的茎与“agt”一起将在整个二级结构中形成完整的发夹。在一个方面,只要保留整个sgRNA的二级结构,任何互补的X:Y碱基配对序列都是容许的。在一个方面,茎可以是X:Y碱基配对的形式,其不破坏整个sgRNA的二级结构,因为它具有DR:tracr双链体和3个茎环。在一个方面,茎环3的“agt”序列可被适体(例如MS2适体或序列)延伸或代替,该适体或序列通常会保留茎环3的构造。在替代性茎环2和/或3的在一个方面,每个X和Y对可指任何碱基对。在一个方面,考虑了非Watson Crick碱基配对,其中这样的配对通常在该位置保留茎环的构造。
在一个方面,DR:tracrRNA双链体可被替换为以下形式:gYYYYag(N)NNNNxxxxNNNN(AAN)uuRRRRu(SEQ ID NO:401)(使用核苷酸的标准IUPAC命名法),其中(N)和(AAN)代表双链体中凸起的一部分,并且“xxxx”代表接头序列。正向重复序列上的NNNN可为任何物,只要其与tracrRNA的相应NNNN部分可碱基配对即可。在一个方面,DR:tracrRNA双链体可通过具有任何长度(xxxx...)、任何碱基组成的接头连接,只要它不改变整体结构即可。
在一个方面,sgRNA结构要求是具有双链体和3个茎环。在大多数方面,许多特定碱基要求的实际序列要求不严格,因为应保留DR:tracrRNA双链体的构造,但是产生所述构造的序列即茎、环、凸起等可改变。
具有第一适体/RNA结合蛋白对的一个指导物可连接或融合至激活子,而具有第二适体/RNA结合蛋白对的第二指导物可连接或融合至阻遏子。所述指导物用于不同的靶标(基因座),因此这允许一个基因被激活并且一个基因被阻遏。例如,以下示意图显示了这种方法:
指导物1–MS2适体-------MS2 RNA结合蛋白-------VP64激活子;和
指导物2–PP7适体-------PP7 RNA结合蛋白-------SID4x阻遏子。
本发明还涉及正交PP7/MS2基因靶向。在该实例中,用不同的RNA环修饰靶向不同基因座的sgRNA,以募集分别激活和阻遏其靶基因座的MS2-VP64或PP7-SID4X。PP7是噬菌体假单胞菌的RNA结合外壳蛋白。像MS2一样,它结合特定的RNA序列和二级结构。PP7 RNA识别基序与MS2不同。因此,PP7和MS2可多重作用以同时在不同的基因组基因座介导不同的作用。例如,靶向基因座A的sgRNA可用MS2环修饰,募集MS2-VP64激活子,而另一靶向基因座B的sgRNA可用PP7环修饰,募集PP7-SID4X阻遏子结构域。因此,在同一细胞中,dC2c1可介导正交的基因座特异性修饰。可扩展该原理以并入其他正交RNA结合蛋白,例如Q-β。
正交阻遏的另一种选择包括将具有反式激活阻遏功能的非编码RNA环并入到指导物中(在与整合到指导物中的MS2/PP7环相似的位置处或在指导物的3'末端处)。例如,指导物设计为具有非编码(但已知是阻遏性)RNA环(例如使用干扰哺乳动物细胞中RNA聚合酶II的Alu阻遏子(在RNA中))。定位Alu RNA序列:代替如本文所用的MS2 RNA序列(例如,在四环和/或茎环2处);和/或在指导物的3'末端处。这得到MS2、PP7或Alu在四环和/或茎环2位处的可能组合,以及任选地在指导物的3'端添加Alu(带有或不带有接头)。
通过使用两种不同的适体(不同的RNA),允许在不同的指导物下使用激活子-衔接子蛋白融合物和阻遏子-衔接子蛋白融合物,以激活一个基因的表达,同时阻遏另一个基因。它们以及它们的不同指导物可以多重方法一起或基本上一起施用。可同时全部使用大量的此类修饰指导物,例如10或20或30个等等,而只有一个(或至少最小数量)的C2c1被递送,而数量相对较少的C2c1可与大量修饰指导物一起使用。衔接子蛋白可与一种或多种激活子或者一种或多种阻遏子缔合(优选连接或融合)。例如,衔接子蛋白可与第一激活子和第二激活子缔合。第一激活子和第二激活子可以相同,但是它们优选是不同的激活子。例如,一个可能是VP64,而另一个可能是p65,但是这些仅是示例,并且可设想其他转录激活子。可使用三个或更多个或甚至四个或更多个激活子(或阻遏子),但是包装尺寸可能会限制数量高于5个不同的功能结构域。优选在与衔接子蛋白直接融合的情况下使用接头,其中两个或更多个功能结构域与衔接子蛋白相缔合。合适的接头可包括GlySer接头。
还可设想,酶-指导物复合物总体上可与两个或更多个功能结构域相缔合。例如,可能有两个或更多个与酶相缔合的功能结构域,或者可能有两个或更多个与指导物相缔合的功能结构域(经由一个或多个衔接子蛋白),或者可能有一个或多个与酶相缔合的功能结构域以及一个或多个与指导物相缔合的功能结构域(经由一个或多个衔接子蛋白)。
衔接子蛋白与激活子或阻遏子之间的融合物可包括接头。例如,可使用GlySer接头GGGS。它们可用于3个((GGGGS)
护送的(Escorted)和可诱导的指导物
在一个优选的实施方案中,正向重复序列可被修饰以包含一种或多种蛋白结合RNA适体。在一个特定的实施方案中,可包括一个或多个适体,例如优化的二级结构的一部分。此类适体可能能够结合如本文进一步详述的噬菌体外壳蛋白。
在特定的实施方案中,指导物是护送的指导物。“护送的”是指将Cas12bCRISPR-Cas系统或复合物或指导物递送至细胞内的选定时间或位置,从而在空间上或时间上控制Cas12b CRISPR-Cas系统或复合物或指导物的活性。例如,Cas12b CRISPR-Cas系统或复合物或指导物的活性和目的可由对适体配体具有结合亲和力的护送RNA适体序列控制,例如细胞表面蛋白或其他局部细胞组分。或者,护送适体可例如对细胞上或细胞中的适体效应子作出反应,例如瞬时效应子,例如在特定时间施加于细胞的外部能源。
护送的Cas12b CRISPR-Cas系统或复合物具有指导分子,该指导分子的功能结构旨在改善指导分子的结构、构造、稳定性、基因表达或其任何组合。这样的结构可包括适体。
适体是可被设计或选择与其他配体紧密结合的生物分子,例如使用一种通过指数富集的配体系统进化的技术(SELEX;Tuerk C,Gold L:“Systematic evolution ofligands by exponential enrichment:RNA ligands to bacteriophage T4DNApolymerase.”Science 1990,249:505-510)。核酸适体可例如选自随机序列寡核苷酸池,其对范围广泛的生物医学相关靶标具有高结合亲和力和特异性,表明对适体的范围广泛的治疗效用(Keefe,Anthony D.,Supriya Pai和Andrew Ellington."Aptamers astherapeutics."Nature Reviews Drug Discovery 9.7(2010):537-550)。这些特性还表明适体作为药物递送载体的范围广泛的用途(Levy-Nissenbaum,Etgar等人,"Nanotechnology and aptamers:applications in drug delivery."Trends inbiotechnology 26.8(2008):442-449;以及Hicke BJ,Stephens AW.“Escort aptamers:adelivery service for diagnosis and therapy.”JClin Invest 2000,106:923-928)。还可构建用作分子开关的适体,其通过改变性质来作出响应,例如结合荧光团以模拟绿色荧光蛋白活性的RNA适体(Paige,Jeremy S.,Karen Y.Wu和Samie R.Jaffrey."RNA mimicsof green fluorescent protein."Science 333.6042(2011):642-646)。还已经提出,适体可用作靶向siRNA治疗性递送系统的组分,例如靶向细胞表面蛋白(Zhou,Jiehua和JohnJ.Rossi."Aptamer-targeted cell-specific RNA interference."Silence 1.1(2010):4)。
因此,在特定的实施方案中,例如通过一个或多个适体来修饰指导分子,所述适体被设计成改善指导分子递送,包括跨细胞膜的递送、递送至细胞内隔室或递送至细胞核中。除了一个或多个适体之外或不使用这样的一个或多个适体,这样的结构可包括一个或多个部分,以使得指导分子可递送、可诱导或可响应于选定的效应子。因此,本发明包括对正常或病理生理状况有响应的指导分子,包括但不限于pH、缺氧、O
可诱导系统的光响应性可经由隐花色素-2(cryptochrome-2)和CIB1的激活和结合来实现。蓝光刺激在隐花色素-2中诱导活化的构象变化,从而导致其结合伴侣CIB1的募集。这种结合是快速且可逆的,在脉冲刺激后的<15秒内达到饱和,并且在刺激结束后的<15分钟内恢复到基线。这些快速结合动力学导致系统在时间上仅受转录/翻译和转录物/蛋白质降解速度的约束,而不是诱导剂的摄取和清除。隐花色素-2激活也是高度敏感的,从而允许使用低光强度刺激并减轻光毒性的风险。此外,在例如完整的哺乳动物脑的情况下,可变的光强度可用于控制受激区域的大小,从而可提供比单独的载体递送更大的精度。
本发明考虑了例如电磁辐射、声能或热能的能量源以诱导指导物。有利的是,电磁辐射是可见光的组分。在一个优选的实施方案中,光是波长为约450至约495nm的蓝光。在一个尤其优选的实施方案中,波长为约488nm。在另一个优选的实施方案中,光刺激是经由脉冲进行的。光功率可在约0-9mW/cm
化学或能量敏感性指导物在诱导时可能会通过化学源的结合或通过能量而发生构象变化,使其充当指导物并具有C2c1 CRISPR-Cas系统或复杂功能。本发明可包括施加化学源或能量以具有指导功能和C2c1 CRISPR-Cas系统或复杂功能;以及任选地进一步确定基因组基因座的表达已改变。
该化学诱导系统存在若干不同的设计:1.脱落酸(ABA)可诱导的基于ABI-PYL的系统(参见例如stke.sciencemag.org/cgi/content/abstract/sigtrans;4/164/rs2),2.雷帕霉素(或基于雷帕霉素的相关化学物质)可诱导的基于FKBP-FR B的系统(参见例如www.nature.com/nmeth/journal/v2/n6/full/nmeth763.html),3.赤霉素(GA)可诱导的基于GID1-GAI的系统(参见例如www.nature.com/nc hembio/journal/v8/n5/full/nchembio.922.html)。
化学诱导系统可以是4-羟基他莫昔芬(4OHT)可诱导的基于雌激素受体(ER)的系统(参见例如www.pnas.org/content/104/3/1027.abstract)。称为ERT2的雌激素受体的一种突变的配体结合结构域在与4-羟基他莫昔芬结合后易位到细胞核中。在本发明的其他实施方案中,任何核受体、甲状腺激素受体、视黄酸受体、雌激素受体、雌激素相关受体、糖皮质激素受体、孕激素受体、雄激素受体的任何天然存在的或工程化的衍生物都可用于与基于ER的可诱导系统类似的可诱导系统中。
另一种可诱导系统是基于使用可通过能量、热或无线电波诱导的基于瞬时受体电势(TRP)离子通道的系统的设计(参见例如www.sciencemag.org/content/336/6081/604)。这些TRP家族蛋白对不同的刺激(包括光和热)做出响应。当这种蛋白质被光或热激活时,离子通道将打开,并允许例如钙的离子进入质膜。离子的这种流入将结合至与多肽连接的细胞内离子相互作用伴侣,所述多肽包括C2c1 CRISPR-Cas复合物或系统的指导物和其他组分,并且所述结合将诱导多肽的亚细胞定位改变,从而导致整个多肽进入细胞核。一旦进入细胞核内部,C2c1 CRISPR-Cas复合物的指导蛋白和其他组分将具活性并调节细胞中靶基因的表达。
尽管光激活可以是一个有利的实施方案,但是有时对于光可能不穿透皮肤或其他器官的体内应用而言可能是不利的。在这种情况下,可考虑其他的能量激活方法,特别是具有类似作用的电场能量和/或超声。
优选在体内条件下使用约1伏/厘米至约10千伏/厘米的一个或多个电脉冲,基本上如本领域中所述施用电场能量。代替脉冲或除了脉冲之外,电场可以连续的方式传递。电脉冲可施加持续1μs至500毫秒,优选地1μs至100毫秒。可连续地或以脉冲方式施加电场持续约5分钟。
如本文所用,“电场能”是细胞暴露于其中的电能。优选地,电场在体内条件下具有约1伏/厘米至约10千伏/厘米或更高的强度(参见WO97/49450)。
如本文所用,术语“电场”包括在可变电容和电压下的一个或多个脉冲,并且包括指数和/或方波和/或调制波和/或调制方波形式。对电场和电的提及应被认为包括对电池环境中存在电势差的提及。如本领域中已知的,可通过静电、交流电(AC)、直流电(DC)等来建立这样的环境。电场可以是均匀的、不均匀的或其他方式,并且可以时间依赖性方式改变强度和/或方向。
电场的单次或多次施加以及超声的单次或多次施加也是可能的,可以是任何顺序和任何组合。超声和/或电场可作为单个或多个连续施加或作为脉冲来传递(脉冲传递)。
电穿孔已用于体外和体内程序中,以将外来物引入活细胞。在体外应用中,首先将活细胞样品与目标剂混合并放置在电极(例如平行板)之间。然后,电极向细胞/植入物混合物施加电场。进行体外电穿孔的系统的实例包括Electro Cell Manipulator ECM600产品和Electro Square Porator T820,它们均由Genetronics,Inc的BTX部门制造(参见美国专利第5,869,326号)。
通过向位于治疗区域周围的电极施加短暂的高压脉冲,已知的电穿孔技术(体外和体内)均起作用。电极之间产生的电场使细胞膜暂时变为多孔的,随后目标剂的分子进入细胞。在已知的电穿孔应用中,该电场包括约100μs持续时间的大约1000V/cm的单个方波脉冲。例如,在Electro Square Porator T820的已知应用中可产生这样的脉冲。
优选地,在体外条件下,电场的强度为约1V/cm至约10kV/cm。因此,电场的强度可为1V/cm、2V/cm、3V/cm、4V/cm、5V/cm、6V/cm、7V/cm、8V/cm、9V/cm、10V/cm、20V/cm、50V/cm、100V/cm、200V/cm、300V/cm、400V/cm、500V/cm、600V/cm、700V/cm、800V/cm、900V/cm、1kV/cm、2kV/cm、5kV/cm、10kV/cm、20kV/cm、50kV/cm或更高。在体外条件下更优选为约0.5kV/cm至约4.0kV/cm。优选地,在体内条件下电场的强度为约1V/cm至约10kV/cm。然而,在传递到目标部位的脉冲数量增加的情况下,电场强度可能会降低。因此,设想在较低的场强下以脉冲方式输送电场。
优选地,电场的施加形式为多个脉冲,例如具有相同强度和电容的双脉冲或具有变化强度和/或电容的顺序脉冲。如本文所用,术语“脉冲”包括处于可变电容和电压并且包括指数和/或方波和/或调制波/方波形式的一个或多个电脉冲。
优选地,电脉冲作为选自指数波形、方波形式、调制波形和调制方波形式的波形来传递。
一个优选的实施方案采用低压直流电。因此,申请人公开了以1V/cm至20V/cm之间的场强施加于细胞、组织或组织块的电场的使用,持续100毫秒或更长、优选15分钟或更长的时期。
超声有利地以约0.05W/cm
如本文所用,术语“超声”是指一种能量形式,其由机械振动组成,该机械振动的频率如此高以至于它们超出人类听力的范围。超声波频谱的频率下限通常可取为约20kHz。超声的大多数诊断应用采用的频率范围为1至15MHz(摘自Ultrasonics in ClinicalDiagnosis,P.N.T.Wells编辑,第2版,Publ.Churchill Livingstone[Edinburgh,London&NY,1977])。
超声已用于诊断和治疗应用。当用作诊断工具(“诊断超声”)时,尽管已使用了高达750mW/cm
聚焦超声(FUS)允许在不使用侵入式探头的情况下传递热能(参见Morocz等人,1998Journal of Magnetic Resonance Imaging第8卷,第1期,第136-142页)。聚焦超声的另一种形式是高强度聚焦超声(HIFU),由Moussatov等人在Ultrasonics(1998)第36卷,第8期,第893-900页以及TranHuuHue等人在Acustica(1997)第83卷,第6期,第1103-1106页中进行了综述。
优选地,采用诊断超声和治疗超声的组合。然而,该组合并非旨在进行限制,并且本领域读者将理解,可使用超声的任何多种组合。另外,能量密度、超声频率和暴露时间可改变。
优选地,暴露于超声能量源的功率密度为约0.05至约100Wcm
优选地,暴露于超声能量源的频率为约0.015至约10.0MHz。更优选地,暴露于超声能量源的频率为约0.02至约5.0MHz或约6.0MHz。最优选地,超声以3MHz的频率施加。
优选地,暴露时间为约10毫秒至约60分钟。优选地,暴露时间为约1秒至约5分钟。更优选地,施加超声约2分钟。然而,取决于要被破坏的特定靶细胞,暴露可持续更长的持续时间,例如15分钟。
有利的是,将靶组织暴露于声功率密度为约0.05Wcm
优选地,超声的施加为多个脉冲的形式;因此,可以任何组合使用连续波和脉冲波(超声的脉冲传递)。例如,可施加连续波超声,接着是脉冲波超声,反之亦然。可以任何顺序和组合将其重复任何数量的次数。可在连续波超声的背景下施加脉冲波超声,并且可以任何数量的组使用任何数量的脉冲。
优选地,超声可包括脉冲波超声。在一个高度优选的实施方案中,以0.7Wcm-2或1.25Wcm-2的功率密度作为连续波施加超声。如果使用脉冲波超声,则可采用更高的功率密度。
超声的使用是有利的,因为像光一样,超声可精确地聚焦在目标上。此外,超声是有利的,因为它可与光不同地更深地聚焦到组织中。因此,它更适合于整个组织的渗透(例如但不限于肝叶)或整个器官(例如但不限于整个肝脏或整个肌肉,例如心脏)治疗。另一个重要的优点在于超声是一种非侵入性刺激,其可用于广泛多种诊断和治疗应用。举例来说,超声在医学成像技术中以及另外在骨科治疗中是众所周知的。此外,适用于将超声施加到受试脊椎动物的仪器是广泛可用的,并且其使用在本领域中是众所周知的。
本发明的快速转录反应和内源性靶向成为研究转录动力学的理想系统。例如,本发明可用于研究诱导的靶基因表达后变体产生的动力学。在转录周期的另一端,经常会响应于强烈的细胞外刺激进行mRNA降解研究,从而导致过多基因的表达水平发生变化。本发明可用于可逆地诱导内源靶标的转录,此后可停止点刺激并且可追踪独特靶标的降解动力学。
本发明的时间精度可提供与实验性干预相结合来定时基因调控的能力。例如,可在器官型或解离的神经元培养物中调节疑似参与长期增强(LTP)的靶标,但只能在刺激期间诱导LTP,从而避免干扰细胞的正常发育。类似地,在表现出疾病表型的细胞模型中,仅在治疗期间可调节疑似与特定疗法的有效性有关的靶标。相反,仅在病理刺激期间才可调节遗传靶标。与外部实验刺激的遗传提示的定时有关的任何数量的实验都可能受益于本发明的实用性。
体内情形为本发明控制基因表达提供了同样丰富的机会。光诱导性为空间精度提供了潜力。利用光极(optrode)技术的发展,可将刺激性的光纤导线放置在精确的大脑区域。然后可通过光强度来调节刺激区域的大小。这可结合本发明的C2c1 CRISPR-Cas系统或复合物的递送来完成,或者在转基因C2c1动物的情况下,可递送本发明的指导RNA,并且光极技术可允许调节精确大脑区域中的基因表达。透光的表达C2c1的生物体可被施用本发明的指导RNA,然后可存在非常精确的激光诱导的局部基因表达变化。
用于培养宿主细胞的培养基包括通常用于组织培养的培养基,例如M199-earle基础培养基、Eagle MEM(E-MEM)、Dulbecco MEM(DMEM)、SC-UCM102、UP-SFM(GIBCO BRL)、EX-CELL302(Nichirei)、EX-CELL293-S(Nichirei)、TFBM-01(Nichirei)、ASF104等。可在美国典型培养物保藏中心(ATCC)或欧洲细胞培养物保藏中心(ECACC)找到适合特定细胞类型的培养基。培养基可补充有氨基酸如L-谷氨酰胺、盐、抗真菌剂或抗细菌剂,例如
本发明还可提供有价值的体内时间精度。本发明可用于在特定发育阶段改变基因表达。本发明可用于将遗传提示定时到特定的实验窗口。例如,仅在完整的啮齿动物或灵长类动物大脑的精确区域中的学习刺激期间,与学习有关的基因才可能被过度表达或阻遏。此外,本发明可仅在疾病发展的特定阶段用于诱导基因表达变化。例如,仅当肿瘤达到特定大小或转移阶段时,癌基因才可能过表达。相反,只有在动物生命的限定时间点和特定大脑区域内,才可能敲低阿尔茨海默氏病发展过程中疑似的蛋白质。尽管这些实例并未详尽列出本发明的潜在应用,但它们强调了本发明可能是一项强大技术的某些领域。
受保护的指导物
在特定的实施方案中,通过二级结构修饰指导分子以增加CRISPR-Cas系统的特异性,并且所述二级结构可防止核酸外切酶活性并允许5'添加到指导序列中,在本文中也称为受保护的指导分子。
在一个方面,本发明提供了使“保护RNA”与指导分子的序列杂交,其中“保护RNA”是与指导分子的3'端互补的RNA链,从而产生部分双链指导RNA。在本发明的一个实施方案中,用完全互补的保护序列来保护错配的碱基(即,不形成指导序列一部分的指导分子的碱基)降低了靶DNA结合于3'端错配碱基对的可能性。在本发明的特定实施方案中,在指导分子内还可能存在包含延长长度的其他序列,使得所述指导物在指导分子内包含保护序列。该“保护序列”确保了指导分子除“暴露序列”(包含与靶序列杂交的指导序列的一部分)之外还包含“受保护的序列”。在特定的实施方案中,通过保护指导物的存在来修饰指导分子以包括二级结构如发夹。有利的是,存在三个或四个至三十个或更多个,例如约10个或更多个具有与受保护序列、指导序列或两者互补的连续碱基对。有利的是,受保护部分不妨碍CRISPR-Cas系统与其靶标相互作用的热力学。通过提供包括部分双链的指导分子的这种延伸,所述指导分子被认为是受保护的并且导致改善的CRISPR-Cas复合物的特异性结合,同时保持特异性活性。
与基因组靶标匹配的指导RNA(gRNA)延伸可提供gRNA保护并增强特异性。设想了对于各个基因组靶标用间隔子种子末端的远端匹配序列来延伸gRNA,以提供增强的特异性。已经在没有截短的细胞中观察到了增强特异性的匹配gRNA延伸。对伴随这些稳定的长度延伸的gRNA结构的预测表明,稳定形式源自保护状态,其中由于间隔子延伸和间隔子种子中的互补序列,延伸与gRNA种子形成闭环。这些结果表明,受保护的指导物概念还包括与20mer间隔子结合区远端的基因组靶序列匹配的序列。热力学预测可用于预测完全匹配或部分匹配的指导物延伸,从而导致受保护的gRNA状态。这将受保护的gRNA的概念扩展到X与Z之间的相互作用,其中X通常长度为17-20nt并且Z长度为1-30nt。热力学预测可用于确定Z的最佳延伸状态,从而可能在Z中引入少量错配以促进X与Z之间受保护构象的形成。在整个本申请中,术语“X”和种子长度(SL)与术语暴露长度(EpL)可互换使用,其表示靶DNA可用于结合的核苷酸数;术语“Y”和保护长度(PL)可互换使用,以表示保护物长度;并且术语“Z”、“E”、“E”和“EL”可互换使用,以对应于术语延伸长度(ExL),其表示靶序列被延伸的核苷酸数。
对应于延伸长度(ExL)的延伸序列可任选地直接附接到受保护的指导序列的3'端的指导序列。延伸序列的长度可以是2至12个核苷酸。优选地,ExL可被表示为长度为0、2、4、6、8、10或12个核苷酸。在一个优选的实施方案中,ExL被表示为长度为0或4个核苷酸。在一个更优选的实施方案中,ExL的长度为4个核苷酸。延伸序列可以与靶序列互补或者可以不与靶序列互补。
延伸序列还可任选地直接附接到受保护的指导序列的5'端的指导序列以及保护序列的3'端。结果,延伸序列用作受保护序列与保护序列之间的连接序列。不希望受到理论的束缚,这样的连接可将保护序列定位在受保护序列附近,以改善保护序列与受保护序列的结合。将理解的是,种子、保护物和延伸物的上述关系适用于指导物的远端(即靶向端)为5'端(例如,在Cas系统中起作用的指导物)的情况。在指导物的远端为3'端的实施方案中,所述关系将是相反的。在这样的实施方案中,本发明提供了将“保护RNA”与指导序列杂交,其中“保护RNA”是与指导RNA(gRNA)的3'端互补的RNA链,从而产生部分双链的gRNA。
将gRNA错配添加到gRNA的远端可显示增强的特异性。在Y中引入未保护的远端错配或用远端错配(Z)延伸gRNA可显示增强的特异性。如所述,该概念与受保护的gRNA中使用的X、Y和Z组分相关。未保护的错配概念可进一步概括为针对受保护的指导RNA所述的X、Y和Z的概念。
截短指导物
在特定的实施方案中,使用了截短指导物(tru-guide),即包含指导序列的长度相对于典型的指导序列长度被截短的指导分子。如Nowak等人(Nucleic Acids Res(2016)44(20):9555-9564)所述,此类指导物可允许具有催化活性的CRISPR-Cas酶结合其靶标而不切割靶DNA。在特定的实施方案中,使用截短的指导物,其允许靶标的结合,但仅保留CRISPR-Cas酶的切口酶活性。
在一个特定的实施方案中,指导分子包含与正向重复序列连接的指导序列,或与正向重复序列和tracr序列连接的指导序列,其中正向重复序列、crRNA序列和/或tracr序列包括一个或多个茎环或优化的二级结构。在特定的实施方案中,正向重复序列具有16nt的最小长度和单个茎环。在其他实施方案中,正向重复序列的长度大于16nt,优选大于17nt,并且具有多于一个的茎环或优化的二级结构。在特定的实施方案中,指导分子包含与全部或部分的天然正向重复序列连接的指导序列或由与全部或部分的天然正向重复序列连接的指导序列组成。典型的V-B型C2c1/Cas12b指导分子包含(在3'至5'方向上):指导序列和与tracr的3'端互补的互补伸长(“重复序列”)。重复序列和tracr可接合到嵌合指导物中,所述嵌合指导物包含设计为形成茎环(通常长度为4或5个核苷酸的环)的区域,包括第二互补伸长(tracr的“反重复序列”与重复序列互补)和poly A(在RNA中通常为poly U)尾部(终止子)。在特定的实施方案中,指导物构造的某些方面可例如通过特征的添加、减去或取代来修饰,而指导物构造的某些其他方面得以保持。工程化的指导分子修饰的优选位置,包括但不限于插入、缺失和取代,包括在指导物末端和与C2c1蛋白和/或靶标复合时暴露的指导分子区域,例如正向重复序列的茎环。
嵌合指导物
本发明提供了各种Cas12b系统指导物。在某些实施方案中,指导物包含两个可杂交的部分,第一部分的3'端与第二部分的5'端至少部分互补并能够与其杂交。在某些实施方案中,两个部分被接合。也就是说,可使用单个指导物(“嵌合指导物”),其包含5'端的第一区段,其对应于天然Cas12b指导物的指导序列和正向重复序列,所述第一区段与3'端的第二区段接合,所述第二区段对应于Cas12b tracr序列。将两个区段接合,使得第一区段的3'端和第二区段的5'端的互补序列可例如在茎环结构中杂交。
死指导物
在一个方面,本发明提供了以允许形成CRISPR复合物并成功结合至靶标而同时不允许成功的核酸酶活性(即没有核酸酶活性/没有插入/缺失活性)的方式修饰的指导序列。出于解释的目的,这种修饰的指导序列被称为“死指导物”或“死指导序列”。就核酸酶活性而言,可认为这些死指导物或死指导序列是无催化活性的或无构象活性的。核酸酶活性可使用本领域通常使用的surveyor分析或深度测序来测量,优选surveyor分析。类似地,就促进催化活性或区分在靶和脱靶结合活性的能力而言,死指导序列可能不充分参与生产性碱基配对。简而言之,surveyor测定涉及纯化和扩增基因的CRISPR靶位点,并用可扩增CRISPR靶位点的引物形成异源双链体。重新退火后,按照制造商推荐的方案用SURVEYOR核酸酶和SURVEYOR增强剂S(Transgenomics)处理产品,在凝胶上进行分析,并根据相对条带强度进行定量。
因此,在一个相关方面,本发明提供了一种非天然存在的或工程化的组合物C2c1CRISPR-Cas系统,所述系统包含如本文所述的功能性Cas12b和指导RNA(gRNA),其中所述gRNA包含死指导序列,由此所述gRNA能够与靶序列杂交以使得Cas12b CRISPR-Cas系统针对细胞中目标基因组基因座,而没有如通过SURVEYOR测定法检测到的系统的非突变Cas12b酶的核酸酶活性所导致的可检测的插入/缺失活性。出于简化目的,一种包含死指导序列的gRNA在本文中称为“死gRNA”,其中所述gRNA能够与靶序列杂交,使得Cas12b CRISPR-Cas系统针对细胞中的目标基因组基因座,而没有如通过SURVEYOR测定法检测到的系统的非突变Cas12b酶的核酸酶活性所导致的可检测的插入/缺失活性。应当理解,如本文其他地方所述的根据本发明的任何gRNA可用作如下文所述的死gRNA/包含死指导序列的gRNA。如本文其他地方所述的任何方法、产品、组合物和用途都同样适用于包含死指导序列的死gRNA/gRNA,如下文进一步详述。通过进一步的指导,提供了以下特定方面和实施方案。
可通过任何合适的测定来评估死指导序列引导CRISPR复合物与靶序列的序列特异性结合的能力。例如,可例如通过用编码CRISPR序列的组分的载体转染,接着评估靶序列内的优先切割,例如通过如本文所述的Surveyor测定,将足以形成CRISPR复合物的CRISPR系统的组分,包括待测试的死指导序列,提供给具有相应靶序列的宿主细胞。类似地,可通过提供靶序列,CRISPR复合物的组分,包括待测试的死指导序列和不同于测试死指导序列的对照指导序列,以及比较测试和对照指导序列反应之间在靶序列处的结合或切割速率,在试管中评价靶多核苷酸序列的切割。其他测定是可能的,并且对本领域技术人员而言是显而易见的。可选择死指导序列以靶向任何靶序列。在一些实施方案中,靶序列是细胞基因组内的序列。
如本文进一步解释的,几个结构参数允许适当的框架达到这样的死指导物。死指导序列比相应的指导序列短,这导致活性Cas12b特异性插入/缺失形成。死指导物比针对相同Cas12b的相应指导物短5%、10%、20%、30%、40%、50%,从而导致活性Cas12b特异性插入/缺失形成。
如下文所解释并在本领域中已知,gRNA–C2c1特异性的一个方面是正向重复序列,该序列应适当地连接至此类指导物。特别是,这意味着正向重复序列的设计取决于C2c1的来源。因此,可用于验证的死指导序列的结构数据可用于设计C2c1特异性等同物。例如两个或更多个C2c1效应蛋白的直系同源核酸酶结构域RuvC之间的结构相似性可用于转移设计等同的死指导物。因此,本文的死指导物可在长度和序列上适当地修饰以反映这种C2c1特异性等同物,从而允许形成CRISPR复合物并成功结合至靶标,而同时不允许成功的核酸酶活性。
在本文以及现有技术的情形下使用死指导物为体外、离体和体内应用中的网络生物学和/或系统生物学提供了令人惊讶且出乎意料的平台,从而允许多重基因靶向,并且特别是双向多重基因靶向。在使用死指导物之前,处理多个靶标,例如使基因活性激活、阻遏和/或沉默一直是具有挑战性的并且在某些情况下是不可能的。通过使用死指导物,可例如在同一细胞中、在同一动物中或在同一患者中处理多个靶标,从而处理多种活性。这种多重化可同时发生或错开所需的时间范围。
例如,死指导物现在首次允许使用gRNA作为基因靶向的手段,而没有核酸酶活性的结果,同时提供了激活或阻遏的直接手段。可修饰包含死指导物的指导RNA,使其还以允许激活或阻遏基因活性的方式包含元件,特别是如本文其他地方所述的蛋白质衔接子(例如适体),从而允许基因效应子(例如基因活性的激活子或阻遏子)的功能性定位。一个实例是并入适体,如本文中和现有技术中所说明。通过工程化包含死指导物的gRNA以并入蛋白质相互作用适体(Konermann等人,“Genome-scale transcription activation by anengineered CRISPR-Cas9 complex,”doi:10.1038/nature14136,通过引用并入本文),可组装由多个不同的效应子结构域组成的合成转录激活复合物。这可在自然转录激活过程之后进行建模。例如,可将选择性结合效应子(例如,激活子或阻遏子;二聚化的MS2噬菌体外壳蛋白,作为与激活子或阻遏子的融合蛋白)的适体,或自身结合效应子(例如激活子或阻遏子)的蛋白质附接到死gRNA四环和/或茎环2。在MS2的情况下,融合蛋白MS2-VP64与四环和/或茎环2结合,进而介导转录上调,例如Neurog2。其他转录激活子是例如VP64、P65、HSF1和MyoD1。仅作为该概念的实例,可使用与PP7相互作用的茎环代替MS2茎环来募集阻遏性元件。
因此,一个方面是包含死指导物的本发明的gRNA,其中所述gRNA还包含提供基因激活或阻遏的修饰,如本文所述。死gRNA可包含一种或多种适体。所述适体可针对基因效应子、基因激活子或基因阻遏子具有特异性。或者,适体可对蛋白质具有特异性,所述蛋白质又对特定的基因效应子、基因激活子或基因阻遏子具有特异性并募集/结合特定的基因效应子、基因激活子或基因阻遏子。如果存在多个用于激活子或阻遏子募集的位点,则优选的是所述位点对于激活子或阻遏子具有特异性。如果存在多个用于激活子或阻遏子结合的位点,则所述位点可能对相同的激活子或相同的阻遏子具有特异性。所述位点也可能对不同的激活子或不同的阻遏子具有特异性。基因效应子、基因激活子、基因阻遏子可以融合蛋白的形式存在。
在一个实施方案中,如本文所述的死gRNA或如本文所述的C2c1CRISPR-Cas复合物包括非天然存在的或工程化的组合物,所述组合物包含两个或更多个衔接子蛋白,其中每个蛋白与一个或多个功能结构域缔合,并且其中所述衔接子蛋白与插入到死gRNA的至少一个环中的独特RNA序列结合。
因此,一方面提供了一种非天然存在的或工程化的组合物,所述组合物包含指导RNA(gRNA),所述指导RNA包含能够与细胞中目标基因组基因座中的靶序列杂交的死指导序列,其中所述死指导序列如本文所定义,包含至少一个或多个核定位序列的C2c1,其中所述C2c1任选地包含至少一个突变,其中通过插入与一个或多个衔接子蛋白结合的不同RNA序列来修饰死gRNA的至少一个环,并且其中所述衔接子蛋白与一个或多个功能结构域相缔合;或者,其中将死gRNA修饰为具有至少一个非编码功能环,并且其中所述组合物包含两个或更多个衔接子蛋白,其中每个蛋白与一个或多个功能结构域相缔合。
在某些实施方案中,所述衔接子蛋白是包含功能结构域的融合蛋白,所述融合蛋白任选地包含衔接子蛋白与功能结构域之间的接头,所述接头任选地包括GlySer接头。
在某些实施方案中,所述死gRNA的至少一个环未通过插入与两个或更多个衔接子蛋白结合的不同RNA序列进行修饰。
在某些实施方案中,与衔接子蛋白缔合的一个或多个功能结构域是转录激活结构域。
在某些实施方案中,与衔接子蛋白缔合的一个或多个功能结构域是包含VP64、p65、MyoD1、HSF1、RTA或SET7/9的转录激活结构域。
在某些实施方案中,与衔接子蛋白缔合的一个或多个功能结构域是转录阻遏子结构域。
在某些实施方案中,所述转录阻遏子结构域是KRAB结构域。
在某些实施方案中,所述转录阻遏子结构域是NuE结构域、NcoR结构域、SID结构域或SID4X结构域。
在某些实施方案中,与衔接子蛋白缔合的一个或多个功能结构域中的至少一者具有一种或多种活性,包括甲基化酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、DNA整合活性、RNA切割活性、DNA切割活性或核酸结合活性。
在某些实施方案中,DNA切割活性是由于Fok1核酸酶。
在某些实施方案中,死gRNA经修饰,以使得在死gRNA结合衔接子蛋白并进一步结合C2c1和靶标之后,功能结构域处于空间定向中,从而允许功能结构域以其赋予的功能起作用。
在某些实施方案中,死gRNA的至少一个环是四环和/或环2。在某些实施方案中,通过插入不同的RNA序列来修饰死gRNA的四环和环2。
在某些实施方案中,与一个或多个衔接子蛋白结合的不同RNA序列的插入是适体序列。在某些实施方案中,所述适体序列是对相同的衔接子蛋白具特异性的两个或更多个适体序列。在某些实施方案中,所述适体序列是对不同的衔接子蛋白具特异性的两个或更多个适体序列。
在某些实施方案中,所述衔接子蛋白包括MS2、PP7、Qβ、F2、GA、fr、JP501、M12、R17、BZ13、JP34、JP500、KU1、M11、MX1、TW18、VK、SP、FI、ID2、NL95、TW19、AP205、φCb5、φCb8r、φCb12r、φCb23r、7s、PRR1。
在某些实施方案中,所述细胞是真核细胞。在某些实施方案中,所述真核细胞是哺乳动物细胞,任选地是小鼠细胞。在某些实施方案中,所述哺乳动物细胞是人类细胞。
在某些实施方案中,第一衔接子蛋白与p65结构域相缔合,而第二衔接子蛋白与HSF1结构域相缔合。
在某些实施方案中,所述组合物包含具有至少三个功能结构域的C2c1CRISPR-Cas复合物,所述功能结构域中的至少一者与C2c1相缔合并且其中至少两者与死gRNA相缔合。
在某些实施方案中,所述组合物还包含第二gRNA,其中所述第二gRNA是能够与第二靶序列杂交的活gRNA,使得第二C2c1 CRISPR-Cas系统被引导至细胞中的目标第二基因组基因座,在所述第二基因组基因座处具有由系统的C2c1酶的核酸酶活性产生的可检测插入/缺失活性。
在某些实施方案中,所述组合物还包含多个死gRNA和/或多个活gRNA。
本发明的一个方面是利用gRNA支架的模块性和可定制性来建立一系列具有不同结合位点(特别是适体)的gRNA支架,用于以正交方式募集不同类型的效应子。此外,作为示例和更广泛概念的说明,可用与PP7相互作用的茎环代替MS2茎环来结合/募集阻遏元件,从而实现多重双向转录控制。因此,通常,可使用包含死指导物的gRNA来提供多重转录控制和优选的双向转录控制。这种转录控制是基因中最优选的。例如,可将一种或多种包含死指导物的gRNA用于靶向一种或多种靶基因的激活。同时,可将包含死指导物的一种或多种gRNA用于靶向一种或多种靶基因的阻遏。这样的序列可以各种不同的组合应用,例如首先阻遏靶基因,然后在适当的时期激活其他靶标,或者在激活选择基因的同时阻遏选择基因,接着进一步激活和/或阻遏。结果,一个或多个生物系统的多个组分可有利地一起处理。
在一个方面,本发明提供了编码如本文所述的死gRNA或C2c1CRISPR-Cas复合物或组合物的核酸分子。
在一个方面,本发明提供了一种载体系统,所述载体系统包含:编码如本文所定义的死指导RNA的核酸分子。在某些实施方案中,所述载体系统还包含编码C2c1的核酸分子。在某些实施方案中,所述载体系统还包含编码(活)gRNA的核酸分子。在某些实施方案中,所述核酸分子或所述载体还包含在真核细胞中可操作的调控元件,其可操作地连接至编码指导序列(gRNA)的核酸分子和/或编码C2c1的核酸分子和/或任选的核定位序列。
在另一方面,结构分析也可用于研究死指导物与活性C2c1核酸酶之间的相互作用,所述相互作用使得能够进行DNA结合而不进行DNA切割。以这种方式确定对于C2c1的核酸酶活性重要的氨基酸。此类氨基酸的修饰允许改善用于基因编辑的C2c1酶。
另一方面是将如本文所说明的死指导物的使用与如本文所说明以及本领域已知的CRISPR的其他应用相结合。例如,如本文所说明,可将包含用于靶向多重基因激活或阻遏或靶向多重双向基因激活/阻遏的死指导物的gRNA与包含维持核酸酶活性的指导物的gRNA组合。这样的包含维持核酸酶活性的指导物的gRNA可以或可以不进一步包含允许阻遏基因活性的修饰(例如适体)。这样的包含维持核酸酶活性的指导物的gRNA可以或可以不进一步包含允许激活基因活性的修饰(例如适体)。以这种方式,引入了用于多重基因控制的另一种手段(例如,不具有核酸酶活性/不具有插入/缺失活性的多重基因靶向激活可与具有核酸酶活性的基因靶向阻遏同时或组合提供)。
例如,1)使用一个或多个(例如1-50个、1-40个、1-30个、1-20个、优选1-10个、更优选1-5个)包含靶向一种或多种基因并用适当的适体进一步修饰以募集基因激活子的死指导物的gRNA;2)可与一个或多个(例如1-50个、1-40个、1-30个、1-20个、优选1-10个、更优选1-5个)包含靶向一种或多种基因并用适当的适体进一步修饰以募集基因阻遏子的死指导物的gRNA组合。然后可将1)和/或2)与3)一个或多个(例如1-50个、1-40个、1-30个、1-20个、优选1-10个、更优选1-5个)靶向一种或多种基因的gRNA组合。然后可依次用1)+2)+3)与4)一个或多个(例如1-50个、1-40个、1-30个、1-20个、优选1-10个、更优选1-5个)靶向一种或多种基因并用适当的适体进一步修饰以募集基因激活子的gRNA,来实施这个组合。然后可依次1)+2)+3)+4)与5)一个或多个(例如1-50个、1-40个、1-30个、1-20个、优选1-10个、更优选1-5个)靶向一种或多种基因并用适当的适体进一步修饰以募集基因阻遏子的gRNA,来实施这个组合。结果,本发明包括各种用途和组合。例如,组合1)+2);组合1)+3);组合2)+3);组合1)+2)+3);组合1)+2)+3)+4);组合1)+3)+4);组合2)+3)+4);组合1)+2)+4);组合1)+2)+3)+4)+5);组合1)+3)+4)+5);组合2)+3)+4)+5);组合1)+2)+4)+5);组合1)+2)+3)+5);组合1)+3)+5);组合2)+3)+5);组合1)+2)+5)。
在一个方面,本发明提供了一种用于设计、评价或选择用于将C2c1CRISPR-Cas系统引导至靶基因座的死指导RNA靶向序列(死指导序列)的算法。特别地,已经确定了死指导RNA特异性与以下有关并且可通过改变以下来优化:i)GC含量和ii)靶向序列长度。在一个方面,本发明提供了一种用于设计或评价死指导RNA靶向序列的算法,该算法使死指导RNA的脱靶结合或相互作用最小化。在本发明的一个实施方案中,用于选择用于将CRISPR系统引导至生物体中的基因座的死指导RNA靶向序列的算法包括:a)在基因座中定位一个或多个CRISPR基序;分析每个CRISPR基序下游的20nt序列,所述分析是通过i)确定序列的GC含量;和ii)确定在生物体基因组中最接近CRISPR基序的15个下游核苷酸是否存在脱靶匹配,以及c)如果所述序列的GC含量为70%或更少并且未鉴定出脱靶匹配,则选择所述15个核苷酸序列用于死指导RNA。在一个实施方案中,如果GC含量为60%或更少,则选择所述序列作为靶向序列。在某些实施方案中,如果GC含量为55%或更少、50%或更少、45%或更少、40%或更少、35%或更少、或30%或更少,则选择所述序列作为靶向序列。在一个实施方案中,分析基因座的两个或更多个序列,并选择具有最低GC含量、或次最低GC含量、或次最低GC含量的序列。在一个实施方案中,如果在生物体的基因组中未鉴定出脱靶匹配,则选择所述序列作为靶向序列。在一个实施方案中,如果在基因组的调控序列中未鉴定出脱靶匹配,则选择靶向序列。
在一个方面,本发明提供了一种选择死指导RNA靶向序列以将官能化的CRISPR系统引导至生物体中的基因座的方法,所述方法包括:a)在基因座中定位一个或多个CRISPR基序;b)分析每个CRISPR基序下游的20nt序列,所述分析是通过:i)确定序列的GC含量;和ii)确定生物体基因组中的所述序列的前15nt是否存在脱靶匹配;c)如果所述序列的GC含量为70%或更少并且未鉴定出脱靶匹配,则选择所述序列用于指导RNA。在一个实施方案中,如果GC含量为50%或更少,则选择所述序列。在一个实施方案中,如果GC含量为40%或更少,则选择所述序列。在一个实施方案中,如果GC含量为30%或更少,则选择所述序列。在一个实施方案中,分析两个或更多个序列,并选择具有最低GC含量的序列。在一个实施方案中,脱靶匹配是在生物体的调控序列中确定的。在一个实施方案中,基因座是调控区。一个方面提供了包含根据前述方法选择的靶向序列的死指导RNA。
在一个方面,本发明提供了用于将官能化的CRISPR系统靶向生物体中的基因座的死指导RNA。在本发明的一个实施方案中,死指导RNA包含靶向序列,其中靶序列的CG含量为70%或更少,并且所述靶向序列的前15nt与生物体中另一个基因座的调控序列中的CRISPR基序下游的脱靶序列不匹配。在某些实施方案中,靶向序列的GC含量为60%或更少、55%或更少、50%或更少、45%或更少、40%或更少、35%或更少或30%或更少。在某些实施方案中,靶向序列的GC含量为70%至60%或60%至50%或50%至40%或40%至30%。在一个实施方案中,在基因座的潜在靶向序列中,所述靶向序列具有最低的CG含量。
在本发明的一个实施方案中,死指导物的前15nt与靶序列匹配。在另一个实施方案中,死指导物的前14nt与靶序列匹配。在另一个实施方案中,死指导物的前13nt与靶序列匹配。在另一个实施方案中,死指导物的前12nt与靶序列匹配。在另一个实施方案中,死指导物的前11nt与靶序列匹配。在另一个实施方案中,死指导物的前10nt与靶序列匹配。在本发明的一个实施方案中,死指导物的前15nt与另一个基因座的调控区域中的CRISPR基序下游的脱靶序列不匹配。在其他实施方案中,死指导物的前14nt或前13nt,或指导物的前12nt,或死指导物的前11nt,或死指导物的前10nt,与另一个基因座的调控区域中的CRISPR序列下游的脱靶序列不匹配。在其他实施方案中,死指导物的前15nt或14nt或13nt或12nt或11nt与基因组中CRISPR基序下游的脱靶序列不匹配。
在某些实施方案中,死指导RNA在3'端包括与靶序列不匹配的其他核苷酸。因此,包含CRISPR基序下游的前15nt或14nt或13nt或12nt或11nt的死指导RNA可在3'端将长度延伸至12nt、13nt、14nt、15nt、16nt、17nt、18nt、19nt、20nt或更长。
本发明提供了用于将C2c1 CRISPR-Cas系统(包括但不限于死C2c1(dC2c1)或官能化的C2c1系统(其可包含官能化的C2c1或官能化的指导物))引导至基因座的方法。在一个方面,本发明提供了一种选择死指导RNA靶向序列并将官能化的CRISPR系统引导至生物体中的基因座的方法。在一个方面,本发明提供了一种通过官能化的C2c1 CRISPR-Cas系统选择死指导RNA靶向序列并实现靶基因座的基因调控的方法。在某些实施方案中,所述方法用于在最小化脱靶效应的同时实现靶基因调控。在一个方面,本发明提供了一种通过官能化的C2c1 CRISPR-Cas系统选择两个或更多个死指导RNA靶向序列并实现两个或更多个靶基因座的基因调控的方法。在某些实施方案中,所述方法用于在最小化脱靶效应的同时实现两个或更多个靶基因座的调控。
在一个方面,本发明提供了一种选择死指导RNA靶向序列以将官能化的C2c1引导至生物体中的基因座的方法,所述方法包括:a)在所述基因座中定位一个或多个CRISPR基序;b)分析每个CRISPR基序下游的序列,所述分析是通过:i)选择与CRISPR基序相邻的10至15nt,ii)确定所述序列的GC含量;以及c)如果所述序列的GC含量为40%或更高,则选择所述10至15nt序列作为靶向序列以用于指导RNA。在一个实施方案中,如果GC含量为50%或更高,则选择所述序列。在一个实施方案中,如果GC含量为60%或更高,则选择所述序列。在一个实施方案中,如果GC含量为70%或更高,则选择所述序列。在一个实施方案中,分析两个或更多个序列,并选择具有最高GC含量的序列。在一个实施方案中,所述方法还包括将与CRISPR基序下游的序列不匹配的核苷酸添加到所选序列的3'端。一个方面提供了包含根据前述方法选择的靶向序列的死指导RNA。
在一个方面,本发明提供了用于将官能化的CRISPR系统引导至生物体中的基因座的死指导RNA,其中所述死指导RNA的靶向序列由与所述基因座的CRISPR基序相邻的10至15个核苷酸组成,其中所述靶序列的CG含量为50%或更高。在某些实施方案中,死指导RNA还包含添加到靶向序列的3'端的核苷酸,其与基因座的CRISPR基序下游的序列不匹配。
在一个方面,本发明提供了针对一个或多个、或两个或更多个基因座的单个效应子。在某些实施方案中,效应子与C2c1相关,并且一个或多个、或两个或更多个选定的死指导RNA被用于将C2c1相关的效应子引导至一个或多个、或两个或更多个选定的靶基因座。在某些实施方案中,效应子与一个或多个、或两个或更多个选定的死指导RNA相缔合,当与C2c1酶复合时,每个选定的死指导RNA均使其相缔合的效应子定位于死指导RNA靶标上。这类CRISPR系统的一个非限制性实例调节一个或多个、或两个或更多个基因座的活性,所述基因座受同一转录因子的调控。
在一个方面,本发明提供了针对一个或多个基因座的两个或更多个效应子。在某些实施方案中,使用两个或更多个死指导RNA,两个或更多个效应子中的每一者与选定的死指导RNA相缔合,两个或更多个效应子中的每一者均定位于其死指导RNA的选定靶标。这种CRISPR系统的一个非限制性实例调节一个或多个、或两个或更多个基因座的活性,所述基因座受到不同转录因子的调控。因此,在一个非限制性实施方案中,两个或更多个转录因子定位于单个基因的不同调控序列上。在另一个非限制性实施方案中,两个或更多个转录因子定位于不同基因的不同调控序列上。在某些实施方案中,一个转录因子是激活剂。在某些实施方案中,一个转录因子是抑制剂。在某些实施方案中,一个转录因子是激活剂,而另一转录因子是抑制剂。在某些实施方案中,表达相同调控通路的不同组分的基因座被调控。在某些实施方案中,表达不同调控通路的不同组分的基因座被调控。
在一个方面,本发明还提供了用于设计和选择特异性针对由活性C2c1CRISPR-Cas系统介导的靶DNA切割或靶结合和基因调控的死指导RNA的方法和算法。在某些实施方案中,C2c1 CRISPR-Cas系统使用活性C2c1提供正交基因控制,所述活性C2c1在一个基因座处切割靶DNA,而同时结合并促进另一基因座的调控。
在一个方面,本发明提供了一种选择死指导RNA靶向序列的方法,所述死指导RNA靶向序列用于将官能化的Cas12b引导至生物体中的基因座而不进行切割。在某些实施方案中,所述方法包括:a)在基因座中定位一个或多个CRISPR基序;b)分析每个CRISPR基序的下游序列,所述分析是通过i)选择与CRISPR基序相邻的10至15nt,ii)确定序列的GC含量,以及c)如果序列的GC含量为30%或更多、40%或更多,则选择所述10至15nt序列作为用于死指导RNA中的靶向序列。在某些实施方案中,靶向序列的GC含量为35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、或70%或更多。在某些实施方案中,靶向序列的GC含量为30%至40%或40%至50%或50%至60%或60%至70%。在本发明的一个实施方案中,分析基因座中的两个或更多个序列,并选择具有最高GC含量的序列。
在本发明的一个实施方案中,靶向序列中评价GC含量的部分是最接近于PAM的15个靶核苷酸中的10至15个连续核苷酸。在本发明的一个实施方案中,指导物中考虑GC含量的部分是最接近于PAM的15个核苷酸中的10至11个核苷酸或11至12个核苷酸或12至13个核苷酸或13或14或15个连续核苷酸。
在一个方面,本发明还提供了一种用于鉴定死指导RNA的算法,所述死指导RNA可促进CRISPR系统基因座的切割,同时避免功能性激活或抑制。已观察到,死指导RNA中16至20个核苷酸的GC含量增加与DNA切割增加和功能激活减少相一致。
通过在指导RNA的3'端添加与CRISPR基序下游的靶序列不匹配的核苷酸,可提高官能化Cas12b的效率。例如,对于长度为11至15nt的死指导RNA,较短的指导物可能不太可能促进靶标切割,但是在促进CRISPR系统结合和功能控制时效率也较低。在某些实施方案中,将与靶序列不匹配的核苷酸添加到死指导RNA的3'端可增加激活效率,而不会增加不需要的靶标切割。在一个方面,本发明还提供了用于鉴定改进的死指导RNA的方法和算法,所述死指导RNA有效地促进DNA结合和基因调控中的CRISPRP系统功能,而不促进DNA切割。因此,在某些实施方案中,本发明提供了死指导RNA,其包含CRISPR基序下游的前15nt或14nt或13nt或12nt或11nt,并且在3'端通过与靶标错配的核苷酸将长度延伸至12nt、13nt、14nt、15nt、16nt、17nt、18nt、19nt、20nt或更长。
在一个方面,本发明提供了一种用于实现选择性正交基因控制的方法。从本文的公开内容中可理解,考虑到指导物长度和GC含量,根据本发明的死指导物选择通过功能性Cas12b CRISPR-Cas系统提供了有效和选择性的转录控制,例如通过激活或抑制来调控基因座的转录并使脱靶效应最小化。因此,通过提供单个靶基因座的有效调控,本发明还提供了两个或更多个靶基因座的有效正交调控。
在某些实施方案中,正交基因控制是通过激活或抑制两个或更多个靶基因座。在某些实施方案中,正交基因控制是通过激活或抑制一个或多个靶基因座和切割一个或多个靶基因座。
在一个方面,本发明提供了包含非天然存在的Cas12b CRISPR-Cas系统的细胞,所述Cas12b CRISPR-Cas系统包含根据本文描述的方法或算法公开或制备的一个或多个死指导RNA,其中一种或多种基因产物的表达已经改变。在本发明的一个实施方案中,两种或更多种基因产物在细胞中的表达已经改变。本发明还提供了来自这种细胞的细胞系。
在一个方面,本发明提供了一种多细胞生物体,其包含一个或多个细胞,所述细胞包含非天然存在的Cas12b CRISPR-Cas系统,所述系统包含一个或多个根据本文所述的方法或算法公开或制备的死指导RNA。在一个方面,本发明提供了来自细胞、细胞系或多细胞生物体的产物,其包含非天然存在的Cas12b CRISPR-Cas系统,所述系统包含一个或多个根据本文所述的方法或算法公开或制备的死指导RNA。
本发明的另一方面是包含如本文所述的死指导物的gRNA的用途,任选地与包含如本文所述或现有技术的指导物的gRNA组合,与被工程化以用于Cas12b的过表达或优选敲入Cas12b的系统(例如细胞、转基因动物、转基因小鼠、诱导型转基因动物、诱导型转基因小鼠)组合。结果,单个系统(例如转基因动物、细胞)可用作系统/网络生物学中多重基因修饰的基础。由于所述死指导物,现在这在体外、离体和体内都是可能的。
例如,一旦提供了Cas12b,就可提供一个或多个死gRNA来指导多重基因调控,并且优选地多重双向基因调控。如果需要或期望的话,可以在空间上和时间上适当的方式提供一个或多个死gRNA(例如,Cas12b表达的组织特异性诱导)。由于在目标细胞、组织、动物中提供(例如表达)了转基因/诱导型Cas12b,因此包含死指导物的gRNA或包含指导物的gRNA都同样有效。以相同的方式,本发明的另一方面是包含如本文所述的死指导物的gRNA的用途,任选地与包含如本文所述或现有技术的指导物的gRNA组合,与被工程化以敲除Cas12bCRISPR-Cas的系统(例如细胞、转基因动物、转基因小鼠、诱导型转基因动物、诱导型转基因小鼠)组合。
因此,如本文所述的死指导物与本文所述的CRISPR应用和本领域已知的CRISPR应用的组合产生了用于系统的多重筛选(例如网络生物学)的高效且准确的手段。这种筛选允许例如鉴定基因活性的特定组合,以鉴定引起疾病的基因(例如开/关组合),特别是与基因相关的疾病。这种筛选的优选应用是癌症。以相同的方式,本发明包括对这些疾病的治疗的筛选。细胞或动物可能会暴露在异常条件下,从而导致疾病或类似疾病的影响。可提供候选组合物,并在所需的多重环境中筛选效果。例如,可筛选患者的癌细胞中哪些基因组合会导致它们死亡,然后使用这种信息来建立适当的疗法。
在一个方面,本发明提供了一种试剂盒,所述试剂盒包含本文所述的一种或多种组分。所述试剂盒可包括如本文所述的死指导物,带有或不带有如本文所述的指导物。
本文提供的结构信息允许质询死gRNA与靶DNA的相互作用,并且Cas12b允许对死gRNA结构进行工程化或改变以优化整个Cas12bCRISPR-Cas系统的功能性。例如,可通过插入可结合RNA的衔接子蛋白来延长死gRNA的环,而不会与Cas12b蛋白发生碰撞。这些衔接子蛋白可进一步募集包含一个或多个功能结构域的效应蛋白或融合物。
在一些优选的实施方案中,功能结构域是转录激活结构域,优选VP64。在一些实施方案中,功能结构域是转录阻遏结构域,优选KRAB。在一些实施方案中,转录阻遏结构域是SID或SID的多联体(例如SID4X)。在一些实施方案中,功能结构域是表观遗传修饰结构域,使得提供了表观遗传修饰酶。在一些实施方案中,功能结构域是激活结构域,其可以是P65激活结构域。在一些实施方案中,Cas12b效应蛋白与一个或多个功能性结构域相缔合;并且Cas12b效应蛋白在RuvC和/或Nuc结构域内含有一个或多个突变,由此形成的CRISPR复合物能够递送表观遗传修饰子或者转录或翻译激活或阻遏信号。
本发明的一个方面是上述元件包含在单一组合物中或包含在单独的组合物中。这些组合物可有利地应用于宿主以在基因组水平上引发功能作用。
通常,以提供包含要结合的一个或多个功能结构域(例如经由融合蛋白)的衔接子蛋白的特异性结合位点(例如适体)的方式来修饰死gRNA。修饰的死gRNA被修饰,以使得一旦死gRNA形成CRISPR复合物(即Cas12b结合于死gRNA和靶标),就会结合衔接子蛋白,并且衔接子蛋白上的功能结构域会以空间定向定位,这有利于所赋予的功能有效。例如,如果功能结构域是转录激活子(例如VP64或p65),则将转录激活子置于空间定向中,以使其能够影响靶标的转录。同样,转录阻遏子将有利地定位以影响靶标的转录,并且核酸酶(例如Fok1)将有利地定位以切割或部分切割靶标。
技术人员将理解,对死gRNA的修饰是非预期的修饰,其允许衔接子+功能结构域的结合但不能正确定位衔接子+功能结构域(例如由于CRISPR复合物的三维结构内的空间位阻)。
如本文所说明,功能结构域可以是例如来自由以下组成的组的一个或多个结构域:甲基化酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、RNA切割活性、DNA切割活性、核酸结合活性和分子开关(例如光诱导型)。在某些情况下,有利的是,另外提供至少一个NLS。在某些情况下,将NLS安置在N末端是有利的。当包括多于一个功能结构域时,所述功能结构域可以相同或不同。
可将死gRNA设计为包括对相同或不同的衔接子蛋白具有特异性的多个结合识别位点(例如适体)。可将死gRNA设计为与转录起始位点(即TSS)上游的启动子区域-1000-+1核酸结合,优选与-200核酸结合。这种定位改善了影响基因激活(例如转录激活子)或基因抑制(例如转录阻遏子)的功能结构域。修饰的死gRNA可以是组合物中包含的靶向一个或多个靶基因座的一个或多个修饰的死gRNA(例如至少1个gRNA、至少2个gRNA、至少5个gRNA、至少10个gRNA、至少20个gRNA、至少30个gRNA、至少50个gRNA)。
衔接子蛋白可以是与引入修饰的死gRNA中的适体或识别位点结合并且允许一个或多个功能结构域的适当定位,一旦死gRNA已并入CRISPR复合物中就可影响具有赋予功能的靶标的任何数量的蛋白质。如在本申请中详细说明的,所述蛋白可以是外壳蛋白,优选噬菌体外壳蛋白。与这样的衔接子蛋白相缔合的功能结构域(例如,以融合蛋白的形式)可包括例如来自由以下组成的组的一个或多个结构域:甲基化酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、RNA切割活性、DNA切割活性、核酸结合活性和分子开关(例如光诱导型)。优选的结构域是Fok1、VP64、P65、HSF1、MyoD1。在功能结构域是转录激活子或转录阻遏子的情况下,有利的是,另外提供至少一个NLS,并且优选在N末端。当包括多于一个功能结构域时,所述功能结构域可以相同或不同。衔接子蛋白可利用已知的接头来附接此类功能结构域。
因此,修饰的死gRNA、(灭活的)Cas12b(具有或不具有功能结构域)和具有一个或多个功能结构域的结合蛋白可各自单独地包含在组合物中并单独或共同施用于宿主。或者,这些组分可以单一组合物的形式提供以施用于宿主。可经由技术人员已知的或本文描述的用于递送至宿主的病毒载体(例如慢病毒载体、腺病毒载体、AAV载体)进行对宿主的施用。如本文所说明,使用不同的选择标志物(例如用于慢病毒gRNA选择)和gRNA的浓度(例如取决于是否使用多个gRNA)可能有利于引起改善的效果。
基于此概念,若干变异适于引发基因组基因座事件,包括DNA切割、基因激活或基因减活。使用提供的组合物,本领域技术人员可有利地和特异性地靶向具有相同或不同功能结构域的单个或多个基因座,以引发一个或多个基因组基因座事件。所述组合物可用于广泛多种方法中,用于在细胞中的文库中筛选和体内功能性建模(例如,lincRNA的基因激活和功能鉴定;功能获得建模;功能丧失建模;使用本发明的组合物来建立用于优化和筛选目的的细胞系和转基因动物)。
本发明包括本发明的组合物用于建立和利用条件性或可诱导的CRISPR转基因细胞/动物的用途,这在本发明或申请之前不是公认的。例如,靶细胞条件性地或诱导性地(例如,以Cre依赖性构建体的形式)包含Cas12b和/或条件性地或诱导性地包含衔接子蛋白,并且在引入到靶细胞中的载体表达时,所述载体表达可在靶细胞中诱导或产生Cas12b表达和/或衔接子表达的条件者。通过用产生CRISPR复合物的已知方法应用本发明的教导和组合物,受功能结构域影响的可诱导基因组事件也是本发明的一个方面。其一个实例是产生CRISPR敲入/条件性转基因动物(例如,包含例如Lox-Stop-polyA-Lox(LSL)盒的小鼠),随后递送一种或多种组合物,所述组合物提供一个或多个如本文所述的修饰的死gRNA(例如,出于基因激活目的,目标靶基因的-200核苷酸至TSS)(例如带有一个或多个被外壳蛋白(例如MS2)识别的适体的修饰的死gRNA),如本文所述的一个或多个衔接子蛋白(与一个或多个VP64连接的MS2结合蛋白)和用于诱导条件性动物的手段(例如,使Cas12b表达可诱导的Cre重组酶)。或者,衔接子蛋白可与条件性或诱导型Cas12b一起作为条件性或诱导型元件提供,以提供用于筛选目的的有效模型,其有利地仅需要最少的设计和特定死gRNA的施用即可用于广泛的应用。
在另一方面,死指导物被进一步修饰以提高特异性。可合成受保护的死指导物,从而将二级结构引入死指导物的3'端以提高其特异性。受保护的指导RNA(pgRNA)包含能够与细胞中目标基因组基因座中的靶序列杂交的指导序列和保护链,其中所述保护链任选地与所述指导序列互补,并且其中所述指导序列可部分地与保护链杂交。pgRNA任选地包括延伸序列。pgRNA-靶DNA杂交的热力学由指导RNA和靶DNA之间互补的碱基数决定。通过采用“热力学保护”,可通过添加保护序列来提高死gRNA的特异性。例如,一种方法在死gRNA内的指导序列的3'端添加了不同长度的互补保护链。结果,保护链与死gRNA的至少一部分结合,并提供了受保护的gRNA(pgRNA)。继而,使用所述的实施方案可容易地保护本文中的死gRNA参考,从而产生pgRNA。保护链可以是单独的RNA转录物或链或接合到死gRNA指导序列的3'端的嵌合形式。
本发明人已经表明,如本文所定义的CRISPR酶可采用一种以上的RNA指导而不丧失活性。这使得如本文所定义的CRISPR酶、系统或复合物能够与如本文所定义的单个酶、系统或复合物一起用于靶向多个DNA靶标、基因或基因座。指导RNA可串联排列,任选地被核苷酸序列例如如本文所定义的正向重复序列分开。不同的指导RNA的位置是串联而不影响活性。
多重CRISPR-Cas系统
在一个方面,本发明提供了非天然存在的或工程化的CRISPR酶,优选地如本文所述的2类CRISPR酶,优选地V或VI型CRISPR酶,例如但不限于如本文其他地方所述的Cas12b,用于串联或多重靶向。应当理解,如本文其他地方所述的根据本发明的任何CRISPR(或CRISPR-Cas或Cas)酶、复合物或系统均可用于这种方法。如本文其他地方所述的任何方法、产品、组合物和用途均可与下文进一步详述的多重或串联靶向方法同样适用。通过进一步的指导,提供了以下特定方面和实施方案。
在一个方面,本发明提供了如本文所定义的Cas12b酶、复合物或系统用于靶向多个基因座的用途。在一个实施方案中,这可通过使用多个(串联或多重)指导RNA(gRNA)序列来建立。
在一个方面,本发明提供了使用如本文定义的Cas12b酶、复合物或系统的一个或多个元件进行串联或多重靶向的方法,其中所述CRISP系统包含多个指导RNA序列。优选地,所述gRNA序列被核苷酸序列如本文其他地方所定义的正向重复序列隔开。
如本文定义的Cas12b酶、系统或复合物提供了对多个靶多核苷酸进行修饰的有效手段。如本文定义的Cas12b酶、系统或复合物具有广泛多种效用,包括在多种细胞类型中修饰(例如,缺失、插入、转运、失活、激活)一种或多种靶多核苷酸。因而,本发明的如本文所定义的Cas12b酶、系统或复合物在例如基因治疗、药物筛选、疾病诊断和预后中具有广泛的应用,包括在单个CRISPR系统内靶向多个基因座。
在一个方面,本发明提供了如本文所定义的Cas12b酶、系统或复合物,即具有Cas12b蛋白的Cas12b CRISPR-Cas复合物,所述Cas12b蛋白具有与其相缔合的至少一个去稳定结构域,以及靶向多个核酸分子如DNA分子的多个指导RNA,由此所述多个指导RNA中的每一者特异性地靶向其相应的核酸分子,例如DNA分子。每个核酸分子靶标例如DNA分子可编码基因产物或涵盖基因座。因此,使用多个指导RNA使得能够靶向多个基因座或多个基因。在一些实施方案中,Cas12b酶可切割编码基因产物的DNA分子。在一些实施方案中,基因产物的表达被改变。Cas12b蛋白和指导RNA不能天然地一起存在。本发明包括包含串联排列的指导序列的指导RNA。本发明还包括Cas12b蛋白的编码序列,所述Cas12b蛋白被密码子优化以在真核细胞中表达。在一个优选的实施方案中,真核细胞是哺乳动物细胞、植物细胞或酵母细胞,并且在一个更优选的实施方案中,哺乳动物细胞是人类细胞。基因产物的表达可能降低。Cas12b酶可形成CRISPR系统或复合物的一部分,所述CRISPR系统或复合物还包含串联排列的指导RNA(gRNA),所述指导RNA包含一系列2、3、4、5、6、7、8、9、10、15、25、25、30或30个以上的指导序列,每个能够与细胞中目标基因组基因座中的靶序列特异性杂交。在一些实施方案中,功能性Cas12b CRISPR系统或复合物与多个靶序列结合。在一些实施方案中,功能性CRISPR系统或复合物可编辑多个靶序列,例如,所述靶序列可包含基因组基因座,并且在一些实施方案中,可存在基因表达的改变。在一些实施方案中,功能性CRISPR系统或复合物可包含其他功能结构域。在一些实施方案中,本发明提供了用于改变或修饰多种基因产物的表达的方法。所述方法可包括引入含有所述靶核酸例如DNA分子或含有并表达靶核酸例如DNA分子的细胞中;例如,靶核酸可编码基因产物或提供基因产物(例如调控序列)的表达。
在优选的实施方案中,用于多重靶向的CRISPR酶是Cas12b,或者CRISPR系统或复合物包含Cas12b。在一些实施方案中,用于多重靶向的Cas12b酶切割DNA的两条链以产生双链断裂(DSB)。在一些实施方案中,用于多重靶向的CRISPR酶是切口酶。在一些实施方案中,用于多重靶向的Cas12b酶是双重切口酶。在一些实施方案中,用于多重靶向的Cas12b酶是Cas12b酶,例如如本文其他地方所定义的DD Cas12b酶。
在一些一般性实施方案中,用于多重靶向的Cas12b酶与一个或多个功能结构域相缔合。在一些更具体的实施方案中,用于多重靶向的CRISPR酶是如本文其他地方所定义的死Cas12b。
在一个方面,本发明提供了用于递送Cas12b酶、系统或复合物以用于如本文所定义的多重靶向或本文所定义的多核苷酸的手段。这种递送手段的非限制性实例是例如递送包含本文所讨论的多核苷酸(例如,编码CRISPR酶,提供编码CRISPR复合物的核苷酸)的复合物、载体的组分的粒子。在一些实施方案中,载体可以是质粒或病毒载体如AAV或慢病毒。用质粒瞬时转染,例如转染至HEK细胞中可能是有利的,特别是考虑到AAV的大小限制,并且尽管Cas12b适合AAV,但是用另外的指导RNA可达到上限。
还提供了组成性表达如本文所用的Cas12b酶、复合物或系统的模型,用于多重靶向。生物体可以是转基因的,并且可能已经用本发明的载体转染,或者可以是如此转染的生物体的后代。在另一方面,本发明提供了包含如本文所定义的CRISPR酶、系统和复合物或本文描述的多核苷酸或载体的组合物。还提供了Cas12b CRISPR系统或复合物,其包含多个指导RNA,优选地以串联排列的形式。所述不同的指导RNA可被核苷酸序列例如正向重复序列隔开。
还提供了一种治疗受试者,例如有需要的受试者的方法,所述方法包括通过用编码Cas12b CRISPR系统或复合物的多核苷酸或本文所述的任何多核苷酸或载体转化所述受试者并将其施用于所述受试者来诱导基因编辑。也可提供合适的修复模板,例如通过包含所述修复模板的载体递送。还提供了一种治疗受试者,例如有需要的受试者的方法,所述方法包括通过用本文所述的多核苷酸或载体转化所述受试者来诱导多个靶基因座的转录激活或阻遏,其中所述多核苷酸或载体编码或包含含有优选串联排列的多个指导RNA的Cas12b酶、复合物或系统。在离体发生任何治疗的地方,例如在细胞培养物中,则应理解,术语“受试者”可用短语“细胞或细胞培养物”代替。
还提供了包含含有优选串联排列的多个指导RNA的Cas12b酶、复合物或系统或者编码或包含含有优选串联排列的多个指导RNA的所述Cas12b酶、复合物或系统的多核苷酸或载体的组合物,其用于如本文其他地方所定义的治疗方法中。可提供包括此类组合物的多组分试剂盒。还提供了所述组合物在用于这种治疗方法的药物制备中的用途。本发明还提供了Cas12b CRISPR系统在筛选(例如功能获得筛选)中的用途。被人为迫使过表达基因的细胞能够随时间下调基因(重新建立平衡),例如通过负反馈循环。直到筛选时间开始时,未调控的基因可能会再次减少。使用可诱导的Cas12b激活子允许人们在即将筛选之前诱导转录,并因此将假阴性命中概率最小化。因此,通过使用本发明进行筛选,例如功能获得筛选,可将假阴性结果的概率降到最低。
在一个方面,本发明提供了一种工程化的非天然存在的CRISPR系统,所述系统包含Cas12b蛋白和多个指导RNA,其各自特异性地靶向细胞中编码基因产物的DNA分子,从而所述多个指导RNA各自靶向其编码基因产物的特异性DNA分子并且Cas12b蛋白切割编码所述基因产物的靶DNA分子,从而改变基因产物的表达;并且,其中所述CRISPR蛋白质和所述指导RNA不是天然地一起存在。本发明包括包含多个指导序列的多个指导RNA,所述多个指导序列优选被核苷酸序列如正向重复序列隔开并且任选地与tracr序列融合。在本发明的一个实施方案中,CRISPR蛋白是V或VI型CRISPR-Cas蛋白,并且在一个更优选的实施方案中,CRISPR蛋白是Cas12b蛋白。本发明还包括为在真核细胞中表达而进行密码子优化的Cas12b蛋白。在一个优选的实施方案中,真核细胞是哺乳动物细胞,并且在一个更优选的实施方案中,哺乳动物细胞是人类细胞。在本发明的另一个实施方案中,基因产物的表达减少。
修饰靶序列
在某些实施方案中,利用CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列来修饰目标基因座。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。在优选的实施方案中,利用CRISPR-C2c1系统在非分裂细胞中修饰目标基因座,其中经由同源性定向修复(HDR)机制进行基因组编辑特别具有挑战性(Chan等人,Nucleic acidsresearch.2011;39:5955-5966)。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将具有5'突出端的短双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ通路介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于如Meresca等人和He等人所述的方法以用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。参见Zhang等人,Genome Biology201718:35;He等人,Nucleic Acids Research,44:9,2016。
模板
在一些实施方案中,还提供了重组模板。重组模板可以是如本文所述的另一种载体的组分,包含在单独的载体中,或以单独的多核苷酸的形式提供。在一些实施方案中,重组模板被设计为用作同源重组的模板,例如在作为核酸靶向复合物的一部分的核酸靶向效应蛋白切刻或切割的靶序列内或附近。在一些实例中,系统包含重组模板。重组模板可通过同源性定向修复(HDR)而被插入。
在一个实施方案中,模板核酸改变靶位置的序列。在一个实施方案中,模板核酸导致将修饰的或非天然存在的碱基并入靶核酸中。
模板序列可与靶序列经历断裂介导或催化的重组。在一个实施方案中,模板核酸可包含与靶序列上被C2c1介导的切割事件切割的位点相对应的序列。在一个实施方案中,模板核酸可包含与在第一C2c1介导的事件中切割的靶序列上的第一位点和在第二C2c1介导的事件中切割的靶序列上的第二位点两者相对应的序列。
在某些实施方案中,模板核酸可包含导致翻译序列的编码序列改变的序列,例如,导致蛋白质产物中的一个氨基酸替换为另一个氨基酸的序列,例如,将突变体等位基因转化为野生型等位基因,将野生型等位基因转化为突变型等位基因,和/或引入终止密码子,氨基酸残基的插入,氨基酸残基的缺失或无义突变。在某些实施方案中,模板核酸可包含导致非编码序列改变的序列,例如外显子中或5'或3'非翻译或非转录区中的改变。这样的改变包括控制元件例如启动子、增强子的改变,以及顺式作用或反式作用控制元件的改变。
与靶基因中的靶位置具有同源性的模板核酸可用于改变靶序列的结构。模板序列可用于改变不需要的结构,例如不需要的或突变的核苷酸。模板核酸可包含这样的序列,当整合时,所述序列导致:降低阳性对照元件的活性;增加阳性对照元件的活性;降低阴性对照元件的活性;增加阴性对照元件的活性;降低基因的表达;增加基因的表达;增加对病症或疾病的抵抗力;增加对病毒进入的抵抗力;校正赋予、增加、消除或降低基因产物生物学性质的突变或改变不需要的氨基酸残基,例如增加酶的酶促活性,或增加基因产物与另一分子相互作用的能力。
模板核酸可包含导致以下的序列:靶序列的1、2、3、4、5、6、7、8、9、10、11、12个或更多个核苷酸的序列变化。
模板多核苷酸可具有任何合适的长度,例如长度为约或大于约10、15、20、25、50、75、100、150、200、500、1000个或更多个核苷酸。在一个实施方案中,模板核酸的长度可以是20+/-10、30+/-10、40+/-10、50+/-10、60+/-10、70+/-10、80+/-10、90+/-10、100+/-10、110+/-10、120+/-10、130+/-10、140+/-10、150+/-10、160+/-10、170+/-10、180+/-10、190+/-10、200+/-10、210+/-10、220+/-10个核苷酸。在一个实施方案中,模板核酸的长度可以是30+/-20、40+/-20、50+/-20、60+/-20、70+/-20、80+/-20、90+/-20、100+/-20、110+/-20、120+/-20、130+/-20、140+/-20、150+/-20、160+/-20、170+/-20、180+/-20、190+/-20、200+/-20、210+/-20、220+/-20个核苷酸。在一个实施方案中,模板核酸的长度是10至1,000、20至900、30至800、40至700、50至600、50至500、50至400、50至300、50至200或50至100个核苷酸。
在一些实施方案中,模板多核苷酸与包含靶序列的多核苷酸的一部分互补。当最佳比对时,模板多核苷酸可能与靶序列的一个或多个核苷酸重叠(例如,约或大于约1、5、10、15、20、25、30、35、40、45、50、60、70、80、90、100个或更多个核苷酸)。在一些实施方案中,当模板序列和包含靶序列的多核苷酸最佳比对时,模板多核苷酸的最近核苷酸在距靶序列的约1、5、10、15、20、25、50、75、100、200、300、400、500、1000、5000、10000个或更多个核苷酸内。
外源多核苷酸模板包含待整合的序列(例如,突变的基因)。整合序列可以是细胞内源或外源的序列。待整合的序列的实例包括编码蛋白质或非编码RNA(例如微小RNA)的多核苷酸。因此,用于整合的序列可以可操作地连接至适当的一个或多个控制序列。或者,待整合的序列可提供调控功能。
上游或下游序列可包含约20bp至约2500bp,例如约50、100、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400或2500bp。在一些方法中,示例性的上游或下游序列具有约200bp至约2000bp、约600bp至约1000bp,或更特别是约700bp至约1000bp。
上游或下游序列可包含约20bp至约2500bp,例如约50、100、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400或2500bp。在一些方法中,示例性的上游或下游序列具有约200bp至约2000bp、约600bp至约1000bp,或更特别是约700bp至约1000bp。
在某些实施方案中,一个或两个同源臂可缩短以避免包括某些序列重复元件。例如,5'同源臂可缩短以避免序列重复元件。在其他实施方案中,3'同源臂可缩短以避免序列重复元件。在一些实施方案中,5'和3'同源臂两者可缩短以避免包括某些序列重复元件。
在一些方法中,外源多核苷酸模板还可包含标志物。这种标志物可使针对靶向整合的筛选变得容易。合适的标志物的实例包括限制性位点、荧光蛋白或可选择标志物。可使用重组技术来构建本发明的外源多核苷酸模板(参见Sambrook等人,2001和Ausubel等人,1996)。
在某些实施方案中,可设计用于校正突变的模板核酸以用作单链寡核苷酸。当使用单链寡核苷酸时,5'和3'同源臂的长度范围可为至多约200个碱基对(bp),例如长度为至少25、50、75、100、125、150、175或200bp。
Suzuki等人描述了经由CRISPR/Cas9介导的不依赖于同源性的靶向整合进行体内基因组编辑(2016,Nature 540:144-149)。
因此,当提及本文的CRISPR系统时,在一些方面或实施方案中,CRISPR系统包含(i)CRISPR蛋白或编码CRISPR效应蛋白的多核苷酸,以及(ii)一种或多种多核苷酸,所述多核苷酸被工程化以:与CRISPR蛋白复合以形成CRISPR复合物;以及与靶序列复合。
在一些实施方案中,所述治疗剂用于体内或离体递送(或应用或施用)至真核细胞。
在一些实施方案中,CRISPR蛋白是引导在靶序列的位置切割一条或两条链的核酸酶,或者其中CRISPR蛋白是引导在靶序列的位置切割的切口酶。
在一些实施方案中,CRISPR蛋白是与CRISPR-Cas系统RNA多核苷酸序列复合的C2c1蛋白,其中所述多核苷酸序列包括:a)能够与靶HBV序列杂交的指导RNA多核苷酸;以及(b)正向重复RNA多核苷酸。
在一些实施方案中,所述CRISPR蛋白是C2c1,并且所述系统包含:I.CRISPR-Cas系统RNA多核苷酸序列,其中所述多核苷酸序列包括:(a)能够与靶序列杂交的指导RNA多核苷酸,和(b)正向重复RNA多核苷酸,以及II.编码C2c1的多核苷酸序列,其任选地包含至少一个或多个核定位序列,其中所述正向重复序列与所述指导序列杂交并引导CRISPR复合物与靶序列的序列特异性结合,并且其中所述CRISPR复合物包含与以下各物复合的CRISPR蛋白:(1)与靶序列杂交或可杂交的指导序列,和(2)正向重复序列,并且编码CRISPR蛋白的多核苷酸序列为DNA或RNA。
本发明还提供了对细胞中目标基因座进行修饰的方法,所述方法包括使细胞与任何本文所述的工程化的CRISPR酶(例如工程化的Cas效应子模块)、组合物或任何本文所述的系统或载体系统接触,或者其中细胞包含存在于细胞内的任何本文所述的CRISPR复合物。在这样的方法中,细胞可以是原核或真核细胞,优选是真核细胞。在这样的方法中,生物体可包含细胞。在这样的方法中,生物体可能不是人类或其他动物。在某些实施方案中,细胞可包含富含A/T的基因组。在一些实施方案中,细胞基因组包含富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在一个特定的实施方案中,PAM是5'-TTG-3'。在一个特定的实施方案中,细胞是恶性疟原虫(Plasmodium falciparum)细胞。
在一些实施方案中,CRISPR效应蛋白是C2c1蛋白。与Cas9在PAM的近端产生的切割相反,C2c1在PAM的远端产生了双链断裂(Jinek等人,2012;Cong等人,2013)。已提出Cpf1突变的靶序列可能易于被单个gRNA重复切割,因此促进Cpf1在HDR介导的基因组编辑中的应用(Front Plant Sci.2016年11月14日;7:1683)。Cpf1和C2c1都是具有结构相似性的V型CRISPR-Cas蛋白。与Cas9在PAM的近端产生钝切不同,Cpf1和C2c1在PAM的远端产生交错的切口。因此,在某些实施方案中,通过CRISPR-C2c1复合物经由同源性定向修复(HR或HDR)来修饰目标基因座。在某些实施方案中,通过不依赖于HR的CRISPR-C2c1复合物来修饰目标基因座。在某些实施方案中,通过CRISPR-C2c1复合物经由非同源末端连接(NHEJ)来修饰目标基因座。
与Cas9产生的钝端相反,C2c1产生了带有5'突出端的交错切口(Garneau等人,Nature.2010;468:67-71;Gasiunas等人,Proc Natl Acad Sci U S A.2012;109:E2579-2586)。切割产物的这种结构对于促进基于非同源末端连接(NHEJ)的基因插入哺乳动物基因组可能特别有利(Maresca等人,Genome research.2013;23:539-546)。
在某些实施方案中,利用CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列来修饰目标基因座。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。在优选的实施方案中,利用CRISPR-C2c1系统在非分裂细胞中修饰目标基因座,其中经由同源性定向修复(HDR)机制进行基因组编辑特别具有挑战性(Chan等人,Nucleic acidsresearch.2011;39:5955-5966)。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将具有5'突出端的短双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ通路介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于如Meresca等人和He等人所述的方法以用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。参见Zhang等人,Genome Biology201718:35;He等人,Nucleic Acids Research,44:9,2016。
在一些实施方案中,CRISPR蛋白是来自酸土脂环酸芽孢杆菌ATCC49025或热噬淀粉芽孢杆菌菌株B4166的C2c1。
本发明还提供了编码效应蛋白的核苷酸序列,所述效应蛋白被密码子优化以在任何本文所述的方法或组合物中在真核生物或真核细胞中表达。在本发明的一个实施方案中,密码子优化的效应蛋白是本文讨论的任何C2c1,并且针对在真核细胞或生物体(例如,如在本文其他地方提到的这种细胞或生物体,例如但不限于酵母细胞或哺乳动物细胞或生物体,包括小鼠细胞、大鼠细胞和人类细胞或非人类真核生物,例如植物)中的可操作性进行了密码子优化。
在一些实施方案中,CRISPR蛋白还包含一种或多种能够将CRISPR蛋白的积累驱动至生物体细胞核中可检测量的核定位信号(NLS)。
在本发明的某些实施方案中,至少一个核定位信号(NLS)附接至编码C2c1效应蛋白的核酸序列。在优选的实施方案中,附接了至少一个或多个C末端或N末端NLS(因此编码C2c1效应蛋白的核酸分子可包括编码NLS,以使得表达的产物具有附接或连接的NLS)。在一个优选的实施方案中,为了在真核细胞、优选人类细胞中最佳表达和核靶向,附接了C末端NLS。在一个优选的实施方案中,密码子优化的效应蛋白是C2c1,并且指导RNA的间隔子长度是15至35nt。在某些实施方案中,指导RNA的间隔子长度是至少16个核苷酸,例如至少17个核苷酸。在某些实施方案中,间隔子长度是例如15至17nt,17至20nt,20至24nt,例如20、21、22、23或24nt,23至25nt,例如23、24或25nt,24至27nt,27-30nt,30-35nt,或35nt或更长。在本发明的某些实施方案中,密码子优化的效应蛋白是C2c1,并且指导RNA的正向重复序列长度是至少16个核苷酸。在某些实施方案中,密码子优化的效应蛋白是C2c1,并且指导RNA的正向重复序列长度是16至20nt,例如16、17、18、19或20个核苷酸。在某些优选的实施方案中,指导RNA的正向重复序列长度是19个核苷酸。
在一些实施方案中,CRISPR蛋白包含一个或多个突变。
在一些实施方案中,CRISPR蛋白在催化结构域中具有一个或多个突变,并且其中所述蛋白质还包含一个或多个功能结构域。
在一些实施方案中,CRISPR系统包含在递送系统内,任选地:包含一个或多个载体的载体系统,任选地其中所述载体包含一个或多个病毒载体,任选地其中一个或多个病毒载体包含一个或多个慢病毒、腺病毒或腺相关病毒(AAV)载体;或粒子或脂质粒子,任选地其中CRISPR蛋白与多核苷酸复合以形成CRISPR复合物。
在一些实施方案中,所述系统、复合物或蛋白质用于通过操纵目标基因组基因座中的靶序列来修饰生物体或非人类生物体的方法中。
在一些实施方案中,经由脂质体、粒子、细胞穿透肽、外泌体、微囊泡或基因枪递送对编码或提供CRISPR系统的序列进行编码的多核苷酸。在一些实施方案中,包括递送系统。在一些实施方案中,所述递送系统包含:载体系统,其包含一种或多种包含工程化的多核苷酸和编码CRISPR蛋白的多核苷酸的载体,任选地其中所述载体包含一种或多种病毒载体,任选地其中所述一种或多种病毒载体包含一种或多种慢病毒、腺病毒或腺相关病毒(AAV)载体;或者含有CRISPR系统或CRISPR复合物的粒子或脂质粒子。
在一些实施方案中,提供了重组/修复模板。
如本文所述的根据本发明的方法包括在如本文所讨论的真核细胞中(在体外,即在分离的真核细胞中)诱导一个或多个突变,包括将如本文所讨论的载体递送至细胞。突变可包括经由指导RNA或sgRNA在细胞的每个靶序列上引入、缺失或取代一个或多个核苷酸。突变可包括经由指导RNA或sgRNA在所述细胞的每个靶序列处引入、缺失或取代1-75个核苷酸。突变可包括经由指导RNA或sgRNA在所述细胞的每个靶序列处引入、缺失或取代1、5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或75个核苷酸。突变可包括经由指导RNA或sgRNA在所述细胞的每个靶序列处引入、缺失或取代5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或75个核苷酸。突变包括经由指导RNA或sgRNA在所述细胞的每个靶序列处引入、缺失或取代10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或75个核苷酸。突变可包括经由指导RNA或sgRNA在所述细胞的每个靶序列处引入、缺失或取代20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或75个核苷酸。突变可包括经由指导RNA或sgRNA在所述细胞的每个靶序列处引入、缺失或取代40、45、50、75、100、200、300、400或500个核苷酸。
为了使毒性和脱靶效应最小化,控制所递送的Cas mRNA和指导RNA的浓度可能是重要的。可通过在细胞或非人类真核生物动物模型中测试不同的浓度并使用深度测序来分析潜在脱靶基因组基因座的修饰程度来确定Cas mRNA和指导RNA的最佳浓度。或者,为了使毒性水平和脱靶效应最小化,可将Cas切口酶mRNA(例如具有D10A突变的化脓链球菌(S.pyogenes)Cas9)与靶向目标位点的一对指导RNA一起递送。使毒性和脱靶效应最小化的指导序列和策略可如WO 2014/093622(PCT/US2013/074667)中;或经由如本文的突变。
通常,在内源性CRISPR系统的情形下,CRISPR复合物(包含与靶序列杂交并与一个或多个Cas蛋白复合的指导序列)的形成导致一条或两条链在靶序列内部或附近(例如,距靶序列1、2、3、4、5、6、7、8、9、10、20、50个或更多个碱基对内)的切割。不希望受到理论的束缚,tracr序列可包含以下或由以下组成:野生型tracr序列的全部或一部分(例如,野生型tracr序列的约或大于约20、26、32、45、48、54、63、67、85个或更多个核苷酸),所述tracr序列也可形成CRISPR复合物的一部分,例如通过沿着tracr序列的至少一部分与可操作地连接至指导序列的tracr配对序列的全部或一部分进行杂交。
工程化的CRISPR-Cas系统
通常,CRISPR(成簇的规律间隔的短回文重复序列),也称为SPIDR(间隔子散在正向重复序列),构成通常对特定细菌物种具特异性的DNA基因座家族。CRISPR基因座包含在大肠杆菌中识别的不同类的散在短序列重复序列(SSR)(Ishino等人,J.Bacteriol.,169:5429-5433[1987];和Nakata等人,J.Bacteriol.,171:3553-3556[1989])和相关基因。类似的散在SSR已经在地中海富盐菌(Haloferax mediterranei)、化脓性链球菌(Streptococcus pyogenes)、鱼腥藻(Anabaena)和结核分枝杆菌(Mycobacteriumtuberculosis)中得到鉴定(参见Groenen等人,Mol.Microbiol.,10:1057-1065[1993];Hoe等人,Emerg.Infect.Dis.,5:254-263[1999];Masepohl等人,Biochim.Biophys.Acta1307:26-30[1996];和Mojica等人,Mol.Microbiol.,17:85-93[1995])。CRISPR基因座通常与其他SSR的不同之处在于重复序列的结构,这些重复序列被称为短规律间隔重复序列(SRSR)(Janssen等人,OMICS J.Integ.Biol.,6:23-33[2002];和Mojica等人,Mol.Microbiol.,36:244-246[2000])。通常,重复序列是簇中出现的短元件,其由具有基本恒定长度的独特插入序列规律间隔(Mojica等人,[2000],同上)。尽管菌株之间的重复序列高度保守,但散在重复序列的数目和间隔子区域的序列通常因不同菌株而异(van Embden等人,J.Bacteriol.,182:2393-2401[2000])。CRISPR基因座已在超过40种原核生物中鉴定(参见例如Jansen等人,Mol.Microbiol.,43:1565-1575[2002];和Mojica等人,[2005]),包括但不限于气火菌属(Aeropyrum)、热棒菌属(Pyrobaculum)、硫化叶菌属(Sulfolobus)、古球菌属(Archaeoglobus)、盐盒菌属(Halocarcula)、甲烷杆菌属(Methanobacterium)、甲烷球菌属(Methanococcus)、甲烷八叠球菌属(Methanosarcina)、甲烷火菌属(Methanopyrus)、焦球菌属(Pyrococcus)、嗜酸菌属(Picrophilus)、热原体属(Thermoplasma)、棒状杆菌属(Corynebacterium)、分枝杆菌属(Mycobacterium)、链霉菌属(Streptomyces)、产水菌属(Aquifex)、紫单胞菌属(Porphyromonas)、绿菌属(Chlorobium)、栖热菌属(Thermus)、芽孢杆菌属(Bacillus)、利斯特菌属(Listeria)、葡萄球菌属(Staphylococcus)、梭菌属(Clostridium)、好热厌氧杆菌属(Thermoanaerobacter)、支原体属(Mycoplasma)、梭杆菌属(Fusobacterium)、固氮弓菌属(Azarcus)、色杆菌属(Chromobacterium)、奈瑟菌属(Neisseria)、亚硝化单胞菌属(Nitrosomonas)、脱硫弧菌属(Desulfovibrio)、地杆菌属(Geobacter)、粘球菌属(Myxococcus)、弯曲杆菌属(Campylobacter)、沃林菌属(Wolinella)、不动杆菌属(Acinetobacter)、欧文菌属(Erwinia)、埃希氏菌属(Escherichia)、军团杆菌属(Legionella)、甲基球菌属(Methylococcus)、巴斯德菌属(Pasteurella)、发光细菌属(Photobacterium)、沙门菌属(Salmonella)、黄单胞菌属(Xanthomonas)、耶尔森菌属(Yersinia)、密螺旋体属(Treponema)和栖热袍菌属(Thermotoga)。
附带活性
Cas12酶可具有附带活性,也就是说,在某些环境中,激活的Cas12酶在结合靶序列后仍然保持活性,并继续非特异性地切割非靶寡核苷酸。该指导分子编程的附带切割活性能够使用Cas12b系统检测特定靶寡核苷酸的存在,从而触发体内程序性细胞死亡或体外非特异性RNA降解,其可用作读数。(Abudayyeh等人,2016;East-Seletsky等人,2016)。
RNA指导的C2c1的可编程性、特异性和附带活性也使其成为核酸非特异性切割的理想的可变换核酸酶。在一个实施方案中,将C2c1系统工程化以提供并利用核酸如ssDNA的附带非特异性切割。在另一个实施方案中,将C2c1系统工程化以提供并利用ssDNA的附带非特异性切割。因此,工程化的C2c1系统提供了核酸检测和转录组操纵以及诱导细胞死亡的平台。C2c1被开发用作哺乳动物转录物敲低和结合工具。当被序列特异性的靶向DNA结合激活时,C2c1能够对RNA和ssDNA进行稳健的附带切割。
在某些实施方案中,C2c1在体外系统或细胞中瞬时或稳定地提供或表达,并靶向或触发以非特异性地切割细胞核酸。在一个实施方案中,将C2c1工程化以敲低ssDNA,例如病毒ssDNA。在另一个实施方案中,将C2c1工程化以敲低RNA。可设计所述系统,使得敲低依赖于存在于细胞或体外系统中的靶DNA,或者通过向所述系统或细胞中添加靶核酸来触发。
在一个实施方案中,将C2c1系统工程化以非特异性地切割细胞子集中的RNA,所述细胞子集可通过异常DNA序列的存在而区分,例如其中异常DNA的切割可能是不完全的或无效的。在一个非限制性实例中,靶向存在于癌细胞中并驱动细胞转化的DNA易位。经历染色体DNA和修复的细胞亚群可存活,而非特异性的附带核糖核酸酶活性则有利地导致潜在存活者的细胞死亡。
附带活性最近被用于称为SHERLOCK的高灵敏度和特异性核酸检测平台,该平台可用于许多临床诊断(Gootenberg,J.S.等人,Nucleic acid detection with CRISPR-Cas13a/C2c2.Science 356,438-442(2017))。
根据本发明,针对DNA或RNA核酸内切酶活性对工程化的C2c1系统进行了优化,并且可在哺乳动物细胞中表达并靶向以有效地敲低细胞中的报告分子或转录物。
具有等温扩增的工程化C2c1的附带作用可提供基于CRISPR的诊断,从而以高灵敏度和单碱基错配特异性提供快速DNA或RNA检测。基于C2c1的分子检测平台用于检测特定病毒株,区分病原细菌、基因型人类DNA和鉴定无细胞的肿瘤DNA突变。此外,反应试剂可被冻干以实现冷链独立性和长期储存,并易于在纸上重建以用于现场应用。
在便携式平台上以高灵敏度和单碱基特异性快速检测核酸的能力可能有助于疾病诊断和监测、流行病学和一般实验室任务。尽管存在用于检测核酸的方法,但是它们在灵敏度、特异性、简单性、成本和速度之间进行制衡。
微生物成簇的规律间隔的短回文重复序列(CRISPR)和CRISPR相关(CRISPR-Cas)适应性免疫系统包含可编程核酸内切酶,其可用于基于CRISPR的诊断(CRISPR-Dx)。可使用CRISPR RNA(crRNA)对C2c1(也称为Cas12b)进行重新编程,从而为特异性DNA传感提供平台。识别其DNA靶标后,激活的C2c1参与附近非靶标核酸(即RNA和/或ssDNA)的“附带”切割。这种crRNA编程的附带切割活性使C2c1通过触发程序性细胞死亡或通过标记的RNA或ssDNA的非特异性降解来检测体内特定DNA的存在。这里描述了一种基于核酸扩增和商业报告RNA的C2c1介导的附带切割的高灵敏度体外核酸检测平台,可允许实时检测靶标。
在某些示例实施方案中,本文公开的直系同源物可单独使用,或与其他Cas12或Cas13直系同源物组合用于诊断组合物和测定中。例如,本文公开的Cas12b直系同源物可用于多重测定中以检测靶序列,然后通过基于寡核苷酸的报告物的非特异性切割,产生可检测的信号。
报告/掩蔽构建体
如本文所用,“掩蔽构建体”是指可被本文所述的激活的CRISPR系统效应蛋白切割或以其他方式减活的分子。可替代地,术语“掩蔽构建体”也可称为“检测构建体”。取决于CRISPR效应蛋白的核酸酶活性,掩蔽构建体可以是基于RNA的掩蔽构建体或基于DNA的掩蔽构建体。基于核酸的掩蔽构建体包含可被CRISPR效应蛋白切割的核酸元件。核酸元件的切割释放出剂或产生构象变化,从而允许产生可检测的信号。下文描述了表明核酸元件可如何用于预防或掩蔽可检测信号的产生的示例构建体,并且本发明的实施方案包括其变体。在切割之前,或者当掩蔽构建体处于“活性”状态时,掩蔽构建体会阻止阳性可检测信号的产生或检测。将理解的是,在某些示例实施方案中,在存在活性掩蔽构建体的情况下可产生最小的背景信号。阳性可检测信号可以是可使用光学、荧光、化学发光、电化学或本领域已知的其他检测方法检测的任何信号。术语“阳性可检测信号”用于与在掩蔽构建体存在下可检测的其他可检测信号区分开。例如,在某些实施方案中,当存在掩蔽剂时,可检测到第一信号(即阴性可检测信号),然后在检测到靶分子以及通过激活的CRISPR效应蛋白切割或减活后将其转换为第二信号(例如阳性可检测信号)。
在某些示例实施方案中,掩蔽构建体可抑制基因产物的产生。基因产物可由添加到样品中的报告构建体编码。掩蔽构建体可以是参与RNA干扰途径的干扰RNA,例如短发夹RNA(shRNA)或小干扰RNA(siRNA)。掩蔽构建体还可包含微小RNA(miRNA)。当存在时,掩蔽构建体抑制基因产物的表达。基因产物可以是荧光蛋白或其他RNA转录物,或者可以其他方式被标记的探针、适体或抗体检测到的蛋白,但存在掩蔽构建体。激活效应蛋白后,将掩蔽构建体切割或以其他方式沉默,从而允许基因产物的表达和检测作为阳性可检测信号。
在某些示例实施方案中,掩蔽构建体可螯合产生可检测阳性信号所需的一种或多种试剂,使得所述一种或多种试剂从掩蔽构建体的释放导致可检测阳性信号的产生。所述一种或多种试剂可组合以产生比色信号、化学发光信号、荧光信号或任何其他可检测的信号,并且可包含已知适合于此类目的的任何试剂。在某些示例实施方案中,一种或多种试剂被结合一种或多种试剂的RNA适体螯合。当效应蛋白在检测到靶分子时被激活并且RNA或DNA适体被降解时,一种或多种试剂被释放。
在某些示例实施方案中,掩蔽构建体可以单独的离散体积(在下文中进一步定义)固定在固体基质上,并螯合单一试剂。例如,试剂可以是包含染料的珠粒。当被固定化试剂螯合时,各个珠粒太扩散而不能产生可检测的信号,但是一旦从掩蔽构建体释放,则能够例如通过聚集或溶液浓度的简单增加而产生可检测的信号。在某些示例实施方案中,固定的掩蔽剂是基于RNA或DNA的适体,其可在检测到靶分子时被激活的效应蛋白切割。
在某些其他示例实施方案中,掩蔽构建体与溶液中的固定化试剂结合,从而阻断了试剂与溶液中游离的单独的标记结合伴侣结合的能力。因此,在将洗涤步骤应用于样品时,可在不存在靶分子的情况下将标记的结合伴侣从样品中洗出。然而,如果效应蛋白被激活,则将掩蔽构建体切割至足以干扰掩蔽构建体结合试剂的能力的程度,从而使标记的结合伴侣结合至固定化试剂。因此,标记的结合伴侣在洗涤步骤之后保留,表明样品中存在靶分子。在某些方面,结合固定化试剂的掩蔽构建体是DNA或RNA适体。固定化试剂可以是蛋白质并且标记的结合伴侣可以是标记的抗体。或者,固定化试剂可以是抗生蛋白链菌素并且标记的结合伴侣可以是标记的生物素。在以上实施方案中使用的结合伴侣上的标记可以是本领域已知的任何可检测标记。另外,可根据本文所述的总体设计使用其他已知的结合伴侣。
在某些示例实施方案中,掩蔽构建体可包含核酶。核酶是具有催化特性的RNA分子。天然和工程化的核酶均包含RNA或由RNA组成,所述RNA可被本文公开的效应蛋白靶向。核酶可被选择或工程化以催化产生阴性可检测信号或阻止阳性对照信号产生的反应。在通过激活的效应蛋白使核酶减活后,除去产生阴性对照信号或防止产生阳性可检测信号的反应,从而允许产生阳性可检测信号。在一个示例实施方案中,核酶可催化比色反应,导致溶液显示为第一种颜色。当核酶减活时,溶液则变成第二种颜色,所述第二种颜色是可检测的阳性信号。Zhao等人“Signal amplification of glucosamine-6-phosphate based onribozyme glmS,”Biosens Bioelectron.2014;16:337-42描述了可如何使用核酶来催化比色反应的实例,并提供了可如何修改这样的系统以在本文公开的实施方案的上下文中起作用的实例。或者,当存在核酶时,其可产生例如RNA转录物的切割产物。因此,检测到阳性可检测信号可包括检测仅在不存在核酶的情况下产生的未切割的RNA转录物。
在某些示例实施方案中,一种或多种试剂是蛋白质,例如酶,其能够促进产生可检测信号(例如比色、化学发光或荧光信号),该信号被抑制或螯合使得所述蛋白质无法通过一个或多个DNA或RNA适体与所述蛋白质的结合而产生可检测的信号。本文公开的效应蛋白激活后,DNA或RNA适体被切割或降解至不再抑制所述蛋白质产生可检测信号的能力的程度。在某些示例实施方案中,适体是凝血酶抑制剂适体。在某些示例实施方案中,凝血酶抑制剂适体具有GGGAACAAAGCUGAAGUACUUACCC(SEQ ID NO:439)的序列。当该适体被切割时,凝血酶将变得有活性并且将切割肽的比色或荧光底物。在某些示例实施方案中,比色底物是共价连接至凝血酶的肽底物的对硝基苯胺(pNA)。通过凝血酶切割后,pNA释放并变为黄色并且眼睛容易看见。在某些示例实施方案中,荧光底物是7-氨基-4-甲基香豆素,可使用荧光检测器检测的蓝色荧光团。抑制性适体也可用于辣根过氧化物酶(HRP)、β-半乳糖苷酶或小牛碱性磷酸酶(CAP),并且在上述一般原理范围内。
在某些实施方案中,经由酶抑制适体的切割以比色法检测RNA酶或DNA酶活性。将DNA酶或RNA酶活性转换为比色信号的一种潜在模式是将DNA或RNA适体的切割与能够产生比色输出的酶的再活化结合在一起。在不存在RNA或DNA切割的情况下,完整的适体将与酶靶标结合并抑制其活性。该读数系统的优点是所述酶提供了额外的扩增步骤:一旦经由附带活性(例如C2c1附带活性)从适体中释放出来,比色酶将继续产生比色产物,从而导致信号倍增。
在某些实施方案中,使用以比色读数抑制酶的现有适体。存在若干具有比色读数的适体/酶对,例如凝血酶、蛋白C、中性粒细胞弹性蛋白酶和枯草杆菌蛋白酶。这些蛋白酶具有基于pNA的比色底物并且可商购。在某些实施方案中,使用靶向普通比色酶的新型适体。通过利用选择策略如SELEX设计的工程化适体可靶向常见而强大的酶,例如β-半乳糖苷酶、辣根过氧化物酶或小牛肠碱性磷酸酶。这样的策略允许快速选择具有纳摩尔结合效率的适体,并且可用于开发用于比色读数的另外的酶/适体对。
在某些实施方案中,经由切割RNA栓系的抑制剂以比色法检测RNA酶或DNA酶活性。许多常见的比色酶具有竞争性、可逆的抑制剂:例如,β-半乳糖苷酶可被半乳糖抑制。这些抑制剂中很多都很弱,但是可通过增加局部浓度来增强其作用。通过将抑制剂的局部浓度与DNA酶和/或RNA酶活性联系起来,可将比色酶和抑制剂对工程化为DNA酶和RNA酶传感器。基于小分子抑制剂的比色DNA酶或RNA酶传感器涉及三个组成部分:比色酶、抑制剂以及与抑制剂和酶两者共价连接的桥接RNA或DNA,将抑制剂栓系在酶上。在未切割的构型中,酶被小分子局部浓度的增加所抑制;当DNA或RNA被切割时(例如通过Cas13或Cas12附带切割),抑制剂将被释放并且比色酶将被激活。
在某些实施方案中,经由G-四链体的形成和/或激活以比色法检测RNA酶或DNA酶活性。DNA中的G四链体可与血红素(铁(III)-原卟啉IX)复合形成具有过氧化物酶活性的DNA酶。当提供过氧化物酶底物(例如ABTS:(2,2'-联氮双[3-乙基苯并噻唑啉-6-磺酸]-二铵盐))时,过氧化氢存在下的G-四链体-血红素复合物会导致底物的氧化,然后在溶液中形成绿色。形成G-四链体的DNA序列的实例是:GGGTAGGGCGGGTTGGGA(SEQ ID NO:440)。通过将另外的DNA或RNA序列(在本文中称为“卡钉(staple)”)与该DNA适体杂交,G-四链体结构的形成将受到限制。附带激活后,卡钉将被切割,从而使G四链体形成并与血红素结合。这种策略特别吸引人,因为颜色形成是酶促的,这意味着除了附带激活外,还存在其他扩增作用。
在某些示例实施方案中,掩蔽构建体可以单独的离散体积(在下文中进一步定义)固定在固体基质上,并螯合单一试剂。例如,试剂可以是包含染料的珠粒。当被固定化试剂螯合时,各个珠粒太扩散而不能产生可检测的信号,但是一旦从掩蔽构建体释放,则能够例如通过聚集或溶液浓度的简单增加而产生可检测的信号。在某些示例实施方案中,固定化掩蔽剂是基于DNA或RNA的适体,其可在检测到靶分子时被激活的效应蛋白切割。
在一个示例实施方案中,掩蔽构建体包含检测剂,其根据检测剂是聚集还是分散在溶液中而改变颜色。例如,某些纳米粒子(例如胶体金)在从聚集体移动到分散的粒子时会经历可见的紫色到红色的转变。因此,在某些示例实施方案中,这样的检测剂可通过一个或多个桥分子保持成聚集体。桥分子的至少一部分包含RNA或DNA。激活本文公开的效应蛋白后,将切割桥分子的RNA或DNA部分,使检测剂分散并导致相应的颜色变化。在某些示例实施方案中,检测剂是胶体金属。胶体金属材料可包括水不溶性金属粒子或分散在液体、水溶胶或金属溶胶中的金属化合物。胶体金属可选自元素周期表的IA、IB、IIB和IIIB族的金属,以及过渡金属,特别是VIII族的那些。优选的金属包括金、银、铝、钌、锌、铁、镍和钙。其他合适的金属还包括以下所有的其各种氧化态:锂、钠、镁、钾、钪、钛、钒、铬、锰、钴、铜、镓、锶、铌、钼、钯、铟、锡、钨、铼、铂和钆。金属优选以离子形式提供,其衍生自适当的金属化合物,例如A13+、Ru3+、Zn2+、Fe3+、Ni2+和Ca2+离子。
当RNA或DNA桥被激活的CRISPR效应子切割时,观察到上述色移。在某些示例实施方案中,粒子是胶体金属。在某些其他示例实施方案中,胶体金属是胶体金。在某些示例实施方案中,胶体纳米粒子是15nm金纳米粒子(AuNP)。由于胶体金纳米粒子的独特表面特性,当完全分散在溶液中并对肉眼呈现红色时,在520nm处观察到最大吸光度。AuNP聚集后,它们表现出最大吸光度的红移,并且颜色看起来更深,最终从溶液中沉淀为深紫色聚集体。在某些示例实施方案中,纳米粒子被修饰成包括从纳米粒子的表面延伸的DNA接头。单个粒子通过单链RNA(ssRNA)或单链DNA桥连接在一起,所述单链DNA桥的每一端与DNA接头的至少一部分杂交。因此,纳米粒子将形成连接的粒子和聚集体的网状物,呈现为黑色沉淀物。本文公开的CRISPR效应子激活后,ssRNA或ssDNA桥将被切割,从连接的网状物中释放AU NPS并产生可见的红色。示例性DNA接头和桥序列在下面列出。DNA接头末端的硫醇接头可用于与AuNPS的表面缀合。可使用其他形式的缀合。在某些示例实施方案中,可产生两个AuNP群体,每个DNA接头一个。这将有助于促进具有正确方向的ssRNA桥的正确结合。在某些示例实施方案中,第一DNA接头通过3'端缀合,而第二DNA接头通过5'端缀合。
在某些其他示例实施方案中,掩蔽构建体可包含RNA或DNA寡核苷酸,可检测标记和该可检测标记的掩蔽剂附接至该RNA或DNA寡核苷酸。这种可检测的标记/掩蔽剂对的实例是荧光团和荧光团的猝灭剂。荧光团的猝灭可由于在荧光团与另一荧光团或非荧光分子之间形成非荧光复合物而发生。这种机理被称为基态复合物形成、静态猝灭或接触猝灭。因此,可设计RNA或DNA寡核苷酸,使得荧光团和猝灭剂足够接近以发生接触猝灭。荧光团及其同源猝灭剂是本领域已知的,并且可由本领域普通技术人员为此目的进行选择。在本发明的上下文中,特定的荧光团/猝灭剂对不是关键性的,仅荧光团/猝灭剂对的选择确保了荧光团的掩蔽。激活本文公开的效应蛋白后,将RNA或DNA寡核苷酸切割,从而切断维持接触猝灭作用所需的荧光团和猝灭剂之间的邻近性。因此,荧光团的检测可用于确定样品中靶分子的存在。
在某些其他示例实施方案中,掩蔽构建体可包含一种或多种RNA寡核苷酸,一种或多种金属纳米粒子如金纳米粒子附接于其上。在一些实施方案中,掩蔽构建体包含被形成闭合环的多个RNA或DNA寡核苷酸交联的多个金属纳米粒子。在一个实施方案中,掩蔽构建体包含通过三个RNA或DNA寡核苷酸交联而形成闭合环的三个金纳米粒子。在一些实施方案中,CRISPR效应蛋白对RNA或DNA寡核苷酸的切割导致金属纳米粒子产生可检测的信号。
在某些其他示例实施方案中,掩蔽构建体可包含一个或多个RNA或DNA寡核苷酸,其附接有一个或多个量子点。在一些实施方案中,CRISPR效应蛋白对RNA或DNA寡核苷酸的切割导致量子点产生可检测的信号。
在一个示例实施方案中,掩蔽构建体可包含量子点。所述量子点可具有附接于表面的多个接头分子。接头分子的至少一部分包含RNA或DNA。接头分子在一端附接于量子点,并沿接头的长度或在接头的末端附接于一个或多个猝灭剂,从而使猝灭剂保持足够接近以使量子点发生猝灭。接头可能是分支的。如上所述,量子点/猝灭剂对不是关键性的,只是量子点/猝灭剂对的选择确保了荧光团的掩蔽。量子点及其同源猝灭剂是本领域已知的,并且可由本领域普通技术人员为此目的进行选择。激活本文公开的效应蛋白后,接头分子的RNA或DNA部分被切割,从而消除了量子点与一种或多种维持猝灭作用所需的猝灭剂之间的邻近性。在某些示例实施方案中,量子点是抗生蛋白链菌素缀合的。RNA或DNA经由生物素接头附接并募集具有序列/5Biosg/UCUCGUACGUUC/3IAbRQSp/(SEQ ID NO.444)或/5Biosg/UCUCGUACGUUCUCUCGUACGUUC/3IAbRQSp/(SEQ ID NO.445)的猝灭分子,其中/5Biosg/是生物素标签,并且/3lAbRQSp/是Iowa黑色猝灭剂。切割后,通过本文公开的激活的效应子,量子点将可见地发荧光。
以类似的方式,荧光能量转移(FRET)可用于产生可检测的阳性信号。FRET是一种非辐射过程,通过该过程,来自能量激发荧光团(即“供体荧光团”)的光子将另一个分子(即“受体”)中电子的能级提高到激发单重态的较高振动水平。供体荧光团返回基态而没有发出该荧光团的荧光特征。受体可以是另一种荧光团或非荧光分子。如果受体是荧光团,则转移的能量作为该荧光团的荧光特征而发射。如果受体是非荧光分子,则吸收的能量作为热量损失。因此,在本文公开的实施方案的上下文中,将荧光团/猝灭剂对替换为附接至寡核苷酸分子的供体荧光团/受体对。当完整无损时,掩蔽构建体产生第一信号(阴性可检测信号),如通过受体发出的荧光或热量所检测到。在激活本文公开的效应蛋白后,RNA寡核苷酸被切割并且FRET被破坏,使得现在检测到供体荧光团的荧光(阳性可检测信号)。
在某些示例实施方案中,掩蔽构建体包括使用嵌入染料,其响应于将长RNA或DNA切割成短核苷酸而改变其吸光度。存在若干这样的染料。例如,派若宁-Y(pyronine-Y)将与RNA复合并形成在572nm处具有吸光度的复合物。RNA的切割导致吸光度损失和颜色变化。亚甲基蓝可以类似的方式使用,在RNA切割后在688nm处的吸光度发生变化。因此,在某些示例实施方案中,掩蔽构建体包含RNA和嵌入染料复合物,其在被本文公开的效应蛋白切割RNA后改变吸光度。
在某些示例实施方案中,掩蔽构建体可包含用于HCR反应的引发剂。参见例如Dirks和Pierce.PNAS 101,15275-15728(2004)。HCR反应利用两种发夹物质中的潜在能量。当具有与发夹之一上的相应区域互补的一部分的单链引发剂被释放到先前稳定的混合物中时,它打开一种物质的发夹。反过来,此过程会暴露单链区域,从而打开其他物质的发夹。反过来,此过程将暴露与原始引发剂相同的单链区域。产生的链反应可能导致形成带切口的双螺旋,该双螺旋一直生长直至发夹供应耗竭为止。所得产物的检测可在凝胶上或以比色法进行。比色检测方法的实例包括例如以下公开的那些:Lu等人“Ultra-sensitivecolorimetric assay system based on the hybridization chain reaction-triggeredenzyme cascade amplification ACS Appl Mater Interfaces,2017,9(1):167-175;Wang等人“An enzyme-free colorimetric assay using hybridization chain reactionamplification and split aptamers”Analyst 2015,150,7657-7662;以及Song等人“Noncovalent fluorescent labeling of hairpin DNA probe coupled with hybridizationchain reaction for sensitive DNA detection.”Applied Spectroscopy,70(4):686-694(2016)。
在某些示例实施方案中,掩蔽构建体可包含HCR引发剂序列和可切割的结构元件,例如环或发夹,其防止引发剂引发HCR反应。在通过激活的CRISPR效应蛋白切割结构元件后,引发剂随后被释放以触发HCR反应,对其的检测表明样品中存在一个或多个靶标。在某些示例实施方案中,掩蔽构建体包含具有RNA环的发夹。当激活的CRISRP效应蛋白切割RNA环时,可释放引发剂以触发HCR反应。
靶寡核苷酸的扩增
在某些示例实施方案中,可在激活CRISPR效应蛋白之前扩增靶RNA和/或DNA。可使用任何合适的RNA或DNA扩增技术。在某些示例实施方案中,RNA或DNA扩增是等温扩增。在某些示例实施方案中,等温扩增可以是基于核酸测序的扩增(NASBA)、重组酶聚合酶扩增(RPA)、环介导的等温扩增(LAMP)、链置换扩增(SDA)、解旋酶依赖性扩增(HDA)或切口酶扩增反应(NEAR)。在某些示例实施方案中,可使用非等温扩增方法,其包括但不限于PCR、多重置换扩增(MDA)、滚环扩增(RCA)、连接酶链反应(LCR)或分枝扩增方法(RAM)。
在某些示例实施方案中,RNA或DNA扩增是NASBA,其通过序列特异性反向引物利用靶RNA的反转录而起始以产生RNA/DNA双链体。然后使用RNA酶H降解RNA模板,使含有启动子(例如T7启动子)的正向引物结合并起始互补链的延伸,生成双链DNA产物。然后,RNA聚合酶启动子介导的DNA模板转录产生靶RNA序列的拷贝。重要的是,每个新的靶RNA可被指导RNA检测到,从而进一步提高了测定的灵敏度。然后,指导RNA与靶RNA的结合导致CRISPR效应蛋白的激活,并且所述方法如上所述进行。NASBA反应的另一个优势是能够在中等等温条件下(例如在约41℃下)进行,使其适用于部署用于现场和远离临床实验室的早期和直接检测的系统和装置。
在某些其他示例实施方案中,重组酶聚合酶扩增(RPA)反应可用于扩增靶核酸。RPA反应使用重组酶,所述酶能够将序列特异性引物与双链DNA中的同源序列配对。如果存在靶DNA,则将起始DNA扩增,无需进行其他样品操纵,例如热循环或化学熔融。整个RPA扩增系统作为干燥制剂稳定,并且无需冷藏即可安全运输。RPA反应也可在等温温度下以37-42℃的最佳反应温度进行。序列特异性引物被设计成用于扩增包含要检测的靶核酸序列的序列。在某些示例实施方案中,将RNA聚合酶启动子如T7启动子添加至引物之一。这产生了包含靶序列和RNA聚合酶启动子的扩增的双链DNA产物。在RPA反应之后或期间,添加RNA聚合酶,该酶将从双链DNA模板中产生RNA。然后可再通过CRISPR效应系统检测扩增的靶RNA。以这种方式,可使用本文公开的实施方案检测靶DNA。RPA反应也可用于扩增靶RNA。首先使用逆转录酶将靶RNA转化为cDNA,接着进行第二链DNA合成,此时RPA反应如上所述进行。
在本发明的一个实施方案中,切口酶是CRISPR蛋白。因此,将缺口引入dsDNA可以是可编程的并且是序列特异性的。图5描绘了本发明的一个实施方案,其以设计为靶向dsDNA靶标的相反链的两个指导物开始。根据本发明,切口酶可以是C2c1或与Cpf1、C℃一起使用的C2c1。在其他实施方案中,可通过选择在不同温度下可操作的聚合酶(例如Bsu、Bst、Phi29、klenow片段等)来选择等温扩增的温度。
因此,在切刻等温扩增技术使用具有固定序列偏好的切刻酶(例如,在切刻酶扩增反应或NEAR中)的情况下,其需要使原始dsDNA靶标变性以允许引物的退火和延伸,从而将切刻底物添加到靶标末端,其中切口位点可经由指导RNA进行编程的CRISPR切口酶的使用意味着不需要变性步骤,从而使整个反应真正等温。这也简化了反应,因为添加切刻底物的这些引物与反应后期使用的引物不同,这意味着NEAR需要两个引物对(即4个引物),而C2c1切刻扩增仅需要一个引物组(即两个引物)。这使得切刻C2c1扩增变得更简单和更容易操作,而无需复杂的仪器进行变性,然后冷却至等温温度。
因此,在某些示例实施方案中,本文公开的系统可包括扩增试剂。本文描述了可用于扩增核酸的不同组分或试剂。例如,如本文所述的扩增试剂可包括缓冲剂,例如Tris缓冲剂。Tris缓冲剂可以适合所需应用或用途的任何浓度使用,例如包括但不限于1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、10mM、11mM、12mM、13mM、14mM、15mM、25mM、50mM、75mM、1M等的浓度。本领域技术人员将能够确定与本发明一起使用的缓冲剂例如Tris的适当浓度。
为了改善核酸片段的扩增,可在扩增反应如PCR中包括例如氯化镁(MgCl2)、氯化钾(KCl)或氯化钠(NaCl)的盐。尽管盐浓度将取决于特定的反应和应用,但是在一些实施方案中,特定大小的核酸片段可在特定盐浓度下产生最佳结果。较大的产物可能需要改变的盐浓度,通常是较低的盐,以产生所需的结果,而较小的产物的扩增可能会在较高的盐浓度下产生更好的结果。本领域技术人员将理解,盐的存在和/或浓度以及盐浓度的改变,可能会改变生物或化学反应的严格性,因此可使用任何提供适于本发明和如本文所述的反应的条件的盐。
生物或化学反应的其他组分可包括细胞裂解组分,以使细胞破裂或裂解以分析其中的物质。细胞裂解组分可包括但不限于洗涤剂,如上所述的盐,例如NaCl、KCl、硫酸铵[(NH4)2SO4]或其他。可能适用于本发明的洗涤剂可包括Triton X-100、十二烷基硫酸钠(SDS)、CHAPS(3-[(3-胆酰胺丙基)二甲基铵]-1-丙烷磺酸盐)、乙基三甲基溴化铵、壬基苯氧基聚乙氧基乙醇(NP-40)。洗涤剂的浓度可能取决于特定的应用,并且在某些情况下可能对反应具特异性。扩增反应可包括以适合于本发明的任何浓度使用的dNTP和核酸引物,例如但不限于100nM、150nM、200nM、250nM、300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、950nM、1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、10mM、20mM、30mM、40mM、50mM、60mM、70mM、80mM、90mM、100mM、150mM、200mM、250mM、300mM、350mM、400mM、450mM、500mM等的浓度。同样,根据本发明有用的聚合酶可以是本领域已知的和本发明可用的任何特异性或通用聚合酶,包括Taq聚合酶、Q5聚合酶等。
在一些实施方案中,如本文所述的扩增试剂可适合用于热启动扩增。在一些实施方案中,热启动扩增可能有益于减少或消除衔接子分子或寡核苷酸的二聚化,或者以其他方式防止不需要的扩增产物或人工产物并获得所需产物的最佳扩增。本文所述用于扩增的许多组分也可用于热启动扩增。在一些实施方案中,可适当地使用用于热启动扩增的试剂或组分代替一种或多种组合物组分。例如,可使用在特定温度或其他反应条件下表现出期望活性的聚合酶或其他试剂。在一些实施方案中,可使用被设计或优化用于热启动扩增的试剂,例如,聚合酶可在转座后或达到特定温度后被激活。这样的聚合酶可以是基于抗体或基于适体的。如本文所述的聚合酶是本领域已知的。这样的试剂的实例可包括但不限于热启动聚合酶、热启动dNTP和光笼dNTP。这样的试剂是本领域已知和可获得的。本领域技术人员将能够确定适合于各个试剂的最佳温度。
核酸的扩增可使用特定的热循环机器或设备进行,并且可以单个反应或批量进行,使得可同时进行任何期望数量的反应。在一些实施方案中,可使用微流体或机器人装置进行扩增,或者可使用温度的人工改变来进行扩增以实现所需的扩增。在一些实施方案中,可进行优化以获得针对特定应用或材料的最佳反应条件。本领域技术人员将理解并且能够优化反应条件以获得足够的扩增。
在某些实施方案中,用本发明的方法或系统检测DNA需要在检测之前将(扩增的)DNA转录成RNA。
显然,本发明的检测方法可涉及多种组合的核酸扩增和检测程序。待检测的核酸可以是任何天然存在的或合成的核酸,包括但不限于DNA和RNA,其可通过任何合适的方法扩增以提供可检测的中间产物。中间产物的检测可通过任何合适的方法,包括但不限于通过直接或附带活性产生可检测信号部分的CRISPR蛋白的结合和激活。
除了核酸的检测之外,本文公开的系统、装置和方法还可适于经由并入特殊配置的多肽检测适体来检测多肽(或其他分子)。多肽检测适体不同于上文讨论的掩蔽构建体适体。首先,将适体设计为特异性结合一个或多个靶分子。在一个示例实施方案中,靶分子是靶多肽。在另一个示例实施方案中,靶分子是靶化学化合物,例如靶治疗分子。设计和选择对给定靶标例如SELEX具有特异性的适体的方法是本领域已知的。除了对给定靶标的特异性外,还进一步设计了适体以并入聚合酶启动子结合位点。在某些示例实施方案中,聚合酶启动子是T7启动子。在将适体结合至靶标之前,聚合酶位点不可接近或不能被聚合酶识别。然而,适体被配置为使得在结合靶标时,适体的结构经历构象变化,使得随后暴露聚合酶启动子。聚合酶启动子下游的适体序列充当模板,用于通过RNA或DNA聚合酶生成触发寡核苷酸。因此,适体的模板部分可进一步并入条形码或其他标识序列,其标识给定的适体及其靶标。然后可将如上所述的指导RNA设计为识别这些特定的触发寡核苷酸序列。指导RNA与触发寡核苷酸的结合激活了CRISPR效应蛋白,其继续使掩蔽构建体减活并产生如前所述的阳性可检测信号。
因此,在某些示例实施方案中,本文公开的方法包括将样品或样品组分布到一组单独的离散体积中的额外步骤,每个单独的离散体积包括肽检测适体、CRISPR效应蛋白、一个或多个指导RNA、掩蔽构建体,并在足以允许检测适体结合至一个或多个靶分子的条件下温育样品或样品组,其中所述适体与相应靶标的结合导致聚合酶启动子结合位点的暴露,以便通过RNA聚合酶与RNA聚合酶启动子结合位点的结合来起始触发寡核苷酸的合成。
在另一个示例实施方案中,适体的结合可在适体与靶多肽结合后暴露引物结合位点。例如,适体可暴露RPA引物结合位点。因此,引物的添加或包含随后将进料到扩增反应例如上文概述的RPA反应中。
在某些示例实施方案中,适体可以是构象转换适体,其在与目标靶标结合后可改变二级结构并暴露单链DNA的新区域。在某些示例实施方案中,单链DNA的这些新区域可用作连接的底物,延伸适体并产生更长的ssDNA分子,其可使用本文公开的实施方案进行特异性检测。适体设计可进一步与三元复合物结合以检测低表位靶标,例如葡萄糖(Yang等人,2015:pubs.acs.org/doi/abs/10.1021/acs.analchem.5b01634)。示例性构象转变适体和相应的指导RNA(crRNA)如下所示。
关于CRISPR系统使用方法的一般性评论
在特定的实施方案中,本文描述的方法可涉及靶向一个或多个目标多核苷酸靶标。目标多核苷酸靶标可以是与特定疾病或其治疗有关,与给定的目标性状的产生有关或与目标分子的产生有关的靶标。当提到“多核苷酸靶标”的靶向时,这可包括靶向一个或多个编码区、内含子、启动子和任何其他5'或3'调控区,例如终止区、核糖体结合位点、增强子、沉默子等。所述基因可编码任何目标蛋白质或RNA。因此,靶标可以是可被转录成mRNA、tRNA或rRNA的编码区,但也可以是参与其复制、转录和调控的蛋白质的识别位点。
在特定的实施方案中,本文所述的方法可涉及靶向一个或多个目标基因,其中至少一个目标基因编码长的非编码RNA(lncRNA)。尽管已经发现lncRNA对于细胞功能至关重要。由于已发现每种细胞类型所必需的lncRNA均不同(C.P.Fulco等人,2016,Science,doi:10.1126/science.aag2445;N.E.Sanjana等人,2016,Science,doi:10.1126/science.aaf8325),因此本文提供的方法可能涉及确定与目标细胞的细胞功能相关的lncRNA的步骤。
在通过整合外源多核苷酸模板修饰靶多核苷酸的示例性方法中,通过CRISPR复合物将双链断裂引入基因组序列中,经由同源重组外源多核苷酸模板修复该断裂,以便将模板整合到基因组中。双链断裂的存在促进了模板的整合。
在其他实施方案中,本发明提供了一种修饰多核苷酸在真核细胞中表达的方法。所述方法包括通过使用与多核苷酸结合的CRISPR复合物来增加或减少靶多核苷酸的表达。
在一些方法中,可使靶多核苷酸失活以影响细胞中表达的修饰。例如,当CRISPR复合物与细胞中的靶序列结合时,靶多核苷酸被灭活,使得所述序列不被转录,不产生编码蛋白,或者所述序列不用作野生型序列。例如,可使蛋白质或微小RNA编码序列失活,从而不产生蛋白质。
在一些方法中,可使控制序列失活,因此其不再起控制序列的作用。如本文所用,“控制序列”是指影响核酸序列的转录、翻译或可及性的任何核酸序列。控制序列的实例包括启动子、转录终止子,并且增强子是控制序列。失活的靶序列可包括缺失突变(即,一个或多个核苷酸的缺失),插入突变(即,一个或多个核苷酸的插入)或无义突变(即,一个核苷酸被另一核苷酸取代以便引入终止密码子)。在一些方法中,靶序列的失活导致靶序列的“敲除”。
本文还提供了功能基因组学的方法,所述方法涉及通过引入多个组合扰动来鉴定细胞相互作用,以及将观察到的基因组、遗传、蛋白质组学、表观遗传和/或表型效应与在单个细胞中检测到的扰动相关联,也称为“扰动测序(perturb-seq)”。在一个实施方案中,这些方法结合了单细胞RNA测序(RNA-seq)和基于成簇的规律间隔的短回文重复序列(CRISPR)的扰动(Dixit等人,2016,Cell 167,1853-1866;Adamson等人,2016,Cell 167,1867-1882)。通常,这些方法涉及向细胞群体中的多个细胞引入许多组合扰动,其中多个细胞中的每个细胞接受至少一种扰动,检测单个细胞中与一个或多个没有受到任何扰动的细胞相比的基因组、遗传、蛋白质组、表观遗传和/或表型差异,并检测单个细胞中的扰动;以及通过应用考虑到测量差异的协变量的模型来确定与扰动有关的测量差异,从而推断出细胞间和/或细胞内网络或回路。更特别地,单细胞测序包括细胞条形码,由此记录每个RNA的起源细胞。更具体地,单细胞测序包括独特的分子标识符(UMI),由此确定单个细胞中所测量信号的捕获率,例如转录物拷贝数或探针结合事件。
这些方法可用于细胞回路的组合探测,剖析细胞回路,描绘分子途径和/或鉴定用于治疗发展的相关靶标。更具体地,这些方法可用于基于细胞的分子谱来鉴定细胞群。有机状态(例如疾病)和诱导状态(例如通过小分子)之间基因表达谱的相似性可鉴定临床上有效的疗法。
因此,在特定的实施方案中,本文提供的治疗方法包括:使用如上所述的扰动测序,针对从受试者分离的细胞群体,确定最佳的治疗靶标和/或治疗剂。
在特定的实施方案中,本文在其他地方提及的扰动测序方法用于确定分离的细胞或细胞系中可能影响目标分子的产生的细胞回路。
额外的CRISPR-Cas开发和使用的考虑因素
可基于以下文章中所述的CRISPR-Cas9开发和使用的方面进一步说明和扩展本发明,特别是涉及CRISPR蛋白复合物的递送以及RNA指导的核酸内切酶在细胞和生物体中的用途:
在本发明的实践中可考虑将所述文献中的每一者通过引用并入本文,并在下面简要讨论:
本文提供的方法和工具以C2c1(不使用tracrRNA的II型核酸酶)为例。如本文所述,已经在不同细菌物种中鉴定出C2c1的直系同源物。可使用本领域描述的方法鉴定具有相似特性的其他II型核酸酶(Shmakov等人,2015,60:385-397;Abudayeh等人,2016,Science,5;353(6299))。在特定的实施方案中,用于鉴定新型CRISPR效应蛋白的此类方法可包括以下步骤:从数据库中选择编码种子的序列,所述种子鉴定出CRISPR Cas基因座的存在,鉴定选定序列中位于包含开放阅读框(ORF)的种子的10kb内的基因座,从中选择包含ORF的基因座,其中只有一个ORF编码一种新型CRISPR效应子,该效应子具有多于700个氨基酸并且与已知的CRISPR效应子的同源性不超过90%。在特定的实施方案中,种子是CRISPR-Cas系统共有的蛋白质,例如Cas1。在其他实施方案中,CRISPR阵列用作种子以鉴定新的效应蛋白。
包含C2c1和crRNA的预组装重组CRISPR-C2c1复合物可进行转染,例如通过电穿孔进行转染,从而导致高突变率并且没有可检测到的脱靶突变。Hur,J.K.等,Targetedmutagenesis in mice by electroporation of Cpf1ribonucleoproteins,NatBiotechnol.2016年6月6日.doi:10.1038/nbt.3596.[印刷版之前的电子版]。在果蝇中已经证实了使用Cpf1的高效多重系统,所述系统使用了从含有本发明tRNA的阵列中加工得到的gRNA。Port,F.等人,Expansion of the CRISPR toolbox in an animal with tRNA-flanked Cas9 and Cpf1gRNAs.doi:dx.doi.org/10.1101/046417。Cpf1和C2c1都是具有结构相似性的V型CRISPR Cas蛋白。像C2c1一样,Cpf1在PAM的远端产生交错的双链断裂(与Cas9相反,Cas9在PAM的近端产生钝切)。因此,设想了采用C2c1的类似的多重系统。
此外,“用于高度特异性基因组编辑的二聚体CRISPR RNA指导的FokI核酸酶(Dimeric CRISPR RNA-guided FokI nucleases for highly specific genomeediting)”,Shengdar Q.Tsai,Nicolas Wyvekens,Cyd Khayter,Jennifer A.Foden,Vishal Thapar,Deepak Reyon,Mathew J.Goodwin,Martin J.Aryee,J.Keith JoungNature Biotechnology 32(6):569-77(2014),涉及二聚体RNA指导的FokI核酸酶,该酶识别扩展序列并可在人类细胞中高效编辑内源基因。
关于CRISPR-Cas系统、其组件以及此类组件的递送的一般信息,包括方法、材料、递送媒介物、载体、粒子、AAV及其制造和使用,包括关于数量和制剂,在本发明的实践中所有有用者,参考:美国专利第8,697,359号、第8,771,945号、第8,795,965号、第8,865,406号、第8,871,445号、第8,889,356号、第8,889,418号、第8,895,308号、第8,906,616号、第8,932,814号、第8,945,839号、第8,993,233号和第8,999,641号;美国专利公开US 2014-0310830(美国申请系列号14/105,031)、US 2014-0287938 A1(美国申请系列号14/213,991)、US 2014-0273234 A1(美国申请系列号14/293,674)、US2014-0273232 A1(美国申请系列号14/290,575)、US 2014-0273231(美国申请系列号14/259,420)、US 2014-0256046A1(美国申请系列号14/226,274)、US 2014-0248702 A1(美国申请系列号14/258,458)、US2014-0242700 A1(美国申请系列号14/222,930)、US 2014-0242699 A1(美国申请系列号14/183,512)、US 2014-0242664 A1(美国申请系列号14/104,990)、US 2014-0234972 A1(美国申请系列号14/183,471)、US 2014-0227787 A1(美国申请系列号14/256,912)、US2014-0189896 A1(美国申请系列号14/105,035)、US 2014-0186958(美国申请系列号14/105,017)、US 2014-0186919 A1(美国申请系列号14/104,977)、US 2014-0186843 A1(美国申请系列号14/104,900)、US 2014-0179770 A1(美国申请系列号14/104,837)和US 2014-0179006 A1(美国申请系列号14/183,486)、US 2014-0170753(美国申请系列号14/183,429);US 2015-0184139(美国申请系列号14/324,960);14/054,414欧洲专利申请EP 2 771468(EP13818570.7)、EP 2 764 103(EP13824232.6)和EP 2 784 162(EP14170383.5);以及PCT专利公开WO 2014/093661(PCT/US2013/074743)、WO 2014/093694(PCT/US2013/074790)、WO 2014/093595(PCT/US2013/074611)、WO 2014/093718(PCT/US2013/074825)、WO 2014/093709(PCT/US2013/074812)、WO 2014/093622(PCT/US2013/074667)、WO 2014/093635(PCT/US2013/074691)、WO 2014/093655(PCT/US2013/074736)、WO 2014/093712(PCT/US2013/074819)、WO 2014/093701(PCT/US2013/074800)、WO 2014/018423(PCT/US2013/051418)、WO 2014/204723(PCT/US2014/041790)、WO 2014/204724(PCT/US2014/041800)、WO 2014/204725(PCT/US2014/041803)、WO 2014/204726(PCT/US2014/041804)、WO 2014/204727(PCT/US2014/041806)、WO 2014/204728(PCT/US2014/041808)、WO 2014/204729(PCT/US2014/041809)、WO 2015/089351(PCT/US2014/069897)、WO 2015/089354(PCT/US2014/069902)、WO 2015/089364(PCT/US2014/069925)、WO 2015/089427(PCT/US2014/070068)、WO 2015/089462(PCT/US2014/070127)、WO 2015/089419(PCT/US2014/070057)、WO 2015/089465(PCT/US2014/070135)、WO 2015/089486(PCT/US2014/070175)、PCT/US2015/051691、PCT/US2015/051830。还参考了分别于2013年1月30日;2013年3月15日;2013年3月28日;2013年4月20日;2013年5月6日和2013年5月28日提交的美国临时专利申请61/758,468;61/802,174;61/806,375;61/814,263;61/819,803和61/828,130。还参考了2013年6月17日提交的美国临时专利申请61/836,123。另外参考了各自于2013年6月17日提交的美国临时专利申请61/835,931、61/835,936、61/835,973、61/836,080、61/836,101和61/836,127。进一步参考了2013年8月5日提交的美国临时专利申请61/862,468和61/862,355;2013年8月28日提交的美国临时专利申请61/871,301;2013年9月25日提交的美国临时专利申请61/960,777和2013年10月28日提交的美国临时专利申请61/961,980。此外还参考了:2014年10月28日提交的PCT/US2014/62558和美国临时专利申请系列号:61/915,148、61/915,150、61/915,153、61/915,203、61/915,251、61/915,301、61/915,267、61/915,260和61/915,397,各自于2013年12月12日提交;61/757,972和61/768,959,于2013年1月29日和2013年2月25日提交;62/010,888和62/010,879,都于2014年6月11日提交;62/010,329、62/010,439和62/010,441,各自于2014年6月10日提交;61/939,228和61/939,242,各自于2014年2月12日提交;61/980,012,于2014年4月15日提交;62/038,358,于2014年8月17日提交;62/055,484、62/055,460和62/055,487,各自于2014年9月25日提交;以及62/069,243,于2014年10月27日提交。参考2014年6月10日提交的PCT申请(尤其指定美国申请)第PCT/US14/41806号。参考2014年1月22日提交的美国临时专利申请61/930,214。参考2014年6月10日提交的PCT申请(尤其指定美国申请)第PCT/US14/41806号。
还参考美国申请62/180,709,2015年6月17日,PROTECTED GUIDE RNAS(PGRNAS);美国申请62/091,455,2014年12月12日提交,PROTECTED GUIDE RNAS(PGRNAS);美国申请62/096,708,2014年12月24日,PROTECTED GUIDE RNAS(PGRNAS);美国申请62/091,462,2014年12月12日,62/096,324,2014年12月23日,62/180,681,2015年6月17日,和62/237,496,2015年10月5日,DEAD GUIDES FOR CRISPR TRANSCRIPTION FACTORS;美国申请62/091,456,2014年12月12日,和62/180,692,2015年6月17日,ESCORTED AND FUNCTIONALIZEDGUIDES FOR CRISPR-CAS SYSTEMS;美国申请62/091,461,2014年12月12日,DELIVERY,USEAND THERAPEUTIC APPLICATIONS OF THE CRISPR-CAS SYSTEMS AND COMPOSITIONS FORGENOME EDITING AS TO HEMATOPOETIC STEM CELLS(HSCs);美国申请62/094,903,2014年12月19日,UNBIASED IDENTIFICATION OF DOUBLE-STRAND BREAKS AND GENOMICREARRANGEMENT BY GENOME-WISE INSERT CAPTURE SEQUENCING;美国申请62/096,761,2014年12月24日,ENGINEERING OF SYSTEMS,METHODS AND OPTIMIZED ENZYME AND GUIDESCAFFOLDS FOR SEQUENCE MANIPULATION;美国申请62/098,059,2014年12月30日,62/181,641,2015年6月18日,和62/181,667,2015年6月18日,RNA-TARGETING SYSTEM;美国申请62/096,656,2014年12月24日,和62/181,151,2015年6月17日,CRISPR HAVING OR ASSOCIATEDWITH DESTABILIZATION DOMAINS;美国申请62/096,697,2014年12月24日,CRISPR HAVINGOR ASSOCIATED WITH AAV;美国申请62/098,158,2014年12月30日,ENGINEERED CRISPRCOMPLEX INSERTIONAL TARGETING SYSTEMS;美国申请62/151,052,2015年4月22日,CELLULAR TARGETING FOR EXTRACELLULAR EXOSOMAL REPORTING;美国申请62/054,490,2014年9月24日,DELIVERY,USE AND THERAPEUTIC APPLICATIONS OF THE CRISPR-CASSYSTEMS AND COMPOSITIONS FOR TARGETING DISORDERS AND DISEASES USING PARTICLEDELIVERY COMPONENTS;美国申请61/939,154,2014年2月12日,SYSTEMS,METHODS ANDCOMPOSITIONS FOR SEQUENCE MANIPULATION WITH OPTIMIZED FUNCTIONAL CRISPR-CASSYSTEMS;美国申请62/055,484,2014年9月25日,SYSTEMS,METHODS AND COMPOSITIONS FORSEQUENCE MANIPULATION WITH OPTIMIZED FUNCTIONAL CRISPR-CAS SYSTEMS;美国申请62/087,537,2014年12月4日,SYSTEMS,METHODS AND COMPOSITIONS FOR SEQUENCEMANIPULATION WITH OPTIMIZED FUNCTIONAL CRISPR-CAS SYSTEMS;美国申请62/054,651,2014年9月24日,DELIVERY,USE AND THERAPEUTIC APPLICATIONS OF THE CRISPR-CASSYSTEMS AND COMPOSITIONS FOR MODELING COMPETITION OF MULTIPLE CANCERMUTATIONS IN VIVO;美国申请62/067,886,2014年10月23日,DELIVERY,USE ANDTHERAPEUTIC APPLICATIONS OF THE CRISPR-CAS SYSTEMS AND COMPOSITIONS FORMODELING COMPETITION OF MULTIPLE CANCER MUTATIONS IN VIVO;美国申请62/054,675,2014年9月24日,和62/181,002,2015年6月17日,DELIVERY,USE AND THERAPEUTICAPPLICATIONS OF THE CRISPR-CAS SYSTEMS AND COMPOSITIONS IN NEURONAL CELLS/TISSUES;美国申请62/054,528,2014年9月24日,DELIVERY,USE AND THERAPEUTICAPPLICATIONS OF THE CRISPR-CAS SYSTEMS AND COMPOSITIONS IN IMMUNE DISEASES ORDISORDERS;美国申请62/055,454,2014年9月25日,DELIVERY,USE AND THERAPEUTICAPPLICATIONS OF THE CRISPR-CAS SYSTEMS AND COMPOSITIONS FOR TARGETINGDISORDERS AND DISEASES USING CELL PENETRATION PEPTIDES(CPP);美国申请62/055,460,2014年9月25日,MULTIFUNCTIONAL-CRISPR COMPLEXES AND/OR OPTIMIZED ENZYMELINKED FUNCTIONAL-CRISPR COMPLEXES;美国申请62/087,475,2014年12月4日,和62/181,690,2015年6月18日,FUNCTIONAL SCREENING WITH OPTIMIZED FUNCTIONAL CRISPR-CASSYSTEMS;美国申请62/055,487,2014年9月25日,FUNCTIONAL SCREENING WITH OPTIMIZEDFUNCTIONAL CRISPR-CAS SYSTEMS;美国申请62/087,546,2014年12月4日,和62/181,687,2015年6月18日,MULTIFUNCTIONAL CRISPR COMPLEXES AND/OR OPTIMIZED ENZYME LINKEDFUNCTIONAL-CRISPR COMPLEXES;以及美国申请62/098,285,2014年12月30日,CRISPRMEDIATED IN VIVO MODELING AND GENETIC SCREENING OF TUMOR GROWTH ANDMETASTASIS。
提及了美国申请62/181,659,2015年6月18日,和62/207,318,2015年8月19日,ENGINEERING AND OPTIMIZATION OF SYSTEMS,METHODS,ENZYME AND GUIDE SCAFFOLDS OFCAS9 ORTHOLOGS AND VARIANTS FOR SEQUENCE MANIPULATION。提及了美国申请62/181,663,2015年6月18日,和62/245,264,2015年10月22日,NOVEL CRISPR ENZYMES ANDSYSTEMS;美国申请62/181,675,2015年6月18日,62/285,349,2015年10月22日,62/296,522,2016年2月17日,和62/320,231,2016年4月8日,NOVEL CRISPR ENZYMES AND SYSTEMS;美国申请62/232,067,2015年9月24日,美国申请14/975,085,2015年12月18日,欧洲申请号16150428.7,美国申请62/205,733,2015年8月16日,美国申请62/201,542,2015年8月5日,美国申请62/193,507,2015年7月16日,和美国申请62/181,739,2015年6月18日,各自名称为NOVEL CRISPR ENZYMES AND SYSTEMS;以及美国申请62/245,270,2015年10月22日,NOVEL CRISPR ENZYMES AND SYSTEMS。还提及了美国申请61/939,256,2014年2月12日,和WO 2015/089473(PCT/US2014/070152),2014年12月12日,各自名称为ENGINEERING OFSYSTEMS,METHODS AND OPTIMIZED GUIDE COMPOSITIONS WITH NEW ARCHITECTURES FORSEQUENCE MANIPULATION。还提及了PCT/US2015/045504,2015年8月15日,美国申请62/180,699,2015年6月17日,和美国申请62/038,358,2014年8月17日,各自名称为GENOME EDITINGUSING CAS9 NICKASES。
另外,提及了PCT申请PCT/US14/70057,代理人案号47627.99.2060和BI-2013/107,名称为“DELIVERY,USE AND THERAPEUTIC APPLICATIONS OF THE CRISPR-CASSYSTEMS AND COMPOSITIONS FOR TARGETING DISORDERS AND DISEASES USING PARTICLEDELIVERY COMPONENTS”(要求以下美国临时专利申请中的一者或多者或全部的优先权:62/054,490,于2014年9月24日提交;62/010,441,于2014年6月10日提交;以及61/915,118、61/915,215和61/915,148,各自于2013年12月12日提交)(“Particle Delivery PCT”),通过引用并入本文;以及PCT申请PCT/US14/70127,代理人案号47627.99.2091和BI-2013/101,名称为“DELIVERY,USE AND THERAPEUTIC APPLICATIONS OF THE CRISPR-CAS SYSTEMS ANDCOMPOSITIONS FOR GENOME EDITING”(要求以下美国临时专利申请中的一者或多者或全部的优先权:61/915,176;61/915,192;61/915,215;61/915,107,61/915,145;61/915,148;和61/915,153,各自于2013年12月12日提交)(“Eye PCT”),通过引用并入本文,关于制备含sgRNA和Cpf1蛋白的粒子的方法,所述方法包括将包含sgRNA和Cpf1蛋白的混合物(和任选地HDR模板)与包含以下或基本上由以下组成或由以下组成的混合物混合:表面活性剂、磷脂、可生物降解的聚合物、脂蛋白和醇;以及来自所述方法的粒子。例如,其中Cpf1蛋白和sgRNA在合适的温度(例如15-30℃,例如20-25℃,例如室温)下以合适的摩尔比(例如3:1至1:3或2:1至1:2或1:1)混合在一起,持续合适的时间,例如15-45分钟,例如30分钟,有利地在无菌的无核酸酶的缓冲液例如1X PBS中。单独地,粒子组分例如或包含:表面活性剂,例如阳离子脂质,例如1,2-二油酰基-3-三甲基铵-丙烷(DOTAP);磷脂,例如二肉豆蔻酰基磷脂酰胆碱(DMPC);可生物降解的聚合物,例如乙二醇聚合物或PEG,和脂蛋白,例如低密度脂蛋白(例如胆固醇),将其溶于醇,有利的是C1-6烷基醇如甲醇、乙醇、异丙醇,例如100%乙醇中。将两种溶液混合在一起以形成含有Cas9-sgRNA复合物的粒子。因此,可将sgRNA与Cpf1蛋白预先复合,然后将整个复合物配制成粒子。可用不同摩尔比的不同组分来制备制剂,所述组分已知可促进核酸向细胞内的递送(例如1,2-二油酰基-3-三甲基铵-丙烷(DOTAP),1,2-双十四烷酰基-sn-甘油-3-磷酸胆碱(DMPC),聚乙二醇(PEG)和胆固醇)。例如,DOTAP:DMPC:PEG:胆固醇摩尔比可为DOTAP 100、DMPC0、PEG 0、胆固醇0;或DOTAP 90、DMPC 0、PEG 10、胆固醇0;或DOTAP90、DMPC 0、PEG 5、胆固醇5;DOTAP 100、DMPC 0、PEG 0、胆固醇0。所述申请相应地包括将sgRNA、Cpf1蛋白和形成粒子的组分混合;以及由这种混合产生的粒子。本发明的各方面可涉及粒子;例如,使用类似于Particle Delivery PCT或EyePCT的方法的粒子,例如,通过将本发明中包含sgRNA和/或Cpf1的混合物与形成粒子的组分混合,如在Particle Delivery PCT或Eye PCT中,形成粒子和由这种混合形成的粒子(或者,当然,如本发明中涉及sgRNA和/或Cpf1的其他粒子)。Cpf1和C2c1都是具有结构相似性的V型CRISPR-Cas蛋白。与Cas9在PAM的近端产生钝切不同,Cpf1和C2c1在PAM的远端产生交错的切口。因此,可设想具有C2c1的类似系统。
本发明可用作其中传输结果或数据的研究程序的一部分。计算机系统(或数字设备)可用于接收、传输、显示和/或存储结果,分析数据和/或结果,和/或产生结果和/或数据和/或分析的报告。计算机系统可被理解为可从介质(例如软件)和/或网络端口(例如从互联网)读取指令的逻辑装置,其可任选地连接至具有固定介质的服务器。计算机系统可包括以下中的一者或多者:CPU,磁盘驱动器,例如键盘和/或鼠标的输入设备以及显示器(例如监视器)。数据通信,例如指令或报告的传输,可通过通信介质到达本地或远程位置的服务器来实现。通信介质可包括发送和/或接收数据的任何手段。例如,通信介质可以是网络连接、无线连接或互联网连接。这样的连接可提供通过万维网(World Wide Web)的通信。可预想,与本发明有关的数据可通过这样的网络或连接(或用于发送信息的任何其他合适的手段,包括但不限于邮寄物理报告,例如打印件)来传输以供接收者接收和/或审查。接收器可以是但不限于个人或电子系统(例如一台或多台计算机和/或一台或多台服务器)。在一些实施方案中,计算机系统包括一个或多个处理器。处理器可与计算机系统的一个或多个控制器、计算单元和/或其他单元相关联,或者根据需要植入固件中。如果以软件实施,则例程可存储在任何计算机可读存储器中,例如RAM、ROM、闪存、磁盘、激光盘或其他合适的存储介质中。同样,可经由任何已知的传递方法将该软件传递给计算设备,例如,通过例如电话线、互联网、无线连接等的通信信道,或者经由可移动介质如计算机可读磁盘、闪存驱动器等。各个步骤可被实现为各种区块、操作、工具、模块和技术,而这些区块、操作、工具、模块和技术又可以硬件、固件、软件或者硬件、固件和/或软件的任意组合来实现。当以硬件实现时,一些或全部区块、操作、技术等可例如以定制集成电路(IC)、专用集成电路(ASIC)、现场可编程逻辑阵列(FPGA)、可编程逻辑阵列(PLA)等来实现。客户端-服务器、关系数据库架构可在本发明的实施方案中使用。客户端-服务器架构是其中网络上的每台计算机或处理器都是客户端或服务器的网络架构。服务器计算机通常是专用于管理磁盘驱动器(文件服务器)、打印机(打印服务器)或网络流量(网络服务器)的功能强大的计算机。客户端计算机包括用户在其上运行应用程序的PC(个人计算机)或工作站,以及如本文所公开的示例输出设备。客户端计算机依靠服务器计算机来获取资源,例如文件、设备甚至处理能力。在本发明的一些实施方案中,服务器计算机处理所有数据库功能。客户端计算机可具有处理所有前端数据管理的软件,并且还可以接收来自用户的数据输入。包括计算机可执行代码的机器可读介质可采取许多形式,包括但不限于有形存储介质、载波介质或物理传输介质。非易失性存储介质包括例如光盘或磁盘,例如任何计算机中的任何存储设备等,例如可用于实现附图中所示的数据库等。易失性存储介质包括动态存储器,例如这种计算机平台的主存储器。有形的传输介质包括同轴电缆;铜线和光纤,包括构成计算机系统内总线的电线。载波传输介质可采用电信号或电磁信号或声波或光波的形式,例如在射频(RF)和红外(IR)数据通信期间生成的那些。因此,计算机可读介质的常见形式包括例如:软盘,软磁盘,硬盘,磁带,任何其他磁性介质,CD-ROM,DVD或DVD-ROM,任何其他光学介质,打孔卡纸磁带,带孔图案的任何其他物理存储介质,RAM,ROM,PROM和EPROM,FLASH-EPROM,任何其他存储芯片或盒带,传输数据或指令的载波,传输此类载波的电缆或链接,或计算机可从中读取编程代码和/或数据的任何其他介质。这些形式的计算机可读介质中的许多可能涉及将一个或多个指令的一个或多个序列传送给处理器以执行。因此,本发明包括执行本文所讨论的任何方法以及存储和/或传输数据和/或由此产生的结果和/或其分析,以及执行本文所讨论的任何方法的产物,包括中间体。
Cas12b(C2c1)
本发明提供了C2c1(V-B型;Cas12b)效应蛋白和直系同源物。术语“直系同源物(orthologue)”(在本文中也称为“直系同源物(ortholog)”)和“同源物(homologue)”(在本文中也称为“同源物(homolog)”)在本领域中是众所周知的。通过进一步的指导,如本文所用的蛋白质的“同源物”是与所述蛋白质的同源物执行相同或相似功能的相同物种的蛋白质。同源蛋白质可以但不必在结构上相关,或者仅部分地在结构上相关。如本文所用,蛋白质的“直系同源物”是不同种类的蛋白质,其执行与其直系同源物的蛋白质相同或相似的功能。直系同源蛋白可以但不必在结构上相关,或者仅部分地在结构上相关。同源物和直系同源物可通过同源性建模来鉴定(参见例如Greer,Science第228卷(1985)1055,和Blundell等人,Eur J Biochem第172卷(1988),513)或“结构BLAST”(Dey F,Cliff Zhang Q,PetreyD,Honig B.Toward a"structural BLAST":using structural relationships to inferfunction.Protein Sci.2013年4月;22(4):359-66.doi:10.1002/pro.2225.)。关于在CRISPR-Cas基因座领域中的应用,还参见Shmakov等人,(2015)。同源蛋白质可以但不必在结构上相关,或仅部分地在结构上相关。
C2c1基因存在于几个不同的细菌基因组中,通常与cas1、cas2和cas4基因以及一个CRISPR盒位于同一基因座中。因此,这种推定的新型CRISPR-Cas系统的布局似乎与II-B型相似。此外,类似于Cas9,C2c1蛋白含有活性RuvC样核酸酶、富含精氨酸的区和Zn指(在Cas9中不存在)。
本发明涵盖源自表示为V-B亚型的C2c1基因座的C2c1(Cas12b)效应蛋白的用途。在本文中,这种效应蛋白也被称为“C2c1p”,例如,C2c1蛋白(并且这种效应蛋白或C2c1蛋白或源自C2c1基因座的蛋白也被称为“CRISPR酶”)。目前,V-B亚型基因座包括cas1-Cas4融合物,cas2,表示为C2c1的独特基因和CRISPR阵列。C2c1(CRISPR相关蛋白C2c1)是一种大蛋白(约1100-1300个氨基酸),其包含与Cas9的相应结构域同源的RuvC样核酸酶结构域,以及与Cas9的特征性精氨酸富集簇的对应部分。然而,C2c1缺少所有Cas9蛋白中都存在的HNH核酸酶结构域,并且RuvC样结构域在C2c1序列中是连续的,与Cas9相比,它含有包含HNH结构域的长插入物。因此,在特定的实施方案中,CRISPR-Cas酶仅包含RuvC样核酸酶结构域。
C2c1(也称为Cas12b)蛋白是RNA指导的核酸酶。其切割依赖于tracr RNA以募集包含指导序列和正向重复序列的指导RNA,其中所述指导序列与靶核苷酸序列杂交以形成DNA/RNA异源双链体。根据目前的研究,C2c1核酸酶活性还需要依赖于PAM序列的识别。C2c1PAM序列可以是富含T的序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一个特定的实施方案中,PAM序列是5'TTC 3'。在一个特定的实施方案中,PAM处于恶性疟原虫的序列中。
C2c1在靶基因座处产生交错切口,带有5'突出端,或者在靶序列的PAM远侧具有“粘性端”。在一些实施方案中,5'突出端为7nt。参见Lewis和Ke,Mol Cell.2017年2月2日;65(3):377-379。
本发明还提供了涵盖使用C2c1效应蛋白的CRISPR-C2c1系统。在一些实施方案中,所述系统包含:I.CRISPR-Cas系统RNA多核苷酸序列,其中所述多核苷酸序列包含:crRNA,其包含(a)正向重复多核苷酸和(b)能够与靶序列杂交的指导序列多核苷酸;II.tracr RNA多核苷酸;和III.编码C2c1的多核苷酸序列,其任选地包含至少一个或多个核定位序列,其中所述正向重复序列与所述指导序列杂交并且引导CRISPR复合物与靶序列的序列特异性结合,并且其中所述CRISPR复合物包含与以下各物复合的CRISPR蛋白:(1)与靶序列杂交或可杂交的指导序列,和(2)正向重复序列,并且编码CRISPR蛋白的多核苷酸序列为DNA或RNA。tracr可与crRNA融合。例如,可在正向重复序列的5'端将tracr RNA与crRNA融合。如本文所用,术语crRNA是指CRISPR RNA,并且在本文中可与术语gRNA或指导RNA互换使用。当tracr与gRNA的crRNA融合时,可将其称为单指导RNA或合成指导RNA(sgRNA)。
与Cas9在PAM的近端发生切割相反,C2c1在PAM的远端产生了双链断裂(Jinek等人,2012;Cong等人,2013)。已提出Cpf1突变靶序列可能易于被单个gRNA重复切割,从而促进Cpf1在HDR介导的基因组编辑中的应用(Front Plant Sci.2016年11月14日;7:1683)。Cpf1和C2c1都是具有结构相似性的V型CRISPR Cas蛋白。像C2c1一样,Cpf1在PAM的远端产生交错的双链断裂(与Cas9不同,Cas9在PAM的近端产生钝切),但是与Cpf1不同,C2c1系统使用tracrRNA。因此,在某些实施方案中,通过CRISPR-C2c1复合物经由同源性定向修复(HR或HDR)来修饰目标基因座。在某些实施方案中,通过不依赖于HR的CRISPR-C2c1复合物来修饰目标基因座。在某些实施方案中,通过CRISPR-C2c1复合物经由非同源末端连接(NHEJ)来修饰目标基因座。
与Cas9产生的钝端相反,C2c1产生了带有5'突出端的交错切口(Garneau等人,Nature.2010;468:67-71;Gasiunas等人,Proc Natl Acad Sci U S A.2012;109:E2579-2586)。切割产物的这种结构对于促进基于非同源末端连接(NHEJ)的基因插入到哺乳动物基因组中可能特别有利(Maresca等人,Genome research.2013;23:539-546)。
在特定的实施方案中,效应蛋白是来自或源自包括以下各属的生物体的C2c1效应蛋白:脂环酸芽孢杆菌属(Alicyclobacillus)、脱硫弧菌属(Desulfovibrio)、脱硫弯曲杆菌属(Desulfonatronum)、丰佑菌科(Opitutaceae)、热生肿块芽孢杆菌属(Tuberibacillus)、芽孢杆菌属(Bacillus)、短芽孢杆菌属(Brevibacillus)、Candidatus、Desulfatirhabdium、柠檬酸杆菌属(Citrobacter)、迷踪菌门(Elusimicrobia)、甲基杆菌属(Methylobacterium)、Omnitrophica、菲西芬氏菌纲、浮霉菌门、螺旋体属(Spirochaetes)、疣微菌门(Verrucomicrobiaceae)、黏胶球形菌纲、莱西氏菌属(Laceyella)。
在另外的特定实施方案中,C2c1效应蛋白来自或源自选自以下的物种:酸土脂环酸芽孢杆菌(例如ATCC 49025),污染脂环酸芽孢杆菌(Alicyclobacillus contaminans)(例如DSM 17975),大孢子脂环酸芽孢杆菌(Alicyclobacillus macrosporangiidus)(例如DSM 17980),外村尚芽孢杆菌菌株C4,Candidatus Lindowbacteria细菌RIFCSPLOWO2,依诺脱硫弧菌(Desulfovibrio inopinatus)(例如DSM 10711),硫歧化脱硫弯曲杆菌(Desulfonatronum thiodismutans)(例如菌株MLF-1或genbank登录号WP_031386437),迷踪菌门细菌RIFOXYA12,Omnitrophica WOR_2细菌RIFCSPHIGHO2,丰佑菌科细菌TAV5或genbank登录号WP_009513281,菲西芬氏菌纲细菌ST-NAGAB-D1,浮霉菌门细菌RBG_13_46_10,螺旋体属细菌GWB1_27_13,疣微菌门细菌UBA2429,好温热生肿块芽孢杆菌(Tuberibacillus calidus)(例如DSM 17572),热噬淀粉芽孢杆菌(例如菌株B4166),短芽孢杆菌属CF112种,芽孢杆菌属NSP2.1种,Desulfatirhabdium butyrativorans(例如DSM18734或genbank登录号WP_028326052),绿草脂环酸芽孢杆菌(Alicyclobacillusherbarius)(例如DSM 13609),弗氏柠檬酸杆菌(Citrobacter freundii)(例如ATCC8090),土壤短芽孢杆菌(例如BAB-2500),结瘤甲基杆菌(Methylobacterium nodulans)(例如ORS 2060或genbank登录号WP_043747912),卡克氏脂环酸芽孢杆菌(例如genbank登录号WP_067936067),芽孢杆菌属V3-13种(例如genbank登录号WP_101661451),黏胶球形菌纲细菌(例如来自DCFZ01000012),沉积物莱西氏菌(Laceyella_sediminis)(例如genbank登录号WP_106341859)。
在某些实施方案中,C2c1效应蛋白来自或源自选自以下的物种:脂环酸芽孢杆菌属、芽孢杆菌属、Desulfatirhabdium、脱硫弯曲杆菌属、黏胶球形菌纲、莱西氏菌属、甲基杆菌属或丰佑菌科。
在某些实施方案中,C2c1效应蛋白来自或源自选自以下的物种:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、Desulfatirhabdium butyrativorans、硫歧化脱硫弯曲杆菌、黏胶球形菌纲细菌、沉积物莱西氏菌、结瘤甲基杆菌或丰佑菌科细菌。
在某些实施方案中,C2c1效应蛋白来自或源自选自以下的物种:卡克氏脂环酸芽孢杆菌,其中野生型序列对应于WP_067936067的序列;芽孢杆菌属V3-13种,其中野生型序列对应于WP_101661451的序列;Desulfatirhabdium butyrativorans,其中野生型序列对应于WP_028326052的序列;硫歧化脱硫弯曲杆菌,其中野生型序列对应于WP_031386437的序列;黏胶球形菌纲细菌,其中野生型序列对应于DCFZ01000012的序列;沉积物莱西氏菌,其中野生型序列对应于WP_106341859的序列;结瘤甲基杆菌,其中野生型序列对应于WP_043747912的序列;或丰佑菌科细菌,其中野生型序列对应于WP_009513281的序列。
在某些实施方案中,C2c1效应蛋白来自或源自选自表1的物种,并且具有如表1所示的野生型序列。应当理解,如本文其他地方所述的突变或截短的Cas12b蛋白可偏离所示序列。
在某些实施方案中,C2c1效应蛋白来自或源自选自黏胶球形菌属或莱西氏菌属的物种。
在某些实施方案中,C2c1效应蛋白来自或源自选自以下的物种:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、黏胶球形菌纲细菌或沉积物莱西氏菌。
在某些实施方案中,C2c1效应蛋白来自或源自选自以下的物种:卡克氏脂环酸芽孢杆菌,其中野生型序列对应于WP_067936067的序列;芽孢杆菌属V3-13种,其中野生型序列对应于WP_101661451的序列;黏胶球形菌纲细菌,其中野生型序列对应于DCFZ01000012的序列;或沉积物莱西氏菌,其中野生型序列对应于WP_106341859的序列。
在某些实施方案中,C2c1效应蛋白来自或源自选自表2的物种,并且具有如表2所示的野生型序列。应当理解,本文其他地方所述的突变或截短的Cas12b蛋白可偏离所示序列。
效应蛋白可包含嵌合效应蛋白,其包含来自第一效应蛋白(例如C2c1)直系同源物的第一片段和来自第二效应子(例如C2c1)蛋白直系同源物的第二片段,并且其中所述第一效应蛋白直系同源物和第二效应蛋白直系同源物是不同的。第一效应蛋白和第二效应蛋白(例如C2c1)直系同源物中的至少一者可包含来自或源自包含以下的生物体的效应蛋白(例如C2c1):脂环酸芽孢杆菌属、脱硫弧菌属、脱硫弯曲杆菌属、丰佑菌科、热生肿块芽孢杆菌属、芽孢杆菌属、短芽孢杆菌属、Candidatus、Desulfatirhabdium、迷踪菌门、柠檬酸杆菌属、甲基杆菌属、Omnitrophicai、菲西芬氏菌纲、浮霉菌门、螺旋体属、疣微菌门、黏胶球形菌纲或莱西氏菌属;例如,包含第一片段和第二片段的嵌合效应蛋白,其中所述第一片段和所述第二片段各自选自以下生物体的C2c1,所述生物体包括脂环酸芽孢杆菌属、脱硫弧菌属、脱硫弯曲杆菌属、丰佑菌科、热生肿块芽孢杆菌属、芽孢杆菌属、短芽孢杆菌属、Candidatus、Desulfatirhabdium、迷踪菌门、柠檬酸杆菌属、甲基杆菌属、Omnitrophicai、菲西芬氏菌纲、浮霉菌门、螺旋体属、疣微菌门、黏胶球形菌纲或莱西氏菌属,其中所述第一片段和所述第二片段不是来自同一细菌;例如包含第一片段和第二片段的嵌合效应蛋白,其中所述第一片段和所述第二片段各自选自以下物种的C2c1:酸土脂环酸芽孢杆菌(例如ATCC 49025)、污染脂环酸芽孢杆菌(例如DSM 17975)、大孢子脂环酸芽孢杆菌(例如DSM17980)、外村尚芽孢杆菌菌株C4、Candidatus Lindowbacteria细菌RIFCSPLOWO2、依诺脱硫弧菌(例如DSM 10711)、硫歧化脱硫弯曲杆菌(例如菌株MLF-1或genbank登录号WP_031386437)、迷踪菌门细菌RIFOXYA12、Omnitrophica WOR_2细菌RIFCSPHIGHO2、丰佑菌科细菌TAV5或genbank登录号WP_009513281、菲西芬氏菌纲细菌ST-NAGAB-D1、浮霉菌门细菌RBG_13_46_10、螺旋体属细菌GWB1_27_13、疣微菌门细菌UBA2429、好温热生肿块芽孢杆菌(例如DSM 17572)、热噬淀粉芽孢杆菌(例如菌株B4166)、短芽孢杆菌属CF112种、芽孢杆菌属NSP2.1种、Desulfatirhabdium butyrativorans(例如DSM 18734或genbank登录号WP_028326052)、绿草脂环酸芽孢杆菌(例如DSM 13609)、弗氏柠檬酸杆菌(例如ATCC 8090)、土壤短芽孢杆菌(例如BAB-2500)、结瘤甲基杆菌(例如ORS 2060或genbank登录号WP_043747912)、卡克氏脂环酸芽孢杆菌(例如genbank登录号WP_067936067)、芽孢杆菌属V3-13种(例如genbank登录号WP_101661451)、黏胶球形菌纲细菌(例如来自DCFZ01000012)、沉积物莱西氏菌(例如genbank登录号WP_106341859),其中所述第一片段和所述第二片段不是来自同一细菌。如本文所用,当Cas12蛋白(例如Cas12b)源自一个物种时,其可以是所述物种中的野生型Cas12蛋白,或所述物种中的野生型Cas12蛋白的同源物。作为所述物种中的野生型Cas12蛋白的同源物的Cas12蛋白可包含野生型Cas12蛋白的一种或多种变异(例如,突变、截短等)。
在一个更优选的实施方案中,C2c1b衍生自或源自选自以下的细菌物种:酸土脂环酸芽孢杆菌(例如ATCC 49025)、污染脂环酸芽孢杆菌(例如DSM17975)、大孢子脂环酸芽孢杆菌(例如DSM 17980)、外村尚芽孢杆菌菌株C4、Candidatus Lindowbacteria细菌RIFCSPLOWO2、依诺脱硫弧菌(例如DSM10711)、硫歧化脱硫弯曲杆菌(例如菌株MLF-1或genbank登录号WP_031386437)、迷踪菌门细菌RIFOXYA12、Omnitrophica WOR_2细菌RIFCSPHIGHO2、丰佑菌科细菌TAV5或genbank登录号WP_009513281、菲西芬氏菌纲细菌ST-NAGAB-D1、浮霉菌门细菌RBG_13_46_10、螺旋体属细菌GWB1_27_13、疣微菌门细菌UBA2429、好温热生肿块芽孢杆菌(例如DSM 17572)、热噬淀粉芽孢杆菌(例如菌株B4166)、短芽孢杆菌属CF112种、芽孢杆菌属NSP2.1种、Desulfatirhabdium butyrativorans(例如DSM 18734或genbank登录号WP_028326052)、绿草脂环酸芽孢杆菌(例如DSM 13609)、弗氏柠檬酸杆菌(例如ATCC 8090)、土壤短芽孢杆菌(例如BAB-2500)、结瘤甲基杆菌(例如ORS 2060或genbank登录号WP_043747912)、卡克氏脂环酸芽孢杆菌(例如genbank登录号WP_067936067)、芽孢杆菌属V3-13种(例如genbank登录号WP_101661451)、黏胶球形菌纲细菌(例如来自DCFZ01000012)、沉积物莱西氏菌(例如genbank登录号WP_106341859)。在某些实施方案中,C2c1p衍生自选自以下的细菌物种:酸土脂环酸芽孢杆菌(例如ATCC 49025)、污染脂环酸芽孢杆菌(例如DSM 17975)。
在特定的实施方案中,如本文所提及的C2c1的同源物或直系同源物与C2c1具有至少80%、更优选至少85%、甚至更优选至少90%、例如至少95%的序列同源性或同一性。在其他实施方案中,如本文所提及的C2c1的同源物或直系同源物与野生型C2c1具有至少80%、更优选至少85%、甚至更优选至少90%、例如至少95%的序列同一性。当C2c1具有一个或多个突变(突变的)时,如本文所提及的所述C2c1的同源物或直系同源物与突变C2c1具有至少80%、更优选至少85%、甚至更优选至少90%、例如至少95%的序列同一性。
在一个实施方案中,C2c1蛋白可以是以下各属的生物体的直系同源物,所述属包括但不限于脂环酸芽孢杆菌属、脱硫弧菌属、脱硫弯曲杆菌属、丰佑菌科、热生肿块芽孢杆菌属、芽孢杆菌属、短芽孢杆菌属、Candidatus、Desulfatirhabdium、迷踪菌门、柠檬酸杆菌属、甲基杆菌属、Omnitrophicai、菲西芬氏菌纲、浮霉菌门、螺旋体属、疣微菌门、黏胶球形菌纲或莱西氏菌属;在特定的实施方案中,V型Cas蛋白可以是以下物种的生物体的直系同源物,所述物种包括但不限于酸土脂环酸芽孢杆菌(例如ATCC 49025)、污染脂环酸芽孢杆菌(例如DSM 17975)、大孢子脂环酸芽孢杆菌(例如DSM17980)、外村尚芽孢杆菌菌株C4、Candidatus Lindowbacteria细菌RIFCSPLOWO2、依诺脱硫弧菌(例如DSM 10711)、硫歧化脱硫弯曲杆菌(例如菌株MLF-1或genbank登录号WP_031386437)、迷踪菌门细菌RIFOXYA12、Omnitrophica WOR_2细菌RIFCSPHIGHO2、丰佑菌科细菌TAV5或genbank登录号WP_009513281、菲西芬氏菌纲细菌ST-NAGAB-D1、浮霉菌门细菌RBG_13_46_10、螺旋体属细菌GWB1_27_13、疣微菌门细菌UBA2429、好温热生肿块芽孢杆菌(例如DSM 17572)、热噬淀粉芽孢杆菌(例如菌株B4166)、短芽孢杆菌属CF112种、芽孢杆菌属NSP2.1种、Desulfatirhabdium butyrativorans(例如DSM 18734或genbank登录号WP_028326052)、绿草脂环酸芽孢杆菌(例如DSM 13609)、弗氏柠檬酸杆菌(例如ATCC 8090)、土壤短芽孢杆菌(例如BAB-2500)、结瘤甲基杆菌(例如ORS2060或genbank登录号WP_043747912)、卡克氏脂环酸芽孢杆菌(例如genbank登录号WP_067936067)、芽孢杆菌属V3-13种(例如genbank登录号WP_101661451)、黏胶球形菌纲细菌(例如来自DCFZ01000012)、沉积物莱西氏菌(例如Genbank登录号WP_106341859)、芽孢杆菌属V3-13种(例如GenBank登录号WP_101661451)。在特定的实施方案中,如本文所提及的C2c1的同源物或直系同源物与本文公开的一个或多个C2c1序列具有至少80%、更优选至少85%、甚至更优选至少90%、例如至少95%的序列同源性或同一性。在其他实施方案中,如本文所提及的C2c1的同源物或直系同源物与野生型AacC2c1或BthC2c1具有至少80%、更优选至少85%、甚至更优选至少90%、例如至少95%的序列同一性。
在特定的实施方案中,本发明的C2c1蛋白与AacC2c1或BthC2c1具有至少60%、更特别是至少70、例如至少80%、更优选地至少85%、甚至更优选地至少90%、例如至少95%的序列同源性或同一性。在其他实施方案中,如本文所提及的C2c1蛋白与野生型AacC2c1具有至少60%、例如至少70%、更特别是至少80%、更优选至少85%、甚至更优选至少90%、例如至少95%的序列同一性。在特定的实施方案中,本发明的C2c1蛋白与AacC2c1具有小于60%的序列同一性。技术人员将理解,这包括C2c1蛋白的截短形式,由此在截短形式的长度上确定序列同一性。
在某些示例实施方案中,Cas12b直系同源物在例如约25℃、约26℃、约27℃、约28℃、约29℃、约30℃、约31℃、约32℃、约33℃、约34℃、约35℃、约36℃、约37℃、约38℃、约39℃、约40℃、约41℃、约42℃、约43℃、约44℃、约45℃、约46℃、约47℃、约48℃、约49℃或约50℃的温度下可具有活性(例如,核酸(例如RNA或DNA)切割活性)。给定的Cas12b直系同源物可能在一定温度范围(例如30℃至50℃、30℃至48℃、37℃至42℃、或37℃至48℃)下具有其最佳活性。在一些实例中,BvCas12b可在约37℃下具有活性。在一些实例中,BhCas12b(例如,本文公开的变体4)可在约37℃下具有活性。在一些实例中,AkCas12b可在约48℃下具有活性。所述活性可为真核细胞中Cas12b直系同源物的活性。可替代地或另外地,活性可以是原核细胞中直系同源物的活性。在某些情况下,这种活性可能是最佳活性。
修饰的C2c1酶
在特定的实施方案中,令人感兴趣的是利用如本文所定义的工程化的C2c1蛋白,例如C2c1,其中所述蛋白与包含RNA的核酸分子复合以形成CRISPR复合物,其中当在CRISPR复合物中时,所述核酸分子靶向一个或多个靶多核苷酸基因座,与未修饰的C2c1蛋白相比,所述蛋白质包含至少一个修饰,并且其中与包含未修饰的C2c1蛋白的复合物相比,包含修饰蛋白质的CRISPR复合物具有改变的活性。应当理解,当在本文中提及CRISPR“蛋白”时,C2c1蛋白优选是修饰的CRISPR酶(例如具有增加的或降低的(或无)酶活性,例如但不限于包括C2c1。术语“CRISPR蛋白”可与“CRISPR酶”互换使用,无论CRISPR蛋白是否已改变,例如与野生型CRISPR蛋白相比,增加的或降低的(或无)酶活性。
除上述突变外,还可对CRISPR-Cas蛋白进行修饰。如本文所用,关于CRISPR-Cas蛋白的术语“修饰的”通常是指与其来源的野生型Cas蛋白相比具有一个或多个修饰或突变(包括点突变、截短、插入、缺失、嵌合体、融合蛋白等)的CRISPR-Cas蛋白。衍生的是指衍生的酶在很大程度上与野生型酶具有高度的序列同源性,但是已经以本领域已知或如本文所述的某种方式进行了突变(修饰)。
CRISPR-Cas蛋白的其他修饰可能会或可能不会导致功能性改变。举例来说,并且特别是关于CRISPR-Cas蛋白,不导致功能性改变的修饰包括例如密码子优化以表达到特定宿主中,或提供具有特定标志物的核酸酶(例如用于可视化)。可能导致功能性改变的修饰也可包括突变,包括点突变、插入、缺失、截短(包括分裂的核酸酶)等。融合蛋白可能包括但不限于例如与异源结构域或功能结构域(例如定位信号、催化结构域等)的融合。在某些实施方案中,可组合各种不同的修饰(例如,无催化活性的突变核酸酶,并且其进一步与功能结构域融合,例如以诱导DNA甲基化或另一种核酸修饰,例如包括但不限于断裂(例如通过不同的核酸酶(结构域))、突变、缺失、插入、置换、连接、消化、断裂或重组)。如本文所用,“改变的功能性”包括但不限于改变的特异性(例如改变的靶标识别,增加的(例如“增强的”Cas蛋白)或降低的特异性,或改变的PAM识别),改变的活性(例如增加或降低的催化活性,包括无催化活性的核酸酶或切口酶)和/或改变的稳定性(例如与去稳定结构域的融合)。合适的异源结构域包括但不限于核酸酶、连接酶、修复蛋白、甲基转移酶、(病毒)整合酶、重组酶、转座酶、argonaute、胞苷脱氨酶、retron、II族内含子、磷酸酶、磷酸化酶、磺酰化酶、激酶、聚合酶、核酸外切酶等。所有这些修饰的实例是本领域已知的。应当理解,如本文所提及的“修饰的”核酸酶,特别是“修饰的”Cas或“修饰的”CRISPR-Cas系统或复合物优选仍具有与多核酸相互作用或结合的能力(例如与指导分子复合)。如本文所述,此类修饰的Cas蛋白可与脱氨酶蛋白或其活性结构域结合。
在某些实施方案中,CRISPR-Cas蛋白可包含一种或多种修饰,导致增强的活性和/或特异性,例如包括使靶向或非靶向链稳定的突变残基(例如eCas9;“具有改进的特异性的合理工程化的Cas9核酸酶(Rationally engineered Cas9 nucleases with improvedspecificity)”,Slaymaker等人,(2016),Science,351(6268):84-88,通过引用整体并入本文)。在某些实施方案中,工程化CRISPR蛋白的改变或修饰的活性包括增加的靶向效率或降低的脱靶结合。在某些实施方案中,工程化CRISPR蛋白的改变的活性包括修饰的切割活性。在某些实施方案中,改变的活性包括对靶多核苷酸基因座的增加的切割活性。在某些实施方案中,改变的活性包括针对靶多核苷酸基因座的降低的切割活性。在某些实施方案中,改变的活性包括针对脱靶多核苷酸基因座的降低的切割活性。在某些实施方案中,修饰的核酸酶的改变的或修饰的活性包括改变的解旋酶动力学。在某些实施方案中,修饰的核酸酶包含改变蛋白质与包含RNA的核酸分子(在Cas蛋白的情况下)或靶多核苷酸基因座的链或脱靶多核苷酸基因座的链的缔合的修饰。在本发明的一个方面,工程化的CRISPR蛋白包含改变CRISPR复合物的形成的修饰。在某些实施方案中,改变的活性包括针对脱靶多核苷酸基因座的增加的切割活性。因此,在某些实施方案中,与脱靶多核苷酸基因座相比,对靶多核苷酸基因座的特异性增加。在其他实施方案中,与脱靶多核苷酸基因座相比,对靶多核苷酸基因座的特异性降低。在某些实施方案中,所述突变导致脱靶效应降低(例如切割或结合特性,活性或动力学),例如在Cas蛋白的情况下,例如导致对靶RNA与指导RNA之间的错配的较低耐受性。其他突变可导致脱靶效应增加(例如切割或结合特性,活性或动力学)。其他突变可导致增加或降低的在靶效应(例如切割或结合特性,活性或动力学)。在某些实施方案中,突变导致改变的(例如增加或降低的)解旋酶活性,功能性核酸酶复合物(例如CRISPR-Cas复合物)的缔合或形成。在某些实施方案中,如上所述,所述突变导致改变的PAM识别,即,与未修饰的Cas蛋白相比,可(另外或可替代地)识别不同的PAM。为了增强特异性,特别优选的突变包括带正电的残基和/或(进化的)保守残基,例如保守的带正电残基。在某些实施方案中,这样的残基可突变为不带电荷的残基,例如丙氨酸。
C2c1的晶体结构揭示与另一个V型Cas蛋白Cpf1(也称为Cas12a)的相似性。C2c1和Cpf1都由α-螺旋识别叶(REC)和核酸酶叶(NUC)组成。NUC叶还包含寡核苷酸结合(WED/OBD)结构域、RuvC结构域、Nuc结构域和桥螺旋(BH),具有结构改组和折叠以形成完整的3D C2c1结构(Liu等人,Mol.Cell 65,310-322)。Nuc结构域中的某些突变(例如AsCpf1中的R1226A,BvCas12b中的R894A)使Cpf1成为用于非靶链切割的切口酶。RuvC结构域中催化残基的突变(例如AsCpf1的D908、E933、D1263处的突变)消除了Cpf1作为核酸酶的催化活性。此外,已经显示Cpf1的PAM相互作用(PI)结构域中的突变(例如AsCpf1的S542、K548、N522和K607处的突变)会改变Cpf1特异性,从而可能增加或减少脱靶切割(参见Gao等人,Cell Research(2016)26,901-913(2016);Gao等人,Nature Biotechnology 35,789-792(2017))。C2c1的晶体结构还揭示,C2c1缺乏可鉴定的PI结构域;相反,建议对C2c1进行构象调整以适应PAM近端双链DNA的结合,以进行PAM识别和R环形成;C2c1可能参与WED/OBD和α螺旋结构域,以从主要和次要凹槽侧识别PAM双链体(Yang等人,Cell 167,1814-1828(2016))。
根据本发明,可产生突变体,其导致酶失活或将双链核酸酶修饰成切口酶活性,或者其改变C2c1的PAM识别特异性。在某些实施方案中,该信息用于开发脱靶效应降低的酶。
在某些示例实施方案中,编辑偏好是针对靶区域内的特定插入或缺失。在某些示例实施方案中,至少一种修饰增加了一个或多个特定插入/缺失的形成。在某些示例实施方案中,至少一种修饰是在C末端RuvC样结构域、NUC结构域、N末端α-螺旋区域、混合的α和β区域或其组合中。在某些示例实施方案中,改变的编辑偏好是插入/缺失形成。在某些示例实施方案中,至少一种修饰增加了一个或多个特定插入的形成。
在某些示例实施方案中,至少一个修饰增加了一个或多个特定插入的形成。在某些示例实施方案中,至少一个修饰导致在靶区域中插入与A、T、G或C相邻的A。在另一个示例实施方案中,至少一个修饰导致在靶区域中插入与A、T、G或C相邻的T。在另一个示例实施方案中,至少一个修饰导致在靶区域中插入与A、T、G或C相邻的G。在另一个示例实施方案中,至少一个修饰导致在靶区域中插入与A、T、C或G相邻的C。插入可以是相邻核苷酸的5'或3'。在一个示例性实施方案中,一个或多个修饰引导与现有T相邻的T的插入。在某些示例实施方案中,现有T对应于指导序列结合区域中的第4位。在某些示例实施方案中,一个或多个修饰产生确保更精确的单碱基插入或缺失的酶,例如上述那些。更具体地,一个或多个修饰可减少酶引起的其他类型的插入/缺失的形成。产生单碱基插入或缺失的能力在许多应用中可能是令人感兴趣的,例如在由小缺失引起的疾病中校正遗传突变体,更特别是在不可能进行HDR的情况下。例如,经由递送引导三个T插入的三个sRNA来校正CFTR中的F508del突变,这是囊性纤维化的最常见的基因型,或者Alia Jafar在大脑CDKL5中单核苷酸缺失的校正。由于编辑方法仅需要NHEJ,因此在有丝分裂后的细胞(例如大脑)中可进行编辑。产生一个碱基对插入/缺失的能力在全基因组CRISPR-Cas阴性选择筛选中也可能有用。在某些示例实施方案中,至少一个修饰是突变。在某些其他示例实施方案中,一个或多个修饰可与以下所述的一个或多个其他修饰或突变组合,包括增加结合特异性和/或降低脱靶效应的修饰。
在某些示例实施方案中,包含与野生型相比改变编辑偏好的至少一个修饰的工程化CRISPR-cas效应子还可包含一个或多个另外的修饰,其改变对包含RNA或靶多肽基因座的核酸分子的结合特性,改变与核酸分子或靶分子或靶多核苷酸的结合动力学,或改变与核酸分子的结合特异性。以下段落概述了此类修饰的实例。根据上述信息,可产生导致酶失活或将双链核酸酶修饰成切口酶活性的突变体。在替代实施方案中,该信息用于开发具有降低的脱靶效应的酶。
修饰的切口酶
也可在参与核酸酶活性的氨基酸的相邻残基处进行突变。在一些实施方案中,仅RuvC结构域失活,而在其他实施方案中,另一假定的核酸酶结构域失活,其中效应蛋白复合物起切口酶的作用并且仅切割一条DNA链。在一些实施方案中,两个C2c1变体(各为不同的切口酶)用于增加特异性,两个切口酶变体用于在靶标上切割DNA(其中两个切口酶均切割DNA链,同时最小化或消除脱靶修饰,其中仅一个DNA链被切割并且随后修复)。在优选的实施方案中,C2c1效应蛋白切割与目标靶位点相关或在目标靶位点处的序列,作为包含两个C2c1效应蛋白分子的同型二聚体。在一个优选的实施方案中,同型二聚体可包含两个C2c1效应蛋白分子,其在各自的RuvC结构域中包含不同的突变。
本发明考虑使用两种或更多种切口酶的方法,特别是双重或双切口酶方法。在一些方面和实施方案中,可递送单一类型的C2c1切口酶,例如如本文所述的修饰的C2c1或修饰的C2c1切口酶。这导致靶DNA被两个C2c1切口酶结合。另外,还设想可使用不同的直系同源物,例如,DNA的一条链(例如编码链)上的C2c1切口酶和非编码或相反的DNA链上的直系同源物。直系同源物可以是但不限于Cas9切口酶,例如SaCas9切口酶或SpCas9切口酶。使用两个需要不同PAM并可能还具有不同指导要求的不同直系同源物可能是有利的,因此允许用户进行更多控制。在某些实施方案中,DNA切割将涉及至少四种类型的切口酶,其中每种类型被引导至靶DNA的不同序列,其中每对将第一切口引入一条DNA链并且第二对将切口引入第二DNA链。在这样的方法中,将至少两对单链断裂引入靶DNA,其中在引入第一对和第二对单链断裂后,切除第一对和第二对单链断裂之间的靶序列。在某些实施方案中,直系同源物中的一者或两者是可控的,即可诱导的。
在根据本发明的某些方法中,优选将CRISPR-Cas蛋白相对于相应的野生型酶进行突变,使得突变的CRISPR-Cas蛋白缺乏切割含有靶序列的靶基因座的一条或两条DNA链的能力。在特定的实施方案中,将C2c1蛋白的一个或多个催化结构域突变以产生仅切割靶序列的一条DNA链的突变的Cas蛋白。
在本文提供的方法的某些实施方案中,CRISPR-Cas蛋白是仅切割一条DNA链的突变的CRISPR-Cas蛋白,即切口酶。更特别地,在本发明的上下文中,切口酶确保在非靶序列即在靶序列的相反DNA链上并且是PAM序列的3'的序列内的切割。通过进一步指导,但不限于,来自酸土脂环酸芽孢杆菌的C2c1的Nuc结构域中的精氨酸-丙氨酸取代(R911A)将C2c1从切割两条链的核酸酶转化为切口酶(切割一条链)。本领域技术人员将理解,在所述酶不是AacC2c1的情况下,可在相应位置的残基处进行突变。
在某些实施方案中,C2c1蛋白是在Nuc结构域中包含突变的C2c1切口酶。在一些实施方案中,C2c1切口酶包含对应于酸土脂环酸芽孢杆菌C2c1中的氨基酸位置R911、R1000或R1015的突变。在一些实施方案中,C2c1切口酶包含对应于酸土脂环酸芽孢杆菌C2c1中的R911A、R1000A或R1015A的突变。在一些实施方案中,C2c1切口酶包含对应于芽孢杆菌属V3-13种C2c1中的R894A的突变。在某些实施方案中,与所述蛋白的未突变或未修饰形式相比,C2c1蛋白识别具有增加或降低的特异性的PAM。在一些实施方案中,与所述蛋白的未突变或未修饰形式相比,C2c1蛋白识别改变的PAM。
减活/失活的C2c1蛋白
在C2c1蛋白具有核酸酶活性的情况下,所述蛋白可被修饰以具有降低的核酸酶活性,例如,与野生型酶相比核酸酶失活至少70%、至少80%、至少90%、至少95%、至少97%或100%;或者换句话讲,C2c1酶有利地具有非突变或野生型C2c1酶或CRISPR酶的核酸酶活性的约0%,或不超过非突变或野生型C2c1酶的核酸酶活性的约3%或约5%或约10%。在一些实施方案中,当突变酶的DNA切割活性为所述酶的非突变形式的DNA切割活性的约不超过25%、10%、5%、1%、0.1%、0.01%或更小时,认为CRISPR-Cas蛋白基本上缺乏所有DNA切割活性;一个实例可以是当突变形式的DNA切割活性与非突变形式相比为零或可忽略时。在这些实施方案中,将CRISPR-Cas蛋白用作通用DNA结合蛋白。通过将突变引入C2c1的核酸酶结构域及其直系同源物中,这是可能的。
在某些实施方案中,CRISPR酶被工程化并且可包含一种或多种降低或消除核酸酶活性的突变。
在某些实施方案中,C2c1蛋白是无催化活性的C2c1,其在RuvC结构域中包含突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于酸土脂环酸芽孢杆菌C2c1中的氨基酸位置D570、E848或D977的突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于酸土脂环酸芽孢杆菌C2c1中的D570A、E848A或D977A的突变。
在一些实施方案中,无催化活性的C2c1蛋白包含对应于外村尚芽孢杆菌C2c1中的氨基酸位置D574、E828或D952的突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于外村尚芽孢杆菌C2c1中的D574A、E828A或D952A的突变。
在一些实施方案中,无催化活性的C2c1蛋白包含对应于芽孢杆菌属V3-13种C2c1中的氨基酸位置D567、E831或D963的突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于芽孢杆菌属V3-13种C2c1中的D567A、E831A或D963A的突变。
在某些实施方案中,C2c1蛋白是无催化活性的C2c1,其在RuvC结构域中包含突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于酸土脂环酸芽孢杆菌C2c1中的氨基酸位置D570、E848或D977的突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于酸土脂环酸芽孢杆菌C2c1中的D570A、E848A或D977A的突变。
在一些实施方案中,无催化活性的C2c1蛋白包含对应于外村尚芽孢杆菌C2c1中的氨基酸位置D574、E828或D952的突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于外村尚芽孢杆菌C2c1中的D574A、E828A或D952A的突变。
在一些实施方案中,无催化活性的C2c1蛋白包含对应于芽孢杆菌属V3-13种C2c1中的氨基酸位置D567、E831或D963的突变。在一些实施方案中,无催化活性的C2c1蛋白包含对应于芽孢杆菌属V3-13种C2c1中的D567A、E831A或D963A的突变。
在某些实施方案中,C2c1蛋白是在Nuc结构域中包含突变的C2c1切口酶。在一些实施方案中,C2c1切口酶包含对应于酸土脂环酸芽孢杆菌C2c1中的氨基酸位置R911、R1000或R1015的突变。在一些实施方案中,C2c1切口酶包含对应于酸土脂环酸芽孢杆菌C2c1中的R911A、R1000A或R1015A的突变。在一些实施方案中,C2c1切口酶包含对应于芽孢杆菌属V3-13种C2c1中的R894A的突变。在某些实施方案中,与蛋白的未突变或未修饰形式相比,C2c1蛋白识别具有增加或降低的特异性的PAM。在一些实施方案中,与蛋白的未突变或未修饰形式相比,C2c1蛋白识别改变的PAM。
在一些实施方案中,当突变酶的DNA切割活性为所述酶的非突变形式的DNA切割活性的约不超过25%、10%、5%、1%、0.1%、0.01%或更小时,认为CRISPR-Cas蛋白基本上缺乏所有DNA切割活性;一个实例可以是当突变形式的DNA切割活性与非突变形式相比为零或可忽略时。在这些实施方案中,将CRISPR-Cas蛋白用作通用DNA结合蛋白。所述突变可以是人为引入的突变或功能获得或功能丧失的突变。
除上述突变外,可另外对CRISPR-Cas蛋白进行修饰。如本文所用,关于CRISPR-Cas蛋白的术语“修饰的”通常是指与衍生自其的野生型Cas蛋白相比具有一个或多个修饰或突变(包括点突变、截短、插入、缺失、嵌合体、融合蛋白等)的CRISPR-Cas蛋白。衍生的是指衍生的酶在很大程度上与野生型酶具有高度的序列同源性,但是已经以本领域已知或如本文所述的某种方式进行了突变(修饰)。
失活的C2c1 CRISPR酶可具有缔合的(例如,经由融合蛋白或合适的接头)一个或多个功能结构域,包括例如来自以下组的一个或多个结构域,所述组包含以下,基本上由以下组成或由以下组成:脱氨酶活性、甲基化酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、RNA切割活性、DNA切割活性、核酸结合活性和分子开关(例如光诱导型)。用于本发明方法的合适的接头是本领域技术人员众所周知的,并且包括但不限于直链或支链碳接头、杂环碳接头或肽接头。然而,如本文所用,接头也可以是共价键(碳-碳键或碳-杂原子键)。在特定的实施方案中,接头用于将靶向结构域和腺苷脱氨酶分开足以确保每种蛋白质保持其所需功能特性的距离。优选的肽接头序列采用柔性的延伸构象,并且不表现出产生有序二级结构的倾向。在某些实施方案中,接头可以是化学部分,其可以是单体、二聚体、多聚体或聚合物。优选地,接头包含氨基酸。柔性接头中的典型氨基酸包括Gly、Asn和Ser。因此,在特定的实施方案中,接头包含Gly、Asn和Ser氨基酸中的一种或多种的组合。其他接近中性的氨基酸,例如Thr和Ala,也可用于接头序列中。示例性的接头公开于Maratea等人,(1985),Gene40:39-46;Murphy等人,(1986)Proc.Nat'l.Acad.Sci.USA 83:8258-62;美国专利第4,935,233号;和美国专利第4,751,180号。例如,可使用GlySer接头GGS、GGGS(SEQ ID NO:402)或GSG。GGS、GSG、GGGS或GGGGS(SEQ ID NO:403)接头可以3(例如(GGS)3(SEQ ID NO:404)、(GGGGS)3(SEQ ID NO:393)或5(SEQ ID NO:405)、6(SEQ ID NO:394)、7(SEQ ID NO:406)、9(SEQ ID NO:395)或甚至12(SEQ ID NO:396)或更多个的重复序列使用,以提供合适的长度。在特定的实施方案中,本文优选使用接头,例如(GGGGS)3。可优选地使用(GGGGS)6(GGGGS)9或(GGGGS)12作为替代物。其他优选的替代物是(GGGGS)1(SEQ ID NO:403)、(GGGGS)2(SEQ ID NO:407)、(GGGGS)4(SEQ ID NO:408)、(GGGGS)5(SEQ ID NO:405)、(GGGGS)7(SEQ ID NO:406)、(GGGGS)8(SEQ ID NO:409)、(GGGGS)10(SEQ ID NO:410)或(GGGGS)11(SEQ ID NO:411)。在又一个实施方案中,将LEPGEKPYKCPECGKSFSQSGALTRHQRTHTR(SEQ ID NO:412)用作接头。在另一个实施方案中,接头是XTEN接头。另外,N末端和C末端NLS也可用作接头(例如PKKKRKVEASSPKKRKVEAS(SEQ ID NO:413)。
下表示出了接头的实例。
示例性功能结构域是含有(ADAD)家族成员Fok1、VP64、P65、HSF1、MyoD1的腺苷脱氨酶结构域。在提供脱氨酶的情况下,有利的是,将指导序列设计成在指导序列与靶序列之间形成的RNA双链体或RNA/DNA异源双链体中引入一个或多个错配。在特定的实施方案中,指导序列和靶序列之间的双链体包含A-C错配。在提供Fok1的情况下,有利的是,提供多个Fok1功能结构域以允许功能性二聚体,并且将gRNA设计为提供适当的间隔以用于功能性使用(Fok1),如Tsai等人,Nature Biotechnology,第32卷,第6期,2014年6月中特别描述。衔接子蛋白可利用已知的接头附接此类功能结构域。在某些情况下,有利的是,另外提供至少一个NLS。在某些情况下,将NLS安置在N末端是有利的。当包括多于一个功能结构域时,所述功能结构域可以相同或不同。
通常,在失活的C2c1酶上的一个或多个功能结构域的定位是允许功能结构域的正确空间定向以影响所赋予功能效应的靶标的定位。例如,如果功能结构域是转录激活子(例如VP64或p65),则将转录激活子置于空间定向中,使其能够影响靶标的转录。同样,转录阻遏子将有利地定位以影响靶标的转录,并且核酸酶(例如Fok1)将有利地定位以切割或部分切割靶标。这可包括除CRISPR酶的N末端/C末端以外的位置。功能结构域修饰靶DNA序列的转录或翻译。
在一些实施方案中,Cas12b效应蛋白与一个或多个功能性结构域相缔合;并且Cas12b效应蛋白在RuvC和/或Nuc结构域内包含一个或多个突变,由此所形成的CRISPR复合物能够递送表观遗传修饰子或者转录或翻译激活或阻遏信号。
在某些实施方案中,本文公开的CRISPR-Cas系统是自灭活系统,并且Cas效应蛋白被瞬时表达。在一些实施方案中,自灭活系统包含病毒载体,例如AAV载体。在一些实施方案中,自灭活系统包含与内源靶序列共有80%、81%、82%、83%、84%、85%、86%、97%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%同一性的DNA序列。在一些实施方案中,自灭活系统包含两个或更多个载体系统。在一些实施方案中,自灭活系统包含单个载体。在一些实施方案中,自灭活系统包含同时靶向内源DNA靶序列的Cas效应蛋白和编码Cas效应蛋白的载体序列。在一些实施方案中,自灭活系统包含靶向内源DNA靶序列的Cas效应蛋白和依序编码Cas效应蛋白的载体序列。在一些实施方案中,编码Cas效应子和指导序列的核苷酸可操作地连接至单个载体上的分开的调控元件。在一些实施方案中,编码Cas效应子和指导序列的核苷酸可操作地连接至分开的载体上的分开的调控元件。在一些实施方案中,调控元件是组成性的。在一些实施方案中,调控元件是可诱导的。
去稳定的C2c1
在某些实施方案中,如本文所述的根据本发明的效应蛋白(CRISPR酶;C2c1)与去稳定结构域(DD)相缔合或融合。在一些实施方案中,DD是ER50。在一些实施方案中,该DD的相应稳定配体是4HT。因此,在一些实施方案中,至少一个DD之一是ER 50,并且其稳定配体是4HT或CMP8。在一些实施方案中,DD是DHFR50。在一些实施方案中,该DD的相应稳定配体是TMP。因此,在一些实施方案中,至少一个DD之一是DHFR50,并且其稳定配体是TMP。在一些实施方案中,DD是ER50。在一些实施方案中,该DD的相应稳定配体是CMP8。因此,CMP8可能是ER50系统中4HT的替代稳定配体。尽管可能的是,CMP8和4HT可以/应该以竞争形式使用,但某些细胞类型可能更易受这两种配体中的一种或另一种影响,并且根据本公开内容和本领域的知识,技术人员可使用CMP8和/或4HT。
在一些实施方案中,可将一个或两个DD融合至CRISPR酶的N末端,而将一个或两个DD融合至CRISPR酶的C末端。在一些实施方案中,至少两个DD与CRISPR酶相缔合,并且所述DD是相同的DD,即,所述DD是同源的。因此,两个(或两个或更多个)DD都可以是ER50 DD。在一些实施方案中这是优选的。或者,两个(或两个或更多个)DD可以是DHFR50 DD。在一些实施方案中这也是优选的。在一些实施方案中,至少两个DD与CRISPR酶相缔合,并且所述DD是不同的DD,即,所述DD是异源的。因此,DD之一可以是ER50,而一个或多个DD或任何其他DD可以是DHFR50。具有两个或更多个异源的DD可能是有利的,因为它将提供更高水平的降解控制。在N或C末端上多于一个DD的串联融合可能会增强降解;并且这样的串联融合可以是例如ER50-ER50-C2c1。设想在不存在任何稳定配体的情况下发生高水平的降解,在不存在一个稳定配体和存在其他(或另一个)稳定配体的情况下发生中等水平的降解,而在存在两个(或两个或更多个)稳定配体的情况下将发生较低水平的降解。也可通过具有N末端ER50 DD和C末端DHFR50 DD来赋予控制。
在一些实施方案中,CRISPR酶与DD的融合物包含DD与CRISPR酶之间的接头。在一些实施方案中,接头是GlySer接头。在一些实施方案中,DD-CRISPR酶还包含至少一种核输出信号(NES)。在一些实施方案中,DD-CRISPR酶包含两个或更多个NES。在一些实施方案中,DD-CRISPR酶包含至少一种核定位信号(NLS)。这可能是NES的补充。在一些实施方案中,CRISPR酶包含以下或基本上由以下组成或由以下组成:定位(核输入或输出)信号,其作为CRISPR酶与DD之间的接头或作为其一部分。HA或Flag标签也作为接头在本发明的范围内。申请人使用NLS和/或NES作为接头,并且还使用甘氨酸丝氨酸接头,短至GS直至(GGGGS)3。
去稳定结构域具有普遍效用以赋予范围广泛的蛋白质以不稳定性;参见例如Miyazaki,J Am Chem Soc.3月7日,2012;134(9):3942-3945,通过引用并入本文。CMP8或4-羟基他莫昔芬可能是去稳定结构域。更一般而言,发现哺乳动物DHFR的温度敏感突变体(DHFRts)(根据N端规则的去稳定残基)在允许的温度下稳定,但在37℃下不稳定。向表达DHFRts的细胞中添加甲氨蝶呤(哺乳动物DHFR的高亲和力配体)可部分抑制蛋白质的降解。这是一个重要的证明,即小分子配体可以稳定蛋白质,否则该蛋白质将靶向细胞降解。雷帕霉素衍生物用于稳定mTOR(FRB*)的FRB结构域的不稳定突变体并恢复融合激酶GSK-3β.6,7的功能。这个系统证明配体依赖性稳定性代表了一种有吸引力的策略来调控特定蛋白质在复杂生物环境中的功能。当雷帕霉素诱导的FK506结合蛋白和FKBP12的二聚化引起泛素互补时,控制蛋白质活性的系统可涉及使DD变得具功能性。可将人类FKBP12或ecDHFR蛋白的突变体工程化为在不存在其高亲和力配体Shield-1或甲氧苄啶(TMP)的情况下在代谢上不稳定。这些突变体是可用于实施本发明的一些可能的去稳定结构域(DD),并且DD与CRISPR酶融合时的不稳定性赋予蛋白酶体对整个融合蛋白的CRISPR蛋白降解。Shield-1和TMP以剂量依赖性方式结合并稳定DD。雌激素受体配体结合结构域(ERLBD,ERS1的残基305-549)也可被工程化为去稳定结构域。由于雌激素受体信号通路涉及多种疾病例如乳腺癌,因此已经对该通路进行了广泛研究,并且已经开发出许多雌激素受体的激动剂和拮抗剂。因此,已知ERLBD和药物的相容对。存在与ERLBD的突变体而非野生型形式结合的配体。通过使用编码三个突变(L384M,M421G,G521R)12的这些突变结构域之一,可使用不扰动内源雌激素敏感性网络的配体来调控ERLBD衍生DD的稳定性。可引入其他突变(Y537S),以使ERLBD进一步去稳定并将其配置为潜在的DD候选物。该四突变体是有利的DD发展。突变体ERLBD可与CRISPR酶融合,并且其稳定性可使用配体来调控或扰动,从而CRISPR酶具有DD。另一个DD可以是基于由Shield1配体稳定化的突变的FKBP蛋白的12kDa(107个氨基酸)标签;参见例如Nature Methods 5,(2008)。例如,DD可以是修饰的FK506结合蛋白12(FKBP12),其与合成的生物学上惰性的小分子Shield-1结合并由其可逆地稳定化;参见例如Banaszynski LA,Chen LC,Maynard-Smith LA,Ooi AG,Wandless TJ.Arapid,reversible,and tunablemethod to regulate protein function in living cells using synthetic smallmolecules.Cell.2006;126:995-1004;Banaszynski LA,Sellmyer MA,Contag CH,Wandless TJ,Thorne SH.Chemical control of protein stability and function inliving mice.Nat Med.2008;14:1123-1127;Maynard-Smith LA,Chen LC,BanaszynskiLA,Ooi AG,Wandless TJ.Adirected approach for engineering conditional proteinstability using biologically silent small molecules.The Journal of biologicalchemistry.2007;282:24866-24872;以及Rodriguez,Chem Biol.3月23日,2012;19(3):391-398,所有文献都通过引用并入本文,并且可在本发明的实践中以选定的DD用于与本发明实践中的CRISPR酶缔合。可看出,本领域的知识包括许多DD,并且所述DD可与CRISPR酶缔合(例如融合),有利地利用接头,从而可在存在配体的情况下使DD稳定化,并且当不存在配体时,DD可能变得去稳定,从而使CRISPR酶完全去稳定,或者在不存在配体的情况下DD可以稳定化,并且当存在配体时,DD可能变得去稳定;DD使CRISPR酶以及因此CRISPR-Cas复合物或系统被调控或控制,可以说是打开或关闭,从而提供了用于调控或控制系统的手段,例如在体内或体外环境中。例如,当目标蛋白质表达为与DD标签的融合物时,它在细胞中去稳定并迅速降解,例如被蛋白酶体降解。因此,缺乏稳定化配体导致D缔合的Cas被降解。当新的DD与目标蛋白融合时,其不稳定性被赋予目标蛋白质,导致整个融合蛋白迅速降解。Cas的峰值活性有时有利于降低脱靶效应。因此,高活性的短暂爆发是优选的。本发明能够提供这样的峰。在某些意义上,系统是可诱导的。在某些其他意义上,所述系统在不存在稳定化配体的情况下受阻遏,并在存在稳定化配体的情况下失阻遏。
分裂设计
C2c1也能够进行可靠的核酸检测。在某些实施方案中,C2c1通过使其核酸酶活性失活而转化成核酸结合蛋白(“死C2c1;dC2c1”)。当转化为核酸结合蛋白时,C2c1可用于以序列依赖性方式将其他功能组分定位于靶核酸。所述组分可以是天然的或合成的。根据本发明,dC2c1用于(i)将效应子模块带入特定的核酸以调节功能或转录,其可用于大规模筛选,合成调控回路的构建和其他目的;(ii)荧光标记特定核酸以可视化其运输和/或定位;(iii)通过对特定亚细胞区室具有亲和力的结构域改变核酸定位;以及(iv)捕获特定核酸(通过直接下拉dC2c2或使用dC2c2来定位生物素连接酶活性)来富集包括RNA和蛋白质在内的近端分子伴侣。dC2c1可用于i)组织细胞的组分,ii)开启或关闭细胞的组分或活性,以及iii)根据细胞中特定转录物的存在或数量来控制细胞状态。在示例性实施方案中,本发明提供分裂的酶和报告分子,其部分以包含核酸结合CRISPR效应子(例如但不限于C2c1)的杂合分子的形式提供。当在细胞中存在核酸的情况下接近时,分裂的报告分子或酶的活性被重建,然后可测量所述活性。以这种方式重建的分裂酶可以可检测地作用于细胞组分和/或途径,包括但不限于内源性组分或途径,或外源性组分或途径。以这种方式重建的分裂报告物可提供可检测的信号,例如但不限于荧光或其他可检测的部分。在某些实施方案中,提供了分裂的蛋白水解酶,其在重建时以可检测的方式作用于一种或多种组分(内源性或外源性)。在一个示例性实施方案中,提供了一种在检测细胞中的核酸物质时诱导程序性细胞死亡的方法。显而易见的是,例如,基于细胞中病毒的存在,可如何使用这种方法消融细胞群体。
根据本发明,提供了一种在含有目标核酸的细胞中诱导细胞死亡的方法,所述方法包括使细胞中的核酸与组合物接触,所述组合物包含:第一CRIPSR蛋白,其与能够诱导细胞死亡的蛋白水解酶的非活性第一部分连接;第二CRISPR蛋白,其与所述酶的互补部分连接,其中当接触蛋白质的第一部分和互补部分时所述蛋白水解酶的酶活性被重建;以及第一指导物,其与第一CRISPR蛋白结合并与核酸的第一靶序列杂交,和第二指导物,其与第二CRISPR蛋白结合并与核酸的第二靶序列杂交。当存在目标靶核酸时,接触蛋白水解酶的第一部分和第二部分,并且所述酶的蛋白水解活性被重建并诱导细胞死亡。在本发明的一个这样的实施方案中,蛋白水解酶是胱天蛋白酶。在另一个这样的实施方案中,蛋白水解酶是TEV蛋白酶,其中当TEV蛋白酶的蛋白水解活性重建时,TEV蛋白酶底物被切割和/或激活。在本发明的一个实施方案中,TEV蛋白酶底物是工程化的胱天蛋白酶原,使得当TEV蛋白酶重建时,胱天蛋白酶原被切割并激活,从而发生凋亡。在本发明的一个实施方案中,可将蛋白水解可切割的转录因子与选择的任何下游报告基因组合以产生“转录偶联的”报告系统。在一个实施方案中,分裂的蛋白酶用于从可检测的底物切割或暴露区域。
根据本发明,提供了标记或鉴定含有目标核酸的细胞的方法,所述方法包括使细胞中的核酸与组合物接触,所述组合物包含:第一CRIPSR蛋白,其与蛋白水解酶的非活性第一部分连接;第二CRISPR蛋白,其与所述酶的互补部分连接,其中当接触蛋白质的第一部分和互补部分时所述蛋白水解酶的酶活性被重建;以及第一指导物,其与第一CRISPR蛋白结合并与核酸的第一靶序列杂交,第二指导物,其与第二CRISPR蛋白结合并与核酸的第二靶序列杂交,和被重建蛋白水解酶可检测地切割的指示剂。当目标核酸存在于细胞中时,接触蛋白水解酶的第一部分和第二部分,从而蛋白水解酶的活性被重建并且指示剂被可检测地切割。在一个这样的实施方案中,可检测的指示剂是荧光蛋白,例如但不限于绿色荧光蛋白。在本发明的另一个这样的实施方案中,可检测的指示剂是发光蛋白,例如但不限于荧光素酶。在一个实施方案中,分裂报告物是基于海肾荧光素酶(Rluc)的分裂片段的重建。在本发明的一个实施方案中,分裂报告物是基于黄色荧光蛋白(YFP)的两个非荧光片段之间的互补。
在一个方面,本发明提供了一种基于细胞或组织中特定核酸的存在或水平来鉴定、测量和/或调节细胞或组织的状态的方法。在一个实施方案中,本发明提供了一种基于CRISPR的控制系统,该控制系统被设计为基于选定的目标核酸物质的存在来调节细胞系统或组分的存在和/或活性,所述细胞系统或组分可以是天然或合成的系统或组分。通常,控制系统具有失活的蛋白质、酶或活性,当存在选定的目标核酸物质时,所述蛋白质、酶或活性被重建。在本发明的一个实施方案中,重建失活的蛋白质、酶或活性涉及将非活性组分聚集在一起以组装活性复合物。
通常需要根据异常内源性或外来DNA的存在来耗尽或杀死细胞,这用于基本生物学应用以研究特定细胞类型的作用或者用于治疗性应用例如癌症或感染细胞清除(Baker,D.J.,Childs,B.G.,Durik,M.,Wijers,M.E.,Sieben,C.J.,Zhong,J.,Saltness,R.A.,Jeganathan,K.B.,Verzosa,G.C.,Pezeshki,A.等人,(2016).Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan.Nature 530,184-189)。这种靶向细胞杀伤作用可通过将分裂凋亡结构域与C2c1蛋白融合来实现,而C2c1蛋白在与DNA结合后被重建,导致特异性表达靶向基因或基因组的细胞死亡。在某些实施方案中,凋亡结构域可为分裂胱天蛋白酶3(Chelur,D.S.和Chalfie,M.(2007).Targeted cell killing byreconstituted caspases.Proc.Natl.Acad.Sci.U.S.A.104,2283-2288)。其他可能性是胱天蛋白酶的组装,例如使两个胱天蛋白酶8(Pajvani,U.B.,Trujillo,M.E.,Combs,T.P.,Iyengar,P.,Jelicks,L.,Roth,K.A.,Kitsis,R.N.和Scherer,P.E.(2005).Fat apoptosisthrough targeted activation of caspase 8:a new mouse model of inducible andreversible lipoatrophy.Nat.Med.11,797-803)或胱天蛋白酶9(Straathof,K.C.,Pulè,M.A.,Yotnda,P.,Dotti,G.,Vanin,E.F.,Brenner,M.K.,Heslop,H.E.,Spencer,D.M.和Rooney,C.M.(2005).An inducible caspase 9safety switch for T-celltherapy.Blood 105,4247-4254)效应子经由C2c1结合而接近。也有可能经由转录物上的C2c1结合来重建分裂TEV(Gray,D.C.,Mahrus,S.和Wells,J.A.(2010).Activation ofspecific apoptotic caspases with an engineered small-molecule-activatedprotease.Cell 142,637-646)。这种分裂TEV可用于多种读数,包括发光和荧光读数(Wehr,M.C.,Laage,R.,Bolz,U.,Fischer,T.M.,Grünewald,S.,Scheek,S.,Bach,A.,Nave,K.-A.和Rossner,M.J.(2006).Monitoring regulated protein-protein interactions usingsplit TEV.Nat.Methods 3,985-993)。一个实施方案涉及重建该分裂TEV以切割修饰的胱天蛋白酶原3或胱天蛋白酶原7(Gray,D.C.,Mahrus,S.和Wells,J.A.(2010).Activationof specific apoptotic caspases with an engineered small-molecule-activatedprotease.Cell 142,637-646),导致细胞死亡。
诱导性凋亡。根据本发明,可使用指导物来定位带有功能结构域以诱导凋亡的C2c1复合物。C2c1可以是任何直系同源物。在一个实施方案中,功能结构域在蛋白质的C末端融合。C2c1例如经由敲除核酸酶活性的突变而无催化活性。系统的适应性可通过采用各种胱天蛋白酶激活方法以及沿靶核酸的指导间隔的优化来证明。可使用C2c1复合物形成将与C2c1缔合的胱天蛋白酶8或胱天蛋白酶9酶结合在一起,从而诱导胱天蛋白酶8和胱天蛋白酶9(又称“引发子”胱天蛋白酶)活性。或者,当带有烟草蚀纹病毒(TEV)N末端和C末端部分(“剪切子”)的C2c1复合物保持接近时,可诱导胱天蛋白酶3和胱天蛋白酶7(又称“效应子”胱天蛋白酶)活性,从而激活TEV蛋白酶活性并导致胱天蛋白酶3或胱天蛋白酶7前蛋白的切割和激活。所述系统可使用分裂胱天蛋白酶3,通过附接到与靶核酸结合的C2c1复合物使胱天蛋白酶3部分异二聚化。示例性的凋亡组分在下表3中列出。
本发明的系统还包括用于将具有连接的酶部分的CRISPR蛋白定位在细胞或组织中可能存在的目标转录物上的指导物。因此,所述系统包含与第一CRISPR蛋白结合并与目标转录物杂交的第一指导物,以及与第二CRISPR蛋白结合并与目标核酸杂交的第二指导物。在大多数实施方案中,优选的是,第一指导物和第二指导物在邻近位置与目标核酸杂交。所述位置可以直接相邻或被几个核苷酸隔开,例如被1nt、2nt、3nt、4nt、5nt、6nt、7nt、8nt、9nt、10nt、11nt、12nt或更多个nt隔开。在某些实施方案中,第一指导物和第二指导物可结合于通过预期的茎环在核酸上隔开的位置。尽管沿线性核酸隔开,但是核酸可呈现使指导靶序列紧密接近的二级结构。
在本发明的一个实施方案中,蛋白水解酶包括胱天蛋白酶。在本发明的一个实施方案中,蛋白水解酶包括引发子胱天蛋白酶,例如但不限于胱天蛋白酶8或胱天蛋白酶9。引发子胱天蛋白酶通常作为单体是无活性的,并且在均二聚作用下获得活性。在本发明的一个实施方案中,蛋白水解酶包括效应子胱天蛋白酶,例如但不限于胱天蛋白酶3或胱天蛋白酶7。此类引发子胱天蛋白酶通常在切割成片段之前是无活性的。切割后,片段缔合形成活性酶。在一个示例性的实施方案中,蛋白水解酶的第一部分包含胱天蛋白酶3p12并且蛋白水解酶的互补部分包含胱天蛋白酶3p17。
在本发明的一个实施方案中,选择蛋白水解酶以靶向特定的氨基酸序列,并相应地选择或工程化底物。这种蛋白酶的非限制性实例是烟草蚀纹病毒(TEV)蛋白酶。因此,可被TEV蛋白酶切割的底物,在一些实施方案中被工程化为可切割的,用作被蛋白酶作用的系统组分。在一个实施方案中,NEV蛋白酶底物包含蛋白酶和一个或多个TEV切割位点。胱天蛋白酶原可以是例如被工程化以被重建的TEV蛋白酶切割的胱天蛋白酶3或胱天蛋白酶7。切割后,胱天蛋白酶原片段可自由地进行主动确认。
在本发明的一个实施方案中,TEV底物包含荧光蛋白和TEV切割位点。在另一个实施方案中,TEV底物包含发光蛋白和TEV切割位点。在某些实施方案中,TEV切割位点提供了底物的切割,使得在切割时丧失了底物蛋白的荧光或发光性质。在某些实施方案中,可例如通过附加干扰荧光或发光的部分来修饰荧光或发光蛋白,所述部分随后在重建TEV蛋白酶时被切割。
根据本发明,提供了一种在含有目标核酸的细胞中提供蛋白水解活性的方法,所述方法包括使细胞中的核酸与组合物接触,所述组合物包含:第一CRIPSR蛋白,其与蛋白水解酶的非活性第一部分连接;和第二CRISPR蛋白,其与蛋白水解酶的互补部分连接,其中当接触蛋白质的第一部分和互补部分时所述蛋白水解酶的酶活性被重建;以及第一指导物,其与第一CRISPR蛋白结合并与核酸的第一靶序列杂交,和第二指导物,其与第二CRISPR蛋白结合并与核酸的第二靶序列杂交。当存在目标靶核酸时,接触蛋白水解酶的第一部分和第二部分,所述酶的蛋白水解活性被重建,并且所述酶的底物被切割。
分裂荧光团构建体可用于在两个C2c1蛋白与转录物结合后经由分裂荧光团的重建而在降低背景下成像。这些分裂蛋白质包括iSplit(Filonov,G.S.和Verkhusha,V.V.(2013).A near-infrared BiFC reporter for in vivo imaging of protein-proteininteractions.Chem.Biol.20,1078-1086),Split Venus(Wu,B.,Chen,J.和Singer,R.H.(2014).Background free imaging of single mRNAs in live cells using splitfluorescent proteins.Sci.Rep.4,3615)和Split superpositive GFP(Blakeley,B.D.,Chapman,A.M.和McNaughton,B.R.(2012).Split-superpositive GFP reassembly is afast,efficient,and robust method for detecting protein-protein interactionsin vivo.Mol.Biosyst.8,2036-2040)。此类蛋白质在下表4中列出:
利用dCas的靶标富集
在某些示例实施方案中,可在检测或扩增靶RNA或DNA之前首先富集靶RNA或DNA。在某些示例实施方案中,该富集可通过CRISPR效应子系统结合靶核酸来实现。
当前的靶标特异性富集方案需要与探针杂交之前的单链核酸。在各种优点中,本发明的实施方案可跳过该步骤,并且能够引导靶向至双链DNA(部分或完全双链)。另外,本文公开的实施方案是酶驱动的靶向方法,其提供更快的动力学和更容易的工作流程,从而允许等温富集。在某些示例实施方案中,富集可在低至20-37℃的温度下进行。在某些示例实施方案中,在单个测定中使用了一组针对不同靶核酸的指导RNA,从而允许检测多个靶标和/或单个靶标的多个变体。
在某些示例实施方案中,死CRISPR效应蛋白可结合溶液中的靶核酸,然后从所述溶液中分离。例如,可使用特异性结合死CRISPR效应蛋白的抗体或其他分子(例如适体),从溶液中分离结合至靶核酸的死CRISPR效应蛋白。
在其他示例实施方案中,死CRISPR效应蛋白可结合至固体底物。固定的底物可以是指适合于或可被修饰以适合于多肽或多核苷酸的附接的任何材料。可能的底物包括但不限于玻璃和改性的官能化玻璃,塑料(包括丙烯酸,聚苯乙烯以及苯乙烯与其他材料的共聚物,聚丙烯,聚乙烯,聚丁烯,聚氨酯,Teflon
然后可将含有或疑似含有靶核酸的样品暴露于底物,以使靶核酸与结合的死CRISPR效应蛋白结合。然后可将非靶分子洗掉。在某些示例实施方案中,然后可使用本文公开的方法从CRISPR效应蛋白/指导RNA复合物中释放靶核酸,以进行进一步检测。在某些示例实施方案中,可以首先如本文所述扩增靶核酸。
在某些示例实施方案中,CRISPR效应子可用结合标签标记。在某些示例实施方案中,CRISPR效应子可被化学标记。例如,CRISPR效应子可被化学生物素化。在另一个示例实施方案中,可通过向CRISPR效应子添加编码融合物的额外序列来产生融合物。这样的融合物的一个实例是AviTag
在某些示例实施方案中,指导RNA可用结合标签标记。在某些示例实施方案中,可使用并入一种或多种生物素化核苷酸如生物素化尿嘧啶的体外转录(IVT)来标记整个指导RNA。在一些实施方案中,可将生物素化学或酶促地添加至指导RNA,例如,向指导RNA的3'端添加一个或多个生物素基团。在发生结合后,结合标签可用于下拉指导RNA/靶核酸复合物,例如,通过将指导RNA/靶核酸暴露于抗生蛋白链菌素包被的固体底物。
截短
在某些示例实施方案中,Cas12蛋白可被截短。在某些示例实施方案中,截短形式可以是减活的或死的Cas12蛋白。Cas12蛋白可在N末端、C末端或两者上进行修饰。在一个示例实施方案中,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150个氨基酸从N末端、C末端或其组合去除。在另一个示例实施方案中,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150个氨基酸从C末端去除。在某些示例实施方案中,1-10、1-20、1-30、1-40、1-50、1-60、1-70、1-80、1-90、1-100、1-110、1-120、1-130、1-140、1-150、1-160、1-170、1-180、1-190、1-200、1-220、1-230、1-240、1-250、200-250、100-200、110-200、120-200、130-200、140-200、150-200、160-200、170-200、180-200、190-200、10-100、20-100、30-100、40-100、50-100、60-100、70-100、80-100、90-100或150-250个氨基酸从N末端、C末端或其组合去除。在某些示例性实施方案中,氨基酸位置是BhCas12b的氨基酸位置或与其相对应的直系同源物的氨基酸。在某些示例性实施方案中,所述截短可融合或以其他方式附接至核苷酸脱氨酶,并用于下文进一步详细公开的碱基编辑实施方案中。
碱基编辑
在某些示例实施方案中,Cas12b(例如dCas12b)可与腺苷脱氨酶或胞苷脱氨酶融合以用于碱基编辑目的。
腺苷脱氨酶
如本文所用,术语“腺苷脱氨酶”或“腺苷脱氨酶蛋白”是指蛋白质,多肽,或蛋白质或多肽的一个或多个功能结构域,其能够催化将腺嘌呤(或分子的腺嘌呤部分)转化为次黄嘌呤(或分子的次黄嘌呤部分)的水解脱氨反应,如下所示。在一些实施方案中,含腺嘌呤的分子是腺苷(A),并且含次黄嘌呤的分子是肌苷(I)。含腺嘌呤的分子可以是脱氧核糖核酸(DNA)或核糖核酸(RNA)。
根据本公开,可与本公开结合使用的腺苷脱氨酶包括但不限于称为作用于RNA的腺苷脱氨酶的酶家族成员(ADAR),称为作用于tRNA的腺苷脱氨酶的酶家族成员(ADAT),以及其他含腺苷脱氨酶结构域(ADAD)的家族成员。根据本公开,腺苷脱氨酶能够靶向RNA/DNA和RNA双链体中的腺嘌呤。实际上,Zheng等人,(Nucleic Acids Res.2017,45(6):3369-3377)证实ADAR可对RNA/DNA和RNA/RNA双链体进行腺苷至肌苷的编辑反应。在特定的实施方案中,腺苷脱氨酶已被修饰以增加其编辑RNA双链体的RNA/DNA异源双链体中的DNA的能力,如下文所详述。
在一些实施方案中,腺苷脱氨酶源自一种或多种后生动物物种,包括但不限于哺乳动物、鸟类、青蛙、鱿鱼、鱼、蝇和蠕虫。在一些实施方案中,腺苷脱氨酶是人类、鱿鱼或果蝇腺苷脱氨酶。
在一些实施方案中,腺苷脱氨酶是人类ADAR,包括hADAR1、hADAR2、hADAR3。在一些实施方案中,腺苷脱氨酶是秀丽隐杆线虫(Caenorhabditis elegans)ADAR蛋白,包括ADR-1和ADR-2。在一些实施方案中,腺苷脱氨酶是果蝇ADAR蛋白,包括dAdar。在一些实施方案中,腺苷脱氨酶是鱿鱼(长翼鱿鱼(Loligo pealeii))ADAR蛋白,包括sqADAR2a和sqADAR2b。在一些实施方案中,腺苷脱氨酶是人类ADAT蛋白。在一些实施方案中,腺苷脱氨酶是果蝇ADAT蛋白。在一些实施方案中,腺苷脱氨酶是人类ADAD蛋白,包括TENR(hADAD1)和TENRL(hADAD2)。
在一些实施方案中,腺苷脱氨酶是TadA蛋白,例如大肠杆菌TadA。参见Kim等人,Biochemistry 45:6407-6416(2006);Wolf等人,EMBO J.21:3841-3851(2002)。在一些实施方案中,腺苷脱氨酶是小鼠ADA。参见Grunebaum等人,Curr.Opin.AllergyClin.Immunol.13:630-638(2013)。在一些实施方案中,腺苷脱氨酶是人类ADAT2。参见Fukui等人,J.Nucleic Acids2010:260512(2010)。在一些实施方案中,脱氨酶(例如腺苷或胞苷脱氨酶)是以下文献中描述的那些中的一种或多种:Cox等人,Science.2017年11月24日;358(6366):1019-1027;Komore等人,Nature.2016年5月19日;533(7603):420-4;以及Gaudelli等人,Nature.2017年11月23日;551(7681):464-471。
在一些实施方案中,腺苷脱氨酶蛋白识别双链核酸底物中的一个或多个靶腺苷残基并将其转化为肌苷残基。在一些实施方案中,双链核酸底物是RNA-DNA杂合双链体。在一些实施方案中,腺苷脱氨酶蛋白识别双链底物上的结合窗口。在一些实施方案中,结合窗口包含至少一个靶腺苷残基。在一些实施方案中,结合窗口在约3bp至约100bp的范围内。在一些实施方案中,结合窗口在约5bp至约50bp的范围内。在一些实施方案中,结合窗口在约10bp至约30bp的范围内。在一些实施方案中,结合窗口为约1bp、2bp、3bp、5bp、7bp、10bp、15bp、20bp、25bp、30bp、40bp、45bp、50bp、55bp、60bp、65bp、70bp、75bp、80bp、85bp、90bp、95bp或100bp。
在一些实施方案中,腺苷脱氨酶蛋白包含一个或多个脱氨酶结构域。不希望受特定理论的束缚,预期脱氨酶结构域用于识别双链核酸底物中所含的一个或多个靶腺苷(A)残基并将其转化为肌苷(I)残基。在一些实施方案中,脱氨酶结构域包含活性中心。在一些实施方案中,活性中心包含锌离子。在一些实施方案中,在A-I编辑过程期间,靶腺苷残基处的碱基配对被破坏,并且靶腺苷残基被“翻转”出双螺旋,以变得可被腺苷脱氨酶接近。在一些实施方案中,活性中心中或附近的氨基酸残基与靶腺苷残基的5'的一个或多个核苷酸相互作用。在一些实施方案中,在活性中心内或附近的氨基酸残基与靶腺苷残基的3'的一个或多个核苷酸相互作用。在一些实施方案中,活性中心中或附近的氨基酸残基进一步与和相反链上的靶腺苷残基互补的核苷酸相互作用。在一些实施方案中,氨基酸残基与核苷酸的2'羟基形成氢键。
在一些实施方案中,腺苷脱氨酶包含人类ADAR2全蛋白(hADAR2)或其脱氨酶结构域(hADAR2-D)。在一些实施方案中,腺苷脱氨酶是与hADAR2或hADAR2-D同源的ADAR家族成员。
特别地,在一些实施方案中,同源ADAR蛋白是人类ADAR1(hADAR1)或其脱氨酶结构域(hADAR1-D)。在一些实施方案中,hADAR1-D的甘氨酸1007对应于甘氨酸487hADAR2-D,并且hADAR1-D的谷氨酸1008对应于hADAR2-D的谷氨酸488。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D的野生型氨基酸序列。在一些实施方案中,腺苷脱氨酶在hADAR2-D序列中包含一个或多个突变,使得hADAR2-D的编辑效率和/或底物编辑偏好根据特定需要而改变。
hADAR1和hADAR2蛋白的某些突变已经描述于:Kuttan等人,Proc Natl Acad SciU S A.(2012)109(48):E3295-304;Want等人,ACS Chem Biol.(2015)10(11):2512-9;和Zheng等人,Nucleic Acids Res.(2017)45(6):3369-337,所述文献各自通过引用整体并入本文。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的甘氨酸336或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置336处的甘氨酸残基被天冬氨酸残基代替(G336D)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列在甘氨酸487或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置487处的甘氨酸残基被具有相对小的侧链的非极性氨基酸残基代替。例如,在一些实施方案中,位置487处的甘氨酸残基被丙氨酸残基代替(G487A)。在一些实施方案中,位置487处的甘氨酸残基被缬氨酸残基代替(G487V)。在一些实施方案中,位置487处的甘氨酸残基被具有相对大的侧链的氨基酸残基代替。在一些实施方案中,位置487处的甘氨酸残基被精氨酸残基代替(G487R)。在一些实施方案中,位置487处的甘氨酸残基被赖氨酸残基代替(G487K)。在一些实施方案中,位置487处的甘氨酸残基被色氨酸残基代替(G487W)。在一些实施方案中,位置487处的甘氨酸残基被酪氨酸残基代替(G487Y)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的谷氨酸488或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置488处的谷氨酸残基被谷氨酰胺残基代替(E488Q)。在一些实施方案中,位置488处的谷氨酸残基被组氨酸残基代替(E488H)。在一些实施方案中,位置488处的谷氨酸残基被精氨酸残基代替(E488R)。在一些实施方案中,位置488处的谷氨酸残基被赖氨酸残基代替(E488K)。在一些实施方案中,位置488处的谷氨酸残基被天冬酰胺残基代替(E488N)。在一些实施方案中,位置488处的谷氨酸残基被丙氨酸残基代替(E488A)。在一些实施方案中,位置488处的谷氨酸残基被甲硫氨酸残基代替(E488M)。在一些实施方案中,位置488处的谷氨酸残基被丝氨酸残基代替(E488S)。在一些实施方案中,位置488处的谷氨酸残基被苯丙氨酸残基代替(E488F)。在一些实施方案中,位置488处的谷氨酸残基被赖氨酸残基代替(E488L)。在一些实施方案中,位置488处的谷氨酸残基被色氨酸残基代替(E488W)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的苏氨酸490或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置490处的苏氨酸残基被半胱氨酸残基代替(T490C)。在一些实施方案中,位置490处的苏氨酸残基被丝氨酸残基代替(T490S)。在一些实施方案中,位置490处的苏氨酸残基被丙氨酸残基(T490A)代替。在一些实施方案中,位置490处的苏氨酸残基被苯丙氨酸残基代替(T490F)。在一些实施方案中,位置490处的苏氨酸残基被酪氨酸残基代替(T490Y)。在一些实施方案中,位置490处的苏氨酸残基被丝氨酸残基代替(T490R)。在一些实施方案中,位置490处的苏氨酸残基被丙氨酸残基代替(T490K)。在一些实施方案中,位置490处的苏氨酸残基被苯丙氨酸残基代替(T490P)。在一些实施方案中,位置490处的苏氨酸残基被酪氨酸残基代替(T490E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的缬氨酸493或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置493处的缬氨酸残基被丙氨酸残基代替(V493A)。在一些实施方案中,位置493处的缬氨酸残基被丝氨酸残基代替(V493S)。在一些实施方案中,位置493处的缬氨酸残基被苏氨酸残基代替(V493T)。在一些实施方案中,位置493处的缬氨酸残基被精氨酸残基代替(V493R)。在一些实施方案中,位置493处的缬氨酸残基被天冬氨酸残基代替(V493D)。在一些实施方案中,位置493处的缬氨酸残基被脯氨酸残基代替(V493P)。在一些实施方案中,位置493处的缬氨酸残基被甘氨酸残基代替(V493G)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的丙氨酸589或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置589处的丙氨酸残基被缬氨酸残基代替(A589V)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的天冬酰胺597或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置597处的天冬酰胺残基被赖氨酸残基代替(N597K)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置597处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置597处的天冬酰胺残基被精氨酸残基代替(N597R)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置597处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置597处的天冬酰胺残基被丙氨酸残基代替(N597A)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置597处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置597处的天冬酰胺残基被谷氨酸残基代替(N597E)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置597处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置597处的天冬酰胺残基被组氨酸残基代替(N597H)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置597处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置597处的天冬酰胺残基被甘氨酸残基代替(N597G)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置597处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置597处的天冬酰胺残基被酪氨酸残基代替(N597Y)。在一些实施方案中,位置597处的天冬酰胺残基被苯丙氨酸残基代替(N597F)。在一些实施方案中,腺苷脱氨酶包含突变N597I。在一些实施方案中,腺苷脱氨酶包含突变N597L。在一些实施方案中,腺苷脱氨酶包含突变N597V。在一些实施方案中,腺苷脱氨酶包含突变N597M。在一些实施方案中,腺苷脱氨酶包含突变N597C。在一些实施方案中,腺苷脱氨酶包含突变N597P。在一些实施方案中,腺苷脱氨酶包含突变N597T。在一些实施方案中,腺苷脱氨酶包含突变N597S。在一些实施方案中,腺苷脱氨酶包含突变N597W。在一些实施方案中,腺苷脱氨酶包含突变N597Q。在一些实施方案中,腺苷脱氨酶包含突变N597D。在某些示例实施方案中,上述N597处的突变是在E488Q背景的情形下进一步进行的。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的丝氨酸599或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置599处的丝氨酸残基被苏氨酸残基代替(S599T)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的天冬酰胺613或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置613处的天冬酰胺残基被赖氨酸残基代替(N613K)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置613处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置613处的天冬酰胺残基被精氨酸残基代替(N613R)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置613处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置613处的天冬酰胺残基被丙氨酸残基代替(N613A)。在一些实施方案中,腺苷脱氨酶在氨基酸序列的位置613处包含突变,其在野生型序列中具有天冬酰胺残基。在一些实施方案中,位置613处的天冬酰胺残基被谷氨酸残基代替(N613E)。在一些实施方案中,腺苷脱氨酶包含突变N613I。在一些实施方案中,腺苷脱氨酶包含突变N613L。在一些实施方案中,腺苷脱氨酶包含突变N613V。在一些实施方案中,腺苷脱氨酶包含突变N613F。在一些实施方案中,腺苷脱氨酶包含突变N613M。在一些实施方案中,腺苷脱氨酶包含突变N613C。在一些实施方案中,腺苷脱氨酶包含突变N613G。在一些实施方案中,腺苷脱氨酶包含突变N613P。在一些实施方案中,腺苷脱氨酶包含突变N613T。在一些实施方案中,腺苷脱氨酶包含突变N613S。在一些实施方案中,腺苷脱氨酶包含突变N613Y。在一些实施方案中,腺苷脱氨酶包含突变N613W。在一些实施方案中,腺苷脱氨酶包含突变N613Q。在一些实施方案中,腺苷脱氨酶包含突变N613H。在一些实施方案中,腺苷脱氨酶包含突变N613D。在一些实施方案中,上述N613处的突变与E488Q突变组合进一步进行。
在一些实施方案中,为了提高编辑效率,腺苷脱氨酶可包含基于hADAR2-D的以下氨基酸序列位置的一个或多个突变:G336D、G487A、G487V、E488Q、E488H、E488R、E488N、E488A、E488S、E488M、T490C、T490S、V493T、V493S、V493A、V493R、V493D、V493P、V493G、N597K、N597R、N597A、N597E、N597H、N597G、N597Y、A589V、S599T、N613K、N613R、N613A、N613E,以及与上述相对应的同源ADAR蛋白中的突变。
在一些实施方案中,为了降低编辑效率,腺苷脱氨酶可包含基于hADAR2-D的以下氨基酸序列位置的一个或多个突变:E488F、E488L、E488W、T490A、T490F、T490Y、T490R、T490K、T490P、T490E、N597F,以及与上述相对应的同源ADAR蛋白中的突变。在特定的实施方案中,可能感兴趣的是使用功效降低的腺苷脱氨酶以降低脱靶效应。
在一些实施方案中,为了降低脱靶效应,腺苷脱氨酶包含基于hADAR2-D的氨基酸序列位置在R348、V351、T375、K376、E396、C451、R455、N473、R474、K475、R477、R481、S486、E488、T490、S495、R510处的一个或多个突变,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶包含在E488和选自R348、V351、T375、K376、E396、C451、R455、N473、R474、K475、R477、R481、S486、T490、S495、R510的一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在T375处和任选地在一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在N473处和任选地在一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在V351处和任选地在一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在E488和T375处以及任选地在一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在E488和N473处以及任选地在一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在E488和V351处以及任选地在一个或多个其他位置处的突变。在一些实施方案中,腺苷脱氨酶包含在E488以及T375、N473和V351中的一者或多者处的突变。
在一些实施方案中,为了降低脱靶效应,腺苷脱氨酶包含选自基于hADAR2-D的氨基酸序列位置的R348E、V351L、T375G、T375S、R455G、R455S、R455E、N473D、R474E、K475Q、R477E、R481E、S486T、E488Q、T490A、T490S、S495T和R510E的一个或多个突变,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶包含突变E488Q和选自R348E、V351L、T375G、T375S、R455G、R455S、R455E、N473D、R474E、K475Q、R477E、R481E、S486T、T490A、T490S、S495T和R510E的一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变T375G或T375S,以及任选地一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变N473D,以及任选地一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变V351L,以及任选地一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变E488Q和T375G或T375G,以及任选地一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变E488Q和N473D,以及任选地一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变E488Q和V351L,以及任选地一个或多个其他突变。在一些实施方案中,腺苷脱氨酶包含突变E488Q以及T375G/S、N473D和V351L中的一者或多者。
在某些实例中,腺苷脱氨酶蛋白或其催化结构域已被修饰以包含hADAR2-D氨基酸序列在E488(优选E488Q)或同源ADAR蛋白中的相应位置处的突变,和/或其中腺苷脱氨酶蛋白或其催化结构域已被修饰以包含hADAR2-D氨基酸序列的T375(优选T375G)或同源ADAR蛋白中的相应位置处的突变。在某些实例中,腺苷脱氨酶蛋白或其催化结构域已被修饰以包含hADAR1d氨基酸序列在E1008(优选E1008Q)或同源ADAR蛋白中的相应位置处的突变。
与双链体RNA结合的人类ADAR2脱氨酶结构域的晶体结构揭示了与修饰位点5'侧上的RNA结合的蛋白质环。该5'结合环是ADAR家族成员之间的底物特异性差异的一个原因。参见Wang等人,Nucleic Acids Res.,44(20):9872-9880(2016),其内容通过引用整体并入本文。另外,在酶活性位点附近鉴定出ADAR2特异性RNA结合环。参见Mathews等人,Nat.Struct.Mol.Biol.,23(5):426-33(2016),其内容通过引用整体并入本文。在一些实施方案中,腺苷脱氨酶在RNA结合环中包含一个或多个突变以改进编辑特异性和/或效率。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的丙氨酸454或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置454处的丙氨酸残基被丝氨酸残基代替(A454S)。在一些实施方案中,位置454处的丙氨酸残基被半胱氨酸残基代替(A454C)。在一些实施方案中,位置454处的丙氨酸残基被天冬氨酸残基代替(A454D)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的精氨酸455或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置455处的精氨酸残基被丙氨酸残基代替(R455A)。在一些实施方案中,位置455处的精氨酸残基被缬氨酸残基代替(R455V)。在一些实施方案中,位置455处的精氨酸残基被组氨酸残基代替(R455H)。在一些实施方案中,位置455处的精氨酸残基被甘氨酸残基代替(R455G)。在一些实施方案中,位置455处的精氨酸残基被丝氨酸残基代替(R455S)。在一些实施方案中,位置455处的精氨酸残基被谷氨酸残基代替(R455E)。在一些实施方案中,腺苷脱氨酶包含突变R455C。在一些实施方案中,腺苷脱氨酶包含突变R455I。在一些实施方案中,腺苷脱氨酶包含突变R455K。在一些实施方案中,腺苷脱氨酶包含突变R455L。在一些实施方案中,腺苷脱氨酶包含突变R455M。在一些实施方案中,腺苷脱氨酶包含突变R455N。在一些实施方案中,腺苷脱氨酶包含突变R455Q。在一些实施方案中,腺苷脱氨酶包含突变R455F。在一些实施方案中,腺苷脱氨酶包含突变R455W。在一些实施方案中,腺苷脱氨酶包含突变R455P。在一些实施方案中,腺苷脱氨酶包含突变R455Y。在一些实施方案中,腺苷脱氨酶包含突变R455E。在一些实施方案中,腺苷脱氨酶包含突变R455D。在一些实施方案中,上述R455处的突变进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的异亮氨酸456或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置456处的异亮氨酸残基被缬氨酸残基代替(I456V)。在一些实施方案中,位置456处的异亮氨酸残基被亮氨酸残基代替(I456L)。在一些实施方案中,位置456处的异亮氨酸残基被天冬氨酸残基代替(I456D)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的苯丙氨酸457或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置457处的苯丙氨酸残基被酪氨酸残基代替(F457Y)。在一些实施方案中,位置457处的苯丙氨酸残基被精氨酸残基代替(F457R)。在一些实施方案中,位置457处的苯丙氨酸残基被谷氨酸残基代替(F457E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的丝氨酸458或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置458处的丝氨酸残基被缬氨酸残基代替(S458V)。在一些实施方案中,位置458处的丝氨酸残基被苯丙氨酸残基代替(S458F)。在一些实施方案中,位置458处的丝氨酸残基被脯氨酸残基代替(S458P)。在一些实施方案中,腺苷脱氨酶包含突变S458I。在一些实施方案中,腺苷脱氨酶包含突变S458L。在一些实施方案中,腺苷脱氨酶包含突变S458M。在一些实施方案中,腺苷脱氨酶包含突变S458C。在一些实施方案中,腺苷脱氨酶包含突变S458A。在一些实施方案中,腺苷脱氨酶包含突变S458G。在一些实施方案中,腺苷脱氨酶包含突变S458T。在一些实施方案中,腺苷脱氨酶包含突变S458Y。在一些实施方案中,腺苷脱氨酶包含突变S458W。在一些实施方案中,腺苷脱氨酶包含突变S458Q。在一些实施方案中,腺苷脱氨酶包含突变S458N。在一些实施方案中,腺苷脱氨酶包含突变S458H。在一些实施方案中,腺苷脱氨酶包含突变S458E。在一些实施方案中,腺苷脱氨酶包含突变S458D。在一些实施方案中,腺苷脱氨酶包含突变S458K。在一些实施方案中,腺苷脱氨酶包含突变S458R。在一些实施方案中,上述S458处的突变进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的脯氨酸459或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置459处的脯氨酸残基被半胱氨酸残基代替(P459C)。在一些实施方案中,位置459处的脯氨酸残基被组氨酸残基代替(P459H)。在一些实施方案中,位置459处的脯氨酸残基被色氨酸残基代替(P459W)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的组氨酸460或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置460处的组氨酸残基被精氨酸残基代替(H460R)。在一些实施方案中,位置460处的组氨酸残基被异亮氨酸残基代替(H460I)。在一些实施方案中,位置460处的组氨酸残基被脯氨酸残基代替(H460P)。在一些实施方案中,腺苷脱氨酶包含突变H460L。在一些实施方案中,腺苷脱氨酶包含突变H460V。在一些实施方案中,腺苷脱氨酶包含突变H460F。在一些实施方案中,腺苷脱氨酶包含突变H460M。在一些实施方案中,腺苷脱氨酶包含突变H460C。在一些实施方案中,腺苷脱氨酶包含突变H460A。在一些实施方案中,腺苷脱氨酶包含突变H460G。在一些实施方案中,腺苷脱氨酶包含突变H460T。在一些实施方案中,腺苷脱氨酶包含突变H460S。在一些实施方案中,腺苷脱氨酶包含突变H460Y。在一些实施方案中,腺苷脱氨酶包含突变H460W。在一些实施方案中,腺苷脱氨酶包含突变H460Q。在一些实施方案中,腺苷脱氨酶包含突变H460N。在一些实施方案中,腺苷脱氨酶包含突变H460E。在一些实施方案中,腺苷脱氨酶包含突变H460D。在一些实施方案中,腺苷脱氨酶包含突变H460K。在一些实施方案中,上述H460处的突变进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的脯氨酸462或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置462处的脯氨酸残基被丝氨酸残基代替(P462S)。在一些实施方案中,位置462处的脯氨酸残基被色氨酸残基代替(P462W)。在一些实施方案中,位置462处的脯氨酸残基被谷氨酸残基代替(P462E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的天冬氨酸469或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置469处的天冬氨酸残基被谷氨酰胺残基代替(D469Q)。在一些实施方案中,位置469处的天冬氨酸残基被丝氨酸残基代替(D469S)。在一些实施方案中,位置469处的天冬氨酸残基被酪氨酸残基代替(D469Y)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的精氨酸470或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置470处的精氨酸残基被丙氨酸残基代替(R470A)。在一些实施方案中,位置470处的精氨酸残基被异亮氨酸残基代替(R470I)。在一些实施方案中,位置470处的精氨酸残基被天冬氨酸残基代替(R470D)。
在一些实施方案中,腺苷脱氨酶包含在hADAR2-D氨基酸序列的组氨酸471或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置471处的组氨酸残基被赖氨酸残基代替(H471K)。在一些实施方案中,位置471处的组氨酸残基被苏氨酸残基代替(H471T)。在一些实施方案中,位置471处的组氨酸残基被缬氨酸残基代替(H471V)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的脯氨酸472或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置472处的脯氨酸残基被赖氨酸残基代替(P472K)。在一些实施方案中,位置472处的脯氨酸残基被苏氨酸残基代替(P472T)。在一些实施方案中,位置472处的脯氨酸残基被天冬氨酸残基代替(P472D)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的天冬酰胺473或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置473处的天冬酰胺残基被精氨酸残基代替(N473R)。在一些实施方案中,位置473处的天冬酰胺残基被色氨酸残基代替(N473W)。在一些实施方案中,位置473处的天冬酰胺残基被脯氨酸残基代替(N473P)。在一些实施方案中,位置473处的天冬酰胺残基被天冬氨酸残基代替(N473D)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的精氨酸474或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置474处的精氨酸残基被赖氨酸残基代替(R474K)。在一些实施方案中,位置474处的精氨酸残基被甘氨酸残基代替(R474G)。在一些实施方案中,位置474处的精氨酸残基被天冬氨酸残基代替(R474D)。在一些实施方案中,位置474处的精氨酸残基被谷氨酸残基代替(R474E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的赖氨酸475或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置475处的赖氨酸残基被谷氨酰胺残基代替(K475Q)。在一些实施方案中,位置475处的赖氨酸残基被天冬酰胺残基代替(K475N)。在一些实施方案中,位置475处的赖氨酸残基被天冬氨酸残基代替(K475D)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的丙氨酸476或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置476处的丙氨酸残基被丝氨酸残基代替(A476S)。在一些实施方案中,位置476处的丙氨酸残基被精氨酸残基代替(A476R)。在一些实施方案中,位置476处的丙氨酸残基被谷氨酸残基代替(A476E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的精氨酸477或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置477处的精氨酸残基被赖氨酸残基代替(R477K)。在一些实施方案中,位置477上的精氨酸残基被苏氨酸残基代替(R477T)。在一些实施方案中,位置477处的精氨酸残基被苯丙氨酸残基(R477F)代替。在一些实施方案中,位置474处的精氨酸残基被谷氨酸残基代替(R477E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的甘氨酸478或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置478处的甘氨酸残基被丙氨酸残基代替(G478A)。在一些实施方案中,位置478处的甘氨酸残基被精氨酸残基代替(G478R)。在一些实施方案中,位置478处的甘氨酸残基被酪氨酸残基代替(G478Y)。在一些实施方案中,腺苷脱氨酶包含突变G478I。在一些实施方案中,腺苷脱氨酶包含突变G478L。在一些实施方案中,腺苷脱氨酶包含突变G478V。在一些实施方案中,腺苷脱氨酶包含突变G478F。在一些实施方案中,腺苷脱氨酶包含突变G478M。在一些实施方案中,腺苷脱氨酶包含突变G478C。在一些实施方案中,腺苷脱氨酶包含突变G478P。在一些实施方案中,腺苷脱氨酶包含突变G478T。在一些实施方案中,腺苷脱氨酶包含突变G478S。在一些实施方案中,腺苷脱氨酶包含突变G478W。在一些实施方案中,腺苷脱氨酶包含突变G478Q。在一些实施方案中,腺苷脱氨酶包含突变G478N。在一些实施方案中,腺苷脱氨酶包含突变G478H。在一些实施方案中,腺苷脱氨酶包含突变G478E。在一些实施方案中,腺苷脱氨酶包含突变G478D。在一些实施方案中,腺苷脱氨酶包含突变G478K。在一些实施方案中,上述G478处的突变进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的谷氨酰胺479或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置479处的谷氨酰胺残基被天冬酰胺残基代替(Q479N)。在一些实施方案中,位置479处的谷氨酰胺残基被丝氨酸残基代替(Q479S)。在一些实施方案中,位置479处的谷氨酰胺残基被脯氨酸残基代替(Q479P)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的精氨酸348或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置348处的精氨酸残基被丙氨酸残基代替(R348A)。在一些实施方案中,位置348处的精氨酸残基被谷氨酸残基代替(R348E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的缬氨酸351或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置351处的缬氨酸残基被亮氨酸残基代替(V351L)。在一些实施方案中,腺苷脱氨酶包含突变V351Y。在一些实施方案中,腺苷脱氨酶包含突变V351M。在一些实施方案中,腺苷脱氨酶包含突变V351T。在一些实施方案中,腺苷脱氨酶包含突变V351G。在一些实施方案中,腺苷脱氨酶包含突变V351A。在一些实施方案中,腺苷脱氨酶包含突变V351F。在一些实施方案中,腺苷脱氨酶包含突变V351E。在一些实施方案中,腺苷脱氨酶包含突变V351I。在一些实施方案中,腺苷脱氨酶包含突变V351C。在一些实施方案中,腺苷脱氨酶包含突变V351H。在一些实施方案中,腺苷脱氨酶包含突变V351P。在一些实施方案中,腺苷脱氨酶包含突变V351S。在一些实施方案中,腺苷脱氨酶包含突变V351K。在一些实施方案中,腺苷脱氨酶包含突变V351N。在一些实施方案中,腺苷脱氨酶包含突变V351W。在一些实施方案中,腺苷脱氨酶包含突变V351Q。在一些实施方案中,腺苷脱氨酶包含突变V351D。在一些实施方案中,腺苷脱氨酶包含突变V351R。在一些实施方案中,上述V351处的突变进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的苏氨酸375或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置375处的苏氨酸残基被甘氨酸残基代替(T375G)。在一些实施方案中,位置375处的苏氨酸残基被丝氨酸残基代替(T375S)。在一些实施方案中,腺苷脱氨酶包含突变T375H。在一些实施方案中,腺苷脱氨酶包含突变T375Q。在一些实施方案中,腺苷脱氨酶包含突变T375C。在一些实施方案中,腺苷脱氨酶包含突变T375N。在一些实施方案中,腺苷脱氨酶包含突变T375M。在一些实施方案中,腺苷脱氨酶包含突变T375A。在一些实施方案中,腺苷脱氨酶包含突变T375W。在一些实施方案中,腺苷脱氨酶包含突变T375V。在一些实施方案中,腺苷脱氨酶包含突变T375R。在一些实施方案中,腺苷脱氨酶包含突变T375E。在一些实施方案中,腺苷脱氨酶包含突变T375K。在一些实施方案中,腺苷脱氨酶包含突变T375F。在一些实施方案中,腺苷脱氨酶包含突变T375I。在一些实施方案中,腺苷脱氨酶包含突变T375D。在一些实施方案中,腺苷脱氨酶包含突变T375P。在一些实施方案中,腺苷脱氨酶包含突变T375L。在一些实施方案中,腺苷脱氨酶包含突变T375Y。在一些实施方案中,上述T375Y处的突变进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Arg481或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置481处的精氨酸残基被谷氨酸残基代替(R481E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Ser486或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置486处的丝氨酸残基被苏氨酸残基代替(S486T)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Thr490或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置490处的苏氨酸残基被丙氨酸残基代替(T490A)。在一些实施方案中,位置490处的苏氨酸残基被丝氨酸残基代替(T490S)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Ser495或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置495处的丝氨酸残基被苏氨酸残基代替(S495T)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Arg510或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置510处的精氨酸残基被谷氨酰胺残基代替(R510Q)。在一些实施方案中,位置510处的精氨酸残基被丙氨酸残基代替(R510A)。在一些实施方案中,位置510处的精氨酸残基被谷氨酸残基代替(R510E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Gly593或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置593处的甘氨酸残基被丙氨酸残基代替(G593A)。在一些实施方案中,位置593处的甘氨酸残基被谷氨酸残基代替(G593E)。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的Lys594或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置594处的赖氨酸残基被丙氨酸残基代替(K594A)。
在一些实施方案中,腺苷脱氨酶包含在hADAR2-D氨基酸序列的位置A454、R455、I456、F457、S458、P459、H460、P462、D469、R470、H471、P472、N473、R474、K475、A476、R477、G478、Q479、R348、R510、G593、K594中的任一者或多者或同源ADAR蛋白中的相应位置处的突变。
在一些实施方案中,腺苷脱氨酶包含hADAR2-D氨基酸序列的突变A454S、A454C、A454D、R455A、R455V、R455H、I456V、I456L、I456D、F457Y、F457R、F457E、S458V、S458F、S458P、P459C、P459H、P459W、H460R、H460I、H460P、P462S、P462W、P462E、D469Q、D469S、D469Y、R470A、R470I、R470D、H471K、H471T、H471V、P472K、P472T、P472D、N473R、N473W、N473P、R474K、R474G、R474D、K475Q、K475N、K475D、A476S、A476R、A476E、R477K、R477T、R477F、G478A、G478R、G478Y、Q479N、Q479S、Q479P、R348A、R510Q、R510A、G593A、G593E、K594A中的任一者或多者,或同源ADAR蛋白中的相应位置的突变。
在某些实施方案中,使腺苷脱氨酶突变以将活性转化为胞苷脱氨酶。因此,在一些实施方案中,腺苷脱氨酶在选自E396、C451、V351、R455、T375、K376、S486、Q488、R510、K594、R348、G593、S397、H443、L444、Y445、F442、E438、T448、A353、V355、T339、P539、T339、P539、V525、I520、P462和N579的位置中包含一个或多个突变。在特定实施方案中,腺苷脱氨酶在选自V351、L444、V355、V525和I520的位置中包含一个或多个突变。在一些实施方案中,所述腺苷脱氨酶可包含基于hADAR2-D的氨基酸序列位置的E488、V351、S486、T375、S370、P462、N597处的一个或多个突变,以及与上述相对应的同源ADAR蛋白中的突变。
在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T、V440I,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T、V440I、S495N,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T、V440I、S495N、K418E,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含一个或多个突变:基于hADAR2-D的氨基酸序列位置的E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T、V440I、S495N、K418E、S661T,以及与上述相对应的同源ADAR蛋白中的突变。在一些实例中,本文提供者包括一种突变的腺苷脱氨酶,例如包含E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T、V440I、S495N、K418E、S661T的一个或多个突变与死Cas12b蛋白或Cas12切口酶融合的腺苷脱氨酶。在一个特定实例中,本文提供者包括一种突变的腺苷脱氨酶,例如包含E488Q、V351G、S486A、T375S、S370C、P462A、N597I、L332I、I398V、K350I、M383L、D619G、S582T、V440I、S495N、K418E和S661T与死Cas12b蛋白或Cas12切口酶融合的腺苷脱氨酶。
在一些实施方案中,腺苷脱氨酶包含在hADAR2-D氨基酸序列的位置T375、V351、G478、S458、H460中的任一者或多者或同源ADAR蛋白中的相应位置处的突变,任选地与E488处的突变组合。在一些实施方案中,腺苷脱氨酶包含选自T375G、T375C、T375H、T375Q、V351M、V351T、V351Y、G478R、S458F、H460I的一个或多个突变,任选地与E488Q组合。
在一些实施方案中,腺苷脱氨酶包含选自T375H、T375Q、V351M、V351Y、H460P的一个或多个突变,任选地与E488Q组合。
在一些实施方案中,腺苷脱氨酶包含突变T375S和S458F,任选地与E488Q组合。
在一些实施方案中,腺苷脱氨酶包含在hADAR2-D氨基酸序列的位置T375、N473、R474、G478、S458、P459、V351、R455、R455、T490、R348、Q479中的两者或更多者或同源ADAR蛋白中的相应位置处的突变,任选地与E488处的突变组合。在一些实施方案中,腺苷脱氨酶包含选自T375G、T375S、N473D、R474E、G478R、S458F、P459W、V351L、R455G、R455S、T490A、R348E、Q479P的两个或更多个突变,任选地与E488Q组合。
在一些实施方案中,腺苷脱氨酶包含突变T375G和V351L。在一些实施方案中,腺苷脱氨酶包含突变T375G和R455G。在一些实施方案中,腺苷脱氨酶包含突变T375G和R455S。在一些实施方案中,腺苷脱氨酶包含突变T375G和T490A。在一些实施方案中,腺苷脱氨酶包含突变T375G和R348E。在一些实施方案中,腺苷脱氨酶包含突变T375S和V351L。在一些实施方案中,腺苷脱氨酶包含突变T375S和R455G。在一些实施方案中,腺苷脱氨酶包含突变T375S和R455S。在一些实施方案中,腺苷脱氨酶包含突变T375S和T490A。在一些实施方案中,腺苷脱氨酶包含突变T375S和R348E。在一些实施方案中,腺苷脱氨酶包含突变N473D和V351L。在一些实施方案中,腺苷脱氨酶包含突变N473D和R455G。在一些实施方案中,腺苷脱氨酶包含突变N473D和R455S。在一些实施方案中,腺苷脱氨酶包含突变N473D和T490A。在一些实施方案中,腺苷脱氨酶包含突变N473D和R348E。在一些实施方案中,腺苷脱氨酶包含突变R474E和V351L。在一些实施方案中,腺苷脱氨酶包含突变R474E和R455G。在一些实施方案中,腺苷脱氨酶包含突变R474E和R455S。在一些实施方案中,腺苷脱氨酶包含突变R474E和T490A。在一些实施方案中,腺苷脱氨酶包含突变R474E和R348E。在一些实施方案中,腺苷脱氨酶包含突变S458F和T375G。在一些实施方案中,腺苷脱氨酶包含突变S458F和T375S。在一些实施方案中,腺苷脱氨酶包含突变S458F和N473D。在一些实施方案中,腺苷脱氨酶包含突变S458F和R474E。在一些实施方案中,腺苷脱氨酶包含突变S458F和G478R。在一些实施方案中,腺苷脱氨酶包含突变G478R和T375G。在一些实施方案中,腺苷脱氨酶包含突变G478R和T375S。在一些实施方案中,腺苷脱氨酶包含突变G478R和N473D。在一些实施方案中,腺苷脱氨酶包含突变G478R和R474E。在一些实施方案中,腺苷脱氨酶包含突变P459W和T375G。在一些实施方案中,腺苷脱氨酶包含突变P459W和T375S。在一些实施方案中,腺苷脱氨酶包含突变P459W和N473D。在一些实施方案中,腺苷脱氨酶包含突变P459W和R474E。在一些实施方案中,腺苷脱氨酶包含突变P459W和G478R。在一些实施方案中,腺苷脱氨酶包含突变P459W和S458F。在一些实施方案中,腺苷脱氨酶包含突变Q479P和T375G。在一些实施方案中,腺苷脱氨酶包含突变Q479P和T375S。在一些实施方案中,腺苷脱氨酶包含突变Q479P和N473D。在一些实施方案中,腺苷脱氨酶包含突变Q479P和R474E。在一些实施方案中,腺苷脱氨酶包含突变Q479P和G478R。在一些实施方案中,腺苷脱氨酶包含突变Q479P和S458F。在一些实施方案中,腺苷脱氨酶包含突变Q479P和P459W。本段落中描述的所有突变也可进一步与E488Q突变组合进行。
在一些实施方案中,腺苷脱氨酶包含在hADAR2-D氨基酸序列的位置K475、Q479、P459、G478、S458中的任一者或多者或同源ADAR蛋白中的相应位置处的突变,任选地与E488处的突变组合。在一些实施方案中,腺苷脱氨酶包含选自K475N、Q479N、P459W、G478R、S458P、S458F的一个或多个突变,任选地与E488Q组合。
在一些实施方案中,腺苷脱氨酶包含在hADAR2-D氨基酸序列的位置T375、V351、R455、H460、A476中的任一者或多者或同源ADAR蛋白中的相应位置处的突变,任选地与E488处的突变组合。在一些实施方案中,腺苷脱氨酶包含选自T375G、T375C、T375H、T375Q、V351M、V351T、V351Y、R455H、H460P、H460I、A476E的一个或多个突变,任选地与E488Q组合。
在某些实施方案中,通过gRNA的化学修饰来实现编辑的改善和脱靶修饰的减少。如Vogel等人,(2014),Angew Chem Int Ed,53:6267-6271,doi:10.1002/anie.201402634(通过引用整体并入本文)所示例进行化学修饰的gRNA降低了脱靶活性并提高了在靶效率。2'-O-甲基和硫代磷酸酯修饰的指导RNA通常可提高细胞中的编辑效率。
已知ADAR表现出对编辑过的A的任一侧的相邻核苷酸的偏好(www.nature.com/nsmb/journal/v23/n5/full/nsmb.3203.html;Matthews等人,(2017),Nature StructuralMol Biol,23(5):426-433,通过引用整体并入本文)。因此,在某些实施方案中,针对基序偏好对gRNA、靶标和/或ADAR进行选择优化。
体外有意错配已被证实可允许编辑非优选基序(academic.oup.com/nar/article-lookup/doi/10.1093/nar/gku272;Schneider等人(2014),Nucleic Acid Res,42(10):e87);Fukuda等人(2017),Scientific Reports,7,doi:10.1038/srep41478,通过引用整体并入本文)。因此,在某些实施方案中,为了提高在非优选的5'或3'相邻碱基上的RNA编辑效率,在相邻碱基中引入了有意错配。
在一些实施方案中,腺苷脱氨酶可以是tRNA特异性腺苷脱氨酶或其变体。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:W23L、W23R、R26G、H36L、N37S、P48S、P48T、P48A、I49V、R51L、N72D、L84F、S97C、A106V、D108N、H123Y、G125A、A142N、S146C、D147Y、R152H、R152P、E155V、I156F、K157N、K161T,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、A142N,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N、P48S,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N、P48S、A142N,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N、P48S、W23R、P48A,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N、P48S、W23R、P48A、A142N,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N、P48S、W23R、P48A、R152P,以及与上述相对应的同源脱氨酶蛋白中的突变。在一些实施方案中,腺苷脱氨酶可包含基于大肠杆菌TadA的氨基酸序列位置的一个或多个突变:A106V、D108N、D147Y、E155V、L84F、H123Y、I156F、H36L、R51L、S146C、K157N、P48S、W23R、P48A、R152P、A142N,以及与上述相对应的同源脱氨酶蛋白中的突变。
结果表明,ADAR脱氨酶结构域的靶向窗口中的A'对C'相比于其他碱基优先被编辑。此外,在靶向碱基的几个碱基内与U'碱基配对的A'显示Cas12b-ADAR融合物的编辑水平较低,这表明所述酶编辑多个A'存在灵活性。这两个观察结果表明,可通过将所有要编辑的A'与C'进行错配,在Cas12b-ADAR融合物的活性窗口中的多个A'可指定用于编辑。因此,在某些实施方案中,活性窗口中的多个A:C错配被设计为产生多个A:I编辑。在某些实施方案中,为了抑制活性窗口中潜在的脱靶编辑,将非靶标A'与A'或G'配对。
术语“编辑特异性”和“编辑偏好”在本文可互换使用,是指在双链底物中特定腺苷位点处A-I编辑的程度。在一些实施方案中,底物编辑偏好由靶腺苷残基的5'最近邻和/或3'最近邻确定。在一些实施方案中,腺苷脱氨酶对底物的5'最近邻具有偏好,排序为U>A>C>G(“>”表示更大的偏好)。在一些实施方案中,腺苷脱氨酶对底物的3'最近邻具有偏好,排序为G>C~A>U(“>”表示更大的偏好;“~”表示相似的偏好)。在一些实施方案中,腺苷脱氨酶对底物的3'最近邻具有偏好,排序为G>C>U~A(“>”表示更大的偏好;“~”表示相似的偏好)。在一些实施方案中,腺苷脱氨酶对底物的3'最近邻具有偏好,排序为G>C>A>U(“>”表示更大的偏好)。在一些实施方案中,腺苷脱氨酶对底物的3'最近邻具有偏好,排序为C~G~A>U(“>”表示更大的偏好;“~”表示相似的偏好)。在一些实施方案中,腺苷脱氨酶对含有靶腺苷残基的三联体序列具有偏好,排序为TAG>AAG>CAC>AAT>GAA>GAC(“>”表示更大的偏好),中心A为靶腺苷残基。
在一些实施方案中,腺苷脱氨酶的底物编辑偏好受腺苷脱氨酶蛋白中是否存在核酸结合结构域影响。在一些实施方案中,为了修饰底物编辑偏好,将脱氨酶结构域与双链RNA结合结构域(dsRBD)或双链RNA结合基序(dsRBM)连接。在一些实施方案中,dsRBD或dsRBM可衍生自ADAR蛋白,例如hADAR1或hADAR2。在一些实施方案中,使用包含至少一个dsRBD和脱氨酶结构域的全长ADAR蛋白。在一些实施方案中,一个或多个dsRBM或dsRBD在脱氨酶结构域的N末端。在其他实施方案中,一个或多个dsRBM或dsRBD在脱氨酶结构域的C末端。
在一些实施方案中,腺苷脱氨酶的底物编辑偏好受酶活性中心附近或其中的氨基酸残基影响。在一些实施方案中,为了修饰底物编辑偏好,腺苷脱氨酶可包含基于hADAR2-D的氨基酸序列位置的一个或多个突变:G336D、G487R、G487K、G487W、G487Y、E488Q、E488N、T490A、V493A、V493T、V493S、N597K、N597R、A589V、S599T、N613K、N613R,以及与上述相对应的同源ADAR蛋白中的突变。
特别地,在一些实施方案中,为了降低编辑特异性,腺苷脱氨酶可包含基于hADAR2-D的氨基酸序列位置的一个或多个突变E488Q、V493A、N597K、N613K,以及与上述相对应的同源ADAR蛋白中的突变。在一些实施方案中,为了增加编辑特异性,腺苷脱氨酶可包含突变T490A。
在一些实施方案中,为了增加对具有直接5'G的靶腺苷(A)的编辑偏好,例如包含三联体序列GAC的底物,中心A是靶腺苷残基,腺苷脱氨酶可包含基于hADAR2-D的氨基酸序列位置的一个或多个突变:G336D、E488Q、E488N、V493T、V493S、V493A、A589V、N597K、N597R、S599T、N613K、N613R,以及与上述相对应的同源ADAR蛋白中的突变。
特别地,在一些实施方案中,腺苷脱氨酶包含突变E488Q或同源ADAR蛋白中的相应突变,用于编辑包含以下三联体序列的底物:GAC、GAA、GAU、GAG、CAU、AAU、UAC,中心A为靶腺苷残基。
在一些实施方案中,腺苷脱氨酶包含hADAR1-D的野生型氨基酸序列。在一些实施方案中,腺苷脱氨酶在hADAR1-D序列中包含一个或多个突变,以便根据特定需要改变hADAR1-D的编辑效率和/或底物编辑偏好。
在一些实施方案中,腺苷脱氨酶包含在hADAR1-D氨基酸序列的甘氨酸1007或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置1007处的甘氨酸残基被具有相对小的侧链的非极性氨基酸残基代替。例如,在一些实施方案中,位置1007处的甘氨酸残基被丙氨酸残基代替(G1007A)。在一些实施方案中,位置1007处的甘氨酸残基被缬氨酸残基代替(G1007V)。在一些实施方案中,位置1007处的甘氨酸残基被具有较大侧链的氨基酸残基代替。在一些实施方案中,位置1007处的甘氨酸残基被精氨酸残基代替(G1007R)。在一些实施方案中,位置1007处的甘氨酸残基被赖氨酸残基代替(G1007K)。在一些实施方案中,位置1007处的甘氨酸残基被色氨酸残基代替(G1007W)。在一些实施方案中,位置1007处的甘氨酸残基被酪氨酸残基代替(G1007Y)。另外,在其他实施方案中,位置1007处的甘氨酸残基被亮氨酸残基代替(G1007L)。在其他实施方案中,位置1007处的甘氨酸残基被苏氨酸残基代替(G1007T)。在其他实施方案中,位置1007处的甘氨酸残基被丝氨酸残基代替(G1007S)。
在一些实施方案中,腺苷脱氨酶包含hADAR1-D氨基酸序列的谷氨酸1008或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,位置1008处的谷氨酸残基被具有相对大侧链的极性氨基酸残基代替。在一些实施方案中,位置1008处的谷氨酸残基被谷氨酰胺残基代替(E1008Q)。在一些实施方案中,位置1008处的谷氨酸残基被组氨酸残基代替(E1008H)。在一些实施方案中,位置1008处的谷氨酸残基被精氨酸残基代替(E1008R)。在一些实施方案中,位置1008处的谷氨酸残基被赖氨酸残基代替(E1008K)。在一些实施方案中,位置1008处的谷氨酸残基被非极性或小极性氨基酸残基代替。在一些实施方案中,位置1008处的谷氨酸残基被苯丙氨酸残基代替(E1008F)。在一些实施方案中,位置1008处的谷氨酸残基被色氨酸残基代替(E1008W)。在一些实施方案中,位置1008处的谷氨酸残基被甘氨酸残基代替(E1008G)。在一些实施方案中,位置1008处的谷氨酸残基被异亮氨酸残基代替(E1008I)。在一些实施方案中,位置1008处的谷氨酸残基被缬氨酸残基代替(E1008V)。在一些实施方案中,位置1008处的谷氨酸残基被脯氨酸残基代替(E1008P)。在一些实施方案中,位置1008处的谷氨酸残基被丝氨酸残基代替(E1008S)。在其他实施方案中,位置1008处的谷氨酸残基被天冬酰胺残基代替(E1008N)。在其他实施方案中,位置1008处的谷氨酸残基被丙氨酸残基代替(E1008A)。在其他实施方案中,位置1008处的谷氨酸残基被甲硫氨酸残基代替(E1008M)。在一些实施方案中,位置1008处的谷氨酸残基被亮氨酸残基代替(E1008L)。
在一些实施方案中,为了提高编辑效率,腺苷脱氨酶可包含基于hADAR1-D的氨基酸序列位置的一个或多个突变:E1007S、E1007A、E1007V、E1008Q、E1008R、E1008H、E1008M、E1008N、E1008K,以及与上述相对应的同源ADAR蛋白中的突变。
在一些实施方案中,为了降低编辑效率,腺苷脱氨酶可包含基于hADAR1-D的氨基酸序列位置的一个或多个突变:E1007R、E1007K、E1007Y、E1007L、E1007T、E1008G、E1008I、E1008P、E1008V、E1008F、E1008W、E1008S、E1008N、E1008K,以及与上述相对应的同源ADAR蛋白中的突变。
在一些实施方案中,腺苷脱氨酶的底物编辑偏好、效率和/或选择性受酶活性中心附近或其中的氨基酸残基影响。在一些实施方案中,腺苷脱氨酶包含在hADAR1-D序列中的谷氨酸1008位置或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,所述突变是E1008R,或同源ADAR蛋白中的相应突变。在一些实施方案中,E1008R突变体对在相反链上具有错配G残基的靶腺苷残基具有提高的编辑效率。
在一些实施方案中,腺苷脱氨酶蛋白还包含或连接至一个或多个双链RNA(dsRNA)结合基序(dsRBM)或结构域(dsRBD),以识别并结合至双链核酸底物。在一些实施方案中,腺苷脱氨酶和双链底物之间的相互作用由一种或多种另外的蛋白质因子介导,包括CRISPR/CAS蛋白质因子。在一些实施方案中,腺苷脱氨酶和双链底物之间的相互作用进一步由一个或多个核酸组分(包括指导RNA)介导。
具有C至U脱氨基活性的修饰的腺苷脱氨酶
在某些示例实施方案中,定向进化可用于设计修饰的ADAR蛋白,该蛋白除了能将腺嘌呤脱氨成次黄嘌呤外还能够催化其他反应。例如,修饰的ADAR蛋白可能能够催化胞苷脱氨为尿嘧啶。尽管不受特定理论的束缚,但提高C至U活性的突变可能会改变结合口袋的形状,使其更适合较小的胞苷碱基。
在一些实施方案中,具有C-U脱氨基活性的修饰的腺苷脱氨酶包含在hADAR2-D氨基酸序列的位置V351、T375、R455和E488中的任一者或多者或同源ADAR蛋白中的相应位置处的突变。在一些实施方案中,腺苷脱氨酶包含突变E488Q。在一些实施方案中,腺苷脱氨酶包含选自以下的一个或多个突变:V351I、V351L、V351F、V351M、V351C、V351A、V351G、V351P、V351T、V351S、V351Y、V351W、V351Q、V351N、V351H、V351E、V351D、V351K、V351R、T375I、T375L、T375V、T375F、T375M、T375C、T375A、T375G、T375P、T375S、T375Y、T375W、T375Q、T375N、T375H、T375E、T375D、T375K、T375R、R455I、R455L、R455V、R455F、R455M、R455C、R455A、R455G、R455P、R455T、R455S、R455Y、R455W、R455Q、R455N、R455H、R455E、R455D、R455K。在一些实施方案中,腺苷脱氨酶包含突变E488Q,并且还包含选自以下的一个或多个突变:V351I、V351L、V351F、V351M、V351C、V351A、V351G、V351P、V351T、V351S、V351Y、V351W、V351Q、V351N、V351H、V351E、V351D、V351K、V351R、T375I、T375L、T375V、T375F、T375M、T375C、T375A、T375G、T375P、T375S、T375Y、T375W、T375Q、T375N、T375H、T375E、T375D、T375K、T375R、R455I、R455L、R455V、R455F、R455M、R455C、R455A、R455G、R455P、R455T、R455S、R455Y、R455W、R455Q、R455N、R455H、R455E、R455D、R455K。
关于具有C-U脱氨基活性的前述修饰的ADAR蛋白,本文所述的本发明还涉及用于使目标靶RNA序列中的C脱氨基的方法,所述方法包括将本文公开的AD官能化的组合物递送至靶RNA或DNA。
在某些示例实施方案中,用于使靶RNA序列中的C脱氨基的方法包括向所述靶RNA中递送:(a)无催化活性的(死)Cas;(b)指导分子,其包含与正向重复序列连接的指导序列;和(c)具有C-U脱氨基活性的修饰的ADAR蛋白或其催化结构域;其中所述修饰的ADAR蛋白或其催化结构域与所述死Cas蛋白或所述指导分子共价或非共价连接,或者所述修饰的ADAR蛋白或其催化结构域适于在递送后与所述死Cas蛋白或所述指导分子连接;其中指导分子与所述死Cas蛋白形成复合物并引导所述复合物结合所述目标靶RNA序列;其中所述指导序列能够与包含所述C的靶序列杂交以形成RNA双链体;其中,任选地,所述指导序列在对应于所述C的位置处包含非配对A或U,导致形成的RNA双链体中的错配;并且其中所述修饰的ADAR蛋白或其催化结构域使所述RNA双链体中的所述C脱氨基。
关于具有C-U脱氨基活性的前述修饰的ADAR蛋白,本文所述的本发明还涉及一种工程化的、非天然存在的系统,所述系统适于使目标靶基因座中的C脱氨基,所述系统包含:(a)指导分子,所述指导分子包含与正向重复序列连接的指导序列,或编码所述指导分子的核苷酸序列;(b)无催化活性的Cas13蛋白,或编码所述无催化活性的Cas13蛋白的核苷酸序列;(c)具有C-U脱氨基活性的修饰的ADAR蛋白或其催化结构域,或编码所述修饰的ADAR蛋白或其催化结构域的核苷酸序列;其中所述修饰的ADAR蛋白或其催化结构域与所述Cas13蛋白或所述指导分子共价或非共价连接,或者所述修饰的ADAR蛋白或其催化结构域适于在递送后与所述Cas13蛋白或所述指导分子连接;其中所述指导序列能够与包含C的靶RNA序列杂交以形成RNA双链体;其中,任选地,所述指导序列在对应于所述C的位置处包含非配对A或U,导致所形成的RNA双链体中的错配;其中,任选地,所述系统是包含一个或多个载体的载体系统,所述载体包含:(a)第一调控元件,其可操作地连接至编码包含所述指导序列的所述指导分子的核苷酸序列,(b)第二调控元件,其可操作地连接至编码所述无催化活性的Cas13蛋白的核苷酸序列;和(c)在所述第一或第二调控元件的控制下或可操作地连接至第三调控元件的编码具有C-U脱氨基活性的修饰的ADAR蛋白或其催化结构域的核苷酸序列;其中,如果所述编码修饰的ADAR蛋白或其催化结构域的核苷酸序列可操作地连接至第三调控元件,则所述修饰的ADAR蛋白或其催化结构域适于在表达后连接至所述指导分子或所述Cas13蛋白;其中组分(a)、(b)和(c)位于所述系统的相同或不同载体上,任选地其中所述第一、第二和/或第三调控元件是诱导型启动子。
在本发明的一个实施方案中,腺苷脱氨酶的底物是在指导分子与其DNA靶标结合后形成的RNA/DNA异源双链体,然后其与CRISPR-Cas酶形成CRISPR-Cas复合物。RNA/DNA或DNA/RNA异源双链体在本文中也称为“RNA/DNA杂合体”、“DNA/RNA杂合体”或“双链底物”。
根据本发明,腺苷脱氨酶的底物是在指导分子与其DNA靶标结合后形成的RNA/DNAn RNA双链体,然后其与CRISPR-Cas酶形成CRISPR-Cas复合物。腺苷脱氨酶的底物也可以是在指导分子与其RNA靶标结合后形成的RNA/RNA双链体,然后其与CRISPR-Cas酶形成CRISPR-Cas复合物。RNA/DNA或DNA/RNAn RNA双链体在本文中也称为“RNA/DNA杂合体”、“DNA/RNA杂合体”或“双链底物”。指导分子和CRISPR-Cas酶的特定特征在下文详述。
如本文所用,术语“编辑选择性”是指通过腺苷脱氨酶编辑的双链底物上所有位点的分率。不受理论的束缚,可预期,腺苷脱氨酶的编辑选择性受双链底物长度和二级结构例如存在错配的碱基、凸起和/或内部环的影响。
在一些实施方案中,当底物是长于50bp的完全碱基配对的双链体时,腺苷脱氨酶可能能够使双链体内的多个腺苷残基(例如,所有腺苷残基的50%)脱氨基。在一些实施方案中,当底物短于50bp时,腺苷脱氨酶的编辑选择性受靶腺苷位点处错配存在的影响。特别地,在一些实施方案中,在相反链上具有错配的胞苷(C)残基的腺苷(A)残基在高效率下脱氨基。在一些实施方案中,跳过在相反链上具有错配的鸟苷(G)残基的腺苷(A)残基而不进行编辑。
在特定的实施方案中,腺苷脱氨酶蛋白或其催化结构域作为单独的蛋白质被递送至细胞或在细胞内表达,但是被修饰以便能够与C2c1蛋白或指导分子连接。在特定的实施方案中,这通过使用存在于噬菌体外壳蛋白多样性内的正交RNA结合蛋白或衔接子蛋白/适体组合来确保。此类外壳蛋白的实例包括但不限于:MS2、Qβ、F2、GA、fr、JP501、M12、R17、BZ13、JP34、JP500、KU1、M11、MX1、TW18、VK、SP、FI、ID2、NL95、TW19、AP205、φCb5、φCb8r、φCb12r、φCb23r、7s和PRR1。适体可以是天然存在的或合成的寡核苷酸,它们已通过反复多轮的体外选择或SELEX(通过指数富集的配体系统进化)以结合特定靶标而工程化。
在特定的实施方案中,指导分子具有可募集衔接子蛋白的一个或多个不同的RNA环或不同的序列。通过插入不同的RNA环或不同的序列,可延伸指导分子,而不会与C2c1蛋白发生碰撞,所述不同的RNA环或不同的序列可募集可以结合不同的RNA环或不同序列的衔接子蛋白。在Konermann(Nature 2015,517(7536):583-588)中提供了修饰的指导物的实例及其在将效应子结构域募集到C2c1复合物中的用途。在特定的实施方案中,适体是最小发夹适体,其选择性地结合哺乳动物细胞中的二聚化的MS2噬菌体外壳蛋白,并被引入到指导分子中,例如茎环和/或四环中。在这些实施方案中,腺苷脱氨酶蛋白与MS2融合。然后将腺苷脱氨酶蛋白与C2c1蛋白和相应的指导RNA一起共同递送。
在一些实施方案中,本文所述的C2c1-ADAR碱基编辑系统包含(a)C2c1蛋白,其是无催化活性的或切口酶;(b)包含指导序列的指导分子;和(c)腺苷脱氨酶蛋白或其催化结构域;其中所述腺苷脱氨酶蛋白或其催化结构域与所述C2c1蛋白或所述指导分子共价或非共价连接,或者所述腺苷脱氨酶蛋白或其催化结构域适于在递送后与所述C2c1蛋白或所述指导分子连接;其中所述指导序列与所述靶序列基本上互补但包含对应于被靶向的A的非配对C以进行脱氨基,导致由所述指导序列和所述靶序列形成的DNA-RNA或RNA-RNA双链体中的A-C错配。为了应用于真核细胞,优选对C2c1蛋白和/或腺苷脱氨酶进行NLS标记。
在一些实施方案中,组分(a)、(b)和(c)作为核糖核蛋白复合物递送至细胞。所述核糖核蛋白复合物可经由一个或多个脂质纳米粒子递送。
在一些实施方案中,组分(a)、(b)和(c)作为一个或多个RNA分子例如一个或多个指导RNA和编码C2c1蛋白、腺苷脱氨酶蛋白和任选地衔接子蛋白的一个或多个mRNA分子被递送至细胞。RNA分子可经由一个或多个脂质纳米粒子递送。
在一些实施方案中,组分(a)、(b)和(c)作为一个或多个DNA分子被递送至细胞。在一些实施方案中,一个或多个DNA分子包含在一个或多个载体例如病毒载体(例如AAV)内。在一些实施方案中,一个或多个DNA分子包含可操作地配置为表达C2c1蛋白、指导分子和腺苷脱氨酶蛋白或其催化结构域的一个或多个调控元件,任选地其中所述一个或多个调控元件包含诱导型启动子。
在一些实施方案中,指导分子能够与包含要在第一DNA链或RNA链内在靶基因座处脱氨基的腺嘌呤的靶序列杂交,以形成包含与所述腺嘌呤相对的非配对胞嘧啶的DNA-RNA或RNA-RNA双链体。在双链体形成后,指导分子与C2c1蛋白形成复合物,并引导所述复合物在目标靶基因座处结合所述第一DNA链或所述RNA链。下文提供了C2c1-ADAR碱基编辑系统的指导物方面的细节。
在一些实施方案中,具有典型长度(例如,对于AacC2c1为约20nt)的C2c1指导RNA用于与靶DNA或RNA形成DNA-RNA或RNA-RNA双链体。在一些实施方案中,比典型长度(例如,对于AacC2c1为>20nt)更长的C2c1指导分子用于与靶DNA或RNA形成DNA-RNA或RNA-RNA双链体(包括C2c1-指导RNA-靶DNA复合物的外部)。在某些示例实施方案中,指导序列具有约29-53nt的长度,其能够与所述靶序列形成DNA-RNA或RNA-RNA双链体。在某些其他示例实施方案中,指导序列具有约40-50nt的长度,其能够与所述靶序列形成DNA-RNA或RNA-RNA双链体。在某些示例实施方案中,所述非配对C与所述指导序列的5'端之间的距离为20-30个核苷酸。在某些示例实施方案中,所述非配对C与所述指导序列的3'端之间的距离为20-30个核苷酸。
在至少第一种设计中,C2c1-ADAR系统包含(a)与C2c1蛋白融合或连接的腺苷脱氨酶,其中所述C2c1蛋白是无催化活性的或切口酶,和(b)包含指导序列的指导分子,所述指导序列被设计为在指导序列与靶序列之间形成的DNA-RNA或RNA-RNA双链体中引入A-C错配。在一些实施方案中,C2c1蛋白和/或腺苷脱氨酶在N末端或C末端或两者上被NLS标记。
在至少第二种设计中,C2c1-ADAR系统包含(a)C2c1蛋白,其为无催化活性的或切口酶,(b)指导分子,所述指导分子包含指导序列,所述指导序列被设计为在指导序列与靶序列之间形成的DNA-RNA或RNA-RNA双链体中引入A-C错配,和适体序列(例如MS2 RNA基序或PP7 RNA基序),所述适体序列能够与衔接子蛋白(例如MS2外壳蛋白或PP7外壳蛋白)结合,和(c)与衔接子蛋白融合或连接的腺苷脱氨酶,其中所述适体和所述衔接子蛋白的结合将腺苷脱氨酶募集到在指导序列与靶序列之间形成的DNA-RNA或RNA-RNA双链体上,以在A-C错配的A处进行靶向脱氨。在一些实施方案中,衔接子蛋白和/或腺苷脱氨酶在N末端或C末端或两者上被NLS标记。C2c1蛋白也可被NLS标记。
使用不同的适体和相应的衔接子蛋白还允许实现正交基因编辑。在腺苷脱氨酶与胞苷脱氨酶组合用于正交基因编辑/脱氨基的一个实例中,用不同的RNA环修饰靶向不同基因座的sgRNA,以分别募集MS2-腺苷脱氨酶和PP7-胞苷脱氨酶(或PP7-腺苷脱氨酶和MS2-胞苷脱氨酶),分别导致目标靶基因座处的A或C的正交脱氨基。PP7是噬菌体假单胞菌的RNA结合外壳蛋白。像MS2一样,它结合特定的RNA序列和二级结构。PP7 RNA识别基序不同于MS2。因此,PP7和MS2可多重作用以同时在不同的基因组基因座介导不同的作用。例如,可用MS2环修饰靶向基因座A的sgRNA,募集MS2-腺苷脱氨酶,而可用PP7环修饰另一种靶向基因座B的sgRNA,募集PP7-胞苷脱氨酶。因此,在同一细胞中,实现了正交的基因座特异性的修饰。可扩展该原理以并入其他正交RNA结合蛋白。
在至少第三种设计中,C2c1-ADAR CRISPR系统包含(a)插入到C2c1蛋白的内部环或非结构化区域中的腺苷脱氨酶,其中C2c1蛋白是无催化活性的或切口酶,和(b)包含指导序列的指导分子,所述指导序列被设计为在指导序列与靶序列之间形成的DNA-RNA或RNA-RNA双链体中引入A-C错配。
可借助于晶体结构来鉴定适合插入腺苷脱氨酶的C2c1蛋白分裂位点。例如,关于AacC2c1突变体,例如序列比对的相应位置应该是显而易见的。对于其他C2c1蛋白,如果直系同源物与预期的C2c1蛋白之间存在相对较高程度的同源性,则可使用直系同源物的晶体结构。
分裂位置可位于区域或环内。优选地,在氨基酸序列的中断不会导致结构特征(例如α-螺旋或β-折叠)的部分或完全破坏的地方出现分裂位置。非结构化区域(由于这些区域的结构化不足以在晶体中“冻结”而未出现在晶体结构中的区域)通常是优选的选择。在本发明的实践中设想在C2c1表面上暴露的所有非结构化区域中的分裂。非结构化区域或外部环内的位置可能不必完全是上面提供的数字,但上文给出的任一侧可能会改变例如1、2、3、4、5、6、7、8、9或甚至10个氨基酸,取决于环的大小,只要分裂位置仍落在外部环的非结构化区域内即可。
本文所述的C2c1-ADAR系统可用于靶向DNA序列内的特定腺嘌呤以进行脱氨基。例如,指导分子可与C2c1蛋白形成复合物并引导复合物结合目标靶基因座处的靶序列。因为指导序列被设计为具有非配对C,所以在指导序列与靶序列之间形成的异源双链体包含A-C错配,它引导腺苷脱氨酶与非配对C相对的A接触并脱氨基,从而将其转化为肌苷(I)。由于肌苷(I)碱基与C配对并在细胞过程中像G一样起作用,因此本文所述的A的靶向脱氨可用于校正不希望的G-A和C-T突变,以及获得所需的A-G和T-C突变。
碱基切除修复抑制剂
在一些实施方案中,AD官能化的CRISPR系统还包含碱基切除修复(BER)抑制剂。不希望受到任何特定理论的束缚,对I:T配对的存在的细胞DNA修复反应可能导致细胞中核碱基编辑效率的降低。烷基腺嘌呤DNA糖基化酶(也称为DNA-3-甲基腺嘌呤糖基化酶、3-烷基腺嘌呤DNA糖基化酶或N-甲基嘌呤DNA糖基化酶)催化从细胞DNA中去除次黄嘌呤,这可能起始碱基切除修复,其中将I:T对回复变异为A:T对作为结果。
在一些实施方案中,BER抑制剂是烷基腺嘌呤DNA糖基化酶的抑制剂。在一些实施方案中,BER抑制剂是人类烷基腺嘌呤DNA糖基化酶的抑制剂。在一些实施方案中,BER抑制剂是多肽抑制剂。在一些实施方案中,BER抑制剂是结合次黄嘌呤的蛋白质。在一些实施方案中,BER抑制剂是结合DNA中的次黄嘌呤的蛋白质。在一些实施方案中,BER抑制剂是无催化活性的烷基腺嘌呤DNA糖基化酶蛋白或其结合结构域。在一些实施方案中,BER抑制剂是不从DNA上切除次黄嘌呤的无催化活性的烷基腺嘌呤DNA糖基化酶蛋白或其结合结构域。能够抑制(例如,空间阻断)烷基腺嘌呤DNA糖基化酶碱基切除修复酶的其他蛋白质在本公开的范围内。另外,任何阻断或抑制碱基切除修复的蛋白质也在本公开的范围内。
不希望受任何特定理论的束缚,碱基切除修复可被结合编辑链,阻断编辑碱基,抑制烷基腺嘌呤DNA糖基化酶,抑制碱基切除修复,保护编辑碱基和/或促进非编辑链固定的分子抑制。据认为,本文所述的BER抑制剂的使用可增加能够催化A至I改变的腺苷脱氨酶的编辑效率。
因此,在上文讨论的AD官能化的CRISPR系统的第一种设计中,可将CRISPR-Cas蛋白或腺苷脱氨酶与BER抑制剂(例如,烷基腺嘌呤DNA糖基化酶的抑制剂)融合或连接。在一些实施方案中,BER抑制剂可包含在以下结构之一中(nC2c1=C2c1切口酶;dC2c1=死C2c1):
[AD]-[任选的接头]-[nC2c1/dC2c1]-[任选的接头]-[BER抑制剂];
[AD]-[任选的接头]-[BER抑制剂]-[任选的接头]-[nC2c1/dC2c1];
[BER抑制剂]-[任选的接头]-[AD]-[任选的接头]-[nC2c1/dC2c1];
[BER抑制剂]-[任选的接头]-[nC2c1/dC2c1]-[任选的接头]-[AD];
[nC2c1/dC2c1]-[任选的接头]-[AD]-[任选的接头]-[BER抑制剂];
[nC2c1/dC2c1]-[任选的接头]-[BER抑制剂]-[任选的接头]-[AD]。
类似地,在上文讨论的AD官能化的CRISPR系统的第二种设计中,可将CRISPR-Cas蛋白、腺苷脱氨酶或衔接子蛋白与BER抑制剂(例如,烷基腺嘌呤DNA糖基化酶的抑制剂)融合或连接。在一些实施方案中,BER抑制剂可包含在以下结构之一中(nC2c1=C2c1切口酶;dC2c1=死C2c1):
[nC2c1/dC2c1]-[任选的接头]-[BER抑制剂];
[BER抑制剂]-[任选的接头]-[nC2c1/dC2c1];
[AD]-[任选的接头]-[衔接子]-[任选的接头]-[BER抑制剂];
[AD]-[任选的接头]-[BER抑制剂]-[任选的接头]-[衔接子];
[BER抑制剂]-[任选的接头]-[AD]-[任选的接头]-[衔接子];
[BER抑制剂]-[任选的接头]-[衔接子]-[任选的接头]-[AD];
[衔接子]-[任选的接头]-[AD]-[任选的接头]-[BER抑制剂];
[衔接子]-[任选的接头]-[BER抑制剂]-[任选的接头]-[AD]。
在上面讨论的AD官能化的CRISPR系统的第三种设计中,可将BER抑制剂插入CRISPR-Cas蛋白的内部环或非结构化区域中。
胞苷脱氨酶
在一些实施方案中,脱氨酶是胞苷脱氨酶。如本文所用,术语“胞苷脱氨酶”或“胞苷脱氨酶蛋白”是指蛋白质、多肽或者蛋白质或多肽的一个或多个功能结构域,其能够催化将胞嘧啶(或分子的胞嘧啶部分)转化为尿嘧啶(或分子的尿嘧啶部分)的水解脱氨基反应,如下所示。在一些实施方案中,含胞嘧啶的分子是胞苷(C),并且含尿嘧啶的分子是尿苷(U)。所述含胞嘧啶的分子可以是脱氧核糖核酸(DNA)或核糖核酸(RNA)。
根据本公开,可与本公开结合使用的胞苷脱氨酶包括但不限于被称为载脂蛋白BmRNA编辑复合物(APOBEC)家族脱氨酶的酶家族的成员,激活诱导的脱氨酶(AID),或胞苷脱氨酶1(CDA1)。在特定的实施方案中,APOBEC1脱氨酶、APOBEC2脱氨酶、APOBEC3A脱氨酶、APOBEC3B脱氨酶、APOBEC3C脱氨酶和APOBEC3D脱氨酶、APOBEC3E脱氨酶、APOBEC3F脱氨酶、APOBEC3G脱氨酶、APOBEC3H脱氨酶或APOBEC4脱氨酶中的脱氨酶。
在本发明的方法和系统中,胞苷脱氨酶能够靶向DNA单链中的胞嘧啶。在某些示例实施方案中,胞苷脱氨酶可在存在于结合组分外部的单链上进行编辑,例如结合Cas13。在其他示例实施方案中,胞苷脱氨酶可在局部化泡,例如由靶标编辑位点处但指导序列错配形成的局部化泡处编辑。在某些示例实施方案中,胞苷脱氨酶可包含有助于聚焦活性的突变,例如Kim等人,Nature Biotechnology(2017)35(4):371-377(doi:10.1038/nbt.3803中所述的那些。
在一些实施方案中,胞苷脱氨酶源自一种或多种后生动物物种,包括但不限于哺乳动物、鸟类、青蛙、鱿鱼、鱼、蝇和蠕虫。在一些实施方案中,胞苷脱氨酶是人类、灵长类、牛、狗、大鼠或小鼠胞苷脱氨酶。
在一些实施方案中,胞苷脱氨酶是人类APOBEC,包括hAPOBEC1或hAPOBEC3。在一些实施方案中,胞苷脱氨酶是人类AID。
在一些实施方案中,胞苷脱氨酶蛋白识别RNA双链体的单链泡中的一个或多个靶胞嘧啶残基并将其转化为尿嘧啶残基。在一些实施方案中,胞苷脱氨酶蛋白识别RNA双链体的单链泡上的结合窗口。在一些实施方案中,结合窗口包含至少一个靶胞嘧啶残基。在一些实施方案中,结合窗口在约3bp至约100bp的范围内。在一些实施方案中,结合窗口在约5bp至约50bp的范围内。在一些实施方案中,结合窗口在约10bp至约30bp的范围内。在一些实施方案中,结合窗口为约1bp、2bp、3bp、5bp、7bp、10bp、15bp、20bp、25bp、30bp、40bp、45bp、50bp、55bp、60bp、65bp、70bp、75bp、80bp、85bp、90bp、95bp或100bp。
在一些实施方案中,胞苷脱氨酶蛋白包含一个或多个脱氨酶结构域。不希望受理论的束缚,预期脱氨酶结构域用于识别RNA双链体的单链泡中所含的一个或多个靶胞嘧啶(C)残基并将其转化为尿嘧啶(U)残基。在一些实施方案中,脱氨酶结构域包含活性中心。在一些实施方案中,活性中心包含锌离子。在一些实施方案中,在活性中心内或附近的氨基酸残基与靶胞嘧啶残基的5'的一个或多个核苷酸相互作用。在一些实施方案中,在活性中心内或附近的氨基酸残基与靶胞嘧啶残基的3'的一个或多个核苷酸相互作用。
在一些实施方案中,胞苷脱氨酶包含人类APOBEC1全蛋白(hAPOBEC1)或其脱氨酶结构域(hAPOBEC1-D)或其C末端截短形式(hAPOBEC-T)。在一些实施方案中,胞苷脱氨酶是与hAPOBEC1、hAPOBEC-D或hAPOBEC-T同源的APOBEC家族成员。在一些实施方案中,胞苷脱氨酶包含人类AID1全蛋白(hAID)或其脱氨酶结构域(hAID-D)或其C末端截短形式(hAID-T)。在一些实施方案中,胞苷脱氨酶是与hAID、hAID-D或hAID-T同源的AID家族成员。在一些实施方案中,hAID-T是C末端截短约20个氨基酸的hAID。
在一些实施方案中,胞苷脱氨酶包含胞嘧啶脱氨酶的野生型氨基酸序列。在一些实施方案中,胞苷脱氨酶在胞嘧啶脱氨酶序列中包含一个或多个突变,使得胞嘧啶脱氨酶的编辑效率和/或底物编辑偏好根据特定需要而改变。
APOBEC1和APOBEC3蛋白的某些突变已描述于Kim等人,Nature Biotechnology(2017)35(4):371-377(doi:10.1038/nbt.3803);和Harris等人,Mol.Cell(2002)10:1247-1253中,所述文献各自通过引用整体并入本文。
在一些实施方案中,胞苷脱氨酶是在与大鼠APOBEC1中的W90、R118、H121、H122、R126或R132相对应的氨基酸位置处包含一个或多个突变的APOBEC1脱氨酶,或在与人类APOBEC3G中的W285、R313、D316、D317X、R320或R326相对应的氨基酸位置处包含一个或多个突变的APOBEC3G脱氨酶。
在一些实施方案中,胞苷脱氨酶包含在大鼠APOBEC1氨基酸序列的色氨酸90或同源APOBEC蛋白中的相应位置(例如APOBEC3G的色氨酸285)处的突变。在一些实施方案中,位置90处的色氨酸残基被酪氨酸或苯丙氨酸残基代替(W90Y或W90F)。
在一些实施方案中,胞苷脱氨酶包含大鼠APOBEC1氨基酸序列的精氨酸118或同源APOBEC蛋白中的相应位置处的突变。在一些实施方案中,位置118处的精氨酸残基被丙氨酸残基代替(R118A)。
在一些实施方案中,胞苷脱氨酶包含大鼠APOBEC1氨基酸序列的组氨酸121或同源APOBEC蛋白中的相应位置处的突变。在一些实施方案中,位置121处的组氨酸残基被精氨酸残基(H121R)代替。
在一些实施方案中,胞苷脱氨酶包含大鼠APOBEC1氨基酸序列的组氨酸122或同源APOBEC蛋白中的相应位置处的突变。在一些实施方案中,位置122处的组氨酸残基被精氨酸残基代替(H122R)。
在一些实施方案中,胞苷脱氨酶包含大鼠APOBEC1氨基酸序列的精氨酸126或同源APOBEC蛋白中的相应位置(例如APOBEC3G的精氨酸320)处的突变。在一些实施方案中,位置126处的精氨酸残基被丙氨酸残基代替(R126A)或被谷氨酸代替(R126E)。
在一些实施方案中,胞苷脱氨酶包含APOBEC1氨基酸序列的精氨酸132或同源APOBEC蛋白中的相应位置处的突变。在一些实施方案中,位置132处的精氨酸残基被谷氨酸残基代替(R132E)。
在一些实施方案中,为了缩小编辑窗口的宽度,胞苷脱氨酶可包含基于大鼠APOBEC1的氨基酸序列位置的一个或多个突变:W90Y、W90F、R126E和R132E,以及与上述相对应的同源APOBEC蛋白中的突变。
在一些实施方案中,为了降低编辑效率,胞苷脱氨酶可包含基于大鼠APOBEC1的氨基酸序列位置的一个或多个突变:W90A、R118A、R132E,以及与上述相对应的同源APOBEC蛋白中的突变。在特定的实施方案中,可能感兴趣的是使用效率降低的胞苷脱氨酶来降低脱靶效应。
在一些实施方案中,胞苷脱氨酶是野生型大鼠APOBEC1(rAPOBEC1),或其催化结构域。在一些实施方案中,胞苷脱氨酶在rAPOBEC1序列中包含一个或多个突变,使得rAPOBEC1的编辑效率和/或底物编辑偏好根据具体需要而改变。
rAPOBEC1:MSSETGPVAVDPTLRRRIEPHEFEVFFDPRELRKETCLLYEINWGGRHSIWRHTSQNTNKHVEVNFIEKFTTERYFCPNTRCSITWFLSWSPCGECSRAITEFLSRYPHVTLFIYIARLYHHADPRNRQGLRDLISSGVTIQIMTEQESGYCWRNFVNYSPSNEAHWPRYPHLWVRLYVLELYCIILGLPPCLNILRRKQPQLTFFTIALQSCHYQRLPPHILWATGLK(SEQ ID NO:433)
在一些实施方案中,胞苷脱氨酶是野生型人类APOBEC1(hAPOBEC1)或其催化结构域。在一些实施方案中,胞苷脱氨酶在hAPOBEC1序列中包含一个或多个突变,使得hAPOBEC1的编辑效率和/或底物编辑偏好根据具体需要而改变。
APOBEC1:MTSEKGPSTGDPTLRRRIEPWEFDVFYDPRELRKEACLLYEIKWGMSRKIWRSSGKNTTNHVEVNFIKKFTSERDFHPSMSCSITWFLSWSPCWECSQAIREFLSRHPGVTLVIYVARLFWHMDQQNRQGLRDLVNSGVTIQIMRASEYYHCWRNFVNYPPGDEAHWPQYPPLWMMLYALELHCIILSLPPCLKISRRWQNHLTFFRLHLQNCHYQTIPPHILLATGLIHPSVAWR(SEQ ID NO:434)
在一些实施方案中,胞苷脱氨酶是野生型人类APOBEC3G(hAPOBEC3G)或其催化结构域。在一些实施方案中,胞苷脱氨酶在hAPOBEC3G序列中包含一个或多个突变,使得hAPOBEC3G的编辑效率和/或底物编辑偏好根据具体需要而改变。
hAPOBEC3G:MELKYHPEMRFFHWFSKWRKLHRDQEYEVTWYISWSPCTKCTRDMATFLAEDPKVTLTIFVARLYYFWDPDYQEALRSLCQKRDGPRATMKIMNYDEFQHCWSKFVYSQRELFEPWNNLPKYYILLHIMLGEILRHSMDPPTFTFNFNNEPWVRGRHETYLCYEVERMHNDTWVLLNQRRGFLCNQAPHKHGFLEGRHAELCFLDVIPFWKLDLDQDYRVTCFTSWSPCFSCAQEMAKFISKNKHVSLCIFTARIYDDQGRCQEGLRTLAEAGAKISIMTYSEFKHCWDTFVDHQGCPFQPWDGLDEHSQDLSGRLRAILQNQEN(SEQ ID NO:435)
在一些实施方案中,胞苷脱氨酶为野生型海七鳃鳗(Petromyzon marinus)CDA1(pmCDA1)或其催化结构域。在一些实施方案中,胞苷脱氨酶在pmCDA1序列中包含一个或多个突变,使得pmCDA1的编辑效率和/或底物编辑偏好根据具体需要而改变。
PmCDA1:MTDAEYVRIHEKLDIYTFKKQFFNNKKSVSHRCYVLFELKRRGERRACFWGYAVNKPQSGTERGIHAEIFSIRKVEEYLRDNPGQFTINWYSSWSPCADCAEKILEWYNQELRGNGHTLKIWACKLYYEKNARNQIGLWNLRDNGVGLNVMVSEHYQCCRKIFIQSSHNQLNENRWLEKTLKRAEKRRSELSIMIQVKILHTTKSPAV(SEQID NO:436)
在一些实施方案中,胞苷脱氨酶是野生型人类AID(hAID)或其催化结构域。在一些实施方案中,胞苷脱氨酶在pmCDA1序列中包含一个或多个突变,使得pmCDA1的编辑效率和/或底物编辑偏好根据具体需要而改变。
hAID:MDSLLMNRRKFLYQFKNVRWAKGRRETYLCYVVKRRDSATSFSLDFGYLRNKNGCHVELLFLRYISDWDLDPGRCYRVTWFTSWSPCYDCARHVADFLRGNPYLSLRIFTARLYFCEDRKAEPEGLRRLHRAGVQIAIMTFKDYFYCWNTFVENHERTFKAWEGLHENSVRLSRQLRRILLPLYEVDDLRDAFRTLGLLD(SEQ ID NO:437)
在一些实施方案中,胞苷脱氨酶是hAID(hAID-DC)的截短形式或其催化结构域。在一些实施方案中,胞苷脱氨酶在hAID-DC序列中包含一个或多个突变,使得hAID-DC的编辑效率和/或底物编辑偏好根据具体需要而改变。
hAID-DC:MDSLLMNRRKFLYQFKNVRWAKGRRETYLCYVVKRRDSATSFSLDFGYLRNKNGCHVELLFLRYISDWDLDPGRCYRVTWFTSWSPCYDCARHVADFLRGNPNLSLRIFTARLYFCEDRKAEPEGLRRLHRAGVQIAIMTFKDYFYCWNTFVENHERTFKAWEGLHENSVRLSRQLRRILL(SEQ ID NO:438)
胞苷脱氨酶的其他实施方案公开于名称为“Nucleobase Editor and Uses”的WOWO2017/070632中,所述文件通过引用整体并入本文。
在一些实施方案中,胞苷脱氨酶具有有效的脱氨基窗口,该窗口包围了易于脱氨基编辑的核苷酸。因此,在一些实施方案中,“编辑窗口宽度”是指在给定靶位点处胞苷脱氨酶的编辑效率超过该靶位点的一半最大值的核苷酸位置的数目。在一些实施方案中,胞苷脱氨酶的编辑窗口宽度在约1至约6个核苷酸的范围内。在一些实施方案中,胞苷脱氨酶的编辑窗口宽度是1、2、3、4、5或6个核苷酸。
不希望受理论的束缚,预期在一些实施方案中,接头序列的长度影响编辑窗口宽度。在一些实施方案中,随着接头长度的延伸(例如,约3至约21个氨基酸),编辑窗口宽度增加(例如,约3至约6个核苷酸)。在一个非限制性实例中,16个残基的接头提供了约5个核苷酸的有效脱氨基窗口。在一些实施方案中,指导RNA的长度影响编辑窗口宽度。在一些实施方案中,缩短指导RNA导致胞苷脱氨酶的有效脱氨基窗口变窄。
在一些实施方案中,胞苷脱氨酶的突变影响编辑窗口宽度。在一些实施方案中,CD官能化的CRISPR系统的胞苷脱氨酶组分包含一个或多个降低胞苷脱氨酶的催化效率的突变,以便防止脱氨酶在每个DNA结合事件中将多个胞苷脱氨基。在一些实施方案中,使APOBEC1的残基90(W90)处的色氨酸或同源序列中的相应色氨酸残基发生突变。在一些实施方案中,无催化活性的Cas13与包含W90Y或W90F突变的APOBEC1突变体融合或连接。在一些实施方案中,使APOBEC3G的残基285(W285)处的色氨酸或同源序列中的相应色氨酸残基发生突变。在一些实施方案中,无催化活性的Cas13与包含W285Y或W285F突变的APOBEC3G突变体融合或连接。
在一些实施方案中,CD官能化的CRISPR系统的胞苷脱氨酶组分包含一个或多个降低对胞苷向脱氨酶活性位点的非最佳呈递的耐受性的突变。在一些实施方案中,胞苷脱氨酶包含一个或多个改变脱氨酶活性位点的底物结合活性的突变。在一些实施方案中,胞苷脱氨酶包含一个或多个改变脱氨酶活性位点识别和结合的DNA的构象的突变。在一些实施方案中,胞苷脱氨酶包含一个或多个改变底物对脱氨酶活性位点的可及性的突变。在一些实施方案中,使APOBEC1的残基126(R126)上的精氨酸或同源序列中的相应精氨酸残基发生突变。在一些实施方案中,无催化活性的Cas13与包含R126A或R126E突变的APOBEC1融合或连接。在一些实施方案中,将APOBEC3G的残基320(R320)处的色氨酸或同源序列中的相应精氨酸残基发生突变。在一些实施方案中,无催化活性的Cas13与包含R320A或R320E突变的APOBEC3G突变体融合或连接。在一些实施方案中,使APOBEC1的残基132(R132)处的精氨酸或同源序列中的相应精氨酸残基发生突变。在一些实施方案中,无催化活性的Cas13与包含R132E突变的APOBEC1突变体融合或连接。
在一些实施方案中,CD官能化的CRISPR系统的APOBEC1结构域包含选自W90Y、W90F、R126A、R126E和R132E的一个、两个或三个突变。在一些实施方案中,APOBEC1结构域包含W90Y和R126E的双突变。在一些实施方案中,APOBEC1结构域包含W90Y和R132E的双突变。在一些实施方案中,APOBEC1结构域包含R126E和R132E的双突变。在一些实施方案中,APOBEC1结构域包含W90Y、R126E和R132E的三个突变。
在一些实施方案中,如本文所公开的胞苷脱氨酶中的一个或多个突变将编辑窗口宽度减少至约2个核苷酸。在一些实施方案中,如本文所公开的胞苷脱氨酶中的一个或多个突变将编辑窗口宽度减少至约1个核苷酸。在一些实施方案中,如本文所公开的胞苷脱氨酶中的一个或多个突变降低了编辑窗口宽度,而仅最小地或适度地影响了酶的编辑效率。在一些实施方案中,如本文所公开的胞苷脱氨酶中的一个或多个突变降低了编辑窗口宽度,而没有降低酶的编辑效率。在一些实施方案中,如本文所公开的胞苷脱氨酶中的一个或多个突变使得能够区分相邻的胞苷核苷酸,否则胞苷脱氨酶将在相似的效率下对其进行编辑。
在一些实施方案中,胞苷脱氨酶蛋白还包含或连接至一个或多个双链RNA(dsRNA)结合基序(dsRBM)或结构域(dsRBD),以识别并结合至双链核酸底物。在一些实施方案中,胞苷脱氨酶与底物之间的相互作用由一种或多种另外的蛋白质因子(包括CRISPR/CAS蛋白质因子)介导。在一些实施方案中,胞苷脱氨酶与底物之间的相互作用进一步由一个或多个核酸组分(包括指导RNA)介导。
根据本发明,胞苷脱氨酶的底物是包含目标胞嘧啶的RNA双链体的DNA单链泡,当指导分子与其DNA靶标结合后,可接近胞苷脱氨酶,然后与CRISPR-Cas酶形成CRISPR-Cas复合物,由此胞嘧啶脱氨酶与CRISPR-Cas复合物的一种或多种组分(即CRISPR-Cas酶和/或指导分子)融合或能够结合。指导分子和CRISPR-Cas酶的特定特征在下文详述。
碱基编辑指导分子设计的考虑因素
在一些实施方案中,指导序列是长度为10至50nt之间的RNA序列,但更特别地为约20-30nt,有利地为约20nt、23-25nt或24nt。在碱基编辑实施方案中,选择指导序列以确保其与包含要脱氨基的腺苷的靶序列杂交。这将在下面更详细地描述。选择可包括进一步的步骤,这些步骤可提高脱氨基的功效和特异性。
在一些实施方案中,指导序列为约20nt至约30nt长,并且与靶DNA链杂交以形成几乎完美匹配的双链体,除了在靶腺苷位点处具有dA-C错配。特别地,在一些实施方案中,dA-C错配位于靠近靶序列的中心(并且因此在指导序列与靶序列杂交后的双链体的中心),从而将腺苷脱氨酶限制为狭窄的编辑窗口(例如约4bp宽)。在一些实施方案中,靶序列可包含一个以上的要脱氨基的靶腺苷。在其他实施方案中,靶序列还可包含与靶腺苷位点的一个或多个dA-C错配3'。在一些实施方案中,为了避免在靶序列中非预期的腺嘌呤位点进行脱靶编辑,可将指导序列设计为在对应于所述非预期的腺嘌呤的位置上包含非配对鸟嘌呤以引入dA-G错配,对于某些腺苷脱氨酶(例如ADAR1和ADAR2),其在催化上不利。参见Wong等人,RNA 7:846-858(2001),其通过引用整体并入本文。
在一些实施方案中,具有典型长度(例如,对于AacC2c1为约20nt)的Cas12b指导序列用于与靶DNA形成异源双链体。在一些实施方案中,长于典型长度(例如,对于AacC2c1为>20nt)的Cas12b指导分子用于与靶DNA形成异源双链体,包括Cas12b-指导RNA-靶DNA复合物的外部。当在给定的一段核苷酸内将一个以上的腺嘌呤脱氨基时,这可能是令人感兴趣的。在替代实施方案中,保持典型指导序列长度的限制是令人感兴趣的。在一些实施方案中,指导序列被设计为在Cas12b指导物的典型长度外部引入dA-C错配,其可减少Cas12b的空间位阻并增加腺苷脱氨酶与dA-C错配之间的接触频率。
在一些碱基编辑实施方案中,错配的核碱基(例如胞苷)的位置是根据PAM在DNA靶标上的位置计算的。在一些实施方案中,错配的核碱基位于从PAM起的12-21nt,或从PAM起的13-21nt,或从PAM起的14-21nt,或从PAM起的14-20nt,或从PAM起的15-20nt,或从PAM起的16-20nt,或从PAM起的14-19nt,或从PAM起的15-19nt,或从PAM起的16-19nt,或从PAM起的17-19nt,或从PAM起的约20nt,或从PAM起的约19nt,或从PAM起的约18nt,或从PAM起的约17nt,或从PAM起的约16nt,或从PAM起的约15nt,或从PAM起的约14nt。在一个优选的实施方案中,错配的核碱基位于从PAM起的17-19nt或18nt。
错配距离是Cas12b间隔子的3'端与错配核碱基(例如胞苷)之间的碱基数,其中错配碱基作为错配距离计算的一部分被包括在内。在一些实施方案中,错配距离是1-10nt,或1-9nt,或1-8nt,或2-8nt,或2-7nt,或2-6nt,或3-8nt,或3-7nt,或3-6nt,或3-5nt,或约2nt,或约3nt,或约4nt,或约5nt,或约6nt,或约7nt,或约8nt。在一个优选的实施方案中,错配距离是3-5nt或4nt。
在一些实施方案中,本文描述的Cas12b-ADAR系统的编辑窗口是从PAM起的12-21nt,或从PAM起的13-21nt,或从PAM起的14-21nt,或从PAM起的14-20nt,或从PAM起的15-20nt,或从PAM起的16-20nt,或从PAM起的14-19nt,或从PAM起的15-19nt,或从PAM起的16-19nt,或从PAM起的17-19nt,或从PAM起的约20nt,或从PAM起的约19nt,或从PAM起的约18nt,或从PAM起的约17nt,或从PAM起的约16nt,或从PAM起的约15nt PAM,或从PAM起的约14nt。在一些实施方案中,本文所述的Cas12b-ADAR系统的编辑窗口是从Cas12b间隔子的3'端起的1-10nt,或从Cas12b间隔子的3'端起的1-9nt,或从Cas12b间隔子的3'端起的1-8nt,或从Cas12b间隔子的3'端起的2-8nt,或从Cas12b间隔子的3'端起的2-7nt,或从Cas12b间隔子的3'端起的2-6nt,或从Cas12b间隔子的3'端起的3-8nt,或从Cas12b间隔子的3'端起的3-7nt,或从Cas12b间隔子的3'端起的3-6nt,或从Cas12b间隔子的3'端起的3-5nt,或从Cas12b间隔子的3'端起的约2nt,或从Cas12b间隔子的3'端起的约3nt,或从Cas12b间隔子的3'端起的约4nt,或从Cas12b间隔子的3'端起的约5nt,或从Cas12b间隔子的3'端起的约6nt,或从Cas12b间隔子的3'端起的约7nt,或从Cas12b间隔子的3'端起的约8nt。
载体
一般来说,并且在整个本说明书中,术语“载体”是指能够转运与其连接的另一核酸的核酸分子。它是复制子,例如质粒、噬菌体或粘粒,可在其中插入另一个DNA区段以实现所插入区段的复制。通常,当与适当的控制元件结合时,载体能够复制。
在一些实施方案中,本公开提供了包含编码CRISPR-Cas系统的一种或多种组分的一种或多种多核苷酸的载体系统。在一些实施方案中,载体系统是Cas12b载体系统,其包含一个或多个载体,所述载体包含:第一调控元件,其可操作地连接至编码来自表1或表2的Cas12b效应蛋白的核苷酸序列,和i)a)第二调控元件,其可操作地连接至编码crRNA的核苷酸序列,和b)第三调控元件,其可操作地连接至编码tracr RNA的核苷酸序列,或ii)第二调控元件,其可操作地连接至编码crRNA和tracr RNA的核苷酸序列。在某些情况下,载体系统包含单个载体。或者,载体系统包含多个载体。载体可以是病毒载体。
载体包括但不限于单链、双链或部分双链的核酸分子;包含一个或多个自由端、无自由端(例如环状)的核酸分子;包含DNA、RNA或两者的核酸分子;和本领域已知的其他多核苷酸变体。载体的一种类型是“质粒”,其是指环状双链DNA环,例如通过标准分子克隆技术,可以在其中插入其他DNA区段。另一种类型的载体是病毒载体,其中载体中存在病毒来源的DNA或RNA序列,用于包装成病毒(例如逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒和腺相关病毒)。病毒载体还包括病毒携带的用于转染到宿主细胞中的多核苷酸。某些载体能够在引入它们的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和游离型哺乳动物载体)。在引入宿主细胞中后,将其他载体(例如,非游离型哺乳动物载体)整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够引导与其可操作连接的基因的表达。此类载体在本文中称为“表达载体”。在真核细胞中表达的载体和导致在真核细胞中表达的载体在本文中可称为“真核表达载体”。在重组DNA技术中有用的常见表达载体通常是质粒的形式。
重组表达载体可以适合在宿主细胞中表达核酸的形式包含本发明的核酸,这意味着重组表达载体包含一个或多个调控元件,所述调控元件可根据待用于表达的宿主细胞进行选择,所述核酸可操作地连接至待表达的核酸序列。在重组表达载体内,“可操作地连接”旨在是指目标核苷酸序列以允许核苷酸序列表达的方式(例如,在体外转录/翻译系统中或者当载体被引入宿主细胞中时在宿主细胞中)连接至调控元件。有利的载体包括慢病毒和腺相关病毒,并且也可选择这些载体的类型以靶向特定类型的细胞。
关于重组和克隆方法,提及美国专利申请10/815,730,2004年9月2日公开为US2004-0171156 A1,其内容通过引用整体并入本文。
术语“调控元件”旨在包括启动子、增强子、内部核糖体进入位点(IRES)和其他表达控制元件(例如,转录终止信号,例如聚腺苷酸化信号和poly-U序列)。此类调控元件描述于例如Goeddel,GENE EXPRESSION TECHNOLOGY:METHODS IN ENZYMOLOGY 185,AcademicPress,San Diego,Calif.(1990)中。调控元件包括在许多类型的宿主细胞中引导核苷酸序列组成性表达的那些和仅在某些宿主细胞中引导核苷酸序列表达的那些(例如组织特异性调控序列)。组织特异性启动子可引导主要在目标所需组织例如肌肉、神经元、骨骼、皮肤、血液、特定器官(例如肝、胰腺)或特定细胞类型(例如淋巴细胞)中表达。调控元件也可以时间依赖性的方式引导表达,例如以细胞周期依赖性或发育阶段依赖性的方式引导表达,其也可以是或可以不是组织或细胞类型特异性的。在一些实施方案中,载体包含一个或多个pol III启动子(例如1、2、3、4、5个或更多个pol III启动子),一个或多个pol II启动子(例如1、2、3、4、5个或更多个pol II启动子),一个或多个pol I启动子(例如1、2、3、4、5个或更多个pol I启动子)或其组合。pol III启动子的实例包括但不限于U6和H1启动子。pol II启动子的实例包括但不限于逆转录病毒劳斯肉瘤病毒(RSV)LTR启动子(任选地带有RSV增强子),巨细胞病毒(CMV)启动子(任选地带有CMV增强子)[参见例如Boshart等,Cell,41:521-530(1985)],SV40启动子,二氢叶酸还原酶启动子,β-肌动蛋白启动子,磷酸甘油激酶(PGK)启动子和EF1α启动子。术语“调控元件”还涵盖增强子元件,例如WPRE;CMV增强子;HTLV-1的LTR中的R-U5'区段(Mol.Cell.Biol.,第8(1)卷,第466-472期,1988);SV40增强子;以及兔β-珠蛋白的外显子2和3之间的内含子序列(Proc.Natl.Acad.Sci.USA.,第78(3)卷,第1527-31页,1981)。本领域技术人员将理解,表达载体的设计可取决于例如要转化的宿主细胞的选择、所需表达水平等因素。可将载体引入宿主细胞以从而产生由本文所述的核酸编码的转录物、蛋白质或肽,包括融合蛋白或肽(例如,成簇的规律间隔的短回文重复序列(CRISPR)转录物、蛋白质、酶、其突变体形式、其融合蛋白等)。关于调控序列,提及了美国专利申请10/491,026,其内容通过引用整体并入本文。关于启动子,提及了PCT公开WO 2011/028929和美国申请12/511,940,其内容通过引用整体并入本文。
有利的载体包括慢病毒和腺相关病毒,并且也可选择这类载体的类型以靶向特定类型的细胞。
在特定的实施方案中,使用双顺反子载体用于指导RNA和(任选地修饰或突变的)CRISPR酶(例如C2c1)。优选用于指导RNA和(任选地修饰或突变的)CRISPR酶的双顺反子表达载体。通常并且特别是在该实施方案中,(任选地修饰或突变的)CRISPR酶优选由CBh启动子驱动。RNA可优选地由Pol III启动子,例如U6启动子驱动。理想地,将两者结合。
可设计载体以在原核或真核细胞中表达CRISPR转录物(例如核酸转录物、蛋白质或酶)。例如,CRISPR转录物可在细菌细胞如大肠杆菌、昆虫细胞(使用杆状病毒表达载体)、酵母细胞或哺乳动物细胞中表达。合适的宿主细胞在Goeddel,GENE EXPRESSIONTECHNOLOGY:METHODS IN ENZYMOLOGY 185,Academic Press,San Diego,Calif.(1990)中进一步讨论。或者,重组表达载体可在体外转录和翻译,例如使用T7启动子调控序列和T7聚合酶。
载体可在原核生物或原核细胞中引入并增殖。在一些实施方案中,原核生物用于扩增将要引入真核细胞的载体的拷贝,或在要引入真核细胞中的载体的生产中作为中间载体(例如,扩增质粒作为病毒载体包装系统的一部分)。在一些实施方案中,原核生物用于扩增载体的拷贝并表达一种或多种核酸,例如提供一种或多种蛋白质的来源以递送至宿主细胞或宿主生物体。蛋白质在原核生物中的表达最通常在大肠杆菌中与含有引导融合蛋白或非融合蛋白表达的组成型或诱导型启动子的载体一起进行。融合载体将许多氨基酸添加到其中编码的蛋白质上,例如添加到重组蛋白的氨基末端上。此类融合载体可提供一个或多个目的,例如:(i)增加重组蛋白的表达;(ii)增加重组蛋白的溶解度;以及(iii)通过在亲和纯化中充当配体来帮助重组蛋白的纯化。通常,在融合表达载体中,在融合部分和重组蛋白的连接处引入蛋白水解切割位点,以使得在纯化融合蛋白之后能够从融合部分分离重组蛋白。这些酶及其同源识别序列包括因子Xa、凝血酶和肠激酶。融合表达载体的实例包括pGEX(Pharmacia Biotech Inc;Smith和Johnson,1988.Gene 67:31-40)、pMAL(NewEngland Biolabs,Beverly,Mass.)和pRIT5(Pharmacia,Piscataway,N.J.),其将谷胱甘肽S-转移酶(GST)、麦芽糖E结合蛋白或蛋白质A分别与靶重组蛋白融合。合适的诱导型非融合大肠杆菌表达载体的实例包括pTrc(Amrann等人,(1988)Gene 69:301-315)和pET 11d(Studier等人,GENE EXPRESSION TECHNOLOGY:METHODS IN ENZYMOLOGY 185,AcademicPress,San Diego,Calif.(1990)60-89)。在一些实施方案中,载体是酵母表达载体。在酵母酿酒酵母(Saccharomyces cerivisae)中表达的载体的实例包括pYepSec1(Baldari等人,1987.EMBO J.6:229-234)、pMFa(Kuijan和Herskowitz,1982.Cell 30:933-943)、pJRY88(Schultz等人,1987.Gene 54:113-123)、pYES2(Invitrogen Corporation,San Diego,Calif.)和picZ(InVitrogen Corp,San Diego,Calif.)。在一些实施方案中,载体使用杆状病毒表达载体驱动昆虫细胞中的蛋白质表达。可用于在培养的昆虫细胞(例如SF9细胞)中表达蛋白质的杆状病毒载体包括pAc系列(Smith等人,1983.Mol.Cell.Biol.3:2156-2165)和pVL系列(Lucklow和Summers,1989.Virology 170:31-39)。
在一些实施方案中,载体能够使用哺乳动物表达载体驱动哺乳动物细胞中一个或多个序列的表达。哺乳动物表达载体的实例包括pCDM8(Seed,1987.Nature 329:840)和pMT2PC(Kaufman等人,1987.EMBO J.6:187-195)。当用于哺乳动物细胞中时,表达载体的控制功能通常由一个或多个调控元件提供。例如,常用的启动子衍生自多瘤、腺病毒2、巨细胞病毒、猿猴病毒40以及本文公开和本领域已知的其他启动子。对于用于原核和真核细胞的其他合适的表达系统,参见例如Sambrook等人,MOLECULAR CLONING:ALABORATORY MANUAL.第2版,Cold Spring Harbor Laboratory,Cold Spring Harbor Laboratory Press,ColdSpring Harbor,N.Y.,1989的第16章和第17章。
在一些实施方案中,重组哺乳动物表达载体能够优先引导核酸在特定细胞类型中的表达(例如,组织特异性调控元件用于表达核酸)。组织特异性调控元件是本领域已知的。合适的组织特异性启动子的非限制性实例包括白蛋白启动子(肝特异性;Pinkert等人,1987.Genes Dev.1:268-277),淋巴样特异性启动子(Calame和Eaton,1988.Adv.Immunol.43:235-275),特别是T细胞受体的启动子(Winoto和Baltimore,1989.EMBO J.8:729-733)和免疫球蛋白(Baneiji等人,1983.Cell 33:729-740;Queen和Baltimore,1983.Cell 33:741-748),神经元特异性启动子(例如,神经丝启动子;Byrne和Ruddle,1989.Proc.Natl.Acad.Sci.USA 86:5473-5477),胰腺特异性启动子(Edlund等人,1985.Science 230:912-916)和乳腺特异性启动子(例如乳清启动子;美国专利第4,873,316号和欧洲申请公开第264,166号)。还涵盖发育调控的启动子,例如鼠类hox启动子(Kessel和Gruss,1990.Science 249:374-379)和α-甲胎蛋白启动子(Campes和Tilghman,1989.Genes Dev.3:537-546)。关于这些原核和真核载体,提及了美国专利6,750,059,其内容通过引用整体并入本文。本发明的其他实施方案可涉及病毒载体的使用,对此提及了美国专利申请13/092,085,其内容通过引用整体并入本文。组织特异性调控元件在本领域中是已知的,并且在这方面,提及美国专利7,776,321,其内容通过引用整体整体并入本文。在一些实施方案中,调控元件可操作地连接至CRISPR系统的一个或多个元件,以驱动CRISPR系统的一个或多个元件的表达。
在一些实施方案中,将驱动核酸靶向系统的一个或多个元件表达的一个或多个载体引入宿主细胞,使得核酸靶向系统的元件的表达引导核酸靶向复合物在一个或多个靶位点的形成。例如,核酸靶向效应酶和核酸靶向指导RNA和/或tracr可各自可操作地连接至分开的载体上的分开的调控元件。可将核酸靶向系统的RNA递送至转基因核酸靶向效应蛋白动物或哺乳动物,例如,组成性或诱导性或条件性表达核酸靶向效应蛋白的动物或哺乳动物;或以其他方式表达核酸靶向效应蛋白或者具有含有核酸靶向效应蛋白的细胞的动物或哺乳动物,例如通过事先向其施用编码并表达体内核酸靶向效应蛋白的一个或多个载体。或者,可将由相同或不同调控元件表达的两个或更多个元件组合在单个载体中,而一个或多个额外载体提供不包含在第一载体中的核酸靶向系统的任何组分。组合在单个载体中的核酸靶向系统元件可以任何合适的方向排列,例如一个元件位于相对于第二元件的(“上游”)5'或相对于第二元件的(“下游”)3'。一个元件的编码序列可位于第二元件的编码序列的相同或相反链上,并以相同或相反的方向定向。在一些实施方案中,单个启动子驱动编码核酸靶向效应蛋白和核酸靶向指导RNA的转录物的表达,所述转录物嵌入一个或多个内含子序列内(例如,各自在不同的内含子中,两个或更多个在至少一个内含子中,或全部在单个内含子中)。在一些实施方案中,核酸靶向效应蛋白和核酸靶向指导RNA可以可操作地连接至同一启动子并从同一启动子表达。用于表达核酸靶向系统的一个或多个元件的递送媒介物、载体、粒子、纳米粒子、制剂及其组分如前述文件例如WO 2014/093622(PCT/US2013/074667)中所使用。在一些实施方案中,载体包含一个或多个插入位点,例如限制性核酸内切酶识别序列(也称为“克隆位点”)。在一些实施方案中,一个或多个插入位点(例如,约或大于约1、2、3、4、5、6、7、8、9、10个或更多个插入位点)位于一个或多个载体的一个或多个序列元件的上游和/或下游。当使用多个不同的指导序列时,单个表达构建体可用于将核酸靶向活性靶向细胞内的多个不同的相应靶序列。例如,单个载体可包含约或大于约1、2、3、4、5、6、7、8、9、10、15、20个或更多个指导序列。在一些实施方案中,可提供约或大于约1、2、3、4、5、6、7、8、9、10个或更多个这样的含指导序列的载体,并任选地递送至细胞。在一些实施方案中,载体包含与编码核酸靶向效应蛋白的酶编码序列可操作地连接的调控元件。核酸靶向效应蛋白或者一种或多种核酸靶向指导RNA可分开递送;并且有利地,这些中的至少一种经由粒子复合物递送。可在核酸靶向指导RNA之前递送核酸靶向效应蛋白mRNA,以留出时间表达核酸靶向效应蛋白。核酸靶向效应蛋白mRNA可在施用核酸靶向指导RNA之前1-12小时(优选约2-6小时)施用。或者,核酸靶向效应蛋白mRNA和核酸靶向指导RNA可一起施用。有利地,可在初次施用核酸靶向效应蛋白mRNA+指导RNA后1-12小时(优选约2-6小时)施用指导RNA的第二加强剂量。核酸靶向效应蛋白mRNA和/或指导RNA的其他施用可能对实现最有效的基因组修饰水平有用。
在一些实施方案中,载体编码C2c1效应蛋白,所述C2c1效应蛋白包含一个或多个核定位序列(NLS),例如约或大于约1、2、3、4、5、6、7、8、9、10个或更多个NLS。更特别地,载体包含一个或多个天然不存在于C2c1效应蛋白中的NLS。最特别地,NLS存在于C2c1效应蛋白序列的载体5'和/或3'中。在一些实施方案中,靶向RNA的效应蛋白在氨基末端处或其附近包含约或大于约1、2、3、4、5、6、7、8、9、10个或更多个NLS,在羧基末端处或其附近包含约或大于约1、2、3、4、5、6、7、8、9、10个或更多个NLS,或这些的组合(例如,在氨基末端处的0个或至少一个或多个NLS和在羧基末端处的0个或一个或多个NLS)。当存在一个以上的NLS时,各自可彼此独立地进行选择,使得单个NLS可存在于一个以上的拷贝中和/或与一个或多个其他NLS组合存在于一个或多个拷贝中。在一些实施方案中,当NLS的最接近的氨基酸从N末端或C末端沿着多肽链在约1、2、3、4、5、10、15、20、25、30、40、50个或更多个氨基酸内时,认为NLS接近N末端或C末端。NLS的非限制性实例包括衍生自以下的NLS序列:SV40病毒大T抗原的NLS,其具有氨基酸序列PKKKRKV(SEQ ID NO:462);来自核质蛋白的NLS(例如具有序列KRPAATKKAGQAKKKK(SEQ ID NO:463)的核质蛋白二分NLS);具有氨基酸序列PAAKRVKLD(SEQID NO:464)或RQRRNELKRSP(SEQ ID NO:465)的c-myc NLS;具有序列NQSSNFGPMKGGNFGGRSSGPYGGGGQYFAKPRNQGGY(SEQ ID NO:466)的hRNPA1 M9 NLS;来自输入蛋白-α的IBB结构域的序列RMRIZFKNKGKDTAELRRRRVEVSVELRKAKKDEQILKRRNV(SEQ ID NO:467);肌瘤T蛋白的序列VSRKRPRP(SEQ ID NO:468)和PPKKARED(SEQ ID NO:469);人类p53的序列PQPKKKPL(SEQID NO:470);小鼠c-abl IV的序列SALIKKKKKMAP(SEQ ID NO:471);流感病毒NS1的序列DRLRR(SEQ ID NO:472)和PKQKKRK(SEQ ID NO:473);肝炎病毒δ抗原的序列RKLKKKIKKL(SEQ ID NO:474);小鼠Mx1蛋白的序列REKKKFLKRR(SEQ ID NO:475);人类聚(ADP-核糖)聚合酶的序列KRKGDEVDGVDEVAKKKSKK(SEQ ID NO:476);以及类固醇激素受体(人类)糖皮质激素的序列RKCLQAGMNLEARKTKK(SEQ ID NO:477)。通常,一个或多个NLS具有足够的强度来驱动可检测量的靶向DNA/RNA的Cas蛋白在真核细胞核中的积累。通常,核定位活性的强度可源自核酸靶向效应蛋白中NLS的数量、所使用的特定NLS或这些因素的组合。细胞核中积累的检测可通过任何合适的技术来进行。例如,可将可检测的标志物融合至核酸靶向蛋白,使得可将细胞内的位置可视化,例如结合用于检测细胞核位置的手段(例如,对细胞核特异性的染色剂,例如DAPI)。也可从细胞中分离细胞核,然后可通过用于检测蛋白质的任何合适的方法,例如免疫组织化学、Western印迹或酶活性测定来分析其含量。也可间接测定细胞核中的积累,例如通过测定核酸靶向复合物形成的作用(例如测定靶序列处的DNA或RNA切割或突变,或测定受DNA或RNA靶向复合物形成影响的改变的基因表达活性和/或DNA或RNA靶向Cas蛋白活性),与未暴露于核酸靶向Cas蛋白或核酸靶向复合物或者暴露于缺乏一个或多个NLS的核酸靶向Cas蛋白的对照相比。在本文描述的C2c1效应蛋白复合物和系统的优选实施方案中,密码子优化的C2c1效应蛋白包含附接到所述蛋白的C末端的NLS。在某些实施方案中,可将其他定位标签融合至Cas蛋白,例如但不限于将Cas定位至细胞中的特定位点,例如细胞器,例如线粒体、质体、叶绿体、囊泡、高尔基体、(核或细胞)膜、核糖体、核仁、ER、细胞骨架、液泡、中心体、核小体、小粒、中心粒等。
本发明还提供了非天然存在的或工程化的组合物,或一种或多种编码所述组合物的组分的多核苷酸,或包含一种或多种编码所述组合物的组分的多核苷酸的载体系统,其用于治疗性治疗方法中。所述治疗性治疗方法可包括基因或基因组编辑或基因疗法。
在一些实施方案中,治疗性治疗方法包括CRISPR-Cas系统,所述系统包含基于靶生物群体中的疗法或治疗剂设计的指导序列。在一些实施方案中,靶生物群体包括至少1000名个体,例如至少5000名个体,例如至少10000名个体,例如至少50000名个体。在一些实施方案中,在群体中具有最小序列变异的靶位点的特征在于在群体的至少99%、优选至少99.9%、更优选至少99.99%中不存在序列变异。
如本文所用,术语单倍型(单倍体基因型)是生物体中从单个亲本一起遗传的一组基因。如本文所用,单倍型频率估计(也称为“定相”)是指根据基因型数据对单倍型进行统计估计的过程。Toshikazu等人(Am J Hum Genet.2003年2月;72(2):384-398)描述了估计单倍型频率的方法,所述方法可用于本文公开的发明中。
本文所述的核酸靶向系统、载体系统、载体和组合物可用于多种核酸靶向应用,改变或修饰基因产物如蛋白质的合成,核酸切割,核酸编辑,核酸剪接;靶核酸的运输,靶核酸的追踪,靶核酸的分离,靶核酸的可视化等。
通常并且在整个本说明书中,术语“载体”是指能够转运与其连接的另一核酸的核酸分子。载体包括但不限于单链、双链或部分双链的核酸分子;包含一个或多个自由端、无自由端(例如环状)的核酸分子;包含DNA、RNA或两者的核酸分子;以及本领域已知的其他多核苷酸变体。载体的一种类型是“质粒”,其是指环状双链DNA环,例如通过标准分子克隆技术,可在其中插入其他DNA区段。载体的另一种类型是病毒载体,其中载体中存在病毒来源的DNA或RNA序列,用于包装成病毒(例如逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒和腺相关病毒)。病毒载体还包括病毒携带的用于转染到宿主细胞中的多核苷酸。某些载体能够在引入它们的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和游离型哺乳动物载体)。在引入宿主细胞中后,将其他载体(例如,非游离型哺乳动物载体)整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够引导与其可操作连接的基因的表达。此类载体在本文中称为“表达载体”。在真核细胞中表达的载体和导致在真核细胞中表达的载体在本文中可称为“真核表达载体”。在重组DNA技术中有用的常见表达载体通常是质粒的形式。
在某些实施方案中,载体系统包含呈反向顺序的启动子-指导表达盒。
重组表达载体可以适合在宿主细胞中表达核酸的形式包含本发明的核酸,这意味着重组表达载体包含一个或多个调控元件,所述调控元件可根据待用于表达的宿主细胞进行选择,所述核酸可操作地连接至待表达的核酸序列。
有利的载体包括慢病毒和腺相关病毒,并且也可选择这类载体的类型以靶向特定类型的细胞。
在一些实施方案中,将驱动核酸靶向系统的一个或多个元件表达的一个或多个载体引入宿主细胞,使得核酸靶向系统的元件的表达引导核酸靶向复合物在一个或多个靶位点的形成。例如,核酸靶向效应子模块和核酸靶向指导RNA可各自可操作地连接至分开的载体上的分开的调控元件。可将核酸靶向系统的RNA递送至转基因核酸靶向效应子模块动物或哺乳动物,例如,组成性或诱导性或条件性表达核酸靶向效应子模块的动物或哺乳动物;或以其他方式表达核酸靶向效应子模块或具有包含核酸靶向效应子模块的细胞的动物或哺乳动物,例如通过事先向其施用一种或多种编码和表达体内核酸靶向效应子模块的载体。或者,可将由相同或不同调控元件表达的两个或更多个元件组合在单个载体中,而一个或多个额外载体提供不包含在第一载体中的核酸靶向系统的任何组分。组合在单个载体中的核酸靶向系统元件可以任何合适的方向排列,例如一个元件位于相对于第二元件的(“上游”)5'或相对于第二元件的(“下游”)3'。一个元件的编码序列可位于第二元件的编码序列的相同或相反链上,并以相同或相反的方向定向。在一些实施方案中,单个启动子驱动编码核酸靶向效应子模块和核酸靶向指导RNA的转录物的表达,所述转录物被嵌入一个或多个内含子序列内(例如,各自在不同的内含子中,两个或更多个在至少一个内含子中,或全部在单个内含子中)。在一些实施方案中,核酸靶向效应子模块和核酸靶向指导RNA可以可操作地连接至同一启动子并从同一启动子表达。
本发明还涵盖用于递送多种核酸组分的方法,其中每种核酸组分对不同的目标靶基因座具有特异性,从而修饰了多个目标靶基因座。复合物的核酸组分可包含一种或多种蛋白结合RNA适体。一种或多种适体可能能够结合噬菌体外壳蛋白。噬菌体外壳蛋白可选自包括以下的组:Qβ、F2、GA、fr、JP501、MS2、M12、R17、BZ13、JP34、JP500、KU1、M11、MX1、TW18、VK、SP、FI、ID2、NL95、TW19、AP205、φCb5、φCb8r、φCb12r、φCb23r、7s和PRR1。在一个优选的实施方案中,噬菌体外壳蛋白是MS2。本发明还提供了复合物的核酸组分,其长度为30个或更多个、40个或更多个或50个或更多个核苷酸。
在一个方面,本发明提供了一种包含一个或多个载体的载体系统,其中所述一个或多个载体包含:a)第一调控元件,其可操作地连接至编码如本文定义的工程化的CRISPR蛋白的核苷酸序列;和任选地b)第二调控元件,其可操作地连接至编码一个或多个核酸分子的一个或多个核苷酸序列,所述核酸分子包括包含指导序列、正向重复序列的指导RNA,任选地其中组分(a)和(b)位于相同或不同的载体上。
本发明还提供了工程化的、非天然存在的成簇的规律间隔的短回文重复序列(CRISPR)-CRISPR相关(Cas效应子模块)(CRISPR-Cas效应子模块)载体系统,所述系统包含一个或多个载体,所述载体包含:a)第一调控元件,其可操作地连接至编码本文任何一种本发明的构建体的非天然存在的CRISPR酶的核苷酸序列;和b)第二调控元件,其可操作地连接至编码一个或多个指导RNA的一个或多个核苷酸序列,所述指导RNA包含指导序列、正向重复序列,其中:组分(a)和(b)位于相同或不同的载体上,形成CRISPR复合物;所述指导RNA靶向靶多核苷酸基因座并且所述酶改变多核苷酸基因座,并且CRISPR复合物中的酶与未修饰的酶相比具有降低的修饰一个或多个脱靶基因座的能力和/或由此CRISPR复合物中的酶与未修饰的酶相比具有增强的修饰一个或多个靶基因座的能力。
如本文所用,CRISPR Cas效应子模块或CRISRP效应子模块包括但不限于C2c1。在一些实施方案中,可对CRISPR-Cas效应子模块进行工程化。
在这样的系统中,组分(II)可包含可操作地连接至包含指导序列、正向重复序列的多核苷酸序列的第一调控元件,并且其中组分(II)可包含可操作地连接至编码CRISPR酶的多核苷酸序列的第二调控元件。在这样的系统中,在适用时,指导RNA可包括嵌合RNA。
在这样的系统中,组分(I)可包含可操作地连接至指导序列和正向重复序列的第一调控元件,并且其中组分(II)可包含可操作地连接至编码CRISPR酶的多核苷酸序列的第二调控元件。这样的系统可包含一个以上的指导RNA,并且每个指导RNA具有不同的靶标,由此存在多重作用。组分(a)和(b)可在相同载体上。
在包含载体的任何此类系统中,一个或多个载体可包含一个或多个病毒载体,例如一个或多个逆转录病毒、慢病毒、腺病毒、腺相关病毒或单纯疱疹病毒。
在任何包含调控元件的此类系统中,所述调控元件中的至少一者可包括组织特异性启动子。组织特异性启动子可引导在哺乳动物血细胞、哺乳动物肝细胞或哺乳动物眼睛中的表达。
在任何上述组合物或系统中,正向重复序列可包含一个或多个与蛋白质相互作用的RNA适体。所述一个或多个适体可位于四环中。所述一个或多个适体可能能够结合MS2噬菌体外壳蛋白。
在任何上述组合物或系统中,细胞可以是真核细胞或原核细胞;其中所述CRISPR复合物在细胞中是可操作的,并且由此所述CRISPR复合物的酶与未修饰的酶相比具有降低的修饰细胞的一个或多个脱靶基因座的能力,和/或由此所述CRISPR复合物中的酶与未修饰的酶相比具有增加的修饰一个或多个靶基因座的能力。
本发明还提供了任何上述组合物或来自任何上述系统的CRISPR复合物。
本发明还提供了对细胞中的目标基因座进行修饰的方法,所述方法包括使所述细胞与任何本文所述的工程化的CRISPR酶(例如,工程化的Cas效应子模块)、组合物或任何本文所述的系统或载体系统接触,或者其中所述细胞包含存在于细胞内的任何本文所述的CRISPR复合物。在这样的方法中,细胞可以是原核或真核细胞,优选是真核细胞。在这样的方法中,生物体可包含细胞。在这样的方法中,生物体可能不是人类或其他动物。
在某些实施方案中,本发明还提供了非天然存在的工程化组合物(例如,C2c1或可适合于AAV载体的任何Cas蛋白)。参考通过引用并入本文的US8,697,359中的图19A、图19B、图19C、图19D和图20A-F,以提供也可使用的其他蛋白质的列表和指导。
任何这样的方法可以是离体的或体外的。
在某些实施方案中,编码所述指导RNA或C2c1效应子模块中的至少一者的核苷酸序列在细胞中与包含目标基因的启动子的调控元件可操作地连接,由此至少一种CRISPR-Cas效应子模块系统组分的表达由目标基因的启动子驱动。“可操作地连接”旨在表示编码指导RNA和/或Cas效应子模块的核苷酸序列以允许核苷酸序列表达的方式与调控元件连接,如本文其他地方所提及。术语“调控元件”也在本文其他地方进行了描述。根据本发明,调控元件包含目标基因的启动子,例如优选地内源性的目标基因的启动子。在某些实施方案中,启动子在其内源性基因组位置处。在这样的实施方案中,编码CRISPR和/或Cas效应子模块的核酸在其天然基因组位置处处于目标基因的启动子的转录控制下。在某些其他实施方案中,启动子提供在(分开的)核酸分子例如载体或质粒或其他染色体外核酸上,即启动子不提供在其天然基因组位置上。在某些实施方案中,启动子在非天然基因组位置上基因组整合。
本发明还提供了改变哺乳动物细胞中目标基因组基因座表达的方法,所述方法包括使细胞与本文所述的工程化的CRISPR酶(例如,工程化的Cas效应子模块)、组合物、系统或CRISPR复合物接触,从而递送CRISPR-Cas效应子模块(载体),并允许CRISPR-Cas效应子模块复合物形成并结合至靶标,以及确定基因组基因座的表达是否已被改变,例如表达的增加或减少,或基因产物的修饰。
本发明还提供了一种对Cas效应子模块或者突变或修饰的Cas效应子模块(其是如本文所述的根据本发明的CRISPR酶的直系同源物)进行突变的方法,所述方法包括确定该直系同源物中的氨基酸可紧密接近或可接触核酸分子例如DNA、RNA、gRNA等和/或与如本文所述的根据本发明的CRISPR酶中的本文鉴定的氨基酸类似或相对应的氨基酸以用于修饰和/或突变,以及合成或制备或表达直系同源物,所述直系同源物包含以下,由以下组成或基本上由以下组成:修饰和/或突变或如本文所讨论的突变,例如将中性氨基酸修饰(例如改变或突变)为带电荷(例如带正电荷)的氨基酸(例如丙氨酸)。如此修饰的直系同源物可用于CRISPR-Cas效应子模块系统;以及表达它的核酸分子可用于载体系统中,所述载体系统递送分子或编码如本文所讨论的CRISPR-Cas效应子模块系统组分。
在一个方面,本发明提供了一种试剂盒,所述试剂盒包含本文所述的一种或多种组分。在一些实施方案中,试剂盒包括载体系统和使用试剂盒的说明书。在一些实施方案中,载体系统包含(a)与正向重复序列可操作地连接的第一调控元件和用于将一个或多个指导序列插入DR序列下游的一个或多个插入位点,其中当表达时,指导序列引导CRISPR-Cas效应子模块复合物与真核细胞中的靶序列的序列特异性结合,其中所述CRISPR-Cas效应子模块复合物包含与以下各物复合的Cas效应子模块:(1)与靶序列杂交的指导序列,(2)DR序列,和(3)tracr序列;和/或(b)第二调控元件,其可操作地连接至编码所述Cas效应子模块的酶编码序列,所述Cas效应子模块包含核定位序列并且有利的是其包括分裂的Cas效应子模块。在一些实施方案中,试剂盒包含位于系统的相同或不同载体上的组分(a)和(b)。在一些实施方案中,组分(a)还包含可操作地连接至第一调控元件的两个或更多个指导序列,其中当被表达时,两个或更多个指导序列中的每一者将引导CRISPR-Cas效应子模块复合物与真核细胞中的不同靶序列的序列特异性结合。tracr可能会或可能不会与和指导物(间隔子)和正向重复序列相同的多核苷酸融合或在其上(编码)。
在一个方面,本发明提供了一种在真核细胞中对靶多核苷酸进行修饰的方法。在一些实施方案中,所述方法包括允许CRISPR-Cas效应子模块复合物结合至靶多核苷酸以实现所述靶多核苷酸的切割,从而修饰靶多核苷酸,其中所述CRISPR-Cas效应子模块复合物包含与和所述靶多核苷酸内的靶序列杂交的指导序列复合的Cas效应子模块,其中所述指导序列与正向重复序列连接。在一些实施方案中,所述切割包括通过所述Cas效应子模块在靶序列的位置处切割一条或两条链;所述Cas效应子模块包括分裂的Cas效应子模块。在一些实施方案中,所述切割导致靶基因的转录降低。在一些实施方案中,所述方法还包括通过与外源模板多核苷酸的同源重组来修复所述切割的靶多核苷酸,其中所述修复导致突变,所述突变包括所述靶多核苷酸的一个或多个核苷酸的插入、缺失或取代。在一些实施方案中,所述突变导致从包含靶序列的基因表达的蛋白质中的一个或多个氨基酸改变。在一些实施方案中,所述方法还包括将一个或多个载体递送至所述真核细胞,其中所述一个或多个载体驱动以下中的一者或多者的表达:Cas效应子模块和与DR序列连接的指导序列。在一些实施方案中,所述载体被递送至受试者中的真核细胞。在一些实施方案中,所述修饰发生在细胞培养物中的所述真核细胞中。在一些实施方案中,所述方法还包括在所述修饰之前从受试者分离所述真核细胞。在一些实施方案中,所述方法还包括将所述真核细胞和/或从其衍生的细胞返回至所述受试者。在一个方面,本发明提供了修饰或编辑真核细胞中的靶多核苷酸的方法。在一些实施方案中,所述方法包括允许CRISPR-Cas效应子模块复合物结合至靶多核苷酸以实现DNA碱基编辑,其中所述CRISPR-Cas效应子模块复合物包含与和所述靶多核苷酸内的靶序列杂交的指导序列复合的Cas效应子模块,其中所述指导序列与正向重复序列连接。在一些实施方案中,Cas效应子模块包含无催化活性的CRISPR-Cas蛋白。在一些实施方案中,指导序列被设计为向靶序列与指导序列之间形成的DNA/RNA异源双链体引入一个或多个错配。在特定的实施方案中,错配是A-C错配。在一些实施方案中,Cas效应子可与一个或多个功能结构域缔合(例如,经由融合蛋白或合适的接头)。在一些实施方案中,效应子结构域包含一种或多种胞苷或腺苷脱氨酶,其介导经由水解脱氨的内源编辑。
在一个方面,本发明提供了一种在真核细胞中对多核苷酸的表达进行修饰的方法。在一些实施方案中,所述方法包括允许CRISPR-Cas效应子模块复合物结合至多核苷酸,使得所述结合导致所述多核苷酸的表达增加或减少;其中所述CRISPR-Cas效应子模块复合物包含与和所述多核苷酸内的靶序列杂交的指导序列复合的Cas效应子模块,其中所述指导序列与正向重复序列连接;所述Cas效应子模块可包括分裂的Cas效应子模块。在一些实施方案中,所述方法还包括将一个或多个载体递送至所述真核细胞,其中所述一个或多个载体驱动以下中的一者或多者的表达:Cas效应子模块和与DR序列连接的指导序列。
在一个方面,本发明提供了一种在真核细胞中修饰或编辑靶转录物的方法。在一些实施方案中,所述方法包括允许CRISPR-Cas效应子模块复合物结合至靶多核苷酸以实现RNA碱基编辑,其中所述CRISPR-Cas效应子模块复合物包含与和所述靶多核苷酸内的靶序列杂交的指导序列复合的Cas效应子模块,其中所述指导序列与正向重复序列连接。在一些实施方案中,Cas效应子模块包含无催化活性的CRISPR-Cas蛋白。在一些实施方案中,指导序列被设计为向在靶序列与指导序列之间形成的RNA/RNA双链体引入一个或多个错配。在特定的实施方案中,错配是A-C错配。在一些实施方案中,Cas效应子可与一个或多个功能结构域缔合(例如,经由融合蛋白或合适的接头)。在一些实施方案中,效应子结构域包含一种或多种胞苷或腺苷脱氨酶,其介导经由水解脱氨的内源编辑。在特定的实施方案中,效应子结构域包含作用于酶的RNA(ADAR)家族的腺苷脱氨酶。在特定的实施方案中,能够使RNA中的腺苷或胞苷脱氨基的腺苷脱氨酶蛋白或其催化结构域,或者是RNA特异性腺苷脱氨酶和/或是细菌、人类、头足类或果蝇腺苷脱氨酶蛋白或其催化结构域,优选TadA,更优选ADAR,任选地huADAR,任选地(hu)ADAR1或(hu)ADAR2,优选地huADAR2或其催化结构域。在一些实施方案中,胞苷脱氨酶是人类、大鼠或海七鳃鳗胞苷脱氨酶。在一些实施方案中,胞苷脱氨酶是载脂蛋白B mRNA编辑复合物(APOBEC)家族脱氨酶、激活诱导的脱氨酶(AID)或胞苷脱氨酶1(CDA1)。
本申请涉及修饰目标靶DNA序列。
本发明的另一方面涉及用于预防性或治疗性治疗的如本文所设想的方法和组合物,优选地其中所述目标靶基因座在人类或动物内,并且涉及修饰目标靶DNA序列中的腺嘌呤或胞苷的方法,所述方法包括将上述组合物递送至所述靶DNA。在特定的实施方案中,CRISPR系统及其腺苷脱氨酶或其催化结构域,作为一种或多种多核苷酸分子,作为核糖核蛋白复合物,任选地经由粒子、囊泡或一种或多种病毒载体被递送。在特定的实施方案中,所述组合物用于治疗或预防由含有病原性G→A或C→T点突变的转录物引起的疾病。因此,在特定的实施方案中,本发明包括用于疗法中的组合物。这意味着所述方法可在体内、离体或体外进行。在特定的实施方案中,所述方法不是治疗动物或人体的方法并且不是修饰人类细胞的种系遗传特性的方法。在特定的实施方案中;当实施所述方法时,人类或动物细胞内不包含靶DNA。在特定的实施方案中,当靶标是人类或动物靶标时,所述方法是离体或体外进行的。
本发明的另一方面涉及用于预防性或治疗性治疗的如本文所设想的方法,优选地其中所述目标靶标在人类或动物体内,并且涉及在目标靶DNA序列中修饰腺嘌呤或胞苷的方法,所述方法包括将上述组合物递送至所述靶RNA。在特定的实施方案中,CRISPR系统和腺苷脱氨酶或其催化结构域,作为一种或多种多核苷酸分子,作为核糖核蛋白复合物,任选地经由粒子、囊泡或一种或多种病毒载体被递送。在特定的实施方案中,所述组合物用于治疗或预防由含有病原性G→A或C→T点突变的转录物引起的疾病。因此,在特定的实施方案中,本发明包括用于疗法中的组合物。这意味着所述方法可在体内、离体或体外进行。在特定的实施方案中,所述方法不是治疗动物或人体的方法并且不是修饰人类细胞的种系遗传特性的方法。在特定的实施方案中;当实施所述方法时,人类或动物细胞内不包含靶DNA。在特定的实施方案中,当靶标是人类或动物靶标时,所述方法是离体或体外进行的。
本发明还涉及通过靶向脱氨或致病变体来治疗或预防疾病的方法。例如,A的脱氨基可补救由含有病原性G→A或C→T点突变的转录物引起的疾病。可用本发明治疗或预防的疾病的实例包括癌症,迈尔-戈林综合症(Meier-Gorlin syndrome),塞克尔综合症4(Seckel syndrome 4),乔伯特综合症5(Joubert syndrome 5),莱伯先天性黑蒙10(Lebercongenital amaurosis 10);2型Charcot-Marie-Tooth病;2型Charcot-Marie-Tooth病;2C型Usher综合征;脊髓小脑共济失调28;脊髓小脑共济失调28;脊髓小脑共济失调28;长QT综合征2;
在一个方面,本发明提供了生成包含突变疾病基因的模型真核细胞的方法。在一些实施方案中,疾病基因是与具有或患上疾病的风险增加相关的任何基因。在一些实施方案中,所述方法包括:(a)将一个或多个载体引入真核细胞,其中所述一个或多个载体驱动以下中的一者或多者的表达:Cas效应子模块,和与正向重复序列连接的指导序列;以及(b)允许CRISPR-Cas效应子模块复合物与靶多核苷酸结合以实现所述疾病基因内靶多核苷酸的切割,其中所述CRISPR-Cas效应子模块复合物包含与以下各物复合的Cas效应子模块:(1)与靶多核苷酸内的靶序列杂交的指导序列,(2)DR序列,和(3)tracr序列,从而生成包含突变的疾病基因的模型真核细胞;所述Cas效应子模块包括分裂的Cas效应子模块。在一些实施方案中,所述切割包括通过所述Cas效应子模块在靶序列的位置处切割一条或两条链。在一个优选的实施方案中,链断裂是具有5'突出端的交错切口。在一些实施方案中,所述切割导致靶基因的转录降低。在一些实施方案中,所述方法还包括通过与外源模板多核苷酸的同源重组来修复所述切割的靶多核苷酸,其中所述修复导致突变,所述突变包括所述靶多核苷酸的一个或多个核苷酸的插入、缺失或取代。在一些实施方案中,所述突变导致来自包含靶序列的基因的蛋白质表达中的一个或多个氨基酸变化。在一些实施方案中,模型真核细胞包含突变的疾病基因,其中通过具有5'突出端的交错双链断裂引入突变。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,模型真核细胞包含突变的疾病基因,其中所述突变是通过HDR在交错的5'突出端的DNA插入物引入的。在一些实施方案中,模型真核细胞包含突变的疾病基因,其中所述突变是通过NHEJ在交错的5'突出端的DNA插入物引入的。在一些实施方案中,模型真核细胞包含由CRISPR-C2c1系统引入的外源DNA序列插入。在特定的实施方案中,CRISPR-C2c1系统包含在5'端和3'端均侧接指导序列的外源DNA。在一些实施方案中,模型真核细胞包含突变的疾病基因,其中所述突变c是通过在交错的5'突出端的DNA插入物引入的,在一个特定的实施方案中,Cas效应子模块包含C2c1蛋白或其催化结构域,并且PAM序列是富含T的序列。在特定的实施方案中,PAM是5'-TTN或5'-ATTN,其中N是任何核苷酸。在一个特定的实施方案中,PAM是5'-TTG。在特定的实施方案中,模型真核细胞包含与癌症相关的突变基因。在一个特定的实施方案中,模型真核细胞包含与宫颈上皮内瘤变(CIN)中人乳头瘤病毒(HPV)驱动的致癌作用相关的突变的疾病基因。在其他特定的实施方案中,模型真核细胞包含与帕金森氏病、囊性纤维化、心肌病和局部缺血性心脏病相关的突变的疾病基因。
在一个方面,本发明提供了一种通过在一个或多个细胞中的基因中引入一个或多个突变来选择一个或多个细胞的方法,所述方法包括:将一个或多个载体引入细胞中,其中所述一个或多个载体驱动以下中的一者或多者的表达:Cas效应子模块,与正向重复序列连接的指导序列,和编辑模板;其中所述编辑模板包含消除Cas效应子模块切割的一个或多个突变;允许编辑模板与待选择的细胞中的靶多核苷酸的同源重组;允许CRISPR-Cas效应子模块复合物与靶多核苷酸结合以实现所述基因内靶多核苷酸的切割,其中CRISPR-Cas效应子模块复合物包含与以下各物复合的Cas效应子模块:(1)与靶多核苷酸内的靶序列杂交的指导序列,和(2)正向重复序列,其中Cas效应子模块CRISPR-Cas效应子模块复合物与靶多核苷酸的结合诱导细胞死亡,从而允许选择已引入一个或多个突变的一个或多个细胞;所述Cas效应子模块包括分裂的Cas效应子模块。在本发明的另一个优选实施方案中,待选择的细胞可以是真核细胞。本发明的方面允许特定细胞的选择而无需选择标志物或可能包括反选择系统的两步过程。
在一个方面,本发明提供了一种生成包含修饰或编辑的基因的真核细胞的方法。在一些实施方案中,所述修饰或编辑的基因是疾病基因。在一些实施方案中,所述方法包括(a)将一个或多个载体引入真核细胞,其中所述一个或多个载体驱动以下中的一者或多者的表达:Cas效应子模块和连接至正向重复序列的指导序列,其中所述Cas效应子模块缔合一个或多个介导碱基编辑的效应子结构域,和(b)允许CRISPR-Cas效应子模块复合物结合至靶多核苷酸以实现所述疾病基因内靶多核苷酸的碱基编辑,其中所述CRISPR-Cas效应子模块复合物包含与和靶多核苷酸内的靶序列杂交的指导序列复合的Cas效应子模块,其中所述指导序列可被设计为在指导序列与靶序列之间形成的DNA/RNA异源双链体或RNA/RNA双链体之间引入一个或多个错配。在特定的实施方案中,错配是A-C错配。在一些实施方案中,Cas效应子可与一个或多个功能结构域缔合(例如,经由融合蛋白或合适的接头)。在一些实施方案中,效应子结构域包含一种或多种胞苷或腺苷脱氨酶,其介导经由水解脱氨的内源编辑。在特定的实施方案中,效应子结构域包含作用于酶的RNA(ADAR)家族的腺苷脱氨酶。在特定的实施方案中,能够使RNA中的腺苷或胞苷脱氨基的腺苷脱氨酶蛋白或其催化结构域,或者是RNA特异性腺苷脱氨酶和/或是细菌、人类、头足类或果蝇腺苷脱氨酶蛋白或其催化结构域,优选地TadA,更优选地ADAR,任选地huADAR,任选地(hu)ADAR1或(hu)ADAR2,优选地huADAR2或其催化结构域。在一些实施方案中,胞苷脱氨酶是人类、大鼠或海七鳃鳗胞苷脱氨酶。在一些实施方案中,胞苷脱氨酶是载脂蛋白B mRNA编辑复合物(APOBEC)家族脱氨酶、激活诱导的脱氨酶(AID)或胞苷脱氨酶1(CDA1)。
另一方面涉及从上述方法获得或可获得的和/或包含上述组合物的分离的细胞或所述修饰细胞的后代,优选地其中所述细胞包含次黄嘌呤或鸟嘌呤代替所述目标靶RNA中的所述腺嘌呤(与未经受所述方法的相应细胞相比)。在特定的实施方案中,细胞是真核细胞,优选人类或非人类动物细胞,任选地治疗性T细胞或产生抗体的B细胞,或者其中所述细胞是植物细胞。另一方面提供了包含所述修饰的细胞或其后代的非人类动物或植物。另一个方面提供了用于疗法、优选细胞疗法中的上述修饰的细胞。
在一些实施方案中,修饰的细胞是治疗性T细胞,例如适合于CAR-T疗法的T细胞。修饰可在治疗性T细胞中导致一种或多种期望的性状,包括但不限于免疫检查点受体(例如,PDA、CTLA4)的表达减少,HLA蛋白(例如,B2M、HLA-A)的表达减少,以及内源性TCR的表达减少。
本发明还涉及一种用于细胞疗法的方法,所述方法包括向有需要的患者施用本文所述的修饰的细胞,其中所述修饰的细胞的存在可治疗患者的疾病。在一个实施方案中,用于细胞疗法的修饰细胞是能够识别和/或攻击肿瘤细胞的CAR-T细胞。在另一个实施方案中,用于细胞疗法的修饰细胞是干细胞,例如神经干细胞、间充质干细胞、造血干细胞或iPSC细胞。
还提供了用于如本文其他地方所定义的治疗方法中的组合物,其包含含有优选串联排列的多个指导RNA的Cas效应子模块、复合物或系统,或者编码或包含含有优选串联排列的多个指导RNA的Cas效应子模块、复合物或系统的多核苷酸或载体。可提供包括此类组合物的多部分试剂盒。还提供了所述组合物在用于这种治疗方法的药物制备中的用途。本发明还提供了Cas效应子模块CRISPR系统在筛选(例如功能获得筛选)中的用途。被人为迫使过表达基因的细胞能够随时间下调基因(重新建立平衡),例如通过负反馈循环。到筛选开始时,未调控的基因可能会再次减少。使用可诱导的Cas效应子模块激活子可以使人们在即将筛选前诱导转录,因此可将假阴性命中概率最小化。因此,通过使用本发明进行筛选,例如功能获得筛选,可将假阴性结果的概率降到最低。
在另一方面,本发明提供了一种工程化的非天然存在的载体系统,所述系统包含一个或多个载体,所述载体包含第一调控元件,其可操作地连接至多个Cas12b CRISPR系统指导RNA,所述指导RNA各自特异性地靶向编码基因产物的DNA分子;和第二载调控元件,其可操作地连接以编码CRISPR蛋白。两个调控元件可位于系统的相同载体上或不同载体上。多个指导RNA靶向细胞中编码多个基因产物的多个DNA分子,并且CRISPR蛋白可切割编码基因产物的多个DNA分子(它可切割一条或两条链或基本上不具有核酸酶活性),从而多基因产物的表达被改变;并且,其中所述CRISPR蛋白和所述多个指导RNA不是天然地一起存在。在一个优选的实施方案中,CRISPR蛋白是Cas12b蛋白,任选地对密码子优化以在真核细胞中表达。在一个优选的实施方案中,真核细胞是哺乳动物细胞、植物细胞或酵母细胞,并且在一个更优选的实施方案中,哺乳动物细胞是人类细胞。在本发明的另一个实施方案中,多个基因产物中的每一者的表达被改变,优选降低。
在一个方面,本发明提供了一种包含一个或多个载体的载体系统。在一些实施方案中,所述系统包含:(a)与正向重复序列可操作地连接的第一调控元件和用于将一个或多个指导序列插入正向重复序列的上游或下游(以适用为准)的一个或多个插入位点,其中当表达时,一个或多个指导序列引导CRISPR复合物与真核细胞中的一个或多个靶序列的序列特异性结合,其中所述CRISPR复合物包含与和一个或多个靶序列杂交的一个或多个指导序列复合的Cas12b酶;和(b)第二调控元件,其可操作地连接至编码所述Cas12b酶的酶编码序列,所述酶编码序列优选包含至少一个核定位序列和/或至少一个NES;其中组分(a)和(b)位于系统的相同或不同载体上。如果适用,还可提供tracr序列。在一些实施方案中,组分(a)还包含可操作地连接至第一调控元件的两个或更多个指导序列,其中当表达时,所述两个或更多个指导序列中的每一者引导Cas12b CRISPR复合物与真核细胞中的不同靶序列的序列特异性结合。在一些实施方案中,CRISPR复合物包含一个或多个核定位序列和/或一个或多个具有足够强度的NES以驱动所述Cas12b CRISPR复合物以可检测的量积聚在真核细胞核内或外。在一些实施方案中,第一调控元件是聚合酶III启动子。在一些实施方案中,第二调控元件是聚合酶II启动子。在一些实施方案中,每个指导序列的长度为至少16、17、18、19、20、25个核苷酸,或在16-30之间,或在16-25之间,或在16-20个核苷酸之间。
重组表达载体可包含编码Cas12b酶、系统或复合物的多核苷酸,以适合于在宿主细胞中表达核酸的形式用于如本文所定义的多重靶向,这意味着重组表达载体包含一个或多个调控元件,所述调控元件可基于待用于表达的宿主细胞进行选择,所述核酸与待表达的核酸序列可操作地连接。在重组表达载体内,“可操作地连接”旨在是指目标核苷酸序列以允许核苷酸序列表达的方式(例如,在体外转录/翻译系统中或者当载体被引入宿主细胞中时在宿主细胞中)与调控元件连接。
在一些实施方案中,用一个或多个载体瞬时或非瞬时转染宿主细胞,所述载体包含编码Cas12b酶、系统或复合物的多核苷酸,用于如本文所定义的多重靶向。在一些实施方案中,细胞在其天然存在于受试者中时被转染。在一些实施方案中,转染的细胞是取自受试者。在一些实施方案中,细胞是源自取自受试者的细胞,例如细胞系。用于组织培养的广泛多种细胞系在本领域中是已知的并且在本文其他地方示例。细胞系可从本领域技术人员已知的多种来源获得(参见例如美国典型培养物保藏中心(ATCC)(Manassus,Va.))。在一些实施方案中,用一个或多个载体转染的细胞用于建立包含一个或多个载体衍生序列的新细胞系,所述载体包含编码如本文所定义的用于多重靶向的Cas12b酶、系统或复合物的多核苷酸。在一些实施方案中,用如本文所定义的用于多重靶向的Cas12b CRISPR系统或复合物的组分瞬时转染(例如通过瞬时转染一个或多个载体,或用RNA转染)并通过Cas12b CRISPR系统或复合物的活性修饰的细胞用于建立新细胞系,所述新细胞系包含含有修饰但缺乏任何其他外源序列的细胞。在一些实施方案中,用一个或多个载体瞬时或非瞬时转染细胞,所述载体包含编码如本文所定义的用于多重靶向的Cas12b酶、系统或复合物的多核苷酸,或源自此类细胞的细胞系用于评估一种或多种测试化合物。
术语“调控元件”如本文其他地方所定义。
有利的载体包括慢病毒和腺相关病毒,并且也可选择这类载体的类型以靶向特定类型的细胞。
在一个方面,本发明提供了一种真核宿主细胞,所述真核宿主细胞包含(a)可操作地连接至正向重复序列的第一调控元件和用于将一个或多个指导RNA序列插入到所述正向重复序列的上游或下游(以适用为准)的一个或多个插入位点,其中当表达时,指导序列引导Cas12b CRISPR复合物与真核细胞中相应靶序列的序列特异性结合,其中Cas12b CRISPR复合物包含与和相应靶序列杂交的一个或多个指导序列复合的Cas12b酶;和/或(b)第二调控元件,其可操作地连接至编码所述Cas12b酶的酶编码序列,所述酶编码序列优选包含至少一个核定位序列和/或NES。在一些实施方案中,宿主细胞包含组分(a)和(b)。如果适用,还可提供tracr序列。在一些实施方案中,组分(a)、组分(b)或者组分(a)和(b)被稳定地整合到宿主真核细胞的基因组中。在一些实施方案中,组分(a)还包含可操作地连接至第一调控元件并任选地被正向重复序列隔开的两个或更多个指导序列,其中所述两个或更多个指导序列中的每一者在表达时引导Cas12b CRISPR复合物与真核细胞中的不同靶序列的序列特异性结合。在一些实施方案中,Cas12b酶包含一个或多个核定位序列和/或核输出序列或NES,其强度足以驱动所述CRISPR酶以可检测的量积聚在真核细胞核内和/或外。
在一些实施方案中,指导分子与包含至少一个待编辑的靶腺苷残基的靶DNA链形成双链体。指导RNA分子与靶DNA链杂交后,腺苷脱氨酶与双链体结合并催化DNA-RNA双链体内包含的一个或多个靶腺苷残基的脱氨基。
此外,对PAM相互作用(PI)结构域的工程化可允许对PAM特异性进行编程,改善靶位点识别保真度并增加CRISPR-Cas蛋白的多功能性,例如如Kleinstiver BP等人,Engineered CRISPR-Cas9 nucleases with altered PAMspecificities.Nature.2015Jul 23;523(7561):481-5.doi:10.1038/nature14592中关于Cas9所述。如本文进一步详述,技术人员将理解,可类似地修饰C2c1蛋白。
在特定的实施方案中,选择指导序列以确保脱氨酶在要脱氨基的腺嘌呤上的最佳效率。可考虑靶链中腺嘌呤相对于C2c1切口酶的切割位点的位置。在特定的实施方案中,令人感兴趣的是确保切口酶将作用于在非靶链上待脱氨基的腺嘌呤附近。例如,在特定的实施方案中,Cas12b切口酶切割了PAM下游的非靶向链,并且可能感兴趣的是设计这样的指导物:对应于要脱氨基的腺嘌呤的胞嘧啶位于指导序列中在相应非靶链序列中的切口酶切割位点上游或下游10bp内。
递送
在一些实施方案中,CRISPR-Cas系统的组分可以各种形式递送,例如DNA/RNA或RNA/RNA或蛋白质RNA的组合。例如,C2c1蛋白可作为编码DNA的多核苷酸或编码RNA的多核苷酸或作为蛋白质被递送。所述指导物可作为DNA编码多核苷酸或RNA被递送。设想了所有可能的组合,包括混合的递送形式。
在一些方面,本发明提供了包括将一个或多个多核苷酸例如如本文所述的一个或多个载体、其一个或多个转录物和/或从其转录的一个或多个蛋白质递送至宿主细胞的方法。
作为递送媒介物的载体
重组表达载体可以适合在宿主细胞中表达核酸的形式包含本发明的核酸,这意味着重组表达载体包含一个或多个调控元件,所述调控元件可根据待用于表达的宿主细胞进行选择,所述核酸与待表达的核酸序列可操作地连接。在重组表达载体内,“可操作地连接”旨在是指目标核苷酸序列以允许核苷酸序列表达的方式(例如,在体外转录/翻译系统中或者当载体被引入宿主细胞中时在宿主细胞中)连接至调控元件。有利的载体包括慢病毒和腺相关病毒,并且也可选择这些载体的类型以靶向特定类型的细胞。
关于重组和克隆方法,提及美国专利申请10/815,730,2004年9月2日公开为US2004-0171156 A1,其内容通过引用整体并入本文。
术语“调控元件”旨在包括启动子、增强子、内部核糖体进入位点(IRES)和其他表达控制元件(例如,转录终止信号,例如聚腺苷酸化信号和poly-U序列)。此类调控元件描述于例如Goeddel,GENE EXPRESSION TECHNOLOGY:METHODS IN ENZYMOLOGY 185,AcademicPress,San Diego,Calif.(1990)中。调控元件包括在许多类型的宿主细胞中引导核苷酸序列组成性表达的那些和仅在某些宿主细胞中引导核苷酸序列表达的那些(例如组织特异性调控序列)。组织特异性启动子可引导主要在目标所需组织例如肌肉、神经元、骨骼、皮肤、血液、特定器官(例如肝、胰腺)或特定细胞类型(例如淋巴细胞)中表达。调控元件也可以时间依赖性的方式引导表达,例如以细胞周期依赖性或发育阶段依赖性的方式引导表达,其也可以是或可以不是组织或细胞类型特异性的。在一些实施方案中,载体包含一个或多个pol III启动子(例如1、2、3、4、5个或更多个pol III启动子),一个或多个pol II启动子(例如1、2、3、4、5个或更多个pol II启动子),一个或多个pol I启动子(例如1、2、3、4、5个或更多个pol I启动子)或其组合。pol III启动子的实例包括但不限于U6和H1启动子。pol II启动子的实例包括但不限于逆转录病毒劳斯肉瘤病毒(RSV)LTR启动子(任选地带有RSV增强子),巨细胞病毒(CMV)启动子(任选地带有CMV增强子)[参见例如Boshart等,Cell,41:521-530(1985)],SV40启动子,二氢叶酸还原酶启动子,β-肌动蛋白启动子,磷酸甘油激酶(PGK)启动子和EF1α启动子。术语“调控元件”还涵盖增强子元件,例如WPRE;CMV增强子;HTLV-I的LTR中的R-U5'区段(Mol.Cell.Biol.,第8(1)卷,第466-472期,1988);SV40增强子;以及兔β-珠蛋白的外显子2和3之间的内含子序列(Proc.Natl.Acad.Sci.USA.,第78(3)卷,第1527-31页,1981)。本领域技术人员将理解,表达载体的设计可取决于例如要转化的宿主细胞的选择、所需表达水平等因素。可将载体引入宿主细胞以从而产生由本文所述的核酸编码的转录物、蛋白质或肽,包括融合蛋白或肽(例如,成簇的规律间隔的短回文重复序列(CRISPR)转录物、蛋白质、酶、其突变体形式、其融合蛋白等)。关于调控序列,提及了美国专利申请10/491,026,其内容通过引用整体并入本文。关于启动子,提及了PCT公开WO 2011/028929和美国申请12/511,940,其内容通过引用整体并入本文。
有利的载体包括慢病毒和腺相关病毒,并且也可选择这类载体的类型以靶向特定类型的细胞。
在特定的实施方案中,使用双顺反子载体用于与腺苷脱氨酶融合的指导RNA和(任选地修饰或突变的)CRISPR-Cas蛋白。与腺苷脱氨酶融合的指导RNA和(任选地修饰或突变的)CRISPR-Cas蛋白的双顺反子表达载体是优选的。通常并且特别是在该实施方案中,与腺苷脱氨酶融合的(任选地修饰或突变的)CRISPR-Cas蛋白优选地由CBh启动子驱动。RNA可优选地由Pol III启动子,例如U6启动子驱动。理想地,将两者结合。
可设计载体以在原核或真核细胞中表达CRISPR转录物(例如核酸转录物、蛋白质或酶)。例如,CRISPR转录物可在细菌细胞如大肠杆菌、昆虫细胞(使用杆状病毒表达载体)、酵母细胞或哺乳动物细胞中表达。合适的宿主细胞在Goeddel,GENE EXPRESSIONTECHNOLOGY:METHODS IN ENZYMOLOGY 185,Academic Press,San Diego,Calif.(1990)中进一步讨论。或者,重组表达载体可在体外转录和翻译,例如使用T7启动子调控序列和T7聚合酶。
载体可在原核生物或原核细胞中引入并增殖。在一些实施方案中,原核生物用于扩增将要引入真核细胞的载体的拷贝,或在要引入真核细胞中的载体的生产中作为中间载体(例如,扩增质粒作为病毒载体包装系统的一部分)。在一些实施方案中,原核生物用于扩增载体的拷贝并表达一种或多种核酸,例如提供一种或多种蛋白质的来源以递送至宿主细胞或宿主生物体。蛋白质在原核生物中的表达最通常在大肠杆菌中与含有引导融合蛋白或非融合蛋白表达的组成型或诱导型启动子的载体一起进行。融合载体将许多氨基酸添加到其中编码的蛋白质上,例如添加到重组蛋白的氨基末端上。此类融合载体可提供一个或多个目的,例如:(i)增加重组蛋白的表达;(ii)增加重组蛋白的溶解度;以及(iii)通过在亲和纯化中充当配体来帮助重组蛋白的纯化。通常,在融合表达载体中,在融合部分和重组蛋白的连接处引入蛋白水解切割位点,以使得在纯化融合蛋白之后能够从融合部分分离重组蛋白。这些酶及其同源识别序列包括因子Xa、凝血酶和肠激酶。融合表达载体的实例包括pGEX(Pharmacia Biotech Inc;Smith和Johnson,1988.Gene 67:31-40)、pMAL(NewEngland Biolabs,Beverly,Mass.)和pRIT5(Pharmacia,Piscataway,N.J.),其将谷胱甘肽S-转移酶(GST)、麦芽糖E结合蛋白或蛋白质A分别与靶重组蛋白融合。合适的诱导型非融合大肠杆菌表达载体的实例包括pTrc(Amrann等人,(1988)Gene 69:301-315)和pET 11d(Studier等人,GENE EXPRESSION TECHNOLOGY:METHODS IN ENZYMOLOGY 185,AcademicPress,San Diego,Calif.(1990)60-89)。在一些实施方案中,载体是酵母表达载体。在酵母酿酒酵母中表达的载体的实例包括pYepSec1(Baldari等人,1987.EMBO J.6:229-234)、pMFa(Kuijan和Herskowitz,1982.Cell 30:933-943)、pJRY88(Schultz等人,1987.Gene54:113-123)、pYES2(Invitrogen Corporation,San Diego,Calif.)和picZ(InVitrogenCorp,San Diego,Calif.)。在一些实施方案中,载体使用杆状病毒表达载体驱动昆虫细胞中的蛋白质表达。可用于在培养的昆虫细胞(例如SF9细胞)中表达蛋白质的杆状病毒载体包括pAc系列(Smith等人,1983.Mol.Cell.Biol.3:2156-2165)和pVL系列(Lucklow和Summers,1989.Virology 170:31-39)。
在一些实施方案中,载体能够使用哺乳动物表达载体驱动哺乳动物细胞中一个或多个序列的表达。哺乳动物表达载体的实例包括pCDM8(Seed,1987.Nature 329:840)和pMT2PC(Kaufman等人,1987.EMBO J.6:187-195)。当用于哺乳动物细胞中时,表达载体的控制功能通常由一个或多个调控元件提供。例如,常用的启动子衍生自多瘤、腺病毒2、巨细胞病毒、猿猴病毒40以及本文公开和本领域已知的其他启动子。对于用于原核和真核细胞的其他合适的表达系统,参见例如Sambrook等人,MOLECULAR CLONING:ALABORATORY MANUAL.第2版,Cold Spring Harbor Laboratory,Cold Spring Harbor Laboratory Press,ColdSpring Harbor,N.Y.,1989的第16章和第17章。
在一些实施方案中,重组哺乳动物表达载体能够优先引导核酸在特定细胞类型中的表达(例如,组织特异性调控元件用于表达核酸)。组织特异性调控元件是本领域已知的。合适的组织特异性启动子的非限制性实例包括白蛋白启动子(肝特异性;Pinkert等人,1987.Genes Dev.1:268-277),淋巴样特异性启动子(Calame和Eaton,1988.Adv.Immunol.43:235-275),特别是T细胞受体的启动子(Winoto和Baltimore,1989.EMBO J.8:729-733)和免疫球蛋白(Baneiji等人,1983.Cell 33:729-740;Queen和Baltimore,1983.Cell 33:741-748),神经元特异性启动子(例如,神经丝启动子;Byrne和Ruddle,1989.Proc.Natl.Acad.Sci.USA 86:5473-5477),胰腺特异性启动子(Edlund等人,1985.Science 230:912-916)和乳腺特异性启动子(例如乳清启动子;美国专利第4,873,316号和欧洲申请公开第264,166号)。还涵盖发育调控的启动子,例如鼠类hox启动子(Kessel和Gruss,1990.Science 249:374-379)和α-甲胎蛋白启动子(Campes和Tilghman,1989.Genes Dev.3:537-546)。关于这些原核和真核载体,提及了美国专利6,750,059,其内容通过引用整体并入本文。本发明的其他实施方案可涉及病毒载体的使用,对此提及了美国专利申请13/092,085,其内容通过引用整体并入本文。组织特异性调控元件在本领域中是已知的,并且在这方面,提及了美国专利7,776,321,其内容通过引用整体整体并入本文。在一些实施方案中,调控元件可操作地连接至CRISPR系统的一个或多个元件,以驱动CRISPR系统的一个或多个元件的表达。
在一些实施方案中,将驱动核酸靶向系统的一个或多个元件表达的一个或多个载体引入宿主细胞,使得核酸靶向系统的元件的表达引导核酸靶向复合物在一个或多个靶位点的形成。例如,核酸靶向效应酶和核酸靶向指导RNA可各自可操作地连接至分开的载体上的分开的调控元件。可将核酸靶向系统的RNA递送至转基因核酸靶向效应蛋白动物或哺乳动物,例如,组成性或诱导性或条件性表达核酸靶向效应蛋白的动物或哺乳动物;或以其他方式表达核酸靶向效应蛋白或者具有含有核酸靶向效应蛋白的细胞的动物或哺乳动物,例如通过事先向其施用编码并表达体内核酸靶向效应蛋白的一个或多个载体。或者,可将由相同或不同调控元件表达的两个或更多个元件组合在单个载体中,而一个或多个额外载体提供不包含在第一载体中的核酸靶向系统的任何组分。组合在单个载体中的核酸靶向系统元件可以任何合适的方向排列,例如一个元件位于相对于第二元件的(“上游”)5'或相对于第二元件的(“下游”)3'。一个元件的编码序列可位于第二元件的编码序列的相同或相反链上,并以相同或相反的方向定向。在一些实施方案中,单个启动子驱动编码核酸靶向效应蛋白和核酸靶向指导RNA的转录物的表达,所述转录物嵌入一个或多个内含子序列内(例如,各自在不同的内含子中,两个或更多个在至少一个内含子中,或全部在单个内含子中)。在一些实施方案中,核酸靶向效应蛋白和核酸靶向指导RNA可以可操作地连接至同一启动子并从同一启动子表达。用于表达核酸靶向系统的一个或多个元件的递送媒介物、载体、粒子、纳米粒子、制剂及其组分如前述文件例如WO 2014/093622(PCT/US2013/074667)中所使用。在一些实施方案中,载体包含一个或多个插入位点,例如限制性核酸内切酶识别序列(也称为“克隆位点”)。在一些实施方案中,一个或多个插入位点(例如,约或大于约1、2、3、4、5、6、7、8、9、10个或更多个插入位点)位于一个或多个载体的一个或多个序列元件的上游和/或下游。当使用多个不同的指导序列时,单个表达构建体可用于将核酸靶向活性靶向细胞内的多个不同的相应靶序列。例如,单个载体可包含约或大于约1、2、3、4、5、6、7、8、9、10、15、20个或更多个指导序列。在一些实施方案中,可提供约或大于约1、2、3、4、5、6、7、8、9、10个或更多个这样的含指导序列的载体,并任选地递送至细胞。在一些实施方案中,载体包含与编码核酸靶向效应蛋白的酶编码序列可操作地连接的调控元件。核酸靶向效应蛋白或者一种或多种核酸靶向指导RNA可分开递送;并且有利地,这些中的至少一种经由粒子复合物递送。可在核酸靶向指导RNA之前递送核酸靶向效应蛋白mRNA,以留出时间表达核酸靶向效应蛋白。核酸靶向效应蛋白mRNA可在施用核酸靶向指导RNA之前1-12小时(优选约2-6小时)施用。或者,核酸靶向效应蛋白mRNA和核酸靶向指导RNA可一起施用。有利地,可在初次施用核酸靶向效应蛋白mRNA+指导RNA后1-12小时(优选约2-6小时)施用指导RNA的第二加强剂量。核酸靶向效应蛋白mRNA和/或指导RNA的其他施用可能对实现最有效的基因组修饰水平有用。
常规的基于病毒和非病毒的基因转移方法可用于将核酸引入哺乳动物细胞或靶组织中。此类方法可用于向培养中或宿主生物体中的细胞施用编码核酸靶向系统组分的核酸。非病毒载体递送系统包含DNA质粒,RNA(例如本文所述的载体的转录物),裸核酸和与例如脂质体的递送媒介物复合的核酸。病毒载体传递系统包含DNA和RNA病毒,它们在递送至细胞后具有游离或整合的基因组。关于基因治疗程序的综述,参见Anderson,Science 256:808-813(1992);Nabel和Felgner,TIBTECH 11:211-217(1993);Mitani和Caskey,TIBTECH11:162-166(1993);Dillon,TIBTECH 11:167-175(1993);Miller,Nature 357:455-460(1992);Van Brunt,Biotechnology 6(10):1149-1154(1988);Vigne,RestorativeNeurology and Neuroscience 8:35-36(1995);Kremer和Perricaudet,British MedicalBulletin 51(1):31-44(1995);Haddada等人,Current Topics in Microbiology andImmunology,Doerfler和
核酸的非病毒递送方法包括脂质转染、核转染、显微注射、生物弹射(biolistics)、病毒体、脂质体、免疫脂质体、聚阳离子或脂质:核酸缀合物、裸DNA、人工病毒体和试剂增强的DNA摄取。脂质转染描述于例如美国专利第5,049,386号、第4,946,787号;和第4,897,355号中并且脂质转染试剂在商业上出售(例如Transfectam
质粒递送涉及将指导RNA克隆到表达CRISPR-Cas蛋白的质粒中,并在细胞培养物中转染DNA。质粒骨架可商购获得并且不需要特定的设备。它们具有模块化的优势,能够携带不同大小的CRISPR-Cas编码序列(包括编码更大尺寸蛋白质的序列)以及选择标志物。同时,质粒的优点在于它们可确保瞬时但持续的表达。然而,质粒的递送并不是直接的,使得体内效率通常很低。持续表达也可能是不利的,因为它可增加脱靶编辑。另外,CRISPR-Cas蛋白的过量积累可能对细胞有毒。最后,质粒始终具有dsDNA在宿主基因组中随机整合的风险,更特别是考虑到产生双链断裂(在靶和脱靶)的风险。
脂质:核酸复合物(包括靶向脂质体,例如免疫脂质复合物)的制备是本领域技术人员众所周知的(参见例如Crystal,Science 270:404-410(1995);Blaese等人,CancerGene Ther.2:291-297(1995);Behr等人,Bioconjugate Chem.5:382-389(1994);Remy等人,Bioconjugate Chem.5:647-654(1994);Gao等人,Gene Therapy 2:710-722(1995);Ahmad等人,Cancer Res.52:4817-4820(1992);美国专利第4,186,183号、第4,217,344号、第4,235,871号、第4,261,975号、第4,485,054号、第4,501,728号、第4,774,085号、第4,837,028号和第4,946,787号)。这将在下面更详细地讨论。
使用基于RNA或DNA病毒的系统来递送核酸利用了将病毒靶向体内的特定细胞并将病毒有效载荷运输至细胞核的高度进化的过程。病毒载体可直接施用于患者(体内),或者它们可用于体外治疗细胞,并且修饰的细胞可任选地施用于患者(离体)。常规的基于病毒的系统可包括逆转录病毒、慢病毒、腺病毒、腺相关病毒和单纯疱疹病毒载体,用于基因转移。用逆转录病毒、慢病毒和腺相关病毒基因转移方法可整合到宿主基因组中,这通常会导致插入的转基因的长期表达。另外,已在许多不同的细胞类型和靶组织中观察到高转导效率。
逆转录病毒的嗜性可通过并入外来包膜蛋白,扩大靶细胞的潜在靶标群体来改变。慢病毒载体是能够转导或感染非分裂细胞并通常产生高病毒滴度的逆转录病毒载体。因此,逆转录病毒基因转移系统的选择将取决于靶组织。逆转录病毒载体由顺式作用的长末端重复序列组成,其包装能力高达6-10kb的外来序列。最小的顺式作用LTR足以复制和包装载体,然后将其用于将治疗性基因整合到靶细胞中以提供永久性转基因表达。广泛使用的逆转录病毒载体包括基于鼠类白血病病毒(MuLV)、长臂猿白血病病毒(GaLV)、猿猴免疫缺陷病毒(SIV)、人免疫缺陷病毒(HIV)及其组合的载体(参见例如Buchscher等人,J.Virol.66:2731-2739(1992);Johann等人,J.Virol.66:1635-1640(1992);Sommnerfelt等人,Virol.176:58-59(1990);Wilson等人,J.Virol.63:2374-2378(1989);Miller等人,J.Virol.65:2220-2224(1991);PCT/US94/05700)。
在优选瞬时表达的应用中,可使用基于腺病毒的系统。基于腺病毒的载体在许多细胞类型中都能够实现很高的转导效率并且不需要细胞分裂。利用这样的载体,已经获得了高滴度和表达水平。该载体可在相对简单的系统中大量产生。腺相关病毒(“AAV”)载体也可用于用靶核酸转导细胞,例如,在核酸和肽的体外生产中,以及用于体内和离体基因治疗程序(参见例如West等人,Virology 160:38-47(1987);美国专利第4,797,368号;WO 93/24641;Kotin,Human Gene Therapy 5:793-801(1994);Muzyczka,J.Clin.Invest.94:1351(1994))。重组AAV载体的构建描述于许多出版物,包括美国专利第5,173,414号;Tratschin等人,Mol.Cell.Biol.5:3251-3260(1985);Tratschin等人,Mol.Cell.Biol.4:2072-2081(1984);Hermonat和Muzyczka,PNAS81:6466-6470(1984);以及Samulski等人,J.Virol.63:03822-3828(1989)。
本发明提供了AAV,其包含以下或基本上由以下组成:编码CRISPR系统的外源核酸分子,例如,多个包含第一盒或由第一盒组成的盒,所述第一盒包含以下或基本上由以下组成:启动子,编码CRISPR相关(Cas)蛋白(假定核酸酶或解旋酶蛋白)的核酸分子,例如,C2c1和终止子,以及一个或多个,有利地多达载体的包装大小极限,例如,总共五个盒(包括第一盒),所述盒包含以下或基本上由以下组成:启动子,编码指导RNA(gRNA)的核酸分子和终止子(例如,每个盒示意性表示为启动子-gRNA1-终止子,启动子-gRNA2-终止子...启动子-gRNA(N)-终止子,其中N是可插入的载体的包装大小极限的上限的数目),或两个或更多个单独的rAAV,每个rAAV含有一个或多于一个CRISPR系统的盒,例如,第一rAAV,其含有第一盒,所述第一盒包含以下或基本上由以下组成:启动子,编码Cas的核酸分子,例如Cas(C2c1)和终止子,和第二rAAV,其含有一个或多个盒,每个盒包含以下或基本上由以下组成:启动子,编码指导RNA(gRNA)的核酸分子和终止子(例如,每个盒示意性表示为启动子-gRNA1-终止子,启动子-gRNA2-终止子...启动子-gRNA(N)-终止子,其中N是可插入的载体的包装大小极限的上限的数目)。或者,由于C2c1可处理其自身的crRNA/gRNA,因此单个crRNA/gRNA阵列可用于多重基因编辑。因此,并非包含多个盒来递送gRNA,rAAV可含有单个盒,所述盒包含以下或基本上由以下组成:启动子,多个crRNA/gRNA和终止子(例如,示意性表示为启动子-gRNA1-gRNA2…gRNA(N)-终止子,其中N是可插入的载体的包装大小极限的上限的数目)。参见Zetsche等人,Nature Biotechnology 35,31-34(2017),其通过引用整体并入本文。由于rAAV是DNA病毒,因此本文关于AAV或rAAV的讨论中的核酸分子有利地是DNA。在一些实施方案中,启动子有利地是人突触蛋白I启动子(hSyn)。用于将核酸递送至细胞的其他方法是本领域技术人员已知的。参见例如US20030087817,其通过引用并入本文。
在另一个实施方案中,考虑了科卡尔水疱病毒(Cocal vesiculovirus)包膜假型逆转录病毒载体粒子(参见例如转让给Fred Hutchinson Cancer Research Center的美国专利公开第20120164118号)。科卡尔病毒属于水疱病毒属,并且是哺乳动物中的水疱性口炎的病原体。科卡尔病毒最初是从特立尼达的螨虫中分离出来的(Jonkers等人,Am.J.Vet.Res.25:236-242(1964)),并且已经在特立尼达、巴西和阿根廷从昆虫、牛和马中鉴定出感染。已经从自然感染的节肢动物中分离出许多使哺乳动物感染的水疱病毒,这表明它们是媒介传播的。在地方性和实验室获得病毒的农村地区,人们普遍获得水疱病毒抗体;人类感染通常会导致类似流感的症状。科卡尔病毒包膜糖蛋白在氨基酸水平上与VSV-GIndiana共有71.5%的同一性,并且水疱病毒包膜基因的系统发育比较显示,科卡尔病毒与水疱病毒中的VSV-G Indiana菌株在血清学上有所区别,但最密切相关。Jonkers等人,Am.J.Vet.Res.25:236-242(1964)和Travassos da Rosa等人,Am.J.Tropical Med.&Hygiene 33:999-1006(1984)。科卡尔水疱病毒包膜假型逆转录病毒载体粒子可包括例如慢病毒、α逆转录病毒、β逆转录病毒、γ逆转录病毒、δ逆转录病毒和ε逆转录病毒载体粒子,其可包含逆转录病毒Gag、Pol和/或一种或多种辅助蛋白和科卡尔水疱病毒包膜蛋白。在这些实施方案的某些方面,Gag、Pol和辅助蛋白是慢病毒和/或γ逆转录病毒。
在一些实施方案中,用本文所述的一个或多个载体瞬时或非瞬时转染宿主细胞。在一些实施方案中,当细胞天然存在于受试者中时,将细胞转染,任选地将其重新引入其中。在一些实施方案中,转染的细胞取自受试者。在一些实施方案中,细胞是源自取自受试者的细胞,例如细胞系。用于组织培养的广泛多种细胞系是本领域已知的。细胞系的实例包括但不限于C8161、CCRF-CEM、MOLT、mIMCD-3、NHDF、HeLa-S3、Huh1、Huh4、Huh7、HUVEC、HASMC、HEKn、HEKa、MiaPaCell、Panc1、PC-3、TF1、CTLL-2、C1R、Rat6、CV1、RPTE、A10、T24、J82、A375、ARH-77、Calu1、SW480、SW620、SKOV3、SK-UT、CaCo2、P388D1、SEM-K2、WEHI-231、HB56、TIB55、Jurkat、J45.01、LRMB、Bcl-1、BC-3、IC21、DLD2、Raw264.7、NRK、NRK-52E、MRC5、MEF、Hep G2、HeLa B、HeLa T4、COS、COS-1、COS-6、COS-M6A、BS-C-1猴肾上皮、BALB/3T3小鼠胚胎成纤维细胞、3T3Swiss、3T3-L1、132-d5人胎儿成纤维细胞;10.1小鼠成纤维细胞、293-T、3T3、721、9L、A2780、A2780ADR、A2780cis、A172、A20、A253、A431、A-549、ALC、B16、B35、BCP-1细胞、BEAS-2B、bEnd.3、BHK-21、BR 293、BxPC3、C3H-10T1/2、C6/36、Cal-27、CHO、CHO-7、CHO-IR、CHO-K1、CHO-K2、CHO-T、CHO Dhfr-/-、COR-L23、COR-L23/CPR、COR-L23/5010、COR-L23/R23、COS-7、COV-434、CML T1、CMT、CT26、D17、DH82、DU145、DuCaP、EL4、EM2、EM3、EMT6/AR1、EMT6/AR10.0、FM3、H1299、H69、HB54、HB55、HCA2、HEK-293、HeLa、Hepa1c1c7、HL-60、HMEC、HT-29、Jurkat、JY细胞、K562细胞、Ku812、KCL22、KG1、KYO1、LNCap、Ma-Mel 1-48、MC-38、MCF-7、MCF-10A、MDA-MB-231、MDA-MB-468、MDA-MB-435、MDCK II、MDCK II、MOR/0.2R、MONO-MAC 6、MTD-1A、MyEnd、NCI-H69/CPR、NCI-H69/LX10、NCI-H69/LX20、NCI-H69/LX4、NIH-3T3、NALM-1、NW-145、OPCN/OPCT细胞系、Peer、PNT-1A/PNT 2、RenCa、RIN-5F、RMA/RMAS、Saos-2细胞、Sf-9、SkBr3、T2、T-47D、T84、THP1细胞系、U373、U87、U937、VCaP、Vero细胞、WM39、WT-49、X63、YAC-1、YAR及其转基因品种。细胞系可从本领域技术人员已知的多种来源获得(参见例如美国典型培养物保藏中心(ATCC)(Manassus,Va.))。
在特定的实施方案中,AD官能化的CRISPR系统的一种或多种组分的瞬时表达和/或存在可以是令人感兴趣的,例如以降低脱靶效应。在一些实施方案中,用本文所述的一个或多个载体转染的细胞用于建立包含一个或多个载体衍生序列的新细胞系。在一些实施方案中,用如本文所述的AD官能化的CRISPR系统的组分瞬时转染(例如通过一个或多个载体的瞬时转染,或用RNA转染)并通过CRISPR复合物的活性进行修饰的细胞用于建立新细胞系,所述新细胞系包含含有修饰但缺乏任何其他外源序列的细胞。在一些实施方案中,用本文所述的一个或多个载体瞬时或非瞬时转染的细胞,或衍生自此类细胞的细胞系用于评估一种或多种测试化合物。
在一些实施方案中,设想将RNA和/或蛋白质直接引入宿主细胞。例如,可将CRISPR-Cas蛋白作为编码mRNA与体外转录的指导RNA一起递送。此类方法可减少确保CRISPR-Cas蛋白作用的时间,并进一步防止CRISPR系统组分的长期表达。
在一些实施方案中,本发明的RNA分子以脂质体或lipofectin制剂等形式递送,并且可通过本领域技术人员众所周知的方法来制备。这类方法描述于例如美国专利第5,593,972号、第5,589,466号和第5,580,859号,所述专利通过引用并入本文。已经开发了专门针对增强和改善siRNA进入哺乳动物细胞的递送的递送系统(参见例如Shen等人,FEBSLet.2003,539:111-114;Xia等人,Nat.Biotech.2002,20:1006-1010;Reich等人,Mol.Vision.2003,9:210-216;Sorensen等人,J.Mol.Biol.2003,327:761-766;Lewis等人,Nat.Gen.2002,32:107-108;以及Simeoni等人,NAR 2003,31,11:2717-2724),并且可应用于本发明。siRNA最近已成功地用于抑制灵长类动物中的基因表达(参见例如Tolentino等人,Retina 24(4):660),其也可应用于本发明。
实际上,RNA递送是体内递送的有用方法。可使用脂质体或粒子将CcC1、腺苷脱氨酶和指导RNA递送至细胞中。因此,CRISPR-Cas蛋白(例如C2c1)的递送,腺苷脱氨酶(其可与CRISPR-Cas蛋白或衔接子蛋白融合)的递送和/或本发明的RNA的递送可为RNA形式并经由微囊泡、脂质体或粒子或纳米粒子。例如,可将C2c1 mRNA、腺苷脱氨酶mRNA和指导RNA包装到脂质体粒子中以在体内递送。脂质体转染试剂,例如来自Life Technologies的lipofectamine和市场上的其他试剂,可有效地将RNA分子递送至肝脏中。
RNA的递送方式还优选包括经由粒子(Cho,S.,Goldberg,M.,Son,S.,Xu,Q.,Yang,F.,Mei,Y.,Bogatyrev,S.,Langer,R.和Anderson,D.,Lipid-like nanoparticles forsmall interfering RNA delivery to endothelial cells,Advanced FunctionalMaterials,19:3112-3118,2010)或外泌体(Schroeder,A.,Levins,C.,Cortez,C.,Langer,R.和Anderson,D.,Lipid-based nanotherapeutics for siRNA delivery,Journal ofInternal Medicine,267:9-21,2010,PMID:20059641)递送RNA。实际上,已显示外泌体在递送siRNA中特别有用,它是与CRISPR系统有些相似的系统。例如,El-Andaloussi S等人,(“Exosome-mediated delivery of siRNA in vitro and in vivo.”Nat Protoc.2012年12月;7(12):2112-26.doi:10.1038/nprot.2012.131.电子出版于2012年11月15日)描述了外泌体如何成为有前途的工具用于跨不同生物屏障的药物递送,并且可用于体外和体内siRNA的递送。他们的方法是通过转染包含与肽配体融合的外泌体蛋白的表达载体来生成靶向外泌体。然后将外泌体纯化并从转染的细胞上清液中表征,然后将RNA装载到外泌体中。根据本发明的递送或施用可用外泌体进行,特别是但不限于大脑。维生素E(α-生育酚)可与CRISPR Cas缀合并与高密度脂蛋白(HDL)一起递送至大脑,例如,采用与Uno等人(HUMAN GENE THERAPY 22:711-719(2011年6月))类似的方式,用于向大脑递送短干扰RNA(siRNA)。经由充满磷酸盐缓冲盐水(PBS)或游离TocsiBACE或Toc-siBACE/HDL并与脑输注试剂盒3(Alzet)连接的Osmotic微型泵(型号1007D;Alzet,Cupertino,CA)向小鼠输注。将脑输注套管放置在前囟后面约0.5mm的中线处,以输注到第三脑室背侧。Uno等人发现,通过相同的ICV输注方法,低至3nmol的含HDL的Toc-siRNA可以相当程度诱导靶标减少。在本发明中,对于人类,可考虑缀合至α-生育酚并与靶向脑的HDL共同施用的相似剂量的CRISPRCas,例如,可考虑约3nmol至约3μmol的靶向脑的CRISPR Cas。Zou等人((HUMAN GENETHERAPY 22:465-475(2011年4月))描述了一种慢病毒介导的靶向PKCγ的短发夹RNA的递送方法,以在大鼠的脊髓中进行体内基因沉默。Zou等人通过鞘内导管施用了约10μl的重组慢病毒,滴度为1×109转导单位(TU)/ml。在本发明中,人类可考虑在靶向脑的慢病毒载体中表达的相似剂量的CRISPR Cas,例如,可考虑在滴度为1×109转导单位(TU)/ml的慢病毒中约10-50ml的靶向脑的CRISPR Cas。
载体的剂量
在一些实施方案中,载体,例如质粒或病毒载体通过例如肌内注射递送至目标组织,而其他时间递送是经由静脉内、透皮、鼻内、口服、粘膜或其他递送方法。这种递送可以是经由单剂量或多剂量。本领域技术人员理解,本文中所递送的实际剂量可根据多种因素而有很大变化,例如载体选择、靶细胞、生物体或组织、待治疗受试者的一般情况、所寻求的转化/修饰的程度、施用途径、施用模式、所寻求的转化/修饰的类型等。
这样的剂量还可包含例如载体(水、盐水、乙醇、甘油、乳糖、蔗糖、磷酸钙、明胶、葡聚糖、琼脂、果胶、花生油、芝麻油等),稀释剂,药学上可接受的载体(例如磷酸盐缓冲盐水),药学上可接受的赋形剂和/或本领域已知的其他化合物。所述剂量还可包含一种或多种药学上可接受的盐,例如,无机酸盐如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;以及有机酸盐如乙酸盐、丙酸盐、丙二酸、苯甲酸盐等。此外,其中还可存在辅助物质,例如润湿剂或乳化剂、pH缓冲物质、凝胶或胶凝材料、调味剂、着色剂、微球、聚合物、悬浮剂等。另外,还可存在一种或多种其他常规药物成分,例如防腐剂、保湿剂、悬浮剂、表面活性剂、抗氧化剂、抗结块剂、填充剂、螯合剂、包衣剂、化学稳定剂等,尤其是在剂型为可复原形式时。合适的示例性成分包括微晶纤维素、羧甲基纤维素钠、聚山梨酸酯80、苯乙醇、氯丁醇、山梨酸钾、山梨酸、二氧化硫、没食子酸丙酯、对羟基苯甲酸酯、乙基香兰素、甘油、苯酚、对氯苯酚、明胶、白蛋白及其组合。药学上可接受的赋形剂的详细讨论可在REMINGTON'S PHARMACEUTICALSCIENCES(Mack Pub.Co.,N.J.1991)中获得,其通过引用并入本文。
在本文的一个实施方案中,递送是经由腺病毒进行的,其可为含有至少1×10
在本文的一个实施方案中,递送是经由AAV进行的。据认为用于向人类体内递送AAV的治疗有效剂量在约20至约50ml盐水溶液的范围内,所述盐水溶液含有约1×10
在本文的一个实施方案中,递送是经由质粒进行的。在这种质粒组合物中,剂量应为足以引起应答的质粒的量。例如,质粒组合物中质粒DNA的合适量可以是每70kg个体约0.1至约2mg、或约1μg至约10μg。本发明的质粒通常将包含(i)启动子;(ii)与所述启动子可操作地连接的编码CRISPR-Cas蛋白的序列;(iii)可选择标志物;(iv)复制起点;和(v)在(ii)下游并与其可操作地连接的转录终止子。所述质粒还可编码CRISPR复合物的RNA组分,但是这些中的一者或多者可以替代地在不同的载体上编码。
本文的剂量是基于平均70kg的个体。施用频率在医学或兽医从业者(例如,医师、兽医)或本领域技术人员的能力范围内。还应注意的是,实验中使用的小鼠通常为约20g,并且根据小鼠实验,可以扩展到70kg的个体。
用于本文提供的组合物的剂量包括用于重复施用或重复给药的剂量。在特定的实施方案中,在数周、数月或数年的时期内重复施用。可进行合适的测定以获得最佳剂量方案。重复施用可允许使用较低剂量,这可以积极影响脱靶修饰。
在特定的实施方案中,使用基于RNA的递送。在这些实施方案中,将CRISPR-Cas蛋白的mRNA、腺苷脱氨酶的mRNA(其可与CRISPR-Cas蛋白或衔接子融合)与体外转录的指导RNA一起递送。Liang等人描述了使用基于RNA的递送进行有效的基因组编辑(ProteinCell.2015年5月;6(5):363-372)。在一些实施方案中,编码C2c1和/或腺苷脱氨酶的mRNA可被化学修饰,与质粒编码的C2c1和/或腺苷脱氨酶相比,这可导致活性提高。例如,mRNA中的尿苷可被假尿苷(Ψ)、N1-甲基假尿苷(me1Ψ)、5-甲氧基尿苷(5moU)部分地或完全地取代。参见Li等人,Nature Biomedical Engineering 1,0066DOI:10.1038/s41551-017-0066(2017),其通过引用整体并入本文。
示例性递送方法
在特定的实施方案中,预复合的指导RNA、CRISPR-Cas蛋白和腺苷脱氨酶(其可与CRISPR-Cas蛋白或衔接子融合)作为核糖核蛋白(RNP)递送。RNP的优势在于,与RNA方法相比,它们甚至导致更快的编辑效果,因为该过程避免了转录的需要。一个重要的优点是RNP传递都是短暂的,从而减少了脱靶效应和毒性问题。通过以下已观察到在不同细胞类型中的有效基因组编辑:Kim等人,(2014,Genome Res.24(6):1012-9);Paix等人,(2015,Genetics 204(1):47-54);Chu等人,(2016,BMC Biotechnol.16:4);和Wang等人,(2013,Cell.9;153(4):910-8)。
在特定的实施方案中,如WO2016161516中所述,通过基于多肽的穿梭剂递送核糖核蛋白。WO2016161516描述了使用包含内体泄漏结构域(ELD)的合成肽对多肽货物的有效转导,所述内体泄漏结构域(ELD)可操作地连接至细胞穿透域(CPD)、富含组氨酸的结构域和CPD。类似地,这些多肽可用于在真核细胞中递送基于CRISPR-效应子的RNP。
在一些方面或实施方案中,可使用包含递送粒子制剂的组合物。在一些方面或实施方案中,所述制剂包含CRISPR复合物,所述复合物包含CRISPR蛋白和引导所述CRISPR复合物与靶序列的序列特异性结合的指导物。在一些实施方案中,递送粒子包括基于脂质的粒子,任选地脂质纳米粒子,或阳离子脂质和任选地可生物降解的聚合物。在一些实施方案中,阳离子脂质包含1,2-二油酰基-3-三甲基铵-丙烷(DOTAP)。在一些实施方案中,亲水性聚合物包括乙二醇或聚乙二醇。在一些实施方案中,递送粒子还包含脂蛋白,优选胆固醇。在一些实施方案中,递送粒子的直径小于500nm,任选地直径小于250nm,任选地直径小于100nm,任选地直径为约35nm至约60nm。
已知若干类型的粒子递送系统和/或制剂可用于多种生物医学应用。通常,粒子被定义为一个小物体,就其传输和性质而言,它表现为整个单元。粒子根据直径进一步分类。粗粒子的覆盖范围在2,500至10,000纳米之间。细粒子的尺寸在100至2,500纳米之间。超细粒子或纳米粒子的尺寸通常在1至100纳米之间。100nm限度的基础在于如下事实:可将粒子与块状材料区分开的新颖性质通常会在100nm以下的临界长度尺度上发展。
如本文所用,粒子递送系统/制剂定义为包括根据本发明的粒子的任何生物递送系统/制剂。根据本发明的粒子是最大尺寸(例如直径)小于100微米(μm)的任何实体。在一些实施方案中,本发明的粒子的最大尺寸小于10μm。在一些实施方案中,本发明的粒子的最大尺寸小于2000纳米(nm)。在一些实施方案中,本发明的粒子的最大尺寸小于1000纳米(nm)。在一些实施方案中,本发明的粒子的最大尺寸小于900nm、800nm、700nm、600nm、500nm、400nm、300nm、200nm或100nm。通常,本发明的粒子的最大尺寸(例如直径)为500nm或更小。在一些实施方案中,本发明的粒子的最大尺寸(例如直径)为250nm或更小。在一些实施方案中,本发明的粒子的最大尺寸(例如直径)为200nm或更小。在一些实施方案中,本发明的粒子的最大尺寸(例如直径)为150nm或更小。在一些实施方案中,本发明的粒子的最大尺寸(例如直径)为100nm或更小。在本发明的一些实施方案中使用较小的粒子,例如最大尺寸为50nm或更小。在一些实施方案中,本发明的粒子的最大尺寸范围在25nm至200nm之间。
就本发明而言,优选具有CRISPR复合物的一种或多种组分,例如CRISPR-Cas蛋白或mRNA,或腺苷脱氨酶(其可与CRISPR-Cas蛋白或衔接子融合)或mRNA,或使用纳米粒子或脂质包膜递送的指导RNA。其他递送系统或载体可结合本发明的粒子方面使用。
通常,“纳米粒子”是指直径小于1000nm的任何粒子。在某些实施方案中,本发明的纳米粒子具有500nm或更小的最大尺寸(例如直径)。在其他实施方案中,本发明的纳米粒子具有在25nm至200nm范围内的最大尺寸。在其他实施方案中,本发明的纳米粒子具有100nm或更小的最大尺寸。在其他实施方案中,本发明的纳米粒子具有在35nm至60nm范围内的最大尺寸。应当理解,在适当的情况下,本文中对粒子或纳米粒子的提及可以互换。
将理解的是,粒子的大小将取决于在装载之前或之后测量而有所不同。因此,在特定的实施方案中,术语“纳米粒子”可仅应用于预装载的粒子。
本发明涵盖的粒子可以不同的形式提供,例如作为固体粒子(例如金属,例如银、金、铁、钛),非金属,基于脂质的固体,聚合物),粒子的悬浮液或其组合。可制备金属、电介质和半导体粒子以及杂合结构(例如核-壳粒子)。如果由半导体材料制成的粒子足够小(通常小于10nm),使得可进行电子能级的量化,则也可将所述粒子标记为量子点。这样的纳米级粒子在生物医学应用中用作药物载体或成像剂,并且可适于本发明中的类似目的。
已经制造了半固体和软粒子,并且它们在本发明的范围内。半固体性质的原型粒子是脂质体。当前,临床上将各种类型的脂质体粒子用作抗癌药物和疫苗的递送系统。具有一半亲水性而另一半疏水性的粒子被称为Janus粒子,并且对于乳液稳定特别有效。它们可在水/油界面处自组装并充当固体表面活性剂。
粒子表征(包括例如表征形态、尺寸等)是使用多种不同技术完成的。常用技术是电子显微镜(TEM、SEM),原子力显微镜(AFM),动态光散射(DLS),X射线光电子能谱(XPS),粉末X射线衍射(XRD),傅里叶变换红外光谱(FTIR),基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF),紫外可见光谱,双极化干涉仪和核磁共振(NMR)。可针对天然粒子(即,预装载)或在装载货物(此处货物是指例如CRISPR-Cas系统的一种或多种组分,例如CRISPR-Cas蛋白或mRNA、腺苷脱氨酶(其可与CRISPR-Cas蛋白或衔接子融合)或mRNA、或指导RNA或其任何组合,并且可能包含其他载体和/或赋形剂)之后进行表征(尺寸测量),以提供最佳尺寸的粒子以递送用于本发明的任何体外、离体和/或体内应用。在某些优选的实施方案中,粒子尺寸(例如直径)表征是基于使用动态激光散射(DLS)的测量。提及美国专利第8,709,843号;美国专利第6,007,845号;美国专利第5,855,913号;美国专利第5,985,309号;美国专利第5,543,158号;以及出版物James E.Dahlman和Carmen Barnes等人,NatureNanotechnology(2014),在线出版于2014年5月11日,doi:10.1038/nnano.2014.84,涉及粒子、其制备和使用方法及其测量。
本发明范围内的粒子递送系统可以任何形式提供,包括但不限于固体、半固体、乳液或胶体粒子。因而,本文所述的任何递送系统(包括但不限于例如基于脂质的系统、脂质体、胶束、微囊泡、外泌体或基因枪)可作为本发明范围内的粒子递送系统提供。
CRISPR-Cas蛋白mRNA、腺苷脱氨酶(其可与CRISPR-Cas蛋白或衔接子融合)或mRNA以及指导RNA可使用粒子或脂质包膜同时递送;例如,本发明的CRISPR-Cas蛋白和RNA,例如作为复合物,可如Dahlman等人,WO2015089419A2及其中引用的文献中经由粒子递送,例如7C1(参见例如James E.Dahlman和Carmen Barnes等人,Nature Nanotechnology(2014),在线出版于2014年5月11日,doi:10.1038/nnano.2014.84),例如,包含脂质或类脂质和亲水性聚合物(例如阳离子脂质和亲水性聚合物)的递送粒子,例如其中所述阳离子脂质包括1,2-二油酰基-3-三甲基铵-丙烷(DOTAP)或1,2-双十四烷酰基-sn-甘油-3-磷酸胆碱(DMPC)和/或其中所述亲水性聚合物包括乙二醇或聚乙二醇(PEG);和/或其中所述粒子还包含胆固醇(例如,来自制剂1的粒子=DOTAP 100,DMPC 0,PEG 0,胆固醇0;制剂编号2=DOTAP90,DMPC 0,PEG 10,胆固醇0;制剂编号3=DOTAP 90,DMPC 0,PEG 5,胆固醇5),其中使用高效的多步方法形成粒子,其中首先将效应蛋白和RNA例如以1:1的摩尔比,例如在室温下,例如在无菌的无核酸酶的1X PBS中混合在一起,例如持续30分钟;并且分别将适用于制剂的DOTAP、DMPC、PEG和胆固醇溶解在醇(例如100%乙醇)中;并且,将两种溶液混合在一起,形成含有复合物的粒子)。
可使用粒子或脂质包膜同时递送核酸靶向效应蛋白(例如,V型蛋白,例如C2c1)mRNA和指导RNA。合适的粒子的实例包括但不限于US 9,301,923中描述的那些。
例如,Su X,Fricke J,Kavanagh DG,Irvine DJ(“In vitro and in vivo mRNAdelivery using lipid-enveloped pH-responsive polymer nanoparticles”MolPharm.2011年6月6日;8(3):774-87.doi:10.1021/mp100390w.电子出版于2011年4月1日)描述了具有可生物降解的核-壳结构的粒子,所述粒子具有被磷脂双层壳包围的聚(β-氨基酯)(PBAE)核。这些被开发用于体内mRNA递送。选择pH响应性PBAE组分以促进内体破坏,而选择脂质表面层以最大程度地降低聚阳离子核的毒性。因此,这对于递送本发明的RNA是优选的。
在一个实施方案中,考虑了基于自组装生物粘附性聚合物的粒子/纳米粒子,其可应用于口服递送肽,静脉内递送肽和经鼻递送肽,都递送至大脑。还考虑了其他实施方案,例如疏水性药物的口服吸收和眼部递送。分子包膜技术涉及工程化的聚合物包膜,该聚合物包膜受到保护并递送至疾病部位(参见例如Mazza,M.等人,ACSNano,2013.7(2):1016-1026;Siew,A.等人,Mol Pharm,2012.9(1):14-28;Lalatsa,A.等人,J Contr Rel,2012.161(2):523-36;Lalatsa,A.等人,Mol Pharm,2012.9(6):1665-80;Lalatsa,A.等人,Mol Pharm,2012.9(6):1764-74;Garrett,N.L.等人,J Biophotonics,2012.5(5-6):458-68;Garrett,N.L.等人,J Raman Spect,2012.43(5):681-688;Ahmad,S.等人,J Royal SocInterface 2010.7:S423-33;Uchegbu,I.F.Expert Opin Drug Deliv,2006.3(5):629-40;Qu,X.等人,Biomacromolecules,2006.7(12):3452-9;以及Uchegbu,I.F.等人,Int JPharm,2001.224:185-199)。预期约5mg/kg的剂量,根据靶组织,利用单剂量或多剂量。
在一个实施方案中,由MIT的Dan Anderson实验室开发的可递送RNA至癌细胞以阻止肿瘤生长的粒子/纳米粒子可使用/和或适于本发明的AD官能化的CRISPR-Cas系统。特别是,Anderson实验室开发了用于合成、纯化、表征和配制新生物材料和纳米制剂的全自动组合系统。参见例如Alabi等人,Proc Natl Acad Sci U S A.2013年8月6日;110(32):12881-6;Zhang等人,Adv Mater.2013年9月6日;25(33):4641-5;Jiang等人,Nano Lett.2013年3月13日;13(3):1059-64;Karagiannis等人,ACS Nano.2012年10月23日;6(10):8484-7;Whitehead等人,ACS Nano.2012年8月28日;6(8):6922-9;以及Lee等人,NatNanotechnol.2012年6月3日;7(6):389-93。
美国专利申请20110293703涉及类脂质化合物在多核苷酸的施用中也特别有用,其可用于递送本发明的AD官能化的CRISPR-Cas系统。在一个方面,将氨基醇类脂质化合物与试剂结合以递送至细胞或受试者以形成微粒、纳米粒子、脂质体或胶束。由粒子、脂质体或胶束递送的试剂可以是气体、液体或固体的形式,并且所述试剂可以是多核苷酸、蛋白质、肽或小分子。氨基醇类脂质化合物可与其他氨基醇类脂质化合物、聚合物(合成的或天然的)、表面活性剂、胆固醇、碳水化合物、蛋白质、脂质等组合形成粒子。然后可将这些粒子任选地与药物赋形剂组合以形成药物组合物。
美国专利公开第20110293703号也提供了制备氨基醇类脂质化合物的方法。使一个或多个当量的胺与一个或多个当量的环氧基封端的化合物在合适的条件下反应,以形成本发明的氨基醇类脂质化合物。在某些实施方案中,胺的所有氨基与环氧基封端的化合物完全反应以形成叔胺。在其他实施方案中,胺的所有氨基不与环氧基封端的化合物完全反应形成叔胺,从而在氨基醇类脂质化合物中产生伯胺或仲胺。这些伯胺或仲胺保持原样,或者可与另一种亲电子试剂(例如不同的环氧基封端的化合物)反应。如本领域技术人员将理解的,使胺与少于过量的环氧基封端的化合物反应将产生具有不同数目的尾部的多种不同的氨基醇类脂质化合物。某些胺可能被两个环氧化物衍生的化合物尾部完全官能化,而其他分子将不会被环氧化物衍生的化合物尾部完全官能化。例如,二胺或多胺可包括一个、两个、三个或四个环氧化物衍生的化合物,其尾部在分子的各个氨基部分上,从而产生伯胺、仲胺和叔胺。在某些实施方案中,所有氨基均未完全官能化。在某些实施方案中,使用两种相同类型的环氧基封端的化合物。在其他实施方案中,使用两种或更多种不同的环氧基封端的化合物。氨基醇类脂质化合物的合成在有或没有溶剂的情况下进行,并且所述合成可在30-100℃、优选约50-90℃范围内的较高温度下进行。所制备的氨基醇类脂质化合物可任选地纯化。例如,可将氨基醇类脂质化合物的混合物纯化,以产生具有特定数量的环氧化物衍生的化合物尾部的氨基醇类脂质化合物,或者可将混合物纯化以产生特定的立体异构体或区域异构体。氨基醇类脂质化合物也可使用烷基卤化物(例如甲基碘)或其他烷基化剂进行烷基化,和/或它们可被酰化。
美国专利公开第20110293703号也提供了通过本发明方法制备的氨基醇类脂质化合物的文库。可使用涉及液体处理器、机器人、微量滴定板、计算机等的高通量技术制备和/或筛选这些氨基醇类脂质化合物。在某些实施方案中,对于氨基醇类脂质化合物筛选其转染多核苷酸或其他试剂(例如,蛋白质、肽、小分子)进入细胞的能力。
美国专利公开第20130302401号涉及一类已经使用组合聚合制备的聚(β-氨基醇)(PBAA)。本发明的PBAA可在生物技术和生物医学应用中用作涂层(例如用于医疗装置或植入物的膜或多层膜的涂层),添加剂,材料,赋形剂,非生物污损剂,微图案形成剂和细胞包封剂。当用作表面涂层时,这些PBAA会根据其化学结构而在体外和体内引起不同程度的炎症。这类材料的巨大化学多样性使我们能够鉴定出可在体外抑制巨噬细胞活化的聚合物涂层。此外,在皮下植入羧化聚苯乙烯微粒之后,这些涂层减少了炎症细胞的募集并减少了纤维化。这些聚合物可用于形成用于细胞包封的聚电解质复合物胶囊。本发明还可具有许多其他生物学应用,例如抗微生物涂层,DNA或siRNA递送以及干细胞组织工程。美国专利公开第20130302401号的教导可应用于本发明的AD官能化的CRISPR-Cas系统。
包含C2c1、腺苷脱氨酶(其可与C2c1或衔接子蛋白融合)和指导RNA的预组装重组CRISPR-Cas复合物可例如通过电穿孔法转染,导致高突变率并且没有可检测到的脱靶突变。Hur,J.K.等人,Targeted mutagenesis in mice by electroporation of C2c1ribonucleoproteins,Nat Biotechnol.2016年6月6日.doi:10.1038/nbt.3596.。
就局部递送至大脑而言,这可通过多种方式实现。例如,材料可以例如通过注射经鼻内递送。可经由开颅术立体定位进行注射。
在一些实施方案中,可使用基于糖的粒子,例如GalNAc,如本文所述并参考WO2014118272(通过引用并入本文)以及Nair,JK等人,2014,Journal of the AmericanChemical Society 136(49),16958-16961)和其中的教导,尤其是关于递送的教导适用于所有粒子,除非另有明显说明。这可被认为是基于糖的粒子,并且本文提供了其他粒子递送系统和/或制剂的更多细节。因此,就本文所述的其他粒子而言,可将GalNAc视为粒子,使得一般用途和其他考虑因素,例如所述粒子的递送,也适用于GalNAc粒子。例如,可使用溶液相缀合策略将激活为PFP(五氟苯基)酯的三触角GalNAc簇(摩尔重量~2000)附接到5'-己氨基氨基修饰的寡核苷酸(5'-HA ASO,摩尔重量~8000Da;
此外,可使用纳米团来递送AD官能化的CRISPR系统,例如,如以下所述:Sun W等人,Cocoon-like self-degradable DNA nanoclew for anticancer drug delivery.,JAm Chem Soc.2014年10月22日;136(42):14722-5.doi:10.1021/ja5088024.电子出版于2014年10月13日;Sun W等人,Self-Assembled DNA Nanoclews for the Efficientdelivery of CRISPR-Cas9 for Genome Editing.,Angew Chem Int Ed Engl.2015年10月5日;54(41):12029-33.doi:10.1002/anie.201506030.电子出版于2015年8月27日。
在一些实施方案中,递送是通过将C2c1蛋白或mRNA形式包封在脂质粒子如LNP中。因此,在一些实施方案中,考虑了脂质粒子(LNP)。转甲状腺素蛋白抗体(antitransthyretin)小干扰RNA已经被包封在脂质纳米颗粒中并递送至人类(参见例如Coelho等人,N Engl J Med 2013;369:819-29),并且可对这样的系统进行改适并将其应用于本发明的CRISPR Cas系统。考虑静脉内施用每kg体重约0.01至约1mg的剂量。考虑了减少输注相关反应风险的药物,例如,地塞米松、对乙酰氨基酚、苯海拉明或西替利嗪和雷尼替丁。还考虑了每4周多个剂量的约0.3mg/kg,共五剂。
已显示出LNP在将siRNA递送至肝脏方面是非常有效的(参见例如Tabernero等人,Cancer Discovery,2013年4月,第3卷,第4期,第363-470页),因此考虑用于将编码CRISPRCas的RNA递送至肝脏。可考虑每两周约四剂6mg/kg LNP的剂量。Tabernero等人表明,在前2个周期以0.7mg/kg给予LNP后,观察到肿瘤消退;到6个周期结束时,患者已实现部分缓解,淋巴结转移完全消退并且肝脏肿瘤明显缩小。该患者接受40剂药物后获得了完全缓解,该患者在接受超过26个月的剂量后仍处于缓解状态并完成了治疗。先前接受VEGF途径抑制剂治疗后有进展的两名具有RCC和肝外疾病部位(包括肾、肺和淋巴结)的患者在所有部位稳定病情约8至12个月,并且具有PNET和肝转移的患者继续扩展研究18个月(36剂),病情稳定。
然而,必须考虑LNP的电荷。由于阳离子脂质与带负电荷的脂质结合,诱导了促进细胞内递送的非双层结构。由于静脉注射后带电荷的LNP迅速从循环中清除,因此开发了pKa值低于7的可电离的阳离子脂质(参见例如Ros in等人,Molecular Therapy,第19卷,第12期,第1286-2200页,2011年12月)。可将带负电荷的聚合物(例如RNA)以低pH值(例如pH4)装载到LNP中,在其中,可电离脂质显示正电荷。然而,在生理pH值下,LNP展现兼容的低表面电荷和更长的循环时间。四种可离子化的阳离子脂质已受到关注,即1,2-二亚油基-3-二甲基铵-丙烷(DLinDAP)、1,2-二亚油基氧基-3-N,N-二甲基氨基丙烷(DLinDMA)、1,2-二亚油基氧基-酮基-N,N-二甲基-3-氨基丙烷(DL inKDMA)和1,2-二亚油基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(DLinKC2-DMA)。已经显示,包含这些脂质的LNP siRNA系统在体内肝细胞中表现出显著不同的基因沉默特性,其效力根据采用因子VII基因沉默模型的DLinKC2-DMA>DLinKDMA>DLinDMA>>DLinDAP系列而变化(参见例如Rosin等人,MolecularTherapy,第19卷,第12期,第1286-2200页,2011年12月)。可考虑剂量为1μg/ml的LNP或在LNP中或与LNP缔合的CRISPR-Cas RNA,尤其是对于含有DLinKC2-DMA的制剂。
LNP和CRISPR Cas包封的制备可使用/和或改编自Rosin等人,MolecularTherapy,第19卷,第12期,第1286-2200页,2011年12月。阳离子脂质1,2-二亚油基-3-二甲基铵-丙烷(DLinDAP)、1,2-二亚油基氧基-3-N,N-二甲基氨基丙烷(DLinDMA),1,2-二亚油基氧基酮基-N,N-二甲基-3-氨基丙烷(DLinK-DMA),1,2-二亚油基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(DLinKC2-DMA),(3-o-[2”-(甲氧基聚乙二醇2000)琥珀酰基]-1,2-二肉豆蔻酰基-sn-乙二醇(PEG-S-DMG)和R-3-[(ω-甲氧基-聚(乙二醇)2000)氨基甲酰基]-1,2-二肉豆蔻氧丙基-3-胺(PEG-C-DOMG)可由Tekmira Pharmaceuticals(Vancouver,Canada)提供或合成。胆固醇可购自Sigma(St Louis,MO)。特定的CRISPR Cas RNA可包封在含有DLinDAP、DLinDMA、DLinK-DMA和DLinKC2-DMA(阳离子脂质:DSPC:CHOL:PEGS-DMG或PEG-C-DOMG的摩尔比为40:10:40:10)的LNP中。在需要时,可并入0.2%SP-DiOC18(Invitrogen,Burlington,Canada)以评估细胞摄取、细胞内递送和生物分布。可通过将由阳离子脂质:DSPC:胆固醇:PEG-c-DOMG(40:10:40:10摩尔比)组成的脂质混合物溶解在乙醇中至最终脂质浓度为10mmol/l来进行包封。可将该脂质的乙醇溶液逐滴添加至pH 4.0的50mmol/l柠檬酸盐中,以形成多层囊泡,产生30%乙醇体积/体积的最终浓度。使用挤出机(Northern Lipids,Vancouver,Canada)通过两个堆叠的80nm Nuclepore聚碳酸酯滤膜挤出多层囊泡后,可能会形成大的单层囊泡。可通过将以2mg/ml溶于含有30%乙醇体积/体积的50mmol/l柠檬酸盐pH 4.0中的RNA逐滴添加至挤出的预制大单层囊泡中并在31℃下在持续混合下温育30分钟来实现包封,最终RNA/脂质重量比为0.06/1wt/wt。使用Spectra/Por2再生纤维素透析膜,通过针对pH 7.4的磷酸盐缓冲盐水(PBS)透析16小时,以去除乙醇并中和制剂缓冲液。可通过使用NICOMP 370粒度仪、囊泡/强度模式和高斯拟合的动态光散射(Nicomp Particle Sizing,Santa Barbara,CA)来确定纳米粒子尺寸分布。所有三个LNP系统的粒度可能为~70nm直径。RNA包封效率可通过使用VivaPureD MiniH柱(SartoriusStedim Biotech)从透析前后收集的样品中除去游离RNA来确定。可从洗脱的粒子中提取包封的RNA并在260nm下定量。通过使用来自Wako Chemicals USA(Richmond,VA)的胆固醇E酶法测定囊泡中的胆固醇含量来确定RNA与脂质的比率。结合本文对LNP和PEG脂质的讨论,聚乙二醇化脂质体或LNP同样适用于递送CRISPR-Cas系统或其组分。
可在含有DLinKC2-DMA、DSPC和胆固醇(50:10:38.5摩尔比)的乙醇中制备脂质预混溶液(总脂质浓度为20.4mg/ml)。乙酸钠可以0.75:1的摩尔比(乙酸钠:DLinKC2-DMA)添加到脂质预混物中。随后可通过在剧烈搅拌下将混合物与1.85体积的柠檬酸盐缓冲液(10mmol/l,pH 3.0)合并来水合脂质,从而在含有35%乙醇的水性缓冲液中自发形成脂质体。脂质体溶液可在37℃下温育,以便随时间增加粒度。在温育过程中的不同时间可取出等分试样,以通过动态光散射(Zetasizer Nano ZS,Malvern Instruments,Worcestershire,UK)研究脂质体大小的变化。一旦达到所需的粒度,就可将PEG脂质水溶液(储备液=10mg/ml PEG-DMG,在35%(体积/体积)乙醇中)添加到脂质体混合物中,以使最终PEG摩尔浓度为3.5%总脂质。加入PEG-脂质后,脂质体应达到其大小,从而有效地抑制进一步的生长。然后可将RNA以大约1:10(wt:wt)的RNA:总脂质比率添加到空脂质体中,接着在37℃下温育30分钟以形成负载的LNP。随后可将混合物在PBS中透析过夜,并用0.45μm针筒过滤器过滤。
球形核酸(SNA
可与本文的教导结合使用的文献包括:Cutler等人,J.Am.Chem.Soc.2011 133:9254-9257;Hao等人,Small.2011 7:3158-3162;Zhang等人,ACS Nano.2011 5:6962-6970;Cutler等人,J.Am.Chem.Soc.2012 134:1376-1391;Young等人,Nano Lett.2012 12:3867-71;Zheng等人,Proc.Natl.Acad.Sci.USA.2012 109:11975-80;Mirkin,Nanomedicine2012 7:635-638;Zhang等人,J.Am.Chem.Soc.2012 134:16488-1691;Weintraub,Nature2013 495:S14-S16;Choi等人,Proc.Natl.Acad.Sci.USA.2013 110(19):7625-7630;Jensen等人,Sci.Transl.Med.5,209ra152(2013);和Mirkin等人,Small,10:186-192。
可用聚乙烯亚胺(PEI)构建带有RNA的自组装粒子,所述聚乙烯亚胺(PEI)已用在聚乙二醇(PEG)末端处附接的Arg-Gly-Asp(RGD)肽配体进行聚乙二醇化。例如,该系统已用作靶向表达整联蛋白的肿瘤新血管并递送siRNA抑制血管内皮生长因子受体-2(VEGF R2)表达从而实现肿瘤血管生成的手段(参见例如Schiffelers等人,Nucleic AcidsResearch,2004,第32卷,第19期)。纳米复合物可通过将等体积的阳离子聚合物和核酸的水溶液混合以使可电离的氮(聚合物)相对于磷酸盐(核酸)的净摩尔过量超过2至6的范围来制备。阳离子聚合物与核酸之间的静电相互作用导致形成平均粒度分布为约100nm的多复合物,因此在此称为纳米复合物。设想约100至200mg CRISPR Cas的剂量可在Schiffelers等人的自组装粒子中递送。
Bartlett等人(PNAS,2007年9月25日,2007,第104卷,第39期)的纳米复合物也可应用于本发明。Bartlett等人的纳米复合物是通过将等体积的阳离子聚合物和核酸的水溶液混合以使可电离的氮(聚合物)相对于磷酸盐(核酸)的净摩尔过量超过2至6的范围来制备。阳离子聚合物和核酸之间的静电相互作用导致形成平均粒度分布为约100nm的多复合物,因此在此称为纳米复合物。Bartlett等人的DOTA-siRNA合成如下:1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸单(N-羟基琥珀酰亚胺酯)(DOTA-NHS酯)从Macrocyclics(Dallas,TX)定购。将在碳酸盐缓冲液(pH 9)中具有100倍摩尔过量的DOTA-NHS酯的胺修饰的RNA有义链添加到微量离心管中。通过在室温下搅拌4小时使内容物反应。将DOTA-RNA有义缀合物进行乙醇沉淀,重悬于水中,并与未修饰的反义链退火,以产生DOTA-siRNA。所有液体均用Chelex-100(Bio-Rad,Hercules,CA)预处理以去除痕量金属污染物。可通过使用含环糊精的聚阳离子来形成Tf靶向和非靶向siRNA粒子。通常,在水中以3(+/-)的电荷比和0.5g/l的siRNA浓度形成粒子。用Tf(金刚烷-PEG-Tf)修饰靶向粒子表面上百分之一的金刚烷-PEG分子。将粒子悬浮在5%(重量/体积)的葡萄糖载体溶液中以进行注射。
Davis等人(Nature,第464卷,2010年4月15日)进行了RNA临床试验,该试验使用靶向纳米粒子递送系统(临床试验注册号NCT00689065)。对标准护理疗法难治性的实体癌患者在21天周期的第1、3、8和10天通过30分钟静脉内输注施用靶向纳米粒子剂量。纳米粒子由合成递送系统组成,所述系统包含:(1)线性的基于环糊精的聚合物(CDP),(2)靶向人转铁蛋白(TF)的配体,其在纳米粒子的外部展示以与TF受体(TFR)接合在癌细胞表面上,(3)亲水性聚合物(用于促进生物流体中纳米粒子稳定性的聚乙二醇(PEG)),和(4)设计用于减少RRM2表达的siRNA(在临床上使用的序列先前表示为siR2B+5)。长期以来,已知TFR在恶性细胞中被上调,并且RRM2是已确立的抗癌靶标。在非人类灵长类动物的多剂量研究中,这些粒子(临床版本表示为CALAA-01)已被证明具有良好的耐受性。尽管已经通过脂质体递送对一名患有慢性骨髓性白血病的患者施用了siRNA,但Davis等人的临床试验是首次通过靶向递送系统全身性递送siRNA并治疗实体癌患者的人类试验。为了确定靶向递送系统是否可向人类肿瘤有效递送功能性siRNA,Davis等人研究了来自三个不同剂量组的三名患者的活检;患者A、B和C均患有转移性黑色素瘤,并分别接受18、24和30mg m
通过引用并入本文的美国专利第8,709,843号提供了一种药物递送系统,其用于将含有治疗剂的粒子靶向递送至组织、细胞和细胞内隔室。本发明提供了包含与表面活性剂、亲水性聚合物或脂质缀合的聚合物的靶向粒子。通过引用并入本文的美国专利第6,007,845号提供了粒子,其具有通过将多官能化合物与一种或多种疏水性聚合物和一种或多种亲水性聚合物共价连接而形成的多嵌段共聚物的核,并且包含生物活性材料。通过引用并入本文的美国专利第5,855,913号提供了一种颗粒组合物,其具有空气动力学轻质粒子,所述粒子的振实密度小于0.4g/cm3,平均直径在5μm至30μm之间,在其表面上结合有表面活性剂,用于将药物递送至肺系统。通过引用并入本文的美国专利第5,985,309号提供了结合有表面活性剂和/或带正电荷或带负电荷的治疗剂或诊断剂的亲水性或疏水性复合物以及带相反电荷的带电分子的粒子,以递送至肺系统。通过引用并入本文的美国专利第5,543,158号提供了可生物降解的可注射粒子,其具有含有生物活性材料的可生物降解的固体核和在表面上的聚(亚烷基二醇)部分。通过引用并入本文的WO2012135025(也公开为US20120251560)描述了共轭聚乙烯亚胺(PEI)聚合物和共轭氮杂大环化合物(统称为“共轭脂聚物”或“脂质体”)。在某些实施方案中,可设想,这种缀合的脂质体可在CRISPR-Cas系统的情形下使用以实现体外、离体和体内基因组扰动来修饰基因表达,包括调节蛋白质表达。
在一个实施方案中,粒子可以是环氧化物改性的脂质聚合物,有利地是7C1(参见例如James E.Dahlman和Carmen Barnes等人,Nature Nanotechnology(2014),在线出版于2014年5月11日,doi:10.1038/nnano.2014.84)。C71通过使C15环氧基封端的脂质与PEI600以14:1摩尔比反应来合成,并与C14PEG2000一起配制成可在PBS溶液中稳定至少40天的粒子(直径在35至60nm之间)。
可利用环氧化物改性的脂质聚合物将本发明的CRISPR-Cas系统递送至肺、心血管或肾细胞,但是,本领域技术人员可使所述系统适于递送至其他靶器官。设想剂量范围为约0.05至约0.6mg/kg。还设想了几天或几周的剂量,总剂量为约2mg/kg。
在一些实施方案中,用于递送RNA分子的LNP通过本领域已知的方法制备,例如在例如WO 2005/105152(PCT/EP2005/004920)、WO 2006/069782(PCT/EP2005/014074)、WO2007/121947(PCT/EP2007/003496)和WO 2015/082080(PCT/EP2014/003274)中描述的那些,所述文件通过引用并入本文。专门针对增强和改善siRNA向哺乳动物细胞递送的LNP描述于例如Aleku等人,Cancer Res.,68(23):9788-98(2008年12月1日);Strumberg等人,Int.J.Clin.Pharmacol.Ther.,50(1):76-8(2012年1月);Schultheis等人,J.Clin.Oncol.,32(36):4141-48(2014年12月20日);以及Fehring等人,Mol.Ther.,22(4):811-20(2014年4月22日),所述文献通过引用并入本文,并且所述LNP可应用于本技术。
在一些实施方案中,LNP包括在WO 2005/105152(PCT/EP2005/004920)、WO 2006/069782(PCT/EP2005/014074)、WO 2007/121947(PCT/EP2007/003496)和WO 2015/082080(PCT/EP2014/003274)中公开的任何LNP。
在一些实施方案中,LNP包括至少一种具有式I的脂质:
其中R1和R2各自独立地选自包括烷基的组,n是1至4的任何整数,并且R3是选自包括以下的组的酰基:赖氨酰基、鸟氨酰基、2,4-二氨基丁酰基、组氨酰基和根据式II的酰基部分:
其中m是1至3的任何整数并且Y
在一些实施方案中,R1是月桂基并且R2是肉豆蔻基。在另一个实施方案中,R1是棕榈基并且R2是油烯基。在一些实施方案中,m是1或2。在一些实施方案中,Y-选自卤离子、乙酸根或三氟乙酸根。
在一些实施方案中,LNP包含选自以下的一种或多种脂质:
-精氨酰基-2,3-二氨基丙酸-N-棕榈基-N-油烯基-酰胺三盐酸盐(式III):
-精氨酰基-2,3-二氨基丙酸-N-月桂基-N-肉豆蔻基-酰胺三盐酸盐(式IV):
-精氨酰基-赖氨酸-N-月桂基-N-肉豆蔻基-酰胺三盐酸盐(式V):
在一些实施方案中,LNP还包括成分。举例来说,但不作为限制,在一些实施方案中,所述成分选自肽、蛋白质、寡核苷酸、多核苷酸、核酸或其组合。在一些实施方案中,所述成分是抗体,例如单克隆抗体。在一些实施方案中,所述成分是选自例如核酶、适体、镜像异构适体(spiegelmer)、DNA、RNA、PNA、LNA或其组合的核酸。在一些实施方案中,核酸是指导RNA和/或mRNA。
在一些实施方案中,LNP的成分包含编码CRIPSR-Cas蛋白的mRNA。在一些实施方案中,LNP的成分包含编码II型或V型CRIPSR-Cas蛋白的mRNA。在一些实施方案中,LNP的成分包含编码腺苷脱氨酶的mRNA(其可与CRISPR-Cas蛋白或衔接子蛋白融合)。
在一些实施方案中,LNP的成分还包含一种或多种指导RNA。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至血管内皮。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至肺内皮。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至肝脏。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至肺。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至心脏。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至脾。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至肾脏。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至胰腺。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至脑。在一些实施方案中,LNP被配置为将前述mRNA和指导RNA递送至巨噬细胞。
在一些实施方案中,LNP还包含至少一种辅助脂质。在一些实施方案中,所述辅助脂质选自磷脂和类固醇。在一些实施方案中,所述磷脂是磷酸的二酯和/或单酯。在一些实施方案中,磷脂是磷酸甘油酯和/或鞘脂。在一些实施方案中,类固醇是基于部分氢化的环戊[a]菲的天然存在的和/或合成的化合物。在一些实施方案中,类固醇包含21至30个C原子。在一些实施方案中,类固醇是胆固醇。在一些实施方案中,辅助脂质选自1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺(DPhyPE)、神经酰胺和1,2-二油烯基sn-甘油-3-磷酸乙醇胺(DOPE)。
在一些实施方案中,至少一种辅助脂质包含选自包括PEG部分、HEG部分、聚羟乙基淀粉(polyHES)部分和聚丙烯部分的组的部分。在一些实施方案中,所述部分具有约500至10,000Da或约2,000至5,000Da的分子量。在一些实施方案中,PEG部分选自1,2-二硬脂酰基-sn-甘油-3磷酸乙醇胺、1,2-二烷基-sn-甘油-3磷酸乙醇胺和神经酰胺-PEG。在一些实施方案中,PEG部分具有约500至10,000Da或约2,000至5,000Da的分子量。在一些实施方案中,PEG部分具有2,000Da的分子量。
在一些实施方案中,辅助脂质为组合物的总脂质含量的约20mol%至80mol%。在一些实施方案中,辅助脂质组分为LNP的总脂质含量的约35mol%至65mol%。在一些实施方案中,LNP包括LNP的总脂质含量的50mol%的脂质和50mol%的辅助脂质。
在一些实施方案中,所述LNP包括-3-精氨酰基-2,3-二氨基丙酸-N-棕榈基-N-油烯基-酰胺三盐酸盐、-精氨酰基-2,3-二氨基丙酸-N-月桂基-N-肉豆蔻基-酰胺三盐酸盐或-精氨酰基-赖氨酸-N-月桂基-N-肉豆蔻基-酰胺三盐酸盐中的任一者与DPhyPE的组合,其中DPhyPE的含量为LNP的总脂质含量的约80mol%、65mol%、50mol%和35mol%。在一些实施方案中,LNP包括-精氨酰基-2,3-二氨基丙酸-N-棕榈基-N-油烯基-酰胺三盐酸盐(脂质)和1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺(辅助脂质)。在一些实施方案中,LNP包括-精氨酰基-2,3-二氨基丙酸-N-棕榈基-N-油烯基-酰胺三盐酸盐(脂质)、1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺(第一辅助脂质)和1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-PEG2000(第二辅助脂质)。
在一些实施方案中,第二辅助脂质为总脂质含量的约0.05mol%至4.9mol%或约1mol%至3mol%。在一些实施方案中,LNP包括在总脂质含量的约45mol%至50mol%之间的脂质、在总脂质含量的约45mol%至50mol%之间的第一辅助脂质,条件是存在聚乙二醇化的第二辅助脂质为总脂质含量的约0.1mol%至5mol%、约1mol%至4mol%或为约2mol%,其中脂质、第一辅助脂质和第二辅助脂质的含量之和为总脂质含量的100mol%,并且其中第一辅助脂质和第二辅助脂质之和为总脂质含量的50mol%。在一些实施方案中,LNP包含:(a)50mol%的-精氨酰基-2,3-二氨基丙酸-N-棕榈基-N-油烯基-酰胺三盐酸盐、48mol%的1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺;和2mol%的1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-PEG2000;或者(b)50mol%的-精氨酰基-2,3-二氨基丙酸-N-棕榈基-N-油烯基-酰胺三盐酸盐、49mol%的1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺;和1mol%的N(羰基-甲氧基聚乙二醇-2000)-1,2-二硬脂酰基-sn-甘油3-磷酸乙醇胺或其钠盐。
在一些实施方案中,LNP包含核酸,其中核酸骨架磷酸酯与阳离子脂质氮原子的电荷比为约1:1.5-7或约1:4。
在一些实施方案中,LNP还包含屏蔽化合物,其在体内条件下可从脂质组合物中去除。在一些实施方案中,所述屏蔽化合物是生物惰性化合物。在一些实施方案中,所述屏蔽化合物在其表面上或因而在分子上不携带任何电荷。在一些实施方案中,所述屏蔽化合物是聚乙二醇(PEG)、基于羟乙基葡萄糖(HEG)的聚合物、聚羟乙基淀粉(polyHES)和聚丙烯。在一些实施方案中,PEG、HEG、polyHES和聚丙烯重量为约500至10,000Da或约2000至5000Da。在一些实施方案中,所述屏蔽化合物是PEG2000或PEG5000。
在一些实施方案中,所述LNP包含至少一种脂质、第一辅助脂质和在体内条件下可从脂质组合物中去除的屏蔽化合物。在一些实施方案中,所述LNP还包含第二辅助脂质。在一些实施方案中,第一辅助脂质是神经酰胺。在一些实施方案中,第二辅助脂质是神经酰胺。在一些实施方案中,神经酰胺包含至少一个6至10个碳原子的短碳链取代基。在一些实施方案中,神经酰胺包含8个碳原子。在一些实施方案中,屏蔽化合物附接至神经酰胺。在一些实施方案中,屏蔽化合物附接至神经酰胺。在一些实施方案中,屏蔽化合物共价附接至神经酰胺。在一些实施方案中,屏蔽化合物附接至LNP中的核酸。在一些实施方案中,屏蔽化合物共价附接至核酸。在一些实施方案中,屏蔽化合物通过接头附接至核酸。在一些实施方案中,接头在生理条件下被切割。在一些实施方案中,接头选自ssRNA、ssDNA、dsRNA、dsDNA、肽、S-S接头和pH敏感性接头。在一些实施方案中,接头部分附接至核酸有义链的3'端。在一些实施方案中,屏蔽化合物包含pH敏感性接头或pH敏感性部分。在一些实施方案中,pH敏感性接头或pH敏感性部分是阴离子接头或阴离子部分。在一些实施方案中,阴离子接头或阴离子部分在酸性环境中为较少阴离子或中性的。在一些实施方案中,pH敏感性接头或pH敏感性部分选自低聚(谷氨酸)、低聚酚盐和二亚乙基三胺五乙酸。
在前述段落中的任何LNP实施方案中,LNP的重量克分子渗透压浓度可以在约50至600mosmole/kg之间,在约250至350mosmole/kg之间或在约280至320mosmole/kg之间,和/或其中由脂质和/或一种或两种辅助脂质和屏蔽化合物形成的LNP具有约20至200nm、约30至100nm或约40至80nm的粒度。
在一些实施方案中,屏蔽化合物在体内提供了更长的循环时间,并允许含核酸的LNP的更好的生物分布。在一些实施方案中,所述屏蔽化合物防止LNP与血清化合物或其他体液或细胞质膜的化合物(例如,向其施用LNP的脉管系统的内皮衬里的细胞质膜)立即相互作用。另外地或可替代地,在一些实施方案中,屏蔽化合物还防止免疫系统的元件立即与LNP相互作用。另外地或可替代地,在一些实施方案中,屏蔽化合物用作抗调理化合物。不希望受到任何机制或理论的束缚,在一些实施方案中,屏蔽化合物形成覆盖物或涂层,其减少了可用于与其环境相互作用的LNP的表面积。另外地或可替代地,在一些实施方案中,屏蔽化合物屏蔽LNP的总电荷。
在另一个实施方案中,LNP包括至少一种具有式VI的阳离子脂质:
其中n是1、2、3或4,其中m是1、2或3,其中Y
式VII的聚乙二醇化磷酸乙醇胺:
其中R
式VIII的聚乙二醇化神经酰胺:
其中R
式IX的聚乙二醇化二酰基甘油:
其中R
在一些实施方案中,R1和R2彼此不同。在一些实施方案中,R1是棕榈基并且R2是油烯基。在一些实施方案中,R1是月桂基并且R2是肉豆蔻基。在一些实施方案中,R1和R2相同。在一些实施方案中,R1和R2各自单独地且独立地选自由C12烷基、C14烷基、C16烷基、C18烷基、C12烯基、C14烯基、C16烯基和C18烯基组成的组。在一些实施方案中,C12烯基、C14烯基、C16烯基和C18烯基各自包含一个或两个双键。在一些实施方案中,C18烯基是在C9和C10之间具有一个双键的C18烯基。在一些实施方案中,C18烯基是顺式-9-十八烷基。
在一些实施方案中,阳离子脂质是式X的化合物:
在一些实施方案中,阳离子脂质是式IV的-精氨酰基-2,3-二氨基丙酸-N-月桂基-N-肉豆蔻基-酰胺三盐酸盐:
在一些实施方案中,阳离子脂质是式V的-精氨酰基-赖氨酸-N-月桂基-N-肉豆蔻基-酰胺三盐酸盐:
在一些实施方案中,固醇化合物是胆固醇。在一些实施方案中,固醇化合物是豆甾醇(stigmasterin)。
在一些实施方案中,PEG化脂质的PEG部分具有约800至5,000Da的分子量。在一些实施方案中,聚乙二醇化脂质的PEG部分的分子量为约800Da。在一些实施方案中,聚乙二醇化脂质的PEG部分的分子量为约2,000Da。在一些实施方案中,聚乙二醇化脂质的PEG部分的分子量为约5,000Da。在一些实施方案中,聚乙二醇化脂质是式VII的聚乙二醇化磷酸乙醇胺,其中R
(式XI)。在一些实施方案中,式VII的聚乙二醇化磷酸乙醇胺是1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-[甲氧基(聚乙二醇)-5000](铵盐):
(式XII)。在一些实施方案中,聚乙二醇化脂质是式VIII的聚乙二醇化神经酰胺,其中R
(式XIII)。在一些实施方案中,式VIII的聚乙二醇化神经酰胺是N-棕榈酰基-鞘氨醇-1-{琥珀酰基[甲氧基(聚乙二醇)2000]}
(式XIV)。在一些实施方案中,聚乙二醇化脂质是式IX的聚乙二醇化二酰基甘油,其中R
在一些实施方案中,式IX的聚乙二醇化二酰基甘油是1,2-二棕榈酰基-sn-甘油[甲氧基(聚乙二醇)2000]:
在前述段落中的任何LNP实施方案中,其中阳离子脂质组合物的含量在约65摩尔%至75摩尔%之间,固醇化合物的含量在约24摩尔%至34摩尔%之间,并且聚乙二醇化脂质的含量在约0.5摩尔%至1.5摩尔%之间,其中脂质组合物中阳离子脂质、固醇化合物和聚乙二醇化脂质的含量之和为100摩尔%。在一些实施方案中,阳离子脂质为约70摩尔%,固醇化合物的含量为约29摩尔%,并且聚乙二醇化脂质的含量为约1摩尔%。在一些实施方案中,LNP是70摩尔%的式III、29摩尔%的胆固醇和1摩尔%的式XI。
外泌体是内源性的纳米囊泡,其转运RNA和蛋白质,并且其可将RNA递送至大脑和其他靶器官。为了降低免疫原性,Alvarez-Erviti等人(2011,Nat Biotechnol 29:341)使用自衍生的树突状细胞来产生外泌体。通过将树突状细胞工程化以表达Lamp2b(一种外泌体膜蛋白),将其与神经元特异性RVG肽融合,从而达到靶向大脑的目的。通过电穿孔向纯化的外泌体装载外源RNA。静脉内注射RVG靶向的外泌体将GAPDH siRNA特异性地递送至大脑中的神经元、小胶质细胞、少突胶质细胞,从而导致特定的基因敲低。预暴露于RVG外泌体不会减弱敲低作用,并且未观察到其他组织中的非特异性摄取。BACE1(阿尔茨海默氏病的治疗靶标)的强大的mRNA(60%)和蛋白质(62%)敲低证明了外泌体介导的siRNA递送的治疗潜力。
为了获得免疫学惰性的外泌体库,Alvarez-Erviti等人从具有同质主要组织相容性复合体(MHC)单倍型的近交C57BL/6小鼠中收集骨髓。由于未成熟的树突状细胞产生大量的不含T细胞激活子(例如MHC-II和CD86)的外泌体,因此Alvarez-Erviti等人选择具有粒细胞/巨噬细胞集落刺激因子(GM-CSF)的树突状细胞持续7天。第二天,使用公认的超速离心方案从培养上清液中纯化外泌体。产生的外泌体在物理上是均质的,其大小分布在直径为80nm处达到峰值,这是通过粒子跟踪分析(NTA)和电子显微镜确定的。Alvarez-Erviti等人获得每106个细胞为6-12μg的外泌体(基于蛋白质浓度测量)。
接下来,Alvarez-Erviti等人研究了使用适合纳米级应用的电穿孔方案将修饰的外泌体装载外源货物的可能性。由于纳米级膜粒子的电穿孔尚未充分表征,因此将非特异性Cy5标记的RNA用于电穿孔方案的实验优化。在外泌体的超速离心和裂解后测定包封的RNA的量。400V和125μF的电穿孔导致RNA的最大保留,并用于所有后续实验。
Alvarez-Erviti等人向正常C57BL/6小鼠施用了150μg的包封在150μgRVG外泌体中的每种BACE1 siRNA,并将其敲低效率与以下四个对照进行比较:未治疗的小鼠,仅注射RVG外泌体的小鼠,注射有与体内阳离子脂质体试剂复合的BACE1 siRNA的小鼠和注射有与RVG-9R复合的BACE1siRNA的小鼠,所述RVG肽与静电结合至siRNA的9个D-精氨酸缀合。施用后3天分析了皮质组织样品,并且在siRNA-RVG-9R处理小鼠和siRNARVG外泌体处理小鼠中均观察到显著的蛋白质敲低(45%,P<0.05,对62%,P<0.01),由BACE1 mRNA水平显著下降产生(分别为66%[+或-]15%,P<0.001和61%[+或-]13%,P<0.01)。此外,申请人证实在经RVG-外泌体处理的动物中,总β-淀粉样蛋白1-42水平(阿尔茨海默氏病病理学中淀粉样蛋白斑块的主要组分)显著降低(55%,P<0.05)。在脑室内注射BACE1抑制剂后,观察到的降低量大于正常小鼠中显示的β-淀粉样蛋白1-40的降低量。Alvarez-Erviti等人在BACE1切割产物上进行了cDNA末端(RACE)的5'快速扩增,这提供了RNAi介导的siRNA敲低的证据。
最后,Alvarez-Erviti等人通过评估IL-6、IP-10、TNFα和IFN-α血清浓度,研究了RNA-RVG外泌体是否在体内诱导免疫反应。外泌体治疗后,与siRNA-RVG-9R相比,所有细胞因子的非显著变化均与siRNA转染试剂处理相似,后者可有效刺激IL-6分泌,从而证实了外泌体治疗的免疫学惰性概况。考虑到外泌体仅包封了20%的siRNA,与RVG-9R递送相比,用RVG-外泌体递送似乎更有效,因为可比较的mRNA敲低和更高的蛋白质敲低可以在没有相应水平的免疫刺激的情况下利用少五倍的siRNA实现。该实验证明了RVG外泌体技术的治疗潜力,该技术潜在地适合于与神经退行性疾病相关的基因的长期沉默。Alvarez-Erviti等人的外泌体递送系统可用于将本发明的AD官能化的CRISPR-Cas系统递送至治疗靶标,尤其是神经退行性疾病。包封在约100至1000mg RVG外泌体中的约100至1000mg CRISPR Cas的剂量可考虑用于本发明。
El-Andaloussi等人(Nature Protocols 7,2112-2126(2012))公开了如何利用源自培养细胞的外泌体在体外和体内递送RNA。该方案首先描述了通过转染表达载体来产生靶向外泌体,所述表达载体包含与肽配体融合的外泌体蛋白。接下来,El-Andaloussi等人解释如何从转染的细胞上清液中纯化和表征外泌体。接下来,El-Andaloussi等人详述了将RNA装载到外泌体中的关键步骤。最后,El-Andaloussi等人概述了如何使用外泌体有效地在体外和小鼠脑中体内递送RNA。还提供了预期结果的实例,其中通过功能测定和成像评价了外泌体介导的RNA递送。整个方案花费~3周。根据本发明的递送或施用可使用由自衍生的树突状细胞产生的外泌体进行。根据本文的教导,这可用于本发明的实践中。
在另一个实施方案中,考虑了Wahlgren等人(Nucleic Acids Research,2012,第40卷,第17期e130)的血浆外泌体。外泌体是由许多细胞类型产生的纳米大小的囊泡(大小为30-90nm),包括树突状细胞(DC)、B细胞、T细胞、肥大细胞、上皮细胞和肿瘤细胞。这些囊泡是由晚期内体的向内萌芽形成的,然后在与质膜融合后释放到细胞外环境。因为外泌体天然地在细胞之间携带RNA,所以该性质可用于基因疗法,并且根据本公开可用于本发明的实践中。
血浆外泌体可通过以下制备:将棕黄层(buffy coat)以900g离心20分钟来分离血浆,接着收集细胞上清液,以300g离心10分钟以除去细胞并以16500g离心30分钟,接着通过0.22mm过滤器过滤。通过以120 000g超离心70分钟将外泌体沉淀。在RNAi人类/小鼠初学者试剂盒(Quiagen,Hilden,Germany)中根据制造商的说明将siRNA化学转染到外泌体中。将siRNA以2mmol/ml的最终浓度添加到100ml PBS中。加入HiPerFect转染试剂后,将混合物在室温下温育10分钟。为了去除过量的胶束,使用醛/硫酸盐乳胶珠粒将外泌体重新分离。将CRISPR Cas化学转染到外泌体中可与siRNA类似地进行。外泌体可与从健康供体的外周血中分离的单核细胞和淋巴细胞共培养。因此,可预期的是,可将含有CRISPR Cas的外泌体引入人类的单核细胞和淋巴细胞中,并自体重新引入人体内。因此,可使用血浆外泌体进行根据本发明的递送或施用。
脂质体
根据本发明的递送或施用可用脂质体进行。脂质体是由围绕内部水室的单层或多层脂质双层和相对不可渗透的外部亲脂性磷脂双层组成的球形囊泡结构。脂质体作为药物递送载体受到了相当多的关注,因为它们具有生物相容性,无毒,可递送亲水性和亲脂性药物分子,保护其货物免受血浆酶的降解以及将其负载跨过生物膜和血脑屏障(BBB)转运(关于综述,参见例如Spuch和Navarro,Journal of Drug Delivery,第2011卷,文章ID469679,第12页,2011.doi:10.1155/2011/469679)。
脂质体可由若干不同类型的脂质制成;然而,磷脂最常用于产生脂质体作为药物载体。尽管当脂质膜与水溶液混合时脂质体的形成是自发的,但是也可通过使用均质器、超声仪或挤出装置以摇动的形式施加力来加速脂质体的形成(关于综述,参见例如Spuch和Navarro,Journal of Drug Delivery,第2011卷,文章ID 469679,第12页,2011.doi:10.1155/2011/469679)。
可将若干其他添加剂添加到脂质体中以改变其结构和性质。例如,可将胆固醇或鞘磷脂加入脂质体混合物中,以帮助稳定脂质体结构并防止脂质体内部货物的泄漏。此外,脂质体由氢化卵磷脂酰胆碱或卵磷脂酰胆碱、胆固醇和磷酸二鲸蜡酯制备,并且它们的平均囊泡大小被调节至约50和100nm。(关于综述,参见例如Spuch和Navarro,Journal ofDrug Delivery,第2011卷,文章ID 469679,第12页,2011.doi:10.1155/2011/469679)。
脂质体制剂可主要由天然磷脂和脂质组成,例如1,2-二硬脂酰基-sn-甘油-3-磷脂酰胆碱(DSPC)、鞘磷脂、卵磷脂酰胆碱和单唾液酸神经节苷脂。由于该制剂仅由磷脂组成,因此脂质体制剂遇到了许多挑战,其中之一是血浆中的不稳定性。已经进行了若干尝试来克服这些挑战,尤其是在脂质膜的操纵中。这些尝试之一集中在胆固醇的操纵上。在常规制剂中添加胆固醇会降低包封的生物活性化合物向血浆中的快速释放,或者1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)会增加稳定性(关于综述,参见例如Spuch和Navarro,Journal of Drug Delivery,第2011卷,文章ID 469679,第12页,2011.doi:10.1155/2011/469679)。
在一个特别有利的实施方案中,特洛伊木马(Trojan Horse)脂质体(也称为分子特洛伊木马)是理想的,并且方案可见于cshprotocols.cshlp.org/content/2010/4/pdb.prot5407.long。这些粒子允许在血管内注射后将转基因递送至整个大脑。不受限制,据信具有缀合至表面的特异性抗体的中性脂质粒子允许经由内吞作用穿越血脑屏障。特洛伊木马脂质体可用于经由血管内注射将CRISPR核酸酶家族递送至大脑,这将使全脑转基因动物无需胚胎操纵。可考虑约1-5g的DNA或RNA用于脂质体的体内施用。
在另一个实施方案中,AD官能化的CRISPR Cas系统或其组分可在脂质体中施用,例如稳定的核酸-脂质粒子(SNALP)(参见例如Morrissey等人,Nature Biotechnology,第23卷,第8期,2005年8月)。考虑了每天静脉内注射约1、3或5毫克/千克/天的在SNALP中靶向的特定CRISPR Cas。每日治疗可能会超过约三天,然后每周治疗持续约五周。在另一个实施方案中,还考虑了通过静脉内注射以约1或2.5mg/kg的剂量施用的特异性CRISPR Cas包封的SNALP(参见例如Zimmerman等人,Nature Letters,第441卷,2006年5月4日)。SNALP制剂可包含脂质3-N-[(w甲氧基聚(乙二醇)2000)氨基甲酰基]-1,2-二肉豆蔻基氧基-丙胺(PEG-C-DMA)、1,2-二亚油基氧基-N,N-二甲基-3-氨基丙烷(DLinDMA)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC)和胆固醇,摩尔百分比为2:40:10:48(参见例如Zimmerman等人,Nature Letters,第441卷,2006年5月4日)。
在另一个实施方案中,稳定的核酸-脂质粒子(SNALP)已被证明是高血管化HepG2衍生的肝肿瘤的有效递送分子,但在低血管化HCT-116衍生的肝肿瘤中却不是有效递送分子(参见例如Li,Gene Therapy(2012)19,775-780)。SNALP脂质体可通过使用25:1的脂质/siRNA比率用二硬脂酰磷脂酰胆碱(DSPC)、胆固醇和siRNA配制D-Lin-DMA和PEG-C-DMA并且胆固醇/D-Lin-DMA/DSPC/PEG-C-DMA摩尔比为48/40/10/2来制备。所得的SNALP脂质体大小为约80-100nm。
在又一个实施方案中,SNALP可包含合成胆固醇(Sigma-Aldrich,St Louis,MO,USA)、二棕榈酰磷脂酰胆碱(Avanti Polar Lipids,Alabaster,AL,USA)、3-N-[(w-甲氧基聚(乙二醇)2000)氨基甲酰基]-1,2-二肉豆蔻基氧基丙胺和阳离子1,2-二亚油基氧基-3-N,N二甲基氨基丙烷(参见例如Geisbert等人,Lancet2010;375:1896-905)。可考虑以例如大剂量静脉内输注施用的每剂量约2mg/kg总CRISPR Cas的剂量。
在又一个实施方案中,SNALP可包含合成胆固醇(Sigma-Aldrich)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC;Avanti Polar Lipids Inc.)、PEG-cDMA和1,2-二亚油基氧基-3-(N;N-二甲基)氨基丙烷(DLinDMA)(参见例如Judge,J.Clin.Invest.119:661-673(2009))。用于体内研究的制剂可包含约9:1的最终脂质/RNA质量比。
Alnylam Pharmaceuticals的Barros和Gollob已对RNAi纳米药物的安全性概况进行了综述(参见例如Advanced Drug Delievry Reviews 64(2012)1730-1737)。稳定的核酸脂质粒子(SNALP)由四种不同的脂质组成,即在低pH下为阳离子的可电离脂质(DLinDMA)、中性辅助脂质、胆固醇和可扩散聚乙二醇(PEG)-脂质。所述粒子的直径大约为80nm并且在生理pH值下呈电荷中性。在配制期间,可电离脂质用于在粒子形成期间将脂质与阴离子RNA凝聚。当在递增酸性的内体条件下带正电荷时,可电离的脂质还会介导SNALP与内体膜的融合,从而使RNA释放到细胞质中。PEG-脂质使粒子稳定并减少配制期间的聚集,并且随后提供可改善药代动力学特性的中性亲水性外部。
迄今为止,已经使用含RNA的SNALP制剂启动了两个临床程序。TekmiraPharmaceuticals最近在LDL胆固醇升高的成年志愿者中完成了SNALP-ApoB的I期单剂量研究。ApoB主要在肝脏和空肠中表达,并且对于VLDL和LDL的组装和分泌至关重要。17名受试者接受了单剂量的SNALP-ApoB(7个剂量水平的剂量递增)。不存在肝毒性的证据(根据临床前研究预期为潜在的剂量限制性毒性)。最高剂量的(两名中的)一名受试者经历了与免疫系统刺激相一致的流感样症状,并决定结束该试验。
Alnylam Pharmaceuticals具有类似的先进ALN-TTR01,它采用上述SNALP技术,并以突变体和野生型TTR的肝细胞生产为目标来治疗TTR淀粉样变性(ATTR)。已经描述了三种ATTR综合征:家族性淀粉样变性多发性神经病(FAP)和家族性淀粉样变性心肌病(FAC),两者均由TTR的常染色体显性突变引起;以及由野生型TTR引起的老年性系统性淀粉样变性(SSA)。最近在ATTR患者中完成了ALN-TTR01的安慰剂对照的单剂量递增I期试验。ALN-TTR01以15分钟的IV输注形式施用至31名患者(23名用研究药物,8名用安慰剂),剂量范围为0.01至1.0mg/kg(基于siRNA)。治疗耐受性良好,肝功能检验无明显增加。在23名患者中有3名在≥0.4mg/kg下注意到与输注相关的反应;所有人都对输注速率的减慢做出了反应并且都继续进行研究。在两名患者中,在最高剂量1mg/kg下,注意到血清细胞因子IL-6、IP-10和IL-1ra的最小和暂时升高(根据临床前和NHP研究所预期)。在1mg/kg下,观察到血清TTR降低,ALN-TTR01的预期药效学作用。
在又一个实施方案中,可通过例如分别以40:10:40:10的摩尔比将阳离子脂质、DSPC、胆固醇和PEG-脂质溶解在例如乙醇中来制备SNALP(参见Semple等人,NatureNiotechnology,第28卷,第2期,2010年2月,第172-177页)。将脂质混合物添加至水性缓冲液(50mM柠檬酸盐,pH 4)中,同时混合至最终乙醇,并且脂质浓度分别为30%(体积/体积)和6.1mg/ml,并使其在挤出前在22℃下平衡2分钟。使用Lipex挤出机(Northern Lipids)在22℃下将水合脂质通过两个堆叠的80nm孔径的过滤器(Nuclepore)挤出,直至获得70-90nm的囊泡直径,如通过动态光散射分析所确定。这通常需要1-3次通过。将siRNA(溶于含30%乙醇的50mM柠檬酸盐pH 4水溶液中)以~5ml/min的速率在混合下加入到预平衡的(35℃)囊泡中。达到0.06(wt/wt)的最终目标siRNA/脂质比率后,将混合物在35℃下再温育30分钟,以允许囊泡重组和siRNA包封。然后除去乙醇,并通过透析或切向流渗滤将外部缓冲液替换为PBS(155mM NaCl,3mM Na2HPO4,1mM KH2PO4,pH 7.5)。使用可控的逐步稀释方法工艺将siRNA包封在SNALP中。KC2-SNALP的脂质成分为以57.1:7.1:34.3:1.4的摩尔比使用的DLin-KC2-DMA(阳离子脂质)、二棕榈酰磷脂酰胆碱(DPPC;Avanti极性脂质)、合成胆固醇(Sigma)和PEG-C-DMA。形成负载粒子后,将SNALP相对于PBS透析,并在使用前通过0.2μm过滤器过滤灭菌。平均粒度为75-85nm,并且90-95%的siRNA被包封在脂质粒子中。用于体内测试的制剂中最终的siRNA/脂质比率为~0.15(wt/wt)。即将使用前,将含有因子VIIsiRNA的LNP-siRNA系统在无菌PBS中稀释至适当浓度,并通过侧尾静脉以总体积10ml/kg静脉内施用制剂。这种方法和这些递送系统可以外推至本发明的AD官能化的CRISPR Cas系统。
其他阳离子脂质,例如氨基脂质2,2-二亚油基-4-二甲基氨基乙基-[1,3]-二氧戊环(DLin-KC2-DMA)可用于包封CRISPR Cas或其组分或编码其的核酸分子,例如类似于SiRNA(参见例如Jayaraman,Angew.Chem.Int.Ed.2012,51,8529-8533),因此可用于本发明的实践中。可以考虑具有以下脂质组成的预先形成的囊泡:氨基脂质、二硬脂酰磷脂酰胆碱(DSPC)、胆固醇和(R)-2,3-双(十八烷氧基)丙基-1-(甲氧基聚(乙二醇)2000)丙基氨基甲酸酯(PEG-脂质),摩尔比分别为40/10/40/10,并且FVII siRNA/总脂质比率大约为0.05(w/w)。为了确保在70-90nm范围内的窄粒度分布和0.11+0.04(n=56)的低多分散指数,在添加指导RNA之前,可将粒子通过80nm膜挤出多达3次。可使用含有高效氨基脂质16的粒子,其中四种脂质组分16、DSPC、胆固醇和PEG-脂质的摩尔比(50/10/38.5/1.5)可以进一步优化以增强体内活性。
Michael S D Kormann等人("Expression of therapeutic proteins afterdelivery of chemically modified mRNA in mice:Nature Biotechnology,第29卷,第154-157页(2011))描述了使用脂质包膜来递送RNA。脂质包膜的使用在本发明中也是优选的。
在另一个实施方案中,脂质可用本发明的AD官能化的CRISPR Cas系统或其组分或编码其的核酸分子配制以形成脂质纳米粒子(LNP)。脂质包括但不限于DLin-KC2-DMA4、C12-200和共脂质二硬脂酰磷脂酰胆碱、胆固醇,并且PEG-DMG可使用CRISPR Cas而不是siRNA配制(参见例如Novobrantseva,Molecular Therapy-Nucleic Acids(2012)1,e4;doi:10.1038/mtna.2011.3),使用自发囊泡形成程序。组分摩尔比可为约50/10/38.5/1.5(DLin-KC2-DMA或C12-200/二硬脂酰磷脂酰胆碱/胆固醇/PEG-DMG)。在DLin-KC2-DMA和C12-200脂质纳米粒子(LNP)的情况下,最终的脂质:siRNA重量比可能分别为~12:1和9:1。制剂可具有~80nm的平均粒径,其中截留效率>90%。可考虑3mg/kg的剂量。
Tekmira在美国和国外拥有一系列的大约95个专利家族,涉及LNP和LNP制剂的各个方面(参见例如美国专利第7,982,027号;第7,799,565号;第8,058,069号;第8,283,333号;第7,901,708号;第7,745,651号;第7,803,397号;第8,101,741号;第8,188,263号;第7,915,399号;第8,236,943号和第7,838,658号以及欧洲专利第1766035号;第1519714号;第1781593号和第1664316号),所有这些均可用于和/或适于本发明。
AD官能化的CRISPR Cas系统或其组分或编码其的核酸分子可包封在PLGA微球中递送,例如在美国公开申请20130252281和20130245107和20130244279(转让给ModernaTherapeutics)中进一步描述,其涉及包含修饰的核酸分子的组合物的制剂的方面,所述修饰的核酸分子可编码蛋白质、蛋白质前体、或者蛋白质或蛋白质前体的部分或完全加工的形式。所述制剂可具有50:10:38.5:1.5-3.0的摩尔比(阳离子脂质:膜融合脂质:胆固醇:PEG脂质)。PEG脂质可选自但不限于PEG-c-DOMG、PEG-DMG。膜融合脂质可以是DSPC。还参见Schrum等人,Delivery and Formulation of Engineered Nucleic Acids,美国公开申请20120251618。
Nanomerics的技术解决了多种治疗剂的生物利用度挑战,包括低分子量疏水性药物、肽和基于核酸的治疗剂(质粒、siRNA、miRNA)。所述技术已显示出明显优势的特定施用途径包括口服途径,跨血脑屏障的转运,向实体瘤以及眼睛的递送。参见例如Mazza等人,2013,ACS Nano.2013年2月26日;7(2):1016-26;Uchegbu和Siew,2013,J Pharm Sci.102(2):305-10;以及Lalatsa等人,2012,J Control Release.2012年7月20日;161(2):523-36。
美国专利公开第20050019923号描述了用于将生物活性分子例如多核苷酸分子、肽和多肽和/或医药剂递送至哺乳动物身体的阳离子树枝状聚合物。树枝状聚合物适合于靶向将生物活性分子递送至例如肝脏、脾脏、肺、肾或心脏(或甚至大脑)。树枝状聚合物是合成的三维大分子,其由简单的支化单体单元以逐步方式制备而成,其性质和功能可以容易地控制和改变。树枝状大分子是通过将结构单元重复添加到多功能核心(发散性合成方法)或向多功能核心(会聚性合成方法)而合成的,并且每次添加3维结构单元外壳都会导致形成更高一代的树枝状聚合物。聚丙烯亚胺树枝状聚合物从二氨基丁烷核心开始,通过丙烯腈双重迈克尔加成将两倍数量的氨基加成到伯胺上,接着将腈加氢。这导致氨基加倍。聚丙烯亚胺树枝状聚合物含有100%的可质子化氮和最多64个末端氨基(第5代,DAB 64)。可质子化的基团通常是能够在中性pH下接受质子的胺基。使用树枝状聚合物作为基因递送剂在很大程度上专注于使用聚酰胺基胺,并且分别含有胺/酰胺或N--P(O2)S的混合物作为共轭单元的含磷化合物,没有报道使用低代聚丙烯亚胺树枝状聚合物进行基因递送。聚丙烯亚胺树枝状聚合物也已被研究作为pH敏感性控释系统,用于药物递送以及当其被外围氨基酸基团化学修饰后对客体分子的包封。还研究了聚丙烯亚胺树枝状聚合物与DNA的细胞毒性和相互作用以及DAB 64的转染功效。
美国专利公开第20050019923号是基于以下观察结果:与较早的报道相反,阳离子树枝状聚合物,例如聚丙烯亚胺树枝状聚合物,显示出合适的性质,例如特异性靶向和低毒性,用于靶向递送生物活性分子,例如遗传物质。另外,阳离子树枝状聚合物的衍生物还显示出合适的性质,用于靶向递送生物活性分子。还参见Bioactive Polymers,美国公开申请20080267903,其公开了“各种聚合物,包括阳离子聚胺聚合物和树枝状聚合物,已显示具有抗增殖活性,因此可用于治疗以不希望的细胞增殖为特征的病症,例如赘瘤和肿瘤、炎症性病症(包括自身免疫性病症)、牛皮癣和动脉粥样硬化。所述聚合物可单独用作活性剂,或者用作其他治疗剂(例如用于基因疗法的药物分子或核酸)的递送媒介物。在这些情况下,聚合物本身固有的抗肿瘤活性可补充要递送的药剂的活性。”这些专利出版物的公开内容可与本文的教导结合使用,以递送AD官能化的CRISPR Cas系统或其组分或编码其的核酸分子。
超电荷蛋白质是一类工程化的或天然存在的蛋白,具有异常高的正或负净理论电荷,并且可用于递送AD官能化的CRISPR Cas系统或其组分或编码其的核酸分子。带超负电荷和带超正电荷的蛋白质均显示出显著的抵抗热或化学诱导的聚集的能力。带超正电荷的蛋白质也能够穿透哺乳动物细胞。将货物与这些蛋白质(例如质粒DNA、RNA或其他蛋白质)相缔合可以使这些大分子在体外和体内功能性递送至哺乳动物细胞中。2007年已经报道了超电荷蛋白质的产生和表征(Lawrence等人,2007,Journal of the American ChemicalSociety 129,10110-10112)。
RNA和质粒DNA的非病毒递送至哺乳动物细胞对于研究和治疗应用都是有价值的(Akinc等人,2010,Nat.Biotech.26,561-569)。在适当的无血清培养基中将纯化的+36GFP蛋白(或其他带超正电荷的蛋白)与RNA混合,并使其复合,然后添加到细胞中。在该阶段包含血清会抑制带超正电荷的蛋白质-RNA复合物的形成,并降低治疗效果。已发现以下方案对多种细胞系均有效(McNaughton等人,2009,Proc.Natl.Acad.Sci.USA 106,6111-6116)(然而,应进行改变蛋白质和RNA的剂量的试点实验以优化特定细胞系的程序):(1)处理前一天,在48孔板中每孔接种1×105个细胞。(2)在治疗当天,在无血清培养基中将纯化的+36GFP蛋白稀释至最终浓度200nM。加入RNA至最终浓度为50nM。涡旋混合并在室温下温育10分钟。(3)温育期间,从细胞中吸出培养基并用PBS洗涤一次。(4)在+36GFP和RNA温育后,将蛋白质-RNA复合物添加到细胞中。(5)将细胞与复合物在37℃下温育4小时。(6)温育后,吸出培养基,并用20U/mL肝素PBS洗涤三次。根据活性测定,将细胞与含血清的培养基再温育48小时或更长时间。(7)通过免疫印迹、qPCR、表型测定或其他适当的方法分析细胞。
进一步发现,+36GFP在许多细胞中是有效的质粒递送试剂。由于质粒DNA是比siRNA更大的货物,需要成比例更多的+36GFP蛋白来有效地复合质粒。为了有效地递送质粒,申请人已经开发了带有C末端HA2肽标签的+36GFP变体,所述标签是一种已知的源自流感病毒血凝素蛋白的内体破坏性肽。以下方案已在多种细胞中有效,但如上所述,建议针对特定细胞系和递送应用来优化质粒DNA和超电荷蛋白剂量:(1)处理前一天,在48孔板中每孔接种1×105个。(2)在治疗当天,将纯化的
还参见例如McNaughton等人,Proc.Natl.Acad.Sci.USA 106,6111-6116(2009);Cronican等人,ACS Chemical Biology 5,747-752(2010);Cronican等人,Chemistry&Biology 18,833-838(2011);Thompson等人,Methods in Enzymology 503,293-319(2012);Thompson,D.B.等人,Chemistry&Biology19(7),831-843(2012)。可使用和/或改适超电荷蛋白质的方法以递送本发明的AD官能化的CRISPR Cas系统。这些系统结合本文的教导可用于递送AD官能化的CRISPR Cas系统或其组分或编码其的核酸分子。
在另一个实施方案中,考虑了细胞穿透肽(CPP)用于递送AD官能化的CRISPR Cas系统。CPP是促进细胞摄取各种分子货物(从纳米尺寸粒子到小化学分子和DNA的大片段)的短肽。如本文所用的术语“货物”包括但不限于由以下组成的组:治疗剂、诊断探针、肽、核酸、反义寡核苷酸、质粒、蛋白质、粒子(包括纳米粒子)、脂质体、生色团、小分子和放射性物质。在本发明的方面中,货物还可包括AD官能化的CRISPR Cas系统的任何组分或整个AD官能化的功能性CRISPR Cas系统。本发明的方面还提供了用于将所需货物递送至受试者的方法,所述方法包括:(a)制备包含本发明的细胞穿透肽和所需货物的复合物,和(b)经口、关节内、腹膜内、鞘内、动脉内、鼻内、实质内、皮下、肌肉内、静脉内、经皮、直肠内或局部施用所述复合物至受试者。货物通过经由共价键的化学键联或通过非共价相互作用而与肽缔合。
CPP的功能是将货物递送至细胞中,这一过程通常通过胞吞作用发生,货物被递送至活体哺乳动物细胞的内体中。细胞穿透肽具有不同的大小、氨基酸序列和电荷,但是所有CPP都具有一个独特的特性,即能够转移质膜并促进将各种分子货物递送至细胞质或细胞器。CPP易位可分为三种主要进入机制:直接穿透膜,内吞作用介导的进入以及通过形成暂时结构而易位。CPP已在医学中广泛应用,作为药物递送剂用于治疗不同疾病(包括癌症)和作为病毒抑制剂以及用于细胞标记的造影剂。后者的实例包括充当GFP、MRI造影剂或量子点的载体。CPP作为用于研究和医学的体外和体内递送载体具有巨大的潜力。CPP通常具有这样的氨基酸组成,其包含高相对丰度的带正电荷的氨基酸,例如赖氨酸或精氨酸,或者具有包含极性/带电荷的氨基酸和非极性的疏水性氨基酸的交替模式的序列。这两种类型的结构分别称为聚阳离子或两亲的。第三类CPP是疏水性肽,仅包含非极性残基,具有低净电荷或具有对细胞摄取至关重要的疏水性氨基酸基团。最初发现的CPP之一是人类免疫缺陷病毒1(HIV-1)的反式激活转录激活子(Tat),已发现其被众多培养细胞类型有效地从周围培养基中摄取。从那时起,已知的CPP数量显著扩增,并产生了具有更有效蛋白质转导特性的小分子合成类似物。CPP包括但不限于Penetratin、Tat(48-60)、Transportan和(R-AhX-R4)(Ahx=氨基己酰基)。
美国专利8,372,951提供了衍生自嗜酸性粒细胞阳离子蛋白(ECP)的CPP,其表现出高的细胞穿透效率和低毒性。还提供了将CPP及其货物递送至脊椎动物受试者中的方面。CPP及其递送的其他方面描述于美国专利8,575,305;8;614,194;和8,044,019。CPP可用于递送AD官能化的CRISPR-Cas系统或其组分。CPP可用于递送AD官能化的CRISPR-Cas系统或其组分也提供于:手稿“Gene disruption by cell-penetrating peptide-mediateddelievry of Cas9protein and guide RNA”,Suresh Ramakrishna,Abu-Bonsrah KwakuDad,Jagadish Beloor等人,Genome Res.2014年4月2日,通过引用整体并入本文,其中证明了用CPP缀合的重组Cas9蛋白和CPP复合的指导RNA处理导致人类细胞系中的内源基因破坏。在论文中,Cas9蛋白经由硫醚键与CPP缀合,而指导RNA与CPP复合,形成浓缩的带正电荷的粒子。已表明,用修饰的Cas9和指导RNA同时和依序处理人类细胞(包括胚胎干细胞、真皮成纤维细胞、HEK293T细胞、HeLa细胞和胚胎癌细胞)可导致有效的基因破坏,相对于质粒转染的脱靶突变减少。
例如,在自主呼吸时,经支气管内递送的每个肺,接受肺部疾病治疗的受试者可例如接受药学有效量的气雾化AAV载体系统。因此,一般而言,气雾化递送优选用于AAV递送。腺病毒或AAV粒子可用于递送。各自可操作地连接至一个或多个调控序列的合适的基因构建体可被克隆到递送载体中。
用于驱动CRISPR-Cas蛋白和任选地编码核酸分子表达的功能结构域(例如腺苷脱氨酶)的启动子可包括AAV ITR,其可用作启动子。这对于消除对另外的启动子元件(其可占据载体中的空间)的需要是有利的。释放的额外空间可用于驱动其他元件(gRNA等)的表达。而且,ITR活性相对较弱,因此可用于降低由于C2c1过表达而引起的潜在毒性。
对于普遍表达,可使用的启动子包括:CMV、CAG、CBh、PGK、SV40、铁蛋白重链或轻链等。对于大脑或其他CNS表达,突触蛋白I可用于所有神经元,CaMKIIα可用于兴奋性神经元,GAD67或GAD65或VGAT可用于GABA能神经元。对于肝脏表达,可使用白蛋白启动子。对于肺表达,可使用SP-B。对于内皮细胞,可使用ICAM。对于造血细胞,可使用IFNβ或CD45。对于成骨细胞,可使用OG-2。
用于驱动指导RNA的启动子可包括Pol III启动子,例如U6或H1,以及使用Pol II启动子和内含子盒来表达指导RNA。
在某些实施方案中,使用腺相关病毒(AAV)、白血病病毒(MuMLV)、慢病毒、腺病毒或其他质粒或病毒载体类型来递送CRISPR-Cas系统。
可使用腺相关病毒(AAV)、慢病毒、腺病毒或其他质粒或病毒载体类型来递送CRISPR-Cas蛋白、腺苷脱氨酶和一个或多个指导RNA,特别是使用来自例如以下的制剂和剂量:美国专利第8,454,972号(制剂、腺病毒的剂量),美国专利第8,404,658号(制剂、AAV的剂量)和美国专利第5,846,946号(制剂、DNA质粒的剂量)以及涉及慢病毒、AAV和腺病毒的临床试验和关于所述临床试验的出版物。例如,对于AAV,施用途径、制剂和剂量可如美国专利第8,454,972号中以及涉及AAV的临床试验中所述。对于腺病毒,施用途径、制剂和剂量可如美国专利第8,404,658号中以及涉及腺病毒的临床试验中所述。对于质粒递送,施用途径、制剂和剂量可如美国专利第5,846,946号中以及涉及质粒的临床研究中所述。剂量可基于或外推至平均70kg的个体(例如成年男性),并且可针对不同体重和物种的患者、受试者、哺乳动物进行调整。施用频率在医学或兽医学专业人员(例如医师、兽医)的能力范围内,这取决于通常的因素,包括年龄、性别、总体健康状况、患者或受试者的其他状况以及要解决的特定疾患或症状。可将病毒载体注射到目标组织中。对于细胞类型特异性基因组修饰,C2c1和腺苷脱氨酶的表达可由细胞类型特异性启动子驱动。例如,肝特异性表达可使用白蛋白启动子,并且神经元特异性表达(例如用于靶向CNS病症)可使用突触蛋白I启动子。
就体内递送而言,AAV优于其他病毒载体有两个原因:低毒性(这可能是由于纯化方法不需要对可激活免疫反应的细胞粒子进行超离心);以及由于它不会整合到宿主基因组中而导致插入诱变的可能性很小。
AAV的包装限度为4.5或4.75Kb。这意味着C2c1以及启动子和转录终止子必须都适合于同一病毒载体。大于4.5或4.75Kb的构建体将导致病毒产生显著减少。SpCas9相当大,基因本身超过4.1Kb,这使其难以包装到AAV中。因此,本发明的实施方案包括利用较短的C2c1的同源物。在一些实施方案中,病毒衣壳包含VP1、VP2、VP3衣壳蛋白中的一种或多种。
关于AAV,AAV可以是AAV1、AAV2、AAV5或其任何组合。可以针对要靶向的细胞选择AAV的AAV;例如,可选择AAV血清型1、2、5或混合衣壳AAV1、AAV2、AAV5或其任何组合以靶向脑或神经元细胞;并且可选择AAV4以靶向心脏组织。AAV8可用于递送至肝脏。本文的启动子和载体单独地是优选的。关于这些细胞的某些AAV血清型的列表(参见Grimm,D.等人,J.Virol.82:5887-5911(2008))如下:
慢病毒是复杂的逆转录病毒,其能够在有丝分裂和有丝分裂后细胞中感染并表达其基因。最通常已知的慢病毒是人类免疫缺陷病毒(HIV),它使用其他病毒的包膜糖蛋白以靶向广泛多种细胞类型。
慢病毒可如下制备。克隆pCasES10(其包含慢病毒转移质粒骨架)后,在转染前一天将低传代率(p=5)的HEK293FT在T-75烧瓶中在含10%胎牛血清且无抗生素的DMEM中接种至50%汇合。20小时后,将培养基更换为OptiMEM(无血清)培养基,并在4小时后进行转染。用10μg慢病毒转移质粒(pCasES10)和以下包装质粒转染细胞:5μg pMD2.G(VSV-g假型)和7.5ug psPAX2(gag/pol/rev/tat)。用阳离子脂质递送剂(50uL Lipofectamine 2000和100ul Plus试剂)在4mL OptiMEM中进行转染。6小时后,将培养基更换为含10%胎牛血清的无抗生素DMEM。这些方法在细胞培养期间使用血清,但是无血清方法是优选的。
慢病毒可如下纯化。48小时后收获病毒上清液。首先清除上清液中的碎片,然后通过0.45um低蛋白结合(PVDF)过滤器进行过滤。然后将它们在超速离心机中以24,000rpm旋转2小时。将病毒沉淀在4C下重悬于50ul DMEM中过夜。然后将它们等分并立即冷冻在-80℃。
在另一个实施方案中,还考虑了基于马传染性贫血病毒(EIAV)的最小的非灵长类慢病毒载体,尤其是用于眼基因疗法(参见例如Balagaan,J Gene Med2006;8:275-285)。在另一个实施方案中,还考虑了
在另一个实施方案中,具有靶向HIV tat/rev共有的共同外显子的siRNA、核仁定位的TAR诱饵和抗CCR5特异性锤头状核酶的自灭活慢病毒载体(参见例如DiGiusto等人,(2010)Sci Transl Med 2:36ra43)可用于/和或适于本发明的AD官能化的CRISPR-Cas系统。可收集每千克患者体重最少2.5×106个CD34+细胞,并在含有2μmol/L-谷氨酰胺、干细胞因子(100ng/ml)、Flt-3配体(Flt-3L)(100ng/ml)和血小板生成素(10ng/ml)(CellGenix)的X-VIVO 15培养基(Lonza)中预刺激16至20小时,密度为2×106个细胞/毫升。可在包被有纤连蛋白(25mg/cm2)(RetroNectin,Takara Bio Inc.)的75cm2组织培养瓶中以5的感染复数以慢病毒转导预刺激的细胞16至24小时。
已在帕金森氏病治疗中公开了慢病毒载体,参见例如美国专利公开第20120295960号以及美国专利第7303910号和第7351585号。也已经公开了用于治疗眼病的慢病毒载体,参见例如美国专利公开第20060281180号、第20090007284号、第US20110117189号;US20090017543;US20070054961;US20100317109。慢病毒载体也已公开用于递送至脑,参见例如美国专利公开第US20110293571号、第US20110293571号、第US20040013648号、第US20070025970号、第US20090111106号以及美国专利第US7259015号。
基于聚合物的粒子
本文的系统和组合物可使用基于聚合物的粒子(例如纳米粒子)来递送。在一些实施方案中,基于聚合物的粒子可模拟膜融合的病毒机制。基于聚合物的粒子可以是流感病毒机制的合成拷贝,并与细胞经由内吞途径摄取的各种类型的核酸(siRNA、miRNA、质粒DNA或shRNA、mRNA)形成转染复合物,这是涉及形成酸性隔室的过程。晚期内体的低pH值用作化学开关,使粒子表面具有疏水性并促进膜穿过。一旦进入细胞溶质,粒子就会释放其有效载荷以进行细胞作用。这种主动的内体逃逸技术是安全的并且在其使用天然摄取途径时最大化转染效率。在一些实施方案中,基于聚合物的粒子可包含烷基化和羧烷基化的支化聚乙烯亚胺。在一些实例中,基于聚合物的粒子是VI ROMER,例如VIROMER RNAi、VIROMER RED、VIROMER mRNA、VI ROMER CRISPR。本文中递送系统和组合物的示例方法包括以下中所述的那些:Bawage SS等人,Synthetic mRNA expressed Cas13a mitigates RNA vir usinfections;www.biorxiv.org/content/10.1101/370460v1.full doi:doi.org/10.1101/370460;
一般应用
本公开提供了利用本文的组分和系统修饰靶核酸(例如DNA)或一种或多种靶核酸的表达的方法。在一些实施方案中,所述方法包括使靶核酸与本文中的一种或多种非天然存在的或工程化的组合物或系统接触。例如,本公开提供了对目标靶基因进行修饰的方法,所述方法包括使靶DNA与一种或多种非天然存在的或工程化的组合物接触,所述组合物包含:i)来自表1或表2的Cas12b效应蛋白,ii)crRNA,所述crRNA包含a)能够与靶DNA序列杂交的3'指导序列,和b)5'正向重复序列,以及iii)tracr RNA,从而形成包含与crRNA和tracrRNA复合的Cas12b效应蛋白的CRISPR复合物,其中所述指导序列引导与细胞中的靶RNA序列的序列特异性结合,从而修饰目标靶基因座的表达。
所述方法可用于修饰靶基因的表达。与在没有用系统或组合物处理下或在用系统或组合物处理之前的靶基因表达相比,修饰可改变靶基因的表达。与在没有用系统或组合物处理下或在用系统或组合物处理之前的靶基因表达相比,修饰可增加靶基因的表达。与在没有用系统或组合物处理下或在用系统或组合物处理之前的靶基因表达相比,修饰可降低靶基因的表达。
在一些实施方案中,所述方法可包括修饰靶寡核苷酸中的一种或多种碱基(例如,腺嘌呤或胞嘧啶)。此类方法可包括将本文的碱基编辑器的一种或多种组分递送至靶寡核苷酸。在一些实例中,所述方法包括将以下递送至所述靶寡核苷酸:无催化活性的Cas12b蛋白;指导分子,其包含与正向重复序列连接的指导序列;以及腺苷或胞苷脱氨酶蛋白或其催化结构域;其中所述腺苷或胞苷脱氨酶蛋白或其催化结构域与所述无催化活性的Cas12b蛋白或所述指导分子共价或非共价连接,或者所述腺苷或胞苷脱氨酶蛋白或其催化结构域适于在递送后与所述无催化活性的Cas12b蛋白或所述指导分子连接;其中所述指导分子与所述无催化活性的Cas12b形成复合物并引导所述复合物结合所述靶寡核苷酸,其中所述指导序列能够与所述靶寡核苷酸内的靶序列杂交以形成寡核苷酸双链体。在一些实施方案中,胞嘧啶在形成寡核苷酸双链体的靶序列外部,其中胞苷脱氨酶蛋白或其催化结构域使RNA双链体外部的胞嘧啶脱氨基,或者(B)胞嘧啶在形成RNA双链体的靶序列内部,其中指导序列在对应于胞嘧啶的位置处包含非配对的腺嘌呤或尿嘧啶,导致RNA双链体中的C-A或C-U错配,并且其中胞苷脱氨酶蛋白或其催化结构域使RNA双链体中与非配对的腺嘌呤或尿嘧啶相对的胞嘧啶脱氨基。指导分子与所述CRISPR效应蛋白形成复合物,并引导所述复合物结合目标靶寡核苷酸序列,其中所述指导序列能够与包含腺嘌呤或胞嘧啶的靶序列杂交以形成RNA双链体;其中腺苷脱氨酶蛋白或其催化结构域使RNA双链体中的腺嘌呤或胞嘧啶脱氨基。
在一些实施方案中,所述方法和系统可用于检测一个或多个样品中核酸靶序列的存在。在一些实施方案中,用于检测一个或多个体外样品中核酸靶序列的存在的系统可包含:Cas12b蛋白;至少一个包含指导序列的指导多核苷酸,所述指导序列设计成与靶序列具有一定程度的互补性,并设计成与Cas12b形成复合物;以及包含非靶序列的基于寡核苷酸的掩蔽构建体;其中,Cas12b一旦被靶序列激活,就表现出附带核酸酶活性并切割基于寡核苷酸的掩蔽构建体的非靶序列。在某些实施方案中,用于检测一种或多种体外样品中靶多肽的存在的系统包含:Cas12b蛋白;一种或多种检测适体,每个检测适体被设计成与一种或多种靶多肽之一结合,每种检测适体包含被掩蔽的提示结合位点或被掩蔽的引物结合位点和触发序列模板;以及包含非靶序列的基于寡核苷酸的掩蔽构建体。用于检测一个或多个体外样品中的核酸序列的方法可包括:使一个或多个样品与以下各物接触:i)Cas12b效应蛋白;ii)至少一个包含指导序列的指导多核苷酸,所述指导序列被设计成与靶序列具有一定程度的互补性,并设计成与Cas12b效应蛋白形成复合物;以及iii)包含非靶序列的基于寡核苷酸的掩蔽构建体;并且其中所述Cas12效应蛋白表现出附带核酸酶活性并切割基于寡核苷酸的掩蔽构建体的非靶序列。
在另一方面,本公开提供了用于在含有靶寡核苷酸的细胞中提供酶促(例如蛋白水解)活性的方法。所述方法可包括使细胞与连接至酶的非活性部分的第一Cas蛋白和连接至酶的互补部分的第二Cas蛋白接触。当接触酶的非活性部分和互补部分时,酶的活性被重建。在一些实施方案中,在含有靶寡核苷酸的细胞中提供蛋白水解活性的方法包括:a)使细胞或细胞群体与以下各物接触:i)连接至蛋白水解酶的非活性部分的第一Cas12b效应蛋白;ii)与蛋白水解酶的互补部分连接的第二Cas12b效应蛋白,其中当接触蛋白水解酶的第一部分和互补部分时,所述蛋白水解酶的蛋白水解活性被重建;iii)与第一Cas12b效应蛋白结合并与RNA的第一靶序列杂交的第一指导物;以及iv)与第二Cas12b效应蛋白结合并与RNA的第二靶序列杂交的第二指导物,由此接触蛋白水解酶的第一部分和第二部分并且蛋白水解酶的蛋白水解活性被重建。
在另一方面,本公开提供了用于鉴定含有目标寡核苷酸的细胞的方法。所述方法可包括用与报告物的非活性部分连接的第一Cas蛋白和与报告物的互补部分连接的第二Cas蛋白鉴定细胞。当接触报告物的非活性部分和互补部分时,报告物的活性被重建。在一些实施方案中,一种鉴定含有目标寡核苷酸的细胞的方法,所述方法包括使细胞中的寡核苷酸与组合物接触,所述组合物包含:i)连接至报告物的非活性第一部分的第一Cas12b效应蛋白;ii)连接至报告物的互补部分的第二Cas12b效应蛋白,其中当接触报告物的第一部分和互补部分时,报告物的活性被重建;iii)与第一Cas12b效应蛋白结合并与寡核苷酸的第一靶序列杂交的第一指导物;iv)与第二Cas12b效应蛋白结合并与寡核苷酸的第二靶序列杂交的第二指导物;以及v)报告物,其中当目标寡核苷酸存在于细胞中时,接触报告物的第一部分和第二部分,由此报告物的活性被重建。在一些实例中,报告物是荧光蛋白或发光蛋白。
在非动物生物体中的应用
C2c1-CRISPR系统在植物和酵母中的应用
通常,术语“植物”涉及植物界的任何各种光合、真核、单细胞或多细胞生物体,其特征在于通过细胞分裂而生长,含有叶绿体,并且细胞壁由纤维素组成。术语植物涵盖单子叶植物和双子叶植物。具体来说,植物意在包括但不限于被子植物和裸子植物,例如金合欢、苜蓿、苋菜红、苹果、杏、朝鲜蓟、白蜡树、芦笋、鳄梨、香蕉、大麦、豆类、甜菜、桦木、山毛榉、黑莓、蓝莓、西兰花、布鲁塞尔芽菜、卷心菜、坎诺拉油菜(canola)、哈密瓜、胡萝卜、木薯、花椰菜、雪松、谷物、芹菜、栗子、樱桃、大白菜、柑橘、克莱门柑(clementine)、三叶草、咖啡、玉米、棉花、豇豆、黄瓜、柏树、茄子、榆木、菊苣、桉树、茴香、无花果、冷杉、天竺葵、葡萄、葡萄柚、落花生、地樱桃、橡胶树、铁杉、山核桃、羽衣甘蓝、奇异果、大头菜、落叶松、生菜、韭菜、柠檬、酸橙、洋槐、松树、铁线蕨、玉米、芒果、枫树、甜瓜、小米、蘑菇、芥菜、坚果、橡木、燕麦、油棕、秋葵、洋葱、橙、观赏植物或花或树、木瓜、棕榈、欧芹、欧洲防风草、豌豆、桃、花生、梨、泥煤、胡椒、柿子、木豆、松树、菠萝、车前草、李子、石榴、马铃薯、南瓜、意大利菊苣、萝卜、油菜籽、覆盆子、水稻、黑麦、高粱、红花、柳、大豆、菠菜、云杉、倭瓜、草莓、糖甜菜、甘蔗、向日葵、甘薯、甜玉米、橘子、茶、烟草、番茄、树木、黑小麦、草皮草、芜菁、藤蔓、胡桃、西洋菜、西瓜、小麦、山药、紫杉和西葫芦。术语植物还涵盖藻类,它们主要是主要由于缺乏根、叶和其他代表高等植物的器官而成为一体的光合自养生物。
如本文所述的使用C2c1系统进行基因组编辑的方法可用于在基本上任何植物上赋予期望的性状。使用本公开的核酸构建体和上述各种转化方法,可针对本文所述的所需生理和农艺学特性对广泛多种植物和植物细胞系统进行工程化。在优选的实施方案中,用于工程化的靶植物和植物细胞包括但不限于那些单子叶和双子叶植物,例如包括以下的作物:谷类作物(例如小麦、玉米、水稻、小米、大麦),水果作物(例如番茄、苹果、梨、草莓、橙),饲料作物(例如苜蓿),块根蔬菜作物(例如胡萝卜、马铃薯、糖甜菜、山药),叶菜类作物(例如生菜、菠菜);开花植物(例如矮牵牛、玫瑰、菊花),针叶树和松树(例如松、杉、云杉);植物修复中使用的植物(例如重金属累积植物);油料作物(例如向日葵、油菜籽)和用于实验目的的植物(例如拟南芥)。因此,所述方法和CRISPR-Cas系统可在广泛多种植物上使用,例如用于属于以下各目的双子叶植物:木兰目(Magniolales)、八角目(Illiciales)、樟目(Laurales)、胡椒目(Piperales)、马兜铃目(Aristolochiales)、睡莲目(Nymphaeales)、毛茛目(Ranunculales)、罂粟目(Papeverales)、瓶子草科(Sarraceniaceae)、昆栏树目(Trochodendrales)、金缕梅目(Hamamelidales)、杜仲目(Eucomiales)、塞子木目(Leitneriales)、杨梅目(Myricales)、壳斗目(Fagales)、木麻黄目(Casuarinales)、石竹目(Caryophyllales)、肉穗果目(Batales)、蓼目(Polygonales)、白花丹目(Plumbaginales)、五桠果目(Dilleniales)、山茶目(Theales)、锦葵目(Malvales)、荨麻目(Urticales)、玉蕊目(Lecythidales)、堇菜目(Violales)、杨柳目(Salicales)、白花菜目(Capparales)、杜鹃花目(Ericales)、岩梅目(Diapensales)、柿树目(Ebenales)、报春花目(Primulales)、蔷薇目(Rosales)、豆目(Fabales)、川草目(Podostemales)、小二仙草目(Haloragales)、桃金娘目(Myrtales)、山茱萸目(Cornales)、山龙眼目(Proteales)、檀香目(Santales)、大花草目(Rafflesiales)、卫矛目(Celastrales)、大戟目(Euphorbiales)、鼠李目(Rhamnales)、无患子目(Sapindales)、胡桃目(Juglandales)、牻牛儿苗目(Geraniales)、远志目(Polygalales)、伞形目(Umbellales)、龙胆目(Gentianales)、花葱目(Polemoniales)、唇形目(Lamiales)、车前目(Plantaginales)、玄参目(Scrophulariales)、桔梗目(Campanulales)、茜草目(Rubiales)、川续断目(Dipsacales)和菊目(Asterales);所述方法和CRISPR-Cas系统可用于单子叶植物,例如属于以下各目的单子叶植物:泽泻目(Alismatales)、水鳖目(Hydrocharitales)、茨藻目(Najadales)、霉草目(Triuridales)、鸭跖草目(Commelinales)、谷精草目(Eriocaulales)、帚灯草目(Restionales)、禾本目(Poales)、灯芯草目(Juncales)、莎草目(Cyperales)、香蒲目(Typhales)、凤梨目(Bromeliales)、姜目(Zingiberales)、槟榔目(Arecales)、环花目(Cyclanthales)、露兜树目(Pandanales)、天南星目(Arales)、百合目(Lilliales)和兰目(Orchidales),或者用于属于裸子植物的植物,例如属于以下各目的裸子植物:松柏目(Pinales)、银杏目(Ginkgoales)、苏铁目(Cycadales)、南洋杉目(Araucariales)、柏目(Cupressales)和买麻藤目(Gnetales)。
本文所述的CRISPR-C2c1系统和使用方法可用于广泛多种植物物种,包括以下双子叶植物、单子叶植物或裸子植物属的非限制性列表:颠茄属(Atropa)、油丹属(Alseodaphne)、腰果属(Anacardium)、落花生属(Arachis)、琼楠属(Beilschmiedia)、芸薹属(Brassica)、红花属(Carthamus)、木防己属(Cocculus)、巴豆属(Croton)、黄瓜属(Cucumis)、柑橘属(Citrus)、西瓜属(Citrullus)、辣椒属(Capsicum)、长春花属(Catharanthus)、椰子属(Cocos)、咖啡属(Coffea)、南瓜属(Cucurbita)、胡萝卜属(Daucus)、端心木属(Duguetia)、花菱草属(Eschscholzia)、榕属(Ficus)、草莓属(Fragaria)、海罂粟属(Glaucium)、大豆属(Glycine)、棉属(Gossypium)、向日葵属(Helianthus)、橡胶树属(Hevea)、天仙子属(Hyoscyamus)、莴苣属(Lactuca)、卷枝藤属(Landolphia)、亚麻属(Linum)、木姜子属(Litsea)、番茄属(Lycopersicon)、羽扇豆属(Lupinus)、木薯属(Manihot)、马郁兰属(Majorana)、苹果属(Malus)、苜蓿属(Medicago)、烟草属(Nicotiana)、木犀榄属(Olea)、银胶菊属(Parthenium)、罂粟属(Papaver)、鳄梨属(Persea)、菜豆属(Phaseolus)、黄连木属(Pistacia)、豌豆属(Pisum)、梨属(Pyrus)、李属(Prunus)、萝卜属(Raphanus)、蓖麻属(Ricinus)、千里光属(Senecio)、风龙属(Sinomenium)、千金藤属(Stephania)、白芥属(Sinapis)、茄属(Solanum)、可可属(Theobroma)、车轴草属(Trifolium)、胡卢巴属(Trigonella)、野豌豆属(Vicia)、蔓长春花属(Vinca)、葡萄属(Vilis)和豇豆属(Vigna);以及以下各属:葱属(Allium)、须芒草属(Andropogon)、剪股颖属(Aragrostis)、天门冬属(Asparagus)、燕麦属(Avena)、狗牙根属(Cynodon)、油棕属(Elaeis)、羊茅属(Festuca)、羊茅黑麦草属(Festulolium)、萱草属(Heterocallis)、大麦属(Hordeum)、浮萍属(Lemna)、黑麦草属(Lolium)、芭蕉属(Musa)、稻属(Oryza)、黍属(Panicum)、狼尾草属(Pannesetum)、梯牧草属(Phleum)、早熟禾属(Poa)、黑麦属(Secale)、高粱属(Sorghum)、小麦属(Triticum)、玉蜀黍属(Zea)、冷杉属(Abies)、杉木属(Cunninghamia)、麻黄属(Ephedra)、云杉属(Picea)、松属(Pinus)和黄杉属(Pseudotsuga)。
CRISPR-C2c1系统和使用方法也可用于范围广泛的“藻类”或“藻类细胞”;包括例如选自若干真核门的藻类,包括红藻门(Rhodophyta)(红藻)、绿藻门(Chlorophyta)(绿藻)、褐藻门(Phaeophyta)(褐藻)、硅藻门(Bacillariophyta)(硅藻)、真眼点藻门(Eustigmatophyta)和甲藻(dinoflagellates)以及原核门的蓝绿藻(Cyanobacteria/blue-green algae)。术语“藻类”包括例如选自以下的藻类:双眉藻属(Amphora)、鱼腥藻属(Anabaena)、纤维藻属(Anikstrodesmis)、葡萄藻属(Botryococcus)、角毛藻属(Chaetoceros)、衣藻属(Chlamydomonas)、小球藻属(Chlorella)、绿球藻属(Chlorococcum)、小环藻属(Cyclotella)、筒柱藻属(Cylindrotheca)、杜氏藻属(Dunaliella)、球石藻属(Emiliana)、裸藻属(Euglena)、红球藻属(Hematococcus)、等鞭金藻属(Isochrysis)、单鞭金藻属(Monochrysis)、单针藻属(Monoraphidium)、微球藻属(Nannochloris)、拟微绿球藻属(Nannnochloropsis)、舟形藻属(Navicula)、肾鞭藻属(Nephrochloris)、肾藻属(Nephroselmis)、菱形藻属(Nitzschia)、节球藻属(Nodularia)、念珠藻属(Nostoc)、金藻属(Oochromonas)、卵囊藻属(Oocystis)、Oscillartoria、巴夫藻属(Pavlova)、褐指藻属(Phaeodactylum)、扁藻属(Playtmonas)、颗石藻属(Pleurochrysis)、甘紫菜属(Porhyra)、伪鱼腥藻属(Pseudoanabaena)、塔胞藻属(Pyramimonas)、裂丝藻属(Stichococcus)、聚球藻属(Synechococcus)、集胞藻属(Synechocystis)、四鞭藻属(Tetraselmis)、海链藻属(Thalassiosira)和蓝藻属(Trichodesmium)。
可根据本发明的方法处理植物的一部分,即“植物组织”,以产生改良的植物。植物组织也涵盖植物细胞。如本文所用的术语“植物细胞”是指活体植物的个体单元,其在完整的整株植物中或呈在体外组织培养中、在培养基或琼脂上、以生长培养基或缓冲液中的悬浮液形式生长的分离形式或作为较高组织化单元(例如植物组织、植物器官或整株植物)的一部分。
“原生质体”是指植物细胞已经通过使用例如机械或酶促方法全或部分去除了其保护性细胞壁,从而产生了活体植物的完整的生化胜任单元,所述原生质体可重新形成其细胞壁,在适当的生长条件下增殖并再生生长成完整的植物。
术语“转化”广义上是指通过农杆菌或多种化学或物理方法之一通过引入DNA对植物宿主进行遗传修饰的过程。如本文所用,术语“植物宿主”是指植物,包括植物的任何细胞、组织、器官或后代。许多合适的植物组织或植物细胞可进行转化,并且其包括但不限于原生质体、体细胞胚、花粉、叶片、幼苗、茎、愈伤组织、匍匐茎、微块茎和芽。植物组织还指这种植物、种子、后代、繁殖体的任何克隆,无论是有性或无性繁殖的,以及任何这些的后代,例如插条或种子。
如本文所用,术语“转化的”是指已向其中引入外来DNA分子例如构建体的细胞、组织、器官或生物体。可将引入的DNA分子整合到受体细胞、组织、器官或生物体的基因组DNA中,使得所引入的DNA分子被传递至随后的后代。在这些实施方案中,“转化的”或“转基因的”细胞或植物还可包括所述细胞或植物的后代,以及从育种程序产生的后代,所述育种程序使用这种转化的植物作为杂交中的亲本并表现出由所引入的DNA分子的存在而产生的改变的表型。优选地,转基因植物是可育的并且能够通过有性繁殖将所引入的DNA传递给后代。
术语“后代”,例如转基因植物的后代,是由植物或转基因植物生出、产生或衍生的后代。所引入的DNA分子也可被瞬时引入受体细胞中,使得所引入的DNA分子不会被随后的后代遗传,因此不被认为是“转基因的”。因此,如本文所用,“非转基因”植物或植物细胞是不包含稳定整合到其基因组中的外来DNA的植物。
如本文所用,术语“植物启动子”是能够启动植物细胞中的转录的启动子,而不管其起源是否是植物细胞。示例性的合适的植物启动子包括但不限于从植物、植物病毒以及包含在植物细胞中表达的基因的细菌例如农杆菌或根瘤菌获得的那些。
如本文所用,“真菌细胞”是指真菌界内的任何类型的真核细胞。真菌界内的门包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、芽枝霉门(Blastocladiomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、微孢子门(Microsporidia)和新美鞭菌门(Neocallimastigomycota)。真菌细胞可包括酵母、霉菌和丝状真菌。在一些实施方案中,真菌细胞是酵母细胞。
如本文所用,术语“酵母细胞”是指子囊菌门和担子菌门内的任何真菌细胞。酵母细胞可包括出芽的酵母细胞、裂变酵母细胞和霉菌细胞。不限于这些生物体,在实验室和工业环境中使用的许多类型的酵母是子囊菌门的一部分。在一些实施方案中,酵母细胞是啤酒酵母(S.cerervisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)或东方伊萨酵母(Issatchenkia orientalis)细胞。其他酵母细胞可包括但不限于假丝酵母属(Candida)(例如白色念珠菌(Candida albicans)),耶氏酵母属(Yarrowia)(例如解脂耶氏酵母(Yarrowia lipolytica)),毕赤酵母属(Pichia)(例如巴斯德毕赤酵母(Pichiapastoris)),克鲁维酵母属(Kluyveromyces)(例如乳酸克鲁维酵母(Kluyveromyceslactis)和马克斯克鲁维酵母(Kluyveromyces marxianus)),链孢霉属(Neurospora)(例如粗糙链孢霉(Neurospora crassa)),镰刀菌属(Fusarium)(例如尖孢镰刀菌(Fusariumoxysporum))和伊萨酵母属(Issatchenkia)(例如东方伊萨酵母(Issatchenkiaorientalis),又称为库德毕赤酵母(Pichia kudriavzevii)和酸嗜热假丝酵母(Candidaacidothermophilum))。在一些实施方案中,真菌细胞是丝状真菌细胞。如本文所用,术语“丝状真菌细胞”是指在丝状体中生长的任何类型的真菌细胞,即菌丝或菌丝体。丝状真菌细胞的实例可包括但不限于曲霉属(Aspergillus)(例如黑曲霉(Aspergillus niger)),木霉属(Trichoderma)(例如里氏木霉(Trichoderma reesei)),根霉属(Rhizopus)(例如米根霉(Rhizopus oryzae))和被孢霉属(Mortierella)(例如深黄被孢霉(Mortierellaisabellina))。
在一些实施方案中,真菌细胞是工业菌株。如本文所用,“工业菌株”是指在工业过程中使用或分离的任何真菌细胞菌株,例如,以商业或工业规模生产产品。工业菌株可指通常在工业过程中使用的真菌物种,或者可指也可用于非工业目的(例如实验室研究)的真菌物种的分离物。工业过程的实例可包括发酵(例如,在食品或饮料产品的生产中),蒸馏,生物燃料的生产,化合物的生产以及多肽的生产。工业菌株的实例可包括但不限于JAY270和ATCC4124。
在一些实施方案中,真菌细胞是多倍体细胞。如本文所用,“多倍体”细胞可指其基因组以一个以上拷贝存在的任何细胞。多倍体细胞可指以多倍体状态天然存在的细胞类型,或者其可指已经被诱导以多倍体状态存在的细胞(例如,通过特定的调控、改变、失活、活化,或减数分裂、胞质分裂或DNA复制的修饰)。多倍体细胞可指其整个基因组是多倍体的细胞,或者其可指在特定的目标基因组基因座中为多倍体的细胞。不希望受理论的束缚,据认为,在多倍体细胞的基因组工程中,相比于单倍体细胞的基因组工程中,指导RNA的丰度可能更通常是限速组分,因此,使用本文所述的C2c1 CRISPRS系统的方法可利用使用某种真菌细胞类型的优势。
在一些实施方案中,真菌细胞是二倍体细胞。如本文所用,“二倍体”细胞可指其基因组以两个拷贝存在的任何细胞。二倍体细胞可指以二倍体状态天然存在的细胞类型,或者其可指已经被诱导以二倍体状态存在的细胞(例如,通过特定的调控、改变、失活、活化,或减数分裂、胞质分裂或DNA复制的修饰)。例如,酿酒酵母菌株S228C可维持在单倍体或二倍体状态。二倍体细胞可指其整个基因组是二倍体的细胞,或者其可指在目标特定基因组基因座中为二倍体的细胞。在一些实施方案中,真菌细胞是单倍体细胞。如本文所用,“单倍体”细胞可指其基因组以一个拷贝存在的任何细胞。单倍体细胞可指以单倍体状态天然存在的细胞类型,或者其可指已经被诱导以单倍体状态存在的细胞(例如,通过特定的调控、改变、失活、活化,或减数分裂、胞质分裂或DNA复制的修饰)。例如,酿酒酵母菌株S228C可维持在单倍体或二倍体状态。单倍体细胞可指其整个基因组为单倍体的细胞,或者其可指在目标特定基因组基因座中为单倍体的细胞。
如本文所用,“酵母表达载体”是指包含一个或多个编码RNA和/或多肽的序列并且还可包含控制核酸表达的任何所需元件以及能够在酵母细胞内部复制和维持表达载体的任何元件的核酸。许多合适的酵母表达载体及其特征在本领域中是已知的;例如,各种载体和技术说明于Yeast Protocols,第2版,Xiao,W.编辑(Humana Press,New York,2007);以及Buckholz,R.G.和Gleeson,M.A.(1991)Biotechnology(NY)9(11):1067-72。酵母载体可包含但不限于着丝粒(CEN)序列,自主复制序列(ARS),可操作地连接至目标序列或基因的启动子(例如RNA聚合酶III启动子),终止子如RNA聚合酶III终止子,复制起点和标志基因(例如营养缺陷型、抗生素或其他可选择标志物)。用于酵母的表达载体的实例可包括质粒,酵母人工染色体,2μ质粒,酵母整合质粒,酵母复制质粒,穿梭载体和游离质粒。
CRISPR-C2c1系统组分在植物和植物细胞的基因组中的稳定整合
在特定的实施方案中,设想引入编码CRISPR-C2c1系统的组分的多核苷酸以稳定整合到植物细胞的基因组中。在这些实施方案中,转化载体或表达系统的设计可根据何时、何地以及在何种条件下表达指导RNA和/或C2c1基因来进行调节。
在特定的实施方案中,设想将CRISPR-C2c1系统的组分稳定地引入植物细胞的基因组DNA中。另外地或可替代地,设想引入CRISPR-C2c1系统的组分以稳定整合到植物细胞器的DNA中,所述植物细胞器例如但不限于质体、线粒体或叶绿体。
用于稳定整合到植物细胞的基因组中的表达系统可包含一种或多种以下元件:可用于在植物细胞中表达RNA和/或C2c1酶的启动子元件;5'非翻译区域,以增强表达;内含子元件,以进一步增强某些细胞如单子叶植物细胞中的表达;多克隆位点,为插入指导RNA和/或C2c1基因序列和其他所需元件提供适宜的限制性位点;以及3'非翻译区,以提供所表达的转录物的有效终止。
表达系统的元件可在一个或多个表达构建体上,所述构建体是环状的,例如质粒或转化载体,或者是非环状的,例如线性双链DNA。
在一个特定的实施方案中,C2c1 CRISPR表达系统至少包含:
(a)编码与植物中的靶序列杂交的指导RNA(gRNA)的核苷酸序列,并且其中所述指导RNA包含指导序列和正向重复序列,
(b)编码tracr RNA的核苷酸序列,以及
(c)编码C2c1蛋白的核苷酸序列,
其中组分(a)或(b)或(c)位于相同或不同的构建体上,并且由此不同的核苷酸序列可在植物细胞中可操作的相同或不同的调控元件的控制下。tracr可与指导RNA融合。
可通过多种常规技术将包含CRISPR-C2c1系统组分以及适当时模板序列的DNA构建体引入植物、植物部分或植物细胞的基因组中。所述方法通常包括以下步骤:选择合适的宿主细胞或宿主组织,将构建体引入宿主细胞或宿主组织,以及从其再生植物细胞或植物。
在特定的实施方案中,可使用例如但不限于植物细胞原生质体的电穿孔、显微注射,气溶胶束注射的技术将DNA构建体引入植物细胞中,或者可使用生物弹射法将DNA构建体直接引入植物组织,例如DNA粒子轰击(也参见Fu等人,Transgenic Res.2000年2月;9(1):11-9)。粒子轰击的基础是被目标基因包被的粒子向细胞的加速,导致原生质被粒子穿透并且通常稳定整合到基因组中。(参见例如Klein等人,Nature(1987);Klein等人,Bio/Technology(1992);Casas等人,Proc.Natl.Acad.Sci.USA(1993))。
在特定的实施方案中,可通过农杆菌介导的转化将含有CRISPR-C2c1系统的组分的DNA构建体引入植物中。可将DNA构建体与合适的T-DNA侧翼区组合,并引入常规的根癌农杆菌(Agrobacterium tumefaciens)宿主载体中。通过感染植物或通过用含有一种或多种Ti(诱导肿瘤)质粒的农杆菌属细菌温育植物原生质体,可将外来DNA并入植物基因组中。(参见例如Fraley等人,(1985);Rogers等人,(1987);以及美国专利第5,563,055号)。
植物启动子
为了确保在植物细胞中的适当表达,本文所述的CRISPR-C2c1系统的组分通常置于植物启动子,即在植物细胞中可操作的启动子的控制下。设想使用不同类型的启动子。
组成型植物启动子是能够表达在植物的所有或几乎所有发育阶段在所有或几乎所有植物组织中控制的开放阅读框(ORF)的启动子(称为“组成型表达”)。组成型启动子的一个非限制性实例是花椰菜花叶病毒35S启动子。“调控的启动子”是指不是组成型地而是以时间和/或空间调控的方式引导基因表达的启动子,并且包括组织特异性的、组织优选的和诱导型的启动子。不同的启动子可引导基因在不同的组织或细胞类型中,或在不同的发育阶段,或响应于不同的环境条件而表达。在特定的实施方案中,一种或多种C2c1CRISPR组分在组成型启动子例如花椰菜花叶病毒35S启动子的控制下表达,组织优选的启动子可用于靶向特定植物组织内某些细胞类型(例如叶或根或种子特定细胞中的维管细胞)中的增强表达。在CRISPR-C2c1系统中使用的特定启动子的实例可见于Kawamata等人,(1997)Plant Cell Physiol38:792-803;Yamamoto等人,(1997)Plant J 12:255-65;Hire等人,(1992)Plant Mol Biol 20:207-18;Kuster等人,(1995)Plant Mol Biol 29:759-72;以及Capana等人,(1994)Plant Mol Biol 25:681-91。
可诱导的并且允许时空控制基因编辑或基因表达的启动子的实例可使用能量的形式。能量的形式可包括但不限于声能、电磁辐射、化学能和/或热能。诱导系统的实例包括四环素诱导型启动子(Tet-On或Tet-Off),小分子双杂合转录激活系统(FKBP、ABA等)或光诱导系统(植物色素、LOV结构域或隐花色素),例如光诱导型转录效应子(LITE),其以序列特异性方式引导转录活性的变化。光诱导系统的组分可包括C2c1 CRISPR酶、光响应性细胞色素异二聚体(例如来自拟南芥)和转录激活/阻遏结构域。可诱导的DNA结合蛋白及其使用方法的其他实例提供于US 61/736465和US 61/721,283,其通过引用整体并入本文。
在特定的实施方案中,瞬时或可诱导的表达可通过使用例如化学调控的启动子来实现,即由此外源化学物质的应用诱导基因表达。基因表达的调节还可通过化学可阻遏的启动子获得,其中化学物质的应用阻遏基因表达。化学诱导型启动子包括但不限于由苯磺酰胺除草剂安全剂激活的玉米ln2-2启动子(De Veylder等人,(1997)Plant Cell Physiol38:568-77),被用作芽前除草剂的疏水性亲电化合物激活的玉米GST启动子(GST-ll-27,WO93/01294),以及被水杨酸激活的烟草PR-1a启动子(Ono等人,(2004)Biosci BiotechnolBiochem 68:803-7)。本文中也可使用由抗生素调控的启动子,例如四环素诱导型和四环素阻遏型启动子(Gatz等人,(1991)Mol Gen Genet 227:229-37;美国专利第5,814,618号和第5,789,156号)。
易位至特定植物细胞器和/或在特定植物细胞器中表达
表达系统可包含用于易位至特定植物细胞器和/或在特定植物细胞器中表达的元件。
叶绿体靶向。在特定的实施方案中,设想将CRISPR-C2c1系统用于特异性修饰叶绿体基因或确保在叶绿体中表达。为此目的,使用叶绿体转化方法或将C2c1 CRISPR组分分隔到叶绿体。例如,在质体基因组中引入遗传修饰可减少生物安全性问题,例如通过花粉进行基因流动。
叶绿体转化的方法是本领域已知的,并且包括粒子轰击、PEG处理和显微注射。另外,可如WO2010061186中所述使用涉及将转化盒从核基因组易位至质体的方法。
或者,设想将一种或多种C2c1 CRISPR组分靶向植物叶绿体。这是通过将编码叶绿体转运肽(CTP)或质体转运肽的序列并入表达构建体中来实现的,所述序列可操作地连接至编码C2c1蛋白的序列的5'区域。在易位到叶绿体期间的处理步骤中,CTP被去除。所表达蛋白质的叶绿体靶向是技术人员众所周知的(参见例如Protein Transport intoChloroplasts,2010,Annual Review of Plant Biology,第61卷:157-180)。在这样的实施方案中,还期望将指导RNA靶向植物叶绿体。可用于通过叶绿体定位序列将指导RNA易位到叶绿体中的方法和构建体描述于例如US 20040142476中,其通过引用并入本文。可将这种构建体的变体并入本发明的表达系统中,以有效地易位C2c1-指导RNA。
在藻类细胞中引入编码CRISPR-C2c1系统的多核苷酸。
转基因藻类(或其他植物如油菜)在生产植物油或生物燃料如醇类(尤其是甲醇和乙醇)或其他产品中可能特别有用。这些可被设计成表达或过表达用于石油或生物燃料工业的高水平的油或醇。
US 8945839描述了一种使用Cas9将微藻(莱茵衣藻(Chlamydomonasreinhardtii)细胞)物种工程化的方法。使用类似的工具,本文所述的CRISPR-C2c1系统的方法可应用于衣藻属物种和其他藻类。在特定的实施方案中,将C2c1和指导RNA引入使用在组成型启动子例如Hsp70A-Rbc S2或β2-微管蛋白的控制下表达C2c1的载体表达的藻类中。指导RNA任选地使用含有T7启动子的载体递送。或者,可将C2c1 mRNA和体外转录的指导RNA递送至藻类细胞。电穿孔方案对于技术人员是可用的,例如来自GeneArt衣藻工程化试剂盒的标准推荐方案。
在特定的实施方案中,本文使用的核酸内切酶是分裂C2c1酶。如WO2015086795中对于Cas9所描述的那样,分裂C2c1酶优先用于藻类中以用于靶向基因组修饰。C2c1分裂系统的使用特别适用于可诱导的基因组靶向方法,并且避免了C2c1过表达在藻类细胞内的潜在毒性作用。在特定的实施方案中,可将所述C2c1分裂结构域(RuvC结构域)同时或依序地引入细胞中,以使得所述分裂C2c1结构域在藻类细胞中加工靶核酸序列。与野生型C2c1相比,分裂C2c1的大小减小,允许将CRISPR系统递送至细胞的其他方法,例如使用如本文所述的细胞穿透肽。这种方法对于生成遗传修饰藻类特别令人感兴趣。
在酵母细胞中引入编码C2c1组分的多核苷酸
在特定的实施方案中,本发明涉及CRISPR-C2c1系统在酵母细胞的基因组编辑中的用途。转化酵母细胞的方法可用于引入编码CRISPR-C2c1系统组分的多核苷酸,这是本领域技术人员众所周知的,并且综述于Kawai等人,2010,Bioeng Bugs.2010年11月至12月;1(6):395-403)。非限制性实例包括通过乙酸锂处理(其还可包括载体DNA和PEG处理)、轰击或通过电穿孔转化酵母细胞。
C2c1 CRISP系统组分在植物和植物细胞中的瞬时表达
在特定的实施方案中,设想了指导RNA和/或C2c1基因在植物细胞中瞬时表达。在这些实施方案中,仅当指导RNA和C2c1蛋白都存在于细胞中时,CRISPR-C2c1系统才能确保靶基因的修饰,从而可进一步控制基因组修饰。由于C2c1酶的表达是瞬时的,因此从此类植物细胞再生的植物通常不包含外来DNA。在特定的实施方案中,C2c1酶由植物细胞稳定表达,并且指导序列是瞬时表达的。
在特定的实施方案中,可使用植物病毒载体将CRISPR-C2c1系统组分引入植物细胞中(Scholthof等人,1996,Annu Rev Phytopathol.1996;34:299-323)。在其他特定实施方案中,所述病毒载体是来自DNA病毒的载体。例如,双生病毒(例如卷心菜叶卷曲病毒、豆黄矮化病毒、小麦矮化病毒、番茄叶卷曲病毒、玉米条纹病毒、烟草叶卷曲病毒或番茄金黄花叶病毒)或纳米病毒(例如蚕豆坏死黄色病毒)。在其他特定的实施方案中,所述病毒载体是来自RNA病毒的载体。例如,妥布病毒(例如,烟草脆裂病毒、烟草花叶病毒),马铃薯X病毒(例如马铃薯病毒X)或大麦病毒(例如大麦条纹花叶病毒)。植物病毒的复制基因组是非整合载体。
在特定的实施方案中,用于C2c1 CRISPR构建体瞬时表达的载体是例如pEAQ载体,该载体针对在原生质体中农杆菌介导的瞬时表达而定制(Sainsbu ry F.等人,PlantBiotechnol J.2009年9月;7(7):682-93)。使用修饰的卷心菜叶卷曲病毒(CaLCuV)载体在表达CRISPR酶的稳定转基因植物中表达gRNA证明了基因组位置的精确靶向(ScientificReports 5,文章编号:14926(2015),doi:10.1038/srep14926)。
在特定的实施方案中,可将编码指导RNA和/或C2c1基因的双链DNA片段瞬时引入植物细胞。在这样的实施方案中,所引入的双链DNA片段以足以修饰细胞的量提供,但是在经过预期的时间段之后或在一次或多次细胞分裂后不会持续存在。植物中直接DNA转移的方法是技术人员已知的(参见例如Davey等人,Plant Mol Biol.1989年9月;13(3):273-85)。
在其他实施方案中,将编码C2c1蛋白的RNA多核苷酸引入植物细胞,然后由宿主细胞翻译和加工,产生足以修饰细胞的量的蛋白(在至少一个指导RNA的存在下),但是在经过预期的时间段后或一次或多次细胞分裂后,这种作用不会持续存在。将mRNA引入植物原生质体以进行瞬时表达的方法是技术人员已知的(参见例如Gallie,Plant Cell Reports(1993),13;119-122)。
还设想了上述不同方法的组合。
将C2c1 CRISPR组分递送至植物细胞
在特定的实施方案中,令人感兴趣的是将CRISPR-C2c1系统的一种或多种组分直接递送至植物细胞。这对于非转基因植物的生成是尤其令人感兴趣的(参见下文)。在特定的实施方案中,一个或多个C2c1组分在植物或植物细胞外部制备并递送至细胞。例如,在特定的实施方案中,在引入植物细胞之前在体外制备C2c1蛋白。C2c1蛋白可通过本领域技术人员已知的多种方法制备,并且包括重组生产。表达后,将C2c1蛋白分离,根据需要重新折叠,纯化并任选地处理以去除任何纯化标签,例如His标签。一旦获得粗制的、部分纯化的或更完全纯化的C2c1蛋白,就可将所述蛋白引入植物细胞。
在特定的实施方案中,将C2c1蛋白与靶向目标基因的指导RNA混合以形成预组装的核糖核蛋白。
可经由电穿孔,通过与C2c1相关的基因产物包被的粒子轰击,通过化学转染或通过一些其他跨细胞膜转运的手段,将单个组分或预组装的核糖核蛋白引入植物细胞。例如,已经证明用预组装的CRISPR核糖核蛋白转染植物原生质体以确保对植物基因组的靶向修饰(如Woo等人,Nature Biotechnology,2015;DOI:10.1038/nbt.3389所述)。
在特定的实施方案中,使用粒子将CRISPR-C2c1系统组分引入植物细胞。可将作为蛋白质或核酸或其组合的组分上载到粒子上或包装在粒子中并施加到植物(例如,在WO2008042156和US 20130185823中所述)。特别地,本发明的实施方案包括用如WO2015089419中所述的编码C2c1蛋白的DNA分子、编码指导RNA和/或分离的指导RNA的DNA分子上载或包装的粒子。
将CRISPR-C2c1系统的一种或多种组分引入植物细胞的其他手段是通过使用细胞穿透肽(CPP)。因此,特别地,本发明的实施方案包括包含与C2c1蛋白连接的细胞穿透肽的组合物。在本发明的特定实施方案中,C2c1蛋白和/或指导RNA与一种或多种CPP偶联,以有效地将其转运到植物原生质体内部;还参见Ramakrishna(20140Genome Res.2014年6月;24(6):1020-7,对于人类细胞中的Cas9)。在其他实施方案中,C2c1基因和/或指导RNA由一个或多个环状或非环状DNA分子编码,所述环状或非环状DNA分子与一种或多种CPP偶联以用于植物原生质体递送。然后将植物原生质体再生为植物细胞并进一步再生为植物。CPP通常被描述为少于35个氨基酸的短肽,其来源于蛋白质或嵌合序列,其能够以不依赖受体的方式跨细胞膜转运生物分子。CPP可以是阳离子肽,具有疏水性序列的肽,两亲性肽,具有富含脯氨酸和抗微生物序列的肽,以及嵌合或二分肽(Pooga和Langel 2005)。CPP能够穿透生物膜并因此触发各种生物分子穿过细胞膜进入细胞质并改善它们的细胞内路径,并因此促进生物分子与靶标的相互作用。CPP的实例尤其包括:Tat,HIV 1型病毒复制所需的核转录激活蛋白,penetratin,Kaposi成纤维细胞生长因子(FGF)信号肽序列,整联蛋白β3信号肽序列;聚精氨酸肽Args序列,富鸟嘌呤分子转运蛋白,甜箭肽等。
使用CRISPR-C2c1系统产生遗传修饰的非转基因植物
在特定的实施方案中,本文所述的方法用于修饰内源基因或修饰其表达,而无需将任何外来基因(包括编码CRISPR组分的那些)永久引入植物的基因组中,以避免植物的基因组中外来DNA的存在。由于非转基因植物的法规要求较不严格,因此这可能是令人感兴趣的。
在特定的实施方案中,这通过C2c1 CRISPR组分的瞬时表达来确保。在特定的实施方案中,一种或多种CRISPR组分在一种或多种病毒载体上表达,所述病毒载体产生足够的C2c1蛋白和指导RNA以根据本文所述的方法始终稳定地确保目标基因的修饰。
在特定的实施方案中,确保了C2c1 CRISPR构建体在植物原生质体中的瞬时表达,因此没有整合到基因组中。有限的表达窗口可足以允许CRISPR-C2c1系统确保如本文所述的靶基因的修饰。
在特定的实施方案中,借助于如上文所述的递送分子如粒子或CPP分子的颗粒,将CRISPR-C2c1系统的不同组分分别地或以混合物形式引入植物细胞、原生质体或植物组织中。
C2c1 CRISPR组分的表达可通过C2c1核酸酶的直接活性和任选地引入模板DNA或通过使用如本文所述的CRISPR-C2c1系统靶向的基因进行修饰来诱导基因组的靶向修饰。上文描述的不同策略允许C2c1介导的靶向基因组编辑,而无需将C2c1 CRISPR组分引入植物基因组。瞬时引入植物细胞中的组分通常在杂交时被去除。
检测植物基因组-可选择标志物中的修饰
在特定的实施方案中,在所述方法涉及植物基因组的内源靶基因的修饰的情况下,在用CRISPR-C2c1系统感染或转染植物、植物部分或植物细胞后,可使用任何合适的方法来确定在靶位点是否发生了基因靶向或靶向诱变。当所述方法涉及转基因的引入时,可通过选择或筛选工程化植物材料中转基因的存在或转基因编码的性状来鉴定和分离转化的植物细胞、愈伤组织、组织或植物。物理和生化方法可用于鉴定含有插入的基因构建体或内源性DNA修饰的植物或植物细胞转化体。这些方法包括但不限于:1)Southern分析或PCR扩增,用于检测和确定重组DNA插入物或修饰的内源基因的结构;2)Northern印迹,S1 RNA酶保护,引物延伸或逆转录酶-PCR扩增,用于检测和检查基因构建体的RNA转录物;3)用于检测酶或核酶活性的酶促测定,其中此类基因产物由基因构建体编码或者表达受遗传修饰影响;4)蛋白质凝胶电泳,Western印迹技术,免疫沉淀或酶联免疫测定,其中基因构建体或内源基因产物为蛋白质。其他技术,例如原位杂交、酶染色和免疫染色,也可用于检测重组构建体的存在或表达或者检测特定植物器官和组织中内源基因的修饰。进行所有这些测定的方法是本领域技术人员众所周知的。
另外地(或可替代地),编码C2c1 CRISPR组分的表达系统通常被设计成包含一个或多个可选择或可检测的标志物,所述标志物提供了一种手段以在早期和大规模地分离或有效地选择包含CRISPR-C2c1系统和/或已被CRISPR-C2c1系统修饰的细胞。
在农杆菌介导的转化的情况下,标志物盒可与侧翼T-DNA边界相邻或在其之间,并包含在二元载体中。在另一个实施方案中,标志物盒可在T-DNA的外部。可选择的标志物盒也可在与表达盒相同的T-DNA边界之内或附近,或者可在二元载体(例如2T-DNA系统)上的第二T-DNA内的其他地方。
对于粒子轰击或用原生质体转化,表达系统可包含一个或多个分离的线性片段,或者可以是较大构建体的一部分,所述较大构建体可能包含细菌复制元件、细菌可选择标志物或其他可检测元件。包含编码指导物和/或C2c1的多核苷酸的表达盒可与标志物盒物理连接,或者可与编码标志物盒的第二核酸分子混合。标志物盒由表达可检测或可选择标志物的必要元件组成,其允许有效选择转化细胞。
基于可选择标志物的细胞选择程序将取决于标志基因的性质。在特定的实施方案中,使用可选择的标志物,即允许基于标志物的表达直接选择细胞的标志物。可选择标志物可赋予阳性或阴性选择,并且取决于外部底物的存在是条件性或非条件性的(Miki等人,2004,107(3):193-232)。最常见的是,将抗生素或除草剂抗性基因用作标志物,从而通过在含有抑制量的标志基因赋予抗性的抗生素或除草剂的培养基上生长工程化植物材料来进行选择。此类基因的实例是赋予抗生素如潮霉素(hpt)和卡那霉素(nptII)抗性的基因,以及赋予除草剂如膦丝菌素(bar)和氯磺隆(als)抗性的基因。
还可通过筛选可见标志物的活性来鉴定转化的植物和植物细胞,所述可见标志物通常是能够处理有色底物的酶(例如,β-葡糖醛酸苷酶、荧光素酶、B或C1基因)。这样的选择和筛选方法是本领域技术人员众所周知的。
植物培养与再生
在特定的实施方案中,可培养具有修饰的基因组并且通过本文所述的任何方法产生或获得的植物细胞,以再生具有转化或修饰的基因型并因此具有所需表型的整株植物。常规的再生技术是本领域技术人员众所周知的。这种再生技术的具体实例依赖于在组织培养基生长培养基中某些植物激素的操纵,并且典型地依赖于已经与所需核苷酸序列一起引入的杀生物剂和/或除草剂标志物。在其他特定实施方案中,植物再生获自培养的原生质体、植物愈伤组织、外植体、器官、花粉、胚胎或其部分(参见例如Evans等人,(1983),Handbook of Plant Cell Culture;Klee等人,(1987)Ann.Rev.of Plant Phys.)。
在特定的实施方案中,如本文所述的转化的或改良的植物可自花传粉以提供本发明的纯合改良植物的种子(用于DNA修饰的纯合子)或与非转基因植物或不同改良植物杂交以提供杂合植物的种子。在将重组DNA引入植物细胞的情况下,这种杂交的所得植物是对于重组DNA分子杂合的植物。通过从改良植物杂交获得并包含遗传修饰(其可以是重组DNA)的这种纯合植物和杂合植物在本文中都称为“后代”。后代植物是原始转基因植物的后代并含有通过本文提供的方法引入的基因组修饰或重组DNA分子的植物。或者,也可使用Cfp1酶通过上述方法之一获得遗传修饰植物,其中不将外来DNA并入基因组中。通过进一步育种获得的此类植物的后代也可能包含遗传修饰。育种是通过通常用于不同农作物的任何育种方法来进行(例如Allard,Principles of Plant Breeding,John Wiley&Sons,NY,U.of CA,Davis,CA,50-98(1960))。
生成具有增强的农艺性状的植物
本文提供的基于C2c1的CRISPR系统可用于引入靶向的双链或单链断裂和/或引入基因激活子和或阻遏子系统,并非限制性地,可用于基因靶向、基因置换、靶向诱变、靶向缺失或插入、靶向倒位和/或靶向易位。通过在单个细胞中共表达旨在实现多种修饰的多个靶向RNA,可确保多重基因组修饰。该技术可用于具有改善特性的植物的高精度工程化,这些特性包括增强的营养质量,增强的抗病性以及对生物和非生物胁迫的抗性,以及商业上有价值的植物产品或异源化合物的产量增加。
在特定的实施方案中,如本文所述的CRISPR-C2c1系统用于在内源DNA序列中引入靶向双链断裂(DSB)。DSB激活细胞DNA修复途径,可利用该途径在断裂位点附近实现所需的DNA序列修饰。当内源基因的失活或修饰可赋予或有助于所需性状时,这是令人感兴趣的。在一些实施方案中,在DSB的位点促进具有模板序列的同源重组(HR),以便引入目标基因。在一些实施方案中,在DSB的位点促进HR非依赖性重组,以便在交错DSB处引入目标序列或基因。在特定的实施方案中,CRISPR-C2c1系统产生具有5'突出端的交错DSB。在某些特定实施方案中,CRISPR-C2c1系统在指导序列中包含插入物模板序列,并在交错DSB处引入特异性DNA插入物。
在特定的实施方案中,CRISPR-C2c1系统可用作与功能结构域融合或可操作地连接以激活和/或阻遏内源植物基因的通用核酸结合蛋白。示例性功能结构域可包括但不限于RNA或DNA脱氨酶、翻译起始子、翻译激活子、翻译阻遏子、核酸酶,特别是核糖核酸酶、剪接体、珠粒、光诱导/可控制结构域或化学诱导/可控制结构域。典型地,在这些实施方案中,C2c1蛋白包含至少一种突变,使得其具有不具有至少一种突变的C2c1蛋白的活性的不超过5%;指导RNA包含能够与靶序列杂交的指导序列。
本文所述的方法通常导致“改良植物”的生成,因为与野生型植物相比,它们具有一种或多种理想的性状。在特定的实施方案中,获得的植物、植物细胞或植物部分是转基因植物,其包含并入到植物的全部或部分细胞的基因组中的外源DNA序列。在特定的实施方案中,获得非转基因的遗传修饰的植物、植物部分或细胞,因为没有外源DNA序列被并入到植物的任何植物细胞的基因组中。在这样的实施方案中,改良的植物是非转基因的。在仅确保内源基因的修饰并且在植物基因组中没有引入或维持外来基因的情况下,所得的经遗传修饰的农作物不包含外来基因,因此基本上可认为是非转基因的。CRISPR-C2c1系统对于植物基因组编辑的不同应用如下进一步详细描述:
a)引入一个或多个外来基因以赋予目标农业性状
本发明提供了基因组编辑或修饰与目标靶基因座相关或在目标靶基因座处的序列的方法,其中所述方法包括将C2c1效应蛋白复合物引入植物细胞,由此C2c1效应蛋白复合物有效地用于将DNA插入物(例如编码目标外来基因)整合到植物细胞的基因组中。在一些实施方案中,通过用具有外源引入的DNA模板或修复模板的HR促进DNA插入物的整合。在一些优选的实施方案中,通过不依赖于HR的整合(例如NHEJ)促进DNA插入物的整合。通常,将外源引入的DNA模板或修复模板与C2c1效应蛋白复合物或一种组分或用于表达复合物组分的多核苷酸载体一起递送。
本文提供的CRISPR-C2c1系统允许靶向基因递送。越来越显而易见的是,表达目标基因的效率在很大程度上取决于整合到基因组中的位置。本方法允许将外来基因靶向整合到基因组中的期望位置。可基于先前生成的事件的信息来选择位置,或者可通过本文其他地方公开的方法来选择位置。
在特定的实施方案中,本文提供的方法包括(a)将包含指导RNA的C2c1CRISPR复合物引入细胞中,所述指导RNA包含正向重复序列和指导序列,其中所述指导序列与植物细胞内源的靶序列杂交;(b)将C2c1效应分子引入植物细胞,当所述指导序列与靶序列杂交时,所述C2c1效应分子与所述指导RNA复合并在所述指导序列所靶向的序列处或其附近诱导双链断裂;以及(c)将编码HDR修复模板的核苷酸序列引入细胞中,所述HDR修复模板编码目标基因,并且由于HDR而被引入DS断裂的位置。在特定的实施方案中,引入步骤可包括将一种或多种编码C2c1效应蛋白、指导RNA和修复模板的多核苷酸递送至植物细胞。在特定的实施方案中,多核苷酸通过DNA病毒(例如双生病毒)或RNA病毒(例如脆裂病毒)被递送至细胞中。在特定的实施方案中,引入步骤包括将含有编码C2c1效应蛋白、指导RNA和修复模板的一个或多个多核苷酸序列的T-DNA递送至植物细胞,其中所述递送是经由农杆菌。编码C2c1效应蛋白的核酸序列可以可操作地连接至启动子,例如组成型启动子(例如花椰菜花叶病毒35S启动子)或细胞特异性或诱导型启动子。在特定的实施方案中,通过微粒轰击引入多核苷酸。在特定的实施方案中,所述方法还包括在引入步骤之后筛选植物细胞,以确定是否已经引入了修复模板,即目标基因。在特定的实施方案中,所述方法包括从植物细胞再生植物的步骤。在其他实施方案中,所述方法包括使植物杂交育种以获得遗传上所需的植物谱系。下面列出了编码目标性状的外来基因的实例。
b)编辑内源基因以赋予目标农业性状
本发明提供了基因组编辑或修饰与目标靶基因座相关或在目标靶基因座处的序列的方法,其中所述方法包括将C2c1效应蛋白复合物引入植物细胞,由此C2c1复合物修饰植物的内源基因的表达。这可以不同的方式实现。在特定的实施方案中,消除内源基因的表达是合乎需要的,并且使用C2c1 CRISPR复合物靶向和切割内源基因以修饰基因表达。在这些实施方案中,本文提供的方法包括(a)将C2c1 CRISPR复合物引入植物细胞,所述C2c1CRISPR复合物包含指导RNA,所述指导RNA包含正向重复序列和指导序列,其中所述指导序列与植物细胞基因组中的目标基因内的靶序列杂交;以及(b)将C2c1效应蛋白引入细胞中,所述C2c1效应蛋白与指导RNA结合后包含与靶序列杂交的指导序列,确保在所述指导序列所靶向的序列处或其附近的双链断裂;在特定的实施方案中,引入步骤可包括将一种或多种编码C2c1效应蛋白和指导RNA的多核苷酸递送至植物细胞。
在特定的实施方案中,多核苷酸通过DNA病毒(例如双生病毒)或RNA病毒(例如脆裂病毒)被递送至细胞中。在特定的实施方案中,引入步骤包括将含有一个或多个编码C2c1效应蛋白和指导RNA的多核苷酸序列的T-DNA递送至植物细胞,其中所述递送是经由农杆菌。可将编码CRISPR-C2c1系统组分的多核苷酸序列可操作地连接至启动子,例如组成型启动子(例如花椰菜花叶病毒35S启动子)或细胞特异性或诱导型启动子。在特定的实施方案中,通过微粒轰击引入多核苷酸。在特定的实施方案中,所述方法还包括在引入步骤之后筛选植物细胞,以确定目标基因的表达是否已经被修饰。在特定的实施方案中,所述方法包括从植物细胞再生植物的步骤。在其他实施方案中,所述方法包括使植物杂交育种以获得遗传上所需的植物谱系。
在上述方法的特定实施方案中,通过疾病易感性基因或编码植物防御基因的负调控子(例如Mlo基因)的基因的靶向突变来获得抗病作物。在一个特定的实施方案中,通过植物基因中特定核苷酸的靶向取代产生耐除草剂作物,所述植物基因例如编码乙酰乳酸合酶(ALS)和原卟啉原氧化酶(PPO)的那些。在特定的实施方案中,通过对编码非生物胁迫耐受性的负调控子的基因进行靶向突变的干旱和耐盐作物,通过对Waxy基因进行靶向突变的低直链淀粉谷物,通过糊粉层中的主要脂肪酶基因进行靶向突变而具有降低的酸败性的水稻或其他谷物等。在特定的实施方案中。下面列出了编码目标性状的内源基因的更广泛的列表。
c)通过CRISPR-C2c1系统调节内源基因以赋予目标农业性状
本文还提供了使用本文提供的C2c1蛋白来调节(即激活或阻遏)内源基因表达的方法。这样的方法利用C2c1复合物靶向植物基因组的不同RNA序列。更特别地,不同的RNA序列与两个或更多个衔接子蛋白(例如适体)结合,由此每个衔接子蛋白与一个或多个功能结构域相缔合,并且其中与衔接子蛋白相缔合的一个或多个功能结构域中的至少一者具有一种或多种活性,包括脱氨酶活性、甲基化酶活性、脱甲基酶活性、转录激活活性、转录阻遏活性、转录释放因子活性、组蛋白修饰活性、DNA整合活性、RNA切割活性、DNA切割活性或核酸结合活性;所述功能结构域用于调节内源植物基因的表达,以获得所需的性状。通常,在这些实施方案中,C2c1效应蛋白具有一个或多个突变,使得所述C2c1效应蛋白的核酸酶活性为不具有至少一个突变的C2c1效应蛋白的核酸酶活性的不超过5%。
在特定的实施方案中,本文提供的方法包括以下步骤:(a)将C2c1 CRISPR复合物引入细胞,所述C2c1 CRISPR复合物包含tracr RNA,包含正向重复序列和指导序列的指导RNA,其中所述指导序列与植物细胞内源的靶序列杂交;(b)将当指导序列与靶序列杂交时与指导RNA复合的C2c1效应分子引入植物细胞;并且其中所述指导RNA被修饰为包含与功能结构域结合的不同RNA序列(适体)和/或所述C2c1效应蛋白被修饰为与功能结构域连接。在特定的实施方案中,引入步骤可包括将一个或多个编码(修饰的)C2c1效应蛋白和(修饰的)指导RNA的多核苷酸递送至植物细胞。用于这些方法的CRISPR-C2c1系统组分的细节在本文其他地方进行了描述。
在特定的实施方案中,多核苷酸通过DNA病毒(例如双生病毒)或RNA病毒(例如脆裂病毒)被递送至细胞中。在特定的实施方案中,引入步骤包括将含有一个或多个编码C2c1效应蛋白和指导RNA的多核苷酸序列的T-DNA递送至植物细胞,其中所述递送是经由农杆菌。编码CRISPR-C2c1系统的一种或多种组分的核酸序列可以可操作地连接至启动子,例如组成型启动子(例如花椰菜花叶病毒35S启动子)或细胞特异性或诱导型启动子。在特定的实施方案中,通过微粒轰击引入多核苷酸。在特定的实施方案中,所述方法还包括在引入步骤之后筛选植物细胞,以确定目标基因的表达是否已经被修饰。在特定的实施方案中,所述方法包括从植物细胞再生植物的步骤。在其他实施方案中,所述方法包括使植物杂交育种以获得遗传上所需的植物谱系。下面列出了编码目标性状的内源基因的更广泛的列表。
使用C2c1修饰多倍体植物
许多植物都是多倍体的,这意味着它们携带其基因组的复制拷贝,有时多达六个,如在小麦中。利用C2c1 CRISPR效应蛋白的根据本发明的方法可被“多重化”以影响基因的所有拷贝,或一次靶向数十个基因。例如,在特定的实施方案中,本发明的方法用于同时确保负责抑制疾病防御的不同基因中的功能丧失突变。在特定的实施方案中,本发明的方法用于同时抑制TaMLO-Al、TaMLO-Bl和TaMLO-Dl核酸序列在小麦植物细胞中的表达并由此再生小麦植物,以确保所述小麦植物对白粉病具有抗性(还参见WO2015109752)。
赋予农艺性状的示例性基因
如上文所述,在特定的实施方案中,本发明涵盖使用本文所述的CRISPR-C2c1系统来插入目标DNA,包括一个或多个植物可表达基因。在其他特定的实施方案中,本发明涵盖使用如本文所述的C2c1系统用于部分或完全缺失一个或多个植物表达基因的方法和工具。在其他进一步的特定实施方案中,本发明涵盖使用如本文所述的C2c1系统的方法和工具,以确保通过一个或多个核苷酸的突变、取代、插入来修饰一个或多个植物表达基因。在其他特定的实施方案中,本发明涵盖使用如本文所述的CRISPR-C2c1系统,以通过引导所述基因表达的一个或多个调控元件的特异性修饰来确保修饰一个或多个植物表达基因的表达。
在特定的实施方案中,本发明涵盖涉及外源基因的引入和/或内源基因及其调控元件的靶向的方法,例如以下所列:
1.赋予对害虫或病害的抗性的基因:
植物抗病基因。可用克隆的抗性基因转化植物以工程化对特定病原体菌株具有抗性的植物。参见例如Jones等人,Science 266:789(1994)(对黄腐枝孢菌(Cladosporiumfulvum)具有抗性的番茄Cf-9基因的克隆);Martin等人,Science 262:1432(1993)(对编码蛋白激酶的丁香假单胞菌番茄致病变种(Pseudomonas syringae pv.tomato)具有抗性的番茄Pto基因);Mindrinos等人,Cell 78:1089(1994)(拟南芥可能是对丁香假单胞菌(Pseudomonas syringae)具有抗性的RSP2基因)。可对病原体感染期间上调或下调的植物基因进行工程化以抵抗病原体。参见例如Thomazella等人,bioRxiv 064824;doi:doi.org/10.1101/064824,电子出版于2016年7月23日(具有SlDMR6-1缺失的番茄植物,SlDMR6-1通常在病原体感染期间被上调)。
赋予对害虫的抗性的基因,所述害虫例如大豆孢囊线虫(soybean cystnematode)。参见例如PCT申请WO 96/30517;PCT申请WO 93/19181。
苏云金芽孢杆菌(Bacillus thuringiensis)蛋白,参见例如Geiser等人,Gene48:109(1986)。
凝集素,参见例如Van Damme等人,Plant Molec.Biol.24:25(1994。
维生素结合蛋白,例如抗生物素蛋白,参见PCT申请US93/06487,教导了抗生物素蛋白和抗生物素蛋白同系物作为针对虫害的杀幼虫剂的用途。
酶抑制剂,例如蛋白酶或蛋白酶抑制剂或淀粉酶抑制剂。参见例如Abe等人,J.Biol.Chem.262:16793(1987);Huub等人,Plant Molec.Biol.21:985(1993));Sumitani等人,Biosci.Biotech.Biochem.57:1243(1993);以及美国专利第5,494,813号。
昆虫特异性激素或信息素,例如蜕皮类固醇或幼年激素、其变体、基于其的模拟物、或其拮抗剂或激动剂。参见例如Hammock等人,Nature 344:458(1990)。
昆虫特异性肽或神经肽,其在表达时会破坏受影响害虫的生理学。例如Regan,J.Biol.Chem.269:9(1994);和Pratt等人,Biochem.Biophys.Res.Comm.163:1243(1989)。还参见美国专利第5,266,317号。
蛇、黄蜂或任何其他生物体在自然界中产生的昆虫特有毒液。例如,参见Pang等人,Gene 116:165(1992)。
引起单萜、倍半萜、类固醇、异羟肟酸、苯丙素类衍生物或另一具有杀虫活性的非蛋白质分子过度积累的酶。
涉及生物活性分子的修饰(包括翻译后修饰)的酶;例如,糖酵解酶、蛋白水解酶、脂解酶、核酸酶、环化酶、转氨酶、酯酶、水解酶、磷酸酶、激酶、磷酸化酶、聚合酶、弹性蛋白酶、几丁质酶和葡聚糖酶,无论是天然的还是合成的。参见PCT申请WO93/02197;Kramer等人,Insect Biochem.Molec.Biol.23:691(1993);以及Kawalleck等人,PlantMolec.Biol.21:673(1993)。
刺激信号转导的分子。例如,参见Botella等人,Plant Molec.Biol.24:757(1994);和Griess等人,Plant Physiol.104:1467(1994)。
病毒侵入性蛋白质或由其衍生的复合毒素。参见Beachy等人,Ann.rev.Phytopathol.28:451(1990)。
自然界中由病原体或寄生虫产生的发育抑制蛋白。参见Lamb等人,Bio/Technology 10:1436(1992);和Toubart等人,Plant J.2:367(1992)。
自然界中由植物产生的发育抑制蛋白。例如,Logemann等人,Bio/Technology 10:305(1992)。
在植物中,病原体通常是宿主特异性的。例如,一些镰刀菌物种将引起番茄萎缩,但仅侵害番茄,而其他镰刀菌物种仅侵害小麦。植物具有抵抗大多数病原体的现有和诱导防御能力。跨植物世代的突变和重组事件导致遗传变异,所述遗传变异引起易感性,尤其是因为病原体的繁殖频率高于植物。在植物中可能存在非宿主抗性,例如宿主与病原体不相容,或者对病原体的所有小种都有部分抗性,通常由许多基因控制,和/或对病原体的某些小种但不是其他小种也具有完全抗性。这种抗性通常由一些基因控制。使用CRISPR-C2c1系统的方法和组分,现在存在一种新工具,可预期诱导特定的突变。因此,人们可分析抗性基因来源的基因组,并在具有所需特性或性状的植物中,使用CRISPR-C2c1系统的方法和组分来诱导抗性基因的产生。本系统可以比以前的诱变剂更精确地进行,因此可加速和改善植物育种程序。
2.涉及植物病害的基因
涉及植物病害的基因。可用CRISPR-C2c1系统转化植物,所述系统修饰疾病易感或相关基因,以工程化对特定病原体菌株具有抗性的植物。例如,已知编码推定糖转运蛋白的植物SWEET基因是由水稻病原性水稻黄单胞菌(Xanthomonas oryzae)的TAL效应子诱导的,导致病原体感染的传播增加。参见Streubel等人,New Phytologist,2013年11月;200(3):808-19.doi:10.1111/nph.12411.电子出版于2013年7月24日。柑橘的CsLOB已知是由涉及柑橘病害如柑橘曲柄病的TAL效应子诱导的。
本发明还提供了一种对植物细胞中的目标基因座进行修饰的方法,所述方法包括使所述细胞与任何本文所述的工程化的CRISPR酶(例如,工程化的Cas效应子模块)、组合物或任何本文所述的系统或载体系统接触,或者其中所述细胞包含存在于细胞内的任何本文所述的CRISPR复合物。在某些实施方案中,植物细胞可包含富含A/T的基因组。在一些实施方案中,细胞基因组包含富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在特定的实施方案中,修饰的基因座与植物病害有关。在一个特定的实施方案中,植物病害与病原体易感性有关。在一个特定的实施方案中,修饰的基因座包括SWEET基因座或CsLOB基因座。在一个特定的实施方案中,植物病害是柑橘曲柄病或稻瘟病。在一些实施方案中,细胞基因组包含富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在一些实施方案中,CRISPR-Cas系统是CRISPR-C2c1系统。在一些实施方案中,通过引入具有5'突出端的交错切口,由C2c1效应蛋白修饰目标基因座。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,通过单核苷酸缺失或突变来修饰目标基因座。在一些实施方案中,通过少于50nt的突变或缺失来修饰目标基因座。在一些实施方案中,目标基因座由通过具有HDR的CRISPR-C2c1系统引入的具有5'突出端的交错切口修饰。在一些实施方案中,目标基因座由通过利用NHEJ的CRISPR-C2c1系统引入的具有5'突出端的交错切口修饰。在一些实施方案中,目标基因座由通过CRISPR-C2c1系统在PAM的远端引入的具有5'突出端的交错切口修饰,接着用HDR修复。在一些实施方案中,目标基因座由通过CRISPR-C2c1系统在5'突出端利用HDR引入的外源DNA序列插入来修饰。在优选的实施方案中,目标基因座由通过CRISPR-C2c1系统在5'突出端利用HDR引入的外源DNA序列插入来修饰。
涉及植物病害的基因,例如WO 2013046247中列出的基因:
水稻病害:稻瘟病菌(Magnaporthe grisea)、宫部旋孢腔菌(Cochliobolusmiyabeanus)、纹枯病菌(Rhizoctonia solani)、稻恶苗病菌(Gibberella fujikuroi);小麦病害:白粉病菌(Erysiphe graminis)、禾谷镰刀菌(Fusarium graminearum)、燕麦镰刀菌(F.avenaceum)、黄色镰刀菌(F.culmorum)、雪霉镰孢菌(Microdochium nivale)、条锈病菌(Puccinia striiformis)、禾柄锈菌(P.graminis)、隐匿柄锈菌(P.recondita)、雪腐小赤壳(Micronectriella nivale)、雪腐病菌(Typhula sp.)、小麦散黑粉病菌(Ustilagotritici)、小麦腥黑穗病菌(Tilletia caries)、小麦基腐病菌(Pseudocercosporellaherpotrichoides)、禾生球腔菌(Mycosphaerella graminicola)、颖枯壳多孢(Stagonospora nodorum)、偃麦草核腔菌(Pyrenophora tritici-repentis);大麦病害:白粉病菌、禾谷镰刀菌、燕麦镰刀菌、黄色镰刀菌、雪霉镰孢菌、条锈病菌、禾柄锈菌、大麦坚黑粉菌(P.hordei)、大麦散黑粉菌(Ustilago nuda)、大麦云纹病菌(Rhynchosporiumsecalis)、大麦网斑病菌(Pyrenophora teres)、禾旋孢腔菌(Cochliobolus sativus)、大麦条纹病菌(Pyrenophora graminea)、纹枯病菌;玉米病害:玉蜀黍黑粉菌(Ustilagomaydis)、异旋孢腔菌(Cochliobolus heterostrophus)、高粱胶尾孢(Gloeocercosporasorghi)、多堆柄锈菌(Puccinia polysora)、玉米灰斑病菌(Cercospora zeae-maydis)、纹枯病菌;
柑橘病害:柑橘间座壳菌(Diaporthe citri)、柑桔痂囊腔菌(Elsinoefawcetti)、柑橘绿霉菌(Penicillium digitatum)、意大利青霉(P.italicum)、寄生疫霉(Phytophthora parasitica)、柑橘褐腐疫霉(Phytophthora citrophthora);苹果病害:苹果链核盘菌(Monilinia mali)、腐烂病菌(Valsa ceratosperma)、苹果白粉病菌(Podosphaera leucotricha)、苹果斑点落叶病菌(Alternaria alternata applepathotype)、苹果黑星病菌(Venturia inaequalis)、炭疽菌(Colletotrichum acutatum)、恶疫霉(Phytophtora cactorum);
梨病害:梨黑星菌(Venturia nashicola)、洋梨黑星菌(V.pirina)、梨黑斑病菌(Alternaria alternata Japanese pear pathotype)、梨胶锈菌(Gymnosporangiumharaeanum)、恶疫霉;
桃病害:桃褐腐病菌(Monilinia fructicola)、嗜果枝孢霉(Cladosporiumcarpophilum)、拟茎点霉(Phomopsis sp.);
葡萄病害:葡萄黑痘病菌(Elsinoe ampelina)、围小丛壳(Glomerellacingulata)、葡萄白粉病菌(Uninula necator)、葡萄层锈菌(Phakopsora ampelopsidis)、葡萄黑腐病菌(Guignardia bidwellii)、葡萄生单轴霉(Plasmopara viticola);
柿病害:柿盘孢子菌(Gloesporium kaki)、柿尾孢(Cercospora kaki)、柿叶球腔菌(Mycosphaerela nawae);
葫芦病害:葫芦科刺盘孢(Colletotrichum lagenarium)、黄瓜白粉病菌(Sphaerotheca fuliginea)、黄瓜蔓枯病菌(Mycosphaerella melonis)、尖孢镰刀菌、黄瓜霜霉病菌(Pseudoperonospora cubensis)、疫霉菌(Phytophthora sp.)、腐霉菌(Pythiumsp.);
番茄病害:早疫病菌(Alternaria solani)、番茄叶霉病菌(Cladosporiumfulvum)、致病疫霉(Phytophthora infestans);丁香假单胞菌番茄致病变种;南瓜疫病菌(Phytophthora capsici);黄单胞菌(Xanthomonas);
茄子病害:褐纹病菌(Phomopsis vexans)、二孢白粉菌(Erysiphecichoracearum);
十字花科蔬菜病害:日本链格孢菌(Alternaria japonica)、白菜白斑病菌(Cercosporella brassicae)、十字花科根肿病菌(Plasmodiophora brassicae)、寄生霜霉(Peronospora parasitica);
大葱病害:葱柄锈菌(Puccinia allii)、葱霜霉(Peronospora destructor);
大豆病害:大豆紫斑病菌(Cercospora kikuchii)、大豆痂囊腔菌(Elsinoeglycines)、菜豆间座壳大豆变种(Diaporthe phaseolorum var.sojae)、大豆壳针孢(Septoria glycines)、大豆灰斑病菌(Cercospora sojina)、大豆锈菌(Phakopsorapachyrhizi)、大豆疫霉菌(Phytophthora sojae)、纹枯病菌、多主棒孢菌(Corynesporacasiicola)、菌核病菌(Sclerotinia sclerotiorum);
芸豆病害:豆刺盘孢(Colletrichum lindemthianum);
花生病害:花生黑斑病菌(Cercospora personata)、花生褐斑病菌(Cercosporaarachidicola)、白绢病菌(Sclerotium rolfsii);
豌豆病害豌豆:豌豆白粉菌(Erysiphe pisi);
马铃薯病害:早疫病菌、致病疫霉、马铃薯疫霉绯腐病菌(Phytophthoraerythroseptica)、马铃薯粉痂菌(Spongospora subterranean f.sp.Subterranean);
草莓病害:草莓白粉病菌(Sphaerotheca humuli)、围小丛壳;
茶病害:网状外担菌(Exobasidium reticulatum)、茶疮痂病菌(Elsinoeleucospila)、拟盘多毛孢菌(Pestalotiopsis sp.)、茶炭疽病菌(Colletotrichum theae-sinensis);
烟草病害:烟草赤星病菌(Alternaria longipes)、二孢白粉菌、烟草炭疽病菌(Colletotrichum tabacum)、烟草霜霉病菌(Peronospora tabacina)、烟草疫霉(Phytophthora nicotianae);
油菜病害:菌核病菌、纹枯病菌;
棉花病害:纹枯病菌;
甜菜病害:甜菜生尾孢(Cercospora beticola)、瓜亡革菌(Thanatephoruscucumeris)、瓜亡革菌、黑腐丝囊霉(Aphanomyces cochlioides);
玫瑰病害:蔷薇双壳菌(Diplocarpon rosae)、蔷薇单丝壳菌(Sphaerothecapannosa)、霜霉病菌(Peronospora sparsa);
菊花和菊科病害:莴苣盘梗霉(Bremia lactuca)、菊褐斑病菌(Septoriachrysanthemi-indici)、堀柄锈菌(Puccinia horiana);
各种植物的病害:瓜果腐霉(Pythium aphanidermatum)、德巴利腐霉(Pythiumdebarianum)、禾草腐霉(Pythium graminicola)、畸雌腐霉(Pythium irregulare)、终极腐霉(Pythium ultimum)、贵腐霉菌(Botrytis cinerea)、菌核病菌;
萝卜病害:甘蓝链格孢(Alternaria brassicicola);
结缕草病害:银斑核盘菌(Sclerotinia homeocarpa)、纹枯病菌;
香蕉病害:香蕉黑条叶斑病菌(Mycosphaerella fijiensis)、香蕉黄条叶斑病菌(Mycosphaerella musicola);
向日葵病害:向日葵霜霉菌(Plasmopara halstedii);
由曲霉属(Aspergillus spp.)、青霉属(Penicillium spp.)、镰刀菌属(Fusariumspp.)、赤霉菌属(Gibberella spp.)、木霉属(Tricoderma spp.)、根串珠霉属(Thielaviopsis spp.)、根霉属(Rhizopus spp.)、毛菌属(Mucor spp.)、伏革菌属(Corticium spp.)、茎点霉属(Rhoma spp.)、丝核菌属(Rhizoctonia spp.)、色二孢属(Diplodia spp.)等引起的各种植物的种子病害或生长初期的病害;
由多粘菌属(Polymixa spp.)、油壶菌属(Olpidium spp.)等介导的各种植物的病毒病。
3.赋予除草剂抗性的基因的实例:
对抑制生长点或分生组织的除草剂如咪唑啉酮或磺酰脲的抗性,分别例如Lee等人,EMBO J.7:1241(1988);以及Miki等人,Theor.Appl.Genet.80:449(1990)。
ACCase抑制剂编码基因的草甘膦耐受性(分别由例如突变的5-烯醇丙酮莽草酸-3-磷酸合酶(EPSP)基因、aroA基因和草甘膦乙酰基转移酶(GAT)基因赋予的抗性),或对其他膦酰基化合物如草铵膦(来自链霉菌属物种包括吸水链霉菌(Streptomyceshygroscopicus)和产色链霉菌(Streptomyces viridichromogenes)的膦丝菌素乙酰基转移酶(PAT)基因)以及对吡啶氧基或苯氧基丙酸和环己酮的抗性。参见例如美国专利第4,940,835号和美国专利6,248,876;美国专利第4,769,061号;欧洲专利第0 333 033号和美国专利第4,975,374号。还参见欧洲专利第0242246号;DeGreef等人,Bio/Technology7:61(1989);Marshall等人,Theor.Appl.Genet.83:435(1992);WO 2005012515(Castle等人)和WO 2005107437。
对抑制光合作用的除草剂的抗性,例如三嗪(psbA和gs+基因)或苯甲腈(硝化酶基因)和谷胱甘肽S-转移酶,Przibila等人,Plant Cell 3:169(1991);美国专利第4,810,648号;以及Hayes等人,Biochem.J.285:173(1992)。
编码能使除草剂或突变型谷氨酰胺合酶解毒的酶的基因,所述合酶具有抑制抗性,例如美国专利申请系列号11/760,602,或者解毒酶是编码草胺膦乙酰基转移酶的酶(例如链霉菌属物种的bar或pat蛋白)。膦丝菌素乙酰基转移酶例如描述于美国专利第5,561,236号;第5,648,477号;第5,646,024号;第5,273,894号;第5,637,489号;第5,276,268号;第5,739,082号;第5,908,810号和第7,112,665号。
羟基苯基丙酮酸双加氧酶(HPPD)抑制剂,即天然存在的HPPD抗性酶,或编码突变或嵌合HPPD酶的基因,如WO 96/38567、WO 99/24585和WO 99/24586、WO 2009/144079、WO2002/046387或美国专利第6,768,044号中所述。
4.与非生物胁迫耐受性有关的基因的实例:
能够降低植物细胞或植物中聚(ADP-核糖)聚合酶(PARP)基因的表达和/或活性的转基因,如WO 00/04173或WO/2006/045633中所述。
能够降低植物或植物细胞的PARG编码基因的表达和/或活性的转基因,如例如WO2004/090140中所述。
编码烟碱酰胺腺嘌呤二核苷酸挽救合成途径的植物功能性酶的转基因,所述酶包括烟碱酰胺酶、烟酸磷酸核糖基转移酶、烟酸单核苷酸腺苷酸转移酶、烟酰胺腺嘌呤二核苷酸合酶或烟碱酰胺磷酸核糖基转移酶,如例如EP04077624.7、WO 2006/133827、PCT/EP07/002,433、EP 1999263或WO 2007/107326中所述。
碳水化合物生物合成中涉及的酶包括例如EP 0571427、WO 95/04826、EP0719338、WO 96/15248、WO 96/19581、WO 96/27674、WO 97/11188、WO 97/26362、WO 97/32985、WO 97/42328、WO 97/44472、WO 97/45545、WO 98/27212、WO 98/40503、WO99/58688、WO 99/58690、WO 99/58654、WO 00/08184、WO 00/08185、WO 00/08175、WO 00/28052、WO00/77229、WO 01/12782、WO 01/12826、WO 02/101059、WO 03/071860、WO 2004/056999、WO2005/030942、WO 2005/030941、WO 2005/095632、WO 2005/095617、WO 2005/095619、WO2005/095618、WO 2005/123927、WO 2006/018319、WO 2006/103107、WO 2006/108702、WO2007/009823、WO 00/22140、WO 2006/063862、WO 2006/072603、WO 02/034923、EP06090134.5、EP 06090228.5、EP 06090227.7、EP 07090007.1、EP 07090009.7、WO 01/14569、WO 02/79410、WO 03/33540、WO 2004/078983、WO 01/19975、WO 95/26407、WO 96/34968、WO 98/20145、WO 99/12950、WO 99/66050、WO 99/53072、美国专利第6,734,341号、WO 00/11192、WO 98/22604、WO 98/32326、WO 01/98509、WO 01/98509、WO 2005/002359、美国专利第5,824,790号、美国专利第6,013,861号、WO 94/04693、WO 94/09144、WO 94/11520、WO 95/35026或WO 97/20936中所述的酶;或涉及生产多聚果糖,尤其是菊粉和果聚糖的酶,如EP 0663956、WO 96/01904、WO 96/21023、WO 98/39460和WO 99/24593中所公开;涉及生产α-1,4-葡聚糖的酶,如WO 95/31553、US 2002031826、美国专利第6,284,479号、美国专利第5,712,107号、WO 97/47806、WO 97/47807、WO 97/47808和WO 00/14249中所公开;涉及生产α-1,6分支α-1,4-葡聚糖的酶,如WO 00/73422中所公开;涉及生产alternan的酶,如例如WO 00/47727、WO 00/73422、EP 06077301.7、美国专利第5,908,975号和EP0728213中所公开;涉及生产玻尿质酸的酶,如例如WO 2006/032538、WO 2007/039314、WO 2007/039315、WO 2007/039316、JP 2006304779和WO 2005/012529中所公开。
改善抗旱性的基因。例如,WO 2013122472公开了功能泛素蛋白连接酶蛋白(UPL)蛋白(更具体地,UPL3)的缺乏或水平降低导致对所述植物的水需求减少或提高的抗旱性。具有增加的耐旱性的转基因植物的其他实例公开于例如US 2009/0144850、US 2007/0266453和WO 2002/083911中。US2009/0144850描述了由于DR02核酸的表达改变而显示出耐旱表型的植物。US 2007/0266453描述了由于DR03核酸的表达改变而表现出耐旱表型的植物,并且WO 2002/08391 1描述了由于在保护细胞中表达的ABC转运蛋白的活性降低而对干旱胁迫具有提高的耐受性的植物。另一个实例是Kasuga及其合作者(1999)的工作,他们描述了转基因植物中编码DREB1 A的cDNA的过表达激活了正常生长条件下许多胁迫耐受基因的表达,并导致对干旱、盐分负荷和冻结的耐受性提高。然而,DREB1A的表达在正常生长条件下也导致严重的生长迟缓(Kasuga(1999)Nat Biotechnol 17(3)287-291)。
在其他特定的实施方案中,可通过影响特定的植物性状来改良农作物。例如,通过开发抗农药植物,提高植物的抗病性,提高植物对昆虫和线虫的抗性,提高植物对寄生性杂草的抗性,提高植物的耐旱性,提高植物的营养价值,提高植物的胁迫耐受性,避免自花授粉,植物饲料消化率生物量,粮食产量等。下文提供了一些具体的非限制性实例。
除了单个基因的靶向突变外,C2c1 CRISPR复合物还可设计成在植物中允许多个基因的靶向突变,染色体片段的缺失,转基因的位点特异性整合,体内定点诱变以及精确的基因替换或等位基因交换。因此,本文描述的方法在基因发现和验证、突变和顺生育种以及杂交育种中具有广泛的应用。这些应用促进了具有各种改良的农艺性状(如除草剂抗性、抗病性、非生物胁迫耐受性、高产量和优异品质)的新一代遗传修饰作物的生产。
使用C2c1基因产生雄性不育植物
与自交植物相比,杂种植物通常具有有利的农艺性状。然而,对于自花授粉的植物而言,杂种的生成可能具有挑战性。在不同的植物类型中,已经鉴定了对植物育性、更特别是雄性育性重要的基因。例如,在玉米中,已鉴定出至少两个对育性至关重要的基因(Amitabh Mohanty International Conference on New Plant Breeding MolecularTechnologies Technology Development And Regulation,2014年10月9-10日,Jaipur,India;Svitashev等人,Plant Physiol.2015年10月;169(2):931-45;Djukanovic等人,Plant J.2013年12月;76(5):888-99)。本文提供的方法可用于靶向雄性育性所需的基因,以产生雄性不育植物,其可容易地杂交以生成杂种。在特定的实施方案中,本文提供的CRISPR-C2c1系统用于细胞色素P450样基因(MS26)或大范围核酸酶基因(MS45)的靶向诱变,从而赋予玉米植物以雄性不育性。如此遗传变异的玉米植物可用于杂交育种程序。
增加植物的生育期
在特定的实施方案中,本文提供的方法用于延长植物例如水稻植物的生育期。例如,可靶向水稻生育期基因如Ehd3,以在所述基因中产生突变,并且可选择幼苗来延长再生植物生育期(如CN 104004782中所述)
使用C2c1在目标作物中生成遗传变异
作物中野生种质的可用性和遗传变异是作物改良计划的关键,但作物中种质的可用多样性有限。本发明设想了在目标种质中产生多种遗传变异的方法。在CRISPR-C2c1系统的这种应用中,提供了针对植物基因组中不同位置的指导RNA文库,并将其与C2c1效应蛋白一起引入植物细胞。以这种方式,可产生基因组规模的点突变和基因敲除的集合。在特定的实施方案中,所述方法包括从如此获得的细胞产生植物部分或植物,以及筛选所述细胞的目标性状。靶基因可包括编码区和非编码区。在特定的实施方案中,性状是胁迫耐受性,并且所述方法是用于生成胁迫耐受性作物品种的方法。
使用C2c1影响果实成熟
成熟是水果和蔬菜成熟过程中的正常阶段。成熟开始后仅几天,就使水果或蔬菜变得不可食用。这个过程给农民和消费者都造成了重大损失。在特定的实施方案中,本发明的方法用于减少乙烯的产生。通过确保以下一项或多项来确保这一点:a.ACC合酶基因表达的抑制。ACC(1-氨基环丙烷-1-甲酸)合酶是负责将S-腺苷甲硫氨酸(SAM)转化为ACC的酶;乙烯生物合成中的第二步到最后一步。当合酶基因的反义(“镜像”)或截短拷贝插入植物基因组中时,酶的表达受到阻碍;b.ACC脱氨酶基因的插入。编码所述酶的基因是从常见的非致病性土壤细菌绿针假单胞菌(Pseudomonas chlororaphis)获得的。它将ACC转化为其他化合物,从而减少了可用于生产乙烯的ACC的数量;c.SAM水解酶基因的插入。这种方法类似于ACC脱氨酶,其中当前体代谢物的量减少时,乙烯的生成受到阻碍;在这种情况下,SAM被转化为高丝氨酸。编码所述酶的基因从大肠杆菌T3噬菌体获得,以及d.抑制ACC氧化酶基因表达。ACC氧化酶是催化ACC氧化为乙烯的酶,这是乙烯生物合成途径的最后一步。使用本文所述的方法,ACC氧化酶基因的下调导致乙烯产生的抑制,从而延迟果实成熟。在特定的实施方案中,除上述修饰之外或作为替代,本文所述的方法用于修饰乙烯受体,从而干扰果实获得的乙烯信号。在特定的实施方案中,编码乙烯结合蛋白的ETR1基因的表达得到修饰,更特别是得到抑制。在特定的实施方案中,除上述修饰之外或作为替代,本文所述的方法用于修饰编码聚半乳糖醛酸酶(PG)的基因的表达,聚半乳糖醛酸酶是负责果胶分解的酶,果胶是维持植物细胞壁的完整性的物质。果胶分解发生在成熟过程的开始,导致果实软化。因此,在特定的实施方案中,本文描述的方法用于在PG基因中引入突变或抑制PG基因的活化,以减少产生的PG酶的量,从而延迟果胶降解。
因此,在特定的实施方案中,所述方法包括使用CRISPR-C2c1系统来确保例如上述植物细胞基因组的一种或多种修饰,以及从其再生植物。在特定的实施方案中,植物是番茄植物。
延长植物的贮存寿命
在特定的实施方案中,本发明的方法用于修饰影响植物或植物部分的贮存寿命的化合物生产中涉及的基因。更具体地,所述修饰位于防止马铃薯块茎中还原糖积累的基因中。经过高温处理,这些还原糖与游离氨基酸反应,产生褐色的苦味产物,并且作为潜在致癌物质的丙烯酰胺的水平升高。在特定的实施方案中,本文提供的方法用于减少或抑制液泡转化酶基因(VInv)的表达,其编码将蔗糖分解为葡萄糖和果糖的蛋白(Clasen等人,DOI:10.1111/pbi.12370)。
使用CRISPR-C2c1系统来确保附加值性状
在特定的实施方案中,CRISPR-C2c1系统用于生产营养改良的农作物。在特定的实施方案中,本文提供的方法适于产生“功能性食品”,即可提供超出其所含传统营养物的健康益处的改良食品或食品成分,和或“营养保健品”,即可被认为是食品或食品的一部分并提供健康益处(包括疾病的预防和治疗)的物质。在特定的实施方案中,营养保健品可用于预防和/或治疗癌症、糖尿病、心血管疾病和高血压中的一种或多种。
营养改良型作物的实例包括(Newell-McGloughlin,Plant Physiology,2008年7月,第147卷,第939-953页):
改变的蛋白质量、含量和/或氨基酸组成,例如关于以下描述:百喜草(Bahiagrass)(Luciani等人,2005,Florida Genetics Conference Poster),坎诺拉油菜(Roesler等人,1997,Plant Physiol 113 75-81),玉米(Cromwell等人,1967,1969J AnimSci 26 1325-1331;O'Quin等人,2000J Anim Sci 78 2144-2149;Yang等人,2002,Transgenic Res 11 11-20;Young等人,2004,Plant J 38910-922),马铃薯(Yu J和Ao,1997Acta Bot Sin 39 329-334;Chakraborty等人,2000,Proc Natl Acad Sci USA 973724-3729;Li等人,2001,Chin Sci Bull 46482-484),水稻(Katsube等人,1999,PlantPhysiol 120 1063-1074),大豆(Dinkins等人,2001,Rapp 2002,In Vitro Cell Dev BiolPlant 37 742-747),甘薯(Egnin和Prakash 1997,In Vitro Cell Dev Biol 33 52A)。
必需氨基酸含量,例如关于以下描述:坎诺拉油菜(Falco等人,1995,Bio/Technology 13 577-582),羽扇豆(White等人,2001,J Sci Food Agric 81147-154),玉米(Lai和Messing,2002,Agbios 2008GM作物数据库(2008年3月11日)),马铃薯(Zeh等人,2001,Plant Physiol 127 792-802),高粱(Zhao等人,2003,Kluwer AcademicPublishers,Dordrecht,The Netherlands,第413-416页),大豆(Falco等人,1995Bio/Technology 13 577-582;Galili等人,2002Crit Rev Plant Sci 21 167-204)。
油和脂肪酸,例如坎诺拉油菜(Dehesh等人,(1996)Plant J 9 167-172[PubMed];Del Vecchio(1996)INFORM International News on Fats,Oils and Related Materials7 230-243;Roesler等人,(1997)Plant Physiol 113 75-81[PMC free article][PubMed];Froman和Ursin(2002,2003)Abstracts of Papers of the American ChemicalSociety 223U35;James等人,(2003)Am J Clin Nutr77 1140-1145[PubMed];Agbios(2008,同上),棉花(Chapman等人,(2001).JAm Oil Chem Soc 78 941-947;Liu等人,(2002)J Am Coll Nutr 21 205S-211S[PubMed];O'Neill(2007)Australian Life Scientist.www.biotechnews.com.au/index.php/id;866694817;fp;4;fpid;2(2008年6月17日),亚麻籽(Abbadi等人,2004,Plant Cell 16:2734-2748),玉米(Young等人,2004,PlantJ 38 910-922),油棕(Jalani等人,1997,J Am Oil Chem Soc 741451-1455;Parveez,2003,AgBiotechNet 113 1-8),水稻(Anai等人,2003,Plant Cell Rep 21 988-992),大豆(Reddy和Thomas,1996,Nat Biotechnol 14639-642;Kinney和Kwolton,1998,BlackieAcademic and Professional,London,第193-213页),向日葵(Arcadia,Biosciences2008),
碳水化合物,例如果聚糖,关于以下所述:菊苣(Smeekens(1997)Trends PlantSci 2 286-287;Sprenger等人,(1997)FEBS Lett 400 355-358;Sévenier等人,(1998)NatBiotechnol 16 843-846),玉米(Caimi等人,(1996)Plant Physiol110 355-363),马铃薯(Hellwege等人,,1997Plant J 12 1057-1065),糖甜菜(Smeekens等人,1997,同上);菊粉,例如关于马铃薯所述(Hellewege等人,2000,Proc Natl Acad Sci USA 97 8699-8704);淀粉,例如关于水稻所述(Schwall等人,(2000)Nat Biotechnol 18 551-554;Chiang等人,(2005)Mol Breed 15125-143),
维生素和类胡萝卜素,例如关于以下所述:坎诺拉油菜(Shintani和DellaPenna(1998)Science 282 2098-2100),玉米(Rocheford等人,(2002).JAm Coll Nutr 21 191S-198S;Cahoon等人,(2003)Nat Biotechnol 21 1082-1087;Chen等人,(2003)Proc NatlAcad Sci USA 100 3525-3530),芥菜籽(Shewmaker等人,(1999)Plant J 20 401-412),马铃薯(Ducreux等人,2005,J Exp Bot 5681-89),水稻(Ye等人,(2000)Science 287 303-305),草莓(Agius等人,(2003),Nat Biotechnol 21 177-181),番茄(Rosati等人,(2000)Plant J 24 413-419;Fraser等人,(2001)J Sci Food Agric 81 822-827;Mehta等人,(2002)Nat Biotechnol 20613-618;Díaz de la Garza等人,(2004)Proc Natl Acad SciUSA 10113720-13725;Enfissi等人,(2005)Plant Biotechnol J 3 17-27;DellaPenna(2007)Proc Natl Acad Sci USA 104 3675-3676),
功能性次生代谢产物,例如关于以下所述:苹果(二苯乙烯,Szankowski等人,(2003)Plant Cell Rep 22:141-149),苜蓿(白藜芦醇,Hipskind和Paiva(2000)Mol PlantMicrobe Interact 13 551-562),猕猴桃(白藜芦醇,Kobayashi等人,(2000)Plant CellRep 19 904-910),玉米和大豆(类黄酮,Yu等人,(2000)Plant Physiol 124 781-794),马铃薯(花色素苷和生物碱糖苷,Lukaszewicz等人,(2004)J Agric Food Chem 52 1526-1533),水稻(类黄酮和白藜芦醇,Stark-Lorenzen等人,(1997)Plant Cell Rep 16 668-673;Shin等人,(2006)Plant Biotechnol J 4 303-315),番茄(+白藜芦醇、绿原酸、类黄酮、二苯乙烯;Rosati等人,(2000)同上;Muir等人,(2001)Nature 19 470-474;Niggeweg等人,(2004)Nat Biotechnol 22 746-754;Giovinazzo等人,(2005)Plant Biotechnol J 357-69),小麦(咖啡酸和阿魏酸、白藜芦醇;United Press International(2002));以及
矿物质可用性,例如关于以下所述:苜蓿(植酸酶,Austin-Phillips等人,(1999)www.molecularfarming.com/nonmedical.html),莴苣(铁,Goto等人,(2000)Theor ApplGenet 100 658-664),水稻(铁,Lucca等人,(2002)J Am Coll Nutr 21 184S-190S),玉米、大豆和小麦(植酸酶,Drakakaki等人,(2005)Plant Mol Biol 59 869-880;Denbow等人,(1998)Poult Sci 77 878-881;Brinch-Pedersen等人,(2000)Mol Breed 6 195-206)。
在特定的实施方案中,附加值性状与植物中存在的化合物的预期健康益处有关。例如,在特定的实施方案中,通过应用本发明的方法获得附加值作物,以确保一种或多种以下化合物的修饰或诱导/增加一种或多种以下化合物的合成:
类胡萝卜素,例如存在于胡萝卜中的α-胡萝卜素,其可中和可能损害细胞的自由基;或存在于各种水果和蔬菜中的β-胡萝卜素,其可中和自由基
绿色蔬菜中存在的叶黄素,其有助于维持健康的视力
番茄和番茄制品中存在的番茄红素,据信其可降低前列腺癌的风险
玉米黄质,存在于柑橘和玉米中,其有助于维持健康的视力
膳食纤维,例如麦麸中存在的不溶性纤维,其可降低乳腺癌和/或结肠癌的风险;和燕麦中存在的β-葡聚糖,车前草(Psylium)和全谷粒中的可溶性纤维,其可降低心血管疾病(CVD)的风险
脂肪酸,例如ω-3脂肪酸,其可降低CVD的风险并改善精神和视觉功能;共轭亚油酸,其可改善身体组成,可降低某些癌症的风险;和GLA,其可降低癌症和CVD的炎症风险,可改善身体组成
小麦中存在的类黄酮如羟基肉桂酸酯,其具有类似抗氧化剂的活性,可降低变性疾病的风险;水果和蔬菜中存在的黄酮醇、儿茶素和丹宁酸,其可中和自由基并可降低癌症的风险
十字花科蔬菜(西兰花、羽衣甘蓝)、辣根中存在的芥子油苷、吲哚、异硫氰酸盐(例如萝卜硫素),其可中和自由基,可降低癌症的风险
酚类化合物,例如葡萄中存在的二苯乙烯,其可降低变性疾病、心脏病和癌症的风险,可能具有延年益寿的作用;蔬菜和柑桔中存在的咖啡酸和阿魏酸,其具有类似抗氧化剂的活性,可降低变性疾病、心脏病和眼病的风险;以及可可中存在的表儿茶素,其具有类似抗氧化剂的活性,可降低变性疾病和心脏病的风险
玉米、大豆、小麦和木油中存在的植物甾烷醇/甾醇,其可通过降低血液胆固醇水平而降低冠心病的风险
菊芋(Jerusalem artichoke)、青葱、洋葱粉中存在的果聚糖、菊粉、低聚果糖,其可改善肠胃健康
大豆中存在的皂苷,其可降低LDL胆固醇
大豆中存在的大豆蛋白,其可降低心脏病的风险
大豆中存在的植物雌激素,例如异黄酮,其可减少更年期症状如潮热,可减少骨质疏松症和CVD;以及亚麻、黑麦和蔬菜中存在的木脂素,其可预防心脏病和某些癌症,可降低LDL胆固醇、总胆固醇
洋葱、大蒜、橄榄、韭菜和scallon中存在的硫化物和硫醇(如二烯丙基硫)以及十字花科蔬菜中存在的烯丙基甲基三硫化物、二硫代硫酮,其可降低LDL胆固醇,有助于维持健康的免疫系统
蔓越莓、可可中存在的丹宁,例如原花青素,其可改善尿道健康,可降低CVD和高血压的风险。
另外,本发明的方法还设想了改变蛋白质/淀粉的功能性、保质期、口味/美学、纤维质量以及变应原、抗营养物和毒素减少性状。
因此,本发明涵盖用于生产具有营养附加值的植物的方法,所述方法包括使用如本文所述的CRISPR-C2c1系统将编码参与生产附加营养价值组分的酶的基因引入植物细胞,以及从所述植物细胞再生植物,所述植物的特征在于所述附加营养价值组分的表达增加。在特定的实施方案中,CRISPR-C2c1系统用于间接修饰这些化合物的内源性合成,例如通过修饰一种或多种控制该化合物代谢的转录因子。上文描述了使用CRISPR-C2c1系统将目标基因引入植物细胞和/或修饰内源基因的方法。
已被修饰以赋予附加值性状的植物修饰的一些具体实例是:具有修饰的脂肪酸代谢的植物,例如,通过用硬脂基-ACP去饱和酶的反义基因转化植物以增加植物的硬脂酸含量。参见Knultzon等人,Proc.Natl.Acad.Sci.U.S.A.89:2624(1992)。另一个实例涉及降低肌醇六磷酸的含量,例如通过克隆并且然后再引入与单个等位基因相关的DNA,该DNA可能造成特征在于低植酸水平的玉米突变体。参见Raboy等人,Maydica 35:383(1990)。
类似地,在强启动子的控制下,玉米(Zea mays)Tfs C1和R的表达调控玉米糊粉层中类黄酮的产生,导致拟南芥(Arabidopsis thaliana)中花色素苷的高积累率,大概是通过激活整个途径(Bruce等人,2000,Plant Cell 12:65-80)。DellaPenna(Welsch等人,2007Annu Rev Plant Biol 57:711-738)发现,Tf RAP2.2及其相互作用的伴侣SINAT2增加了拟南芥叶片中的类胡萝卜素生成。在转基因拟南芥中表达Tf Dof1诱导了编码用于碳骨架生产的酶的基因的上调,氨基酸含量的显著增加以及Glc水平的降低(Yanagisawa,2004Plant Cell Physiol 45:386-391),并且DOF Tf AtDof1.1(OBP2)上调拟南芥中芥子油苷生物合成途径的所有步骤(Skirycz等人,2006Plant J 47:10-24)。
减少植物中的变应原
在特定的实施方案中,本文提供的方法用于产生变应原水平降低的植物,从而使它们对消费者更安全。在特定的实施方案中,所述方法包括修饰负责植物变应原产生的一种或多种基因的表达。例如,在特定的实施方案中,所述方法包括递送CRISPR-C2c1系统以下调Lol p5基因在植物细胞(例如黑麦草植物细胞)中的表达并从其再生植物以降低所述植物的花粉的变应原性(Bhalla等人,1999,Proc.Natl.Acad.Sci.USA第96卷:11676-11680)。在特定的实施方案中,CRISPR-C2c1系统将一个或多个交错的双链断裂(DSB)引入Lol p5基因。在其他特定的实施方案中,CRISPR-C2c1系统包含与修饰Lol p5基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统向Lolp5基因引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统向Lol p5基因的转录物引入单个核苷酸修饰。
花生过敏和对豆类过敏通常是实际和严重的健康问题。本发明的C2c1效应蛋白系统可用于鉴定并且然后编辑或沉默编码此类豆科植物的致敏蛋白的基因。对于这类基因和蛋白质没有限制,Nicolaou等人鉴定了花生、大豆、小扁豆、豌豆、羽扇豆、青豆和绿豆中的致敏蛋白。参见Nicolaou等人,Current Opinion in Allergy and Clinical Immunology2011;11(3):222)。
目标内源基因的筛选方法
本文提供的方法进一步允许鉴定附加营养价值组分的生产中所涉及的价值编码酶的基因或通常跨物种、门类和植物界通常影响目标农艺性状的基因。通过使用如本文所述的CRISPR-C2c1系统选择性地靶向例如编码植物中代谢途径的酶的基因,可鉴定出负责植物某些营养方面的基因。类似地,通过选择性地靶向可影响所需农艺性状的基因,可鉴定相关基因。因此,本发明涵盖用于编码具有特定营养价值和/或农艺性状的化合物的生产中所涉及的酶的基因的筛选方法。
CRISPR-C2c1系统在生物燃料生产中的用途
如本文所用,术语“生物燃料”是由植物和植物来源的资源制成的替代燃料。可从有机物质中提取可再生的生物燃料,这些有机物质的能量是通过碳固定过程获得的,或者是通过利用或转化生物质制得的。该生物质可直接用于生物燃料,或者可通过热转化、化学转化和生化转化而转化为方便的含能量物质。这种生物质转化可产生固体、液体或气体形式的燃料。生物燃料有两种类型:生物乙醇和生物柴油。生物乙醇主要是通过纤维素(淀粉)的糖发酵过程生产的,纤维素大部分源自玉米和甘蔗。在另一方面,生物柴油主要由油料作物如油菜籽、棕榈和大豆产生。生物燃料主要用于运输。
增强植物特性以生产生物燃料
在特定的实施方案中,使用利用如本文所述的CRISPR-C2c1系统的方法来改变细胞壁的性质,以便于关键水解剂的进入,从而更有效地释放糖以进行发酵。在特定的实施方案中,纤维素和/或木质素的生物合成被修饰。纤维素是细胞壁的主要组分。纤维素和木质素的生物合成是共同调控的。通过减少植物中木质素的比例,可增加纤维素的比例。在特定的实施方案中,本文所述的方法用于下调植物中木质素的生物合成,从而增加可发酵的碳水化合物。更具体来说,本文所述的方法用于下调至少第一木质素生物合成基因,所述基因选自由以下组成的组:4-香豆酸3-羟化酶(C3H),苯丙氨酸氨裂合酶(PAL),肉桂酸4-羟化酶(C4H),羟肉桂酰基转移酶(HCT),咖啡酸O-甲基转移酶(COMT),咖啡酰辅酶A 3-O-甲基转移酶(CCoAOMT),阿魏酸5-羟化酶(F5H),肉桂醇脱氢酶(CAD),肉桂酰基辅酶A还原酶(CCR),4-香豆酸-CoA连接酶(4CL),单木酚-木质素特异性糖基转移酶和醛脱氢酶(ALDH),如WO2008064289A2中所公开。
在特定的实施方案中,本文所述的方法用于生产在发酵期间产生较低水平的乙酸的植物物质(也参见WO 2010096488)。更具体来说,本文公开的方法用于生成与CaslL同源的突变以减少多糖乙酰化。
修饰酵母以生产生物燃料
在特定的实施方案中,本文提供的C2c1酶用于通过重组微生物生产生物乙醇。例如,C2c1可用于将微生物如酵母工程化,以由可发酵糖生成生物燃料或生物聚合物,并且任选地能够降解源自农业废弃物的植物来源木质纤维素,作为可发酵糖的来源。更具体来说,本发明提供了将C2c1 CRISPR复合物用于将生物燃料生产所需的外来基因引入微生物和/或修饰可干扰生物燃料合成的内源基因的方法。更具体来说,所述方法涉及将一种或多种编码参与丙酮酸向乙醇或另一种目标产物转化的酶的核苷酸序列引入微生物如酵母中。在特定的实施方案中,所述方法确保引入一种或多种酶,其允许微生物降解纤维素,例如纤维素酶。在其他实施方案中,C2c1 CRISPR复合物用于修饰与生物燃料生产途径竞争的内源性代谢途径。
因此,在更特定的实施方案中,本文所述的方法用于如下修饰微生物:
引入至少一种异源核酸或增加至少一种编码植物细胞壁降解酶的内源核酸的表达,以使得所述微生物能够表达所述核酸并能够产生和分泌所述植物细胞壁降解酶;
引入至少一种异源核酸或增加至少一种编码将丙酮酸转化为乙醛的酶的内源核酸的表达,任选地与至少一种编码将乙醛转化为乙醇的酶的异源核酸结合,使得所述宿主细胞能够表达所述核酸;和/或
在所述宿主细胞的代谢途径中修饰至少一种编码酶的核酸,其中所述途径产生除丙酮酸产生的乙醛或乙醛产生的乙醇以外的代谢产物,并且其中所述修饰导致所述代谢产物的产生减少,或引入至少一种编码所述酶的抑制剂的核酸。
修饰藻类和植物以生产植物油或生物燃料
例如,转基因藻类或其他植物如油菜在生产植物油或生物燃料如醇(尤其是甲醇和乙醇)中可能特别有用。这些可被工程化以表达或过表达用于石油或生物燃料工业的高水平的油或醇。
根据本发明的特定实施方案,CRISPR-C2c1系统用于生成可用于生物燃料生产的富含脂质的硅藻。
在特定的实施方案中,设想特异性修饰与植物产生的生物质生产有关的基因。在特定的实施方案中,CRISPR-C2c1系统用于通过靶向teosine分支(tb)基因或其同源物来生成高生物量植物。在某些实施方案中,CRISPR-C2c1系统向tb基因引入一个或多个交错的双链断裂(DSB)。在一个特定的实施方案中,CRISPR-C2c1系统将单个突变引入tb基因。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入tb基因的转录物中。在某些特定实施方案中,CRISPR-C2c1系统包含与功能结构域例如腺苷或胞苷脱氨酶(例如经由融合蛋白或合适的接头)缔合的无催化活性的C2c1蛋白,以向tb基因或其同源物引入单核苷酸突变。在一个特定的实施方案中,CRISPR-C2c1系统用于通过靶向tb1a和tb1b基因并引入单核苷酸突变来生成高生物量柳枝稷植物。参见Liu等人,Plant Biotechnology Journal(doi:10.1111/pbi.12778)。
在特定的实施方案中,设想特异性修饰参与藻类细胞产生的脂质量和/或脂质质量的修饰的基因。编码参与脂肪酸合成途径的酶的基因的实例可编码具有例如乙酰基-CoA羧化酶、脂肪酸合酶、3-酮酰基-酰基-载体蛋白合酶III、甘油-3-磷酸去氢酶(G3PDH)、烯酰基-酰基载体蛋白还原酶(烯酰基-ACP-还原酶)、甘油-3-磷酸酰基转移酶、溶血磷脂酰酰基转移酶或二酰基甘油酰基转移酶、磷脂:二酰基甘油酰基转移酶、磷脂酰磷酸酶、脂肪酸硫酯酶如棕榈酰蛋白硫酯酶或苹果酸酶活性的蛋白质。在其他实施方案中,设想生成具有增加的脂质积累的硅藻。这可通过靶向降低脂质分解代谢的基因来实现。在本发明的方法中使用特别感兴趣的是与三酰基甘油和游离脂肪酸的活化有关的基因,以及与脂肪酸的β-氧化直接有关的基因,例如酰基-CoA合酶、3-酮酰基-CoA硫解酶、酰基-CoA氧化酶活性和磷酸葡萄糖变位酶。本文所述的CRISPR-C2c1系统和方法可用于特异性激活硅藻中的此类基因以增加其脂质含量。
例如微藻的生物被广泛用于合成生物学。Stovicek等人(Metab.Eng.Comm.,2015;2:13)描述了对工业酵母(例如酿酒酵母)进行基因组编辑,以有效生产用于工业生产的稳健菌株。Stovicek使用对于酵母进行密码子优化的CRISPR-Cas9系统以同时破坏内源基因的两个等位基因和敲入异源基因。Cas9和gRNA从基于基因组或游离2μ的载体位置表达。作者还表明可通过优化Cas9和gRNA的表达水平来提高基因破坏效率。Hlavová等人(Biotechnol.Adv.2015)讨论了使用例如CRISPR的技术开发微藻物种或菌株以靶向核和叶绿体基因来进行插入诱变和筛选。Stovicek和Hlavová的方法可适用于本发明的C2c1效应蛋白系统。关于CRISPR-C2c1系统,在一些实施方案中,CRISPR-C2c1系统可识别作为5'TTN3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个交错的双链断裂(DSB)引入靶基因。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰Lol p5基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
US 8,945,839描述了一种使用Cas9将微藻(莱茵衣藻细胞物种)工程化的方法。使用类似的工具,本文所述的CRISPR-C2c1系统的方法可应用于衣藻属物种和其他藻类。在特定的实施方案中,将C2c1和指导RNA引入使用在组成型启动子例如Hsp70A-Rbc S2或β2-微管蛋白的控制下表达C2c1的载体表达的藻类中。指导RNA将使用含有T7启动子的载体递送。或者,可将C2c1mRNA和体外转录的指导RNA递送至藻类细胞。电穿孔方案遵循来自GeneArt衣藻工程化试剂盒的标准推荐方案。US 8,945,839的方法可应用于本发明的C2c1效应蛋白系统。关于CRISPR-C2c1系统,在一些实施方案中,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个交错的双链断裂(DSB)引入靶基因。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
C2c1在生成能够产生脂肪酸的微生物中的用途
在特定的实施方案中,本发明的方法用于生成能够产生脂肪酸酯(例如脂肪酸甲酯(“FAME”)和脂肪酸乙酯(“FAEE”))的遗传工程微生物。
通常,宿主细胞可通过表达或过表达编码硫酯酶的基因、编码酰基辅酶A合酶的基因和编码酯合酶的基因而被工程化,以从培养基中存在的碳源(例如醇)产生脂肪酸酯。因此,本文提供的方法用于修饰微生物以过表达或引入硫酯酶基因、编码酰基辅酶A合酶的基因和编码酯合酶的基因。在特定的实施方案中,所述硫酯酶基因选自tesA、'tesA、tesB、fatB、fatB2、fatB3、fatAl或fatA。在特定的实施方案中,编码酰基辅酶A合酶的基因选自fadDJadK、BH3103、pfl-4354、EAV15023、fadDl、fadD2、RPC_4074、fadDD35、fadDD22、faa39或编码具有相同特性的酶的鉴定基因。在特定的实施方案中,编码酯合酶的基因是来自霍霍巴(Simmondsia chinensis)、不动杆菌属ADP种、泊库岛食烷菌(Alcanivoraxborkumensis)、铜绿假单胞菌(Pseudomonas aeruginosa)、Fundibacter jadensis、拟南芥或真养产碱杆菌(Alkaligenes eutrophus)或其变体的编码合酶/酰基-CoA:二酰基甘油酰基转移酶的基因。
另外地或可替代地,本文提供的方法用于降低所述微生物中编码酰基辅酶A脱氢酶的基因、编码外膜蛋白受体的基因和编码脂肪酸生物合成的转录调控子的基因中的至少一者的表达。在特定的实施方案中,例如通过引入突变使这些基因中的一个或多个失活。在特定的实施方案中,编码酰基辅酶A脱氢酶的基因是fadE。在特定的实施方案中,编码脂肪酸生物合成的转录调控子的基因编码DNA转录阻遏子,例如fabR。
另外地或可替代地,修饰所述微生物以减少编码丙酮酸甲酸裂解酶的基因、编码乳酸脱氢酶的基因中的至少一者或两者的表达。在特定的实施方案中,编码丙酮酸甲酸裂解酶的基因是pflB。在特定的实施方案中,编码乳酸脱氢酶的基因是IdhA。在特定的实施方案中,例如通过在其中引入突变来使这些基因中的一者或多者失活。在一些实施方案中,CRISPR-C2c1系统向靶基因引入一个或多个具有5'-突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
在特定的实施方案中,微生物选自埃希氏菌属、芽孢杆菌属、乳杆菌属、红球菌属(Rhodococcus)、聚球藻属、Synechoystis、假单胞菌属、曲霉属、木霉属、链孢霉属、镰刀菌属、腐质霉菌(Humicola)、根毛霉属(Rhizomucor)、克鲁维酵母属、毕赤酵母属、毛菌属、Myceliophtora、青霉属、原毛平革菌属(Phanerochaete)、侧耳属(Pleurotus)、栓菌属(Trametes)、金孢属(Chrysosporium)、酵母属(Saccharomyces)、寡养单胞菌属(Stenotrophamonas)、裂殖酵母属(Schizosaccharomyces)、耶氏酵母属(Yarrowia)或链霉菌属(Streptomyces)。
C2c1在生成能够产生有机酸的微生物中的用途
本文提供的方法还用于工程化能够产生有机酸的微生物,更特别是由戊糖或己糖产生有机酸的微生物。在特定的实施方案中,所述方法包括将外源LDH基因引入微生物。在特定的实施方案中,通过使编码参与内源性代谢途径的蛋白质的内源基因失活来另外地或可替代地增加所述微生物中有机酸的产生,所述内源性代谢途径产生目标有机酸以外的代谢产物和/或其中内源性代谢途径消耗有机酸。在特定的实施方案中,修饰确保减少了除目标有机酸以外的代谢产物的产生。根据特定的实施方案,所述方法用于引入其中消耗有机酸的内源途径的至少一种工程化基因缺失和/或失活,或编码产生除目标有机酸以外的代谢产物的内源途径中涉及的产物的基因。在特定的实施方案中,至少一种工程化基因缺失或失活是在编码选自由以下组成的组的酶的一种或多种基因中:丙酮酸脱羧酶(pdc)、富马酸还原酶、醇脱氢酶(adh)、乙醛脱氢酶、磷酸烯醇丙酮酸羧化酶(ppc)、D-乳酸脱氢酶(d-ldh)、L-乳酸脱氢酶(l-ldh)、乳酸2-单加氧酶。在其他实施方案中,至少一种工程化基因缺失和/或失活是在编码丙酮酸脱羧酶(pdc)的内源基因中。
在其他实施方案中,微生物被工程化以产生乳酸,并且至少一个工程化基因的缺失和/或失活是在编码乳酸脱氢酶的内源基因中。另外地或可替代地,微生物包含编码细胞色素依赖性乳酸脱氢酶如细胞色素B2依赖性L-乳酸脱氢酶的内源基因的至少一种工程化基因缺失或失活。
C2c1在利用酵母菌株生成改良的木糖或纤维二糖中的用途
在特定的实施方案中,CRISPR-C2c1系统可用于利用酵母菌株选择改良的木糖或纤维二糖。易错PCR可用于扩增木糖利用或纤维二糖利用途径中涉及的一个(或多个)基因。涉及木糖利用途径和纤维二糖利用途径的基因的实例可包括但不限于Ha,S.J.等人,(2011)Proc.Natl.Acad.Sci.USA 108(2):504-9和Galazka,J.M.等人,(2010)Science 330(6000):84-6中描述的那些。所产生的双链DNA分子文库(每个文库在这样的选定基因中包含随机突变)可与CRISPR-C2c1系统的组分共转化为酵母菌株(例如S288C),并且可选择具有增强的木糖或纤维二糖利用能力的菌株,如WO2015138855中所述。
C2c1在生成用于类异戊二烯生物合成的改良酵母菌株中的用途
Tadas
C2c1在生成产乳酸的酵母菌株中的应用
在另一个实施方案中,涵盖了多重CRISPR-C2c1系统的成功应用。与VratislavStovicek等人(Metabolic Engineering Communications,第2卷,2015年12月,第13-22页)类似,可设计并在单个转化事件中获得改良的产乳酸菌株。在一个特定的实施方案中,CRISPR-C2c1系统用于同时插入异源乳酸脱氢酶基因以及破坏两个内源基因PDC1和PDC5基因。关于C2c1蛋白,在一些实施方案中,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统将单个突变引入PDC1或PD5基因。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入PDC1或PDC5基因的转录物。
CRISPR-C2c1系统在植物中的进一步应用
在特定的实施方案中,CRISPR系统并且优选地本文所述的CRISPR-C2c1系统可用于遗传元件动力学的可视化。例如,CRISPR成像可使重复或非重复的基因组序列可视化,报告端粒长度变化和端粒运动,并在整个细胞周期内监测基因基因座的动力学(Chen等人,Cell,2013)。这些方法也可应用于植物。
CRISPR系统并且优选地本文所述的CRISPR-C2c1系统的其他应用是体外和体内靶向基因破坏阳性选择筛选(Malina等人,Genes and Development,2013)。这些方法也可应用于植物。
在特定的实施方案中,无活性的C2c1核酸内切酶与组蛋白修饰酶的融合可在复杂的表观基因组中引入定制的变化(Rusk等人,Nature Methods,2014)。这些方法也可应用于植物。
在特定的实施方案中,CRISPR系统并且优选地本文所述的CRISPR-C2c1系统可用于纯化染色质的特定部分并鉴定相缔合的蛋白,从而阐明其在转录中的调控作用(Waldrip等人,Epigenetics,2014)。这些方法也可应用于植物。
在特定的实施方案中,由于本发明能够切割病毒DNA和RNA,因此其可用作植物系统中病毒去除的疗法。先前在人类系统中的研究表明,已成功地利用CRISPR靶向单链RNA病毒丙型肝炎(A.Price等人,Proc.Natl.Acad.Sci,2015)以及双链DNA病毒乙型肝炎(V.Ramanan等人,Sci.Rep,2015)。这些方法也可能适于在植物中使用CRISPR-C2c1系统。
在特定的实施方案中,本发明可用于改变基因组复杂性。在另一个特定的实施方案中,CRISPR系统并且优选地本文所述的CRISPR-C2c1系统可用于破坏或改变染色体数目并生成单倍体植物,其仅包含来自一个亲本的染色体。可诱导此类植物进行染色体复制并转化为仅包含纯合等位基因的二倍体植物(Karimi-Ashtiyani等人,PNAS,2015;Anton等人,Nucleus,2014)。这些方法也可应用于植物。
在特定的实施方案中,本文所述的CRISPR-C2c1系统可用于自切割。在这些实施方案中,C2c1酶和gRNA的启动子可以是组成型启动子,并且第二gRNA被引入相同的转化盒中,但是由诱导型启动子控制。可指定该第二gRNA诱导C2c1基因中的位点特异性切割,以产生非功能性的C2c1。在另一个特定的实施方案中,第二gRNA在转化盒的两端诱导切割,导致从宿主基因组中去除盒。该系统提供细胞暴露于Cas酶的受控持续时间并进一步减少脱靶编辑。此外,CRISPR/Cas盒的两端的切割可用于生成具有双等位基因突变的无转基因的T0植物(如关于Cas9所述,例如Moore等人,Nucleic Acids Research,2014;Schaeffer等人,Plant Science,2015)。Moore等人的方法可应用于本文所述的CRISPR-C2c1系统。
Sugano等人(Plant Cell Physiol.2014年3月;55(3):475-81.doi:10.1093/pcp/pcu014.电子出版于2014年1月18日)报道了CRISPR-Cas9在地钱(Marchantia polymorphaL.)中的靶向诱变的应用,地钱已成为研究陆地植物进化的模型物种。鉴定出地钱的U6启动子并克隆以表达gRNA。设计了gRNA的靶序列以破坏地钱中编码植物生长素应答因子1(ARF1)的基因。使用农杆菌介导的转化,Sugano等人在地钱的配子体世代中分离出稳定突变体。使用花椰菜花叶病毒35S或地钱EF1α启动子表达Cas9可实现基于CRISPR-Cas9的体内定点诱变。显示出植物生长素抗性表型的分离的突变个体不是嵌合体。此外,通过T1植物的无性繁殖产生了稳定的突变体。使用基于CRIPSR-Cas9的靶向诱变很容易建立多个arf1等位基因。Sugano等人的方法可应用于本发明的C2c1效应蛋白系统。
Kabadi等人(Nucleic Acids Res.2014年10月29日;42(19):e147.doi:10.1093/nar/gku749.电子出版于2014年8月13日)开发了单一慢病毒系统来表达Cas9变体、报告基因和多达四个来自独立的RNA聚合酶III启动子的sgRNA,其可通过方便的Golden Gate克隆方法并入载体中。每个sgRNA被有效表达,并且可在永生化和原代人类细胞中介导多重基因编辑和持续转录激活。Kabadi等人的方法可应用于本发明的C2c1效应蛋白系统。
Ling等人(BMC Plant Biology 2014,14:327)开发了基于pGreen或pCAMBIA骨架以及gRNA的CRISPR-Cas9二元载体集。该工具包除BsaI外不需要任何限制酶来生成带有玉米密码子优化的Cas9和一个或多个gRNA的最终构建体,只需少至一个克隆步骤即可获得高效率。所述工具包已使用玉米原生质体、转基因玉米品系和转基因拟南芥品系进行了验证,并显示出高效率和特异性。更重要的是,使用该工具包,在T1代转基因幼苗中检测到了三个拟南芥基因的靶向突变。此外,多基因突变可被下一代遗传。(指导RNA)模块载体集,作为植物中多重基因组编辑的工具包。Lin等人的工具箱可应用于本发明的C2c1效应蛋白系统。
基于Methods in Molecular Biology系列的第1284卷的第239-255页,2015年2月10日中关于CRISPR-Cas9系统所公开的那些,经由CRISPR-C2c1用于靶向植物基因组编辑的方案也可用。描述了设计、构建和评价使用拟南芥和本氏烟草(Nicotiana benthamiana)原生质体模型细胞系统对双重gRNA进行植物密码子优化的Cas9(pcoCas9)介导的基因组编辑的详细程序。还讨论了将CRISPR-Cas9系统应用于在整个植物中产生靶向基因组修饰的策略。本章中描述的方案可应用于本发明的C2c1效应蛋白系统。
关于上述方法和方案中的C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Ma等人(Mol Plant.2015年8月3日;8(8):1274-84.doi:10.1016/j.molp.2015.04.007)报道了稳健的CRISPR-Cas9载体系统,其利用植物密码子优化的Cas9基因,用于在单子叶植物和双子叶植物中进行方便且高效率的多重基因组编辑。Ma等人设计了基于PCR的程序以快速生成多个sgRNA表达盒,可通过Golden Gate连接或Gibson组装在一轮克隆中将其组装成二元CRISPR-Cas9载体。利用这个系统,Ma等人编辑了水稻中的46个靶位点,平均突变率为85.4%,主要是双等位基因和纯合子状态。Ma等人通过同时靶向基因家族的多个(至多八个)成员,生物合成途径中的多个基因或单个基因中的多个位点,提供了T0水稻和T1拟南芥植物中功能丧失的基因突变的实例。Ma等人的方法可应用于本发明的C2c1效应蛋白系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Lowder等人(Plant Physiol.2015年8月21日.pii:pp.00636.2015)还开发了一种CRISPR-Cas9工具箱,其能够对植物中表达的、沉默的或非编码基因进行多重基因组编辑和转录调控。该工具箱为研究人员提供了方案和试剂,以使用Golden Gate和Gateway克隆方法快速且有效地组装用于单子叶植物和双子叶植物的功能性CRISPR-Cas9 T-DNA构建体。它具有一整套功能,包括多重基因编辑以及植物内源基因的转录激活或阻遏。基于T-DNA的转化技术是现代植物生物技术、遗传学、分子生物学和生理学的基础。因此,可将C2c1(WT、切口酶或dC2c1)和gRNA组装成目标T-DNA目的载体。组装方法是基于Golden Gate组装和MultiSite Gateway重组。组装需要三个模块。第一个模块是C2c1进入载体,其包含无启动子的C2c1或其衍生基因,侧接attL1和attR5位点。第二个模块是gRNA进入载体,其包含进入gRNA表达盒,侧接attL5和attL2位点。第三个模块包括含有attR1-attR2的目的T-DNA载体,这些载体为C2c1表达提供了选择的启动子。Lowder等人的工具箱可应用于本发明的C2c1效应蛋白系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Wang等人(bioRxiv 051342;doi:doi.org/10.1101/051342;电子出版于2016年5月12日)展示了使用具有若干gRNA-tRNA单元的多重基因编辑构建体在单个启动子的控制下对影响六倍体小麦中的重要农艺性状的四个基因的同源拷贝进行编辑。
在一个有利的实施方案中,植物可以是树。本发明还可将本文公开的CRISPR Cas系统用于草本系统(参见例如Belhaj等人,Plant Methods 9:39;和Harrison等人,Genes&Development 28:1859-1872)。在一个特别有利的实施方案中,本发明的CRISPR Cas系统可靶向树木中的单核苷酸多态性(SNP)(参见例如Zhou等人,New Phytologist,第208卷,第2期,第298-301页,2015年10月)。在Zhou等人的研究中,作者使用4-香豆酸酯:CoA连接酶(4CL)基因家族作为案例研究,将CRISPR Cas系统应用于多年生木本杨木中,并针对两个靶向的4CL基因实现了100%的突变效率,每个所研究的转化体均带有双等位基因修饰。在Zhou等人的研究中,CRISPR-Cas9系统对单核苷酸多态性(SNP)高度敏感,因为由于靶序列中的SNP而取消了对第三个4CL基因的切割。这些方法可应用于本发明的C2c1效应蛋白系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Zhou等人(New Phytologist,第208卷,第2期,第298-301页,2015年10月)可如下应用于本发明。分别与木质素和类黄酮生物合成相关的两个4CL基因4CL1和4CL2被靶向用于CRISPR-Cas9编辑。常规用于转化的杂种白杨(Populus tremula×alba)克隆717-1B4与基因组测序的毛果杨(Populus trichocarpa)不同。因此,从参考基因组设计的4CL1和4CL2gRNA受到内部717RNA-Seq数据的质询,以确保不存在可能限制Cas效率的SNP。还包括为4CL5设计的第三个gRNA,即4CL1的基因组复制。相应的717序列在PAM附近/之内的每个等位基因中都带有一个SNP,预计这两者都将消除4CL5-gRNA的靶向作用。所有三个gRNA靶位点均位于第一个外显子内。对于717转化,在二元载体中,由Medicago U6.6启动子以及在CaMV35S启动子的控制下的人类密码子优化的Cas表达gRNA。利用仅Cas载体的转化可用作对照。对随机选择的4CL1和4CL2系进行扩增子测序。然后处理数据,并在所有情况下确认双等位基因突变。这些方法可应用于本发明的C2c1效应蛋白系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
在植物中,病原体通常是宿主特异性的。例如,尖孢镰刀菌番茄专化型病原菌(Fusarium oxysporum f.sp.lycopersici)引起番茄枯萎,但仅侵害番茄,并且香石竹尖孢镰刀菌(F.oxysporum f.dianthii)、小麦秆锈菌(Puccinia graminis f.sp.tritici)仅侵害小麦。植物具有抵抗大多数病原体的现有和诱导防御能力。跨植物世代的突变和重组事件导致遗传变异,所述遗传变异引起易感性,尤其是因为病原体的繁殖频率高于植物。在植物中可存在非宿主抗性,例如宿主与病原体不相容。还可存在水平抗性,例如,对病原体所有小种的部分抗性,通常由许多基因控制,以及垂直抗性,例如对病原体的某些小种而不是其他小种的完全抗性,通常由少数基因控制。在基因-基因水平上,植物和病原体一起进化,并且一者中的遗传变化与另一者中的遗传变化平衡。因此,利用自然变异性,育种者结合了对于产量、品质、均匀性、硬度和抗性最有用的基因。抗性基因的来源包括天然或外来品种、传家宝品种、野生植物亲缘种和诱导突变,例如用诱变剂处理植物材料。使用本发明,为植物育种者提供了诱导突变的新工具。因此,本领域技术人员可分析抗性基因来源的基因组,并且在具有所需特征或性状的品种中,利用本发明以比以前的诱变剂更精确的方式诱导抗性基因的产生,从而加速和改善植物育种程序。
下表提供了关于可使用CRISPR-Cas复合物、修饰的效应蛋白、系统和优化方法来改善生物生产的其他参考文献和相关领域。在一些实施方案中,CRISPR-Cas复合物包含与tracr RNA复合的C2c1蛋白或其催化结构域,包含与正向重复序列连接的指导序列的指导RNA,其中所述指导序列与靶序列杂交。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
改良的植物和酵母细胞
本发明还提供了通过本文提供的方法可获得和获得的植物和酵母细胞。通过本文所述方法获得的改良植物可通过基因的表达来用于食品或饲料生产,所述基因例如确保对植物害虫、除草剂、干旱、低温或高温、过量水等的耐受性。
通过本文描述的方法获得的改良植物,尤其是农作物和藻类,可通过表达例如比野生型中通常可见的更高的蛋白质、碳水化合物、营养物或维生素水平而可用于食品或饲料生产。在这方面,优选改良植物,尤其是豆类和块茎。
例如,改良的藻类或其他植物(例如油菜)在生产植物油或生物燃料如醇类(尤其是甲醇和乙醇)中特别有用。这些可被工程化以表达或过表达用于石油或生物燃料工业的高水平的油或醇。
本发明还提供了改良的植物部分。植物部分包括但不限于叶、茎、根、块茎、种子、胚乳、胚珠和花粉。本文所设想的植物部分可以是可存活的、不可存活的、可再生的和/或不可再生的。
在一个实施方案中,Soyk等人(Nat Genet.2017年1月;49(1):162-168)描述的方法,其使用CRISPR-Cas9介导的靶向番茄中开花阻遏子SP5G的突变来产生早期产量番茄,所述方法可针对本发明公开的CRISPR-Cas系统进行修饰。在一些实施方案中,所述CRISPR蛋白是C2c1,并且所述系统包含:I.CRISPR-Cas系统RNA多核苷酸序列,其中所述多核苷酸序列包含:(a)能够与靶序列杂交的指导RNA多核苷酸,和(b)正向重复RNA多核苷酸,和II.编码C2c1的多核苷酸序列,其任选地包含至少一个或多个核定位序列,其中所述正向重复序列与所述指导序列杂交并引导CRISPR复合物与靶序列的序列特异性结合,并且其中所述CRISPR复合物包含与以下各物复合的CRISPR蛋白:(1)与靶序列杂交或可杂交的指导序列,和(2)正向重复序列,并且编码CRISPR蛋白的多核苷酸序列为DNA或RNA。在一些实施方案中,植物细胞基因组包含富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在一个特定的实施方案中,PAM是5'-TTG-3'。在一些实施方案中,CRISPR效应蛋白是C2c1蛋白。与Cas9在PAM的近端发生切割相反,C2c1在PAM的远端产生双链断裂(Jinek等人,2012;Cong等人,2013)。已提出Cpf1突变的靶序列可能易于被单个gRNA重复切割,从而促进Cpf1在HDR介导的基因组编辑中的应用(Front Plant Sci.2016年11月14日;7:1683)。Cpf1和C2c1都是共有结构相似性的V型CRISPR Cas蛋白。像C2c1一样,Cpf1在PAM的远端产生交错的双链断裂(与Cas9相反,Cas9在PAM的近端产生钝切)。因此,在某些实施方案中,通过CRISPR-C2c1复合物经由同源性定向修复(HR或HDR)来修饰目标基因座。在某些实施方案中,通过不依赖于HR的CRISPR-C2c1复合物来修饰目标基因座。在某些实施方案中,通过CRISPR-C2c1复合物经由非同源末端连接(NHEJ)来修饰目标基因座。
本文还涵盖提供根据本发明的方法生成的植物细胞和植物。通过传统育种方法产生的包含遗传修饰的植物的配子、种子、胚胎(合子或体细胞)的后代或杂种,也包括在本发明的范围内。此类植物可包含插入在靶序列或代替靶序列的异源或外来DNA序列。或者,此类植物可在一个或多个核苷酸中仅包含改变(突变、缺失、插入、取代)。因此,此类植物将仅通过存在特定修饰而与其祖先植物不同。
因此,本发明提供了通过本方法产生的植物、动物或细胞或其后代。后代可以是所生产的植物或动物的克隆,或者可以是通过与相同物种的其他个体杂交以向其后代渗入更多所需性状而由有性繁殖产生的。在多细胞生物体、特别是动物或植物的情况下,细胞可以是体内或离体的。
如本文所述的使用C2c1系统进行基因组编辑的方法可用于在基本上任何植物、藻类、真菌、酵母等上赋予期望的性状。使用本公开的核酸构建体和上述各种转化方法,各种各样的植物、藻类、真菌、酵母等以及植物藻类、真菌、酵母细胞或组织系统可针对本文所述的期望的生理和农艺学特性进行工程化。
在特定的实施方案中,本文所述的方法用于修饰内源基因或修饰其表达,而无需将任何外来基因(包括编码CRISPR组分的外来基因)永久引入植物、藻类、真菌、酵母等的基因组中,从而避免在植物基因组中出现外来DNA。由于非转基因植物的法规要求较不严格,因此这可能是令人感兴趣的。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,功能结构域包含脱氨酶,优选腺苷脱氨酶。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
本文提供的CRISPR系统可用于引入靶向的双链或单链断裂和/或引入基因激活子和/或阻遏子系统,并非限制性地,可用于基因靶向、基因置换、靶向诱变、靶向缺失或插入、靶向倒位和/或靶向易位。通过在单个细胞中共表达旨在实现多种修饰的多个靶向RNA,可确保多重基因组修饰。该技术可用于具有改善特性的植物的高精度工程化,这些特性包括增强的营养质量,增强的抗病性以及对生物和非生物胁迫的抗性,以及商业上有价值的植物产品或异源化合物的产量增加。
本文所述的方法通常导致“改良的植物、藻类、真菌、酵母等”的生成,因为与野生型植物相比,它们具有一种或多种理想的性状。在特定的实施方案中,获得的植物、藻类、真菌、酵母等细胞或部分是转基因植物,其包含并入全部或部分细胞的基因组中的外源DNA序列。在特定的实施方案中,获得非转基因的遗传修饰的植物、藻类、真菌、酵母等部分或细胞,因为没有外源DNA序列被并入到植物的任何细胞的基因组中。在这样的实施方案中,改良的植物、藻类、真菌、酵母等是非转基因的。如果仅确保内源基因的修饰,而在植物、藻类、真菌、酵母等基因组中没有引入或维持任何外来基因,则所得的遗传修饰作物不包含外来基因,因此基本上可被认为是非转基因的。CRISPR-C2c1系统对于植物、藻类、真菌、酵母等基因组编辑的不同应用包括但不限于:引入一个或多个外来基因以赋予目标农业性状;编辑内源基因以赋予目标农业性状;通过CRISPR-C2c1系统调节内源基因以赋予目标农业性状。由于C2c1蛋白在靶位点处产生交错的双链断裂(DSB),因此可引入外源DNA序列,或者在有或没有同源性定向修复(HR)的情况下敲入外源DNA序列(例如经由NHEJ)。赋予农艺性状的示例性基因包括但不限于赋予对害虫或病害的抗性的基因;涉及植物病害的基因,例如WO 2013046247中列出的那些;赋予对除草剂、杀真菌剂等的抗性的基因;涉及(非生物)胁迫耐受性的基因。使用CRISPR-Cas系统的其他方面包括但不限于:产生(雄性)不育植物;增加植物/藻类等的生育期;在目标作物中产生遗传变异;影响果实成熟;增加植物/藻类等的贮存寿命;减少植物/藻类等中的变应原;确保附加值性状(例如营养改善);目标内源基因的筛选方法;生物燃料、脂肪酸、有机酸等的生产。
C2c1效应蛋白复合物可用于非动物生物体,例如植物、藻类、真菌、酵母等。
如本文所述的使用C2c1系统进行基因组编辑的方法可用于在基本上任何植物、藻类、真菌、酵母等上赋予期望的性状。使用本公开的核酸构建体和上述各种转化方法,各种各样的植物、藻类、真菌、酵母等以及植物藻类、真菌、酵母细胞或组织系统可针对本文所述的期望的生理和农艺学特性进行工程化。
通过使用包含指导RNA和Cas9蛋白的CRISPR-Cas9系统将1-14nt缺失引入多酚氧化酶基因中,经由PEG转化递送至蘑菇细胞,开发了一种抗褐变白蘑菇(双孢蘑菇(Aaricusbisporus))菌株。参见Yang等人(news.psu.edu/sto ry/432734/2016/10/19/academics/penn-state-developer-gene-edited-mushroom-wi ns-best-whats-new)。如本文所述的CRISPR-C2c1系统可与Yang等人的方法一起使用。关于C2c1蛋白,CRISPR-C2c1系统识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在优选的实施方案中,CRISPR-C2c1系统经由NHEJ在交错DSB处引入外源模板DNA序列。在一些实施方案中,C2c1效应蛋白包含一个或多个突变。在一些实施方案中,C2c1效应蛋白是切口酶。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰目标靶基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在特定的实施方案中,本文所述的方法用于修饰内源基因或修饰其表达,而无需将任何外来基因(包括编码CRISPR组分的外来基因)永久引入植物、藻类、真菌、酵母等的基因组中,从而避免在植物基因组中存在外来DNA。由于非转基因植物的法规要求较不严格,因此这可以是令人感兴趣的。
本文提供的CRISPR系统可用于引入靶向的双链或单链断裂和/或引入基因激活子和/或阻遏子系统,并非限制性地,可用于基因靶向、基因置换、靶向诱变、靶向缺失或插入、靶向倒位和/或靶向易位。通过在单个细胞中共表达旨在实现多种修饰的多个靶向RNA,可确保多重基因组修饰。该技术可用于具有改善特性的植物的高精度工程化,这些特性包括增强的营养质量,增强的抗病性以及对生物和非生物胁迫的抗性,以及商业上有价值的植物产品或异源化合物的产量增加。
本文所述的方法通常导致“改良的植物、藻类、真菌、酵母等”的生成,因为与野生型植物相比,它们具有一种或多种理想的性状。在特定的实施方案中,获得的植物、藻类、真菌、酵母等细胞或部分是转基因植物,其包含并入全部或部分细胞的基因组中的外源DNA序列。在特定的实施方案中,获得非转基因的遗传修饰的植物、藻类、真菌、酵母等部分或细胞,因为没有外源DNA序列被并入到植物的任何细胞的基因组中。在这样的实施方案中,改良的植物、藻类、真菌、酵母等是非转基因的。如果仅确保内源基因的修饰,而在植物、藻类、真菌、酵母等基因组中没有引入或维持任何外来基因,则所得的遗传修饰作物不包含外来基因,因此基本上可被认为是非转基因的。CRISPR-C2c1系统对于植物、藻类、真菌、酵母等基因组编辑的不同应用包括但不限于:引入一个或多个外来基因以赋予目标农业性状;编辑内源基因以赋予目标农业性状;通过CRISPR-C2c1系统调节内源基因以赋予目标农业性状。赋予农艺性状的示例性基因包括但不限于赋予对害虫或病害的抗性的基因;涉及植物病害的基因,例如WO 2013046247中列出的那些;赋予对除草剂、杀真菌剂等的抗性的基因;涉及(非生物)胁迫耐受性的基因。使用CRISPR-Cas系统的其他方面包括但不限于:产生(雄性)不育植物;增加植物/藻类等的生育期;在目标作物中产生遗传变异;影响果实成熟;增加植物/藻类等的贮存寿命;减少植物/藻类等中的变应原;确保附加值性状(例如营养改善);目标内源基因的筛选方法;生物燃料、脂肪酸、有机酸等的生产。
在非人类动物中的应用
在一个方面,本发明提供了一种非人类的真核生物;优选多细胞真核生物,其包含根据任何所述实施方案的真核宿主细胞。在其他方面,本发明提供了一种真核生物;优选多细胞真核生物,其包含根据任何所述实施方案的真核宿主细胞。在这些方面的一些实施方案中,生物体可以是动物。例如哺乳动物。此外,生物体可以是节肢动物,例如昆虫。本发明还可扩展到其他农业应用,例如农场和生产动物。例如,猪具有许多使其作为生物医学模型具有吸引力的特征,尤其是在再生医学中。特别地,具有严重的联合免疫缺陷(SCID)的猪可为再生医学、异种移植(也在本文其他地方讨论)和肿瘤发展提供有用的模型,并且将有助于开发用于人类SCID患者的疗法。Lee等人(Proc Natl Acad Sci U S A.2014年5月20日;111(20):7260-5)利用报告物指导的转录激活子样效应子核酸酶(TALEN)系统以在体细胞中以高效率产生重组激活基因(RAG)2的靶向修饰,包括影响两个等位基因的一些靶向修饰。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Lee等人(Proc Natl Acad Sci U S A.2014年5月20日;111(20):7260-5)的方法可类似地如下应用于本发明。突变猪是通过在胎儿成纤维细胞中靶向修饰RAG2,接着进行SCNT和胚胎转移而生产的。将编码CRISPR Cas和报告物的构建体电穿孔到胎儿来源的成纤维细胞中。48小时后,将表达绿色荧光蛋白的转染细胞以估计的每孔单细胞稀释度分选到96孔板的各个孔中。通过扩增位于任何CRISPR Cas切割位点两侧的基因组DNA片段来筛选RAG2的靶向修饰,接着对PCR产物进行测序。在筛选并确保不存在异位突变后,将带有RAG2靶向修饰的细胞用于SCNT。除去极性体以及大概含有中期II板的卵母细胞的相邻细胞质的一部分,并将供体细胞放置在周玻璃体中。然后将重建的胚胎电穿孔以使供体细胞与卵母细胞融合,然后进行化学激活。激活的胚胎在含0.5μM Scriptaid(S7817;Sigma-Aldrich)的猪合子培养基3(PZM3)中温育14-16小时。然后将胚胎洗涤以除去Scriptaid,并在PZM3中培养,直到将它们转移到代孕猪的输卵管中。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
本发明用于创建对动物(在一些实施方案中为哺乳动物,在一些实施方案中为人类)的疾病或病症建模的平台。在某些实施方案中,这样的模型和平台是基于啮齿动物(在非限制性实例中为大鼠或小鼠)的。这样的模型和平台可利用自交啮齿动物品系之间的区别和比较。在某些实施方案中,这样的模型和平台是基于灵长类、马、牛、绵羊、山羊、猪、狗、猫或鸟,例如以对此类动物的疾病和病症直接建模或者产生此类动物的改性和/或改良品系。有利地,在某些实施方案中,创建基于动物的平台或模型以模拟人类疾病或病症。例如,猪与人的相似性使得猪成为模拟人类疾病的理想平台。与啮齿动物模型相比,猪模型的开发既昂贵又费时。在另一方面,猪和其他动物在遗传学、解剖学、生理学和病理生理学上与人类的相似性更高。本发明提供了用于靶向基因和基因组编辑、基因和基因组修饰以及基因和基因组调控的高效平台,以用于此类动物平台和模型。尽管伦理标准阻碍了人类模型的开发,并且在许多情况下阻碍了基于非人类灵长类动物的模型的开发,但是本发明可用于体外系统,包括但不限于细胞培养系统、三维模型和系统,以及模拟、建模和研究人类的结构、器官和系统的遗传学、解剖学、生理学和病理生理学的类器官。平台和模型提供对单个或多个靶标的操纵。
在某些实施方案中,本发明适用于像Schomberg等人(FASEB Journal,2016年4月;30(1):增刊571.1)的疾病模型。为了模拟遗传性疾病1型神经纤维瘤病(NF-1),Schomberg使用CRISPR-Cas9通过将CRISPR/Cas9组分胞质显微注射到猪胚胎中,在猪神经纤维蛋白1基因中引入突变。为针对Cas9靶向切割的基因内外显子上游和下游的靶向位点区域创建了CRISPR指导RNA(gRNA),并通过特定的单链寡脱氧核苷酸(ssODN)模板介导了修复以引入2500bp缺失。CRISPR-Cas系统还用于工程改造具有特定NF-1突变或突变簇的猪,并且此外可用于工程改造给定人类个体的特异性或代表性的突变。本发明类似地用于开发人类多基因疾病的动物模型,包括但不限于猪模型。根据本发明,使用多重指导物和任选地一个或多个模板同时靶向一个基因或多个基因中的多个遗传基因座。
本发明还适用于修饰其他动物如牛的SNP。Tan等人(Proc Natl Acad Sci USA.2013年10月8日;110(41):16526-16531)扩展了牲畜基因编辑工具箱,以使用质粒、rAAV和寡核苷酸模板来包括转录激活子样(TAL)效应子核酸酶(TALEN)刺激的同源性定向修复(HDR)和成簇的规律间隔的短回文重复序列(CRISPR)/Cas9刺激的同源性定向修复(HDR)。根据他们的方法(Mali P等人,(2013)RNA-Guided Human Genome Engineering viaCas9.Science339(6121):823-826)将基因特异性gRNA序列克隆到Church Lab gRNA载体(Addgene ID:41824)。通过共转染hCas9质粒(Addgene ID:41815)或从RCIScript-hCas9合成的mRNA来提供Cas9核酸酶。通过将来自hCas9质粒(涵盖hCas9 cDNA)的XbaI-AgeI片段亚克隆到RCIScript质粒中来构建这种RCIScript-hCas9。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N为任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7-nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统在转录物的SNP位置处引入单个核苷酸修饰。
Heo等人(Stem Cells Dev.2015年2月1日;24(3):393-402.doi:10.1089/scd.2014.0278.电子出版于2014年11月3日)报道了使用牛多能细胞和成簇的规律间隔的短回文重复序列(CRISPR)/Cas9核酸酶在牛基因组中进行高效基因靶向。首先,Heo等人通过yamanaka因子的异位表达以及GSK3β和MEK抑制剂(2i)处理,从牛体细胞成纤维细胞生成诱导型多能干细胞(iPSC)。Heo等人观察到这些牛iPSC在畸胎瘤中的基因表达和发育潜能与幼稚的多能干细胞高度相似。此外,对牛NANOG基因座具特异性的CRISPR-Cas9核酸酶显示出对牛iPSC和胚胎中牛基因组的高效编辑。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统向NANOG基因座引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰NANOG基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入对应于NANOG基因座的转录物。
Qingjian Zou等人(Journal of Molecular Cell Biology Advance Access,出版于2015年10月12日)证实了通过靶向狗肌肉生长抑制素(Myostatin/MSTN)基因的第一外显子(骨骼肌质量的负调控子)使狗的肌肉质量增加。首先,使用将靶向MSTN的sgRNA与Cas9载体共转染到犬胚成纤维细胞(CEF)中,验证了sgRNA的效率。此后,通过将具有正常形态的胚胎与Cas9 mRNA和MSTN sgRNA的混合物显微注射,并将受精卵自体移植到同一只雌性狗的输卵管中,生成MSTN KO狗。与野生型同窝姐妹相比,敲除的幼犬在大腿上表现出明显的肌肉表型。这也可使用本文提供的CRISPR-C2c1系统执行。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
牲畜
在一些实施方案中,牲畜中的病毒靶标可包括猪CD163,例如在猪巨噬细胞上。CD163与PRRSv(猪繁殖与呼吸综合征病毒,一种动脉炎病毒)感染(被认为是通过病毒细胞进入)相关。PRRSv的感染,尤其是猪肺泡巨噬细胞(在肺中发现)的感染会导致先前无法治愈的猪综合征(“神秘猪病”或“蓝耳病”),在家猪中造成痛苦,包括生殖衰竭、体重减轻和高死亡率。由于通过巨噬细胞活性丧失引起的免疫缺陷,经常会出现机会性感染,例如动物性肺炎、脑膜炎和耳部水肿。由于抗生素使用的增加和经济损失(估计每年6.6亿美元),它也具有重大的经济和环境影响。
如密苏里州大学(University of Missouri)的Kristin M Whitworth和RandallPrather等人(Nature Biotech 3434,在线出版于2015年12月07日)与Genus Plc合作所报道,使用CRISPR-Cas9靶向CD163,并且经过编辑的猪的后代在暴露于PRRSv时具有抗性。繁殖了一个创始雄性和一个创始雌性,它们都在CD163的外显子7中具有突变,以产生后代。创始雄性在一个等位基因上的外显子7中具有11bp的缺失,这导致结构域5的第45位氨基酸发生移码突变和错义翻译,随后在第64位氨基酸上出现过早的终止密码子。另一个等位基因在外显子7中具有2bp加成并且在前一个内含子中具有377bp缺失,这预计会导致结构域5的前49个氨基酸表达,接着是氨基酸85处过早终止密码子。母猪在一个等位基因中具有7bp添加,当翻译时预计表达结构域5的前48个氨基酸,接着在氨基酸70处过早终止密码子。母猪的其他等位基因无法扩增。预计选定的后代将是无效动物(CD163-/-),即CD163敲除。
因此,在一些实施方案中,猪肺泡巨噬细胞可被CRISPR蛋白靶向。在一些实施方案中,猪CD163可被CRISPR蛋白靶向。在一些实施方案中,猪CD163可通过DSB的诱导或通过插入或缺失来敲除,例如靶向外显子7的缺失或修饰,包括上述那些中的一个或多个,或在基因的其他区域中,例如外显子5的缺失或修饰。
还设想了经编辑的猪及其后代,例如CD163敲除猪。这可用于牲畜、育种或建模目的(即猪模型)。还提供了包含基因敲除的精液。
CD163是富含半胱氨酸的清道夫受体(SRCR)超家族的成员。根据体外研究,所述蛋白质的SRCR结构域5是负责解包装和释放病毒基因组的结构域。因而,SRCR超家族的其他成员也可被靶向以评估对其他病毒的抗性。PRRSV也是哺乳动物动脉炎病毒组的成员,该组还包括鼠类乳酸脱氢酶升高病毒、猿猴出血热病毒和马动脉炎病毒。动脉炎病毒共同具有重要的发病机理性质,包括巨噬细胞嗜性和引起严重疾病和持续感染的能力。因此,例如通过猪CD163或其在其他物种中的同源物,可靶向动脉炎病毒,特别是鼠类乳酸脱氢酶升高病毒、猿猴出血热病毒和马动脉炎病毒,并且还提供了鼠类、猿猴和马模型以及敲除。
实际上,这种方法可能会扩展到引起其他牲畜疾病的病毒或细菌,这些疾病可能会传播给人类,例如猪流感病毒(SIV)株,其包括丙型流感和称为H1N1、H1N2、H2N1、H3N1、H3N2和H2N3的甲型流感亚型,以及上述肺炎、脑膜炎和水肿。
C2c1效应蛋白可应用于如上所述的类似系统。关于C2c1蛋白,CRISPR-C2c1系统可识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统向CD163基因座引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰CD163的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入CD163转录物,而不修饰牲畜的基因组。
解偶联蛋白1(UCP1)位于线粒体内膜上,并通过跨内膜的质子传递将ATP合成解偶联而产生热量。UCP1是非颤抖性生热的关键元件,并且在调控人体肥胖中很可能是重要的。缺少功能性UCP1基因的猪(偶蹄目猪科)的体温调节较差,容易感冒。猪的脂肪积累也可能与其缺乏UCP1有关,因此会影响猪的生产效率。Zheng等人报道了CRISPR/Cas9介导的不依赖于同源重组(HR)的方法以将小鼠脂联素-UCP1有效插入猪内源UCP1基因座中的应用。
UCP1敲入(KI)猪在急性冷暴露期间显示出提高的维持体温的能力,但他们的身体活动水平或每日总能量消耗(DEE)均未改变。白色脂肪组织(WAT)中异位UCP1表达使脂肪沉积显著减少了4.89%(P<0.01),因此增加了胴体瘦肉率(CLP;P<0.05)。机制研究表明,WAT中UCP1激活后脂肪的损失与脂解升高有关。本发明中公开的CRISPR-C2c1系统可应用于与Zheng等人所述的类似系统。关于C2c1蛋白,CRISPR-C2c1系统可识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在某些实施方案中,5'突出端为7nt。在特定的实施方案中,CRISPR-C2c1系统可用于经由HR或HR非依赖性机制例如NHEJ在UCP1基因座处的交错DSB处引入外源模板DNA序列。
Niu等人(DOI:10.1126/science.aan4187)报道了一种利用CRISPR-Cas9系统经由体细胞核转移的猪内源性逆转录病毒(PERV)灭活猪牲畜。异种移植是减轻人体移植器官短缺的一种有前途的策略。猪内源性逆转录病毒(PERV)跨物种传播的一种主要风险,所述病毒对猪无害,但可能对人类致命。描述了使用CRISPR-Cas9使永生化猪细胞系中的PERV活性失活,并经由体细胞核转移产生了PERV灭活的猪。Wu等人(Scientific Reports 7,文章编号:10487(2017)doi:10.1038/s41598-017-08596-5)报道了经由合子共递送Cas9 mRNA和靶向PDX1基因的双重sgRNA来有效禁止猪胚胎中胰腺生成的方法,其与有嵌合能力的人类多能干细胞结合,可作为在猪中异种生成人类组织和器官的合适平台。Zhou等人(HumMutat 37:110-118,2016)报道了使用单链DNA作为模板在猪受精卵中经由CRISPR-Cas9诱导的HDR而带有精确直系同源人类突变(Sox 10c.A325>T)的基因修饰猪,效率高达80%。如本文所公开的CRISPR-C2c1系统可应用于如Niu等人、Wu等人、Zhou等人所述的类似系统,以生产猪牲畜。在某些实施方案中,CRISPR-C2c1系统修饰病毒抗性相关基因。在一些实施方案中,CRISPR-C2c1系统修饰疾病相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜生物质相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜性状相关基因。在特定的实施方案中,性状相关基因参与肥胖的调控。在一些实施方案中,性状相关基因参与特定蛋白质表达的调控,其中此类蛋白质与食物过敏有关。在一个特定的实施方案中,CRISPR-C2c1系统修饰了UCP1基因座。关于C2c1蛋白,CRISPR-C2c1系统识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰目标靶基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入目标靶基因座的转录物,而不修饰牲畜的基因组。
Gao等人(Genome Biology 201718:13,doi:10.1186/s13059-016-1144-4)报道了使用单个CRISPR-Cas9切口酶(Cas9n)在牛中的选定基因座处诱导基因插入的耐结核病(TB)牛牲畜。通过染色质免疫沉淀测序(ChIP-seq)确定了牛胎儿成纤维细胞(BFF)中无催化活性的Cas9蛋白的主要结合位点。随后,使用CRISPR-Cas9n诱导的单链断裂来刺激天然抗性相关巨噬细胞蛋白-1(NRAM P1)基因的插入。耐TB牲畜是经由体细胞核转移获得的。Carlson等人(Nat Biotechnol.2016年5月6日;34(5):479-81.doi:10.1038/nbt.3560)报道了无角奶牛牲畜,使用转录激活子样效应子核酸酶(TALEN)将POLLED基因的等位基因插入牛胚胎成纤维细胞的基因组,接着进行体细胞核转移以克隆基因工程细胞系,并将胚胎植入受牛体内。如本文所公开的CRISPR-C2c1系统可应用于如Gao等人和Carlson等人在生产牛牲畜中所述的类似系统。在某些实施方案中,CRISPR-C2c1系统修饰病毒抗性相关基因。在一些实施方案中,CRISPR-C2c1系统修饰疾病相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜生物质相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜性状相关基因。在一些实施方案中,性状相关基因参与特定蛋白质表达的调控,其中此类蛋白质与食物过敏有关。在特定的实施方案中,性状相关基因参与肥胖的调控。关于C2c1蛋白,CRISPR-C2c1系统识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在一些实施方案中,C2c1效应蛋白包含一个或多个突变。在一些实施方案中,C2c1效应蛋白是切口酶。在一些特定的实施方案中,CRISP R-C2c1系统包含与修饰目标靶基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入目标靶基因座的转录物,而不修饰牲畜的基因组。
已经证明两种鸡基因卵清蛋白(OVA)和卵粘蛋白(OVM)与蛋清过敏有关。OVA和OVM的基因破坏有可能在鸡蛋中产生低致敏性,从而降低了对例如含蛋清的食品和疫苗等物敏感的个体的免疫反应。Oishi等人(Scientific Reports 6,文章编号:23980(2016)doi:10.1038/srep23980)报道了CRISPR/Cas9介导的鸡中的基因靶向。通过转染编码Cas9的环状质粒、单指导RNA和编码耐药性的基因,接着瞬时抗生素选择,可在培养的鸡原始生殖细胞(PGC)中有效(>90%)诱变卵清蛋白和卵粘蛋白这两个蛋清基因。将CRISPR诱导的突变体卵粘蛋白PGC移植到受体鸡胚胎中,并建立了3个种系嵌合雄鸡(G0)。所有的雄鸡都具有供体来源的突变体卵粘液样精子,而两个具有高供体来源配子传播率的雄鸡产生的杂合突变体卵粘液样鸡在下一代(G1)中约占其供体来源后代的一半。卵粘液样纯合子突变体后代(G2)是通过杂交G1突变鸡而产生的。
禽类转基因的传统方法涉及胚盘的逆转录病毒感染或原始生殖细胞(PGC)的离体操纵,接着将细胞注射回受体胚胎中。与哺乳动物系统不同,禽类胚胎PGC在其生殖腺路径上通过脉管系统迁移,在此它们成为精子或卵子产生细胞。Tyack等人(TransgenicRes.2013年12月;22(6):1257-64.doi:10.1007/s11248-013-9727-2)描述了使用与Tol2转座子和转座酶质粒复合的Lipofectamine 2000来转化PGC的方法,以在体内稳定转化PGC,产生转基因后代,所述后代表达转座子中携带的报告基因。如本文所公开的CRISPR-C2c1系统可应用于如Oishi等人在生产家禽牲畜中所述的类似系统。在某些实施方案中,CRISPR-C2c1系统修饰病毒抗性相关基因。在一些实施方案中,CRISPR-C2c1系统修饰疾病相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜生物质相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜性状相关基因。在一些实施方案中,性状相关基因参与特定蛋白质表达的调控,其中此类蛋白质与食物过敏有关。在特定的实施方案中,性状相关基因参与肥胖的调控。关于C2c1蛋白,CRISPR-C2c1系统识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在一些实施方案中,C2c1效应蛋白包含一个或多个突变。在一些实施方案中,C2c1效应蛋白是切口酶。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰目标靶基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入目标靶基因座的转录物,而不修饰牲畜的基因组。
动物模型
本发明提供了一种CRISPR-Cas系统,其可用于开发体内、离体和体外动物模型和细胞模型。
Niu等人(Cell.2014年2月13日;156(4):836-43.doi:10.1016/j.cell.2014.01.027)开发了一种猴子模型,其可作为研究人类疾病和制定治疗策略的重要模型物种,然而猴子在生物医学研究中的应用却由于使用CRISPR/Cas9系统难以产生在所需的靶位点进行遗传修饰的动物而受到了极大的阻碍。所述系统能够在一个步骤中同时破坏两个靶基因(Ppar-γ和Rag1),并且通过全面分析未检测到脱靶诱变。
Wang等人(Cell.2013;153(4):910-8)描述了使用直接注射Cas9 mRNA和sgRNA到受精卵中来高效率生产胚胎干细胞(ESC)转染模型以生产单突变(95%)或双突变(70-80%)小鼠。小鼠合子细胞中的各种小鼠模型描述于yen等人,Dev Biol.2014;393(1):3-9;Aida等人,Biol.2015;16(1):87;Inui等人,Sci Rep.2014;4:5396;Yang等人,Cell.2013;154(6):1370-9。涉及干细胞的离体修饰的移植疾病模型为创建种系突变提供了另一种选择,例如,利用在Eμ-Myc淋巴瘤中靶向p53的sgRNA。参见Heckl等人,Nat Biotechnol.2014;32(9):941-946;Chen等人,Cell.2015;160(6):1246-1260。
在一个方面,本发明提供了一种对中枢神经系统肿瘤的治疗,特别是由1型神经纤维瘤病(NF1)神经遗传性疾患诱导的肿瘤。患有NF1的个体天生就有NF1基因的种系突变,但可能会发展出许多独特的神经系统问题,从自闭症和注意力缺陷到脑和周围神经鞘瘤。本发明可用于开发患者特异性疾病模型并研究在等基因背景中诱导的多能干细胞(iPSC)衍生的疾病相关细胞。成年患者的皮肤或血细胞可产生类胚胎干细胞(ESC)类细胞,也称为诱导性多能干细胞或iPSC。最近的研究工作已开始开发将iPSC分化为中枢神经系统和外周神经系统(CNS和PNS)中多种细胞类型的培养方案,这些细胞类型在NF1患者中受到影响。本发明的CRISPR C2c1系统可用于通过修复现有的突变基因或产生新的突变来遗传编辑特定的疾病基因。为了站在NF1研究的前沿,对于儿童国家医学中心的吉尔伯特家族神经纤维瘤病研究所(Gilbert Family Neurofibromatosis Institute,GFNI)来说,探索这些令人振奋的研究进展,系统性地开发患者特异性的人类NF1疾病模型,以及提供用于对个别NF患者进行药物筛选和评价的工具将是重要的。
在一个方面,本发明提供了一种开发可诱导疾病模型的方法。
Platt等人(Cell.2014;159(2):440-55)开发了Cre依赖性CAGs-LSL-Cas9敲入转基因,同时生成了“多合一”的强力霉素(dox)诱导型构建体,以提供动物种系中的sgRNA和Cas9。Cre依赖性模型允许将CRISPR介导的靶向简单整合到现有的Cre驱动系统中,并在强大的CAGs启动子下游提供稳定且广泛的Cas9表达。Dox诱导模型能够靶向单个或多个组织,不受外源sgRNA递送能力的限制,并提供了在基因修饰后消除Cas9表达的手段。两种方法均显示出在多个组织中进行单个或多重基因修饰的极高效率,并且概括了传统基因敲除中所见的表型后果。每种都可外源性地或通过动物的种系进行sgRNA的递送,但重要的是,Cas9在基因组中的稳定整合可避免将大Cas9 cDNA包装入大小受限的病毒盒的复杂性。
通过CRISPR/Cas9基因组编辑来创建人类疾病的单核苷酸多态性(SNP)动物模型现在在啮齿动物中很常见。这些模型导致了对人类遗传学的功能洞察,并允许开发潜在的新疗法。例如,人类GWAS在STXBP5基因(人类血小板分泌的调节剂)中鉴定出潜在的病理性SNP(rs1039084A>G)。然后,CRISPR在小鼠体内以几乎相同的血栓形成表型重现了这种突变,从而证实了该SNP在人类中的因果关系(Zhu等人,Arterioscler Thromb VascBiol.2017;37:264-270)。同样,全基因组测序被用于在来自Estonia的基于群体的生物库中进行GWAS。确定了许多潜在的因果变体和潜在机制。其中之一是嗜碱性粒细胞产生所必需的调控元件,它在此过程中特别起着调控转录因子CEBPA表达的作用。该增强子在造血干细胞和祖细胞中受到CRISPR/Cas9的干扰,表明它在嗜碱性粒细胞分化过程中特异性调控CEBPA表达(Guo等人,Proc Natl Acad Sci.2016;114:E327-E336.doi:10.1073/pnas.1619052114)。
如本文所公开的CRISPR-C2c1系统可与如Zhu等人、Niu等人和Wang等人中所述的在扰动和破坏系统中所描述的方法等一起使用。在一些实施方案中,动物模型包括非人类真核细胞。在一些实施方案中,动物模型包括非人类哺乳动物细胞。在一些实施方案中,动物模型包括灵长类细胞。在某些实施方案中,动物模型包括鱼、斑马鱼、猿、黑猩猩、猕猴、小鼠、兔、大鼠、犬、牛、绵羊、山羊或猪细胞。关于C2c1蛋白,CRISPR-C2c1系统识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在优选的实施方案中,CRISPR-C2c1系统经由NHEJ在交错DSB处引入外源模板DNA序列。在一些实施方案中,C2c1效应蛋白包含一个或多个突变。在一些实施方案中,C2c1效应蛋白是切口酶。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰目标靶基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入目标靶基因座的转录物,而不修饰牲畜的基因组。
治疗应用
显而易见的是,设想本系统可用于靶向任何目标多核苷酸序列。本发明提供了非天然存在的或工程化的组合物,或一种或多种编码所述组合物的组分的多核苷酸,或包含一种或多种编码所述组合物的组分的多核苷酸的载体或递送系统,用于体内、离体或体外修饰靶细胞,并且可以改变细胞的方式进行,使得一旦被修饰,CRISPR修饰的细胞的后代或细胞系保留改变的表型。修饰的细胞和后代可以是多细胞生物体的一部分,例如将CRISPR系统离体或体内应用于所需细胞类型的植物或动物。CRISPR发明可以是治疗性治疗方法。所述治疗性治疗方法可包括基因或基因组编辑或基因疗法。
治疗病原体,如细菌、真菌和寄生虫病原体
本发明还可用于治疗细菌、真菌和寄生虫病原体。大多数研究工作都集中在开发新的抗生素上,一旦开发出新的抗生素,它们将同样面临耐药性问题。本发明提供了克服这些困难的新颖的基于CRISPR的替代物。此外,与现有抗生素不同,基于CRISPR的治疗可使病原体具有特异性,从而在避免有益细菌的情况下诱导目标病原体的细菌细胞死亡。
Jiang等人(“RNA-guided editing of bacterial genome using CRISPR-Cassystems,”Nature Biotechnology第31卷,第233-9页,2013年3月)使用CRISPR-Cas9系统来突变或杀死肺炎链球菌和大肠杆菌。这项工作将精确的突变引入基因组,它依赖于在靶向基因组位点上的双重RNA:Cas9定向切割来杀死未突变的细胞,从而避免了对可选择标志物或反选择系统的需求。CRISPR系统已用于逆转抗生素耐药性并消除菌株之间的耐药性转移。Bickard等人表明,Cas9经过重新编程以靶向毒力基因,杀死有毒但无毒力的金黄色葡萄球菌。重新编程核酸酶以靶向抗生素抗性基因,破坏了带有抗生素抗性基因的葡萄球菌质粒,并针对质粒携带的抗性基因的传播进行免疫。(参见Bikard等人,“ExploitingCRISPR-Cas nucleases to produce sequence-specific antimicrobials,”NatureBiotechnology第32卷,1146-1150,doi:10.1038/nbt.3043,在线出版于2014年10月05日)。Bikard显示CRISPR-Cas9抗菌剂在体内用于杀死小鼠皮肤定植模型中的金黄色葡萄球菌。类似地,Yosef等人使用CRISPR系统来靶向编码赋予对β-内酰胺抗生素具有抗性的酶的基因(参见Yousef等人,“Temperate and lytic bacteriophages programmed to sensitizeand kill antibiotic-resistant bacteria,”Proc.Natl.Acad.Sci.USA,第112卷,第7267-7272页,doi:10.1073/pnas.1500107112,在线出版于2015年5月18日)。
CRISPR系统可用于编辑对其他遗传方法具有抗性的寄生虫基因组。例如,显示出CRISPR-Cas9系统将双链断裂引入约氏疟原虫(Plasmodium yoeli i)基因组中(参见Zhang等人,“Efficient Editing of Malaria Parasite Genome Using the CRISPR/Cas9System,”mBio.第5卷,e01414-14,2014年7-8月)。Ghorbal等人(“Genome editing in thehuman malaria parasite Plasmodium fa lciparumusing the CRISPR-Cas9 system,”Nature Biotechnology,第32卷,第819-821页,doi:10.1038/nbt.2925,在线出版于2014年6月1日)修饰了orc1和kelch13这两个基因的序列,其分别在基因沉默和出现青蒿素抗性方面具有推定作用。尽管没有直接选择用于修饰,但仍能以非常高的效率回收在适当位点改变的寄生虫,这表明使用这种系统可生成中性或甚至有害的突变。CR ISPR-Cas9还用于修饰其他致病性寄生虫(包括刚地弓形虫(Toxoplasma gondi i))的基因组(参见Shen等人,“Efficient gene disruption in diverse strains of Toxoplasma gondii usingCRISPR/CAS9,”mBio第5卷:e01114-14,2014;以及Sidik等人,“Efficient GenomeEngineering of Toxoplasma gondii Using CRISPR/Cas9,”PLoS One第9卷,e100450,doi:10.1371/journal.pone.0100450,在线出版于2014年6月27日)。
Vyas等人(“A Candida albicans CRISPR system permits geneticengineering of essential genes and gene families,”Science Advances,第1卷,e1500248,DOI:10.1126/sciadv.1500248,2015年4月3日)采用CRISPR系统克服了长期存在的障碍而在白色念珠菌(C.albicans)中进行基因工程,并在单个实验中有效地突变了若干不同基因的两个拷贝。在若干机制导致耐药性的生物体中,Vyas生产了纯合的双突变体,该突变体不再展现亲本临床分离株Can90所展现的对氟康唑或环己酰亚胺的高抗性。Vyas还通过创建条件性等位基因而在白色念珠菌的必需基因中获得了纯合功能丧失突变。核糖体RNA加工所需的DCR1无效等位基因在低温下可致死,但在高温下可存活。Vyas使用了引入无义突变的修复模板并分离了无法在16℃下生长的dcr1/dcr1突变体。
通过破坏染色体基因座将本发明的CRISPR系统用于恶性疟原虫。Ghorbal等人(“Genome editing in the human malaria parasite Plasmodium falciparum usingthe CRISPR-Cas9 system”,Nature Biotechnology,32,819-821(2014),DOI:10.1038/nbt.2925,2014年6月1日)采用了CRISPR系统来引入疟疾基因组中的特定基因敲除和单核苷酸取代。为了使CRISPR-Cas9系统适应恶性疟原虫,Ghorbal等人生成了用于在pUF1-Cas9附加体中的纤溶酶调控元件的控制下的表达载体,所述表达载体还带有药物可选择标志物ydhodh,它对恶性疟原虫双氢乳清酸脱氢酶(PfDHODH)抑制剂DSM1产生抗性,并用于转录sgRNA,使用了恶性疟原虫U6小核(sn)RNA调控元件,将指导RNA和供体DNA模板置于同一质粒pL7上进行同源重组修复。还参见Zhang C.等人(“Efficient editing of malariaparasite genome using the CRISPR/Cas9 system”,MBio,2014年7月1日;5(4):E01414-14,doi:10.1128/MbIO.01414-14)和Wagner等人(“Efficient CRISPR-Cas9-mediatedgenome editing in Plasmodium falciparum,Nature Methods 11,915-918(2014),DOI:10.1038/nmeth.3063)。
在一个方面,本发明提供了一种在具有富含A/T的基因组的生物体例如恶性疟原虫中破坏染色体基因座的方法。在一些实施方案中,本发明的CRISPR系统包含CRISPR-C2c1系统,其中C2c1蛋白在靶位点处产生7nt的交错切口,并且其中PAM序列是富含T的序列(Gardner等人,Nature.2002;419:531-534)。本领域普通技术人员可将如Jiang等人、Bikard等人、Yosef等人、Vyas等人、Ghober等人、Zhang等人和Wagner等人所述的方法与如本文所公开的CRISPR-C2c1系统一起使用,以将序列破坏引入富含A/T的基因组中。
在某些实施方案中,利用CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列来修饰目标基因座。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。在优选的实施方案中,利用CRISPR-C2c1系统在非分裂细胞中修饰目标基因座,其中经由同源性定向修复(HDR)机制进行基因组编辑特别具有挑战性(Chan等人,Nucleic acidsresearch.2011;39:5955-5966)。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将带有5'突出端的短双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ途径介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于Meresca等人和He等人中所述的方法,以利用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。
治疗病原体,如病毒病原体如HIV
Cas介导的基因组编辑可用于在体细胞组织中引入保护性突变,以对抗非遗传或复杂疾病。例如,NHEJ介导的淋巴细胞中CCR5受体的失活(Lombardo等人,NatBiotechnol.2007年11月;25(11):1298-306)可能是规避HIV感染的可行策略,而PCSK9(Cohen等人,Nat Genet.2005年2月;37(2):161-5)或血管生成素(Musunuru等人,N Engl JMed.2010年12月2日;363(23):2220-7)的缺失可能提供针对他汀类药物耐药性高胆固醇血症或高脂血症的治疗作用。尽管也可使用siRNA介导的蛋白敲低来解决这些靶标,但NHEJ介导的基因失活的独特优势是无需持续治疗即可获得永久治疗益处的能力。与所有基因疗法一样,确定每种拟议的治疗用途具有有利的益处风险比当然很重要。
将编码Cas9和指导RNA的质粒DNA连同修复模板以流体动力学方式递送至酪氨酸血症成年小鼠模型的肝脏中,显示能够校正突变的Fah基因并在250个细胞中的约1个中拯救野生型Fah蛋白的表达(Nat Biotechnol.2014年6月;32(6):551-3)。此外,临床试验成功地使用ZF核酸酶通过离体敲除CCR5受体来抵抗HIV感染。在所有患者中,HIV DNA水平下降,并且在四分之一的患者中,HIV RNA变得不可检测(Tebas等人,N Engl J Med.2014年3月6日;370(10):901-10)。这些结果都证实了可编程核酸酶有望成为一种新型治疗平台。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
在另一个实施方案中,具有靶向HIV tat/rev共有的共同外显子的siRNA、核仁定位的TAR诱饵和抗CCR5特异性锤头状核酶的自灭活慢病毒载体(参见例如DiGiusto等人(2010)Sci Transl Med 2:36ra43)可用于/和或适于本发明的CRISPR-Cas系统。可收集每千克患者体重最少2.5×106个CD34+细胞,并在含有2μmol/L-谷氨酰胺、干细胞因子(100ng/ml)、Flt-3配体(Flt-3L)(100ng/ml)和血小板生成素(10ng/ml)(CellGenix)的X-VIVO 15培养基(Lonza)中预刺激16至20小时,密度为2×106个细胞/毫升。可在包被有纤连蛋白(25mg/cm2)(RetroNectin,Takara Bio Inc.)的75cm2组织培养瓶中以5的感染复数用慢病毒转导预刺激的细胞16至24小时。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
利用本领域的知识和本公开的教导,技术人员可校正HSC以抵抗例如HIV/AIDS的免疫缺陷疾患,包括使HSC与靶向并敲除CCR5的CRISPR-C2c1系统接触。使靶向并敲除含有CCR5和C2c1蛋白的粒子的指导RNA(并且有利的是双重指导方法,例如一对不同的指导RNA;例如,在原代人CD4+T细胞和CD34+造血干细胞和祖细胞(HSPC)中靶向两种临床相关基因B2M和CCR5的指导RNA)与HSC接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。还参见Kiem,“Hematopoietic stemcell-based gene therapy for HIVdisease,”Cell Stem Cell.2012年2月3日;10(2):137-147;通过引用并入本文以及其引用的文件;Mandal等人,“Efficient Ablation of Genes in Human Hematopoietic Stemand Effector Cells using CRISPR/Cas9,”Cell Stem Cell,第15卷,第5期,第643-652页,2014年11月6日;通过引用并入本文以及其引用的文件。还提及了Ebina,“CRISPR/Cas9system to suppress HIV-1expression by editing HIV-1integrated proviralDNA”SCIENTIFIC REPORTS|3:2510|DOI:10.1038/srep02510,通过引用并入本文以及其引用的文件,作为使用CRISPR-C2c1系统对抗HIV/AIDS的另一种手段。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
对HIV治疗进行基因组编辑的基本原理源自以下观察结果:CCR5(病毒的细胞共受体)功能丧失突变的纯合个体对感染具有很高的抵抗力并且在其他方面很健康,这表明用基因组编辑模仿这种突变可能是一种安全有效的治疗策略[Liu,R.等人,Cell 86,367-377(1996)]。当HIV感染的患者接受来自功能丧失CCR5突变的纯合子供体的同种异体骨髓移植,从而导致HIV水平不可检测并恢复正常的CD4 T细胞计数时,这一想法在临床上得到了验证[Hutter,G.等人,The New England journal of medicine 360,692-698(2009)]。尽管对于大多数HIV患者而言,骨髓移植并不是一种现实的治疗策略,但由于成本高昂和潜在的移植物抗宿主疾病,将患者自身T细胞转化为CCR5的HIV治疗是理想的。
早期使用ZFN和NHEJ敲除HIV人源化小鼠模型中的CCR5的研究表明,CCR5编辑的CD4 T细胞的移植改善了病毒载量和CD4 T细胞计数[Perez,E.E.等人,Naturebiotechnology 26,808-816(2008)]。重要的是,这些模型还表明,HIV感染导致选择了CCR5无效细胞,这表明编辑赋予了适合性优势并可能使少量经编辑的细胞产生治疗效果。
作为这项和其他有希望的临床前研究的结果,敲除患者T细胞中CCR5的基因组编辑疗法现已在人体中进行了测试[Holt,N.等人,Nature biotechnology 28,839-847(2010);Li,L.等人,Molecular therapy:the journal of the American Society ofGene Therapy 21,1259-1269(2013)]。在最近的I期临床试验中,从HIV患者中取出CD4+T细胞,用旨在敲除CCR5基因的ZFN编辑,并自体移植回患者中[Tebas,P.等人,The NewEngland journal of medicine 370,901-910(2014)]。
在另一项研究中(Mandal等人,Cell Stem Cell,第15卷,第5期,第643-652页,2014年11月6日),CRISPR-Cas9已靶向人CD4+T细胞和CD34+造血干细胞和祖细胞(HSPC)中的两个临床相关基因B2M和CCR5。单个RNA指导物的使用导致在HSPC中高效诱变,但在T细胞中却没有。双重指导方法改善了两种细胞类型的基因缺失功效。用CRISPR-Cas9进行基因组编辑的HSPC保留了多谱系潜力。经由HSPC中的靶标捕获测序研究了预测的在靶和脱靶突变,并且仅在一个位点观察到低水平的脱靶诱变。这些结果表明,CRISPR-Cas9可有效消融HSPC中的基因,并具有最小的脱靶诱变,对于基于造血细胞的疗法具有广泛的适用性。
Wang等人(PLoS One.2014年12月26日;9(12):e115987.doi:10.1371/journal.pone.0115987)经由CRISPR相关蛋白9(Cas9)和单个指导RNA(指导RNA)用表达Cas9和CCR5指导RNA的慢病毒载体使CCR5沉默。Wang等人表明,将表达Cas9和CCR5指导RNA的慢病毒载体单轮转导至HIV-1易感的人类CD4+细胞中,从而产生了高频率的CCR5基因破坏。CCR5基因破坏的细胞不仅对R5嗜性的HIV-1具有抗性,包括传播/创始(T/F)HIV-1分离株,而且在R5嗜性的HIV-1感染期间比CCR5基因未破坏的细胞具有选择性优势。通过T7核酸内切酶I测定,即使在转导后84天,在稳定转导的细胞中与这些CCR5指导RNA高度同源的潜在脱靶位点处的基因组突变也未检测到。
Fine等人(Sci Rep.2015年7月1日;5:10777.doi:10.1038/srep10777)鉴定了一个双盒系统,所述系统表达化脓性链球菌Cas9(SpCas9)蛋白的片段,这些片段在细胞中剪接在一起,形成能够位点特异性DNA切割的功能蛋白。利用特定的CRISPR指导链,Fine等人证实了该系统在切割人HEK-293T细胞中的HBB和CCR5基因中作为单个Cas9和一对Cas9切口酶的功效。在标准转染剂量下,与野生型SpCas9(wtSpCas9)相比,反式剪接的SpCas9(tsSpCas9)显示出约35%的核酸酶活性,但在较低剂量水平下其活性却大大降低。相对于wtSpCas9,tsSpCas9的开放阅读框长度大大减少,这可能允许将更复杂和更长的遗传元件包装到AAV载体中,所述载体包括组织特异性启动子、多重指导RNA表达以及与SpCas9融合的效应子结构域。
Li等人(J Gen Virol.2015年8月;96(8):2381-93.doi:10.1099/vir.0.000139.电子出版于2015年4月8日)证明CRISPR-Cas9可有效介导细胞系中CCR5基因座的编辑,从而导致CCR5表达在细胞表面的敲除。下一代测序揭示,在CCR5的预期切割位点周围引入了各种突变。对于所分析的三个最有效的指导RNA中的每一者,在15个得分最高的潜在位点处均未检测到明显的脱靶效应。通过构建携带CRISPR-Cas9组分的嵌合Ad5F35腺病毒,Li等人有效地转导了原代CD4+T淋巴细胞并破坏了CCR5表达,并且正转导的细胞被赋予了HIV-1抵抗力。
本领域技术人员可利用例如以下的上述研究:Holt,N.等人,Naturebiotechnology 28,839-847(2010);Li,L.等人,Molecular therapy:the journal of theAmerican Society of Gene Therapy 21,1259-1269(2013);Mandal等人,Cell StemCell,第15卷,第5期,第643-652页,2014年11月6日;Wang等人(PLoS One.2014年12月26日;9(12):e115987.doi:10.1371/journal.pone.0115987);Fine等人(Sci Rep.2015年7月1日;5:10777.doi:10.1038/srep10777);以及Li等人(J Gen Virol.2015年8月;96(8):2381-93.doi:10.1099/vir.0.000139.电子出版于2015年4月8日),用本发明的CRISPR Cas系统靶向CCR5。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。值得注意的是,富含T的PAM允许将本发明应用于不分裂的细胞和组织中。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
治疗病原体,如病毒病原体如HBV
本发明还可用于治疗乙型肝炎病毒(HBV)。但是,必须通过例如优化剂量和序列来调整CRISPR Cas系统,以避免RNAi的缺点,例如夸大内源性小RNA途径的风险(参见例如Grimm等人,Nature,第441卷,2006年5月26日)。例如,考虑了低剂量,例如每人约1-10×1014个粒子。在另一个实施方案中,针对HBV的CRISPR Cas系统可在脂质体中施用,例如稳定的核酸-脂质粒子(SNALP)(参见例如Morrissey等人,Nature Biotechnology,第23卷,第8期,2005年8月)。预期每日静脉内注射约1、3或5毫克/千克/天的靶向SNALP中HBV RNA的CRISPR Cas。每日治疗可能会超过约三天,然后每周治疗持续约五周。在另一个实施方案中,Chen等人(Gene Therapy(2007)14,11-19)的系统可用于/和或适于本发明的CRISPRCas系统。Chen等人使用双链腺相关病毒8假型载体(dsAAV2/8)递送shRNA。单次施用带有HBV特异性shRNA的dsAAV2/8载体(每只小鼠1×1012个载体基因组),可有效抑制HBV转基因小鼠肝脏中的HBV蛋白、mRNA和复制性DNA的稳定水平,导致循环中HBV负荷下降多达2-3log10。施用载体后,HBV的显著抑制作用持续至少120天。shRNA的治疗作用是靶序列依赖性的,并且不涉及干扰素的激活。对于本发明,可将针对HBV的CRISPR Cas系统克隆到AAV载体,例如dsAAV2/8载体中,并以例如每个人约1×1015个载体基因组至约1×1016载体基因组的剂量施用于人类。在另一个实施方案中,Wooddell等人(Molecular Therapy第21卷第5期,973-985,2013年5月)的方法可用于/和或适于本发明的CRISPR Cas系统。Woodell等人表明将肝细胞靶向的N-乙酰基半乳糖胺缀合的蜂毒肽样肽(NAG-MLP)与靶向凝血因子VII(F7)的嗜肝胆固醇缀合的siRNA(chol-siRNA)简单共注射,可在小鼠和非人类灵长类动物中有效地敲低F7,而不存在临床化学或诱导细胞因子的变化。使用HBV感染的瞬时和转基因小鼠模型,Wooddell等人表明,将NAG-MLP与靶向保守HBV序列的有效chol-siRNA单次共注射,导致病毒RNA、蛋白质和病毒DNA的多对数抑制并具有长效作用。对于本发明,可设想例如约6mg/kg的NAG-MLP和6mg/kg的HBV特异性CRISPR Cas的静脉内共注射。或者,可在第一天递送约3mg/kg的NAG-MLP和3mg/kg的HBV特异性CRISPR Cas,接着在两周后施用约2-3mg/kg的NAG-MLP和2-3mg/kg的HBV特异性CRISPR Cas。
在一些实施方案中,靶序列是HBV序列。在一些实施方案中,靶序列包含在游离病毒核酸分子中,所述游离病毒核酸分子没有整合到生物体的基因组中,从而操纵游离病毒核酸分子。在一些实施方案中,游离核酸分子是双链DNA多核苷酸分子或者是共价闭合的环状DNA(cccDNA)。在一些实施方案中,与不提供复合物的生物体细胞中的游离病毒核酸分子的量相比,CRISPR复合物能够减少生物体细胞中的游离病毒核酸分子的量,或者能够操纵游离病毒核酸分子以促进游离核酸分子的降解。在一些实施方案中,靶HBV序列被整合到生物体的基因组中。在一些实施方案中,当在细胞内形成时,CRISPR复合物能够操纵整合的核酸以促进从生物体基因组中切除全部或部分的靶HBV核酸。在一些实施方案中,所述至少一种靶HBV核酸包含在整合到生物体基因组中的双链DNA多核苷酸cccDNA分子和/或病毒DNA中,并且其中CRISPR复合物操纵至少一种靶HBV核酸以切割病毒cccDNA和/或整合的病毒DNA。在一些实施方案中,所述切割包含引入病毒cccDNA和/或整合的病毒DNA中的一个或多个双链断裂,任选地至少两个双链断裂。在一些实施方案中,所述切割是经由引入病毒cccDNA和/或整合的病毒DNA中的一个或多个单链断裂,任选地至少两个单链断裂。在一些实施方案中,所述一个或多个双链断裂或所述一个或多个单链断裂导致在病毒cccDNA序列和/或整合的病毒DNA序列中形成一个或多个插入或缺失突变(INDEL)。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Lin等人(Mol Ther Nucleic Acids.2014年8月19日;3:e186.doi:10.1038/mtna.2014.38)设计了八种针对基因型A的HBV的gRNA。利用HBV特异性gRNA,CRISPR-Cas9系统显著降低了用HBV表达载体转染的Huh-7细胞中HBV核和表面蛋白的产生。在八种筛选的gRNA中,鉴定出两种有效的gRNA。靶向保守HBV序列的一种gRNA针对不同的基因型起作用。使用流体动力学-HBV持久性小鼠模型,Lin等人进一步证明该系统可切割含肝内HBV基因组的质粒并促进其在体内的清除,从而降低血清表面抗原水平。这些数据表明,CRISPR-Cas9系统可在体外和体内破坏表达HBV的模板,表明其在消除持久性HBV感染方面的潜力。
Dong等人(Antiviral Res.2015年6月;118:110-7.doi:10.1016/j.antiviral.2015.03.015.电子出版于2015年4月3日)使用CRISPR-Cas9系统靶向HBV基因组并有效抑制HBV感染。Dong等人合成了四个靶向HBV保守区域的单指导RNA(指导RNA)。这些带有Cas9的指导RNA的表达减少了Huh7细胞以及HBV复制细胞HepG2.2.15中的病毒产生。Dong等人进一步证实了CRISPR-Cas9的直接切割和切割介导的诱变发生在转染细胞的HBVcccDNA中。在携带HBV cccDNA的小鼠模型中,经由快速尾静脉注射指导RNA-Cas9质粒导致低水平的cccDNA和HBV蛋白。
Liu等人(J Gen Virol.2015年8月;96(8):2252-61.doi:10.1099/vir.0.000159.电子出版于2015年4月22日)设计了八种指导RNA(gRNA),所述指导RNA靶向不同HBV基因型的保守区域,在体外和体内都显著抑制HBV复制,以研究使用CRISPR-Cas9系统破坏HBV DNA模板的可能性。HBV特异性的gRNA/C2c1系统可抑制细胞中不同基因型的HBV复制,并且病毒DNA通过单个gRNA/C2c1系统显著减少并通过不同gRNA/C2c1系统的组合清除。
Wang等人(World J Gastroenterol.2015年8月28日;21(32):9554-65.doi:10.3748/wjg.v21.i32.9554)设计了15种针对A-D基因型HBV的gRNA。选择了两个上述覆盖HBV调控区的gRNA(双重gRNA)的11种组合。通过测量培养上清液中的HBV表面抗原(HBsAg)或e抗原(HBeAg),研究了每种gRNA和11种双重gRNA在抑制HBV(基因型A-D)复制时的效率。使用聚合酶链反应(PCR)和测序方法在与双重gRNA和HBV表达载体共转染的HuH7细胞中研究HBV表达载体的破坏,并且使用KCl沉淀、质粒安全的ATP依赖性DNA酶(PSAD)消化、滚环扩增和定量PCR组合方法研究了HepAD38细胞中cccDNA的破坏。这些gRNA的细胞毒性通过线粒体四唑鎓测定法评估。所有gRNA均可显著降低培养上清液中HBsAg或HBeAg的产生,这取决于gRNA所针对的区域。所有双重gRNA均可有效抑制基因型A-D的HBV的HBsAg和/或HBeAg产生,并且与单独使用的单个gRNA相比,双重gRNA抑制HBsAg和/或HBeAg产生的功效显著提高。此外,通过PCR直接测序,我们证实了这些双重gRNA可通过去除两个使用的gRNA切割位点之间的片段来特异性破坏HBV表达模板。最重要的是,gRNA-5和gRNA-12组合不仅可有效抑制HBsAg和/或HBeAg的产生,而且可破坏HepAD38细胞中的cccDNA储库。
Karimova等人(Sci Rep.2015年9月3日;5:13734.doi:10.1038/srep13734)鉴定了HBV基因组的S和X区域中交叉基因型保守的HBV序列,这些序列被靶向以通过Cas9切口酶特异性和有效切割。这种方法不仅破坏了报告细胞系中的游离cccDNA和染色体整合的HBV靶位点,而且破坏了慢性和从头感染的肝癌细胞系中的HBV复制。
本领域技术人员可利用例如以下的上述研究:Lin等人(Mol Ther NucleicAcids.2014年8月19日;3:e186.doi:10.1038/mtna.2014.38);Dong等人(AntiviralRes.2015年6月;118:110-7.doi:10.1016/j.antiviral.2015.03.015.电子出版于2015年4月3日);Liu等人(J Gen Virol.2015年8月;96(8):2252-61.doi:10.1099/vir.0.000159.电子出版于2015年4月22日);Wang等人(World JGastroenterol.2015年8月28日;21(32):9554-65.doi:10.3748/wjg.v21.i32.9554);以及Karimova等人(Sci Rep.2015年9月3日;5:13734.doi:10.1038/srep13734),用于通过本发明的CRISPR Cas系统靶向HBV。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
慢性乙型肝炎病毒(HBV)感染是普遍的、致命的,并且由于病毒游离DNA(cccDNA)在感染细胞中的持久性而很少治愈。Ramanan等人(Ramanan V,Shlomai A,Cox DB,Schwartz RE,Michailidis E,Bhatta A,Scott DA,Zhang F,Rice CM,Bhatia SN,.SciRep.2015年6月2日;5:10833.doi:10.1038/srep10833,在线出版于2015年6月2日)表明CRISPR/Cas9系统可特异性靶向和切割HBV基因组中的保守区域,导致病毒基因表达和复制的稳健抑制。一旦Cas9的持续表达和适当选择的指导RNA,证实了Cas9对cccDNA的切割,并且cccDNA以及病毒基因表达和复制的其他参数均显著降低。因此,他们表明直接靶向病毒游离DNA是控制病毒并可能治愈患者的新型治疗方法。这也以The Broad Institute等人的名义在WO2015089465 A1中描述,所述文件的内容通过引用并入本文。
因此,在一些实施方案中优选靶向HBV中的病毒游离DNA。
本发明还可用于治疗病原体,例如细菌、真菌和寄生虫病原体。大多数研究工作都集中在开发新的抗生素,然而一旦开发出新的抗生素,它们将同样面临耐药性问题。本发明提供了克服这些困难的新颖的基于CRISPR的替代物。此外,与现有抗生素不同,基于CRISPR的治疗可使病原体具有特异性,从而在避免有益细菌的情况下诱导目标病原体的细菌细胞死亡。
本发明也可用于治疗丙型肝炎病毒(HCV)。Roelvinki等人(Molecular Therapy第20卷第9期,1737-1749 2012年9月)的方法可应用于CRISPR Cas系统。例如,诸如AAV8的AAV载体可以是预期的载体,并且例如可预期每千克体重约1.25×1011至1.25×1013个载体基因组的剂量(vg/kg)。本发明还可用于治疗病原体,例如细菌、真菌和寄生虫病原体。大多数研究工作都集中在开发新的抗生素,然而一旦开发出新的抗生素,它们将同样面临耐药性问题。本发明提供了克服这些困难的新颖的基于CRISPR的替代物。此外,与现有抗生素不同,基于CRISPR的治疗可使病原体具有特异性,从而在避免有益细菌的情况下诱导目标病原体的细菌细胞死亡。在一些实施方案中,CRISPR-C2c1系统可识别的PAM序列是富含T的序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Jiang等人(“RNA-guided editing of bacterial genomes using CRISPR-Cassystems,”Nature Biotechnology第31卷,第233-9页,2013年3月)使用CRISPR-Cas9系统来突变或杀死肺炎链球菌和大肠杆菌。这项工作将精确的突变引入基因组,它依赖于在靶向基因组位点上的双重RNA:Cas9定向切割来杀死未突变的细胞,从而避免了对可选择标志物或反选择系统的需求。CRISPR系统已用于逆转抗生素耐药性并消除菌株之间的耐药性转移。Bickard等人表明,Cas9经过重新编程以靶向毒力基因,杀死有毒但无毒力的金黄色葡萄球菌。重新编程核酸酶以靶向抗生素抗性基因,破坏了带有抗生素抗性基因的葡萄球菌质粒,并针对质粒携带的抗性基因的传播进行免疫。(参见Bikard等人,“ExploitingCRISPR-Cas nucleases to produce sequence-specific antimicrobials,”NatureBiotechnology第32卷,1146-1150,doi:10.1038/nbt.3043,在线出版于2014年10月05日)。Bikard显示CRISPR-Cas9抗菌剂在体内用于杀死小鼠皮肤定植模型中的金黄色葡萄球菌。类似地,Yosef等人使用CRISPR系统来靶向编码赋予对β-内酰胺抗生素具有抗性的酶的基因(参见Yousef等人,“Temperate and lytic bacteriophages programmed to sensitizeand kill antibiotic-resistant bacteria,”Proc.Natl.Acad.Sci.USA,第112卷,第7267-7272页,doi:10.1073/pnas.1500107112,在线出版于2015年5月18日)。
本发明也可用于开发诺如病毒感染的治疗方法。诺如病毒是归因于不安全食品引起的腹泻病的最常见病原体之一。它也是食源性感染中的幼儿和成年人死亡的主要原因。诺如病毒不仅仅是食源性负担。在最近的荟萃分析中,诺如病毒在散发性和暴发性疾病中占急性胃肠炎的所有原因(包括人对人传播)的近五分之一,并影响所有年龄组。毫无疑问,诺如病毒在发达国家和发展中国家都是最重要的公共卫生问题。为了有针对性地进行干预,有必要进行研究工作以更好地了解诺如病毒的病理生物学。从中东呼吸综合征冠状病毒到寨卡病毒,鉴定对介导病毒感染起重要作用的宿主因素的工作一直是研究的重点。这些信息将为抗病毒干预中潜在的治疗靶标提供启示。在过去的20年中,缺乏稳健的细胞培养模型阻碍了诺如病毒-宿主相互作用研究。2016年,诺如病毒终于成功地在源自干细胞的三维人体肠道样结构(称为肠样或小肠)中培养。Chan等人使用从参与者收集的十二指肠活组织检查中分离出的肠道干细胞,接着分化为小肠。使用敲除CRISPR和功能获得CRISPRSAM来鉴定与诺如病毒感染有关的基因的候选名单。本发明中公开的C2c1-CRISPR系统可用于与Chan等人的系统相似的系统中。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
本发明还可用于治疗人乳头瘤病毒(HPV)相关的恶性赘瘤和HPV诱导的宫颈癌。宫颈癌是全世界女性中第二大最常见的癌症。高危型人乳头瘤病毒(HR-HPV),尤其是HPV16和HPV18,被认为是宫颈癌的主要病因。致癌基因E6和E7在HPV感染的早期阶段表达,并且其功能是破坏正常细胞周期并维持转化的恶性表型。例如,E7蛋白与cullin 2泛素连接酶复合物结合,并导致视网膜母细胞瘤(pRb)肿瘤抑制子的泛素化和降解。
Hu等人(Biomed Res Int.2014;2014:612823.doi:10.1155/2014/61283)使用CRISPR-Cas9系统靶向HPV阳性细胞系中的HPV16-E7 DNA并显示HPV16-E7单指导RNA(sgRNA)引导的CRISPR/Cas系统可在特定位点破坏HPV16-E7 DNA,在HPV阳性SiHa和Caski细胞中诱导凋亡和生长抑制,但在HPV阴性C33A和HEK293细胞中不诱导凋亡和生长抑制。此外,E7 DN A的破坏直接导致E7蛋白的下调和肿瘤抑制蛋白pRb的上调。按照Mali等人的方案设计了靶向HPV16-E7基因的gRNA,并在Genewiz公司(中国)中合成它们。SSA荧光素酶报告物pSSA Rep3-1被用作CRISPR系统递送的报告系统。在24孔板中,将细胞与0.8μg的Cas9质粒和0.2μg的gRNA质粒共转染。转染后48小时,收集它们并使用Annexin V-FITC细胞凋亡检测试剂盒(KeyGen BioTech)根据制造商的说明用异硫氰酸荧光素(FITC)缀合的膜联蛋白V(annexin V-FITC)和碘化丙啶(PI)进行双重染色。使用FACS Calib ur(BDBioscience)分析所有四种经CRISPR/Cas系统处理的细胞系的凋亡率,以计算诱导的细胞死亡。使用BD Cell Quest软件分析数据。使用Cell Counting Kit-8(CCK-8;Beyotime)测定体外细胞增殖。用1×104细胞/孔的gRNA-4/Cas9质粒转染,将细胞用胰蛋白酶消化并在转染后24小时接种到96孔板上。接种到96孔板上后0小时、24小时、48小时、72小时和96小时,在每个孔中添加10μL CCK-8溶液,接着在37℃下温育2.5小时。本发明中公开的CRISPR-C2c1系统可用于类似的系统中。关于C2c1蛋白,CRISPR-C2c1系统可识别作为5'TTN 3'或5'ATTN 3'的PAM序列,其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将具有5'突出端的一个或多个交错的双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRIS PR-C2c1系统将单个核苷酸修饰引入转录物。
CRISPR系统可用于编辑对其他遗传方法具有抗性的寄生虫基因组。例如,显示出CRISPR-Cas9系统将双链断裂引入约氏疟原虫基因组中(参见Zhang等人,“EfficientEditing of Malaria Parasite Genome Using the CRISPR/Cas9 System,”mBio.第5卷,e01414-14,2014年7-8月)。Ghorbal等人(“Genome editing in the human malariaparasite Plasmodium falciparumusing the CRISPR-Cas9 system,”NatureBiotechnology,第32卷,第819-821页,doi:10.1038/nbt.2925,在线出版于2014年6月1日)修饰了orc1和kelch13这两个基因的序列,其分别在基因沉默和出现青蒿素抗性方面具有推定作用。尽管没有直接选择用于修饰,但仍能以非常高的效率回收在适当位点改变的寄生虫,这表明使用这种系统可生成中性或甚至有害的突变。CRISPR-Cas9还用于修饰其他致病性寄生虫(包括刚地弓形虫)的基因组(参见Shen等人,“Efficient gene disruption indiverse strains of Toxoplasma gondii using CRISPR/CAS9,”mBio第5卷:e01114-14,2014;以及Sidik等人,“Efficient Genome Engineering of Toxoplasma gondii UsingCRISPR/Cas9,”PLoS One第9卷,e100450,doi:10.1371/journal.pone.0100450,在线出版于2014年6月27日)。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入转录物。
Vyas等人(“A Candida albicans CRISPR system permits geneticengineering of essential genes and gene families,”Science Advances,第1卷,e1500248,DOI:10.1126/sciadv.1500248,2015年4月3日)使用CRISPR系统克服了长期存在的障碍而在白色念珠菌中进行基因工程,并在单个实验中有效地突变了若干不同基因的两个拷贝。在若干机制导致耐药性的生物体中,Vyas生产了纯合的双突变体,该突变体不再展现亲本临床分离株Can90所展现的对氟康唑或环己酰亚胺的高抗性。Vyas还通过创建条件性等位基因而在白色念珠菌的必需基因中获得了纯合功能丧失突变。核糖体RNA加工所需的DCR1无效等位基因在低温下可致死,但在高温下可存活。Vyas使用了引入无义突变的修复模板并分离了无法在16℃下生长的dcr1/dcr1突变体。C2c1效应蛋白可应用于类似的系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入DCR1的转录物。在一些实施方案中,修复模板不包含PAM序列。
在遗传或表观遗传学方面治疗疾病
本发明的CRISPR-Cas系统可用于校正先前尝试使用TALEN和ZFN但成功率有限的遗传突变,并且已被鉴定为Cas9系统的潜在靶标,包括如Editas Medicine的公开申请中,所述公开申请描述了使用Cas9系统来靶向基因座以用基因疗法治疗性地处理疾病的方法,包括Gluckmann等人的WO2015/048577CRISPR-RELATED METHODS AND COMPOSITIONS;Gluckmann等人的WO 2015/070083 CRISPR-RELATED METHODS AND COMPOSITIONS WITHGOVERNING gRNAS;在一些实施方案中,提供了原发性开角型青光眼(POAG)的治疗、预防或诊断。靶标优选是MYOC基因。这在WO2015153780中描述,其公开内容通过引用并入本文。
提及Maeder等人的WO2015/134812CRISPR/CAS-RELATED METHODS ANDCOMPOSITIONS FOR TREATING USHER SYNDROME AND RETINITIS PIGMENTOSA。通过本文的教导,本发明包括结合本文的教导应用的这些文件的方法和材料。在眼部和听觉基因疗法的一个方面,用于治疗Usher综合征和色素性视网膜炎的方法和组合物可适于本发明的CRISPR-Cas系统(参见例如WO 2015/134812)。在一个实施方案中,WO2015/134812涉及通过基因编辑,例如使用CRISPR-Cas9介导的方法来校正USH2A基因第2299位的鸟嘌呤缺失(例如,替换USH2A基因第2299位的缺失的鸟嘌呤残基),来治疗或延迟IIA型Usher综合征(USH2A、USH11A)和色素性视网膜炎39(RP39)的发作或进展。C2c1可达到类似的效果。在一个相关方面,通过用一种或多种核酸酶、一种或多种切口酶或其组合切割来靶向突变,例如以用校正点突变(例如单核苷酸例如鸟嘌呤缺失)的供体模板来诱导HDR。突变USH2A基因的改变或校正可通过任何机制来介导。可与突变型HSH2A基因的改变(例如校正)相关的示例性机制包括但不限于非同源末端连接,微同源性介导的末端连接(MMEJ),同源性引导的修复(例如内源性供体模板介导的),SDSA(合成依赖性链退火),单链退火或单链入侵。在一个实施方案中,用于治疗Usher综合征和色素性视网膜炎的方法可包括例如通过对USH2A基因的适当部分进行测序来获得受试者所携带的突变的知识。
因此,在一些实施方案中,提供了色素性视网膜炎的治疗、预防或诊断。已知许多不同的基因与色素性视网膜炎相关或导致色素性视网膜炎,例如RP1、RP2等。在一些实施方案中,这些基因被靶向并且通过提供合适的模板被敲除或修复。在一些实施方案中,通过注射递送至眼睛。
在一些实施方案中,一种或多种色素性视网膜炎基因可选自:RP1(色素性视网膜炎-1),RP2(色素性视网膜炎-2),RPGR(色素性视网膜炎-3),PRPH2(色素性视网膜炎-7),RP9(色素性视网膜炎-9),IMPDH1(色素性视网膜炎-10),PRPF31(色素性视网膜炎-11),CRB1(色素性视网膜炎-12,常染色体隐性),PRPF8(色素性视网膜炎-13),TULP1(色素性视网膜炎-14),CA4(色素性视网膜炎-17),HPRPF3(色素性视网膜炎-18),ABCA4(色素性视网膜炎-19),EYS(色素性视网膜炎-25),CERKL(色素性视网膜炎-26),FSCN2(色素性视网膜炎-30),TOPORS(色素性视网膜炎-31),SNRNP200(色素性视网膜炎33),SEMA4A(色素性视网膜炎-35),PRCD(色素性视网膜炎-36),NR2E3(色素性视网膜炎-37),MERTK(色素性视网膜炎-38),USH2A(色素性视网膜炎-39),PROM1(色素性视网膜炎-41),KLHL7(色素性视网膜炎-42),CNGB1(色素性视网膜炎-45),BEST1(色素性视网膜炎-50),TTC8(色素性视网膜炎51),C2orf71(色素性视网膜炎54),ARL6(色素性视网膜炎55),ZNF513(色素性视网膜炎58),DHDDS(色素性视网膜炎59),BEST1(色素性视网膜炎,同轴),PRPH2(色素性视网膜炎,双基因型),LRAT(色素性视网膜炎,青少年),SPATA7(色素性视网膜炎,青少年,常染色体隐性),CRX(色素性视网膜炎,晚发性显性)和/或RPGR(色素性视网膜炎,X连锁,和鼻呼吸道感染,有或没有耳聋)。
在一些实施方案中,色素性视网膜炎基因是MERTK(色素性视网膜炎-38)或USH2A(色素性视网膜炎-39)。
还提及了WO 2015/138510,并且通过本文的教导,本发明(使用CRISPR-Cas9系统)包括提供治疗或延迟莱伯先天性黑蒙10(LCA 10)的发作或进展。LCA 10是由CEP290基因的突变(例如,CEP290基因中的c.2991+1655腺嘌呤至鸟嘌呤突变)引起的,其在内含子26中产生一个隐含的剪接位点。这是CEP290的内含子26的核苷酸1655处的突变,例如A至G突变。CEP290也称为:CT87;MKS4;POC3;rd16;BBS14;JBTS5;LCAJO;NPHP6;SLSN6;和3H11Ag(参见例如WO 2015/138510)。在基因疗法的一个方面,本发明涉及在CEP290基因的至少一个等位基因中在LCA靶位置的位点附近(例如,c.2991+1655;A至G)引入一个或多个断裂。改变LCA10靶位置是指(1)接近或包括LCA10靶位置(例如,c.2991+1655A至G)的断裂诱导的插入/缺失的引入(在本文中也称为NHEJ介导的插入/缺失的引入),或(2)断裂诱导的基因组序列的缺失(在本文中也称为NHEJ介导的缺失),包括LCA10靶位置的突变(例如c.2991+1655A至G)。两种方法都导致了由于LCA 10靶位置处的突变而导致的隐蔽剪接位点的丢失或破坏。因此,特别设想了在LCA的治疗中使用C2c1。
研究人员正在考虑是否可将基因疗法用于治疗多种疾病。设想基于C2c1效应蛋白的本发明的CRISPR系统用于这样的治疗用途,包括但不限于进一步示例性的靶向区域和利用如下的递送方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。可使用本系统有效治疗的疾患或疾病的一些实例包括在本文包括的基因和参考文献的实例中,并且在此还提供了目前还与这些疾患相关联者。示例性的基因和疾患并不详尽。
治疗循环系统疾病
本发明还预期将CRISPR-Cas系统,特别是本文所述的新型CRISPR效应蛋白系统,递送至血液或造血干细胞。Wahlgren等人(Nucleic Acids Research,2012,第40卷,第17期e130)的血浆外泌体先前已经描述并且可用于将CRISPR Cas系统递送至血液。还考虑本发明的核酸靶向系统来治疗血红蛋白病,例如地中海贫血和镰状细胞病。关于可被本发明的CRISPR Cas系统靶向的潜在靶标,参见例如国际专利公开第WO 2013/126794号。
通过引用并入本文的Drakopoulou,“Review Article,The Ongoing Chall engeof Hematopoietic Stem Cell-Based Gene Therapy forβ-Thalassemia,”Stem CellsInternational,第2011卷,文章ID 987980,10页,doi:10.4061/2011/987980以及其引用的文件(如同全文列出一样),讨论了使用慢病毒修饰HS C的方法,所述慢病毒递送β-珠蛋白或γ-珠蛋白的基因。与使用慢病毒相反,利用本领域的知识和本公开的教导,技术人员可使用靶向和校正突变的CRI SPR-Cas系统针对β-地中海贫血校正HSC(例如,利用合适的HDR模板,其递送β-珠蛋白或γ-珠蛋白的编码序列,有利地为非镰刀β-珠蛋白或γ-珠蛋白的编码序列);具体来说,指导RNA可靶向引起β-地中海贫血的突变,并且HDR可为β-珠蛋白或γ-珠蛋白的适当表达提供编码。使靶向包含突变和Cas蛋白的粒子的指导RNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以适当表达β-珠蛋白或γ-珠蛋白;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。在这方面,提及:Cavazzana,“Outcomes of GeneTherapy forβ-Thalassemia Major via Transplantation of Autologou sHematopoietic Stem Cells Transduced Ex Vivo with a LentiviralβA-T87Q-GlobinVector.”tif2014.org/abstractFiles/Jean%20Antoine%20Ribeil_Abstrac t.pdf;Cavazzana-Calvo,“Transfusion independence and HMGA2 activation after genetherapy of humanβ-thalassaemia”,Nature 467,318-322(2010年9月16日)doi:10.1038/nature09328;Nienhuis,“Development of Gene Therapyfor Thalassemia,Cold SpringHarbor Perpsectives in Medicine,doi:10.1101/cshperspect.a011833(2012),LentiGlobin BB305,a lentiviral vector contain ing an engineeredβ-globin gene(βA-T87Q);以及Xie等人,“Seamless gene correction ofβ-thalassaemia mutations inpatient-specific iPSCs using CRISPR/Cas9 and piggyback”Genome Researchgr.173427.114(2014)www.genom e.org/cgi/doi/10.1101/gr.173427.114(Cold SpringHarbor Laboratory Press);这是涉及人类β-地中海贫血的Cavazzana研究的主题和Xie研究的主题,所述文献都通过引用并入本文,以及其中引用或与其相关的所有文献。在本发明中,HDR模板可提供HSC以表达工程化的β-珠蛋白基因(例如,βA-T87Q)或如Xie中的β-珠蛋白。
Xu等人(Sci Rep.2015年7月9日;5:12065.doi:10.1038/srep12065)设计了TALEN和CRISPR-Cas9来直接靶向珠蛋白基因中的内含子2突变位点IVS2-654。Xu等人使用TALEN和CRISPR-Cas9在IVS2-654基因组处观察到了不同频率的双链断裂(DSB),并且当与piggyBac转座子供体组合时,TALEN介导了与CRISPR-Cas9相比更高的同源基因靶向效率。另外,与TALEN相比,CRISPR-Cas9观察到更明显的脱靶事件。最后,使用OP9共培养系统选择经TALEN校正的iPSC克隆用于成红细胞分化,并且检测到的HBB转录相对高于未校正的细胞。
Song等人(Stem Cells Dev.2015年5月1日;24(9):1053-65.doi:10.1089/scd.2014.0347.电子出版于2015年2月5日)使用CRISPR/Cas9校正β-Thal iPSC;经基因校正的细胞表现出正常的核型和全能性,因为人类胚胎干细胞(hESC)不显示脱靶效应。然后,Song等人评价了经基因校正的β-Thal iPSC的分化效率。Song等人发现在造血分化期间,经基因校正的β-Thal iPSC显示出胚状体比率增加和各种造血祖细胞百分比。更重要的是,与未经校正的组相比,经基因校正的β-Thal iPSC品系恢复了HBB表达并减少了活性氧的产生。Song等人的研究表明,一旦通过CRISPR-Cas9系统校正,β-Thal iPSC的造血分化效率就大大提高。可利用本文所述的CRISPR-Cas系统,例如包含C2c1效应蛋白的系统,进行类似的方法。
镰状细胞性贫血是一种常染色体隐性遗传疾病,其中红细胞变成镰刀状。它是由位于11号染色体短臂上的β-珠蛋白基因中的单个碱基取代引起的。结果,产生缬氨酸而不是谷氨酸,其引起镰刀状血红蛋白(HbS)的产生。这导致变形的红细胞形状的形成。由于这种异常形状,会阻塞小血管,从而严重损坏骨骼、脾脏和皮肤组织。这可能导致疼痛发作,频繁感染,手足综合征或甚至多器官功能衰竭。变形的红细胞也更容易溶血,导致严重的贫血。与β-地中海贫血的情况一样,镰状细胞性贫血可通过使用CRISPR-Cas系统修饰HSC来校正。所述系统允许通过切割细胞基因组的DNA并且然后使其自我修复,可对细胞的基因组进行特定的编辑。插入Cas蛋白并通过RNA指导物将其引导至突变点,然后在该点切割DNA。同时,插入序列的健康形式。细胞自己的修复系统使用此序列来修复诱导的切割。以这种方式,CRISPR-Cas可校正先前获得的干细胞中的突变。利用本领域的知识和本公开的教导,技术人员可使用靶向并校正突变的CRISPR-Cas系统来校正关于镰状细胞性贫血的HSC(例如,使用合适的HDR模板,其递送β-珠蛋白、有利地非镰刀β-珠蛋白的编码序列);具体来说,指导RNA可靶向引起镰状细胞性贫血的突变,并且HDR可为β-珠蛋白的适当表达提供编码。使靶向包含突变和Cas蛋白的粒子的指导RNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以适当表达β-珠蛋白;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。HDR模板可提供HSC以表达工程化的β-珠蛋白基因(例如βA-T87Q)或如Xie中的β-珠蛋白。
通过引用并入本文的Williams,“Broadening the Indications forHematopoietic Stem Cell Genetic Therapies,”Cell Stem Cell 13:263-264(2013)以及其引用的文献(如同全文列出一样)报道了慢病毒介导的基因转移至来自具有溶酶体贮积病、异染性脑白质营养不良病(MLD)、由芳基硫酸酯酶A(ARSA)缺乏导致神经脱髓鞘而引起的遗传性疾病的患者的HSC/P细胞中;以及慢病毒介导的基因转移至Wiskott-Aldrich综合征(WAS)患者(具有缺陷性WAS蛋白的患者,缺陷性WAS蛋白是小GTP酶CDC42的效应物,它调节血细胞谱系中的细胞骨架功能,并因此患有免疫缺陷并反复感染,自身免疫症状,和血小板减少症与血小板异常少和功能异常,导致大量出血以及白血病和淋巴瘤的风险增加)的HSC中。与使用慢病毒相反,利用本领域的知识和本公开的教导,技术人员可使用靶向并校正突变的CRISPR-Cas系统来校正关于MLD(芳基硫酸酯酶A(ARSA)缺乏症)的HSC(芳基硫酸酯酶A(ARSA)缺乏症)(例如,利用递送ARSA编码序列的合适HDR模板);具体来说,指导RNA可靶向引起MLD(ARSA缺乏)的突变,并且HDR可为ARSA的适当表达提供编码。使靶向包含突变和Cas蛋白的粒子的指导RNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以适当表达ARSA;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。与使用慢病毒相反,利用本领域的知识和本公开的教导,本领域技术人员可使用靶向并校正突变(WAS蛋白缺乏症)的CRISPR-Cas系统来校正关于WAS的HSC(例如利用合适的HDR模板,其递送WAS蛋白的编码序列);具体来说,指导RNA可靶向引起WAS(WAS蛋白缺乏)的突变,并且HDR可为WAS蛋白的适当表达提供编码。使靶向含有突变和C2c1蛋白的粒子的指导RNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以适当表达WAS蛋白;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。
通过引用并入本文的Watts,“Hematopoietic Stem Cell Expansion and GeneTherapy”Cytotherapy 13(10):1164-1171.doi:10.3109/14653249.2011.620748(2011)以及其引用的文献(如同全文列出一样)讨论了造血干细胞(HSC)基因疗法,例如病毒介导的HSC基因疗法,作为许多病症的非常有吸引力的治疗选择,所述病症包括血液疾患,免疫缺陷病(包括HIV/AIDS),以及其他遗传病症如溶酶体贮积病,包括SCID-X1、ADA-SCID、β-地中海贫血,X连锁CGD、Wiskott-Aldrich综合征、范可尼贫血(Fanconi anemia)、肾上腺脑白质营养不良(ALD)和异染性脑白质营养不良(MLD)。
转让给Cellectis的美国专利公开第20110225664号、第20110091441号、第20100229252号、第20090271881号和第20090222937号涉及CREI变体,其中两个I-CreI单体中的至少一者具有至少两个取代,LAGLIDADG(SEQ ID NO:26)核心结构域的两个功能性子结构域中的每个分别位于I-CreI的位置26至40和44至77,所述变体还能够从人白介素2受体γ链(IL2RG)基因(还称为共同的细胞因子受体γ链基因或γC基因)切割DNA靶序列。美国专利公开第20110225664号、第20110091441号、第20100229252号、第20090271881号和第20090222937号中鉴定的靶序列可用于本发明的核酸靶向系统。
严重的免疫缺陷综合征(SCID)是由淋巴细胞T成熟缺陷引起的,所述缺陷总是与淋巴细胞B的功能缺陷相关联(Cavazzana-Calvo等人,Annu.Rev.Med.,2005,56,585-602;Fischer等人,Immunol.Rev.,2005,203,98-109)。总体发病率估计为75,000例新生儿中有1例。未治疗SCID的患者会遭受多种机会性微生物感染,并且一般不会存活超过一年。可通过来自家族供体的同种异体造血干细胞转移来治疗SCID。与供体的组织相容性差异很大。在SCID形式之一的腺苷脱氨酶(ADA)缺乏的情况下,可通过注射重组腺苷脱氨酶来治疗患者。
由于已证明ADA基因在SCID患者中发生了突变(Giblett等人,Lancet,1972,2,1067-1069),因此已鉴定出SCID中涉及的若干其他基因(Cavazzana-Calvo等人,Annu.Rev.Med.,2005,56,585-602;Fischer等人,Immunol.Rev.,2005,203,98-109)。SCID的主要原因有四个:(i)SCID的最常见形式SCID-X1(X连锁的SCID或X-SCID)是由IL2RG基因的突变引起的,导致不存在成熟的T淋巴细胞和NK细胞。IL2RG编码γC蛋白(Noguchi等人,Cell,1993,73,147-157),其是至少五种白介素受体复合物的共同组分。这些受体通过JAK3激酶激活若干靶标(Macchi等人,Nature,1995,377,65-68),这种失活导致与γC失活相同的综合征;(ii)ADA基因的突变导致嘌呤代谢缺陷,其对淋巴细胞前体致死,进而导致B、T和NK细胞几乎不存在;(iii)V(D)J重组是免疫球蛋白和T淋巴细胞受体(TCR)成熟中必不可少的步骤。重组激活基因1和2(RAG1和RAG2)和Artemis(参与此过程的三个基因)中的突变导致不存在成熟的T和B淋巴细胞;以及(iv)还已报道了参与T细胞特异性信号传导的其他基因(例如CD45)的突变,尽管它们代表了少数病例(Cavazzana-Calvo等人,Annu.Rev.Med.,2005,56,585-602;Fischer等人,Immunol.Rev.,2005,203,98-109)。自从鉴定了它们的遗传基础以来,由于两个主要原因,不同的SCID形式已成为基因治疗方法的范例(Fischer等人,Immunol.Rev.,2005,203,98-109)。首先,与所有血液疾病一样,可设想离体治疗。造血干细胞(HSC)可从骨髓中回收,并保持其多能性以进行几次细胞分裂。因此,它们可在体外进行治疗,然后重新注射到患者体内,在其中使骨髓增殖。其次,由于SCID患者的淋巴细胞成熟受到损害,因此经校正的细胞具有选择优势。因此,少量的校正细胞可恢复功能性免疫系统。通过以下多次验证了这个假说:(i)与SCID患者突变回复相关的免疫功能的部分恢复(Hirschhorn等人,Nat.Genet.,1996,13,290-295;Stephan等人,N.Engl.J.Med.,1996,335,1563-1567;Bousso等人,Proc.Natl.,Acad.Sci.USA,2000,97,274-278;Wada等人,Proc.Natl.Acad.Sci.USA,2001,98,8697-8702;Nishikomori等人,Blood,2004,103,4565-4572);(ii)体外校正造血细胞中的SCID-X1缺乏(Candotti等人,Blood,1996,87,3097-3102;Cavazzana-Calvo等人,Blood,1996,Blood,88,3901-3909;Taylor等人,Blood,1996,87,3103-3107;Hacein-Bey等人,Blood,1998,92,4090-4097);(iii)在动物模型中体内校正SCID-X1(Soudais等人,Blood,2000,95,3071-3077;Tsai等人,Blood,2002,100,72-79)、JAK-3(Bunting等人,Nat.Med.,1998,4,58-64;Bunting等人,Hum.Gene Ther.,2000,11,2353-2364)和RAG2(Yates等人,Blood,2002,100,3942-3949)缺乏;以及(iv)基因治疗临床试验的结果(Cavazzana-Calvo等人,Science,2000,288,669-672;Aiuti等人,Nat.Med.,2002;8,423-425;Gaspar等人,Lancet,2004,364,2181-2187)。
转让给儿童医学中心公司(Children's Medical Center Corporation)和哈佛学院院长和同事的美国专利公开第20110182867号涉及经由BCL11A表达或活性抑制剂(例如RNAi和抗体)调节造血祖细胞中胎儿血红蛋白表达(HbF)的方法和用途。美国专利公开第20110182867号中公开的靶标,例如BCL11A,可被本发明的CRISPR Cas系统靶向以调节胎儿血红蛋白表达。关于额外的BCL11A靶标,还参见Bauer等人(Science,2013年10月11日:第342卷第6155期,第253-257页)和Xu等人(Science,2011年11月18日:第334卷第6058期,第993-996页)。
利用本领域的知识和本公开的教导,技术人员可利用本发明公开的C2c1-CRISPR系统和如上所述的CRISPR Cas系统校正关于遗传性血液病症例如β-地中海贫血、血友病或遗传溶酶体贮积病的HSC。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
HSC—造血干细胞的递送和编辑;和特定条件。
术语“造血干细胞”或“HSC”意在广泛地包括被认为是HSC的那些细胞,例如血细胞,其产生所有其他血细胞并源自中胚层;位于包含在大多数骨骼核心中的红色骨髓中。本发明的HSC包括具有造血干细胞表型的细胞,可通过小尺寸鉴定,缺乏谱系(lin)标志物,以及属于分化系列簇的标志物,如:CD34、CD38、CD90、CD133、CD105、CD45以及c-kit(干细胞因子的受体)。造血干细胞对于用于检测谱系定型的标志物呈阴性,因此被称为Lin-;并且在通过FACS纯化期间,有多达14种不同的成熟血液谱系标志物,例如,对于人类,髓细胞的CD13和CD33,红系细胞的CD71,B细胞的CD19,巨核细胞的CD61等;以及B细胞的B220(鼠类CD45),单核细胞的Mac-1(CD11b/CD18),粒细胞的Gr-1,红系细胞的Ter119,T细胞的Il7Ra、CD3、CD4、CD5、CD8等。小鼠HSC标志物:CD34lo/-、SCA-1+、Thy1.1+/lo、CD38+、C-kit+、lin-,和人类HSC标志物:CD34+、CD59+、Thy1/CD90+、CD38lo/-、C-kit/CD117+和lin-。HSC通过标志物鉴定。因此,在本文讨论的实施方案中,HSC可以是CD34+细胞。HSC也可以是CD34-/CD38-的造血干细胞。在本领域中被视为HSC的细胞表面上可能缺乏c-kit的干细胞在本发明的范围内,以及在本领域中同样被视为HSC的CD133+细胞。
可将CRISPR-Cas(例如C2c1)系统设计为靶向HSC中的一个或多个遗传基因座。可制备有利地对真核细胞并且尤其是哺乳动物细胞(例如人类细胞,例如HSC)进行密码子优化的Cas(例如C2c1)蛋白,以及靶向HSC中的一个或多个基因座的sgRNA(例如基因EMX1)。这些可经由粒子递送。所述粒子可由Cas(例如C2c1)蛋白和gRNA混合形成。可例如将gRNA和Cas(例如C2c1)蛋白混合物与如下混合物混合,所述混合物包含以下或基本上由以下组成或由以下组成:表面活性剂、磷脂、可生物降解的聚合物、脂蛋白和醇,由此可形成包含gRNA和Cas(例如C2c1)蛋白的粒子。本发明包括如此制备粒子和由这种方法制备的粒子以及其用途。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
更一般来说,可使用有效的方法来形成粒子。首先,靶向基因EMX1或对照基因LacZ的Cas(例如C2c1)蛋白和gRNA可以合适的(例如3:1至1:3或2:1至1:2或1:1)摩尔比混合在一起,有利地在无菌的无核酸酶的缓冲液(例如1X PBS)中,在合适的温度(例如15-30℃,例如20-25℃,例如室温)下进行合适的时间(例如15-45,例如30分钟)。单独地,粒子组分例如为或包含:表面活性剂,例如阳离子脂质,例如1,2-二油酰基-3-三甲基铵-丙烷(DOTAP);磷脂,例如二肉豆蔻酰基磷脂酰胆碱(DMPC);可生物降解的聚合物,例如乙二醇聚合物或PEG,以及脂蛋白,例如低密度脂蛋白,例如胆固醇,可溶于醇,有利地C1-6烷基醇,例如甲醇、乙醇、异丙醇,例如100%乙醇。可将两种溶液混合在一起以形成含有Cas(例如C2c1)-gRNA复合物的粒子。在某些实施方案中,粒子可包含HDR模板。这可以是与含gRNA+Cas(例如C2c1)蛋白的粒子共同施用的粒子,或者,即,除了使HSC与含gRNA+Cas(例如C2c1)蛋白的粒子接触之外,HSC还可与包含HDR模板的粒子接触;或者将HSC与包含所有gRNA、Cas(例如C2c1)和HDR模板的粒子接触。HDR模板可通过单独的载体施用,由此在第一种情况下,粒子穿透HSC细胞并且单独的载体也穿透细胞,其中HSC基因组被gRNA+Cas(例如C2c1)修饰并且还存在HDR模板,从而通过HDR修饰基因组基因座;例如,这可能导致校正突变。
粒子形成后,可用每孔15ug Cas(例如C2c1)蛋白转染96孔板中的HSC。转染后三天,可收获HSC,并且可量化EMX1基因座处的插入和缺失(indel)的数量。
这说明了可如何使用靶向HSC中一个或多个目标基因组基因座的CRISPR-Cas(例如C2c1)修饰HSC。待修饰的HSC可在体内,即在生物体中,例如在人类或非人类真核生物,例如动物,例如鱼,例如斑马鱼,哺乳动物,例如灵长类动物,例如猿、黑猩猩、猕猴,啮齿动物,例如小鼠、兔子、大鼠、犬或狗,牲畜(牛/牛科、绵羊/羊科、山羊或猪),禽类或家禽,例如鸡。待修饰的HSC可在体外,即在这种生物体外。并且,修饰的HSC可离体使用,即,可从生物体中获得或分离出这种生物体的一种或多种HSC,任选地,可扩增HSC,通过包含靶向HSC中的一个或多个遗传基因座的CRISPR-Cas(例如C2c1)的组合物来修饰HSC,例如通过使HSC与所述组合物接触,例如,其中所述组合物包含含有CRISPR酶和一种或多种gRNA的粒子,所述gRNA靶向HSC中的一个或多个遗传基因座,例如通过将gRNA和Cas(例如C2c1)蛋白混合物与如下混合物混合而获得或可获得的粒子,所述混合物包含以下或基本上由以下组成或由以下组成:表面活性剂、磷脂、可生物降解的聚合物、脂蛋白和醇(其中一个或多个gRNA靶向HSC中的一个或多个遗传基因座),任选地扩增所得修饰的HSC并向生物体施用所得修饰的HSC。在一些情况下,分离或获得的HSC可来自第一生物体,例如来自与第二生物体相同物种的生物体,并且第二生物体可以是对其施用所得修饰的HSC的生物体,例如第一生物体可以是第二生物体的供体(例如像父母或同胞一样的亲属)。修饰的HSC可具有遗传修饰以解决或减轻或减少个体或受试者或患者的疾病或疾患状况的症状。修饰的HSC,例如在第二生物体的第一生物体供体的情况下,可具有遗传修饰以使HSC具有一种或多种蛋白质,例如更像第二生物体的表面标志物或蛋白质。修饰的HSC可具有遗传修饰以模拟个体或受试者或患者的疾病或疾患状况,并且将其重新施用于非人类生物体以制备动物模型。根据本公开内容和本领域的知识,HSC的扩增在技术人员的能力范围内,参见例如Lee,“Improved ex vivoexpansion of adult hematopoietic stem cells by overcoming CUL4-mediateddegradation of HOXB4.”Blood.2013年5月16日;121(20):4082-9.doi:10.1182/blood-2012-09-455204.电子出版于2013年3月21日。
如所指示,为提高活性,在将整个复合物配制成粒子之前,可将gRNA与Cas(例如C2c1)蛋白预先复合。可用不同摩尔比的不同组分来制备制剂,所述成分已知可促进核酸向细胞内的递送(例如1,2-二油酰基-3-三甲基铵-丙烷(DOTAP),1,2-双十四烷酰基-sn-甘油-3-磷酸胆碱(DMPC),聚乙二醇(PEG)和胆固醇)。例如,DOTAP:DMPC:PEG:胆固醇摩尔比可为DOTAP 100、DMPC0、PEG 0、胆固醇0;或DOTAP 90、DMPC 0、PEG 10、胆固醇0;或DOTAP90、DMPC 0、PEG 5、胆固醇5;DOTAP 100、DMPC 0、PEG 0、胆固醇0。因此,本发明包括将gRNA、Cas(例如C2c1)蛋白和形成粒子的组分混合;以及由这种混合产生的粒子。
在一个优选的实施方案中,可通过将Cas(例如C2c1)蛋白和一种或多种gRNA(优选1:1摩尔比的酶:指导RNA)混合在一起来形成包含Cas(例如C2c1)-gRNA复合物的粒子。单独地,将已知促进核酸递送的不同组分(例如DOTAP、DMPC、PEG和胆固醇)溶解,优选溶解在乙醇中。将两种溶液混合在一起以形成含有Cas(例如C2c1)-gRNA复合物的粒子。形成粒子后,可将Cas(例如C2c1)-gRNA复合物转染到细胞(例如HSC)中。可应用条形编码。粒子、Cas和/或gRNA可被条形码化。
在一个实施方案中,本发明包括制备含gRNA和Cas(例如C2c1)蛋白的粒子的方法,所述方法包括将gRNA和Cas(例如C2c1)蛋白混合物与如下混合物混合,所述混合物包含以下或基本上由以下组成或由以下组成:表面活性剂、磷脂、可生物降解的聚合物、脂蛋白和醇。一个实施方案包括来自所述方法的含gRNA和Cas(例如C2c1)蛋白的粒子。在一个实施方案中,本发明包括所述粒子在通过操纵目标基因组基因座中的靶序列来修饰目标基因组基因座或生物体或非人类生物体的方法中的用途,包括使包含目标基因组基因座的细胞与其中gRNA靶向目标基因组基因座的粒子接触;或者通过操纵目标基因组基因座中的靶序列来修饰目标基因组基因座或生物体或非人类生物体的方法,包括使包含目标基因组基因座的细胞与其中gRNA靶向目标基因组基因座的粒子接触。在这些实施方案中,目标基因组基因座有利地是HSC中的基因组基因座。
治疗应用的考虑因素:基因组编辑疗法中的考虑因素是选择序列特异性核酸酶,例如C2c1核酸酶的变体。每个核酸酶变体可具有自己独特的一组优点和缺点,其中的许多优点和缺点都必须在治疗情形下加以平衡,以最大化治疗益处。迄今为止,两种使用核酸酶的治疗编辑方法已显示出重大前景:基因破坏和基因校正。基因破坏涉及NHEJ的刺激,以在遗传元件中产生靶向的插入/缺失,通常会导致对患者有益的功能丧失突变。相反,基因校正使用HDR来直接逆转引起突变的疾病,恢复功能,同时保留所校正元件的生理调控。HDR还可用于将治疗性转基因插入基因组中定义的“安全港”基因座,以恢复缺失的基因功能。为了使特定的编辑疗法有效,必须在靶细胞群体中实现足够高水平的修饰以逆转疾病症状。这种治疗修饰“阈值”取决于处理后编辑细胞的适应性以及逆转症状所需的基因产物量。关于适应性,相对于未编辑的对应物,编辑对于经处理的细胞产生三个潜在结果:适应性增加、中性或降低。在增加适应性的情况下,例如在SCID-X1的治疗中,修饰的造血祖细胞相对于其未编辑的对应物选择性地扩增。SCID-X1是由IL2RG基因突变引起的疾病,IL2RG基因的功能是造血淋巴细胞谱系正常发育所必需的[Leonard,W.J.等人,Immunological reviews138,61-86(1994);Kaushansky,K.和Williams,W.J.Williams hematology,(McGraw-HillMedical,New York,2010)]。在接受SCID-X1病毒基因治疗的患者的临床试验以及SCID-X1突变的自发校正的罕见实例中,经校正的造血祖细胞可能能够克服这种发育障碍并相对于其患病的对应物扩增以介导治疗[Bousso,P.等人,Proceedings of the NationalAcademy of Sciences of the United States of America 97,274-278(2000);Hacein-Bey-Abina,S.等人,The New England journal of medicine 346,1185-1193(2002);Gaspar,H.B.等人,Lancet 364,2181-2187(2004)]。在这种情况下,在经编辑的细胞具有选择优势时,甚至可通过扩增来扩增少量的经编辑细胞,从而为患者提供治疗益处。相比之下,编辑其他造血疾病,如慢性肉芽肿性病症(CGD),将不会诱导经编辑的造血祖细胞的适应性发生变化,从而增加了治疗修饰的阈值。CGD是由编码吞噬细胞氧化酶蛋白的基因的突变引起的,嗜中性粒细胞通常使用所述基因突变来生成可杀死病原体的活性氧[Mukherjee,S.&Thrasher,A.J.Gene 525,174-181(2013)]。由于这些基因的功能障碍不影响造血祖细胞的适应性或发育,而仅影响成熟的造血细胞类型抵抗感染的能力,因此在这种疾病中可能不会优先扩增经编辑细胞。实际上,在基因治疗试验中未观察到CGD中基因校正细胞的选择性优势,导致长期细胞植入困难[Malech,H.L.等人,Proceedings of theNational Academy of Sciences of the United States of America 94,12133-12138(1997);Kang,H.J.等人,Molecular therapy:the journal of the American Society ofGene Therapy 19,2092-2101(2011)]。因而,相对于其中编辑会产生对靶细胞的适应性增加的疾病,需要显著更高水平的编辑来治疗疾病像CGD,其中编辑产生中性的适应性优势。如果编辑在适应性方面不利,如恢复癌细胞中肿瘤抑制基因功能的情况,则修饰的细胞将在与其患病的对应物的竞争中胜出,从而导致治疗益处相对于编辑率低。后一类疾病将特别难以用基因组编辑疗法治疗。
除细胞适应性外,治疗疾病所需的基因产物量还影响为逆转症状所必须实现的治疗性基因组编辑的最低水平。乙型血友病是一种疾病,其中基因产物水平的微小变化可导致临床结果的重大变化。这种疾病是由编码因子IX的基因突变引起的,该因子是通常由肝脏分泌到血液中的一种蛋白质,在血液中它用作凝血级联的组成部分。乙型血友病的临床严重程度与因子IX活性的量有关。严重的疾病与正常活性的不足1%相关,而较轻形式的疾病与因子IX活性超过1%相关[Kaushansky,K.和Williams,W.J.Williams hematology,(McGraw-Hill Medical,New York,2010);Lofqvist,T.等人,Journal of internalmedicine 241,395-400(1997)]。这表明可将因子IX表达恢复到肝细胞的甚至很小百分比的编辑疗法对临床结果可能会有很大影响。一项使用ZFN校正出生后不久的乙型血友病小鼠模型的研究表明,3-7%的校正足以逆转疾病症状,为该假说提供了临床前证据[Li,H.等人,Nature 475,217-221(2011)]。
其中基因产物水平的微小变化可影响临床结果的病症以及其中经编辑的细胞具有适应性优势的疾病,是基因组编辑疗法的理想靶标,因为治疗修饰的阈值足够低,在当前技术下有很大的成功机会。现在,利用编辑疗法靶向这些疾病已在临床前水平和I期临床试验中获得成功。需要将DSB修复途径操纵和核酸酶递送方面的改进,以将这些有希望的结果扩展到对经编辑细胞具有中性适应性优势的疾病,或者其中需要大量基因产物以进行治疗。下表6显示了基因组编辑对治疗模型的应用的一些实例,并且下表6的参考文献和那些参考文献中引用的文献据此通过引用并入本文,如同全文列出一样。
表6
根据本公开和本领域的知识,处理上述表格中的每个条件,使用CRISPR-Cas(例如C2c1)系统通过HDR介导的突变校正或HDR介导的适当基因序列插入进行靶向,有利地经由如本文所述的递送系统(例如粒子递送系统)进行,在本领域技术人员的能力范围内。因此,一个实施方案包括将携带乙型血友病、SCID(例如SCID-X1、ADA-SCID)或遗传性酪氨酸血症突变的HSC与靶向关于乙型血友病、SCID(例如SCID-X1、ADA-SCID)或遗传性酪氨酸血症(例如,在Li、Genovese或Yin中)的目标基因组基因座的含有gRNA和Cas(例如C2c1)的蛋白接触。所述粒子还可包含合适的HDR模板以校正突变;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。在这方面,提到乙型血友病是一种X连锁的隐性病症,其由编码因子IX(凝血级联的重要组成部分)的基因中的功能丧失突变引起。在受到严重影响的个体中,将因子IX的活性恢复至其水平的1%以上可将疾病转化为明显更温和的形式,因为从年轻时就预防性地向此类患者输注重组因子IX以达到这种水平可大大改善临床并发症。利用本领域的知识和本公开的教导,技术人员可使用CRISPR-Cas(例如C2c1)系统来校正关于乙型血友病的HSC,该CRISPR-Cas系统靶向并校正突变(X连锁隐性病症,由编码因子IX的基因中的功能丧失突变引起)(例如,利用递送因子IX编码序列的合适的HDR模板);具体来说,gRNA可靶向引起乙型血友病的突变,并且HDR可为因子IX的适当表达提供编码。使靶向含有突变和Cas(例如C2c1)蛋白的粒子的gRNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以适当表达因子IX;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier,在此讨论。
在通过引用并入本文的Cartier,“MINI-SYMPOSIUM:X-Linked Adrenoleukodystrophypa,Hematopoietic Stem Cell Transplantation and Hematopoieti cStem Cell Gene Therapy in X-Linked Adrenoleukodystrophy,”Brain Patho logy 20(2010)857-862以及其引用的文献(如同全文列出一样)中,已经认识到,利用同种异体造血干细胞移植(HSCT)将正常的溶酶体酶递送至Hurler病患者的大脑,并对HSC基因疗法治疗ALD进行了讨论。在两名患者中,在粒细胞集落刺激因子(G-CSF)动员后收集外周CD34+细胞,并用骨髓增生性肉瘤病毒增强子、缺失的阴性对照区、dl587rev引物结合位点取代(MND)-AL D慢病毒载体转导。在低浓度细胞因子存在的情况下,在16小时期间用MN D-ALD载体转导来自患者的CD34+细胞。转导后,将转导的CD34+细胞冷冻,以对5%的细胞进行各种安全性测试,其中包括特别是三种具有复制能力的慢病毒(RCL)测定。CD34+细胞的转导效率范围为35%至50%,慢病毒整合拷贝的平均数在0.65至0.70之间。在转导的CD34+细胞解冻后,用白消安和环磷酰胺进行完全的骨髓消融后,将患者重新输注超过4.106个转导的CD34+细胞/千克。将患者的HSC消融以有利于基因校正的HSC的植入。两名患者在第13至15天之间出现血液学恢复。第一位患者在12个月时并且第二位患者在9个月时,出现几乎完全的免疫学恢复。与使用慢病毒相反,利用本领域的知识和本公开的教导,技术人员可使用靶向并校正突变的CRISPR-Cas(C2c1)系统(例如,使用合适的HDR模板)校正关于ALD的HSC;具体来说,gRNA可靶向ABCD1中的突变,ABCD1是位于X染色体上的编码ALD的基因,过氧化物酶体膜转运蛋白,并且HDR可为所述蛋白的适当表达提供编码。使靶向含有突变和Cas(C2c1)蛋白的粒子的gRNA与HSC(例如,携带突变的CD34+细胞,如在Cartier中)接触。所述粒子还可含有合适的HD R模板,以校正过氧化物酶体膜转运蛋白表达的突变;或者使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞任选地可如Cartier中进行处理。如此接触的细胞可如Cartier中进行施用。
提及WO 2015/148860,通过本文的教导,本发明包括结合本文的教导应用的这些文献的方法和材料。在血液相关疾病基因疗法的一个方面,用于治疗β地中海贫血的方法和组合物可适于本发明的CRISPR-Cas系统(参见例如WO 2015/148860)。在一个实施方案中,WO 2015/148860涉及例如通过改变B细胞CLL/淋巴瘤11A(BCL11A)的基因来治疗或预防β地中海贫血或其症状。BCL11A基因也称为B细胞CLL/淋巴瘤11A、BCL11A-L、BCL11A-S、BCL11AXL、CTIP 1、HBFQTL5和ZNF。BCL11A编码参与调控珠蛋白基因表达的锌指蛋白。通过改变BCL11A基因(例如,BCL11A基因的一个或两个等位基因),可增加γ珠蛋白的水平。γ珠蛋白可代替血红蛋白复合物中的β珠蛋白,并有效地将氧气运载至组织,从而改善β地中海贫血疾病的表型。
还提及WO 2015/148863,并且通过本文的教导,本发明包括可适于本发明的CRISPR-Cas系统的这些文献的方法和材料。在治疗和预防作为一种遗传性血液疾病的镰状细胞疾病的一个方面,WO 2015/148863包括改变BCL11A基因。通过改变BCL11A基因(例如,BCL11A基因的一个或两个等位基因),可增加γ珠蛋白的水平。γ珠蛋白可代替血红蛋白复合物中的β珠蛋白,并有效地将氧气运载至组织,从而改善镰状细胞疾病的表型。
在本发明的一个方面,通过适应本发明的CRISPR-Cas系统来包括涉及编辑靶核酸序列或调节靶核酸序列表达的方法和组合物及其在癌症免疫疗法中的应用。参考WO 2015/161276中的基因疗法的应用,其涉及可用于通过改变一种或多种T细胞表达的基因(例如,一种或多种FAS、BID、CTLA4、PDCD1、CBLB、PTPN6、TRAC和/或TRBC基因)来影响T细胞增殖、存活和/或功能的方法和组合物。在一个相关方面,可通过改变一个或多个T细胞表达的基因,例如CBLB和/或PTPN6基因、FAS和/或BID基因、CTLA4和/或PDCDI和/或TRAC和/或TRBC基因,来影响T细胞增殖。
嵌合抗原受体(CAR)19T细胞在患者的恶性疾病中表现出抗白血病作用。但是,白血病患者通常没有足够的T细胞可收集,这意味着治疗必须涉及来自供体的修饰T细胞。因此,存在建立供体T细胞库的兴趣。Qasim等人(“First Clinical Application of TalenEngineered Universal CAR19 T Cell s in B-ALL”ASH 57th Annual Meeting andExposition,2015年12月5-8日,Abstract 2046(ash.confex.com/ash/2015/webprogram/Paper81653.html,在线出版于2015年11月)讨论了通过破坏T细胞受体表达和CD52靶向来修饰CAR19 T细胞以消除移植物抗宿主病的风险。此外,靶向CD52细胞使其对阿仑单抗(Alemtuzumab)不敏感,因此允许阿仑单抗防止宿主介导的人白细胞抗原(HLA)错配的CAR19 T细胞排斥。研究人员使用了第三代自灭活慢病毒载体,该载体编码与RQR8连接的4g7 CAR19(CD19 scFv-4-1BB-CD3ζ),然后将具有两对TALEN mRNA用于多重靶向T细胞受体(TCR)α恒定链基因座和CD52基因基因座的细胞电穿孔。在离体扩增后仍表达TCR的细胞使用CliniMacsα/βTCR耗尽来耗尽,产生T细胞产物(UCART19),TCR表达<1%,其中85%表达CAR19,并且64%变成CD52阴性。施用修饰的CAR19T细胞以治疗患者的复发性急性淋巴细胞白血病。本文提供的教导提供了用于提供经修饰的造血干细胞及其后代的有效方法,所述造血干细胞及其后代包括但不限于血液的髓系和淋巴系的细胞,包括T细胞、B细胞、单核细胞、巨噬细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、红细胞、树突状细胞、和巨核细胞或血小板,以及自然杀伤细胞及其前体和祖细胞。可通过敲除、敲入或以其他方式调节靶标来修饰此类细胞,例如以如上所述除去或调节CD52以及其他靶标,例如但不限于CXCR4和PD-1。因此,本发明的组合物、细胞和方法可结合向患者施用T细胞或其他细胞的修饰而用于调节免疫应答并治疗但不限于恶性疾病、病毒感染和免疫病症。
提及了WO 2015/148670,并且通过本文的教导,本发明包括结合本文的教导应用的该文献的方法和材料。在基因疗法的一个方面,包括了用于编辑与人类免疫缺陷病毒(HIV)和获得性免疫缺陷综合征(AIDS)有关或相关的靶序列的方法和组合物。在一个相关方面,本文所述的发明包括通过在5型C-C趋化因子受体(CCR5)的基因中引入一个或多个突变来预防和治疗HIV感染和AIDS。CCR5基因也称为CKR5、CCR-5、CD195、CKR-5、CCCKR5、CMKBR5、IDDM22和CC-CKR-5。在另一方面,本文所述的发明包括预防或减少HIV感染和/或预防或降低HIV进入宿主细胞的能力,例如在已经感染的受试者中。HIV的示例性宿主细胞包括但不限于CD4细胞、T细胞、肠相关淋巴组织(GALT)、巨噬细胞、树突状细胞、髓样前体细胞和小胶质细胞。病毒进入宿主细胞需要病毒糖蛋白gp41和gp120与CD4受体和共受体例如CCR5相互作用。如果宿主细胞表面上不存在共受体例如CCR5,则病毒不能结合并进入宿主细胞。因此,疾病的进展受到阻碍。通过敲除或敲低宿主细胞中的CCR5,例如通过引入保护性突变(例如CCR5δ32突变),可防止HIV病毒进入宿主细胞。
X连锁慢性肉芽肿性疾病(CGD)是由于吞噬细胞NADPH氧化酶的活性缺乏或降低引起的宿主防御性遗传病症。使用靶向并校正突变(吞噬细胞NADPH氧化酶的活性缺乏或降低)的CRISPR-Cas(C2c1)系统(例如,使用递送吞噬细胞NADPH氧化酶编码序列的合适HDR模板);具体来说,gRNA可靶向引起CGD(缺乏吞噬细胞NADPH氧化酶)的突变,并且HDR可为吞噬细胞NADPH氧化酶的适当表达提供编码。使靶向含有突变和Cas(C2c1)蛋白的粒子的gRNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以使吞噬细胞NADPH氧化酶适当表达;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。
范可尼贫血:至少15个基因(FANCA、FANCB、FANCC、FANCD1/BR CA2、FANCD2、FANCE、FANCF、FANCG、FANCI、FANCJ/BACH1/BR IP1、FANCL/PHF9/POG、FANCM、FANCN/PALB2、FANCO/Rad51C和FANCP/SLX4/BTBD12)中的突变会引起范可尼贫血。由这些基因产生的蛋白质参与称为FA通路的细胞过程。当制造新的DNA拷贝(称为DNA复制)的过程由于DNA损伤而被阻断时,FA通路被打开(激活)。FA通路将某些蛋白质传送到受损区域,从而触发DNA修复,因此DNA复制可以继续。FA通路对于称为链间交联(ICL)的特定类型的DNA损伤特别具响应性。当DNA相反链上的两个DNA结构单元(核苷酸)异常附接或连接在一起时,就会发生ICL,这会终止DNA复制的过程。ICL可能是由体内产生的有毒物质堆积或某些癌症治疗药物的治疗引起的。与范可尼贫血相关的八种蛋白质结合在一起形成复合物,称为FA核心复合物。FA核心复合物激活两种蛋白,称为FANCD2和FANCI。这两种蛋白的激活将DNA修复蛋白带到ICL区域,因此可去除交联并且DNA复制可继续。FA核心复合物。更特别地,FA核心复合物是由FANCA、FANCB、FANCC、FANCE、FANCF、FANCG、FANCL和FANCM组成的核多蛋白复合物,起E3泛素连接酶的作用并介导ID复合物(其是由FANCD2和FANCI组成的异二聚体)的活化。一旦单泛素化后,它就会与FA通路下游的经典肿瘤抑制子(包括FANCD1/BRCA2、FANCN/PAL B2、FANCJ/BRIP1和FANCO/Rad51C)相互作用,从而经由同源重组(HR)促进DNA修复。80%至90%的FA病例是由于FANCA、FANCC和FANCG这三种基因之一的突变引起的。这些基因为生产FA核心复合物的组分提供了说明。与FA核心复合物相关的此类基因中的突变将导致复合物失去功能,并破坏整个FA通路。结果,DNA损伤无法得到有效修复,并且ICL随着时间而积累。Geiselhart,“Review Article,Disrupted Signaling through the Fanc oni Anemia Pathway Leadsto Dysfunctional Hematopoietic Stem Cell Biolo gy:Underlying Mechanisms andPotential Therapeutic Strategies,”Anemia第2012卷(2012),文章ID 265790,dx.doi.org/10.1155/2012/265790讨论了FA和涉及股内注射编码FANCC基因的慢病毒的动物实验,该慢病毒导致体内HSC的校正。使用靶向和与FA相关的一个或多个突变的CRISPR-Cas(C2c1)系统,例如具有分别靶向FANCA、FANCC或FANCG的一个或多个突变的gRNA和HDR模板的CRISPR-Cas(C2c1)系统,所述突变产生FA并提供FANCA、FANCC或FANCG中的一者或多者的校正性表达;例如,gRNA可靶向关于FANCC的突变,并且HDR可为FANCC的适当表达提供编码。使靶向包含突变(例如,涉及FA的一种或多种,例如关于FANCA、FANCC或FANCG中的任何一者或多者的突变)和Cas(C2c1)蛋白的粒子的gRNA与携带突变的HSC接触。所述粒子还可包含合适的HDR模板,以校正突变以适当表达FA中涉及的一种或多种蛋白质,例如FANCA、FANCC或FANCG中的任何一者或多者;或者可使HSC与包含或递送HDR模板的第二粒子或载体接触。如此接触的细胞可被施用;以及任选地处理/扩增;参考Cartier。
本文讨论中的粒子(例如,关于包含gRNA和Cas(C2c1),任选地HDR模板,或HDR模板;例如关于乙型血友病、SCID、SCID-X1、ADA-SCID、遗传性酪氨酸血症、β-地中海贫血、X连锁CGD、Wiskott-Aldrich综合征、范可尼贫血、肾上腺脑白质营养不良(ALD)、异染性脑白质营养不良(MLD)、HIV/AIDS、免疫缺陷病症、血液疾患或遗传溶酶体贮积病)有利地通过将gRNA和Cas(C2c1)蛋白质混合物(任选地包含HDR模板或者仅当需要关于模板的单独粒子时仅包含HDR模板的这种混合物)与如下混合物混合来获得或可获得,所述混合物包含以下或基本上由以下组成或由以下组成:表面活性剂、磷脂、可生物降解的聚合物、脂蛋白和醇(其中一个或多个gRNA靶向HSC中的一个或多个遗传基因座)。
实际上,本发明特别适合通过基因组编辑来治疗造血遗传病症,以及尤其是通过使用本文讨论的粒子技术来治疗免疫缺陷病症,例如遗传免疫缺陷病症。遗传免疫缺陷是可成功进行本发明的基因组编辑干预的疾病。原因包括:造血细胞是治疗可及的,免疫细胞是其中的一个子集。可将它们从体内移出并自体或同种异体移植。此外,某些遗传免疫缺陷,例如严重的联合免疫缺陷(SCID),对免疫细胞产生了增殖性不利。校正由罕见的自发的“反向”突变引起的SCID的遗传病变,表明即使校正一个淋巴细胞祖细胞也可能足以恢复患者的免疫功能.../../../Users/t_kowalski/AppData/Local/Microsoft/Windows/Temporary Internet Files/Content.Outlook/GA8VY8LK/Treating SCID forEllen.docx-_ENREF_1。参见Bousso,P.等人,Diversity,functionality,and stabilityof the Tcell repertoire derived in vivo from a single human T cellprecursor.Proceedings of the National Academy of Sciences of the UnitedStates of America 97,274-278(2000)。经编辑细胞的选择性优势甚至可实现低水平的编辑,从而产生治疗效果。本发明的这种效果可在SCID、Wiskott-Aldrich综合征和本文提及的其他疾患(包括其他遗传性造血障碍如α-地中海贫血和β-地中海贫血)中看到,其中血红蛋白缺乏对红系祖细胞的适应性产生负面影响。
NHEJ和HDR DSB修复的活性随细胞类型和细胞状态而显著变化。NHEJ不受细胞周期高度调节,并且在各种细胞类型中均有效,从而可在可接近的靶细胞群体中进行高水平的基因破坏。相比之下,HDR主要在S/G2阶段期间起作用,因此仅限于活跃分裂的细胞,从而限制了需要对有丝分裂细胞进行精确的基因组修饰的治疗方法[Ciccia,A.和Elledge,S.J.Molecular cell 40,179-204(2010);Chapman,J.R.等人,Molecular cell 47,497-510(2012)]。值得注意的是,包含C2c1蛋白的CRISPR-C2c1系统在靶位点处产生交错切口。因此,本发明中靶序列的切割、修饰和/或修复可以是HDR依赖性的或非依赖性的。在特定的实施方案中,CRISPR-C2c1系统经由NHEJ引入交错DSB修复。在某些特定实施方案中,本发明中的CRISPR-C2c1系统经由NHEJ在非分裂细胞例如神经元中引入交错DSB修复。
经由HDR进行校正的效率可由靶向基因座的表观遗传状态或序列控制,或者由所用的特定修复模板配置(单链对双链,长同源臂对短同源臂)控制[Hacein-Bey-Abina,S.等人,The New England journal of medicine 346,1185-1193(2002);Gaspar,H.B.等人,Lancet 364,2181-2187(2004);Beumer,K.J.等人,G3(2013)]。NHEJ和HDR机制在靶细胞中的相对活性也可能影响基因校正效率,因为这些途径可能竞争解决DSB的问题[Beumer,K.J.等人,Proceedings of the National Academy of Sciences of the United Statesof America105,19821-19826(2008)]。HDR还带来了NHEJ策略所未见的递送挑战,因为它需要同时递送核酸酶和修复模板。在实践中,到目前为止,这些限制导致治疗相关细胞类型的HDR水平低。因此,尽管现在已经针对乙型血友病和遗传性酪氨酸血症的小鼠模型描述了概念验证的临床前HDR治疗,但临床转化因此在很大程度上聚焦于NHEJ策略来治疗疾病[Li,H.等人,Nature 475,217-221(2011);Yin,H.等人,Nature biotechnology 32,551-553(2014)]。
任何给定的基因组编辑应用都可包含蛋白质、小RNA分子和/或修复模板的组合,这使得这些多个部分的递送比小分子治疗剂基本上更具挑战性。已经开发出两种主要的用于递送基因组编辑工具的策略:离体和体内。在离体治疗中,患病细胞会从体内移出,进行编辑,然后移植回患者体内。离体编辑的优点是允许很好地定义靶细胞群体,并且可确定递送至细胞的治疗性分子的具体剂量。当关注脱靶修饰时,后一种考虑特别重要,因为滴定核酸酶的量可能会减少此类突变(Hsu等人,2013)。离体方法的另一个优点是,由于开发了用于蛋白质和核酸进入培养细胞的有效递送系统以用于研究和基因疗法应用,可以实现通常较高的编辑率。
离体方法可能存在这样的缺点:其应用局限在少数疾病中。例如,靶细胞必须能够在体外存活操纵。对于许多组织(如大脑)而言,在体外培养细胞是一项重大挑战,因为细胞要么无法存活,要么失去体内功能所需的特性。因此,鉴于本公开内容和本领域的知识,能够通过CRISPR-Cas(C2c1)系统对具有适合于离体培养和操纵的成年干细胞群体的组织(例如造血系统)进行离体治疗。[Bunn,H.F.和Aster,J.Pathophysiology of blooddisorders,(McGraw-Hill,New York,2011)]
体内基因组编辑涉及将编辑系统直接递送至其天然组织中的细胞类型。体内编辑允许治疗其中受影响的细胞群体不适合离体操纵的疾病。此外,将核酸酶原位递送至细胞允许治疗多种组织和细胞类型。这些特性可能使体内治疗比离体治疗更广泛地应用于疾病。
迄今为止,体内编辑已经很大程度上通过使用具有确定的组织特异性嗜性的病毒载体来实现。此类载体目前在货物运载能力和嗜性方面受到限制,将这种治疗方式限制于有效利用临床上有用的载体进行转导的器官系统,例如肝脏、肌肉和眼睛[Kotterman,M.A.和Schaffer,D.V.Nature reviews.Genetics15,445-451(2014);Nguyen,T.H.和Ferry,N.Gene therapy 11增刊1,S76-84(2004);Boye,S.E.等人,Molecular therapy:thejournal of the American Society of Gene Therapy 21,509-519(2013)]。
体内递送的潜在障碍是免疫应答,该免疫应答可能是对治疗所需的大量病毒的应答而产生的,但是这种现象并非基因组编辑所独有,在其他基于病毒的基因疗法中也观察到[Bessis,N.等人,Gene therapy 11增刊1,S10-17(2004)]。来自编辑核酸酶本身的肽也可能会呈递在MHC I类分子上,以刺激免疫反应,尽管在临床前水平上尚无证据支持这种情况。这种治疗模式的另一个主要困难是在体内控制基因组编辑核酸酶的分布并因此控制其剂量,导致可能难以预测的脱靶突变谱。然而,鉴于本公开内容和本领域的知识,包括使用用于治疗癌症的基于病毒和粒子的疗法,HSC的体内修饰,例如通过粒子或病毒的递送,在技术人员的能力范围内。
离体编辑疗法:长期以来在造血细胞的纯化、培养和移植方面的临床专业知识使影响血液系统的疾病(例如SCID、范可尼贫血、Wiskott-Aldrich综合征和镰状细胞性贫血)成为离体编辑疗法的重点。关注造血细胞的另一个原因是,由于先前为血液病症设计基因疗法的努力,已经存在效率相对较高的递送系统。凭借这些优势,这种治疗模式可应用于经编辑的细胞具有适应性优势的疾病,从而使少量植入的经编辑的细胞可扩增和治疗疾病。一种这样的疾病是HIV,其中感染导致对CD4+T细胞的适应性不利。
离体编辑疗法最近已扩展到包括基因校正策略。Genovese及其同事的最新论文克服了离体HDR的障碍,他们在从患有SCID-X1的患者获得的造血干细胞(HSC)中实现了突变IL2RG基因的基因校正[Genovese,P.等人,Nature510,235-240(2014)]。Genovese等人使用多模式策略在HSC中完成了基因校正。首先,使用包含编码IL2RG的治疗性cDNA的HDR模板的整合缺陷型慢病毒转导HSC。转导后,用编码靶向IL2RG中突变热点的ZFN的mRNA将细胞电穿孔,以刺激基于HDR的基因校正。为了提高HDR率,使用小分子优化培养条件以促进HSC分裂。通过优化的培养条件、核酸酶和HDR模板,可在培养中以治疗相关的速率从SCID-X1患者中获得基因校正的HSC。来自未受影响个体的HSC经过相同的基因校正程序后,可维持小鼠长期造血功能,这是HSC功能的金标准。HSC能够产生所有造血细胞类型,并且可以自体移植,使其成为所有造血遗传病症的极有价值的细胞群体[Weissman,I.L.和Shizuru,J.A.Blood112,3543-3553(2008)]。原则上,基因校正的HSC可用于治疗广泛多种遗传性血液病症,使得这项研究成为治疗性基因组编辑的令人激动的突破。
体内编辑疗法:根据本公开内容和本领域的知识,可有利地使用体内编辑。对于有效递送的器官系统,已经有许多令人激动的临床前治疗成功。在乙型血友病小鼠模型中证明了成功进行体内编辑疗法的第一个实例[Li,H.等人,Nature 475,217-221(2011)]。如前所述,乙型血友病是一种由编码因子IX(凝血级联的关键组成部分)的基因中的功能丧失突变引起的X连锁隐性病症。在受到严重影响的个体中,将因子IX的活性恢复至其水平的1%以上可将所述疾病转化为明显更温和的形式,因为从年轻时就预防性地向此类患者输注重组因子IX以达到这种水平可大大改善临床并发症[Lofqvist,T.等人,Journal ofinternal medicine 241,395-400(1997)]。因此,仅需低水平的HDR基因校正即可改变患者的临床结果。另外,因子IX由肝脏合成和分泌,肝脏是可通过编码编辑系统的病毒载体有效转导的器官。
使用编码ZFN的嗜肝腺相关病毒(AAV)血清型和校正性HDR模板,在鼠肝中实现了突变的人源化因子IX基因的高达7%的基因校正[Li,H.等人,Nature 475,217-221(2011)]。这导致了血凝块形成动力学的改善,血凝块形成动力学是凝血级联功能的一种量度,这首次证明了体内编辑疗法不仅可行,而且有效。如本文中所讨论的,本领域技术人员根据本文的教导和本领域的知识(例如Li)来定位,以利用含HDR模板和CRISPR-Cas(C2c1)系统的粒子来处理乙型血友病,所述系统靶向X连锁隐性病症的突变以逆转功能丧失突变。
在这项研究的基础上,其他小组最近使用CRISPR-Cas对肝脏进行了体内基因组编辑,从而成功治疗了遗传性酪氨酸血症的小鼠模型并产生了可针对心血管疾病提供保护的突变。这两种截然不同的应用证明了这种方法在涉及肝功能障碍的病症中的通用性[Yin,H.等人,Nature biotechnology 32,551-553(2014);Ding,Q.等人,Circulation research115,488-492(2014)]。必须将体内编辑应用于其他器官系统,以证明该策略可广泛应用。目前,正在进行优化病毒和非病毒载体的努力,以扩展可用这种治疗模式治疗的病症的范围[Kotterman,M.A.和Schaffer,D.V.Nature reviews.Genetics 15,445-451(2014);Yin,H.等人,Nature reviews.Genetics 15,541-555(2014)]。如本文所讨论的,技术人员根据本文的教导和本领域的知识(例如Yin)来定位,以利用含HDR模板和靶向突变的CRISPR-Cas(C2c1)系统的粒子来处理遗传性酪氨酸血症。
靶向缺失,治疗应用:基因的靶向缺失可能是优选的。因此,优选的是涉及免疫缺陷病症、血液疾患或遗传溶酶体贮积病例如乙型血友病、SCID、SCID-X1、ADA-SCID、遗传性酪氨酸血症、β-地中海贫血、X连锁CGD、Wiskott-Aldrich综合征、范可尼贫血、肾上腺脑白质营养不良(ALD)、异染性脑白质营养不良(MLD)、HIV/AIDS、其他代谢异常的基因,编码与疾病有关的错误折叠蛋白的基因,导致与疾病有关的功能丧失的基因;通常,使用任何本文讨论的递送系统,可在HSC中靶向的突变,其中粒子系统被认为是有利的。
在本发明中,特别是按照Tangri等人关于促红细胞生成素首先提出并且随后开发的方法,特别是可降低CRISPR酶的免疫原性。因此,定向进化或合理设计可用于降低宿主物种(人类或其他物种)中的CRISPR酶(例如C2c1)的免疫原性。
基因组编辑:本发明的CRISPR/Cas(C2c1)系统可用于校正先前尝试使用TALEN和ZFN以及慢病毒并且成功率有限的遗传突变,包括如本文所讨论的;还参见WO2013163628。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
治疗大脑、中枢神经和免疫系统的疾病
本发明还涵盖将CRISPR-Cas系统递送至大脑或神经元。在一些实施方案中,CRISPR-Cas系统包含C2c1蛋白。在一些实施方案中,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在优选的实施方案中,CRISPR-C2c1系统经由HR或NHEJ、优选NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。例如,RNA干扰(RNAi)通过减少HTT(亨廷顿氏病的致病基因)的表达而为该病症提供了治疗潜力(参见例如McBride等人,Molecular Therapy第19卷第12期,2011年12月,第2152-2162页),因此申请人假定它可被使用/和或适于CRISPR-Cas系统。可使用减少反义序列的脱靶潜能的算法来生成CRISPR-Cas系统。CRISPR-Cas序列可靶向小鼠、恒河猴或人类亨廷顿蛋白的外显子52中的序列,并在病毒载体例如AAV中表达。可向动物(包括人类)每半球注射约3次显微注射(总共六次注射):前联合部的前1mm(12μl)和其余两次注射(分别为12μl和10μl),与第一次注射后尾间隔3和6mm,以约1μl/min的速率注射1e12 vg/ml的AAV,并且将针头留在原处另外5分钟,以使注射液从针尖扩散。
DiFiglia等人(PNAS,2007年10月23日,第104卷,第43期,17204-17209)观察到,向成年纹状体中单次施用靶向Htt的siRNA可使突变型Htt沉默,减弱神经元病理并延缓在HD的快速发作病毒转基因小鼠模型中观察到的异常行为表型。DiFiglia将2μl的10μM的Cy3标记的cc-siRNA-Htt或未缀合的siRNA-Htt经纹状体内注射给小鼠。在本发明中可考虑将类似剂量的靶向Htt的CRISPR Cas用于人类,例如,可经纹状体内注射约5-10ml的10μM靶向Htt的CRISPR Cas。
在另一个实例中,Boudreau等人(Molecular Therapy第17卷第6期,2009年6月)将5μl表达htt特异性RNAi病毒的重组AAV血清型2/1载体(4×1012病毒基因组/ml)注射到纹状体中。在本发明中可考虑将类似剂量的靶向Htt的CRISPR Cas用于人类,例如,可经纹状体内注射约10-20ml的(4×1012病毒基因组/ml)靶向Htt的CRISPR Cas。
在另一个实例中,可连续施用靶向HTT的CRISPR Cas(参见例如Yu等人,Cell 150,895-908,2012年8月31日)。Yu等人利用流量为0.25ml/hr的渗透泵(2004型)来递送300毫克/天的ss-siRNA或磷酸盐缓冲盐水(PBS)(Sigma Aldrich)持续28天,以及使用设计成流量为0.5μl/hr的泵(2002型)来递送75毫克/天的阳性对照MOE ASO持续14天。泵(Durect公司)配备有在无菌PBS中稀释的ss-siRNA或MOE,然后在植入前于37℃温育24或48小时(2004型)。用2.5%异氟烷麻醉小鼠,并在颅骨底部做中线切口。使用立体定向引导器,将套管植入右侧脑室,并用Loctite胶粘剂固定。将附接至Alzet渗透微型泵的导管附接至套管,并将所述泵皮下置于肩胛中部区域。用5.0尼龙缝线封闭切口。在本发明中可考虑将类似剂量的靶向Htt的CRISPR Cas用于人类,例如,可施用约500至1000克/天的靶向Htt的CRISPR Cas。
在连续输注的另一个实例中,Stiles等人(Experimental Neurology 233(2012)463-471)将带有钛针尖的实质内导管植入右壳核中。将所述导管连接至皮下植入腹部的
在另一个实例中,也可将转让给Sangamo的美国专利公开第20130253040号(WO2013130824)的方法从TALES改适为用于治疗亨廷顿氏病的本发明的CRISPR Cas系统。
通过引用并入本文的以The Broad Institute等人名义的WO2015089354A1描述了亨廷顿氏病(HP)的靶标。关于亨廷顿氏病的CRISPR复合物的可能靶基因:PRKCE;IGF1;EP300;RCOR1;PRKCZ;HDAC4;和TGM2。因此,在本发明的一些实施方案中,可选择PRKCE;IGF1;EP300;RCOR1;PRKCZ;HDAC4;和TGM2中的一者或多者作为亨廷顿氏病的靶标。
其他三核苷酸重复病症。这些可能包括以下任何一项:第I类包括亨廷顿氏病(HD)和脊髓小脑共济失调;第II类扩增在表型上各不相同,异质扩增通常量值较小,但也存在于基因的外显子中;以及第III类包括脆性X综合征,肌强直性营养不良,脊髓小脑共济失调、青少年肌阵挛性癫痫和弗里德里希共济失调中的两种。
本发明的另一方面涉及利用CRISPR-Cas系统来校正已经被鉴定与Lafora病相关的EMP2A和EMP2B基因中的缺陷。Lafora疾病是常染色体隐性疾患,其特征为可能开始于青春期的癫痫发作的进行性肌阵挛性癫痫。所述疾病的少数病例可能是由于尚未鉴定的基因突变引起的。所述疾病引起癫痫发作,肌肉痉挛,行走困难,痴呆,以及最终死亡。目前尚无针对疾病进展证实有效的疗法。CRISPR-Cas系统也可靶向与癫痫相关的其他遗传异常,并且潜在遗传学进一步描述于Genetics of Epilepsy and Genetic Epilepsies,GiulianoAvanzini,Jeffrey L.Noebels编辑,Mariani Foundation Paediatric Neurology:20;2009)。
转让给Sangamo BioSciences公司的涉及灭活T细胞受体(TCR)基因的美国专利公开第20110158957号的方法也可被修改为本发明的CRISPR Cas系统。在另一个实例中,转让给Sangamo BioSciences公司的美国专利公开第20100311124号和转让给Cellectis的美国专利公开第20110225664号的方法都涉及使谷氨酰胺合酶基因表达基因失活,其也可被修改为本发明的CRISPR Cas系统。
用于大脑的递送选择包括将CRISPR酶和呈DNA或RNA的形式的指导RNA包封到脂质体中,并与分子特洛伊木马缀合以进行跨血脑屏障(BBB)递送。分子特洛伊木马已被证明可有效地将B-gal表达载体递送至非人类灵长类动物的大脑中。相同的方法可用于递送含有CRISPR酶和指导RNA的载体。例如,Xia CF和Boado RJ,Pardridge WM("Antibody-mediatedtargeting of siRNA via the human insulin receptor using avidin-biotintechnology."Mol Pharm.2009年5-6月;6(3):747-51.doi:10.1021/mp800194)描述了可如何通过结合使用受体特异性单克隆抗体(mAb)和抗生物素蛋白-生物素技术将短干扰RNA(siRNA)递送至培养细胞以及体内细胞。作者还报道,由于用抗生物素蛋白-生物素技术稳定了靶向mAb与siRNA之间的键,并且在静脉内施用靶向siRNA后在体内观察到遥远位点(如大脑)处的RNAi作用。
Zhang等人(Mol Ther.2003年1月;7(1):11-8.))描述了如何将编码报告物如荧光素酶的表达质粒包封在由85nm聚乙二醇化免疫脂质体组成的“人工病毒”内部,所述“人工病毒”利用针对人胰岛素受体(HIR)的单克隆抗体(MAb)体内靶向恒河猴脑。HIRMAb使携带外源基因的脂质体在静脉内注射后能够通过血脑屏障进行转胞吞作用并通过神经元质膜进行内吞作用。与大鼠相比,恒河猴脑中的荧光素酶基因表达水平高50倍。组织化学和共焦显微镜证实了灵长类动物脑中β-半乳糖苷酶基因的广泛神经元表达。作者指出,这种方法可在24小时内实现可行的可逆成人转基因。因此,优选使用免疫脂质体。这些可与靶向特定组织或细胞表面蛋白的抗体结合使用。
阿尔茨海默氏病
美国专利公开第20110023153号描述了使用锌指核酸酶来遗传修饰与阿尔茨海默氏病相关的细胞、动物和蛋白质。一旦修饰的细胞和动物可使用已知方法进行进一步测试,以使用AD研究中常用的措施来研究靶向突变对AD发生和/或进展的影响,例如但不限于学习和记忆、焦虑、抑郁、成瘾和感觉运动功能,以及测量行为、功能、病理、代谢和生化功能的测定法。
本公开包括编码与AD相关的蛋白质的任何染色体序列的编辑。
在一些实施方案中,本发明中公开的系统包含C2c1-CRISPR系统。在一些实施方案中,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统将单个突变引入AD相关基因。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入AD相关基因的转录物。通常基于与AD相关的蛋白质与AD病症的实验关联来选择与AD相关的蛋白质。例如,相对于缺乏AD病症的群体,在患有AD病症的群体中,与AD相关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码蛋白质的基因的基因表达谱来鉴定与AD相关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。
阿尔茨海默氏病相关蛋白的实例包括例如VLDLR基因编码的极低密度脂蛋白受体蛋白(VLDLR),UBA1基因编码的泛素样修饰物激活酶1(UBA1),或UBA3基因编码的NEDD8激活酶E1催化亚基蛋白(UBE1C)。
作为非限制性实例,与AD相关的蛋白质包括但不限于如下列出的蛋白质:染色体序列编码蛋白ALAS2δ-氨基乙酰丙酸合酶2(ALAS2),ABCA1ATP结合盒转运蛋白(ABCA1),ACE血管紧张素I-转化酶(ACE),APOE载脂蛋白E前体(APOE),APP淀粉样前体蛋白(APP),AQP1水通道蛋白1蛋白(AQP1),BIN1 Myc盒依赖性相互作用蛋白1或桥接整合子1蛋白(BIN1),BDNF脑源性神经营养因子(BDNF),BTNL8嗜乳脂蛋白样蛋白8(BTNL8),C1ORF49染色体1开放阅读框49,CDH4钙粘蛋白-4,CHRNB2神经元乙酰胆碱受体亚基β-2,CKLFSF2 CKLF样含MARVEL跨膜结构域蛋白2(CKLFSF2),CLEC4E C型凝集素结构域家族4成员e(CLEC4E),CLU簇蛋白(也称为载脂蛋白J),CR1红细胞补体受体1(CR1,也称为CD35、C3b/C4b受体和免疫粘附受体),CR1L红细胞补体受体1(CR1L),CSF3R粒细胞集落刺激因子3受体(CSF3R),CST3胱抑素C或胱抑素3,CYP2C细胞色素P4502C,DAPK1死亡相关蛋白激酶1(DAPK1),ESR1雌激素受体1,IgA受体的FCAR Fc片段(FCAR,也称为CD89),IgG的FCGR3B Fc片段,低亲和力IIIb,受体(FCGR3B或CD16b),FFA2游离脂肪酸受体2(FFA2),FGA纤维蛋白原(因子I),GAB2 GRB2相关结合蛋白2(GAB2),GAB2 GRB2相关结合蛋白2(GAB2),GALP甘丙肽样肽,GAPDHS生精甘油醛-3-磷酸脱氢酶(GAPDHS),GMPB GMBP,HP结合珠蛋白(HP),HTR7 5-羟色胺(血清素)受体7(腺苷酸环化酶偶联),IDE胰岛素降解酶,IF127 IF127,IFI6干扰素α诱导蛋白6(IFI6),IFIT2干扰素诱导的具有四肽重复序列的蛋白2(IFIT2),IL1RN白介素-1受体拮抗剂(IL-1RA),IL8RA白介素8受体α(IL8RA或CD181),IL8RB白介素8受体β(IL8RB),JAG1锯齿状1(JAG1),KCNJ15钾内向整流通道亚家族J成员15(KCNJ15),LRP6低密度脂蛋白受体相关蛋白6(LRP6),MAPT微管相关蛋白τ(MAPT),MARK4 MAP/微管亲和力调节激酶4(MARK4),MPHOSPH1 M期磷酸蛋白1,MTHFR 5,10-亚甲基四氢叶酸还原酶,MX2干扰素诱导的GTP结合蛋白Mx2,NBN Nibrin也称为NBN,NCSTN Nicastrin,NIACR2烟酸受体2(NIACR2,也称为GPR109B),NMNAT3烟酰胺核苷酸腺苷酸转移酶3,NTM Neurotrimin(或HNT),ORM1血清类粘蛋白1(ORM1)或α-1-酸糖蛋白1,P2RY13 P2Y嘌呤受体13(P2RY13),PBEF1烟酰胺磷酸核糖基转移酶(NAmPRTase或Nampt)也称为前B细胞集落增强因子1(PBEF1)或visfatin,PCK1磷酸烯醇丙酮酸羧激酶,PICALM磷脂酰肌醇结合网格蛋白装配蛋白(PICALM),PLAU尿激酶型纤溶酶原激活剂(PLAU),PLXNC1Plexin C1(PLXNC1),PRNP朊病毒蛋白,PSEN1早老蛋白1蛋白(PSEN1),PSEN2早老蛋白2蛋白(PSEN2),PTPRA蛋白酪氨酸磷酸酶受体A型蛋白(PTPRA),RALGPS2具有PH结构域和SH3结合基序2的Ral GEF(RALGPS2),RGSL2 G蛋白信号传导调控子样2(RGSL2),SELENBP1硒结合蛋白1(SELNBP1),SLC25A37 Mitoferrin-1,SORL1含分拣蛋白(sortilin)相关受体L(DLR类)A重复序列的蛋白(SORL1),TF转铁蛋白,TFAM线粒体转录因子A,TNF肿瘤坏死因子,TNFRSF10C肿瘤坏死因子受体超家族成员10C(TNFRSF10C),TNFSF10肿瘤坏死因子受体超家族成员(TRAIL)成员10a(TNFSF10),UBA1泛素样修饰物激活酶1(UBA1),UBA3 NEDD8激活酶E1催化亚基蛋白(UBE1C),UBB泛素B蛋白(UBB),UBQLN1泛醌蛋白-1,UCHL1泛素羧基末端酯酶L1蛋白(UCHL1),UCHL3泛素羧基末端水解酶同工酶L3蛋白(UCHL3),VLDLR极低密度脂蛋白受体蛋白(VLDLR)。
在示例性实施方案中,其染色体序列被编辑的与AD相关的蛋白质可以是由VLDLR基因编码的极低密度脂蛋白受体蛋白(VLDLR),由UBA1基因编码的泛素样修饰物激活酶1(UBA1),由UBA3基因编码的NEDD8活化酶E1催化亚基蛋白(UBE1C),由AQP1基因编码的水通道蛋白1蛋白(AQP1),由UCHL1基因编码的泛素羧基末端酯酶L1蛋白(UCHL1),由UCHL3基因编码的泛素羧基末端水解酶同工酶L3蛋白(UCHL3),由UBB基因编码的泛素B蛋白(UBB),由MAPT基因编码的微管相关蛋白τ(MAPT),由PTPRA基因编码的蛋白质酪氨酸磷酸酶受体A型蛋白(PTPRA),由PICALM基因编码的磷脂酰肌醇结合网格蛋白装配蛋白(PICALM),由CLU基因编码的簇蛋白(也称为载脂蛋白J),由PSEN1基因编码的早老蛋白1蛋白,由PSEN2基因编码的早老蛋白2蛋白,由SORL1基因编码的含分拣蛋白相关受体L(DLR类)A重复序列的蛋白(SORL1)蛋白,由APP基因编码的淀粉样前体蛋白(APP),由APOE基因编码的载脂蛋白E前体(APOE),或由BDNF基因编码的脑源性神经营养因子(BDNF)。在一个示例性的实施方案中,遗传修饰的动物是大鼠,并且编码与AD相关的蛋白质的经编辑的染色体序列如下:APP淀粉样前体蛋白(APP)NM_019288,AQP1水通道蛋白1蛋白(AQP1)NM_012778,BDNF脑源性神经营养因子NM_012513,CLU簇蛋白(也称为NM_053021载脂蛋白J),MAPT微管相关蛋白NM_017212τ(MAPT),PICALM磷脂酰肌醇结合蛋白NM_053554网格蛋白装配蛋白(PICALM),PSEN1早老蛋白1蛋白(PSEN1)NM_019163,PSEN2早老蛋白2蛋白(PSEN2)NM_031087,PTPRA蛋白酪氨酸磷酸酶NM_012763A型受体蛋白(PTPRA),SORL1含分拣蛋白相关受体L(DLR NM_053519,类别)A重复序列的XM_001065506蛋白(SORL1)XM_217115,UBA1泛素样修饰物激活NM_001014080酶1(UBA1),UBA3 NEDD8激活酶E1 NM_057205催化亚基蛋白(UBE1C),UBB泛素B蛋白(UBB)NM_138895,UCHL1泛素羧基末端NM_017237酯酶L1蛋白(UCHL1),UCHL3泛素羧基末端NM_001110165水解酶同工酶L3蛋白(UCHL3),VLDLR极低密度脂蛋白NM_013155受体蛋白(VLDLR)。
所述动物或细胞可包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15个或更多个编码与AD相关的蛋白质的破坏染色体序列以及0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15个或更多个编码与AD相关的蛋白质的染色体整合序列。
可修饰编辑或整合的染色体序列以编码与AD相关的改变的蛋白质。与AD相关的染色体序列中的许多突变已经与AD相关。例如,APP中的V7171(即位置717处的缬氨酸变成异亮氨酸)错义突变引起家族性AD。早老蛋白-1蛋白的多重突变,例如H163R(即位置163处的组氨酸变为精氨酸),A246E(即位置246处的丙氨酸变为谷氨酸),L286V(即位置286处的亮氨酸变为缬氨酸)和C410Y(即位置410处的半胱氨酸变为酪氨酸)引起家族性3型阿尔茨海默氏病。早老蛋白2蛋白的突变,例如N141I(即位置141处的天冬酰胺变为异亮氨酸),M239V(即位置239处的甲硫氨酸变为缬氨酸)和D439A(即位置439处的天冬氨酸改变为丙氨酸)引起家族性4型阿尔茨海默氏病。AD相关基因和疾病中遗传变异的其他关联是本领域已知的。参见例如Waring等人,(2008)Arch.Neurol.65:329-334,其公开内容通过引用整体并入本文。
分泌酶病症
美国专利公开第20110023146号描述了锌指核酸酶用于遗传修饰与分泌酶相关病症相关的细胞、动物和蛋白质的用途。分泌酶对于将前蛋白加工成生物活性形式至关重要。本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与美国专利公开第20010023146号中的系统类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
分泌酶途径的各个组成部分的缺陷导致许多病症,特别是具有标志性淀粉样蛋白生成或淀粉样蛋白斑块的病症,例如阿尔茨海默氏病(AD)。
分泌酶病症和与这些病症相关的蛋白质是影响众多病症的易感性、病症的存在、病症的严重程度或其任何组合的一组多种蛋白质。本公开包括编码与分泌酶病症相关的蛋白质的任何染色体序列的编辑。通常基于与分泌酶相关的蛋白质与分泌酶病症的发展之间的实验关联来选择与分泌酶病症相关的蛋白质。例如,相对于不具有分泌酶病症的群体,在具有分泌酶病症的群体中,与分泌酶病症相关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码蛋白质的基因的基因表达谱来鉴定与分泌酶病症相关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。
作为非限制性实例,与分泌酶病症相关的蛋白质包括PSENEN(早老蛋白增强子2同源物(秀丽隐杆线虫)),CTSB(组织蛋白酶B),PSEN1(早老蛋白1),APP(淀粉样β(A4)前体蛋白),APH1B(前咽缺陷1同源物B(秀丽隐杆线虫)),PSEN2(早老蛋白2(阿尔茨海默氏病4)),BACE1(β位点APP切割酶1),ITM2B(整合膜蛋白2B),CTSD(组织蛋白酶D),NOTCH1(Notch同源物1,易位相关(果蝇)),TNF(肿瘤坏死因子(TNF超家族,成员2)),INS(胰岛素),DYT10(肌张力障碍10),ADAM17(ADAM金属肽酶结构域17),APOE(载脂蛋白E),ACE(血管紧张素I转化酶(肽基-二肽酶A)1),STN(他汀类),TP53(肿瘤蛋白p53),IL6(白介素6(干扰素,β2)),NGFR(神经生长因子受体(TNFR超家族,成员16)),IL1B(白介素1,β),ACHE(乙酰胆碱酯酶(Yt血型)),CTNNB1(连环蛋白(钙粘蛋白相关蛋白),β1,88kDa),IGF1(胰岛素样生长因子1(生长调节素C)),IFNG(干扰素,γ),NRG1(神经调节蛋白1),CASP3(胱天蛋白酶3,凋亡相关的半胱氨酸肽酶),MAPK1(有丝分裂原激活的蛋白激酶1),CDH1(钙粘蛋白1,1型,E-钙粘蛋白(上皮)),APBB1(淀粉样β(A4)前体蛋白结合,家族B,成员1(Fe65)),HMGCR(3-羟基-3-甲基戊二酰-辅酶A还原酶),CREB1(cAMP响应元件结合蛋白1),PTGS2(前列腺素-内过氧化物合酶2(前列腺素G/H合酶和环加氧酶)),HES1(发状分裂相关增强子1(果蝇)),CAT(过氧化氢酶),TGFB1(转化生长因子,β1),ENO2(烯醇酶2(γ,神经元)),ERBB4(v-erb-a成红细胞白血病病毒致癌基因同源物4(禽类)),TRAPPC10(运输蛋白粒子复合物10),MAOB(单胺氧化酶B),NGF(神经生长因子(β多肽)),MMP12(基质金属肽酶12(巨噬细胞弹性蛋白酶)),JAG1(锯齿状1(Alagille综合征)),CD40LG(CD40配体),PPARG(过氧化物酶体增殖物激活受体γ),FGF2(成纤维细胞生长因子2(碱性)),IL3(白介素3(集落刺激因子,多种)),LRP1(低密度脂蛋白受体相关蛋白1),NOTCH4(Notch同源物4(果蝇)),MAPK8(有丝分裂原激活的蛋白激酶8),PREP(脯氨酰内肽酶),NOTCH3(Notch同源物3(果蝇)),PRNP(朊病毒蛋白),CTSG(组织蛋白酶G),EGF(表皮生长因子(β-尿抑胃素)),REN(肾素),CD44(CD44分子(印度血型)),SELP(选择素P(颗粒膜蛋白140kDa,抗原CD62)),GHR(生长激素受体),ADCYAP1(腺苷酸环化酶激活多肽1(垂体)),INSR(胰岛素受体),GFAP(胶质纤维酸性蛋白),MMP3(基质金属肽酶3(基质溶素1,前明胶酶)),MAPK10(有丝分裂原激活蛋白激酶10),SP1(Sp1转录因子),MYC(v-myc骨髓细胞瘤病病毒致癌基因同源物(禽类)),CTSE(组织蛋白酶E),PPARA(过氧化物酶体增殖物激活受体α),JUN(jun致癌基因),TIMP1(TIMP金属肽酶抑制剂1),IL5(白介素5(集落刺激因子,嗜酸性粒细胞)),IL1A(白介素1,α),MMP9(基质金属肽酶9(明胶酶B,92kDa明胶酶,92kDa IV型胶原酶)),HTR4(5-羟色胺(血清素)受体4),HSPG2(硫酸乙酰肝素蛋白聚糖2),KRAS(v-Ki-ras2 Kirsten大鼠肉瘤病毒致癌基因同源物),CYCS(细胞色素c,体细胞),SMG1(SMG1同源物,磷脂酰肌醇3激酶相关激酶(秀丽隐杆线虫)),IL1R1(白介素1受体,I型),PROK1(前动力蛋白1),MAPK3(有丝分裂原激活蛋白激酶3),NTRK1(神经营养性酪氨酸激酶,受体,1型),IL13(白介素13),MME(膜金属内肽酶),TKT(转酮醇酶),CXCR2(趋化因子(C-X-C基序)受体2),IGF1R(胰岛素样生长因子1受体),RARA(视黄酸受体,α),CREBBP(CREB结合蛋白),PTGS1(前列腺素-内过氧化物合酶1(前列腺素G/H合酶和环加氧酶)),GALT(半乳糖-1-磷酸尿嘧啶转移酶),CHRM1(胆碱能受体,毒蕈碱1),ATXN1(ataxin 1),PAWR(PRKC,细胞凋亡,WT1,调控子),NOTCH2(Notch同源物2(果蝇)),M6PR(甘露糖-6-磷酸受体(阳离子依赖性)),CYP46A1(细胞色素P450,家族46,亚家族A,多肽1),CSNK1D(酪蛋白激酶1,δ),MAPK14(有丝分裂原激活的蛋白激酶14),PRG2(蛋白聚糖2,骨髓(天然杀伤细胞激活子,嗜酸性粒细胞主要碱性蛋白)),PRRKA(蛋白激酶C,α),L1 CAM(L1细胞粘附分子),CD40(CD40分子,TNF受体超家族成员5),NR1I2(核受体亚家族1,I组,成员2),JAG2(锯齿状2),CTNND1(连环蛋白(钙粘蛋白相关蛋白),δ1),CDH2(钙粘蛋白2,1型,N-钙粘蛋白(神经元)),CMA1(糜酶1,肥大细胞),SORT1(分拣蛋白1),DLK1(δ样1同源物(果蝇)),THEM4(硫酯酶超家族成员4),JUP(连接桥粒斑珠蛋白),CD46(CD46分子,补体调控蛋白),CCL11(趋化因子(C-C基序)配体11),CAV3(小窝蛋白3),RNASE3(核糖核酸酶,RNA酶A家族,3(嗜酸性粒细胞阳离子蛋白)),HSPA8(热休克70kDa蛋白8),CASP9(胱天蛋白酶9,凋亡相关半胱氨酸肽酶),CYP3A4(细胞色素P450,家族3,亚家族A,多肽4),CCR3(趋化因子(C-C基序)受体3),TFAP2A(转录因子AP-2α(激活增强子结合蛋白2α)),SCP2(固醇载体蛋白2),CDK4(细胞周期蛋白依赖性激酶4),HIF1A(缺氧诱导因子1,α亚基(碱性螺旋-环-螺旋转录因子)),TCF7L2(转录因子7-样2(T细胞特异性,HMG盒)),IL1R2(白介素1受体,II型),B3GALTL(β1,3-半乳糖基转移酶样),MDM2(Mdm2 p53结合蛋白同源物(小鼠)),RELA(v-rel网状内皮病病毒致癌基因同源物A(禽类)),CASP7(胱天蛋白酶7,凋亡相关的半胱氨酸肽酶),IDE(胰岛素降解酶),FABP4(脂肪酸结合蛋白4,脂肪细胞),CASK(钙/钙调蛋白依赖性丝氨酸蛋白激酶(MAGUK家族)),ADCYAP1R1(腺苷酸环化酶激活多肽1(垂体)I型受体),ATF4(激活转录因子4(tax响应性增强子元件B67)),PDGFA(血小板衍生的生长因子α多肽),C21或f33(21号染色体开放阅读框33),SCG5(分泌粒蛋白V(7B2蛋白)),RNF123(无名指蛋白123),NFKB1(B细胞1中κ轻多肽基因增强子的核因子),ERBB2(v-erb-b2成红细胞白血病病毒致癌基因同源物2,神经/胶质母细胞瘤衍生的致癌基因同源物(禽类),CAV1(小窝蛋白1,胞膜窖蛋白,22kDa),MMP7(基质金属肽酶7(基质溶素,子宫)),TGFA(转化生长因子,α),RXRA(类维生素A X受体,α),STX1A(突触融合蛋白1A(脑)),PSMC4(蛋白酶体(蛋白酶体,macropain)26S亚基,ATP酶,4),P2RY2(嘌呤能受体P2Y,G蛋白偶联,2),TNFRSF21(肿瘤坏死因子受体超家族,成员21),DLG1(圆盘,大同源物1(果蝇)),NUMBL(numb同源物(果蝇)样),SPN(载唾液酸蛋白),PLSCR1(磷脂加扰酶1),UBQLN2(泛素2),UBQLN1(泛素1),PCSK7(原蛋白转化酶枯草杆菌蛋白酶/kexin类型7),SPON1(spondin 1,细胞外基质蛋白),SILV(银同源物(小鼠)),QPCT(谷氨酰胺肽环转移酶),HESS(发状分裂相关增强子5(果蝇)),GCC1(包含GRIP和卷曲螺旋结构域的1),及其任何组合。
所述经遗传修饰的动物或细胞可包含1、2、3、4、5、6、7、8、9、10个或更多个编码与分泌酶病症相关蛋白质的破坏染色体序列以及0、1、2、3、4、5、6、7、8、9、10个或更多个编码与分泌酶病症相关的破坏蛋白质的染色体整合序列。
ALS
美国专利公开第20110023144号描述了锌指核酸酶用于遗传修饰与肌萎缩性侧索硬化症(ALS)疾病相关的细胞、动物和蛋白质的用途。ALS的特征为参与随意运动的大脑皮层、脑干和脊髓中的某些神经细胞逐渐稳定退化。本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与美国专利公开第20110023144号中的系统类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在优选的实施方案中,交错DSB是经由HR非依赖性机制如NHEJ修复。在一些实施方案中,靶细胞是非分裂细胞。在一个特定的实施方案中,靶细胞是运动神经元。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
运动神经元病症和与这些病症相关的蛋白质是影响患上运动神经元病症的易感性、运动神经元病症的存在、运动神经元病症的严重程度或其任何组合的一组多种蛋白质。本公开包括编码与ALS疾病、特定运动神经元病症相关的蛋白质的任何染色体序列的编辑。通常基于ALS相关蛋白与ALS的实验关联来选择与ALS相关的蛋白质。例如,相对于不具有ALS的群体,在具有ALS的群体中,与ALS相关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码蛋白质的基因的基因表达谱,来鉴定与ALS相关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。
作为非限制性实例,与ALS相关的蛋白质包括但不限于以下蛋白质:SOD1超氧化物歧化酶1,ALS3肌萎缩性侧索硬化3,SETX senataxin,ALS5肌萎缩性侧索硬化5,FUS融合在肉瘤中,ALS7肌萎缩性侧索硬化7,ALS2肌萎缩侧索DPP6二肽基肽酶6硬化2,NEFH重神经丝,PTGS1前列腺素-多肽内过氧化物合酶1,SLC1A2溶质载体家族1TNFRSF10B肿瘤坏死因子(神经胶质高亲和力受体超家族,谷氨酸转运蛋白)成员10b成员2,PRPH周围蛋白,HSP90AA1热休克蛋白90kDaα(胞质)A类成员1,GRIA2谷氨酸受体,IFNG干扰素γ亲离子性,AMPA 2S100BS100钙结合,FGF2成纤维细胞生长因子2蛋白B,AOX1醛氧化酶1,CS柠檬酸合酶,TARDBP TARDNA结合蛋白,TXN硫氧还蛋白,RAPH1 Ras关联MAP3K5有丝分裂原激活蛋白(RaIGDS/AF-6)和激酶5普利克底物蛋白(pleckstrin)同源结构域1,NBEAL1类神经管蛋白1,GPX1谷胱甘肽过氧化物酶1,ICA1L胰岛细胞自身抗原,RAC1 ras相关的C3肉毒杆菌毒素1.69kDa样毒素底物1,MAPT微管相关,ITPR2肌醇1,4,5-蛋白τ三磷酸受体2型,ALS2CR4肌萎缩侧索GLS谷氨酰胺酶硬化2(青少年)染色体区域候选物4,ALS2CR8肌萎缩侧索CNTFR睫状神经营养因子硬化2(青少年)受体染色体区域候选物8,ALS2CR11肌萎缩侧索FOLH1叶酸水解酶1硬化2(青少年)染色体区域候选物11,FAM117B具有序列P4HB脯氨酰4-羟化酶的家族相似性117成员Bβ多肽,CNTF睫状神经营养因子,SQSTM1螯合体1,STRADB STE20相关激酶NAIP NLR家族凋亡衔接子β抑制蛋白,YWHAQ酪氨酸3-SLC33A1溶质载体家族33单加氧酶/色氨酸(乙酰辅酶A转运蛋白),5-单加氧酶成员1激活蛋白,θ多肽,TRAK2转运蛋白同源物,SAC1含驱动蛋白结合2脂质磷酸酶结构域,NIF3L1 NIF3 NGG1相互作用INA互联蛋白神经元因子3样1中间丝蛋白,αPARD3B par-3分区,COX8A细胞色素c氧化酶缺陷3同源B亚基VIIIA,CDK15细胞周期蛋白依赖性激酶,HECW1含HECT、C2和WW 15结构域的E3泛素蛋白连接酶1,NOS1一氧化氮合酶1,METmet原癌基因,SOD2超氧化物歧化酶2,HSPB1热休克27kDa线粒体蛋白1,NEFL轻神经丝,CTSB组织蛋白酶B多肽,ANG血管生成素,HSPA8热休克70kDa核糖核酸酶,RNA酶A蛋白8家族,5VAPB VAMP(囊泡-ESR1雌激素受体1相关膜蛋白)相关蛋白B和C,SNCA突触核蛋白α,HGF肝细胞生长因子,CAT过氧化氢酶,ACTB肌动蛋白β,NEFM中等神经丝,TH酪氨酸羟化酶多肽,BCL2 B细胞CLL/淋巴瘤2,FAS Fas(TNF受体超家族,成员6),CASP3凋亡胱天蛋白酶3,CLU丛生蛋白相关半胱氨酸肽酶,SMN1运动神经元存活,G6PD葡萄糖-6-磷酸1端粒脱氢酶,BAXBCL2相关的X,HSF1热休克转录蛋白因子1,RNF19A无名指蛋白19A,JUN jun致癌基因,ALS2CR12肌萎缩侧索HSPA5热休克70kDa硬化2(青少年)蛋白5染色体区域候选物12,MAPK14有丝分裂原激活蛋白,IL10白介素10激酶14,APEX1 APEX核酸酶,TXNRD1硫氧还蛋白还原酶1(多功能DNA修复酶)1,NOS2一氧化氮合酶2,TIMP1 TIMP金属肽酶诱导型抑制剂1,CASP9凋亡胱天蛋白酶9,XIAP X连锁相关半胱氨酸凋亡肽酶,GLG1高尔基糖蛋白1,EPO促红细胞生成素,VEGFA血管内皮ELN弹性蛋白生长因子A,GDNF胶质细胞衍生的NFE2L2核因子(类胡萝卜素-神经营养因子2)样2,SLC6A3溶质载体家族6HSPA4热休克70kDa(神经递质4蛋白转运蛋白,多巴胺)成员3,APOE载脂蛋白E,PSMB8蛋白酶体(蛋白酶体,macropain)亚基β型8,DCTN1动力蛋白1,TIMP3 TIMP金属肽酶抑制剂3,KIFAP3与驱动蛋白相关的SLC1A1溶质载体家族1蛋白3(神经/上皮高亲和力谷氨酸转运蛋白,系统Xag)成员1,SMN2运动神经元CCNC细胞周期蛋白C 2的存活,着丝粒MPP4膜蛋白,STUB1含STIP1同源性和U-棕榈酰化的4盒蛋白1,ALS2淀粉样蛋白β(A4),PRDX6过氧化物酶6前体蛋白,SYP突触素,CABIN1钙调神经磷酸酶结合蛋白1,CASP1凋亡胱天蛋白酶1,GART磷酸核糖甘氨酰胺相关的半胱氨酸甲酰基转移酶、肽酶磷酸核糖基甘氨酰胺合酶、磷酸核糖氨基咪唑合酶,CDK5细胞周期蛋白依赖性激酶5,ATXN3 ataxin 3,RTN4网织蛋白4,C1QB补体成分1q亚组分B链,VEGFC神经生长因子,HTT亨廷顿蛋白受体,PARK7帕金森氏病7,XDH黄嘌呤脱氢酶,GFAP胶质原纤维酸性,MAP2微管相关蛋白2,CYCS体细胞细胞色素c,FCGR3B IgG的Fc片段低亲和力IIIb,CCS铜伴侣蛋白,UBL5泛素样5超氧化物歧化酶,MMP9基质金属肽酶,SLC18A3溶质载体家族18 9((囊泡乙酰胆碱)成员3,TRPM7瞬时受体HSPB2热休克27kDa潜在阳离子通道蛋白2亚家族M成员7,AKT1 v-akt鼠类胸腺瘤,DERL1 Der1样结构域家族病毒致癌基因同源物1成员1,CCL2趋化因子(C--C基序),NGRN neugrin,神经突配体2增长相关的GSR谷胱甘肽还原酶,TPPP3微管蛋白聚合促进蛋白家族成员3,APAF1凋亡肽酶,BTBD10含BTB(POZ)结构域激活因子1的10,GLUD1谷氨酸,CXCR4趋化因子(C--X--C基序)脱氢酶1受体4,SLC1A3溶质载体家族1,FLT1 fms相关酪氨酸(神经胶质高亲和力谷氨酸转运蛋白)成员3激酶1,PON1对氧磷酶1,AR雄激素受体,LIF白血病抑制因子,ERBB3 v-erb-b2成红细胞白血病病毒致癌基因同源物3,LGALS1半乳糖苷凝集素,CD44 CD44分子结合可溶1,TP53肿瘤蛋白p53,TLR3 toll样受体3,GRIA1谷氨酸受体,GAPDH甘油醛-3-嗜离子性,AMPA 1磷酸脱氢酶,GRIK1 DES结蛋白嗜离子性谷氨酸受体红藻氨酸1,CHAT胆碱乙酰基转移酶,FLT4 fms相关酪氨酸激酶4,CHMP2B染色质修饰BAG1 BCL2相关蛋白2B永生基因,MT3金属硫蛋白3,CHRNA4烟碱酸胆碱能受体α4,GSS谷胱甘肽合酶,BAK1 BCL2-拮抗剂/杀手1,KDR激酶插入结构域,GSTP1谷胱甘肽S-转移酶受体(III型π1受体酪氨酸激酶),OGG1 8-氧鸟嘌呤DNA,IL6白介素6(干扰素,糖基化酶β2)。
所述动物或细胞可包含1、2、3、4、5、6、7、8、9、10个或更多个编码与ALS相关的蛋白质的破坏染色体序列以及0、1、2、3、4、5、6、7、8、9、10个或更多个编码与ALS相关的破坏蛋白质的染色体整合序列。优选的与ALS相关的蛋白质包括SOD1(超氧化物歧化酶1),ALS2(肌萎缩性侧索硬化2),FUS(融合在肉瘤中),TARDBP(TAR DNA结合蛋白),VAGFA(血管内皮生长因子A),VAGFB(血管内皮生长因子B)和VAGFC(血管内皮生长因子C)及其任何组合。
孤独症
美国专利公开第20110023145号描述了锌指核酸酶用于遗传修饰与自闭症谱系障碍(ASD)相关的细胞、动物和蛋白质的用途。自闭症谱系障碍(ASD)是一类以社交互动和交流中的定性损伤以及行为、兴趣和活动的受限重复性和刻板模式为特征的病症。自闭症、阿斯伯格综合征(AS)和未另外说明的普遍性发育障碍(PDD-NOS)这三种病症是具有不同程度的严重程度、相关的智力功能和医学状况的一系列相同病症。ASD是主要由遗传决定的病症,遗传率为约90%。
美国专利公开第20110023145号包括可被应用于本发明的CRISPR Cas系统的编码与ASD相关的蛋白质的任何染色体序列的编辑。通常基于与ASD相关的蛋白质与ASD发生率或适应症的实验关联来选择与ASD相关的蛋白质。例如,相对于缺乏ASD的群体,在具有ASD的群体中,与ASD相关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码所述蛋白质的基因的基因表达谱来鉴定与ASD相关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与美国专利公开第20110023145号中的系统类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
可能和与ASD相关的蛋白质有关的疾病状态或病症的非限制性实例包括自闭症,阿斯伯格综合征(AS),未另外说明的普遍性发育障碍(PDD-NOS),雷特氏综合征(Rett'ssyndrome),结节性硬化症,苯丙酮尿症,Smith-Lemli-Opitz综合征和脆性X综合征。作为非限制性实例,与ASD相关的蛋白质包括但不限于以下蛋白质:ATP10C氨基磷脂-MET MET受体转运ATP酶酪氨酸激酶(ATP10C),BZRAP1 MGLUR5(GRM5)代谢型谷氨酸受体5(MGLUR5),CDH10钙粘蛋白-10,MGLUR6(GRM6)代谢型谷氨酸受体6(MGLUR6),CDH9钙粘蛋白-9,NLGN1神经连接蛋白-1,CNTN4接触蛋白-4,NLGN2神经连接蛋白-2,CNTNAP2接触蛋白相关的SEMA5A神经连接蛋白-3蛋白样2(CNTNAP2),DHCR7 7-去氢胆固醇,NLGN4X神经连接蛋白-4X-还原酶(DHCR7)连接的DOC2A双C2样结构域,NLGN4Y含神经连接蛋白-4Y蛋白的α连接的DPP6二肽基,NLGN5神经连接蛋白-5氨基肽酶样蛋白6,EN2 engrailed 2(EN2),NRCAM神经元细胞粘附分子(NRCAM),MDGA2脆性X智力低下NRXN1神经毒素-1 1(MDGA2),FMR2(AFF2)AF4/FMR2家族成员2,OR4M2嗅觉受体(AFF2)4M2,FOXP2叉头盒蛋白P2,OR4N4嗅觉受体(FOXP2)4N4,FXR1脆性X智力OXTR催产素受体低下常染色体(OXTR)同源物1(FXR1),FXR2脆性X智力PAH苯丙氨酸低下常染色体羟化酶(PAH)同源物2(FXR2),GABRA1γ-氨基丁酸PTEN磷酸酶和受体亚基α-1张力蛋白同源物(GABRA1)(PTEN),GABRA5 GABAA(γ-氨基丁酸PTPRZ1受体型酸)受体α5酪氨酸蛋白亚基(GABRA5)磷酸酶ζ(PTPRZ1),GABRB1γ-氨基丁酸RELN Reelin受体亚基β-1(GABRB1),GABRB3 GABAA(γ-氨基丁酸RPL10 60S核糖体酸)受体β3亚基蛋白L10(GABRB3),GABRG1γ-氨基丁酸SEMA5A脑信号蛋白-5A受体亚基γ-1(SEMA5A)(GABRG1),HIRIP3 HIRA相互作用蛋白3,SEZ6L2发作相关的6同源物(小鼠)样2,HOXA1同源盒蛋白Hox-A1,SHANK3SH3和多个(HOXA1)锚蛋白重复结构域3(SHANK3),IL6白介素-6,SHBZRAP1 SH3和多个锚蛋白重复结构域3(SHBZRAP1),LAMB1层粘连蛋白亚基β-1,SLC6A4血清素转运蛋白(LAMB1)转运蛋白(SERT),MAPK3有丝分裂原激活的蛋白,TAS2R1味觉受体激酶3 2型成员1,TAS2R1MAZ Myc相关的锌指TSC1结节性硬化蛋白蛋白1,MDGA2含MAM结构域的TSC2结节性硬化糖基磷脂酰肌醇蛋白2锚2(MDGA2),MECP2甲基CpG结合UBE3A泛素蛋白2(MECP2)连接酶E3A(UBE3A)MECP2甲基CpG结合WNT2无翼型蛋白2(MECP2)MMTV整合位点家族成员2(WNT2)。
其染色体序列被编辑的与ASD相关的蛋白质的身份可以并且将会改变。在优选的实施方案中,其染色体序列被编辑的与ASD相关的蛋白质可以是由BZRAP1基因编码的苯并二氮杂卓受体(外围)相关蛋白1(BZRAP1),由AFF2基因编码的AF4/FMR2家族成员2蛋白(AFF2)(也称为MFR2),由FXR1基因编码的脆性X智力低下常染色体同源物1蛋白(FXR1),由FXR2基因编码的脆性X智力低下常染色体同源物2蛋白(FXR2),由MDGA2基因编码的包含MAM结构域的糖基磷脂酰肌醇锚2蛋白(MDGA2),由MECP2基因编码的甲基CpG结合蛋白2(MECP2),由MGLUR5-1基因编码的代谢型谷氨酸受体5(MGLUR5)(也称为GRM5),由NRXN1基因编码的轴突蛋白1蛋白,或由SEMA5A基因编码的脑信号蛋白-5A蛋白(SEMA5A)。在一个示例性的实施方案中,基因修饰的动物是大鼠,并且编码与ASD相关的蛋白质的经编辑的染色体序列如下所列:BZRAP1苯二氮杂卓受体XM_002727789,(外围)相关的XM_213427,蛋白质1(BZRAP1)XM_002724533,XM_001081125AFF2(FMR2)AF4/FMR2家族成员2XM_219832,(AFF2)XM_001054673FXR1脆性X智力NM_001012179低下,常染色体同源物1(FXR1)FXR2脆性X智力NM_001100647低下,常染色体同源物2(FXR2),MDGA2含MAM结构域的NM_199269糖基膦酰肌醇锚2(MDGA2),MECP2甲基CpG结合NM_022673蛋白2(MECP2),MGLUR5代谢型谷氨酸NM_017012(GRM5)受体5(MGLUR5),NRXN1轴突蛋白-1NM_021767,SEMA5A脑信号蛋白-5A(SEMA5A)NM_001107659。
三核苷酸重复扩增病症
美国专利公开第20110016540号描述了锌指核酸酶在遗传修饰与三核苷酸重复扩增病症相关的细胞、动物和蛋白质中的用途。三核苷酸重复扩增病症是复杂的进行性病症,其涉及发育神经生物学并且通常会影响认知以及感觉运动功能。本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与美国专利公开第20110016540号中的系统类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
三核苷酸重复扩增蛋白是与患上三核苷酸重复扩增病症的易感性、三核苷酸重复扩增病症的存在、三核苷酸重复扩增病症的严重程度或其任何组合相关的多种蛋白质。三核苷酸重复序列扩增病症分为两类,由重复序列类型决定。最常见的重复序列是三联体CAG,当存在于基因的编码区中时,它编码氨基酸谷氨酰胺(Q)。因此,这些病症被称为多聚谷氨酰胺(polyQ)病症并且包括以下疾病:亨廷顿病(HD);脊髓球肌萎缩症(SBMA);脊髓小脑共济失调(SCA类型1、2、3、6、7和17);和Dentatorubro-Pallidoluysian萎缩症(DRPLA)。其余的三核苷酸重复扩增病症不涉及CAG三联体,或者CAG三联体不在基因的编码区中,因此被称为非多聚谷氨酰胺病症。非多聚谷氨酰胺病症包括脆性X综合征(FRAXA);脆性XE智力低下(FRAXE);Friedreich共济失调(FRDA);强直性肌营养不良(DM);和小脑共济失调(SCA类型8和12)。
通常基于与三核苷酸重复扩增病症相关的蛋白质与三核苷酸重复扩增病症的实验关联来选择与三核苷酸重复扩增病症相关的蛋白质。例如,相对于缺乏三核苷酸重复扩增病症的群体,在具有三核苷酸重复扩增病症的群体中,与三核苷酸重复扩增病症相关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码所述蛋白质的基因的基因表达谱来鉴定与三核苷酸重复扩增病症相关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。
与三核苷酸重复扩增病症相关的蛋白质的非限制性实例包括AR(雄激素受体),FMR1(脆性X智力低下1),HTT(亨廷顿蛋白),DMPK(营养不良性肌强直蛋白激酶),FXN(frataxin),ATXN2(ataxin 2),ATN1(肌萎缩蛋白1),FEN1(flap结构特异性核酸内切酶1),TNRC6A(包含三核苷酸重复序列的6A),PABPN1(聚(A)结合蛋白,核1),JPH3(亲联蛋白3),MED15(介体复合物亚基15),ATXN1(ataxin 1),ATXN3(ataxin 3),TBP(TATA盒结合蛋白),CACNA1A(钙通道,电压依赖性,P/Q型,α1A亚基),ATXN80S(ATXN8相反链(非蛋白编码)),PPP2R2B(蛋白磷酸酶2,调节亚基B,β),ATXN7(ataxin 7),TNRC6B(含三核苷酸重复序列的6B),TNRC6C(含三核苷酸重复序列的6C),CELF3(CUGBP,Elav样家族成员3),MAB21L1(mab-21-样1(秀丽隐杆线虫)),MSH2(mutS同源物2,结肠癌,非息肉病1型(大肠杆菌)),TMEM185A(跨膜蛋白185A),SIX5(SIX同源盒5),CNPY3(canopy 3同源物(斑马鱼)),FRAXE(脆性位点,叶酸类型,稀有,fra(X)(q28)E),GNB2(鸟嘌呤核苷酸结合蛋白(G蛋白),β多肽2),RPL14(核糖体蛋白L14),ATXN8(ataxin 8),INSR(胰岛素受体),TTR(转甲状腺素蛋白),EP400(E1A结合蛋白p400),GIGYF2(与GRB10相互作用的GYF蛋白2),OGG1(8-氧代鸟嘌呤DNA糖基化酶),STC1(斯钙素1),CNDP1(肌肽二肽酶1(金属肽酶M20家族)),C10orf2(染色体10开放阅读框2),MAML3主导控制样3(果蝇),DKC1(先天性角化不良1,角化不良蛋白),PAXIP1(PAX相互作用(与转录激活结构域)蛋白1),CASK(钙/钙调蛋白依赖性丝氨酸蛋白激酶(MAGUK家族)),MAPT(微管相关蛋白τ),SP1(Sp1转录因子),POLG(聚合酶(DNA定向),γ),AFF2(AF4/FMR2家族,成员2),THBS1(血小板反应蛋白1),TP53(肿瘤蛋白p53),ESR1(雌激素受体1),CGGBP1(CGG三联体重复结合蛋白1),ABT1(基础转录激活子1),KLK3(激肽释放酶相关肽酶3),PRNP(朊病毒蛋白),JUN(jun致癌基因),KCNN3(钾中间体/小电导钙激活通道,亚家族N,成员3),BAX(与BCL2相关的X蛋白),FRAXA(脆性位点,叶酸类型,稀有,fra(X)(q27.3)A(大兰花病,智力低下)),KBTBD10(含kelch重复序列和BTB(POZ)结构域的10),MBNL1(肌盲样(果蝇)),RAD51(RAD51同源物(RecA同源物,大肠杆菌)(酿酒酵母)),NCOA3(核受体共激活子3),ERDA1(扩展重复结构域,CAG/CTG 1),TSC1(结节性硬化症1),COMP(软骨寡聚基质蛋白),GCLC(谷氨酸-半胱氨酸连接酶,催化亚基),RRAD(与糖尿病相关的Ras相关),MSH3(mutS同源物3(大肠杆菌)),DRD2(多巴胺受体D2),CD44(CD44分子(印度血型)),CTCF(CCCTC结合因子(锌指蛋白)),CCND1(细胞周期蛋白D1),CLSPN(claspin同源物(非洲爪蟾(Xenopuslaevis))),MEF2A(肌细胞增强因子2A),PTPRU(蛋白酪氨酸磷酸酶,受体类型,U),GAPDH(甘油醛-3-磷酸脱氢酶),TRIM22(含三重基序的22),WT1(Wilms肿瘤1),AHR(芳烃受体),GPX1(谷胱甘肽过氧化物酶1),TPMT(硫嘌呤S-甲基转移酶),NDP(Norrie病(假神经胶质瘤)),ARX(无芒相关同源盒),MUS81(MUS81核酸内切酶同源物(酿酒酵母)),TYR(酪氨酸酶(眼皮肤白化病IA)),EGR1(早期生长反应1),UNG(尿嘧啶-DNA糖基化酶),NUMBL(numb同源物(果蝇)样),FABP2(脂肪酸结合蛋白2,肠),EN2(engrailed同源盒2),CRYGC(结晶蛋白,γC),SRP14(信号识别粒子14kDa(同源Alu RNA结合蛋白)),CRYGB(结晶蛋白,γB),PDCD1(程序性细胞死亡1),HOXA1(同源盒A1),ATXN2L(ataxin 2样),PMS2(PMS2减数分裂后分离增加2(酿酒酵母)),GLA(半乳糖苷酶,α),CBL(Cas-Br-M(鼠类)亲嗜性逆转录病毒转化序列),FTH1(铁蛋白,重多肽1),IL12RB2(白介素12受体,β2),OTX2(邻牙本质同源盒2),HOXA5(同源盒A5),POLG2(聚合酶(DNA定向),γ2,辅助亚基),DLX2(无远端同源盒2),SIRPA(信号调控蛋白α),OTX1(邻牙本质同源盒1),AHRR(芳基烃受体阻遏子),MANF(中脑星形胶质细胞衍生的神经营养因子),TMEM158(跨膜蛋白158(基因/假基因))和ENSG00000078687。
优选的与三核苷酸重复扩增病症相关的蛋白质包括HTT(亨廷顿蛋白)、AR(雄激素受体)、FXN(frataxin)、Atxn3(ataxin)、Atxn1(ataxin)、Atxn2(ataxin)、Atxn7(ataxin)、Atxn10(ataxin)、DMPK(营养不良性肌强直蛋白激酶)、Atn1(肌萎缩蛋白1)、CBP(creb结合蛋白)、VLDLR(极低密度脂蛋白受体)及其任何组合。
治疗听力疾病
本发明还预期将CRISPR-Cas系统递送至一只或两只耳朵。
研究人员正在研究是否可使用基因疗法来辅助目前的耳聋治疗,即耳蜗植入物。耳聋通常是由于无法将信号传递到听觉神经元的毛细胞丧失或损坏引起的。在这些情况下,耳蜗植入物可用于响应声音并将电信号传输到神经细胞。但是,由于受损的毛细胞释放出的生长因子较少,因此这些神经元通常会退化并从耳蜗回缩。
美国专利申请20120328580描述了例如通过使用注射器(例如单剂量注射器)将药物组合物注射入耳内(例如耳廓施用),例如注射入耳蜗的内腔(例如,中阶、前庭阶和鼓阶)。例如,本文所述的一种或多种化合物可通过鼓室内注射(例如至中耳)和/或注射至外耳、中耳和/或内耳来施用。这样的方法在本领域中是常规使用的,例如,用于将类固醇和抗生素施用于人耳。注射可例如通过耳圆窗或通过耳蜗胶囊进行。其他内耳施用方法在本领域中是已知的(参见例如Salt和Plontke,Drug Discovery Today,10:1299-1306,2005)。
在另一种施用模式中,药物组合物可经由导管或泵原位施用。导管或泵可例如将药物组合物引导到耳蜗内腔或耳圆窗和/或结肠内腔中。McKenna等人(美国公开第2006/0030837号)和Jacobsen等人(美国专利第7,206,639号)描述了适合于将本文所述的一种或多种化合物施用于耳(例如人耳)的示例性药物递送装置和方法。在一些实施方案中,可在外科手术过程中将导管或泵定位在例如患者的耳(例如,外耳、中耳和/或内耳)中。在一些实施方案中,可将导管或泵定位在例如患者的耳(例如,外耳、中耳和/或内耳)中,而不需要外科手术。
可替代地或另外地,本文所述的一种或多种化合物可与佩戴在外耳中的机械装置例如耳蜗植入物或助听器组合施用。Edge等人(美国公开第2007/0093878号)描述了适用于本发明的示例性耳蜗植入物。
在一些实施方案中,上述施用模式可以任何顺序组合并且可同时或散布。
可替代地或另外地,本发明可根据食品和药物管理局批准的任何方法来施用,例如,如CDER数据标准手册,版本号004(其可在fda.give/cder/dsm/DRG/drg00301.htm获得)中所述。
通常,在美国专利申请20120328580中描述的细胞治疗方法可用于在体外促进细胞至或向内耳的成熟细胞类型(例如毛细胞)的完全或部分分化。然后可将由这种方法得到的细胞移植或植入需要这种治疗的患者中。下文描述了实践这些方法所需的细胞培养方法,包括鉴定和选择合适细胞类型的方法,促进所选细胞的完全或部分分化的方法,鉴定完全或部分分化的细胞类型的方法,以及植入完全或部分分化的细胞的方法。
适用于本发明的细胞包括但不限于能够完全或部分分化为内耳成熟细胞的细胞,例如毛细胞(例如内和/或外毛细胞),例如当与例如本文所述的一种或多种化合物体外接触时。能够分化为毛细胞的示例性细胞包括但不限于干细胞(例如,内耳干细胞、成年干细胞、骨髓源干细胞、胚胎干细胞、间充质干细胞、皮肤干细胞、iPS细胞和脂肪衍生的干细胞),祖细胞(例如内耳祖细胞),支持细胞(例如Deiters细胞、支柱细胞、内指骨细胞、顶盖细胞和Hensen细胞)和/或生殖细胞。Li等人(美国公开第2005/0287127号)和Li等人(美国专利系列号11/953,797)描述了使用干细胞代替内耳感觉细胞。使用骨髓源干细胞代替内耳感觉细胞描述于Edge等人,PCT/US2007/084654中。iPS细胞描述于例如Takahashi等人,Cell,第131卷,第5期,第861-872页(2007);Takahashi和Yamanaka,Cell 126,663-76(2006);Okita等人,Nature 448,260-262(2007);Yu,J.等人,Science 318(5858):1917-1920(2007);Nakagawa等人,Nat.Biotechnol.26:101-106(2008);以及Zaehres和Scholer,Cell 131(5):834-835(2007)。可通过分析(例如,定性或定量)一种或多种组织特异性基因的存在来鉴定此类合适的细胞。例如,可通过检测一种或多种组织特异性基因的蛋白质产物来检测基因表达。蛋白质检测技术涉及使用针对适当抗原的抗体对蛋白质染色(例如,使用细胞提取物或全细胞)。在这种情况下,适当的抗原是组织特异性基因表达的蛋白质产物。尽管原则上可标记第一抗体(即与抗原结合的抗体),但更常见(并改善可视化)的是使用针对第一抗体的第二抗体(例如抗IgG)。将该第二抗体与荧光染料或用于比色反应的适当酶或金珠(用于电子显微镜)或生物素-抗生物素蛋白系统缀合,以便可识别初级抗体的位置,从而识别抗原。
本发明的CRISPR Cas分子可通过将药物组合物直接施用于外耳而递送至耳部,所述组合物由美国公开申请20110142917改进。在一些实施方案中,将药物组合物施用于耳道。递送至耳部也可称为听觉或视觉递送。
本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与上文讨论的专利公开中类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
在一些实施方案中,本发明的RNA分子以脂质体或lipofectin制剂等形式递送,并且可通过本领域技术人员众所周知的方法制备。这些方法描述于例如美国专利第5,593,972号、第5,589,466号和第5,580,859号,所述文件通过引用并入本文。
已经开发了专门针对增强和改善siRNA进入哺乳动物细胞的递送的递送系统(参见例如Shen等人,FEBS Let.2003,539:111-114;Xia等人,Nat.Biotech.2002,20:1006-1010;Reich等人,Mol.Vision.2003,9:210-216;Sorensen等人,J.Mol.Biol.2003,327:761-766;Lewis等人,Nat.Gen.2002,32:107-108;以及Simeoni等人,NAR 2003,31,11:2717-2724)并且可应用于本发明。siRNA最近已成功地用于抑制灵长类动物中的基因表达(参见例如Tolentino等人,Retina 24(4):660,其也可应用于本发明。
Qi等人公开了通过新颖的蛋白质递送技术通过完整圆窗有效地将siRNA转染到内耳的方法,所述蛋白质递送技术可应用于本发明的核酸靶向系统(参见例如Qi等人,GeneTherapy(2013),1-9)。特别是,可通过完整圆窗渗透将Cy3标记的siRNA转染到内耳细胞(包括内和外毛细胞、壶腹嵴、椭圆囊斑和球囊斑)中的TAT双链RNA结合结构域(TAT-DRBD)成功地用于体内递送双链siRNA以治疗各种内耳疾病和保持听力功能。可考虑将约40μl的10mMRNA作为施用于耳朵的剂量。
根据Rejali等人(Hear Res.2007年6月;228(1-2):180-7),可通过很好地保留螺旋神经节神经元来改善耳蜗植入物功能,螺旋神经节神经元是植入物的电刺激靶标并且脑源性神经营养因子(BDNF)先前已被证明可增强实验性致聋耳中的螺旋神经节的存活率。Rejali等人测试了耳蜗植入物电极的改良设计,其中包括由带有BDNF基因插入物的病毒载体转导的成纤维细胞涂层。为了完成这种类型的离体基因转移,Rejali等人用带有BDNF基因盒插入物的腺病毒转导豚鼠成纤维细胞,并确定这些细胞分泌BDNF并且然后经由琼脂糖凝胶将BDNF分泌细胞附接到耳蜗植入物电极,并将所述电极植入鼓阶中。Rejali等人确定,与对照电极相比,BDNF表达电极在植入48天后能够在耳蜗底转中保留显著更多的螺旋神经节神经元,并证明了将耳蜗植入疗法与离体基因转移结合以增强螺旋神经节神经元存活的可行性。这样的系统可应用于本发明的核酸靶向系统以递送至耳朵。
Mukherjea等人(Antioxidants&Redox Signaling,第13卷,第5期,2010)记录了使用短干扰(si)RNA敲低NOX3消除了顺铂的耳毒性,如通过保护OHC免受损害和降低听觉脑干反应(ABR)阈值变化来证明。向大鼠施用不同剂量的siNOX3(0.3、0.6和0.9μg),并通过实时RT-PCR评价NOX3的表达。与经鼓室施用加扰的siRNA或未经处理的耳蜗相比,使用的最低剂量的NOX3 siRNA(0.3μg)没有显示出对NOX3 mRNA的任何抑制作用。但是,与对照加扰的siRNA相比,更高剂量的NOX3 siRNA(0.6和0.9μg)的施用降低了NOX3表达。这样的系统可以供施用于人类的约2mg至约4mg的CRISPR Cas的剂量应用于本发明的CRISPR Cas系统以经鼓室施用。
Jung等人(Molecular Therapy,第21卷第4期,834-841,2013年4月)证明,在应用siRNA后,椭圆囊中的Hes5水平下降,并且这些椭圆囊中的毛细胞数量明显多于对照治疗。数据表明,siRNA技术可用于诱导内耳的修复和再生,并且Notch信号通路是特定基因表达抑制的潜在有用靶标。Jung等人将通过将无菌生理盐水添加至冻干的siRNA制备的2μl体积的8μg Hes5siRNA注射到耳朵的前庭上皮。这样的系统可以供施用于人类的约1至约30mg的CRISPR Cas的剂量应用于本发明的核酸靶向系统以施用于耳朵的前庭上皮。本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与上述专利公开类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
非分裂细胞(神经元和肌肉)中的基因靶向
非分裂(尤其是非分裂、完全分化)的细胞类型为基因靶向或基因组工程带来了问题,例如,因为同源重组(HR)通常在G1细胞周期阶段受到抑制。但是,在研究细胞控制正常DNA修复系统的机制时,Durocher发现了一个以前未知的开关,该开关使HR在非分裂细胞中保持“关闭”状态,并设计了一种策略来重新打开该开关。Orthwein等人(Daniel Durocher实验室,Mount Sinai Hospital,Ottawa,Canada)最近报道(Nature 16142,在线出版于2015年12月9日)显示,可解除对HR的抑制作用,并且在肾脏(293T)和骨肉瘤(U2OS)细胞中成功完成了基因靶向。已知肿瘤抑制因子BRCA1、PALB2和BRAC2可通过HR促进DNA DSB修复。他们发现,BRCA1与PALB2-BRAC2的复合物的形成受PALB2上一个泛素位点的控制,从而使E3泛素连接酶对该位点起作用。这种E3泛素连接酶由KEAP1(与PALB2相互作用的蛋白)与cullin-3(CUL3)-RBX1的复合物组成。PALB2泛素化会抑制其与BRCA1的相互作用,并被去泛素化酶USP11抵消,后者本身受细胞周期控制。BRCA1-PALB2相互作用的恢复与DNA末端切除的激活相结合足以在G1中诱导同源重组,如通过多种方法所测量,所述方法包括针对USP11或KEAP1的基于CRISPR-Cas9的基因靶向测定法(已从pX459载体表达)。但是,当使用KEAP1耗尽或PALB2-KR突变体的表达在具有切除能力的G1细胞中恢复BRCA1-PALB2相互作用时,检测到基因靶向事件的稳健增加。
因此,在一些实施方案中,优选细胞中HR的再活化,特别是非分裂、完全分化的细胞类型。在一些实施方案中,在一些实施方案中优选促进BRCA1-PALB2相互作用。在一些实施方案中,靶细胞是非分裂细胞。在一些实施方案中,靶细胞是神经元或肌肉细胞。在一些实施方案中,靶细胞在体内被靶向。在一些实施方案中,细胞在G1中并且HR被抑制。在一些实施方案中,优选使用KEAP1耗尽,例如抑制KEAP1活性的表达。可通过siRNA来实现KEAP1耗尽,例如如Orthwein等人中所示。或者,优选PALB2-KR突变体的表达(在BRCA1相互作用结构域中缺少所有八个Lys残基),无论是与KEAP1耗尽结合还是单独表达。PALB2-KR与BRCA1相互作用都与细胞周期位置无关。因此,在一些实施方案中优选促进或恢复BRCA1-PALB2相互作用,尤其是在G1细胞中,尤其是在靶细胞是非分裂的,或者在去除和恢复(离体基因靶向)有问题的情况下,例如神经元或肌肉细胞。KEAP1 siRNA可获自ThermoFischer。在一些实施方案中,可将BRCA1-PALB2复合物递送至G1细胞。在一些实施方案中,可例如通过增加去泛素化酶USP11的表达来促进PALB2去泛素化,因此可设想可提供构建体以促进或上调去泛素化酶USP11的表达或活性。
治疗眼部疾病
本发明还预期将CRISPR-Cas系统递送至一只或两只眼睛。
在本发明的特定实施方案中,CRISPR-Cas系统可用于校正由若干遗传突变引起的眼缺陷,所述遗传突变进一步描述于Genetic Diseases of the Eye,第二版,由EliasI.Traboulsi编辑,Oxford University Press,2012中。
在一些实施方案中,待治疗或靶向的疾患是眼部病症。在一些实施方案中,所述眼部病症可包括青光眼。在一些实施方案中,所述眼部病症包括视网膜退行性疾病。在一些实施方案中,所述视网膜退行性疾病选自Stargardt病、Bardet-Biedl综合征、Best病、蓝锥单色症(Blue Cone Monochromacy)、脉络膜炎、视锥视杆营养不良、先天性静止性夜盲症、增强S锥体综合征、青少年X连锁视网膜劈裂症、莱伯先天性黑蒙、Malattia Leventinesse、Norrie病或X连锁家族性渗出性玻璃体视网膜病、Pattern营养不良、Sorsby营养不良、Usher综合征、色素性视网膜炎、色盲或黄斑营养不良或变性、色素性视网膜炎、色盲和年龄相关性黄斑变性。在一些实施方案中,视网膜退行性疾病是莱伯先天性黑蒙(LCA)或色素性视网膜炎。在一些实施方案中,CRISPR系统任选地经由玻璃体内注射或视网膜下注射被递送至眼睛。
对于向眼睛施用,特别优选慢病毒载体,特别是马传染性贫血病毒(EIAV)。
在另一个实施方案中,还考虑了基于马传染性贫血病毒(EIAV)的最小的非灵长类慢病毒载体,特别是用于眼基因疗法(参见例如Balagaan,J Gene Med2006;8:275-285,在线出版于2005年11月21日,Wiley InterScience(www.interscience.wiley.com).DOI:10.1002/jgm.845)。预期载体具有驱动靶基因表达的巨细胞病毒(CMV)启动子。前房内注射、视网膜下注射、眼内注射和玻璃体内注射都可考虑(参见例如Balagaan,J Gene Med2006;8:275-285,2005年11月21日,在线出版于Wiley InterScience(www.interscience.wiley.com).DOI:10.1002/jgm.845)。眼内注射可在手术显微镜的帮助下进行。对于视网膜下和玻璃体内注射,可通过轻柔的数字化压力使眼睛脱垂,并使用由一滴耦合介质溶液滴在角膜上的隐形眼镜系统使眼底可视化,所述角膜上覆盖有玻璃显微镜载玻片盖玻片。对于视网膜下注射,安装在5-μl Hamilton注射器上的10mm 34号针的尖端可在直视下通过赤道上巩膜切向向后极前进,直到在视网膜下空间可见针孔。然后,可注射2μl的载体悬浮液以产生上方泡状视网膜脱离,从而确认视网膜下载体施用。这种方法产生了自动密封硬化,通常在手术后48小时内,载体悬浮液会保留在视网膜下空间中,直到被RPE吸收为止。可在下半球重复此过程,以产生下视网膜脱离。该技术导致约70%的神经感觉视网膜和RPE暴露于载体悬浮液。对于玻璃体内注射,可将针尖穿过巩膜推进至角膜巩膜缘后1mm,并将2μl载体悬浮液注射到玻璃体腔中。对于前房内注射,针尖可通过角膜巩膜角膜缘穿刺术前进,直接朝向角膜中央,并且可注射2μl载体悬浮液。对于前房内注射,针尖可通过角膜巩膜角膜缘穿刺术前进,直接朝向角膜中央,并且可注射2μl载体悬浮液。这些载体可以1.0-1.4×1010或1.0-1.4×109转导单位(TU)/ml的滴度注射。
在另一个实施方案中,还考虑了基于马传染性贫血病毒的慢病毒基因治疗载体
在另一个实施方案中,可考虑缺失E1、部分E3、E4的腺病毒载体以递送至眼睛。对28名晚期新血管性年龄相关性黄斑变性(AMD)患者给予表达人色素上皮衍生因子(AdPEDF.ll)的缺失E1、部分E3、E4的腺病毒载体的玻璃体内单次注射(参见例如Campochiaro等人,Human Gene Therapy 17:167-176(2006年2月))。研究了范围从106至109.5粒子单位(PU)的剂量,并且不存在与AdPEDF.II相关的严重不良事件和剂量限制性毒性(参见例如Campochiaro等人,Human Gene Therapy 17:167-176(2006年2月))。腺病毒载体介导的眼基因转移似乎是治疗眼部病症治疗的可行方法并且可应用于CRISPR Cas系统。
在另一个实施方案中,RXi Pharmaceuticals的
Millington-Ward等人(Molecular Therapy,第19卷第4期,642-649,2011年4月)描述了腺相关病毒(AAV)载体,该载体可递送基于RNA干扰(RNAi)的视紫红质抑制因子和经密码子修饰的视紫红质替代基因,其抵抗由于在RNAi靶位点简并位置上的核苷酸改变的抑制作用。Millington-Ward等人将6.0×108vp或1.8×1010vp AAV的注射液注入经视网膜下注射到眼睛中。可将Millington-Ward等人的AAV载体应用于本发明的CRISPR Cas系统,考虑施用于人类的约2×1011至约6×1013vp的剂量。
Dalkara等人(Sci Transl Med 5,189ra76(2013))还涉及体内定向进化以形成一种AAV载体,该载体在向眼睛的玻璃体液中无害注射后,可在整个视网膜中递送野生型的缺陷基因。Dalkara描述了7mer肽展示文库和由来自AAV1、2、4、5、6、8和9的cap基因的DNA改组构建的AAV文库。包装了在CAG或Rho启动子下表达GFP的rcAAV文库和rAAV载体并且通过定量PCR获得抗脱氧核糖核酸酶的基因组滴度。合并文库,并进行两轮进化,每轮由初始文库多样化和接着三个体内选择步骤组成。在每个这样的步骤中,向P30 rho-GFP小鼠玻璃体内注射2ml碘克沙醇纯化的磷酸盐缓冲液(PBS)透析的文库,其基因组滴度为约1×1012vg/ml。Dalkara等人的AAV载体可应用于本发明的核酸靶向系统,考虑施用于人类的约1×1015至约1×1016vg/ml的剂量。
在一个特定的实施方案中,视紫红质基因可被靶向用于治疗色素性视网膜炎(RP),其中转让给Sangamo BioSciences公司的美国专利公开第20120204282号的系统可根据本发明的CRISPR Cas系统进行修饰。在另一个实施方案中,转让给Cellectis的美国专利公开第20130183282号的方法,其涉及从人视紫红质基因切割靶序列的方法,也可被修改为本发明的核酸靶向系统。在另一个实施方案中,转让给Editas Medicine的美国公开第20150252358号的方法,其涉及用于治疗莱伯先天性黑蒙10(Lca10)的CRISPR-Cas相关方法和组合物,也可被修改为本发明的核酸靶向系统。
在另一个实施方案中,转让给Editas Medicine的美国专利公开第20170073674号的方法,其涉及用于治疗usher综合征和色素性视网膜炎的CRISPR-Cas相关方法和组合物,也可被修改为本发明的核酸靶向系统。
在一些实施方案中,所述CRISPR蛋白是C2c1,并且所述系统包含:I.CRISPR-Cas系统RNA多核苷酸序列,其中所述多核苷酸序列包含:(a)tracr RNA多核苷酸和能够与靶序列杂交的指导RNA多核苷酸,和(b)正向重复RNA多核苷酸,和II.编码C2c1的多核苷酸序列,其任选地包含至少一个或多个核定位序列,其中所述正向重复序列与所述指导序列杂交并引导CRISPR复合物与靶序列的序列特异性结合,并且其中所述CRISPR复合物包含与以下各物复合的CRISPR蛋白:(1)与靶序列杂交或可杂交的指导序列,和(2)正向重复序列,并且编码CRISPR蛋白的多核苷酸序列是DNA或RNA。
在某些实施方案中,C2c1效应蛋白识别富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在某些实施方案中,与MPS I有关的目标基因座由CRISPR-C2c1复合物通过产生具有5'突出端的交错切口来修饰。在一些实施方案中,5'突出端为7nt。在一些实施方案中,交错切口之后是NHEJ或HDR。在某些实施方案中,利用CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列来修饰目标基因座。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将具有5'突出端的短的双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ途径介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于如Meresca等人和He等人中所述的方法,以利用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。
Wu(Cell Stem Cell,13:659-62,2013)设计了一种指导RNA,其导致Cas9进行单个碱基对突变,从而引起小鼠白内障,在其中诱导DNA切割。然后,使用给予受精卵修复机制的其他野生型等位基因或寡核苷酸,校正了破坏等位基因的序列并校正了突变小鼠中引起白内障的遗传缺陷。
美国专利公开第20120159653号描述了锌指核酸酶用于遗传修饰与黄斑变性(MD)相关的细胞、动物和蛋白质的用途。黄斑变性(MD)是老年人视力障碍的主要原因,但也是儿童期疾病如Stargardt病、Sorsby眼底病和致命的儿童神经退行性疾病(发病年龄低至婴儿时期)的标志性症状。由于视网膜受损,黄斑变性导致视野中央(黄斑)的视力丧失。当前存在的动物模型不能概括所述疾病的主要特征,正如在人类中观察到的那样。包含编码与MD相关的蛋白质的突变基因的可用动物模型也会产生高度可变的表型,从而使人类疾病的翻译和治疗发展成为问题。
美国专利公开第20120159653号的一个方面涉及对编码与MD相关的蛋白质的任何染色体序列的编辑,其可应用于本发明的核酸靶向系统。通常基于与MD相关的蛋白质与MD病症的实验关联来选择与MD相关的蛋白质。例如,相对于缺乏MD病症的群体,在具有MD病症的群体中,与MD相关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码蛋白质的基因的基因表达谱来鉴定与MD相关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。
作为非限制性实例,与MD相关的蛋白质包括但不限于以下蛋白质:(ABCA4)ATP结合盒亚家族A(ABC1)成员4,ACHM1色盲(视杆单色性)1,ApoE载脂蛋白E(ApoE),C1QTNF5(CTRP5)C1q和肿瘤坏死因子相关蛋白5(C1QTNF5),C2补体成分2(C2),C3补体成分(C3),CCL2趋化因子(C-C基序)配体2(CCL2),CCR2趋化因子(C-C基序)受体2(CCR2),CD36分化簇36,CFB补体因子B,CFH补体因子CFH H,CFHR1补体因子H相关1,CFHR3补体因子H相关3,CNGB3环状核苷酸门控通道β3,CP铜蓝蛋白(CP),CRP C反应蛋白(CRP),CST3胱抑素C或胱抑素3(CST3),CTSD组织蛋白酶D(CTSD),CX3CR1趋化因子(C-X3-C基序)受体1,ELOVL4极长链脂肪酸的延伸4,ERCC6切除修复交叉互补啮齿动物修复缺陷互补组6,FBLN5腓骨蛋白-5,FBLN5腓骨蛋白5,FBLN6腓骨蛋白6,FSCN2 fascin(FSCN2),HMCN1半中心蛋白1,HMCN1半中心蛋白1,HTRA1 HtrA丝氨酸肽酶1(HTRA1),HTRA1 HtrA丝氨酸肽酶1,IL-6白介素6,IL-8白介素8,LOC387715假定蛋白,PLEKHA1含普利克底物蛋白同源结构域的家族A成员1(PLEKHA1),PROM1 Prominin 1(PROM1或CD133),PRPH2外周蛋白-2,RPGR色素性视网膜炎GTP酶调控剂,SERPING1 serpin肽酶抑制剂进化枝G成员1(C1-抑制剂),TCOF1糖蜜,TIMP3金属蛋白酶抑制剂3(TIMP3),TLR3 Toll样受体3。
与其染色体序列被编辑的MD相关的蛋白质的身份可以并且将会改变。在优选的实施方案中,其染色体序列被编辑的与MD相关的蛋白质可以是由ABCR基因编码的ATP结合盒亚家族A(ABC1)成员4蛋白(ABCA4),由APOE基因编码的载脂蛋白E蛋白(APOE),由CCL2基因编码的趋化因子(C-C基序)配体2蛋白(CCL2),由CCR2基因编码的趋化因子(C-C基序)受体2蛋白(CCR2),由CP基因编码的铜蓝蛋白(CP),由CTSD基因编码的组织蛋白酶D蛋白(CTSD),或由TIMP3基因编码的金属蛋白酶抑制剂3蛋白(TIMP3)。在一个示例性的实施方案中,遗传修饰的动物是大鼠,并且编码与MD相关的蛋白质的编辑的染色体序列可以是:(ABCA4)ATP结合盒NM_000350亚家族A(ABC1)成员4,APOE载脂蛋白E NM_138828(APOE),CCL2趋化因子(C-C NM_031530基序)配体2(CCL2),CCR2趋化因子(C-C NM_021866基序)受体2(CCR2),CP铜蓝蛋白(CP)NM_012532,CTSD组织蛋白酶D(CTSD)NM_134334,TIMP3金属蛋白酶NM_012886抑制剂3(TIMP3)。动物或细胞可包含1、2、3、4、5、6、7个或更多个编码与MD相关的蛋白质的破坏的染色体序列和0、1、2、3、4、5、6、7个或更多个编码所述与MD相关的破坏蛋白质的染色体整合序列。
可修饰经编辑或整合的染色体序列以编码与MD相关的改变的蛋白质。MD相关的染色体序列中的若干突变已与MD相关联。与MD相关的染色体序列中的突变的非限制性实例包括可能引起MD的突变,包括:在ABCR蛋白中,E471K(即第471位的谷氨酸变为赖氨酸),R1129L(即第1129位的精氨酸变为亮氨酸),T1428M(即第1428位的苏氨酸变为甲硫氨酸),R1517S(即第1517位的精氨酸变为丝氨酸),I1562T(即第1562位的异亮氨酸变为苏氨酸)和G1578R(即第1578位的甘氨酸变为精氨酸);在CCR2蛋白中,V64I(即第192位的缬氨酸变为异亮氨酸);在CP蛋白中,G969B(即第969位的甘氨酸变为天冬酰胺或天冬氨酸);在TIMP3蛋白中,S156C(即第156位的丝氨酸变为半胱氨酸),G166C(即第166位的甘氨酸变为半胱氨酸),G167C(即第167位的甘氨酸变为半胱氨酸),Y168C(即第168位的酪氨酸变为半胱氨酸),S170C(即第170位的丝氨酸变为半胱氨酸),Y172C(即第172位的酪氨酸变为半胱氨酸)和S181C(即第181位的丝氨酸变为半胱氨酸)。MD相关基因中遗传变异与疾病的其他关联是本领域已知的。
CRISPR系统可用于校正由常染色体显性基因导致的疾病。例如,CRISPR/Cas9被用于去除引起眼睛受体损失的常染色体显性基因。Bakondi,B.等人,In Vivo CRISPR/Cas9Gene Editing Corrects Retinal Dystrophy in the S334ter-3Rat Model ofAutosomal Dominant Retinitis Pigmentosa.Molecular Therapy,2015;DOI:10.1038/mt.2015.220。
本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与上述类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
治疗循环系统和肌肉疾病
本发明还考虑了将本文所述的CRISPR-Cas系统例如C2c1效应蛋白系统递送至心脏。对于心脏,优选心肌嗜性腺相关病毒(AAVM),特别是在心脏中显示优先基因转移的AAVM41(参见例如Lin-Yanga等人,PNAS,2009年3月10日,第106卷,第10期)。施用可以是全身性的或局部的。预期约1-10×1014个载体基因组的剂量用于全身性施用。还参见例如Eulalio等人,(2012)Nature 492:376和Somasuntharam等人,(2013)Biomaterials 34:7790。
例如,美国专利公开第20110023139号描述了锌指核酸酶用于遗传修饰与心血管疾病相关的细胞、动物和蛋白质的用途。心血管疾病通常包括高血压、心脏病发作、心力衰竭以及中风和TIA。与心血管疾病有关的任何染色体序列或由与心血管疾病有关的任何染色体序列编码的蛋白质可用于本公开中描述的方法中。通常基于与心血管有关的蛋白质与心血管疾病发展的实验关联来选择与心血管有关的蛋白质。例如,相对于缺乏心血管病症的群体,在具有心血管病症的群体中,与心血管有关的蛋白质的生产率或循环浓度可升高或降低。蛋白质水平的差异可使用蛋白质组学技术进行评估,所述蛋白质组学技术包括但不限于Western印迹、免疫组织化学染色、酶联免疫吸附测定(ELISA)和质谱法。或者,可通过使用基因组技术获得编码蛋白质的基因的基因表达谱来鉴定与心血管有关的蛋白质,所述基因组技术包括但不限于DNA微阵列分析、基因表达的系列分析(SAGE)和定量实时聚合酶链反应(Q-PCR)。
举例来说,染色体序列可包括但不限于IL1B(白介素1,β),XDH(黄嘌呤脱氢酶),TP53(肿瘤蛋白p53),PTGIS(前列腺素12(前列环素)合酶),MB(肌红蛋白),IL4(白介素4),ANGPT1(血管生成素1),ABCG8(ATP结合盒,亚家族G(WHITE),成员8),CTSK(组织蛋白酶K),PTGIR(前列腺素12(前列环素)受体(IP)),KCNJ11(钾内向整流通道,亚家族J,成员11),INS(胰岛素),CRP(C反应蛋白,与正五聚蛋白相关),PDGFRB(血小板衍生的生长因子受体,β多肽),CCNA2(细胞周期蛋白A2),PDGFB(血小板衍生的生长因子β多肽(猿猴肉瘤病毒(v-sis)致癌基因同源物)),KCNJ5(钾内向整流通道,亚家族J,成员5),KCNN3(钾中等/小电导钙激活通道,亚家族N,成员3),CAPN10(钙蛋白酶10),PTGES(前列腺素E合酶),ADRA2B(肾上腺素,α-2B-,受体),ABCG5(ATP结合盒,亚家族G(WHITE),成员5),PRDX2(过氧化物酶2),CAPN5(钙蛋白酶5),PARP14(聚(ADP-核糖)聚合酶家族,成员14),MEX3C(mex-3同源物C(秀丽隐杆线虫)),ACE血管紧张素I转化酶(肽基-二肽酶A)1),TNF(肿瘤坏死因子(TNF超家族,成员2)),IL6(白介素6(干扰素,β2)),STN(他汀类),SERPINE1(serpin肽酶抑制剂,进化枝E(连接蛋白,纤溶酶原激活物抑制剂1型),成员1),ALB(白蛋白),ADIPOQ(含脂联素、C1Q和胶原蛋白结构域),APOB(载脂蛋白B(包括Ag(x)抗原)),APOE(载脂蛋白E),LEP(瘦素),MTHFR(5,10-亚甲基四氢叶酸还原酶(NADPH)),APOA1(载脂蛋白A-I),EDN1(内皮素1),NPPB(利钠肽前体B),NOS3(一氧化氮合酶3(内皮细胞)),PPARG(过氧化物酶体增殖物激活受体γ),PLAT(纤溶酶原激活物,组织),PTGS2(前列腺素-内过氧化物合酶2(前列腺素G/H合酶和环氧合酶)),CETP(胆固醇酯转移蛋白,血浆),AGTR1(血管紧张素II受体,1型),HMGCR(3-羟基-3-甲基戊二酰辅酶A还原酶),IGF1(胰岛素样生长因子1(生长调节素C)),SELE(选择素E),REN(肾素),PPARA(过氧化物酶体增殖物激活受体α),PON1(对氧磷酶1),KNG1(激肽原1),CCL2(趋化因子(C-C基序)配体2),LPL(脂蛋白脂肪酶),VWF(von Willebrand因子),F2(凝血因子II(凝血酶)),ICAM1(细胞间粘附分子1),TGFB1(转化生长因子,β1),NPPA(利钠肽前体A),IL10(白介素10),EPO(促红细胞生成素),SOD1(超氧化物歧化酶1,可溶性),VCAM1(血管细胞粘附分子1),IFNG(干扰素,γ),LPA(脂蛋白,Lp(a)),MPO(髓过氧化物酶),ESR1(雌激素受体1),MAPK1(有丝分裂原激活的蛋白激酶1),HP(触珠蛋白),F3(凝血因子III(凝血酶原,组织因子)),CST3(胱抑素C),COG2(低聚高尔基复合体组分2),MMP9(基质金属肽酶9(明胶酶B,92kDa明胶酶,92kDa IV型胶原酶)),SERPINC1(serpin肽酶抑制剂,进化枝C(抗凝血酶),成员1),F8(凝血因子VIII,促凝血组分),HMOX1(血红素加氧酶(decycling)1),APOC3(载脂蛋白C-III),IL8(白介素8),PROK1(前动力蛋白1),CBS(胱硫醚-β-合酶),NOS2(一氧化氮合酶2,诱导型),TLR4(toll样受体4),SELP(选择素P(颗粒膜蛋白140kDa,抗原CD62)),ABCA1(ATP结合盒,亚家族A(ABC1),成员1),AGT(血管紧张素原(serpin蛋白酶抑制剂,进化枝A,成员8)),LDLR(低密度脂蛋白受体),GPT(谷氨酸-丙酮酸转氨酶(丙氨酸氨基转移酶)),VEGFA(血管内皮生长因子A),NR3C2(核受体亚家族3,C组,成员2),IL18(白介素18(干扰素-γ诱导因子)),NOS1(一氧化氮合酶1(神经元)),NR3C1(核受体亚家族3,C组,成员1(糖皮质激素受体)),FGB(纤维蛋白原β链),HGF(肝细胞生长因子(hepapoietin A;散射因子)),IL1A(白介素1,α),RETN(抵抗素),AKT1(v-akt鼠类胸腺瘤病毒致癌基因同源物1),LIPC(脂肪酶,肝),HSPD1(热休克60kDa蛋白1(伴侣蛋白)),MAPK14(有丝分裂原激活的蛋白激酶14),SPP1(分泌的磷蛋白1),ITGB3(整合素,β3(血小板糖蛋白)111a,抗原CD61)),CAT(过氧化氢酶),UTS2(尿紧张素2),THBD(血栓调节素),F10(凝血因子X),CP(铜蓝蛋白(铁氧化酶)),TNFRSF11B(肿瘤坏死因子受体超家族,成员11b),EDNRA(A型内皮素受体),EGFR(表皮生长因子受体(成红细胞白血病病毒(v-erb-b)致癌基因同源物,禽类)),MMP2(基质金属肽酶2(明胶酶A,72kDa明胶酶,72kDa IV型胶原酶)),PLG(纤溶酶原),NPY(神经肽Y),RHOD(ras同源基因家族,成员D),MAPK8(有丝分裂原激活的蛋白激酶8),MYC(v-myc骨髓细胞瘤病病毒致癌基因同源物(禽类)),FN1(纤连蛋白1),CMA1(糜酶1,肥大细胞),PLAU(纤溶酶原激活剂,尿激酶),GNB3(鸟嘌呤核苷酸结合蛋白(G蛋白),β多肽3),ADRB2(肾上腺素,β-2-,受体,表面),APOA5(载脂蛋白A-V),SOD2(超氧化物歧化酶2,线粒体),F5(凝血因子V(前加速素,不稳定因子)),VDR(维生素D(1,25-二羟基维生素D3)受体),ALOX5(花生四烯酸5-脂氧合酶),HLA-DRB1(主要组织相容性复合物,II类,DRβ1),PARP1(聚(ADP-核糖)聚合酶1),CD40LG(CD40配体),PON2(对氧磷酶2),AGER(晚期糖基化终产物特异性受体),IRS1(胰岛素受体底物1),PTGS1(前列腺素-内过氧化物合酶1(前列腺素G/H合酶和环加氧酶)),ECE1(内皮素转化酶1),F7(凝血因子VII(血清凝血酶原转化促进剂)),URN(白介素1受体拮抗剂),EPHX2(环氧水解酶2,细胞质),IGFBP1(胰岛素样生长因子结合蛋白1),MAPK10(有丝分裂原激活的蛋白激酶10),FAS(Fas(TNF受体超家族,成员6)),ABCB1(ATP结合盒,亚家族B(MDR/TAP),成员1),JUN(jun致癌基因),IGFBP3(胰岛素样生长因子结合蛋白3),CD14(CD14分子),PDE5A(磷酸二酯酶5A,cGMP特异性),AGTR2(血管紧张素II受体,2型),CD40(CD40分子,TNF受体超家族成员5),LCAT(卵磷脂-胆固醇酰基转移酶),CCR5(趋化因子(C-C基序)受体5),MMP1(基质金属肽酶1(间质胶原酶)),TIMP1(TIMP金属肽酶抑制剂1),ADM(肾上腺髓质素),DYT10(肌张力障碍10),STAT3(信号转导子和转录激活子3(急性期反应因子)),MMP3(基质金属肽酶3(基质溶素1,前明胶酶)),ELN(弹性蛋白),USF1(上游转录因子1),CFH(补体因子H),HSPA4(热休克70kDa蛋白4),MMP12(基质金属肽酶12(巨噬细胞弹性蛋白酶)),MME(膜金属内肽酶),F2R(凝血因子II(凝血酶)受体),SELL(选择素L),CTSB(组织蛋白酶B),ANXA5(annexin A5),ADRB1(肾上腺素,β-1-,受体),CYBA(细胞色素b-245,α多肽),FGA(纤维蛋白原α链),GGT1(γ-谷氨酰转移酶1),LIPG(脂肪酶,内皮),HIF1A(低氧诱导因子1,α亚基(碱性螺旋-环-螺旋转录因子)),CXCR4(趋化因子(C-X-C基序)受体4),PROC(蛋白C(凝血因子Va和VIIIa的灭活剂)),SCARB1(B类清道夫受体,成员1),CD79A(CD79a分子,免疫球蛋白相关α),PLTP(磷脂转移蛋白),ADD1(内收蛋白1(α)),FGG(纤维蛋白原γ链),SAA1(血清淀粉样蛋白A1),KCNH2(钾电压门控通道,亚家族H(eag相关),成员2),DPP4(二肽基-肽酶4),G6PD(葡萄糖-6-磷酸脱氢酶),NPR1(利钠肽受体A/鸟苷酸环化酶A(利尿钠肽受体A)),VTN(玻连蛋白),KIAA0101(KIAA0101),FOS(FBJ鼠类骨肉瘤病毒致癌基因同源物),TLR2(toll类受体2),PPIG(肽基脯氨酰异构酶G(亲环素G)),IL1R1(白介素1受体,I型),AR(雄激素受体),CYP1A1(细胞色素P450,家族1,亚家族A,多肽1),SERPINA1(serpin肽酶抑制剂,进化枝A(α-1抗蛋白酶,抗胰蛋白酶),成员1),MTR(5-甲基四氢叶酸-高半胱氨酸甲基转移酶),RBP4(视黄醇结合蛋白4,血浆),APOA4(载脂蛋白A-IV),CDKN2A(细胞周期蛋白依赖性激酶抑制剂2A(黑色素瘤,p16,抑制CDK4)),FGF2(成纤维细胞生长因子2(碱性)),EDNRB(内皮素B型受体),ITGA2(整合素,α2(CD49B,VLA-2受体的α2亚基)),CABIN1(钙调神经磷酸结合蛋白1),SHBG(性别激素结合球蛋白),HMGB1(高迁移率组盒1),HSP90B2P(热休克蛋白90kDaβ(Grp94),成员2(假基因)),CYP3A4(细胞色素P450,家族3,亚家族A,多肽4),GJA1(间隙连接蛋白,α1,43kDa),CAV1(小窝蛋白1,胞膜窖蛋白,22kDa),ESR2(雌激素受体2(ERβ)),LTA(淋巴毒素α(TNF超家族,成员1)),GDF15(生长分化因子15),BDNF(脑源性神经营养因子),CYP2D6(细胞色素P450,家族2,亚家族D,多肽6),NGF(神经生长因子(β多肽)),SP1(Sp1转录因子),TGIF1(TGFB诱导的因子同源盒1),SRC(v-src肉瘤(Schmidt-Ruppin A-2)病毒致癌基因同源物(禽类)),EGF(表皮生长因子(β-尿抑胃素),PIK3CG(磷酸肌醇-3-激酶,催化,γ多肽),HLA-A(主要组织相容性复合物,I类,A),KCNQ1(钾电压门控通道,KQT样亚家族,成员1),CNR1(大麻素受体1(脑)),FBN1(原纤维蛋白1),CHKA(胆碱激酶α),BEST1(斑萎蛋白1),APP(淀粉样β(A4)前体蛋白),CTNNB1(连环蛋白(钙粘蛋白相关蛋白),β1、88kDa),IL2(白介素2),CD36(CD36分子(血小板反应蛋白受体)),PRKAB1(蛋白激酶,AMP激活,β1非催化亚基),TPO(甲状腺过氧化物酶),ALDH7A1(醛脱氢酶7家族,成员A1),CX3CR1(趋化因子(C-X3-C基序)受体1),TH(酪氨酸羟化酶),F9(凝血因子IX),GH1(生长激素1),TF(转铁蛋白),HFE(血色素沉着病),IL17A(白介素17A),PTEN(磷酸酶和张力蛋白同源物),GSTM1(谷胱甘肽S-转移酶μ1),DMD(肌营养不良蛋白),GATA4(GATA结合蛋白4),F13A1(凝血因子XIII,A1多肽),TTR(转甲状腺素蛋白),FABP4(脂肪酸结合蛋白4,脂肪细胞),PON3(对氧磷酶3),APOC1(载脂蛋白C-I),INSR(胰岛素受体),TNFRSF1B(肿瘤坏死因子受体超家族,成员1B),HTR2A(5-羟色胺(血清素)受体2A),CSF3(集落刺激因子3(粒细胞)),CYP2C9(细胞色素P450,家族2,亚家族C,多肽9),TXN(硫氧还蛋白),CYP11B2(细胞色素P450,家族11,亚家族B,多肽2),PTH(甲状旁腺激素),CSF2(集落刺激因子2(粒细胞-巨噬细胞)),KDR(激酶插入物结构域受体(III型受体酪氨酸激酶)),PLA2G2A(磷脂酶A2,IIA组(血小板,滑液)),B2M(β-2-微球蛋白),THBS1(血小板反应蛋白1),GCG(胰高血糖素),RHOA(ras同源基因家族,成员A),ALDH2(醛脱氢酶2家族(线粒体)),TCF7L2(转录因子7样2(T细胞特异性,HMG-盒)),BDKRB2(缓激肽受体B2),NFE2L2(核因子(红系衍生的2)样2),NOTCH1(Notch同源物1,易位相关(果蝇)),UGT1A1(UDP葡萄糖醛酸转移酶1家族,多肽A1),IFNA1(干扰素,α1),PPARD(过氧化物酶体增殖物激活的受体δ),SIRT1(沉默调节蛋白(沉默的交配类型信息调节2同源物)1(酿酒酵母),GNRH1(促性腺激素释放激素1(促黄体生成素释放激素)),PAPPA(妊娠相关血浆蛋白A,pappalysin 1),ARR3(arrestin 3,视网膜(X-arrestin)),NPPC(利钠肽前体C),AHSP(α血红蛋白稳定蛋白),PTK2(PTK2蛋白酪氨酸激酶2),IL13(白介素13),MTOR(雷帕霉素的机械靶标(丝氨酸/苏氨酸激酶)),ITGB2(整合素,β2(补体成分3受体3和4亚基),GSTT1(谷胱甘肽S-转移酶θ1),IL6ST(白介素6信号转导子(gp130,抑瘤素M受体)),CPB2(羧肽酶B2(血浆)),CYP1A2(细胞色素P450,家族1,亚家族A,多肽2),HNF4A(肝细胞核因子4,α),SLC6A4(溶质载体家族6(神经递质转运蛋白,血清素),成员4),PLA2G6(磷脂酶A2,VI组(胞质,不依赖钙)),TNFSF11(肿瘤坏死因子(配体)超家族,成员11),SLC8A1(溶质载体家族8(钠/钙交换剂),成员1),F2RL1(凝血因子II(凝血酶)受体样1),AKR1A1(醛基酮还原酶家族1,成员A1(醛还原酶)),ALDH9A1(醛脱氢酶9家族,成员A1),BGLAP(骨γ-羧基谷氨酸(gla)蛋白),MTTP(微粒体甘油三酸酯转移蛋白),MTRR(5-甲基四氢叶酸-高半胱氨酸甲基转移酶还原酶),SULT1A3(磺基转移酶家族,胞质,1A,酚优选,成员3),RAGE(肾肿瘤抗原),C4B(补体成分4B(Chido血型),P2RY12(嘌呤能受体P2Y,G蛋白偶联,12),RNLS(肾酶,FAD依赖性胺氧化酶),CREB1(cAMP反应元件结合蛋白1),POMC(阿黑皮素原),RAC1(ras相关的C3肉毒杆菌毒素底物1(rho家族,小GTP结合蛋白Rac1)),LMNA(lamin NC),CD59(CD59分子,补体调控蛋白),SCN5A(钠通道,电压门控,V型,α亚基),CYP1B1(细胞色素P450,家族1,亚家族B,多肽1),MIF(巨噬细胞迁移抑制因子(糖基化抑制因子)),MMP13(基质金属肽酶13(胶原酶3)),TIMP2(TIMP金属肽酶抑制剂2),CYP19A1(细胞色素P450,家族19,亚家族A,多肽1),CYP21A2(细胞色素P450,家族21,亚家族A,多肽2),PTPN22(蛋白酪氨酸磷酸酶,22型非受体(淋巴样)),MYH14(肌球蛋白,重链14,非肌肉),MBL2(甘露糖结合凝集素(蛋白C)2,可溶性(调理素缺陷)),SELPLG(选择素P配体),AOC3(胺氧化酶,含铜3(血管粘附蛋白1)),CTSL1(组织蛋白酶L1),PCNA(增殖细胞核抗原),IGF2(胰岛素样生长因子2(生长调节素A)),ITGB1(整联蛋白,β1(纤连蛋白受体,β多肽,抗原CD29包括MDF2、MSK12)),CAST(钙抑素),CXCL12(趋化因子(C-X-C基序)配体12(基质细胞衍生因子1)),IGHE(免疫球蛋白)重常数ε),KCNE1(钾电压门控通道,Isk相关家族,成员1),TFRC(转铁蛋白受体(p90,CD71)),COL1A1(胶原蛋白,I型,α1),COL1A2(胶原蛋白,I型,α2),IL2RB(白介素2受体,β),PLA2G10(磷脂酶A2,X组),ANGPT2(血管生成素2),PROCR(蛋白C受体,内皮(EPCR)),NOX4(NADPH氧化酶4),HAMP(铁调素抗菌肽),PTPN11(蛋白酪氨酸磷酸酶,11型非受体),SLC2A1(溶质载体家族2(促进葡萄糖转运蛋白),成员1),IL2RA(白介素2受体,α),CCL5(趋化因子(C-C基序)配体5),IRF1(干扰素调节因子1),CFLAR(CASP8和FADD样凋亡调控剂),CALCA(降钙素相关多肽α),EIF4E(真核翻译起始因子4E),GSTP1(谷胱甘肽S-转移酶π1),JAK2(Janus激酶2),CYP3A5(细胞色素P450,家族3,亚家族A,多肽5),HSPG2(硫酸乙酰肝素蛋白聚糖2),CCL3(趋化因子(C-C基序)配体3),MYD88(髓样分化初级应答基因(88)),VIP(血管活性肠肽),SOAT1(甾醇O-酰基转移酶1),ADRBK1(肾上腺素,β,受体激酶1),NR4A2(核受体亚家族4,A组,成员2),MMP8(基质金属肽酶8(中性粒细胞胶原酶)),NPR2(利钠肽受体B/鸟苷酸环化酶B(利钠肽受体B)),GCH1(GTP环水解酶1),EPRS(谷氨酰-脯氨酰-tRNA合酶),PPARGC1A(过氧化物酶体增殖物激活的受体γ,共激活子1α),F12(凝血因子XII(Hageman因子)),PECAM1(血小板/内皮细胞粘附分子),CCL4(趋化因子(C-C基序)配体4),SERPINA3(serpin蛋白酶抑制剂,进化枝A(α-1抗蛋白酶,抗胰蛋白酶),成员3),CASR(钙敏感受体),GJA5(间隙连接蛋白,α5,40kDa),FABP2(脂肪酸结合蛋白2,肠),TTF2(转录终止因子,RNA聚合酶II),PROS1(蛋白质S(α)),CTF1(心肌营养蛋白1),SGCB(肌聚糖,β(与43kDa肌营养不良蛋白相关的糖蛋白)),YME1L1(YME1样1(酿酒酵母)),CAMP(组织蛋白酶抑制素抗菌肽),ZC3H12A(含锌指CCCH型的12A),AKR1B1(醛酮还原酶家族1,成员B1(醛糖还原酶)),DES(结蛋白),MMP7(基质金属肽酶7(基质溶素,子宫),AHR(芳基烃受体),CSF1(集落刺激因子1(巨噬细胞)),HDAC9(组蛋白脱乙酰基酶9),CTGF(结缔组织生长因子),KCNMA1(钾大电导钙激活通道,亚家族M,α成员1),UGT1A(UDP葡萄糖醛酸转移酶1家族,多肽A复合基因座),PRCKA(蛋白激酶C,α),COMT(儿茶酚-β-甲基转移酶),S100B(S100钙结合蛋白B),EGR1(早期生长反应1),PRL(促乳素),IL15(白介素15),DRD4(多巴胺受体D4),CAMK2G(钙/钙调蛋白依赖性蛋白激酶IIγ),SLC22A2(溶质载体家族22(有机阳离子转运蛋白),成员2),CCL11(趋化因子(C-C基序)配体11),PGF(B321胎盘生长因子),THPO(血小板生成素),GP6(糖蛋白VI(血小板)),TACR1(速激肽受体1),NTS(神经降压素),HNF1A(HNF1同源盒A),SST(生长抑素),KCND1(钾电压门控通道,Shal相关亚家族,成员1),LOC646627(磷脂酶抑制剂),TBXAS1(血栓烷A合酶1(血小板)),CYP2J2(细胞色素P450,家族2,亚家族J,多肽2),TBXA2R(血栓烷A2受体),ADH1C(醇脱氢酶1C(I类),γ多肽),ALOX12(花生四烯酸12-脂加氧酶),AHSG(α-2-HS-糖蛋白),BHMT(甜菜碱-高半胱氨酸甲基转移酶),GJA4(间隙连接蛋白,α4,37kDa),SLC25A4(溶质载体家族25(线粒体载体;腺嘌呤核苷酸易位子),成员4),ACLY(ATP柠檬酸裂解酶),ALOX5AP(花生四烯酸5-脂氧合酶激活蛋白),NUMA1(核有丝分裂器蛋白1),CYP27B1(细胞色素P450,家族27,家族B,多肽1),CYSLTR2(半胱氨酰白三烯受体2),SOD3(超氧化物歧化酶3,细胞外),LTC4S(白三烯C4合酶),UCN(尿皮质素),GHRL(胃饥饿素/肥胖抑制素前原肽),APOC2(载脂蛋白C-II),CLEC4A(C型凝集素结构域家族4,成员A),KBTBD10(含kelch重复序列和BTB(POZ)结构域的10),TNC(肌腱蛋白C),TYMS(胸苷酸合酶),SHCl(SHC(含Src同源性2结构域)转化蛋白1),LRP1(低密度脂蛋白受体相关蛋白1),SOCS3(细胞因子信号传导抑制剂3),ADH1B(醇脱氢酶1B(I类),β多肽),KLK3(激肽释放酶相关肽酶3),HSD11B1(羟类固醇(11-β)脱氢酶1),VKORC1(维生素K环氧化物还原酶复合物,亚基1),SERPINB2(serpin肽酶抑制剂,进化枝B(卵清蛋白),成员2),TNS1(张力蛋白1),RNF19A(无名指蛋白19A),EPOR(促红细胞生成素受体),ITGAM(整合素,αM(补体成分3受体3亚基)),PITX2(成对样同源结构域2),MAPK7(有丝分裂原激活的蛋白激酶7),FCGR3A(IgG的Fc片段,低亲和力111a,受体(CD16a)),LEPR(瘦素受体),ENG(内皮糖蛋白),GPX1(谷胱甘肽过氧化物酶1),GOT2(谷氨酸-草酰乙酸-转氨酶2,线粒体(天冬氨酸氨基转移酶2)),HRH1(组胺受体H1),NR112(核受体亚家族1,I组,成员2),CRH(促肾上腺皮质激素释放激素),HTR1A(5-羟色胺(血清素)受体1A),VDAC1(电压依赖性阴离子通道1),HPSE(乙酰肝素酶),SFTPD(表面活性蛋白D),TAP2(转运蛋白2,ATP结合盒,亚家族B(MDR/TAP)),RNF123(无名指蛋白123),PTK2B(PTK2B蛋白酪氨酸激酶2β),NTRK2(神经营养性酪氨酸激酶,受体,2型),IL6R(白介素6受体),ACHE(乙酰胆碱酯酶(Yt血型)),GLP1R(胰高血糖素样肽1受体),GHR(生长激素受体),GSR(谷胱甘肽还原酶),NQO1(NAD(P)H脱氢酶,醌1),NR5A1(核受体亚家族5,A组,成员1),GJB2(间隙连接蛋白,β2,26kDa),SLC9A1(溶质载体家族9(钠/氢交换剂),成员1),MAOA(单胺氧化酶A),PCSK9(前蛋白转化酶枯草杆菌蛋白酶/kexin型9),FCGR2A(IgG的Fc片段,低亲和力IIa,受体(CD32)),SERPINF1(serpin肽酶抑制剂,进化枝F(α-2抗纤溶酶,色素上皮衍生因子),成员1),EDN3(内皮素3),DHFR(二氢叶酸还原酶),GAS6(生长停滞特异性6),SMPD1(鞘磷脂磷酸二酯酶1,酸性溶酶体),UCP2(解偶联蛋白2(线粒体,质子载体)),TFAP2A(转录因子AP-2α(激活增强子结合蛋白2α)),C4BPA(补体成分4结合蛋白,α),SERPINF2(serpin肽酶抑制剂,进化枝F(α-2抗纤溶酶,色素上皮衍生因子),成员2),TYMP(胸苷磷酸化酶),ALPP(碱性磷酸酶,胎盘(Regan同功酶)),CXCR2(趋化因子(C-X-C基序)受体2),SLC39A3(溶质载体家族39(锌转运蛋白),成员3),ABCG2(ATP结合盒,亚家族G(WHITE),成员2),ADA(腺苷脱氨酶),JAK3(Janus激酶3),HSPA1A(热休克70kDa蛋白1A),FASN(脂肪酸合酶),FGF1(成纤维细胞生长因子1(酸性)),F11(凝血因子XI),ATP7A(ATP酶,Cu++转运,α多肽),CR1(补体成分(3b/4b)受体1(Knops血型),GFAP(神经胶质纤维酸性蛋白),ROCK1(与Rho相关的卷曲螺旋蛋白激酶1),MECP2(甲基CpG结合蛋白2(雷特综合征)),MYLK(肌球蛋白轻链激酶),BCHE(丁酰胆碱酯酶),LIPE(脂肪酶,对激素敏感),PRDX5(过氧化物酶5),ADORA1(腺苷A1受体),WRN(Werner综合征,RecQ解旋酶样),CXCR3(趋化因子(C-X-C基序)受体3),CD81(CD81分子),SMAD7(SMAD家族成员7),LAMC2(层粘连蛋白,γ2),MAP3K5(有丝分裂原激活的蛋白激酶激酶激酶5),CHGA(嗜铬粒蛋白A(甲状旁腺分泌蛋白1)),IAPP(胰岛淀粉样多肽),RHO(视紫红质),ENPP1(外核苷酸焦磷酸酶/磷酸二酯酶1),PTHLH(甲状旁腺激素样激素),NRG1(神经调节蛋白1),VEGFC(血管内皮生长因子C),ENPEP(谷氨酰胺基肽酶(氨基肽酶A)),CEBPB(CCAAT/增强子结合蛋白(C/EBP),β),NAGLU(N-乙酰氨基葡萄糖苷酶,α-),F2RL3(凝血因子II(凝血酶)受体样3),CX3CL1(趋化因子(C-X3-C基序)配体1),BDKRB1(缓激肽受体B1),ADAMTS13(具有血小板反应蛋白1型基序的ADAM金属肽酶,13),ELANE(弹性蛋白酶,嗜中性粒细胞表达),ENPP2(外核苷酸焦磷酸酶/磷酸二酯酶2),CISH(含细胞因子诱导的SH2的蛋白质),GAST(胃泌素),MYOC(肌球蛋白,小梁网诱导的糖皮质激素反应),ATP1A2(ATP酶,Na+/K+转运,α2多肽),NF1(神经纤维蛋白1),GJB1(间隙连接蛋白,β1,32kDa),MEF2A(肌细胞增强因子2A),VCL(粘着斑蛋白),BMPR2(骨形态发生蛋白受体,II型(丝氨酸/苏氨酸激酶)),TUBB(微管蛋白,β),CDC42(细胞分裂周期42(GTP结合蛋白,25kDa)),KRT18(角蛋白18),HSF1(热休克转录因子1),MYB(v-myb成纤维细胞病病毒致癌基因同源物(禽类)),PRKAA2(蛋白激酶,AMP激活,α2催化亚基),ROCK2(Rho相关,含卷曲螺旋的蛋白激酶2),TFPI(组织因子途径抑制剂(脂蛋白相关凝结抑制剂)),PRKG1(蛋白激酶,cGMP依赖性,I型),BMP2(骨形态发生蛋白2),CTNND1(连环蛋白(钙粘蛋白相关蛋白),δ1),CTH(胱硫醚酶(胱硫醚γ-裂解酶)),CTSS(组织蛋白酶S),VAV2(vav2鸟嘌呤核苷酸交换因子),NPY2R(神经肽Y受体Y2),IGFBP2(胰岛素样生长因子结合蛋白2,36kDa),CD28(CD28分子),GSTA1(谷胱甘肽S-转移酶α1),PPIA(肽基脯氨酰异构酶A(亲环蛋白A)),APOH(载脂蛋白H(β-2-糖蛋白I)),S100A8(S100钙结合蛋白A8),IL11(白介素11),ALOX15(花生四烯酸15-脂加氧酶),FBLN1(腓骨蛋白1),NR1H3(核受体亚家族1,H组,成员3),SCD(硬脂酰-CoA去饱和酶(δ-9-去饱和酶)),GIP(胃抑制多肽),CHGB(嗜铬粒蛋白B(分泌粒蛋白1)),PRKCB(蛋白激酶C,β),SRD5A1(类固醇-5-α-还原酶,α多肽1(3-氧代-5α-类固醇δ4-脱氢酶α1)),HSD11B2(羟基类固醇(11-β)脱氢酶2),CALCRL(降钙素受体样),GALNT2(UDP-N-乙酰-α-D-半乳糖胺:多肽N-乙酰半乳糖胺基转移酶2(GalNAc-T2)),ANGPTL4(血管生成素样4),KCNN4(钾中等/小电导钙激活通道,亚家族N,成员4),PIK3C2A(磷酸肌醇-3-激酶,2类,α多肽),HBEGF(肝素结合EGF样生长因子),CYP7A1(细胞色素P450,家族7,亚家族A,多肽1),HLA-DRB5(主要组织相容性复合物,II类,DRβ5),BNIP3(BCL2/腺病毒E1B 19kDa相互作用蛋白3),GCKR(葡萄糖激酶(己糖激酶4)调控剂),S100A12(S100钙结合蛋白A12),PADI4(肽基精氨酸脱亚氨酶,IV型),HSPA14(热休克70kDa蛋白14),CXCR1(趋化因子(C-X-C基序)受体1),H19(H19,压印母体表达的转录物(非蛋白质编码)),KRTAP19-3(角蛋白相关蛋白19-3),IDDM2(胰岛素依赖型糖尿病2),RAC2(ras相关的C3肉毒杆菌毒素底物2(rho家族,小GTP结合蛋白Rac2)),RYR1(兰尼碱受体1(骨骼)),CLOCK(clock同源物(小鼠)),NGFR(神经生长因子受体(TNFR超家族,成员16)),DBH(多巴胺β-羟化酶(多巴胺β-单加氧酶)),CHRNA4(胆碱能受体,烟碱,α4),CACNA1C(钙通道,电压依赖性,L型,α1C亚基),PRKAG2(蛋白激酶,AMP激活,γ2非催化亚基),CHAT(胆碱乙酰基转移酶),PTGDS(前列腺素D2合酶21kDa(脑)),NR1H2(核受体亚家族1,H组,成员2),TEK(TEK酪氨酸激酶,内皮),VEGFB(血管内皮生长因子B),MEF2C(肌细胞增强因子2C),MAPKAPK2(有丝分裂原激活的蛋白激酶激活的蛋白激酶2),TNFRSF11A(肿瘤坏死因子受体超家族,成员11a,NFKB激活剂),HSPA9(热休克70kDa蛋白9(寿命蛋白)),CYSLTR1(半胱氨酰白三烯受体1),MAT1A(甲硫氨酸腺苷转移酶I,α),OPRL1(鸦片受体样1),IMPA1(肌醇(肌)-1(或4)-单磷酸酶1),CLCN2(氯化物通道2),DLD(二氢脂酰胺脱氢酶),PSMA6(蛋白酶体(蛋白酶体,macropain)亚基,α型,6),PSMB8(蛋白酶体(蛋白酶体,macropain)亚基,β型,8(大型多功能肽酶7)),CHI3L1(几丁质酶3-样1(软骨糖蛋白-39)),ALDH1B1(醛脱氢酶1家族,成员B1),PARP2(聚(ADP-核糖)聚合酶2),STAR(类固醇生成急性调节蛋白),LBP(脂多糖结合蛋白),ABCC6(ATP结合盒,亚家族C(CFTR/MRP),成员6),RGS2(G蛋白信号传导调控剂2,24kDa),EFNB2(ephrin-B2),GJB6(间隙连接蛋白,β6,30kDa),APOA2(载脂蛋白A-II),AMPD1(单磷酸腺苷脱氨酶1),DYSF(dysferlin,肢带肌肉萎缩症2B(常染色体隐性)),FDFT1(法呢基-二磷酸法呢基转移酶1),EDN2(内皮素2),CCR6(趋化因子(C-C基序)受体6),GJB3(间隙连接蛋白,β3,31kDa),IL1RL1(白介素1受体样1),ENTPD1(外核苷三磷酸二磷酸水解酶1),BBS4(Bardet-Biedl综合征4),CELSR2(钙粘蛋白,EGF LAG七次G型受体2(火烈鸟同源物,果蝇)),F11R(F11受体),RAPGEF3(Rap鸟嘌呤核苷酸交换因子(GEF)3),HYAL1(透明质酸氨基葡糖苷酶1),ZNF259(锌指蛋白259),ATOX1(ATX1抗氧化剂蛋白1同源物(酵母)),ATF6(激活转录因子6),KHK(酮己糖激酶(果糖激酶)),SAT1(亚精胺/精胺N1-乙酰基转移酶1),GGH(γ-谷氨酰水解酶(结合酶,叶酰多γ谷氨酰水解酶)),TIMP4(TIMP金属肽酶抑制剂4),SLC4A4(溶质载体家族4,碳酸氢钠共转运蛋白,成员4),PDE2A(磷酸二酯酶2A,cGMP刺激),PDE3B(磷酸二酯酶3B,cGMP抑制),FADS1(脂肪酸去饱和酶1),FADS2(脂肪酸去饱和酶2),TMSB4X(胸腺素β4,X连锁),TXNIP(硫氧还蛋白相互作用蛋白),LIMS1(LIM和衰老细胞抗原样结构域1),RHOB(ras同源基因家族,成员B),LY96(淋巴细胞抗原96),FOXO1(叉头盒O1),PNPLA2(包patatin样磷脂酶结构域的2),TRH(促甲状腺激素释放激素),GJC1(间隙连接蛋白,γ1,45kDa),SLC17A5(溶质载体家族17(阴离子/糖转运蛋白),成员5),FTO(脂肪物质和肥胖相关),GJD2(间隙连接蛋白,δ2,36kDa),PSRC1(富含脯氨酸/丝氨酸的卷曲螺旋1),CASP12(胱天蛋白酶12(基因/假基因)),GPBAR1(G蛋白偶联胆汁酸受体1),PXK(含PX结构域的丝氨酸/苏氨酸激酶),IL33(白介素33),TRIB1(tribbles同源物1(果蝇)),PBX4(前B细胞白血病同源盒4),NUPR1(核蛋白,转录调控子,1),15-Sep(15kDa硒蛋白),CILP2(软骨中间层蛋白2),TERC(端粒酶RNA组分),GGT2(γ-谷氨酰转移酶2),MT-CO1(线粒体编码的细胞色素c氧化酶I)和UOX(尿酸氧化酶,假基因)。这些序列中的任何一者都可以是CRISPR-Cas系统的靶标,例如以处理突变。
在另一个实施方案中,染色体序列可进一步选自Pon1(对氧磷酶1),LDLR(LDL受体),ApoE(载脂蛋白E),Apo B-100(载脂蛋白B-100),ApoA(载脂蛋白(a)),ApoA1(载脂蛋白A1),CBS(胱硫醚B-合酶),糖蛋白IIb/IIb,MTHRF(5,10-亚甲基四氢叶酸还原酶(NADPH)及其组合。在一次反复操作中,与心血管疾病有关的染色体序列和由染色体序列编码的蛋白质可选自Cacna1C、Sod1、Pten、Ppar(α)、Apo E、瘦素及其组合作为CRISPR-Cas系统的靶标。
本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统在与上述方法类似的系统中使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
治疗肝脏和肾脏疾病
本发明还考虑了将本文所述的CRISPR-Cas系统例如C2c1效应蛋白系统递送至肝脏和/或肾脏。诱导治疗性核酸的细胞摄取的递送策略包括物理力或载体系统,例如基于病毒、脂质或复合物的递送或纳米载体。从具有较少可能临床相关性的最初应用开始,当通过流体动力高压注射系统性地将核酸用于肾脏细胞时,已经将广泛多种基因治疗性病毒和非病毒载体应用于靶向不同动物肾脏疾病模型体内的转录后事件(Csaba Révész和PéterHamar(2011).Delivery Methods to Target RNAs in the Kidney,Gene TherapyApplications,Prof.Chunsheng Kang(编),ISBN:978-953-307-541-9,InTech,获自:www.intechopen.com/books/gene-therapy-applications/delivery-methods-to-target-rnas-inthe-kidney)。肾脏的递送方法可包括Yuan等人(Am J Physiol RenalPhysiol 295:F605-F617,2008)中的方法,其研究了靶向花生四烯酸酸代谢的12/15-脂氧合酶(12/15-LO)途径的小干扰RNA(siRNA)的体内递送是否可改善链脲佐菌素注射的1型糖尿病小鼠模型中的肾损伤和糖尿病性肾病(DN)。为了在肾脏中获得更大的体内接近和siRNA表达,Yuan等人使用了与胆固醇缀合的双链12/15-LO siRNA寡核苷酸。将约400μg的siRNA皮下注射到小鼠中。Yuang等人的方法可应用于本发明的CRISPR Cas系统,其考虑将1-2g与胆固醇缀合的CRISPR Cas皮下注射至人类以递送至肾脏。
Molitoris等人(J Am Soc Nephrol 20:1754-1764,2009)利用近端肾小管细胞(PTC)作为肾脏内寡核苷酸重吸收的位点来测试靶向p53的siRNA的功效,p53是凋亡途径中的关键蛋白,以预防肾脏损伤。缺血性损伤后4小时静脉注射p53的裸合成siRNA最大程度地保护了PTC和肾脏功能。Molitoris等人的数据表明,静脉内施用后,siRNA迅速递送至近端小管细胞。为了进行剂量反应分析,向大鼠注射siP53的剂量,在相同的四个时间点分别给予0.33、1、3或5mg/kg,导致累积剂量分别为1.32、4、12和20mg/kg。与PBS处理的缺血性对照大鼠相比,所有测试的siRNA剂量在第一天就产生了SCr降低作用,并且在大约五天内更高的剂量是有效的。12和20mg/kg的累积剂量提供了最佳的保护作用。Molitoris等人的方法可应用于本发明的核酸靶向系统,其考虑向人类递送12和20mg/kg的累积剂量以递送至肾脏。
Thompson等人(Nucleic Acid Therapeutics,第22卷,第4期,2012)报道了在啮齿动物和非人类灵长类动物中静脉内施用后合成的小干扰RNA I5NP的毒理学和药代动力学特性。I5NP被设计为经由RNA干扰(RNAi)途径起作用,以暂时抑制促凋亡蛋白p53的表达,并且正在开发用于保护细胞免受急性缺血/再灌注损伤,例如在重大心脏外科手术时可能出现的急性肾损伤以及肾移植后可能发生的移植物功能延迟。在啮齿动物中需要800mg/kgI5NP的剂量以及在非人类灵长类动物中需要1,000mg/kg I5NP的剂量才会引起不良反应,所述物质在猴子中分离以引导对血液的影响,包括亚临床激活补体以及凝血时间略有增加。在大鼠中,未观察到大鼠I5NP类似物的其他不良反应,表明所述作用可能代表合成RNA双链体的类别作用,而不是与I5NP预期药理活性有关的毒性。综上所述,这些数据支持在急性缺血/再灌注损伤后静脉内施用I5NP以保持肾功能的临床测试。在猴子中未观察到的不良反应水平(NOAEL)为500mg/kg。以高达25mg/kg的剂量水平静脉内施用后,在猴子中未观察到对心血管、呼吸和神经系统参数的影响。因此,可考虑相似剂量用于将CRISPR Cas静脉内施用至人类的肾脏。
Shimizu等人(J Am Soc Nephrol 21:622-633,2010)开发了一种系统,可经由基于聚(乙二醇)-聚(L-赖氨酸)的媒介物将siRNA靶向递送至肾小球。siRNA/纳米载体复合物的直径约为10至20nm,其大小将使其能够穿过有孔的内皮移动而进入肾小球系膜。腹膜内注射荧光标记的siRNA/纳米载体复合物后,Shimizu等人在血液循环中长时间检测到siRNA。反复腹膜内施用有丝分裂原激活的蛋白激酶1(MAPK1)siRNA/纳米载体复合物抑制了肾小球肾炎小鼠模型中的肾小球MAPK1 mRNA和蛋白质表达。为了研究siRNA的积累,将与PIC纳米载体复合的Cy5标记的siRNA(0.5ml,5nmol的siRNA含量),裸露的Cy5标记的siRNA(0.5ml,5nmol)或包封在HVJ-E中的Cy5标记的siRNA(0.5ml,5nmol的siRNA含量)施用于BALBc小鼠。Shimizu等人的方法可应用于本发明的核酸靶向系统,考虑将约1-2升的与纳米载体复合的约10-20μmol CRISPR Cas的剂量用于腹膜内施用于人类并递送至肾脏。
本领域普通技术人员可利用如本文所公开的C2c1-CRISPR系统用如Shimizu等人、Thompson等人和Molitoris等人中所述的方法使用本文公开的方法。关于C2c1蛋白,CRISPR-C2c1系统可识别为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
肾脏的递送方法总结如下:
靶向肝脏或肝细胞
提供了靶向肝细胞。这可以是体外或体内的。肝细胞是优选的。CRISPR蛋白例如本文的C2c1的递送可经由病毒载体、尤其是AAV(并且特别是AAV2/6)载体。这些可通过静脉内注射施用。
无论在体外或体内,肝脏的优选靶标都是白蛋白基因。这是所谓的“安全港”,因为白蛋白以很高的水平表达,因此可容许在成功的基因编辑后白蛋白产生的某些减少。由于从白蛋白启动子/增强子可见的高水平表达允许实现有用水平的正确或转基因产生(从插入的供体模板产生),即使仅编辑少量肝细胞,这也是优选的。
Wechsler等人(在美国血液学会第57届年会和博览会上的报告,摘要可在线获自ash.confex.com/ash/2015/webprogram/Paper86495.html并于2015年12月6日提交)已经表明白蛋白的内含子1为合适的靶位点。他们的工作使用锌指在该靶位点切割DNA,并且可生成合适的指导序列来引导CRISPR蛋白在同一位点进行切割。
如Wechsler等人报道,在高表达基因(具有高活性增强子/启动子的基因)例如白蛋白中使用靶标也可允许使用无启动子的供体模板,并且这在肝脏靶向外部也广泛适用。高表达基因的其他实例是已知的。
其他肝脏疾病
在特定的实施方案中,本发明的CRISPR蛋白用于治疗肝脏病症,例如转甲状腺素蛋白淀粉样变性(ATTR),α-1抗胰蛋白酶缺乏症和其他基于肝的先天性代谢错误。FAP是由编码转甲状腺素蛋白(TTR)的基因突变引起的。尽管它是常染色体显性疾病,但并非所有携带者都会患上该疾病。已知TTR基因中有超过100个突变与该疾病相关。常见突变的实例包括V30M。利用iRNA的研究已证明了基于基因沉默的TTR治疗原理(Ueda等人,2014TranslNeurogener.3:19)。威尔逊氏病(WD)是由编码ATP7B的基因突变引起的,该基因仅在肝细胞中发现。与WD相关的突变超过500种,在特定地区(例如东亚)的患病率增加。其他实例是A1ATD(一种由SERPINA1基因突变引起的常染色体隐性疾病)和PKU(一种由苯丙氨酸羟化酶(PAH)基因突变引起的常性隐性疾病)。
在一个方面,本发明提供了一种治疗肝脏病症的方法,所述方法包括将包含与tracr RNA复合的C2c1-CRISPR、包含指导序列和正向重复序列的指导RNA的C2c1-CRIPSR系统递送至细胞,其中所述指导序列与涉及肝脏疾病的基因的靶序列杂交,所述CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
肝相关性血液病症,尤其是血友病并且特别是乙型血友病
已在小鼠(体外和体内)和非人类灵长类动物(体内)中成功完成了肝细胞的基因编辑,这表明通过基因编辑/基因组工程改造肝细胞来治疗血液病症是可行的。特别地,已经在非人类灵长类动物中显示了人类F9(hF9)基因在肝细胞中的表达,表明对于人类乙型血友病的治疗。在一个方面,本发明提供了一种治疗肝脏相关血液病症的方法,其包括将C2c1-CRIPSR系统递送至细胞,所述系统包含与tracr RNA复合的C2c1-CRISPR、包含指导序列和正向重复序列的指导RNA,其中所述指导序列与涉及肝脏疾病的基因的靶序列杂交,所述CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
Wechsler等人在美国血液学会第57届年会和博览会上报道(摘要呈现于2015年12月6日并且可在线获自ash.confex.com/ash/2015/webprogram/Paper86495.html),他们已经通过体内基因编辑在非人类灵长类动物中成功表达了来自肝细胞的人类F9(hF9)。使用1)靶向白蛋白基因座的内含子1的两个锌指核酸酶(ZFN)和2)人F9供体模板构建体可实现这一点。ZFN和供体模板在静脉内注射的单独的肝细胞性腺相关病毒血清型2/6(AAV2/6)载体上编码,从而导致将hF9基因的校正拷贝靶向插入一定比例的肝细胞中的白蛋白基因座中。
白蛋白基因座被选为“安全港”,因为这种最丰富的血浆蛋白的产量超过10克/天,并且这些水平的适度降低具有良好的耐受性。基因组编辑的肝细胞产生了治疗量的正常hFIX(hF9),而不是由高活性白蛋白增强子/启动子驱动的白蛋白。显示了hF9转基因在白蛋白基因座上的靶向整合以及该基因剪接成白蛋白转录物。
小鼠研究:经由尾静脉注射向C57BL/6小鼠施用了以1.0x 1013载体基因组(vg)/kg编码小鼠替代试剂的媒介物(n=20)或AAV2/6载体(n=25)。在经治疗的小鼠中血浆hFIX的ELISA分析显示,在6个月的研究持续时间内,峰值水平一直维持在50-1053ng/mL。来自小鼠血浆的FIX活性的分析证实了生物活性与表达水平相当。
非人类灵长类动物(NHP)研究:编码NHP靶向白蛋白特异性ZFN的AAV2/6载体和人类F9供体的单次静脉内共输注,1.2x1013 vg/kg(n=5/组),在这个大型动物模型中导致>50ng/mL(>正常水平的1%)。在研究持续时间(3个月)内,在几只动物中使用较高的AAV2/6剂量(至多1.5x1014 vg/kg)产生的血浆hFIX水平至多为1000ng/ml(或正常水平的20%),并且在单个动物中为至多2000ng/ml(或正常水平的50%)。
所述治疗在小鼠和NHP中耐受良好,在任何剂量下在任一物种中均未与AAV2/6ZFN+供体治疗相关的明显毒理学发现。此后,Sangamo(CA,USA)已向FDA申请并获得了进行体内基因组编辑应用的全球首个人类临床试验的许可。这是基于EMEA批准Glybera基因疗法治疗脂蛋白脂肪酶缺乏症。
因此,在一些实施方案中,优选使用以下的任何或全部:AAV(特别是AAV2/6)载体,优选通过静脉内注射施用;白蛋白作为基因编辑/转基因插入/模板的靶标,特别是在白蛋白内含子1处;人类F9供体模板;和/或无启动子的供体模板。
乙型血友病
因此,在一些实施方案中,优选将本发明用于治疗乙型血友病。因此,优选通过提供合适的指导RNA来靶向F9(因子IX)。尽管可将它们一起或分开递送,但理想地,酶和指导物可靶向产生F9的肝脏。在一些实施方案中,提供了模板,并且其是人类F9基因。应当理解,hF9模板包含hF9的wt或“适当”版本,使得治疗是有效的。在一些实施方案中,可使用双载体系统,一个载体用于C2c1并且一个载体用于修复模板。修复模板可包括两个或更多个修复模板,例如,来自不同哺乳动物物种的两个F9序列。在一些实施方案中,提供了小鼠和人类F9序列。这可递送至小鼠。Yang Yang,John White,McMenamin Deirdre和Peter Bell,PhD(提供于第58届美国血液学会年度会议(2016年11月))报道,这提高了效力和准确性。第二个载体将因子IX的人类序列插入小鼠基因组中。在一些实施方案中,靶向插入导致嵌合的高活性因子IX蛋白的表达。在一些实施方案中,这在天然小鼠因子IX启动子的控制下。以增加的剂量将这种双组分系统(载体1和载体2)注射到新生和成年“敲除”小鼠中,导致在正常(或甚至更高)水平上稳定的IX因子活性的表达和活性超过四个月。在治疗人类的情况下,可替代地使用天然人类F9启动子。在一些实施方案中,wt表型被恢复。
在一个替代实施方案中,可递送F9的乙型血友病形式,以便产生模型生物体、细胞或细胞系(例如鼠类或非人类灵长类模型生物体、细胞或细胞系),所述模型生物体、细胞或细胞系具有或带有乙型血友病表型(即无法产生wt F9)。
甲型血友病
在一些实施方案中,F9(因子IX)基因可被上述F8(因子VIII)基因代替,从而导致甲型血友病的治疗(通过提供适当的F8基因)和/或产生甲型血友病模型生物体、细胞或细胞系(通过提供不适当的F8基因的甲型血友病形式)。
丙型血友病
在一些实施方案中,F9(因子IX)基因可被上述F11(因子XI)基因代替,从而导致丙型血友病的治疗(通过提供适当的F11基因)和/或产生丙型血友病模型生物体、细胞或细胞系(通过提供不适当的F11基因的丙型血友病形式)。
转甲状腺素蛋白淀粉样变性
转甲状腺素蛋白是一种蛋白质,主要在肝脏中产生,存在于血清和CSF中,其携带与视黄醇(维生素A)结合的甲状腺素激素和视黄醇结合蛋白。超过120种不同的突变可引起转甲状腺素蛋白淀粉样变性(ATTR),这是一种遗传性病症,其中蛋白质的突变形式聚集在组织中,尤其是周围神经系统中,引起多发性神经病。家族性淀粉样蛋白多发性神经病(FAP)是最常见的TTR病症,并且在2014年,据认为该疾病影响了欧洲每100,000人中的47人。Val30Met的TTR基因突变被认为是最常见的突变,导致FAP病例的估计50%。在没有肝移植手术(迄今为止唯一已知的治愈方法)的情况下,所述疾病通常在诊断后的十年内致命。大多数情况是单基因的。
在ATTR的小鼠模型中,可通过递送CRISPR/Cas9以剂量依赖性方式编辑TTR基因。在一些实施方案中,C2c1作为mRNA提供。在一些实施方案中,C2c1 mRNA和指导RNA包装在LNP中。包含C2c1 mRNA和包装在LNP中的指导RNA的系统在肝脏中的编辑效率高达60%,而血清TTR水平降低了高达80%。因此,在一些实施方案中,转甲状腺素蛋白是靶向的,特别是校正Val30Met突变。因此,在一些实施方案中,治疗ATTR。
α-1抗胰蛋白酶缺乏症
α-1抗胰蛋白酶(A1AT)是一种在肝脏中产生的蛋白质,其主要功能是降低肺中性粒细胞弹性蛋白酶(一种降解结缔组织的酶)的活性。α-1抗胰蛋白酶缺乏症(ATTD)是由编码A1AT的SERPINA1基因的突变引起的疾病。A1AT的产生受损会导致肺结缔组织逐渐退化,从而导致肺气肿样症状。
尽管最常见的突变是Glu342Lys(称为Z等位基因,野生型称为M)或Glu264Val(称为S等位基因),但有若干突变可能会导致ATTD,并且每个等位基因均对疾病状态有同等的贡献,其中两个受影响的等位基因导致更明显的病理生理学。这些结果不仅导致例如肺的敏感器官的结缔组织退化,但是肝中突变体的积累会导致蛋白毒性。目前的治疗重点是通过注射从捐献的人类血浆中回收的蛋白质来代替A1AT。在严重的情况下,可考虑肺和/或肝移植。
此外,所述疾病的常见变异体是单基因的。在一些实施方案中,SERPINA1基因是靶向的。在一些实施方案中,校正Glu342Lys突变(称为Z等位基因,野生型称为M)或Glu264Val突变(称为S等位基因)。因此,在一些实施方案中,有缺陷的基因将需要被野生型功能基因代替。在一些实施方案中,需要敲除和修复方法,因此提供了修复模板。在双等位基因突变的情况下,在一些实施方案中,纯合突变仅需要一个指导RNA,但是在杂合突变的情况下,可能需要两个指导RNA。在一些实施方案中,递送至肺或肝。
先天性代谢错误
先天性代谢错误(IEM)是影响代谢过程的疾病统称。在一些实施方案中,将治疗IEM。这些疾病中的大多数本质上是单基因的(例如苯丙酮尿症),并且其病理生理学是由固有毒性物质的异常积累或导致无法合成必需物质的突变引起的。根据IEM的性质,可使用CRISPR/C2c1单独进行敲除,或与经由修复模板代替有缺陷的基因组合使用。在一些实施方案中,可受益于CRISPR/C2c1技术的示例性疾病为:原发性高草酸尿症1型(PH1)、精氨琥珀酸裂解酶缺乏症、鸟氨酸转氨甲酰酶缺乏症、苯丙酮尿症或PKU,以及枫糖浆尿病。
治疗上皮和肺部疾病
本发明还考虑了将本文所述的CRISPR-Cas系统例如C2c1效应蛋白系统递送至一个或两个肺。
尽管最初建议将基于AAV-2的载体用于CFTR递送至CF气道,但其他血清型(例如AAV-1、AAV-5、AAV-6和AAV-9)在多种肺上皮模型中均表现出提高的基因转移效率(参见例如Li等人,Molecular Therapy,第17卷第12期,2067-2077,2009年12月)。在体外转导人气道上皮细胞方面,AAV-1的效率显示比AAV-2和AAV-5高约100倍,5尽管AAV-1在体内转导鼠类气管气道上皮细胞的效率与AAV-5相同。其他研究表明,在体外将基因递送至人气道上皮(HAE)时,AAV-5的效率比AAV-2高50倍,而在体内小鼠肺气道上皮中,AAV-5的效率显著更高。在体外在人类气道上皮细胞中和在体内在鼠类气道中,AAV-6也证明比AAV-2更有效。8在体内鼠类鼻和肺泡上皮中,最近的分离株AAV-9被证明比AAV-5具有更高的基因转移效率,检测到的基因表达超过9个月,这表明AAV可在体内长期表达基因,这是CFTR基因递送载体的理想特性。此外,已证明可将AAV-9再次施用至鼠类肺中,而不会损失CFTR表达并且免疫影响最小。CF和非CF HAE培养物可在顶表面上用100μl AAV载体接种数小时(参见例如Li等人,Molecular Therapy,第17卷第12期,2067-2077,2009年12月)。MOI可从1×103至4×105个载体基因组/细胞变化,取决于病毒浓度和实验目的。上述载体被考虑用于本发明的递送和/或施用。
Zamora等人(Am J Respir Crit Care Med,第183卷,第531-538页,2011)报道了RNA干扰治疗剂在人类感染性疾病治疗中以及呼吸道合胞病毒(RSV)感染的肺移植受者中抗病毒药物的随机试验的应用实例。Zamora等人在患有RSV呼吸道感染的LTX接受者中进行了一项随机、双盲、安慰剂对照试验。允许患者接受RSV的标准护理。每天施用气雾化的ALN-RSV01(0.6mg/kg)或安慰剂,持续3天。这项研究表明,靶向RSV的RNAi治疗剂可安全地施用于具有RSV感染的LTX接受者。每天三剂ALN-RSV01不会导致呼吸道症状的任何加重或肺功能受损,并且也不会表现出任何全身性促炎作用,例如诱导细胞因子或CRP。药代动力学显示,吸入后仅具有低的短暂全身暴露,这与临床前动物数据一致,表明通过核酸外切酶介导的消化和肾脏排泄,经静脉内或通过吸入施用的ALN-RSV01可迅速从循环中清除。Zamora等人的方法可应用于本发明的核酸靶向系统,并且本发明可考虑例如以0.6mg/kg的剂量的气雾化的CRISPR Cas。
例如,在自主呼吸时,经支气管内递送的每个肺,接受肺部疾病治疗的受试者可例如接受药学有效量的气雾化AAV载体系统。因此,一般而言,气雾化递送优选用于AAV递送。腺病毒或AAV粒子可用于递送。各自可操作地连接至一个或多个调控序列的合适的基因构建体可被克隆到递送载体中。在这种情况下,提供以下构建体作为实例:Cas(C2c1)的Cbh或EF1a启动子,指导RNA的U6或H1启动子:一种优选的配置是使用CFTRdelta508靶向指导物,deltaF508突变的修复模板和密码子优化的C2c1酶,任选地具有一个或多个核定位信号或序列(NLS),例如两个NLS。还设想了没有NLS的构建体。
治疗肌肉系统疾病
本发明还考虑了将本文所述的CRISPR-Cas系统例如C2c1效应蛋白系统递送至肌肉。
Bortolanza等人(Molecular Therapy,第19卷第11期,2055-2064,2011年11月)显示,在面肩肱型肌营养不良症(FSHD)发作后,FRG1小鼠中的RNA干扰表达盒的系统性递送导致剂量依赖性长期FRG1敲低而无毒性迹象。Bortolanza等人发现,单次静脉注射5×1012vg的rAAV6-sh1FRG1可拯救FRG1小鼠的肌肉组织病理学和肌肉功能。详细地,使用25号Terumo注射器将200μl含2×1012或5×1012vg载体的生理溶液注射到尾静脉中。Bortolanza等人的方法可应用于表达CRISPR Cas的AAV并以约2×1015或2×1016vg载体的剂量注射至人类中。
Dumonceaux等人(Molecular Therapy,第18卷第5期,881-887,2010年5月)使用针对肌生长抑制素受体AcvRIIb mRNA(sh-AcvRIIb)的RNA干扰技术抑制肌生长抑制素途径。拟肌营养不良蛋白的恢复是通过载体化的U7外显子跳跃技术(U7-DYS)介导的。将单独携带sh-AcvrIIb构建体、单独携带U7-DYS构建体或两种构建体组合的腺相关载体注射入营养不良的mdx小鼠的胫前肌(TA)。用1011个AAV病毒基因组进行注射。Dumonceaux等人的方法可应用于表达CRISPR Cas的AAV并例如以约1014至约1015vg载体的剂量注射至人类中。
Kinouchi等人(Gene Therapy(2008)15,1126-1130)报道了通过将未化学修饰的siRNA与缺端胶原蛋白(ATCOL)形成粒子,将siRNA体内递送至正常或患病小鼠骨骼肌的有效性。ATCOL介导的靶向肌抑制素的siRNA(骨骼肌生长的负调控剂)在小鼠骨骼肌中或经静脉内的局部应用,在应用后数周内引起肌肉质量明显增加。这些结果表明,ATCOL介导的siRNA的应用是将来用于包括肌肉萎缩症在内的疾病的治疗性用途的强大工具。根据制造商的说明,将MstsiRNA(最终浓度,10mM)与ATCOL(局部施用的最终浓度,0.5%)(AteloGene,Kohken,Tokyo,Japan)混合。用Nembutal(25mg/kg,i.p.)麻醉小鼠(20周龄的雄性C57BL/6)后,将Mst-siRNA/ATCOL复合物注射到咬肌和股二头肌中。Kinouchi等人的方法可应用于CRISPR Cas并注射至人类中,例如以约500至1000ml的40μM溶液的剂量注射至肌肉中。Hagstrom等人(Molecular Therapy,第10卷,第2期,2004年8月)描述了一种血管内非病毒方法,所述方法能够将核酸有效且可重复地递送至整个哺乳动物肢体肌肉中的肌细胞(肌纤维)。所述程序涉及将裸质粒DNA或siRNA注射到通过止血带或血压袖带暂时隔离的肢体远端静脉中。快速注入足够量的核酸有助于将核酸递送至肌纤维,以使核酸溶液渗入肌肉组织。在小型和大型动物中均以最小的毒性实现了骨骼肌中高水平的转基因表达。还获得了将siRNA递送至肢体肌肉的证据。为了向恒河猴静脉内注射质粒DNA,将三通旋塞阀连接至两个注射泵(型号PHD 2000;Harvard Instruments),每个注射泵都装有一个注射器。罂粟碱注射后五分钟,以1.7或2.0ml/s的速率注射pDNA(在40-100ml盐水中为15.5至25.7mg)。对于人类,可对表达本发明的CRISPR Cas的质粒DNA按比例放大,注射于800至2000ml盐水中的约300至500mg。对于大鼠中的腺病毒载体注射,注射于3ml生理盐水溶液(NSS)中的2×109个感染性粒子。对于人类,可对表达本发明的CRISPR Cas的腺病毒载体按比例放大,注射于10升NSS中的约1×1013个感染性粒子。对于siRNA,将12.5μg的siRNA注射到大鼠的大隐静脉中,并将750μg的siRNA注射到灵长类动物的大隐静脉中。可对本发明的CRISPR Cas按比例放大,例如,向人类的大隐静脉中注射约15至约50mg。
还参见例如杜克大学(Duke University)的已公开申请WO2013163628 A2,突变基因的遗传校正(Genetic Correction of Mutated Genes),其描述了努力校正例如导致过早终止密码子和截短基因产物的移码突变,所述突变可经由核酸酶介导的非同源末端连接来校正,例如造成杜氏肌营养不良症(“DMD”)的那些突变,杜氏肌营养不良症是一种隐性的致命的X连锁病症,其由于肌营养不良蛋白基因的突变而导致肌肉变性。引起DMD的大多数肌营养不良蛋白突变是外显子的缺失,其破坏阅读框并导致肌营养不良蛋白基因的过早翻译终止。肌营养不良蛋白是一种细胞质蛋白,可为负责调节肌肉细胞完整性和功能的细胞膜的肌营养不良蛋白聚糖复合物提供结构稳定性。如本文可互换使用的肌营养不良蛋白基因或“DMD基因”在基因座Xp21处为2.2兆碱基。初级转录测量为约2,400kb,其中成熟mRNA为约14kb。79个外显子编码超过3500个氨基酸的蛋白质。外显子51在DMD患者中经常与破坏框架的缺失相邻,并且已成为基于寡核苷酸的外显子跳跃的临床试验的靶标。最近,一项关于外显子51跳跃化合物eteplirsen的临床试验报道,在48周内有显著的功能益处,肌营养不良蛋白阳性纤维与基线相比为平均47%。外显子51中的突变非常适合通过基于NHEJ的基因组编辑进行永久校正。
转让给Cellectis的美国专利公开第20130145487号的方法,其涉及从人类肌营养不良蛋白基因(DMD)切割靶序列的大范围核酸酶变体,也可被修改为用于本发明的核酸靶向系统。在优选的实施方案中,核酸靶向系统包含CRISPR-C2c1系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
治疗皮肤疾病
本发明还考虑了将本文所述的CRISPR-Cas系统例如C2c1效应蛋白系统递送至皮肤。
Hickerson等人(Molecular Therapy—Nucleid Acids(2013)2,e129)涉及一种电动微针阵列皮肤递送装置,用于向人类和鼠类皮肤递送自递送(sd)-siRNA。将基于siRNA的皮肤治疗剂转化到临床的主要挑战是开发有效的递送系统。在各种皮肤递送技术中已投入大量精力,但收效甚微。在一项用siRNA进行皮肤治疗的临床研究中,与皮下注射针注射相关的剧烈疼痛使该试验的其他患者无法参加,这强调了需要改善的对患者更友好(即几乎没有疼痛)的递送方法。微针代表跨主要屏障角质层递送包括siRNA的大型带电货物的有效方式,并且通常被认为比传统的皮下注射针疼痛小。电动“邮票型”微针装置,包括Hickerson等人使用的电动微针阵列(MMNA)装置,已被证明在无毛小鼠研究中是安全的,并且几乎不会引起疼痛,如以下所证明:(i)在化妆品行业中广泛使用,和(ii)几乎所有志愿者都发现使用所述装置的疼痛比小针剂(flushot)少得多的有限测试,这表明使用该装置进行siRNA递送所导致的疼痛要比以前使用皮下注射针注射进行的临床试验所经历的疼痛少得多。MMNA装置(由韩国首尔的Bomtech Electronic公司以Triple-M或Tri-M销售)适于向小鼠和人类皮肤递送siRNA。将sd-siRNA溶液(至多300μl的0.1mg/ml RNA)引入一次性Tri-M针盒(Bomtech)的腔室中,其深度设置为0.1mm。为了治疗人类皮肤,在治疗之前,手动拉伸未标识的皮肤(在外科手术后立即获得),并钉在软木平台上。所有皮内注射均使用带有28号0.5英寸针的胰岛素注射器进行。Hickerson等人的MMNA装置和方法可用于和/或适于将本发明的CRISPR Cas例如以至多300μl的0.1mg/ml CRISPR Cas的剂量递送至皮肤。
Leachman等人(Molecular Therapy,第18卷第2期,442-446,2010年2月)涉及用于治疗罕见皮肤病症先天性厚甲(PC)(包括致残的足底角皮病的常染色体显性综合征)的Ib期临床试验,其利用第一种基于短干扰RNA(siRNA)的皮肤治疗剂。这种称为TD101的siRNA特异性且有效地靶向角蛋白6a(K6a)N171K突变体mRNA,而不会影响野生型K6a mRNA。
Zheng等人(PNAS,2012年7月24日,第109卷,第30期,11975-11980)显示球形核酸粒子缀合物(SNA-NC),金核被高度定向的共价固定的siRNA的致密壳包围,在应用后数小时内即可自由渗透几乎100%的体外角质形成细胞、小鼠皮肤和人类表皮。Zheng等人证明了单次应用25nM表皮生长因子受体(EGFR)SNA-NC持续60小时可在人类皮肤中显示有效的基因敲低。用于皮肤施用,对于固定在SNA-NC中的CRISPR Cas,可考虑类似的剂量。Zheng等人、Leachman等人和Hickerson等人的方法还可被修改用于本发明的核酸靶向系统。在优选的实施方案中,核酸靶向系统包含CRISPR-C2c1系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
癌症
在一些实施方案中,提供了癌症的治疗、预防或诊断。靶标优选是FAS、BID、CTLA4、PDCD1、CBLB、PTPN6、TRAC或TRBC基因中的一种或多种。癌症可以是以下中的一种或多种:淋巴瘤,慢性淋巴细胞性白血病(CLL),B细胞急性淋巴细胞性白血病(B-ALL),急性淋巴母细胞性白血病,急性骨髓性白血病,非霍奇金淋巴瘤(NHL),弥漫性大细胞淋巴瘤(DLCL),多发性骨髓瘤,肾细胞癌(RCC),成神经细胞瘤,结直肠癌,去势抵抗性前列腺癌,转移性肾细胞癌,转移性非小细胞肺癌,乳腺癌,膀胱癌,卵巢癌,黑色素瘤,肉瘤,前列腺癌,肺癌,食道癌,肝细胞癌,胰腺癌,星形细胞瘤,间皮瘤,头颈癌和髓母细胞瘤。这可用工程化的嵌合抗原受体(CAR)T细胞来实现。这在WO2015161276中描述,所述文件的公开内容通过引用并入本文并在下文描述。
提出并描述了利用CRISPR-Cas9系统通过产生PD-1敲除T细胞来治疗多种癌症,包括食道癌、浸润性膀胱癌、激素难治性前列腺癌、转移性肾细胞癌、转移性非小细胞肺癌、IV期胃癌、IV期鼻咽癌、IV期t细胞淋巴瘤和与Epstei-Barr病毒相关的恶性疾病。参见Niu等人,Cell 2014,156(4):836-43;Rosenberg等人,Science 2015,348(6230):62-8;Sharma等人,Cell 2015,161(2):205-14;Bidnur等人,Bladder Cancer,2016,2(1):15-25;Kim等人,Investig Clin Urol.2016,57增刊1:S98-S105;Argon-Ching等人,Future Oncol.,2016,12(17):2049-58;Festino等人,Drugs 2016,76(9):925-45;Zibelman等人,Future Oncl.,2016,12(19):2227-42;Doni等人,J.Urol.,2017 197(1):14-22;Yi等人,Biochim BiophysActa.,2016,1866(2):197-207;Taube等人,Oncoimmunology,2014,3(11)L e963413;Yatsuda等人,Nihon Rinsho,2014,72(12):2174-8;Modena等人,Oncol Rev.2016,10(1):293;Bishop等人,Oncotarget,2015,6(1):234-42;Gandini等人,Crit Rev OncolHematol.2016,100:88-98;Koshikin等人,Expert Opin Pharmacother.2016 17(9):1225-32;Hofmann等人,Eur J Cancer.2016,60:190-209;Gunturi等人,Curr Treat OptionsOncol.2014,15(1):137-46;Bockorny等人,Expert Opin Biol Ther.2013,13(6):911-25;Garon等人,N Engl J Med 2015,372(21)L 2018-28;Brahmer等人,N Eng J Med,2015 373(2):123-35;Borghaei等人,N Engl JH Med 2015,373(17):1627-39;Kim等人,Gastroenterology,2015 148(1):137-147;Quan等人,PloS One,2015,10(9):30136476;Louis等人,J Immunother.,2010,33(9):983-90;Lloyd等人,Frot Immunol.,2013,4:221;Su等人,Sci Rep.2016,6:20070。将收集外周血淋巴细胞,并在实验室中通过CRISPR Cas9敲除程序性细胞死亡蛋白1(PDCD1)基因(PD-1敲除T细胞)。选择淋巴细胞并离体扩增并输回患者体内。一个周期共注入2×10
在一些实施方案中,适合于治疗或预防癌症的靶基因可包括WO2015048577中描述的那些,所述文件的公开内容通过引用并入本文。WO2015161276和WO2015048577的方法也可被修改以用于本发明的核酸靶向系统。
本文公开的CRISPR-C2c1系统可与上述癌症治疗方法一起应用。在优选的实施方案中,核酸靶向系统包含CRISPR-C2c1系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。与Cas9在PAM的近端发生切割相反,C2c1在PAM的远端产生双链断裂(Jinek等人,2012;Cong等人,2013)。提出C2c1突变的靶序列可能易于被单个gRNA重复切割,因此促进C2c1在HDR介导的基因组编辑中的应用(Front Plant Sci.2016年11月14日;7:1683)。在某些实施方案中,通过CRISPR-C2c1复合物经由同源性定向修复(HR或HDR)来修饰目标基因座。在某些实施方案中,通过不依赖于HR的CRISPR-C2c1复合物来修饰目标基因座。在某些实施方案中,通过CRISPR-C2c1复合物经由非同源末端连接(NHEJ)来修饰目标基因座。
与Cas9产生的钝端相反,C2c1产生了带有5'突出端的交错切口(Garneau等人,Nature.2010;468:67-71;Gasiunas等人,Proc Natl Acad Sci U S A.2012;109:E2579-2586)。切割产物的这种结构对于促进基于非同源末端连接(NHEJ)的基因插入哺乳动物基因组可能特别有利(Maresca等人,Genome research.2013;23:539-546)。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源DNA插入。在某些实施方案中,由CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列来修饰目标基因座。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。在优选的实施方案中,利用CRISPR-C2c1系统在非分裂细胞中修饰目标基因座,其中经由同源性定向修复(HDR)机制进行基因组编辑特别具有挑战性(Chan等人,Nucleic acids research.2011;39:5955-5966)。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将带有5'突出端的短双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ途径介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于Meresca等人和He等人中所述的方法,以利用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。参见Zhang等人,Genome Biology201718:35;He等人,Nucleic Acids Research,44:9,2016。
Usher综合征或色素性视网膜炎-39
在一些实施方案中,提供了对Usher综合征或色素性视网膜炎-39的治疗、预防或诊断。靶标优选是USH2A基因。在一些实施方案中,提供了对位置2299处的G缺失(2299delG)的校正。这在WO2015134812A1中描述,所述文件的公开内容通过引用并入本文。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
自身免疫性和发炎性病症
在一些实施方案中,治疗自身免疫性和发炎性病症。例如,这些病症包括多发性硬化症(MS)或类风湿关节炎(RA)。
囊性纤维化(CF)
在一些实施方案中,提供了囊性纤维化的治疗、预防或诊断。靶标优选是SCNN1A或CFTR基因。这在WO2015157070中描述,所述文件的公开内容通过引用并入本文。
Schwank等人(Cell Stem Cell,13:653-58,2013)使用CRISPR-Cas9校正与人类干细胞的囊性纤维化相关的缺陷。研究小组的靶标是离子通道基因,囊性纤维化跨膜导体受体(CFTR)。CFTR缺失会导致所述蛋白质在囊性纤维化患者中错误折叠。使用从两个患有囊性纤维化的儿童的细胞样品发育的培养的肠干细胞,Schwank等人能够使用CRISPR以及包含待插入修复序列的供体质粒来校正缺陷。然后,研究人员将细胞培养成肠“类器官”或微型肠,并且表明它们功能正常。在这种情况下,大约一半的克隆类器官经历了适当的遗传校正。
在一些实施方案中,例如治疗囊性纤维化。因此,优选递送至肺。优选地校正F508突变(δ-F508,全名CFTRΔF508或F508del-CFTR)。在一些实施方案中,靶标可以是ABCC7、CF或MRP7。
在另一个实施方案中,转让给Editas medicine的专利公开US20170022507的方法,涉及用于治疗囊性纤维化的Crispr-Cas相关的方法和组合物,其可被修改以用于本发明中公开的CRISPR-Cas系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
杜氏肌营养不良症
杜氏肌营养不良症(DMD)是一种隐性的与性相关的肌肉萎缩性疾病,会影响大约1/5,000的出生男性。肌营养不良蛋白基因的突变导致骨骼肌中肌营养不良蛋白的缺失,在正常情况下,肌营养不良蛋白基因的功能是将肌纤维的细胞骨架连接至基底层。肌营养不良蛋白的缺乏是由于这些突变导致过多的钙进入体细胞,导致线粒体破裂,从而破坏了细胞。当前的治疗方法着重于缓解DMD症状,并且平均预期寿命约为26年。
在小鼠模型中已经证明了CRISPR/Cas9作为某些类型DMD的治疗的功效。在一项此类研究中,通过敲除突变体外显子从而产生功能蛋白,小鼠中的肌营养不良症表型得到部分校正(参见Nelson等人(2016)Science;Long等人(2016)Science;和Tabebordbar等人(2016)Science)。
在一些实施方案中,转让给Editas Medine的专利公开WO2016161380的方法,涉及治疗DMD的Crispr相关方法,其可被修改以用于本发明的CRISPR-Cas系统。在一些实施方案中,治疗DMD。在一些实施方案中,通过注射递送至肌肉。在一些实施方案中,所述CRISPR蛋白是C2c1,并且所述系统包含:I.CRISPR-Cas系统RNA多核苷酸序列,其中所述多核苷酸序列包含:(a)tracr RNA多核苷酸和能够与靶序列杂交的指导RNA多核苷酸,和(b)正向重复RNA多核苷酸,和II.编码C2c1的多核苷酸序列,其任选地包含至少一个或多个核定位序列,其中所述正向重复序列与所述指导序列杂交并引导CRISPR复合物与靶序列的序列特异性结合,并且其中所述CRISPR复合物包含与以下各物复合的CRISPR蛋白:(1)与靶序列杂交或可杂交的指导序列,和(2)正向重复序列,并且编码CRISPR蛋白的多核苷酸序列是DNA或RNA。
在一些实施方案中,CRISPR-C2c1系统识别富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在某些实施方案中,目标基因座由CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列而修饰。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将具有5'突出端的短的双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ途径介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于如Meresca等人和He等人中所述的方法,以利用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。
糖原贮积病,包括1a
糖原贮积病1a是一种由于葡萄糖-6-磷酸酶缺乏引起的遗传疾病。所述缺乏会损害肝脏从糖原和糖异生产生游离葡萄糖的能力。在一些实施方案中,靶向编码葡萄糖-6-磷酸酶的基因。在一些实施方案中,治疗糖原贮积病1a。在一些实施方案中,通过将C2c1(以蛋白质或mRNA形式)包封在脂质粒子如LNP中而递送至肝脏。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
在一些实施方案中,例如通过靶向与疾患/疾病/感染相关的多核苷酸,靶向并优选治疗糖原贮积病,包括1a。相关的多核苷酸包括DNA,其可包括基因(其中基因包括任何编码序列和调控元件,例如增强子或启动子)。在一些实施方案中,相关的多核苷酸可包括SLC2A2、GLUT2、G6PC、G6PT、G6PT1、GAA、LAMP2、LAMPB、AGL、GDE、GBE1、GYS2、PYGL或PFKM基因。
Hurler综合征
Hurler综合征,也称为I型粘多糖贮积病(MPS I)、Hurler病,是一种遗传病症,由于缺乏α-L异丁糖醛酸酶(一种负责降解溶酶体中粘多糖的酶)而导致糖胺聚糖(以前称为粘多糖)的积累。Hurler综合征通常被分类为溶酶体贮积病,并且在临床上与Hunter综合征相关。Hunter综合征是X连锁的,而Hurler综合征是常染色体隐性遗传的。根据症状的严重程度,MPS I分为三种亚型。所有三种类型都是由于缺乏或不足的酶α-L-艾杜糖醛酸酶水平造成的。MPS IH或Hurler综合征是MPS I亚型中最严重的一种。其他两种类型是MPS I S或Scheie综合征和MPS I H-S或Hurler-Scheie综合征。MPS I父母所生的孩子携带有缺陷性IDUA基因,该基因已被定位到4号染色体上的4p16.3位点。该基因被命名为IDUA的原因是其艾杜糖醛酸酶蛋白质产物。截至2001年,已显示IDUA基因的52个不同突变导致了Hurler综合征。通过经由逆转录病毒、慢病毒、AAV和甚至非病毒载体递送艾杜糖醛酸酶基因,成功治疗MPS I的小鼠、狗和猫模型。
在一些实施方案中,靶向α-L-艾杜糖醛酸酶基因并且优选提供修复模板。在一些实施方案中,所述CRISPR蛋白是C2c1,并且所述系统包含:I.CRISPR-Cas系统RNA多核苷酸序列,其中所述多核苷酸序列包含:(a)能够与靶序列杂交的指导RNA多核苷酸,和(b)正向重复RNA多核苷酸,和II.编码C2c1的多核苷酸序列,其任选地包含至少一个或多个核定位序列,其中所述正向重复序列与所述指导序列杂交并引导CRISPR复合物与靶序列的序列特异性结合,并且其中所述CRISPR复合物包含与以下各物复合的CRISPR蛋白:(1)与靶序列杂交或可杂交的指导序列,和(2)正向重复序列,并且编码CRISPR蛋白的多核苷酸序列是DNA或RNA。在某些实施方案中,C2c1效应蛋白识别富含T的PAM。在特定的实施方案中,PAM是5'-TTN-3'或5'-ATTN-3'。在某些实施方案中,与MPS I有关的目标基因座由CRISPR-C2c1复合物通过产生具有5'突出端的交错切口来修饰。在一些实施方案中,5'突出端为7nt。在一些实施方案中,交错切口之后是NHEJ或HDR。在某些实施方案中,目标基因座由CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列而修饰。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将带有5'突出端的短双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ途径介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于Meresca等人和He等人中所述的方法,以利用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。
HIV和AIDS
在一些实施方案中,提供了HIV和AIDS的治疗、预防或诊断。靶标优选是HIV中的CCR5基因。这在WO2015148670A1中描述,所述文件的公开内容通过引用并入本文。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
β地中海贫血和镰状细胞病(SCD)
在一些实施方案中,提供了β地中海贫血的治疗、预防或诊断。靶标优选是BCL11A基因。这在WO2015148860中描述,所述文件的公开内容通过引用并入本文。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
在一些实施方案中,提供了镰状细胞病(SCD)的治疗、预防或诊断。靶标优选是HBB或BCL11A基因。这在WO2015148863中描述,所述文件的公开内容通过引用并入本文。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。在某些实施方案中,目标基因座由CRISPR-C2c1复合物通过插入或“敲入”模板DNA序列而修饰。在特定的实施方案中,将DNA插入物设计成以适当的方向整合到基因组中。在优选的实施方案中,利用CRISPR-C2c1系统在非分裂细胞中修饰目标基因座,其中经由同源性定向修复(HDR)机制进行基因组编辑特别具有挑战性(Chan等人,Nucleic acids research.2011;39:5955-5966)。Maresca等人(Genome Res.2013年3月;23(3):539-546)描述了一种适用于锌指核酸酶(ZFN)和Tale核酸酶(TALEN)的定点精确插入方法,其中将带有5'突出端的短双链DNA连接至互补端,这允许15kb外源表达盒在人类细胞系中的限定基因座的精确插入。He等人(Nucleic Acids Res.2016年5月19日;44(9))描述了CRISPR/Cas9诱导的4.6kb无启动子ires-eGFP片段在GAPDH基因座中的位点特异性敲入,在体LO2细胞中产生高达20%的GFP+细胞,以及由NHEJ途径介导的人类胚胎干细胞中的1.70%GFP+细胞,并且还报道了在所有研究的人类细胞类型中,基于NHEJ的敲入比HDR介导的基因靶向更有效。由于C2c1生成了具有5'突出端的交错切口,因此本领域普通技术人员可使用类似于Meresca等人和He等人中所述的方法,以利用本文公开的CRISPR-C2c1系统在目标基因座处产生外源DNA插入。
在某些实施方案中,目标基因座首先在PAM序列的远端利用CRISPR-C2c1系统修饰,并且在PAM序列附近利用CRISPR-C2c1系统进一步修饰并经由HDR修复。在某些实施方案中,利用CRISPR-C2c1系统通过经由HDR引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在一些实施方案中,利用CRISPR-C2c1系统通过经由NHEJ引入外源DNA序列的突变、缺失或插入来修饰目标基因座。在优选的实施方案中,外源DNA在3'端和5'端侧接单指导DNA(sgDNA)-PAM序列。在优选的实施方案中,在CRISPR-C2c1切割后释放外源DNA。
单纯疱疹病毒1和2
疱疹病毒科是由具有75-200个基因的线性双链DNA基因组组成的病毒家族。出于基因编辑的目的,最常研究的家族成员是单纯疱疹病毒-1(HSV-1),这种病毒比其他病毒载体具有多种明显优势(在Vannuci等人(2003)中综述)。因此,在一些实施方案中,病毒载体是HSV病毒载体。在一些实施方案中,HSV病毒载体是HSV-1。
HSV-1具有大约152kb双链DNA的大型基因组。该基因组包含超过80个基因,其中许多可被代替或去除,从而允许30-150kb的基因插入物。衍生自HSV-1的病毒载体通常分为3组:具有复制能力的减毒载体,无复制能力的重组载体和依赖于缺陷性辅助的载体,称为扩增子。先前已经证明了使用HSV-1作为载体的基因转移,例如用于治疗神经性疼痛(参见例如Wolfe等人(2009)Gene Ther)和类风湿性关节炎(参见例如Burton等人(2001)StemCells)。
因此,在一些实施方案中,病毒载体是HSV病毒载体。在一些实施方案中,HSV病毒载体是HSV-1。在一些实施方案中,载体用于递送一种或多种CRISPR组分。对于递送C2c1和一个或多个指导RNA,例如2个或更多个、3个或更多个、或4个或更多个指导RNA,可能特别有用。因此,在一些实施方案中,载体在多重系统中是有用的。在一些实施方案中,该递送用于治疗神经性疼痛或类风湿性关节炎。
在一些实施方案中,提供了HSV-1(单纯疱疹病毒1)的治疗、预防或诊断。靶标优选是HSV-1中的UL19、UL30、UL48或UL50基因。这在WO2015153789中描述,所述文件的公开内容通过引用并入本文。
在其他实施方案中,提供了HSV-2(单纯疱疹病毒2)的治疗、预防或诊断。靶标优选是HSV-2中的UL19、UL30、UL48或UL50基因。这在WO2015153791中描述,所述文件的公开内容通过引用并入本文。
在一些实施方案中,提供了原发性开角型青光眼(POAG)的治疗、预防或诊断。靶标优选是MYOC基因。这在WO2015153780中描述,所述文件的公开内容通过引用并入本文。本发明可通过如上所述的方法来应用。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
过继细胞疗法
本发明还考虑了本文所述的CRISPR-Cas系统例如C2c1效应蛋白系统用于修饰细胞以进行过继疗法的用途。
如本文所用,“ACT”、“过继细胞疗法”和“过继细胞转移”可互换使用。在某些实施方案中,过继细胞疗法(ACT)可指将细胞转移至患者,目的是通过细胞的植入将功能性和特性转移到新宿主中(参见例如Mettananda等人,Editing anα-globin enhancer inprimary human hematopoietic stem cells as a treatment forβ-thalassemia,NatCommun.2017年9月4日;8(1):424)。如本文所用,术语“植入(engraft/engraftment)”是指通过与组织的现有细胞接触而在体内将细胞并入到目标组织中的过程。过继细胞疗法(ACT)可指将细胞(最常见的是免疫衍生细胞)转移回同一患者或新的受者宿主中,目的是将免疫功能性和特性转移到新宿主中。如果可能,自体细胞的使用可通过最大程度地减少GVHD问题来帮助受者。自体肿瘤浸润淋巴细胞(TIL)(Besser等人,(2010)Clin.Cancer Res16(9)2646-55;Dudley等人,(2002)Science 298(5594):850-4;以及Dudley等人,(2005)Journal of Clinical Oncology 23(10):2346-57)或基因重定向的外周血单核细胞(Johnson等人,(2009)Blood 114(3):535-46;以及Morgan等人,(2006)Science 314(5796)126-9)的过继转移已用于成功地治疗晚期实体瘤(包括黑色素瘤和结肠直肠癌)患者,以及表达CD19的血液系统恶性疾病的患者(Kalos等人,(2011)Science TranslationalMedicine 3(95):95ra73)。在某些实施方案中,同种异体细胞免疫细胞被转移(参见例如Ren等人,(2017)Clin Cancer Res 23(9)2255-2266)。如本文进一步所述,可编辑同种异体细胞以减少同种异体反应性并预防移植物抗宿主疾病。因此,同种异体细胞的使用允许从健康供体获得细胞并准备供患者使用,这与在诊断后从患者制备自体细胞相反。
在一些实施方案中,本文所述的发明涉及过继免疫疗法的方法,其中通过CRISPR离体编辑T细胞以调节至少一个基因,并且随后施用于有需要的患者。在一些实施方案中,CRISPR编辑包括敲除或敲低经编辑的T细胞中至少一种靶基因的表达。在一些实施方案中,除了调节靶基因之外,还通过CRISPR离体编辑T细胞以(1)敲入编码嵌合抗原受体(CAR)或T细胞受体(TCR)的外源基因,(2)敲除或敲低免疫检查点受体的表达,(3)敲除或敲低内源性TCR的表达,(4)敲除或敲低人类白细胞抗原类别I(HLA-I)蛋白的表达,和/或(5)敲除或敲低编码受外源CAR或TCR靶向的抗原的内源基因的表达。
在一些实施方案中,使T细胞与编码CRISPR效应蛋白的腺相关病毒(AAV)载体和包含可与靶序列杂交的指导序列、tracr配对序列和可与tracr配对序列杂交的tracr序列的指导分子离体接触。在一些实施方案中,使T细胞(例如通过电穿孔)与包含与指导分子复合的CRISPR效应蛋白的核糖核蛋白(RNP)离体接触,其中所述指导分子包含可与靶序列杂交的指导序列、tracr配对序列以及可与tracr配对序列杂交的tracr序列。参见Rupp等人,Scientific Reports 7:737(2017);Liu等人,Cell Research 27:154-157(2017)。在一些实施方案中,使T细胞(例如通过电穿孔)与编码CRISPR效应蛋白的mRNA以及包含可与靶序列杂交的指导序列、tracr配对序列和可与tracr配对序列杂交的tracr序列的指导分子离体接触。参见Eyquem等人,Nature 543:113-117(2017)。在一些实施方案中,T细胞不与慢病毒或逆转录病毒载体离体接触。
在一些实施方案中,所述方法包括通过CRISPR离体编辑T细胞以敲入编码CAR的外源基因,从而允许经编辑的T细胞基于位于细胞表面上的特定蛋白的表达来识别癌细胞。在一些实施方案中,通过CRISPR离体编辑T细胞以敲入编码TCR的外源基因,从而允许经编辑的T细胞识别源自癌细胞表面或内部的蛋白质。在一些实施方案中,所述方法包括提供外源CAR编码或TCR编码序列作为供体序列,其可通过同源性定向修复(HDR)整合到由CRISPR指导序列靶向的基因组基因座中。在一些实施方案中,将外源CAR或TCR靶向内源TCRα恒定(TRAC)基因座可减少tonic CAR信号传导并促进在单次或重复暴露于抗原后CAR的有效内在化和重新表达,从而延迟效应T细胞分化和耗竭。参见Eyquem等人,Nature 543:113-117(2017)。
在一些实施方案中,所述方法包括通过CRISPR离体编辑T细胞以阻断一种或多种免疫检查点受体以减少癌细胞的免疫抑制。在一些实施方案中,通过CRISPR离体编辑T细胞以敲除或敲低参与程序性死亡-1(PD-1)信号通路的内源基因,例如PD-1和PD-L1。在一些实施方案中,通过CRISPR离体编辑T细胞以突变Pdcd1基因座或CD274基因座。在一些实施方案中,使用靶向PD-1的第一个外显子的一个或多个指导序列,通过CRISPR离体编辑T细胞。参见Rupp等人,Scientific Reports 7:737(2017);Liu等人,Cell Research27:154-157(2017)。
在一些实施方案中,所述方法包括通过CRISPR离体编辑T细胞以消除潜在的同种异体反应性TCR,以允许同种异体过继转移。在一些实施方案中,通过CRISPR离体编辑T细胞以敲除或敲低编码TCR的内源基因(例如αβTCR),以避免移植物抗宿主疾病(GVHD)。在一些实施方案中,通过CRISPR离体编辑T细胞以使TRAC基因座突变。在一些实施方案中,使用靶向TRAC的第一个外显子的一个或多个指导序列,通过CRISPR离体编辑T细胞。参见Liu等人,Cell Research 27:154-157(2017)。在一些实施方案中,所述方法包括使用CRISPR将编码CAR或TCR的外源基因敲入TRAC基因座,而同时敲除内源TCR(例如,在CAR cDNA之后为编码自切割P2A肽的供体序列)。参见Eyquem等人,Nature 543:113-117(2017)。在一些实施方案中,外源基因包含可操作地插入内源TCR启动子下游的无启动子的CAR编码或TCR编码序列。
在一些实施方案中,所述方法包括通过CRISPR离体编辑T细胞以敲除或敲低编码HLA-1蛋白的内源基因,以最小化经编辑的T细胞的免疫原性。在一些实施方案中,通过CRISPR离体编辑T细胞以使β-2微球蛋白(B2M)基因座突变。在一些实施方案中,使用靶向B2M的第一个外显子的一个或多个指导序列,通过CRISPR离体编辑T细胞。参见Liu等人,Cell Research27:154-157(2017)。在一些实施方案中,所述方法包括使用CRISPR将编码CAR或TCR的外源基因敲入B2M基因座,而同时敲除内源B2M(例如,在CAR cDNA之后为编码自切割P2A肽的供体序列)。参见Eyquem等人,Nature543:113-117(2017)。在一些实施方案中,外源基因包含无启动子的CAR编码或TCR编码序列,该序列可操作地插入内源B2M启动子的下游。
在一些实施方案中,所述方法包括通过CRISPR离体编辑T细胞以敲除或敲低编码被外源CAR或TCR靶向的抗原的内源基因。在一些实施方案中,通过CRISPR离体编辑T细胞以敲除或敲低选自人端粒酶逆转录酶(hTERT)、存活蛋白、小鼠双微体2同源物(MDM2)、细胞色素P450 1B 1(CYP1B)、HER2/neu、Wilms肿瘤基因1(WT1)、livin、甲胎蛋白(AFP)、癌胚抗原(CEA)、粘蛋白16(MUC16)、MUC1、前列腺特异性膜抗原(PSMA)、p53或细胞周期蛋白(DI)的肿瘤抗原的表达(参见WO2016/011210)。在一些实施方案中,通过CRISPR离体编辑T细胞以敲除或敲低选自B细胞成熟抗原(BCMA)、跨膜激活物和CAML相互作用物(TACI)或B细胞激活因子受体(BAFF-R)、CD38、CD138、CS-1、CD33、CD26、CD30、CD53、CD92、CD100、CD148、CD150、CD200、CD261、CD262或CD362的抗原的表达(参见WO2017/011804)。
因此,本发明的方面涉及对选定抗原例如肿瘤相关抗原具特异性的免疫系统细胞如T细胞的过继转移(参见Maus等人,2014,Adoptive Immunotherapy for Cancer orViruses,Annual Review of Immunology,第32卷:189-225;Rosenberg和Restifo,2015,Adoptive cell transfer as personalized immunotherapy for human cancer,Science,第348卷第6230期第62-68页;以及Restifo等人,2015,Adoptive immunotherapyfor cancer:harnessing the T cell response.Nat.Rev.Immunol.12(4):269-281;以及Jenson和Riddell,2014,Design and implementation of adoptive therapy withchimeric antigen receptor-modified Tcells.Immunol Rev.257(1):127-144)。例如,可通过改变T细胞受体(TCR)的特异性,例如通过引入具有选定肽特异性的新TCRα和β链,采用各种策略来遗传修饰T细胞(参见美国专利第8,697,854号;PCT专利公开:WO2003020763、WO2004033685、WO2004044004、WO2005114215、WO2006000830、WO2008038002、WO2008039818、WO2004074322、WO2005113595、WO2006125962、WO2013166321、WO2013039889、WO2014018863、WO2014083173;美国专利第8,088,379号)。
作为TCR修饰的替代或补充,可使用嵌合抗原受体(CAR)来生成对选定的靶标(例如恶性细胞)具有特异性的免疫应答细胞(例如T细胞),其中已经描述了广泛多种受体嵌合体构建体(参见美国专利第5,843,728号;第5,851,828号;第5,912,170号;第6,004,811号;第6,284,240号;第6,392,013号;第6,410,014号;第6,753,162号;第8,211,422号;以及PCT公开WO9215322)。经过工程化以表达针对B细胞上的白血病抗原(例如CD19)的嵌合抗原受体(CAR)的自体T细胞已显示出治疗复发性或难治性B细胞恶性疾病的有希望的结果。但是,由于扩增失败,一部分癌症患者,尤其是经过大量预先治疗的癌症患者,可能无法接受这种高活性疗法。而且,由于婴儿的血液量小,为婴儿癌症患者制造有效的治疗产品仍然是一个挑战。在另一方面,自体CAR-T细胞疗法(包括个性化自体T细胞制造和广泛的“分布式”方法)的固有特征导致自体CAR-T细胞疗法的工业化困难。通用CD19特异性CAR-T细胞(UCART019)源自一个或多个与健康无关的供体,但可避免移植物抗宿主病(GVHD)并最小化其免疫原性,这无疑是解决上述问题的另一种选择。可选的CAR构建体可表征为属于连续的世代。第一代CAR通常由对抗原具有特异性的抗体的单链可变片段组成,例如包含与特定抗体的VH连接的VL,通过柔性接头,例如通过CD8α铰链结构域和CD8α跨膜结构域,连接至CD3ζ或FcRγ的跨膜和细胞内信号传导结构域(scFv-CD3ζ或scFv-FcRγ;参见美国专利第7,741,465号;美国专利第5,912,172号;美国专利第5,906,936号)。第二代CAR结合一个或多个共刺激分子的细胞内结构域,例如胞内域内的CD28、OX40(CD134)或4-1BB(CD137)(例如scFv-CD28/OX40/4-1BB-CD3ζ;参见美国专利第8,911,993号;第8,916,381号;第8,975,071号;第9,101,584号;第9,102,760号;第9,102,761号)。第三代CAR包括共刺激胞内域例如CD3ζ链、CD97、GDI la-CD18、CD2、ICOS、CD27、CD154、CDS、OX40、4-1BB或CD28信号传导结构域的组合(例如scFv-CD28-4-1BB-CD3ζ或scFv-CD28-OX40-CD3ζ;参见美国专利第8,906,682号;美国专利第8,399,645号;美国专利第5,686,281号;PCT公开第WO2014134165号;PCT公开第WO2012079000号)。或者,可通过以下来协调共刺激:在抗原特异性T细胞中表达CAR,选择所述抗原特异性T细胞以使其在天然αβTCR接合后被激活并扩增,例如通过专业抗原呈递细胞上的抗原,伴随着共刺激。另外,可在免疫应答细胞上提供其他工程化的受体,例如以改善对T细胞攻击的靶向和/或最小化副作用。Han等人(clinicaltrials,A StudyEvaluating UCART019 in Patients with Relapsed or Refactory CD19+Lukemia andLymphoma)通过将慢病毒递送CAR和CRISPR RNA电穿孔相结合以同时破坏内源性TCR和B2M基因,产生了基因破坏的同种异体CD19定向的BBζCAR-T细胞(称为UCART019),并且将测试其是否可逃避宿主介导的免疫力并在没有GVHD的情况下提供抗白血病作用。
替代技术可用于转化靶免疫应答细胞,例如原生质体融合、脂转染、转染或电穿孔。可使用广泛多种载体,例如逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体、质粒或转座子,例如睡美人转座子(参见美国专利第6,489,458号;第7,148,203号;第7,160,682号;第7,985,739号;第8,227,432号),可用于引入CAR,例如使用通过CD3ζ以及CD28或CD137信号传导的第二代抗原特异性CAR。病毒载体可例如包括基于HIV、SV40、EBV、HSV或BPV的载体。
被靶向用于转化的细胞可包括例如T细胞,自然杀伤(NK)细胞,细胞毒性T淋巴细胞(CTL),调节性T细胞,人胚胎干细胞,肿瘤浸润淋巴细胞(TIL)或可能分化出淋巴样细胞的多能干细胞。表达期望的CAR的T细胞可例如通过与共表达癌症抗原和共刺激分子的经γ照射的激活和增殖细胞(AaPC)共培养来选择。可例如通过在可溶性因子如IL-2和IL-21存在下在AaPC上共培养来扩增工程化的CAR T细胞。例如,可进行这种扩增以便提供记忆性CAR+T细胞(可例如通过非酶数字阵列和/或多板流式细胞术进行测定)。以这种方式,可提供对带有抗原的肿瘤具有特异性细胞毒性活性的CAR T细胞(任选地与所需趋化因子例如干扰素-γ的产生相结合)。这种CAR T细胞可例如用于动物模型中,例如威胁肿瘤异种移植物。
通常,CAR由细胞外结构域、跨膜结构域和细胞内结构域组成,其中所述细胞外结构域包含对预定靶标具特异性的抗原结合结构域。尽管CAR的抗原结合结构域通常是抗体或抗体片段(例如,单链可变片段、scFv),但是对结合结构域没有特别限制,只要其导致靶标的特异性识别即可。例如,在一些实施方案中,抗原结合结构域可包含受体,使得CAR能够结合受体的配体。或者,抗原结合结构域可包含配体,使得CAR能够结合该配体的内源性受体。
CAR的抗原结合结构域通常通过铰链或间隔子与跨膜结构域分开。间隔子也没有特别限制,并且其被设计成为CAR提供柔韧性。例如,间隔子结构域可包含人类Fc结构域的一部分,包括CH3结构域的一部分,或任何免疫球蛋白的铰链区,例如IgA、IgD、IgE、IgG或IgM或其变体。此外,可修饰铰链区,以防止FcR或其他潜在干扰物体的脱靶结合。例如,铰链可包含具有或不具有S228P、L235E和/或N297Q突变(根据Kabat编号)的IgG4 Fc结构域,以减少与FcR的结合。其他间隔子/铰链包括但不限于CD4、CD8和CD28铰链区。
CAR的跨膜结构域可源自天然或合成来源。在来源是天然的情况下,所述结构域可源自任何膜结合或跨膜蛋白。在本公开中特别使用的跨膜区可源自CD8、CD28、CD3、CD45、CD4、CD5、CDS、CD9、CD 16、CD22、CD33、CD37、CD64、CD80、CD86、CD 134、CD137、CD 154、TCR。或者,跨膜结构域可以是合成的,在这种情况下,其将主要包含疏水性残基,例如亮氨酸和缬氨酸。优选在合成的跨膜结构域的每个末端存在苯丙氨酸、色氨酸和缬氨酸的三联体。任选地,优选长度在2至10个氨基酸的短的寡肽或多肽接头,可形成CAR的跨膜结构域和细胞质信号传导结构域之间的连接。甘氨酸-丝氨酸二联体提供了特别合适的接头。
可选的CAR构建体可表征为属于连续的世代。第一代CAR通常由对抗原具有特异性的抗体的单链可变片段组成,例如包含与特定抗体的VH连接的VL,通过柔性接头,例如通过CD8α铰链结构域和CD8α跨膜结构域,连接至CD3ζ或FcRγ的跨膜和细胞内信号传导结构域(scFv-CD3ζ或scFv-FcRγ;参见美国专利第7,741,465号;美国专利第5,912,172号;美国专利第5,906,936号)。第二代CAR结合一个或多个共刺激分子的细胞内结构域,例如胞内域内的CD28、OX40(CD134)或4-1BB(CD137)(例如scFv-CD28/OX40/4-1BB-CD3ζ;参见美国专利第8,911,993号;第8,916,381号;第8,975,071号;第9,101,584号;第9,102,760号;第9,102,761号)。第三代CAR包括共刺激胞内域例如CD3ζ链、CD97、GDI la-CD18、CD2、ICOS、CD27、CD154、CDS、OX40、4-1BB、CD2、CD7、LIGHT、LFA-1、NKG2C、B7-H3、CD30、CD40、PD-1或CD28信号传导结构域的组合(例如scFv-CD28-4-1BB-CD3ζ或scFv-CD28-OX40-CD3ζ;参见美国专利第8,906,682号;美国专利第8,399,645号;美国专利第5,686,281号;PCT公开第WO2014134165号;PCT公开第WO2012079000号)。在某些实施方案中,主要信号传导结构域包含选自由以下组成的组的蛋白质的功能信号传导结构域:CD3ζ、CD3γ、CD3δ、CD3ε、常见FcRγ(FCERIG)、FcRβ(FcεR1b)、CD79a、CD79b、FcγRIIa、DAP10和DAP12。在某些优选的实施方案中,主要信号传导结构域包含CD3ζ或FcRγ的功能性信号传导结构域。在某些实施方案中,一个或多个共刺激信号传导结构域包含蛋白质的功能信号传导结构域,所述蛋白质各自独立地选自由以下组成的组:CD27、CD28、4-1BB(CD137)、OX40、CD30、CD40、PD-1、ICOS、淋巴细胞功能相关抗原-1(LFA-1)、CD2、CD7、LIGHT、NKG2C、B7-H3、与CD83特异性结合的配体、CDS、ICAM-1、GITR、BAFFR、HVEM(LIGHTR)、SLAMF7、NKp80(KLRF1)、CD160、CD19、CD4、CD8α、CD8β、IL2Rβ、IL2Rγ、IL7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CD11d、ITGAE、CD103、ITG AL、CD11a、LFA-1、ITGAM、CD11b、ITGAX、CD11c、ITGB1、CD29、ITGB2、CD18、ITGB7、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(触觉)、CEACAM1、CRTAM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、NKp44、NKp30、NKp46和NKG2D。在某些实施方案中,一个或多个共刺激信号传导结构域包含如下蛋白质的功能性信号传导结构域,所述蛋白质各自独立地选自由以下组成的组:4-1BB、CD27和CD28。在某些实施方案中,嵌合抗原受体可具有如美国专利第7,446,190号中所述的设计,其包含CD3ζ链的细胞内结构域(例如人CD3ζ链的氨基酸残基52-163,如US 7,446,190的SEQ ID NO:14所示),来自CD28的信号传导区域和抗原结合元件(或部分或结构域;例如scFv)。当在ζ链部分和抗原结合元件之间时,CD28部分可适当地包括CD28的跨膜和信号传导结构域(例如SEQ ID NO:10的氨基酸残基114-220,如US 7,446,190的SEQ ID NO:6所示的完整序列;这些可包括如Genb ank标识符NM_006139中所示的CD28的以下部分(序列形式1、2或3):IEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS)(SEQ ID NO:478)。或者,当ζ序列位于CD28序列和抗原结合元件之间时,可单独使用CD28的细胞内结构域(例如US 7,446,190的SEQ ID NO:9所示的氨基序列)。因此,某些实施方案采用CAR,其包含(a)包含人CD3ζ链的胞内结构域的ζ链部分,(b)共刺激信号传导区,和(c)抗原结合元件(或部分或结构域),其中共刺激信号传导区包含由US 7,446,190的SEQ ID NO:6编码的氨基酸序列。
或者,可通过以下来协调共刺激:在抗原特异性T细胞中表达CAR,选择所述抗原特异性T细胞以使其在天然αβTCR接合后被激活并扩增,例如通过专业抗原呈递细胞上的抗原,伴随着共刺激。另外,可在免疫应答细胞上提供其他工程化的受体,例如以改善对T细胞攻击的靶向和/或最小化副作用。
作为实例但不限于,Kochenderfer等人,(2009)J Immunother.32(7):689-702描述了抗CD19嵌合抗原受体(CAR)。FMC63-28Z CAR包含识别源自FMC63小鼠杂交瘤的CD19的单链可变区部分(scFv)(描述于Nicholson等人,(1997)Molecular Immunology 34:1157-1165中),人类CD28分子的一部分,和人类TCR-ζ分子的细胞内组分。FMC63-CD828BBZ CAR包含FMC63scFv,CD8分子的铰链和跨膜区域,CD28和4-1BB的细胞质部分以及TC R-ζ分子的细胞质组分。FMC63-28Z CAR中包括的CD28分子的确切序列对应于Genbank标识符NM_006139;所述序列包括从氨基酸序列IEVMYPPPY开始并一直延伸到蛋白质羧基末端的所有氨基酸。为了编码载体的抗CD19scFv组分,作者设计了一个DNA序列,该序列是基于先前公开的CAR的一部分(Cooper等人,(2003)Blood 101:1637-1644)。该序列编码从5'端至3'端的框架内的以下组分:XhoI位点,人类粒细胞-巨噬细胞集落刺激因子(GM-CSF)受体α链信号序列,FMC63轻链可变区(如Nicholson等人,同上),接头肽(如Cooper等人,同上),FMC63重链可变区(如Nicholson等人,同上)和NotI位点。用XhoI和NotI消化编码该序列的质粒。为了形成MSGV-FMC63-28Z逆转录病毒载体,将XhoI和NotI消化的编码FMC63 scFv的片段连接至第二个XhoI和NotI消化的编码MSGV逆转录病毒骨架的片段(如Hughes等人,(2005)Human GeneTherapy 16:457-472)以及人类CD28的细胞外部分、人类CD28的整个跨膜和细胞质部分以及人类TCR-ζ分子的细胞质部分的一部分(如Maher等人,(2002)Nature Biotechnology20:70-75)。FMC63-28Z CAR包含在Kite Pharma公司正在开发的KTE-C19(axicabtageneciloleu cel)抗CD19 CAR-T治疗产品中,用于治疗尤其是具有复发性/难治性侵袭性B细胞非霍奇金淋巴瘤(NHL)的患者。因此,在某些实施方案中,旨在用于过继细胞疗法的细胞,更特别是免疫应答细胞如T细胞,可表达如Kochenderf er等人(同上)所述的FMC63-28Z CAR。因此,在某些实施方案中,旨在用于过继细胞疗法的细胞,更特别是免疫应答细胞如T细胞,可包含CAR,其包含特异性结合抗原的细胞外抗原结合元件(或部分或结构域;例如scFv),包含CD3ζ链的细胞内结构域的细胞内信号传导结构域,以及包含CD28的信号传导结构域的共刺激信号传导区。优选地,CD28氨基酸序列如Genbank标识符NM_006139(序列形式1、2或3)所示,起始于氨基酸序列IEVMYPPPY并一直延伸到蛋白质的羧基末端。所述序列在此处再现:IEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS(SEQ ID NO:479)。优选地,抗原是CD19,更优选地,抗原结合元件是抗CD19 scFv,甚至更优选地,抗CD19 scFv如Kochenderfer等人(同上)所述。
另外的抗CD19 CAR在WO2015187528中进一步描述。更具体地,通过引用并入本文的WO2015187528的实施例1和表1证明了基于完全人类抗CD19单克隆抗体(47G4,如US20100104509中所述)和鼠类抗CD19单克隆抗体(如Nicholson等人中描述并在上文解释)的抗CD19 CAR的产生。公开了信号序列(人类CD8-α或GM-CSF受体)、细胞外和跨膜区域(人类CD8-α)和细胞内T细胞信号传导结构域(CD28-CD3ζ;4-1BB-CD3ζ;CD27-CD3ζ;CD28-CD27-CD3ζ;4-1BB-CD27-CD3ζ;CD27-4-1BB-CD3ζ;CD28-CD27-FcεRIγ链;或CD28-FcεRIγ链)的各种组合。因此,在某些实施方案中,旨在用于过继细胞疗法的细胞,更特别是免疫应答细胞如T细胞,可包含CAR,其包含特异性结合抗原的细胞外抗原结合元件,如WO2015187528的表1中所列的细胞外和跨膜区域,以及如WO2015187528的表1中所列的细胞内T细胞信号传导结构域。优选地,抗原是CD19,更优选地,抗原结合元件是抗CD19 scFv,甚至更优选地,小鼠或人类抗CD19scFv如WO2015187528的实施例1中所述。在某些实施方案中,CAR包含以下氨基酸序列,基本上由以下氨基酸序列组成或由以下氨基酸序列组成:SEQ ID NO:1,SEQID NO:2,SEQ ID NO:3,SEQ ID NO:4,SEQ ID NO:5,SEQ ID NO:6,SEQ ID NO:7,SEQ IDNO:8,SEQ ID NO:9,SEQ ID NO:10,SEQ ID NO:11,SEQ ID NO:12或SEQ ID NO:13,如WO2015187528的表1中所示。
作为实例但不限于,在WO2012058460A2中描述了识别CD70抗原的嵌合抗原受体(还参见Park等人,CD70 as a target for chimeric antigen receptor Tcells in headand neck squamous cell carcinoma,Oral Oncol.2018年3月;78:145-150;以及Jin等人,CD70,a novel target of CAR T-cell therapy for gliomas,Neuro Oncol.2018年1月10日;20(1):55-65)。CD70由弥漫性大B细胞和滤泡性淋巴瘤以及霍奇金斯淋巴瘤、Waldenstrom巨球蛋白血症和多发性骨髓瘤的恶性细胞以及与HTLV-1和EBV相关的恶性疾病表达。((Agathanggelou等人,Am.J.Pathol.1995;147:1152-1160;Hunter等人,Blood2004;104:4881.26;Lens等人,J Immunol.2005;174:6212-6219;Baba等人,JVirol.2008;82:3843-3852。)另外,CD70由非血液学恶性疾病如肾细胞癌和胶质母细胞瘤表达。(Junker等人,J Urol.2005;173:2150-2153;Chahlavi等人,Cancer Res 2005;65:5428-5438)。在生理学上,CD70表达是短暂的,并局限于高度激活的T、B和树突状细胞的子集。
作为实例而非限制,已经描述了识别BCMA的嵌合抗原受体(参见例如US20160046724A1;WO2016014789A2;WO2017211900A1;WO2015158671A1;US20180085444A1;WO2018028647A1;US20170283504A1;和WO2013154760A1)。
本文公开的CRISPR系统可用于靶向在过继细胞疗法中靶向的抗原。在某些实施方案中,在疾病(例如特别是肿瘤或癌症)的过继细胞疗法(例如TIL、CAR或TCR T细胞疗法)中待靶向的抗原(例如肿瘤抗原)可选自由以下组成的组:B细胞成熟抗原(BCMA)(参见例如Friedman等人,Effective Targetin g of Multiple BCMA-Expressing HematologicalMalignancies by Anti-BCM A CAR T Cells,Hum Gene Ther.2018年3月8日;Berdeja JG等人,Dur able clinical responses in heavily pretreated patients withrelapsed/refractory multiple myeloma:updated results from a multicenter studyof bb2121 anti-Bcma CAR T cell therapy.Blood.2017;130:740;以及Mouhieddine和Ghob rial,Immunotherapy in Multiple Myeloma:The Era of CAR T Cell Therap y,Hematologist,2018年5-6月,第15卷,第3期);PSA(前列腺特异性抗原);前列腺特异性膜抗原(PSMA);PSCA(前列腺干细胞抗原);酪氨酸蛋白激酶跨膜受体ROR1;成纤维细胞活化蛋白(FAP);肿瘤相关糖蛋白72(TAG72);癌胚抗原(CEA);上皮细胞粘附分子(EPCAM);间皮素;人表皮生长因子受体2(ERBB2(Her2/neu));前列素酶;前列腺酸性磷酸酶(PAP);伸长因子2突变体(ELF2M);胰岛素样生长因子1受体(IGF-1R);gplOO;BCR-AB L(断点簇区域-Abelson);酪氨酸酶;纽约食管鳞状细胞癌1(NY-ESO-1);κ轻链,LAGE(L抗原);MAGE(黑色素瘤抗原);黑色素瘤相关抗原1(MA GE-A1);MAGE A3;MAGE A6;豆荚蛋白;人乳头瘤病毒(HPV)E6;HP VE7;prostein;存活蛋白;PCTA1(半乳糖凝集素8);Melan-A/MART-1;Ras突变体;TRP-1(酪氨酸酶相关蛋白1或gp75);酪氨酸酶相关蛋白2(TRP2);TRP-2/INT2(TRP-2/内含子2);RAGE(肾抗原);晚期糖基化终产物的受体1(RAGE1);肾普遍存在的1、2(RU1、RU2);肠羧基酯酶(iCE);热休克蛋白70-2(HSP70-2)突变体;甲状腺刺激激素受体(TSHR);CD123;CD171;CD19;CD20;CD22;CD26;CD30;CD33;CD44v7/8(分化簇44,外显子7/8);CD53;CD92;CD100;CD148;CD150;CD200;CD261;CD262;CD362;CS-1(CD2子集1、CRACC、SLAMF7、CD319和19A24);C型凝集素样分子-1(CLL-1);神经节苷脂GD3(aNeu5Ac(2-8)aNeu5Ac(2-3)bD Galp(1-4)bDGlcp(1-1)Cer);Tn抗原(Tn Ag);Fms样酪氨酸激酶3(FLT3);CD38;CD138;CD44v6;B7H3(CD276);KIT(CD117);白介素-13受体亚基α-2(IL-13Ra2);白介素11受体α(IL-11Ra);前列腺干细胞抗原(PSCA);蛋白酶丝氨酸21(PRSS21);血管内皮生长因子受体2(VEGFR2);Lewis(Y)抗原;CD24;血小板衍生的生长因子受体β(PDGFR-β);阶段特异性胚胎抗原-4(SSEA-4);粘蛋白1,细胞表面缔合(MUC1);粘蛋白16(MUC16);表皮生长因子受体(EGFR);表皮生长因子受体变体III(EGFRvIII);神经细胞粘附分子(NCAM);碳酸酐酶IX(CAIX);蛋白酶体(蛋白酶体,Macropain)亚基,β型,9(LMP2);肝配蛋白A型受体2(EphA2);肝配蛋白B2;岩藻糖基GM1;唾液酸化路易斯粘附分子(sLe);神经节苷脂GM3(aNeu5Ac(2-3)bDGal p(1-4)bDGlcp(1-1)Cer);TGS5;高分子量黑色素瘤相关抗原(HMWMAA);邻乙酰基GD2神经节苷脂(OAcGD2);叶酸受体α;叶酸受体β;肿瘤内皮标志物1(TEM1/CD248);肿瘤内皮标志物7相关(TEM7R);紧密连接蛋白6(CL DN6);G蛋白偶联受体C类5群,成员D(GPRC5D);X染色体开放阅读框61(CXORF61);CD97;CD179a;间变性淋巴瘤激酶(ALK);聚唾液酸;胎盘特异性1(PLAC1);globoH糖神经酰胺(GloboH)的六糖部分;乳腺分化抗原(NY-BR-1);尿空斑蛋白2(UPK2);甲型肝炎病毒细胞受体1(HAVCR1);肾上腺素受体β3(ADRB3);泛连接蛋白3(PANX3);G蛋白偶联受体20(GPR20);淋巴细胞抗原6复合体,基因座K 9(LY6K);嗅觉受体51E2(OR51E2);TCRγ替代阅读框蛋白(TARP);Wilms肿瘤蛋白(WT1);位于染色体12p上的ETS易位变异基因6(ETV6-AML);精子蛋白17(SPA17);X抗原家族,成员1A(XAGE1);血管生成素结合细胞表面受体2(Tie 2);CT(癌症/睾丸(抗原));黑色素瘤睾丸抗原-1(MAD-CT-1);黑色素瘤睾丸抗原-2(MA D-CT-2);Fos相关抗原1;p53;p53突变体;人端粒酶逆转录酶(hTERT);肉瘤易位断点;黑色素瘤凋亡抑制剂(ML-IAP);ERG(跨膜蛋白酶,丝氨酸2(TMPRSS2)ETS融合基因);N-乙酰氨基葡萄糖氨基转移酶V(NA17);配对盒蛋白Pax-3(PAX3);雄激素受体;细胞周期蛋白B1;细胞周期蛋白D1;v-myc禽类骨髓增生病病毒致癌基因神经母细胞瘤衍生同源物(MYCN);Ras同源物家庭成员C(RhoC);细胞色素P450 1B1(CYP1B1);CCCTC结合因子(锌指蛋白)样(BORIS);T细胞1或3识别的鳞状细胞癌抗原(SART1、SAR T3);配对盒蛋白Pax-5(PAX5);前顶体蛋白结合蛋白sp32(OY-TES1);淋巴细胞特异性蛋白酪氨酸激酶(LCK);激酶锚蛋白4(AKAP-4);滑膜肉瘤,X断点-1、-2、-3或-4(SSX1、SSX2、SSX3、SSX4);CD79a;CD79b;CD72;白细胞相关的免疫球蛋白样受体1(LAIR1);IgA受体的Fc片段(FCAR);白细胞免疫球蛋白样受体亚家族A成员2(LILRA2);CD300分子样家族成员f(CD300LF);C型凝集素结构域家族12成员A(CLEC12A);骨髓基质细胞抗原2(BST2);含有EGF样模块的粘蛋白样激素受体样2(EMR2);淋巴细胞抗原75(LY75);磷脂酰肌醇聚糖-3(GPC3);Fc受体样5(FCRL5);小鼠双微体2同源物(MDM2);livin;甲胎蛋白(AFP);跨膜激活物和CAML相互作用物(TACI);B细胞活化因子受体(BAFF-R);V-Ki-ras2 Kirsten大鼠肉瘤病毒致癌基因同源物(KRAS);免疫球蛋白λ样多肽1(IGLL1);707-AP(707丙氨酸脯氨酸);ART-4(被T4细胞识别的腺癌抗原);BAGE(B抗原;b-连环蛋白/m,b-连环蛋白/突变);CAMEL(CTL识别的黑色素瘤上抗原);CA P1(癌胚抗原肽1);CASP-8(胱天蛋白酶-8);CDC27m(突变的细胞分裂周期27);CDK4/m(突变的细胞周期依赖性激酶4);Cyp-B(亲环蛋白B);DAM(分化抗原黑色素瘤);EGP-2(上皮糖蛋白2);EGP-40(上皮糖蛋白40);Erbb2、3、4(成红细胞白血病病毒致癌基因同源物-2、-3、4);FBP(叶酸结合蛋白);fAchR(胎儿乙酰胆碱受体);G250(糖蛋白250);GAGE(G抗原);GnT-V(N-乙酰氨基葡萄糖氨基转移酶V);HAGE(螺旋酶抗原);ULA-A(人类白细胞抗原-A);HST2(人类印戒肿瘤2);KIAA0205;KDR(激酶插入结构域受体);LDLR/FUT(低密度脂质受体/GDP L-岩藻糖:b-D-半乳糖苷酶2-a-L岩藻糖基转移酶);L1CAM(L1细胞粘附分子);MC1R(黑皮质素1受体);肌球蛋白/m(突变肌球蛋白);MUM-1、-2、-3(黑色素瘤普遍突变的1、2、3);NA88-A(患者M88的NA cDNA克隆);KG2D(天然杀手2群,成员D)配体;癌胎抗原(h5T4);p190次要bcr-abl(190KD bcr-abl蛋白);Pml/RARa(早幼粒细胞白血病/视黄酸受体a);PRAME(黑色素瘤的优先表达抗原);SAGE(肉瘤抗原);TEL/AML1(易位Ets家族白血病/急性骨髓性白血病1);TPI/m(突变的磷酸丙糖异构酶);CD70;滋养层糖蛋白(TPBG);ανβó整联蛋白,B7-H3;B7-H6;CD20;CD44;硫酸软骨素蛋白聚糖4(CSPG4),bDGalpNAc(l-4)[aNeu5Ac(2-8)aNeu5Ac(2-3)]bDGalp(l-4)bDGlcp(l-l)Cer(GD2),aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(l-4)bDGlcp(l-l)Cer(GD3);人白细胞抗原A1 MAGE家族成员A1(HLA-A1
在某些实施方案中,在疾病(例如特别是肿瘤或癌症)的过继细胞疗法(例如特别是CAR或TCR T细胞疗法)中靶向的抗原是肿瘤特异性抗原(TSA)。
在某些实施方案中,在疾病(例如特别是肿瘤或癌症)的过继细胞疗法(例如特别是CAR或TCR T细胞疗法)中靶向的抗原是新抗原。
在某些实施方案中,在疾病(例如特别是肿瘤或癌症的)的过继细胞疗法(例如特别是CAR或TCR T细胞疗法)中靶向的抗原是肿瘤相关抗原(TAA)。
在某些实施方案中,在疾病(例如特别是肿瘤或癌症的)的过继细胞疗法(例如特别是CAR或TCR T细胞疗法)中靶向的抗原是通用肿瘤抗原。在某些优选的实施方案中,所述通用肿瘤抗原选自由以下组成的组:人端粒酶逆转录酶(hTERT)、存活蛋白、小鼠双微体2同源物(MDM2)、细胞色素P450 1B 1(CYP1B)、HER2/neu、Wilms肿瘤基因1(WT1)、livin、甲胎蛋白(AFP)、癌胚抗原(CEA)、粘蛋白16(MUC16)、MUC1、前列腺特异性膜抗原(PSMA)、p53、细胞周期蛋白(D1)及其任何组合。
在某些实施方案中,疾病(例如特别是肿瘤或癌症)的过继细胞疗法(例如特别是CAR或TCR T细胞疗法)中靶向的抗原(例如肿瘤抗原)可选自由以下组成的组:CD19、BCMA、CD70、CLL-1、MAGE A3、MAGE A6、HPV E6、HPV E7、WT1、CD22、CD171、ROR1、MUC16和SSX2。在某些优选的实施方案中,抗原可以是CD19。例如,在血液系统恶性疾病中,例如在淋巴瘤中,更特别是在B细胞淋巴瘤中,例如但不限于在弥漫性大B细胞淋巴瘤、原发性纵隔b细胞淋巴瘤、转化的滤泡性淋巴瘤、边缘区淋巴瘤、套细胞淋巴瘤、包括成人和小儿ALL的急性母淋巴细胞性白血病、非霍奇金淋巴瘤、惰性非霍奇金淋巴瘤或慢性淋巴细胞性白血病中可靶向CD19。例如,在多发性骨髓瘤或浆细胞白血病中可靶向BCMA(参见例如2018年美国癌症研究协会(AACR)年会海报:靶向B细胞成熟抗原的同种异体嵌合抗原受体T细胞(AllogeneicChimeric Antigen Receptor T Cells Targeting B Cell Maturation Antigen))。例如,在急性骨髓性白血病中可靶向CLL1。在实体瘤中可靶向MAGE A3、MAGE A6、SSX2和/或KRAS。例如,在宫颈癌或头颈癌中可靶向HPV E6和/或HPV E7。例如,在急性骨髓性白血病(AML)、骨髓增生异常综合征(MDS)、慢性骨髓性白血病(CML)、非小细胞肺癌、乳腺癌、胰腺癌、卵巢癌或结直肠癌或间皮瘤中可靶向WT1。例如,在B细胞恶性疾病(包括非霍奇金淋巴瘤、弥漫性大B细胞淋巴瘤或急性淋巴母细胞性白血病)中可靶向CD22。例如,在成神经细胞瘤、成胶质细胞瘤或肺癌、胰腺癌或卵巢癌中可靶向CD171。例如,在ROR1+恶性疾病(包括非小细胞肺癌、三阴性乳腺癌、胰腺癌、前列腺癌、ALL、慢性淋巴细胞性白血病或套细胞淋巴瘤)中可靶向ROR1。例如,在MUC16ecto+上皮性卵巢癌、输卵管癌或原发性腹膜癌中可靶向MUC16。例如,在血液系统恶性疾病以及例如肾细胞癌(RCC)、神经胶质瘤(例如GBM)和头颈癌(HNSCC)的实体癌中可靶向CD70。CD70在血液系统恶性疾病中以及实体癌中均表达,而其在正常组织中的表达仅限于淋巴样细胞类型的子集(参见例如2018年美国癌症研究协会(AACR)年会海报:同种异体CRISPR工程化抗CD70 CAR-T细胞表现出针对实体和血液癌细胞的强大的临床前活性(Allogeneic CRISPR Engineered Anti-CD70 CAR-T Cells DemonstratePotent Preclinical Activity Against Both Solid and Hematological CancerCells))。
在一些实施方案中,靶抗原是病毒抗原。已经鉴定出许多已知的病毒抗原靶标,包括衍生自HIV、HTLV和其他病毒中的病毒基因组的肽(参见例如Addo等人,(2007)PLoS ONE,2,e321;Tsomides等人,(1994)J Exp Med,180,1283-93;Utz等人,(1996)J Virol,70,843-51)。示例性病毒抗原包括但不限于来自甲型肝炎、乙型肝炎(例如HBV核心和表面抗原(HBVc、HBVs))、丙型肝炎(HCV)、Epstein-Ban
在一些实施方案中,病毒抗原是HBV或HCV抗原,在某些情况下,与HBV或HCV阴性受试者相比,其可导致患肝癌的风险更大。例如,在一些实施方案中,异源抗原是HBV抗原,例如乙型肝炎核心抗原或乙型肝炎包膜抗原(US2012/0308580)。
在一些实施方案中,病毒抗原是EBV抗原,在某些情况下,与EBV阴性受试者相比,其可导致患上伯基特氏淋巴瘤(Burkitt's lymphoma)、鼻咽癌和霍奇金氏病的风险更大。例如,EBV是一种人类疱疹病毒,在某些情况下,发现其与众多来自不同组织起源的人类肿瘤相关。EBV阳性肿瘤虽然主要发现为无症状感染,但其特征在于可活性表达病毒基因产物,例如EBNA-1、LMP-1和LMP-2A。在一些实施方案中,异源抗原是EBV抗原,其可包括Epstein-Barr核抗原(EBNA)-1、EBNA-2、EBNA-3A、EBNA-3B、EBNA-3C、EBNA前导蛋白(EBNA-LP)、潜在膜蛋白LMP-1、LMP-2A和LMP-2B、EBV-EA、EBV-MA或EBV-VCA。在一些实施方案中,病毒抗原是HTLV-1或HTLV-2抗原,在某些情况下,与HTLV-1或HTLV-2阴性受试者相比,其可导致患上T细胞白血病的风险更大。例如,在一些实施方案中,异源抗原是HTLV-抗原,例如TAX。
在一些实施方案中,病毒抗原是HHV-8抗原,在某些情况下,与HHV-8阴性受试者相比,其可导致患上卡波西氏肉瘤的风险更大。在一些实施方案中,异源抗原是CMV抗原,例如pp65或pp64(参见美国专利第8361473号)。
在一些实施方案中,病毒抗原是病毒特异性表面抗原,例如HIV特异性抗原(例如HIV gp120);EBV特异性抗原、CMV特异性抗原、HPV特异性抗原、Lasse病毒特异性抗原、流感病毒特异性抗原以及这些表面标志物的任何衍生物或变体。
在一个方面,本发明提供了对中枢神经系统肿瘤的治疗,特别是由1型神经纤维瘤病(NF1)神经遗传性疾患引起的肿瘤的治疗。患有NF1的个体天生具有NF1基因的种系突变,但可能会发展出许多独特的神经系统问题,从自闭症和注意力缺陷到脑和周围神经鞘瘤。本发明可用于开发患者特异性疾病模型并研究在等基因背景中诱导的多能干细胞(iPSC)衍生的疾病相关细胞。成年患者的皮肤或血细胞可产生胚胎干细胞(ESC)类细胞,也称为诱导性多能干细胞或iPSC。最近的研究工作已开始开发将iPSC分化为中枢神经系统和外周神经系统(CNS和PNS)中多种细胞类型的培养方案,这些细胞类型在NF1患者中受到影响。通过修复现有的突变基因或产生新的突变,本发明的CRISPR C2c1系统可用于遗传编辑特定的疾病基因。为了站在NF1研究的前沿,对于儿童国家医学中心的吉尔伯特家族神经纤维瘤病研究所(GFNI)来说,重要的是探索这些最近令人振奋的研究进展,系统地开发患者特异性的人类NF1疾病模型,以及提供用于对个别NF患者进行药物筛选和评价的工具。
例如前述的方法可适于提供治疗和/或增加患有疾病例如瘤形成的受试者的方法,例如通过施用有效量的包含识别结合所选抗原的受体的抗原的免疫应答细胞,其中所述结合激活免疫应答细胞,从而治疗或预防疾病(例如瘤形成、病原体感染、自身免疫性疾病或同种异体移植反应)。CAR T细胞疗法中的给药可例如包括以106至109个细胞/千克的剂量施用,存在或不存在淋巴衰竭过程,例如用环磷酰胺。
本领域普通技术人员可在如上所述的类似系统中利用本发明中公开的CRISPR-C2c1系统。关于C2c1蛋白,CRISPR-C2c1系统可识别作为富含T的序列的PAM序列。在一些实施方案中,PAM序列是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统将一个或多个具有5'突出端的交错双链断裂(DSB)引入靶基因。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入模板DNA序列。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰靶基因的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入靶基因的转录物。
在一个实施方案中,可将所述治疗施用于进行免疫抑制治疗的患者中。由于编码这种免疫抑制剂的受体的基因的失活,可使细胞或细胞群体对至少一种免疫抑制剂具有抗性。不受理论的束缚,免疫抑制治疗应有助于在患者体内选择和扩增根据本发明的免疫应答或T细胞。
根据本发明的细胞或细胞群体的施用可以任何适宜的方式进行,包括通过气雾吸入、注射、摄取、输液、植入或移植。可经皮下、经皮内、经肿瘤内、经结节内、经髓内、经肌内,通过静脉内或淋巴内注射,或经腹膜内向患者施用细胞或细胞群体。在一个实施方案中,本发明的细胞组合物优选通过静脉内注射施用。
细胞或细胞群体的施用可包括施用104-109个细胞/千克体重,优选105-106个细胞/千克体重,包括那些范围内的细胞数的所有整数值。CAR T细胞疗法中的给药可例如包括以106至109个细胞/千克的剂量施用,存在或不存在淋巴衰竭过程,例如用环磷酰胺。可以一个或多个剂量施用细胞或细胞群体。在另一个实施方案中,有效量的细胞以单剂量施用。在另一个实施方案中,在一段时间内以多于一个剂量的方式施用有效量的细胞。施用时间在主治医师的判断范围内,并取决于患者的临床状况。细胞或细胞群体可从任何来源获得,例如血库或供体。尽管个体需求变化,但是针对特定疾病或疾患的给定细胞类型的有效量的最佳范围的确定在本领域技术人员的能力范围内。有效量是指提供治疗或预防益处的量。施用的剂量将取决于接受者的年龄、健康状况和体重,同时进行的治疗的种类(如果有的话),治疗的频率和所需效果的性质。
在另一个实施方案中,肠胃外施用有效量的细胞或包含那些细胞的组合物。施用可以是静脉内施用。可通过在肿瘤内注射直接进行施用。
为了防止可能的不良反应,工程化的免疫应答细胞可配备转基因安全开关,其形式为使细胞易于暴露于特定信号的转基因。例如,单纯疱疹病毒胸苷激酶(TK)基因可通过这种方式使用,例如通过在干细胞移植后引入同种异体T淋巴细胞中用作供体淋巴细胞输注(Greco等人,Improving the safety of cell therapy with the TK-suicidegene.Front.Pharmacol.2015;6:95)。在此类细胞中,施用例如更昔洛韦或阿昔洛韦的核苷前药会导致细胞死亡。可选的安全开关构建体包括可诱导的胱天蛋白酶9,例如由小分子二聚体的施用触发,该小分子二聚体将两个无功能的icasp9分子聚集在一起形成活性酶。已经描述了用于实现细胞增殖控制的广泛多种替代方法(参见美国专利公开第20130071414号;PCT专利公开WO2011146862;PCT专利公开WO2014011987;PCT专利公开WO2013040371;Zhou等人,BLOOD,2014,123/25:3895-3905;Di Stasi等人,The New England Journal ofMedicine 2011;365:1673-1683;Sadelain M,The New England Journal of Medicine2011;365:1735-173;Ramos等人,Stem Cells 28(6):1107-15(2010))。
在过继疗法的进一步改进中,可使用如本文所述的CRISPR-Cas系统进行基因组编辑以使免疫应答细胞适应替代的实现方式,例如提供经编辑的CAR T细胞(参见Poirot等人,2015,Multiplex genome edited T-cell manufacturing platform for"off-the-shelf"adoptive T-cell immunotherapies,Cancer Res 75(18):3853)。例如,可编辑免疫应答细胞以缺失II型和/或I型HLA分子中的一些或全部的表达,或者敲除可能抑制所需免疫应答的选定基因,例如PD1基因。
可使用如本文所述的任何CRISPR系统及其使用方法来编辑细胞。CRISPR系统可通过本文描述的任何方法递送至免疫细胞。在优选的实施方案中,将细胞离体编辑并转移至有需要的受试者。可编辑免疫应答细胞、CAR T细胞或用于过继细胞转移的任何细胞。可进行编辑以消除潜在的同种异体反应性T细胞受体(TCR),破坏化学治疗剂的靶标,阻断免疫检查点,激活T细胞和/或增加功能耗竭或功能异常的CD8+T细胞的分化和/或增殖(参见PCT专利公开:WO2013176915、WO2014059173、WO2014172606、WO2014184744和WO2014191128)。编辑可能导致基因失活。
通过使基因失活,预期目标基因不以功能蛋白形式表达。在一个特定的实施方案中,CRISPR系统特异性催化一个靶向基因的切割,从而使所述靶向基因失活。引起的核酸链断裂通常通过同源重组或非同源末端连接(NHEJ)的独特机制修复。但是,NHEJ是一个不完善的修复过程,通常会导致切割位点的DNA序列发生变化。经由非同源末端连接(NHEJ)进行的修复通常会导致小插入或缺失(插入/缺失),并且可用于产生特定的基因敲除。可通过本领域众所周知的方法鉴定和/或选择发生切割诱导的诱变事件的细胞。
T细胞受体(TCR)是响应于抗原呈递而参与T细胞激活的细胞表面受体。TCR通常由两条链α和β构成,它们组装形成异二聚体并与CD3转导亚基缔合,形成存在于细胞表面上的T细胞受体复合物。TCR的每条α和β链均由免疫球蛋白样的N末端可变(V)和恒定(C)区、疏水跨膜结构域和短细胞质区域组成。关于免疫球蛋白分子,α和β链的可变区是通过V(D)J重组产生的,从而在T细胞群体内产生了多种多样的抗原特异性。但是,与识别完整抗原的免疫球蛋白相反,T细胞被经加工的肽片段与MHC分子缔合而被激活,从而为T细胞的抗原识别引入了一个额外的维度,称为MHC限制。通过T细胞受体识别供体和受体之间的MHC差异会导致T细胞增殖以及移植物抗宿主病(GVHD)的潜在发展。TCRα或TCRβ的失活可导致T细胞表面TCR的消除,从而阻止对同种异体抗原和因此GVHD的识别。但是,TCR破坏通常会导致CD3信号传导组分的消除,并改变进一步T细胞扩增的方式。
同种异体细胞被宿主免疫系统迅速排斥。已经证明,存在于非照射的血液制品中的同种异体白细胞将持续不超过5至6天(Boni,Muranski等人,2008Blood 1;112(12):4746-54)。因此,为了防止同种异体细胞排斥,通常必须在一定程度上抑制宿主的免疫系统。然而,在过继细胞转移的情况下,使用免疫抑制药物也对引入的治疗性T细胞具有有害作用。因此,为了在这些情况下有效地使用过继免疫疗法方法,引入的细胞将需要对免疫抑制治疗具有抗性。因此,在一个特定的实施方案中,本发明还包括修饰T细胞以使其对免疫抑制剂具有抗性的步骤,优选通过使至少一个编码免疫抑制剂靶标的基因失活来进行。免疫抑制剂是通过若干作用机制之一抑制免疫功能的剂。免疫抑制剂可以是但不限于钙调神经磷酸酶抑制剂,雷帕霉素的靶标,白介素2受体α链阻滞剂,肌苷单磷酸脱氢酶抑制剂,二氢叶酸还原酶抑制剂,皮质类固醇或免疫抑制性抗代谢物。本发明允许通过使T细胞中的免疫抑制剂的靶标失活而赋予针对T细胞的免疫抑制抗性以用于免疫疗法。作为非限制性实例,免疫抑制剂的靶标可以是免疫抑制剂的受体,例如:CD52、糖皮质激素受体(GR)、FKBP家族基因成员和亲环蛋白家族基因成员。
免疫检查点是可减慢或停止免疫反应并防止免疫细胞的不受控制的活性对组织造成过多损害的抑制途径。在某些实施方案中,靶向的免疫检查点是程序性死亡-1(PD-1或CD279)基因(PDCD1)。在其他实施方案中,靶向的免疫检查点是细胞毒性T淋巴细胞相关抗原(CTLA-4)。在另外的实施方案中,靶向的免疫检查点是CD28和CTLA4 Ig超家族的另一个成员,例如BTLA、LAG3、ICOS、PDL1或KIR。在其他另外的实施方案中,靶向的免疫检查点是TNFR超家族的成员,例如CD40、OX40、CD137、GITR、CD27或TIM-3。
其他免疫检查点包括含Src同源性2结构域的蛋白酪氨酸磷酸酶1(SHP-1)(WatsonHA等人,SHP-1:the next checkpoint target for cancer immunotherapy?Biochem SocTrans.2016年4月15;44(2):356-62)。SHP-1是一种广泛表达的抑制蛋白酪氨酸磷酸酶(PTP)。在T细胞中,它是抗原依赖性激活和增殖的负调控剂。它是一种胞质蛋白,因此不适合抗体介导的疗法,但它在激活和增殖中的作用使其成为过继转移策略中遗传操纵的有吸引力的靶标,例如嵌合抗原受体(CAR)T细胞。免疫检查点还可包括具有Ig和ITIM结构域(TIGIT/Vstm3/WUCAM/VSIG9)和VISTA的T细胞免疫受体(Le Mercier I等人,(2015)BeyondCTLA-4and PD-1,the generation Z of negative checkpointregulators.Front.Immunol.6:418)。
WO2014172606涉及MT1和/或MT1抑制剂在增加耗竭的CD8+T细胞的增殖和/或活性和减少CD8+T细胞耗竭(例如,减少功能性耗竭或无反应性的CD8+免疫细胞)中的用途。在某些实施方案中,金属硫蛋白通过过继转移的T细胞中的基因编辑而被靶向。
在某些实施方案中,基因编辑的靶标可以是参与免疫检查点蛋白表达的至少一个靶向基因座。此类靶标可包括但不限于CTLA4、PPP2CA、PPP2CB、PTPN6、PTPN22、PDCD1、ICOS(CD278)、PDL1、KIR、LAG3、HAVCR2、BTLA、CD160、TIGIT、CD96、CRTAM、LAIR1、SIGLEC7、SIGLEC9、CD244(2B4)、TNFRSF10B、TNFRSF10A、CASP8、CASP10、CASP3、CASP6、CASP7、FADD、FAS、TGFBRII、TGFRBRI、SMAD2、SMAD3、SMAD4、SMAD10、SKI、SKIL、TGIF1、IL10RA、IL10RB、HMOX2、IL6R、IL6ST、EIF2AK4、CSK、PAG1、SIT1、FOXP3、PRDM1、BATF、VISTA、GUCY1A2、GUCY1A3、GUCY1B2、GUCY1B3、MT1、MT2、CD40、OX40、CD137、GITR、CD27、SHP-1、TIM-3、CEACAM-1、CEACAM-3或CEACAM-5。在优选的实施方案中,靶向与PD-1或CTLA-4基因的表达有关的基因座。在其他优选的实施方案中,靶向基因的组合,例如但不限于PD-1和TIGIT。
在其他实施方案中,至少两个基因被编辑。基因对可包括但不限于PD1和TCRα,PD1和TCRβ,CTLA-4和TCRα,CTLA-4和TCRβ,LAG3和TCRα,LAG3和TCRβ,Tim3和TCRα,Tim3和TCRβ,BTLA和TCRα,BTLA和TCRβ,BY55和TCRα,BY55和TCRβ,TIGIT和TCRα,TIGIT和TCRβ,B7H5和TCRα,B7H5和TCRβ,LAIR1和TCRα,LAIR1和TCRβ,SIGLEC10和TCRα,SIGLEC10和TCRβ,2B4和TCRα,2B4和TCRβ。
无论是在T细胞遗传修饰之前还是之后,通常可使用例如美国专利6,352,694;6,534,055;6,905,680;5,858,358;6,887,466;6,905,681;7,144,575;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和7,572,631中所述的方法来激活和扩增T细胞。T细胞可在体外或体内扩增。
除非另有说明,否则本发明的实践采用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组DNA的常规技术,它们在本领域技术范围内。参见MOLECULAR CLONING:A LABORATORY MANUAL,第2版(1989)(Sambrook,Fritsch和Maniatis);MOLECULAR CLONING:A LABORATORY MANUAL,第4版(2012)(Green和Sambrook);CURRENT PROTOCOLS IN MOLECULAR BIOLOGY(1987)(F.M.Ausubel等人编辑);METHODS INENZYMOLOGY系列(Academic Press,Inc.);PCR 2:A PRACTICAL APPROACH(1995)(M.J.MacPherson,B.D.Hames和G.R.Taylor编辑);ANTIBODIES,A LABORATORY MANUAL(1988)(Harlow和Lane编辑);ANTIBODIES A LABORATORY MANUAL,第2版(2013)(E.A.Greenfield编辑);以及ANIMAL CELL CULTURE(1987)(R.I.Freshney编辑)。
除非另有说明,否则本发明的实践采用常规技术来生成遗传修饰小鼠。参见Marten H.Hofker和Jan van Deursen,TRANSGENIC MOUSE METHODS AND PROTOCOLS,第2版(2011)。
使用CRISPR系统的筛选/诊断/治疗
癌症
本发明的方法和组合物可用于鉴定与耐药性和疾病细胞持久性相关的细胞状态、组分和机制。Terai等人(Cancer Research,2017年12月19日,doi:10.1158/0008-5472.CAN-17-1904)报道了用厄洛替尼+THZ1(CDK7/12抑制剂)组合疗法处理的EGFR依赖性肺癌PC9细胞中的全基因组CRISPR/Cas9增强子/抑制子筛选,以鉴定增强埃洛替尼/THZ1协同作用的多个基因,以及抑制协同作用的组分和途径。Wang等人(Cell Rep.2017年2月7日;18(6):1543-1557.doi:10.1016/j.celrep.2017.01.031.;Krall等人,Elife.2017年2月1日;6.pii:e18970.doi:10.7554/eLife.18970)报道了使用全基因组CRISPR功能丧失筛选来鉴定对MAPK抑制剂耐药的介体。Donovan等人(PLoS One.2017年1月24日;12(1):e0170445.doi:10.1371/journal.pone.0170445.eCollection 2017)使用CRISPR介导的方法进行诱变,以鉴定MAPK信号通路基因的新的功能获得和耐药等位基因。Wang等人(Cell.2017年2月23日;168(5):890-903.e15.doi:10.1016/j.cell.2017.01.013.电子出版于2017年2月2日)使用全基因组CRISPR筛选来鉴定基因网络和与致癌性Ras的合成致死相互作用。Chow等人(Nat Neurosci.2017年10月;20(10):1329-1341.doi:10.1038/nn.4620.电子出版于2017年8月14日)在开发了胶质母细胞瘤中的腺相关病毒介导的自体遗传CRISPR筛选,以鉴定胶质母细胞瘤中的功能抑制因子。Xue等人(Nature.2014年10月16日;514(7522):380-4.doi:10.1038/nature13589.电子出版于2014年8月6日)使用小鼠肝脏中CRISPR介导的癌症基因的直接突变。
Chen等人(J Clin Invest.2017年12月4日.pii:90793.doi:10.1172/JCI90793.[印刷版之前的电子版])使用基于CRISPR的筛选来鉴定MYCN扩增的神经母细胞瘤对EZH2的依赖性。支持在MYCH扩增的神经母细胞瘤患者中测试EZH2抑制剂。
Vijai等人(Cancer Discov.2016年11月;6(11):1267-1275.电子出版于2016年9月21日)报道了使用CRISPR在乳腺上皮细胞系中产生杂合突变,以评估患乳腺癌的风险。
Chakraborty等人(Sci Transl Med.2017年7月12日;9(398).pii:eaal5272.doi:10.1126/scitranslmed.aal5272)使用基于CRISPR的筛选将EZH1鉴定为治疗透明细胞肾细胞癌的潜在靶标
代谢性疾病
本发明的方法和组合物在治疗遗传性肝脏代谢疾病方面提供优于常规基因治疗方法的优势,所述疾病包括但不限于家族性高胆固醇血症、血友病、鸟氨酸转氨甲酰酶缺乏症、遗传性酪氨酸血症1型和α-1抗胰蛋白酶缺乏症。参见Bryson等人,Yale J.Biol.Med.90(4):553-566,2017年12月19日。
Bompada等人(Int J Biochem Cell Biol.2016年12月;81(Pt A):82-91.doi:10.1016/j.biocel.2016.10.022.电子出版于2016年10月29日)描述了使用CRISPR敲除胰腺β细胞中的组蛋白乙酰转移酶,以证明组蛋白乙酰化充当葡萄糖诱导的TXNIP基因表达增加以及进而糖毒性诱导的细胞凋亡的关键调控子。
眼睛
本发明提供了对遗传性和获得性视网膜眼病的有效治疗。Holmgaard等人(Mol.Ther.Nucleic Acids 9:89-99,2017年12月15日,doi:10.1016/j.omtn.2017.08.016.电子出版于2017年9月21日)报道了当SpCas9被编码靶向Vegfa的SpCas9的慢病毒载体(LV)递送时,在高频率下形成插入/缺失,并且转导细胞中VEGFA显著减少。Duan等人(J Biol Chem.2016年7月29日;291(31):16339-47.doi:10.1074/jbc.M116.729467.电子出版于2016年5月31日)描述了使用CRISPR来靶向人类原代视网膜色素上皮细胞中的MDM2基因组基因座
本发明的方法和组合物类似地适用于眼病(包括与年龄有关的黄斑变性)的治疗。
Huang等人(Nat Commun.2017年7月24日;8(1):112.doi:10.1038/s41467-017-00140-3)使用CRISPR来编辑VEGFR2以治疗与血管新生相关的疾病。
听力
Gao等人(Nature.2017年12月20日.doi:10.1038/nature25164.[印刷版之前的电子版])报道了使用CRISPR-Cas9进行基因组编辑以靶向小鼠中的Tmc1基因并减少进行性听力损失和耳聋。
肌肉
Provenzano等人(Mol Ther Nucleic Acids.9:337-348.2017年12月15日;doi:10.1016/j.omtn.2017.10.006.电子出版于2017年10月14日)报道了CRISPR/Cas9介导的CTG扩增缺失和永久回复至1型肌强直性营养不良患者的肌细胞的正常表型。本发明的方法和组合物类似地适用于核苷酸重复病症,不限于CTG扩增。Tabebordbar等人(2016年1月22日;351(6271):407-411.doi:10.1126/science.aad5177.电子出版于2015年12月31日)报道了使用CRISPR来编辑Dmd外显子23基因座以校正DMD中的破坏性突变。Tabebordbar表明,可编程CRISPR复合物可在新生和成年小鼠中局部性和全身性递送至终末分化的骨骼肌纤维和心肌细胞以及肌肉卫星细胞,其中它们介导靶向基因修饰,恢复肌营养不良蛋白的表达并部分恢复营养不良性肌肉的功能缺陷。还参见Nelson等人(Science.2016年1月22日;351(6271):403-7.doi:10.1126/science.aad5143.电子出版于2015年12月31日)。
感染性疾病
Sidik等人(Cell.2016年9月8日;166(6):1423-1435.e12.doi:10.1016/j.cell.2016.08.019.电子出版于2016年9月2日)以及Patel等人(Nature.2017年8月31日;548(7669):537-542.doi:10.1038/nature23477.电子出版于2017年8月7日)描述了弓形虫中的CRISPR筛选和抗寄生虫干预的扩展。
存在几份关于全基因组CRISPR筛选的报告,旨在鉴定宿主-病原体相互作用的组分和潜在过程。实例包括Blondel等人(Cell Host Microbe.2016年8月10日;20(2):226-37.doi:10.1016/j.chom.2016.06.010.电子出版于2016年7月21日);Shapiro等人(NatMicrobiol.2018年1月;3(1):73-82.doi:10.1038/s41564-017-0043-0.电子出版于2017年10月23日);以及Park等人(Nat Ge net.2017年2月;49(2):193-203.doi:10.1038/ng.3741.电子出版于2016年12月19日)。
Ma等人(Cell Host Microbe.2017年5月10日;21(5):580-591.e7.doi:10.1016/j.chom.2017.04.005)使用全基因组CRISPR功能丧失筛选来鉴定病毒转化驱动的合成致命靶标以用于治疗干预。
心血管疾病
CRISPR系统可用作鉴定与血管疾病相关的基因或遗传变体的工具。这对于鉴定潜在的治疗或预防靶标是有用的。Xu等人(Atherosclerosis,2017年9月21日,pii:S0021-9150(17)31265-0.doi:10.1016/j.atherosclerosis.2017.08.031.[印刷版之前的电子版])报道了使用CRISPR来敲除ANGPTL3基因以确认ANGPTL3在调节LDL-C血浆水平中的作用。Gupta等人(Cell.2017年7月27日;170(3):522-533.e15.doi:10.1016/j.cell.2017.06.049)报道了使用CRISPR来编辑干细胞衍生的内皮细胞以鉴定与血管疾病相关的遗传变体。Beaudoin等人(Arterioscler Thromb Vasc Biol.2015年6月;35(6):1472-1479.doi:10.1161/ATVBAHA.115.305534.电子出版于2015年4月2日)报道了使用CRISPR基因组编辑来破坏转录因子MEF2在基因座处的结合。这为探索PHACTR1在血管内皮中的功能如何影响冠状动脉疾病奠定了基础。Pashos等人(Cell Stem Cell.2017年4月6日;20(4):558-570.e10.doi:10.1016/j.stem.2017.03.017.)报道了使用CRISPR技术靶向多能干细胞和肝细胞样细胞以鉴定功能变体和脂质功能基因。
除了用作鉴定靶标的工具外,CRISPR系统还可直接用于治疗或预防已知靶标的心血管疾病。Khera等人(Nat Rev Genet.2017年6月;18(6):331-344.doi:10.1038/nrg.2016.160.电子出版于2017年3月13日)描述了常见变异关联研究,该研究将约60个遗传基因座与冠心病风险联系在一起,以促进对因果风险因素、新疗法的潜在生物学发展的更好理解。例如,Khera解释,PCSK9的失活突变降低了循环LDL胆固醇的水平并降低了CAD的风险,这引起了人们对PCSK9抑制剂开发的浓厚兴趣。此外,设计用于模拟APOC3或LPA中保护性突变的反义寡核苷酸分别显示甘油三酯水平降低~70%并且循环脂蛋白(a)水平降低80%。另外,Wang等人(Arterioscler Thromb Vasc Biol.2016年5月;36(5):783-6.doi:10.1161/ATVBAHA.116.307227.电子出版于2016年3月3日)和Ding等人(Circ Res.2014年8月15日;115(5):488-92.doi:10.1161/CIRCRESAHA.115.304351.电子出版于2014年6月10日)报道了使用CRISPR来靶向基因Pcsk9以预防心血管疾病。
本发明提供了用于研究和治疗神经系统疾病和病症的方法和组合物。Nakayama等人(Am J Hum Genet.2015年5月7日;96(5):709-19.doi:10.1016/j.ajhg.2015.03.003.电子出版于2015年4月9日)报道了使用CRISPR来研究PYCR2在人类CNS发育中的作用以及鉴定小头畸形和髓鞘形成减少的潜在靶标。Swiech等人(Nat Biotechnol.2015年1月;33(1):102-6.doi:10.1038/nbt.3055.电子出版于2014年10月19日)报道了体内使用CRISPR来靶向成年小鼠脑中的单一(Mecp2)以及多个基因(Dnmt1、Dnmt3a和Dnmt3b)。Shin等人(HumMol Genet.2016年10月15日;25(20):4566-4576.doi:10.1093/hmg/ddw286)描述了使用CRISPR来灭活亨廷顿氏病的突变。Platt等人(Cell Rep.2017年4月11日;19(2):335-350.doi:10.1016/j.celrep.2017.03.052)报道了使用CRISPR敲入小鼠来鉴定Chd8在自闭症谱系障碍中的作用。Seo等人(J Neurosci.2017年10月11日;37(41):9917-9924.doi:10.1523/JNEUROSCI.0621-17.2017.电子出版于2017年9月14日)描述了使用CRISPR来生成神经退行性病症的模型。Petersen等人(Neuron.2017年12月6日;96(5):1003-1012.e7.doi:10.1016/j.neuron.2017.10.008.电子出版于2017年11月2日)证明了CRISPR敲除少突胶质祖细胞中I型激活素A受体以鉴定髓鞘再生失败的疾病的潜在靶标。本发明的方法和组合物类似地适用。
CRISPR技术的其他应用。
Renneville等人(Blood.2015年10月15日;126(16):1930-9.doi:10.1182/blood-2015-06-649087.电子出版于2015年8月28日)报道了使用CRISPR来研究EHMT1和EMHT2在胎儿血红蛋白表达中的作用并鉴定SCD的新型治疗靶标。
Tothova等人(Cell Stem Cell.2017年10月5日;21(4):547-555.e8.doi:10.1016/j.stem.2017.07.015)报道了在造血干细胞和祖细胞中使用CRISPR来生成人类骨髓疾病的模型。
Giani等人(Cell Stem Cell.2016年1月7日;18(1):73-78.doi:10.1016/j.stem.2015.09.015.电子出版于2015年10月22日)报道,通过在人类多能干细胞中进行CRISPR/Cas9基因组编辑来灭活SH2B3,可增强红系细胞扩增并保持分化。
Wakabayashi等人(Proc Natl Acad Sci U S A.2016年4月19日;113(16):4434-9.doi:10.1073/pnas.1521754113.电子出版于2016年4月4日)使用CRISPR来深入了解GATA1转录活性并研究非编码变体在人类红系病症中的致病性。
Mandal等人(Cell Stem Cell.2014年11月6日;15(5):643-52.doi:10.1016/j.stem.2014.10.004.电子出版于2014年11月6日)描述了两种临床相关基因B2M和CCR5在原代人CD4+T细胞和CD34+造血干细胞和祖细胞(HSPC)中的CRISPR/Cas9靶向。
Polfus等人(Am J Hum Genet.2016年9月1日;99(3):785.doi:10.1016/j.ajhg.2016.08.002.电子出版于2016年9月1日)使用CRISPR来编辑造血细胞系并跟踪人类原代造血干细胞和祖细胞的靶向敲低实验,并研究GFI1B变体在人类造血中的作用。
Najm等人(Nat Biotechnol.2017年12月18日.doi:10.1038/nbt.4048.[印刷版之前的电子版])报道了使用具有一对SaCas9和SpCas9的CRISPR复合物来实现双重靶向,以生成高复杂度的合并双重敲除文库,以鉴定跨多种细胞类型的合成致死和缓冲基因对,包括MAPK途径基因和凋亡基因。
Manguso等人(Nature.2017年7月27日;547(7664):413-418.doi:10.1038/nature23270.电子出版于2017年7月19日)报道了使用CRISPR筛选来鉴定和/或确认新的免疫治疗靶标。还参见Roland等人(Proc Natl Acad Sci US A.2017年6月20日;114(25):6581-6586.doi:10.1073/pnas.1701263114.电子出版于2017年6月12日);Erb等人(Nature.2017年3月9日;543(7644):270-274.doi:10.1038/nature21688.电子出版于2017年3月1日);Hong等人(Nat Commun.2016年6月22日;7:11987.doi:10.1038/ncomms11987);Fei等人(Proc Natl Acad Sci U S A.2017年6月27日;114(26):E5207-E5215.doi:10.1073/pnas.1617467114.电子出版于2017年6月13日);Zhang等人(Cancer Discov.2017年9月29日.doi:10.1158/2159-8290.CD-17-0532.[印刷版之前的电子版])。
Joung等人(Nature.2017年8月17日;548(7667):343-346.doi:10.1038/nature23451.电子出版于2017年8月9日)报道了使用全基因组筛选来分析长的非编码RNA(lncRNA);还参见Zhu等人(Nat Biotechnol.2016年12月;34(12):1279-1286.doi:10.1038/nbt.3715.电子出版于2016年10月31日);Sanjana等人(Science.2016年9月30日;353(6307):1545-1549)。
Barrow等人(Mol Cell.2016年10月6日;64(1):163-175.doi:10.1016/j.molcel.2016.08.023.电子出版于2016年9月22日)报道了使用全基因组CRISPR筛选来寻找线粒体疾病的治疗靶标。还参见Vafai等人(PLoS One.2016年9月13日;11(9):e0162686.doi:10.1371/journal.pone.0162686.eCollection 2016)。
Guo等人(Elife.2017年12月5日;6.pii:e29329.doi:10.7554/eLife.29329)报道了使用CRISPR来靶向人软骨细胞以阐明人类生长的生物学机制。
Ramanan等人(Sci Rep.2015年6月2日;5:10833.doi:10.1038/srep10833)报道了使用CRISPR来靶向和切割HBV基因组中的保守区。
基因驱动
本发明还考虑了本文所述的CRISPR-Cas系统,例如C2c1效应蛋白系统,例如在类似于PCT专利公开WO 2015/105928中所述的基因驱动的系统中,提供RNA指导的基因驱动的用途。这种类型的系统例如可通过将编码RNA指导的DNA核酸酶和一种或多种指导RNA的核酸序列引入种系细胞中来提供改变真核种系细胞的方法。指导RNA可被设计为与种系细胞的基因组DNA上的一个或多个靶标位置互补。可在构建体上在侧翼序列之间提供编码RNA指导的DNA核酸酶的核酸序列和编码指导RNA的核酸序列,并布置启动子,使得种系细胞可表达RNA指导的DNA核酸酶和指导RNA,以及也位于侧翼序列之间的任何所需的货物编码序列。侧翼序列通常将包括与所选靶染色体上的相应序列相同的序列,使得侧翼序列与由构建体编码的组分一起工作,以促进通过例如同源重组的机制将外源核酸构建体序列插入基因组DNA中的靶标切割位点,以使种系细胞对外来核酸序列为纯合的。通过这种方式,基因驱动系统能够在整个繁殖种群中渗入所需的货物基因(Gantz等人,2015,Highly efficientCas9-mediated gene drive for population modification of the malaria vectormosquito Anopheles stephensi,PNAS 2015,印刷版之前的电子版,2015年11月23日,doi:10.1073/pnas.1521077112;Esvelt等人,2014,Concerning RNA-guided gene drives forthe alteration of wild populations eLife2014;3:e03401)。在一些实施方案中,本发明提供了一种通过基因驱动系统来控制昆虫传播疾病的方法,所述疾病包括疟疾、寨卡病毒、西尼罗河病毒、日本脑炎病毒和登革热病毒,所述基因驱动系统在整个昆虫繁殖种群中渗入所需的货物基因。在一些实施方案中,基因驱动系统是CRISPR-C2c1系统。在特定的实施方案中,昆虫是蚊子。在选定的实施方案中,可选择在基因组中几乎没有脱靶位点的靶序列。使用多个指导RNA靶向靶基因座内的多个位点,可能会增加切割频率并阻碍抗驱动等位基因的进化。截短的指导RNA可能会减少脱靶切割。可使用成对的切口酶代替单个核酸酶,以进一步提高特异性。基因驱动构建体可包括编码转录调控子的货物序列,例如以激活同源重组基因和/或阻遏非同源末端连接。可在必需基因中选择靶位点,以便非同源末端连接事件可能导致致死性,而不是产生抗驱动等位基因。基因驱动构建体可经工程化以在一定温度范围下在多种宿主中发挥功能(Cho等人,2013,Rapid and Tunable Control ofProtein Stability in Caenorhabditis elegans Using a Small Molecule,PLoS ONE 8(8):e72393.doi:10.1371/journal.pone.0072393)。如本文所公开的CRISPR-C2c1系统可应用于如Ganz等人和Cho等人中所述的类似的基因驱动构建体和系统。在某些实施方案中,CRISPR-C2c1系统修饰参与生殖调节的基因。在一些实施方案中,CRISPR-C2c1系统修饰疾病相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜生物质相关基因。在某些实施方案中,CRISPR-C2c1系统修饰牲畜性状相关基因。在一些实施方案中,性状相关基因涉及害虫和真菌感染的易感性。在特定的实施方案中,将CRISPR-C2c1系统递送至昆虫细胞。在一个特定的实施方案中,昆虫细胞是蜜蜂细胞。在一些实施方案中,将CRISPR-C2c1系统递送至动物细胞。在一些实施方案中,将CRISPR-C2c1系统递送至非人类哺乳动物细胞。在特定的实施方案中,性状相关基因参与肥胖的调控。关于C2c1蛋白,CRISPR-C2c1系统识别富含T的PAM序列。在一些实施方案中,PAM是5'TTN 3'或5'ATTN 3',其中N是任何核苷酸。在一些实施方案中,CRISPR-C2c1系统引入一个或多个具有5'突出端的交错双链断裂(DSB)。在特定的实施方案中,5'突出端为7nt。在一些实施方案中,CRISPR-C2c1系统经由HR或NHEJ在交错DSB处引入外源模板DNA序列。在一些实施方案中,C2c1效应蛋白包含一个或多个突变。在一些实施方案中,C2c1效应蛋白是切口酶。在一些特定的实施方案中,CRISPR-C2c1系统包含与修饰目标靶基因座的功能结构域相缔合的无催化活性的C2c1蛋白。在一个特定的实施方案中,CRISPR-C2c1系统引入单个突变。在另一个特定的实施方案中,CRISPR-C2c1系统将单个核苷酸修饰引入目标靶基因座的转录物,而不修饰牲畜的基因组。
异种移植
本发明还考虑了本文所述的CRISPR-Cas系统,例如C2c1效应蛋白系统,用于提供适合使用的RNA指导的DNA核酸酶以提供用于移植的修饰组织的用途。例如,RNA指导的DNA核酸酶可用于敲除、敲低或破坏动物(例如转基因猪(例如人血红素加氧酶-1转基因猪系))中的选定基因,例如通过破坏编码由人类免疫系统识别的表位的基因即异种抗原基因的表达。用于破坏的候选猪基因可例如包括α(1,3)-半乳糖基转移酶和胞苷单磷酸-N-乙酰神经氨酸羟化酶基因(参见PCT专利公开WO 2014/066505)。另外,编码内源性逆转录病毒的基因,例如编码所有猪内源性逆转录病毒的基因,可能会被破坏(参见Yang等人,2015,Genome-wide inactivation of porcine endogenous retroviruses(PERVs),Science,2015年11月27日:第350卷第6264期,第1101-1104页)。另外,RNA指导的DNA核酸酶可用于靶向异种移植供体动物中其他基因的整合位点,例如人类CD55基因,以提高针对超急性排斥的保护。
通用基因疗法的考虑因素
疾病相关基因和多核苷酸以及疾病特定信息的实例可获自在万维网上可用的McKusick-Nathans Institute of Genetic Medicine,Johns Hopkins University(Baltimore,Md.)和National Center for Biotechnology Information,NationalLibrary of Medicine(Bethesda,Md.)。
这些基因和途径中的突变可导致产生不当的蛋白质或不当量的蛋白质,从而影响功能。基因、疾病和蛋白质的其他实例在此通过从2012年12月12日提交的美国临时申请61/736,527引用而并入。此类基因、蛋白质和途径可以是本发明的CRISPR复合物的靶多核苷酸。疾病相关基因和多核苷酸的实例列于表7和表8。信号传导生化途径相关的基因和多核苷酸的实例列于表9。
本发明的实施方案还涉及与敲除基因、扩增基因和修复与DNA重复不稳定性和神经系统病症相关的特定突变有关的方法和组合物(Robert D.Wells,Tetsuo Ashizawa,Genetic Instabilities and Neurological Diseases,第二版,Academic Press,2011年10月13日,-Medical)。已发现串联重复序列的特定方面与超过二十种人类疾病有关(Newinsights into repeat instability:role of RNA·DNA hybrids.McIvor EI,Polak U,Napierala M.RNA Biol.2010年9-10月;7(5):551-8)。可利用本发明的效应蛋白系统来校正基因组不稳定性的这些缺陷。
本发明的若干其他方面涉及校正与广泛范围的遗传疾病相关的缺陷,所述遗传疾病在美国国立卫生研究院的网站上的“遗传病症”小节下有进一步描述(网站health.nih.gov/topic/GeneticDisorders)。遗传性脑疾病可包括但不限于肾上腺脑白质营养不良、胼胝体发育不良(Agenesis of the Corpus Callosum)、爱卡迪综合征(AicardiSyndrome)、阿尔珀斯病(Alpers'Disease)、阿尔茨海默氏病、巴特综合征(BarthSyndrome)、巴滕病(Batten Disease)、CADASIL、小脑变性、法布里氏病(Fabry'sDisease)、格斯特曼-施特劳斯勒-舍因克病(Gerstmann-Straussler-ScheinkerDisease)、亨廷顿氏病和其他三联体重复病症、雷氏病(Leigh's Disease)、Lesch-Nyhan综合征、孟克斯病(Menkes Disease)、线粒体肌病和NINDS空洞脑。这些疾病在美国国立卫生研究院网站“遗传性脑病症”小节中有进一步描述。
在整个本公开内容中,已经提到了CRISPR或CRISPR-Cas复合物或系统。CRISPR系统或复合物可靶向核酸分子,例如CRISPR-C2c1复合物可靶向并切割或切刻或仅位于靶DNA分子上(取决于C2c1是否具有使其成为切口酶或“死亡”的突变)。这样的系统或复合物适合于实现候选疾病基因的组织特异性和时间控制的靶向缺失。实例包括但不限于涉及胆固醇和脂肪酸代谢、淀粉样疾病、显性阴性疾病、潜伏病毒感染以及其他病症的基因。因此,此类系统或复合物的靶序列可在候选疾病基因中,例如:
因此,关于CRISPR或CRISPR-Cas复合物,本发明考虑了造血障碍的校正。例如,严重的免疫缺陷综合征(SCID)是由淋巴细胞T成熟缺陷引起的,所述缺陷总是与淋巴细胞B的功能缺陷相关(Cavazzana-Calvo等人,Annu.Rev.Med.,2005,56,585-602;Fischer等人,Immunol.Rev.,2005,203,98-109)。在SCID形式之一的腺苷脱氨酶(ADA)缺乏的情况下,可通过注射重组腺苷脱氨酶来治疗患者。由于已证明ADA基因在SCID患者中突变(Giblett等人,Lancet,1972,2,1067-1069),因此已鉴定出SCID中涉及的若干其他基因(Cavazzana-Calvo等人,Annu.Rev.Med.,2005,56,585-602;Fischer等人,Immunol.Rev.,2005,203,98-109)。SCID的主要原因有四个:(i)SCID的最常见形式SCID-X1(X连锁的SCID或X-SCID)是由IL2RG基因的突变引起的,导致不存在成熟的T淋巴细胞和NK细胞。IL2RG编码γC蛋白(Noguchi等人,Cell,1993,73,147-157),其是至少五种白介素受体复合物的共同组分。这些受体通过JAK3激酶激活若干靶标(Macchi等人,Nature,1995,377,65-68),这种失活导致与γC失活相同的综合征;(ii)ADA基因的突变导致嘌呤代谢缺陷,从而对淋巴细胞前体致死,进而导致B、T和NK细胞几乎不存在;(iii)V(D)J重组是免疫球蛋白和T淋巴细胞受体(TCR)成熟中必不可少的步骤。重组激活基因1和2(RAG1和RAG2)和Artemis(参与此过程的三个基因)中的突变导致不存在成熟的T和B淋巴细胞;以及(iv)还已报道了参与T细胞特异性信号传导的其他基因(例如CD45)的突变,尽管它们代表了少数病例(Cavazzana-Calvo等人,Annu.Rev.Med.,2005,56,585-602;Fischer等人,Immunol.Rev.,2005,203,98-109)。在涉及CRISPR或CRISPR-Cas复合物考虑系统的本发明的方面中,本发明考虑其可用于校正由若干遗传突变引起的眼缺陷,所述眼缺陷在Genetic Diseases of the Eye,第二版,EliasI.Traboulsi编辑,Oxford University Press,2012中进一步描述。要校正的眼缺陷的非限制性实例包括黄斑变性(MD)、色素性视网膜炎(RP)。与眼缺陷相关的基因和蛋白质的非限制性实例包括但不限于以下蛋白质:(ABCA4)ATP结合盒亚家族A(ABC1)成员4,ACHM1色盲(视杆单色性)1,ApoE载脂蛋白E(ApoE),C1QTNF5(CTRP5)C1q和肿瘤坏死因子相关蛋白5(C1QTNF5),C2补体成分2(C2),C3补体成分(C3),CCL2趋化因子(C-C基序)配体2(CCL2),CCR2趋化因子(C-C基序)受体2(CCR2),CD36分化簇36,CFB补体因子B,CFH补体因子CFH H,CFHR1补体因子H相关1,CFHR3补体因子H相关3,CNGB3环状核苷酸门控通道β3,CP铜蓝蛋白(CP),CRP C反应蛋白(CRP),CST3胱抑素C或胱抑素3(CST3),CTSD组织蛋白酶D(CTSD),CX3CR1趋化因子(C-X3-C基序)受体1,ELOVL4极长链脂肪酸的延伸4,ERCC6切除修复交叉互补啮齿动物修复缺陷互补组6,FBLN5腓骨蛋白-5,FBLN5腓骨蛋白5,FBLN6腓骨蛋白6,FSCN2fascin(FSCN2),HMCN1半中心蛋白1,HMCN1半中心蛋白1,HTRA1 HtrA丝氨酸肽酶1(HTRA1),HTRA1 HtrA丝氨酸肽酶1,IL-6白介素6,IL-8白介素8,LOC387715假定蛋白,PLEKHA1含普利克底物蛋白同源结构域的家族A成员1(PLEKHA1),PROM1 Prominin1(PROM1或CD133),PRPH2外周蛋白-2,RPGR色素性视网膜炎GTP酶调控剂,SERPING1 serpin肽酶抑制剂进化枝G成员1(C1-抑制剂),TCOF1糖蜜,TIMP3金属蛋白酶抑制剂3(TIMP3),TLR3 Toll样受体3。关于CRISPR或CRISPR-Cas复合物,本发明也考虑递送至心脏。对于心脏,优选心肌嗜性腺相关病毒(AAVM),特别是在心脏中显示优先基因转移的AAVM41(参见例如Lin-Yanga等人,PNAS,2009年3月10日,第106卷,第10期)。例如,美国专利公开第20110023139号描述了锌指核酸酶用于遗传修饰与心血管疾病相关的细胞、动物和蛋白质的用途。心血管疾病通常包括高血压、心脏病、心力衰竭以及中风和TIA。举例来说,染色体序列可包括但不限于IL1B(白介素1,β),XDH(黄嘌呤脱氢酶),TP53(肿瘤蛋白p53),PTGIS(前列腺素12(前列环素)合酶),MB(肌红蛋白),IL4(白介素4),ANGPT1(血管生成素1),ABCG8(ATP结合盒,亚家族G(WHITE),成员8),CTSK(组织蛋白酶K),PTGIR(前列腺素12(前列环素)受体(IP)),KCNJ11(钾内向整流通道,亚家族J,成员11),INS(胰岛素),CRP(C反应蛋白,与正五聚蛋白相关),PDGFRB(血小板衍生的生长因子受体,β多肽),CCNA2(细胞周期蛋白A2),PDGFB(血小板衍生的生长因子β多肽(猿猴肉瘤病毒(v-sis)致癌基因同源物)),KCNJ5(钾内向整流通道,亚家族J,成员5),KCNN3(钾中等/小电导钙激活通道,亚家族N,成员3),CAPN10(钙蛋白酶10),PTGES(前列腺素E合酶),ADRA2B(肾上腺素,α-2B-,受体),ABCG5(ATP结合盒,亚家族G(WHITE),成员5),PRDX2(过氧化物酶2),CAPN5(钙蛋白酶5),PARP14(聚(ADP-核糖)聚合酶家族,成员14),MEX3C(mex-3同源物C(秀丽隐杆线虫)),ACE血管紧张素I转化酶(肽基-二肽酶A)1),TNF(肿瘤坏死因子(TNF超家族,成员2)),IL6(白介素6(干扰素,β2)),STN(他汀类),SERPINE1(serpin肽酶抑制剂,进化枝E(连接蛋白,纤溶酶原激活物抑制剂1型),成员1),ALB(白蛋白),ADIPOQ(含脂联素、C1Q和胶原蛋白结构域),APOB(载脂蛋白B(包括Ag(x)抗原)),APOE(载脂蛋白E),LEP(瘦素),MTHFR(5,10-亚甲基四氢叶酸还原酶(NADPH)),APOA1(载脂蛋白A-I),EDN1(内皮素1),NPPB(利钠肽前体B),NOS3(一氧化氮合酶3(内皮细胞)),PPARG(过氧化物酶体增殖物激活受体γ),PLAT(纤溶酶原激活物,组织),PTGS2(前列腺素-内过氧化物合酶2(前列腺素G/H合酶和环氧合酶)),CETP(胆固醇酯转移蛋白,血浆),AGTR1(血管紧张素II受体,1型),HMGCR(3-羟基-3-甲基戊二酰辅酶A还原酶),IGF1(胰岛素样生长因子1(生长调节素C)),SELE(选择素E),REN(肾素),PPARA(过氧化物酶体增殖物激活受体α),PON1(对氧磷酶1),KNG1(激肽原1),CCL2(趋化因子(C-C基序)配体2),LPL(脂蛋白脂肪酶),VWF(von Willebrand因子),F2(凝血因子II(凝血酶)),ICAM1(细胞间粘附分子1),TGFB1(转化生长因子,β1),NPPA(利钠肽前体A),IL10(白介素10),EPO(促红细胞生成素),SOD1(超氧化物歧化酶1,可溶性),VCAM1(血管细胞粘附分子1),IFNG(干扰素,γ),LPA(脂蛋白,Lp(a)),MPO(髓过氧化物酶),ESR1(雌激素受体1),MAPK1(有丝分裂原激活的蛋白激酶1),HP(触珠蛋白),F3(凝血因子III(凝血酶原,组织因子)),CST3(胱抑素C),COG2(低聚高尔基复合体组分2),MMP9(基质金属肽酶9(明胶酶B,92kDa明胶酶,92kDa IV型胶原酶)),SERPINC1(serpin肽酶抑制剂,进化枝C(抗凝血酶),成员1),F8(凝血因子VIII,促凝血组分),HMOX1(血红素加氧酶(decycling)1),APOC3(载脂蛋白C-III),IL8(白介素8),PROK1(前动力蛋白1),CBS(胱硫醚-β-合酶),NOS2(一氧化氮合酶2,诱导型),TLR4(toll样受体4),SELP(选择素P(颗粒膜蛋白140kDa,抗原CD62)),ABCA1(ATP结合盒,亚家族A(ABC1),成员1),AGT(血管紧张素原(serpin蛋白酶抑制剂,进化枝A,成员8)),LDLR(低密度脂蛋白受体),GPT(谷氨酸-丙酮酸转氨酶(丙氨酸氨基转移酶)),VEGFA(血管内皮生长因子A),NR3C2(核受体亚家族3,C组,成员2),IL18(白介素18(干扰素-γ诱导因子)),NOS1(一氧化氮合酶1(神经元)),NR3C1(核受体亚家族3,C组,成员1(糖皮质激素受体)),FGB(纤维蛋白原β链),HGF(肝细胞生长因子(hepapoietin A;散射因子)),IL1A(白介素1,α),RETN(抵抗素),AKT1(v-akt鼠类胸腺瘤病毒致癌基因同源物1),LIPC(脂肪酶,肝),HSPD1(热休克60kDa蛋白1(伴侣蛋白)),MAPK14(有丝分裂原激活的蛋白激酶14),SPP1(分泌的磷蛋白1),ITGB3(整合素,β3(血小板糖蛋白)111a,抗原CD61)),CAT(过氧化氢酶),UTS2(尿紧张素2),THBD(血栓调节素),F10(凝血因子X),CP(铜蓝蛋白(铁氧化酶)),TNFRSF11B(肿瘤坏死因子受体超家族,成员11b),EDNRA(A型内皮素受体),EGFR(表皮生长因子受体(成红细胞白血病病毒(v-erb-b)致癌基因同源物,禽类)),MMP2(基质金属肽酶2(明胶酶A,72kDa明胶酶,72kDa IV型胶原酶)),PLG(纤溶酶原),NPY(神经肽Y),RHOD(ras同源基因家族,成员D),MAPK8(有丝分裂原激活的蛋白激酶8),MYC(v-myc骨髓细胞瘤病病毒致癌基因同源物(禽类)),FN1(纤连蛋白1),CMA1(糜酶1,肥大细胞),PLAU(纤溶酶原激活剂,尿激酶),GNB3(鸟嘌呤核苷酸结合蛋白(G蛋白),β多肽3),ADRB2(肾上腺素,β-2-,受体,表面),APOA5(载脂蛋白A-V),SOD2(超氧化物歧化酶2,线粒体),F5(凝血因子V(前加速素,不稳定因子)),VDR(维生素D(1,25-二羟基维生素D3)受体),ALOX5(花生四烯酸5-脂氧合酶),HLA-DRB1(主要组织相容性复合物,II类,DRβ1),PARP1(聚(ADP-核糖)聚合酶1),CD40LG(CD40配体),PON2(对氧磷酶2),AGER(晚期糖基化终产物特异性受体),IRS1(胰岛素受体底物1),PTGS1(前列腺素-内过氧化物合酶1(前列腺素G/H合酶和环加氧酶)),ECE1(内皮素转化酶1),F7(凝血因子VII(血清凝血酶原转化促进剂)),URN(白介素1受体拮抗剂),EPHX2(环氧水解酶2,细胞质),IGFBP1(胰岛素样生长因子结合蛋白1),MAPK10(有丝分裂原激活的蛋白激酶10),FAS(Fas(TNF受体超家族,成员6)),ABCB1(ATP结合盒,亚家族B(MDR/TAP),成员1),JUN(jun致癌基因),IGFBP3(胰岛素样生长因子结合蛋白3),CD14(CD14分子),PDE5A(磷酸二酯酶5A,cGMP特异性),AGTR2(血管紧张素II受体,2型),CD40(CD40分子,TNF受体超家族成员5),LCAT(卵磷脂-胆固醇酰基转移酶),CCR5(趋化因子(C-C基序)受体5),MMP1(基质金属肽酶1(间质胶原酶)),TIMP1(TIMP金属肽酶抑制剂1),ADM(肾上腺髓质素),DYT10(肌张力障碍10),STAT3(信号转导子和转录激活子3(急性期反应因子)),MMP3(基质金属肽酶3(基质溶素1,前明胶酶)),ELN(弹性蛋白),USF1(上游转录因子1),CFH(补体因子H),HSPA4(热休克70kDa蛋白4),MMP12(基质金属肽酶12(巨噬细胞弹性蛋白酶)),MME(膜金属内肽酶),F2R(凝血因子II(凝血酶)受体),SELL(选择素L),CTSB(组织蛋白酶B),ANXA5(annexin A5),ADRB1(肾上腺素,β-1-,受体),CYBA(细胞色素b-245,α多肽),FGA(纤维蛋白原α链),GGT1(γ-谷氨酰转移酶1),LIPG(脂肪酶,内皮),HIF1A(低氧诱导因子1,α亚基(碱性螺旋-环-螺旋转录因子)),CXCR4(趋化因子(C-X-C基序)受体4),PROC(蛋白C(凝血因子Va和VIIIa的灭活剂)),SCARB1(B类清道夫受体,成员1),CD79A(CD79a分子,免疫球蛋白相关α),PLTP(磷脂转移蛋白),ADD1(内收蛋白1(α)),FGG(纤维蛋白原γ链),SAA1(血清淀粉样蛋白A1),KCNH2(钾电压门控通道,亚家族H(eag相关),成员2),DPP4(二肽基-肽酶4),G6PD(葡萄糖-6-磷酸脱氢酶),NPR1(利钠肽受体A/鸟苷酸环化酶A(利尿钠肽受体A)),VTN(玻连蛋白),KIAA0101(KIAA0101),FOS(FBJ鼠类骨肉瘤病毒致癌基因同源物),TLR2(toll类受体2),PPIG(肽基脯氨酰异构酶G(亲环素G)),IL1R1(白介素1受体,I型),AR(雄激素受体),CYP1A1(细胞色素P450,家族1,亚家族A,多肽1),SERPINA1(serpin肽酶抑制剂,进化枝A(α-1抗蛋白酶,抗胰蛋白酶),成员1),MTR(5-甲基四氢叶酸-高半胱氨酸甲基转移酶),RBP4(视黄醇结合蛋白4,血浆),APOA4(载脂蛋白A-IV),CDKN2A(细胞周期蛋白依赖性激酶抑制剂2A(黑色素瘤,p16,抑制CDK4)),FGF2(成纤维细胞生长因子2(碱性)),EDNRB(内皮素B型受体),ITGA2(整合素,α2(CD49B,VLA-2受体的α2亚基)),CABIN1(钙调神经磷酸结合蛋白1),SHBG(性别激素结合球蛋白),HMGB1(高迁移率组盒1),HSP90B2P(热休克蛋白90kDaβ(Grp94),成员2(假基因)),CYP3A4(细胞色素P450,家族3,亚家族A,多肽4),GJA1(间隙连接蛋白,α1,43kDa),CAV1(小窝蛋白1,胞膜窖蛋白,22kDa),ESR2(雌激素受体2(ERβ)),LTA(淋巴毒素α(TNF超家族,成员1)),GDF15(生长分化因子15),BDNF(脑源性神经营养因子),CYP2D6(细胞色素P450,家族2,亚家族D,多肽6),NGF(神经生长因子(β多肽)),SP1(Sp1转录因子),TGIF1(TGFB诱导的因子同源盒1),SRC(v-src肉瘤(Schmidt-Ruppin A-2)病毒致癌基因同源物(禽类)),EGF(表皮生长因子(β-尿抑胃素),PIK3CG(磷酸肌醇-3-激酶,催化,γ多肽),HLA-A(主要组织相容性复合物,I类,A),KCNQ1(钾电压门控通道,KQT样亚家族,成员1),CNR1(大麻素受体1(脑)),FBN1(原纤维蛋白1),CHKA(胆碱激酶α),BEST1(斑萎蛋白1),APP(淀粉样β(A4)前体蛋白),CTNNB1(连环蛋白(钙粘蛋白相关蛋白),β1、88kDa),IL2(白介素2),CD36(CD36分子(血小板反应蛋白受体)),PRKAB1(蛋白激酶,AMP激活,β1非催化亚基),TPO(甲状腺过氧化物酶),ALDH7A1(醛脱氢酶7家族,成员A1),CX3CR1(趋化因子(C-X3-C基序)受体1),TH(酪氨酸羟化酶),F9(凝血因子IX),GH1(生长激素1),TF(转铁蛋白),HFE(血色素沉着病),IL17A(白介素17A),PTEN(磷酸酶和张力蛋白同源物),GSTM1(谷胱甘肽S-转移酶μ1),DMD(肌营养不良蛋白),GATA4(GATA结合蛋白4),F13A1(凝血因子XIII,A1多肽),TTR(转甲状腺素蛋白),FABP4(脂肪酸结合蛋白4,脂肪细胞),PON3(对氧磷酶3),APOC1(载脂蛋白C-I),INSR(胰岛素受体),TNFRSF1B(肿瘤坏死因子受体超家族,成员1B),HTR2A(5-羟色胺(血清素)受体2A),CSF3(集落刺激因子3(粒细胞)),CYP2C9(细胞色素P450,家族2,亚家族C,多肽9),TXN(硫氧还蛋白),CYP11B2(细胞色素P450,家族11,亚家族B,多肽2),PTH(甲状旁腺激素),CSF2(集落刺激因子2(粒细胞-巨噬细胞)),KDR(激酶插入物结构域受体(III型受体酪氨酸激酶)),PLA2G2A(磷脂酶A2,IIA组(血小板,滑液)),B2M(β-2-微球蛋白),THBS1(血小板反应蛋白1),GCG(胰高血糖素),RHOA(ras同源基因家族,成员A),ALDH2(醛脱氢酶2家族(线粒体)),TCF7L2(转录因子7样2(T细胞特异性,HMG-盒)),BDKRB2(缓激肽受体B2),NFE2L2(核因子(红系衍生的2)样2),NOTCH1(Notch同源物1,易位相关(果蝇)),UGT1A1(UDP葡萄糖醛酸转移酶1家族,多肽A1),IFNA1(干扰素,α1),PPARD(过氧化物酶体增殖物激活的受体δ),SIRT1(沉默调节蛋白(沉默的交配类型信息调节2同源物)1(酿酒酵母),GNRH1(促性腺激素释放激素1(促黄体生成素释放激素)),PAPPA(妊娠相关血浆蛋白A,pappalysin 1),ARR3(arrestin 3,视网膜(X-arrestin)),NPPC(利钠肽前体C),AHSP(α血红蛋白稳定蛋白),PTK2(PTK2蛋白酪氨酸激酶2),IL13(白介素13),MTOR(雷帕霉素的机械靶标(丝氨酸/苏氨酸激酶)),ITGB2(整合素,β2(补体成分3受体3和4亚基),GSTT1(谷胱甘肽S-转移酶θ1),IL6ST(白介素6信号转导子(gp130,抑瘤素M受体)),CPB2(羧肽酶B2(血浆)),CYP1A2(细胞色素P450,家族1,亚家族A,多肽2),HNF4A(肝细胞核因子4,α),SLC6A4(溶质载体家族6(神经递质转运蛋白,血清素),成员4),PLA2G6(磷脂酶A2,VI组(胞质,不依赖钙)),TNFSF11(肿瘤坏死因子(配体)超家族,成员11),SLC8A1(溶质载体家族8(钠/钙交换剂),成员1),F2RL1(凝血因子II(凝血酶)受体样1),AKR1A1(醛基酮还原酶家族1,成员A1(醛还原酶)),ALDH9A1(醛脱氢酶9家族,成员A1),BGLAP(骨γ-羧基谷氨酸(gla)蛋白),MTTP(微粒体甘油三酸酯转移蛋白),MTRR(5-甲基四氢叶酸-高半胱氨酸甲基转移酶还原酶),SULT1A3(磺基转移酶家族,胞质,1A,酚优选,成员3),RAGE(肾肿瘤抗原),C4B(补体成分4B(Chido血型),P2RY12(嘌呤能受体P2Y,G蛋白偶联,12),RNLS(肾酶,FAD依赖性胺氧化酶),CREB1(cAMP反应元件结合蛋白1),POMC(阿黑皮素原),RAC1(ras相关的C3肉毒杆菌毒素底物1(rho家族,小GTP结合蛋白Rac1)),LMNA(lamin NC),CD59(CD59分子,补体调控蛋白),SCN5A(钠通道,电压门控,V型,α亚基),CYP1B1(细胞色素P450,家族1,亚家族B,多肽1),MIF(巨噬细胞迁移抑制因子(糖基化抑制因子)),MMP13(基质金属肽酶13(胶原酶3)),TIMP2(TIMP金属肽酶抑制剂2),CYP19A1(细胞色素P450,家族19,亚家族A,多肽1),CYP21A2(细胞色素P450,家族21,亚家族A,多肽2),PTPN22(蛋白酪氨酸磷酸酶,22型非受体(淋巴样)),MYH14(肌球蛋白,重链14,非肌肉),MBL2(甘露糖结合凝集素(蛋白C)2,可溶性(调理素缺陷)),SELPLG(选择素P配体),AOC3(胺氧化酶,含铜3(血管粘附蛋白1)),CTSL1(组织蛋白酶L1),PCNA(增殖细胞核抗原),IGF2(胰岛素样生长因子2(生长调节素A)),ITGB1(整联蛋白,β1(纤连蛋白受体,β多肽,抗原CD29包括MDF2、MSK12)),CAST(钙抑素),CXCL12(趋化因子(C-X-C基序)配体12(基质细胞衍生因子1)),IGHE(免疫球蛋白)重常数ε),KCNE1(钾电压门控通道,Isk相关家族,成员1),TFRC(转铁蛋白受体(p90,CD71)),COL1A1(胶原蛋白,I型,α1),COL1A2(胶原蛋白,I型,α2),IL2RB(白介素2受体,β),PLA2G10(磷脂酶A2,X组),ANGPT2(血管生成素2),PROCR(蛋白C受体,内皮(EPCR)),NOX4(NADPH氧化酶4),HAMP(铁调素抗菌肽),PTPN11(蛋白酪氨酸磷酸酶,11型非受体),SLC2A1(溶质载体家族2(促进葡萄糖转运蛋白),成员1),IL2RA(白介素2受体,α),CCL5(趋化因子(C-C基序)配体5),IRF1(干扰素调节因子1),CFLAR(CASP8和FADD样凋亡调控剂),CALCA(降钙素相关多肽α),EIF4E(真核翻译起始因子4E),GSTP1(谷胱甘肽S-转移酶π1),JAK2(Janus激酶2),CYP3A5(细胞色素P450,家族3,亚家族A,多肽5),HSPG2(硫酸乙酰肝素蛋白聚糖2),CCL3(趋化因子(C-C基序)配体3),MYD88(髓样分化初级应答基因(88)),VIP(血管活性肠肽),SOAT1(甾醇O-酰基转移酶1),ADRBK1(肾上腺素,β,受体激酶1),NR4A2(核受体亚家族4,A组,成员2),MMP8(基质金属肽酶8(中性粒细胞胶原酶)),NPR2(利钠肽受体B/鸟苷酸环化酶B(利钠肽受体B)),GCH1(GTP环水解酶1),EPRS(谷氨酰-脯氨酰-tRNA合酶),PPARGC1A(过氧化物酶体增殖物激活的受体γ,共激活子1α),F12(凝血因子XII(Hageman因子)),PECAM1(血小板/内皮细胞粘附分子),CCL4(趋化因子(C-C基序)配体4),SERPINA3(serpin蛋白酶抑制剂,进化枝A(α-1抗蛋白酶,抗胰蛋白酶),成员3),CASR(钙敏感受体),GJA5(间隙连接蛋白,α5,40kDa),FABP2(脂肪酸结合蛋白2,肠),TTF2(转录终止因子,RNA聚合酶II),PROS1(蛋白质S(α)),CTF1(心肌营养蛋白1),SGCB(肌聚糖,β(与43kDa肌营养不良蛋白相关的糖蛋白)),YME1L1(YME1样1(酿酒酵母)),CAMP(组织蛋白酶抑制素抗菌肽),ZC3H12A(含锌指CCCH型的12A),AKR1B1(醛酮还原酶家族1,成员B1(醛糖还原酶)),DES(结蛋白),MMP7(基质金属肽酶7(基质溶素,子宫),AHR(芳基烃受体),CSF1(集落刺激因子1(巨噬细胞)),HDAC9(组蛋白脱乙酰基酶9),CTGF(结缔组织生长因子),KCNMA1(钾大电导钙激活通道,亚家族M,α成员1),UGT1A(UDP葡萄糖醛酸转移酶1家族,多肽A复合基因座),PRKCA(蛋白激酶C,α),COMT(儿茶酚-β-甲基转移酶),S100B(S100钙结合蛋白B),EGR1(早期生长反应1),PRL(促乳素),IL15(白介素15),DRD4(多巴胺受体D4),CAMK2G(钙/钙调蛋白依赖性蛋白激酶IIγ),SLC22A2(溶质载体家族22(有机阳离子转运蛋白),成员2),CCL11(趋化因子(C-C基序)配体11),PGF(B321胎盘生长因子),THPO(血小板生成素),GP6(糖蛋白VI(血小板)),TACR1(速激肽受体1),NTS(神经降压素),HNF1A(HNF1同源盒A),SST(生长抑素),KCND1(钾电压门控通道,Shal相关亚家族,成员1),LOC646627(磷脂酶抑制剂),TBXAS1(血栓烷A合酶1(血小板)),CYP2J2(细胞色素P450,家族2,亚家族J,多肽2),TBXA2R(血栓烷A2受体),ADH1C(醇脱氢酶1C(I类),γ多肽),ALOX12(花生四烯酸12-脂加氧酶),AHSG(α-2-HS-糖蛋白),BHMT(甜菜碱-高半胱氨酸甲基转移酶),GJA4(间隙连接蛋白,α4,37kDa),SLC25A4(溶质载体家族25(线粒体载体;腺嘌呤核苷酸易位子),成员4),ACLY(ATP柠檬酸裂解酶),ALOX5AP(花生四烯酸5-脂氧合酶激活蛋白),NUMA1(核有丝分裂器蛋白1),CYP27B1(细胞色素P450,家族27,家族B,多肽1),CYSLTR2(半胱氨酰白三烯受体2),SOD3(超氧化物歧化酶3,细胞外),LTC4S(白三烯C4合酶),UCN(尿皮质素),GHRL(胃饥饿素/肥胖抑制素前原肽),APOC2(载脂蛋白C-II),CLEC4A(C型凝集素结构域家族4,成员A),KBTBD10(含kelch重复序列和BTB(POZ)结构域的10),TNC(肌腱蛋白C),TYMS(胸苷酸合酶),SHC1(SHC(含Src同源性2结构域)转化蛋白1),LRP1(低密度脂蛋白受体相关蛋白1),SOCS3(细胞因子信号传导抑制剂3),ADH1B(醇脱氢酶1B(I类),β多肽),KLK3(激肽释放酶相关肽酶3),HSD11B1(羟类固醇(11-β)脱氢酶1),VKORC1(维生素K环氧化物还原酶复合物,亚基1),SERPINB2(serpin肽酶抑制剂,进化枝B(卵清蛋白),成员2),TNS1(张力蛋白1),RNF19A(无名指蛋白19A),EPOR(促红细胞生成素受体),ITGAM(整合素,αM(补体成分3受体3亚基)),PITX2(成对样同源结构域2),MAPK7(有丝分裂原激活的蛋白激酶7),FCGR3A(IgG的Fc片段,低亲和力111a,受体(CD16a)),LEPR(瘦素受体),ENG(内皮糖蛋白),GPX1(谷胱甘肽过氧化物酶1),GOT2(谷氨酸-草酰乙酸-转氨酶2,线粒体(天冬氨酸氨基转移酶2)),HRH1(组胺受体H1),NR112(核受体亚家族1,I组,成员2),CRH(促肾上腺皮质激素释放激素),HTR1A(5-羟色胺(血清素)受体1A),VDAC1(电压依赖性阴离子通道1),HPSE(乙酰肝素酶),SFTPD(表面活性蛋白D),TAP2(转运蛋白2,ATP结合盒,亚家族B(MDR/TAP)),RNF123(无名指蛋白123),PTK2B(PTK2B蛋白酪氨酸激酶2β),NTRK2(神经营养性酪氨酸激酶,受体,2型),IL6R(白介素6受体),ACHE(乙酰胆碱酯酶(Yt血型)),GLP1R(胰高血糖素样肽1受体),GHR(生长激素受体),GSR(谷胱甘肽还原酶),NQO1(NAD(P)H脱氢酶,醌1),NR5A1(核受体亚家族5,A组,成员1),GJB2(间隙连接蛋白,β2,26kDa),SLC9A1(溶质载体家族9(钠/氢交换剂),成员1),MAOA(单胺氧化酶A),PCSK9(前蛋白转化酶枯草杆菌蛋白酶/kexin型9),FCGR2A(IgG的Fc片段,低亲和力IIa,受体(CD32)),SERPINF1(serpin肽酶抑制剂,进化枝F(α-2抗纤溶酶,色素上皮衍生因子),成员1),EDN3(内皮素3),DHFR(二氢叶酸还原酶),GAS6(生长停滞特异性6),SMPD1(鞘磷脂磷酸二酯酶1,酸性溶酶体),UCP2(解偶联蛋白2(线粒体,质子载体)),TFAP2A(转录因子AP-2α(激活增强子结合蛋白2α)),C4BPA(补体成分4结合蛋白,α),SERPINF2(serpin肽酶抑制剂,进化枝F(α-2抗纤溶酶,色素上皮衍生因子),成员2),TYMP(胸苷磷酸化酶),ALPP(碱性磷酸酶,胎盘(Regan同功酶)),CXCR2(趋化因子(C-X-C基序)受体2),SLC39A3(溶质载体家族39(锌转运蛋白),成员3),ABCG2(ATP结合盒,亚家族G(WHITE),成员2),ADA(腺苷脱氨酶),JAK3(Janus激酶3),HSPA1A(热休克70kDa蛋白1A),FASN(脂肪酸合酶),FGF1(成纤维细胞生长因子1(酸性)),F11(凝血因子XI),ATP7A(ATP酶,Cu++转运,α多肽),CR1(补体成分(3b/4b)受体1(Knops血型),GFAP(神经胶质纤维酸性蛋白),ROCK1(与Rho相关的卷曲螺旋蛋白激酶1),MECP2(甲基CpG结合蛋白2(Rett综合征)),MYLK(肌球蛋白轻链激酶),BCHE(丁酰胆碱酯酶),LIPE(脂肪酶,对激素敏感),PRDX5(过氧化物酶5),ADORA1(腺苷A1受体),WRN(Werner综合征,RecQ解旋酶样),CXCR3(趋化因子(C-X-C基序)受体3),CD81(CD81分子),SMAD7(SMAD家族成员7),LAMC2(层粘连蛋白,γ2),MAP3K5(有丝分裂原激活的蛋白激酶激酶激酶5),CHGA(嗜铬粒蛋白A(甲状旁腺分泌蛋白1)),IAPP(胰岛淀粉样多肽),RHO(视紫红质),ENPP1(外核苷酸焦磷酸酶/磷酸二酯酶1),PTHLH(甲状旁腺激素样激素),NRG1(神经调节蛋白1),VEGFC(血管内皮生长因子C),ENPEP(谷氨酰胺基肽酶(氨基肽酶A)),CEBPB(CCAAT/增强子结合蛋白(C/EBP),β),NAGLU(N-乙酰氨基葡萄糖苷酶,α-),F2RL3(凝血因子II(凝血酶)受体样3),CX3CL1(趋化因子(C-X3-C基序)配体1),BDKRB1(缓激肽受体B1),ADAMTS13(具有血小板反应蛋白1型基序的ADAM金属肽酶,13),ELANE(弹性蛋白酶,嗜中性粒细胞表达),ENPP2(外核苷酸焦磷酸酶/磷酸二酯酶2),CISH(含细胞因子诱导的SH2的蛋白质),GAST(胃泌素),MYOC(肌球蛋白,小梁网诱导的糖皮质激素反应),ATP1A2(ATP酶,Na+/K+转运,α2多肽),NF1(神经纤维蛋白1),GJB1(间隙连接蛋白,β1,32kDa),MEF2A(肌细胞增强因子2A),VCL(粘着斑蛋白),BMPR2(骨形态发生蛋白受体,II型(丝氨酸/苏氨酸激酶)),TUBB(微管蛋白,β),CDC42(细胞分裂周期42(GTP结合蛋白,25kDa)),KRT18(角蛋白18),HSF1(热休克转录因子1),MYB(v-myb成纤维细胞病病毒致癌基因同源物(禽类)),PRKAA2(蛋白激酶,AMP激活,α2催化亚基),ROCK2(Rho相关,含卷曲螺旋的蛋白激酶2),TFPI(组织因子途径抑制剂(脂蛋白相关凝结抑制剂)),PRKG1(蛋白激酶,cGMP依赖性,I型),BMP2(骨形态发生蛋白2),CTNND1(连环蛋白(钙粘蛋白相关蛋白),δ1),CTH(胱硫醚酶(胱硫醚γ-裂解酶)),CTSS(组织蛋白酶S),VAV2(vav2鸟嘌呤核苷酸交换因子),NPY2R(神经肽Y受体Y2),IGFBP2(胰岛素样生长因子结合蛋白2,36kDa),CD28(CD28分子),GSTA1(谷胱甘肽S-转移酶α1),PPIA(肽基脯氨酰异构酶A(亲环蛋白A)),APOH(载脂蛋白H(β-2-糖蛋白I)),S100A8(S100钙结合蛋白A8),IL11(白介素11),ALOX15(花生四烯酸15-脂加氧酶),FBLN1(腓骨蛋白1),NR1H3(核受体亚家族1,H组,成员3),SCD(硬脂酰-CoA去饱和酶(δ-9-去饱和酶)),GIP(胃抑制多肽),CHGB(嗜铬粒蛋白B(分泌粒蛋白1)),PRKCB(蛋白激酶C,β),SRD5A1(类固醇-5-α-还原酶,α多肽1(3-氧代-5α-类固醇δ4-脱氢酶α1)),HSD11B2(羟基类固醇(11-β)脱氢酶2),CALCRL(降钙素受体样),GALNT2(UDP-N-乙酰-α-D-半乳糖胺:多肽N-乙酰半乳糖胺基转移酶2(GalNAc-T2)),ANGPTL4(血管生成素样4),KCNN4(钾中等/小电导钙激活通道,亚家族N,成员4),PIK3C2A(磷酸肌醇-3-激酶,2类,α多肽),HBEGF(肝素结合EGF样生长因子),CYP7A1(细胞色素P450,家族7,亚家族A,多肽1),HLA-DRB5(主要组织相容性复合物,II类,DRβ5),BNIP3(BCL2/腺病毒E1B 19kDa相互作用蛋白3),GCKR(葡萄糖激酶(己糖激酶4)调控剂),S100A12(S100钙结合蛋白A12),PADI4(肽基精氨酸脱亚氨酶,IV型),HSPA14(热休克70kDa蛋白14),CXCR1(趋化因子(C-X-C基序)受体1),H19(H19,压印母体表达的转录物(非蛋白质编码)),KRTAP19-3(角蛋白相关蛋白19-3),IDDM2(胰岛素依赖型糖尿病2),RAC2(ras相关的C3肉毒杆菌毒素底物2(rho家族,小GTP结合蛋白Rac2)),RYR1(兰尼碱受体1(骨骼)),CLOCK(clock同源物(小鼠)),NGFR(神经生长因子受体(TNFR超家族,成员16)),DBH(多巴胺β-羟化酶(多巴胺β-单加氧酶)),CHRNA4(胆碱能受体,烟碱,α4),CACNA1C(钙通道,电压依赖性,L型,α1C亚基),PRKAG2(蛋白激酶,AMP激活,γ2非催化亚基),CHAT(胆碱乙酰基转移酶),PTGDS(前列腺素D2合酶21kDa(脑)),NR1H2(核受体亚家族1,H组,成员2),TEK(TEK酪氨酸激酶,内皮),VEGFB(血管内皮生长因子B),MEF2C(肌细胞增强因子2C),MAPKAPK2(有丝分裂原激活的蛋白激酶激活的蛋白激酶2),TNFRSF11A(肿瘤坏死因子受体超家族,成员11a,NFKB激活剂),HSPA9(热休克70kDa蛋白9(寿命蛋白)),CYSLTR1(半胱氨酰白三烯受体1),MAT1A(甲硫氨酸腺苷转移酶I,α),OPRL1(鸦片受体样1),IMPA1(肌醇(肌)-1(或4)-单磷酸酶1),CLCN2(氯化物通道2),DLD(二氢脂酰胺脱氢酶),PSMA6(蛋白酶体(蛋白酶体,macropain)亚基,α型,6),PSMB8(蛋白酶体(蛋白酶体,macropain)亚基,β型,8(大型多功能肽酶7)),CHI3L1(几丁质酶3-样1(软骨糖蛋白-39)),ALDH1B1(醛脱氢酶1家族,成员B1),PARP2(聚(ADP-核糖)聚合酶2),STAR(类固醇生成急性调节蛋白),LBP(脂多糖结合蛋白),ABCC6(ATP结合盒,亚家族C(CFTR/MRP),成员6),RGS2(G蛋白信号传导调控剂2,24kDa),EFNB2(肝配蛋白-B2),GJB6(间隙连接蛋白,β6,30kDa),APOA2(载脂蛋白A-II),AMPD1(单磷酸腺苷脱氨酶1),DYSF(dysferlin,肢带肌肉萎缩症2B(常染色体隐性)),FDFT1(法呢基-二磷酸法呢基转移酶1),EDN2(内皮素2),CCR6(趋化因子(C-C基序)受体6),GJB3(间隙连接蛋白,β3,31kDa),IL1RL1(白介素1受体样1),ENTPD1(外核苷三磷酸二磷酸水解酶1),BBS4(Bardet-Biedl综合征4),CELSR2(钙粘蛋白,EGF LAG七次G型受体2(火烈鸟同源物,果蝇)),F11R(F11受体),RAPGEF3(Rap鸟嘌呤核苷酸交换因子(GEF)3),HYAL1(透明质酸氨基葡糖苷酶1),ZNF259(锌指蛋白259),ATOX1(ATX1抗氧化剂蛋白1同源物(酵母)),ATF6(激活转录因子6),KHK(酮己糖激酶(果糖激酶)),SAT1(亚精胺/精胺N1-乙酰基转移酶1),GGH(γ-谷氨酰水解酶(结合酶,叶酰多γ谷氨酰水解酶)),TIMP4(TIMP金属肽酶抑制剂4),SLC4A4(溶质载体家族4,碳酸氢钠共转运蛋白,成员4),PDE2A(磷酸二酯酶2A,cGMP刺激),PDE3B(磷酸二酯酶3B,cGMP抑制),FADS1(脂肪酸去饱和酶1),FADS2(脂肪酸去饱和酶2),TMSB4X(胸腺素β4,X连锁),TXNIP(硫氧还蛋白相互作用蛋白),LIMS1(LIM和衰老细胞抗原样结构域1),RHOB(ras同源基因家族,成员B),LY96(淋巴细胞抗原96),FOXO1(叉头盒O1),PNPLA2(包patatin样磷脂酶结构域的2),TRH(促甲状腺激素释放激素),GJC1(间隙连接蛋白,γ1,45kDa),SLC17A5(溶质载体家族17(阴离子/糖转运蛋白),成员5),FTO(脂肪物质和肥胖相关),GJD2(间隙连接蛋白,δ2,36kDa),PSRC1(富含脯氨酸/丝氨酸的卷曲螺旋1),CASP12(胱天蛋白酶12(基因/假基因)),GPBAR1(G蛋白偶联胆汁酸受体1),PXK(含PX结构域的丝氨酸/苏氨酸激酶),IL33(白介素33),TRIB1(tribbles同源物1(果蝇)),PBX4(前B细胞白血病同源盒4),NUPR1(核蛋白,转录调控子,1),15-Sep(15kDa硒蛋白),CILP2(软骨中间层蛋白2),TERC(端粒酶RNA组分),GGT2(γ-谷氨酰转移酶2),MT-CO1(线粒体编码的细胞色素c氧化酶I)和UOX(尿酸氧化酶,假基因)。在另一个实施方案中,染色体序列还可选自Pon1(对氧磷酶1),LDLR(LDL受体),ApoE(载脂蛋白E),Apo B-100(载脂蛋白B-100),ApoA(载脂蛋白(a)),ApoA1(载脂蛋白A1),CBS(胱硫醚B-合酶),糖蛋白IIb/IIb,MTHRF(5,10-亚甲基四氢叶酸还原酶(NADPH)及其组合。在一次反复操作中,与心血管疾病有关的染色体序列和由染色体序列编码的蛋白质可选自Cacna1C、Sod1、Pten、Ppar(α)、Apo E、瘦素及其组合。因此本文正文提供了关于CRISPR或CRISPR-Cas系统或复合物的示例性靶标。
免疫正交直系同源物
在一些实施方案中,当需要在受试者中表达或施用CRISPR酶时,可通过向受试者顺序表达或施用CRISPR酶的免疫正交直系同源物来降低CRISPR酶的免疫原性。如本文所用,术语“免疫正交直系同源物”是指具有相似或基本相同的功能或活性,但是与彼此生成的免疫应答没有或具有低交叉反应性的直系同源蛋白。此类直系同源物的顺序表达或施用可能不会引起稳健或任何继发性免疫应答。免疫正交直系同源物可避免被现有抗体中和。表达直系同源物的细胞可避免被宿主的免疫系统清除(例如,被激活的CTL清除)。在一些实例中,来自不同物种的CRISPR酶直系同源物可以是免疫正交直系同源物。
免疫正交直系同源物可通过分析一组候选直系同源物的序列、结构和免疫原性来鉴定。在一种示例方法中,可通过以下方法来鉴定一组免疫正交直系同源物:a)比较一组候选直系同源物(例如,来自不同物种的直系同源物)的序列以鉴定具有低序列相似性或没有序列相似性的候选物子集;b)评估候选物子集成员之间的免疫重叠,以鉴定没有免疫重叠或具有低免疫重叠的候选物。在某些情况下,可通过确定候选直系同源物与MHC(例如I型MHC和/或II型MHC)之间的结合(例如亲和力)来评估候选物之间的免疫重叠。可替代地或另外地,可通过确定候选直系同源物的B细胞表位来评估候选物之间的免疫重叠。在一个实例中,可使用Moreno AM等人,BioRxiv,在线出版于2018年1月10日,doi:doi.org/10.1101/245985中所述的方法来鉴定免疫正交直系同源物。
本申请还提供了以下编号的声明中阐述的方面和实施方案:
1.一种非天然存在的或工程化的系统,所述系统包含:i)来自表1或表2的Cas12b效应蛋白,ii)包含能够与靶序列杂交的指导序列的指导物。
2.如声明1所述的系统,其中所述Cas12b效应蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
3.如声明1或2所述的系统,其中tracr RNA在正向重复序列的5'端与crRNA融合。
4.如前述声明中任一项所述的系统,所述系统包含两个或更多个能够使两个不同靶序列或同一靶序列的不同区域杂交的指导序列。
5.如前述声明中任一项所述的系统,其中所述指导序列与原核细胞中的一个或多个靶序列杂交。
6.如前述声明中任一项所述的系统,其中所述指导序列与真核细胞中的一个或多个靶序列杂交。
7.如前述声明中任一项所述的系统,其中所述Cas12b效应蛋白包含一个或多个核定位信号(NLS)。
8.如前述声明中任一项所述的系统,其中所述Cas12b效应蛋白是无催化活性的。
9.如前述声明中任一项所述的系统,其中所述Cas12b效应蛋白与一个或多个功能结构域相缔合。
10.如声明9所述的系统,其中所述一个或多个功能结构域切割所述一个或多个靶序列。
11.如声明10所述的系统,其中所述功能结构域修饰所述一个或多个靶序列的转录或翻译。
12.如前述声明中任一项所述的系统,其中所述Cas12b效应蛋白与一个或多个功能结构域相缔合;并且所述Cas12b效应蛋白在RuvC和/或Nuc结构域内含有一个或多个突变,由此所形成的CRISPR复合物能够在靶序列处或其附近递送表观遗传修饰子或者转录或翻译激活或阻遏信号。
13.如前述声明中任一项所述的系统,其中所述Cas12b效应蛋白与腺苷脱氨酶或胞苷脱氨酶相缔合。
14.如前述声明中任一项所述的系统,所述系统还包含重组模板。
15.如权利要求14所述的系统,其中所述重组模板通过同源性定向修复(HDR)而被插入。
16.一种Cas12b载体系统,所述Cas12b载体系统包含一个或多个载体,所述载体包含:第一调控元件,所述第一调控元件可操作地连接至编码来自表1或表2的Cas12b效应蛋白的核苷酸序列,以及i)a)第二调控元件,所述第二调控元件可操作地连接至编码指导序列的核苷酸序列,和b)第三调控元件,所述第三调控元件可操作地连接至编码tracr RNA的核苷酸序列,或者ii)第二调控元件,所述第二调控元件可操作地连接至编码所述指导序列和所述tracr RNA的核苷酸序列。
17.如声明16所述的载体系统,其中编码所述Cas12b效应蛋白的所述核苷酸序列被密码子优化以在真核细胞中表达。
18.如声明16或17所述的载体系统,所述载体系统包含在单个载体中。
19.如声明17至18中任一项所述的载体系统,其中所述一个或多个载体包括病毒载体。
20.如声明17至19中任一项所述的载体系统,其中所述一个或多个载体包括一个或多个逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体或单纯疱疹病毒载体。
21.一种递送系统,所述递送系统被配置为递送非天然存在的或工程化的组合物的Cas12b效应蛋白和一个或多个核酸组分,所述非天然存在的或工程化的组合物包含:i)选自表1或表2的Cas12b效应蛋白,ii)能够与一个或多个靶序列杂交的指导序列,和iii)tracr RNA。
22.如声明21所述的递送系统,所述递送系统包含一个或多个载体,或一个或多个多核苷酸分子,所述一个或多个载体或多核苷酸分子包含编码所述非天然存在的或工程化的组合物的所述Cas12b效应蛋白和一个或多个核酸组分的一个或多个多核苷酸分子。
23.如声明21或22所述的递送系统,所述递送系统包含递送媒介物,所述递送媒介物包括脂质体、粒子、外泌体、微囊泡、基因枪或病毒载体。
24.如声明1至15中任一项所述的非天然存在的或工程化的系统,如声明16至20中任一项所述的载体系统,或如声明21至23中任一项所述的递送系统,所述系统用于治疗性治疗方法中。
25.一种对一个或多个目标靶序列进行修饰的方法,所述方法包括使所述一个或多个靶序列与一种或多种非天然存在的或工程化的组合物接触,所述组合物包含:i)来自表1或表2的Cas12b效应蛋白,ii)能够与所述一个或多个靶序列杂交的指导序列,和iii)tracr RNA,由此形成CRISPR复合物,所述CRISPR复合物包含与crRNA和所述tracr RNA复合的所述Cas12b效应蛋白,其中所述指导序列引导与细胞中的所述一个或多个靶序列的序列特异性结合,由此修饰所述一个或多个靶序列的表达。
26.如声明25所述的方法,其中对所述一个或多个靶序列进行修饰包括切割所述靶DNA。
27.如声明25或26所述的方法,其中对所述一个或多个靶序列进行修饰包括增加或减少所述一个或多个靶序列的表达。
28.如声明25至27中任一项所述的方法,其中所述组合物还包含重组模板,并且其中对所述一个或多个靶序列进行修饰包括插入所述重组模板或其一部分。
29.如声明25至28中任一项所述的方法,其中所述靶序列在原核细胞中。
30.如声明25至29中任一项所述的方法,其中所述一个或多个靶序列在真核细胞中。
31.一种包含目标修饰靶标的细胞或其后代,其中所述一个或多个靶序列已经根据声明25至30中任一项所述的方法进行修饰,任选地治疗性T细胞或产生抗体的B细胞或者其中所述细胞是植物细胞。
32.如声明31所述的细胞,其中所述细胞是原核细胞。
33.如声明31所述的细胞,其中所述细胞是真核细胞。
34.根据声明31至33中任一项所述的细胞,其中所述一个或多个靶序列的修饰导致:所述细胞包含至少一种基因产物的表达改变;所述细胞包含至少一种基因产物的表达改变,其中所述至少一种基因产物的表达增加;或者所述细胞包含至少一种基因产物的表达改变,其中所述至少一种基因产物的表达减少;或者产生和/或分泌内源性或非内源性生物产物或化学化合物的细胞或群体。
35.根据声明31或34所述的真核细胞,其中所述细胞是哺乳动物细胞或人类细胞。
36.一种根据声明31至35中任一项所述的细胞或其后代的细胞系,或包含根据声明31至35中任一项所述的细胞或其后代的细胞系。
37.一种多细胞生物体,所述多细胞生物体包含一个或多个根据声明31至35中任一项所述的细胞。
38.一种植物或动物模型,所述植物或动物模型包含一个或多个根据声明31至35中任一项所述的细胞。
39.一种基因产物,所述基因产物来自声明31至35中任一项所述的细胞或声明36所述的细胞系或声明37所述的生物体或声明38所述的植物或动物模型。
40.如声明39所述的基因产物,其中所表达的基因产物量大于或小于来自不具有改变的表达的细胞的基因产物量。
41.一种分离的Cas12b效应蛋白,所述分离的Cas12b效应蛋白来自表1或表2。
42.一种分离的核酸,所述分离的核酸编码声明41所述的Cas12b效应蛋白。
43.根据声明42所述的分离的核酸,所述分离的核酸是DNA并且还包含编码crRNA和tracr RNA的序列。
44.一种分离的真核细胞,所述分离的真核细胞包含根据声明42或43所述的核酸或声明41所述的Cas12b。
45.一种非天然存在的或工程化的系统,所述系统包含:i)编码来自表1或表2的Cas12b效应蛋白的mRNA,ii)指导序列,和iii)tracr RNA。
46.根据声明45所述的非天然存在的或工程化的系统,其中所述tracr RNA在正向重复序列的5'端与crRNA融合。
47.一种用于定点碱基编辑的工程化组合物,所述工程化组合物包含靶向结构域和腺苷脱氨酶、胞苷脱氨酶或其催化结构域,其中所述靶向结构域包含Cas12b效应蛋白或其保留寡核苷酸结合活性的片段和指导分子。
48.如声明47所述的组合物,其中所述Cas12b效应蛋白是无催化活性的。
49.如声明47或48所述的组合物,其中所述Cas12b效应蛋白选自表1或表2。
50.如声明47-49中任一项所述的组合物,蛋白质其中所述Cas12b效应蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
51.一种对一个或多个目标靶寡核苷酸中的腺苷或胞苷进行修饰的方法,所述方法包括将根据声明47至50中任一项所述的组合物递送至所述一个或多个靶寡核苷酸。
52.如声明51所述的方法,其中所述用于治疗或预防由含有致病性T→C或A→G点突变的转录物引起的疾病。
53.一种分离的细胞,所述分离的细胞获自声明51或52中任一项所述的方法和/或包含声明47-50中任一项所述的组合物。
54.如声明53所述的细胞或其后代,其中所述真核细胞,优选地人类或非人类动物细胞,任选地治疗性T细胞或产生抗体的B细胞,或者其中所述细胞是植物细胞。
55.一种非人类动物,所述非人类动物包含声明53或54的所述修饰的细胞或其后代。
56.一种植物,所述植物包含声明54的所述修饰的细胞。
57.根据声明53或54所述的修饰的细胞,所述修饰的细胞用于疗法,优选细胞疗法中。
58.一种对靶寡核苷酸中的腺嘌呤或胞嘧啶进行修饰的方法,所述方法包括将以下各物递送至所述靶寡核苷酸:无催化活性的Cas12b蛋白;指导分子,所述指导分子包含与正向重复序列连接的指导序列;和腺苷或胞苷脱氨酶蛋白或其催化结构域;其中所述腺苷或胞苷脱氨酶蛋白或其催化结构域与所述无催化活性的Cas12b蛋白或所述指导分子共价或非共价连接,或者所述腺苷或胞苷脱氨酶蛋白或其催化结构域适于在递送后与所述无催化活性的Cas12b蛋白或所述指导分子连接;其中所述指导分子与所述无催化活性的Cas12b形成复合物并引导所述复合物结合所述靶寡核苷酸,其中所述指导序列能够与所述靶寡核苷酸内的靶序列杂交以形成寡核苷酸双链体。
59.如声明58所述的方法,其中:(A)所述胞嘧啶在形成所述寡核苷酸双链体的所述靶序列外部,其中所述胞苷脱氨酶蛋白或其催化结构域使所述寡核苷酸双链体外部的所述胞嘧啶脱氨基,或者(B)所述胞嘧啶在形成所述寡核苷酸双链体的所述靶序列内部,其中所述指导序列在对应于所述胞嘧啶的位置处包含非配对的腺嘌呤或尿嘧啶,导致所述寡核苷酸双链体中的C-A或C-U错配,并且其中所述胞苷脱氨酶蛋白或其催化结构域使所述寡核苷酸双链体中与所述非配对的腺嘌呤或尿嘧啶相对的所述胞嘧啶脱氨基。
60.如声明58或59所述的方法,所述腺苷脱氨酶蛋白或其催化结构域使所述寡核苷酸双链体中的所述腺嘌呤或胞嘧啶脱氨基。
61.如声明58-60中任一项所述的方法,其中所述Cas12b蛋白选自表1或表2。
62.如声明61所述的方法,其中所述Cas12b蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
63.一种用于检测一个或多个体外样品中核酸寡核苷酸靶序列的存在的系统,所述系统包含:Cas12b蛋白;至少一个包含指导序列的指导多核苷酸,所述指导序列设计成与所述一个或多个靶序列具有一定程度的互补性,并设计成与所述Cas12b蛋白形成复合物;以及基于寡核苷酸的掩蔽构建体,所述掩蔽构建体包含非靶序列;其中所述Cas12b蛋白一旦被所述一个或多个靶序列激活,就表现出附带核酸酶活性并切割所述基于寡核苷酸的掩蔽构建体的所述非靶序列。
64.一种用于检测一个或多个体外样品中靶多肽的存在的系统,所述系统包含:Cas12b蛋白;一个或多个检测适体,每个检测适体被设计成与所述一个或多个靶多肽中的一者结合,每个检测适体包含掩蔽的启动子结合位点或掩蔽的引物结合位点和触发序列模板;以及包含非靶序列的基于寡核苷酸的掩蔽构建体。
65.如声明64或65所述的系统,所述系统还包含核酸扩增试剂以扩增所述靶序列或所述触发序列。
66.如声明652所述的系统,其中所述核酸扩增试剂是等温扩增试剂。
67.如声明63至66中任一项所述的系统,其中所述Cas12b蛋白选自表1或表2。
68.如声明67所述的系统,其中所述Cas12b蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
69.一种用于检测一个或多个体外样品中一个或多个序列的方法,所述方法包括:使一个或多个样品与以下各物接触:i)Cas12b效应蛋白;ii)至少一个包含指导序列的指导多核苷酸,所述指导序列设计成与一个或多个靶序列具有一定程度的互补性,并设计成与所述Cas12b效应蛋白形成复合物;以及iii)基于寡核苷酸的掩蔽构建体,所述掩蔽构建体包含非靶序列;并且其中所述Cas12效应蛋白表现出附带核酸酶活性并切割所述基于寡核苷酸的掩蔽构建体的所述非靶序列。
70.如声明69所述的方法,其中所述Cas12b效应蛋白选自表1或表2。
71.如声明70所述的方法,其中所述Cas12b效应蛋白来源于选自由以下组成的组的细菌:卡克氏脂环酸芽孢杆菌、芽孢杆菌属V3-13种、外村尚芽孢杆菌、黏胶球形菌纲细菌和沉积物莱西氏菌。
72.一种非天然存在的或工程化的组合物,所述组合物包含连接至酶或报告部分的非活性第一部分的Cas12b蛋白,其中当接触所述酶或报告部分与所述酶或报告部分的互补部分时,所述酶或报告部分被重建。
73.如声明72所述的组合物,其中所述酶或报告部分包括蛋白水解酶。
74.如声明72或73所述的组合物,其中所述Cas12蛋白包含连接至所述酶或报告部分的所述互补部分的第一Cas12b蛋白和第二Cas12b蛋白。
75.如声明72-74中任一项所述的组合物,所述组合物还包含:i)第一指导物,所述第一指导物能够与所述第一Cas12b蛋白形成复合物并与靶核酸的第一靶序列杂交;和ii)第二指导物,所述第二指导物能够与所述第二Cas12b蛋白形成复合物,并与所述靶核酸的第二靶序列杂交。
76.如声明72-75中任一项所述的组合物,其中所述酶包括胱天蛋白酶。
77.如声明72-75中任一项所述的组合物,其中所述酶包括烟草蚀纹病毒(TEV)。
78.一种在含有靶寡核苷酸的细胞中提供蛋白水解活性的方法,所述方法包括:a)使细胞或细胞群体与以下各物接触:i)第一Cas12b效应蛋白,所述第一Cas12b效应蛋白与蛋白水解酶的非活性部分连接;ii)第二Cas12b效应蛋白,所述第二Cas12b效应蛋白与所述蛋白水解酶的互补部分连接,其中当接触所述蛋白水解酶的所述第一部分和所述互补部分时,所述蛋白水解酶的蛋白水解活性被重建;iii)第一指导物,所述第一指导物与所述第一Cas12b效应蛋白结合并与所述靶寡核苷酸的第一靶序列杂交;和iv)第二指导物,所述第二指导物与所述第二Cas12b效应蛋白结合并与所述靶寡核苷酸的第二靶序列杂交,由此接触所述蛋白水解酶的所述第一部分和互补部分并且所述蛋白水解酶的蛋白水解活性被重建。
79.如声明78所述的方法,其中所述蛋白水解酶是胱天蛋白酶。
80.如声明79所述的方法,其中所述蛋白水解酶是TEV蛋白酶,其中所述TEV蛋白酶的蛋白水解活性被重建,由此TEV底物被切割并激活。
81.如声明80所述的方法,其中所述TEV底物是被工程化而含有TEV靶序列的胱天蛋白酶原,由此所述TEV蛋白酶进行的切割激活所述胱天蛋白酶原。
82.一种鉴定含有目标寡核苷酸的细胞的方法,所述方法包括使所述细胞中的所述寡核苷酸与组合物接触,所述组合物包含:i)第一Cas12b效应蛋白,所述第一Cas12b效应蛋白与蛋白水解酶的非活性第一部分连接;ii)第二Cas12b效应蛋白,所述第二Cas12b效应蛋白与所述蛋白水解酶的互补部分连接,其中当接触所述蛋白水解酶的所述第一部分和所述互补部分时,所述蛋白水解酶的活性被重建;iii)第一指导物,所述第一指导物与所述第一Cas12b效应蛋白结合并与所述寡核苷酸的第一靶序列杂交;iv)第二指导物,所述第二指导物与所述第二Cas12b效应蛋白结合并与所述寡核苷酸的第二靶序列杂交;以及v)报告物,所述报告物被可检测地切割,其中当所述目标寡核苷酸存在于所述细胞中时,接触所述蛋白水解酶的所述第一部分和所述互补部分,由此所述蛋白水解酶的活性被重建并可检测地切割所述报告物。
83.一种鉴定含有目标寡核苷酸的细胞的方法,所述方法包括使所述细胞中的所述寡核苷酸与组合物接触,所述组合物包含:i)第一Cas12b效应蛋白,所述第一Cas12b效应蛋白与报告物的非活性第一部分连接;ii)第二Cas12b效应蛋白,所述第二Cas12b效应蛋白与所述报告物的互补部分连接,其中当接触所述报告物的所述第一部分和所述互补部分时,所述报告物的活性被重建;iii)第一指导物,所述第一指导物与所述第一Cas12b效应蛋白结合并与所述寡核苷酸的第一靶序列杂交;iv)第二指导物,所述第二指导物与所述第二Cas12b效应蛋白结合并与所述寡核苷酸的第二靶序列杂交;以及v)所述报告物,其中当所述目标寡核苷酸存在于所述细胞中时,接触所述报告物的所述第一部分和互补部分,由此所述报告物的活性被重建。
84.如声明82或83所述的方法,其中所述报告物是荧光蛋白或发光蛋白。
在以下实施例中进一步说明本发明,所述实施例不限制权利要求中描述的本发明的范围。
实施例
实施例1
表11示出示例C2c1直系同源物的氨基酸序列。
表13示出其他的示例Cas12b直系同源物。
实施例2-腺苷脱氨酶的选择和设计:
使用了许多AD,并且各AD将具有不同水平的活性。这些AD包括:
1.人类ADAR(hADAR1、hADAR2、hADAR3)
2.鱿鱼长翼鱿鱼ADAR(sqADAR2a、sqADAR2b)
3.ADAT(人类ADAT、果蝇ADAT)
突变也可用于增加ADAR针对DNA-RNA异源双链体反应的活性。例如,对于人类ADAR基因,hADAR1d(E1008Q)或hADAR2d(E488Q)突变用于增加其针对DNA-RNA靶标的活性。
每个ADAR具有不同水平的序列情形要求。例如,对于hADAR1d(E1008Q),tAg和aAg位点被有效地脱氨基,而aAt和cAc的编辑效率较低,并且gAa和gAc的编辑效率更低。然而,情形要求因不同的ADAR而改变。
图1提供了所述系统的一种版本的示意图。图2至图4提供了示例Cpf1-AD融合蛋白的氨基酸序列。
实施例3-菲西芬氏菌纲细菌ST-NAGAB-D1的C2c1(Cas12b)的表征
用低拷贝质粒(pACYC184)转化大肠杆菌(Stbl3),所述质粒含有菲西芬氏菌纲细菌CRISPR-C2c1基因座的内源性基因组序列的一部分。从培养14小时的细胞提取完整RNA,并且制备RNA并通过小RNA测序进行分析。所述方法如Zetsche等人,2015所述。
小RNAseq揭示了tracer RNA的位置和成熟crRNA的构造。成熟crRNA最有可能是14nt的正向重复序列,接着是20-24nt的指导序列。具有高读段数的潜在tracr序列示于图2中,并且序列示于表12中。基于RNA折叠预测的具有正向重复序列(DR)的tracrRNA双链体的结构在图2中描绘。
按照Zetsche等人,2015中的方法进行PAM筛选。特别是,用10ng质粒DNA转化Stbl3大肠杆菌,所述质粒DNA编码位于可识别的原间隔子5'处的不同PAM序列,并进行菌落计数。对于TTH PAM(H=A、T、C),证实菌落形成减少。
实施例4-比色检测
DNA四链体可用于生物分子分析物检测(图6)。在一种情况下,OTA-适体(蓝色)识别OTA,从而导致构象变化,使四链体(红色)暴露以结合氯化血红素。氯化血红素-四链体复合物具有过氧化物酶活性,其然后可将TMB底物氧化为有色形式(通常在溶液中为蓝色)。因此,四链体可被本文所述的CRISPR附带活性降解。申请人还创建了这些四链体的RNA形式,其可被降解作为本文所述的CRISPR附带活性的一部分。降解导致RNA适体的损失,以及因此在核酸靶标存在下颜色信号的损失。下面示出了两个示例性设计。
1)rUrGrGrGrUrUrGrGrGrUrUrGrGrGrUrUrGrGrGrA(SEQ ID NO:514)
2)rUrGrGrGrUrUrUrGrGrGrUrUrUrGrGrGrUrUrUrGrGrGrA(SEQ ID NO:515)
鸟嘌呤形成生成四链体结构的关键碱基对,并且其然后结合氯化血红素分子。申请人将鸟嘌呤组与尿苷隔开(以粗体显示),以使四链体降解,因为二核苷酸数据显示鸟嘌呤降解不佳。
比色测定法适用于如本文所述的诊断测定法。在一个实施方案中,将适当的四链体与测试样品和Cas12系统一起温育。在另一个实施方案中,将适当的四链体与测试样品和Cas13系统一起温育。例如,在允许Cas13鉴定靶序列并通过附带活性降解适体的温育期之后,可添加底物。然后可测量吸光度。在其他实施方案中,底物包括在具有四链体和CRISPRCas9、Cas12或Cas13系统的测定中。
实施例5
图13示出不同的sgRNA。图14示出质粒转染后针对不同靶位点用图13的不同sgRNA获得的插入/缺失百分比。使用的Cas12b来自外村尚芽孢杆菌菌株C4。
实施例6
表14示出示例性的Cas12b直系同源物。
表15示出了表14中所示的Ls、Ak、Bv、Phyci和Planc的Cas12b直系同源物的crRNA、tracrRNA和sgRNA的示例性序列。图15A-15C分别示出了使用Ls、Ak和Bv中的Cas12b直系同源物的PAM发现、用纯化蛋白质和RNA的体外切割。图15D-15E分别示出了使用Phyci和Planc的Cas12B直系同源物用纯化蛋白质和RNA的体外切割。
表15
实施例7
下表16示出了大孢子脂环酸芽孢杆菌Cas12b的示例性正向重复序列、crRNA序列、tracrRNA序列和sgRNA。
表16
图16示出了纯化的AmCas12b(AmC2C1)蛋白和利用来自小RNAseq的不同预测tracrRNA的体外切割测定。我们使用TTTA PAM,因为此时TTA是C2C1的共有PAM。
各种sgRNA设计示于图17A-17E中。图17A示出了与tracr RNA(红色)退火的全长AmC2C1正向重复序列(绿色)。Tracr由小RNAseq预测并在体外确认。蓝色圆圈=5'端;红色圆圈=3'端。图17B示出了与tracr RNA(红色)退火的21nt的AmC2C1正向重复序列(绿色)。Tracr由小RNAseq预测并在体外确认。蓝色圆圈=5'端;红色圆圈=3'端。图17C示出了全长正向重复序列与具有CTA环的tracr的融合。图17D示出了29nt的正向重复序列和具有CTA环的tracr。图17E示出了21nt的正向重复序列和具有CTA环的tracr。
图18示出了用AmC2C1进行的体外切割,以比较sgRNA的效率。
生成了AmC2C1 RuvC突变体,并使用HEK细胞裂解物测试了它们的活性(图19)。
通过体外PAM筛选确定Cas12b直系同源物的PAM。简而言之,将Cas12b蛋白和sgRNA与PAM文库质粒一起温育。结果如图20所示。
实施例8
将外村尚芽孢杆菌Cas12b(BhC2C1)纯化并在不同温度下测试其活性。图21A-21D分别示出了小的RNAseq tracr预测,来自体内筛选的BhC2C1(外村尚芽孢杆菌Cas12b)PAM,BhC2C1蛋白纯化,在37℃和48℃下用BhC2C1蛋白和预测的tracr RNA进行的体外切割。
图22A-22D示出了BhC2C1 sgRNA设计。例如,图22A示出了20nt正向重复序列(绿色)和预测的tracr RNA(红色)。
BhC2C1的正向重复序列、tracr RNA序列和sgRNA序列示于下表17中。
表17
将BhC2C1克隆到质粒中。质粒的图谱示于图23中。支架是GTTCTGTCTTTTGGTCAGGACAACCGTCTAGCTATAAGTGCTGCAGGGTGTGAGAAACTCCTATTGCTGGACGACGCCTCTTACGAGGCGTTAGCACn23_间隔子(SEQ ID NO:565)。
实施例9
图24示出了质粒转染后针对不同靶位点使用不同sgRNA获得的插入/缺失百分比。使用的Cas12b是来自芽孢杆菌属V3-13种(WP_101661451)。蛋白质序列、sgRNA序列和靶向位点示于下表18中。
表18
实施例10
将BvCas12b(芽孢杆菌属V3-13种Cas12b)克隆到质粒(pcDNA3-BvCas12b)中。质粒的图谱示于图25中。克隆构建体的序列示于下表19中。
表19
实施例11
将BhCas12b(外村尚芽孢杆菌Cas12b)克隆到质粒(pcDNA3-BhCas12b)中。质粒的图谱示于图26中。克隆构建体的序列示于下表20中。
表20
实施例12
将EbCas12b(迷踪菌门细菌Cas12b)克隆到质粒(pcDNA3-EbCas12b)中。质粒的图谱示于图27中。克隆构建体的序列示于下表21中。
表21
实施例13
将AkCas12b(卡克氏脂环酸芽孢杆菌Cas12b)克隆到质粒(pcDNA3-AkCas12b)中。质粒的图谱示于图28中。克隆构建体的序列示于下表22中。
表22
实施例14
将PhyciCas12b(菲西芬氏菌纲细菌Cas12b)克隆到质粒(pcDNA3-PhyciCas12b)中。质粒的图谱示于图29中。克隆构建体的序列示于下表23中。
表23
实施例15
将PlancCas12b(浮霉菌门细菌Cas12b)克隆到质粒(pcDNA3-PlancCas12b)中。质粒的图谱示于图30中。克隆构建体的序列示于下表24中。
表24
实施例16
生成了含有BvCas12b的质粒pZ143-pcDNA3-BvCas12b。质粒的图谱示于图31中并且克隆构建体的序列示于下表25中。
表25
生成了含有BvCas12b sgRNA支架的质粒pZ147-BvCas12b-sgRNA-支架。质粒的图谱示于图32中并且克隆构建体的序列示于下表26中。
表26
实施例17
生成了含有BhCas12b sgRNA支架的质粒pZ148-BhCas12b-sgRNA-支架。质粒的图谱示于图33中并且克隆构建体的序列示于下表27中。
表27
生成了含有在S893、K846和E836处具有突变的BhCas12b的质粒pZ149-BhCas12b-S893R-K846R-E836G。质粒的图谱示于图34中并且克隆构建体的序列示于下表28中。
表28
生成了含有在S893、K846和E836处具有突变的BhCas12b的质粒pZ150-pCDNA3-BhCas12b-S893R-K846R-E836K。质粒的图谱示于图35中并且克隆构建体的序列示于下表29中。
表29
实施例18
在各种条件下通过体外PAM筛选确定BhCas12b的大肠杆菌PAM。结果示于图36中。
实施例19
在各种条件下通过体外PAM筛选确定BvCas12b的大肠杆菌PAM。结果示于图37中。
实施例20
生成BhCas12b的变体。突变示于下表30中。
表30
通过测试在不同结合位点的插入/缺失百分比来评价变体的活性。测试结果示于图38中。
实施例21
生成了BhCas12b的其他变体并测试了它们的活性,并且将其与实施例20中生成的变体进行比较。
其他变体包含突变S893R和K846R,并且还包含突变E837H、E837K、E837N、E837L、E837I、D533G、N644K、D680P、L741Q、L792Q、F881L、V895A、V980E、T984A、K1022E或M1073I。通过测试不同结合位点的插入/缺失百分比来评价变体的活性。测试结果示于图39中。
实施例22
在不同位点测试了被BhCas12b(实施例20中的变体4)和野生型BvCas12b切割的HDR。DNMT1-1处的HDR结果示于图40A中并且VEGFA-2处的HDR结果示于图40B中。
实施例23
本实施例示出了在293T细胞中进行的用于测试Cas12b直系同源物接近不同PAM的活性的实验,以及使用ssODN供体进行的实验。
图41A示出了AsCas12a在TTTV PAM以及BhCas12b变体4和BvCas12b在ATTN PAM的插入/缺失百分比的比较。图41B示出了BhCas12b变体4和BvCas12b活性在不同PAM序列下的细分。
图42A示出了VEGFA靶标的示意图,所述靶标包括有待与ssDNA供体一起引入的所需改变。图42B示出了每个核酸酶在VEGFA靶位点的插入/缺失活性。图42C示出了在VEGFA位点含有所需编辑(两个核苷酸取代)的细胞的百分比。图42D示出了DNMT1靶标的示意图,所述靶标包括有待与ssDNA供体一起引入的所需改变。图42E示出了每个核酸酶在DNMT1靶位点的插入/缺失活性。图42E示出了在DNMT1位点含有所需编辑(两个核苷酸取代)的细胞的百分比。对于图42C和图42E,以蓝色和红色条显示的完美编辑指示包含完全校正的基因座的细胞的百分比,如示意图所示,其包括所需的两个核苷酸取代以及两个PAM的突变而没有其他突变。
实施例24
具有靶向CXCR4基因的sgRNA的BhCas12b(v4)和BvCas12b核糖蛋白(RNP)复合物在体外组装,并使用Lonza 4D-Nucleofector电穿孔到人类CD4+T细胞中。人类CD4+T细胞是从两个不同的供体获得的。将RNP以3μM的最终浓度递送至3×10
实施例25-使用CRISPR-Cas12b的基因组编辑
开发V型CRISPR效应Cas12b(也称为C2c1)用于人类细胞中的基因组编辑一直具有挑战性,这至少部分是由于已表征家族成员的高温需求。在这里,申请人探索了Cas12b家族的多样性,并鉴定了用于从外村尚芽孢杆菌BhCas12b进行人类基因编辑的示例性的有希望的候选物。在37℃下,野生型BhCas12b优先切刻非靶DNA链,而不是形成双链断裂,导致编辑效率较低。使用多种方法的组合,申请人鉴定了克服该限制的BhCas12b的功能获得突变。突变的BhCas12b促进了人类细胞系中和离体原代人类T细胞中稳健的基因组编辑,并且与化脓性链球菌Cas9相比,表现出更高的特异性。这项工作建立了除Cas9和Cpf1/Cas12a之外的第三个RNA指导的核酸酶平台,用于人类细胞中的基因组编辑。
在此,申请人搜索了嗜中温Cas12b酶,并从外村尚芽孢杆菌BhCas12b中鉴定出了有前途的候选物,该候选物在37℃下优先切刻非靶DNA链。使用多种方法的组合,申请人工程改造了BhCas12b变体,该变体克服了这种限制并在37℃下切割两条DNA链。申请人还鉴定了从组装维京号宇宙飞船(Viking spacecrafts)的洁净室
基因组编辑工具可能需要具可重编程性和高度特异性,并且原核成簇的规律间隔的短回文重复序列和CRISPR相关蛋白(CRISPR-Cas)系统自然具有这些特性
使用先前检测到的Cas12b蛋白作为查询的更新序列数据库的BLAST搜索,鉴定了在V-B型基因座内编码的Cas12b家族的约25个成员。V-B型系统广泛散布在细菌之间,并且Cas12b的系统发育树的拓扑结构(图48a)通常不遵循细菌分类法,这表明广泛的水平流动性。但是,值得注意的是,在树中形成牢固支撑的进化枝的大约一半的V-B型基因座存在于细菌芽孢杆菌目的成员中。申请人从各种细菌中选择了14个未表征的Cas12b基因进行实验研究(图48e),避免了先前描述的成员和公认的嗜热菌中的成员。所有已知的靶向DNA的2类CRISPR-Cas核酸酶都需要与原间隔子相邻的基序(PAM)
为了对Cas12b进行生物化学表征,申请人对含有鉴定出的PAM的靶标进行了纯化的Cas12b蛋白和预测的tracrRNA和crRNA的体外活性测试(图44b,图49e)。申请人仅观察到EbCas12b和LsCas12b的最小活性,但是,AkCas12b和BhCas12b在37℃下均显示出强烈的切割,这需要在人类细胞中进一步研究。鉴于使用单指导RNA(sgRNA)使细胞中的基因组编辑更有效
申请人经常在体外切割反应的凝胶电泳期间观察到较慢的迁移带,最明显的是使用AkCas12b,这表明Cas12b可切刻双链DNA(dsDNA)底物(图44b)。与差异标记的DNA链的反应揭示,AkCas12b和BhCas12b优先切割了非靶链,并且这种行为在较低温度下更为明显(图45a)。由于无法切割靶链降低了BhCas12b作为基因组编辑工具的潜力,因此申请人寻求通过蛋白质工程来解决这个限制。
BhCas12b的RuvC活性位点可能难以接近靶链。申请人测试了改变BhCas12b中这个口袋的性质是否可改善靶链的可及性和DNA切割。申请人使通过与AacCas12b比对鉴定的12个BhCas12b残基突变,这些残基在几乎相同的来自热噬淀粉芽孢杆菌(BthCas12b)的Cas12b的结构中也是保守的(BthCas12b在细胞中也表现出活性,但效率不如BhCas12b,图51a)
作为正交方法,申请人寻求解决靶链切割的温度依赖性。申请人在66个表面暴露的残基处生成甘氨酸取代,并再次测试了两个靶位点的插入/缺失活性。引人注目的是,申请人观察到相对于野生型,E837G变体提高了2倍以上,E837G变体位于指导RNA:DNA双链体与RuvC活性位点之间的位置(图45d和图45e)。测试突变的组合会导致具有最终的BhCas12bv4突变体(包含K846R/S893R/E837G)的渐进活性变体,所述变体在多个靶标中表现出最高的活性(图45f和图45g)。与人类细胞中的这些结果一致,纯化的BhCas12b v4蛋白在37℃下表现出增加的dsDNA切割活性,并且有切口的dsDNA明显降低(图45h,图51g-51j)。
申请人最初对Cas12b酶的选择避免了来自同一物种的直系同源物,从而增加了筛选变体的多样性。但是,鉴于BhCas12b的积极的基因组编辑结果,申请人重新访问了芽孢杆菌属成员并发现了在最近沉积的来自芽孢杆菌属V3-13种的基因组中编码的Cas12b直系同源物
强大的基因组编辑工具可能需要对一系列靶标有效且特异。与先前研究的Cas核酸酶相比,申请人更充分地研究了Cas12b活性。申请人测试了293T细胞中5个基因的56个靶标上的BhCas12b v4和BvCas12b,并发现在TTTV PAM处使用AsCas12a作为阳性对照,在ATTNPAM处进行了稳健切割(图46a)。对由Cas12b形成的插入/缺失模式的分析揭示了主要的5-15-bp缺失(图46b)。申请人还观察到在TTTN和GTTN PAM子集上的高Cas12b活性,尽管这种活性不那么稳健(图54a)。申请人仅观察到BhCas12b v4和BvCas12b在匹配位点的活性之间的弱相关性(R
申请人接下来试图确定细胞中的Cas12b特异性。申请人选择了9个在不同Cas核酸酶之间具有类似插入/缺失活性的靶位点(图47a),并使用这些靶标进行了Guide-Seq
在此,申请人描述了适用于人类细胞中基因组编辑的V型CRISPR Cas12b家族的前两个成员。尽管许多Cas12b核酸酶显示出对较高温度的强烈偏好,但我们的广泛筛选导致鉴定出在37℃下具有高活性的该家族的成员。此外,我们对BhCas12b的工程化导致dsDNA切割的效率显著提高,并提供了可释放其他Cas12b核酸酶作为基因组编辑工具的潜力的框架。BhCas12b和BvCas12b都是相对致密的蛋白质(各自约1100个氨基酸),因此适合有效包装成腺相关病毒(AAV)。结合其高靶标特异性,这些Cas12b酶有望成为用于体内基因组编辑的新工具。
补充信息。Cas12b家族蛋白的多重比对
序列用登录号表示。来自芽孢杆菌属V3-13种(WP 101661451.1)和外村尚芽孢杆菌(WP_095142515.1)的序列以红色突出显示。在这项工作中突变的12个残基在通过红色突出显示的外村尚芽孢杆菌(WP_095142515.1)序列中示出。在BhCas12 v4突变体中,对其取代显著影响DNA切割效率的残基用黄色呈现,并带有红色突出显示。
材料和方法
Cas12b序列比对和系统发育树重建
使用MUSCLE程序(v 3.7)构建比对
Cas12b表达质粒的生成
合成Cas12b基因座并将其克隆到pACYC184(Genewiz)中以在大肠杆菌中表达。Cas12b开放阅读框(ORF)已针对人类表达进行了密码子优化,而OR F侧翼的上游和下游序列则保持不变。将CRISPR阵列缩短至3个正向重复序列,并将第一个内源间隔子替换为FnCpf1原间隔子1(FnPSP1)序列(GAG AAGTCATTTAATAAGGCCACTGTTAAAA)(SEQ ID NO:591)。
PAM发现
PAM鉴定如先前所述进行
细菌RNA测序
小RNA-Seq如先前所述进行
Cas12b蛋白的纯化
将Cas12b基因克隆到细菌表达质粒(T7-TwinStrep-SUMO-NLS-Cas12b-NLS-3xHA)中,并在BL21(DE3)细胞(含有来自Novagen#70956的pLysS-tRNA质粒的NEB#C2527H)中表达。细胞在Terrific Broth中生长至对数中期,并且将温度降至20℃。用0.25mM IPTG在0.6OD下诱导表达16-20小时,然后收集细胞并于-80℃冷冻。将细胞糊状物重悬于补充有不含EDTA的完全蛋白酶抑制剂(Roche)的裂解缓冲液(50mM TRIS pH 8,500mM NaCl,5%甘油,1mM DTT)中。使用LM20微流化仪装置(Microfluidics)裂解细胞,并清除与Strep-Tactin Superflow Plus树脂(Qiagen)结合的裂解物。用裂解缓冲液洗涤树脂,并用补充有5mM去硫生物素的裂解缓冲液洗脱Cas12b蛋白。通过在4℃下用自制SUMO蛋白酶Ulp1以蛋白酶:Cas12b的重量比为1:100下进行过夜消化来去除TwinStrep-SUMO标签。将切割的Cas12b蛋白稀释至200mM NaCl,并使用HiTrap Heparin HP柱在AKTA Pure 25L(GE HealthcareLife Sciences)上以200mM-1M NaCl梯度进行纯化。合并含有Cas12b的级分并浓缩,并装载到Superdex 200Increase柱(GE Healthcare Life Sciences)上,最终储存缓冲液为25mMTRIS pH 8、500mM NaCl、5%甘油、1mM DTT。将纯化的Cas12b蛋白浓缩至5uM或73uM储备液并在液氮中快速冷冻,然后储存在-80℃。
体外RNA合成
通过将含有所需RNA反向互补序列的DNA寡核苷酸与短T7寡核苷酸退火来生成所有RNA。使用HiScribe T7高产RNA合成试剂盒(NEB)在37℃下进行体外转录8-12小时,并使用Agencourt AMPure RNA Clean珠粒(Beckman Coulter)纯化RNA。
体外切割反应
通过包含FnPSP1靶位点的pUC19质粒的PCR扩增来生成DNA底物。典型的反应包含100ng DNA底物、250nM Cas12b蛋白、500nM RNA和20mM TRIS pH 6.5的最终1x反应缓冲液、6mM MgCl2。用20mM EDTA淬灭反应,用5ug RNAse A(Qiagen)于37℃消化RNA持续5分钟,并使用PCR提纯试剂盒(Qiagen)纯化DNA产物。反应在1x TBE缓冲液(Thermo FisherScientific)中的Novex 10%TBE PAGE凝胶上进行,并用SYBR Gold(Thermo FisherScientific)染色。用IR700和IR800缀合的DNA寡核苷酸(IDT)生成标记的DNA底物。为了使凝胶变性,将DNA与等体积的100%甲酰胺混合,接着在95℃加热变性5分钟。将产物在预热至60℃的1x TBE缓冲液中的Novex尿素-PAGE凝胶(Thermo Fisher Scientific)上分离,并用Odyssey CLx装置(LI-COR)成像。在适用情况下,DNA切割或切刻的定量由以下公式确定:100×(1-sqrt(1-(b+c)/(a+b+c))),其中a是未消化产物的积分强度并且b和c是每个切割或切刻产物的积分强度。
哺乳动物表达构建体和诱变
从相应的pACYC184质粒扩增Cas12b基因,并将其克隆到包含N末端和C末端NLS标签和C末端3xHA标签的pCDNA3.1中。指导表达质粒是通过将在U6启动子后面包含两个反向BsmBI IIS型限制性位点的sgRNA支架克隆而生成的。用两个退火的互补寡核苷酸通过Golden Gate组装将指导物克隆到支架中。除非另有说明,否则所有指导物的长度均为23-nt。在寡核苷酸上定制所需的Cas12b突变,以生成两个重叠的Cas12b PCR产物,这些产物使用Gibson组装预混液(NEB)进行组装。下表31示出了所使用的指导序列。
表31
细胞培养和转染
HEK293T细胞(ATCC)在含有高葡萄糖、丙酮酸钠和GlutaMAX(Thermo FisherScientific)、1x青霉素-链霉素(Thermo Fisher Scientific)和10%胎牛血清(Seradigm)的达尔伯克改良伊格尔培养基(Dulbecco's Modified Eagle Medium)中培养。将细胞维持在低于90%的汇合度,并使用MycoAlert检测试剂盒(Lonza)检验支原体阴性。为了进行插入/缺失分析,在转染前约16小时,以17,500个细胞/孔接种96孔板,转染时汇合度约为75%。每个96孔在含0.6uL TransIt-LT1转染试剂(Mirus)的20uL Opti-MEM(ThermoFisher Scientific)中用100ng核酸酶表达质粒和100ng指导质粒转染。转染后72小时,用QuickExtract DNA提取溶液(Lucigen)收获细胞。
对于HDR实验,每96孔用0.9uL TransIt-LT1转染试剂(Mirus)转染100ng核酸酶、100ng指导物和100ng ssODN。ssODN被定制为Ultramer DNA寡核苷酸(IDT),并在每个末端包含3个硫代磷酸酯修饰。
插入/缺失突变的深度测序
通过使用两轮PCR策略用NEBNext高保真2x PCR预混液(NEB)扩增目标基因组区域来进行靶向插入/缺失分析,以添加Illumina P5衔接子和独特的样品特异性条形码。使用1x200个周期的MiSeq操作(Illumina)对文库进行测序。使用Outknocker 2测量插入/缺失率
(www.outknocker.org/outknocker2.htm)。
脱靶分析
使用Guide-Seq利用改进的文库制备来鉴定脱靶切割位点。简而言之,在96孔板中在含0.5uL GeneJuice转染试剂(Millipore)的50uL Opti-MEM中用75ng核酸酶质粒、25ng指导质粒和100ng退火dsDNA寡核苷酸转染细胞。
F:/5phos/G*T*TGTGAGCAAGGGCGAGGAGGATAACGCCTCTCTCCCAGCGACT*A*T(SEQ IDNO:644)
R:/5phos/A*T*AGTCGCTGGGAGAGAGGCGTTATCCTCCTCGCCCTTGCTCACA*A*C(SEQ IDNO:645)
72小时后收获细胞,并且对于每个实验合并10个孔。裂解1E6个细胞并用Tn5标记基因组DNA,接着使用质粒微型制备柱(Qiagen)纯化。使用Tn5衔接子特异性引物和DNA供体中的套式引物,使用KOD热启动DNA聚合酶(Millipore)进行两轮PCR扩增来制备文库。使用75次循环的NextSeq试剂盒(Illumina)对文库进行测序。使用BrowserGenome.org将读段映射到人类基因组(hg38)
T细胞培养
将人类CD4+T细胞(STEMCELL Technologies)在补充有5mM HEPES pH8.0(Gibco)、50ug/mL青霉素/链霉素(Gibco)、50uM 2-巯基乙醇(Sigma-Aldrich)、5mM MEM非必需氨基酸(Gibco)、5mM丙酮酸钠(Gibco)和10%FBS(Seradigm)的RMPI 1640(GlutamaxSupplement,Gibco)中培养。解冻后,通过每两天在包被有10ug/mL抗CD3(UCHT1,eBioscience,Invitrogen)和抗CD28(CD28.2,eBioscience,Invitrogen)单克隆抗体的培养皿上接种,将细胞激活5-7天。
RNP复合和递送
合成在3'端具有3个2'O-甲基修饰的BhCas12b sgRNA(Integrated DNATechnologies)。通过将10mg/mL蛋白质与50uM退火的RNA以1:1摩尔比在37℃温育15分钟来形成RNP。将RNP存储在冰上直至电穿孔。
使用Amaxa P3原代细胞4D-Nucleofector X试剂盒(Lonza)将细胞电穿孔。对于每个反应,使3×10
参考文献
·1 Shmakov,S.et al.Discovery and Functional Characterization ofDiverse Class 2CRISPR-Cas Systems.Mol Cell60,385-397,doi:10.1016/jmolcel.201510.008(2015)
·2Seuylemezian,A.,Cooper,K.,Schubert,W.&Vaishampayan,P.DraftGenomeSequences of 12 Dry-Heat-Resistant Bacillus Strains Isolated from theCleanrooms Where the Viking Spacecraft Were Assembled.Genome announcements6,doi:10.1128/genomeA.00094-18(2018).
·3Knott,G.J&Doudna,J.A.CRISPR-Cas guides the future of geneticengineering.Science 361,866-869,doi:10.1126/science.aat5011(2018)
·4Hsu,P.D.,Lander,E.S&Zhang,F.Development and Applications ofCRISPR-Cas9for Genome Engineering.Cell157,1262-1278,doi:10.1016/j.cell.2014.05.010(2014).
·5Cong,L.et al.Multiplex Genome Engineering Using CRISPR/CasSystems.Science339,819-823,doi:10.1126/science.1231143(2013).
·6Mali,P.et al.RNA-Guided Human Genome Engineering via Cas9.Science339,823-826,doi101126/science.1232033(2013).
·7Deltcheva,E.et al.CRISPR RNA maturation by trans-encoded small RNAand host factor RNase III.Nature 471,602-607,doi:101038/nature09886(2011)
·8Bolotin,A.,Ouinquis,B.,Sorokin,A.&Ehrlich,S.D.Clustered regularlyinterspacedshort palindrome repeats(CRISPRs)have spacers of extrachromosomalorigin.Microbiol-Sgm151,2551-2561,doi:10.1099/mic.028048-0(2005).
·9Makarova,K.S.,Grishin,N.V.,Shabalina,S.A.,Wolf,,Y.I.&Koonin,E.V.Aputative RNA-interference-based immune system in prokaryotes:computational analysisof the predicted enzymatic machinery,functionalanalogies with eukaryotic RNAi,and hypothetical mechanisms ofaction.BiolDirect 1,doi:Artn 710.1186/1745-6150-1-7(2006)
·10Zetsche,B.et al.Cpfl is a single RNA-guided endonuclease of aclass 2 CRISPR-Cassystem.Cell 163,759-771,doi:101016/j.cell201 509038(2015).
·11Shmakov,Set al.Diversity and evolution of class 2 CRISPR-Cassystems.Nat RevMicrobiol15,169-182,doi:101038/nrmicro.2016.184(2017)
·12Cox,D.B.T.et al.RNA editing with CRISPR-Cas13.Science 358,1019-1027,doi:101126/science.aaq0180(2017).
·13Hsu,P.D.et al.DNA targeting specificity of RNA-guided Cas9nucleases.NatBiotechnol31,827-+,doi:10.1038/nbt.2647(2013).
·14Yang,H.,Gao,P.,Rajashankar,K.R.&Patel,D.J.PAM-Dependent TargetDNARecognition and Cleavage by C2c1 CRISPR-Cas Endonuclease.Cell167,1814-1828e1812,doi:10.1016/j.cell.2016.11.053(2016)
·15Wu,D.,Guan,X.,Zhu,Y.,Ren,K.&Huang,Z.Structural basis of stringentPAMrecognition by CRISPR-C2cl in complex with sgRNA.Cell Ress27,705-708,doi:10.1038/cr.2017.46(2017).
·16Suzuki,M.A framework for the DNA-protein recognition code of theprobe helix in transcription factors:the chemical and stereochemicalrules.Structure (London,England:1993)2,317-326(1994).
·17Mavromatis,K.,Tsigos,I.,Tzanodaskalaki,M.,Kokkinidis,M.&Bouriotis,V.Exploring the role of a glycine cluster in cold adaptation of analkaIine phosphatase.Eur JBiochem269,2330-2335(2002).
·18Saavedra,H.G.,Wrabl,J.O.,Anderson,J.A.,Li,J.&Hilser,V.J.Dynamicallostery can drive cold adaptation in enzymes.Nature 558,324-+,doi:10.1038/s41586-018-0183-2(2018).
·19Tsai,S.Q.et al.GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases.Nat Biotechnol33,187-197,doi:10.1038/nbt.3117(2015).
·20Fu,Y.F.et al.High-frequency off-target mutagenesis induced byCRISPR-Casnucleases in human cells.Nat Biotechnol31,822-+,doi:10.1038/nbt.2623(2013).
·21Liu,L.et al.C2c1-sgRNA Complex Structure Reveals RNA-Guided DNACleavage Mechanism.Mol Cell65,310-322,doi:10.1016/j.molcel.2016.11.040(2017).
·22Leenay,R.T.et al.Identifying and Visualizing Functional PAMDiversity across CRISPR-Cas Systems.Molecular Cell62,137-147,doi:10.1016/j.molcel.2016.02.031(2016).
·23Edgar,R.C.MUSCLE:multiple sequence alignment with high accuracyand highthroughput.Nucleic Acids Res 32,1792-1797,doi:10.1093/nar/gkh340(2004).
·24Guindon,S.&Gascuel,O.A simple,fast,and accurate algorithm toestimate large phylogenies by maximum likelihood.Syst Biol 52,696-704(2003)
·25Schmid-BurgkJ.L.et al.OutKnocker:a web tool for rapid and simplegenotyping of designer nuclease edited cell lines.Genome Res 24,1719-1723,doi:10.1101/gr.176701.114(2014).
·26Schmid-Burgk,J.L.&Hornung,V.BrowserGenome.org:web-based RNA-seqdataanalysis and visualization.Nat Methods12,1001,doi:10.1038/nmeth.3615(2015).
·Jinek,M.et al.A Programmable Dual-RNA-Guided DNA Endonuclease inAdaptive Bacterial Immunity.Science 337,816-821(2012).
·Teng,F.et al.Repurposing CRISPR-Cas12b for mammalian genomeengineering.Cell Discov 4,63(2018).
实施例26-
图58示出了Cas12b(C2c1)结构(基于PDB结构5U30)。该图示出了结构预测的ssDNA路径,以及可部分或完全去除以接近其他ssDNA的结构域。
实施例27
使用酵母筛选来筛选影响ADAR活性的ADAR突变。进行了多轮筛选。每轮筛选产生一组候选突变。然后在哺乳动物细胞中验证候选突变。表现最好的突变被添加到最后突变形式中并进行重新筛选。在下表32中示出了在10轮中筛选的突变。在第n轮中鉴定出的突变体命名为“RESCUEvn-1”。如本文所讨论,RESCUE是指将腺苷脱氨酶活性转化为胞苷脱氨酶活性的突变。
表32
测试了RESCUE突变体对T基序(图59)以及C和G基序(图60)的剂量反应。测试了利用RESCUE v3、v6、v7和v8的内源性靶向(图61和图62)。
进行了RESCUE v9突变的筛选(图63)。鉴定了RESCUEv9的潜在突变(图64)。进行了碱基翻转和基序测试(图65)。测试了RESCUEv9对不同基序翻转的影响(图66)。数据表明,v9与C翻转指导物一起表现更好。利用50bp指导物(图67)和30bp指导物(图68),使用RESCUEv1和v8对B6和B12进行比较。
实施例28
本实施例总结了RESCUE第1-12轮的结果(参见图69-80)。测试的其他表型包括PCSK9、Stat3、IRS1和TFEB。PCSK9显示克隆改善了启动子。Stat3显示~10%的位点编辑。信号传导的抑制将用荧光素酶报告物进行测试。对于IRS1,将在转移至前脂肪细胞之前测试合成位点的靶向。对于TFEB,可将靶向设计为引起转录因子->自噬的易位。另外,还将测试一组12个内源性phosphosite靶标和48个合成靶标。酵母中的筛选将在V11背景上用S22P继续进行。在V12上针对V13筛选了顶部命中,并将评价新一轮的酵母命中。将评价荧光素酶上的几百个额外筛选命中,并验证Ade2编辑的特异性筛选。基因改组还将针对文库复杂性和不同的酵母报告物进行测试。
实施例29
本实施例说明了使用Cas12b及其变体和脱氨酶进行碱基编辑的示例性方法。
图81、图83至图86示出了具有C-T碱基编辑能力的Cas12b Bhv4截短。除去无催化活性的Bhv4的C末端142个氨基酸(dBhv4Δ142,失活的突变D574A,新的总大小为966个氨基酸)并将接头和大鼠Apobec结构域融合至C端末端后,观察到C-T碱基编辑在非靶链上的指导碱基对位置14处的频率高达10.95%。在指导物位置15处检测到6.97%的编辑效率。这种活性取决于指导物。通过与现有构建体融合或自由表达而添加尿嘧啶-DNA糖基化酶抑制剂(UGI)结构域,增加了这种C至T的转化。列出的指导序列(大写字母)靶向HEK 293T细胞中GRIN2B内部的区域。
图87示出了使用全长BhCas12b的示例性碱基编辑方法。将第二个NLS序列添加到N末端rApobec,以使结构域彼此隔开。
实施例30
图88A示出了BhCas12b v4与另一种直系同源物AaCas12b的插入/缺失活性的比较(如Teng F.等人,Repurposing CRISPR-Cas12b for mammalian genome engineering inHEK293T cells中所述)。图88B和图88C说明了用表达AAV1/2的BhCas12b v4或BhCas12b转导大鼠神经元。这种设计展现更高的活性,如通过插入/缺失活性所测量。在优化的载体中延长了polyA序列,并且U6启动子和sgRNA支架移向相反链。
该研究中的序列示于下表33中。图89A中示出了px602-bh-优化-AAV的图谱,并且图89B中示出了px602-bv-优化-AAV的图谱。
表33
***
在不脱离本发明的范围和精神的情况下,本发明的所述方法、药物组合物和试剂盒的各种修改和变化对于本领域技术人员将是显而易见的。尽管已经结合特定实施方案对本发明进行了说明,但是应当理解,本发明能够进行进一步的修改,并且所要求保护的本发明不应不适当地限于这些特定的实施方案。实际上,对于本领域技术人员显而易见的所描述的用于实施本发明的模式的各种修改预期都在本发明的范围内。本申请旨在涵盖总体遵循本发明的原理且包括相比于本公开在本发明所属领域内的已知惯用实践内并且可应用于本文前文所述的必要特征的这样的偏离的本发明的任何变化、用途或改编。
- 新型CAS12B酶和系统
- 新型CRISPR-Cas12M酶和系统
