一种脉冲场消融导管及设备
文献发布时间:2023-06-19 12:25:57
技术领域
本申请涉及医疗设备技术领域,特别涉及一种脉冲场消融导管及设备。
背景技术
脉冲场消融(Pulse Field Ablation,PFA)是利用高压放电使细胞产生不可逆电穿孔的技术,其能够直接作用于细胞,使细胞凋亡从而达到治疗目的。脉冲场消融所利用的不可逆电穿孔消融技术是一种非加热性消融技术,与其他消融方法相比,不可逆电穿孔具有一些理论上的优势。首先,不可逆电穿孔的消融时间很短;其次,由于不可逆电穿孔为非热消融,没有热沉效应,可以在血管周围产生完整的细胞死亡;再者,不可逆电穿孔可以消融活细胞,它在理论上保留细胞基质和细胞周围的结构;另外,利用不可逆电穿孔消融病灶的边缘或顶部时,对附近结构间接损伤的可能性很小。与此同时,不可逆电穿孔引起细胞死亡的机制是凋亡,而非坏死。细胞凋亡的优点是通过免疫介入来清除凋亡细胞同时吞噬细胞将凋亡细胞作为正常细胞的死亡过程而将其清除从而促进正常组织的再生与修复,因此经不可逆性电穿孔治疗后治疗区域可以在短时间内被正常细胞替代从而恢复原有功能。
发明内容
本申请实施例之一提供一种脉冲场消融导管,包括内管和弹性变形体;所述弹性变形体设置在所述内管的前端,所述弹性变形体的至少一端与所述内管固连;所述弹性变形体的中部能够扩张或收缩,当所述弹性变形体收缩时,所述弹性变形体的内表面至少部分与所述内管相贴合。
本申请实施例之一提供一种脉冲场消融设备,包括脉冲场消融导管和控制手柄;所述脉冲场消融导管包括内管、弹性变形体和外管;所述弹性变形体设置在所述内管的前端,所述弹性变形体的至少一端与所述内管固连,所述弹性变形体的中部能够扩张或收缩,当所述弹性变形体收缩时,所述弹性变形体的内表面至少部分与所述内管相贴合;所述外管套设在所述内管外,所述内管能够相对于所述外管移动;所述控制手柄用于控制所述内管和所述外管相对移动从而控制所述弹性变形体的中部扩张或收缩。
附图说明
本申请将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行详细描述。这些实施例并非限制性的,在这些实施例中,相同的编号表示相同的结构,其中:
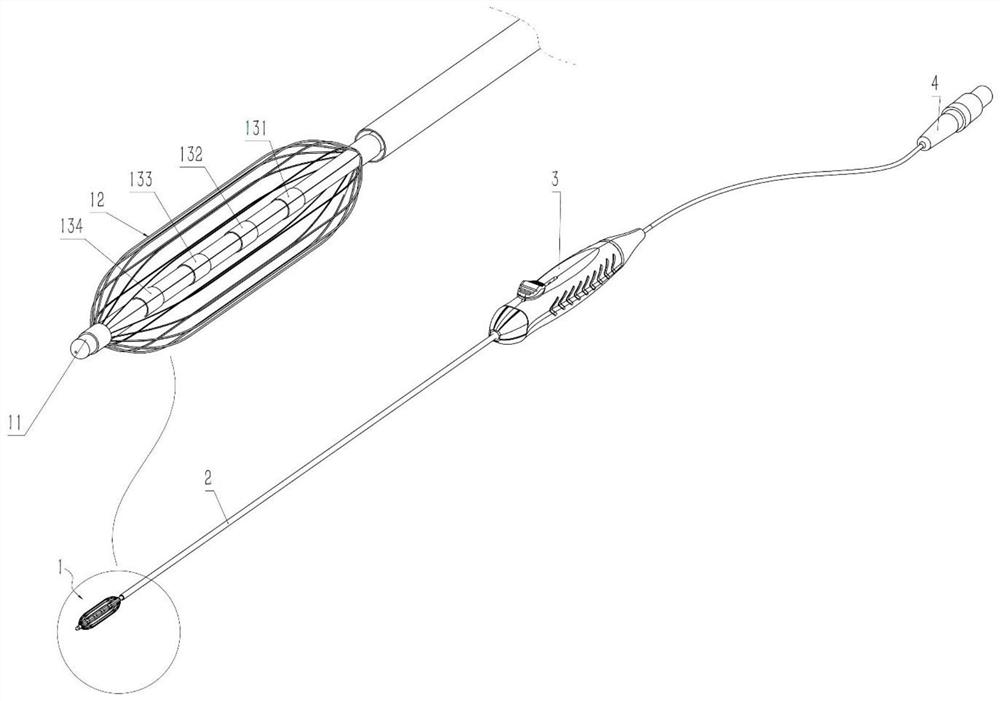
图1是根据本申请一些实施例所示的脉冲场消融导管及设备的整体结构示意图;
图2是根据本申请一些实施例所示的弹性变形体处于收缩状态的脉冲场消融导管的结构示意图;
图3是根据本申请另一实施例所示的脉冲场消融导管及设备的整体结构示意图;
图4是根据本申请另一实施例所示的弹性变形体处于扩张状态的脉冲场消融导管的结构示意图;
图5是根据本申请一些实施例所示的脉冲场消融场景示意图;
图6是根据本申请另一实施例所示的脉冲场消融场景示意图;
图7是根据本申请又一实施例所示的脉冲场消融导管及消融场景示意图;
图8是根据本申请一些实施例所示的包含控弯机构的控制手柄结构示意图;
图9是根据本申请一些实施例所示的控弯机构左旋转的结构示意图;
图10是根据本申请一些实施例所示的控弯机构右旋转的结构示意图;
图11是根据本申请一些实施例所示的脉冲场消融控制方法的示例性流程图;
图12是根据本申请一些实施例所示的脉冲场消融控制系统的模块图;
图13是根据本申请一些实施例所示的病变组织特征确定模型训练方法的示例性流程图;
图14是根据本申请一些实施例所示的消融参数确定模型训练方法的示例性流程图。
图中,1为内管前端,2为外管,3为控制手柄,31为控制按钮,31’为控制按钮处于后端状态,31a为控制按钮处于后端状态,4为线缆插头,11为内管,12为弹性变形体,121为前端固定环,122为后端固定环,131为1号电极,132为2号电极,133为3号电极,134为4号电极,5为支气管镜,51为内管通道,6为组织管腔,61为病变组织,7为控弯旋钮,7a为控弯旋钮左旋转状态,7b为控弯旋钮右旋转状态,11a为内管左弯曲状态,11b为内管右弯曲状态,2a为外管左弯曲状态,2b为外管右弯曲状态,12a为第一弹性变形体,12b为第二弹性变形体,13c为5号电极,13d为6号电极,14为脉冲场区域。
具体实施方式
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本申请,并不用于限定本申请。相反,本申请涵盖任何由权利要求定义的在本申请的精髓和范围上做的替代、修改、等效方法以及方案。进一步,为了使公众对本申请有更好的了解,在下文对本申请的细节描述中,详尽描述了一些特定的细节部分。对本领域技术人员来说没有这些细节部分的描述也可以完全理解本申请。
由于本申请产品摆放的位置可以随意发生变化,本申请中所述的“上”、“下”、“左”、“右”、“前”、“后”等方位词,只表示相对的位置关系,而不用于限定绝对的位置关系。此外,本申请中所述的“前端”是指远离手术操作者的一端,“后端”是指接近手术操作者的一端。
本申请中使用了流程图用来说明根据本申请的实施例的系统所执行的操作。应当理解的是,流程图中前面或后面操作不一定按照顺序精确地执行。相反,可以按照倒序或同时处理各个步骤。同时,也可以将其他操作添加到这些过程中,或从这些过程移除某一步或数步操作。
本申请实施例涉及一种脉冲场消融导管和设备。脉冲场消融导管和设备能够用于对病变组织进行消融。在一些实施例中,脉冲场消融导管和设备能够用于对人体不同部位的多种病变组织(如病灶)进行消融。例如,脉冲场消融导管和设备能够用于气管、支气管、肠道(如大肠、小肠、十二指肠等)、胆囊、心脏等部位的病灶消融。又例如,脉冲场消融导管和设备能够用于支气管炎、肺气肿、支气管腺体增生肥大、房颤、局部增生肿瘤等相关病灶的消融。下文将以慢性阻塞性肺疾病(COPD)为例对脉冲场消融导管和设备的消融原理进行说明。
慢性阻塞性肺疾病(COPD)是一种具有气流阻塞特征的慢性支气管炎和/或肺气肿,可进一步发展为肺心病和呼吸衰竭的常见慢性疾病。临床研究发现中性粒细胞、巨噬细胞、T淋巴细胞等炎症细胞均参与了COPD的发病过程,气道、肺实质及肺血管的慢性炎症是COPD的明显特征。中性粒细胞的活化和聚集是COPD炎症过程的一个重要环节,通过释放中性粒细胞弹性蛋白酶、中性粒细胞组织蛋白酶G、中性粒细胞蛋白酶3和基质金属蛋白酶引起慢性黏液高分泌状态并破坏肺实质。
炎症带来的组织感染是COPD发生发展的重要因素。COPD的病理改变主要表现为慢性支气管炎及肺气肿的病理变化。支气管黏膜上皮细胞变性、坏死,溃疡形成。纤毛倒伏、变短、不齐、粘连,部分脱落。缓解期黏膜上皮修复、增生、鳞状上皮化生和肉芽肿形成。杯状细胞数目增多肥大,分泌亢进,腔内分泌物储留。基底膜变厚坏死。支气管腺体增生肥大,腺体肥厚与支气管壁厚度比值常大于0.55-0.79(正常小于0.4)。各级支气管壁均有多种炎症细胞浸润,以中性粒细胞、淋巴细胞为主。急性发作期可见到大量中性粒细胞,严重者为化脓性炎症,黏膜充血、水肿、变性坏死和溃疡形成,基底部肉芽组织和机化纤维组织增生导致管腔狭窄。炎症导致气管壁的损伤-修复过程反复发生,进而引起气管结构重塑、胶原含量增加及瘢痕形成,这些病理改变是COPD气流受限的主要病理基础之一。肺气肿的病理改变可见肺过度膨胀,弹性减退。外观灰白或苍白,表面可见多个大小不一的大疱。镜检见肺泡壁变薄,肺泡腔扩大、破裂或形成大疱,血液供应减少,弹力纤维网破坏。细支气管壁有炎症细胞浸润,管壁黏液腺及杯状细胞增生、肥大,纤毛上皮破损、纤毛减少。有的管腔纤细狭窄或扭曲扩张,管腔内有痰液存留。细支气管的血管内膜可增厚或管腔闭塞。
按累及肺小叶的部位,可将阻塞性肺气肿分为小叶中央型、全小叶型及介于两者之间的混合型三类。其中以小叶中央型为多见。小叶中央型是由于终末细支气管或一级呼吸性细支气管炎症导致管腔狭窄,其远端的二级呼吸性细支气管呈囊状扩张,其特点是囊状扩张的呼吸性细支气管位于二级小叶的中央区。全小叶型是呼吸性细支气管狭窄,引起所属终末肺组织,即肺泡管、肺泡囊及肺泡的扩张,其特点是气肿囊腔较小,遍布于肺小叶内。有时两型同时存在一个肺内称混合型肺气肿。多在小叶中央型基础上,并发小叶周边区肺组织膨胀。
慢性阻塞性肺疾病的临床表现是肺部气管腔狭窄、闭塞,形成肺大疱堵塞气管,外科治疗时临床医生一般利用支气管镜和外科器械对肺大疱进行切除,但术后往往慢阻肺急性加重、肺炎和咯血情况相对较多,不能延长患者寿命。在对慢性阻塞性肺疾病(COPD)进行治疗时,也会采用射频消融技术,即对病变组织冷消融或热消融,但都会损伤气管。例如,通过高温使气管处的蛋白组织变性,从而达到消融病变组织的效果,但消融过程中高温可能会导致气管碳化,气管被烧塌。
本申请实施例所涉及的脉冲场消融导管和设备可以消融人体支气管内部的病灶。与外科切除、外科消融(例如微波、射频)术不同,脉冲场消融导管可以采用的进入人体肺部的通路是人体上呼吸道气管,因此不会贯穿气管与肺叶,不会形成气胸,不会导致针道烧伤、咳血、胸腔积液、肺炎等并发症。本申请实施例的脉冲场消融导管具有柔顺可变形的弹性网状支撑部件(如弹性变形体),弹性网状支撑部件可自适应肺部气管、支气管的管腔结构,使得消融电极布置在病灶气管的周边时,保证人在呼吸时电极仍然可以与病灶保持相对静止,镂空的网状支撑部件具有弹性,其能够自适应贴靠人体的组织管腔,镂空的球网状的支撑结构能够更利于导管的定位。弹性网状支撑部件(如弹性变形体)扩张后可贴靠撑起气管内的病变组织,镂空的弹性变形体可以使人体气管内的组织液渗入接触至电极。在一些实施例中,电极(或电极的一部分)布置在弹性变形体中部,弹性变形体扩张后,电极自然的被布置在了病变组织的中心部位。通过高压放电,非接触的电场能量覆盖病变组织,不需要像射频消融那样需要贴靠病变组织就能够实现消融。高压电场对病变组织具有选择性,未病变组织在经过高压电场时不会被消融,中性粒细胞、巨噬细胞、T淋巴细胞等炎症细胞均参与了COPD发病过程,这类细胞对电场更敏感,更容易吸收电场能量被消融掉。因此,本申请实施例的脉冲场消融导管和设备能够直接作用于肺部气管内的病变组织,有效实现对COPD的治疗,同时由于脉冲场消融不会产生高温,不会使得气管碳化或者被烧塌陷。
图1是根据本申请一些实施例所示的脉冲场消融导管及设备的整体结构示意图;图2是根据本申请一些实施例所示的弹性变形体处于收缩状态的脉冲场消融导管的结构示意图;图3是根据本申请另一实施例所示的脉冲场消融导管及设备的整体结构示意图;图4是根据本申请另一实施例所示的弹性变形体处于扩张状态的脉冲场消融导管的结构示意图;图5是根据本申请一些实施例所示的脉冲场消融场景示意图;图6是根据本申请另一实施例所示的脉冲场消融场景示意图;图7是根据本申请又一实施例所示的脉冲场消融导管及消融场景示意图。以下将结合附图1-7对本申请实施例所涉及的脉冲场消融导管及设备进行详细说明。值得注意的是,以下实施例仅仅用以解释本申请,并不构成对本申请的限定。
图1为根据本申请一些实施例所示的脉冲场消融导管及设备的整体结构示意图,其中对内管前端1进行了放大展示。在一些实施例中,如图1所示,脉冲场消融导管可以包括内管11和弹性变形体12。弹性变形体12设置在内管11的前端,其中,前端可以指远离手术操作者的一端。在一些实施例中,弹性变形体12的至少一端与内管11固连。例如,弹性变形体12的至少一端可以通过焊接、卡接、粘接、热熔接、螺纹连接或一体成型等方式与内管11实现固连。弹性变形体12的中部能够扩张或收缩,当弹性变形体12收缩时,弹性变形体12的内表面至少部分与内管11相贴合。弹性变形体12的中部可以理解为弹性变形体12沿其长度方向的中间部分。如图2或图5所示为弹性变形体12处于收缩状态的示意图。在图2或图5的所示的实施例中,弹性变形体12的内表面可以在收缩状态下与内管11完全贴合,从而能够有效减小弹性变形体12处于收缩状态时脉冲场消融导管所占的体积。在一些实施例中,当弹性变形体12收缩时,弹性变形体12的内表面可以不与内管11完全贴合。在一些实施例中,当弹性变形体12收缩时,弹性变形体12可以呈圆柱形。
在一些实施例中,弹性变形体12可以为镂空的网状结构。通过将弹性变形体12设置为镂空的网状结构,可以使液体(如组织液)能够流入弹性变形体12内,从而更好地实现病变组织的消融。此外,镂空的弹性变形体12能够便于脉冲场消融导管的定位,以及便于利用内窥镜、X射线等手段对病变组织进行观察。在一些实施例中,弹性变形体12可以由能够产生弹性形变的材料制成,弹性变形体12可以在受到外力时扩张或收缩。弹性变形体12扩张或收缩可以理解为弹性变形体12的至少一部分(如中部)的横截面扩大或缩小。在一些实施例中,弹性变形体12的材料可以包括但不限于金属材料(如弹簧钢、镍钛合金等)、塑料(如高弹性尼龙材料等)、热塑性弹性体(如TPU、TPS等)等。在一些实施例中,弹性变形体12可以由丝状原材料编织形成。例如,弹性变形体12可以由镍钛合金丝编织形成。在一些实施例中,弹性变形体12可以由管体材料切割形成。例如,弹性变形体12可以由镍钛合金管通过激光切割或水切割等方式切割形成。在一些实施例中,网状结构且具有弹性的弹性变形体12能够自适应贴靠人体的组织管腔,并能够使得脉冲场消融导管的电极位置与病变组织对应并保持相对静止,从而增强消融病变组织的效果。
在一些实施例中,脉冲场消融导管可以包括外管2,外管2套设在内管11外,内管11能够相对于外管2移动(如沿内管/外管的轴线方向移动)。在一些实施例中,内管11和外管2之间的相对移动能够控制内管11前端的弹性变形体12扩张和/或收缩。在一些实施例中,内管和/或外管可以由绝缘材料制成,且制成后的内管和外管均具有一定弹性,能够受力弯曲且不易弯折变形。在一些实施例中,内管11和/或外管2可以由高分子绝缘材料制成。高分子绝缘材料可以包括但不限于聚氨酯(PU)、聚乙烯(PE)、聚醚嵌段聚酰胺(PEBAX)等中的一种或多种的组合。在一些实施例中,内管11和外管2的材料可以相同或不同。
在一些实施例中,如图1-2所示,弹性变形体12的两端可以均与内管11固连。弹性变形体12的两端与内管11固连的方式可以包括但不限于焊接、卡接、粘接、热熔接、螺纹连接等一种或多种的组合。在一些实施例中,弹性变形体12在自然状态下可以处于扩张状态。弹性变形体12的中部能够在伸出外管2时自动扩张,且弹性变形体12的中部能够在缩进外管2内时自动收缩。其中,弹性变形体12在扩张状态下其中部的直径大于外管2的直径;弹性变形体12在收缩状态下其中部的直径小于外管2的直径。通过将弹性变形体12的两端固连在内管11上,内管11与外管2通过相对移动便能够带动弹性变形体12伸出或缩进外管2,从而控制弹性变形体12自动扩张或收缩,控制方式简便、稳定性高。在一些实施例中,当弹性变形体12收缩时,其直径可以为0.3~3mm(如0.3mm、0.5mm、0.7mm、1mm、2mm、3mm等)。外管2内壁的直径可以略大于弹性变形体12收缩时的直径。例如,外管2内壁的直径可以为0.4~3.5mm(如0.4mm、0.6mm、0.8mm、1.2mm、2.2mm、3.5mm等)。当弹性变形体12扩张时,其扩张后的最大直径可以为5~40mm(如5mm、8mm、15mm、25mm、40mm等)。在一些实施例中,内管11和外管的尺寸,以及弹性变形体12的尺寸可以根据消融部位、病变组织类型、患者年龄等进行适应性调整,本申请对此不做限制。
在一些实施例中,如图1所示,在扩张状态下弹性变形体12的中部至少部分呈圆柱形,该圆柱形的两端至弹性变形体12两端的直径逐渐变小。通过扩张状态下弹性变形体12的中部至少部分呈圆柱形的设计,可以使得弹性变形体12在扩张时贴靠组织管腔的力更均匀,从而不容易对人体的组织管腔造成伤害。在一些实施例中,弹性变形体12可以由第一管体(如镍钛合金管、高弹性尼龙管等)切割成型。第一管体的直径可以与弹性变形体12的中部在扩张状态下的直径相同。在一些实施例中,可以对第一管体切割后的结构进行热处理(如热处理定型)、两端收拢、两端固定等操作,从而形成弹性变形体12。通过利用第一管体切割形成弹性变形体12,弹性变形体12在扩张状态下其中部可在自身弹力作用下自动扩张至第一管体(或热处理定型后的结构)的直径大小。在一些替代性实施例中,第一管体的直径可以大于或小于弹性变形体12的中部在扩张状态下的直径。在一些实施例中,弹性变形体12可以由丝状原材料(如镍钛合金丝)编织形成。在一些实施例中,弹性变形体12可以形成为其他形状。在一些实施例中,弹性变形体12在扩张状态下其中部的直径最大,且弹性变形体12由中部向两端直径不断变小。在一些实施例中,弹性变形体12在扩张状态的形状可以为纺锤状、椭球状等。
在一些实施例中,如图3-4所示,弹性变形体12的前端可以与内管11固连,弹性变形体12的后端可以与外管2的前端固连。内管11和外管2能够相对移动以控制弹性变形体12扩张或收缩。在一些实施例中,弹性变形体12前端与内管11固连的方式以及后端与外管2固连的方式可以包括但不限于焊接、卡接、粘接、热熔接、螺纹连接等一种或多种的组合。在一些实施例中,如图3所示,弹性变形体12的前端可以通过前端固定环121与内管11固连;弹性变形体12的后端可以通过后端固定环122与外管2的前端固连。
在一些实施例中,如图3所示,弹性变形体12的后端可以与外管2前端的内壁固连。在一些实施例中,弹性变形体12的后端可以与外管2前端的外壁固连。在一些实施例中,弹性变形体12的后端可以与外管2前端的端部固连。通过将弹性变形体12的前端与内管11固连、后端与外管2前端固连,内管11与外管2通过相对移动能够带动弹性变形体12两端之间距离的变化。当弹性变形体12处于收缩状态时,其两端的距离可以为最大。当弹性变形体12两端的距离由最大逐渐变小时,弹性变形体12将受到挤压从而使得弹性变形体12的中部能够逐渐扩张。在本实施例中,内管11与外管2的相对移动能够准确控制弹性变形体12两端的距离,从而能够准确调节弹性变形体12中部的扩张程度,使得脉冲场消融导管能够适用于不同的组织管腔和/或病变组织。
在一些实施例中,弹性变形体12可以由第二管体(如镍钛合金管、高弹性尼龙管等)切割成型,第二管体的直径可以与弹性变形体12的中部在收缩状态下的直径相同。在一些实施例中,可以对第二管体切割后的结构进行热处理(如热处理定型)、两端固定等操作,从而形成弹性变形体12。通过利用第二管体切割形成弹性变形体12,弹性变形体12在收缩状态下可与内管更好地贴合,从而能够降低脉冲场消融导管在输送过程中划伤组织管腔的风险。与此同时,第二管体的直径较小,能够在一定程度上节省弹性变形体12的制造材料。在一些替代性实施例中,第二管体的直径可以大于或小于弹性变形体12的中部在收缩状态下的直径。在一些实施例中,弹性变形体12可以由丝状原材料(如镍钛合金丝)编织形成。在一些实施例中,如图4所示,弹性变形体12在扩张状态下其中部的直径最大,且弹性变形体12由中部向两端直径不断变小。在一些实施例中,弹性变形体12在扩张状态的形状可以为纺锤状、椭球状等。在一些实施例中,在扩张状态下弹性变形体12的中部可以至少部分呈圆柱形,该圆柱形的两端至弹性变形体12两端的直径逐渐变小。
在一些实施例中,弹性变形体12的一端可以与内管11固连,弹性变形体12的另一端可以相对于内管11活动连接。具体的,弹性变形体12的前端可以与内管11固连,弹性变形体12的后端可以活动套设在内管11外部。弹性变形体12在自然状态可以处于收缩状态。在本实施例中,脉冲场消融导管在输送进入组织管腔时,弹性变形体12可以收缩在外管2的内部,以避免对组织管腔造成伤害。当脉冲场消融导管输送至指定位置时,内管11可以相对于外管2移动以带动弹性变形体12伸出外管2。当弹性变形体12伸出外管2后,弹性变形体12的后端(或与后端固连的限位部件)能够与外管2的前端相卡接,以防止弹性变形体12缩回至外管2中。在弹性变形体12伸出外管2后,内管11与外管2的相对移动能够带动弹性变形体12两端之间距离的变化,从而控制弹性变形体12扩张或收缩。
在一些实施例中,如图1-5所示,内管11外侧可以间隔设置至少两个环状电极。例如,内管11外侧间隔设置的电极数量可以包括2个、3个、4个、6个、8个等。在一些实施例中,环状电极可以环绕设置在内管11的外侧。环状电极与内管11的连接方式可以包括但不限于焊接、卡接、胶接、一体成型等。环状电极的长度可以为0.4~20mm(如0.4mm、0.6mm、0.8mm、1mm、3mm、10mm、20mm等)。在一些实施例中,相邻两个环状电极可以分别连接能量发生器(图中未示出)的正极和负极。每个环状电极可以通过导线与能量发生器的正极或负极连接。在一些实施例中,导线可以为漆包线,漆包线具有电绝缘特性,其可耐压大于等于500V。导线可以从内管11内部走线,也可以从内管11和外管2之间走线,还可以嵌入在内管壁中。在一些实施例中,如图1-5所示,内管11外侧可以间隔设置4个环状电极,分别为:1号电极131、2号电极132、3号电极133和4号电极134。在一些实施例中,如图5所示,1号电极131和3号电极133可以连接能量发生器的正极,2号电极132和4号电极134可以连接能量发生器的负极。在图5所示的实施例中,脉冲场消融导管可以用于对组织管腔6(如支气管)内的病变组织61进行消融。在消融过程中,可以使弹性变形体12扩张并贴靠病变组织61,然后对4个环状电极通电以形成脉冲场,该脉冲场的区域能够覆盖病变组织61,从而实现了对病变组织61的消融。在一些实施例中,通过设置环状电极,可以使得电极之间所形成的脉冲场更均匀,从而实现更好的消融效果。在一些实施例中,内管11外侧所设置的电极中的部分或全部可以为非环状的电极。在一些实施例中,可以仅在内管11的某一侧间隔设置电极片,从而使得电极片之间所形成的脉冲场能够有针对性的对某一侧的病变组织进行消融。在一些实施例中,可以在内管11的多侧(如两侧、3侧)分别间隔设置电极片,从而使得电极片之间所形成的脉冲场能够对多侧的病变组织进行消融。
在一些实施例中,环状电极(如1号电极131、2号电极132、3号电极133和4号电极134等)可以位于弹性变形体12内部。通过将环状电极设置在弹性变形体12内部,可以便于利用内窥镜、X射线成像、超声成像等手段对病变组织及环状电极的相对位置进行观察,以更准确的对病变组织进行消融。同时,通过将环状电极设置在弹性变形体12内部,当弹性变形体12在组织管腔内处于扩张状态时,环状电极将处于组织管腔的居中位置。居中放置的环状电极可以让所产生的消融电场均匀分布在组织管腔的病变组织中心,并均匀覆盖病变组织,从而能够减小手术难度,降低医生操作时对位置布置准确度的要求。在一些替代性实施例中,环状电极可以部分或全部设置在弹性变形体12的两端或外部。
在一些实施例中,内管11外侧可以间隔设置多个环状电极(如三个及以上),多个环状电极之间可以等间隔设置或不等间隔设置。在一些实施例中,多个环状电极之间的间隔可以大于或等于0.3mm(如0.3mm、0.5mm、0.8mm、1mm、2mm等)。在一些实施例中,内管11外侧所有的环状电极可以同时通电,从而在各个环状电极之间均能够形成脉冲电场,以用于对脉冲电场所覆盖的病变组织进行消融。在一些实施例中,多个环状电极可以分别连接至能量发生器的同一个正极或同一个负极,从而可以简便地实现所有环状电极同时通电。在一些实施例中,可以对内管11外侧的任意两个相邻环状电极进行通电,从而仅在通电的环状电极之间(或周围一定范围内)形成脉冲电场,以用于对特定位置的病变组织进行消融。在一些实施例中,多个环状电极可以分别连接至能量发生器上不同的正极或负极,从而可以通过能量发生器对内管11外侧的任意两个相邻环状电极进行通电。例如,每个环状电极可以通过单独的导线连接至能量发生器上不同的正极或负极。
在一些实施例中,内管11外侧可以设有至少一个环状电极(如1个、2个、3个、4个、5个、8个等),环状电极位于弹性变形体12内部,弹性变形体12由金属材料(如弹簧钢、镍钛合金等)制成,具有导电性。在一些实施例中,环状电极和弹性变形体12可以分别连接能量发生器的正极和负极。在一些实施例中,如图6所示,环状电极(如1号电极131、2号电极132、3号电极133和4号电极134)可以与能量发生器的正极连接,弹性变形体12与能量发生器的负极连接。在一些实施例中,环状电极可以与能量发生器的负极连接,弹性变形体12与能量发生器的正极连接。在一些实施例中,每个环状电极可以通过导线(如漆包线)与能量发生器的正极或负极连接。弹性变形体12可以通过导线与能量发生器的负极或正极连接。在一些实施例中,部分或全部导线可以从内管11内部走线,或者可以从内管11和外管2之间走线,或者可以嵌入在内管壁中。通过将弹性变形体12连接能量发生器的一极,弹性变形体12与环状电极之间(或周围一定范围内)能够形成脉冲电场,从而实现对病变组织的消融。在图6所示的实施例中,脉冲场消融导管可以用于对组织管腔6(如支气管)内的病变组织61进行消融。在消融过程中,可以使弹性变形体12扩张并贴靠病变组织61,然后对4个环状电极和弹性变形体12通电以形成脉冲场,该脉冲场区域能够覆盖病变组织61,从而实现了对病变组织61的消融。在一些实施例中,由于弹性变形体12能够扩张并贴靠组织管腔内壁或病变组织,可以使得将弹性变形体12作为电极的方式消融得更深。例如,将弹性变形体12作为电极的方式能够对距离管腔内壁(如气管壁)一定范围(如10mm、15mm等)内的病变组织进行消融,从而可以消融到距离管腔内壁较远的病变组织。在一些实施例中,通过将弹性变形体12作为电极贴靠于管腔内壁(如气管壁),脉冲场消融设备能够准确检测出组织的阻抗,从而分辨出不同的病变组织并进行有针对性的消融(如根据病变组织的耐受程度设定相应的脉冲电压),进而提升病变组织的消融效果。
在一些实施例中,内管11外侧可以设有至少两个环状电极(如2个、3个、4个、5个、8个等),该至少两个环状电极均与能量发生器的其中一极(如正极或负极)连接;弹性变形体12与能量发生器的另一极(如负极或正极)连接。在一些实施例中,内管11外侧所有的环状电极以及弹性变形体12可以同时通电,从而在各个环状电极与弹性变形体12之间均能够形成脉冲电场,以用于对脉冲电场所覆盖的病变组织进行消融。在一些实施例中,至少两个环状电极可以均连接至能量发生器的同一个正极或同一个负极,从而可以简便地实现所有环状电极和弹性变形体12同时通电。在一些实施例中,可以对内管11外侧的任意环状电极与弹性变形体12进行通电,从而仅在通电的环状电极与弹性变形体12之间(或周围一定范围内)形成脉冲电场,以用于对特定位置的病变组织进行消融。在一些实施例中,至少两个环状电极可以分别连接至能量发生器上不同的正极(或不同的负极),从而可以通过能量发生器对弹性变形体12和任意的一个或多个环状电极进行通电。
在一些实施例中,如图7所示,脉冲场消融导管可以包括内管11和至少两个弹性变形体12(如2个、3个、4个等),至少两个弹性变形体12沿内管11的长度方向间隔设置在内管11的前端。如图7所示,至少两个弹性变形体12可以包括第一弹性变形体12a和第二弹性变形体12b。第一弹性变形体12a和第二弹性变形体12b的两端均与内管11固连。第一弹性变形体12a和第二弹性变形体12b在自然状态下可以处于扩张状态。第一弹性变形体12a和第二弹性变形体12b的中部能够在伸出外管2时自动扩张,且能够在缩进外管2内时自动收缩。在一些实施例中,内管11外侧可以间隔设置至少两个环状电极,相邻两个环状电极分别连接能量发生器的正极和负极。如图7所示,内管11外侧可以间隔设置5号电极13c和6号电极13d,5号电极13c与能量发生器的正极连接,6号电极13d与能量发生器的负极连接。在一些实施例中,至少两个环状电极所形成的脉冲场区域能够覆盖至少两个弹性变形体(如第一弹性变形体12a和第二弹性变形体12b)的间隔区域。在利用脉冲场消融导管对病变组织进行消融时,可以将病变组织置于至少两个弹性变形体的间隔区域,从而通过至少两个环状电极所形成的脉冲电场对病变组织进行消融。通过设置至少两个弹性变形体12,可以使得弹性变形体12的支撑定位效果更佳。通过将病变组织置于至少两个弹性变形体的间隔区域,可以避免弹性变形体12可能产生的阻挡,使得病变组织与环状电极更贴近,进而提升消融效果。在一些实施例中,至少两个环状电极可以分别位于至少两个弹性变形体12内部,从而使得至少两个环状电极所形成的脉冲场区域能够覆盖至少两个弹性变形体12的间隔区域。例如,如图7所示,5号电极13c可以位于第一弹性变形体12a内,6号电极13d可以位于第二弹性变形体13d内。在图7所示的实施例中,脉冲场消融导管可以用于对组织管腔6(如支气管)内的病变组织61进行消融。在消融过程中,可以使第一弹性变形体12a和第二弹性变形体12b扩张并分别支撑定位在病变组织61的两端,然后对5号电极13c和6号电极13d通电以形成脉冲场区域14,该脉冲场区域14能够覆盖位于第一弹性变形体12a和第二弹性变形体12b之间的病变组织61,从而实现了对病变组织61的消融。在一些替代性实施例中,至少两个弹性变形体12可以分别与能量发生器的其中一极(如正极或负极)连接,且至少两个弹性变形体12可以分别与其内部的环状电极形成脉冲电场以消融对应位置的病变组织。
本申请实施例还涉及一种脉冲场消融设备。在一些实施例中,如图1-4所示,脉冲场消融设备可以包括脉冲场消融导管和控制手柄3。在一些实施例中,脉冲场消融设备可以包括本申请任一实施例所述的脉冲场消融导管。例如,脉冲场消融导管可以包括内管11、弹性变形体12和外管2;弹性变形体12设置在内管11的前端,弹性变形体12的至少一端与内管11固连,弹性变形体12的中部能够扩张或收缩,当弹性变形体12收缩时,弹性变形体12的内表面至少部分与内管11相贴合;外管2套设在内管11外,内管11能够相对于外管2移动。在一些实施例中,控制手柄3可以用于控制内管11和外管2相对移动从而控制弹性变形体12的中部扩张或收缩。
在一些实施例中,控制手柄3可以包括外壳和控制按钮31,控制按钮31能够相对于外壳滑动。在一些实施例中,控制手柄3的外壳可以为长条形结构,控制按钮31相对于外壳滑动的方向可以与外壳的长度方向一致,从而便于操作控制手柄3以控制内管11和外管2相对移动。在一些实施例中,外壳的一侧可以设有滑槽,控制按钮31可以与滑槽滑动连接,从而使得控制按钮31能够相对于外壳滑动。在一些实施例中,内管11或外管2中的一者可以与控制按钮31相连(如胶接、焊接、卡接等),内管11或外管2中的另一者可以与外壳相连(如胶接、焊接、卡接等);控制按钮31相对于外壳滑动能够带动内管11和外管2相对移动。
在一些实施例中,如图1-2所示,内管11(如内管11的后端)可以与控制按钮31相连,外管2(如外管2的后端)可以与外壳相连,当控制按钮31相对于外壳滑动时,与其相连的内管11可相对于外管2移动,从而使得内管11前端的弹性变形体12从外管2中伸出或缩入外管2中。如图2所示,控制按钮31和31’可以为滑动的两种状态,分别对应控制按钮31滑动至前端和后端的状态。在一些实施例中,当控制按钮31由后端滑动至前端时,内管11的前端可以从外管2中移出,内管11前端上设置的弹性变形体12可以从外管2中伸出并在自身的弹力作用下扩张。在实际应用场景中,当外管2前端伸入至组织管腔的指定位置时,医务人员可以通过推动控制按钮31使其从后端滑动至前端,从而控制弹性变形体12伸出并扩张以在指定位置支撑定位。在一些实施例中,当控制按钮31由前端滑动至后端时,内管11的前端可以移动至外管2中,设置在内管11前端的弹性变形体12可以在外管2内壁的限制下收缩并随着内管11移动至外管2中。在实际应用场景中,在对患者治疗完毕后,医务人员可以通过推动控制按钮31使其从前端滑动至后端,以控制弹性变形体12缩入外管2内,然后再将脉冲场消融导管(如包括外管2和内管11)从组织管腔中取出,从而可以避免贴靠于组织管腔内壁的弹性变形体12在移动时对组织管腔内壁造成损伤。在一些替代性实施例中,外管2(如外管2的后端)可以与控制按钮31相连,内管11(如内管11的后端)可以与外壳相连,当控制按钮31相对于外壳滑动时,与其相连的外管2可相对于内管11移动,从而使得内管11前端的弹性变形体12从外管2中伸出或缩入外管2中。
在一些实施例中,如图3-4所示,内管11(如内管11的后端)可以与控制按钮31相连,外管2(如外管2的后端)可以与外壳相连,当控制按钮31相对于外壳滑动时,与其相连的内管11可相对于外管2移动,从而控制弹性变形体12扩张或收缩。在图3-4所示的实施例中,弹性变形体12的前端可以与内管11固连,弹性变形体12的后端可以与外管2的前端固连。在一些实施例中,如图4所示,控制按钮31和31a可以为滑动的两种状态,分别对应控制按钮31滑动至前端和后端的状态。在一些实施例中,当控制按钮31处于前端时,弹性变形体12可以处于收缩状态(如图3所示),弹性变形体12两端的距离可以为最大。在控制按钮31由前端向后端滑动的过程中,弹性变形体12两端的距离可以由最大逐渐变小,弹性变形体12将受到挤压从而使得弹性变形体12的中部能够逐渐扩张。当控制按钮31处于后端时,弹性变形体12可以处于扩张状态(如图4所示)。在实际应用场景中,当内管11和外管2伸入组织管腔的过程中,控制按钮31可以一直处于前端位置,此时弹性变形体12保持收缩状态。当内管11前端伸入至组织管腔的指定位置时,医务人员可以通过推动控制按钮31使其从前端滑动至后端,从而控制弹性变形体12扩张以实现在指定位置支撑定位。在对患者治疗完毕后,医务人员可以通过推动控制按钮31使其从后端滑动至前端,以控制弹性变形体12收缩,然后再将脉冲场消融导管(如包括外管2和内管11)从组织管腔中取出,从而可以避免弹性变形体12在移动时对组织管腔内壁造成损伤。在一些实施例中,医务人员可以推动控制按钮31在滑槽的多个位置或任意位置停留,从而能够调节弹性变形体12中部的扩张程度,使得脉冲场消融导管能够适用于不同的组织管腔和/或病变组织。在一些实施例中,控制按钮31与滑槽之间可以设有限位机构,当控制按钮31在滑槽的多个位置或任意位置停留时,限位机构能够限制控制按钮31与滑槽的相对移动,从而能够避免消融过程中控制按钮31的不必要的移动。在一些实施例中,限位机构可以包括但不限于卡扣结构、阻尼结构、磁吸结构等一种或多种的组合。在一些替代性实施例中,外管2(如外管2的后端)可以与控制按钮31相连,内管11(如内管11的后端)可以与外壳相连,当控制按钮31相对于外壳滑动时,与其相连的外管2可相对于内管11移动,从而控制弹性变形体12扩张或收缩。
在一些实施例中,脉冲场消融设备可以包括能量发生器。能量发生器可以用于对电极施加高压,以形成脉冲场(或称作脉冲电场)。在一些实施例中,电极(如环状电极、弹性变形体12)可以通过导线与能量发生器的正极或负极连接。在一些实施例中,如图1所示,多条导线可以通过线缆插头4与能量发生器连接。在一些实施例中,内管11外侧可以间隔设置至少两个环状电极,相邻两个环状电极分别连接能量发生器的正极和负极。在一些实施例中,内管11外侧可以间隔设置至少三个环状电极,能量发生器能够控制任意两个相邻的环状电极之间形成脉冲场。例如,能量发生器可以控制对任意两个相邻的环状电极进行通电。又例如,能量发生器可以控制对所有环状电极同时通电。通过对内管11外侧的任意两个相邻环状电极进行通电,可以实现仅在通电的环状电极之间(或周围一定范围内)形成脉冲电场,以用于对特定位置的病变组织进行针对性消融。在一些实施例中,内管外侧可以设有至少一个环状电极,该至少一个环状电极位于弹性变形体12的内部;弹性变形体由金属材料制成。在一些实施例中,该至少一个环状电极与能量发生器的正极连接,弹性变形体12与能量发生器的负极连接;或者,该至少一个环状电极与能量发生器的负极连接,弹性变形体12与所述能量发生器的正极连接。通过将环状电极与弹性变形体12分别与能量发生器的正负极进行连接,能量发生器可以控制环状电极与弹性形变体12之间形成脉冲电场,从而对相应位置的病变组织进行消融。在一些实施例中,内管11外侧可以设有至少两个环状电极,能量发生器能够控制任意的环状电极与弹性变形体12之间形成脉冲场。例如,能量发生器可以控制对任意的环状电极和弹性变形体12进行通电。又例如,能量发生器可以控制对所有环状电极和弹性变形体12进行通电。通过对内管11外侧的任意环状电极与弹性变形体12进行通电,可以实现仅在通电的环状电极与弹性变形体12之间(或周围一定范围内)形成脉冲电场,以用于对特定位置的病变组织进行针对性消融;并且可以在不移动脉冲场消融导管的情况下灵活调节消融部位。
图8是根据本申请一些实施例所示的包含控弯机构的控制手柄结构示意图;图9是根据本申请一些实施例所示的控弯机构左旋转的结构示意图;图10是根据本申请一些实施例所示的控弯机构右旋转的结构示意图。在一些实施例中,如图8-10所示,控制手柄3可以包括控弯机构,控弯机构可以用于控制外管2的前部弯曲。在一些实施例中,如图8-10所示,控弯机构可以包括控弯旋钮7,当控弯旋钮7旋转至不同状态时,外管2的前部可以朝不同方向弯曲。例如,如图8所示,当控弯旋钮7旋转至左旋转状态7a时,外管2的前部可以向左弯曲以达到外管左弯曲状态2a,内管11可以随着外管2弯曲以达到内管左弯曲状态11a。又例如,如图9所示,当控弯旋钮7旋转至右旋转状态7b时,外管2的前部可以向右弯曲以达到外管右弯曲状态2b,内管11可以随着外管2弯曲以达到内管右弯曲状态11b。在一些实施例中,控弯旋钮7可以通过牵引绳控制外管2的前部弯曲。例如,控弯旋钮7可以与两条牵引绳的一端连接,两条牵引绳的另一端可以分别与外管2前端的左右两侧相连,当控弯旋钮7向左或向右旋转时,控弯旋钮7可以分别拉动不同的牵引绳,从而控制外管2的前部向左或向右弯曲。在一些实施例中,外管2前部的结构与外管其他部位的结构不同,从而使得外管2前部相对于外管2其他部位更容易受力弯曲。在一些实施例中,控弯机构可以包括其他能够控制外管2前部弯曲的结构。例如,控弯机构可以包括推拉结构、按钮结构、摇臂结构等。通过设置控弯机构控制外管2的前部弯曲,可以便于脉冲场消融导管(如外管2和/或内管11)输送进入组织管腔。
在一些实施例中,外管2可以包括一个或多个通道,内管11可以在其中一个通道内穿过,并相对于外管2移动。在一些实施例中,如图5-7所示,脉冲场消融导管可以用于对组织管腔6(如支气管)内侧的病变组织6进行消融。在图5-7所示的实施例中,外管2可以采用支气管镜5(如纤维支气管镜),该支气管镜5可以包括3个通道,内管11可以从其中的内管通道51中穿过。在一些实施例中,脉冲场消融设备还可以包括内窥镜,外管2中可以设有供内窥镜穿过的通道(如支气管镜5的其中一个通道)。内窥镜的设置能够便于观察脉冲场消融导管在组织管腔中的状态以及病变组织的消融情况。在一些实施例中,外管2的其他通道可以用于供其他器械(如活检针等)通过。
本申请所披露的脉冲场消融导管和设备可能带来的有益效果包括但不限于:(1)能够适用于对不同部位的多种病变组织实施脉冲场消融;(2)能够方便地将消融电极定位在指定位置;(3)能够在不移动脉冲场消融导管的情况下对不同位置的病变组织实施针对性的消融;(4)能够消融到距离组织管腔内壁较远的病变组织;(5)能够在消融过程中减少对组织管腔内壁的损伤;(6)操作简便,实用性强。需要说明的是,不同实施例可能产生的有益效果不同,在不同的实施例里,可能产生的有益效果可以是以上任意一种或几种的组合,也可以是其他任何可能获得的有益效果。
本申请实施例还涉及一种脉冲场消融控制方法及系统。脉冲场消融控制系统可以用于对脉冲场消融设备进行控制,以使得脉冲场消融设备能够根据病变组织的不同而采取针对性的脉冲场消融方案,从而能够更好的对病变组织实现消融。
图11是根据本申请一些实施例所示的脉冲场消融控制方法的示例性流程图。脉冲场消融控制方法1100可以由脉冲场消融控制系统1200执行。如图11所示,该脉冲场消融控制方法1100可以包括:
步骤1110,确定待消融部位的阻抗特性。在一些实施例中,步骤1110可以由脉冲场消融控制系统1200(如阻抗特性确定模块1210)执行。
在一些实施例中,待消融部位可以为准备进行脉冲场消融的区域。在一些实施例中,待消融部位可以包括至少部分病变组织。在一些实施例中,待消融部位可以由医务人员选择确定。例如,医务人员可以利用内窥镜、X射线成像、超声成像等手段对组织管腔进行检查,从而确定待消融部位。
在一些实施例中,待消融部位的阻抗特性可以包括待消融部位的一个或多个阻抗值。在一些实施例中,阻抗特性确定模块1210可以对处于待消融部位的至少两个电极施加电压,并检测流过至少两个电极的电流;根据所述电压和所述电流,阻抗特性确定模块1210可以确定待消融部位的阻抗值。具体的,阻抗特性确定模块1210可以控制能量发生器对处于待消融部位的至少两个电极施加电压,并检测流过至少两个电极的电流。在一些实施例中,处于待消融部位的至少两个电极可以为:所形成的脉冲电场的区域与待消融部位有重叠的电极。在一些实施例中,处于待消融部位的至少两个电极可以为:所形成的脉冲电场的区域能够覆盖待消融部位的电极。
在一些实施例中,电极可以均设置在内管11外侧(例如,1号电极131、2号电极132、3号电极133和4号电极134)。在一些实施例中,当有两个电极(如两个相邻电极)处于待消融部位时,阻抗特性确定模块1210可以对该两个电极施加电压,并检测流过该两个电极的电流,从而确定待消融部位的阻抗值。在一些实施例中,当有多个电极(如3个电极、4个电极)处于待消融部位时,待消融部位可以被划分为两个或多个子部位,待消融部位的阻抗值可以包括两个或多个子部位的子阻抗值。其中,每个子部位为两个相邻电极之间的待消融部位。阻抗特性确定模块1210可以对多个电极的任意两个相邻电极施加电压,并检测流过这两个相邻电极的电流,从而确定待消融部位对应子部位的阻抗值。
在一些实施例中,弹性变形体12可以作为其中一个电极,内管11外侧可以设有至少一个环状电极,至少一个环状电极位于弹性变形体12内部。在一些实施例中,当弹性变形体12处于扩张状态时,阻抗特性确定模块1210可以对处于待消融部位的弹性变形体12和至少一个环状电极施加电压,并检测流过弹性变形体12和至少一个环状电极的电流,从而确定待消融部位的阻抗值。在一些实施例中,当有两个或多个环状电极处于待消融部位时,待消融部位可以被划分为两个或多个子部位,待消融部位的阻抗值可以包括两个或多个子部位的子阻抗值。其中,每个子部位可以为每个环状电极与弹性变形体12之间所形成的脉冲电场能够覆盖的待消融部位。阻抗特性确定模块1210可以对任意的环状电极和弹性变形体12施加电压,并检测流过该环状电极和弹性变形体12的电流,从而确定待消融部位对应子部位的阻抗值。
在一些实施例中,阻抗特性确定模块1210可以获取弹性变形体12在多个状态下所对应的待消融部位的多个阻抗值。在一些实施例中,弹性变形体12的状态可以反映弹性变形体12的扩张程度。在一些实施例中,弹性变形体12的扩张程度可以调节,当弹性变形体12的扩张程度不同时,弹性变形体12与病变组织或管腔内壁的贴靠面积和/或贴靠力度不同,从而使得待消融部位所测得的阻抗值不同。在一些实施例中,弹性变形体12的扩张程度可以通过弹性变形体12两端的距离进行调节。例如,如图3-4所示,弹性变形体12两端的距离越大其扩张程度越小;弹性变形体12两端的距离越小其扩张程度越大。在一些实施例中,医务人员可以通过控制手柄3上的控制按钮31控制弹性变形体12两端的距离,从而控制弹性变形体12的扩张程度。在一些实施例中,阻抗特性确定模块1210可以获取弹性变形体12的状态(如两端距离)。例如,阻抗特性确定模块1210可以通过传感器(如位移传感器)获取控制手柄3上的控制按钮31的位置信息,并根据控制按钮31的位置信息确定弹性变形体12的两端距离。在一些实施例中,当医务人员推动控制按钮31移动以使得弹性变形体12的状态变化时,阻抗特性确定模块1210可以每隔一定时间(如0.2s、0.5s、1s等)获取弹性变形体12的状态,以及在此状态下的待消融部位的阻抗值。
在一些实施例中,阻抗特性确定模块1210可以根据待消融部位的阻抗值,确定待消融部位的阻抗特性。在一些实施例中,阻抗特性确定模块1210可以将待消融部位的一个或多个阻抗值作为待消融部位的阻抗特性。在一些实施例中,阻抗特性确定模块1210可以根据弹性变形体12的多个状态和与多个状态对应的待消融部位的多个阻抗值,确定待消融部位的阻抗特性。在此情况下,阻抗特性可以表示为弹性变形体12的多个状态与待消融部位的多个阻抗值之间的对应映射关系。在一些实施例中,待消融部位的阻抗特性可以包括阻抗值变化曲线。在一些实施例中,阻抗值变化曲线可以反映待消融部位的阻抗值相对于弹性变形体12的状态的变化。例如,阻抗值变化曲线可以反映待消融部位的阻抗值相对于弹性变形体12两端距离的变化。
在一些实施例中,阻抗特性确定模块1210可以通过其他方式检测待消融部位的阻抗值。在一些实施例中,阻抗特性确定模块1210可以通过对处于待消融部位的电极施加电流以检测待消融部位的阻抗值。例如,阻抗特性确定模块1210可以对处于待消融部位的一对电极施加振幅恒定的交变电流,并检测该对电极两端的电压;从而根据振幅恒定的交变电流和测得电压,确定待消融部位的阻抗值。
步骤1120,根据待消融部位的阻抗特性,确定病变组织的特征。在一些实施例中,步骤1120可以由脉冲场消融控制系统1200(如病变组织特征确定模块1220)执行。
在一些实施例中,病变组织的特征可以包括病变组织的类型、形状、体积和质量等一种或多种的任意组合。在一些实施例中,病变组织的类型可以包括但不限于支气管炎、肺气肿、支气管腺体增生肥大、房颤、局部增生肿瘤等。在一些实施例中,病变组织的类型还可以包括病变组织中细胞、细菌、真菌、病毒等的分类信息。例如,支气管炎可以包括细菌性支气管炎、真菌性支气管炎、病毒性支气管炎等。在一些实施例中,病变组织的形状可以包括但不限于规则形状(如球形、椭球型等)或不规则形状。
在一些实施例中,病变组织特征确定模块1220可以根据待消融部位的阻抗值,以及阻抗值与病变组织的特征的对应关系,确定病变组织的特征。在一些实施例中,阻抗值与病变组织的特征的对应关系可以根据临床经验和/或实验等方式确定。在一些实施例中,脉冲场消融控制系统1200中可以包括根据阻抗值和病变组织的特征的对应关系建立的数据库,阻抗特性为待消融部位的阻抗值时,病变组织特征确定模块1220可以根据阻抗值搜索数据库,以获得相应的病变组织的特征。在一些实施例中,待消融部位的阻抗特性可以仅包括一个阻抗值。在此情况下,病变组织特征确定模块1220可以根据该阻抗值,以及阻抗值与病变组织的特征的对应关系,确定病变组织的特征。在一些实施例中,待消融部位的阻抗特性可以包括两个或多个阻抗值。例如,待消融部位的阻抗特性可以包括弹性变形体在多个状态下所对应的待消融部位的多个阻抗值。在此情况下,病变组织特征确定模块1220可以根据多个阻抗值的平均值,并利用阻抗值与病变组织的特征的对应关系,确定病变组织的特征。通过基于阻抗值及其与病变组织的特征的对应关系来确定病变组织的特征,可以使得确定过程简便、高效、准确。
在一些实施例中,脉冲场消融控制系统1200可以根据人体不同部位(如支气管、肠道、胆囊等)分别建立多个子数据库,每个子数据库包括在该部位下阻抗值与病变组织的特征的对应关系。病变组织特征确定模块1220可以根据待消融部位在人体中所处的位置,在相应的子数据库中搜索阻抗值,以确定病变组织的特征。在一些实施例中,病变组织特征确定模块1220可以根据用户输入的信息确定待消融部位在人体中所处的位置。例如,用户(如医务人员)可以通过输入设备(如鼠标、键盘等)输入待消融部位在人体中所处的位置。通过对不同人体部位建立不同的子数据库,可以提升病变组织特征确定的准确率。在一些实施例中,当待消融部位被划分为两个或多个子部位时,病变组织特征确定模块1220可以分别根据每个子部位的阻抗值,以及阻抗值与病变组织的特征的对应关系,确定每个子部位的病变组织的特征。
在一些实施例中,病变组织特征确定模块1220可以根据待消融部位的阻抗值变化曲线,利用训练好的病变组织特征确定模型确定病变组织的特征。在一些实施例中,病变组织特征确定模型可以为机器学习模型。病变组织特征确定模型可以包括但不限于卷积神经网络模型(CNN,Convolutional Neural Networks)、循环神经网络模型(RNN,RecurrentNeural Network)、RCNN模型(Regions with CNN)、Fast-RCNN模型、BP神经网络模型、K近邻算法模型(KNN)、支持向量机模型(SVM)等中的一种或其任意组合。在一些实施例中,病变组织特征确定模块1220可以利用训练好的病变组织特征确定模型确定待消融部位的一种或多种病变组织特征。通过基于待消融部位的阻抗值变化曲线,利用病变组织特征确定模型来确定病变组织的特征,能够有效提高确定的准确率。关于病变组织特征确定模型的更多细节可以参见图13及其相关描述。
在一些实施例中,脉冲场消融控制系统1200可以根据人体不同部位(如支气管、肠道、胆囊等)分别训练获得多个病变组织特征确定子模型。病变组织特征确定模块1220可以根据待消融部位在人体中所处的位置,利用相应的病变组织特征确定子模型确定病变组织的特征。在一些实施例中,病变组织特征确定模块1220可以根据用户输入的信息确定待消融部位在人体中所处的位置。例如,用户(如医务人员)可以通过输入设备(如鼠标、键盘等)输入待消融部位在人体中所处的位置。通过对不同人体部位采用不同的病变组织特征确定子模型,可以提升病变组织特征确定的准确率。在一些实施例中,当待消融部位被划分为两个或多个子部位时,病变组织特征确定模块1220可以分别根据每个子部位的阻抗值变化曲线,利用训练好的病变组织特征确定模型确定病变组织的特征。
在一些实施例中,脉冲场消融控制系统1200可以采用其他方式确定病变组织的特征。在一些实施例中,脉冲场消融控制系统1200可以获取用户(如医务人员)输入的病变组织特征的识别信息。例如,用户可以基于内窥镜图像、X射线图像、超声波图像等,根据经验识别出待消融部位的病变组织的特征,并将结果输入到脉冲场消融控制系统1200。在一些实施例中,用户可以通过操作终端/人机交互界面输入病变组织特征的确定结果。具体的,用户输入方式可以包括但不限于语音输入、文字输入、鼠标选择输入、触摸屏输入等。
在一些实施例中,病变组织特征确定模块1220可以先利用训练好的病变组织特征确定模型确定病变组织特征,再将该病变组织特征的信息发送给用户确认(例如,向用户展示、播报病变组织特征信息)。用户可以对该病变组织特征信息进行确认或是重新输入/选择,从而确定最终的病变组织特征。通过模型识别与人工判断结合的方式,可以提升识别效率及准确率。在一些实施例中,基于用户对信息确认,还可以防止系统故障或者通过病变组织特征确定模型无法识别出病变组织特征的情况。在一些实施例中,当病变组织特征确定模块1220确定了病变组织特征,但是用户对结果不认同时,用户可以向脉冲场消融控制系统1200反馈并使系统进行二次处理。在进行二次处理时,病变组织特征确定模块1220可以结合用户对病变组织特征的识别信息,重新确定病变组织特征。
步骤1130,基于病变组织的特征,确定脉冲场消融参数。在一些实施例中,步骤1130可以由脉冲场消融控制系统1200(如消融参数确定模块1230)执行。
在一些实施例中,脉冲场消融参数可以包括但不限于消融时间、脉冲电压、脉冲宽度和脉冲频率等中的一种或多种的组合。其中,消融时间可以包括消融开始时间、消融结束时间和/或消融时长。脉冲电压可以为施加在电极上的电压。脉冲宽度可以为高电平持续的时间。脉冲频率可以为单位时间(如1s)内脉冲的次数。在一些实施例中,当弹性变形体作为电极时,脉冲场消融参数还可以包括弹性变形体的状态(如扩张程度)。
在一些实施例中,消融参数确定模块1230可以基于病变组织的特征,并根据病变组织的特征和脉冲场消融参数的对应关系,确定脉冲场消融参数。在一些实施例中,病变组织的特征和脉冲场消融参数的对应关系可以根据临床经验和/或实验确定。在一些实施例中,脉冲场消融控制系统1200中可以包括根据病变组织的特征和脉冲场消融参数的对应关系建立的数据库。消融参数确定模块1230可以基于病变组织的特征,从数据库中检索确定相应的脉冲场消融参数。通过基于病变组织的特征和脉冲场消融参数的对应关系来确定脉冲场消融参数,可以使得消融参数的确定过程简便、高效、准确。在一些实施例中,消融参数确定模块1230可以基于病变组织的特征及其与脉冲场消融参数的对应关系,确定脉冲场消融参数中弹性变形体的状态,以使得在消融过程中采用更优的弹性变形体状态,从而提升消融效果。
在一些实施例中,消融参数确定模块1230可以基于病变组织的特征,利用训练好的消融参数确定模型确定脉冲场消融参数。在一些实施例中,消融参数确定模型可以为机器学习模型。消融参数确定模型可以包括但不限于卷积神经网络模型(CNN,ConvolutionalNeural Networks)、循环神经网络模型(RNN,Recurrent Neural Network)、RCNN模型(regions with CNN)、Fast-RCNN模型、BP神经网络模型、K近邻算法模型(KNN)、支持向量机模型(SVM)等中的一种或其任意组合。在一些实施例中,消融参数确定模块1230可以利用训练好的消融参数确定模型确定一种或多种消融参数。通过基于病变组织的特征,利用训练好的消融参数确定模型确定脉冲场消融参数,能够有效提高消融参数确定的准确率。关于消融参数确定模型的更多细节可以参见图14及其相关描述。
在一些实施例中,当待消融部位被划分为两个或多个子部位时,消融参数确定模块1230可以分别根据每个子部位的病变组织的特征,确定脉冲场消融参数。在一些实施例中,当各个子部位的病变组织的特征不同时,消融参数确定模块1230可以为各个子部位确定不同的脉冲场消融参数,从而能够更有效、准确的对各个子部位的病变组织进行消融。
在一些实施例中,脉冲场消融控制系统1200可以采用其他方式确定脉冲场消融参数。在一些实施例中,脉冲场消融控制系统1200可以获取用户(如医务人员)输入的脉冲场消融参数的确定结果。例如,用户可以根据人工判断确定消融参数并通过操作终端/人机交互界面输入消融参数。具体的,用户输入方式可以包括但不限于语音输入、文字输入、鼠标选择输入、触摸屏输入等。
在一些实施例中,消融参数确定模块1230可以先利用训练好的消融参数确定模型确定消融参数,再将该消融参数信息发送给用户确认(例如,向用户展示、播报消融参数信息)。用户可以对该消融参数信息进行确认或是重新输入/选择,从而确定最终的脉冲场消融参数。通过模型识别与人工判断结合的方式,可以提升消融参数确定效率及准确率。在一些实施例中,基于用户对信息确认,还可以防止系统故障或者通过消融参数确定模型无法获得消融参数的情况。在一些实施例中,当消融参数确定模块1230确定了消融参数,但是用户对结果不认同时,用户可以向脉冲场消融控制系统1200反馈并使系统进行二次处理或人工输入消融参数。
步骤1140,基于脉冲场消融参数,对病变组织进行消融。在一些实施例中,步骤1140可以由脉冲场消融控制系统1200(如消融模块1240)执行。
在一些实施例中,消融模块1240可以基于脉冲场消融参数(如消融时间、脉冲电压、脉冲宽度和脉冲频率等),控制能量发生器对处于待消融部位的至少两个电极进行通电,从而对待消融部位的病变组织进行消融。在一些实施例中,当待消融部位被划分为两个或多个子部位时,消融模块1240可以根据每个子部位的脉冲场消融参数对与各子部位对应的电极进行通电,从而对各个子部位的病变组织进行消融。在一些实施例中,当脉冲场消融参数包括弹性变形体的状态时,消融模块1240可以对用户(如医务人员)进行提示,以使用户控制弹性变形体达到指定状态。在一些实施例中,消融过程中弹性变形体的状态可以为弹性变形体的扩张状态。
应当注意的是,上述有关脉冲场消融控制方法1100的描述仅仅是为了示例和说明,而不限定本申请的适用范围。对于本领域技术人员来说,在本申请的指导下可以对脉冲场消融控制方法1100进行各种修正和改变。然而,这些修正和改变仍在本申请的范围之内。例如,可以省略步骤1110中对待消融部位阻抗特性的确定,直接获取用户对病变组织特征的识别信息。又例如,可以省略步骤1120中对病变组织特征的确定,直接建立阻抗特性和消融参数的关系。
图12是根据本申请一些实施例所示的脉冲场消融控制系统的模块图。如图12所示,该脉冲场消融控制系统1200可以包括阻抗特性确定模块1210、病变组织特征确定模块1220、消融参数确定模块1230和消融模块1240。
阻抗特性确定模块1210可以用于确定待消融部位的阻抗特性。在一些实施例中,阻抗特性确定模块1210可以获取待消融部位的阻抗值,从而确定待消融部位的阻抗特性。在一些实施例中,阻抗特性确定模块1210可以获取待消融部位的多个阻抗值,建立阻抗值变化曲线,从而确定待消融部位的阻抗特性。
病变组织特征确定模块1220可以用于根据待消融部位的阻抗特性,确定病变组织的特征。在一些实施例中,病变组织特征确定模块1220可以根据待消融部位的阻抗值,以及阻抗值与病变组织的特征的对应关系,确定病变组织的特征。在一些实施例中,病变组织特征确定模块1220可以根据待消融部位的阻抗值变化曲线,利用训练好的病变组织特征确定模型确定病变组织的特征。
消融参数确定模块1230可以基于病变组织的特征,确定脉冲场消融参数。在一些实施例中,消融参数确定模块1230可以基于病变组织的特征,并根据病变组织的特征和脉冲场消融参数的对应关系,确定脉冲场消融参数。在一些实施例中,消融参数确定模块1220可以基于病变组织的特征,利用训练好的消融参数确定模型确定脉冲场消融参数。
消融模块1240可以用于对病变组织进行消融。在一些实施例中,消融模块1240可以用于基于脉冲场消融参数,对病变组织进行消融。
在一些实施例中,脉冲场消融控制系统1200还可以包括其他执行模块。例如,脉冲场消融控制系统1200还可以包括数据处理模块、信息显示模块、信息提示模块、模型训练模块等一种或多种的任意组合。
在一些实施例中,脉冲场消融控制系统1200可以包括计算设备,计算设备可以包括至少一个处理器,该至少一个处理器可以用于实现上述各个模块。在一些实施例中,计算设备可以是单个服务器或服务器组。服务器组可以是集中式的或分布式的。在一些实施例中,计算设备可以是本地的或远程的。在一些实施例中,计算设备还可以在云平台上实现。
在一些实施例中,脉冲场消融控制系统1200还可以包括输入设备、输出设备、网络、终端、存储介质等一种或多种的组合。在一些实施例中,网络可以包括能够促进脉冲场消融控制系统1200的信息和/或数据交换的任何合适的网络。例如,网络可以包括公共网络(如互联网)、私有网络(如局域网(LAN)、广域网(WAN)等)、有线网(如以太网)、无线网络(如802.11网络、WiFi网络等)、蜂窝网络、帧中继网络、虚拟专用网络(VPN)、卫星网络、电话网络、路由器、集线器等或以上任意组合。在一些实施例中,终端可以包括移动设备、平板电脑、手提电脑等或其任意组合。在一些实施例中,移动设备可以包括智能家居设备、可穿戴设备、智能移动设备、虚拟现实设备、混合现实设备等或其任意组合。在一些实施例中,存储介质可以连接到网络与脉冲场消融控制系统1200中的一个或多个其他组件(例如,计算设备、终端等)通信。脉冲场消融控制系统1200中的一个或多个组件可以经由网络访问存储在存储介质中的数据或指令。在一些实施例中,存储介质可以直接连接到图像处理系统1200中的一个或多个其他组件(例如,计算设备、终端等)或与之通信。在一些实施例中,存储介质可以是计算设备的一部分。
在一些实施例中,脉冲场消融控制系统1200可以与脉冲场消融设备具有信号连接(如通过网络连接),从而脉冲场消融控制系统1200可以控制脉冲场消融设备的部件或者获取部件的信息。例如,脉冲场消融控制系统1200可以控制脉冲场能量发生器对电极进行通电,从而对病变组织进行消融。又例如,脉冲场消融控制系统1200可以获取控制手柄3上的控制按钮31的位置信息。在一些实施例中,脉冲场消融控制系统1200可以全部或部分集成在脉冲场消融设备中。例如,脉冲场消融设备可以包括存储介质和处理器,存储介质存储计算机指令,当处理器读取存储介质中的计算机指令后,处理器能够执行本申请任一实施例描述的脉冲场消融控制方法。
需要注意的是,以上对于脉冲场消融控制系统及其模块的描述,仅为描述方便,并不能把本申请限制在所举实施例范围之内。可以理解,对于本领域的技术人员来说,在了解该系统的原理后,可以在不背离这一原理的情况下,对各个模块进行任意组合,或者构成子系统与其他模块连接。例如,在一些实施例中,图12中披露的阻抗特性确定模块1210、病变组织特征确定模块1220、消融参数确定模块1230和消融模块1240可以是一个系统中的不同模块,也可以是一个模块实现上述的两个或两个以上模块的功能。例如,病变组织特征确定模块1220和消融参数确定模块1230可以是两个模块,也可以是一个模块同时具有确定病变组织特征和确定消融参数的功能。又例如,各个模块可以共用一个存储模块,各个模块也可以分别具有各自的存储模块。诸如此类的变形,均在本申请的保护范围之内。
图13是根据本申请一些实施例所示的病变组织特征确定模型训练方法的示例性流程图。病变组织特征确定模型训练方法1300可以由脉冲场消融控制系统1200执行。如图13所示,该训练方法1300可以包括:
步骤1310,获取阻抗值变化曲线样本。
在一些实施例中,阻抗值变化曲线样本可以包括历史消融过程中,待消融部位的阻抗值变化曲线。在一些实施例中,阻抗值变化曲线样本可以反映历史消融过程中,待消融部位的阻抗值相对于弹性变形体12的状态的变化。例如,阻抗值变化曲线样本可以反映历史消融过程中,待消融部位的阻抗值相对于弹性变形体12两端距离的变化。在一些实施例中,历史消融过程中所获得的待消融部位的阻抗值变化曲线可以存储在存储介质(如数据库)中,脉冲场消融控制系统1200可以从数据库中获取阻抗值变化曲线样本。在一些实施例中,阻抗值变化曲线样本可以通过其他方式获得。例如,阻抗值变化曲线样本可以包括试验样本、仿真样本等。
步骤1320,获取与阻抗值变化曲线样本对应的病变组织特征。
在一些实施例中,与阻抗值变化曲线样本对应的病变组织特征可以由用户(如医务人员)标注获得。具体的,用户可以基于与阻抗值变化曲线样本对应的信息(如待消融部位中的病变组织图像、病变组织所处位置、病变组织检测结果、患者信息等)综合识别出病变组织的特征。在一些实施例中,用户可以通过操作终端/人机交互界面标注与阻抗值变化曲线样本对应的病变组织特征。具体的,用户可以通过人机交互界面输入病变组织特征识别信息。用户输入病变组织特征识别信息的方式可以包括但不限于语音输入、文字输入、鼠标选择输入、触摸屏输入等。例如,用户在选择某阻抗值变化曲线样本后,系统可以显示与该样本对应的信息并弹出病变组织特征列表,用户可以根据判断选择该曲线对应的病变组织特征。在一些实施例中,阻抗值变化曲线样本及其对应的病变组织特征可以存储在数据库中,脉冲场消融控制系统1200可以从数据库中获取与阻抗值变化曲线样本对应的病变组织特征。
在执行步骤1310和1320后,脉冲场消融控制系统1200可以获得多个样本对,每个样本对包括阻抗值变化曲线样本和对应的病变组织特征。在一些实施例中,如图13所示,脉冲场消融控制系统1200可以将多个样本对划分为模型训练集1301和模型测试集1302。模型训练集1301可以用于训练病变组织特征确定模型;模型测试集1302可以用于对训练获得的病变组织特征确定模型进行测试。在一些实施例中,脉冲场消融控制系统1200可以将多个样本对按一定比例随机进行划分。例如,训练集和测试集的比例可以为8比2、9比1、9.5比0.5等。
步骤1330,将模型训练集输入到初始病变组织特征确定模型中进行训练,以获得病变组织特征确定模型。
在一些实施例中,初始病变组织特征确定模型可以包括但不限于卷积神经网络模型(CNN,Convolutional Neural Networks)、循环神经网络模型(RNN,Recurrent NeuralNetwork)、RCNN模型(regions with CNN)、Fast-RCNN模型、BP神经网络模型、K近邻算法模型(KNN)、支持向量机模型(SVM)等中的一种或其任意组合。在一具体实施例中,初始病变组织特征确定模型可以基于卷积神经网络(CNN)模型来构建。CNN模型可以包括一个输入节点和多个输出节点。在训练过程中,输入节点的输入为模型训练集1301中的阻抗值变化曲线样本,输出节点的输出为病变组织的类型、体积和质量。通过模型训练集1301中的样本对输入到该初始病变组织特征确定模型进行训练,即可以获得训练后的病变组织特征确定模型。
步骤1340,测试病变组织特征确定模型。
在此步骤中,脉冲场消融控制系统1200可以将模型测试集1302中的样本对数据输入到步骤1330所得的训练后的病变组织特征确定模型进行测试,获得输出结果。脉冲场消融控制系统1200可以进一步对比模型的输出结果与测试数据的标注信息是否一致。例如,脉冲场消融控制系统1200可以判断模型识别出的病变组织特征(如类型、体积和质量)与所标注的病变组织特征是否一致。
步骤1350,判断病变组织特征确定模型是否符合要求。
在此步骤中,脉冲场消融控制系统1200可以统计病变组织特征确定模型测试结果的正确率,并基于该正确率判断模型是否符合要求。具体的,当模型测试结果的正确率超过预设阈值(如85%、90%、95%、98%等)时,脉冲场消融控制系统1200可以认为该训练后的模型通过测试,模型训练方法1300可以进行步骤1360。当模型测试结果的正确率低于预设阈值时,脉冲场消融控制系统1200可以认为该训练后的模型没有通过测试,模型训练方法1300可以重新进行步骤1330。
步骤1360,输出训练好的病变组织特征确定模型。
在一些实施例中,训练好的病变组织特征确定模型可以适用于人体多个部位(如支气管、肠道、胆囊等)的病变组织特征的确定。在一些实施例中,脉冲场消融控制系统1200可以根据人体不同部位分别训练获得对应的病变组织特征确定子模型。
应当注意的是,上述有关模型训练方法1300的描述仅仅是为了示例和说明,而不限定本申请的适用范围。对于本领域技术人员来说,在本申请的指导下可以对模型训练方法1300进行各种修正和改变。然而,这些修正和改变仍在本申请的范围之内。例如,脉冲场消融控制系统1200可以将标注好的样本分为训练集、验证集和测试集,当病变组织特征确定模型初步训练完成之后,脉冲场消融控制系统1200可以使用验证集对模型进行验证。又例如,脉冲场消融控制系统1200可以基于模型在使用过程中的情况(如用户对模型处理结果的反馈)对模型进行定期或不定期更新。
图14是根据本申请一些实施例所示的消融参数确定模型训练方法的示例性流程图。消融参数确定模型训练方法1400可以由脉冲场消融控制系统1200执行。如图14所示,该训练方法1400可以包括:
步骤1410,获取病变组织特征样本。
在一些实施例中,病变组织特征样本可以包括历史消融过程中病变组织的特征。在一些实施例中,病变组织特征样本可以包括病变组织的类型、形状、体积和质量等中的一种或多种的组合。在一些实施例中,病变组织特征样本可以由用户(如医务人员)识别获得。具体的,用户可以基于待消融部位中的病变组织图像、病变组织所处位置、病变组织检测结果、患者信息等综合识别出病变组织的特征。在一些实施例中,病变组织特征样本也可以通过其他方式获得。例如,病变组织特征样本可以由图像识别模型对病变组织图像进行识别获得。又例如,病变组织特征样本可以通过仿真获得。再例如,病变组织特征样本可以通过病变组织特征确定模型获得。在一些实施例中,历史消融过程中病变组织的特征可以存储在存储介质(如数据库)中,脉冲场消融控制系统1200可以从数据库中获取病变组织特征样本。
步骤1420,获取与病变组织特征样本对应的消融参数。
在一些实施例中,与病变组织特征样本对应的消融参数可以由用户(如医务人员)标注获得。例如,用户可以基于病变组织特征样本的信息(如病变组织类型、形状、体积和质量等)判断与病变组织特征样本对应的消融参数。又例如,用户可以通过试验确定出与病变组织特征样本对应的消融参数。在一些实施例中,用户可以通过操作终端/人机交互界面标注与病变组织特征样本对应的消融参数。具体的,用户可以通过人机交互界面输入消融参数信息。用户输入消融参数信息的方式可以包括但不限于语音输入、文字输入、鼠标选择输入、触摸屏输入等。在一些实施例中,病变组织特征样本及其对应的消融参数可以存储在数据库中,脉冲场消融控制系统1200可以从数据库中获取与病变组织特征样本对应的消融参数。
在执行步骤1410和1420后,脉冲场消融控制系统1200可以获得多个样本对,每个样本对包括病变组织特征样本和对应的消融参数。在一些实施例中,如图14所示,脉冲场消融控制系统1200可以将多个样本对划分为模型训练集1401和模型测试集1402。模型训练集1401可以用于训练消融参数确定模型;模型测试集1402可以用于对训练获得的消融参数确定模型进行测试。在一些实施例中,脉冲场消融控制系统1200可以将多个样本对按一定比例随机进行划分。例如,训练集和测试集的比例可以为8比2、9比1、9.5比0.5等。
步骤1430,将模型训练集输入到初始消融参数确定模型中进行训练,获得消融参数确定模型。
在一些实施例中,初始消融参数确定模型可以包括但不限于卷积神经网络模型(CNN,Convolutional Neural Networks)、循环神经网络模型(RNN,Recurrent NeuralNetwork)、RCNN模型(regions with CNN)、Fast-RCNN模型、BP神经网络模型、K近邻算法模型(KNN)、支持向量机模型(SVM)等中的一种或其任意组合。
步骤1440,测试消融参数确定模型。
在此步骤中,脉冲场消融控制系统1200可以将模型测试集1402中的样本对数据输入到步骤1430所得的训练后的消融参数确定模型进行测试,获得输出结果。脉冲场消融控制系统1200可以进一步对比模型的输出结果与测试数据的标注信息是否一致。例如,脉冲场消融控制系统1200可以判断模型识别出的消融参数与所标注的消融参数是否一致。
步骤1450,判断消融参数确定模型是否符合要求。
在此步骤中,脉冲场消融控制系统1200可以统计消融参数确定模型测试结果的正确率,并基于该正确率判断模型是否符合要求。具体的,当模型测试结果的正确率超过预设阈值(如85%、90%、95%、98%等)时,脉冲场消融控制系统1200可以认为该训练后的模型通过测试,模型训练方法1400可以进行步骤1460。当模型测试结果的正确率低于预设阈值时,脉冲场消融控制系统1200可以认为该训练后的模型没有通过测试,模型训练方法1400可以重新进行步骤1430。
步骤1460,输出训练好的消融参数确定模型。
应当注意的是,上述有关模型训练方法1400的描述仅仅是为了示例和说明,而不限定本申请的适用范围。对于本领域技术人员来说,在本申请的指导下可以对模型训练方法1400进行各种修正和改变。然而,这些修正和改变仍在本申请的范围之内。例如,脉冲场消融控制系统1200可以将标注好的样本分为训练集、验证集和测试集,当消融确定模型初步训练完成之后,脉冲场消融控制系统1200可以使用验证集对模型进行验证。又例如,脉冲场消融控制系统1200可以基于模型在使用过程中的情况(如用户对模型处理结果的反馈)对模型进行定期或不定期更新。
本申请实施例的脉冲场消融控制方法及系统可能带来的有益效果包括但不限于:(1)能够准确、高效地确定病变组织的特征;(2)能够针对不同的病变组织,提供不同的脉冲场消融方案,以进行针对性消融。需要说明的是,不同实施例可能产生的有益效果不同,在不同的实施例里,可能产生的有益效果可以是以上任意一种或几种的组合,也可以是其他任何可能获得的有益效果。
以上仅为本申请的较佳实施例而已,并不用以限制本申请,凡在本申请的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本申请的保护范围之内。本申请使用了特定词语来描述本申请的实施例。如“一个实施例”、“一实施例”、和/或“一些实施例”意指与本申请至少一个实施例相关的某一特征、结构或特点。因此,应强调并注意的是,本说明书中在不同位置两次或多次提及的“一实施例”或“一个实施例”或“一个替代性实施例”并不一定是指同一实施例。此外,本申请的一个或多个实施例中的某些特征、结构或特点可以进行适当的组合。
此外,本申请的各个方面可以完全由硬件执行、可以完全由软件(包括固件、常驻软件、微码等)执行、也可以由硬件和软件组合执行。以上硬件或软件均可被称为“数据块”、“模块”、“引擎”、“单元”、“组件”或“系统”。此外,本申请的各方面可能表现为位于一个或多个计算机可读介质中的计算机产品,该产品包括计算机可读程序编码。计算机存储介质可能包含一个内含有计算机程序编码的传播数据信号,例如在基带上或作为载波的一部分。该传播信号可能有多种表现形式,包括电磁形式、光形式等,或合适的组合形式。计算机存储介质可以是除计算机可读存储介质之外的任何计算机可读介质,该介质可以通过连接至一个指令执行系统、装置或设备以实现通讯、传播或传输供使用的程序。位于计算机存储介质上的程序编码可以通过任何合适的介质进行传播,包括无线电、电缆、光纤电缆、RF、或类似介质,或任何上述介质的组合。
本申请各部分操作所需的计算机程序编码可以用任意一种或多种程序语言编写,包括面向对象编程语言如Java、Scala、Smalltalk、Eiffel、JADE、Emerald、C++、C#、VB.NET、Python等,常规程序化编程语言如C语言、Visual Basic、Fortran 12003、Perl、COBOL12002、PHP、ABAP,动态编程语言如Python、Ruby和Groovy,或其他编程语言等。该程序编码可以完全在用户计算机上运行、或作为独立的软件包在用户计算机上运行、或部分在用户计算机上运行部分在远程计算机运行、或完全在远程计算机或服务器上运行。在后种情况下,远程计算机可以通过任何网络形式与用户计算机连接,比如局域网(LAN)或广域网(WAN),或连接至外部计算机(例如通过因特网),或在云计算环境中,或作为服务使用如软件即服务(SaaS)。
此外,除非权利要求中明确说明,本申请所述处理元素和序列的顺序、数字字母的使用、或其他名称的使用,并非用于限定本申请流程和方法的顺序。尽管上述披露中通过各种示例讨论了一些目前认为有用的发明实施例,但应当理解的是,该类细节仅起到说明的目的,附加的权利要求并不仅限于披露的实施例,相反,权利要求旨在覆盖所有符合本申请实施例实质和范围的修正和等价组合。例如,虽然以上所描述的系统组件可以通过硬件设备实现,但是也可以只通过软件的解决方案得以实现,如在现有的服务器或移动设备上安装所描述的系统。
同理,应当注意的是,为了简化本申请披露的表述,从而帮助对一个或多个发明实施例的理解,前文对本申请实施例的描述中,有时会将多种特征归并至一个实施例、附图或对其的描述中。但是,这种披露方法并不意味着本申请对象所需要的特征比权利要求中提及的特征多。实际上,实施例的特征要少于上述披露的单个实施例的全部特征。
- 一种脉冲场消融导管及设备
- 一种自稳定且直径可调节的脉冲电场消融导管及其设备
