用于治疗皮炎症状的卤代水杨酰苯胺
文献发布时间:2023-06-19 12:25:57
本发明涉及用于治疗非人受试者的皮炎,例如治疗非人受试者的特应性皮炎的卤代水杨酰苯胺。
皮炎是以红斑、瘙痒、鳞屑、渗出、结痂和囊泡中的一种或多种为特征的炎性皮肤病。有许多形式的皮炎,特应性皮炎是最常见的,特别是在狗和猫中。
特应性皮炎(AD)是以红斑、瘙痒、鳞屑、苔癣样变和丘疹囊泡为特征的皮肤炎性病症。AD是与受损的先天性免疫反应相关的复杂病症,其中病变部位的皮肤屏障受到损害,使得诸如刺激物、过敏原、尘螨、细菌和/或食物之类的触发物能够穿透皮肤并引发炎症反应。特应性皮炎中的初始炎症反应被认为主要由Th2介导(Bieber T.《特应性皮炎(Atopicdermatitis)》《新英格兰医学杂志(N.Engl.J.Med.)》2008;358(14):1483-94)。
AD的症状包括皮肤斑片呈红色或褐色、干燥、破裂或鳞状。AD的特别成问题的症状是瘙痒(皮肤瘙痒),其会对受试者的生活质量具有显著影响,包括睡眠剥夺和精神病学影响,包括抑郁和焦虑。在动物中,瘙痒会导致动物反复抓挠皮肤病变部位,导致对已经受损的上皮屏障的进一步损害,自身引发的脱发和皮炎症状的恶化。
皮肤受损的屏障功能还会导致皮炎病变部位易于发生细菌感染,特别是发生金黄色葡萄球菌感染。皮肤病变的细菌定殖和感染与AD中的炎症反应有关。金黄色葡萄球菌在病变部位的定殖是特应性皮炎的发病机理中的重要因素,因为复发性并发症会加剧病症。甚至在没有明显感染的情况下,其存在似乎通过毒素触发多种炎症反应,所述毒素充当超抗原和外源性蛋白酶抑制剂,其进一步损害表皮屏障并增强过敏原渗透。(Bieber T.《特应性皮炎(Atopic dermatitis)》《新英格兰医学杂志(N.Engl.J.Med.)》2008;358(14):1483-94)。
目前对皮炎如AD的治疗通常针对皮炎的一种或多种症状,并且包括使用皮肤软化剂(例如保湿剂和油)来湿润皮肤,使用局部用皮质类固醇,使用抗组胺剂来减轻瘙痒,以及使用抗生素,包括克林霉素(clindamycin)、双氯西林(dicloxacillin)、第一代头孢菌素和大环内酯抗生素来治疗皮肤病变的继发性感染。也可用免疫抑制剂,如环孢菌素、他克莫司(tacrolimus)或硫唑嘌呤(azathioprine)对患者进行治疗。在一线治疗失败后,光疗也被用作二线治疗(Sidbury等,《特应性皮炎处理指南(Guidelines of care for themanagement of atopic dermatitis):第3节》《美国皮肤病学会杂志(J AmAcad.Dermatol.)》2014年8月;71(2):327-49)
局部用皮质类固醇可有效减轻炎症和皮炎(例如AD)的某些其它症状。然而,长期使用局部用皮质类固醇与不希望有的副作用,特别是皮肤萎缩相关。
最近,Dupilumab被FDA批准用于治疗患有中度至重度特应性皮炎的成人患者,其疾病不能用局部用处方疗法充分控制。Dupiliumab通过结合白介素-4受体α来抑制白介素-4和白介素-13信号传导。
FDA于2016年批准非甾体磷酸二酯酶4(PDE4)抑制剂Crisaborole软膏用于2岁及以上人类患者的轻度至中度特应性皮炎(AD)的局部治疗。
然而,仍然需要在非人受试者中治疗皮炎,特别是AD的新方法。
卤代水杨酰苯胺是一系列化合物,包括氯硝柳胺(niclosamide)、氯氰碘柳胺(closantel)、雷复尼特(rafoxanide)和羟氯扎胺(oxyclozanide)。
氯硝柳胺被批准用作人和兽药的驱虫药。氯硝柳胺是有效对抗家畜和宠物的几种寄生绦虫(例如,绦虫属(Taenia spp.)、莫尼茨绦虫属(Moniezia spp.))和抗瘤胃吸虫(同端盘吸虫属(Paramphistomum spp.))和血吸虫(裂体吸虫属(Schistosoma spp.))的已知杀绦虫剂。氯硝柳胺还被证明可以防止曼氏血吸虫穿过人皮肤。以及用作抗癌药、杀虫剂和抗锥虫药。氯硝柳胺还被证明可以抑制人细胞中的病毒复制。(Ofori-Adjei等人;《国际医学风险与安全杂志(The International Journal of Risk&Safety in Medicine)》2008;20:113-22;和Pearson等人;《内科学年鉴(Annals of Internal Medicine)》。1985;102(4):550-1)。
羟氯扎胺(CAS号2277-92-1)用于口服治疗和控制牛、绵羊和山羊的片吸虫病(《欧洲药品管理局成果或转诊程序报告(European Medicines Agency outcome or referralprocedure report)》EMA/586006/2017,日期2017年9月28日)。
GB 2,456,376和WO 2008/155535描述了卤代水杨酰苯胺用于治疗由丙酸杆菌引起的痤疮的用途。
WO 2016/038035公开了卤代水杨酰苯胺用于局部治疗由革兰氏阳性细菌引起的疾病或感染的用途。
Wu等人(《抗蠕虫药氯硝柳胺调节树突细胞的激活和功能(Antihelminthicniclosamide modulates dendritic cells activation and function)》,《细胞免疫学(Cellular Immunology)》,288(1-2):15-23(2014)公开了氯硝柳胺对脂多糖(LPS)诱导的树突细胞成熟和细胞因子共刺激分子和MHC分子体外表达具有抑制作用。还发现经氯硝柳胺治疗的树突细胞抑制抗原特异性T细胞应答。该参考文献假定氯硝柳胺可用于治疗慢性炎性病症或树突细胞介导的自身免疫疾病,然而,没有提供临床数据并且该论文的结论表明需要进一步研究以更好地理解与该化合物相关的分子机制。
在本专利申请的优先权日之后公开的WO2019/053180公开了包含羟氯扎胺或氯硝柳胺和二甲亚砜的局部用组合物。据称这些组合物可用于局部治疗非人哺乳动物的脓皮病或皮炎。
发明内容
根据本发明,提供了用于治疗非人受试者的皮炎(例如特应性皮炎)的卤代水杨酰苯胺或其药学上可接受的盐或水合物。
在实施例中,提供了卤代水杨酰苯胺或其药学上可接受的盐或水合物,其用于治疗非人受试者的皮炎(例如特应性皮炎)以减少或消除与皮炎(例如特应性皮炎)相关的瘙痒、红斑、硬结、表皮脱落、苔藓样变、鳞屑、渗出、结痂、干燥、脱落、病变结节、痒疹结节、病变囊泡、病变丘疹、病变斑块或病变肿胀中的一种或多种。
在一些实施例中,皮炎(或湿疹)选自:局部皮炎、接触性皮炎、过敏性接触性皮炎、刺激性接触性皮炎、特应性皮炎、脂溢性皮炎、光化性皮炎、足皮炎、蠕形螨病、汗疱疹皮炎、慢性单纯性苔癣(包括犬肢端舔皮炎和神经性皮炎)、趾皮炎(包括牛趾皮炎)、剥脱性皮炎(干性皮炎)、癌性皮炎、钱币状皮炎、郁积性皮炎、跳蚤过敏性皮炎、耳炎、食物过敏性皮炎、马拉色氏皮炎、擦烂、口周皮炎、皮肌炎、湿疹性皮炎、光过敏性皮炎、光毒性皮炎、植物光敏性皮炎或辐射诱导的皮炎。
在一些实施例中,皮炎(或湿疹)选自:局部皮炎、接触性皮炎、过敏性接触性皮炎、刺激性接触性皮炎、特应性皮炎、脂溢性皮炎、足皮炎、包皮病、神经性皮炎、剥脱性皮炎、癌性皮炎、跳蚤过敏性皮炎、耳炎、食物过敏性皮炎、马拉色氏皮炎、擦烂、口周皮炎和皮肌炎。
在一些实施例中,皮炎是特应性皮炎。
卤代水杨酰苯胺可以减少或消除与皮炎(例如,AD)相关的瘙痒、红斑、硬结、表皮脱落、苔藓样硬化、鳞屑、渗出、结痂、干燥、病变结节、痒疹结节、病变囊泡、病变丘疹、病变斑块和病变肿胀中的一种或多种。
在一些实施例中,卤代水杨酰苯胺可以减少或消除与皮炎(例如AD)相关的瘙痒、红斑、硬结、表皮脱落、苔藓样硬化、干燥、病变结节、痒疹结节、病变囊泡、病变丘疹或病变肿胀中的一种或多种。
与皮炎,特别是AD相关的具体问题是瘙痒。疾病的这种症状对于受折磨的受试者是不愉快的,并且经常导致应激、焦虑、睡眠紊乱、睡眠剥夺和精神病学影响(包括抑郁和焦虑)中的一种或多种,导致生活质量受损。在试图减轻瘙痒时,动物也易于抓挠病变部位,然而,这会进一步损害病变部位的已受损皮肤,导致表皮脱落、红斑增加、硬化和/或肿胀。与抓挠病变部位相关的对皮肤屏障功能的额外损害也增强了对过敏原和刺激物的暴露,这会触发皮炎的恶化。抓挠病变部位也增加了皮炎感染的风险。因此,在本发明的实施例中,卤代水杨酰苯胺用于减少或消除与皮炎(例如AD)相关的瘙痒症。
可以使用针对与皮炎相关的瘙痒的合适评分系统对受试者的瘙痒进行评估。可能的情况是,使用卤代水杨酰苯胺局部治疗皮炎会导致瘙痒分数与紧挨治疗前的分数相比降低。
卤代水杨酰苯胺可以用于治疗轻度皮炎(例如轻度AD)。
卤代水杨酰苯胺可以用于治疗中度皮炎(例如中度AD)。
卤代水杨酰苯胺可以用于治疗重度皮炎(例如重度AD)。
卤代水杨酰苯胺可以用于治疗中度至重度皮炎(例如中度至重度AD)。
卤代水杨酰苯胺可以用于治疗轻度至中度皮炎(例如轻度至中度AD)。
可以使用已知方法评估皮炎的严重程度。例如评估受试者的皮炎的临床体征的合适的评分系统。适于测定AD严重程度的一种这样的评分方法是犬特应性皮炎程度和严重程度指数(CADESI),例如CADESI-01、CADESI-02或CADESI-03(Olivry等人《CADESI-03的验证,登记患有特应性皮炎的狗的临床试验的严重程度量表(Validation of CADESI-03,aseverity scale for clinical trials enrolling dogs with atopic dermatitis)》。《兽医皮肤病学(Veterinary Dermatology)》,18:78-86),或CADESI-04(Olivry T等,《兽医皮肤病学(Veterinary Dermatology)》。2014年4月;25(2):77-85)。CADESI-4目前由ICADA(国际动物变应性疾病委员会)推荐并且是针对AD的优选评分系统。这些评分系统也可用于对其它类似形式的皮炎进行分级。
CADESI评分定量描述狗的皮肤状况,分别将狗身体红斑、苔藓样变和/或表皮脱落的区域评分为“正常或不存在”(0),“轻度”(1),“中度”(2)或“重度”(3)。CADESI-03与CADESI-02的不同之处在于,其评估的身体部位数量从40个增加到62个,并且包括另一种临床体征(自诱导脱发),并且每个体征的分级范围更广(0到5级)。CADESI-03。与CADESI-03相比,CADESI-04仅需要20个定义的身体部位并且花费大约33%的时间进行。因此,优选的皮炎评分系统是CADESI-04。
可能的情况是,与开始治疗前的分数(基线分数)相比,CADESI分数(例如CADESI-03或优选地CADESI-04分数)可能降低2、4、6或8分。
AD的特征在于急性期和慢性期。急性AD被认为主要由Th2驱动,而在疾病的慢性阶段有向Th1的转换(Gittler等人《过敏临床免疫学杂志(J Allergy Clin Immunol.)》2012年12月;130(6):1344-1354)急性AD病变通常为亮红色,“湿的”和扁平的,慢性时变成暗红、干燥、粘稠。
卤代水杨酰苯胺可用于治疗急性AD。例如,卤代水杨酰苯胺可用于治疗或预防患有急性AD的非人受试者的病变发红(红斑、炎症)、硬化、丘疹形成、瘙痒或表皮脱落。急性AD可以是轻度、中度或重度急性AD,例如中度至重度急性AD或轻度至中度AD。
卤代水杨酰苯胺可以用于治疗慢性形式的皮炎(例如慢性AD)。例如,卤代水杨酰苯胺可用于治疗或预防患有慢性AD的非人受试者的苔藓样变(例如,纹状皮肤或痒疹结节)、瘙痒或表皮脱落。慢性AD可以是轻度、中度或重度慢性AD,例如中度或重度慢性AD。
皮炎病变部位可能会由细菌定殖,例如病变部位可能会由革兰氏阳性细菌定殖。在某些实施例中,卤代水杨酰苯胺用于治疗由革兰氏阳性细菌定植的皮炎病变(例如AD病变)。可定殖病变部位的革兰氏阳性细菌包括但不限于葡萄球菌属、链球菌属、丙酸杆菌或棒状杆菌属。在一些实施例中,革兰氏阳性菌选自葡萄球菌属。在一些实施例中,革兰氏阳性菌选自金黄色葡萄球菌、酿脓链球菌和痤疮丙酸杆菌。在一些实施例中,革兰氏阳性细菌选自乳房链球菌、金黄色葡萄球菌、伪中间型葡萄球菌、中间型葡萄球菌、施氏葡萄球菌和凝固酶阳性葡萄球菌。在一些实施例中,革兰氏阳性菌选自金黄色葡萄球菌、伪中间型葡萄球菌、中间型葡萄球菌、施氏葡萄球菌和猪葡萄球菌。在优选的实施例中,细菌是伪中间型葡萄球菌。例如,细菌可以是耐甲氧西林的菌株,例如耐甲氧西林金黄色葡萄球菌(MRSA)、耐甲氧西林伪中间型葡萄球菌(MRSP)或耐甲氧西林中间型葡萄球菌(MRSI)。
在其它实施例中,皮炎病变不被细菌定植。提及“未定殖”是指病变基本上不含细菌,例如受试者中待治疗的病变携带小于1000CFU/cm
患有某些形式的皮炎(包括AD)的受试者的皮炎易于恶化(潮红)。在AD的情况下,潮红可由例如暴露于刺激物或过敏原或环境条件如升高的温度或湿度的变化引起。因此,卤代水杨酰苯胺可用于预防或治疗非人受试者的皮炎(例如AD)的恶化。卤代水杨酰苯胺可以用于降低非人受试者的皮炎(例如AD)恶化的频率。卤代水杨酰苯胺可以用于降低非人受试者的皮炎(例如AD)恶化的严重程度。卤代水杨酰苯胺可以用于减少非人受试者的皮炎(例如AD)恶化的持续时间。
因此,在实施例中,卤代水杨酰苯胺用于治疗非人受试者的皮炎(例如AD)的恶化。在实施例中,卤代水杨酰苯胺用于预防或降低非人受试者的皮炎(例如AD)恶化的频率。在实施例中,卤代水杨酰苯胺用于降低非人受试者的皮炎(例如,AD)恶化的严重程度。
在本文所述的涉及皮炎恶化的实施例中,所述恶化可以是本文所述的皮炎的一种或多种症状的恶化(例如瘙痒、红斑、硬结或表皮脱落中的一种或多种的恶化)。
本发明的另一方面提供了治疗非人受试者的皮炎(例如,AD)的方法,所述方法包含向所述受试者施用治疗有效量的卤代水杨酰苯胺或其药学上可接受的盐或水合物。所述方法适用于治疗本文所述的皮炎(例如,AD)的所有方面。
本发明的另一方面提供了卤代水杨酰苯胺或其药学上可接受的盐或水合物在制备用于治疗非人受试者皮炎(例如AD)的药物中的用途。所述用途适用于治疗本文所述的皮炎(例如,AD)的所有方面。
在一些实施例中,受试者是伴侣动物,例如狗或猫。
卤代水杨酰苯胺也称为2-羟基-N-苯基苯甲酰胺或2-羟基苯甲酰苯胺。水杨酰苯胺是弱酸性酚类化合物。卤代水杨酰苯胺是被至少一种卤素基团取代的水杨酰苯胺。已知许多卤代水杨酰苯胺衍生物。对AD具有影响的任何卤代水杨酰苯胺可用于本发明。例如,卤代水杨酰苯胺可以是WO 2008/021088中描述的任何氯硝柳胺类似物,其通过引用并入本文。
卤代水杨酰苯胺可以是式(I)的卤代水杨酰苯胺:
其中
X是O或S;
R
R
R
R
L
R
R
R
n和p各自独立地选自0、1、2、3或4,条件是n+p为至少1;
t和v独立地选自0、1和2;
或其药学上可接受的盐或酯或水合物。
在一些实施例中,卤代水杨酰苯胺选自氯硝柳胺、氯氰碘柳胺、羟氯扎胺和雷复尼特,或其药学上可接受的盐或水合物。卤代水杨酰苯胺可以是氯硝柳胺或其药学上可接受的盐。卤代水杨酰苯胺可以是氯硝柳胺或其水合物。卤代水杨酰苯胺可以是氯硝柳胺。在一些实施例中,卤代水杨酰苯胺是无水氯硝柳胺。
卤代水杨酰苯胺可以使用任何合适的给药途径给药,例如口服、局部、肠胃外(例如静脉内、皮下、肌内或腹膜内给药)或作为直肠给药的栓剂。
在一个具体实施例中,将卤代水杨酰苯胺局部施用于受试者。合适地,将卤代水杨酰苯胺局部直接施用于受试者的AD病变部位。当局部施用卤代水杨酰苯胺时,它适合以适合局部施用的剂型的药物组合物的形式施用,例如作为乳膏、软膏、凝胶、泡沫或水性、非水性或油性溶液或悬浮液。在具体的实施例中,将卤代水杨酰苯胺配制成适于局部施用的非水性药物组合物,例如包含卤代水杨酰苯胺(例如氯硝柳胺或其药学上可接受的盐或水合物)的非水性乳膏、软膏、凝胶、洗剂或泡沫。在一些实施例中,将卤代水杨酰苯胺配制成适于局部施用的含水药物组合物,例如包含卤代水杨酰苯胺(例如氯硝柳胺或其药学上可接受的盐或水合物或羟氯扎胺或其药学上可接受的盐或水合物)的含水乳膏、软膏、凝胶、洗剂或泡沫。
在一些实施例中,将卤代水杨酰苯胺(例如氯硝柳胺或其药学上可接受的盐或水合物或羟氯扎胺或其药学上可接受的盐或水合物)配制为点涂或线涂制剂。
在某些实施例中,将卤代水杨酰苯胺配制为包含卤代水杨酰苯胺(例如,选自氯硝柳胺、雷复尼特、羟氯扎胺和氯生太尔,或其药学上可接受的盐或其水合物);和聚乙二醇(PEG)的局部用组合物。
在某些实施例中,将卤代水杨酰苯胺配制成包含卤代水杨酰苯胺(例如,选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺,或其药学上可接受的盐或其水合物)和非聚合二醇(例如亚烷基二醇,例如C
在某些实施例中,将卤代水杨酰苯胺配制为包含卤代水杨酰苯胺(例如,选自氯硝柳胺、雷复尼特、羟氯扎胺和氯生太尔,或其药学上可接受的盐或其水合物)和二醇醚例如2-(2-乙氧基乙氧基)乙醇(Transcutol)的局部用组合物。
在某些实施例中,将卤代水杨酰苯胺配制成非水性局部用组合物,其包含:
(i)卤代水杨酰苯胺(例如,选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺,或其药学上可接受的盐或其水合物);以及
(ii)聚乙二醇(PEG)。
在某些实施例中,将卤代水杨酰苯胺配制为包含卤代水杨酰苯胺(例如,选自氯硝柳胺、雷复尼特、羟氯扎胺和氯生太尔,或其药学上可接受的盐或其水合物)和凝胶形成剂的非水性局部用凝胶组合物。凝胶形成剂可以是本文公开的任何凝胶形成剂。合适地,局部用凝胶组合物还包含PEG。
合适地,如此选择组合物中的PEG,使得组合物与组合物的任何其它组分(例如,以液体、半固体或凝胶组合物的形式)一起可容易地施用、铺展和/或擦到皮肤中。PEG可以具有小于35℃的熔点。在某些实施例中,如此选择PEG以使其是软的或在体温下适当地熔融。例如,PEG可具有32℃或更低,或小于30℃,或小于25℃的熔点。
卤代水杨酰苯胺的存在量可以为本文所述组合物的至多15%重量,例如组合物的0.05-10%重量、0.05-4.5%重量、1-3%重量、1.5-4.5%重量。例如,占组合物重量的约2%或占组合物重量的约4%。
包含卤代水杨酰苯胺的局部用组合物可以在组合物的施用部位(例如AD病变部位)提供大于4.5的局部pH。可以是在局部施用组合物后,组合物在施用部位提供小于6的局部pH。合适地,组合物在局部施用组合物的部位提供约4.5至约6范围内的局部pH。
还提供了包含卤代水杨酰苯胺或其药学上可接受的盐或溶剂合物的点涂或线涂组合物。此类组合物的实例在本文的详细描述中阐述。
本发明的其它方面和特征在下面的详细描述中阐述。
图1示出了与TSS/TAA相关的生物标志物表达的变化,并且发现与媒剂和基线(S100A12、S100A9、PI3、CXCL1和S100A7)相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图2-5示出了生物标志物表达(KRT16、MMP12、IL13、CCL17、CCL22、IL8、LOR、FLG、CD11c真皮、S100A8、S100A12、S100A7、S100A9、IL22、PI3、CXCL1、IL17A、IL19、CAMP和DEFB4A/DEFB4B)的发现与TSS相关的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图6示出了如实例3的研究中发现的单独评分(红斑、水肿/丘疹、渗出/结痂、表皮脱落、苔藓样变和干燥)和TSS之间的相关性。
图7示出了与水肿/丘疹形成相关的生物标志物(IL13、S100A7、S100A8、KRT16、IL22、S100A9、S100A12、CCL17、MMP12、PI3、CCL22、DEFB4A/DEFB4B、IL19和LOR)的表达的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图8示出了与红斑相关的生物标志物(S100A7、S100A9、KRT16、IL13、S100A8、DEFB4A/DEFB4B、PI3、CCL17、S100A12、IL22和MMP12)的表达的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图9示出了与苔藓样变相关的生物标志物(IL22、S100A7、S100A8、S100A12、DEFB4A/DEFB4B、S100A9和LOR)的表达的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检所分析的。
图10示出了与干燥度相关的生物标志物(IL13)的表达的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图11示出了与表皮脱落相关的生物标志物(IL8)的表达的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图12-15示出了发现与TAA相关的生物标志物表达(KRT16、MMP12、IL13、CCL17、CCL22、IL8、LOR、FLG、S100A8、S100A12、S100A7、S100A9、IL22、PI3、DEFB4A/DEFB4B、IL19)的变化,并且发现与基线相比显著变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
图16-25示出了媒剂(A)和氯硝柳胺(B)的生物标志物表达(IL6、IL8、IL17C、IL1B、IL15、IL15RA、IL2、CCL5、IFNG、CXCL9、IL12A/IL12p35、CXCL10、IL13、IL10、IL33、TSLP-R、IL31、IL5、CCL17、CCL18、CCL22、CCL26、IL17A、IL17F、IL23A/IL23p19、CAMP/LL37、IL19、IL12B/IL23p40、DEFB4A/DEFB4B、CXCL1、CXCL2、CCL20、PI3、IL22、S100A7、S100A8、S100A9、S100A12、FLG、PPL、LOR、KRT16、MMP12、IL9和FOXP3)的与基线相比的变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。FCH代表倍数变化。
图26-29示出了媒剂(A)和氯硝柳胺(B)的细胞标志物(CD3、朗格汉斯蛋白、CD11c和FceR1)的与基线相比的变化,如在实例3的研究中在第22天进行的皮肤活检中分析的。
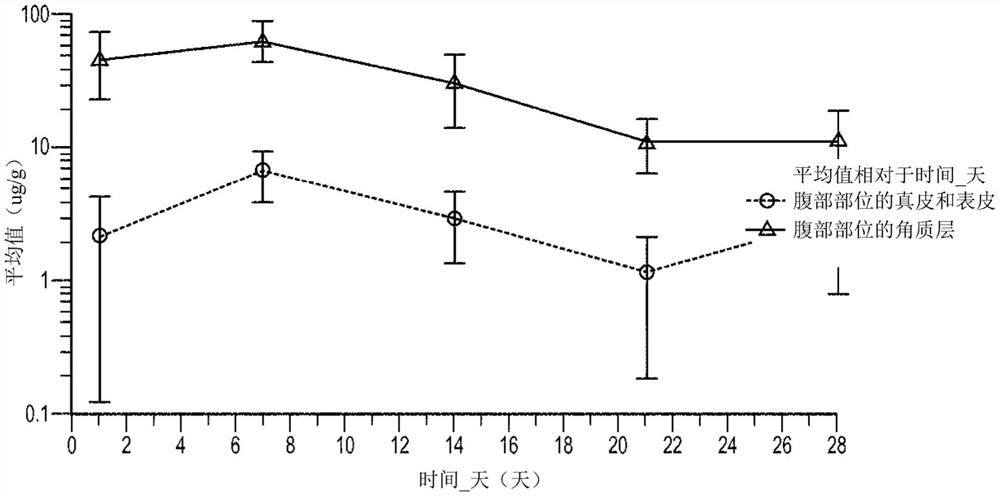
图30说明了在实例4的研究中,在狗口服或局部施用后,皮肤胁腹角质层中羟氯扎胺(μg/g)的算术分布。
图31说明了在实例5的研究中在狗中局部施用后获得的羟氯扎胺(μg/L)的平均血浆浓度-时间。
图32说明了在实例5的研究中在狗中局部施用后获得的羟氯扎胺的平均(μg/g)皮肤活检浓度-时间。
图33说明了在实例5的研究中在6个区域对狗局部施用后获得的羟氯扎胺的平均(μg/g)角质层(条)浓度-时间。
具体实施方式
除非另有说明,否则说明书和权利要求书中使用的以下术语具有以下陈述的含义。
术语“治疗”是指在治疗或改善疾病、病理或病症中成功的任何指征,包括任何客观或主观参数如减轻;症状缓解;减轻症状或使病理或病症对患者更耐受;退化或衰退速率减慢;使退化的终点更不衰弱;改善患者的身体或精神健康。例如,本文的某些方法通过减少皮炎(例如AD)的症状来治疗皮炎(例如AD)。皮炎的症状是已知的或者可以由本领域普通技术人员容易地确定。术语“治疗”及其变化形式包括预防病理、病症或疾病(预防皮炎(例如AD)的一种或多种症状的发展)。
提及“减少或消除”皮炎的一种或多种症状的治疗应理解为对这些症状的“治疗”。因此,提及减少或消除症状包括对症状的治疗。因此,本发明还包括卤代水杨酰苯胺或其药用盐,其用于治疗本文公开的与皮炎(例如AD)相关的一种或多种症状,例如治疗与皮炎(例如特应性皮炎)相关的瘙痒、红斑、硬结、表皮脱落、苔藓样变、鳞屑、渗出、结痂、干燥、脱落、病变结节、痒疹结节、病变囊泡、病变丘疹、病变斑块或病变肿胀中的一种或多种。因此,它可以是用于治疗与皮炎(例如AD)相关的瘙痒的卤代水杨酰苯胺。作为另一个实例,卤代水杨酰苯胺可以用于治疗与皮炎(例如AD)相关的红斑。
术语“相关的”或“与…相关”在与疾病(例如,AD)相关的物质或物质活性或功能的上下文中是指疾病由物质或物质活性或功能(全部或部分)引起,或疾病的症状由物质或物质活性或功能(全部或部分)引起。
当施用本说明书中描述的化合物或盐以治疗病症时,“治疗有效量”是足以减轻或完全缓解病症的症状或其它有害作用;治愈紊乱;逆转、完全停止或减缓病症的进展;或降低疾病恶化的风险的量。
菌落形成单位(CFU)是样本中活细菌细胞数目的近似估计。“存活”定义为细胞在受控条件下通过二分裂繁殖的能力。
术语“药学上可接受的盐”是指保留本文所述化合物的生物学效力和性质并且在生物学上或其他方面不是所不希望的盐。提及“药学上可接受的盐”旨在涵盖适于向非人受试者施用的所有盐形式,并且因此涵盖兽医学上可接受的盐。药学上可接受的盐是本领域技术人员众所周知的。具体的盐包括乙醇胺或哌嗪盐。因此,本文提及“卤代水杨酰苯胺的盐”可以是指卤代水杨酰苯胺的药学上可接受的盐。
本文使用的术语“溶剂合物”是指溶质(例如化合物或化合物的盐)和溶剂的复合物。如果溶剂是水,则溶剂合物可以称为水合物,例如一水合物、二水合物、三水合物等,这取决于每分子底物存在的水分子的数目。提及“卤代水杨酰苯胺或其药学上可接受的盐或水合物”包括卤代水杨酰苯胺的水合物和卤代水杨酰苯胺的盐的水合物。
术语“卤代”或“卤素”是指元素周期表第17族的卤素之一。该术语特别是指氟、氯、溴和碘。优选地,该术语是指氟、氯或溴,特别是氟。
术语C
术语“C
术语“C
提及卤代水杨酰苯胺的“酯”是指与卤代水杨酰苯胺上可用的羟基或羧基形成的酯(RC(O)O-或ROC(O)-)。例如,通过苯甲酰胺的2-羟基在卤代水杨酰苯胺中酯化形成的酯。所述酯可在局部施用水杨酰苯胺后裂解以提供母体分子的游离羟基或羧基,从而提供卤代水杨酰苯胺的前药。酯可以是例如C
提及“烷基单羟基醇”是指具有一个羟基的烷基醇,烷基单羟基醇的代表性实例包括短链烷基单羟基醇,特别是C
提及“烷醇胺”是指被一个、两个或三个烷基醇部分(例如一个、两个或三个C
本文提及的“PEG x00”是指平均分子量为x00的聚乙二醇。例如,PEG 400是指平均分子量为400的PEG。除非另有说明,否则本文提及的聚合物如PEG的分子量是指聚合物的数均分子量(Mn)。数均分子量可以使用熟知的方法测量,例如通过凝胶渗透色谱法或1H NMR端基分析。此类方法包括如Guadalupe等人《聚合物合成、表征和加工手册,第一版,2013年(Handbook of Polymer Synthesis,Characterization,and Processing,First Edition,2013)》中所述的GPC分析以及如Page等人所描述的端基分析,见《分析化学(Anal.Chem.)》1964,36(10),第1981-1985页。
本文公开的方法涉及治疗非人受试者的皮炎。除非另有说明,本文提及的“受试者”或“患者”是指非人受试者。
卤代水杨酰苯胺可以以卤代水杨酰苯胺的前药的形式施用于受试者。如本文所用,术语“前药”是指卤代水杨酰苯胺上的共价键合部分,其改变化合物的生物和/或物理特性。活性卤代水杨酰苯胺在施用(例如局部施用)前药化合物后释放。前药可通过例如修饰母体化合物中的合适官能团来形成,例如可修饰羧基或羟基以形成酯,其在局部施用前药后裂解。各种前药策略是已知的并且描述于例如以下文献中:
a)《酶学方法(Methods in Enzymology)》,第42卷,第309-396页,由K.Widder等人编辑(美国学术出版社(Academic Press),1985);
b)《前药设计(Design of Pro-drugs)》,H.Bundgaard编辑,(爱思唯尔(Elsevier),1985);
c)《药物设计与开发教材(Textbook of Drug Design and Development)》,Krogsgaard-Larsen、
d)H.Bundgaard,第5章“前药的设计和应用(Design and Application of Pro-drugs)”,H.Bundgaard第113-191页(1991);以及
e)H.Bundgaard,《先进药物输送评论(Advanced Drug Delivery Reviews)》,8,1-38(1992)。
除非另有说明,本文提及的“卤代水杨酰苯胺或其药学上可接受的盐的%重量”是指卤代水杨酰苯胺的游离酸(即非盐形式)的量。例如,提及包含“5%重量的氯硝柳胺或其药学上可接受的盐”的组合物是指包含5%重量的游离酸形式的氯硝柳胺的组合物。因此,当这样的组合物包含氯硝柳胺的盐时,考虑到也存在于组合物中的盐抗衡离子,组合物中氯硝柳胺盐的绝对量将高于5%重量。类似地,提及“卤代水杨酰苯胺或其药学上可接受的盐的重量/体积%(%w/v)”是指每单位体积的卤代水杨酰苯胺的游离酸(即非盐形式)的浓度,并且计算为%wt/v=(以g计的水杨酰苯胺的重量/以mL计的组合物的体积)*100%。
本文使用的术语“凝胶”是指半固体,明显均匀的物质,其可以是弹性的和胶状的(如在明胶中)。凝胶包含其中分散有液相的三维聚合物或无机基质。凝胶基质包含在溶剂(例如低分子量PEG)存在下溶胀但不溶解的物理或化学交联的聚合物或共聚物的网络。凝胶基质内的交联可以是物理交联(例如通过氢键或离子交联)或可以是共价交联。在一些实施例中,凝胶组合物是非水性凝胶组合物,其中卤代水杨酰苯胺溶解或分散在合适的非水性介质(例如PEG)中。然后将非水性介质/卤代水杨酰苯胺溶液或分散体分散在凝胶的聚合交联网络中。或者,卤代水杨酰苯胺可以溶解或分散在凝胶的聚合交联网络中。凝胶优选外观透明;然而,也考虑了混浊的凝胶。通常,凝胶形成剂,例如凝胶形成聚合物以约0.5-15%重量,通常0.5-2%重量的量存在于凝胶中。美国药典将凝胶定义为由小无机颗粒或大有机分子组成的分散体组成的半固体系统,其被液体包围和渗透。
提及“非水性”组合物(例如非水性局部用组合物)是指该组合物是无水的并且因此基本上不含水。例如,本文公开的包括凝胶、乳膏和泡沫组合物的组合物含有按重量计小于5%、小于1%或合适地小于0.01%,优选小于0.001%的水。优选的非水性组合物是无水且不含可检测水的那些。
质子有机溶剂是能够氢键键合的那些。质子有机溶剂的最常见实例包括但不限于醇和羧酸。
非质子有机溶剂是不能氢键键合的那些。常见的非质子有机溶剂包括但不限于醚、二甲基甲酰胺(DMF)、二甲亚砜(DMSO)和乙腈。
在数值的上下文中提及“约”旨在包括值+/-10%。例如,约20%包括18%至22%的范围。
在本说明书的整个描述和权利要求书中,词语“包含”和“含有”以及它们的变型意味着“包括但不限于”,并且它们不旨在(并且不)排除其他部分、添加剂、组分、整体或步骤。在本说明书的整个描述和权利要求书中,单数包括复数,除非上下文另有要求。特别地,在使用不定冠词的情况下,说明书应理解为涵盖复数以及单数,除非上下文另有要求。
结合本发明的特定方面、实施例或实例描述的特征、整体、特性、化合物、化学部分或基团应理解为适用于本文描述的任何其他方面,实施例或实例,除非与其不相容。本说明书(包括任何所附权利要求、摘要和附图)中公开的所有特征和/或如此公开的任何方法或过程的所有步骤可以以任何组合来组合,除了其中至少一些这样的特征和/或步骤相互排斥的组合。本发明不限于任何前述实施例的细节。本发明扩展到本说明书(包括任何所附权利要求、摘要和附图)中公开的特征的任何新颖特征或任何新颖组合,或者扩展到如此公开的任何方法或过程的步骤的任何新颖步骤或任何新颖组合。
读者的注意力指向与本申请相关的与本说明书同时提交或在本说明书之前提交的并且与本说明书一起对公众检查开放的所有论文和文献,并且所有这些论文和文献的内容通过引用并入本文。
卤代水杨酰苯胺
对皮炎(例如AD)症状具有有益效果的任何卤代水杨酰苯胺可用于治疗本文所述的皮炎(例如AD)。
卤代水杨酰苯胺可以是式(I)的卤代水杨酰苯胺:
其中
X是O或S;
R
R
R
R
L
R
R
R
n和p各自独立地选自0、1、2、3或4,条件是n+p为至少1;
t和v独立地选自0、1和2;
或其药学上可接受的盐或酯或水合物。
以下编号段落中的以下陈述适用于式(I)的化合物。这些陈述是独立且可互换的。换言之,在以下任何一个陈述中描述的任何特征可以(在化学上允许的情况下)与在以下一个或多个其他陈述中描述的特征组合。特别地,当在本说明书中例示或说明化合物时,以下描述该化合物的特征的任何两种或更多种陈述(以任何普遍性水平表达)可组合以表示预期形成本说明书中本发明公开内容的一部分的主题。
1.X是O。
2.R
3.R
4.R
5.R
6.R
7.R
8.R
9.R
10.R
11.R
12.R
13.R
14.R
15.R
16.R
17.L
18.R
19.R
20.R
21.L
22.R
23.R
24.t=0或1。
25.t=0。
26.v=0或1。
27.v=0。
28.o为1。
29.v=1且R
30.v=1且R
31.式(I)的化合物或其药学上可接受的盐。
特定化合物为式(I)的化合物或其药学上可接受的盐、水合物或酯,其中:
X是O;
R
R
R
R
L
R
R
n和p各自独立地选自0、1、2、3或4,条件是n+p为至少1;
t和v独立地选自0、1和2;
或其药学上可接受的盐或酯。
卤代水杨酰苯胺可以选自:
或其药学上可接受的盐或溶剂合物(例如水合物)。
卤代水杨酰苯胺可以是硫代酰胺衍生物,例如溴替尼:
或其药学上可接受的盐、溶剂合物(例如水合物)。
卤代水杨酰苯胺可以选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、雷复尼特、羟氯扎胺、雷索坦、氯碘沙尼、二溴沙仑、三溴沙仑、溴硫尼胺和氯硝柳胺,或其药学上可接受的盐或前药或衍生物。
卤代水杨酰苯胺可以选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、雷复尼特、羟氯扎胺、雷索坦、二溴沙仑、三溴沙仑和氯硝柳胺,或其药学上可接受的盐或酯。
卤代水杨酰苯胺可以选自由以下组成的组:氯碘沙尼、氯氰碘柳胺、羟氯扎胺、雷复尼特、三溴沙仑或其药学上可接受的盐或酯。
卤代水杨酰苯胺可以选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、雷复尼特、羟氯扎胺、雷索坦、氯碘沙尼、二溴沙仑、三溴沙仑、溴硫尼胺和氯硝柳胺,或其药学上可接受的盐或水合物。
卤代水杨酰苯胺可以选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、雷复尼特、羟氯扎胺、雷索坦、氯复尼特、二溴沙仑、三溴沙仑和氯硝柳胺,或其药学上可接受的盐或水合物。
卤代水杨酰苯胺可以选自由以下组成的组:氯硝柳胺、氯碘沙尼、氯氰碘柳胺、羟氯扎胺、雷复尼特和三溴沙仑,或其药学上可接受的盐或水合物。
卤代水杨酰苯胺可以选自由以下组成的组:氯碘沙尼、氯氰碘柳胺、羟氯扎胺、雷复尼特和三溴沙仑,或其药学上可接受的盐或水合物。
卤代水杨酰苯胺可以选自由以下组成的组:氯碘沙尼、氯氰碘柳胺、雷复尼特和三溴沙仑,或其药学上可接受的盐或水合物。
卤代水杨酰苯胺可以选自由以下组成的组:氯硝柳胺和羟氯扎胺,或其药学上可接受的盐或水合物。
卤代水杨酰苯胺可以选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、雷复尼特、羟氯扎胺、雷索坦、氯碘沙尼、二溴沙仑、三溴沙仑、溴硫尼胺和氯硝柳胺。
卤代水杨酰苯胺可以选自由以下组成的组:氯硝柳胺、氯氰碘柳胺、羟氯扎胺和雷复尼特,或其药学上可接受的盐。
卤代水杨酰苯胺可以是氯碘沙尼或其药学上可接受的盐或酯,例如卤代水杨酰苯胺是氯碘沙尼或其药学上可接受的盐或水合物,合适地卤代水杨酰苯胺是氯碘沙尼。
卤代水杨酰苯胺可以是氯氰碘柳胺或其药学上可接受的盐或水合物,例如卤代水杨酰苯胺是氯氰碘柳胺或其药学上可接受的盐,合适地卤代水杨酰苯胺是氯氰碘柳胺。
卤代水杨酰苯胺可以是五氯柳胺或其药学上可接受的盐或酯,例如卤代水杨酰苯胺是五氯柳胺或其药学上可接受的盐或水合物,合适地卤代水杨酰苯胺是五氯柳胺。
卤代水杨酰苯胺可以是雷复尼特或其药学上可接受的盐或水合物,例如卤代水杨酰苯胺是雷复尼特或其药学上可接受的盐,合适地卤代水杨酰苯胺是雷复尼特。
卤代水杨酰苯胺可以是三溴沙仑或其药学上可接受的盐或水合物,例如卤代水杨酰苯胺是三溴沙仑或其药学上可接受的盐,合适地特别是卤代水杨酰苯胺是三溴沙仑。
卤代水杨酰苯胺可以是氯硝柳胺或其药学上可接受的盐或水合物,例如卤代水杨酰苯胺是氯硝柳胺或其药学上可接受的盐。
在某些实施例中,卤代水杨酰苯胺是游离酸形式的氯硝柳胺。
在某些实施例中,卤代水杨酰苯胺是氯硝柳胺的药学上可接受的盐,例如乙醇胺盐或哌嗪盐。
卤代水杨酰苯胺可以是氯硝柳胺或其药学上可接受的盐的水合物。然而,通常优选氯硝柳胺不以水合物的形式施用于受试者。在某些实施例中,氯硝柳胺为无水氯硝柳胺或其药学上可接受的盐。在一个具体实施例中,氯硝柳胺为无水氯硝柳胺。
药物组合物
卤代水杨酰苯胺适合以包含卤代水杨酰苯胺或其药学上可接受的盐或水合物和药学上可接受的赋形剂的药物组合物的形式施用于受试者。
用于选择和制备合适的药物组合物的常规程序描述于例如《药物—剂型设计的科学(Pharmaceuticals-The Science of Dosage Form Designs)》,M.E.Aulton,丘吉尔利文斯敦(Churchill Livingstone),1988。
组合物可以呈适合于口服使用(例如作为片剂、锭剂、硬或软胶囊、水性或油性悬浮液、乳液、可分散粉末或颗粒、糖浆或酏剂),适合于局部使用(例如作为乳膏、软膏、凝胶、泡沫或水性或油性溶液或悬浮液),适合于通过吸入给药(例如作为细分散粉末或液体气溶胶),适合于通过吹入给药(例如作为微细粉末)或适合于肠胃外给药(例如作为用于静脉内、皮下、肌内或腹膜内给药的无菌水性或油性溶液或作为用于直肠给药的栓剂)的形式。优选地卤代水杨酰苯胺以局部用药物组合物的形式给药。
卤代水杨酰苯胺适当地与适当和方便量的赋形剂混合,赋形剂的量可占组合物总重量的约5%至约99%。组合物可以使用本领域公知的常规方法制备。
局部用药物组合物
在实施例中,将卤代水杨酰苯胺局部施用于非人受试者以治疗皮炎(例如AD)。
在一些实施例中,卤代水杨酰苯胺的存在量为本文所述组合物的至多15重量%,例如组合物的0.05%至10%重量、组合物的0.05%至5%重量、0.1%至4.5%重量、0.1%至7.5%重量、1%至15%重量、1%至12%重量、1%至3%重量、1.5%至4.5%重量、2%至15%重量、2%至12%重量、3%至12%重量、4%至12%重量、7%至12%重量或8%至11%重量。卤代水杨酰苯胺(例如氧氯唑胺或氯硝柳胺)的存在量可以是组合物重量的约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%。例如,卤代水杨酰苯胺(例如羟氯扎胺或氯硝柳胺)以按组合物的重量计约2%或按组合物的重量计约4%存在于组合物中。卤代水杨酰苯胺(例如羟氯扎胺或氯硝柳胺)的存在量可以为组合物重量/体积的约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%。在一个具体的实施例中,卤代水杨酰苯胺在羟氯扎胺中并且以按组合物的重量计7至12%或按组合物的重量计约9%至11%的量存在于组合物中,例如其中羟氯扎胺以按组合物的重量/体积计约10%的量存在。
在某些实施例中,包含卤代水杨酰苯胺的组合物不包含二甲亚砜(DMSO)。
在一些实施例中,卤代水杨酰苯胺以至多250mg/ml,例如200mg/ml或更少,150mg/ml或更少,100mg/ml或更少或者50mg/ml或更少的浓度存在于组合物中。例如,卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺)以0.5mg/ml至200mg/ml,1mg/ml至150mg/mL,1mg/mL至120mg/mL,1mg/mL至100mg/mL,1mg/mL至50mg/ml,1mg/mL至20mg/mL或1mg/mL至10mg/mL的浓度存在于组合物中。在一些实施例中,卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺)以50mg/mL至200mg/mL,50mg/mL至200,或80mg/mL至120mg/mL,例如约100mg/mL的浓度存在于组合物中。
在一些实施例中,局部用组合物是包含卤代水杨酰苯胺或其药学上可接受的盐或水合物的水性局部用组合物。水性局部用组合物合适地包含至少5%重量的水和一种或多种药学上可接受的赋形剂。
在其它实施例中,局部用组合物为包含卤代水杨酰苯胺或其药学上可接受的盐或水合物的非水性局部用组合物。
局部用组合物可以是适于局部给药的任何形式,例如乳膏、软膏、凝胶、泡沫或包含卤代水杨酰苯胺的水性、非水性或油性溶液或悬浮液。在一些实施例中,局部用组合物可以是包含卤代水杨酰苯胺和凝胶形成剂的水性或非水性凝胶的形式。凝胶形成剂可以是任何合适的凝胶形成剂,包括但不限于本文所述的任何凝胶形成剂。在一些实施例中,局部用组合物可以是包含卤代水杨酰苯胺和合适的水性乳膏或非水性软膏基质的水性乳膏或软膏的形式。在一些实施例中,局部用组合物可以是包含卤代水杨酰苯胺和合适的非水性乳膏或非水性软膏基质的非水性乳膏或软膏的形式。
合适地,局部用组合物是点涂、浇涂或线涂局部用组合物。点涂组合物施用于动物身体上,动物肩部或颈部之间的单个点。活性成分通过表皮分布以提供治疗有效剂量的卤代水杨酰苯胺。
本文提及的“点涂”组合物是指包含卤代水杨酰苯胺的组合物,其中将该组合物局部施用(优选地作为单一单位剂量)至受试者皮肤的单一局部区域(即斑点)。
本文提及的“线涂”组合物是指包含卤代水杨酰苯胺的组合物,其中将该组合物以线或条的形式局部施用于受试者的皮肤上。合适地,线涂组合物局部施用于受试者(例如狗或猫)的皮肤,从尾部基部开始沿着脊柱至肩胛骨,或从背部中部沿着脊柱至肩胛骨,或更少。“线涂”施用的长度将取决于所治疗的受试者。例如,线或条约30cm,或20cm,或15cm,或10cm,或5cm长。优选地,线或条的长度为约10cm。线涂组合物也可以围绕待治疗的特定皮肤区域(例如受感染的皮肤区域或皮炎病变部位)特异性施用。将点涂或线涂组合物适当地配制成适于动物体重和/或大小的单位剂量,其中将整个剂量以单次施用的方式施用于动物。
浇泼(pour-on)或线涂(line-on)组合物适合以线或条的形式施用于非人受试者的皮肤。这样的组合物特别适用于大型动物如马或牛以及小型非人哺乳动物(例如狗或猫)。浇泼或线涂组合物适用于对抗非人受试者的毛皮或毛发。
可以使用已知的其中溶解或分散有卤代水杨酰苯胺的载体或“基质”来制备局部用组合物。例如,局部用组合物可包含溶解或分散在合适的基质制剂中的卤代水杨酰苯胺,所述基质制剂选自油性基质(例如凡士林、白凡士林、黄软膏或白软膏)、吸收基质(例如亲水性凡士林或羊毛脂)、水可除去基质(水包油乳液);水溶性基质(例如聚乙二醇)。
非水性局部用组合物
在具体的实施例中,将卤代水杨酰苯胺配制成适于局部给药的非水性药物组合物。例如,包含卤代水杨酰苯胺(例如氯硝柳胺或其药学上可接受的盐或水合物)的非水性乳膏、软膏、凝胶或泡沫。
在某些实施例中,非水性局部用组合物包含:
(i)卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物);以及
(ii)聚乙二醇(PEG),优选地熔点小于40℃的PEG。
在某些实施例中,非水性组合物包含:
(i)卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物;以及
(ii)大于60%重量的PEG,优选地其中PEG的平均分子量为800或更小,特别是600或更小。例如,PEG的平均分子量小于800。PEG的平均分子量可以小于400。
在某些实施例中,组合物还包含非聚合二醇(例如亚烷基二醇,例如C
在某些实施例中,非水性局部用组合物包含丙二醇。因此,所述组合物可包含:
(i)卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物;
(ii)聚乙二醇(PEG),(优选地熔点小于40℃的PEG);以及
(iii)C
在某些实施例中,非水性局部用组合物包含:
(i)0.1至5%重量的卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物;
(ii)熔点小于40℃的聚乙二醇(PEG);以及
(iii)0.5至30%重量(例如5至25%重量)的非聚合二醇(优选地丙二醇)。
可用于非水性组合物中的优选地平均分子量小于600的PEG的实例在下文“聚乙二醇(PEG)”部分更详细地描述。
非水性组合物可包含按重量计至多10%、至多20%、至多30%、至多35%、至多40%、至多45%、至多50%或至多55%的PEG。例如,其中PEG的下限是1%重量,上限是本段中给出的任何值。例如,其中PEG的下限是5%重量,上限是本段中列出的任何值(例如5%重量至20、30、40、50、60、70、80、90或95%重量PEG的范围)。
在一些实施例中,已经发现组合物中高浓度的PEG提供了具有有利特性的非水性局部用组合物,例如当局部施用于皮肤时改善的皮肤渗透和/或良好的耐受性中的一种或多种。本文所述的某些组合物在皮肤组织(例如真皮和表皮)中提供高浓度的卤代水杨酰苯胺,并且在全身暴露于(例如在血浆中)卤代水杨酰苯胺的水平非常低。因此,期望组合物提供例如对皮肤状况的有效局部治疗,而几乎没有或没有全身性副作用,因为全身性暴露是低的。预期这样的组合物在有益的治疗效果和可能与卤代水杨酰苯胺相关的不期望的全身性副作用的发作之间提供宽的治疗窗口。这种副作用可能是全身毒性。
可以是非水性组合物包含大于65%、大于70%、大于75%、大于80%、大于85%、大于90%、大于95%、大于96%、大于97%、大于98%或大于99%的PEG(优选地具有600或更小的平均分子量,例如具有400或更小的平均分子量的PEG);并且其中%是按所述组合物的重量计。组合物中可存在的PEG的其它量描述于“聚乙二醇(PEG)”部分。
卤代水杨酰苯胺或其药学上可接受的盐可以以0.01%至10%,例如0.01%至7.5%、0.01%至7%、0.01%至6.5%、0.01%至6%、0.01%至5.5%、0.01%至5%、0.01%至4.5%、0.01%至4%、0.01%至3.5%、0.01%至3%、0.1%至5%、0.1%至4.5%、0.1%至4%、0.1%至3.5%、0.1至3%、0.1至2.5%、0.1至2%、0.1至1.5%、0.1至1%或0.5至3%、2%至12%、从4%至12%或从9%至约11%、例如约1%、约2%、约2.5%、约3%、约4%、约4.5%、约5%、约6%、约7%或约10%的量存在于非水性组合物中,其中%是按组合物的重量计。本文描述了可以使用的卤代水杨酰苯胺的合适实例,例如氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺,或其药学上可接受的盐或水合物。卤代水杨酰苯胺可以是水合物的形式,然而,在本文所述的非水性组合物中这是不太优选的。因此,优选卤代水杨酰苯胺为基本上无水的形式。
可以是本发明的非水性组合物包含:
(i)按重量计0.01%至7.5%,诸如0.01%至4.5%(例如0.1%至4%,或0.1至3.5%,或0.1至3%或约2%,或约4%)的卤代水杨酰苯胺或其药学上可接受的盐;以及
(ii)按重量计至少70%(例如至少90%)的PEG,其中PEG的平均分子量是600或更小(例如小于600或从约200至约600或约400)。
可以是本文所述的非水性组合物还包含极性有机溶剂,例如选自亚烷基二醇(例如丙二醇)、2-(2-乙氧基乙氧基)乙醇、甘油、聚乙二醇硬脂基醚(例如聚乙二醇15硬脂基醚)或聚乙二醇异硬脂酸酯或脂肪醇,例如C
可以是本文所述的非水性组合物还包含二醇,例如亚烷基二醇(例如丙二醇)。组合物可包含按重量计约5%至约30%、约10%至约30%、或约14%至约28%的二醇,特别是丙二醇。
本文所述的非水性组合物还可包含2-(2-乙氧基乙氧基)乙醇。组合物可包含按重量计约1%至约25%,约5%至约20%或约10%至约20%的2-(2-乙氧基乙氧基)乙醇。
可以是本文所述的非水性组合物还包含甘油。组合物可包含按重量计约5%至约30%、约10%至约30%、或约15%至25%的甘油。
组合物可以包含一种或多种非极性赋形剂,例如一种或多种非极性油、烃溶剂或蜡。组合物可以包含一种或多种选自芳族或脂族酯、矿物油、植物油和长链或中链甘油三酯的非极性赋形剂。例如,非极性赋形剂可选自矿物油(例如液体石蜡或石蜡)和中链甘油三酯中的一种或多种。非极性赋形剂可以以组合物重量的约2%至约50%、约5%至约40%、约5%至约30%或约5%至25%的量存在于组合物中。
本文所述的非水性组合物还可包含一种或多种表面活性剂或乳化剂,例如离子型或非离子型表面活性剂或乳化剂。表面活性剂或乳化剂的代表性实例包括本文所述的那些中的任一种,例如聚乙二醇化脂肪酸甘油酯(labrasol)、聚氧乙烯二醇脱水山梨糖醇烷基酯(聚山梨醇酯)、聚氧乙烯二醇烷基醚(Brij)、脂肪醇的聚氧乙烯醚(鲸蜡硬脂醇聚醚)或甘油的脂肪酸酯(例如硬脂酸甘油酯)。表面活性剂或乳化剂可以按组合物的重量计约0.1%至约15%、约0.2%至约10%、或约0.2%至约5%的量存在于组合物中。
在某些实施例中,非水组合物包含非水性乳液或微乳液。非水性乳液或微乳液组合物特别适于提供非水局部用乳膏组合物形式的组合物。非水性乳液包含非水亲水相(合适地包含极性赋形剂)和与亲水相不混溶的非水疏水相(合适地包含非极性赋形剂如油)。亲水相可以包含乳液的连续相,并且疏水相作为乳液的不连续相分散在亲水相中。在某些实施例中,非水疏水相包含乳液的连续相,并且非水相作为乳液的不连续相分散在非水疏水相内。
在某些实施例中,非水亲水相包含卤代水杨酰苯胺、PEG和任选地本文所述的极性溶剂中的一种或多种。因此,非水亲水相可以包含氯硝柳胺、PEG和任选地一种或多种极性溶剂,所述极性溶剂选自丙二醇、2-(2-乙氧基乙氧基)乙醇、甘油、聚乙二醇硬脂基醚(例如聚乙二醇15硬脂基醚)和脂肪醇,例如C
乳液或微乳液的非水疏水相可以包含本文所述的非极性赋形剂中的一种或多种,例如矿物油、植物油和长链或中链甘油三酯。
在组合物为非水性乳液或微乳液形式的那些实施例中,组合物合适地包含表面活性剂或乳化剂,例如本文所述的表面活性剂或乳化剂中的一种或多种。
合适地,非水组合物包含卤代水杨酰苯胺的溶液。因此,优选卤代水杨酰苯胺完全溶解在非水组合物中。然而,预期卤代水杨酰苯胺可以作为分散体存在于组合物中。或者,在一些实施例中,至少一部分卤代水杨酰苯胺溶解在组合物中。在该实施例中,优选至少80%,优选地至少90%,更优选地至少95%重量的卤代水杨酰苯胺溶解在组合物中。
非水性凝胶组合物
在某些实施例中,本发明的非水性局部用组合物为非水性局部用凝胶组合物的形式。
在某些实施例中,提供了非水性局部用凝胶组合物,其包含:
(i)卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物;以及
(ii)熔点小于40℃的PEG;以及
(iii)凝胶形成剂。
在某些实施例中,提供了非水性局部用凝胶组合物,其包含:
(i)卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物;
(ii)大于60%重量的PEG,优选地其中所述PEG的平均分子量小于600;以及
(iii)凝胶形成剂。
非水凝胶组合物的具体方面描述如下。
凝胶形成剂
本文公开的组合物中存在的凝胶形成剂可以是无机凝胶形成剂。凝胶形成剂可以是凝胶形成聚合物。
凝胶形成剂可以是无机凝胶形成剂,例如膨润土或二氧化硅。凝胶形成剂可以是硅酸镁铝
凝胶形成剂可以是凝胶形成聚合物。凝胶形成聚合物可以是亲水性凝胶形成聚合物。凝胶形成聚合物可选自由以下组成的组:明胶;琼脂;琼脂糖;果胶;角叉菜胶;壳聚糖;藻酸盐;淀粉;淀粉组分(例如直链淀粉或支链淀粉);黄蓍胶;黄原胶;阿拉伯树胶(acaciagum);瓜尔胶;结冷胶;刺槐豆胶;聚氨酯;聚醚聚氨酯;纤维素;纤维素醚类(例如甲基纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素或羟丙基纤维素),纤维素酯、乙酸纤维素、三乙酸纤维素;交联聚乙烯醇;丙烯酸、丙烯酸羟烷基酯、丙烯酸羟乙酯、二乙二醇单丙烯酸酯、丙烯酸2-羟丙酯或丙烯酸3-羟丙酯的聚合物和共聚物;卡波姆(交联聚丙烯酸),例如卡波姆910、934P、940GE、941GE、971P、974P;甲基丙烯酸、甲基丙烯酸羟乙酯、二乙二醇单甲基丙烯酸酯、甲基丙烯酸2-羟丙酯、甲基丙烯酸3-羟丙酯或二丙二醇单甲基丙烯酸酯的聚合物和共聚物;乙烯基吡咯烷酮聚合物;聚合物和共聚物或丙烯酰胺、N-甲基丙烯酰胺、N-丙基丙烯酰胺;甲基丙烯酰胺、N-异丙基甲基丙烯酰胺,或N-2-羟乙基甲基丙烯酰胺;泊洛沙姆(三嵌段共聚物,其包含侧接两个聚氧乙烯嵌段的中心聚氧丙烯嵌段,例如
凝胶形成聚合物可以是树胶,例如选自黄蓍胶,黄原胶的树胶;阿拉伯树胶(acacia gum);瓜尔胶;结冷胶刺槐豆胶。
凝胶形成聚合物可以是纤维素醚,例如甲基纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或羟丙基纤维素。
在一个具体实施例中,凝胶形成剂是卡波姆。卡波姆是高分子量交联聚(丙烯酸)聚合物。聚合物可以通过多元醇烯丙基醚(例如烯丙基蔗糖或烯丙基季戊四醇)交联。卡波姆可以是均聚物,例如910、934P、940GE、941GE、971P、974P,其中“GE”是指医用级和“P”口服级。也可以使用卡波姆聚合物的衍生物,例如包含卡波姆聚合物的Carbopol共聚体,所述卡波姆聚合物包含聚乙二醇和长链烷基酸酯的嵌段共聚物,这些衍生物可以ETD 2020NF和Ultrez 10NF从路博润公司(Lubrizol)商购获得。
卡波姆(也称为Carbopols)是公知的,并且在针对卡波姆的《美国药典/国家处方集(USP/NF)(United States Pharmacopeia/National Formulary)专论和欧洲药典(Ph.Eur.)卡波姆专论中进行了描述,在此引入作为参考。
卡波姆可具有约4,000至约70,000,例如约10,000至约60,000,约20,000至约50,000,约25,000至约45,000或约29,400至约39,400cP的粘度,其中粘度是卡波姆在水中的0.5wt%溶液的粘度,在25℃下中和至pH 7.3-7.8,使用Brookfield RVT,20rpm,转子#6测量。
适当地,卡波姆包含约56%重量至约68.0%重量的羧酸(-COOH)基团。存在于卡波姆中的羧基的比例可以使用已知方法测定,例如通过用NaOH滴定聚合物的水溶液或分散体。
适当地,卡波姆基本上不含残留的苯(例如含有小于0.5ppm)。因此,优选在聚合过程中不使用苯作为溶剂制备卡波姆。优选的卡波姆是在聚合期间使用乙酸乙酯和任选地环己烷作为溶剂制备的那些。
在本发明中用作胶凝剂的具体卡波姆是卡波姆974P。该卡波姆合适地具有29400至39400cP的粘度(0.5%水溶液中和至pH 7.3-7.8并在25℃下使用Brookfield RVT,20rpm,转子#6测量)。卡波姆通常具有56-68%的羧酸含量。
通常,卡波姆凝胶通过将卡波姆分散在水中形成,这导致聚合物中存在的羧基电离。然后使用碱中和所得溶液或分散体,导致粘度增加和凝胶形成。然而,在本发明中,凝胶是非水性凝胶,并且凝胶形成可以通过将卡波普(carbopol)与卤代水杨酰苯胺一起溶解或分散在有机溶剂中,并将混合物加热至约70℃来实现。
凝胶形成聚合物也可称为胶体,即其中胶体颗粒分散在有机溶剂中并且可利用的溶剂的量允许形成凝胶的胶体体系。在实施例中,与不可逆(单态)胶体相反,优选使用可逆胶体,优选地热可逆胶体(例如琼脂、琼脂糖和明胶等)。热可逆胶体可以以凝胶和溶胶状态存在,并且在加热或消热的情況下在不同状态之间交替。可根据本发明单独或组合使用的热可逆胶体包括例如明胶、角叉菜胶、琼脂、琼脂糖(得自琼脂的多糖)、果胶和纤维素衍生物例如甲基纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或羟丙基纤维素。可用于凝胶形成聚合物的另一个术语是“热致性”:热致胶凝剂是由温度变化引起胶凝的胶凝剂。因此,在本发明的实施例中,凝胶形成剂是热致凝胶形成聚合物或这些聚合物的组合。
凝胶形成聚合物可以是或包含离子移变的凝胶形成聚合物,其胶凝由离子诱导。合适的亲离子凝胶形成剂是可通过多价抗衡离子交联形成凝胶的阴离子或阳离子聚合物。离子移变的凝胶形成聚合物可以是例如壳聚糖、藻酸盐、角叉菜胶或果胶。
凝胶形成聚合物可包含或为单一凝胶形成聚合物或两种或更多种凝胶形成聚合物的混合物。例如,凝胶形成聚合物可包含本文所列的两种或更多种凝胶形成聚合物的组合。
应选择组合物中存在的凝胶形成剂的量以提供具有所需流变特性(例如适于局部施用的粘度)的凝胶组合物。通常,凝胶组合物的粘度使得其可以容易地挤出和涂敷在例如感染的皮肤区域。凝胶组合物的流变性取决于所用的具体胶凝剂、PEG的分子量,具体的卤代水杨酰苯胺及其在组合物中的量。通常,凝胶组合物中存在的胶凝剂例如卡波姆的量为至多约10%重量,例如,按所述凝胶组合物的重量计,至多约1%、2%、3%、4%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%或9.5%。合适地,胶凝剂例如卡波姆可以以按凝胶组合物的重量计约0.01%至约10%,例如约0.01%至约8%、约0.05%至约7%、约0.05%至约6%、约0.05%至约5%、约0.05%至约4%、约1%至约6%、约1%至约5%,或约1%至约4%、约2%至约5%、约2%至约4%,或约2%至约3%的量存在,其中所述%以重量计,基于所述凝胶组合物的重量。
聚乙二醇(PEG)
在PEG存在于包含本文所述的卤代水杨酰苯胺的组合物中的实施例中,PEG合适地具有本部分所述的一种或多种特征。
合适地,PEG在环境温度(例如20至25℃)下为液体,因此溶剂可为低分子量PEG。特别地,PEG具有600或更小,合适地小于约600的平均分子量。例如,PEG可具有约200至约600,约200至约500或约200至约400的平均分子量。具体的PEG选自PEG 200、PEG300和PEG 400。在一个具体实施例中,PEG是PEG 400。或者,PEG可包含PEG的混合物,其与组合物的其它组分一起提供适于例如局部施用于受试者的组合物。因此,PEG可以是一种或多种低分子量PEG与一种或多种较高分子量PEG的混合物,其中PEG的混合物的熔点低于40℃,或优选地低于约37℃。
合适地,PEG以至少足以在组合物中提供卤代水杨酰苯胺溶液的量存在。可以认识到,溶解卤代水杨酰苯胺所需的PEG的量将取决于所用的具体卤代水杨酰苯胺和组合物的其它组分。在某些实施例中,PEG以组合物重量的至少60%,合适地大于60%的量存在于本发明的组合物中。含有大量PEG的非水性组合物提供了局部用组合物,其在皮肤组织中产生高水平的卤代水杨酰苯胺,并且向卤代水杨酰苯胺的全身暴露仅是最小的。尽管含有高PEG浓度,也已经发现这样的组合物是良好耐受的。合适地,PEG以大于60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的量存在,其中%是以重量计,基于组合物的重量。PEG,优选地平均分子量为600或更小(特别是小于600)的PEG可以例如65-98%,例如65%至95%、65%至90%、65%至80%、70%至98%、70%至95%、70%至85%、70%至80%、80%至98%、80%至95%、80%至90%、85%至98%或85%至95%的量存在于本发明的非水性组合物中,其中%是以重量计,基于本发明的非水性组合物的重量。
在某些实施例中,组合物(例如非水性组合物)包含较低浓度的PEG,例如50%或更少、45%或更少、40%或更少、35%或更少、30%或更少、25%或更少、20%或更少、15%或更少,其中%为组合物的重量%。PEG可以占组合物重量的约1%至约50%、约5%至约40%、约5%至约35%或约5%至约30%。
局部用泡沫组合物
在某些实施例中,将卤代水杨酰苯胺配制成泡沫组合物。泡沫组合物可以是水性泡沫组合物,例如乳液或纳米乳液泡沫或水-醇基泡沫(例如水-乙醇泡沫)。或者,泡沫可以是非水性(即不含水)泡沫组合物,包括但不限于油基泡沫、凡士林基泡沫、软膏泡沫;润肤剂泡沫和使用非水亲水赋形剂形成的泡沫。当泡沫是由乳液形成的泡沫时,乳液可以是包含卤代水杨酰苯胺的油包水乳液或水包油乳液。适于递送药物的泡沫是众所周知的,并且描述于例如Arzhavitina等人的《用于药物和化妆品的泡沫(Foams for pharmaceuticaland cosmetic application)》《国际药学杂志(Int.J.Pharm.)》,394,1-17(2010)。
合适地,泡沫是可破裂泡沫,即热稳定泡沫,其在向泡沫施加剪切应力时崩溃(破裂)。这种可破裂的泡沫可以作为泡沫施用到皮肤上,然后当将泡沫擦到皮肤上时破裂,从而使活性物质能够在所需区域施用到皮肤上。
在某些实施例中,泡沫是由包含卤代水杨酰苯胺的水包油乳液形成的润肤剂泡沫。油可以是例如矿物油、植物来源的油(例如橄榄油、大豆油、椰子油或蓖麻油),中链或长链甘油三酯及其酯、脂肪酸、脂肪酸酯、脂肪酸醇和蜡。例如,油可以包含选自月桂醇、肉豆蔻醇、鲸蜡醇、硬脂醇、花生醇、二十二醇、二十四烷醇、二十六烷醇、二十八烷醇、三十烷醇和三十四烷醇的醇。油可以包含选自十二烷酸、十四烷酸、十六烷酸、十七烷酸、十八烷酸、二十烷酸、二十二烷酸、二十四烷酸、二十六烷酸、二十七烷酸、二十八烷酸、三十烷酸、三十二烷酸、三十三烷酸、三十四烷酸和三十五烷酸的脂肪酸。油可以包含羟基脂肪酸如12-羟基硬脂酸。油可以包含蜡,例如巴西棕榈蜡、小烛树蜡、小冠巴西棕蜡、甘蔗蜡、retamo蜡、霍霍巴油、动物蜡(例如蜂蜡)或石油衍生的蜡(例如石蜡)。
乳液可包括乳化剂或表面活性剂以稳定乳液,例如一种或多种非离子表面活性剂(包括本文所述的任何表面活性剂,特别是与上述非水局部用组合物相关的那些)。泡沫可包含其它赋形剂,例如溶剂、胶凝剂、湿润剂、防腐剂和吸收增强剂,包括但不限于本文所述的那些。
在一个具体实施例中,泡沫是非水性泡沫。此类泡沫可通过将上述非水性制剂之一(例如非水性凝胶组合物)形成泡沫组合物来制备。可适用于递送卤代水杨酰苯胺的非水性泡沫组合物的实例描述于例如WO2010/041141、WO2009/098595和WO2008/152444中。
在某些实施例中,泡沫是使用合适的药学上可接受的油制备的非水性油基泡沫,例如如以上关于其中分散或溶解卤代水杨酰苯胺的润肤剂泡沫所讨论的。可以使用表面活性剂来稳定泡沫。还预期可以制备不需要表面活性剂的非水性油基泡沫。此类泡沫包括但不限于WO2011/013008、WO2011/013009、WO2011/064631和WO2011/039637中所述的那些。
可用于配制卤代水杨酰苯胺的泡沫组合物的其它实例包括与例如WO2011/138678、WO2011/039638、WO/2010/125470、WO/2009/090558、WO2009/090495、WO2009/007785、WO2008/038140、WO2007/085902、WO2007/054818、WO2007/039825、WO2006/003481、WO2005/018530、WO2005/011567和WO2004/037225中所述的那些类似的组合物。
包含卤代水杨酰苯胺的泡沫组合物合适地配制成与推进剂一起包装在合适的气溶胶加压容器中的半固体或液体组合物。通过容器出口中的合适气溶胶喷嘴从加压容器中释放组合物时形成泡沫。合适的推进剂包括烃推进剂如丙烷或丁烷,或卤化碳氟化合物如四氟乙烷。合适的气溶胶容器和喷嘴是公知的。
点涂/线涂组合物
在一些实施例中,组合物配制为包含卤代水杨酰苯胺的点涂或线涂组合物。点涂或线涂组合物的实例包含卤代水杨酰苯胺或其药学上可接受的盐或水合物(例如氯硝柳胺或羟氯扎胺)和溶剂,优选地非水溶剂。
点涂或线涂组合物可以包含卤代水杨酰苯胺和一种或多种极性非质子溶剂。在一些实施例中,极性非质子溶剂选自酮(例如丙酮)、N,N-二甲基甲酰胺、乙腈和二甲亚砜(DMSO)。优选地,溶剂是DMSO。在一些实施例中,点涂或线涂组合物包含一种或多种另外的助溶剂。合适地,助溶剂是亲脂性溶剂(例如油或脂肪或脂质或本文所述的任何非极性赋形剂)、本文所述的二醇(例如PEG或丙二醇)、二醇醚(例如2-(2-乙氧基乙氧基)乙醇)、本文所述的质子极性溶剂、醇,例如乙醇和/或烷醇胺(例如乙醇胺、二乙醇胺、三乙醇胺、异丙醇胺和二异丙醇胺)。溶剂在点涂或线涂组合物中的存在使得组合物能够用高浓度的卤代水杨酰苯胺配制,从而使得卤代水杨酰苯胺的浓缩溶液或分散体“点涂”或“线涂”给受试者。
在一些实施例中,点涂或线涂组合物包含2至20%wt/v,优选地5至15%wt/v,更优选地8至12%wt/v的卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺);以及
35至55%wt/v(优选地30至50%,更优选地约45%)的极性非质子溶剂,例如二甲基亚砜(DMSO)。
合适地,点涂或线涂组合物还包含二醇醚(例如2-(2-乙氧基乙氧基)乙醇)和任选地链烷醇胺(例如乙醇胺)。
因此,在优选的实施例中,点涂或线涂组合物包含:
2至20%wt/v,优选地5至15%wt/v,更优选地8至12%wt/v的卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺);
35至55%wt/v(优选地30至50%,更优选地约45%)的极性非质子溶剂,例如二甲基亚砜(DMSO);
25至55%w/v(优选地30至55%wt/v,更优选地35至50%wt/v)二醇醚(例如2-(2-乙氧基乙氧基)乙醇);
和0至10%wt/v(优选地0至5%wt/v(例如0或1至5%wt/v)链烷醇胺(例如乙醇胺)。
在另一个实施例中,点涂或线涂组合物是选自表A中所示的制剂A'至I'的组合物:
表A
本发明的另一方面提供如本文所述的点涂或线涂组合物。
用于局部用组合物的任选组分
以下组分和特征可任选地存在于本文所述的卤代水杨酰苯胺组合物,例如本文所述的非水性局部用组合物中。
局部用组合物可包含一种或多种溶剂。另外的溶剂的存在可以提高卤代水杨酰苯胺的溶解度和/或有助于在非水性组合物的制备、储存和局部使用期间将卤代水杨酰苯胺保持在溶液中。另外的溶剂可以是例如卤代水杨酰苯胺可溶于其中的极性有机溶剂,例如其中卤代水杨酰苯胺在另外的溶剂中的溶解度大于2%重量的极性有机溶剂。
极性有机溶剂可以是质子极性有机溶剂。在一个实施例中,溶剂是介电常数为约10至约45,例如介电常数为约10至约25的质子极性有机溶剂。具体的极性质子有机溶剂是介电常数为约10至约20的那些,其中在每种情况下,介电常数在20-25℃下测量。有机溶剂的介电常数是公知的或可以使用公知技术测量。
介电常数在10至45范围内的代表性质子极性有机溶剂包括下表中列出的那些:
介电常数在该范围内的其它极性有机溶剂是公知的(参见例如SamuelH.Yalkowsky所著《在水介质中的溶解度和增溶作用(Solubility and Solubilization inAqueous Media)》)。(亚利桑那大学)。牛津大学出版社(Oxford University Press):纽约。1999)。例如,极性有机溶剂可选自乙酸乙酯、二甲基甲酰胺、二氯甲烷、甘油、丙二醇或2-(2-乙氧基乙氧基)乙醇(Transcutol)、丙二醇硬脂基醚和丙二醇异硬脂酸酯。
在实施例中,极性有机溶剂为具有约10至约45的介电常数,例如在25℃温度下约10至约25的介电常数的非质子极性有机溶剂。
当存在时,另外的溶剂合适地以组合物的至多35%重量的量存在。例如,组合物重量的至多30%、25%、20%、15%或10%。在特定实施例中,另外的溶剂以小于10%,例如小于8%、小于6%、小于5%或小于3%的量存在,其中%是以重量计,基于非水性组合物的重量。另外的溶剂可以以1%至30%、1%至25%、1%至20%、1%至10%、3%至30%、3%至20%、3%至15%、5%至30%、5%至20%或5%至10%的量存在,其中%是以重量计,基于组合物的重量。
局部用组合物中乙醇的存在可引起皮肤干燥和/或剥落,特别是在具有敏感皮肤的患者中。这在患有皮肤病症(例如皮炎,例如,AD)的患者中可能是特别的问题。因此,在某些实施例中,包含卤代水杨酰苯胺的局部用组合物不含乙醇。因此,在一个优选的实施例中,局部用卤代水杨酰苯胺组合物包含非水性、非乙醇(不含乙醇)组合物,例如非水性、非乙醇凝胶组合物。
局部用组合物可任选地包含吸收增强剂。吸收增强剂可以是用于增强卤代水杨酰苯胺渗透进入真皮和表皮的任何物质。合适的吸收增强剂包括例如Smith和Maibach(2005)所著《经皮渗透增强剂(Percutaneous Penetration Enhancers)》(第二版,ISBN9780849321528)中公开的透皮吸收增强剂,其通过引用并入本文。
当存在于局部用组合物中时,吸收增强剂可以选自例如亚砜(例如二甲亚砜);二甲基乙酰胺;二甲基甲酰胺;脲;脂肪醇,例如C
当存在时,吸收增强剂的量可以为按局部用组合物(例如凝胶组合物)的重量计至多35%,例如0.5%至35%、1%至35%、5%至30%、10%至30%、5%至35%,5%至30%或10%至30%,其中%按组合物的重量计。
本文所述的卤代水杨酰苯胺组合物(例如局部用组合物)可以包含一种或多种除卤代水杨酰苯胺和上述其它赋形剂之外的其它赋形剂(例如非水性局部用组合物中的PEG)。可选择其它赋形剂以提供局部给药所需形式的组合物。另外的赋形剂可以是例如选自粘度调节剂、乳化剂、表面活性剂、湿润剂、油、蜡、溶剂、防腐剂、pH调节剂(例如合适的酸或碱,例如有机酸或有机胺碱)、缓冲剂、抗氧化剂(例如丁基化羟基苯甲醚或丁基化羟基甲苯)、结晶抑制剂(例如纤维素衍生物如羟丙基甲基纤维素)、着色剂、香料的一种或多种赋形剂。此类另外的赋形剂的代表性实例是公知的,例如在Rowe等人所著《药物赋形剂手册(Handbook of Pharmaceutical Excipients)》(第七版)中列出的。进一步更具体的赋形剂在本文实例中描述的任何非水性组合物中阐述。
在一些实施例中,所述组合物不是包含卤代水杨酰苯胺或其药学上可接受的盐或水合物的非水性局部用组合物,所述卤代水杨酰苯胺选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺;和聚乙二醇。
在某些实施例中,包含卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺)的局部用组合物不含DMSO。
在某些实施例中,包含卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺)的组合物不是WO2019/053180中公开的组合物之一。
在某些实施例中,包含卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺)的组合物不是组合物W、组合物X或组合物Y:
组合物W:包含2至20wt/v%的至少一种卤代水杨酰苯胺或其药学上可接受的盐或水合物,35至55wt/v%二甲亚砜的局部兽用点涂或线涂组合物,其中所述至少一种卤代水杨酰苯胺选自氯硝柳胺和/或羟氯扎胺,并且其中所述组合物溶于二甘醇单甲醚。
组合物X:包含2至20wt/v%的至少一种卤代水杨酰苯胺或其药学上可接受的盐或水合物,35至55wt/v%二甲亚砜的局部兽用点涂或线涂组合物,其中所述至少一种卤代水杨酰苯胺选自氯硝柳胺和/或羟氯扎胺,并且其中所述组合物溶于二甘醇单乙醚(Transcutol)。
组合物Y:选自上表A的局部用组合物。
在某些实施例中,组合物不是用于局部治疗或预防非人哺乳动物的脓皮病或皮炎的组合物W、X或Y。
在某些实施例中,所述组合物不是用于治疗或预防非人哺乳动物的脓皮病或皮炎的组合物W、X或Y,其中所述组合物局部施用于非人哺乳动物,作为单次施用,任选地每5至10天重复多次,例如每5至10天一次,连续3至5周。
局部用组合物的制造
本文所述的局部用组合物可使用熟知的方法制造。例如,包含PEG的非水凝胶组合物可通过包含以下步骤的方法制备:
(i)将卤代水杨酰苯胺溶解在PEG中;
(ii)将来自步骤(i)的溶液与凝胶形成剂合并以形成混合物;以及
(iii)使混合物胶凝。
合适地,在步骤(i)中将卤代水杨酰苯胺完全溶解在PEG中以形成溶液。可以通过搅拌或应用超声搅拌混合物来帮助溶解。任选地,可以加热混合物以促进溶解。然而,优选地在环境温度下制备溶液。任选地,在将溶液与凝胶形成剂在方法的步骤(ii)中合并之前,可以通过合适的过滤或其它分离方法除去未溶解的任何卤代水杨酰苯胺。
可将来自步骤(i)的溶液加入到凝胶形成剂中,或者可将凝胶形成剂加入到溶液中。任选地,凝胶形成剂可以溶解在一些PEG中以形成溶液或分散体,然后将其与来自步骤(i)的溶液合并。合适地,在组合物胶凝之前,将凝胶组合物的任何另外的任选组分,例如吸收增强剂、另外的溶剂等加入到混合物中。或者,可在凝胶形成后通过将另外的组分与凝胶混合来添加一种或多种任选的组分。
根据所用凝胶形成剂的性质,步骤(iii)中的凝胶形成可能会受各种方法影响。例如,当凝胶形成剂为热致型时,可在添加来自步骤(i)的溶液之前加热凝胶形成剂以形成液体。在凝胶形成剂与溶液混合后,可将所得混合物冷却,从而使混合物胶凝。或者,当通过离子交联实现胶凝时,在步骤(iii)中向混合物中加入合适的离子剂,例如合适的盐,从而使混合物胶凝。也可以通过使用合适的酸或碱改变混合物的pH以达到发生胶凝所需的pH来诱导胶凝。该方法合适地使用无水试剂在无水条件下进行以确保所得凝胶组合物是非水性凝胶组合物。
当凝胶形成剂为卡波姆时,制备非水凝胶组合物的具体方法包括:
(i)将卤代水杨酰苯胺溶解在PEG中;
(ii)将来自步骤(i)的溶液与卡波姆合并以形成混合物;以及
(iii)加热混合物以形成凝胶。
该方法的步骤(i)适合在室温下进行。将溶液与卡波姆混合后,将混合物混合以提供均匀的分散体。可以使用任何合适的方法进行混合,例如搅拌或优选地通过均化。所得分散体在步骤(iii)中形成凝胶之前适当地脱气。
在步骤(iii)中,优选地在搅拌下将混合物适当加热至60至80℃的温度,例如加热至约70℃。混合物可以在该温度下保持足够的时间以形成均匀和透明的分散体并实现凝胶形成。通常约30分钟的保持时间足以使卡波姆溶剂化并形成凝胶。
该方法适合在无水条件下使用无水试剂进行,以确保所得凝胶组合物为非水凝胶。
当本发明的组合物为洗剂、软膏剂或乳膏剂形式时,所述组合物可使用用于制备此类组合物的已知方法来制备。例如,洗剂或软膏剂可通过简单地将卤代水杨酰苯胺与包含制剂的其它赋形剂例如粘度调节剂、溶剂和/或表面活性剂共混来制备。
非水性局部用组合物也可制备为非水性乳液或微乳液以提供例如非水性乳膏形式的组合物。可以使用熟知的方法制备非水性乳液和微乳液。非水性乳液和微乳液可以通过混合两种不混溶的非水相来制备。合适地,非水亲水相(例如包含极性赋形剂和卤代水杨酰苯胺的亲水相)用不混溶的疏水相(例如包含非极性疏水赋形剂)乳化。非水性乳液可包含连续疏水相和不连续亲水相。然而,非水性乳液通常包含连续亲水相和不连续疏水相。非水亲水相包含卤代水杨酰苯胺和PEG,并且非水疏水相包含与疏水相不混溶的非极性液体,例如中链甘油三酯、植物油、烃油或矿物油如石蜡。通常,将通过一种或多种合适的表面活性剂或乳化剂,例如一种或多种非离子表面活性剂(例如聚乙二醇鲸蜡硬脂醇、鲸蜡硬脂醇、硬脂酸甘油酯、聚山梨醇酯80、Brij s721、Brij S2、鲸蜡硬脂醇聚醚-20或聚乙二醇硬脂醚),使非水性乳液稳定。乳液或微乳液可以使用公知的方法形成,例如通过将亲水相与疏水相以及非水性乳液或微乳液的其它组分一起均化。
剂量和给药方案
用于治疗皮炎(例如AD)的卤代水杨酰苯胺的有效量是足以减轻非人受试者的本文所述的皮炎(例如AD)的一种或多种症状或减缓皮炎(例如AD)的进展或发展的量。
与一种或多种赋形剂组合以产生单一剂型的活性成分的量将必须根据所治疗的宿主和特定施用途径而变化。例如,用于对动物局部给药的制剂通常以足以覆盖皮炎病变部位的量给药。合适地,以提供约0.001至约1mg/cm
在一些实施例中,向非人受试者局部施用的卤代水杨酰苯胺的剂量为0.5至5ml/10kg受试者体重,优选地1至3ml/10Kg受试者体重,甚至更优选地约2ml/10Kg受试者体重。例如,在该实施例中,卤代水杨酰苯胺作为点涂/浇泼/线涂组合物施用(例如本文所述的包含浓度为例如2至20%wt/v,优选地5至15%wt/v,更优选地8至12%wt/v的卤代水杨酰苯胺的点涂组合物、线涂组合物或浇泼组合物)。组合物适当地配制成适合非人哺乳动物的体重和/或大小的单位剂量。优选地,整个剂量作为单个“点”或“线”局部施用于动物。
当局部施用于非人受试者时,卤代水杨酰苯胺适合直接施用于皮炎病变部位。合适地,卤代水杨酰苯胺以局部用组合物的形式局部施用,并轻轻涂敷在皮肤的待治疗的病变部位,以基本上覆盖整个病变部位。任选地,包含卤代水杨酰苯胺的组合物可以使用合适的载体基质局部施用,例如浸渍有或携带包含卤代水杨酰苯胺的组合物的伤口敷料或贴片。可以将载体施加到病变部位,使得病变部位与载体基质中或载体基质上存在的卤代水杨酰苯胺接触。
卤代水杨酰苯胺的(例如局部)施用频率取决于医师可容易确定的许多因素,例如皮炎的严重程度(例如AD)。合适地,卤代水杨酰苯胺每天局部施用1、2、3或4次。治疗的持续时间可以是例如1周或更长、2周或更长、3周或更长、4周或更长、6周或更长、12周或更长、6个月或更长,或1年或更长。
在一些实施例中,卤代水杨酰苯胺的平均血浆C
在一些实施例中,在局部施用20mg/kg的单剂量(作为沿动物(例如狗)脊柱的线施用)的卤代水杨酰苯胺后24至96小时期间测量的卤代水杨酰苯胺(例如羟氯扎胺)的平均血浆浓度小于约1300μg/l,例如小于约800μg/l、小于700μg/l、小于500μg/l、小于200μg/l或小于150μg/l,或对于20mg/kg以外的单一剂量,浓度与其成正比。例如,局部施用卤代水杨酰苯胺(例如羟氯扎胺)后24至96小时内卤代水杨酰苯胺(例如羟氯扎胺)的平均血浆浓度可为约20至约200μg/l或约50μg/l至约150μg/l。
本文所述实施例中的血浆C
在一些实施例中,在局部施用20mg/kg的单剂量(作为沿动物(例如狗)的脊柱的线施用)的卤代水杨酰苯胺(例如羟氯扎胺)后1天至28天的时间段内测量的角质层中的卤代水杨酰苯胺(例如羟氯扎胺)的平均C
在一些实施例中,在局部施用20mg/kg的单剂量(作为沿动物(例如狗)的脊柱的线施用)的卤代水杨酰苯胺(例如羟氯扎胺)后1天至28天的时间段内测量的真皮和表皮中的卤代水杨酰苯胺(例如羟氯扎胺)的平均C
在一些实施例中,在局部施用20mg/kg的单剂量的(作为沿动物(例如狗)的脊柱的线施用)卤代水杨酰苯胺(例如羟氯扎胺)28天后,角质层中卤代水杨酰苯胺(例如羟氯扎胺)的曲线下面积(AUC
在一些实施例中,在局部施用单剂量例如20mg/kg的(作为沿动物(例如狗)的脊柱的线施用)卤代水杨酰苯胺(例如羟氯扎胺)后,在远离施用点的部位处达到卤代水杨酰苯胺(例如羟氯扎胺)在皮肤中的最大浓度的时间T
皮肤(或单个皮肤层)中卤代水杨酰苯胺的浓度可以通过测量在局部施用卤代水杨酰苯胺后取自受试者的皮肤活检组织中的浓度来评估,例如使用本文和实例中所述的方法(例如胶带剥离法)。C
受试者
用卤代水杨酰苯胺局部治疗的受试者是非人受试者。受试者可以是温血非人哺乳动物。在一些实施例中,受试者是商业动物,例如家畜(例如牛、绵羊、鸡、猪、鹅、鸭、山羊等)。在其它实施例中,受试者是伴侣动物如猫、狗或马。在一些实施例中,受试者是狗或猫。在特定实施例中,受试者是狗。
在一些实施例中,受试者是狗并且皮炎选自犬科动物特应性皮炎、跳蚤过敏性皮炎、疥疮、马拉色氏皮炎、擦烂、足皮炎,蠕形螨病、接触性皮炎和犬科动物细菌性脓皮病。
在一些实施例中,受试者是猫,并且皮炎选自跳蚤过敏性皮炎、特应性皮炎、食物过敏性皮炎、耳鼻喉螨病和猫细菌性脓皮病。
实例
非水性局部氯硝柳胺凝胶制剂
制备表1中所示的局部用凝胶组合物:
表1
按如下方式制备组合物。在蓝盖瓶中称量氯硝柳胺200mg、PEG 400(对于制剂A,为9.56g,对于制剂B,为9.36g)。将混合物在室温下搅拌直至形成澄清溶液。然后,将240mg卡波姆974P分散在氯硝柳胺PEG 400溶液中。将分散体均化并脱气。然后,将悬浮液加热至70℃,并以250rpm机械搅拌,直至在约30分钟后形成均匀分散体。然后将最终溶液冷却,得到标题非水性凝胶组合物。
最终制剂在进一步使用前避光。
其他非水性局部用组合物
制备表2和3中所示的非水性局部用组合物。
表2
表3
使用以下一般方法将表2和3中列出的软膏制剂D、E、F、G、H、I和J制备为非水性乳液。
将乳液的亲水相和无水氯硝柳胺(参见表2和3中标题“亲水相”)在容器中搅拌混合在一起以形成氯硝柳胺在亲水相中的溶液。通常将亲水相温和加热至约60至75℃(通常至约70℃)的温度,以帮助氯硝柳胺的溶解。
通过在加热容器中搅拌,将标题为“疏水相和乳化剂”下的包含油和乳化剂的疏水相混合在一起。温度为约60至75℃(通常在约70℃)。
通过温和搅拌,将疏水相和亲水相混合在一起以避免相分离,并将混合物冷却至约40至50℃的温度。然后将混合物均化,得到最终组合物。
所得组合物的外观和一些特性描述于表2和3中标记为“外观”的行中。
点涂或线涂制剂
制备下表B中所示的组合物A至I':
表B
Transcutol P是二甘醇单甲醚,也称为2-(2-乙氧基乙氧基)乙醇。
可以通过利用搅拌来将羟氯扎胺分散到DMSO、Transcutol和任选的单乙醇胺中以形成溶液,来制备组合物。
研究设计
一项前瞻性、单中心、随机、双盲、安慰剂对照研究。
试验的主要目的
本研究的主要目的是证明局部用氯硝柳胺制剂在健康志愿者中的安全性和耐受性。
试验的次要目的:
·确定局部用氯硝柳胺组合物的局部和全身暴露。
探索性目的:
·收集关于局部用氯硝柳胺组合物的局部耐受性的说明性信息。
·确定进入试验II期的最佳耐受制剂。
患者:
随机化比率1:1;在右臂或左臂上随机施用氯硝柳胺组合物或安慰剂。
入选标准:
·已获得签名并注明日期的知情同意书。
·年龄18-70岁。
·男性或女性。
·具有生育能力的女性受试者必须在试验治疗前通过阴性尿妊娠试验证实未怀孕。
·有生育能力的女性受试者必须愿意在试验开始时使用有效的避孕措施直至完成。
·男性受试者必须同意在试验期间使用适当的避孕措施。
排除标准:
·定期使用药物,除非研究者认为临床无关。
·在本研究第1天前14天内对臂部使用任何皮肤病药物治疗。
方案
该研究包含一组30名健康志愿者。这些志愿者中的每一个在4个分开的区域用氯硝柳胺局部用制剂或媒剂对照物在7天期间每天治疗两次。
测试以下局部用氯硝柳胺制剂:
2%氯硝柳胺非水性皮肤凝胶:上表1中描述的制剂A,2%氯硝柳胺非水性皮肤乳膏:上表2中描述的制剂G,对于试验的每个组,还测试了仅包含媒剂(即不含氯硝柳胺)的安慰剂制剂。
剂量和给药
给药途径:局部给药。
治疗持续时间:7天。
每个志愿者将4种制剂(2种活性制剂及其各自的安慰剂)施用于背臂中的限定皮肤区域。待治疗的身体区域是用直径为5cm(约20cm
在第0天进行筛选。在第1天,将患者随机分组,这也是治疗的第一天。在第1至7天,在研究中心每天治疗健康志愿者两次。在第8天,结合PK分析施用最终剂量。在第15天进行最终检查(研究结束)。
另外6名健康志愿者也参加了方法测试。志愿者和医生都不知道治疗的情况。待治疗的身体区域为直径约5cm的圆形,预期剂量为2至5mg产品/cm
也在最后一次给药后,对试验中的健康志愿者进行PK分析。PK分析包括在最终暴露后采集血液样本以评估氯硝柳胺的全身暴露,以及采集皮肤活检样本以评估皮肤中氯硝柳胺的局部暴露。对30名健康志愿者随机进行单冲活检以从每种活性制剂收集10个活检样本。这意味着每个健康志愿者的1个活性治疗区域必须在活检取样前揭盲。为了确保这不干扰对制剂安全性的盲法评估,在第8天的早晨评估安全性,然后在第8天结合生物分析给予第15剂。在施用相应制剂后1小时(+/-10分钟)进行活检。
打孔活检
使用无菌一次性活检穿孔器(BP40F,位于德国索林根的Kai Europe GmbH)进行皮肤活检。在第1天对6名未治疗的健康志愿者进行活检。对于方法确认组,在第1天收集10mL血液,以确定血液中的氯硝柳胺浓度。
对于30名经治疗的健康志愿者,在第15次施用后1小时(+/-10分钟)在第8天进行皮肤活检。
使用经确认的生物分析UPLC-MS/MS方法,测定皮肤活检样本中氯硝柳胺的浓度。
使用以下色谱条件:
使用以电喷雾负模式(ESI
制备含有氯硝柳胺的皮肤活检样本
按如下方式提取皮肤活检样本:
1.将组织切成小块,使用振荡器在室温下用5.0ml DMSO/乙腈(50/50v/v)提取过夜。
2.以3700g旋转组织,收集上清液并将其储存在冰箱(-20℃)中。
皮肤活检中氯硝柳胺浓度的测定
用10μl工作标准溶液掺入50μl未处理的人皮肤提取物(将为每个参数提供标准浓度)。涡旋样本,然后加入200μl甲醇/水溶液1:1(v:v)。最后,将样本在4℃下以2000g离心10分钟。将上清液转移到HPLC板中并使用UPLC-MS/MS进行分析。
局部耐受性的评估
根据FDA关于皮肤刺激和致敏检测的指南(1999),由研究者在所有治疗访视时使用8点皮肤评价分数评价局部用制剂施用部位的局部皮肤耐受性。皮肤评估评分0至7定义如下:
0=无刺激迹象,
1=轻微红斑,几乎看不到,
2=确定的红斑,容易看见;轻微水肿或轻微丘疹反应,
3=红斑和丘疹,
4=确定的水肿,
5=红斑、水肿和丘疹,
6=水泡性疹,
7=强反应扩散到检测部位之外。
试验结果
所有局部用皮肤氯硝柳胺制剂和安慰剂制剂耐受良好,在给药部位没有不良反应迹象。所有受试者在所有时间点的所有6个试验用药品评分均为0,见表4。
表4:治疗访视时的平均局部耐受性评分
氯硝柳胺的全身暴露极小,平均血清氯硝柳胺浓度为0.24ng/mL,而皮肤的局部暴露相当大(见表5)。
表5:皮肤活检中的氯硝柳胺浓度
来自第一阶段研究的结果显示所检测的皮肤氯硝柳胺和安慰剂制剂局部耐受良好,在施用部位没有不良反应的迹象。没有发现安全性问题,并且制剂以最小的全身暴露递送治疗相关浓度至皮肤。
在研究的第一阶段完成后,选择2%氯硝柳胺凝胶制剂A用于进一步开发。
在以下临床试验中检测如上表2中所述的局部用氯硝柳胺制剂G。
研究的基本原理
Wu等人(2014,同上)报道,氯硝柳胺通过调节树突细胞的活化和抑制促炎细胞因子的表达而表现出体外抗炎特性。本研究将研究氯硝柳胺是否具有能够转化为对特应性皮炎的体征和症状的治疗效果的抗炎特性。
研究设计
31例中度特应性皮炎患者(研究者全球评估[IGA]为3)被纳入本双盲、随机、个体内媒剂对照,2期研究,以评价局部施用氯硝柳胺的疗效和安全性。患者具有至少2个面积为至少3x 3cm的特应性皮炎,总体征评分(TSS)>5。2名患者在第22天前停止研究。
患者接受2%氯硝柳胺组合物和媒剂的局部施用,每天一次,持续3周,随后是1周的随访期。将2%氯硝柳胺和媒剂局部施用于特应性皮炎的两个单独的靶病变部位(至少3x3cm的病变,相距至少2cm,不包括面部、头皮、生殖器、手和脚)。
将施用区域(5x 5cm)随机化(1:1),每周6天以5mg/cm
使用总体征评分(TSS)和治疗区域评估(TAA)评估疗效。采用生命体征、体格检查、临床实验室检测(血液学;生物化学;尿分析),并通过收集不良事件(AE),来评估安全性。
在所有患者中收集三个皮肤活检样本(一个来自基线(第1天的给药前)时的病变皮肤,和两个来自第22天的病变皮肤(一个是来自施用了局部用2%氯硝柳胺的部位,一个是来自施用了媒剂的部位)。分析病变皮肤活检样本的皮肤厚度和炎症生物标志物。
研究终点
主要终点:
·每个治疗组局部和全身治疗中出现的不良事件(AE)的数量(34天内)。
次要终点:
·第8、15和22天病变TSS相对于基线(第1天给药前)的变化。
·与媒剂相比,随机化局部施用2%氯硝柳胺的区域在第8、15和22天的病变治疗区域评估(TAA)中相对于基线(第1天给药前)的变化。
·与媒剂相比,随机化局部施用2%氯硝柳胺的区域在第22天皮肤屏障和生物标志物水平相对于基线的变化。
入选标准
除非另有规定,否则如果患者在筛选和基线(第1天给药前)访视时满足所有以下入选标准,则其将有资格参与研究:
1.同意时18岁或以上的男性或女性。
2.根据Hanifin和Rajka标准(Hanifin等人所著《特应性皮炎的诊断性特征(Diagnostic feature of atopic dermatitis)》,Acta.Derm.Ven.第92卷(增刊):44-47,1980)。
3.患者具有至少6个月的特应性皮炎病史,并且在筛选前至少4周无明显的特应性皮炎潮红(信息从医疗图表或患者的医师获得,或直接从患者获得)。
4.患者在基线(第1天给药前)具有中度特应性皮炎,如IGA为3所定义。
5.患者具有至少3x3cm的至少两个特应性皮炎区域(不包括面部、头皮、生殖器、手和脚);基线时(第1天)TSS至少为5。这些区域应至少相隔2cm。
6.对于参与可能会导致妊娠的任何性交的患者(男人和女人),患者同意使用有效的避孕方法,从基线(第1天)前至少4周直至最后一次研究产品给药后至少4周。有效的避孕方法包括激素避孕药(组合的口服避孕药、贴剂、阴道环、注射剂或植入物),子宫内装置或子宫内系统、输精管切除术、输卵管结扎或避孕的屏障方法(男性避孕套、女性避孕套、子宫颈帽、隔膜、避孕海绵)与杀精子剂的组合。注:激素避孕药必须在基线(第1天)之前稳定剂量至少4周。
注:无生育能力的妇女如下:
-经手术绝育(子宫切除、双侧卵巢切除或双侧输卵管切除)的女性
-年龄≥40岁的女性,其月经停止至少12个月,经卵泡刺激素(FSH)试验确认无生育能力(参考确认水平的实验室参考范围)或月经停止至少24个月,未确认FSH水平
7.对于有生育能力的妇女,筛查时血清妊娠试验阴性,基线(第1天)尿妊娠试验阴性。
8.患者愿意参与并能够给予知情同意书。注:必须在任何研究相关的程序之前获得知情同意书。
排除标准
除非另有规定,否则如果患者在筛选和基线(第1天)访视时满足以下任何标准,则其将不符合参与研究的条件:
1.患者是正在哺乳、怀孕或计划在研究期间怀孕的妇女。
2.患者患有临床感染的特应性皮炎。
3.患者的Fitzpatrick皮肤光型>5。
4.研究者认为靶病变区域存在纹身、抓痕、开放性疮、毛发过多或皮肤损伤可能会干扰研究评价。
5.已知患者具有免疫缺陷或免疫受损。
6.患者在基线(第1天)前5年内有癌症或淋巴组织增生病病史。不排除成功治疗非转移性皮肤鳞状细胞或基底细胞癌和/或宫颈原位局部癌的患者。
7.患者在基线(第1天)前8周内接受大手术或在研究期间计划接受大手术。
8.根据研究者的意见,患者有任何具有临床意义的医学状况或身体/实验室/生命体征异常,将使患者处于不当风险或干扰研究结果的解释。
9.患者具有已知的慢性传染病史(例如,乙型肝炎、丙型肝炎或人类免疫缺陷病毒感染)。
10.患者在第1天前1周内使用羟嗪或苯海拉明。
11.患者在第1天前12周内使用dupilumab。
12.患者在第1天前4周内接受过任何非生物研究产品或器械。
13.患者在第1天前4周内使用crisaborole和任何其它局部用PDE-4抑制剂。
14.患者在第1天前1周内使用多塞平。
15.患者在基线(第1天)前1周内在目标区域使用含有尿素的局部用产品。
16.患者在第1天前1天在身体任何部位使用不含尿素的润肤剂。
17.患者在基线前(第1天)2周内使用全身抗生素或1周内在靶部位局部使用抗生素。
18.患者在基线(第1天)前1周内使用任何局部用药物治疗特应性皮炎,包括但不限于局部用皮质类固醇、钙调磷酸酶抑制剂、焦油、漂白剂、抗微生物剂、医疗器械和漂白浴。
19.患者在基线(第1天)前不到4周使用可能会影响特应性皮炎的全身性治疗(生物制剂除外)(例如类视黄醇、钙调磷酸酶抑制剂、甲氨蝶呤、环孢菌素、羟基脲[羟基脲]、硫唑嘌呤、口服/可注射皮质类固醇)。注:如果患者在基线(第1天)之前已服用稳定剂量至少4周,并且在研究期间将继续使用相同剂量,则允许在稳定的医疗条件下使用鼻内皮质类固醇和吸入皮质类固醇。允许含有皮质类固醇的滴眼剂。
20.患者在基线(第1天)之前12周或5个半衰期(以较长者为准)内已接受任何市售或试验用生物制剂。
21.患者在基线(第1天)之前4周内过度暴露于阳光,计划在阳光充足的环境下旅行,或使用仿晒机,或不愿意在研究期间最小化自然和人工阳光暴露。当无法避免暴露时,建议使用防晒产品和防护服。
22.患者已知或怀疑对氯硝柳胺或待测制剂的任何组分过敏。
23.患者在基线(第0天)前的去年具有已知的临床显著药物或酒精滥用史。
24.患者对利多卡因或其他局部麻醉剂有过敏反应病史或明显敏感。
25.患者在疤痕或缝合部位有增生性瘢痕或瘢痕疙瘩形成史。
26.患者正在服用抗凝药物,如肝素、低分子量(LMW)肝素、华法林、抗血小板药物(非甾体抗炎药[NSAID]和低剂量阿司匹林≤81mg将不被视为抗血小板药物),或对皮肤活检有禁忌症。
AD的诊断
受试者中AD的诊断将使用根据Hanifin等人(同上)并且在本申请的说明书中阐述的标准。为了诊断为AD,受试者应具有至少三个主要标准和至少三个次要标准。
治疗
该研究涉及氯硝柳胺局部用组合物与匹配媒剂的比较,以5mg/cm
疗效评估
特应性皮炎的临床评价由有经验和合格的皮肤科医生(经专业认证或等同)或其他适当合格和有经验的指定人员进行。为确保一致性并减少变化性,同一评估员尽可能对给定受试者进行所有评估。
湿疹面积和严重度指数
在给药前(第1天)评估湿疹面积和严重度指数(EASI)。其基于病变严重度和受影响的体表面积(BSA)的百分比来量化特应性皮炎的严重度。EASI是在0至72范围内的综合评分,其考虑四个身体区域中的每一个的红斑、硬结/浸润(丘疹)、表皮脱落和苔藓样硬化的程度(各自分别从0至3评分),其中调节每个身体区域涉及的BSA的百分比和身体区域与全身的比例。EASI分数计算在说明书中陈述。
体表面积
评价受特应性皮炎影响的总BSA(0%至100%)-给药前(第1天)。例如,一个受试者的手掌代表总BSA的1%。
总体征评分(TSS)
在给药前(第1天)评估两个治疗区域的每一个上的病变TSS。其基于红斑、水肿/丘疹形成、渗出/结痂、表皮脱落、苔藓样变和干燥的严重程度量化受试者的特应性皮炎的严重度(各自分别从0至3评分)。病变TSS为0至18的复合评分。详细的病变TSS分数计算程序在说明书中陈述。为了符合本研究的条件,受试者在每个治疗区域的给药前(第1天)TSS分数>5。
治疗区域评估(TAA)
在访视时评估两个治疗区域的病变TAA。病变TAA对疾病的严重度分级(每个区域分别从0至5评分)。
皮肤活检
皮肤屏障和炎症生物标志物水平根据施用区域的病变皮肤活检确定。对所有受试者共进行3次皮肤活检:第1天进行1次活检,第22天进行2次活检(一次是来自施用了氯硝柳胺的部位,一次是来自施用了媒剂的部位)。
中止研究但至少完成第15天访视,在第13天和第14天接受治疗施用,并且直到第14天接受至少12施应用(包括在内)的受试者按第22天的计划进行活检。
通过免疫组织化学(IHC),并通过基因表达,通过RT-PCR,使用TaqMan低密度阵列(TLDA),以及通过微阵列,使用Affymetrix U133A Plus 2,来分析皮肤活检样本。免疫组织化学(IHC)用于分析细胞生物标志物。除了使用U133A Plus 2-set基因芯片探针阵列代替U95A-set基因芯片探针阵列之外,遵循Guttman-Yassky等人所著“炎性树突细胞及其产物的主要差异将特应性皮炎与银屑病区分开来(Major differences in inflammatorydendritic cells and their products differentiate atopic dermatitis frompsoriasis)”,《过敏和临床免疫学杂志(The Journal of Allergy and ClinicalImmunology)》(第119卷,第5版,第1210-1217页,2007所公开的方法。
TLDA数据分析
通过将Ct值负转化为-dCt,将表达值(阈值循环[Ct])归一化为Rplp0(IL17A被归一化为hARP,如通过qPCR分析)。将每个基因的未检测到的-dCt值估计为所有样本中最小值的20%。使用混合效应模型,将qRT-PCR表达数据建模,其中将“访视”和“治疗区域”作为每个患者的固定效应和随机截距。该公式本质上模拟了配对t检验情况下的患者内相关结构。对于完成研究的患者,该方法引入的偏倚小于限制分析。使用对照物来估计每个治疗组中治疗的倍数变化并进行假设检验。
微阵列数据分析
实验设计:杂交策略与实验设计原则一致,例如通过保留来自同一日期的同一患者的所有样本,并且总是包括来自每个治疗组的样本。
质量控制和预处理:使用标准QC度量和R包装“微阵列质量控制”进行微阵列芯片的质量控制。使用GCRMA算法(Wu&Irizarry,2004)获得表达测量值。采用几个可视化
和建模技术来说明是否存在批效应。使用主组分分析图检测是否存在任何明显的批效应。如果发现此类批次效应,则使用Combat(一种用于调整批次效应数据的经验贝叶斯方法)对其进行调整,该方法对小样本量的离群值具有鲁棒性(Johnson、Li和Rabinovic,2007)。使用了通过软件包sva的Combat的实现。
保留具有至少5%表达大于3(log2-标度)的样本的调查组用于进一步分析。使用具有固定因子“访视”和“治疗区域”的混合效应模型和每个患者的随机效应,来模拟表达值。估计感兴趣的比较的倍数变化,并使用limma软件包中的线性模型的一般框架下的对比,对这种比较进行假设检验。通过“重复相关”函数计算重复之间的相关性,并通过ImFit估计线性模型。使用控制FDR的Benjamini-Hochberg程序,针对多个假设调整了中度(配对)t检验的p值。
统计分析-TSS和TAA
连续变量总结在表格中,包括患者数量、平均值、标准差、中值、最小值和最大值。分类变量以频率和百分比表示在表中。
使用配对的Student t-检验,比较在第22天治疗组的TSS相对于基线的变化。估计治疗之间的差异,并以95%置信区间呈现。
使用与针对主要终点所述相同的方法来分析涉及相对于基线的变化的其他终点。
分析集
来自随机化的受试者的数据包括在意向治疗(ITT)分析集中。修改后的ITT(MITT)分析集中包括对每个病变接受至少一次研究治疗给药的受试者的数据。根据受试者被随机化分配到的治疗组分析数据。
符合方案(PP)分析集包括来自被随机化的受试者的数据,没有影响疗效评估的重大方案偏离,并且具有主要终点的可评价数据。
安全性分析集(SAF)被定义为接受至少一次研究产品给药的受试者的数据。根据受试者接受的实际治疗进行分析。
疗效分析-第22天的病变TSS
使用配对的Student t-检验,比较在第22天治疗组的病变TSS相对于基线的变化。估计治疗之间的差异,并以95%置信区间呈现。对于MITT人群中用氯硝柳胺和媒剂治疗的病变,呈现基线、第22天和从基线至第22天病变TSS变化的描述性统计。对于每个治疗组中相对于基线的变化的点估计,使用t分布,确定95%置信区间(CI)。对于氯硝柳胺和安慰剂的病变TSS,相对于基线的变化之间的差异,还将提供描述性统计和使用t分布的95%CI。在第22天,使用对缺失数据进行的最后一次观察结转插补,将缺失TSS的受试者纳入分析。在PP人群中重复主要疗效终点分析。
疗效终点包括第1天(给药前)、8、15和22天的TSS和第1天(给药前)、8、15和22天的TAA。以与其它疗效终点所述相同的方式进行终点分析。
疗效分析-生物标志物/临床评分相关性分析
用于相关性分析的变量是第22天和基线(第1天)的临床评分(总体征评分(TSS)和目标面积评估(TAA))和用qRT-PCR(TLDA)分析的相同天的归一化生物标志物表达值。对每个患者和每个治疗,计算第22天治疗的绝对变化。对于成对相关性的评估,使用Spearman相关性系数。它是秩相关的非参数度量。用各自的线性回归线,95%的置信区间及其各自的ρ(spearman系数,R)和p值绘制显著相关性。对于该相关性分析,选择在qRT-PCR和/或微阵列中显示显著变化的生物标志物。除了免疫细胞是IHC数据的情况之外,仅对qRT-PCR数据进行相关性分析。
当分析单个得分和生物标志物表达值的相关性时,应用相同的程序。对于该分析,采用显示与TSS或/和TAA显著相关的生物标志物。仅对qRT-PCR数据进行相关性分析。
生物标志物
如表7中所示,对包括在免疫组织化学(IHC)和使用qRT-PCR的基因表达分析中的免疫效应物(本文也称为生物标志物)进行分组:
表7
胸腺基质淋巴细胞生成素蛋白受体(TSLP-R)是促炎细胞因子胸腺基质淋巴细胞生成素(TSLP)的受体。
CD3(分化簇3)是T细胞的生物标志物。
FOXP3(也称为scurfin)是称为调节性T细胞(也称为抑制性T细胞)的T细胞亚群的生物标志物。
如上所述,选择在qRT-PCR(TLDA)表达分析中显示显著变化的生物标志物用于与TSS和TAA的相关性分析。
进一步的生物标志物包括在微阵列分析中,参见表14-17。
第22天时的皮肤厚度
与基线和媒剂相比,在用2%氯硝柳胺治疗后没有发现皮肤厚度的差异。
第22天生物标志物的表达水平以及与总严重度评分(TSS)和目标面积评估(TAA)的相关性
如上文所述,对第1天和第22天采集的皮肤活检样本,通过qRT-PCR或微阵列,分析生物标志物。
通过qRT-PCR分析的所有生物标志物的结果示于表8-13中。
通过微阵列分析的所有生物标志物的结果示于表14-16中。
表8:qRT-PCR-所有生物标志物结果
***(p<0.001)**(p<0.01)*(p<0.05)+(p<0.1)
表9:与基线相比,在第22天,生物标志物在治疗过程中发生了显著变化(qRT-PCR)
***(p<0.001)**(p<0.01)*(p<0.05)+(p<0.1)
表10:与媒剂相比,生物标志物在治疗过程中发生了显著变化(qRT-PCR)
***(p<0.001)**(p<0.01)*(p<0.05)+(p<0.1)
表11:相对于基线以及媒剂与氯硝柳胺相比,生物标志物显著变化(qRT-PCR)
***(p<0.001)**(p<0.01)*(p<0.05)+(p<0.1)
表12:在第22天,生物标志物表达(基于qRT-PCR/IHC数据)与TSS显著相关
表13:在第22天,生物标志物表达(基于qRT-PCR数据)与TAA显著相关
表14:与基线相比,生物标志物表达水平在治疗过程中发生了显著变化(微阵列)
表15:与媒剂相比,生物标志物表达在治疗过程中发生了显著变化(微阵列)
表16:与基线和媒剂相比,生物标志物在治疗过程中发生了显著变化(微阵列)
结论
在第22天采集的活检中发现某些免疫效应物相对于基线(第1天给药前)发生了显著变化。
发现S100A12在局部施用2%氯硝柳胺后第22天与基线(-3.62)和与媒剂(-2.30)相比显著下调,(p<0.05)。发现S100A12与TSS和TAA显著相关。结果分别示于图1a和1h。图示出了与基线相比,第22天生物标志物表达的变化与第22天TSS变化的相关性。
发现S100A9在局部施用2%氯硝柳胺后第22天与基线(-2.81)和与媒剂(-1.88)相比显著下调(p<0.05)。发现S100A9与TSS和TAA显著相关。
结果分别示于图1b和1f中。图示出了与基线相比,第22天生物标志物表达的变化与第22天TSS变化的相关性。
发现PI3在局部施用2%氯硝柳胺后第22天与基线(-3.13)和与媒剂(-1.87)相比显著下调(p<0.05)。发现PI3与TSS和TAA显著相关。结果分别示于图1c和1g中。图示出了与基线相比,第22天生物标志物表达的变化与第22天TSS变化的相关性。
发现CXCL1在局部施用2%氯硝柳胺后第22天与基线(-2.83)和与媒剂(-2.10)相比显著下调(p<0.05)。发现CXCL1与TSS显著相关。结果如图1d所示。图示出了与基线相比,第22天生物标志物表达的变化与第22天TSS变化的相关性。
发现S100A7在局部施用2%氯硝柳胺后第22天与基线(-3.04)和与媒剂(-2.20)相比显著下调(p<0.05)。发现S100A7与TSS和TAA显著相关。结果分别示于图1e和1i中。图示出了与基线相比,第22天生物标志物表达的变化与第22天TSS变化的相关性。
因此,与基线以及媒剂相比,S100A12、S100A9、PI3、S100A7和CXCL1均显示出表达显著下调,并且均发现与TSS临床相关。
在与媒剂和基线相比显示显著变化的这些生物标志物中,发现S100A7和S100A9与TSS具有最高相关性,并且发现S100A7和S100A9与TAA具有最高相关性。
还发现与基线相比,在局部施用2%氯硝柳胺后,上表9中所列并通过qRT-PCR分析的生物标志物的水平在第22天显著变化。
结果示于图16-25中,其中A表示媒剂,B表示氯硝柳胺,与基线相比,在第22天。
图16示出了与先天性免疫相关的生物标志物(IL6、IL8、IL17C、IL1B)的变化。
图17示出了与T细胞活化相关的生物标志物(IL15、IL15RA、IL2、CCL5)的变化。
图18示出了与Th1相关基因相关的生物标志物(IFNG、CXCL9、IL12A/IL12p35、CXCL10)的变化。
图19示出了与Th2相关基因相关的生物标志物(IL13、IL10、IL33、TSLP-R、IL31、IL5)的变化。
图20示出了与Th2相关趋化因子相关的生物标志物(CCL17、CCL18、CCL22、CCL26)的变化。
图21示出了与Th17细胞因子相关基因相关的生物标志物(IL17A、IL17F、IL23A/IL23p19、CAMP/LL37、IL19、IL12B/IL23p40)的变化。
图22示出了与Th17趋化因子相关基因相关的生物标志物(DEFB4A/DEFB4B、CXCL1、CXCL2、CCL20、PI3)的变化。
图23示出了与Th17/Th22相关基因相关的生物标志物(IL22、S100A7、S100A8、S100A9、S100A12)的变化。
图24示出了与终末分化相关的生物标志物(FLG、PPL、LOR)的变化。
图25示出了与增殖、全身性炎症(MMP12)、Th9(IL9)和T调节细胞(FOXP3)相关的生物标志物(KRT16)的变化。
生物标志物表达的变化与TSS之间的相关性如图2-5所示。图示出了与基线相比第22天的生物标志物变化与第22天的TSS变化的相关性。
图2a和2b示出了与增殖/全身性炎症相关的生物标志物(KRT16、MMP12)。
图2c、2d和2e示出了与Th2相关趋化因子和细胞因子相关的生物标志物(IL13、CCL17、CCL22)。
图3a示出了与先天性免疫相关的生物标志物(IL8)。
图3b和3c示出了与皮肤屏障/终末分化相关的生物标志物(LOR、FLG)。
图3d示出了与树突细胞相关的生物标志物(CD11c真皮)。
图4a-4e示出了与Th17/Th22相关趋化因子和细胞因子相关的生物标志物(S100A8、S100A12、S100A7、S100A9、IL22)。
图5a-5f示出了与Th17相关趋化因子和细胞因子相关的生物标志物(PI3、CXCL1、IL17A、IL19、CAMP、DEFB4A/DEFB4B)。
生物标志物表达的变化与TAA之间的相关性如图12-15所示。图示出了与基线相比第22天的生物标志物变化。
图12a和12b示出了与增殖/全身性炎症相关的生物标志物(KRT16、MMP12)。
图12c、12d和12e示出了与Th2相关趋化因子和细胞因子相关的生物标志物(IL13、CCL17、CCL22)。
图13a示出了与先天性免疫相关的生物标志物(IL8)。
图13b和13c示出了与皮肤屏障/终末分化相关的生物标志物(LOR、FLG)。
图14a-14e示出了与Th17/Th22相关趋化因子和细胞因子相关的生物标志物(S100A8、S100A12、S100A7、S100A9、IL22)。
图15a-15c示出了与Th17相关趋化因子和细胞因子相关的生物标志物(PI3、DEFB4A/DEFB4B、IL19)。
与基线相比,用qRT-PCR分析的除LOR和FLG外的所有这些生物标志物在局部施用2%氯硝柳胺后第22天显著降低(参见表8-13)。
发现与基线相比,局部施用2%氯硝柳胺后第22天LOR和FLG显著增加,参见图13b和13c。LOR和FLG涉及表皮细胞的终末分化,这些蛋白中任何一种的表达增加与更好的皮肤屏障有关。显示局部用氯硝柳胺诱导的LOR表达增加与AD体征和症状的改善相关。
此外,发现用微阵列分析的一些皮肤屏障蛋白和脂质(参见表14-16)在局部施用2%氯硝柳胺后第22天与基线和媒剂相比显著增加。通过使用微阵列分析发现与基线和媒剂相比增加的皮肤屏障脂质是ACOX2、EVOLV3、FA2H、FAR2、KRT79、PNPLA3。通过使用微阵列分析发现与基线和媒剂相比增加的皮肤屏障蛋白是DGAT2和FAXDC2。
结构性皮肤屏障蛋白和脂质的表达增加表明氯硝柳胺可用于通过改善皮肤屏障功能来治疗与皮肤屏障功能障碍相关的炎性皮肤病症,例如与一种或多种皮肤屏障分子中的皮肤屏障缺乏相关的炎性皮肤病症(如AD)。
显示与基线(第1天给药前)相比,用2%氯硝柳胺治疗会减少炎症和免疫细胞浸润。发现在用2%氯硝柳胺局部治疗的患者中,与基线(第1天给药前)相比,炎性细胞(树突细胞:CD11c、表皮中的FceR1,和朗格汉斯细胞:朗格汉斯蛋白/CD207)显著减少(图27-29)。与基线相比,CD11 c真皮的表达水平显著改变,并且与TSS临床相关(参见图28)。
在用2%氯硝柳胺局部治疗的患者中,发现与基线(第1天给药前)相比,T细胞(即:表达CD3D和CD3G的T细胞)(在真皮和表皮中)总量没有显著变化,参见图26。
在用2%氯硝柳胺治疗的患者中,某些炎性标志物与基线相比存在显著变化,所述炎性标志物包括全身性炎症(MMP12)、增殖(KRT16)、先天性免疫(IL6、IL17C、IL8、IL1B)、终末分化(FLG、LOR)、T细胞/NK细胞活化(IL15、IL15RA)、Th1途径(CXCL10)、Th2途径(CCL17、CCL18、CCL22、IL10、IL13、IL5、TSLPR)、Th17途径(IL17A、IL23p19、IL23A、CCL20、CXCL1、CXCL2、PI3、DEFB4A/DEFB4B、PI3、IL12B)、全身性炎症(MMP12)、T调节性细胞(FOXP3)、Th17/TH22途径(S100A7、IL22、S100A8、S100A9、S100A12)。
结果显示局部施用氯硝柳胺显著下调与Th1、Th2、Th17和Th22型免疫反映相关的免疫效应物(包括先天性免疫效应物)的表达。
Th2、Th17、Th22应答在AD的炎症回路中是关键的。这些关键生物标志物的降低的表达和这些生物标志物与临床体征和症状的直接相关性强烈支持使用氯硝柳胺来治疗AD。
Brunner等人(《过敏和临床免疫学杂志(The Journal of Allergy and ClinicalImmunology)》,第139卷,第4版,增刊,第S65-S76页,2017)公开了dupilumab对病变AD皮肤的作用,如Th2相关分子如CCL17、CCL18和CCL26的表达降低,以及与T
这里也参考Hamilton,Jennifer D.等人所著《Dupilumab改善中度至重度特应性皮炎患者皮肤中的分子特征(Dupilumab improves the molecular signature in skinof patients with moderate-to-severe atopic dermatitis)》《过敏和临床免疫学杂志(The Journal of Allergy and Clinical Immunology)》134.6(2014):1293-1300;和Brunner,Patrick M.等人所著《轻度局部类固醇导致中度至重度特应性皮炎患者皮肤的进行性抗炎作用(A mild topical steroid leads to progressive anti-inflammatoryeffects in the skin of patients with moderate-to-severe atopic dermatitis)》《过敏和临床免疫学杂志(The Journal of Allergy and Clinical Immunology)》138.1(2016):169-178。
在狗中进行初步PK研究,其中在以下治疗组中口服给予羟氯扎胺:每天口服一次5mg/kg,连续4天;以单次20mg/kg局部施用(使用以下实例5中所述的组合物K);和作为单一2.5mg/kg剂量静脉内给药。
静脉内给药后,根据两室模型,分配羟氯扎胺。终末半衰期为38小时,Vss为约0.60L/kg,表明分布的体积低至中等。口服给药后的生物利用度为48%,局部施用后的生物利用度为12%,表明少量全身暴露。当在施用部位约8cm处(沿骨架)收集胶带条(粘性膜)时,在长时间局部施用后,羟氯扎胺在角质层中积累良好。
图30说明在狗口服或局部施用后皮肤胁腹角质层中羟氯扎胺(μg/g)的算术分布。
研究目的
本研究的目的是测定狗(i)局部施用组合物K后羟氯扎胺在血浆和皮肤中的耐受性和药代动力学分布,和(ii)局部施用组合物K 4周后羟氯扎胺在距离施用部位10-40cm的皮肤的几个区域的扩散。
入选标准
在本研究中使用12只体重超过11kg的成年比格犬。对每个阶段的D-3
测试系统管理
在28天的动物研究阶段(从D0到D28),将动物单独圈养,以通过避免在施用治疗后狗相互舔来保证结果的质量。未经研究负责人批准,除研究纳入的治疗外,未进行其它治疗。
治疗
皮肤途径(局部施用)是对狗施用组合物K的途径。组合物K沿着骨架均匀地施用,从尾部的基部开始到颈部的后部。给药剂量为20mg羟氯扎胺/kg(0.20ml/kg体重)。
将12只狗分成2组,每组6只动物,具有均一的年龄和体重平均值。用相同的组合物对它们进行治疗,但施用后的活动不同:
A组:狗1至6只
-采血
-在腹部区域进行皮肤细胞(角质层)取样后进行皮肤活检
-美容和皮肤评估
组Β:狗7至12
-在几个部位(耳、肩、腹部、前腿、蹄关节和胸部区域)取样皮肤细胞(角质层)。
对每只狗的给药量如下表所示:
临床随访
在D-3a或D-4b,由合格人员对每组的6只狗进行身体检查,包括称重。
在每个阶段的D0时,在治疗施用后的小时内,进行临床观察。特别注意以下临床征象:全身症状(如发热、疲劳、颤抖)、神经和血管症状、唾液分泌过多、呕吐、瘙痒、疼痛、异常行为(如仰卧)。
在D-3a,对A组中的所有狗在腹部区域(动物右侧或左侧的腹部下部)剃毛以进行活检。在D4a、D11a、D18a和D25a重复剃毛,在每个取样时间交替动物的右侧和左侧。
在D-4b,对B组的所有狗在以下区域剃毛,在每个取样时间交替动物的右侧和左侧:耳朵、腹部、胸部、蹄(跗骨)关节、前腿和肩部。在约5cm x 5cm的区域,剃刮每个区域。
皮肤耐受性评估在D0a+1小时、D0a+3小时、D0a+24小时、D3a、D7a、D14a、D21a和D28a,对A组的6只狗,评估皮肤耐受性。
每次评估后,根据以下评分系统,评估治疗部位的皮肤耐受性:
红斑:
-无红斑
-极轻微红斑(几乎看不到)
-明确的红斑
-中度红斑
-严重的红斑(甜菜根红),伴有轻微的疮(深部病变)
水肿(是/否)
表皮脱落(是/否)
结痂(是/否)
取样
干管采血
在两阶段的内含物检查前和D28时,用4ml干燥管和3ml EDTA K3管从每只狗的颈静脉采集血样。进行这些取样用于血液生化分析。
离心(约3500转/分钟,在+4℃下15分钟)后,收集血清,然后用管(Nunc 1.8ml型)中分成两等分。用研究代码;动物的标识号及其病例号;取样的类型、日期和时间来标识每个等分试样。将等分试样在5℃+/-3℃下储存直至运输。在取样当天将冷包装的等分试样运送至分析实验室。
实验室分析了以下内容:
-生物化学参数:总胆红素、总蛋白、葡萄糖、碱性磷酸酶(ALP)、丙氨酸转氨酶(ALAT)、天冬氨酸转氨酶(AST)、肌酸激酶(CK)和γ谷氨酰转移酶(GGT)。
-血液学参数:血红蛋白、血细胞比容、RBC、MCV、MCH、MCHC和网织红细胞。
肝素锂采血
对于A组的所有动物,在以下时间(公差为10%)使用含有肝素锂的管从颈静脉收集约4ml的血液样本:D-3a、D0a+1小时、D0a+6小时、D0a+12小时、D0a+16小时、D0a+24小时、D0a+32小时、D0a+48小时、D3a、D5a和D7a。
在取样后最多30分钟进行离心(约3500转/分钟,在+4℃下15分钟)。收集血浆,然后在试管(Nunc 1.8ml型)中分成两等分,如下:
-S1等分试样:约0.5ml
-S2等分试样:血浆的剩余部分(大于0.5ml)
将等分试样在-70℃+/-5℃下储存直至运输。在每个阶段结束时将等分试样包装在干冰中运送到分析实验室。
皮肤活检
对于A组的所有狗,在麻醉下在腹部区域(在每个取样时间交替动物的右侧和左侧)用4mm“活检穿孔器”在以下时间进行皮肤活检:D1 a、D7a、D14a、D21 a和D28a。在每次活检之前,对活检区域进行皮肤细胞取样。将小瓶冷冻在-70℃+/-5℃下直至运输用于分析。
角质层取样(D-Squame discs)
用与Emilie Videmont等人(《通过胶带剥离急性破坏后犬皮肤屏障修复的特征(Characterization of the canine skin barrier restoration after acutedisruption by tape stripping)》《兽医皮肤病学(Veterinary Dermatology)》,第23卷,第103-123页,2011)和Lionel Trottet(《皮肤药物的选择和开发,工业前景(Dermal DrugSelection and Development,An Industrial Perspective)》Springer 2017。第57页)所描述的方法类似的方法进行胶带剥离(胶膜)。在除去之前,用固定量的压力将胶带压在皮肤表面上。将粘附到膜上的SC的表面层从角质层剥离,然后可接近角质层以便进行进一步研究。
对于B组的所有动物,在以下时间使用圆盘(D-Squame DISCS)在禁食动物的六个剃毛区域进行皮肤细胞取样:D-4b、D0b+24小时、D0b+24小时、D3b、D7b、D14b、D21b和D28b,交替动物的右侧和左侧。将20个22mm直径的圆盘(D-Squame Discs)连续施加到目标区域上,在用标记物限定的相同区域中。
按如下方式施加圆盘:
-使用镊子,使用所提供的边缘,从其背衬上小心地移除圆盘。
-将圆盘施加到限定区域。
-用D-Squame压力仪表压制圆盘1秒。
-每次施用圆盘后除去150g/cm
对于每个循环,将从皮肤上取下的20个圆盘分成如下2个样本(S1和S2):
S1:将前10个圆盘置于闪烁瓶中
S2:将最后10个圆盘置于闪烁瓶中
在原始数据中记录取样区域在皮肤的色素沉着。将小瓶在-70℃±5℃下冷冻,直至运输至分析实验室
PK分析
使用Phoenix软件(版本6.3,Pharsight,USA)进行药代动力学分析。在计算期间系统地忽略表示为“缺失”的数据点,且因此对结果没有影响。分配缺失状态并且不使用旗标符号。如果在药动学家的判断中认为一些值不是“药物动力学相关的”,则排除这些值。如果怀疑存在离群值,则采用STATGRAPHICS的离群值识别程序对其进行识别。
评价以下药代动力学参数:
统计分析
每天,并针对每个浓度参数的治疗,计算平均值(算术平均值)、标准偏差(SD)、平均值的标准误差、变异系数(CV%、SD/平均值*100),最大值和最小值。计算平均浓度和标准偏差并绘制平均浓度时间曲线。计算每次治疗的药代动力学参数的描述性统计。
分析方法
使用LC-MS-MS方法量化样本中的羟氯扎胺浓度。
结果
在整个研究过程中,狗的总体健康状况令人满意且具有可比性。它们的血液学-生化分析结果是可接受的,没有任何迹象表明活性物质对A组动物的检查参数可能有负面影响。对于B组的动物,血液学-生物化学参数存在一些异常,例如丙氨酸转氨酶增加。这是由于肝脏中代谢的替来他明的密切和重复麻醉超过4周。
在D0a,治疗后未观察到症状或异常。在D0b,治疗后,两只狗(狗9和12)舔其尾部的底部,并且它们颤抖着。在D0b,一只狗(狗12)的左肩(皮肤取样区域)上观察到一些轻微的痂。
在皮肤治疗后,沿着A期,没有出现皮肤耐受性的显著迹象。在A组的六只狗中,皮毛在D0a+1小时和D0a+3小时时呈油腻外观,3只狗在浅色皮肤上呈橙色。
血浆样本
图31说明在狗中局部施用后获得的羟氯扎胺的平均血浆浓度-时间(μg/L)。
羟氯扎胺在血浆中呈现类似于在实例4的早期PK研究中和在相同全身暴露下获得的PK概况。没有计算生物利用度,因为在该研究中没有静脉内途径。然而,当比较AUCinf(60604h*μg/L与55712h*μg/L)时,生物利用度似乎与实例4的探索性药代动力学研究相似(约12%)。在局部施用后观察到血浆中低浓度的羟氯扎胺,表明低全身暴露。
表皮/真皮(活检)+角质层(条状样本)
图32说明在狗中局部施用后获得的羟氯扎胺的平均(μg/g)皮肤活检浓度-时间。
羟氯扎胺在深层皮肤(表皮和真皮)中比在角质层中积累少约10倍。在局部施用后动物之间的体内可变性低。
下表17示出了每个收集部位的平均暴露量(AUC)。给药后观察到羟氯扎胺在浅表皮肤和深层皮肤中长时间暴露。
表17
角质层(条状样本)
如在先前实例4的研究中所观察到的,在局部施用较长时间后,羟氯扎胺在角质层中积累良好。羟氯扎胺在身体的所有皮肤区域扩散良好并保持显著高于MIC,尽管比较溶解在皮肤脂质中的羟氯扎胺的浓度和在缓冲水性介质中测定的MIC的测量值是困难的。
图33说明在6个区域局部施用于狗后获得的羟氯扎胺的平均(μg/g)角质层(条)浓度-时间。
结果显示,羟氯扎胺浓度与给药部位和皮肤采集取样部位之间的距离密切相关。
羟氯扎胺从浅表皮肤(角质层)缓慢消除,消除速率似乎与通过表皮层的细胞迁移过程(表皮更新)相关,需要约22至28天。
表18示出了每个收集部位的平均暴露量(AUC)。羟氯扎胺在浅表皮肤中的暴露与施用部位和施用后一段时间皮肤收集的取样部位之间的距离相关。
表18
所有12只狗在研究期间保持良好的一般状况,没有观察到显著的皮肤不耐受迹象。
在身体的所有皮肤区域,在角质层中长时间观察到高浓度的羟氯扎胺。羟氯扎胺在浅表皮肤和深层皮肤之间的分布为约10:1。如在实例4的早期药代动力学研究中观察到低全身浓度。
其它实施例
本发明的其它实施例在以下编号的条款中阐述:
1.一种卤代水杨酰苯胺或其药学上可接受的盐或水合物,其用于治疗非人受试者的皮炎以减少或消除与皮炎相关的瘙痒、红斑、硬结、表皮脱落、苔藓样变、鳞屑、渗出、结痂、干燥、脱落、病变结节、痒疹结节、病变囊泡、病变丘疹、病变斑块或病变肿胀中的一种或多种。
2.根据条款1所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是严重皮炎。
3.根据条款1所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是中度皮炎。
4.根据条款1所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是轻度皮炎。
5.根据条款1所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是中度至重度皮炎。
6.根据条款1所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是轻度至中度皮炎。
7.根据条款1至6中任一项所述的卤代水杨酰苯胺,其用于治疗皮炎的恶化。
8.根据条款1至7中任一项所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是急性形式的皮炎。
9.根据条款1至7中任一项所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是慢性形式的皮炎。
10.根据条款1至9中任一项所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎选自局部皮炎、接触性皮炎、过敏性接触性皮炎、刺激性接触性皮炎、特应性皮炎、脂溢性皮炎、光化性皮炎、足皮炎、包皮病、汗疱性皮炎、慢性单纯性苔癣(包括犬肢舔皮炎和神经性皮炎)、趾皮炎(包括牛趾皮炎)、剥脱性皮炎(干性皮肤皮炎)、癌性皮炎、钱币状皮炎、郁积性皮炎、跳蚤过敏性皮炎、耳炎、食物过敏性皮炎、马拉色氏皮炎、擦烂、口周皮炎、皮肌炎、湿疹性皮炎、光过敏性皮炎、光毒性皮炎、植物光敏性皮炎或辐射诱导的皮炎。
11.根据条款1至9中任一项所述的供所述用途使用的卤代水杨酰苯胺,其中所述皮炎是特应性皮炎。
12.一种治疗非人受试者的皮炎以减少或消除与皮炎相关的瘙痒、红斑、硬结、表皮脱落、苔藓样变、鳞屑、渗出、结痂、干燥、脱落、病变结节、痒疹结节、病变囊泡、病变丘疹、病变斑块或病变肿胀中的一种或多种的方法,所述方法包含向受试者施用有效量的卤代水杨酰苯胺或其药学上可接受的盐或水合物。
13.根据条款12所述的方法,其中所述皮炎是严重皮炎。
14.根据条款12所述的方法,其中所述皮炎是中度皮炎。
15.根据条款12所述的方法,其中所述皮炎是轻度皮炎。
16.根据条款12所述的方法,其中所述皮炎是中度至重度皮炎。
17.一种治疗受试者皮炎恶化的方法,所述方法包含向所述受试者施用有效量的卤代水杨酰苯胺或其药学上可接受的盐或水合物。
18.根据条款17所述的方法,其中所述治疗减少或消除与皮炎相关的瘙痒、红斑、硬结、表皮脱落、苔藓样变、鳞屑、渗出、结痂、干燥、病变结节、痒疹结节、病变囊泡、病变丘疹、病变斑块或病变肿胀中的一种或多种。
19.根据条款12至18中任一项所述的方法,其中所述特应性皮炎是急性皮炎。
20.根据条款12至18中任一项所述的方法,其中所述特应性皮炎是慢性皮炎。
21.根据条款12至20中任一项所述的方法,其中所述皮炎选自局部皮炎、接触性皮炎、过敏性接触性皮炎、刺激性接触性皮炎、特应性皮炎、脂溢性皮炎、光化性皮炎、足皮炎、包皮病、汗疱性皮炎、慢性单纯性苔癣(包括犬肢舔皮炎和神经性皮炎)、趾皮炎(包括牛趾皮炎)、剥脱性皮炎(干性皮肤皮炎)、癌性皮炎、钱币状皮炎、郁积性皮炎、跳蚤过敏性皮炎、耳炎、食物过敏性皮炎、马拉色氏皮炎、擦烂、口周皮炎、皮肌炎、湿疹性皮炎、光过敏性皮炎、光毒性皮炎、植物光敏性皮炎或辐射诱导的皮炎。
22.根据条款12至20中任一项所述的方法,其中所述皮炎是特应性皮炎。
23.根据条款1至11中任一项所述的供所述用途使用的卤代水杨酰苯胺或根据条款12至22中任一项所述的方法,其中所述受试者是伴侣动物,优选地是狗或猫,更优选地是狗。
24.根据条款1至11中任一项所述的供所述用途使用的卤代水杨酰苯胺或根据条款12至22中任一项所述的方法,其中所述卤代水杨酰苯胺选自雷复尼特、羟氯扎胺、氯氰碘柳胺和氯硝柳胺或其药学上可接受的盐、溶剂合物或酯。
25.根据条款1至11中任一项所述的供所述用途使用的卤代水杨酰苯胺或根据条款12至22中任一项所述的方法,其中所述卤代水杨酰苯胺是氯硝柳胺或其药学上可接受的盐或水合物,任选地氯硝柳胺或其药学上可接受的盐,例如其中所述卤代水杨酰苯胺是氯硝柳胺。
26.根据条款1至11中任一项所述的供所述用途使用的卤代水杨酰苯胺或根据条款12至22中任一项所述的方法,其中所述卤代水杨酰苯胺是羟氯扎胺或其药学上可接受的盐或水合物,任选地羟氯扎胺或其药学上可接受的盐,例如其中所述卤代水杨酰苯胺是羟氯扎胺。
27.根据条款1至11中任一项所述的供所述用途使用的卤代水杨酰苯胺或根据条款12至22中任一项所述的方法,其中将所述卤代水杨酰苯胺局部施用于所述受试者。
28.根据条款27所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述卤代水杨酰苯胺以局部用组合物的形式局部施用。
29.根据条款28所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述局部用组合物选自局部用乳膏、软膏、凝胶、糊剂、泡沫、溶液、悬浮液、浇泼、点涂或线涂组合物。
30.根据条款28或条款29所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述局部用组合物包含所述卤代水杨酰苯胺和选自以下各项的制剂基质:油性基质(例如凡士林、白凡士林、黄软膏或白软膏)、吸收基质(例如亲水性凡士林或羊毛脂)、水可除去基质(水包油乳液);和水溶性基质(例如聚乙二醇)。
31.根据条款28至30中任一项所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述局部用组合物为非水性组合物。
32.根据条款28至31中任一项所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述局部用组合物是水性组合物。
33.根据条款28或条款29所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述局部用组合物为非水性局部用组合物,其包含:
(i)所述卤代水杨酰苯胺(例如选自氯硝柳胺、雷复尼特、羟氯扎胺和氯氰碘柳胺)或其药学上可接受的盐或水合物;以及
(ii)聚乙二醇(PEG),优选地熔点小于40℃的PEG。
34.根据条款28或条款29所述的供所述用途使用的卤代水杨酰苯胺或所述的方法其中所述局部用组合物为非水性局部用组合物,其包含:
(i)按重量计0.01%至4.5%(例如0.1至3%或约2%)的
(ii)所述卤代水杨酰苯胺,或其药学上可接受的盐或水合物;以及
(iii)按重量计至少70%(例如至少90%)的PEG,其中所述PEG的所述平均分子量是600或更小(例如小于600或从约200至约600或约400)。
35.根据条款28或条款29所述的用于所述用途或方法的所述卤代水杨酰苯胺,其中所述局部用组合物还包含非聚合二醇(例如丙二醇)。
36.根据条款28至35中任一项所述的供所述用途使用的卤代水杨酰苯胺或所述的方法,其中所述卤代水杨酰苯胺溶解或部分溶解在所述组合物中。
37.一种局部用组合物,其包含2至20%wt/v,优选地5至15%wt/v,更优选地8至12%wt/v的卤代水杨酰苯胺(例如氯硝柳胺或羟氯扎胺或其药学上可接受的盐或水合物);
35至55%wt/v(优选地30至50%wt/v,更优选地约45%wt/v)的极性非质子溶剂,例如二甲亚砜(DMSO);
25至55%w/v(优选地30至55%wt/v,更优选地35至50%wt/v)二醇醚(例如2-(2-乙氧基乙氧基)乙醇);
和0至10%wt/v(优选地0至5%wt/v(例如0或1至5%wt/v)链烷醇胺(例如乙醇胺)。
38.根据条款37所述的局部用组合物,其选自选自下表所示的制剂A'至I'的组合物:
39.根据条款37或条款38所述的局部用组合物,其中所述卤代水杨酰苯胺是羟氯扎胺或其药学上可接受的盐或水合物。
40.根据条款37至39中任一项所述的局部用组合物,其中组合物是点涂或线涂组合物的形式。
- 用于治疗皮炎症状的卤代水杨酰苯胺
- 用于治疗梭菌属感染的卤代水杨酰苯胺
