在单层片剂中包括氨氯地平、氯沙坦和氯噻酮的预防或治疗心血管系统疾病的药学上组合制剂
文献发布时间:2023-06-19 18:27:32
技术领域
本发明涉及一种在单层片剂中包括氨氯地平、氯沙坦和氯噻酮为有效成分的用于预防或治疗心血管系统疾病的单层片剂组合制剂,更具体地,涉及一种在单层片剂中以低剂量包括氨氯地平、氯沙坦和氯噻酮的具有改善的溶出率、稳定性和生产率的药学上组合制剂。
背景技术
心血管系统疾病在全世界的患病率很高,并且许多慢性疾病通过长时间发病并会持续复发,因此从早期进行适当的治疗管理是很重要的。以前,为了进行包括高血压在内的心血管系统的治疗,从单一药剂开始的阶梯治疗方法(stepped care approach)是优选,但在这种治疗方法中,造成以下问题:随单一药剂的剂量增加而增加的剂量依赖性不良反应、为增加药物剂量和添加药物而增加患者就诊次数、由此引起的患者服药依从性降低和相应的血压控制失败以及由反复向上滴定(up-titration)和增加药物剂量引起的治疗惯性(treatment inertia;即使血压没有受控制也可以接受)。因此,临床上需要一种有效的心血管系统疾病治疗方法,其可以替代现有的复杂的阶梯治疗方法。
具有不同作用机制的药学上组合制剂,例如氨氯地平和氯沙坦的组合制剂比现有的单一药剂的优点在于更有效地预防或治疗高血压和心血管系统疾病,并减少了分别使用时的药物副作用,且提高了患者的依从性。所述组合制剂在韩国注册专利第1160151号和第1232296号等中公开,并且目前以商品名Amosartan出售。另外,正在研究有关氨氯地平、氯沙坦和氯噻酮的组合制剂,并且韩国注册专利第1914930号和第1910902号公开一种用于防止由于氯沙坦凝胶化引起的药物溶出率降低而通过将包括氨氯地平和氯噻酮的第一混合部与包括氯沙坦的第二混合部分开来制造组合制剂的方法。
然而,当将包括常规已知的单一药剂的常用量的组合制剂施用于分类为早期心血管系统疾病,例如轻度高血压或中度高血压的患者时,存在可能导致血压过度下降和由此的副作用的问题。此外,心血管系统疾病的治疗剂的异常事例报告案件数量每年都在增加,例如,已知相比于其他系列,包括氨氯地平在内的钙通道拮抗剂具有更多的与浮肿相关的不良反应,例如末梢浮肿、全身浮肿和面部浮肿。另外,就提供低剂量组合制剂的方法而言,现时研究的组合制剂及其制造方法在溶出率、稳定性或生产率方面并不优选。因此,需要开发一种可用于预防或治疗早期心血管系统疾病的具有改善的溶出率、稳定性或生产率的低剂量组合制剂。
发明内容
技术问题
一方面提供一种可用于预防或治疗早期心血管系统疾病的具有改善的溶出率、稳定性或生产率的低剂量药学上组合制剂。
另一方面提供一种制造所述组合制剂的方法。
另一方面提供使用所述组合制剂的治疗心血管系统疾病的方法。
技术方案
一方面提供一种用于预防或治疗心血管系统疾病的药学上单层片剂组合制剂,其以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐为有效成分。
另一方面提供一种用于预防或治疗心血管系统疾病的药学上单层片剂组合制剂的制造方法,其中,所述组合制剂以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐为有效成分。
另一方面提供一种通过施用药学上单层片剂组合制剂治疗早期心血管系统疾病的方法,其中,所述组合制剂以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐为有效成分。
有益效果
根据一方面的药学上单层片剂组合制剂可以用于预防或治疗早期心血管系统疾病,提高有效成分的溶出率,且提高组合制剂的稳定性和生产率。
根据一方面,以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐为有效成分的药学上组合制剂显示出改善的血压降低效果,并同时最小化由临床药物的施用引起的不良反应,因此,可以克服由于过度降低血压或不良反应而导致的现有血压治疗方法的局限性,并且与风险相比具有极好的益处。此外,所述组合制剂通过组合施用具有彼此不同的机制的药物有效地预防或治疗心血管系统疾病,并通过同时抑制所有可能的高血压发生机制来最大化血压降低的效果,且通过互补的作用机理降低对每个患者的效果的变动性,并提高由于多因素(multifactorial)机制引起的高血压的血压治疗率。同时,所述组合制剂可以通过尽可能降低每种单一成分的施用剂量来减少剂量依赖性的不良反应,因此作为高血压治疗剂,具有优异的安全性。
因此,所述低剂量药学上组合制剂可以在早期快速有效地治疗患有轻度至中度高血压的个体的血压,并提高血压控制率,从而避免由于临床或患者的治疗惯性或惰性(treatment inertia)而导致的血压控制失败,并快速达到目标血压来最终改善患者依从性。
另外,在一实施例中,所述低剂量药学上组合制剂可降低作为氨氯地平药剂的特异性不良反应的踝关节浮肿的表达。
此外,所述组合制剂可以减轻患者的服用药物的负担(Pill burden),并提高服用便利性,减少对每个患者的变动性,通过简单的施用方法提高患者的依从性,并且由于与现有的阶梯(stepped-care)治疗法相比降低药剂成本,因此是经济的。
另外,在一实施例中,所述组合制剂在同一层,即单层片剂中包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐为有效成分,从以在制造过程中比诸如双层片剂的多层片剂增加压片速度,因此提高组合制剂的生产率。另外,所述组合制剂在压片工艺中的收率优异,并且同时具有优异的制剂均匀性,从而提高药物的质量。
另外,在所述组合制剂中包括为有效成分的氨氯地平、氯沙坦和氯噻酮具有优异的溶出率、含量均匀性和热稳定性,杂质的产生减少并且保存稳定性优异,因此可以在制药领域中有用地使用。另外,所述组合制剂可以通过互补的作用机制降低对每个患者的效果的变动性。所述组合制剂可维持24小时的药效,以减少夜间高血压和活动后的血压动性。
附图说明
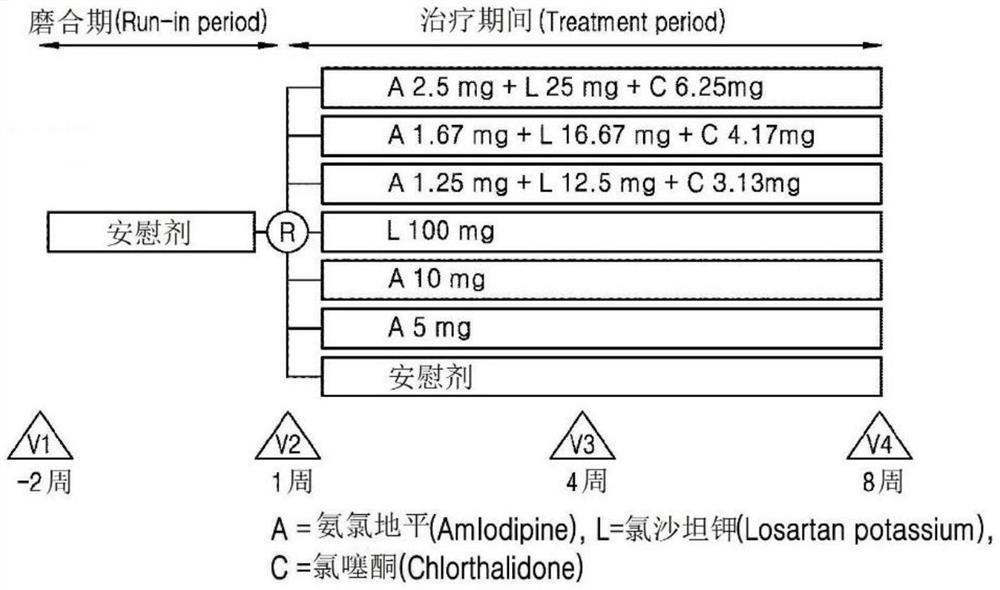
图1示出在一实施例中在经过磨合期(Run-in period)到治疗期间(Treatmentperiod)向临床试验对象施用试验药物、对照药物或安慰剂(placebo)的方法,其中,所述试验药物分别包括氨氯地平2.5mg、氯沙坦钾25mg和氯噻酮6.25mg;氨氯地平1.67mg、氯沙坦钾16.67mg和氯噻酮4.17mg;或氨氯地平1.25mg、氯沙坦钾12.5mg和氯噻酮3.13mg,并且所述对照药物分别包括氨氯地平5mg或10mg或氯沙坦钾100mg。
图2示出在第8周时在分析对象组(Full analysis set:FAS)中从基线(baseline)的sitSBP变化。
图3示出在第8周时在FAS中从基线的sitDBP变化。
图4示出在第8周时在FAS中达到血压控制的对象的比例。此时,将达到的血压控制定义为sitSBP<140mmHg和sitDBP<90mmHg。
图5示出在第8周时在FAS中血压反应者的比例。此时,血压反应者是指与基线相比,sitSBP减少量≥20mmHg或sit DBP减少量≥10mmHg的试验对象。
图6示出在第8周时在FAS中从基线的脉压变化。
图7示出在第8周时在FAS(sitSBP<160mmHg)中从基线的sitSBP变化。
图8示出在施用分别包括氨氯地平2.5mg、氯沙坦钾25mg和氯噻酮6.25mg;氨氯地平1.67mg、氯沙坦钾16.67mg和氯噻酮4.17mg;或氨氯地平1.25mg、氯沙坦钾12.5mg和氯噻酮3.13mg的试验药物或分别包括氨氯地平5mg和10mg的对照药物的第8周时在FAS中从基线的脚踝周长的变化(在两个脚踝中,基于第8周时具有大脚踝周长变化的绝对值的脚踝)。
图9示出比较例1和比较例2中的(a)苯磺酸氨氯地平和(b)氯噻酮随时间的溶出率(%)。
图10示出实施例1以及比较例3和比较例4中的(a)苯磺酸氨氯地平和(b)氯噻酮随时间的溶出率(%)。
图11示出实施例4以及比较例5和比较例6中的(a)苯磺酸氨氯地平和(b)氯噻酮随时间的溶出率(%)。
图12示出比较例3、比较例4和实施例1中的氯噻酮的(a)杂质B(Impurity B:ImpB)和(b)未知最大(Unknown max)杂质的含量(%)。
图13示出实施例1和实施例2中的(a)苯磺酸氨氯地平、(b)氯沙坦钾和(c)氯噻酮随时间的溶出率(%)。
图14示出实施例2至实施例6中的(a)苯磺酸氨氯地平、(b)氯沙坦钾和(c)氯噻酮随时间的溶出率(%)。
图15分别示出在(a)比较例3和(b)实施例1中根据压片速度的含量鉴定值(%)。
具体实施方式
在下文中,将详细描述本发明。
一方面提供一种用于预防或治疗心血管系统疾病的药学上单层片剂组合制剂,其以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐为有效成分。
在本说明书中所用的术语“心血管系统疾病”不仅包括由体内循环系统的异常、功能障碍、损害等各种原因引起的直接疾病,还包括源自这种直接疾病的继发性疾病。例如,所述心血管系统疾病可包括高血压、血脂异常症、心绞痛、动脉痉挛、深静脉、心脏肥大、脑梗塞、充血性心力衰竭、动脉硬化症、冠状动脉心脏病或心肌梗塞。
在本说明书中所用的术语“血压”是指由沿着血管流动的血液对血管壁施加的压力。血压可以概括为脉搏中的收缩期的血压峰值和舒张期的最低血压的两种测量值。
在本说明书中所用的术语“高血压(hypertension)”是指血压高于正常范围的慢性疾病。高血压可分为本态性高血压(原发性高血压)和继发性高血压。另外,高血压的标准可以通过各种流行病学调查定义为由于心血管系统并发症导致的死亡率增加的血压。此外,可以考虑对比于风险的效果,即证明在血压降低时的利益比风险大的数字来确定高血压的标准。例如,根据2018年欧洲高血压学会(European Society of Hypertension:ESH)指南的高血压诊断标准,可以将正常或高血压如以下分类。
[表1]
根据ESH(2018)指南,对于人体而言,最理想的最佳血压是120/80mmHg或更低,并且当收缩期血压为120至129mmHg和/或舒张期血压为80至84mmHg,则可以称为正常。另外,ESH指南根据收缩期血压和舒张期血压进行细分类为如下:高于正常的血压(130至139/85至89mmHg)、高血压1期(140至159/90至99mmHg)、高血压2期(160至179/100至109mmHg)、高血压3期(180/110mmHg或更大)和单纯性收缩期高血压(140mmHg或更大/小于90mmHg)等。
另外,通常休息时的正常血压在收缩时为100至140mmHg,在舒张时为60至90mmHg,当血压持续为140/90mmHg或更大时,可以称为具有高血压。
根据2018年韩国高血压学会高血压治疗指南,通过将高血压前期的舒张期血压(DBP)标准降低至80mmHg,从而促进积极预防高血压。此外,通过引入“注意血压(SBP 120至129mmHg和DBP小于80mmHg)”的概念,对指南进行了修改,使得即使血压略高于正常血压,也尽量保持血压在正常范围内,还建议,即使将血压控制在140/90mmHg或更低,也尽可能将血压降低到130/80mmHg。
在本说明书中所用的术语“脉压”是指收缩期血压与舒张期血压之间的差(sitSBP-sitDBP)。脉压是心脏收缩和放松时的血压差,如果血管壁随着老化而变厚并失去弹性,则收缩期压力升高,此时,由于扩张的动脉难以恢复到其原始状态,因此舒张压降低,使得脉压可能升高。在1999年Framingham的研究中,Franklin等人报告出,在对年龄、性别和其他危险因素进行修正后,脉压是冠状动脉疾病风险的有力预测指标。此外,对于50岁或更年老人士,收缩期血压和脉压比舒张期血压对心血管并发症具有更大的预测力(根据主要医疗用途的高血压的建议摘要、韩国医学会和韩国疾病中心)。
在本说明书中所用的术语“并发症(complication)”是指具有其他症状的疾病。高血压可伴有头晕、头痛、心悸和呼吸急促等症状,如果人体长时间处于高血压状态,则可能导致许多并发症,例如中风、冠状动脉心脏病、肾功能失调等。
所述组合制剂可用于预防或治疗包括高血压的心血管系统疾病或根据其的并发症。
作为心血管系统治疗的一个例子,用于治疗高血压的药物根据其作用机制大致分为利尿剂、交感神经抑制剂和血管扩张剂,并且血管扩张剂可再次根据其作用机制分为血管紧张素转换酶(Angiotension converting enzyme:ACE)抑制剂、血管紧张素II受体阻滞剂和钙通道阻断剂。
“氨氯地平(amlodipine)”为3-乙基5-甲基2-[((2-氨基乙氧基)甲基]-4-(2-氯苯基)-6-甲基-1,4-二氢吡啶-3,5-二羧酸酯的通用名称,作为钙通道阻滞剂,其可以阻挡心肌和血管平滑肌表面的钙离子通道来松弛血管平滑肌,并通过松弛肾脏的输入小动脉来提高肾小球滤过率,从而引起利尿作用来降低血压。氨氯地平可通过阻断钙通道来用作治疗诸如心绞痛、高血压和充血性心脏麻痹的心血管系统疾病。氨氯地平是第三代钙离子通道阻断剂(calcium channel blockers:CCB),口服时吸收缓慢,同时由于约35至40小时的长半衰期而具有长时间缓慢的降血压效果,并减少了体位性低血压等副作用,对预防收缩期高血压和脑中风有效,且具有冠状动脉扩张作用,因此可用于心绞痛。
“氯噻酮(chlorthalidone)”是苯磺酰胺-2-氯-5-(2,3-二氢-1-羟基-3-氧代-1H-异吲哚-1-基)的通用名称,目前以商品名
“氯沙坦(losartan)”是2-丁基-4-氯-1-[{2′-(1H-四唑-5-基)[1,1′-联苯]-4-基]甲基]-1H-咪唑-5-甲醇的通用名称,其是血管紧张素受体拮抗剂系列成分中第一个开发的。氯沙坦可通过阻断作为血管收缩物质的血管紧张素II与受体的结合来治疗高血压和心力衰竭。另外,还用于治疗缺血性末梢循环障碍、心肌缺血(心绞痛),预防心肌梗塞后心力衰竭的进展以及治疗糖尿病性神经病、青光眼等。此外,通过选择性和竞争性拮抗作为强大的血管收缩物质的血管紧张素II的受体而显示出降压效果,并且可治疗高血压、心力衰竭、缺血性末梢循环障碍、心肌缺血(心绞痛)等,或预防心肌梗塞后心力衰竭的进展,并对糖尿病性神经病和青光眼等有用。
在一实施例中,所述组合制剂以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐为有效成分。
在本说明书中所用的术语“每日限定剂量(Daily Defined Dose;DD)”是指对于该药物的每种主要成分的主要适应症而一个70公斤的成年人一天应服用的平均维持剂量。例如,在市售药物的情况下,氨氯地平、氯沙坦钾和氯噻酮的每日限定剂量分别可以为约5至10mg、50至100mg和12.5至25mg。例如,氨氯地平、氯沙坦钾和氯噻酮的每日限定剂量中的最低剂量分别可以是约5mg、50mg和12.5mg。
在本说明书中所用的术语“低剂量”是指小于药物的每日限定剂量的剂量。相比于每日限定剂量,所述低剂量可以是约1/6至约1/2剂量、约1/5至约1/2剂量、或约1/4至约1/2剂量。
在一实施例中,在转化为氨氯地平游离碱基形式时,氨氯地平或其药学上可接受的盐的含量可以为0.5至5mg。在一实施例中,在转化为氨氯地平游离碱基形式时,氨氯地平或其药学上可接受的盐的含量可以为0.8至3mg。
在一实施例中,在转化为氯噻酮游离碱基形式时,氯噻酮或其药学上可接受的盐的含量可以为1至7mg。在一实施例中,在转化为氯噻酮游离碱基形式时,氯噻酮或其药学上可接受的盐的含量可以为2至7mg。
在一实施例中,在转化为氯沙坦游离酸形式时,氯沙坦或其药学上可接受的盐的含量可以为7至30mg。
在一实施例中,氨氯地平或其药学上可接受的盐在转化为氨氯地平游离碱基形式时,含量可以为0.5至5mg,氯噻酮或其药学上可接受的盐在转化为氯噻酮游离碱基形式时,含量可以为1至7mg,氯沙坦或其药学上可接受的盐在转化为氯沙坦游离酸形式时,含量可以为7至30mg。
在一实施例中,氨氯地平或其药学上可接受的盐在转化为氨氯地平游离碱基形式时,含量可以为0.8至3mg,氯噻酮或其药学上可接受的盐在转化为氯噻酮游离碱基形式时,含量可以为2至7mg,氯沙坦或其药学上可接受的盐在转化为氯沙坦游离酸形式时,含量可以为7至30mg。
在一实施例中,在转化为氨氯地平游离碱基形式时,氨氯地平或其药学上可接受的盐的含量可以为1.25至3.5mg或1.25至2.5mg。
在一实施例中,在转化为氯噻酮游离碱基形式时,氯噻酮或其药学上可接受的盐的含量为3至6.25mg。
在一实施例中,在转化为氯沙坦游离酸形式时,氯沙坦或其药学上可接受的盐的含量可以为11至22mg。在一实施例中,在转化为氯沙坦游离酸形式时,氯沙坦或其药学上可接受的盐的含量可以为11.5至25mg或11.5至23mg。
在一实施例中,氨氯地平或其药学上可接受的盐在转化为氨氯地平游离碱基形式时,含量可以为1.25至2.5mg,氯噻酮或其药学上可接受的盐在转化为氯噻酮游离碱基形式时,含量可以为3至6.25mg,氯沙坦或其药学上可接受的盐在转化为氯沙坦游离酸形式时,含量可以为11至22mg。
在一实施例中,氨氯地平或其药学上可接受的盐在转化为氨氯地平游离碱基形式时,含量可以为1.25至2.5mg,氯噻酮或其药学上可接受的盐在转化为氯噻酮游离碱基形式时,含量可以为3至6.25mg,氯沙坦或其药学上可接受的盐在转化为氯沙坦游离酸形式时,含量可以为11.5至23mg。
在所述低剂量药学上组合制剂中,氨氯地平或其药学上可接受的盐在转化为氨氯地平游离碱基形式时,含量可以为0.5至4mg、0.5至3mg、0.8至3mg、0.8至2.5mg、0.83至2.5mg、1.25至2.5mg、1至3mg、1.5至3.5mg、1.5至2.5g或1.25至2.5mg。例如,所述氨氯地平游离碱基或氨氯地平的药学上可接受的盐的含量可以为0.83mg、1mg、1.25mg、1.5mg、1.67mg、2.5mg、3mg或3.5mg,或者可以在使用上述数值作为上限或下限的范围内。
所述氨氯地平可以包括为药学上可接受的盐的形式,例如氨氯地平氯磺酸盐或苯磺酸氨氯地平,其含量可以为1至4mg、1.3至3.9mg、1.5至4mg、1.8至4mg或1.96至3.9mg。例如,所述氨氯地平可以包括为药学上可接受的盐的形式,例如氨氯地平氯磺酸盐或苯磺酸氨氯地平,其含量可以为1.3mg、1.57mg、1.74mg、1.96mg、2.32mg、2.62mg、3.47mg或3.92mg,或者可以在使用上述数值作为上限或下限的范围内。
在所述低剂量药学上组合制剂中,氯噻酮或其药学上可接受的盐在转化为氯噻酮游离碱基的形式时,其含量可以为1至7mg、2至7mg、2至6.5mg、2.1至6.25mg、3至6.25mg、3.13至6.25mg、3至6.5mg或3至7mg。例如,所述氯噻酮的含量可以为2.08mg、2.5mg、3.13mg、4.17mg或6.25mg,或可以在使用上述数值作为上限或下限的范围内。
在所述低剂量药学上组合制剂中,当氯沙坦或其药学上可接受的盐转化为氯沙坦的游离酸形式时,其含量可以为5至30mg、7至30mg、7至25mg、7.5至23mg、7.6至22.9mg、10至30mg、11至23mg、11至22mg、11.4至22.95mg、11.47至22.93mg、11.5至23mg或12至25mg。例如,所述氯沙坦游离酸的含量可以为约7.64mg、9.17mg、11.47mg、12.5mg、15.29mg、16.67mg、22.93mg或25mg,或可以在使用上述数值作为上限或下限的范围内。
所述氯沙坦可以包括为药学上可接受的盐的形式,例如氯沙坦钾,其含量可以为8至30mg,例如8.3至25mg、10至25mg或12.5至25mg。例如,所述氯沙坦的药学上可接受的盐,例如氯沙坦钾的含量可以为8.33mg、10mg、12.5mg、16.67mg或25mg,或可以在使用上述数值作为上限或下限的范围内。
在所述低剂量药学上组合制剂中,当氨氯地平或其药学上可接受的盐、氯沙坦或其药学上可接受的盐以及氯噻酮或其药学上可接受的盐分别转化为氨氯地平游离碱基、氯沙坦游离酸和氯噻酮游离碱基的形式时,其含量可以分别为0.5至3mg、5至30mg和1至7mg;0.8至3mg、8至30mg和2至7mg;0.62至2.5mg、6.25至25mg和1.56至6.25mg;0.8至2.5mg、8.3至25mg和2至6.5mg;0.8至2.5mg、8至25mg和2至6.25mg;1至3mg、10至30mg和3至7mg;1.25至2.5mg、11至23mg和3.13至6.25mg;1.25至2.5mg、12至27mg和3至6.5mg;1.25至2.5mg、12.5至25和3.13至6.25mg;或1.5至2.5mg、12.5至25mg和3.13至6.25mg。
例如,在所述低剂量药学上组合制剂中,当氨氯地平或其药学上可接受的盐、氯沙坦或其药学上可接受的盐以及氯噻酮或其药学上可接受的盐分别转化为氨氯地平游离碱基、氯沙坦游离酸和氯噻酮游离碱基的形式时,其含量可以分别为2.5mg、25mg和6.25mg;2.5mg、23mg和6.5mg;2.5mg、22.9mg和6.25mg;1.7mg、15.3mg和4.2mg;1.67mg、15.29mg和4.17mg;1.25mg、11.47mg和3.13mg;1.25mg、12.5mg和3.13mg;1.67mg、16.67mg和4.17mg;1mg、10mg和2.5mg;1mg、9.2mg和2.5mg;1mg、9mg和3mg;1mg、9mg和2.5mg;0.8mg、8mg和2mg;或0.8mg、7.6mg和2mg,或可以在使用上述数值作为上限或下限的范围内。
所述剂量可根据患者的年龄、性别、体重、病症的程度、种族和施用途径而变化。
当参考高血压治疗剂临床试验指南时,通常在评估降压效果时,高血压治疗剂的有效性以治疗前后的坐位收缩期血压的变化量作为第一评估项目来进行评估,并且以治疗前后的坐位舒张期血压的变化量作为第二评估项目来进行评估。
在本说明书中,高血压治疗反应程度可以以血压的正常化比率,即血压控制率(Control rate)(治疗后收缩期血压小于140mmHg和舒张期血压小于90mmHg的试验对象的比例)(sitSBP<140mmHg和sitDBP<90mmHg的试验对象比例)进行评估。
另外,在本说明书中,高血压治疗反应程度可以以血压反应率(与基线相比,治疗后的收缩期血压减少20mmHg或更多或舒张期血压减少10mmHg或更多的试验对象比例)(与基线相比,sitSBP减少量≥20mmHg或sitDBP减少量≥10mmHg的试验对象的比例)进行评估。
另外,在本说明书中,可以基于脉压(pulse pressure)的变化量,例如平均脉压变化量(平均sitSBP-sitDBP)来评估高血压治疗剂的有效性。
根据一实施例的低剂量药学上组合制剂可以减少坐位收缩期血压的变化量和/或坐位舒张期血压的变化量,并且同时或选择性地减少脉压的变化量。
根据一实施例的所述低剂量药学上组合制剂可以在具有轻度高血压或中度高血压的个体中安全、快速且充分地抑制血压升高,并表现出降血压效果。
根据一实施例的所述低剂量药学上组合制剂可以用作治疗高血压的初始疗法。
与安慰剂相比,根据一实施例的所述低剂量药学上组合制剂可以表现出优异的血压改善效果,并且可以表现出与施用5mg或10mg的氨氯地平或100mg的氯沙坦时相似的血压改善效果。
根据一实施例的所述低剂量药学上组合制剂可以有效地用于治疗轻度高血压或中度高血压。
在本说明书中,轻度高血压是指收缩期血压(mmHg)为140或更大且小于160和/或舒张期血压(mmHg)为90或更大且小于100的情况。在本说明书中,中度高血压是指收缩期血压(mmHg)为160或更大且小于180和/或舒张期血压(mmHg)为100或更大且小于110的情况。
根据一实施例的所述低剂量药学上组合制剂可以有效改善收缩期血压(mmHg)为140或更大且小于180和/或舒张期血压(mmHg)为90或更大且小于110的个体的血压,并且相对比风险具有优异的益处。例如,所述组合制剂可以有效地改善收缩期血压(mmHg)为140或更大且179或更小和/或舒张期血压(mmHg)为90或更大且109或更小的个体的血压。
在一实施例中,根据2018年的ESH指南,轻度高血压或中度高血压可以包括高血压1级至2级。
根据一实施例的低剂量药学上组合制剂可以有效地用于治疗根据ESH(2018)指南的高血压1期(Grade 1)或2期(Grade 2)。
在本说明书中,高血压1期是指收缩期血压(mmHg)为140或更大且159或更小和/或舒张期血压(mmHg)为90或更大且99或更小的情况。在本说明书中,高血压2期是指收缩期血压(mmHg)为160或更大且179或更小和/或舒张期血压(mmHg)为100或更大且109或更小的情况。
根据一实施例的低剂量药学上组合制剂可以有效地改善其中收缩期血压(mmHg)为140或更大且179或更小和/或舒张期血压(mmHg)为90或更大且109或更小的个体的血压。例如,所述组合制剂可以有效地改善其中收缩期血压(mmHg)为140或更大且159或更小和/或舒张期血压(mmHg)为90或更大且99或更小的个体的血压。根据一实施例的低剂量药学上组合制剂可以有效地改善其中坐位收缩期血压(sitSBP)小于160mm Hg的个体的血压。
根据一实施例的低剂量药学上组合制剂可以为轻度高血压或中度高血压的患者提供有效的初始治疗法治疗剂。
根据一实施例的低剂量药学上组合制剂可以对其中坐位收缩期血压(sitSBP)小于160mmHg的高血压有效。所述组合制剂可以在其中sitSBP小于160mmHg的个体中表现出根据剂量成比例增加的血压减少量。
所述低剂量药学上组合制剂可以制剂成包括上述含量的氨氯地平或其药学上可接受的盐、氯沙坦或其药学上可接受的盐和氯噻酮或其药学上可接受的盐的固定剂量组合制剂(fixed-dose combination formulation)。取决于施用量,所述组合制剂可以一天一次至几次施用,例如一次或三次。
在一实施例中,所述低剂量药学上组合制剂可以每天施用一次。通过每天施用一次所述组合制剂,可以改善患者的便利性和服用药物依从性,并且就降血压效果而言提供最佳的药理和临床效果。考虑到要施用的对象的病理状态及其严重性,可以将所述组合制剂施用至少4周或8周,或更长或更短的时间。
在所述低剂量药学上组合制剂中,氨氯地平、氯沙坦或氯噻酮的药学上可接受的盐是指根据本领域常规方法制备的盐,并且这种制备方法是本领域技术人员已知的。具体地,所述药学上可接受的盐包括但不限于衍生自以下药理上或生理上可接受的无机酸和有机酸以及碱基。例如,合适的酸的实例包括盐酸、氢溴酸、硫酸、硝酸、高氯酸、富马酸、马来酸、磷酸、乙醇酸、乳酸、水杨酸、琥珀酸、对甲醛磺酸、酒石酸、乙酸、柠檬酸、甲磺酸、甲酸、苯甲酸、丙醇二酸、萘-2-磺酸、苯磺酸(benzenesulfonic acid)、羧酸、苯磺酸(besylate)、樟脑磺酸等。衍生自合适的碱基的盐可包括但不限于碱金属如钠或钾,碱土金属如钙、镁。
所述氨氯地平的药学上可接受的盐由包括药学上可接受的阴离子的形成无毒酸加成盐的酸形成,例如盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、马来酸盐、富马酸盐、乳酸盐、酒石酸盐、柠檬酸盐、葡萄糖酸盐、苯磺酸盐和樟脑磺酸盐,但不限于此。例如,可以使用苯磺酸氨氯地平盐或樟脑磺酸盐。所述氨氯地平包括氨氯地平外消旋体和(S)-氨氯地平。所述氯沙坦的药学上可接受的盐可以优选为例如氯沙坦钾盐,但不限于此。
在一实施例中,所述组合制剂可包括氨氯地平樟脑酸盐(amlodipinecamsylate)、氯沙坦钾(losartan potassium)和氯噻酮(chlorthalidone)。
在一实施例中,所述组合制剂可包括苯磺酸氨氯地平(amlodipine besylate)、氯沙坦钾和氯噻酮。
所述低剂量药学上组合制剂在用于口服制剂时,可存在为例如粉剂、片剂、胶囊剂、水性或油性悬浮液、乳液或可分散的粉末或颗粒,在用于肠胃外制剂时例如静脉内、皮下、肌肉内或血管内可存在为无菌水性或油性溶液或悬浮液,或可以存在为适合局部使用的形式,例如乳膏、凝胶或软膏,或用于直肠施用的栓剂。
在一实施例中,所述低剂量药学上组合制剂可以制剂成片剂、胶囊剂或囊片(caplet)的形式。在一实施例中,所述组合制剂是单层片剂。
在本说明书中所用的术语“片剂”是指包括所有形状和尺寸的压缩的药物施用形式。
在本说明书中所用的术语“双层片剂”是指其中两种或更多种不同的成分通过分隔区划而独立存在于两层中的片剂。
在本说明书中所用的术语“单层片剂”是指两种或更多种不同的成分混合存在于一个层中的片剂。在根据一实施例的单层片剂组合制剂中,氨氯地平、氯噻酮和氯沙坦不通过分隔区划而存在,且可以存在于同一层中。所述术语“单层片剂”与其中两种或多种不同的成分独立存在于不同层中的多层片剂如双层片剂和三层片剂分开使用。
根据一实施例的药学上组合制剂为单层片剂,并且不会引起诸如所述氯沙坦凝胶化或由此引起的溶出度降低或杂质产生等的问题。
当制备包括氨氯地平、氯噻酮和氯沙坦的组合制剂时,氯沙坦的凝胶化(gelation)可能是一个问题。氯沙坦在相对较高的pH值如纯净水、pH4.0和pH6.8下溶出时显示出非常好的溶出模式。然而,在低pH值(例如,pH值1.2、pH值2.0等)下,氯沙坦凝胶化并缓慢溶出。在服用口服制剂时最先发生崩解和溶出的地方是分泌低pH消化液的胃的方面,这种现像对制剂的溶出率影响很大,而且会影响药物在人体内的吸收。此外,如上所述,随着氯沙坦凝胶化,与氯沙坦混合的氨氯地平和氯噻酮也被截留在凝胶中,导致溶出度降低的问题。
然而,在包括低剂量的氯沙坦的组合制剂中,例如,当转化为氯沙坦游离酸形式时,包括30mg或更少,如7至30mg,可能不会发生由于所述氯沙坦凝胶化引起的溶出度降低。
因此,以低剂量包括氨氯地平、氯噻酮和氯沙坦的单层片剂组合制剂表现出改善的溶出率、稳定性和生产率,而不会引起此类凝胶化问题。
因此,根据一实施例的低剂量单层片剂药学上组合制剂可以提高其中所含药物成分的溶出率、含量均匀度、保管安全性、压片速度和生产率。
根据一实施例的低剂量单层片剂药学上组合制剂在混合颗粒部包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐、氯沙坦或其药学上可接受的盐。
所述单层片剂药学上组合制剂在混合颗粒部包括有效成分,与包括有效成分在分离颗粒部中的双层片剂或单层片剂的情况相比,未显示有效成分的溶出率降低或杂质增加,并且显示出氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐、氯沙坦或其药学上可接受的盐的溶出率和组合制剂的稳定性优异。
在一实施例中,用于预防或治疗心血管系统疾病的药学上单层片剂组合制剂的总重量可为350mg或更少。在一实施例中,所述组合制剂的总重量可以是330mg或更少、300mg或更少、200mg或更少、170mg或更少、或165mg或更少。由于所述组合制剂的总重量为330mg或更少、300mg或更少、200mg或更少、170mg或更少、或165mg或更少,可以显示氨氯地平、氯噻酮和氯沙坦的改善的溶出率。
所述组合制剂的总重量可以是42mg或更多、40mg或更多、50mg或更多、60mg或更多、70mg或更多、或80mg。
在一实施例中,用于预防或治疗心血管系统疾病的药学上单层片剂组合制剂的总重量可以为70mg或更多且350mg或更少。
当组合制剂的总重量在上述范围内时,可以提高有效成分的溶出率,同时可以确保制剂的均匀性,并制备出具有优异质量的组合制剂。
在一实施例中,在组合制剂中,作为有效成分的氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐的总重量可以等于或大于15mg。
当组合制剂中的有效成分的总重量在上述范围内时,可以提高有效成分的溶出率,同时可以确保制剂的均匀性,并制备出具有优异质量的组合制剂。
在一实施例中,基于组合制剂的总重量,所述有效成分的含量可以为10%或更多。
在一实施例中,基于组合制剂的总重量,所述有效成分的含量可以为20%或更多。
通过在组合制剂中包括上述重量范围内的有效成分,可以提高溶出率,并且可以制备质量优异的组合制剂。
在一实施例中,可进一步包括崩解剂,在这种情况下,基于组合制剂的总重量,崩解剂的含量可以为1至15%。
基于组合制剂总重量,当崩解剂的含量小于1%时,不能达到快速溶出的效果,当超过15%时,制剂的稳定性降低,而当基于组合制剂总重量,崩解剂的含量为1至15%时,可以实现所需的溶出率和制剂的稳定性。
在一实施例中,可进一步包括崩解剂,在这种情况下,基于组合制剂的总重量,崩解剂的含量可以为2%或更多、3%或更多、4%或更多、或5%或更多。
在一实施例中,可进一步包括崩解剂,在这种情况下,基于组合制剂的总重量,崩解剂的含量可以为4至15%。
在一实施例中,可进一步包括崩解剂,在这种情况下,基于组合制剂的总重量,崩解剂的含量可以为4.5至10%。
在一实施例中,可进一步包括崩解剂,在这种情况下,基于组合制剂的总重量,崩解剂的含量可以为9至15%。
通过在组合制剂中包括上述重量范围内的崩解剂,可以提高溶出率,并且可以制备质量优异的组合制剂。
在一实施例中,所述组合制剂还可包括选自稀释剂、崩解剂、润滑剂及其组合的药物添加剂。
在一实施例中,所述稀释剂选自微晶纤维素、淀粉、预糊化淀粉、磷酸二钙、乳糖、低取代的羟丙基纤维素及其组合中的任何一种。
在一实施例中,所述崩解剂选自交联聚维酮、交联羧甲基纤维素钠、淀粉葡糖酸钠、淀粉、预糊化淀粉及其组合中的任何一种。
在一实施例中,所述润滑剂选自硬脂酸镁、棕榈酸、滑石、硬脂酸锌、硬脂酸钙、及其组合中的任何一种。
在一实施例中,所述组合制剂还可包括粘合剂。
在一实施例中,粘合剂可以是选自羟丙基纤维素、羟丙基甲基纤维素、聚乙烯聚吡咯烷酮、明胶、阿拉伯胶及其组合中的任何一种。
在一实施例中,在组合制剂中,氨氯地平或其药学上可接受的盐的含量可为0.1至7重量%。例如,可以为0.5至3重量%。
在一实施例中,氯噻酮或其药学上可接受的盐的含量可为0.3至9重量%。例如,可以为1至5重量%。
在一实施例中,氯沙坦或其药学上可接受的盐的含量可为1至40重量%。例如,可为5至20重量%。
在一实施例中,稀释剂的含量可为40至95重量%。例如,可为50至90重量%。
在一实施例中,崩解剂的含量可为1至20重量%。例如,可为1.5至15重量%。
在一实施例中,润滑剂的含量可为0.1至2重量%。例如,可为0.5至1.5重量%。
在一实施例中,粘合剂的含量可为0至10重量%。例如,可为0.1至10重量%。例如,可为0.5至5重量%。
根据需要,所述组合制剂还可包括pH调节剂、悬浮剂、防腐剂、调味剂、着色剂、甜味剂、吸附剂、增溶剂等。本发明对所述添加剂的含量没有特别限制,可以根据需要来适当调整。
在一实施例中,可以包括稀释剂,使得除低取代的羟丙基纤维素之外的稀释剂与低取代的羟丙基纤维素的重量比为6∶1至1∶1。
在一实施例中,可进一步包括微晶纤维素和低取代的羟丙基纤维素为稀释剂,并且微晶纤维素与低取代的羟丙基纤维素的重量比可为2∶1至1∶1。
例如,所述重量比可为6∶1至1∶1、5∶1至1∶1、4∶1至1∶1或2∶1至1.5∶1。
当在上述含量范围内使用低取代的羟丙基纤维素时,可以表现出改善的压片性和溶出率。具体而言,可以提高片剂的流动性和压片性,并提高氯噻酮的溶出率。
当含量小于上述含量范围时,在压片操作中会出现压片障碍,当含量大于上述含量范围时,会出现制成大于所需的剂型的问题。
因此,通过在上述含量范围内使用除低取代的羟丙基纤维素的稀释剂与低取代的羟丙基纤维素的重量比,例如,微晶纤维素与低取代的羟丙基纤维素的重量比,可以制造质量提高的片剂。
在一实施例中,作为有效成分的氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐、氯沙坦或其药学上可接受的盐与稀释剂的总重量与稀释剂可以进一步包括在1∶2至1∶9的重量比中。
通过在组合制剂中包括上述重量比的有效成分和稀释剂,可以提高有效成分的溶出率,并且可以制造出质量优异的组合制剂。
在一实施例中,根据所述口服药物溶出度标准设定指南,在溶出度试验中,所述单层片剂组合制剂在30分钟内可具有分别80%或更多的有效成分的溶出率。
在一实施例中,根据所述口服药物溶出度标准设定指南,在溶出度试验中,所述组合制剂在30分钟内可具有80%或更多的氨氯地平的溶出率。
在一实施例中,根据所述口服药物溶出度标准设定指南,在溶出度试验中,所述组合制剂在30分钟内可具有80%或更多的氯噻酮的溶出率。
在一实施例中,根据所述口服药物溶出度标准设定指南,在溶出度试验中,所述组合制剂在30分钟内可具有80%或更多的氯沙坦的溶出率。
在一实施例中,根据美国药典溶出度试验项目桨法,所述单层片剂组合制剂在100±5rpm、37±0.5℃、0.01M盐酸溶液和900mL的溶出度试验中,在30分钟内具有80%或更多的氨氯地平的溶出率。
在一实施例中,根据美国药典氯噻酮片剂项目的溶出度试验项目,以桨法在75±2rpm、37±0.5℃、纯净水900mL中进行溶出度试验,所述单层片剂组合制剂在30分钟内具有80%或更多的氯噻酮的溶出率。
在一实施例中,根据美国药典氯沙坦钾片剂项目的溶出度试验项目,以桨法在75±2rpm、37±0.5℃、纯净水900mL中进行溶出度试验,所述单层片剂组合制剂在30分钟内具有80%或更多的氯沙坦的溶出率。
在根据美国药典溶出度试验项目的桨法进行溶出度试验时,所述组合制剂在30分钟内可具有每种有效成分的85%或更多的溶出率,并且在一实施例中,在15分钟内可具有85%或更多的溶出率。
在一实施例中,在所述单层片剂中,氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐可存在于一个混合部或颗粒部中。
在所述组合制剂中,当氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐包括在一个混合部或颗粒部中时,相比于包括所述药物在分离的混合部或颗粒部的情况,具有最大压片速度、高压片工艺收率和优异的含量均匀度。
在所述组合制剂中,氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐、氯沙坦或其药学上可接受的盐,以及如稀释剂、崩解剂等的药物添加剂可混合来形成混合部中。所述混合部可以在通过常规颗粒化方法例如压缩颗粒方法颗粒化后压片。在另一实施例中,所述混合部可以是经过碾压工艺的颗粒形式。所述经碾压颗粒化的混合部可以与润滑剂混合以获得最终颗粒部。
当将所述混合部或最终颗粒部压片成单层片剂时,氨氯地平、氯噻酮和氯沙坦的溶出率优异,并且表现出所需的溶出模式,而氯沙坦不会胶凝化,且组合制剂的稳定性为优秀的。
另外,当将所述组合制剂压片成单层片剂时,相比于压片成双层片剂的情况,具有最大压片速度、更大压片工艺收率,并且优异的含量均匀性。
在所述组合制剂中的氯噻酮或其药学上可接受的粒径D90可为约0.5至50μm,例如0.5至25μm,或0.5至10μm。如上所述,当将氯噻酮的颗粒微粉化时,可以提高有效成分的溶出率、含量均匀性和热稳定性。可以使用市售装置基于米氏(Mie)理论的激光衍射.散射方法测量所述粒径。例如,可以使用诸如用于光谱测量的氦氖激光器(Helium-neon Laserfor Optical Spectrometry:HELOS,Sympatec公司)的激光衍射仪等的市售装置进行测量。在该装置中,当将氦氖激光束照射到颗粒上时,发生散射并且在检测器上出现光散射图案,并且可以通过根据米氏理论分析该光散射图案来获得粒径分布。
在所述组合制剂的制备中控制粒径的方法没有特别限制,可以适当选择本领域公知的方法。具体地,所述氯噻酮是使用能够微粉化颗粒的常规粉磨机而粉碎的,例如,气流磨(Jet mill)、球磨机(ball mill)和流能磨(fluid energy mill)。另外,也可以采用筛子(sieve)的筛分法或气流分级(air current classification)等粒度分级法(sizeclassification method)对药物的粒径进行细分。
另一方面提供一种用于预防或治疗心血管系统疾病的药学上组合制剂的制造方法,其中,所述组合制剂在单层片剂中以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐。
所述制造方法包括混合药学上可接受的添加剂。所述制造方法可包括混合当转化为氨氯地平游离碱基形式时相应于0.5至5mg的量的氨氯地平或其药学上可接受的盐、当转化为氯噻酮游离碱基形式时相应于1至7mg的量的氯噻酮或其药学上可接受的盐、当转化为氯沙坦游离酸形式时相应于7至30mg的量的氯沙坦或其药学上可接受的盐以及药学上可接受的添加剂的步骤。
所述制造方法可包括混合当转化为氨氯地平游离碱基形式时相应于0.8至3mg的量的氨氯地平或其药学上可接受的盐、当转化为氯噻酮游离碱基形式时相应于2至7mg的量的氯噻酮或其药学上可接受的盐、当转化为氯沙坦游离酸形式时相应于7至30mg的量的氯沙坦或其药学上可接受的盐以及药学上可接受的添加剂的步骤。
所述制造方法可包括混合当转化为氨氯地平游离碱基形式时相应于1至3mg的量的氨氯地平或其药学上可接受的盐、当转化为氯噻酮游离碱基形式时相应于3至7mg的量的氯噻酮或其药学上可接受的盐、当转化为氯沙坦游离酸形式时相应于10至30mg的量的氯沙坦或其药学上可接受的盐以及药学上可接受的添加剂的步骤。
所述制造方法可包括:将氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐、氯沙坦或其药学上可接受的盐和药学上可接受的添加剂混合形成混合物的步骤(1);
将所述混合物颗粒化来制成颗粒部的步骤(2);
将所述颗粒部与药学上可接受的添加剂混合以获得最终颗粒部的步骤(3);以及
将所述最终颗粒部压片来制造单层片剂的步骤(4)。
在所述步骤(1)中混合的药学上可接受的添加剂可以包括稀释剂、崩解剂及其组合。
在所述步骤(2)中混合的药学上可接受的添加剂可以包括润滑剂。
另一方面提供通过施用组合制剂治疗早期心血管系统疾病的方法,其中,所述组合制剂在单层片剂中以低剂量包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐以及氯沙坦或其药学上可接受的盐。
根据一实施例的治疗方法可有效作为治疗轻度高血压或中度高血压的初始疗法。
包括在所述组合制剂或组合物中的氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐可以以有效治疗或预防个体或患者的量根据预期目的通过口服或肠胃外等多各种施用方法进行施用。应当理解,在所述施用方法中,应根据患者的体重、年龄、种族、性别、健康状况、饮食、施用时间、施用方法、疾病的严重程度等几个相关因素确定特定个体或患者的施用剂量,并可以由专家适当增加或减少,且上述施用量并不以任何方式限制本发明的范围。具有相关技术领域的常规技术的医生可以根据需要容易地确定和处方所用化合物的施用量。例如,对于用于药物组合物的本发明化合物的剂量,医生可以以低于达到所需治疗效果所需的剂量开始,并逐渐增加施用量直至实现所需效果。
在本说明书中所用的术语“治疗”用作包括疾病的治疗(treatment)、改善(improvement)、缓和(amelioration)或管理(management)的概念。在本说明书中所用的术语“治疗的”或“治疗”是指抑制疾病,例如在经历或表现出疾病、病态或障碍的病理或症状的个体中抑制疾病、病态或障碍、防止病理和/或症状的进一步发展、改善疾病或逆转病理和/或症状,例如,降低疾病的严重程度。
在本说明书中所用的术语“预防的”或“预防”是指预防疾病,例如,在虽然有疾病、病态或障碍的倾向但尚未经历或表现出疾病病理或症状的个体中预防疾病、病态或障碍。
在本说明书中所用的术语“个体”或“患者”是指哺乳动物,例如包括小鼠、大鼠、其他嚙齿动物、兔、狗、猫、猪、牛、羊、马或灵长类动物和人类的任意动物。
在根据一实施例的的治疗方法中,可以以包括氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐的单一剂型施用,或可以以单独包括上述氨氯地平或其药学上可接受的盐、氯噻酮或其药学上可接受的盐和氯沙坦或其药学上可接受的盐的多种剂型施用。所述成分可以存在于一种单一施用型中,或者可以分别存在于单独的施用型中并且组合施用。所述单一施用型或单独的施用型可以是片剂或胶囊的形式。例如,当存在于单独的施用型来施用时,可以通过不同的途径施用。当顺序或分开所述成分的施用时,第二成分的施用延迟应优选不损害例如组合疗法的有益效果。在这种情况下,顺序施用还可以包括(但不限于),例如,有效成分的交替施用。
在根据一实施例的治疗方法中,药物的施用量可以根据要施用的对象的年龄、性别、体重、病理状态和其严重程度、施用途径或处方者的判断而变化。基于这些因素确定要施用的量在本领域普通技术人员的水平之内。此外,根据需要,可以与一种或多种其他用于预防或治疗心血管系统疾病的药物组合施用。
除非另有定义,在本说明书中使用的所有技术术语与本领域普通技术人员通常理解的含义相同。此外,虽然本说明书描述了优选的方法和样品,但相似或等效的方法和样品也包括在本说明书的范围内。
在本说明书中作为参考文献记载的所有出版物的内容通过引用整体并入本说明书中。即使没有特别说明,在本说明书中记载的数值也被认为包括“约”的含义,并且本说明书中所用的术语“约”是指所述的值可能会有一定程度的变化。例如,所述值可能有10%、5%、2%或1%的变化。例如,“约5”意味着包括在4.5与5.5之间、在4.75与5.25之间、在4.9与5.1之间,或者在4.95与5.05之间的任何值。在本说明书中,使用术语“至”表示的数值范围是指包括术语“至”前后描述的数值分别作为下限和上限的范围。在本说明书中使用的术语“具有”、“可以具有”、“包括”或“可以包括”等表达指示相应特征(例如,数值或诸如成分的组分)的存在,并且不排除附加特征的存在。
在下文中,将基于以下实施例详细描述本发明。然而,以下实施例仅用于说明本发明,本发明的范围不限于此。
[实施例]
1.试验对象的选择
基于以下选择标准和排除标准选择试验对象。
(1)选择标准
1)满19岁或以上的原发性高血压患者
2)了解临床试验流程并签署同意书的试验对象
3)在第一次访问(Visit 1)和第二次访问(Visit 2)中测量的平均血压为140mmHg≤sitSBP<180mmHg且sitDBP<110mmHg的患者
然而,基于以下举例的排除标准,如果根据临床试验方案中设定的标准不适合临床试验,将从对象中被排除。
(2)排除标准
1)在第一次访问时在两臂测量的平均血压值的差异在sitSBP大于或等于20mmHg或在sitDBP大于或等于10mmHg的患者
2)第一次访问和第二次访问之间平均sitSBP差异大于15mmHg的患者
3)在第一次访问和第二次访问中的平均sitSBP大于或等于180mmHg或平均sitDBP大于或等于110mmHg的患者
4)继发性高血压或疑似继发性高血压患者(大动脉瓣狭窄症、原发性醛固酮增多症、肾动脉狭窄、肾性高血压、嗜铬细胞瘤和库欣综合症等)
5)基于第一次访问2周内服用过降血压药或在试验期间需要服用禁止组合施用的药物的患者(本文82组合施用药物和禁止施用的药物)
6)1型糖尿病患者或未控制的2型糖尿病患者(第一访问时HbA1c≥9%)等
2.临床试验药物的制备和施用方法
(1)试验药物的制备
作为对选择的对象组施用的试验药物,制备含有以下含量的试验药物。为了开发以轻度高血压或中度高血压的患者为对象的治疗剂,需要证明适当水平的降血压效果。因此,为了考虑安全性和有效性来开发适当剂量的低剂量组合制剂,本发明人基于各自作为Amosartan Plus
1)HCP1803-2.5/25/6.25:氨氯地平2.5mg、氯沙坦钾25mg、氯噻酮6.25mg
2)HCP1803-1.67/16.67/4.17:氨氯地平1.67mg、氯沙坦钾16.67mg、氯噻酮4.17mg
3)HCP1803-1.25/12.5/3.13:氨氯地平1.25mg、氯沙坦钾12.5mg、氯噻酮3.13mg
(2)对照药物(活性对照组)的制备
作为对照药物,制备了HGP0904(Novasc
(3)安慰剂(Placebo)的制备
1)HGP0904(氨氯地平5mg)的安慰剂(白色八角形片剂)
2)HCP1803-1.25/12.5/3.13的安慰剂(白色圆形薄膜衣片剂)
(4)用于双盲的DB胶囊制造
为了确保双盲性,将(1)至(3)中制备的片剂包装在DB胶囊(DB
为了使各施用组服用的DB胶囊的重量相似,将试验药或对照药与HGP0904的安慰剂或HCP1803-1.25/12.5/3.13的安慰剂一起填充在DB胶囊中。然而,对于氨氯地平10mg的组,考虑到DB胶囊的大小,将2片HGP0904填充在DB胶囊中。
(5)施用方法
在两周的磨合期(run-in period)内,所有试验对象均服用1片Novasque 5mg的安慰剂以单盲,在8周的治疗期间(treatmentperiod),根据随机分配的施用组,每天一次经口服施用临床试验药物1粒胶囊,不论进餐。
3.临床试验计划和方法
本临床试验设计为多机构共同、随机、双盲、平行设计方式的试验。
在第一次访问(Visit 1)中适合选择/排除标准的对象进行为期两周的磨合期,并要求控制饮食(盐摄入量)、吸烟、饮酒、体重和运动量等。在第二次访问(Visit 2)适合选择/排除标准的患者基于sitSBP 160mmHg分层,分为7组,按1∶1∶1∶1∶1∶1∶1的比例随机分组,并在8周期间施用相应的临床试验药物。在治疗期间,对象在第0周(Visit 2)、第4周(Visit 3)和第8周(Visit 4)访问试验机构评估有效性和安全性,并在试验期间,维持相同的治疗方法而不调整临床试验药物的剂量。此外,在整个临床试验期间,要求所有对象恒定保持可能影响血压测量结果的生活习惯,如饮食(盐摄入量)、吸烟、饮酒、体重和运动等。
图1示出根据上述临床试验的计划在经过磨合期(Run-in period)到治疗期间(Treatment period)向临床试验对象施用上述试验药物(氨氯地平2.5mg、氯沙坦钾25mg和氯噻酮6.25mg;氨氯地平1.67mg、氯沙坦钾16.67mg和氯噻酮4.17mg;或氨氯地平1.25mg、氯沙坦钾12.5mg和氯噻酮3.13mg)、对照药物(氨氯地平5mg;氨氯地平10mg;氯沙坦钾100mg)或安慰剂(placebo)的方法。
4.临床试验结果评估标准
临床试验结果根据以下有效性和安全性评估项目进行评估。
(1)有效性评估
1)第一次有效性评估项目
①相比于基线的在8周后的平均sitSBP变化量
2)第二次有效性评估项目
①相比于基线的在4周后的平均sitSBP变化量
②相比于基线的在4、8周后的平均sitDBP变化量
③在4、8周中的血压控制率(sitSBP/sitDBP<140/90mmHg试验对象的比率)
④在4、8周中的血压反应率(Responder rate)(对比基线sitSBP/sitDBP减少量≥20/10mmHg试验对象比率)
⑤相比于基线的在4、8周后的平均脉压变化量(平均sitSBP-sitDBP)
(2)安全性评估
1)不良反应
2)生命体征、临床试验室检查、身体检查、心电图(electrocardiogram:ECG)
(3)剂量选择
通过综合评估各施用组的有效性和安全性,选择适合第3期确认试验的剂量。
5.统计分析方法
对基于所述临床试验评估项目得到的结果值以如下方法进行统计分析。在有效性评估分析中,以所有分析对象组(Full analysis set:FA set或FAS)(在随机化后服用一次或更多次的临床试验药物的试验对象中,在服用临床试验药物后直到临床试验结束至少测量一次sitSBP的试验对象)为主要分析对象,并以符合计划书的临床试验对象组(Perprotocol set:PP set或PPS)为次要分析对象。
(1)有效性分析
1)第一次有效性评估
①相比于基线的在8周后的平均sitSBP变化量
为了检定试验组的相比于基线的在8周后的sitSBP变化是否优于安慰剂对照组,进行以基线为协变量(Covariate)的协方差分析(ANCOVA)。
2)第二次有效性评估
①相比于基线的在8周后的平均sitSBP变化量
为了比较试验组和对照组的相比于基线的在8周后的sitSBP变化,进行以基线为协变量的协方差分析。(不包括作为第一次评估变量的试验药物和安慰剂之间的比较)
②相比于基线的在4周后的平均sitSBP变化量
为了比较试验组和对照组的相比于基线的在4周后的sitSBP变化,进行以基线为协变量的协方差分析。
③相比于基线的在4、8周后的平均sitDBP变化量
为了比较试验组和对照组的相比于基线的在4、8周后的sitDBP变化,进行以基线和分层变量为协变量的协方差分析。
④4、8周中的血压控制率(sitSBP<140mmHg及sitDBP<90mmHg试验对象比例)
为了比较试验组和对照组的第4周和第8周的血压控制率,进行了皮尔森卡方检验(Pearson′s chi-square test)或费希尔精确检验(Fisher′s exact test)以在施用组之间进行比较。
⑤4、8周中的血压反应率(Responder rate)(相比于基线的sitSBP减少量≥20mmHg或sitDBP减少量≥10mmHg的试验对象比例)
为了比较试验组和对照组的第4周和第8周的血压反应率,进行了皮尔森卡方检验或费希尔精确检验以在施用组之间进行比较。
⑥相比于基线的在4、8周后的平均脉压变化量(平均sitSBP-sitDBP)
为了比较试验组和对照组的相比于基线的在4、8周后的脉压变化,进行以基线和分层变量为协变量的协方差分析。
(2)安全性评估分析
在安全性分析中,在随机化后服用一次或更多次临床试验药物的对象中,以在服用临床试验药物后直至临床试验结束期间至少确认一次安全性相关数据的试验对象作为对象。
1)不良反应
不良反应是指在施用临床试验药物的试验对象发生所有有害的和非预期的体征(sign:试验室检测值异常)、症状(symptom)或疾病,且不一定与临床试验药物有因果关系。试验对象记录并评估试验期间发生的任何不良反应。
随机化前发生的不良反应(pre-existing AEs)以列表形式提出,而对于随机化后发生的不良反应(TEAEs;Treatment Emergent Adverse Events),根据每个施用组、是否存在严重不良反应、严重程度和与临床试验药物的相关性来提出试验对象数量和发生率(%),并进行了比较评估。
2)生命体征、临床试验检查、身体检查、心电图(ECG)
对于每个施用组,按时间点提出正常、临床非显著异常(NCS)和临床显著异常(CS)的移位表(shift table),并进行McNemar′s检验以检验施用前/后组内变化的统计学显著性检验。对于连续变量,针对每个测量时间点提出描述性统计量(试验对象数量、算术平均值、标准偏差、中位数、最小值、最大值)。
药物不良反应是指在临床试验药物的任何剂量下发生的任何有害和非预期的反应,并且不能排除与临床试验药物的因果关系。在本临床试验中,将评估‘具有’因果关系的不良反应归类为药物不良反应。
严重的不良反应和药物不良反应(Serious AE,ADR)是指在任何剂量的临床试验药物下发生的不良反应或药物不良反应中相应以下任一情况。
1)在死亡或对生命造成威胁的情况
2)需要住院或延长住院时间的情况
3)导致永久性或严重障碍和功能衰退的情况
4)发生胎儿畸形或异常的情况
5)除1)至4)情况外,发生药物依赖或滥用的情况或其他医学上重要的情况,如血液病
在根据本临床试验的临床试验药物中,低剂量高血压治疗剂(氨氯地平2.5mg、氯沙坦钾25mg和氯噻酮6.25mg;氨氯地平1.67mg、氯沙坦钾16.67mg和氯噻酮4.17mg;或氨氯地平1.25mg、氯沙坦钾12.5mg和氯噻酮3.13mg)的施用未显示临床显著严重的不良反应或药物不良反应。
(1)测量对象组的在药物施用前的血压
在施用试验药物之前测量试验对象的收缩期血压和舒张期血压。
(2)根据施用低剂量的高血压治疗剂的血压改善效果
在所述对象组测量根据施用试验药物的收缩期血压和舒张期血压,并与施用对照药物或安慰剂的结果进行比较。结果,相比于安慰剂,制备为试验药物的低剂量高血压治疗剂(HCP1803-2.5/25/6.25,HCP1803-1.67/16.67/4.17,HCP1803-1.25/12.5/3.13)显示出更好的血压改善效果,并显示出与施用5mg或10mg的氨氯地平或100mg的氯沙坦时相似的血压改善效果。所述试验药物在轻度高血压或中度高血压患者中没有表现出过度的血压下降,同时表现出足以控制血压的平均降血压效果,证实其安全性和耐受性优异。此外,确认出在所述对象组中,相比于对照药或安慰剂,试验药物在轻度至中度高血压,例如,根据ESH(2018)指南的1期至2期高血压中具有相比于风险优异的益处。
相比于施用安慰剂,施用低剂量高血压治疗剂(氨氯地平2.5mg、氯沙坦钾25mg和氯噻酮6.25mg;氨氯地平1.67mg、氯沙坦钾16.67mg和氯噻酮4.17mg;或氨氯地平1.25mg、氯沙坦钾12.5mg和氯噻酮3.13mg)在包括根据ESH(2018)指南的高血压1期或2期的轻度或中度高血压患者组中显示出优越的血压改善效果,尽管施用低剂量,但显示出与施用常用量的氨氯地平或常用量的氯沙坦时类似的效果。具体而言,与作为对照组的施用5mg或10mg的氨氯地平或100mg的氯沙坦的情况相比,制备为试验药物的低剂量高血压治疗剂(HCP1803-2.5/25/6.25,HCP1803-1.67/16.67/4.17,HCP1803-1.25/12.5/3.13)在包括根据ESH(2018)指南的高血压1期或2期的轻度高血压至中度高血压中显示出改善的血压正常化率。
为了比较试验组和安慰剂对照组的相比于基线的在8周后的sitSBP的变化,进行了其中将从基线的平均sitSBP校正为协变量的协方差分析。
对于通过协方差分析结果估计的相比于基线的在8周后sitSBP变化量的最小二乘均值±标准误差(LS平均值±SE),基于FAS比较各试验组与安慰剂对照组的结果如下。
对于作为本临床试验的第一次有效性评估的变量的相比于基线的在8周后sitSBP变化量的最小二乘均值±标准误差(LS平均值±SE),氨氯地平/氯沙坦钾/氯噻酮1.25/12.5/3.13mg(以下简称A/L/C-1.25/12.5/3.13)、氨氯地平/氯沙坦钾/氯噻酮1.67/16.67/4.17mg(以下简称A/L/C-1.67/16.67/4.17)和氨氯地平/氯沙坦钾/氯噻酮2.5/25/6.25mg(以下简称A/L/C-2.5/25/6.25)施用组分别大于安慰剂施用组-14.91±3.89mmHg、-19.49±4.36mmHg、-17.21±3.60mmHg,这显示了统计学上的显著差异(p=0.0003,p<0.0001,p<0.0001)。通过这一点,从统计学上证明,对于所有剂量的试验药物HCP1803,相比于基线的在8周后的sitSBP变化比安慰剂优异。
-在所有分析对象组(FAS)中测量从基线的sitSBP的变化
为了比较试验组和活性对照组的相比于基线的在8周后的sitSBP的变化,进行了其中将从基线的平均sitSBP校正为协变量的协方差分析。
对于通过协方差分析结果估计的相比于基线的在8周后sitSBP变化量的最小二乘均值±标准误差(LS平均值±SE),基于FAS比较各试验组与活性对照组的结果如表2和图2所示。
图2示出在第8周时所有分析对象组(FAS)中从基线的sitSBP变化。
当将A/L/C-1.25/12.5/3.13施用组的相比于基线的8周后sitSBP变化量与氨氯地平5mg(以下称为A5)施用组、氨氯地平10mg(以下称为A10)施用组和氯沙坦钾100mg施用组(以下简称L100)分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-3.83±3.14mmHg、3.43±2.87mmHg和-5.13±3.38mmHg,并且A/L/C-1.25/12.5/3.13施用组与所有活性对照组没有示出统计学上显著的差异(p=0.2280,p=0.2355,p=0.1339)。
当将A/L/C-1.67/16.67/4.17施用组的相比于基线的8周后sitSBP变化量与A5施用组、A10施用组和L100施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为8.64±3.64mmHg、-1.42±3.35mmHg和-10.06±3.80mmHg,并且A/L/C-1.67/16.67/4.17施用组与A5施用组和L100施用组显示出统计学上显著的差异(p=0.0205,p=0.6745,p=0.0102)。
当将A/L/C-2.5/25/6.25施用组的相比于基线的8周后sitSBP变化量与A5施用组、A10施用组和L100施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-5.68±2.85mmHg,1.48±2.57mmHg,-6.84±3.18mmHg,并且A/L/C-2.5/25/6.25施用组与L100施用组显示出统计学上显著的差异(p=0.0502,p=0.5673,p=0.0353)。
试验组之间没有显示出统计学上显著的差异。
为了比较试验组和对照组的相比于基线的在8周后的sitSBP的变化,进行了其中将从基线的平均sitDBP和分层变量校正为协变量的协方差分析。
-在所有分析对象组(FAS)中测量从基线sitDBP的变化
对于通过协方差分析结果估计的相比于基线的在8周后sitDBP变化量的最小二乘均值±标准误差(LS平均值±SE),基于FAS比较各试验组与对照组的结果如图3所示。
图3示出在第8周时在FAS中从基线的sitDBP变化。
当将A/L/C-1.25/12.5/3.13施用组的相比于基线的8周后的sitDBP变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为0.44±1.77mmHg、4.07±1.87mmHg、-4.12±1.93mmHg和-8.17±2.27mmHg,并且A/L/C-1.25/12.5/3.13施用组与A10施用组、L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.8033,0.0333,p=0.0362,p=0.0006)。
当将A/L/C-1.67/16.67/4.17施用组的相比于基线的8周后的sitDBP变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-1.59±1.66mmHg、1.63±1.74mmHg、-6.02±1.73mmHg和-10.03±2.16mmHg,并且A/L/C-1.67/16.67/4.17施用组与L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.3415,p=0.3533,p=0.0009,p<0.0001)。
当将A/L/C-2.5/25/6.25施用组的相比于基线的8周后的sitDBP变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-0.69±1.58mmHg、2.62±1.68mmHg、-5.52±1.69mmHg和-9.36±2.06mmHg,并且A/L/C-2.5/25/6.25施用组与L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.6620,p=0.1253,p=0.0018,p<0.0001)。
试验组之间没有显示出统计学上显著的差异。
在施用临床试验药物8周后,进行皮尔森卡方检验或费希尔精确检验以比较施用组之间的控制至sitSBP小于140mmHg和sitDBP小于90mmHg的试验对象比例,基于FAS的各试验组与对照组的比较结果如下。
图4示出在第8周时在FAS中达到血压控制的对象的比例。此时,将达到的血压控制定义为sitSBP<140mmHg和sitDBP<90mmHg。
在施用临床试验药物8周后,控制至sitSBP小于140mmHg和sitDBP小于90mmHg的试验对象比例为如下:A/L/C-1.25/12.5/3.13施用组为57.14%(20/35名),A/L/C-1.67/16.67/4.17施用组为69.70%(23/33名),A/L/C-2.5/25/6.25施用组为63.89%(23/36名),A5施用组为44.12%(15/34名),A10施用组为66.67%(22/33名),L100施用组为41.18%(14/34名),以及安慰剂施用组为18.18%(6/33名)。
在施用临床试验药物8周后,当将A/L/C-1.25/12.5/3.13施用组的血压控制率与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,A/L/C-1.25/12.5/3.13施用组与安慰剂施用组显示出统计学上显著的差异(p=0.0010)。
在施用临床试验药物8周后,当将A/L/C-1.67/16.67/4.17施用组的血压控制率与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,A/L/C-1.67/16.67/4.17施用组与A5施用组、L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0346,p=0.0189,p=0.0000)。
在施用临床试验药物8周后,当将A/L/C-2.5/25/6.25施用组的血压控制率与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,A/L/C-2.5/25/6.25施用组与安慰剂施用组显示出统计学上显著的差异(p=0.0001)。
试验组之间没有显示出统计学上显著的差异。
在施用临床试验药物8周后,进行皮尔森卡方检验或费希尔精确检验以比较施用组之间的相比于基线的sitSBP减少量等于或大于20mmHg或sitDBP减少量等于或大于10mmHg的试验对象的比例,基于FAS的各试验组与对照组的比较结果如下。
图5示出在第8周时在FAS中血压反应者的比例。此时,血压反应者是指与基线相比,sitSBP减少量≥20mmHg或sit DBP减少量≥10mmHg的试验对象。
在施用临床试验药物8周后,相比于基线的sitSBP减少量≥20mmHg或sitDBP减少量≥10mmHg的试验对象的比例为如下:A/L/C-1.25/12.5/3.13施用组为51.43%(18/35名),A/L/C-1.67/16.67/4.17施用组为60.61%(20/33名),A/L/C-2.5/25/6.25施用组为58.33%(21/36名),A5施用组为47.06%(16/34名),A10施用组为63.64%(21/33名),L100施用组为32.35%(11/34名),以及安慰剂施用组为21.21%(7/33名)。
在施用临床试验药物8周后,当将A/L/C-1.25/12.5/3.13施用组的血压反应率与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,A/L/C-1.25/12.5/3.13施用组与安慰剂施用组显示出统计学上显著的差异(p=0.0098)。
在施用临床试验药物8周后,当将A/L/C-1.67/16.67/4.17施用组的血压反应率与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,A/L/C-1.67/16.67/4.17施用组与L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0204,p=0.0011)。
在施用临床试验药物8周后,当将A/L/C-2.5/25/6.25施用组的血压反应率与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,A/L/C-2.5/25/6.25施用组与L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0292,p=0.0017)。
试验组之间没有显示出统计学上显著的差异。
为了比较试验组和对照组的相比于基线的在8周后脉压(sitSBP-sitDBP)的变化,进行了其中从基线的平均脉压(平均saSBP-satDBP)和分层变量校正为协变量的协方差分析。
-测量所有分析对象组(FAS)在8周后的平均脉压变化量
对于通过协方差分析结果估计的相比于基线的在8周后脉压变化量的最小二乘均值±标准误差(LS平均值±SE),基于FAS比较各试验组与对照组的结果如图6所示。
图6示出在第8周时在FAS中从基线的脉搏压力的变化。
当将A/L/C-1.25/12.5/3.13施用组的相比于基线的在8周后脉压变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-4.23±2.10mmHg、0.05±1.93mmHg、-0.92±2.31mmHg和-6.85±2.82mmHg,并且A/L/C-1.25/12.5/3.13施用组与A5施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0483,p=0.9801,p=0.6910,p=0.0180)。
当将A/L/C-1.67/16.67/4.17施用组的相比于基线的在8周后脉压变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-6.71±2.54mmHg、-2.67±2.40mmHg、-3.86±2.65mmHg和-9.43±3.18mmHg,并且A/L/C-1.67/16.67/4.17施用组与A5施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0104,p=0.02710,p=0.1503,p=0.0043)。
当将A/L/C-2.5/25/6.25施用组的相比于基线的在8周后脉压变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-4.88±1.91mmHg、-0.73±1.80mmHg、-1.88±2.27mmHg和-7.54±2.71mmHg,并且A/L/C-2.5/25/6.25施用组与A5施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0157,p=0.6855,p=0.4109,p=0.0071)。
试验组之间没有显示出统计学上显著的差异。
对于相比于基线的在8周后sitSBP的平均变化量,根据分层变量,关于根据基线血压为sitSBP<160mmHg的对象(178名),进一步分析了FAS对象。
为了比较试验组和对照组的基线血压为sitSBP<160mmHg的对象的相比于基线的在8周后sitSBP的变化,进行了其中从基线的平均sitSBP校正为协变量的协方差分析。
对于通过协方差分析结果估计的相比于基线的在8周后sitSBP变化量的最小二乘均值±标准误差(LS平均值±SE),基于FAS比较各试验组与对照组的结果如表3和图7所示。
图7示出在第8周时在FAS(sitSBP<160mmHg)中从基线的sitSBP变化。
当将A/L/C-1.25/12.5/3.13施用组的相比于基线的的8周后sitSBP变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-1.40±3.74mmHg、5.44±3.25mmHg、-7.02±3.62mmHg和-13.13±4.06mmHg,并且A/L/C-1.25/12.5/3.13施用组与安慰剂施用组显示出统计学上显著的差异(p=0.7100,p=0.1013,p=0.0586,p=0.0022)。
当将A/L/C-1.67/16.67/4.17施用组的相比于基线的8周后sitSBP变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-4.42±4.27mmHg、1.17±3.78mmHg、-9.94±4.19mmHg和-16.11±4.59mmHg,并且A/L/C-1.67/16.67/4.17施用组与安慰剂施用组显示出统计学上显著的差异(p=0.3503,p=0.6524,p=0.0220,p=0.0010)。
当将A/L/C-1.67/16.67/4.17施用组的相比于基线的8周后sitSBP变化量与A5施用组、A10施用组、L100施用组和安慰剂施用组分别进行比较时,施用组之间的变化量差异(LS平均值±SE)分别为-6.07±3.40mmHg、1.29±2.77mmHg、-11.94±3.26mmHg和-17.77±3.71mmHg,并且A/L/C-1.67/16.67/4.17施用组与L100施用组和安慰剂施用组显示出统计学上显著的差异(p=0.0806,p=0.6427,p=-0.0006,p<0.0001)。
试验组之间没有显示出统计学上显著的差异。
浮肿试验通过测量各临床试验药物施用组的脚踝周长来进行。进行Wilcoxon秩和检验(rank sum test)以比较试验药物施用组和氨氯地平单一药剂施用组的相比于基线的8周后的脚踝周长变化量,并进行Wilcoxon符号秩检验(signed-rank test)以确认每组内变化的统计学上的显著性。在分析中,在每个对象的两个脚踝中选择了8周后脚踝周长变化的绝对值大的脚踝,当两个脚踝周长变化的绝对值相同时,选择脚踝周长增加的脚踝,结果如图8所示。
图8示出在施用分别包括氨氯地平2.5mg、氯沙坦钾25mg和氯噻酮6.25mg;氨氯地平1.67mg、氯沙坦钾16.67mg和氯噻酮4.17mg;或氨氯地平1.25mg、氯沙坦钾12.5mg和氯噻酮3.13mg的试验药物施用组或分别包括氨氯地平5mg和10mg的对照药物施用组的第8周时在FAS中从基线的脚踝周长的变化(在两个脚踝中,基于第8周大脚踝周长变化的绝对值大的脚踝)。
如图8所示,相比于基线的在8周后脚踝周长变化量的平均值±标准差(平均值±SD)为如下:试验药物施用组为-0.76±6.33mm,氨氯地平单一药剂施用组为2.48±8.79mm。氨氯地平单一药剂施用组的脚踝周长比试验药物施用组增加了3.23mm,也显示出统计学上的显著差异(p=0.0033)。此外,在试验药物施用组中,相比于基线的在8周后脚踝周长变化没有显示出统计学上的显著差异(p=0.2668),而在氨氯地平单一药剂施用组中,相比于基线的的在8周后脚踝周长变化显示出统计学上的显著差异(p=0.0150)。
[缩写说明]
A2.5、A1.67、A1.25:每个氨氯地平(氨氯地平:A)2.5(mg)、1.67(mg)、1.25(mg)
L25、L16.67、L12.5:每个氯沙坦钾(氯沙坦钾:L)25(mg)、16.67(mg)、12.5(mg)
C6.25、C4.17、C3.13:每个氯噻酮(氯噻酮:C)6.25(mg)、4.17(mg)、3.13(mg)
DBP:舒张期血压(diastolic blood pressure)
SBP:收缩期血压(systolic blood pressure)
sitDBP:坐位舒张期血压(sitting diastolic blood pressure)
sitSBP:坐位收缩期血压(sitting systolic blood pressure)
HbA1c:糖化血红蛋白(Hemoglobin A
ANCOVA:协方差分析(analysis of covariance)
<组合制剂的制造>
根据下表4所示的组成,取氨氯地平、氯噻酮、氯沙坦微晶纤维素(Microcystalline Cellulose)和低取代的羟丙基纤维素(Low-SubstitutedHydroxypropyl Cellulose)以及交联聚维酮(Crospovidone)来混合10分钟。将混合物压制成块状,然后通过1.0mm筛子过筛以制备颗粒部。将硬脂酸镁(Magnesium Steartate)加入该颗粒部并混合5分钟制成最终颗粒部。使用最终颗粒部生产单层片剂组合制剂。
根据实施例1至6的药学上组合制剂的组成示于下表4中。
[表4]
根据下表5所示的组成,取氨氯地平、氯噻酮、微晶纤维素、低取代的羟丙基纤维素和交联聚维酮混合10分钟。将混合物压制成块状,然后通过1.0mm筛子过筛以制备颗粒部。将硬脂酸镁加入该颗粒部并混合5分钟以制备颗粒部I。
另外,取氯沙坦、微晶纤维素和交聚维酮混合10分钟。将混合物压制成块状,然后通过1.0mm筛子过筛以制备颗粒部。将硬脂酸镁与该颗粒部并混合5分钟以制备颗粒部II。
比较例1和3:通过使用颗粒部I为上层颗粒部和颗粒部II作下层颗粒部来生产双层片剂。
比较例2和4:最后将颗粒部I和颗粒部II混合以制备单层片剂。
[表5]
根据下表6所示的组成,取氨氯地平、氯噻酮、微晶纤维素、低取代的羟丙基纤维素和交联聚维酮混合10分钟。将混合物压制成块状,然后通过1.0mm筛子过筛以制备颗粒部。将硬脂酸镁加入该颗粒部并混合5分钟以制备颗粒部I。
另外,取氯沙坦、微晶纤维素和交聚维酮混合10分钟。将混合物压制成块状,然后通过1.0mm筛子过筛以制备颗粒部。将硬脂酸镁与该颗粒部并混合5分钟以制备颗粒部II。
根据实施例5至8的药学上组合制剂的组成示于下表6中。
[表6]
使用比较例1至6的片剂,根据以下条件确定氨氯地平和氯噻酮的溶出率。溶出条件和高效液相色谱(High Performance Liquid Chromatography:HPLC)分析条件如下。
[溶出条件]
装置:USP<711>溶出项目中的设备2方法(桨法)
试验液:0.01M盐酸溶液,900mL
溶出温度:37±0.5℃
旋转数:100±5rpm
[分析条件]
检测器:紫外吸收光谱仪(测量波长:240mm)
色谱柱:Inertsil ODS-4,4.6×250mm,5μm或等效色谱柱
流动相:10mM己磺酸钠水合物(pH2.5):乙腈(ACN)=64∶36(v/v)
柱温:35℃
分析时间:25分钟
流速:1.3mL/分钟
注入量:40μL
氨氯地平和氯噻酮的溶出度测试验如图9至图11所示。
图9示出比较例1和比较例2中的(a)苯磺酸氨氯地平和(b)氯噻酮随时间的溶出率(%)。
图10示出实施例1以及比较例3和比较例4中的(a)苯磺酸氨氯地平和(b)氯噻酮随时间的溶出率(%)。
图11示出实施例4以及比较例5和比较例6中的(a)苯磺酸氨氯地平和(b)氯噻酮随时间的溶出率(%)。
如图9所示,在与氨氯地平或氯噻酮分离的颗粒部含有高剂量(50mg)的氯沙坦且是双层片剂的比较例1在相同条件下相比于作为单层片剂的比较例2显示出氨氯地平和氯噻酮的溶出率高。
然而,如图10所示,在相同条件下,在与氨氯地平和氯噻酮分离的颗粒部含有低剂量(25mg)的氯沙坦且是双层片剂的比较例3和作为单层片剂的比较例4的氨氯地平和氯噻酮的溶出率差异不大。
另外,如图10所示,在与氨氯地平和氯噻酮分离的颗粒部含有低剂量(25mg)的氯沙坦且是单层片剂的比较例4和在氨氯地平和氯噻酮混合的颗粒部含有低剂量(25mg)的氯沙坦且是单层片剂的实施例1显示出相似的溶出率。
此外,如图11所示,相比于在氨氯地平和氯噻酮混合的颗粒部含有低剂量(25mg)的氯沙坦且是单层片剂的实施例4,在氨氯地平和氯噻酮混合的颗粒部含有高剂量(分别为50mg或33.33mg)的氯沙坦且是单层片剂的比较例5和比较例6显示出低溶出率。
由此可见,可以确认在组合制剂中氨氯地平和氯噻酮的溶出率可能会因根据氯沙坦剂量的凝胶化程度而受到影响,特别是当氯沙坦的剂量为高剂量时,由于凝胶化,氨氯地平和氯噻酮的溶出率降低。
此外,当包括高剂量的氯沙坦时,片剂的形式(单层片剂、双层片剂)影响氨氯地平和氯噻酮的溶出率(图9),而当包括低剂量的氯沙坦时,组合制剂的片剂的形式(单层片剂、双层片剂)或颗粒形式(混合颗粒部分部、分离颗粒部)对氨氯地平和氯噻酮的溶出率没有大影响(图10和图11)。
对比较例3的分离颗粒双层片剂、比较例4的分离颗粒单层片剂和实施例1的混合颗粒单层片剂在以下苛刻的保管条件下测量氨氯地平、氯噻酮和氯沙坦的杂质含量变化,从而评估片剂的稳定性。
[苛刻的保管条件]
保管条件:60℃下包装在高密度聚乙烯(High Density Polyethylene:HDPE)瓶中
试验条件:初期、1周、2周
分析对象:氨氯地平、氯噻酮、氯沙坦
[分析条件]
[表7]
检测器:紫外吸收光谱仪(测量波长:239mm)
色谱柱:Zorbax SB-C18,4.6×250mm,5μm或等效色谱柱
流动相:A-17mM己磺酸钠/0.05%(v/v)磷酸
B-17mM己烷磺酸钠/0.05%(v/v)磷酸:乙腈=10∶90(v/v)
柱温:35℃
分析时间:110分钟
流速:1.0mL/分钟
注入量::40μL
图12示出通过测量比较例3、比较例4和实施例1中的氯噻酮的(a)杂质B(Imp B)和(b)未知杂质(Unknown max)杂质的含量(%)来确定是否产生杂质的结果。
如图12所示,可以确认在比较例3、比较例4和实施例1中,在苛刻的保管条件下持续2周,杂质含量(%)恒定为(a)Imp B(1.00%)(b)Unknown max(0.3%),杂质含量没有增加,因此显示出组合制剂非常稳定的方面。
此外,在比较例3的分离颗粒双层片剂、比较例4的分离颗粒单层片剂和实施例1的混合颗粒单层片剂中均未检出氨氯地平和氯沙坦的杂质。如图12所示,确认几乎没有氯噻酮的(a)ImpB和(b)未知最大杂质,因此组合制剂是稳定的。
由此,当在组合制剂中以低剂量(25mg)包含氯沙坦时,组合制剂的片剂形式(单层片剂、双层片剂)或颗粒形式(混合颗粒部分离颗粒部)几乎对从组合制剂中产生杂质没有影响。
使用所述实施例1至6中获得的片剂进行溶出度试验。溶出条件和高效液相色谱分析条件如下。
[溶出条件-氨氯地平]
装置:USP<711>溶出项目中的设备2方法(桨法)
试验液:0.01M盐酸溶液,900mL
溶出温度:37±0.5℃
旋转数:100±5rpm
鉴定条件:30分钟后溶出率80%或更大
[溶出条件-氯沙坦、氯噻酮]
装置:USP<711>溶出项目中的设备2方法(桨法)
试验液:纯净水,900mL
溶出温度:37±0.5℃
旋转数:75±2rpm
鉴定条件:30分钟后溶出率80%或更大
[分析条件]
检测器:紫外吸收光谱仪(测量波长:240mm)
色谱柱:Inertsil ODS-4,4.6×250mm,5μm或等效色谱柱
流动相:10mM己磺酸钠水合物(pH2.5):ACN=64∶36(v/v)
柱温:35℃
分析时间:25分钟
流速:1.3mL/分钟
注入量:40μL
图13至14显示氨氯地平、氯噻酮和氯沙坦的溶出率。
图13示出实施例1和实施例2中的(a)苯磺酸氨氯地平、(b)氯沙坦钾和(c)氯噻酮随时间的溶出率(%)。
图14示出实施例2至实施例6中的(a)苯磺酸氨氯地平、(b)氯沙坦钾和(c)氯噻酮随时间的溶出率(%)。
如图13所示,根据测量实施例1和2的溶出率的结果,相比于实施例1的片剂总重量降低50%的实施例2表现出更大的氨氯地平、氯噻酮和氯沙坦的溶出率。
如图14所示,相比于实施例2的崩解剂的含量增加的实施例3和实施例4示出崩解剂的含量越高,溶出率越高(实施例2至实施例4中的片剂硬度为18kp)。
此外,如图14所示,相比于实施例4的片剂总重量和各成分含量减少了1/2的实施例5和片剂总重量和各成分含量减少了2/3的实施例6各自显示出与实施例4相似的溶出率(实施例5至实施例6的片剂硬度为16kp)。另外,实施例4至实施例6的片剂均满足制剂均匀性的鉴定条件(试验例4)。
使用实施例4至实施例5和比较例7至比较例8的片剂确认根据一片剂的氨氯地平、氯噻酮和氯沙坦的制剂均匀性。
[分析条件]
检测器:紫外吸收光谱仪(测量波长:240mm)
色谱柱:Inertsil ODS-4,4.6×250mm、5μm或等效色谱柱
流动相:10mM己磺酸钠水合物(pH2.5):ACN=64∶36(v/v)
柱温:35℃
分析时间:25分钟
流速:1.3mL/分钟
注入量:10μL
表8显示了氨氯地平、氯噻酮和氯沙坦的制剂均匀性结果。
[表8]
如表8所示,在主成分含量高的实施例4至实施例6中,在制剂均匀性的鉴定中,出现98.0至102.0%内的结果,偏差为2.0%或更少,因此满足鉴定条件。
但是,在主成分含量低的比较例7和实施例8中,各样品的数值偏差非常大,为2.0%或更多。这意味着主要成分的含量越小,其在一片剂中不均匀为一定量。
当生产具有相同重量的比较例3的双层片剂和实施例1的单层片剂时,确认生产率(压片速度)和根据压片速度的质量(含量均匀性)。
[表9]
如表9所示,在生产相同数量的片剂时,在比较例3的双层片剂的情况下,可以以高达5万T/h的压片速度生产片剂,但在实施例1的单层片剂的情况下,其可以以高于比较例3.6倍的压片速度,即18万T/h,来生产片剂。
即,相比于使用分离的颗粒作为上下层而压片成的双层片剂(比较例3),将混合颗粒部压片并生产单层片剂(实施例1)的情况具有更高的生产率。此外,相比于包括分离颗粒部的单层片剂,将混合颗粒部压片成单层片剂时表现出更高的生产率。
另外,在表9中的压片工艺收率的情况下,双层片剂在调整每层重量的消耗量和料斗中的残留量高于单层片剂,因此确认实施例1的单层片剂的生产收率高于比较例3的双层片剂。
图15分别示出在(a)比较例3和(b)实施例1中根据压片速度的含量确定值(%)。
如图15所示,在比较例3的双层片剂的情况下,随着压片速度的增加,含量均匀性不均匀,而在实施例1的单层片剂的况下,即使压片速度增加,也表现出含量均匀性均匀。这是因为,当分成双层片剂时,每层的重量都很低,所以很难均匀地表现出每种有效成分的含量均匀性。
到目前为止,关于本发明,已经说明了优选实施例。本发明所属领域的普通技术人员将理解,在不脱离本发明的本质特征的情况下,可以以修改的形式实施本发明。因此,所公开的实施例被认为是说明性的而不是限制性的。本发明的范围以发明申请专利范围而非前述说明为准,凡在与其等同的范围内的不同之处,均应理解为包含在本发明之内。
- 含有氨氯地平、氯沙坦和氯噻酮的药物复合制剂
- 含有氨氯地平、氯沙坦和氯噻酮的药物复合制剂
