用于治疗患有类风湿性关节炎的受试者的非炎性疼痛的组合物和方法
文献发布时间:2023-06-19 18:32:25
相关申请的交叉引用
本申请要求美国临时专利申请序列号63/032,035(2020年5月29日提交)和63/077,378(2020年9月11日提交)以及EP临时专利申请序列号21315081.6(2021年5月11日提交)的优先权。这些申请中的每一个的全部公开内容特此通过引用以其整体并入本文。
技术领域
本公开文本涉及患有或已经患有类风湿性关节炎的受试者的非炎性疼痛的治疗性治疗领域。
背景技术
类风湿性关节炎(RA)是自身免疫性炎症性关节炎最普遍的形式,患病人数占该群体的约1%。它是自身免疫性疾病,其中,身体免疫系统攻击围绕关节的膜的衬里。RA引起慢性炎症,所述慢性炎症可造成关节疼痛、肿胀和僵硬。疼痛是RA患者的主要且令人困扰的症状,并且可能与炎症直接相关;然而,非炎性疼痛(NIP)在RA患者中也是普遍的。
萨瑞鲁单抗是用于治疗对一种或多种改善疾病抗风湿药物(DMARD)反应不充分或不耐受的中度至重度活动性RA成人的白细胞介素-6受体拮抗剂。
发明内容
本公开文本提供了用于治疗患有类风湿性关节炎的受试者的NIP的方法和组合物。在各种实施方案中,治疗所述受试者包括施用治疗有效量的特异性结合IL-6R的抗体。
在一方面,本公开文本提供了用于治疗患有类风湿性关节炎的有需要的受试者的非炎性疼痛(NIP)的方法,所述方法包括向所述受试者施用治疗有效剂量的特异性结合IL-6受体的抗体,其中,所述抗体包含含有互补决定区HCDR1、HCDR2和HCDR3的重链可变区以及含有互补决定区LCDR1、LCDR2和LCDR3的轻链可变区,其中:HCDR1包含SEQ ID NO:3的氨基酸序列;HCDR2包含SEQ ID NO:4的氨基酸序列;HCDR3包含SEQ ID NO:5的氨基酸序列;LCDR1包含SEQ ID NO:6的氨基酸序列;LCDR2包含SEQ ID NO:7的氨基酸序列;并且LCDR3包含SEQ ID NO:8的氨基酸序列。在各种实施方案中,所述特异性结合IL-6受体的抗体包含SEQ ID NO:1的重链可变区序列和SEQ ID NO:2的轻链可变区序列。在各种实施方案中,所述受试者的压痛关节计数(TJC)为至少21个。在各种实施方案中,所述压痛关节计数与肿胀关节计数相差至少5个。在各种实施方案中,将所述抗体皮下施用。在各种实施方案中,向所述受试者施用约150mg或约200mg的剂量的所述抗体。在各种实施方案中,将所述抗体每两周至少一次施用于所述受试者。在各种实施方案中,所述受试者患有中度至重度活动性类风湿性关节炎。在各种实施方案中,在施用所述抗体的历程中,所述受试者未被施用任何其他DMARD。在各种实施方案中,所述受试者还被施用一种或多种另外的DMARD连同所述抗体。在各种实施方案中,所述一种或多种另外的DMARD包括甲氨蝶呤。在各种实施方案中,所述一种或多种另外的DMARD包括TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。在各种实施方案中,先前通过施用不同于所述抗体的至少一种DMARD未有效治疗所述受试者的类风湿性关节炎。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。在各种实施方案中,所述受试者对一种或多种DMARD不耐受,或其中所述受试者被认为是不适合作为连续用一种或多种DMARD治疗的候选者。在各种实施方案中,所述受试者曾对一种或多种DMARD的反应不充分。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。
在另一方面,本公开文本提供了用于治疗有需要的受试者的NIP的方法,所述方法包括选择患有类风湿性关节炎和NIP的受试者;并且向所述受试者施用治疗有效剂量的特异性结合IL-6受体的抗体,其中,所述抗体包含含有互补决定区HCDR1、HCDR2和HCDR3的重链可变区以及含有互补决定区LCDR1、LCDR2和LCDR3的轻链可变区,其中:HCDR1包含SEQ IDNO:3的氨基酸序列;HCDR2包含SEQ ID NO:4的氨基酸序列;HCDR3包含SEQ ID NO:5的氨基酸序列;LCDR1包含SEQ ID NO:6的氨基酸序列;LCDR2包含SEQ ID NO:7的氨基酸序列;并且LCDR3包含SEQ ID NO:8的氨基酸序列。在各种实施方案中,所述特异性结合IL-6受体的抗体包含SEQ ID NO:1的重链可变区序列和SEQ ID NO:2的轻链可变区序列。在各种实施方案中,所述受试者的TJC为至少21个。在各种实施方案中,所述压痛关节计数与肿胀关节计数相差至少5个。在各种实施方案中,将所述抗体皮下施用。在各种实施方案中,向所述受试者施用约150mg或约200mg的剂量的所述抗体。在各种实施方案中,将所述抗体每两周至少一次施用于所述受试者。在各种实施方案中,所述受试者患有中度至重度活动性类风湿性关节炎。在各种实施方案中,在施用所述抗体的历程中,所述受试者未被施用任何其他DMARD。在各种实施方案中,所述受试者还被施用一种或多种另外的DMARD连同所述抗体。在各种实施方案中,所述一种或多种另外的DMARD包括甲氨蝶呤。在各种实施方案中,所述一种或多种另外的DMARD包括TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。在各种实施方案中,先前通过施用不同于所述抗体的至少一种DMARD未有效治疗所述受试者的类风湿性关节炎。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。在各种实施方案中,所述受试者对一种或多种DMARD不耐受,或其中所述受试者被认为是不适合作为连续用一种或多种DMARD治疗的候选者。在各种实施方案中,所述受试者曾对一种或多种DMARD的反应不充分。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。
在另一方面,本公开文本提供了用于治疗患有类风湿性关节炎的有需要的患者的NIP的抗体,其中所述抗体特异性结合IL-6受体,并且其中所述抗体包含含有互补决定区HCDR1、HCDR2和HCDR3的重链可变区以及含有互补决定区LCDR1、LCDR2和LCDR3的轻链可变区,其中:HCDR1包含SEQ ID NO:3的氨基酸序列;HCDR2包含SEQ ID NO:4的氨基酸序列;HCDR3包含SEQ ID NO:5的氨基酸序列;LCDR1包含SEQ ID NO:6的氨基酸序列;LCDR2包含SEQ ID NO:7的氨基酸序列;并且LCDR3包含SEQ ID NO:8的氨基酸序列。在各种实施方案中,所述特异性结合IL-6受体的抗体包含SEQ ID NO:1的重链可变区序列和SEQ ID NO:2的轻链可变区序列。在各种实施方案中,所述受试者的TJC为至少21个。在各种实施方案中,所述压痛关节计数与肿胀关节计数相差至少5个。在各种实施方案中,将所述抗体皮下施用。在各种实施方案中,向所述受试者施用约150mg或约200mg的剂量的所述抗体。在各种实施方案中,将所述抗体每两周至少一次施用于所述受试者。在各种实施方案中,所述受试者患有中度至重度活动性类风湿性关节炎。在各种实施方案中,在施用所述抗体的历程中,所述受试者未被施用任何其他DMARD。在各种实施方案中,所述受试者还被施用一种或多种另外的DMARD连同所述抗体。在各种实施方案中,所述一种或多种另外的DMARD包括甲氨蝶呤。在各种实施方案中,所述一种或多种另外的DMARD包括TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。在各种实施方案中,先前通过施用不同于所述抗体的至少一种DMARD未有效治疗所述受试者的类风湿性关节炎。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。在各种实施方案中,所述受试者对一种或多种DMARD不耐受,或其中所述受试者被认为是不适合作为连续用一种或多种DMARD治疗的候选者。在各种实施方案中,所述受试者曾对一种或多种DMARD的反应不充分。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF拮抗剂。在各种实施方案中,所述TNF拮抗剂选自依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。
附图说明
根据以下说明性实施方案的详细描述并结合附图,将更充分地理解本发明的前述和其他特征和优点。
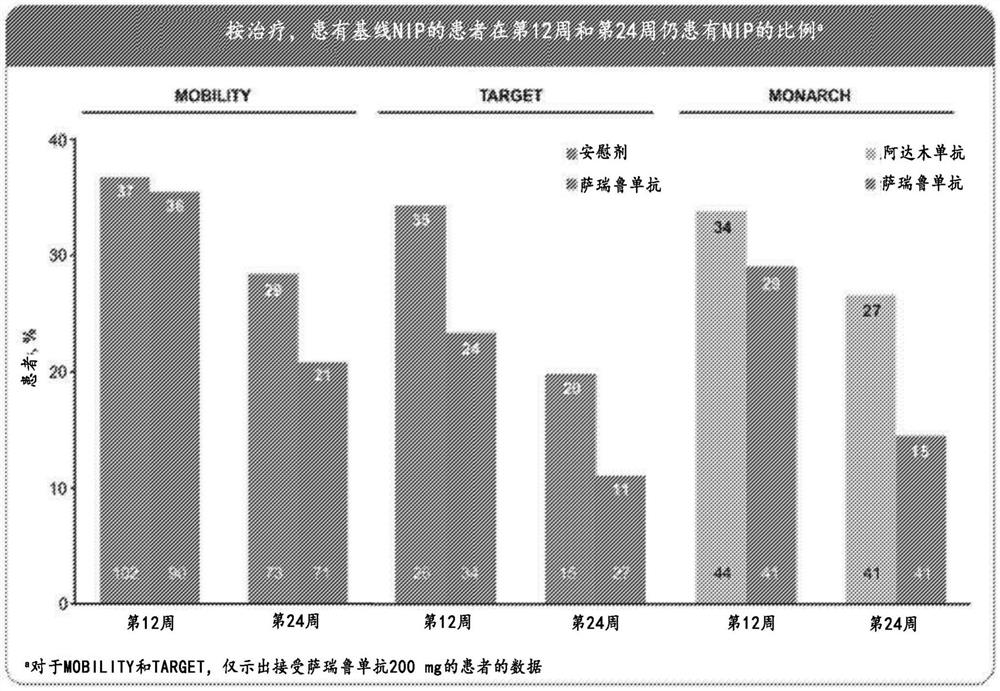
图1示出了按治疗,到第12周和第24周患有NIP的患者的百分比。
图2示出了萨瑞鲁单抗或阿达木单抗反应者在第24周的NIP状态。
具体实施方式
炎症是类风湿性关节炎(RA)中疼痛的关键驱动因素。然而,一些患者会感受比基于观察到的滑膜炎的量而预期的更多的疼痛,这可以表明非炎性疼痛(NIP)的存在。本公开文本提供了药物组合物和使用这些组合物治疗患有RA的受试者的NIP的方法。这些组合物和方法包括特异性结合白细胞介素-6受体(hIL-6R)的至少一种抗体。
如在本文的权利要求、发明内容和具体实施方式中所用,术语“约”在定量术语中是指它所修饰的值的加或减10%(如果所述值不可再分,如分子或核苷酸的数目,则上舍入到最接近的整数)。例如,短语“约100mg”将涵盖90mg至110mg,包含端值;短语“约2500mg”将涵盖2250mg至2750mg。当应用于百分比时,术语“约”是指相对于所述百分比的加或减10%。例如,短语“约20%”将涵盖18%-22%,并且“约80%”将涵盖72%-88%,包含端值。此外,在本文中结合定量术语使用“约”的情况下,应理解,除将值加或减10%以外,也涵盖和描述了定量术语的精确值。例如,术语“约23%”明确地考虑、描述并包括精确的23%。
应注意,术语“一个/一种(a)”或“一个/一种(an)”实体是指一个/一种或多个/多种所述实体;例如,“一种症状”应理解为代表一种或多种症状。因此,术语“一个/一种(a或an)”、“一个/一种或多个/多种(one or more)”以及“至少一个/一种(at least one)”在本文中可以互换使用。
此外,在本文中使用时将“和/或”视为对两个指定特征或组分中的每一个具有或不具有另一者的具体公开内容。因此,如在本文中以短语如“A和/或B”使用的术语“和/或”旨在包括“A和B”、“A或B”、“A”(单独)和“B”(单独)。同样地,在如“A、B和/或C”的短语中使用的术语“和/或”旨在涵盖以下方面中的每一个:A、B和C;A、B或C;A或C;A或B;B或C;A和C;A和B;B和C;A(单独);B(单独);以及C(单独)。
应理解,无论在本文中将多方面用语言“包含”来描述的情况如何,还提供以“由……组成”和/或“基本上由……组成”措辞描述的其他类似方面。
术语“疼痛”是指由包括疾患、损伤或精神痛苦在内的剧烈或损伤性刺激造成的不适。在一些实施方案中,疼痛具有身体和情感的组分并且会让人感受到从轻微、局部不适到剧痛的不愉快的感觉。
如本文所用,“急性疼痛”是指持续少于3个月的疼痛。在一些实施方案中,急性疼痛与软组织损伤有关,并且会随着损害愈合而渐渐消退。急性疼痛是由专门的神经感受器(伤害性感受器)检测到的,所述专门的神经感受器检测到并响应于向生物体传递危险信息的强烈信号,可能使得生物体可调动防御。在RA中,来自发炎关节内部的持续信号传导可引起伤害性感受器的刺激阙值降低,并产生对伤害性刺激的超敏感性(外周敏感化)。可能的是,如细胞因子的局部因素可对感觉神经元施加直接的非炎性影响。
术语“慢性疼痛”是指持续至少3个月的疼痛。在一些实施方案中,慢性疼痛被描述为长于预期治愈期限的疼痛。在一些实施方案中,慢性疼痛包括看起来缓解的RA患者的未预料到的延长的疼痛。慢性疼痛通常与中枢敏感化相关,并且可以是初级感觉神经元的外周敏感化和CNS中神经元的随后或附加敏感化引发的神经元活性异常的表现。在此状态下,与先前或现在的炎症关系很小或无关。
如上文所述,术语“非炎性疼痛”或“NIP”是指与炎症无关的疼痛。在一些情况下,NIP可由于关节痛或多关节痛造成。NIP通常呈现为不存在如发烧或体重减轻等全身症状。NIP还可呈现为无肿胀或温暖。NIP还表征为间歇性的持续少于60分钟的轻微晨僵,和/或活动不会改善而会加剧的僵硬。在一些实施方案中,NIP包括急性或慢性疼痛。在一些实施方案中,NIP包括痛觉超敏、增强的疼痛和神经性疼痛。在一些实施方案中,患有NIP的受试者还会经历中枢敏感化。在一些实施方案中,患有NIP的受试者处于RA的早期阶段。在一些实施方案中,这些受试者尚未被诊断为患有RA并且未示出炎症症状。在一些实施方案中,患有NIP的受试者患有关节外疼痛或弥漫性疼痛。
如本文所用,“中枢敏感化”是指脊髓和脑疼痛处理异常,其引起弥漫性位点的疼痛敏感度增加并且引起整个中枢神经系统(CNS)响应于感觉冲动的总体响应状态提高,这在脑中通过复杂的过滤器解读为增强的疼痛。此类别可包括与对慢性疼痛状态的痛觉的心理社会相互作用。在中枢敏感化中,创造了新的伤害性路径,例如通过募集机械感受器传导疼痛。这主要通过在脊髓中产生增加的敏感化而发生,并且,在时间上,这一状态甚至在不存在损伤时也能自身永久存在并且与任何保护目的无关。
因此,在一些实施方案中,在患有由RA造成的潜在炎性疼痛的患者中可能仅内在地造成轻微的疼痛。如本文所用,“痛觉过敏”或“增强的疼痛”是指相对轻微的疼痛夸大并且感受为更剧烈的疼痛。在此状态下的痛感还可产生于如移动(例如握拳)等通常无痛苦的刺激,这些刺激正常情况下被解读为信息输入。如本文所用,“痛觉超敏”是指由通常无痛苦的刺激引起的疼痛。临床观察表明,一些早期RA病例中疼痛与炎症之间没有关联,例如,在关节炎症的任何客观证据之前可发生双侧对称性小关节痛。相反,一些RA患者可能仅呈现关节炎症(和关节损害),却无疼痛(“稳固类风湿性”型)。在一些实施方案中,存在RA呈现谱,表型范围为从患有伴随疼痛的主要可鉴别的滑膜炎的患者到仅呈现疼痛的患者。已尝试例如通过使用肿胀关节计数与压痛关节计数的比率鉴别后一种在疾病进程早期患有非炎性疼痛的RA患者。
已报告患者自报告的疼痛与炎症客观评价之间的不一致,并且在多个研究中患者报告的疼痛显现与医师对炎症的评估和测量的相关性差。疼痛不仅仅源自炎症的观点还由如下观察结果支持,即在炎症减轻前抗细胞因子治疗很好地缓解了疼痛,并且在对RA的炎症组分治疗后在得到缓解的患者中12%-50%的一些患者仍有余痛,并且疾病得到“稍微至完全控制”的患者中有82%仍有余痛。风湿病学家通常将此余痛归因于纤维肌痛或RA引发的潜在关节损害,但是鉴于射线摄影的损害已示出仅占患者报告疼痛的2.1%,后一种解释看起来不可能。满足纤维肌痛分类鉴定标准的RA患者的比例还在整个疾病进展历程中增加,这再次表明中枢疼痛加强。
RA是累及关节的疾病,但是,在一些实施方案中,疼痛通常报告为关节外的疼痛,并且可能是弥漫性的(在远的非关节部位以及在关节中广泛分布疼痛),并且位置和时间可能不同。这种疼痛显现与滑膜炎无关并且可能是由于中枢疼痛处理的改变引起的。有观察力的临床医师有时会发现线索,这些线索提示,例如当痛感报告为刺痛、灼痛或锐痛时,RA患者的疼痛的方面可源自神经系统受累。CNS受累越来越变得清晰;大部分RA患者具有某种形式的可鉴别的神经性受累。自主神经病也越来越多地被鉴别为与RA相关。因此,在一些实施方案中,CNS是RA中显著相关的器官系统。
许多临床上在疼痛与炎症之间的清楚不相关表明某些RA疼痛可能是与炎症重叠的独立问题而不仅仅归因于炎症,其中涉及多重机制。在一些实施方案中,RA患者的疼痛起因于某种形式的炎症或损伤,但此外RA患者还感觉到还并行和独立触发(无或少量感觉刺激)、通过外周神经系统传递、在脊髓中放大并在CNS中感受到的疼痛。在脑中,来自更远侧的感觉与外部心理社会因素相互交织。实际上,疼痛一直被描述为“一种观点”。在各种实施方案中,这种疼痛是与炎症疼痛不同的实体,并且这种形式的疼痛至少部分是由于与细胞因子调节异常相关的异常所致。
在一些实施方案中,细胞因子造成关节炎症(进而造成疼痛),但是存在细胞因子对神经系统的外周以及其他部分的更直接引发疼痛的其他作用,并且不一定与炎症相关。
在一些实施方案中,细胞因子IL-6在此发挥着重要的作用。
在一些实施方案中,NIP被定义为使用确立的公式:TJC–SJC≥7得到的28-关节压痛关节计数(TJC)与肿胀关节计数(SJC)之间的差。
在一些实施方案中,测量了前一周感受到的疼痛。在一些实施方案中,测量了在前2、3、4、5、6、7、8或更多周感受到的疼痛。在一些实施方案中,测量了在前一个月感受到的疼痛。在一些实施方案中,测量了在前2、3、4、5、6、7、8、9、10、11、12或更多个月感受到的疼痛。在一些实施方案中,测量了前一年感受到的疼痛。在一些实施方案中,测量了在前2、3、4、5、6、7、8、9、10或更多年中感受到的疼痛。
IL-6与IL-6Rα亚基直接相互作用,并且IL-6/IL-6Rα对与糖蛋白130(gp130)亚基形成高亲和力复合物并且通过Janus激酶(JAK)-信号转导及转录激活蛋白(STAT)(JAK/STAT)以及Ras-Raf-丝裂原激活的蛋白激酶(MAPK)路径启动细胞内信号传导。IL-6Rα也以可溶性形式存在,其参与反式信号传导,并使IL-6影响不表达IL-6Rα的细胞,包括关节滑膜细胞。
萨瑞鲁单抗(SAR153191),也称为REGN88,是一种针对IL-6受体复合物α亚基(IL-6Rα)的全人序列的重组IgG1κ单克隆抗体。萨瑞鲁单抗阻断IL-6的结合并中断细胞因子介导的信号传导级联。
抗体
本公开文本包括如下方法,所述方法包括向受试者施用特异性结合hIL-6R的抗体或其抗原结合片段。如本文所用,术语“hIL-6R”意指特异性结合人白细胞介素-6(IL-6)的人细胞因子受体。在某些实施方案中,向患者施用的抗体特异性结合hIL-6R的细胞外结构域。
如本文所用,术语“抗体”是指包含通过二硫键相互连接的四条多肽链即两条重(H)链和两条轻(L)链的免疫球蛋白分子,以及其多聚体(例如,IgM)。每条重链包含重链可变区(本文缩写为HCVR或VH)和重链恒定区。所述重链恒定区包含三个结构域,CH1、CH2和CH3。每条轻链包含轻链可变区(本文缩写为LCVR或VL)和轻链恒定区。所述轻链恒定区包含一个结构域(CL1)。VH和VL区可以进一步细分为具有高变性的区域,称为互补决定区(CDR),其间穿插有更保守的区域,称为框架区(FR)。每个VH和VL由三个CDR和四个FR构成,按照以下顺序从氨基末端到羧基末端排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。在一些实施方案中,抗体(或其抗原结合部分)的FR可以与人种系序列相同,或者可以是天然的或人工修饰的。可以基于两个或更多个CDR的并排分析来定义氨基酸共有序列。
如本文所用,术语“抗体”还包括完整抗体分子的抗原结合片段。如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包括任何天然存在的、可酶促获得的、合成的或基因工程化的多肽或糖蛋白,其特异性结合抗原以形成复合物。抗体的抗原结合片段可以使用任何合适的标准技术,如蛋白水解消化或涉及操纵和表达编码抗体可变结构域和任选恒定结构域的DNA的重组基因工程技术,例如从完整抗体分子衍生。这种DNA是已知的和/或容易从例如商业来源、DNA文库(包括例如噬菌体-抗体文库)获得,或可以合成。DNA可以按化学方式或通过使用分子生物学技术进行测序和操纵,例如,以将一个或多个可变结构域和/或恒定结构域排列成合适的构型,或引入密码子,产生半胱氨酸残基,修饰、添加氨基酸或使之缺失等。
抗原结合片段的非限制性例子包括:(i)Fab片段;(ii)F(ab')2片段;(iii)Fd片段;(iv)Fv片段;(v)单链Fv(scFv)分子;(vi)dAb片段;和(vii)由模拟抗体高变区的氨基酸残基组成的最小识别单位(例如,分离的互补决定区(CDR),如CDR3肽),或受限FR3-CDR3-FR4肽。其他工程化分子,如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、CDR移植的抗体、双抗体、三抗体、四抗体、微型抗体、纳米抗体(例如单价纳米抗体和二价纳米抗体)、小的模块化免疫药物(SMIP)和鲨鱼可变IgNAR结构域也涵盖在如本文所用的表述“抗原结合片段”内。
抗体的抗原结合片段通常将包含至少一个可变结构域。可变结构域可以具有任何大小或氨基酸组成,并且通常包含至少一个与一个或多个框架序列相邻或同在框内的CDR。在其中VH结构域与VL结构域相缔合的抗原结合片段中,VH结构域和VL结构域可以按任何适合的排列相对彼此定位。例如,可变区可以是二聚体并含有VH-VH、VH-VL或VL-VL二聚体。可替代地,抗体的抗原结合片段可以含有单体VH或VL结构域。
在某些实施方案中,抗体的抗原结合片段可以含有与至少一个恒定结构域共价连接的至少一个可变结构域。可以在抗体的抗原结合片段内发现的可变结构域和恒定结构域的非限制性示例性构型包括:(i)VH-CH1;(ii)VH-CH2;(iii)VH-CH3;(iv)VH-CH1-CH2;(v)VH-CH1-CH2-CH3;(vi)VH-CH2-CH3;(vii)VH-CL;(viii)VL-CH1;(ix)VL-CH2;(x)VL-CH3;(xi)VL-CH1-CH2;(xii)VL-CH1-CH2-CH3;(xiii)VL-CH2-CH3;和(xiv)VL-CL。在可变结构域和恒定结构域的任何构型中,包括上文列出的任何示例性构型,可变结构域和恒定结构域可以彼此直接连接或可以通过完整或部分铰链或接头区连接。在各种实施方案中,铰链区可以由至少2个(例如,5、10、15、20、40、60或更多个)氨基酸组成,其导致单个多肽分子中相邻可变结构域和/或恒定结构域之间的柔性或半柔性连接。此外,在各种实施方案中,抗体的抗原结合片段可以包含上文列出的任何可变结构域和恒定结构域构型的同型二聚体或异型二聚体(或其他多聚体),彼此非共价缔合和/或与一个或多个单体VH或VL结构域非共价缔合(例如,通过一个或多个二硫键)。
在某些实施方案中,用于本文公开的方法中的抗体或抗体片段可以是单特异性抗体。在某些实施方案中,用于本文公开的方法中的抗体或抗体片段可以是多特异性抗体,其可以对一种靶多肽的不同表位具有特异性,或者可以含有对多于一种靶多肽的表位具有特异性的抗原结合结构域。可以用于某些实施方案情形中的示例性双特异性抗体形式涉及使用第一免疫球蛋白(Ig)CH3结构域和第二Ig CH3结构域,其中所述第一Ig CH3结构域和所述第二Ig CH3结构域彼此相差至少一个氨基酸,并且其中与缺乏所述氨基酸差异的双特异性抗体相比,至少一个氨基酸差异降低了所述双特异性抗体与蛋白A的结合。在一个实施方案中,所述第一Ig CH3结构域结合蛋白A并且所述第二Ig CH3结构域含有减少或消除蛋白A结合的突变,如H95R修饰(根据IMGT外显子编号;根据EU编号为H435R)。所述第二CH3还可以包含Y96F修饰(根据IMGT;根据EU为Y436F)。在IgG1抗体的情况下,可以在所述第二CH3中发现的其他修饰包括:D16E、L18M、N44S、K52N、V57M和V82I(根据IMGT;根据EU为D356E、L358M、N384S、K392N、V397M和V422I);在IgG2抗体的情况下,则为N44S、K52N和V82I(根据IMGT;根据EU为N384S、K392N和V422I);并且在IgG4抗体的情况下,则为Q15R、N44S、K52N、V57M、R69K、E79Q和V82I(根据IMGT;根据EU为Q355R、N384S、K392N、V397M、R409K、E419Q和V422I)。在某些实施方案的范围内考虑了上述双特异性抗体形式的变化。在各种实施方案中,任何多特异性抗体形式,包括本文公开的示例性双特异性抗体形式,可以使用本领域中可利用的常规技术来改编,使其适用于抗IL-6R抗体的抗原结合片段情形。
如与对应种系序列相比,本文公开的全人抗IL-6R抗体可以包含重链和轻链可变结构域的框架和/或CDR区中的一个或多个氨基酸取代、插入和/或缺失。通过将本文公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列相比较,可以容易地确定此类突变。本公开文本包括源自本文公开的任何氨基酸序列的抗体及其抗原结合片段,其中一个或多个框架和/或CDR区内的一个或多个氨基酸回复突变至一个或多个对应种系残基或者一个或多个对应种系残基的保守氨基酸取代(天然或非天然)(此类序列变化在本文中称为“种系回复突变”)。本领域普通技术人员可以容易地从本文公开的重链和轻链可变区序列开始产生包括一个或多个单独种系回复突变或其组合的许多抗体和抗原结合片段。在某些实施方案中,VH和/或VL结构域内的所有框架残基和/或CDR残基回复突变到种系序列。在其他实施方案中,仅将某些残基回复突变到种系序列,例如,仅在FR1的前8个氨基酸内或在FR4的最后8个氨基酸内发现的突变残基,或仅在CDR1、CDR2或CDR3中发现的突变残基。此外,本文包括如下抗体,所述抗体可以含有框架和/或CDR区内的两个或更多个种系回复突变的任何组合,即,其中某些单独残基回复突变到种系序列,同时保留不同于种系序列的某些其他残基。一旦获得,则可以容易地测试含有一个或多个种系回复突变的抗体和抗原结合片段的一种或多种所希望特性,如改善的结合特异性、增加的结合亲和力、改进或增强的拮抗或激动生物学特性(视情况而定)、降低的免疫原性等。以这种一般方式获得的抗体和抗原结合片段涵盖在本公开文本内。
抗体的恒定区在抗体结合补体和介导细胞依赖性细胞毒性的能力中是重要的。因此,可以基于其是否是抗体介导细胞毒性所需的来选择抗体的同种型。
如本文所用,术语“人抗体”旨在包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。尽管如此,在各种实施方案中,本公开文本中表征的人抗体(例如在CDR中,并且在一些实施方案中是在CDR3中)可以包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。然而,如本文所用,术语“人抗体”不旨在包括其中衍生自另一种哺乳动物物种(如小鼠)的种系的CDR序列已经被移植到人框架序列上的抗体。
如本文所用,术语“重组人抗体”旨在包括通过重组方式制备、表达、产生或分离的所有人抗体,如使用转染到宿主细胞中的重组表达载体表达的抗体(下文进一步描述),从重组的组合人抗体文库分离的抗体(下文进一步描述),从对于人免疫球蛋白基因为转基因的动物(例如,小鼠)分离的抗体或通过涉及将人免疫球蛋白基因序列剪接到其他DNA序列的任何其他方式制备、表达、产生或分离的抗体。此类重组人抗体具有源自人种系免疫球蛋白序列的可变区和恒定区。然而,在某些实施方案中,对此类重组人抗体进行体外诱变(或者,当使用针对人Ig序列转基因的动物时,进行体内体细胞诱变),从而尽管重组抗体的VH和VL区的氨基酸序列源自人种系VH和VL序列且与其相关,但是重组抗体的VH和VL区的氨基酸序列为可能不是天然存在于体内人抗体种系库内的序列。
人抗体可以以两种与铰链异质性相关的形式存在。在一个实施方案中,免疫球蛋白分子包含大约150-160kDa的稳定四链构建体,其中二聚体通过链间重链二硫键保持在一起。在另一个实施方案中,二聚体不经由链间二硫键连接,并且形成约75-80kDa的分子,其由共价偶联的轻链和重链(半抗体)构成。在某些实施方案中,这些形式极难以分离,即使在亲和纯化后也是如此。
在各完整IgG同种型中第二种形式出现的频率是归因于但不限于与抗体的铰链区同种型相关的结构差异。人IgG4铰链的铰链区中的单个氨基酸取代可以将第二种形式的出现率显著降低至典型地使用人IgG1铰链观察到的水平。在各种实施方案中,本公开文本涵盖在铰链区、CH2区或CH3区中具有一个或多个突变的抗体,所述突变例如在制造上可能是期望的,以改善所期望抗体形式的产率。
如本文所用,“分离的抗体”意指已被鉴定并从它的天然环境的至少一种组分分离和/或回收的抗体。例如,已从生物体的至少一种组分或从其中天然存在或天然产生抗体的组织或细胞中分离或除去的抗体是“分离的抗体”。在各种实施方案中,分离的抗体还包括重组细胞内的原位抗体。在其他实施方案中,分离的抗体是已经受至少一个纯化或分离步骤的抗体。在各种实施方案中,分离的抗体可以基本上不含其他细胞材料和/或化学品。
术语“特异性结合”等意指抗体或其抗原结合片段与抗原形成在生理条件下相对稳定的复合物。用于确定抗体是否特异性结合抗原的方法是本领域熟知的,并且包括例如平衡透析、表面等离子体共振等。例如,如本文所用,“特异性结合”IL-6R的抗体包括以如下KD(如在表面等离子体共振测定中所测量)结合IL-6R(例如,人IL-6R)的抗体或其部分:小于约1000nM、小于约500nM、小于约300nM、小于约200nM、小于约100nM、小于约90nM、小于约80nM、小于约70nM、小于约60nM、小于约50nM、小于约40nM、小于约30nM、小于约20nM、小于约10nM、小于约5nM、小于约4nM、小于约3nM、小于约2nM、小于约1nM或约0.5nM。在一些实施方案中,所述抗体以约0.1nM至约1000nM或约1nM至约100nM的KD结合IL-6R(例如,人IL-6Rα)。在一些实施方案中,所述抗体以约1pM至约100pM或约40pM至约60pM的KD结合IL-6R(例如,人IL-6Rα)。特异性结合还可以表征为解离常数为至少约1x10
如本文所用,术语“表面等离子体共振”是指一种光学现象,它允许通过例如使用
如本文所用,术语“KD”旨在是指抗体-抗原相互作用的平衡解离常数。
术语“表位”是指与抗体分子的可变区中称为互补位的特异性抗原结合位点相互作用的抗原决定簇。单一抗原可以具有多于一个表位。因此,不同的抗体可以与抗原上的不同区域结合,并且可以具有不同的生物效应。表位可以是构象的或线性的。通过来自线性多肽链的不同区段的空间并列氨基酸产生构象表位。线性表位是由多肽链中相邻的氨基酸残基产生的表位。在某些情况下,表位可包括抗原上的糖、磷酰基或磺酰基的部分。
在各种实施方案中,与衍生所述抗体的对应种系序列相比,可用于本文所述方法的抗IL-6R抗体可以在重链和轻链可变结构域的框架和/或CDR区中包含一个或多个氨基酸取代、插入和/或缺失。通过将本文公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列相比较,可以容易地确定此类突变。在各种实施方案中,本公开文本包括涉及使用抗体及其抗原结合片段的方法,所述抗体及其抗原结合片段源自本文公开的任何氨基酸序列,其中一个或多个框架和/或CDR区内的一个或多个氨基酸突变为衍生所述抗体的种系序列的一个或多个对应残基,或另一个人种系序列的一个或多个对应残基,或所述一个或多个对应种系残基的保守氨基酸取代(此类序列变化在本文中统称为“种系突变”)。可以构建许多抗体和抗原结合片段,其包含一个或多个单独种系突变或其组合。在某些实施方案中,VH和/或VL结构域内的所有框架残基和/或CDR残基回复突变到衍生所述抗体的原始种系序列中发现的残基。在其他实施方案中,仅将某些残基回复突变到原始种系序列,例如,仅在FR1的前8个氨基酸内或在FR4的最后8个氨基酸内发现的突变残基,或仅在CDR1、CDR2或CDR3中发现的突变残基。在其他实施方案中,一个或多个框架和/或CDR残基中的一个或多个突变成不同种系序列(即与最初衍生所述抗体的种系序列不同的种系序列)的一个或多个对应残基。此外,抗体可以含有所述框架和/或CDR区内的两个或更多个种系突变的任何组合,例如,其中某些单独残基突变为某一种系序列的对应残基,同时保留不同于原始种系序列的某些其他残基或使之突变为不同种系序列的对应残基。一旦获得,则可以容易地测试含有一个或多个种系突变的抗体和抗原结合片段的一种或多种所需特性,如改善的结合特异性、增加的结合亲和力、改善或增强的拮抗或激动生物学特性(视情况而定)、降低的免疫原性等。本公开文本涵盖使用以这种通用方式获得的抗体和抗原结合片段。
本公开文本还包括涉及使用抗IL-6R抗体的方法,所述抗IL-6R抗体包含具有一个或多个保守取代的本文公开的任何HCVR、LCVR和/或CDR氨基酸序列的变体。例如,本公开文本包括使用具有HCVR、LCVR和/或CDR氨基酸序列的抗IL-6R抗体,其具有例如相对于本文公开的任何HCVR、LCVR和/或CDR氨基酸序列的10个或更少、8个或更少、6个或更少、4个或更少等保守氨基酸取代。
根据本公开文本,在各种实施方案中,抗IL-6R抗体或其抗原结合片段包含重链可变区(HCVR)、轻链可变区(LCVR)和/或互补决定区(CDR),所述HCVR、LCVR和/或CDR包含美国专利号7,582,298(将其通过引用以其整体并入本文)中所述的抗IL-6R抗体的任何氨基酸序列。在某些实施方案中,抗IL-6R抗体或其抗原结合片段包含含有SEQ ID NO:1的氨基酸序列的HCVR的重链互补决定区(HCDR)和含有SEQ ID NO:2的氨基酸序列的LCVR的轻链互补决定区(LCDR)。根据某些实施方案,抗IL-6R抗体或其抗原结合片段包含三个HCDR(即HCDR1、HCDR2和HCDR3)和三个LCDR(即LCDR1、LCDR2和LCDR3),其中HCDR1包含SEQ ID NO:3的氨基酸序列;HCDR2包含SEQ ID NO:4的氨基酸序列;HCDR3包含SEQ ID NO:5的氨基酸序列;LCDR1包含SEQ ID NO:6的氨基酸序列;LCDR2包含SEQ ID NO:7的氨基酸序列;并且LCDR3包含SEQ ID NO:8的氨基酸序列。在又其他实施方案中,抗IL-6R抗体或其抗原结合片段包含含有SEQ ID NO:1的氨基酸序列的HCVR和含有SEQ ID NO:2的氨基酸序列的LCVR。
在另一个实施方案中,抗IL-6R抗体或其抗原结合片段包含含有SEQ ID NO:9的氨基酸序列的重链和含有SEQ ID NO:10的氨基酸序列的轻链。在一些实施方案中,hIL-6R的细胞外结构域包含SEQ ID NO:11的氨基酸序列。根据某些示例性实施方案,本公开文本的方法包括使用本领域中称作和已知为萨瑞鲁单抗的抗IL-6R抗体或其生物等效物。
SEQ ID NO:1的氨基酸序列是
EVQLVESGGGLVQPGRSLRLSCAASRFTFDDYAMHWVRQAPGKGLEWVSGISWNSGRIGYADSVKGRFTISRDNAENSLFLQMNGLRAEDTALYYCAKGRDSFDIWGQGTMVTVSS。
SEQ ID NO:2的氨基酸序列是
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYGASSLESGVPSRFSGSGSGTDFTLTISSLQPEDFASYYCQQANSFPYTFGQGTKLEIK。
SEQ ID NO:3的氨基酸序列是RFTFDDYA。
SEQ ID NO:4的氨基酸序列是ISWNSGRI。
SEQ ID NO:5的氨基酸序列是AKGRDSFDI。
SEQ ID NO:6的氨基酸序列是QGISSW。
SEQ ID NO:7的氨基酸序列是GAS。
SEQ ID NO:8的氨基酸序列是QQANSFPYT。
SEQ ID NO:9的氨基酸序列是
EVQLVESGGGLVQPGRSLRLSCAAS
SEQ ID NO:10的氨基酸序列是
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYGASSLESGVPSRFSGSGSGTDFTLTISSLQPEDFASYYCQQANSFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC。
SEQ ID NO:11的序列是
MVAVGCALLAALLAAPGAALAPRRCPAQEVARGVLTSLPGDSVTLTCPGVEPEDNATVHWVLRKPAAGSHPSRWAGMGRRLLLRSVQLHDSGNYSCYRAGRPAGTVHLLVDVPPEEPQLSCFRKSPLSNVVCEWGPRSTPSLTTKAVLLVRKFQNSPAEDFQEPCQYSQESQKFSCQLAVPEGDSSFYIVSMCVASSVGSKFSKTQTFQGCGILQPDPPANITVTAVARNPRWLSVTWQDPHSWNSSFYRLRFELRYRAERSKTFTTWMVKDLQHHCVIHDAWSGLRHVVQLRAQEEFGQGEWSEWSPEAMGTPWTESRSPPAENEVSTPMQALTTNKDDDNILFRDSANATSLPVQD。
如本文所用,术语“生物等效物”是指在相同摩尔剂量和相似条件下(例如,相同的施用途径)施用后具有相似生物利用度(利用度的速率和程度),使得可以预期在功效和安全性两个方面的效果与对比分子本质上相同的分子。如果包含抗IL-6R抗体的两种药物组合物在药学上等效,则它们是生物等效的,这意味着它们含有相同量的活性成分(例如IL-6R抗体),以相同的剂型,用于相同的施用途径,并满足相同或可比的标准。生物等效性可以例如通过比较两种组合物的药代动力学参数的体内研究来确定。生物等效性研究中常用的参数包括峰值血浆浓度(Cmax)和血浆药物浓度时间曲线下面积(AUC)。
在某些实施方案中,本公开文本涉及包括向受试者施用抗体的方法,所述抗体包含含有序列SEQ ID NO:1的重链可变区和含有序列SEQ ID NO:2的轻链可变区。
本公开文本提供了包含这种抗体的药物组合物,以及使用这些组合物的方法。
在各种实施方案中的抗体包含含有序列SEQ ID NO:1的重链可变区和含有序列SEQ ID NO:2的轻链可变区,是特异性结合人白细胞介素-6受体(hIL-6R)的抗体。参见国际公开号WO2007/143168,将其通过引用以其整体并入本文。在一个实施方案中,所述抗体包含含有序列SEQ ID NO:9的重链可变区和含有序列SEQ ID NO:10的轻链可变区。在各种实施方案中,所述抗体是萨瑞鲁单抗。
DMARD
改善疾病抗风湿药物(DMARD)是定义为用于类风湿性关节炎以减缓疾病进展的药物。DMARD已被分为合成(sDMARD)和生物(bDMARD)的两类。合成DMARD非详尽地包括甲氨蝶呤、柳氮磺胺吡啶、来氟米特和羟氯喹。生物DMARD非详尽地包括阿达木单抗、戈利木单抗、依那西普、阿巴西普、英夫利昔单抗、利妥昔单抗、和托珠单抗。在一些实施方案中,所述DMARD是TNF拮抗剂。TNF拮抗剂包括但不限于依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和培赛利珠单抗。
施用方法和配制品
本文所述的方法包括向受试者施用治疗有效量的抗IL-6R抗体。如本文所用,“有效量”或“治疗有效量”是治疗剂的导致治疗NIP的剂量。在某些实施方案中,有效量是治疗剂的导致对炎症控制后(IC)仍存在的NIP的治疗的剂量。如本文所用,“治疗”是指引起与NIP相关的一种或多种症状的可检测的改善,或引起与产生病症或者一种或多种症状的一种或多种潜在病理机制相关的生物效应(例如,特定生物标记物水平的降低)。例如,抗IL-6R抗体的引起NIP减轻的剂量被视为“治疗有效量”。
在各种实施方案中,NIP相关症状的“改善”是指疼痛症状发生率的降低,这可能与一种或多种疼痛相关测试、得分或度量(如本文所述)的改善相关。例如,所述改善可能与一种或多种疼痛标准自基线的降低相关。在各种实施方案中,改善可包括VAS自基线的降低。如本文所用,术语“基线”,关于疼痛相关参数,意指在施用本发明技术的抗体之前或之时患者的疼痛相关参数的数值。还可以使用本文所述的至少一种测试、得分或度量来检测可检测的“改善”。在各种实施方案中,所述改善是使用VAS检测的。在各种实施方案中,所述改善的特征在于其与受试者的PASS状态有关。
在各种实施方案中,先前使用DMARD而不是抗IL-6R抗体(如萨瑞鲁单抗)治疗曾是不充分的(例如由受试者和/或医师评估)、曾是无效的和/或并未导致与NIP相关的一种或多种参数或症状的可检测的改善和/或并未引起与产生NIP的病症或者一种或多种症状的一种或多种潜在病理机制相关的生物效应。
在各种实施方案中,将IL-6R抗体皮下施用。在各种实施方案中,所述IL-6R抗体是萨瑞鲁单抗。
在各种实施方案中,向受试者施用的抗IL-6R抗体的治疗有效量将根据受试者的年龄和大小(例如体重或体表面积)以及施用途径和本领域普通技术人员熟知的其他因素而变化。
在各种实施方案中,所述剂量是与所述受试者的体重或表面积无关的固定剂量。在各种实施方案中,所述受试者为至少18岁。在各种实施方案中,所述受试者为30岁至100岁。在各种实施方案中,所述受试者为35岁至100岁。在各种实施方案中,所述受试者为35岁至8岁。在各种实施方案中,所述受试者为40岁至70岁。
本公开文本提供了使用治疗组合物的方法,所述治疗组合物包含抗IL-6R抗体或其抗原结合片段,以及任选的一种或多种另外的治疗剂。本公开文本的治疗组合物将与合适的载体、赋形剂和/或掺入配制品中以提供改进的传递、递送、耐受性等的其他药剂一起施用。在所有药物化学家都已知的处方集中可以找到许多适当的配制品:Remington’sPharmaceutical Sciences,Mack Publishing Company,Easton,PA。这些配制品包括例如粉末、糊剂、软膏、胶状物、蜡、油、脂质、含有脂质(阳离子或阴离子)的囊泡(如
各种递送系统是已知的并且可用于施用本文提供的药物组合物,例如,包裹在脂质体中、微粒、微胶囊、受体介导的胞吞作用。引入的方法包括但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。可以将组合物通过任何便利的途径施用,例如通过输注或团注,通过上皮或粘膜皮肤内层(例如,口腔粘膜、直肠和肠粘膜等)吸收,并且可以与其他生物活性剂一起施用。施用可以是全身性或局部的。可以将IL-6R抗体皮下施用。
所述药物组合物还可在囊泡如脂质体中递送。在某些实施方案中,可以将药物组合物在控制释放系统中递送,例如,使用泵或聚合物材料。在某些实施方案中,控制释放系统可以被放置成接近组合物的靶标,因此只需要全身剂量的一部分。
可注射制剂可以包括用于静脉内、皮下、皮内和肌肉内注射、局部注射、点滴输注等的剂型。这些可注射制剂可以通过公共已知的方法来制备。例如,可以通过例如将上述抗体或其盐溶解、悬浮或乳化在常规用于注射的无菌水性介质或油性介质中来制备可注射制剂。作为用于注射的水性介质,例如有生理盐水、含葡萄糖的等渗溶液和其他辅助剂等,其可以与以下组合使用:适当的增溶剂,如醇(例如乙醇);多元醇(例如丙二醇、聚乙二醇);非离子表面活性剂[例如,聚山梨醇酯80、HCO-50(氢化蓖麻油的聚氧乙烯(50mol)加合物)]等。作为油性介质,采用例如芝麻油、大豆油等,其可以与如苯甲酸苄酯、苄醇等增溶剂组合使用。可以将由此所制备的注射剂填充在适当的安瓿中。
所述抗体通常是如本文和国际公开号WO 2011/085158(将其通过引用以其整体并入本文)中所述进行配制的。
在各种实施方案中,所述抗体被作为约pH 6.0的水性缓冲溶液施用,其含有
-约21mM组氨酸,
-约45mM精氨酸,
-约0.2%(w/v)聚山梨醇酯20,
-约5%(w/v)蔗糖,以及
-约100mg/mL与约200mg/mL之间的所述抗体。
在另一个实施方案中,所述抗体被作为约pH 6.0的水性缓冲溶液施用,其含有
-约21mM组氨酸,
-约45mM精氨酸,
-约0.2%(w/v)聚山梨醇酯20,
-约5%(w/v)蔗糖,以及
-至少约130mg/mL的所述抗体。
在另一个实施方案中,所述抗体被作为约pH 6.0的水性缓冲溶液施用,其含有-约21mM组氨酸,
-约45mM精氨酸,
-约0.2%(w/v)聚山梨醇酯20,
-约5%(w/v)蔗糖,以及
-约131.6mg/mL的所述抗体。
在另一个实施方案中,所述抗体被作为约pH 6.0的水性缓冲溶液施用,其含有
-约21mM组氨酸,
-约45mM精氨酸,
-约0.2%(w/v)聚山梨醇酯20,
-约5%(w/v)蔗糖;以及
-约175mg/mL的所述抗体。
在其他实施方案中,所述抗体被作为pH 6.0的水性缓冲溶液施用,其含有
-21mM组氨酸,
-45mM精氨酸,
-0.2%(w/v)聚山梨醇酯20,
-5%(w/v)蔗糖,以及
-100mg/mL与200mg/mL之间的所述抗体。
在另一个实施方案中,所述抗体被作为pH 6.0的水性缓冲溶液施用,其含有
-21mM组氨酸,
-45mM精氨酸,
-0.2%(w/v)聚山梨醇酯20,
-5%(w/v)蔗糖,以及
-至少130mg/mL的所述抗体。
在另一个实施方案中,所述抗体被作为pH 6.0的水性缓冲溶液施用,其含有
-21mM组氨酸,
-45mM精氨酸,
-0.2%(w/v)聚山梨醇酯20,
-5%(w/v)蔗糖,以及
-131.6mg/mL的所述抗体。
在另一个实施方案中,所述抗体被作为pH 6.0的水性缓冲溶液施用,其含有
-21mM组氨酸,
-45mM精氨酸,
-0.2%(w/v)聚山梨醇酯20,
-5%(w/v)蔗糖;以及
-175mg/mL的所述抗体。
在各种实施方案中,所述抗体在稳定的药物配制品中施用,所述药物配制品包含:(i)25mM至100mM浓度的组氨酸;(ii)25mM至50mM浓度的精氨酸;(iii)3%至10%w/v的量的蔗糖;以及(iv)0.1%至0.2%的量的聚山梨醇酯20,其中所述配制品具有约5.8、约6.0或约6.2的pH,并且,如通过尺寸排阻色谱所测定的,在45℃下储存1个月后回收到至少90%的天然形式的所述抗体。在各种实施方案中,向所述受试者施用约150mg的所述抗体(例如萨瑞鲁单抗)。
在各种实施方案中,所述抗体在稳定的药物配制品中施用,所述药物配制品包含:(i)约10mM至约25mM浓度的组氨酸;(ii)约25mM至约50mM浓度的精氨酸;(iii)约5%至约10%w/v的量的蔗糖;以及(iv)约0.1%至约0.2%w/v的量的聚山梨醇酯,其中所述配制品具有约5.8、约6.0或约6.2的pH,并且,如通过尺寸排阻色谱所测定的,在45℃下储存1个月后回收到至少90%的天然形式的所述抗体。在各种实施方案中,向所述受试者施用约150mg的所述抗体(例如萨瑞鲁单抗)。
有利地,将上述的用于口服或肠胃外使用的药物组合物制备成适于配合活性成分剂量的单位剂量的剂型。单位剂量的此类剂型包括例如片剂、丸剂、胶囊、注射剂(安瓿剂)、栓剂等。
在各种实施方案中,可以使用任何可接受的装置或机构向患者施用所述抗IL-6R抗体(或包含所述抗体的药物配制品)。例如,所述施用可以使用注射筒和针或者使用可重复使用的笔和/或自动注射器递送装置来完成。本公开文本的方法包括使用许多可重复使用的笔和/或自动注射器递送装置来施用抗IL-6R抗体(或包含所述抗体的药物配制品)。此类装置的例子包括但不限于
在各种实施方案中,将所述抗体用预填充注射筒施用。在各种实施方案中,将所述抗体用含有安全系统的预填充注射筒施用。例如,安全系统防止意外针刺损伤。在各种实施方案中,将所述抗体用含有ERIS安全系统(West Pharmaceutical Services Inc.)的预填充注射筒施用。
在各种实施方案中,将所述抗体用自动注射器施用。在各种实施方案中,将所述抗体用特征为
本文还考虑使用微融合器向患者递送抗IL-6R抗体(或包含所述抗体的药物配制品)。如本文所用,术语“微融合器”意指皮下递送装置,其被设计成在延长的时间段(例如,约10、15、20、25、30或更多分钟)内缓慢施用大体积(例如,高达约2.5mL或更多)的治疗配制品。微融合器特别适用于递送包含在高浓度(例如,约100、125、150、175、200mg/mL或更高)和/或粘稠溶液中的大剂量治疗性蛋白质。
在各种实施方案中,对先前治疗的不充分反应是指在以最大耐受典型剂量接受先前治疗后,受试者的疼痛未得到良好控制。在一个实施方案中,对先前治疗的不充分反应是指尽管有先前治疗,但受试者仍具有中度或高度疾病活动性和不良预后特征。在各种实施方案中,对先前治疗的不充分反应是指尽管有先前治疗,但受试者仍具有未改善或已经恶化的疼痛症状(例如,本文列出的任何症状)。
患者群体
如本文所用,“受试者”是指人受试者或人患者。
在各种实施方案中,向患有类风湿性关节炎和遭受NIP的受试者施用本文所述的抗体。在各种实施方案中,所述受试者患有NIP和类风湿性关节炎。在各种实施方案中,先前通过施用不同于所述IL-6R抗体的一种或多种DMARD未有效治疗所述受试者的类风湿性关节炎。
被其医师视为“无效治疗”的受试者是在各种实施方案中已显示出对医师测试的一种或多种DMARD不耐受的受试者,和/或已显示出对医师测试的一种或多种DMARD的反应不充分的受试者,典型地是尽管先前施用了一种或多种DMARD但仍被医师认为呈现出或患有NIP的受试者。
在各种实施方案中,患有类风湿性关节炎的受试者具有:
-如由医师在典型定量肿胀和压痛关节计数检查中所计数的,66个关节中至少有6个肿胀关节并且68个关节中至少有8个压痛关节,
-高敏C反应蛋白(hs-CRP)≥8mg/L或ESR≥28mm/H
-DAS28ESR>5.1。
在各种实施方案中,先前通过施用至少一种不同于抗体的DMARD而无效治疗类风湿性关节炎的受试者为先前通过施用DMARD而无效治疗NIP的受试者。在各种实施方案中,所述DMARD选自甲氨蝶呤、柳氮磺胺吡啶、来氟米特和羟氯喹。在各种实施方案中,所述DMARD是甲氨蝶呤。在各种实施方案中,所述DMARD是TNF-α拮抗剂。在各种实施方案中,所述DMARD是阿达木单抗。
在各种实施方案中,先前通过施用一种或多种不同于所述抗体的DMARD而无效治疗NIP的受试者为对甲氨蝶呤的反应或耐受性不充分的受试者。
在各种实施方案中,先前通过施用一种或多种不同于所述抗体的DMARD而无效治疗NIP的受试者为对阿达木单抗的反应或耐受性不充分的受试者。
在各种实施方案中,对于先前通过施用一种或多种不同于所述IL-6R抗体的DMARD而无效治疗NIP的那些受试者,不再向所述受试者施用一种或多种DMARD,并且在各种实施方案中,以单一疗法向受试者单独施用所述IL-6R抗体。
在各种实施方案中,受试者由于用DMARD治疗引起的一种或多种身体反应、病症或症状而对DMARD不耐受。身体反应、病症或症状可以包括过敏、疼痛、恶心、腹泻、氮血症、胃出血、肠出血、口腔溃疡、血小板减少、肠穿孔、细菌感染、牙龈或口腔炎症、胃衬里或肠衬里炎症、细菌性脓毒症、胃溃疡、肠溃疡、对阳光敏感的皮肤、头晕、食欲不振、低能量和呕吐。在某些实施方案中,不耐受可以由受试者或由医学专业人员在检查受试者时确定。在各种实施方案中,所述DMARD选自甲氨蝶呤、柳氮磺胺吡啶、来氟米特和羟氯喹。在某些实施方案中,所述DMARD是甲氨蝶呤。在某些实施方案中,所述DMARD是阿达木单抗。
在某些实施方案中,本公开文本提供将一种或多种另外的治疗剂与IL-6R抗体组合施用于受试者。如本文所用,表述“与……组合”是指在包含IL-6R抗体的药物组合物之前、之后或与其并行施用另外的治疗剂。在某些实施方案中,将抗体与DMARD和/或TNF-α拮抗剂一起施用于受试者。
实施例
实施例1:萨瑞鲁单抗、NIP状态和疾病活动性
在本研究中,调查了非炎性疼痛(NIP)的普遍性、萨瑞鲁单抗对NIP的作用以及萨瑞鲁单抗治疗、疾病活动性和基线处的NIP状态之间的关联性,并且在萨瑞鲁单抗治疗3个月和6个月后再次调查。
数据崃源
患者数据汇集自萨瑞鲁单抗150mg和200mg q2w(MOBILITY,NCT01061736;TARGET,NCT01709578)的两个安慰剂对照RCT,以及萨瑞鲁单抗200mg q2w(MONARCH,NCT02332590)的一个阿达木单抗对照RCT。
研究终点
NIP被定义为使用确立的公式:TJC-SJC≥7
结果
按NIP状态的人口统计学和基线疾病特征
相比于未患有NIP的患者,尽管炎症测量是相似的,但是患有基线NIP的患者具有更高的综合测量的疾病活动性(表1)。在分析中的2112名患者中,490名(23%)在基线处患有NIP(MOBILITY,25%[294/1197];TARGET,19%[106/546];MONARCH,24%[90/369])。患有和未患有基线NIP的患者在基线处具有相似的人口统计学特征(表2)。
表1:按NIP状态的基线疾病特征
所有值平均值±SD:HAQ-DI=健康评估问卷-残疾指数;VAS=视觉模拟量表
表2:按NIP状态的基线人口统计学特征
萨瑞鲁单抗、NIP状态和疾病活动性
在患有基线NIP的患者中,相比于接受安慰剂或阿达木单抗的患者,接受萨瑞鲁单抗的患者在第12周和第24周更可能无NIP(图1)。在所有三项研究(MOBILITY、TARGET和MONARCH)中,萨瑞鲁单抗与对照治疗之间的相对差异显现随着治疗持续时间的增加而增加。在MONARCH中,无论是否存在基线NIP,用萨瑞鲁单抗治疗的患者比用阿达木单抗治疗的患者有更高比例在第24周实现了治疗反应(图2)。对于除ACR50之外的所有评估,患有基线NIP的患者中各治疗组之间的相对差异更大。在治疗3个月和6个月后,与用萨瑞鲁单抗治疗的患者相比,用安慰剂和阿达木单抗治疗的患者中非炎性疼痛更普遍。此外,无论在基线处是否存在非炎性疼痛,治疗6个月后更高比例的患者在用萨瑞鲁单抗而不是阿达木单抗的情况下实现了低疾病活动性。
结论
在第12周和第24周,相比于用安慰剂或阿达木单抗治疗的患者,用萨瑞鲁单抗治疗的患者中NIP更少。此数据示出NIP是RA患者疼痛的原因之一,并且RA患者的NIP可用本公开文本中的组合物治疗。
参考文献
1.Boyden SD,et al.Curr Rheumatol Rep 2016;18:30.
2.Choy EHS,Calabrese LH.Rheumatology(Oxford)2018;57:1885-95.
3.Brenn D,et al.Arthritis Rheum 2007;56:351-9.
4.Zhou YQ,et al.J Neuroinflammation 2016;13:141.
5.KEVZARA(sarilumab)[Summary of Product Characteristics].Bridgewater,NJ:Sanofi.
6.KEVZARA(sarilumab)[Prescribing Information]2017.Bridgewater,NJ:Sanofi.
7.Strand V,et al.Arthritis Res Ther 2016;18:198.
8.Strand V,et al.RMD Open 2017;3:e000416.
9.Burmester GR,et al.Ann Rheum Dis 2017;76:840-7.
10.Duran J,et al.Rheumatology(Oxford)2015;54:2166-70.
11.Pollard LC,et al.Rheumatology(Oxford)2010;49:924-8.
12.Schaible H.Nociceptive neurons detect cytokines inarthritis.Arthritis Res Ther.2014;16(5):470.
13.Turk D,Okifuji A.Pain terms and taxonomies.Bonica’s Management ofPain.3rd ed:Lippincott Williams&Wilkins;2001.
14.Yang S,Chang M.Chronic pain:Structural and functional changes inbrain structures and associated negative affective states.Int J Mol Sci.2019;20(13):3130.
15.Schaible H.Nociceptive neurons detect cytokines inarthritis.Arthritis Res Ther.2014;16(5):470.
16.Cazzola M,et al.Physiopathology of pain inrheumatology.Reumatismo.2014;66(1):4–13.
17.Deane KD,et al.Preclinical rheumatoid arthritis:identification,evaluation,and future directions for investigation.Rheum Dis Clin NorthAm.2010;36(2):213–41.
18.de Haas WH,et al.Rheumatoid arthritis,typus robustus.Ann RheumDis.1973;32(1):91–2.
19.Kristensen LE,et al.Is swollen to tender joint count ratio a newand useful clinical marker for biologic drug response in rheumatoidarthritis?results from a Swedish cohort.Arthritis Care Res(Hoboken).2014;66(2):173–9
20.Challa DN,et al.Patient-provider discordance between globalassessments of disease activity in rheumatoid arthritis:A comprehensiveclinical evaluation.Arthritis Res Ther.2017;19(1):212.
21.Khan NA,et al.Determinants of discordance in patients'andphysicians'rating of rheumatoid arthritis disease activity.Arthritis Care Res(Hoboken).2012;64(2):206–14.
22.Studenic P,et al.Discrepancies between patients and physicians intheir perceptions of rheumatoid arthritis disease activity.ArthritisRheum.2012;64(9):2814–23.
23.Hammer H,et al.Major reduction of ultrasound detected synovitisduring subcutaneous tocilizumab treatment;results from a multicenter 24 weeksstudy of patients with rheumatoid arthritis[abstract].ArthritisRheumatol.2018;70(suppl 10).
24.Maini RSC,E.W.,et al.Infliximab(chimeric anti-tumour necrosisfactor alpha monoclonal antibody)versus placebo in rheumatoid arthritispatients receiving concomitant methotrexate:A randomised phase IIItrial.ATTRACT study group.Lancet.1999;354(9194):1932–9.
25.Lee YC,et al.Pain persists in DAS28 rheumatoid arthritis remissionbut not in ACR/EULAR remission:A longitudinal observational study.ArthritisRes Ther.2011;13(3):R83.
26.Taylor P,et al.Patient perceptions concerning pain management inthe treatment of rheumatoid arthritis.J Int Med Res.2010;38(4):1213–24.
27.Sarzi-Puttini P,et al.Correlation of the score for subjective painwith physical disability,clinical and radiographic scores in recent onsetrheumatoid arthritis.BMC Musculoskelet Disord.2002;3:18.
28.McWilliams DF,Walsh DA.Pain mechanisms in rheumatoidarthritis.Clin Exp Rheumatol.2017;35(5):94–101.
29.Flodin P,et al.Intrinsic brain connectivity in chronic pain:Aresting-state fMRI study in patients with rheumatoid arthritis.Front HumNeurosci.2016;10:107.
30.Biswas M,et al.Prevalence,types,clinical associations,anddeterminants of peripheral neuropathy in rheumatoid patients.Ann Indian AcadNeurol.2011;14(3):194–7.
31.Adlan A,et al.Autonomic function and rheumatoid arthritis:Asystematic review.Semin Arthritis Rheum 2014;44(3):283–304.
32.Walsh DA,McWilliams DF.Mechanisms,impact and management of pain inrheumatoid arthritis.Nat Rev Rheumatol.2014;10(10):581–92.
33.Ramachandran VS,Blakeslee S.Phantoms in the brain:human nature andthe architecture of the mind:HarperCollins;1998.
34.Taylor et al.,Nucl.Acids Res.1992;20:6287-6295.
35.Angal et al.,Molecular Immunology;1993 30:105.
36.Powell et al."Compendium of excipients for parenteralformulations"PDA J Pharm Sci Technol 1998;52:238-311.
37.Wu et al.J.Biol.Chem.1987;262:4429-4432.
38.Langer Science 1990;249:1527-1533.
39.U.S.Patent No.5,215,534.
40.U.S.Patent No.9,248,242.
41.U.S.Patent No.9,427,531.
42.U.S.Patent No.9,566,395.
43.U.S.Patent No.6,629,949.
44.U.S.Patent No.6,659,982.
45.Meehan et al.,J.Controlled Release 1996;46:107-116.
46.Rose-John et al.,J Leukoc Biol.2006;80(2),227-36.
47.Committee for Medicinal Products for Human Use,Assessment Report,April 27,2017EMA/292840/2017,available at www_dot_ema_dot_europa_dot_eu/documents/assessment_report/kevzara_epar_public_assessment_report_en_dot_pdf.
- 一种治疗类风湿性关节炎的朝医方组合物及其乳膏剂的制备方法
- 一种治疗类风湿性关节炎的中药组合物及其贴剂的制备方法
- 治疗具有类风湿性关节炎的受试者的疼痛的组合物和方法
- 用于治疗患有类风湿性关节炎的个体的方法和组合物
