鼠尾草酸或其衍生物在制备治疗和/或预防Ⅰ型干扰素病药物中的应用
文献发布时间:2023-06-19 18:46:07
技术领域
本文涉及生物医药技术领域,尤指涉及鼠尾草酸或其衍生物在制备治疗和/或预防Ⅰ型干扰素病药物中的应用。
背景技术
Ⅰ型干扰素病是近十年来概念较新的一组疾病,属于免疫缺陷病中的自身炎症性疾病,以体内Ⅰ型干扰素过度激活表达造成炎症损伤为突出特点。I干扰素病是一组遗传性自身炎症性疾病,其特征是I型干扰素(IFN)通路失调,导致多种细胞、组织、器官的功能损伤。
STING(stimulator of interferon genes),又名为TMEM173、MITA、ERIS或MPYS,在胞质DNA刺激下,它响应来自胞质DNA受体的信号,在诱导产生干扰素的过程中发挥着关键性的作用。宿主细胞的DNA识别受体识别外源或内源的“非己”DNA后将信号传递给内质网上的节点分子STING,随后STING迅速二聚化并从内质网转移到核外周小体上。在这个过程中,激酶TBK1也会被招募并转移到核外周小体上激活,被激活的TBK1磷酸化转录因子IRF3,随后IRF3发生二聚化并进入细胞核激活多种靶基因的转录表达。正常激活的cGAS-STING信号通路有助于机体识别和清除入侵的DNA病原微生物,但是异常过度激活的cGAS-STING信号通路会造成机体发生炎症及自身免疫性疾病等,如Aicardi-Goutieres综合征、系统性红斑狼疮或狼疮样疾病。
对于Ⅰ型干扰素病的治疗,抑制I型干扰素的产生具有重要意义。从理论上讲,Ⅰ型干扰素的抗体是一种潜在的治疗方式,体外试验显示抗Ⅰ型干扰素的抗体可阻止Ⅰ型干扰素及其相关基因的过度表达,并且目前显示干扰素单克隆抗体用于治疗系统性红斑狼疮正处于Ⅱ期临床实验阶段。另外,有研究指出在Janus kinase(JAK)抑制剂和逆转录酶抑制剂治疗下能改善Ⅰ型干扰素介导的一些相关疾病如AGS综合征,但是到目前为止,接受治疗的患者数量非常少,目前还没有来自临床试验的数据,而且这类药物对中枢神经系统疾病的影响难以判断。因此,开发一种高效且有安全性的治疗Ⅰ型干扰素相关疾病的药物是必要的。
发明内容
本申请要解决的技术问题是找寻一种治疗Ⅰ型干扰素疾病的高效,稳定以及有良好安全性的药物,具体地,本申请提供了鼠尾草酸或其衍生物在制备治疗和/或预防Ⅰ型干扰素病药物中的应用。
在一方面,本申请中的鼠尾草酸或其衍生物包括但不限于鼠尾草酸、鼠尾草酚和迷迭香酚。鼠尾草酸(Carnosic acid,CA;CAS号:3650-09-7;分子式:C20H28O4;分子量:332.434;淡黄色粉末;易溶于DMSO等有机溶剂;其结构式Ⅰ如下所示)及其衍生物鼠尾草酚(Carnosol,CAS号:5957-80-2;分子式:C20H26O4;分子量:330.418;淡黄色粉末;可溶于甲醇和DMSO等溶剂;其结构式Ⅱ如下所示)和迷迭香酚(Rosmanol;CAS号:80225-53-2;分子式:C20H26O5;分子量:346.42,白色粉末,溶于甲醇和DMSO等溶剂;其结构式Ⅲ如下所示)均为唇形科植物迷迭香中的成分,有着良好的抗炎、抗氧化、抗菌和抗病毒活性。
鼠尾草酸(式Ⅰ)、鼠尾草酚(式Ⅱ)和迷迭香酚(式Ⅲ):
申请人发现,鼠尾草酸能特异性抑制cGAS-STING信号通路的异常活化,显著降低下游Ⅰ型干扰素以及相关基因如CXCL10,ISG以及IL-6的表达。同时,在体内研究中,鼠尾草酸能显著抑制DMXAA诱导的Ⅰ型干扰素的水平,这为涉及Ⅰ型干扰素相关疾病的病人提供潜在的治疗方案。另外,鼠尾草酸还能有效降低Trex1
本申请具有以下增益效果:
本申请提供了鼠尾草酸或其衍生物在制备治疗和/或预防Ⅰ型干扰素病药物中的应用。通过大量的实验表明,鼠尾草酸或其衍生物在细胞水平能通过抑制cGAS-STING信号通路的活化抑制Ⅰ型干扰素的表达。进一步研究表明,在体内实验中,鼠尾草酸能有效抑制Ⅰ型干扰素的过度活化以及改善Trex1
本申请的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本申请而了解。本申请的其他优点可通过在说明书以及附图中所描述的方案来实现和获得。
附图说明
附图用来提供对本申请技术方案的理解,并且构成说明书的一部分,与本申请的实施例一起用于解释本申请的技术方案,并不构成对本申请技术方案的限制。
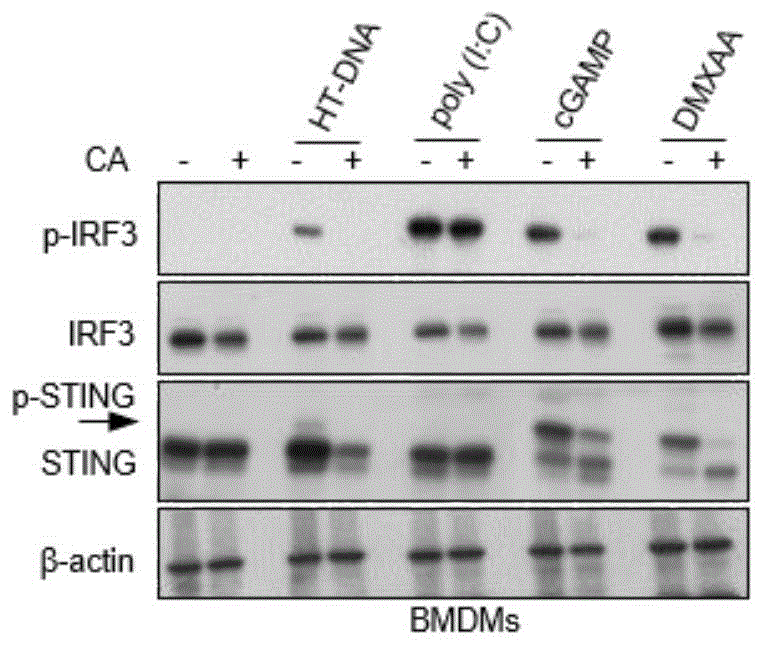
图1为本申请的一种实施方案中鼠尾草酸在小鼠BMDM(骨髓来源的巨噬细胞)细胞中对cGAS-STING信号通路活性的抑制效果的结果图。其中,HT-DNA、poly(I:C)、cGAMP和DMXAA为cGAS-STING信号通路的激活剂,p-IRF3为IRF3蛋白的磷酸化形式,p-STING为STING蛋白的磷酸化形式。p-IRF3和p-STING的增加代表cGAS-STING信号通路的活化程度提高。
图2为本申请的一种实施方案中鼠尾草酸在人类PBMC(外周血单个核细胞)细胞中对cGAS-STING信号通路活性的抑制效果的结果图。
图3为本申请的一种实施方案中鼠尾草酸在小鼠BMDM细胞中对Ⅰ型干扰素的mRNA水平的抑制效果的结果图。其中,DMSO为空白对照,CA为鼠尾草酸处理组。
图4为本申请的一种实施方案中鼠尾草酸在人类PBMC细胞中对Ⅰ型干扰素的mRNA水平的抑制效果的结果图。
图5为本申请的一种实施方案中鼠尾草酸或其衍生物鼠尾草酚和迷迭香酚在BMDM中对cGAS-STING信号通路活性的抑制效果的结果图。
图6A-图6B为本申请的一种实施方案中在小鼠体内鼠尾草酸对干扰素诱导剂如DMXAA诱导的Ⅰ型干扰素水平异常升高的抑制作用的结果图,其中图6A为血清中的Ⅰ型干扰素水平,图6B为腹腔中的Ⅰ型干扰素水平。
图7A-图7B为本申请的一种实施方案中鼠尾草酸对Trex1
图8为本申请的一种实施方案中鼠尾草酸对Trex1
图9为本申请的一种实施方案中鼠尾草酸对Trex1
图10为本申请的一种实施方案中鼠尾草酸对Trex1
具体实施方式
在许多生物体中,检测外来DNA是免疫的一个关键因素。在哺乳动物细胞中,这一任务在很大程度上是由环GMP-AMP合成酶(cGAS)-干扰素基因刺激物(STING)途径完成的,它已成为耦合DNA感知和诱导强大的先天免疫防御程序的关键机制。然而,值得注意的是,这一高度通用的先天免疫感知系统的失调可能引发cGAS-STING通路的异常活化,伴随着Ⅰ型干扰素的大量产生,从而介导多种炎症性和自身免疫性疾病。
I型自身炎症性干扰素疾病是一种基因定义的(单基因或双基因)免疫失调疾病,其特征是外周血中存在I型干扰素信号和可变的全身性炎症。在这个不断扩大的罕见疾病的群体中,慢性非典型中性粒细胞性皮肤病伴脂肪营养不良和体温升高/蛋白酶体相关自身炎症综合征(CANDLE/PRAAS)、干扰素基因刺激因子(STING)相关婴儿期血管病变(SAVI)和Aicardi-Goutieres综合征(AGS)是最常见的。对于AGS而言,常表现为一种罕见的以神经系统及皮肤受累为主的遗传性疾病,并且随着对疾病的认识,逐渐发现显著的临床异质性和遗传异质性。至今已发现了7个AGS致病基因,其中Trex1基因具有显著的代表性。
因此,本申请提供了鼠尾草酸或其衍生物在制备治疗和/或预防Ⅰ型干扰素病药物中的应用。本申请提供的鼠尾草酸或其衍生物能够抑制或阻止cGAS-STING信号通路异常活化而触发Ⅰ型干扰素上升从而引起的炎症性或自身免疫性疾病。可选地是Trex1基因缺陷引起的炎症性或自身免疫性疾病,例如AGS综合征。
术语“衍生物”可以指具有与化合物相同或相似的核心结构但具有至少一个结构差异(包括取代、缺失和/或添加一个或更多个原子或官能团)的任何化合物。
在一些实施方案中,鼠尾草酸或其衍生物为下述结构式所示的鼠尾草酸、鼠尾草酚和迷迭香酚:
在一些实施方案中,本申请中制备的药物可以包含鼠尾草酸或其衍生物的药学上可接受的盐。在一些实施方案中,制备的药物还可以包含其他鼠尾草酸的衍生物及其药学上可接受的盐。“药学上可接受的盐”是可以被配制成用于药物使用的化合物的盐,包括例如金属盐(钠、钾、镁、钙等)和氨或有机胺的盐。
在一些实施方案中,Ⅰ型干扰素病包括Aicardi-Goutieres综合征、腺苷脱氨酶2缺陷、系统性红斑狼疮、STING相关婴儿期起病血管病、蛋白酶体相关的自身炎症综合征、症状性腹泻/三肝肠综合征、X连锁网状色素异常症、脊柱软骨发育不良伴免疫调节异常、家族性冻疮狼疮和视网膜血管病变伴脑白质营养不良中。
在一些实施方案中,本申请中制备的药物为抑制cGAS-STING信号通路异常活化的抑制剂。cGAS-STING信号通路的异常活化包括Trex1基因变异,如Trex1基因缺陷,以及干扰素诱导剂的诱导等。cGAS-STING信号通路异常活化能诱导各种疾病及并发症,包括但不限于AGS综合征。抑制剂是指抑制、部分或全部阻断刺激或激活、减少、阻止、延迟激活、失活、脱敏或下调生理/细胞过程的化合物。激活剂是指诱导、激活、刺激、增加、促进、增强激活、敏化或上调至少一种生理/细胞过程的化合物。本申请中制备的抑制剂能通过抑制cGAS-STING信号通路异常活化进而降低Ⅰ型干扰素的水平。
在一些实施方案中,本申请中制备的药物通过口服、静脉内、皮内、经皮、鞘内、动脉内、腹膜内、鼻内、阴道内、直肠内、膀胱内、肿瘤内、局部、肌肉内、皮下、粘膜、吸入、注射、输注,或前述的任何组合来施用。
在一些实施方案中,本申请中制备的药物的剂型包括胶囊、片剂、丸剂、液体、粉末、颗粒剂、细颗粒剂、薄膜包衣剂、药丸、锭剂、舌下剂、胶溶剂、含服制剂、糊剂、糖浆、悬剂、酏剂、乳剂、包衣剂、软膏剂、硬膏剂、泥罨剂、透皮制剂、洗剂、吸入剂、气雾剂、注射剂或栓剂。
在一些实施方案中,本申请中制备的药物还包含药学上可接受的赋形剂。“药学上可接受的赋形剂”意指可用于制备药物组合物的通常为安全的、无毒性的且合意的赋形剂,并且包括对于兽医使用以及人类药物使用是可接受的赋形剂。这样的赋形剂可以是固体、液体、半固体的,或者在气雾剂组合物的情况下是气体的。适于口服和表面使用的药用级有机或无机载体和/或稀释剂可以用于制成含有治疗活性化合物的组合物。本领域已知的稀释剂包括水性介质、植物油和动物油以及脂肪。稳定剂、润湿剂和乳化剂、用于改变渗透压的盐或用于确保适当的pH值的缓冲剂以及皮肤渗透增强剂可以被用作辅助剂。赋形剂的非限制性实例包括制粒剂、粘合剂、润滑剂、崩解剂、甜味剂、助流剂、抗粘剂、抗静电剂、表面活性剂、抗氧化剂、树胶、包衣剂、着色剂、调味剂、增塑剂、防腐剂、悬浮剂、乳化剂、抗微生物剂、植物纤维素材料和成球剂及其任何组合。
在一些实施方案中,鼠尾草酸或其衍生物或其药学上可接受的盐可以合适地被制备为药物组合物和单位剂型,以作为以下使用:用于口服使用的固体(例如,片剂或填充胶囊)或液体(例如,溶液、悬浮液、乳液、酏剂或用其填充的胶囊),用于直肠施用的软膏、栓剂或灌肠剂的形式,用于肠胃外使用(例如,肌内施用、皮下施用、静脉内施用、硬膜外施用、关节内施用和鞘内施用)的无菌可注射溶液的形式;或用于肠胃外(例如,表面、含服、舌下、阴道)施用的软膏、洗剂、乳膏、凝胶、贴剂、舌下条或膜等形式。
在一些实施方案中,本申请中制备的药物制剂可以静脉内、皮内、经皮、鞘内、动脉内、腹膜内、鼻内、阴道内、直肠内、膀胱内(例如,诸如通过注射或通过膀胱内滴注直接施用至膀胱中)、肿瘤内、局部、肌肉内、皮下、粘膜、口服、局部、吸入(例如,气雾剂吸入)、注射、输注、连续输注,经由导管、经由灌洗以乳油、以液体组合物(例如,脂质体)直接局部灌注,或者通过如本领域普通技术人员已知的其他方法或前述的任何组合来施用。
在一些实施方案中,鼠尾草酸或其衍生物在受试者中的施用剂量为1-50mg/kg/d。在一些实施方案中,每天施用至受试者的鼠尾草酸或其衍生物的剂量选自由以下组成的组:约1.0mg/kg、约2.0mg/kg、约3.0mg/kg、约4.0mg/kg、约5.0mg/kg、约6.0mg/kg、约7.0mg/kg、约8.0mg/kg、约9.0mg/kg、约10.0mg/kg、约11.0mg/kg、约12.0mg/kg、约13.0mg/kg、约14.0mg/kg、约15.0mg/kg、约16.0mg/kg、约17.0mg/kg、约18.0mg/kg、约19.0mg/kg、约20.0mg/kg、约22.5mg/kg、约25.0mg/kg、约27.5mg/kg、约30.0mg/kg、约32.5mg/kg、约35.0mg/kg、约37.5mg/kg、约40.0mg/kg、约42.5mg/kg、约45mg/kg、约47.5mg/kg和约50.0mg/kg。
在一些实施方案中,本申请中的受试者是人类、大鼠、小鼠、猫、狗、马、绵羊、奶牛、猴。在一些实施方案中,受试者的说明性实例包括灵长类动物,特别是人类,伴侣动物诸如猫和狗以及类似动物,工作动物诸如马、驴以及类似动物,牲畜动物诸如绵羊、牛、山羊、猪以及类似动物,实验室测试动物诸如兔、小鼠、大鼠、豚鼠、仓鼠以及类似动物,以及圈养野生动物诸如动物园和野生动物园中的圈养野生动物、鹿、澳洲野狗以及类似动物。在一些实施方案中,受试者是人类。
下面结合附图和实施例对本申请的具体实施方式作进一步详细描述。
本申请描述了多个实施例,但是该描述是示例性的,而不是限制性的,并且对于本领域的普通技术人员来说显而易见的是,在本申请所描述的实施例包含的范围内可以有更多的实施例和实现方案。尽管在附图中示出了许多可能的特征组合,并在具体实施方式中进行了讨论,但是所公开的特征的许多其它组合方式也是可能的。除非特意加以限制的情况以外,任何实施例的任何特征可以与任何其它实施例中的任何其他特征结合使用,或可以替代任何其它实施例中的任何其他特征。
本申请包括并设想了与本领域普通技术人员已知的特征的组合。本申请已经公开的实施例和特征也可以与任何常规特征组合,以形成由权利要求限定的独特的发明方案。任何实施例的任何特征也可以与来自其它发明方案的特征组合,以形成另一个由权利要求限定的独特的发明方案。因此,应当理解,在本申请中示出和/或讨论的任何特征可以单独地或以任何适当的组合来实现。因此,除了根据所附权利要求及其等同替换所做的限制以外,实施例不受其它限制。此外,可以在所附权利要求的保护范围内进行各种修改和改变。
此外,在描述具有代表性的实施例时,说明书可能已经将方法和/或过程呈现为特定的步骤序列。然而,在该方法或过程不依赖于本文所述步骤的特定顺序的程度上,该方法或过程不应限于所述的特定顺序的步骤。如本领域普通技术人员将理解的,其它的步骤顺序也是可能的。因此,说明书中阐述的步骤的特定顺序不应被解释为对权利要求的限制。此外,针对该方法和/或过程的权利要求不应限于按照所写顺序执行它们的步骤,本领域技术人员可以容易地理解,这些顺序可以变化,并且仍然保持在本申请实施例的精神和范围内。
下列实施例中未注明具体条件的实验方法,通常按照国家标准测定。下述实施例中未注明出处的实验材料,均为市售原料。下述实施例中的各步骤中采用的设备均为常规设备。若没有相应的国家标准,则按照通用的国际标准、常规条件、或按照制造厂商所建议的条件进行。除非另有定义或说明,本发明中所使用的所有专业与科学用语与本领域技术熟练人员所熟悉的意义相同。此外任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。本申请实施例中所采用的鼠尾草酸或其衍生物均购自TargetMol公司。
实施例1:鼠尾草酸在小鼠BMDM和人PBMC细胞中显著抑制了cGAS-STING信号通路活性
1实验方法:
从小鼠大腿股骨出分离出骨髓细胞并培养于含生长因子MCSF(巨噬细胞集落刺激因子)的DMEM(dulbecco's modified eagle medium)中(10% FBS,1%青霉素/链霉素)使其完全分化为小鼠骨髓巨噬细胞(BMDMs)。随后,BMDMs以1.2x106个/ml的密度接种于12孔板中过夜。第二天,用鼠尾草酸(10uM)处理细胞1小时后,再分别加入几种不同的cGAS-STING信号通路激活剂如HT-DNA,poly(I:C),cGAMP和DMXAA(Vadimezan)刺激2小时。随后,弃去上清,用PBS清洗3遍,然后用RIPA(Radio Immunoprecipitation Assay)裂解液裂解细胞,并通过免疫印迹评估鼠尾草酸对cGAS-STING信号通路的抑制情况。
类似地,从健康志愿者处分离出的hPBMC细胞用无血清的opti-MEM重悬并以3x106个/ml的密度接种于12孔板中,使其饥饿2小时,便于更好地贴壁。随后,将培养基更换为1640培养基(10% FBS,1%青霉素/链霉素)孵育过夜。第二天,先用opti-MEM稀释的鼠尾草酸(2.5,5,10uM)处理1小时,然后加入HT-DNA刺激2小时.随后,弃去上清,用PBS清洗3遍,然后用RIPA裂解液裂解细胞,并通过免疫印迹评估鼠尾草酸对cGAS-STING信号通路的抑制情况。
免疫印迹检测cGAS/STING信号通路相关蛋白的表达
Western blot测定:检测细胞裂解液中磷酸化IRF3、IRF3、磷酸化STING、STING、β-Actin的蛋白水平。
2、实验结果:
上述实验结果如图1所示,在BMDMs中,鼠尾草酸对HT-DNA,cGAMP和DMXAA或诱导的cGAS-STING信号通路活化有显著的抑制效果。另外一个实验结果如图2所示,在人的PBMC细胞中,鼠尾草酸显著抑制了HT-DNA,cGAMP和DIABZI诱导的cGAS-STING信号通路活化。
实施例2:鼠尾草酸在小鼠BMDM和人PBMC细胞中对cGAS-STING信号通路活化后伴随的Ⅰ型干扰素的mRNA水平升高有很好的的抑制效果
实验方法:
实施例2的实验方法与实施例1类似,BMDMs细胞经鼠尾草酸(10uM)处理1小时后,用HT-DNA,cGAMP和DMXAA刺激2小时。随后,弃去上清,用PBS清洗三遍,然后用RNA裂解液Trizol裂解细胞,并通过qPCR评估鼠尾草酸对cGAS-STING信号通路活化后IFN的mRNA水平的抑制情况。同样地,人hPBMC细胞经鼠尾草酸(10uM)处理1小时后,用HT-DNA,cGAMP和DIABZI刺激2小时。随后,弃去上清,用PBS清洗三遍,然后用Trizol裂解细胞,并通过qPCR评估鼠尾草酸对cGAS-STING信号通路活化后Ⅰ型干扰素的mRNA水平的抑制情况。
实验结果:
上述实验结果如图3所示,在BMDMs中,鼠尾草酸显著抑制了HT-DNA,cGAMP和DMXAA诱导的IFN基因的mRNA水平。另外,结果如图4所示,在人PBMC细胞中,鼠尾草酸对HT-DNA,cGAMP和DIABZI诱导的Ⅰ型干扰素基因的mRNA水平同样有显著的抑制效果。
实施例3:鼠尾草酸或其衍生物鼠尾草酚和迷迭香酚在小鼠BMDMs中显著抑制cGAS-STING信号通路活性
1、实验方法:
从小鼠股骨处收集并分化完全的BMDMs以1.2x106个/ml的密度接种于12孔板中过夜。第二天,先分别用鼠尾草酸,鼠尾草酚以及迷迭香酚处理细胞1小时后,再用HT-DNA和cGAMP处理细胞2小时。随后,完全弃去上清,用PBS清洗3遍,然后用RIPA裂解液裂解细胞。收集样品,通过免疫印迹分析细胞裂解液中磷酸化IRF3、IRF3、磷酸化STING、STING、β-Actin的蛋白水平,以此来评估鼠尾草酸或其衍生物鼠尾草酚和迷迭香酚对cGAS-STING信号通路活化的影响。
实验结果:
上述实验结果如图5所示,在BMDMs中,鼠尾草酸或其衍生物鼠尾草酚和迷迭香酚,能特异性抑制HT-DNA和cGAMP诱导的cGAS-STING信号通路活性。
实施例4:在小鼠体内鼠尾草酸对DMXAA诱导的IFN水平有显著的抑制效果
实验方法:
8周左右的C57BL/6小鼠购自斯贝福生物技术有限公司,预先适应性喂养一周。小鼠随机分为空白组、模型组以及鼠尾草酸治疗组,每组6只。小鼠用不同剂量的鼠尾草酸(15mg/kg、30mg/kg)通过腹腔注射预处理1小时。随后,配置浓度为30mg/kg的DMXAA并通过腹腔注射处理小鼠5小时。收集小鼠血清,腹腔灌洗液以及腹腔细胞。评估鼠尾草酸对DMXAA诱导的Ⅰ型干扰素水平的抑制效果。
实验结果
实验结果如图6A部分所示,鼠尾草酸显著抑制了血清中DMXAA诱导的IFN水平。另外,如图6B部分所示,鼠尾草酸对腹腔中的Ⅰ型干扰素水平同样有显著的抑制效果。
实施例5:鼠尾草酸显著抑制了Trex1
实验方法:
野生型小鼠(WT)BMDMs和Trex1
实验结果
实验结果如图7A-图7B所示,鼠尾草酸显著抑制了Trex1
实施例6:鼠尾草酸对Trex1
实验方法:
选用4周大小的WT小鼠和Trex1
实验结果:
上述结果如图8所示,Trex1
由上述实施例可知,本申请提供了鼠尾草酸或其衍生物可以作为Ⅰ型干扰素介导的疾病的潜在治疗方案,其为临床诊断和治疗方案提供了重要参照依据。但本申请并不局限于上述详细特征及因cGAS-STING活性失调导致的列举疾病类型。所属技术领域的技术人员应该明了,对本申请的任何改进以及增加因cGAS-STING活性失调导致的疾病类型的检测等,均属于本申请的保护和公开范围之内。
