新型去端肽胶原蛋白及其用途
文献发布时间:2023-06-19 19:07:35
技术领域
本发明涉及一种新型去端肽胶原蛋白及其用途。
背景技术
胶原蛋白是一种存在于真皮、韧带和骨骼中的细胞外基质,并且占人体中总蛋白质的约30%。胶原蛋白可以通过将细胞以一定次序聚集在它们周围来形成组织或器官的基本结构。因此,存在许多为了使活体的损伤部位再生而将胶原蛋白用作该损伤部位处的人工组织替代物的基础基质的情况。此外,胶原蛋白的类型取决于其所位于的组织而不同。最丰富的胶原蛋白类型是I型胶原蛋白,其分子量为约300kDa并且由三种多肽组成。I型胶原蛋白在组织工程学中的使用最广泛,因为它被大量包含于几乎所有的组织,诸如皮肤、韧带、骨骼等中。胶原蛋白的分子结构包括非螺旋端肽区和位于N末端区域和C末端区域中的三螺旋区。该三螺旋区是跨物种保守的,表现出低免疫原性,而端肽区是高免疫原性的。因此,为了将胶原蛋白用作药物或化妆品的原材料,使用去端肽胶原蛋白,该去端肽胶原蛋白经蛋白酶处理以去除端肽区并维持与胶原蛋白相似的性质。
在使用通过常规方法制备的去端肽胶原蛋白作为药物载体(通常地,药物递送系统)的情况下,i)所负载的药物以高浓度不均匀地负载在表面上,并且ii)当药物被负载并移植到体内时,药物初始过度释放并且药物释放随时间推移迅速减少,因此引起药物持续时间较短的问题。在药物递送系统的情况下,重要的是在最大化治疗效应的同时最小化副作用。为此目的,重要的是药物以最佳药物释放速率长时间均匀地释放。就这一点而言,由于药物的过度初始释放,因此存在无法预期常规去端肽胶原蛋白药物递送系统的治疗效应的缺点。
发明内容
[待由本发明解决的问题]
本发明的目的是提供一种新型去端肽胶原蛋白及其制备方法。
此外,本发明的另一个目的是提供一种含有该新型去端肽胶原蛋白的药物递送系统。
进一步地,本发明的另一目的是提供一种包含该新型去端肽胶原蛋白的癌症转移抑制剂。
[用于解决问题的手段]
1、一种去端肽胶原蛋白,其包含:含有以下结构式1或结构式2的重复单元的α链;作为α链的二聚体的β链;以及
作为α链的三聚体的γ链,其中当通过高效液相色谱法(HPLC)分析时,β链的峰面积(S
[式1]
Gly-Pro-X
(在结构式1中,Gly是甘氨酸,Pro是脯氨酸,并且X是除了甘氨酸和脯氨酸以外的氨基酸残基)
[结构式2]
Gly-Y-Hyp
(在结构式2中,Gly是甘氨酸,Y是除了甘氨酸和羟脯氨酸以外的氨基酸残基,并且Hyp是羟脯氨酸)。
2、根据上述1所述的去端肽胶原蛋白,其中α链是α1链或α2链中的至少一者,β链是α1链与α1链的二聚体、α1链与α2链的二聚体、或α2链与α2链的二聚体。
3、根据上述1所述的去端肽胶原蛋白,其中α链是α1链或α2链中的至少一者,并且该γ链是α1链、α1链和α2链的三聚体。
4、根据上述1所述的去端肽胶原蛋白,其中S
[等式1]
1.1≤S
5、根据上述1所述的去端肽胶原蛋白,其中S
[等式2]
0.2≤S
(其中S
6、根据上述1所述的去端肽胶原蛋白,其中α链的分子量为100kDa至150kDa。
7、根据上述1所述的去端肽胶原蛋白,其中高效液相色谱(HPLC)分析是在下表1所示的条件下执行的:
[表1]
8、根据上述7所述的去端肽胶原蛋白,其中S
9、根据上述7所述的去端肽胶原蛋白,其中S
10、根据上述1所述的去端肽胶原蛋白,其中去端肽胶原蛋白通过在1至10℃下用蛋白酶处理哺乳动物源性真皮0.5至12小时而获得。
11、根据上述10所述的去端肽胶原蛋白,其中蛋白酶以每100g真皮0.1×10
12、根据上述1所述的去端肽胶原蛋白,其中去端肽胶原蛋白通过包括以下的方法制备:
用蛋白酶处理哺乳动物源性真皮;
将碱性溶液添加至经蛋白酶处理的真皮,并在8至9的范围内调整pH,以使蛋白酶失活;以及
用酸性溶液处理其中蛋白酶失活的样品,以将样品的pH调整到3至4的pH调整步骤。
13、一种药物递送系统,其包含:根据上述1至12中任一项所述的去端肽胶原蛋白;以及负载在该去端肽胶原蛋白中的药物。
14、根据上述13所述的药物递送系统,其中去端肽胶原蛋白是具有多个孔隙的结构,其中该孔隙的平均直径是10至100μm。
15、根据上述13所述的药物递送系统,其中药物递送系统被移植到或注射到手术后残留的癌症部位中。
16、一种癌症转移抑制剂,其包含:根据上述1至12中任一项所述的去端肽胶原蛋白;以及负载在该去端肽胶原蛋白中的抗癌剂。
17、根据上述16所述的癌症转移抑制剂,其中癌症是胰腺癌、乳腺癌、肝癌、结直肠癌、卵巢癌、头颈癌或胶质母细胞瘤。
18、根据上述16所述的癌症转移抑制剂,其中将癌症转移抑制剂移植到或注射到手术后残留的癌症部位中。
19、根据上述16所述的癌症转移抑制剂,其中抗癌剂是低分子量化合物、高分子量化合物、核酸、肽、蛋白质或适体。
[有益效果]
本发明的去端肽胶原蛋白由于其具有的β链含量高于α2链的含量而可表现出与传统去端肽胶原蛋白不同的物理性质(例如,优异的粘度)。
生理活性物质可以被均匀地负载在本发明的去端肽胶原蛋白中。
当生理活性物质被负载在本发明的去端肽胶原蛋白中时,可以控制由于生理活性物质在体内的过慢初始释放而导致的生理活性物质的效应降低。也就是说,当生理活性物质被负载在本发明的去端肽胶原蛋白中时,可以控制生理活性物质在体内的释放速率,并且最终地,可以通过控制生理活性物质的释放来增加该生理活性物质在体内的功效。
本发明的去端肽胶原蛋白可以表现出优异的癌症转移抑制效应。
本发明的去端肽胶原蛋白可以是可生物降解的。
本发明的生产方法可以调整去端肽胶原蛋白的α链、β链或γ链的含量。
附图说明
图1示出了高效液相色谱(HPLC)分析图表(色谱图)的示例。
图2示出了高效液相色谱(HPLC)分析图表(色谱图)的示例。
图3示出了根据一个实施方式的分析条件的高效液相色谱(HPLC)分析图(色谱图)的示例。
图4示出了根据一个实施方式的用于生产去端肽胶原蛋白的方法的流程图。
图5示出了使用切向流过滤系统(Minimate TFF系统)用去端肽胶原蛋白缓冲液置换去端肽胶原蛋白-乙酸钠溶液的方法。
图6示出了根据一个实施方式的去端肽胶原蛋白的癌症转移抑制效应的机制。
图7示出了根据比较例的去端肽胶原蛋白的癌转移抑制效应的机制。
图8示出通过SDS-PAGE确认pH中性去端肽胶原蛋白溶液的纯度的结果。
图9示出了通过HPLC洗脱时间制备去端肽胶原蛋白的峰,然后经由SDS-PAGE对所述峰进行分析,从而确认去端肽胶原蛋白链在HPLC分析色谱图中的分布的结果。
图10示出了在相同条件下,通过分别对实施例中的去端肽胶原蛋白和比较例中的(市售的)去端肽胶原蛋白进行HPLC分析而获得的图。
图11示出了这样的图,所述图指示通过在相同条件下对实施例和比较例中的去端肽胶原蛋白进行HPLC分析而获得的所述图中每个峰的面积的数值。
图12示出了通过在相同条件下对实施例和比较例中的去端肽胶原蛋白进行HPLC分析而获得的图。
图13示出了这样的图,所述图指示通过在相同条件下对实施例和比较例中的去端肽胶原蛋白进行HPLC分析而获得的所述图中每个峰的面积的数值。
图14示出了这样的图,所述图指示通过在相同条件下对实施例和比较例中的去端肽胶原蛋白进行HPLC分析而获得的所述图中每个峰的面积的数值。
图15示出了这样的图,所述图指示通过在相同条件下对实施例和比较例中的去端肽胶原蛋白进行HPLC分析而获得的所述图中每个峰的面积的数值。
图16示出了这样的图,所述图指示通过在相同条件下对实施例和比较例中的去端肽胶原蛋白进行HPLC分析而获得的所述图中每个峰的面积的数值。
图17示出了这样的图,所述图指示通过在相同条件下对比较例中的去端肽胶原蛋白进行HPLC分析而获得的所述图中每个峰的面积的数值。
图18示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图19示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图20示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图21示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图22示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图23示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图24示出了这样的图,所述图指示通过在相同条件下对实施例中的去端肽胶原蛋白进行HPLC分析而获得的图中的每个峰的面积的数值。
图25示出了通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析实施例和比较例中的去端肽胶原蛋白的结果。
图26示出了使用扫描电子显微镜观察实施例和比较例中的去端肽胶原蛋白的结构的结果。
图27示出了使用扫描电子显微镜观察实施例和比较例中均负载有药物的去端肽胶原蛋白的结构的结果。
图28是实施例1中的去端肽胶原蛋白的拉伸强度测试结果的图和详细数值。
图29是实施例31中的去端肽胶原蛋白的拉伸强度测试结果的图和详细数值。
图30是比较例2中的去端肽胶原蛋白的拉伸强度试验结果的图和详细数值。
图31示出了制备固体去端肽胶原蛋白药物递送系统(包括贴剂型去端肽胶原蛋白药物递送系统)的步骤。
图32示出了借助于酶谱法确认MMP-2和MMP-9活性的结果。
图33示出了比较比较例的去端肽胶原蛋白药物递送系统和实施例的去端肽胶原蛋白药物递送系统在过表达MMP-2和MMP-9的培养基中的药物释放效应的图。
图34示出了负载有吉西他滨的贴剂型去端肽胶原蛋白药物递送系统的肿瘤抑制和转移抑制效应。
图35示出了负载有[GRO-适体和吉西他滨缀合物]的贴剂型去端肽胶原蛋白药物递送系统的肿瘤抑制和转移抑制效应。
图36示出了负载有吉西他滨的溶胶-凝胶型去端肽胶原蛋白药物递送系统的肿瘤抑制和转移抑制效应。
图37示出了负载有[GRO-适体和吉西他滨缀合物]的溶胶-凝胶型去端肽胶原蛋白药物递送系统的肿瘤抑制和转移抑制效应。
图38示出了确认负载有[GRO-适体和吉西他滨缀合物]的贴剂型去端肽胶原蛋白药物递送系统中的药物释放效应的图。
具体实施方式
在下文中,将对本发明进行详细描述。
本发明提供了一种新型去端肽胶原蛋白。
本发明提供了去端肽胶原蛋白,其包含α链;作为α链的二聚体的β链;以及作为α链的三聚体的γ链,其中当通过高效液相色谱法(HPLC)分析时,β链的峰面积(S
术语“峰面积”意指在HPLC分析图中存在的具有对应峰的脊的面积,其中具有每个峰的脊及其面积是根据常规色谱分析方法定义的。
峰的面积可以意指通过对HPLC分析图(色谱图)中从紧接在对应于特定峰的洗脱时间之前的拐点处的洗脱时间(或在紧接在该对应于特定峰的洗脱时间之前的脊与基线的交点处的洗脱时间)至紧接在对应于上述峰的洗脱时间之后的拐点处的洗脱时间(或在紧接在对应于该峰的洗脱时间之后的脊与基线的交点处的洗脱时间)的检测量进行积分而获得的值。在本文中,基线是指在HPLC分析图表中检测值为0的平行于宽度(横)轴的线。
将用以下示例描述计算具有特定峰的脊的面积的方法。然而,具有特定峰的峰的面积不特别限于以下示例,而是也可以根据任何常规色谱分析方法获得。
在以下情况中:存在在特定峰的洗脱时间之前具有不同峰的脊,将针对该脊计算面积(在此时,具有上述其他峰的脊与具有该特定峰的脊相邻,并且在具有该其他峰的脊与具有特定峰的脊之间存在拐点);并且存在在在特定峰的洗脱时间之后的具有另一个峰的另一个脊(在此时,该具有另一个峰的脊与该具有特定峰的脊相邻,并且在该具有另一个峰的脊与该具有特定峰的脊之间存在拐点),将参照图1详细描述计算具有特定峰的脊的面积的方法。
在图1中,具有第一峰10的脊的面积意指通过对从与在具有第三峰30的脊(其洗脱时间比第一峰10更快)与具有第一峰10的脊之间存在的第一拐点(a1)对应的洗脱时间(ta1)至与在具有第二峰20的脊(其洗脱时间比第一峰10更慢)与具有第一峰10的脊之间存在的第二拐点(a2)对应的洗脱时间(ta2)的检测量进行积分而获得的值(参见图1)(在此时,第三峰30存在于第一峰10之前,并且具有第三峰30的脊与具有第一峰10的脊相邻。进一步地,第二峰20存在于第一峰之后,并且具有第二峰20的脊与具有第一峰10的脊相邻)。也就是说,这展示了图1中向左下方倾斜的倾斜部分的面积1。
类似地,参见图1,具有第二峰20的脊的面积意指通过对从与在具有第一峰10的脊(其洗脱时间比第二峰20更快)与具有第二峰20的脊之间存在的第二拐点(a2)对应的洗脱时间(ta2)至与在具有第四峰40的脊(其洗脱时间比第二峰20更慢)与具有第二峰20的脊之间存在的第三拐点(a3)对应的洗脱时间(ta3)的检测量进行积分而获得的值(参见图1)(在此时,第一峰10存在于第二峰20之前,并且具有第一峰10的脊与具有第二峰20的脊相邻。进一步地,第四峰40存在于第二峰20之后,并且具有第四峰40的脊与具有第二峰20的脊相邻)。也就是说,这种面积是指图1中向右下方倾斜的倾斜部分的面积2。
如果在要计算面积的特定峰的洗脱时间之前存在具有该特定峰的脊与基线的交点(在此时,在该交点与该特定峰之间不存在其他峰),并且当在该特定峰的洗脱时间之后存在具有另一峰的脊时(在此时,该具有另一峰的脊与该具有特定峰的脊相邻,并且在该具有另一个峰的脊与该具有特定峰的脊之间存在拐点),则将参照图2详细描述计算具有该特定峰(对应于图2中的第一峰10)的脊的面积的方法。
在图2中,具有第一峰10的脊的面积意指通过对从与在早于第一峰10的洗脱时间(t10)的时间处出现的基线与具有第一峰10的脊的交点(b1)对应的洗脱时间(tb1)至与在具有第二峰20的脊(其洗脱时间慢于第一峰10)与具有第一峰10的脊之间存在的第一拐点(a1)对应的洗脱时间(ta1)的检测量进行积分而获得的值(参见图2)(在此时,在交点(b1)与第一峰10之间不存在其他峰,第二峰20存在于第一峰10之后,并且具有第二峰20的脊与具有第一峰10的脊相邻)。也就是说,上述面积意指图2中向左下方倾斜的倾斜部分的面积1。
与此同时,参见图2,具有第二峰20的脊的面积意指通过对从与在具有第一峰10的脊与具有第二峰20的脊之间存在的第一拐点(a1)对应的洗脱时间(ta1)至与在具有第三峰30的面积(其洗脱时间比第二峰20更慢)与具有第二峰20的脊之间存在的第二拐点(a2)对应的洗脱时间(ta2)的检测量进行积分而获得的值(参见图2)(在此时,第一峰10存在于第二峰20之前,并且具有第一峰10的脊与具有第二峰20的脊相邻。进一步地,第三峰30存在于第二峰20之后,并且具有第三峰30的脊与具有第二峰20的脊相邻)。也就是说,上述面积指示由图2中与横轴平行的线指示的部分的面积2。
在要计算面积的特定峰的洗脱时间之后,当在具有特定峰的脊与基线之间存在交点时(在此时,在该交点与该特定峰之间不存在其他峰),并且当在该特定峰的洗脱时间之前存在具有另一峰的脊时(在此时,该具有另一峰的脊与该具有特定峰的脊相邻,并且在该具有另一峰的脊与该具有特定峰的脊之间存在拐点),将参照图3详细描述计算该具有特定峰(对应于图3中的第二峰20)的脊的面积的方法。
在图3中,具有第二峰20的脊的面积意指通过对从与在具有第一峰10的脊(其洗脱时间比第二峰20更快)的脊与具有第二峰20的脊之间存在的第二拐点(a2)对应的洗脱时间(ta2)至处于比第二峰20的洗脱时间(t20)更慢的时间处的与在基线b与具有第二峰20的脊的交点(b2)对应的洗脱时间(tb2)的检测量进行积分而获得的值(参见图3)(在此时,在交点(b2)与第二峰20之间不存在其他峰。进一步地,第一峰10存在于第二峰20之前,并且具有第一峰10的脊与具有第二峰20的脊相邻)。也就是说,上述面积是指由图3中与横轴平行的线所指示的部分的面积2。
与此同时,参见图3,具有第一峰10的脊的面积意指通过对从与在具有第一峰10的脊(其洗脱时间比第二峰20更快)与具有第二峰20的脊之间存在的第一拐点(a1)对应的洗脱时间(ta1)至与在具有第二峰20的脊(其洗脱时间比第一峰10更慢)与具有第一峰10的脊之间存在的第二拐点(a2)对应的洗脱时间(ta2)的检测量进行积分而获得的值(参见图3)(在此时,第三峰30存在于第一峰10之前,并且具有第三峰30的脊与具有第一峰10的脊相邻。进一步地,第二峰20存在于第一峰10之后,并且具有第二峰20的脊与具有第一峰10的脊相邻)。也就是说,上述面积意指图3中向左下方倾斜的倾斜部分的面积1。
每个峰的面积与代表该峰的材料的含量成比例。也就是说,关于本发明的去端肽胶原蛋白,去端肽胶原蛋白中所包含的β链的含量高于α2链的含量。具体的,含量的单位可以是w/v%。
术语“去端肽胶原蛋白”是指去除位于胶原蛋白的N末端和C末端的端肽,其中去除免疫原性,与此同时维持胶原蛋白的特性。去端肽胶原蛋白可以通过从天然存在的胶原蛋白中去除N末端和C末端端肽来制备。例如,本发明的去端肽胶原蛋白可以通过从1型胶原蛋白或2型胶原蛋白中去除N末端和C末端端肽来制备。
术语“胶原蛋白”是指占据大部分细胞外基质并参与组织结构的形成或细胞之间的相互作用或细胞与基质之间的相互作用的蛋白质。胶原蛋白分子是这样的分子,在该分子中以α链为基本结构单元的三条链扭曲以形成螺旋结构,其中α链包含Gly-AB重复单元(Gly是甘氨酸,A和B是氨基酸,并且A和B中的至少一者是脯氨酸或羟脯氨酸),并且可以是由约1000个氨基酸组成的肽。取决于组织中的功能、排列等,存在许多不同类型的胶原蛋白。代表性的胶原蛋白类型可包括1型胶原蛋白和2型胶原蛋白。1型胶原蛋白由两条α1链和一条α2链组成,而2型胶原蛋白由三条α1链组成。
本发明的去端肽胶原蛋白中所包含的α链可包含Gly-AB重复单元(Gly是甘氨酸,A和B是氨基酸,并且A和B中的至少一者是脯氨酸或羟脯氨酸)。
例如,本发明的去端肽胶原蛋白中所包含的α链可包含以下结构式1或结构式2的重复单元:
[结构式1]
Gly-Pro-X
(在结构式1中,Gly是甘氨酸,Pro是脯氨酸,并且X是除了甘氨酸和脯氨酸以外的氨基酸残基),
[结构式2]
Gly-Y-Hyp
(在结构式2中,Gly是甘氨酸,Y是除了甘氨酸和羟脯氨酸以外的氨基酸残基,并且Hyp是羟脯氨酸)。
α链可以是α1链或α2链中的至少一者。
β链可以是α1链和α1链的二聚体、α1链和α2的二聚体链、或α2链与α2链的二聚体。
γ链可以是α1链、α1链和α2链的三聚体。
α链的分子量可为100kDa至150kDa,诸如100kDa、105kDa、110kDa、115kDa、120kDa、125kDa、130kDa、131kDa、132kDa、133kDa、134kDa、135kDa、136kDa、137kDa、138kDa、139kDa、140kDa、145kDa或150kDa。
β链的分子量可为180kDa至270kDa。
γ链的分子量可为280kDa至350kDa。
除了α链、β链和γ链之外,本发明的去端肽胶原蛋白还可进一步包含辅助组分(例如,水、盐、缓冲液等)。
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
[等式1]
1.1≤S
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
[等式2]
0.2≤S
(其中S
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
α链的第一峰是α1链的峰,而α链的第二峰是α2链的峰。α链的峰的次序是基于洗脱时间区分的。也就是说,α链的第一峰的洗脱时间比α链的第二峰的洗脱时间更快。
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
当通过高效液相色谱法(HPLC)分析本发明的去端肽胶原蛋白时,S
对于高效液相色谱法(HPLC)分析,可以使用填充有硅固定相的反相C18柱,该硅固定相结合有十八烷基官能团,但是对该反相C18柱的类型没有限制,只要其能够分析样品即可。
根据一个实施方式,可以在下表1的条件下执行高效液相色谱法(HPLC)分析。
[表1]
可以改变高效液相色谱法分析条件以获得最佳分析,但是这些不会改变本发明的去端肽胶原蛋白的性质。作为高效液相色谱法分析的结果获得的图可以在纵轴上表示检测量或检测强度,并在横轴上表示洗脱时间。
根据一个实施方式,S
如上所述,本发明的去端肽胶原蛋白的β链含量高于α2链含量。然而,在传统去端肽胶原蛋白中,与总去端肽胶原蛋白相比的β链含量低于α2链含量(在传统去端肽胶原蛋白的情况下,β链的峰面积(S
本发明的去端肽胶原蛋白可以是通过于1至10℃下用蛋白酶处理哺乳动物源性真皮0.5至12小时而获得的去端肽胶原蛋白。
本发明的去端肽胶原蛋白可以是通过于18至30℃下用蛋白酶处理哺乳动物源性真皮小于3小时而获得的去端肽胶原蛋白。
本发明的去端肽胶原蛋白可以通过用蛋白酶处理哺乳动物源性真皮并使该经处理的哺乳动物源性真皮于1至15℃反应12小时或更短并于18至30℃反应小于3小时来获得。
蛋白酶可以每100g真皮0.1×10
本发明的去端肽胶原蛋白可以通过包括以下的方法生产:用蛋白酶处理哺乳动物源性真皮;将氢氧化钠溶液添加至经蛋白酶处理的真皮中并在8至9的范围内调整pH,以使蛋白酶失活;以及用酸性溶液处理其中蛋白酶失活的样品,以将样品的pH调整到3至4的pH调整步骤。
本发明的去端肽胶原蛋白可以来源于哺乳动物,并且该哺乳动物可以是人、猪、牛、鸡等。本发明的去端肽胶原蛋白可以来源于哺乳动物的组织,并且该组织可以是皮肤、尾巴、软骨、骨骼、肌腱、韧带等。
本发明的去端肽胶原蛋白可以配制成多种形式,例如,为水溶液、分散体、凝胶、粉末、片剂、贴剂、膜、海绵、泡沫或基质形式。
进一步地,本发明提供了一种用于生产去端肽胶原蛋白的新型方法。
上述生产方法可包括(a)用蛋白酶处理哺乳动物真皮样品。
在用蛋白酶处理的步骤中,哺乳动物可以是人、猪、牛、鸡等。在用蛋白酶处理的步骤中,真皮可以从尾巴、软骨、骨骼、肌腱或韧带获得。蛋白酶可以是胃蛋白酶、木瓜蛋白酶、碱性蛋白酶(alkalase)和过氧化氢酶中的至少一者。根据一个实施方式,蛋白酶可以是胃蛋白酶。可以在将乙酸添加至哺乳动物的真皮中的同时将真皮样品匀化。
在用蛋白酶处理的步骤中,蛋白酶可以以下量用于处理:每100g真皮0.1×10
在用蛋白酶处理的步骤中,蛋白酶可以用于1至30℃、1至25℃、1至15℃、1至10℃、1至8℃、2至6℃、或3至5℃进行处理。进一步地,根据一个实施方式,蛋白酶可用于在4℃进行处理。在用蛋白酶处理的步骤中,蛋白酶可用于处理达24小时或更短时间。例如,蛋白酶用于处理达0.1至24小时、0.2至20小时、0.3至18小时、0.4至16小时、0.5至12小时、1至5小时、或1.5至3小时。
在用蛋白酶处理的步骤中,蛋白酶可用于在1至15℃处理达12小时或更短时间。根据一个实施方式,蛋白酶可用于在4℃处理达1.5小时至11.5小时(例如,于4℃处理达1.5至3小时、4.5小时、11.5小时)。根据一个实施方式,当蛋白酶于4℃使用达少于13小时,例如0.5小时至12小时时,即使不进行蛋白酶灭活过程,也可以获得β链含量高于α2链含量的本发明的去端肽胶原蛋白。
在用蛋白酶处理的步骤中,蛋白酶可以于18至30℃处理达小于3小时。根据一个实施方式,蛋白酶可以于18至24℃使用达1.5小时。根据一个实施方式,当使用蛋白酶来在RT(室温)下处理达少于3小时时,即使不进行蛋白酶灭活过程,也可以获得β链含量高于α2链含量的本发明的去端肽胶原蛋白。
在用蛋白酶处理的步骤中,蛋白酶可用于在1至15℃处理达12小时或更短时间,或于18至30℃处理达小于3小时。根据一个实施方式,蛋白酶可以于4℃处理达1.5至11.5小时,或在室温下处理达小于3小时。
由此,对于本发明的去端肽胶原蛋白,α链、β链和γ链的含量比率可以根据蛋白酶用于在用蛋白酶处理的步骤中进行处理所处的条件进行调整。根据一个实施方式,α链、β链和γ链的含量比率可以通过改变用蛋白酶处理的步骤中的所用的胃蛋白酶的量、反应温度或时间来调整。
上述生产方法可进一步包括:(b)使真皮样品中的蛋白酶失活。
蛋白酶失活步骤可包括将碱性溶液(例如,氢氧化钠溶液)添加至经蛋白酶处理的真皮样品中以使蛋白酶失活。根据一个实施方式,当进行蛋白酶失活步骤时,可以确认可以获得β链含量高于α2链含量的本发明的去端肽胶原蛋白。
蛋白酶失活步骤可于1至10℃、1至8℃、1至5℃、或1至4℃进行。
蛋白酶失活步骤可用于通过将碱性溶液添加至经蛋白酶处理的真皮样品中将pH调整至8至12、8至11、8至10、或8至10。
氢氧化钠溶液的浓度可为1M至28M、1M至25M、1M至20M、1M至15M、或1M至10M。
上述生产方法可进一步包括:(c)通过用酸性溶液处理其中蛋白酶失活的样品,将该样品的pH调整到3至4的pH调整步骤。
因此,本发明的去端肽胶原蛋白可以通过包括蛋白酶失活步骤和pH调整步骤两者的方法来生产,使得可以调整α链、β链、γ链的含量比率。
上述生产方法可进一步包括:(d)将氯化钠溶液添加到经pH调整的真皮样品的上清液中并获得沉淀物。
真皮样品的上清液可为已去除脂肪或杂质的上清液。
在沉淀物获得步骤中,可以通过将pH调整到3至4的样品离心来收集上清液,与此同时脂肪和杂质可以通过离心去除。
上述生产方法可进一步包括:(e)洗涤和/或过滤沉淀物。通过该过滤步骤,可以获得更高纯度的经纯化的去端肽胶原蛋白。
可以将通过上述生产方法获得的去端肽胶原蛋白和/或经纯化的去端肽胶原蛋白冻干并储存。
根据一个实施方式,本发明的去端肽胶原蛋白可以是通过将通过上述方法制备的去端肽胶原蛋白或经纯化的去端肽胶原蛋白溶解在酸中,之后在添加缓冲液的同时进行渗滤而获得的去端肽胶原蛋白分散体。
根据一个实施方式,本发明的去端肽胶原蛋白可以是通过将通过上述方法制备的去端肽胶原蛋白溶解,然后冻干并储存在酸中,之后在添加缓冲液的同时进行渗滤而获得的去端肽胶原蛋白分散体。
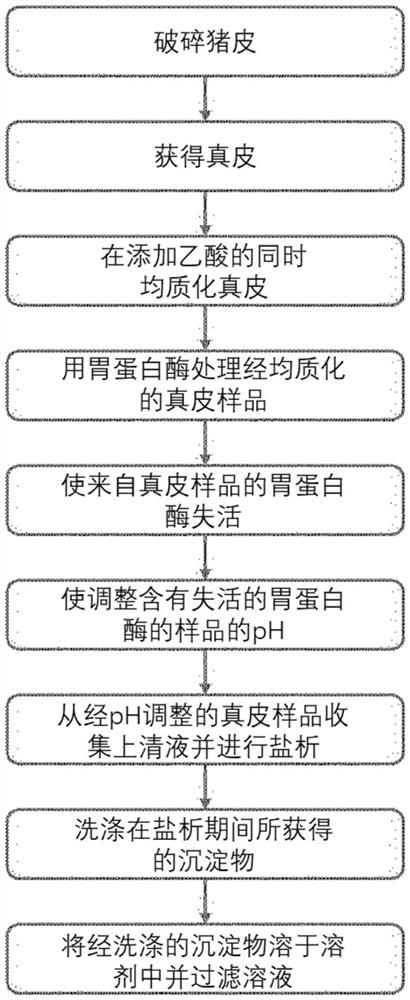
根据一个实施方式,本发明的去端肽胶原蛋白可以通过包括以下的方法生产:将猪皮破碎;从该猪皮中获得真皮;将乙酸添加至所获得的真皮并均质化该混合物;用胃蛋白酶处理经均质化的真皮样品;使该真皮样品中的胃蛋白酶失活;调整该胃蛋白酶失活的样品的pH;从该经pH调整的真皮样品收集上清液,在该上清液中脂肪或杂质已被去除;将氯化钠溶液添加至该所收集的上清液中,然后进行盐析以获得沉淀物;用乙醇洗涤该所获得的沉淀物;以及将该经洗涤的沉淀物溶解在溶剂中并对该溶液进行过滤(参见图4)。
进一步地,本发明提供了一种药物递送系统,该药物递送系统包含去端肽胶原蛋白。
本发明的药物递送系统可以包括上述去端肽胶原蛋白和负载在该去端肽胶原蛋白中的生理活性物质。本发明的药物递送系统可用于递送生理活性物质。
本发明的药物递送系统可以配制成多种形式,诸如分散体、凝胶、粉末、片剂、贴剂、膜、海绵、泡沫、基质等。
在本发明的药物递送系统中,去端肽胶原蛋白可以是固体去端肽胶原蛋白结构。
在本发明的药物递送系统中,去端肽胶原蛋白可以是具有多个孔隙的去端肽胶原蛋白结构。
关于本发明的药物递送系统,其物理性质(例如,孔隙的大小、孔隙之间的开度、生物降解速率、药物负载量、药物负载方式、药物释放速率、初始药物释放速率、药物释放曲线等)可根据药物递送系统中所包含的去端肽胶原蛋白的α1链、α2链、β链和γ链的含量比率进行调节。
考虑到根据本发明的药物递送系统的临床应用条件(例如,所负载的药物、所植入的身体部位、适应性等),可以调节物理性质以显示出最佳的药物功效。
关于使用本发明的去端肽胶原蛋白制备的具有多个孔隙的去端肽胶原蛋白结构,孔隙的平均直径小于使用常规去端肽胶原蛋白产生的结构的孔隙的平均直径,在常规去端肽胶原蛋白中通过与上述相同的方法,β链的含量基本上等于或小于α2链的含量(参见表3和图26)。根据一个实施方式,孔隙的平均直径可为10μm至100μm、20μm至90μm、30μm至80μm、或3μm至75μm。使用本发明的去端肽胶原蛋白制备的具有多个孔隙的去端肽胶原蛋白结构可以是在两侧上具有开放孔隙的结构。
使用本发明的去端肽胶原蛋白制备的固体去端肽胶原蛋白结构的拉伸强度小于使用常规去端肽胶原蛋白以相同方式形成的结构的拉伸强度,在该常规去端肽胶原蛋白中β链的含量基本上等于或小于α2链的含量。根据一个实施方式,使通过冻干本发明的去端肽胶原蛋白而制备的宽度为20mm、长度为3mm并且厚度为2mm的去端肽胶原蛋白结构在该结构的纵轴方向上以10.0mm/min的速度经受均匀张力的施加,之后测量最大张力,直到该材料被切断,使得所测量的拉伸强度可以在0.05N/mm
本发明的去端肽胶原蛋白具有比常规去端肽胶原蛋白更高的粘性,在该常规去端肽胶原蛋白中β链的峰的面积(S
由本发明的去端肽胶原蛋白制备的固体去端肽胶原蛋白结构和/或包含该固体去端肽胶原蛋白结构的药物递送系统显示出高粘度,并且可植入体内并易粘附至身体。进一步地,由本发明的去端肽胶原蛋白制备的固体去端肽胶原蛋白结构和/或包含该固体去端肽胶原蛋白结构的药物递送系统表现出高粘度,并且因此可以植入体内并且可以容易地弯曲。此外,它可以容易地粘附至弯曲区域(例如,体内的移植部位)。
包含本发明的去端肽胶原蛋白的药物递送系统可以减少所负载的生理活性物质的快速初始释放,或可以调节由于过低的初始释放而导致的生理活性物质的效应降低。包含本发明的去端肽胶原蛋白的药物递送系统可将所负载的生理活性物质的持续释放时间调整至最佳范围。
与使用常规去端肽胶原蛋白制备的药物递送系统相比,使用本发明的去端肽胶原蛋白制备的药物递送系统可以抑制所负载的生理活性物质释放得太慢,由此可以增强生理活性物质的功效,在该常规去端肽胶原蛋白中β链的峰的面积(S
生理活性物质可以是已知物质,并且可以是低分子量化合物、高分子量化合物、适体、核酸、核苷酸、蛋白质或多肽。
生理活性物质可包括抗癌剂、抗生素等,但不限于此。进一步地,可以使用任何类型的药学上可接受的生理活性物质,而对其没有限制。可以负载一种类型的生理活性物质,或者可以负载一种或多种类型的生理活性物质。
抗癌药可包括烷基化剂,诸如环磷酰胺、异环磷酰胺、丙卡巴肼、白消安、卡莫司汀、洛莫司汀、达卡巴嗪、顺铂等。抗癌药可包括抗代谢物,诸如氨甲蝶呤、氟尿嘧啶(5-氟尿嘧啶)、卡培他滨、胞嘧啶阿拉伯糖苷、吉西他滨等。抗癌剂可包括基于长春花生物碱的天然物质,诸如长春花碱、长春新碱等。抗癌剂可包括紫杉烷类药物,诸如紫杉醇、多西紫杉醇等。作为表鬼臼毒素药物,可以包含依托泊苷等。抗癌剂可包括喜树碱类药物,诸如托泊替康、伊立替康等。抗癌剂可包括抗肿瘤抗生素,诸如丝裂霉素(丝裂霉素-C)、柔红霉素、多柔比星、博莱霉素等。抗癌剂可包括基于酶的药物,诸如天冬酰胺酶等。抗癌剂可包括基于尿素的药物,诸如羟基脲等。作为酪氨酸激酶抑制剂,可以包含利妥昔单抗、曲妥珠单抗、伊马替尼、吉非替尼、厄洛替尼等。抗癌剂可包括欧狄沃(Opdivo)、可瑞达(Keytruda)、Yervoy、Tishentric、Kymria、Yescata等作为免疫抗癌剂。进一步地,抗癌剂可以是药学上可接受的盐或水合物的形式。
本发明的药物递送系统可以植入体内或注射入体内。
本发明的药物递送系统可以附接至、施加至或插入至手术后处于开放状态的手术部位。根据一个实施方式,本发明的药物递送系统可以附接至、施加至或插入至在癌症手术后处于开放状态的癌症切除部位。根据一个实施方式,本发明的药物递送系统可以附接至、施加至或插入至在癌症手术后处于开放状态的剩余癌症部位。
本发明的药物递送系统可以皮下地植入。本发明的药物递送系统可以粘附或施加至皮肤或粘膜。本发明的药物递送系统可插入口腔、胃肠道等中。
本发明的药物递送系统可以通过任何已知的用于制造药物递送系统的方法来生产。
根据一个实施方式,本发明的药物递送系统可以通过包括以下步骤的方法制备:
将按重量计0.5%至3%(“重量%”)的本发明的去端肽胶原蛋白添加至乙酸钠溶液中,并在维持pH为2至4的同时进行搅拌;以及
将缓冲液添加至已添加去端肽胶原蛋白的乙酸钠溶液(在下文中,去端肽胶原蛋白-乙酸钠溶液)中,并用缓冲液置换该乙酸钠溶液以便获得去端肽胶原蛋白-缓冲液(在下文中,去端肽胶原蛋白分散体)。
该用于生产药物递送系统的方法可进一步包括将生理活性物质分散于在上述步骤中获得的去端肽胶原蛋白分散体中。
缓冲液可以是磷酸盐缓冲盐水(PBS)。
在获得去端肽胶原蛋白分散体的步骤中,可使用切向流过滤系统(Minimate
图5是示出通过切向流过滤装置(Minimate TFF系统)用去端肽胶原蛋白-缓冲液置换去端肽胶原蛋白-乙酸钠溶液的方法的示意图。
本发明提供了一种癌症转移抑制剂,该癌症转移抑制剂包含上述去端肽胶原蛋白。
本发明的癌症转移抑制剂可以包含上述去端肽胶原蛋白和负载在该去端肽胶原蛋白中的抗癌剂。
该抗癌剂可以是低分子量化合物、高分子量化合物、核酸、肽、蛋白质或适体。抗癌剂的含量已在上面进行了描述,并且因此将不再详细描述。
癌症可以是胰腺癌、乳腺癌、肝癌、头颈癌、结直肠癌、卵巢癌或胶质母细胞瘤。
癌症转移在癌细胞浸润到组织中时发生,已知细胞外基质和基底膜由基质金属蛋白酶(MMP)(一种蛋白质降解所必需的酶),特别是MMP-2和MMP-9降解,从而导致细胞浸润(参见图6的上部部分)。
如上所述,当将β链含量高于α2链含量的本发明的去端肽胶原蛋白移植到癌症组织中时,出现了转移抑制效应。这可能被认为是因为本发明的去端肽胶原蛋白由MMP-2和MMP-9识别和降解,使得患有癌症疾病的个体的体内存在的细胞外基质和基底膜相对较少被降解(参见图6)。进一步地,由于本发明的去端肽胶原蛋白由MMP-2和MMP-9识别和降解,所以负载在其中的生理活性物质(例如,抗癌剂)被释放,从而导致癌细胞死亡。
另一方面,β链含量等于或小于α2链含量的去端肽胶原蛋白(比较例)即使当被移植到癌组织中,也不会显示出转移抑制效应。这可能被认为是因为β链含量等于或小于α2链含量的去端肽胶原蛋白不能由MMP-2和MMP-9识别和降解,替代地,患有癌症的个体的体内存在的细胞外基质和基底膜由MMP-2和MMP-9分解(参见图7)。
在下文中,将给出一些实例来详细描述本发明。
1)实施例1
将参考图4的流程图说明实施例1中的制备去端肽胶原蛋白的方法。
步骤(1):猪皮准备和破碎步骤
将猪皮用自来水洗涤3次,用初级纯化水洗涤3次,然后分成2kg(20cm×20cm)并储存在-20℃的冷冻器中。在于4℃静置2小时并解冻后,将冷冻的猪皮切成1.5cm×8cm大小,并添加5L的0.5M乙酸,之后静置过夜以确认猪皮溶胀。
步骤(2):获得真皮的步骤
取出溶胀的猪皮,并借助于刀去除猪皮的表皮层和脂肪层以取出真皮,将去除了表皮层和脂肪层的组织(真皮)切成1.5cm×1.5cm的大小。然后,再次向真皮中添加5L新鲜的0.5M乙酸,并且在静置数小时后,通过使用筛子过滤来仅收集真皮。将真皮用10L纯净水洗涤。将该洗涤过程重复总共5次。在向经洗涤的真皮中添加20L的乙醇之后,将混合物于4℃搅拌过夜。在过夜搅拌完成之后,仅回收真皮,添加20L新鲜乙醇,并将混合物再次于4℃搅拌1小时。使用筛子仅回收真皮,并且通过静置约1小时去除乙醇。将去除了脂肪的真皮分成适当的重量(250g)并储存在-80℃的冷冻器中。
步骤(3):均质化真皮的步骤
在向冷冻的真皮(250g)中添加0.625L的0.5M乙酸后,通过静置30分钟来解冻。在此时,0.5M乙酸的体积优选地为0.25L/100g真皮。使用筛子仅回收解冻的真皮并静置约1小时以去除0.5M乙酸。以下均质化步骤于4℃执行。将250g真皮和2L三级蒸馏水放入搅拌机中并粉碎2分钟,然后进一步添加2L纯净水并再次粉碎2分钟。将4L的0.5M乙酸添加到经粉碎的组织中。在此时,0.5M乙酸的体积优选地为4L/250g真皮。再次,使用均化器将组织均质化3分钟。将4.5L的0.5M乙酸进一步添加到均质化的组织中。在使用搅拌器搅拌的同时,检查pH是否为2.5或更低,并且当pH为2.5或更高时,用少量4M盐酸溶液调整pH。使用搅拌器低速搅拌3小时。
步骤(4):用胃蛋白酶处理均质化的真皮样品的步骤
在接下来的胃蛋白酶处理步骤中,于4℃添加1.5×10
步骤(5):灭活胃蛋白酶的步骤
以下胃蛋白酶灭活步骤于4℃执行。向经胃蛋白酶处理的样品中添加10M氢氧化钠溶液,并搅拌以将pH调整至8至9,之后进一步搅拌10分钟以使胃蛋白酶失活。
步骤(6):调整pH的步骤
在通过碱处理使胃蛋白酶失活后,添加4M盐酸溶液并搅拌以将pH调整到3.4,之后进一步搅拌10分钟。
步骤(7)(包括以下步骤(7-1)和(7-2)):收集并盐析经pH调整的皮肤样品的上清液
步骤(7-1):使用离心分离器于4℃以7800rpm离心10分钟,并在去除上清液表面上的脂肪层后收集剩余的上清液。将去除了脂肪层的上清液通过筛子再过滤一次,以仅收集上清液。
步骤(7-2):向最终获得的上清液中缓慢添加5M氯化钠溶液,于4℃搅拌15分钟,然后于4℃静置24小时或过夜以进行盐析。在此时,5M氯化钠溶液的体积优选地为16.3ml/100g上清液重量。在盐析之后,使用离心机于4℃以7800rpm执行离心10分钟。在离心之后,去除上清液以获得沉淀物。
步骤(8)(包括以下步骤(8-1)和(8-2)):洗涤沉淀物的步骤
步骤(8-1):在将1L乙醇/100g添加到在盐析步骤中获得的沉淀物中之后,首先将混合物于4℃通过搅拌洗涤过夜。然后,使用离心机于4℃以7800rpm执行离心10分钟。
步骤(8-2):在离心后,将1L乙醇/100g添加到所获得的沉淀物中,之后于4℃通过搅拌进行第二次洗涤达6小时。在使用离心机于4℃以7800rpm离心10分钟之后获得了产物。
2)实施例2
以与实施例1相同的方式获得产物,但不执行步骤(6)至(8)。
3)实施例3
以与实施例1相同的方式获得产物,但不执行步骤(7)至(8)。
4)实施例4
以与实施例1相同的方式获得产物,但不执行步骤(8)(即,步骤(8-1)和(8-2))。
5)实施例5
以与实施例1相同的方式获得产物,但不执行步骤(8-2)。
6)实施例6
以与实施例1相同的方式获得产物,不同之处在于执行步骤(4)(胃蛋白酶处理步骤)达24小时。
7)实施例7
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(6)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达24小时。
8)实施例8
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(7)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达24小时。
9)实施例9
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8)并且执行步骤(4)(胃蛋白酶处理步骤)达24小时。
10)实施例10
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8-2)并且执行步骤(4)(胃蛋白酶处理步骤)达24小时。
11)实施例11
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达1.5小时。
12)实施例12
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达3小时。
13)实施例13
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达4.5小时。
14)实施例14
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达11.5小时。
15)实施例15
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达1.5小时。
16)实施例16
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(6)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达1.5小时。
17)实施例17
以与实施例1相同的方式制备产物,不同之处在于不执行步骤(7)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达1.5小时。
18)实施例18
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行步骤(7)中的盐析达17小时。
19)实施例19
以与实施例16相同的方式获得产物,不同之处在于不执行步骤(8-2),并且进行步骤(7)中的盐析达17小时。
20)实施例20
以与实施例1相同的方式获得产物,不同之处在于执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行盐析达17小时。
21)实施例21
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行步骤(7)中的盐析达0.25小时。
22)实施例22
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行步骤(7)中的盐析达1.5小时。
23)实施例23
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行步骤(7)中的盐析达11.4小时。
24)实施例24
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行步骤(7)中的盐析达14.2小时。
25)实施例25
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),执行步骤(4)(胃蛋白酶处理步骤)达1.5小时,并且进行步骤(7)中的盐析达17小时。
26)实施例26
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
27)实施例27
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(6)至(8),并且在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
28)实施例28
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(7)至(8),并且在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
29)实施例29
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
30)实施例30
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
31)实施例31
以与实施例1相同的方式获得产物,不同之处在于在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
32)实施例32
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
33)实施例33
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
34)实施例34
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
35)实施例35
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
36)实施例36
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),在步骤(4)(胃蛋白酶处理步骤)中添加0.75×10
37)实施例37
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时。
38)实施例38
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(6)至(8),并且步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时。
39)实施例39
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(7)至(8),并且步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时。
40)实施例40
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达17小时。
41)实施例41
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8-2),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达17小时。
42)实施例42
以与实施例1相同的方式获得产物,不同之处在于步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行盐析达17小时。
43)实施例43
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且于4℃执行步骤(4)(胃蛋白酶处理步骤)达8小时。
44)实施例44
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且步骤(4)(胃蛋白酶处理步骤)于4℃执行达8小时并且在RT(室温)下执行达2.68小时。
45)实施例45
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(7-2)和步骤(8),并且步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时。
46)实施例46
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达5小时。
47)实施例47
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达10小时。
48)实施例48
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达12.5小时。
49)实施例49
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达14小时。
50)实施例50
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),并且步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达15小时。
51)实施例51
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),步骤(4)(胃蛋白酶处理步骤)于4℃执行达1.5小时并且在RT(室温)下执行达2.68小时,并且进行步骤(7)中的盐析达17小时。
52)比较例1
在比较例1中制备市售的去端肽胶原蛋白(Matrixen-PSP,SK Bioland)。
53)比较例2
在比较例2中制备市售的去端肽胶原蛋白(
54)比较例3
以与实施例1相同的方式获得产物,但不执行步骤(5)至(8)。
55)比较例4
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达24小时。
56)比较例5
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且执行步骤(4)(胃蛋白酶处理步骤)达13小时。
57)比较例6
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达20小时。
58)比较例7
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(6)至(8),在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达20小时。
59)比较例8
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(7)至(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达20小时。
60)比较例9
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达20小时。
61)比较例10
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(8-2),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达20小时。
62)比较例11
以与实施例1相同的方式获得产物,不同之处在于在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达20小时。
63)比较例12
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达3小时。
64)比较例13
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达4.5小时。
65)比较例14
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达11.5小时。
66)比较例15
以与实施例1相同的方式获得产物,不同之处在于不执行步骤(5)至(8),并且在RT(室温)下执行步骤(4)(胃蛋白酶处理步骤)达13小时。
(1)高纯度去端肽胶原蛋白的生产
将0.02M尿素溶液添加到在上述“1.去端肽胶原蛋白(AC)的制备”的实施例和比较例中制备的产品中的每种产品中,之后将其于4℃搅拌过夜。在此时,0.02M尿素溶液的体积优选地为1.4L/100g去端肽胶原蛋白。使用Centramate切向流过滤(TFF)系统或Minimate切向流过滤系统(Minimate TFF系统)对去端肽胶原蛋白溶液进行超滤和渗滤,以获得高纯度的去端肽胶原蛋白。在搅拌的同时将0.5M氢氧化钠溶液添加到所获得的去端肽胶原蛋白溶液中以达到pH 7。将所制备的中性去端肽胶原蛋白在拉链袋中薄且扁平地细分,并储存于-80℃的超低温(“低温”)冷冻器中。在冻干机中预冻(-40℃)至少1小时后,将保存在-80℃低温冷冻器中的去端肽胶原蛋白放入该冻干机中冷冻干燥(即,冻干)。在冻干完成后,将去端肽胶原蛋白切成合适的大小,真空包装,然后在合适的温度下冷藏。
(2)具有中性pH的去端肽胶原蛋白溶液的制备
通过将2.4g的乙酸钠(CH
使用Minimate
(3)具有中性pH的去端肽胶原蛋白溶液中的去端肽胶原蛋白的纯度的确认
使用SDS-PAGE电泳,对在上述“2.(2)具有中性pH的去端肽胶原蛋白溶液的制备”中制备的去端肽胶原蛋白溶液中的去端肽胶原蛋白的纯度进行确认。具体地,将在上述“2.(1)高纯度去端肽胶原蛋白的生产”的实施例1中制备的产物在0.5M乙酸溶液中以0.3重量%溶解,并用作对照。将在上述“2.(2)具有中性pH的去端肽胶原蛋白溶液的制备”中制备的去端肽胶原蛋白溶液(具有中性pH的去端肽胶原蛋白样品)在0.5M乙酸溶液进行10倍稀释,以制备去端肽胶原蛋白分析样品。将5X样品缓冲液与该样品混合以变成1X,并于85℃加热5分钟。对在6%SDS-PAGE凝胶上制备的样品进行上样和电泳。电泳在90V下进行30分钟,然后将电压增加到120V并显影,直到75kDa大小的凝胶标记物下落到凝胶的底部。当样品在凝胶上完全分离时,取出凝胶并用考马斯亮蓝R250染色溶液(BIO-RAD)在室温下染色2小时或于4℃染色16小时。将在摇摆器上染色的凝胶用脱色溶液洗涤,使得去端肽胶原蛋白条带清晰可见。通过上述分析方法,可以确认上述2.(2)中制备的去端肽胶原蛋白样品的纯度(参见图8)。
(1)在HPLC分析中去端肽胶原蛋白的各链的分布的确认
使用高效液相色谱(HPLC)仪器,制备去端肽胶原蛋白样品,然后执行SDS-PAGE分析以确认HPLC分析中的去端肽胶原蛋白链分布。
以5.0μg/μl的浓度制备含去端肽胶原蛋白的0.5M乙酸溶液,并使用Agilent HPLC仪器和UV检测器(220nm)作为检测器进行分析。使用反相柱RP C18柱、流动相将柱设置为梯度,该流动相包括缓冲液A:0.1%TFA的DW溶液和缓冲液B:0.1%TFA的ACN溶液,并且流率为1ml/min。首先,注入30μl的去端肽胶原蛋白样品以确认色谱图中的四个去端肽胶原蛋白峰。注入100μl的去端肽胶原蛋白样品,并且仅对色谱图中保留时间为11分钟至14.5分钟的峰进行分级,然后对该级分进行再分析以确认峰分离度。在确认了分离程度的级分中,仅收集去端肽胶原蛋白主峰,并通过SDS-PAGE对每个峰进行分析。
作为分析的结果,可确认具有最短洗脱时间的峰1是γ链的峰,具有第二短洗脱时间的峰2是α1链的峰,并且具有第三短洗脱时间的峰3是β链的峰,并且具有最长洗脱时间的峰4是α2链的峰(参见图9)。
(2)通过HPLC分析比较去端肽胶原蛋白的链含量
通过将上述“2.(1)高纯度去端肽胶原蛋白的生产”的实施例和比较例中的每种高纯度产物溶解在0.5M乙酸溶液中,以2.5μg/μl的浓度制备分析样品。
在分析条件中,使用Agilent HPLC仪器并使用UV检测器(220nm)作为检测器。使用反相柱RP C18柱和流动相将柱设置为梯度,该流动相包括缓冲液A:0.1%TFA的D.W溶液和缓冲液B:0.1%TFA的ACN溶液,并且该流动相的流率为1ml/min。
作为实施例和比较例的通过高效液相色谱法分析测量脊(包括对应于每条链的峰)下的面积的结果,实施例1至实施例51显示β链的峰的面积(S
更具体地,关于市售的去端肽胶原蛋白(比较例1和比较例2),β链含量几乎等于或小于α2链含量,而本发明的去端肽胶原蛋白的β链含量比α2链更大,其中β链相对于α2链的含量为1.1或更大且5或更小(参见图10至图11)。
进一步地,证实了通过执行使胃蛋白酶失活的步骤(实施例1中所述的步骤(5))生产的去端肽胶原蛋白的β链相对于α2链的含量高于其他情况(图12、图13、图16、图19和图24)。
即使不执行使胃蛋白酶失活的步骤(实施例1中所述的步骤(5)),当胃蛋白酶处理步骤(实施例1中所述的步骤(4))于4℃执行达小于13小时时,也可以确认β链相对于α2链的含量较大。另一方面,当执行胃蛋白酶处理步骤达13小时或更长时间时,α2链的含量大于β链的含量(参见图14和图22)。
即使不执行使胃蛋白酶失活的步骤(实施例1中所述的步骤(5)),当胃蛋白酶处理步骤(实施例1中所述的步骤(4))在室温下执行达小于3小时时,也可以确认β链相对于α2链的含量增加。另一方面,当在室温下执行胃蛋白酶处理步骤达3小时或更长时间时,α2链的含量高于β链的含量(参见图15、图17和图19)。
进一步地,通过执行上述实施例和比较例中的所有步骤(1)至(8)获得的去端肽胶原蛋白(实施例和比较例)中的每条链的含量以及β链:α2链的比率示于下表2中。
[表2]
根据上述分析结果,i)在去端肽胶原蛋白生产期间使胃蛋白酶灭活(实施例1中所述的步骤(5))和/或在使胃蛋白酶灭活之后调整pH(实施例1中所述的步骤(6)),或ii)在包括特定温度和反应时间(例如,于4℃达小于13小时,或在RT(室温)下达小于3小时)的特定条件下用胃蛋白酶处理真皮(实施例1中所述的步骤(4)),可使得能够生产β链含量高于α2链的去端肽胶原蛋白。根据上述结果,确认了去端肽胶原蛋白中的β链:α2链的比率可以取决于去端肽胶原蛋白的生产过程中是否执行特定步骤或胃蛋白酶处理条件(胃蛋白酶处理时间、胃蛋白酶处理温度等)来调整。
以与上述“2.(3)具有中性pH的去端肽胶原蛋白溶液中的去端肽胶原蛋白的纯度的确认”中相同的方式执行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。作为使用ImageJ程序测量从上述分析获得的凝胶图像的相对凝胶带强度的结果,确认了实施例1的β链的带厚度明显比比较例1或比较例2的β链的带厚度更厚。也就是说,确认了实施例的去端肽胶原蛋白的β链含量比比较例的去端肽胶原蛋白的β链含量更大(参见图25)。
(1)固体去端肽胶原蛋白结构的形成
将实施例和比较例中的每一者中制备的高纯度去端肽胶原蛋白倒入硅胶模具中,并冻干以形成固体去端肽胶原蛋白结构。
具体地,将预定量的高纯度去端肽胶原蛋白溶液分配到硅胶模具中。首先将分配了去端肽胶原蛋白溶液的硅胶模具于-20℃冷冻4小时或更长时间。在第一次冷冻完成之后,将样品从硅胶模具中分离出来,并转移到无菌培养皿或平板,然后于-80℃冷冻达2小时或更长时间。在预冷冻以使得冻干机的冷阱温度达到-80℃之后,将去端肽胶原蛋白样品放入该冻干机中并冻干至少16小时。将冻干的固体去端肽胶原蛋白结构于4℃冷藏。
(2)通过扫描电子显微镜(SEM)观察去端肽胶原蛋白的结构
使用扫描电子显微镜(SEM),确认了去端肽胶原蛋白的结构是否根据去端肽胶原蛋白的β链于α2链的比率而改变。具体地,将实施例1、实施例42、实施例31、比较例1和比较例2的每一者中的去端肽胶原蛋白溶液冻干,以制备直径为10mm并且高度为5mm的圆形样品。在使用铂涂覆装置涂覆所制备的样品的表面之后,将经涂覆的样品放入SEM腔室中,之后对该样品施加10.0kV至15.0kV的高压,然后以50X、500X和1000X的放大倍率测量样品的表面、横侧和底部。此后,测量在相同放大倍数下所制备的样品的孔径,并计算孔隙的平均直径和标准偏差。
作为测量的结果,确认了实施例1、实施例42和实施例31的所有去端肽胶原蛋白样品都具有两侧敞开的孔隙,并且随着β链相对于α2链的含量增加,孔隙的平均直径减小(参见图26和表3)。另一方面,比较例1包含一侧封闭的孔隙,并且比较例2包含一侧宽并且另一侧窄的孔隙,而比较例1和比较例2的孔隙的平均直径明显大于实施例的孔隙的平均直径。这些结果表明,物理性质可取决于β链与α2链的含量比而变化。
[表3]
(3)去端肽胶原蛋白的拉伸强度的测量
研究了去端肽胶原蛋白的强度是否根据去端肽胶原蛋白的β链与α2链的比率而变化。
将实施例1和实施例31的去端肽胶原蛋白溶液以及比较例2的去端肽胶原蛋白溶液冻干,以制备大小为20mm×3mm×2mm的用于拉伸强度测试的各测试材料。使用拉伸压缩测试仪(MCT-1150),在测试材料纵轴方向上以10.0mm/min的速度均匀地施加张力,以测量直到材料断裂时的最大张力,从而计算拉伸强度强度(最大应力)和拉伸应变(最大拉伸应变)。观察到了β链含量大于α2链含量的实施例与β链含量小于α2链含量的比较例之间的拉伸强度和拉伸应变值的显著差异(参见表4,以及图28至图30)。
[表4]
(4)去端肽胶原蛋白的粘度测量
研究了去端肽胶原蛋白的粘度是否根据去端肽胶原蛋白的β链与α2链的比率而变化。
具体地,将实施例1、实施例42和实施例31的去端肽胶原蛋白溶液以及比较例2的去端肽胶原蛋白制备成具有为1.0%的胶原蛋白浓度和为6.8至7.4的pH(中性)。使用旋转流变仪(TA instrument Ltd.,ARES-G2)测量所制备的去端肽胶原蛋白溶液于10℃的粘度η(Pa·s)。确认了在剪切速率1(1/s)条件下,实施例1具有比比较例2更高的粘度η。随着β链与α2链含量的比率增加,实施例1、实施例42和实施例31在相同条件下的粘度η略微降低(参见表5)。
[表5]
(1)固体去端肽胶原蛋白药物递送系统的生产
将实施例和对比例中制备的高纯度去端肽胶原蛋白与药物混合,倒入圆形硅胶模具中并冻干,从而制备其中负载有药物(吉西他滨或[GRO-适体和吉西他滨缀合物])的固体去端肽胶原蛋白药物递送系统。对于[GRO-适体和吉西他滨缀合物],使用其中(Gem)
具体地,在将药物(例如,吉西他滨或[GRO-适体和吉西他滨缀合物])添加到高纯度去端肽胶原蛋白中之后,使用多用混合器(SLRM-3,MYLAB)将此在室温下均匀混合30分钟。此后,将去端肽胶原蛋白-药物混合物以恒定量分配在圆形硅胶模具中(图31中的上部照片)。首先将分配了去端肽胶原蛋白-药物混合物的圆形硅胶模具于-20℃冷冻4小时或更长时间。在一次冷冻完成之后,将样品从圆形硅胶模具中分离出来,并转移到无菌培养皿或平板,然后于-80℃冷冻达2小时或更长时间。在预冷冻直到冻干机的冷阱温度达到-80℃之后,将去端肽胶原蛋白样品放入该冻干机中并冻干达16小时或更长时间(图31中的左下侧照片)。将冻干的固体去端肽胶原蛋白药物递送系统于4℃冷藏。
(2)使用扫描电子显微镜(SEM)观察去端肽胶原蛋白药物递送系统的结构
使用扫描电子显微镜(SEM),确认了负载有药物的去端肽胶原蛋白药物递送系统的结构是否根据去端肽胶原蛋白的β链与α2链的比率而改变。将实施例1、实施例42、实施例31、比较例1和比较例2的每一者中的去端肽胶原蛋白溶液与[GRO-适体和吉西他滨缀合物]混合,并将溶液冻干以制备直径为10mm并且高度为5mm的圆形样品。在使用铂涂覆装置涂覆所制备的样品的表面之后,将经涂覆的样品放入SEM腔室中,之后施加15.0kV的高压并以50X、100X、200X、500X、1000X和2000X的放大倍率测量样品的表面、横侧和底部。此后,测量在相同放大倍数下所制备的样品的孔径,并计算孔隙的平均直径和标准偏差。
作为测量的结果,确认了负载有药物的实施例1的去端肽胶原蛋白样品具有两侧敞开的孔隙,并且随着β链相对于α2的含量增加,孔隙的平均直径减小(参见图27和表6)。另一方面,比较例1和比较例2包含一侧宽并且另一侧窄的孔隙。这些结果表明,物理性质可取决于β链与α2链的含量比而变化。
[表6]
(3)去端肽胶原蛋白药物递送系统的药物释放测试
研究了去端肽胶原蛋白药物递送系统的药物释放模式是否根据去端肽胶原蛋白的β链与α2链的比率而改变。
通过与上述“6.(1)“固体去端肽胶原蛋白药物递送系统的生产”相同的方法,但是在冻干后,使用丙烯酸板将去端肽胶原蛋白样品压缩成贴剂形式(图31中的右下侧照片)。制备贴剂型去端肽胶原蛋白药物递送系统以在每贴剂型去端肽胶原蛋白药物递送系统中负载2mg的[GRO-适体和吉西他滨缀合物]。更具体地,将实施例1、实施例42和实施例31中的每一种去端肽胶原蛋白溶液与[GRO-适体和吉西他滨缀合物]混合以制备溶液,之后冻干以制备直径为10mm的贴剂型去端肽胶原蛋白药物递送系统。在此之后,将贴剂型去端肽胶原蛋白药物递送系统添加至洗脱液中,然后测量每个时间段于37℃洗脱的药物。作为通过UV测量在绝对260mm下释放的[GRO-适体和吉西他滨缀合物]的浓度的结果,确认了随着β链含量的增加,药物被逐渐释放(参见图38)。
在实施例1的去端肽胶原蛋白上负载有药物的贴剂型药物递送系统与在比较例2的去端肽胶原蛋白上负载有药物的贴剂型药物递送系统之间比较了药物释放对抑制癌细胞死亡和转移的影响。
作为实验的结果,从实施例1的去端肽胶原蛋白制备的贴剂型药物递送系统表现出优异的抑制胰腺癌和转移的效应,而由比较例2的去端肽胶原蛋白制备的贴剂型药物递送系统具有低胰腺癌抑制效应并且确认发生了至腹腔中的其他组织的转移,即发生至肝、肾和腹膜的转移。这被认为是因为导致癌症转移的MMP-2和MMP-9可以很好地识别本发明的去端肽胶原蛋白(实施例),因此用本发明的去端肽胶原蛋白(实施例)制备的贴剂型药物递送系统可以容易地被降解,由此以释放药物。另一方面,由于MMP-2和MMP-9不能很好地识别比较例的去端肽胶原蛋白,因此由比较例的去端肽胶原蛋白制备的贴剂型药物递送系统不能很好地分解,并且因此药物可能不容易被吸收,因此预期癌细胞死亡和转移抑制效应不良(参见图6和图7)。
确认从贴剂型去端肽胶原蛋白药物递送系统释放所负载的药物的效应以及贴剂型去端肽胶原蛋白药物递送系统的肿瘤抑制和癌症转移效应的具体实验方法和结果将在以下(1)至(3)中描述。
(1)贴剂型去端肽胶原蛋白药物递送系统的生产
将在上述“2.(2)具有中性pH的去端肽胶原蛋白溶液的制备”中制备的具有中性pH的去端肽胶原蛋白溶液与药物混合,倒入圆形硅胶模具中并冻干以获得负载有药物(吉西他滨或与SEQ ID NO:1的5'末端处的(Gem)
具体地,在将药物(例如,吉西他滨或[GRO-适体和吉西他滨缀合物])添加到中性pH的去端肽胶原蛋白溶液中之后,使用多用混合器(SLRM-3,MYLAB)将此在室温下均匀混合30分钟。此后,将去端肽胶原蛋白-药物混合物以恒定量分配在圆形硅胶模具中(图31中的上部照片)。首先将分配了去端肽胶原蛋白-药物混合物的圆形硅胶模具于-20℃冷冻4小时或更长时间。在第一次冷冻完成之后,将样品从圆形硅胶模具中分离出来,并转移到无菌培养皿或平板,然后于-80℃冷冻达2小时或更长时间。在预冷冻直到冻干机的冷阱温度达到-80℃之后,将去端肽胶原蛋白样品放入该冻干机中并冻干达16小时或更长时间(图31中的左下侧照片)。在使用丙烯酸板将冻干的去端肽胶原蛋白样品压缩成贴剂形式后(图31中的右下侧照片),将其放入铝袋中并密封。将经包装的贴剂型去端肽胶原蛋白药物递送系统于4℃冷藏。
(2)贴剂型去端肽胶原蛋白药物递送系统在胰腺癌细胞系中的药物释放效应
将胰腺癌细胞系BXPC-3培养3天以制备其中MMP-2和MMP-9过表达的培养基(CM培养基),以及不表达MMP-2和MMP-9的培养基(对照培养基)。使用酶谱法研究MMP-2和MMP-9活性(参见图32)。
在过表达MMP-2和MMP-9活性的CM培养基中,研究了从实施例1的去端肽胶原蛋白药物递送系统和比较例2的去端肽胶原蛋白药物递送系统负载的药物([GRO-适体和吉西他滨缀合物])是否很好地释放。所释放的[GRO-适体和吉西他滨缀合物]和吉西他滨的浓度是在绝对260nm下用UV测量的。作为实验的结果,使用实施例1的去端肽胶原蛋白制备的贴剂型药物递送系统在CM介质中比在对照介质中更易溶。因此,确认了药物递送系统中所包含的[GRO-适体和吉西他滨缀合物]和吉西他滨被更有效地释放。通过此可以发现,实施例1的去端肽胶原蛋白由MMP-2和MMP-9很好地识别。进一步地,确认了与比较例2的去端肽胶原蛋白药物递送系统相比,实施例1的去端肽胶原蛋白药物递送系统可以在CM培养基中有效地释放贴剂中所包含的[GRO-适体和吉西他滨缀合物]和吉西他滨(参见图33)。
(3)在胰腺癌小鼠模型中去除残余癌症后贴剂型去端肽胶原蛋白药物系统的肿瘤抑制和转移抑制效应
1)负载有吉西他滨的药物递送系统的肿瘤抑制和转移抑制效应
将其中在实施例1的去端肽胶原蛋白上负载了0.12mg的吉西他滨的贴剂型药物递送系统(下文中,Gem/AC[实施例1]贴剂型药物递送系统)和其中在比较例2去端肽胶原蛋白上负载了0.12mg的吉西他滨的贴剂型药物递送系统(下文中,Gem/AC[比较例2]贴剂型药物递送系统)分别移植到原位胰腺癌小鼠中,以便观察残余肿瘤是否被抑制以及至腹腔中的其他器官的转移是否被抑制。
具体地,制备Balb/c裸小鼠(雄性,6周龄,21只小鼠)和25μl的通过特定载体的取代表达荧光素酶的5×10
2)负载有[GRO-适体和吉西他滨缀合物]的药物递送系统的肿瘤抑制和转移抑制效应
通过与上述“7.(3)-1)负载有吉西他滨的药物递送系统的肿瘤抑制和转移抑制效应”相同的方法,但使用[GRO-适体和吉西他滨缀合物]作为所负载的药物,未观察到对残留肿瘤的抑制和至腹腔内的其他器官的转移是否被抑制。
更具体地,将其中在实施例1的去端肽胶原蛋白上负载有2mg的[GRO-适体和吉西他滨缀合物]的贴剂型药物递送系统(下文中,Gem-适体[实施例1]贴剂型药物递送系统)和其中在比较例2的去端肽胶原蛋白上负载有2mg的[GRO-适体和吉西他滨缀合物]的贴剂型药物递送系统(下文中,Gem-适体[比较例2]贴剂型药物递送系统)分别移植到原位胰腺癌小鼠中,之后观察残余肿瘤的抑制以及至腹腔中的其他器官的转移是否被抑制。结果,在移植有Gem-适体[比较例2]贴剂型药物递送系统的小鼠中,表现出了至脾、腹膜和肾等的癌症转移。另一方面,在移植有Gem-适体[实施例1]贴剂型药物递送系统的小鼠中,确认了没有腹膜内转移并且肿瘤大小也很小(参见图35)。
(1)溶胶-凝胶型去端肽胶原蛋白药物递送系统的生产
在将药物(吉西他滨或[GRO-适体和吉西他滨缀合物])添加到100μL的浓度为0.5%至3.0%的中性pH的去端肽胶原蛋白溶液中之后,使用多用混合器(SLRM-3,MYLAB)将此在室温下均匀混合30分钟。或者,将100μL的浓度为0.5%至3.0%的中性pH的去端肽胶原蛋白溶液和药物分别添加到两个注射器中,然后将这两个注射器连接并通过活塞往复运动均匀地混合。
(2)在胰腺癌小鼠模型中去除残余癌症后溶胶-凝胶型去端肽胶原蛋白药物递送系统的肿瘤抑制和转移抑制效应
1)负载有吉西他滨的药物递送系统的肿瘤抑制和转移抑制效应
通过与上述“7.(3)-1)负载有吉西他滨的药物递送系统的肿瘤抑制和转移抑制效应”相同的方法,但分别将其中在由实施例1的去端肽胶原蛋白制成的溶胶-凝胶中负载有0.12mg的吉西他滨的药物递送系统(在下文中,Gem/AC[实施例1]溶胶-凝胶药物递送系统)和其中在由比较例2的去端肽胶原蛋白制成的溶胶-凝胶中负载有0.12mg的吉西他滨的药物递送系统(在下文中,Gem/AC[比较例2]溶胶-凝胶药物递送系统)注射到原位胰腺癌小鼠中,之后观察残余肿瘤的抑制以及至腹腔中的其他器官的转移是否被抑制。结果,在注射了Gem/AC[比较例2]溶胶-凝胶药物递送系统的小鼠中,表现出了至脾、腹膜等的癌症转移。另一方面,在注射了Gem/AC[实施例1]溶胶-凝胶药物递送系统的小鼠中,确认完全没有腹膜内转移(参见图36)。
2)负载有[GRO-适体和吉西他滨缀合物]的药物递送系统的肿瘤抑制和转移抑制效应
通过与上述“8.(2)-1)负载有吉西他滨的药物递送系统的肿瘤抑制和转移抑制效应”相同的方法,但使用[GRO-适体和吉西他滨缀合物]作为所负载的药物,观察到了对残留肿瘤的抑制和是否发生至腹腔内的其他器官的转移。
将其中在由实施例1的去端肽胶原蛋白制成的溶胶-凝胶中负载有2mg的[GRO-适体和吉西他滨缀合物]的药物递送系统(在下文中,Gem/适体[实施例1]溶胶-凝胶药物递送系统)和其中在由比较例2的去端肽胶原蛋白制成的溶胶-凝胶中负载有2mg的[GRO-适体和吉西他滨缀合物]的药物递送系统(在下文中,Gem/适体[比较例2]溶胶-凝胶药物递送系统)分别注射到原位胰腺癌小鼠中,之后观察残余肿瘤的抑制以及至腹腔中的其他器官的转移是否被抑制。
结果,确认了与注射了Gem/适体[比较例2]溶胶-凝胶药物递送系统的小鼠相比,注射了Gem/适体[实施例1]溶胶-凝胶药物递送系统的小鼠中的肿瘤大小更小(参见图37)。
[附图标记说明]
1、2:具有HPLC峰的脊的面积
10、20、30、40:HPLC峰
a1、a2、a3:具有HPLC峰的脊与脊之间的拐点
b:HPLC色谱图的基线
t10、t20:对应于HPLC峰的洗脱时间
ta1、ta2、ta3:与具有两个HPLC峰的脊之间的拐点对应的洗脱时间
tb1、tb2:与基线和具有HPLC峰的脊的交点对应的洗脱时间
<110> 因特欧力多公司
<120> 新型去端肽胶原蛋白及其用途
<130> 21OP06008PCT
<150> KR 10-2020-0079224
<151> 2020-06-29
<150> KR 10-2021-0084609
<151> 2021-06-29
<160> 1
<170> KoPatentIn 3.0
<210> 1
<211> 30
<212> DNA
<213> 人工序列
<220>
<223> GRO适体
<400> 1
tggtggtggt ggttgtggtg gtggtggtgg 30
- 芽孢杆菌H3、由其发酵鱼皮制备胶原蛋白多肽的用途和胶原蛋白多肽
- 一种去端肽胶原蛋白及其制备方法和应用
- 去端肽胶原及其分离方法、改性去端肽胶原及其制备方法、胶原型基质
