一种鉴定中药材羚羊角及其代用品的MLPA探针组及方法
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于中药材鉴定领域,具体涉及一种快速鉴别中药材羚羊角及其代用品的MLPA探针,本发明还涉及一种快速鉴别中药材羚羊角及其代用品的MLPA方法。
背景技术
羚羊角(Saigae Tataricae Cornu)为牛科动物赛加羚羊(Saiga tataricaLinnaeus)的角,其具有突出的抗炎、解热镇痛、抗惊厥作用及理想的降压作用,在临床上用于肝风内动、惊痫抽搐、癫痫发狂、头痛眩晕、高热痉厥、妊娠子痫、痈肿疮毒等症,具有较高的药用价值。近年来,赛加羚羊野生资源逐渐减少,被列入世界濒危动物红色名录,且标注为极濒危类目。由于羚羊角货源短缺、市场价格居高不下,不法商家有意造假以牟取利益,造成羚羊角贸易混乱、用药错误等问题。羚羊角常见伪品主要有水牛(Bubalusbubalis)、绵羊(Ovis aries)、山羊(Capra hircus)、黄羊(Procapra gutturosa)等动物的角,甚至在民间被作为羚羊角代用品使用。羚羊角通常以粉末、条状或切片销售,难以通过肉眼鉴别,而显微观察以及薄层鉴别等方法操作复杂且受主观经验和环境影响较大。因此,需要一种有效、准确的羚羊角药材及其常见伪品的鉴别方法,以确保用药安全,同时对于监控赛加羚羊等濒危物种的盗猎和走私活动也具有重要意义。
多重连接探针扩增技术(multiplex ligation-dependent probeamplification,MLPA)是一种新的核酸检测技术,该方法结合DNA探针杂交和PCR扩增技术的特点,可以实现对待检DNA序列的定性。通过样品DNA变性,杂交反应,连接反应,PCR扩增四个步骤实现在同一反应体系中完成多达50个不同DNA序列的检测。该方法核心在于用连接酶将与靶序列杂交的左探针和右探针连接成含通用引物的全长探针,每个探针扩增产物的长度和熔解温度唯一,可通过毛细管电泳分离或其熔解温度差异区分开。MLPA方法有诸多优点,比如:对模板DNA质量要求低,总量要求少,仅需要研究物种杂交片段遗传信息存在差异即可;MLPA方法用一对通用引物扩增多个物种的探针连接产物序列,避免了不同引物扩增效率差异导致的误差。目前,该技术已应用于临床诊断、病毒检测、食物中过敏原和转基因成分的检测及中药材鉴定等多个领域。本发明与传统MLPA相比,缩短了探针与靶序列杂交的时间并应用了连接效率更高的连接酶,从而实现明显缩短样品检测周期的目的。同时,将该方法与熔解曲线结合,能够通过观测熔解曲线Tm值,实现在短时间对样品的鉴别。目前还没有采用MLPA结合熔解曲线的方法对中药材羚羊角进行鉴别的报道。
发明内容
本发明采用MLPA结合熔解曲线的方法,针对中药材羚羊角及其常见伪品的COI序列设计特异性MLPA探针,并且建立一种鉴别羚羊角药材及其代用品的方法,该方法具有特异性强、准确性高、快速便捷等优点。
为实现第一个目的,本发明提供一种鉴别羚羊角及其代用品的MLPA探针,所述探针共4条,由三条左探针和一条右探针组成,探针序列如下:
羚羊角左探针:GGGTTCCCTAAGGGTTGGACCTCTATTTGTATGATCTGTCCTAATTACGGCTGTC(SEQ ID NO:1);
绵羊/山羊角左探针:GGGTTCCCTAAGGGTTGGATTATAATTATGTGTGATCCGTCATAATTACCGCCGTA(SEQ ID NO:2);
黄羊/水牛角左探针:GGGTTCCCTAAGGGTTGGACCTGGCCGCGTGTGATCCGTAATAATTACCGCCGTG(SEQ ID NO:3);
共同右探针:CTCCTACTCCTTTCACTTCCCGTACTAGCTCTAGATTGGATCTTGCTGGCAC(SEQID NO:4);
其中,由羚羊角左探针和共同右探针组成的探针组,可单独用于鉴定羚羊角;由绵羊/山羊角左探针和共同右探针组成的探针组,可单独用于鉴定绵羊角/山羊角;由黄羊/水牛角左探针和共同右探针组成的探针组,可单独用于鉴定黄羊角/水牛角。
其中,由三条左探针和共同右探针组成的混合体系,可用于羚羊角、绵羊/山羊角、黄羊/水牛角的单独鉴定以及掺伪羚羊角样品的鉴定。在进行未知样品鉴时,所述MLPA探针组需混合使用而非拆分。
为实现第二个目的,本发明提供一种鉴定中药材羚羊角及其代用品的MLPA方法,该方法包括以下步骤:
1)提取样品基因组DNA;
2)以提取的基因组DNA为模板,利用特异性引物扩增样品COI序列并纯化扩增产物;
3)将扩增产物变性后与以上所述的MLPA探针组杂交;
4)利用DNA连接酶将步骤3)的杂交产物进行连接;
5)利用通用引物对步骤4)的连接产物进行荧光定量PCR扩增;
6)收集熔解曲线信号,观测Tm值。
优选地,所述特异性引物包括上游引物和下游引物,引物核苷酸序列分别如SEQIDNO:5、6所示。
优选地,所述杂交的温度是65℃,时间20min。
优选地,所述连接的温度是45℃,时间15min。
优选地,所述荧光定量PCR扩增的反应循环数是35。
优选地,所述荧光定量PCR扩增的反应体系为2×T5 Fast qPCR Mix 10μL,10μM上游通用引物0.8μL,10μM下游通用引物0.8μL,50×ROX Reference Dye I 0.4μL,连接产物5μL,ddH
优选地,所述MLPA探针组中,三条左探针的体积比为2:3:1。
通过观测样品熔解曲线峰和Tm值判断结果,若样品出现单一熔解曲线峰并且Tm值为80.7℃±0.2℃,则为羚羊角;若样品出现单一熔解峰且Tm值为78.9℃±0.2℃,则为绵羊角或山羊角;若样品出现单一熔解峰且Tm值为82.3℃±0.2℃,则为黄羊角或水牛角;若样品出现两个或三个相应Tm值的熔解曲线峰,则为混合样品。
本发明的有益效果是:
本发明能够在较短的时间内快速鉴别中药材羚羊角,并可有效检测出羚羊角掺混样品,判断出羚羊角中是否掺混了绵羊角/山羊角、黄羊角/水牛角。本发明还可用于绵羊角/山羊角、黄羊角/水牛角的单独鉴定。该方法具有特异性强,灵敏度高等优点,在中药材真伪鉴定领域有很好的应用前景。
附图说明
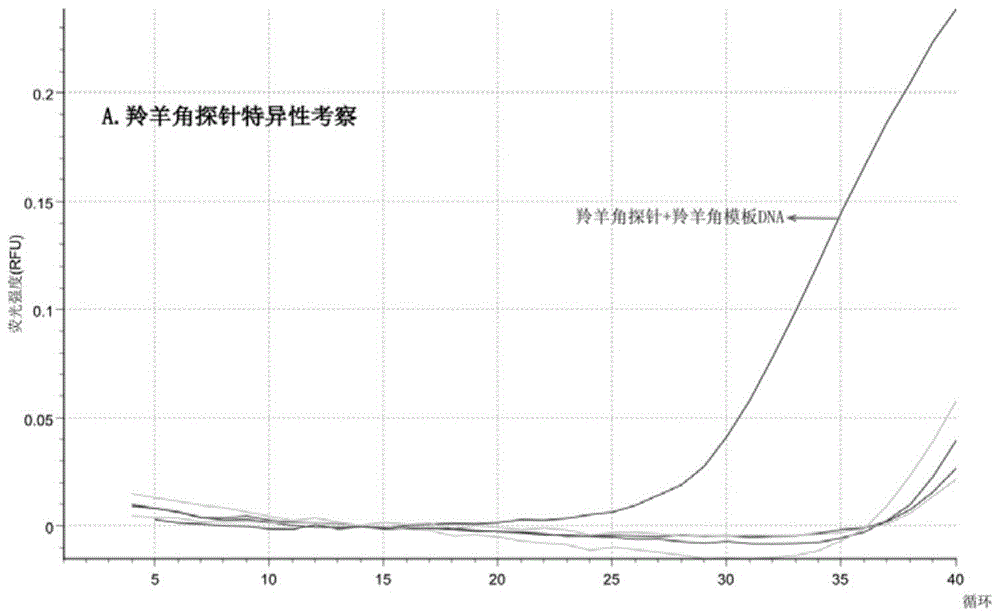
图1是羚羊角特异性探针与不同模板DNA反应的扩增曲线图谱。
图2是绵羊角/山羊角特异性探针与不同模板DNA反应的扩增曲线图谱。
图3是黄羊角/水牛角特异性探针与不同模板DNA反应的扩增曲线图谱。
图4是不同杂交温度下羚羊角单一探针与羚羊角DNA反应的溶解曲线图谱。
图5是不同扩增循环数扩增曲线图谱。
图6是不同比例混合探针体系与混合模板反应的熔解曲线图谱。
图7是羚羊角灵敏度考察熔解曲线图谱。
图8是绵羊角/山羊角灵敏度考察熔解曲线图谱。
图9是黄羊角/水牛角灵敏度考察熔解曲线图谱。
图10是掺伪样品检测熔解曲线图谱。
图11是采用混合探针检测未知样品的熔解曲线图谱。
具体实施方式
下面通过具体实施例对本发明进行详细说明。
实施例1羚羊角样品及其常见伪品基因组DNA提取及COI目的片段扩增、纯化
1.样品基因组DNA提取
采用庄盟生物动物组织基因组DNA提取试剂盒提取动物角基因组DNA
1)取药材粉末80mg,加入2ml脱钙液[0.5M EDTA(pH 8.0)]充分混匀,置于4℃孵育24h。在冷冻高速离心机中12,000rpm离心2min,弃上清液;
2)在经脱钙液处理后的样品中加入500μL缓冲液A和20μL蛋白酶K,56℃水浴8h或过夜,水浴过程中颠倒离心管数次混合样品;
3)在样品充分水浴后,向样品组织裂解的混合液中加入500μL缓冲液B,充分混匀,置于65℃水浴10-30min;
4)向上述混合液中加入500μL无水乙醇,颠倒混匀,充分混匀后转移至吸附柱中,在冷冻高速离心机中12,000rpm离心30s,弃废液;
5)向吸附柱中加入500μL缓冲液C,在冷冻高速离心机中12,000rpm离心30s,弃废液;
6)向吸附柱中加入700μL漂洗液W2(使用前检查是否加入无水乙醇),在冷冻高速离心机中12,000rpm离心30s,弃废液;
7)向吸附柱中加入500μL漂洗液W2(使用前检查是否加入无水乙醇),在冷冻高速离心机中12,000rpm离心30s,弃废液;
8)将吸附柱再次放回收集管中,在冷冻高速离心机中12,000rpm离心2min,将吸附柱转移到新的离心管,彻底晾干吸附柱中的漂洗液;
9)向吸附柱膜的正中位置悬空滴加洗脱缓冲液TE 80μL,在室温条件下放置5min使洗脱缓冲液TE充分浸润吸附柱膜,在冷冻高速离心机中12,000rpm离心2min,将溶液收集到离心管中。
2.PCR扩增
根据赛加羚羊、山羊、绵羊、黄羊及水牛COI序列片段的保守区域,利用Primer 3(http://primer3.ut.ee/)软件设计PCR扩增引物。
特异性扩增引物:
FP:5′-TTCTGACTTCTTCCCCCTTCTTT-3′(SEQ ID NO:5)
RR:5′-GTGTTGATATAGAATTGGGTC-3′(SEQ ID NO:6)
反应体系:
反应程序:
羚羊角扩增目的片段的核苷酸序列为SEQ ID NO:7所示的序列:5′-TTCTGACTTCTTCCCCCTTCTTTCCTGCTACTTCTAGCATCTTCCATAGTTGAGGCAGGAGCAGGAACAGGCTGAACTGTATACCCTCCTCTAGCAGGTAATTTAGCCCACGCAGGAGCCTCAGTAGACTTAACCATTTTTTCCCTTCACCTAGCAGGTGTTTCATCAATTTTAGGAGCTATTAATTTTATTACAACAATTATTAATATAAAACCCCCCGCAATATCACAATATCAAACGCCTCTATTTGTATGATCTGTCCTAATTACGGCTGTCCTCCTACTCCTTTCACTTCCCGTACTAGCTGCCGGCATTACAATGCTTCTAACAGACCGAAATCTAAACACAACTTTCTTTGACCCAGCAGGAGGAGGAGACCCAATTCTATATCAACAC-3′
绵羊角扩增目的片段的核苷酸序列为SEQ ID NO:8所示的序列:5′-TTTTGACTTCTTCCCCCATCTTTCCTGTTACTCCTAGCATCCTCTATGGTTGAGGCCGGAGCAGGAACAGGTTGAACCGTATACCCTCCTCTAGCAGGCAACCTAGCCCATGCAGGAGCCTCAGTAGATCTAACTATTTTCTCCCTACACCTGGCAGGTGTCTCTTCAATTCTAGGAGCCATTAATTTTATTACAACTATTATTAATATAAAACCCCCTGCGATGTCACAGTATCAAACCCCCTTGTTTGTATGATCTGTACTAATTACTGCCGTACTTCTCCTTCTCTCACTTCCTGTATTAGCAGCTGGTATCACAATACTACTAACGGACCGAAACCTGAATACAACCTTTTTTGACCCAGCAGGAGGAGGAGACCCTATCCTATATCAACAC-3′
山羊角扩增目的片段的核苷酸序列为SEQ ID NO:9所示的序列:5′-TTTTGACTCCTTCCCCCCTCTTTCCTATTACTTCTAGCATCCTCTATAGTTGAAGCCGGAGCAGGAACAGGTTGAACCGTATATCCTCCTCTAGCAGGTAATCTAGCCCATGCAGGAGCCTCAGTAGACCTAACTATTTTTTCCCTACACCTAGCAGGCATCTCTTCAATTCTAGGAGCCATTAATTTTATTACAACTATCATTAACATGAAACCACCCGCAATATCACAATATCAAACTCCCCTGTTTGTGTGATCTGTCTTAATTACTGCCGTACTACTCCTCCTTTCACTTCCTGTATTAGCAGCTGGCATCACAATACTACTAACAGACCGAAACCTAAACACAACCTTCTTCGACCCGGCAGGAGGAGGAGACCCTATTCTATATCAACAC-3′
黄羊角扩增目的片段的核苷酸序列为SEQ ID NO:10所示的序列:5′-TTTTGACTCCTCCCTCCCTCTTTTCTTCTGCTTCTGGCATCTTCTATAGTTGAAGCAGGTGCAGGTACAGGTTGGACTGTATATCCCCCTCTAGCGGGCAATTTAGCCCACGCAGGGGCCTCAGTAGACCTGACTATCTTCTCTCTTCACTTAGCAGGTGTTTCTTCCATCTTAGGGGCTATTAACTTTATTACAACAATTATTAATATAAAACCTCCCGCAATATCACAATATCAAACTCCTTTATTCGTATGATCCGTTATAATTACTGCCGTGCTATTACTTCTCTCACTTCCTGTACTAGCCGCCGGCATTACTATGCTCTTAACAGACCGAAATCTAAATACAACTTTCTTCGATCCAGCAGGAGGGGGCGACCCTATTCTATACCAACAC-3′
水牛角扩增目的片段的核苷酸序列为SEQ ID NO:11所示的序列:5′-TTCTGACTCCTCCCTCCCTCTTTCCTACTACTTCTAGCATCATCTATAGTTGAAGCTGGAGCAGGGACAGGTTGAACCGTATACCCCCCTTTAGCAGGTAACCTAGCCCACGCAGGAGCCTCGGTAGATCTAACCATCTTCTCTCTGCACTTAGCAGGTGTCTCCTCAATTTTAGGGGCTATTAATTTTATTACAACAATTATCAATATAAAACCTCCTGCAATATCACAATACCAAACCCCTTTATTCGTGTGATCCGTAATAATCACCGCCGTGCTATTACTCCTTTCACTTCCTGTGCTAGCAGCTGGCATTACAATGCTACTAACAGATCGAAACCTAAACACAACTTTCTTTGATCCAGCGGGGGGAGGAGATCCTATTCTATACCAACAC-3′
利用BLAST同源比对程序将获得的扩增产物序列针对NCBI核酸非冗余数据库进行同源比对,SEQ ID NO:7比对且仅比对到羚羊角COI基因,SEQ ID NO:8、9分别比对且仅比对到绵羊、山羊COI基因,SEQ ID NO:10、11分别比对且仅比对到黄羊、水牛COI基因,表明扩增产物与目标产物一致。
3.纯化扩增产物获得模板DNA
1)估计PCR反应液体积,向其中加入4倍体积的结合液,充分混匀。
2)将上一步所得溶液加入一个吸附柱中(吸附柱放入收集管中),室温放置2分钟,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放入收集管中。
3)向吸附柱中加入700μl漂洗液,12,000rpm离心1min,弃废液,将吸附柱放入收集管中。重复一次。
4)12000rpm离心2min,尽量除去漂洗液。将吸附柱敞口置于室温或50℃温箱放置数分钟,目的是将吸附柱中残余的漂洗液去除,防止漂洗液中的乙醇影响后续的实验。
5)将吸附柱放入一个干净的离心管中,向吸附膜中央悬空滴加适量经65℃水浴预热的洗脱缓冲液,室温放置2min,12000rpm离心2min收集DNA溶液,放置-20℃备用。
实施例2探针设计与配制
1)探针设计:利用实施例1扩增的COI基因序列,并从NCBI数据库中下载得到羚羊角基源动物赛加羚羊(Saiga tatarica)及其常见伪品水牛(Bubalus bubalis)、绵羊(Ovisaries)、山羊(Capra hircus)、黄羊(Procapra gutturosa)等物种的COI序列,将序列导入MEGA6.05软件中进行比对分析,找到可用于探针设计差异位点,即276位C/A/G位点,该位点在羚羊角中为C,在绵羊、山羊中为A,在黄羊、水牛中为G。以276位差位点作为MLPA探针的左探针3’差异碱基,设计物种特异性探针。设计的探针应尽量满足以下条件:(1)用于与探针杂交的目的片段特异性要好,避开同源序列且用于探针杂交的目的片段GC%含量40~60%为宜;(2)MLPA试验的左探针3’端和右探针的5’端在位置上要能直接相连;(3)用于同一个物种MLPA试验的左探针和右探针熔解温度(Tm值)要相近;(4)为保证探针的特异性,杂交片段不宜过长,左探针杂交序列21~33bp为宜,右探针杂交序列21~44bp为宜;(5)左探针的3’端和右探针的5’端要避免出现C/G聚集的情况;(6)左探针和右探针的自由能要大于0。使用Primer 3(http://primer3.ut.ee/)筛选出长度在42nt~60nt、GC分布均匀、Tm值≥68℃的作为特异MLPA探针的杂交片段。选择出合适的探针杂交序列后,使用DNAFolding Form评价探针质量,折叠温度设置为60℃,钠盐浓度为0.35M,最终选择ΔG>0的序列作为物种特异性探针。并将特异性探针在BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对以避免交叉反应干扰。综合BLAST结果、探针二级结及熔解温度等初步评判,设计得到以下四条探针并由生工生物有限公司进行人工合成(表1)。
表1 羚羊角特异性MLPA探针信息表
2)探针配制:将探针制备成10μM的储存溶液,使用时稀释为1μM的工作溶液。取0.8μL羚羊角左探针与0.8μL共同右探针,加TE至600μL,制备成羚羊角单一探针溶液1;取0.8μL绵羊角/山羊角左探针与0.8μL共同右探针,加TE至600μL,制备成绵羊角/山羊角单一探针溶液2;取0.8μL黄羊角/水牛角左探针与0.8μL共同右探针,加TE至600μL,制备成黄羊角/水牛角单一探针溶液3。
实施例3 MLPA检测条件筛选
1)杂交温度及扩增循环数的确定
DNA变性、杂交:取样品COI片段纯化产物100ng左右,分别加入实施例2中配制三组单一探针溶液1、2、3各1.5μL,TE缓冲液补足体积至8μL。另取8μL TE缓冲液作为阴性对照。98℃变性5min,分别于62℃、65℃、70℃、72℃杂交20min;
连接反应:取出1.28μL杂交产物至连接体系(9°N
熔解曲线确定Tm值:以连接产物为模板进行荧光定量PCR扩增并获取扩增产物的熔解曲线及对应的Tm值;
扩增体系及程序如下:
荧光定量PCR反应体系为:2×T5 Fast qPCR Mix 10μL,上游引物0.8μL(10μM),下游引物0.8μL(10μM),50×ROX Reference Dye I 0.4μL,ddH
荧光定量PCR扩增通用引物为:
Primer F:5′-GGGTTCCCTAAGGGTTGGA-3′
Primer R:5′-TCTAGATTGGATCTTGCTGGCAC-3′
如图1-3所示,羚羊角单一探针溶液1仅与羚羊角DNA产生扩增曲线;绵羊角/山羊角单一探针溶液2仅与绵羊角/山羊角DNA产生扩增曲线;黄羊角/水牛角单一探针溶液3仅与黄羊角/水牛角DNA产生扩增曲线,表明所设计的探针具有良好的特异性。杂交温度会影响羚羊角DNA与探针的杂交成功率,通过温度进行筛选以确定较适合的杂交温度是很必要的。如图4所示,不同杂交温度下,熔解曲线峰不同,杂交温度为65℃时,羚羊角DNA与探针产生的单一溶解曲线峰优于62℃、70℃及72℃。故而选择将65℃作为最佳杂交温度。同时,根据不同扩增循环数下非特异性出现的情况,确定反应的最佳循环数为35(如图5)。
2)最佳探针混合比例的筛选
将探针制备成10μM的储存溶液,使用时稀释为1μM的工作溶液。取0.8μL羚羊角左探针+0.8μL绵羊/山羊左探针+0.8μL黄羊/水牛左探针+共同右探针2.4μL+595.2μLTE缓冲液配制为混合探针A;取0.8μL羚羊角左探针+0.9μL绵羊/山羊左探针+0.7μL黄羊/水牛左探针+共同右探针2.4μL+595.2μLTE缓冲液配制为混合探针B;取0.8μL羚羊角左探针+1.0μL绵羊/山羊左探针+0.6μL黄羊/水牛左探针+共同右探针2.4μL+595.2μLTE缓冲液配制为混合探针C;取0.8μL羚羊角左探针+1.2μL绵羊/山羊左探针+0.4μL黄羊/水牛左探针+共同右探针2.4μL+595.2μL TE缓冲液配制为混合探针D;
杂交反应:取浓度相同羚羊角、绵羊角/山羊角、黄羊/水牛角DNA纯化产物各1μL混合后与混合探针进行杂交,配置8μL杂交体系(1.5μL探针,1μL模板,5.5μL TE),反应程序:98℃变性5min,65℃杂交20min;
连接反应:取出1.28μL杂交产物至连接体系(9°N
熔解曲线确定Tm值:以连接产物为模板进行荧光定量PCR扩增并获取扩增产物的熔解曲线及对应的Tm值;
扩增体系及程序如下:
荧光定量PCR反应体系为:2×T5 Fast qPCR Mix 10μL,上游引物0.8μL(10μM),下游引物0.8μL(10μM),50×ROX Reference Dye I 0.4μL,ddH
依据扩增出现的熔解曲线峰选择最佳探针比例,在混合探针D的情况下,混合样品与混合体系出现高度相近的三个峰(如图6)。
实施例4 MLPA方法检测羚羊角灵敏度实验
1)将羚羊角、绵羊角/山羊角、黄羊角/水牛角的DNA纯化产物由高浓度不断稀释至低浓度,取一定量的DNA纯化产物进行实验,取样量如下,
2)DNA变性、杂交:分别取不同浓度的COI片段纯化产物1μL与实施例3中筛选得到的混合探针D溶液1.5μL,以TE缓冲液补足反应体积至8μL。另取1μLTE缓冲液作为阴性对照。98℃变性5min,65℃杂交20min;
3)连接反应:取出1.28μL杂交产物至连接体系(9°NTMDNA Ligase 0.32μL,NEBufferfor 9°N DNA Ligase 0.8μL,ddH
4)熔解曲线确定Tm值:以连接产物为模板进行荧光定量PCR扩增并获取羚羊角的Tm值。荧光定量PCR反应体系为:2×T5 Fast qPCR Mix 10μL,上游引物0.8μL(10μM),下游引物0.8μL(10μM),50×ROX Reference Dye I 0.4μL,ddH
5)灵敏度验证:根据出现在80.7℃±0.2℃、78.9℃±0.2℃及82.3℃±0.2℃熔解曲线峰的情况确定MLPA方法检测羚羊角及其常见伪品的灵敏度(如附图7-9)。在较低浓度(0.1ng)时,仍能检测出羚羊角及其常见伪品,则说明该方法具有较高的灵敏度。
实施例5 MLPA方法检测羚羊角掺混样品实验
1)将绵羊角/山羊角模板DNA、黄羊角/水牛角模板DNA按不同比例(90%、80%、70%、60%、50%、40%、30%、20%、10%)掺入羚羊角模板DNA中,制备得到掺混样品模板DNA;
2)DNA变性、杂交:分别取不同浓度的模板DNA1μL与实施例3中筛选得到的混合探针体系1.5μL,以TE缓冲液补足反应体积至8μL。另取1μLTE缓冲液作为阴性对照。98℃变性5min,65℃杂交20min;
3)连接反应:取出1.28μL杂交产物至连接体系(9°N
4)熔解曲线确定Tm值:以连接产物为模板进行荧光定量PCR扩增并获取羚羊角的Tm值。荧光定量PCR反应体系为:2×T5 Fast qPCR Mix 10μL,上游引物0.8μL(10μM),下游引物0.8μL(10μM),50×ROX Reference Dye I 0.4μL,ddH
5)掺混情况分别根据出现的熔解曲线峰(如附图10)来确定。若熔解曲线为双峰,且熔解温度分别为78.9℃±0.2℃和80.7℃±0.2℃,表明羚羊角样品中掺混了绵羊角/山羊角;若熔解曲线为双峰,且熔解温度分别为80.7℃±0.2℃和82.3℃±0.2℃,则表明羚羊角样品中掺混了黄羊角/水牛角。
实施例6 MLPA方法检测未知样品
1)按实施例1方法提取、扩增并纯化样品的COI序列;
2)按实施例3筛选的最佳条件方法对未知样品进行熔解曲线峰定位;其中,杂交温度为65℃,扩增循环数为35,使用混合探针为混合探针D。
3)根据熔解曲线(如附图11),判断未知样品1、2均为羚羊角。
- 一种檀香基因组特异序列的确定方法和檀香的鉴定方法
- 一种用于辅助鉴定身高的方法及其专用引物组
- 一种河蚬线粒体基因组富集提取及鉴定方法
- 一种基于二代测序数据分析对宏基因组中的沙门氏菌进行鉴定及分型的方法
- 一种同时检测中药材三种毒源真菌污染的MLPA探针及其应用
- 一种同时检测中药材三种毒源真菌污染的MLPA探针及其应用
