一种肾清除型双通道光学纳米探针及其制备方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及生物医学技术领域,更具体地,涉及一种肾清除型双通道光学纳米探针及其制备方法和应用。
背景技术
生物成像技术是诊断多种疾病最可靠的工具之一。在过去的几十年里,随着成像技术的巨大进步,各种成像方式已成功地应用于临床诊断,人类医疗保健得到了巨大改善。然而,X射线成像、计算机辅助断层扫描(CT)、超声(US)成像和磁共振(MR)成像主要用于获取组织或器官水平的结构和解剖信息。为了实现疾病的早期检测、精准诊断和个性化的图像引导治疗,迫切需要开发能够在细胞和分子水平上提供病理信息的成像技术。其中使用高性能高生物相容性的光学探针进行光学成像,可以为体外和体内的应用提供特定生物信息,比如公开号为CN114377152 A的中国专利提供了一种生物标志物响应型荧光示踪剂,其可实现在细胞和分子水平上提供病理成像信息。
光学探针具有高时空分辨率、高灵敏度和安全的非电离辐射等优点,已经被广泛应用于生物医学研究领域。光学探针具有体内循环时间长及靶向性好等优势,但由于其在体内长期累积、代谢慢,严重阻碍了其转化为临床实践。此外,为了克服光学探针光学信号在体内穿透深度有限的缺陷,开发肾清除型纳米探针用于体外尿液检测,来诊断体内疾病的发生发展具有重要应用价值。目前,大多数已报道的光学探针的尺寸超过了肾小球基底膜孔径,导致无法通过尿液排出体外。近年来,具有肾清除特性的无机纳米探针如金纳米簇以及量子点等逐渐被报道,然而无机纳米材料的长期毒性仍然亟待解决,而具有肾清除特性的有机纳米探针鲜有报道。因此,开发在靶器官/病灶中富集并在期望时间内排出体外的肾清除型有机纳米探针,对于临床生物应用具有重要意义。
发明内容
本发明的首要目的是克服上述现有技术中的光学探针不具有肾清除特性或存在长期毒性的问题。提供一种肾清除型双通道光学纳米探针。
本发明的另一目的是提供上述肾清除型双通道光学纳米探针的制备方法。
本发明的另一目的是提供上述肾清除型双通道光学纳米探针及其药学上可接受的盐或溶剂化物、对映异构体、非对映异构体、互变异构体在制备光学分子探针中的应用。
本发明的上述目的通过以下技术方案实现:
一种肾清除型双通道光学纳米探针,具有如式(Ⅰ)~式(Ⅲ)任一所示的结构:
其中,R
本发明的肾清除型双通道光学纳米探针包括三个关键组成部分:生物标志物响应基团R
需要说明的是,式(Ⅰ)~式(Ⅲ)中
在起始状态下,由于化学发光-荧光团单元的酚基被修饰从而导致酚基的供电子能力被抑制,肾清除型双通道光学纳米探针无化学发光和荧光信号。在被生物标志物激活的状态下,肾清除型双通道光学纳米探针发生响应并诱导自消除基团级联自消除以解聚,释放化学发光和近红外荧光团用于成像和尿液检测。此外,亲水性基团使得肾清除型双通道光学纳米探针具有良好的水溶性,保证了其生物相容性:当体内无生物标志物时,水溶性的纳米探针通过血液循环达到肝脏,进一步通过粪便排出体外;当体内有生物标志物时,肾清除型双通道光学纳米探针被生物标志物解聚成的小分子化合物,亲水性基团使得小分子化合物会到达肾脏并在期望时间内通过尿液排出体外,体现出纳米探针的肾清除功能。该肾清除型双通道光学纳米探针可以特异性在疾病部位被激活并且其药代动力学发生转换,触发化学发光和荧光信号报告生物标志物水平,并通过安全的肾脏清除途径快速排泄而进行无创尿液分析,其超高的肾清除效率和生物标志物特异性释放荧光片段加上原位放大催化解聚使尿液检测优于血液检测,允许超灵敏地检测炎症、癌症和早期诊断器官异体排斥反应的疾病,这不仅为将光学纳米粒子转化提供了新机会,而且提出了一个通用的纳米平台来填补超灵敏尿液检测的空白以进行早期诊断。
根据生物标志物的不同,R
优选地,所述生物标志物响应基团为
上述生物标志物响应基团与生物标志物之间特异性激发对应关系如下:
/>
/>
优选地,所述亲水性基团为
优选地,肾清除型双通道光学纳米探针具有如下所述结构:
上述肾清除型双通道光学纳米探针的制备方法,包括如下步骤:
S1.化合物21和式(22)所示的化合物22以及化合物5发生取代反应得到化合物23;
S2.化合物23与氧气发生加成反应得到化合物24;
S3.化合物24与化合物25发生click反应,即得所述肾清除型双通道光学纳米探针;化合物25为以下化合物:发生click反应后的残基为-R
所述化合物21具有如式(21-1)、式(21-2)或式(21-3)所示的结构;
所述化合物23具有如式(23-1)、式(23-2)或式(23-3)所示的结构;
所述化合物24具有如式(24-1)、式(24-2)或式(24-3)所示的结构;
/>
优选地,步骤S1中所述取代反应的温度0~30℃,时间为1~5h;步骤S2中所述加成反应的温度为-20~0℃,时间为5~8h;步骤S3中所述click反应的温度为-20~0℃,时间为8~12h。
优选地,步骤S1中所述取代反应的溶剂为二氯甲烷、乙腈或四氢呋喃中的一种或多种;步骤S2中所述加成反应的的溶剂为甲醇或乙醇中的一种或两种;步骤S3中所述click反应的溶剂为四氢呋喃或二甲基亚砜中的一种或多种,催化剂为抗坏血酸钠、硫酸铜或溴化亚铜中的一种或几种。
优选地,步骤S1中所述化合物21通过如下步骤制备得到:
S11.化合物17与式(12)所示的化合物12发生缩合反应得到化合物18;
S12.化合物18发生脱乙酰胺保护反应得到化合物19;
S13.化合物19与式(20)所示的化合物20发生取代反应得到化合物21;
所述化合物17具有如式(17-1)、式(17-2)或式(17-3)所示的结构;
所述化合物18具有如式(18-1)、式(18-2)或式(18-3)所示的结构;
所述化合物19具有如式(19-1)、式(19-2)或式(19-3)所示的结构;
更为优选地,步骤S11中所述缩合反应的温度为50~80℃,时间为12~48h;步骤S12中所述脱乙酰胺保护反应的温度为80~100℃,时间为8~12h;步骤S13中取代反应的温度为0~30℃,时间为0.5~2h。
更为优选地,步骤S11中所述缩合反应的溶剂为醋酐、乙醇或乙腈中的一种或多种;步骤S12中所述脱乙酰胺保护反应的溶剂为甲醇或乙醇中的一种或两种;步骤S13中取代反应的溶剂为二氯甲烷、乙腈或四氢呋喃中的一种或多种。
更为优选地,所述步骤S11中所述化合物12通过如下步骤制备得到:
S111.式(6)所示的化合物6发生双甲氧基化反应得到式(7)所示的化合物7;
S112.化合物7发生取代反应得到式(8)所示的化合物8;
S113.化合物8发生亚磷酸化反应得到式(9)所示的化合物9;
S114.化合物9和式(10)所示的化合物10发生亲核加成反应得到式(11)所示的化合物11;
S115.化合物11发生脱溴上醛反应得到式(12)所示的化合物12;
进一步优选地,步骤S111中所述双甲氧基化反应的温度为10~30℃,时间为8~24h;S112中所述取代反应的温度为10~30℃,时间为3~15h;步骤S113所述亚磷酸化反应的温度为0~30℃,时间为5~15h;步骤S114所述亲核加成反应的温度为10~30℃,时间为3~15h;步骤S114所述脱溴上醛反应的温度为-78~30℃,时间为2~5h。
进一步优选地,步骤S111中所述双甲氧基化反应的溶剂为二氯甲烷、四氢呋喃或乙腈中的一种或多种;S112中所述取代反应的溶剂为二氯甲烷或四氢呋喃中的一种或两种;步骤S113所述亚磷酸化反应的溶剂为二氯甲烷或乙腈中的一种或两种;步骤S114所述亲核加成反应的溶剂为二氯甲烷或四氢呋喃中的一种或两种;步骤S114所述脱溴上醛反应的溶剂为四氢呋喃或乙醚中的一种或两种。
更为优选地,所述步骤S11中所述式(17-1)所示的化合物17通过如下步骤制备得到:式(13)所示的化合物13发生氨基化反应得到式(14)所示的化合物14,化合物14发生成环反应得到式(15)所示的化合物15,化合物15和式(16)所示的化合物16发生取代反应得到式(17)所示的化合物17;
式(17-2)所示的化合物17通过如下步骤制备得到:2,3,3-三甲基-4,5-苯并吲哚与浓硝酸发生硝化反应,随后与氯化亚锡发生还原反应,随后乙酰化保护氨基,最后与式(16)所示的化合物16发生取代反应得到式(17-2)所示的化合物17;
式(17-3)所示的化合物17通过如下步骤制备得到:2-甲基苯并[c,d]吲哚与浓硝酸发生硝化反应,随后与氯化亚锡发生还原反应,随后乙酰化保护氨基,最后与式(16)所示的化合物16发生取代反应得到式(17-2)所示的化合物17。
进一步优选地,所述氨基化反应的温度为0~10℃,时间为1~3h;所述成环反应的温度为110~130℃,时间为12~24h;所述取代反应的温度为30~-50℃,时间为48~72h。
进一步优选地,所述氨基化反应在浓盐酸中进行;所述成环反应的溶剂为醋酸或甲苯中的一种或两种;所述取代反应的溶剂为甲苯、乙腈或四氢呋喃中的一种或多种。
优选地,步骤S1中所述化合物5通过如下步骤制备得到:
式(1)所示的化合物1发生取代反应得到式(2)所示的化合物2,化合物2与化合物3发生取代反应得到式(4)的化合物4,化合物4发生脱保护反应得到式(5)的化合物5;化合物3为以下化合物:发生取代反应后的残基为-R
更为优选地,所述化合物1发生的取代反应的温度为10~30℃,时间为2~12h;化合物2与化合物3发生的取代反应的温度为10~30℃,时间为2~24h;所述脱保护反应的温度为10~30℃,时间为3~15h。
更为优选地,所述化合物1发生的取代反应的溶剂为N,N二甲基甲酰胺,二氯甲烷中的一种或两种;化合物2与化合物3发生的取代反应的溶剂为二氯甲烷或四氢呋喃中的一种或两种;所述脱保护反应的溶剂为二氯甲烷、甲醇或乙醇中的一种或多种。
上述肾清除型双通道光学纳米探针及其药学上可接受的盐或溶剂化物、对映异构体、非对映异构体、互变异构体在制备光学分子探针中的应用也在本发明的保护范围内。
优选地,所述药学上可接受的盐为盐酸盐、氢溴酸盐、硝酸盐、甲基硝酸盐、硫酸盐、硫酸氢盐、氨基硫酸盐、磷酸盐、乙酸盐、羟基乙酸盐、苯基乙酸盐、丙酸盐、丁酸盐、异丁酸盐、戊酸盐、马来酸盐、羟基马来酸盐、丙烯酸盐、延胡索酸盐、苹果酸盐、酒石酸盐、柠檬酸盐、水杨酸盐、对氨基水杨酸盐、乙醇酸盐、乳酸盐、庚酸盐、邻苯二甲酸盐、草酸盐、琥珀酸盐、苯甲酸盐、邻乙酰氧基苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟苯酸盐、甲氧基苯甲酸盐、扁桃酸盐、丹宁酸盐、甲酸盐、硬脂酸盐、抗坏血酸盐、棕榈酸盐、油酸盐、丙酮酸盐、双羟奈酸盐、丙二酸盐、月桂酸盐、戊二酸盐、谷氨酸盐、丙酸酯月桂硫酸盐(estolate)、甲磺酸盐、乙磺酸盐、2-羟基乙磺酸盐、苯磺酸盐、对氨基苯磺酸盐、对甲苯磺酸盐(甲苯磺酸盐)或萘-2-磺酸盐中的至少一种。
与现有技术相比,本发明的有益效果是:
本发明开发了一种肾清除型双通道光学纳米探针,该肾清除型双通道光学纳米探针以特定的主体结构作为化学发光-荧光信号部分,侧链连接生物标志物响应基团和肾脏清除基团,其能够在生物标志物触发响应后进行肾脏清除并激活化学发光和荧光信号,可用于非侵入性的化学发光体内成像和近红外荧光体外尿液诊断。该肾清除型双通道光学纳米探针不仅具有高灵敏度,且具有较好的安全性和生物相容性,可实现在疾病部位特异性激活纳米颗粒到小分子的药代动力学转换,灵敏地触发化学发光和荧光信号进而反映疾病生物标志物的水平,并通过安全的肾脏清除途径快速排泄,用于非侵入性的尿液分析。该肾清除型双通道光学纳米探针填补了超灵敏尿液检测的空白,在疾病的早期诊断方面具有重要的推动意义
附图说明
图1为实施例1~17中各化合物的合成示意图;
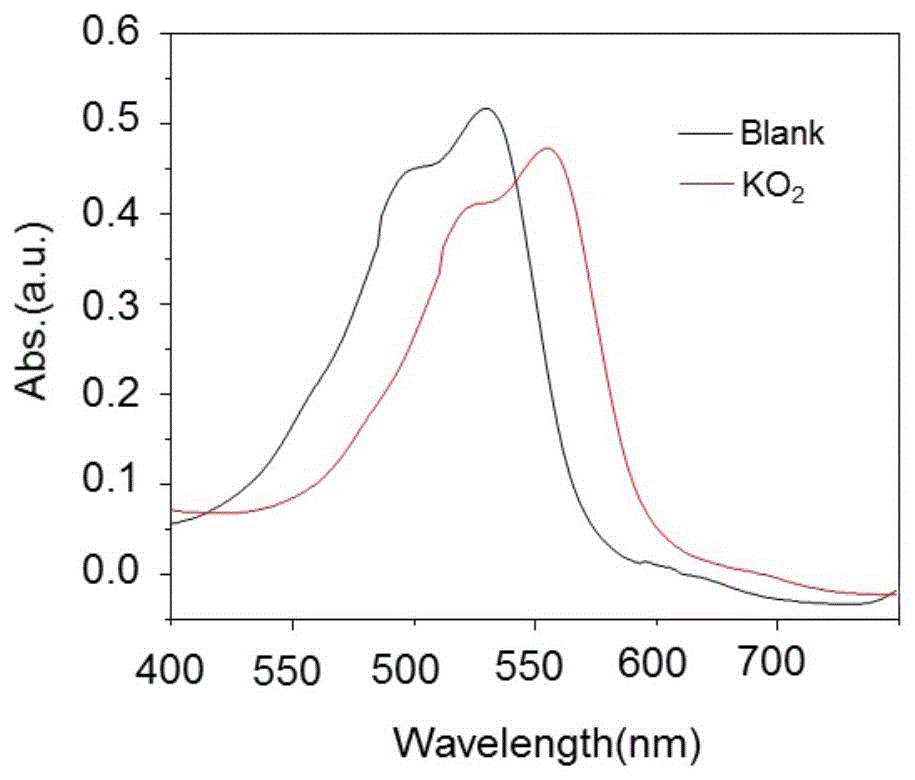
图2为肾清除型双通道光学纳米探针在有无超氧化钾存在下的情况下的紫外吸收光谱变化;
图3为肾清除型双通道光学纳米探针在有无超氧化钾存在下的情况下的荧光光谱变化;
图4为肾清除型双通道光学纳米探针在有无超氧化钾存在下的情况下化学发光光谱变化;
图5为肾清除型双通道光学纳米探针在不同浓度超氧化钾下的情况下化学发光光谱变化;
图6为肾清除型双通道光学纳米探针在固定浓度超氧化钾下的情况下随时间的化学发光光谱变化;
图7为肾清除型双通道光学纳米探针在其他分析物存在下的情况下的荧光和化学发光光谱,显示其对超氧化钾的特异性;
图8为肾清除型双通道光学纳米探针以及解聚后的单体在小鼠体内代谢的肾清除效率。
图9为肾清除型双通道光学纳米探针在小鼠腹膜炎中的化学发光成像;
图10为肾清除型双通道光学纳米探针在小鼠腹膜炎中的正面荧光成像;
图11为肾清除型双通道光学纳米探针在小鼠腹膜炎中的侧面荧光成像;
图12为肾清除型双通道光学纳米探针在小鼠腹膜炎模型中的其他器官的荧光成像。
具体实施方式
为了更清楚、完整的描述本发明的技术方案,以下通过具体实施例进一步详细说明本发明,应当理解,此处所描述的具体实施例仅用于解释本发明,并不用于限定本发明,可以在本发明权利限定的范围内进行各种改变。
除非特别说明、本发明所用试剂和材料均为市购。
实施例1化合物2的合成
将2-羟基-5-甲基间苯二甲醇(4.2g,25mmol,化合物1)加入到干燥的DMF(50ml)中,然后加入叔丁基二甲基氯硅烷(1.83g,50mmol)和咪唑(0.81g、50mmol),在室温下氩气保护反应6小时。反应完成后,将混合物减压真空浓缩,用乙酸乙酯(3×30mL)和盐水(3×30mL)萃取,有机层用无水硫酸钠干燥,粗产物用石油醚/乙酸乙酯(10/1)柱层析提纯,即得到油状液体的化合物2(9.8g,产率99%)。
实施例2化合物4的合成
在0℃下将化合物2(1.98g,5mmol)溶解于无水二氯甲烷(25ml)中,滴加三氟甲磺酸酐(1.68g,6mmol,化合物3)于混合溶液中,然后在逐滴加入吡啶(0.4g,5mmol),在室温下氩气保护反应过夜。用TLC监测反应,反应完成后,用硫酸铜溶液和盐水除去混合物中的吡啶,有机层用无水硫酸钠干燥,粗产物用石油醚/乙酸乙酯(20/1)柱层析分离,最后得到油状液体的化合物4(2.1g,产率80%)。
实施例3化合物5的合成
将化合物4(1.56g,3mmol)溶于干燥的THF(15ml)中,然后滴加TBAF(3ml),在室温下氩气保护反应4h。反应完后,减压真空浓缩,用乙酸乙酯(3×30mL)和盐水(3×30ml)萃取,有机相用无水硫酸钠干燥,减压浓缩,用二氯甲烷/甲醇(25/1)柱层析提纯,最终得到白色固体的化合物5(0.83g,产率92%)。
实施例4化合物7的合成
将2-溴-5-羟基苯甲醛(2g,10mmo,化合物6)加入甲醇(20ml)中,然后加入原甲酸三甲酯(1.2ml,11mmol),最后加入TBAB(32mg,0.1mmol),在室温下氩气保护反应6h,采用薄层色谱法监测反应进度。反应完后,减压浓缩,用乙酸乙酯(3×30mL)和水(3×30mL)萃取,有机层用无水硫酸钠干燥,然后浓缩,用石油醚/乙酸乙酯(5/1)柱层析纯化,最终得到无色油状液体的化合物7(2.1g,产率85%)。
实施例5化合物8的合成
将化合物7(2g,8mmol)和咪唑(1.64g,24mmol)加入二氯甲烷(25ml)中,然后加入叔丁基二甲基氯硅烷(1.52g,10mmol),在常温下氩气保护反应2h。反应完后,加入DCM(3×25mL)和盐水(3×25mL)萃取,有机层用无水硫酸钠干燥,减压浓缩,粗产品用石油醚/乙酸乙酯(20/1)柱层析纯化,最终得到无色油状液体的化合物8(2.9g,产率99%)。
实施例6化合物9的合成
将化合物8(3g,10mmol)和亚磷酸三甲酯(1.5ml,14mmol)溶于DCM(40ml)中,然后滴加四氯化钛(1.5ml,14mmol)到混合溶液中,在室温下氩气保护反应8h,使用薄层色谱法检测反应。反应完成后,加入DCM(20ml)稀释混合溶液,然后用饱和碳酸氢钠(50ml)和盐水(3×25mL)提取,有机相用无水硫酸钠干燥,减压浓缩后,粗产物用石油醚/乙酸乙酯(5/1)柱层析纯化,得到白色固体的化合物9(3.2g,产率80%)。
实施例7化合物11的合成
将化合物9(3.5g,8mmol)溶于干燥四氢呋喃(20ml)中,密闭冷冻,抽气干燥,然后在氩气保护,-78℃下加入二异丙基氨基锂(6ml),反应30分钟后,滴加溶于干燥四氢呋喃(10ml)的2-金刚烷酮(3.1g,10mmo化合物10l),在室温下反应2h。反应完后,将反应混合物倒入纯水,用乙酸乙酯(3×25mL)萃取,有机相用无水硫酸钠干燥,低压浓缩,用硅胶闪蒸柱层析法纯化粗产物,得到黄色固体的化合物11(2.7g,产率73%)。
实施例8化合物12的合成
将化合物11(2.3g,5mmol)在氩气条件下溶于干燥的四氢呋喃中(20ml),溶液冷却至-78℃,加入正丁基锂(3.9ml,2.5M溶于Hex中),搅拌反应30min后,加入DMF(1.9ml),随后升温至常温反应3h。薄层色谱法监测反应,反应完成后,加入饱和氯化铵溶液(5ml)淬灭反应,用乙酸乙酯(3×50mL)和盐水(3×50mL)萃取,有机相用无水硫酸钠干燥,减压浓缩,用柱层析纯化粗产物,得到淡黄色固体的化合物12(1.2g,57%)。
实施例9化合物14的合成
将4-氨基乙酰苯胺(1.3g,10mmo,化合物13)和浓盐酸(13M,5ml)在冰浴条件下搅拌,在水(10ml)中加入亚硝酸钠(1.38g,10mmol),慢慢滴加进混合溶液中,然后将氯化亚锡(1.446g,40mmol)溶于盐酸(5ml)中加入上述混合溶液,在氩气保护,冰浴条件下继续搅拌2h。反应完后,将混合溶液过滤干燥得到黄色固体的化合物14(1.6g,产率80%)。
实施例10化合物15的合成
将化合物14(1.6g,8mmol)和3-甲基-2-丁酮(0.86g,10mmol)溶于冰醋酸(15ml)中,然后加入醋酸钠(0.8g,10mmol),在氩气保护下100℃回流搅拌6h。薄层色谱法监测反应,反应完成后,待混合溶液冷却至室温后,用柱层析法纯化粗产物,得到化合物15(1.5g,产率84%)。
实施例11化合物17的合成
将化合物15(1.5g,7mmol)和1-叠氮-6溴己烷(1.545g,7.5mmo,化合物16)混合溶于乙腈(15ml)中,在90℃下氩气保护搅拌72h。反应完后,用HPLC纯化粗产物,得到化合物17(1.2g,产率51%)。
实施例12化合物18的合成
将化合物17(1.0g,3mmol)和化合物12(1.0g,3.3mmol)混合溶于乙醇(20ml)中,然后加入无水醋酸钠(0.6g,6mmol),在80℃下氩气保护搅拌12h。反应完后,混合物减压下被冷却和浓缩,使用柱层析纯化粗产物,得到红色固体(0.8g,产率52%)化合物18。
实施例13化合物19的合成
将化合物18(622mg,1mmol)溶于甲醇(5ml)中,氩气保护下逐滴加入三氟化硼-甲醇溶液(5ml),在80℃下回流8h,混合溶液颜色由红色转为蓝色后停止反应。减压冷却浓缩,使用HPLC纯化粗产物,得到蓝色的化合物19(455mg,产率78%)。
实施例14化合物21的合成
将三光气(48mg,0.16mmol,化合物20)在氩气保护下溶于干燥DCM(2ml)中,冰浴搅拌下加入化合物19(12mg,0.02mmol)和三乙胺(50μL),在0℃下反应1h。反应完后加入纯水淬灭反应,用二氯甲烷(3×10ml)提取有机相,用无水硫酸钠干燥,减压浓缩后无需纯化得到化合物21。
实施例15化合物23的合成
将化合物21(0.02mmol)溶于无水DCM(5ml)中,加入化合物5(6mg,0.02mmol)和对二甲氨基吡啶(36mg,0.3mmol),在氩气保护,0℃下搅拌1h,然后加入二甲胺(2μL in 100μLDCM,化合物22)继续搅拌10min。反应完后,加入冰水,用DCM(3×15ml)提取有机相,用无水硫酸钠干燥,减压常温浓缩,得到化合物23.
1
实施例16化合物24的合成
将化合物23(0.02mmol)溶于甲醇(10ml)中,加入亚甲基蓝(5mg,0.015mmol),用气泵接针头插入混合溶液中鼓O
实施例17化合物26的合成
将化合物24(0.02mmol)溶于无水THF(5ml)中,Propynyl-HPβCD(2-羟丙基-β-环糊精,厂家阿拉丁,牌号:128446-35-5,90mg,0.08mmol,化合物25)溶于水(500μL)后加入混合溶液中,然后加入五水硫酸铜(2mg,0.008mmol)和抗坏血酸钠(2.5mg,0.01mmol),在遮光和冰浴下搅拌5h。反应完后,低压浓缩去除THF,然后用二氯甲烷(3×30ml)和纯水(3×30ml)萃取,无需纯化减压浓缩得到化合物26,即为肾清除型双通道光学纳米探针。
实施例1~17中各化合物的反应过程如图1所示。
性能测试
光谱测试:将10μM的肾清除型双通道光学纳米探针溶液与超氧化钾溶液在37℃下测定溶液的紫外可见光谱和荧光光谱。其中,超氧化钾的超氧离子可以作为肾清除型双通道光学纳米探针的响应生物标志物,与肾清除型双通道光学纳米探针反应后会发出化学发光和荧光。采用IVIS系统采集荧光图像,采用化学发光仪采集化学发光数据,激发波长为580±10nm,发射波长为620±10nm,采集时间为0.1s。
测试结果如图2,从图2可知肾清除型双通道光学纳米探针的最大吸收波长为580nm,肾清除型双通道光学纳米探针溶液与超氧化钾响应后的最大的吸收波长为580nm。
测试结果如图3,从图3可知肾清除型双通道光学纳米探针的最大发射波长为620nm,肾清除型双通道光学纳米探针溶液与超氧化钾响应后的最大的发射波长为620nm。
测试结果如图4,从图4可知肾清除型双通道光学纳米探针在没有超氧化钾响应下,无明显化学发光变化,加入超氧化钾响应后化学发光最大发射波长为610nm。
测试结果如图5,从图5可知肾清除型双通道光学纳米探针的化学发光强度随着滴加超氧化钾溶液的浓度增加而增加。
测试结果如图6,从如图6可知肾清除型双通道光学纳米探针的化学发光动力学在2.5分钟时存在最大值,随后逐渐衰弱。
腹膜炎小鼠模型的建立:随机选取C57小鼠,实验组将含有酵母聚糖和PBS基质凝胶的混悬液注射到小鼠腹腔中,5小时后进行影像学检查。对照组将含有酵母聚糖和N-乙酰-L-半胱氨酸(NAC)的混悬液注射到小鼠腹腔,其中酵母聚糖可引发小鼠产生腹膜炎症,N-乙酰-L-半胱氨酸作为抗氧化剂减缓小鼠炎症,5小时后进行影像学检查,空白组直接注射PBS基质凝胶到小鼠腹腔,5小时后进行影像学检查。
活体小鼠炎症的实时体内NIRF成像:
测试结果如图7,从图7可知,在同浓度下的肾清除型双通道光学纳米探针中,加入不同底物如PBS、氢氧根、次氯酸根、过氧化氢、钠离子、钾离子、镁离子、亚铁离子、钙离子和超氧化钾。结果显示,肾清除型双通道光学纳米探针只对超氧化钾有反应,这证明了本发明的肾清除型双通道光学纳米探针的特异性。
测试结果如图8,从图8可知,纳米探针在未解聚前在小鼠体内清除率较低,而纳米探针在解聚后在小鼠体内的肾清除率较高,在解聚后成为小分子会通过肾脏代谢出体外,这证明了本发明的肾清除型双通道光学纳米探针具有超高肾清除效率。
测试结果如图9,从图9可知,实验组、对照组和空白组在10分钟时的化学发光达到峰值,随后逐渐衰弱,相比于对照组和空白组,实验组的化学发光强度高于其他两组。纳米探针通过小鼠腹腔注射进小鼠体内,会进入全身血液循环到达各个器官,但是图9显示,只在腹膜处有化学发光和荧光信号,这证明了本发明的肾清除型双通道光学纳米探针具有原位放大催化解聚的效果。
测试结果如图10,从图10可知,实验组、对照组和空白组在40分钟时的荧光达到峰值,强度在0-40分钟之间处于持续上升。
测试结果如图11,从图11可知,实验组在40分钟时的荧光达到峰值,强度在0-40分钟间处于持续上升。而对照组和空白组几乎没有荧光。
对于腹膜炎小鼠模型,在注射5h后,再腹膜注射肾清除型双通道光学纳米探针(10μmol/kg)后进行实时NIRF成像。使用IVIS spectrumCT系统采集荧光图像和化学发光图像,激发波长为580±10nm,荧光采集时间为1s,化学发光采集时间为3分钟。在注射纳米探针1h后被安乐处死,处死后对小鼠切除的器官进行成像。成像图如图12所示。从图12可知,实验组小鼠的膀胱荧光强度明显强于对照组和空白组,这表明解聚后的纳米探针通过肾脏代谢由尿液排出体外,而对照组加了NAC减缓炎症效果后,解聚的纳米探针较少,从而膀胱荧光强度比实验组弱,而空白组没有炎症,纳米探针无法解聚直接通过粪便排出体外,几乎不会达到肾脏通过尿液排出体外。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
