一种鸭肝蛋白源抗氧化功能肽及其制备方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及一种抗氧化功能肽,尤其是涉及一种鸭肝蛋白源抗氧化功能肽及其制备方法和应用。
背景技术
鸭肝的营养价值较高,但由于其强烈的泥土或金属的特殊气味,除了极少量的直接食用鸭肝和加工食品的辅料外,大部分鸭肝都被加工成肥料或饲料,利用附加值低。这就造成了资源的大量浪费、效益的流失,甚至影响了农业的可持续发展。因此推动鸭类产品加工副产物的高值转化利用,减少副产物处理带来的环境污染,实现变废为宝,是畜禽业健康发展必须面对的关键问题。
此外,在机体受到外界刺激时,例如环境污染物、紫外线照射等时就会打破机体内自由基的平衡状况。同时当机体处于衰老、疾病以及过度疲劳同样会产生相似的结果,这时机体会产生过量的活性氧自由基(ROS)等,导致细胞死亡和组织损伤。合成抗氧化剂是目前最常用的抗氧化剂,如丁基羟基茴香醚(BHA)、丁基羟基甲苯(BHT)、叔丁基对苯二酚(TBHQ)和没食子酸丙酯(PG),可用于抑制食品中自由基的形成,从而阻止脂质氧化。然而,由于与这些化合物存在潜在的健康风险,合成抗氧化剂的使用受到越来越多的审查。因此,寻找天然抗氧化剂作为合成化合物的替代品一直是研究人员的亟需解决的问题。
发明内容
本发明所要解决的技术问题是提供一种抗氧化活性强的鸭肝蛋白源抗氧化功能肽及其制备方法和应用
本发明解决上述技术问题所采用的技术方案为:一种鸭肝蛋白源抗氧化功能肽,包括GEHGDSSVPVWSGVN(Q1)、HLDYYLGK(Q2)、HLTPWIGK(Q3)、DTYIRQPW(Q4)、WDDMEKIWHH(Q5)和MYPGIAD(Q6)中的至少一种肽。
上述鸭肝蛋白源抗氧化功能肽的制备方法,包括以下步骤:
(1)提取鸭肝蛋白;
(2)将鸭肝蛋白酶解制备得到含有抗氧化肽的酶解粗提物;
(3)将酶解粗提物通过Sephadex G-15分离得到抗氧化肽分离物;
(4)将抗氧化肽分离物通过RP-HPLC纯化得到鸭肝蛋白源抗氧化功能肽,经LC-MS/MS鉴定分别为GEHGDSSVPVWSGVN(Q1)、HLDYYLGK(Q2)、HLTPWIGK(Q3)、DTYIRQPW(Q4)、WDDMEKIWHH(Q5)和MYPGIAD(Q6)。
进一步,步骤(1)具体为:取鸭肝,去筋,切碎后加水按质量体积比1 g:6 mL的比例于匀浆机上充分匀浆,用1 mol/L氢氧化钠调pH至12,不断搅拌,于8000 rpm,4 ℃离心10min,取中间层,继续用盐酸调pH至5.5,不断搅拌,于8000 rpm,4 ℃离心10 min,取沉淀即得到抗氧化肽分离物,冻干后冷冻保存备用。
进一步,步骤(2)具体为:在底物质量分数5%的鸭肝蛋白悬液中按添加量5000 U/g加混合酶,于pH 7.5,温度50℃,磁力水浴锅中酶解4 h后,95℃加热15 min灭酶,终止水解,将pH调至4.5,然后于8000 rpm,4 ℃,离心10min,以去除未酶解的蛋白质,得到含有抗氧化肽的酶解粗提物,然后冷冻干燥,保存在-40 ℃冰箱。
进一步,所述的混合酶为碱性蛋白酶、风味蛋白酶、木瓜蛋白酶和中性蛋白酶按质量比2:1:2:2的比例混合而成。
进一步,步骤(3)具体为:将0.1g酶解粗提物溶于10mL蒸馏水中,然后用0.45 μm水相过滤膜过滤后,采用Sephadex G-15葡聚糖凝胶柱分离,上样量为1.5 mL,超纯水以1 mL/min的流速洗脱,检测波长为220 nm,共得到4个吸收峰,收集第2个吸收峰得到抗氧化肽分离物。
进一步,步骤(4)具体为:将抗氧化肽分离物用蒸馏水配置成5 mg/mL的溶液,用0.22 μm超滤膜过滤并超声脱气后,使用装有C18柱(250×9.4 mm,5 μm)RP-HPLC进行纯化,流动相A为0.1%三氟乙酸(TFA)和5%乙腈水溶液,流动相B为100%乙腈,以流动相A 15 min内0~30%(V/V)进行线性梯度洗脱,流速为1 mL/min,检测波长设置为280 nm,上样量为100 μL,分离得到6个峰,收集第4个峰,冷冻干燥,经LC-MS/MS鉴定分别为GEHGDSSVPVWSGVN(Q1)、HLDYYLGK(Q2)、HLTPWIGK(Q3)、DTYIRQPW(Q4)、WDDMEKIWHH(Q5)和MYPGIAD(Q6)。
进一步,所述的0.1%三氟乙酸和5%乙腈水溶液的配制方法为:称取1克三氟乙酸和5ml乙腈,溶于994mL水中即可。
上述鸭肝蛋白源抗氧化功能肽在制备炎症因子TNF-α、IL-1β抑制剂或者ACE抑制剂或者DPP-IV抑制剂方面的用途。
与现有技术相比,本发明的优点在于:本发明一种鸭肝蛋白源抗氧化功能肽及其制备方法和应用,利用多种酶水解鸭肝蛋白获得小分子活性肽,进一步纯化并鉴定鸭肝肽,得到了6种新的抗氧化肽,通过体外合成、计算机模拟、分子对接确认肽的生物学功能,在氧化损伤HepG2细胞探讨抗氧化肽的保护作用。不仅可以解决鸭肝副产物的高值化利用,增加经济效益,还解决了工业生产肽的得率低、特异性不强、质量不稳定等问题,提供了具抗氧化功能的肽高效生产方法。
附图说明
图1为鸭肝蛋白单酶水解物的DPPH自由基清除率和水解度;
图2为鸭肝蛋白最佳条件下酶解产物的分子量分布;
图3为鸭肝蛋白最佳条件下酶解产物的电镜扫描图;上面3个a表示鸭肝蛋白,下面3个b代表鸭肝多肽粉;
图4为鸭肝蛋白酶解粗提物Sephadex G-15凝胶色谱分离峰图;
图5 为Sephadex G-15分离鸭肝蛋白酶解产物所得各组分在DPPH、ABTS及羟基法中的抗氧化活性;
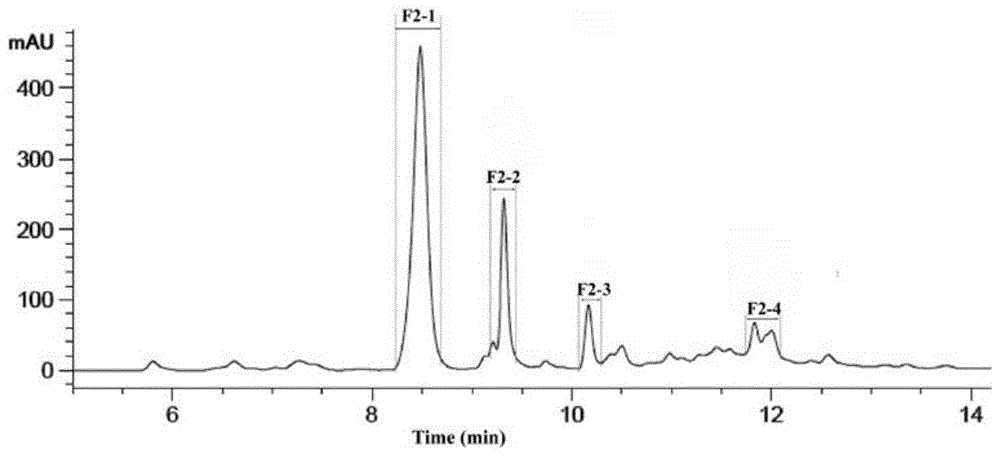
图6为F2组分经RP-HPLC纯化抗炎、抗菌肽的洗脱峰图;
图7为RP-HPLC分离组分F2所得各组分的抗氧化活性;
图8为LC-MS/MS鉴定6条新的抗氧化肽的质谱图;
图9为鸭肝抗氧化肽的体外抗氧化活性的验证;其中(1)为鸭肝抗氧化肽对ABTS自由基清除能力;(2)为鸭肝抗氧化肽对DPPH自由基清除能力;
图10为6条新的抗氧化肽3D结构预测和分子对接;其中(1)为;6条新的抗氧化肽;(2)为6条新抗氧化肽与DPPH分子对接图,a-f对应的多肽分别为Q1-Q6;(3) 为6条新的抗氧化肽与ABTS分子对接图,a-f对应的多肽分别为Q1-Q6;
图11为抗氧化肽对HepG2细胞和H
图12为抗氧化肽对H
图13为抗氧化肽对SOD酶和CAT酶相对基因表达的影响以及对促炎因子TNF-α和IL-1β的影响;其中(1)为抗氧化肽对SOD酶相对基因表达的影响。(2)为抗氧化肽对CAT酶相对基因表达的影响。(3)为抗氧化肽对促炎因子TNF-α的影响。(4)为抗氧化肽对促炎因子IL-1β的影响。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
在下文中,仅简单地描述了某些示例性实施例。正如本领域技术人员可认识到的那样,在不脱离本发明申请实施例的精神或范围的情况下,可通过各种不同方式修改所描述的实施例。因此,附图和描述被认为本质上是示例性的而非限制性的。
本发明中的以下缩略语具体定义为:
LC-MS/MS,液相二级质谱;RP-HPLC,反相高效液相色谱;LPS,脂多糖;PCR,聚合酶链式反应;qPCR,实时荧光定量核酸扩增检测系统;ELISA,酶联接免疫吸附剂测定;DCFH-DA,活性氧ROS荧光探针;SOD,超氧化物歧化酶;DSS,葡聚糖硫酸钠盐。
一、具体实施例
一种鸭肝蛋白源抗氧化功能肽的制备方法,包括以下步骤:
1、提取鸭肝蛋白
首先,取鸭肝适量,去筋,切碎后加水1:6(m/v,g/mL)于匀浆机上充分匀浆,1 mol/L氢氧化钠调至pH 12,不断搅拌,8500 rpm,4 ℃离心10 min,取中间层,继续用盐酸调至pH5.5,不断搅拌,8500 rpm,4 ℃离心10 min取沉淀,冻干后冷冻保存备用,凯氏定氮法测定鸭肝中粗蛋白质含量为79.58%。
2、制备抗炎和抗菌肽粗提物
首先,向底物质量分数5%的鸭肝蛋白悬液加酶5000 U/g,pH 7.5;温度为50℃;碱性蛋白酶:风味蛋白酶:木瓜蛋白酶:中性蛋白酶在2:1:2:2的条件下,磁力水浴锅中酶解4h后,95 ℃加热15 min灭酶,终止水解,将pH调至4.5,然后离心(8000 rpm, 4 ℃,10min),以去除未酶解的蛋白质,得到含有抗氧化肽的酶解粗提物,然后冷冻干燥,保存在-40 ℃冰箱。
3、Sephadex G-15分离小分子肽
首先,将0.1g酶解粗提物溶于10mL蒸馏水中,然后用0.45 μm水相过滤膜过滤,采用Sephadex G-15葡聚糖凝胶柱分离,上样量为1.5 mL,超纯水以1 mL/min的流速洗脱,检测波长:220 nm,共得到4个吸收峰,收集第2个吸收峰得到抗氧化肽分离物F2。
4、RP-HPLC纯化
首先,将用抗氧化肽分离物F2蒸馏水配置成5 mg/mL的溶液,用0.22 μm超滤膜过滤并超声脱气;使用装有C18柱(250×9.4 mm,5 μm)RP-HPLC纯化鸭肝蛋白抗氧化菌肽分离物F2,流动相A为0.1%三氟乙酸(TFA)和5%乙腈水溶液(称取1克三氟乙酸和5ml乙腈,溶于994mL水中即可),流动相B为100%乙腈,以流动相A 15 min内0~30%(V/V)进行线性梯度洗脱,流速为1 mL/min,检测波长设置为280 nm,上样量为100 μL,分离得到6个峰,收集第4个峰,冷冻干燥。
5、LC-MS/MS鉴定活性组分
首先,使用LC-MS/MS鉴定,根据MS/MS光谱、查阅鸭肝蛋白库以及通过比对Biopep数据库并用蛋白质组学软件MaxQuant(1.6.2.10版)分析MS/MS数据。序列在Anasplatyrhynchos的蛋白质组参考数据库中检索,以匹配亲本蛋白。筛选肽段序列的标准是根据质谱的可信度与峰强度。经鉴定F2-4为6条首次发现的抗氧化肽,分别是GEHGDSSVPVWSGVN(Q1)、HLDYYLGK(Q2)、HLTPWIGK(Q3)、DTYIRQPW(Q4)、WDDMEKIWHH(Q5)和MYPGIAD(Q6)。
二、实验结果分析
1、四种酶水解鸭肝蛋白制备抗炎和抗菌肽;
由图1可知,在五种蛋白酶中,复合蛋白酶水解后抗氧化能力最弱,碱性蛋白酶的自由基清除率最强,但水解度比风味蛋白酶小,故删除复合蛋白酶。
表1鸭肝蛋白酶解物的水解度和自由基清除率
如表1所示,加酶量5000 U/g,pH 7.5;温度为50 ℃;碱性蛋白酶:风味蛋白酶:木瓜蛋白酶:中性蛋白酶在2:1:2:2的条件下,底物水解度较高,且·OH与DPPH自由基清除率均较强,采用优化后的酶解条件为:底物质量分数5%的鸭肝蛋白悬液在最佳酶解条件下,磁力水浴锅中酶解4 h后,95 ℃加热15 min灭酶,终止水解。将pH调至4.5,然后离心(8000rpm,10 min,4℃),以去除未消化的蛋白质,旋蒸后冻干,保存在-40℃冰箱。
四种酶水解产物的分子量分布如图2所示,鸭肝蛋白经四种酶协同水解后,获得了分子量较小的多肽,其中小分子肽(<1500 Da)达到70.25%,而>3000 Da的肽百分比含量仅为1.43%。其中酶解后得到的小分子肽(< 1000 Da)均达到53%左右,多肽的分子量大小影响抗氧化活性。从图3可以看出鸭肝蛋白呈连续凹凸不平、不规则的大孔海绵状结构,降解后的蛋白更加光滑且有片状堆叠的结构出现。结果表明,酶处理后的蛋白质已降解成小片段。
2、水解物的分离、纯化
图4是对鸭肝水解物的分离。鸭肝蛋白酶解产物经Sephadex G-15初步分离后,共得到4个吸收峰。图5是其在DPPH、ABTS及羟基自由基法中的抗氧化活性,在1.0 mg/mL浓度下,组分F2的抗氧化性最强,其中DPPH自由基清除活性(45.55 ± 2.37%)、ABTS自由基清除活性(77.68 ± 1.08%)和羟基自由基清除活性(24.06 ± 1.33%)明显高于其他三个组分(p < 0.05)。确认组分F2的抗氧化性最强,作为抗氧化肽粗品。
图6是对抗氧化肽的分离纯化,通过RP-HPLC进一步分离组分F2,并将其分为4个组分F2-1、F2-2、F2-3、F2-4。图7是在浓度为1.0 mg/mL所有四个馏分中,馏分F2-4具有较高的DPPH、ABTS和羟自由基清除活性(26.95 ± 1.30%)(p<0.05),F2-4的ABTS和羟基自由基清除活性能力与谷胱甘肽类似。
使用LC-MS/MS分离并鉴定了高抗氧化活性馏分F2-4,发现了6个新肽,如图8和表2,分别是GEHGDSSVPVWSGVN(Q1)、HLDYYLGK(Q2)、HLTPWIGK(Q3)、DTYIRQPW(Q4)、WDDMEKIWHH(Q5)和MYPGIAD(Q6)。这些肽具有7-15个氨基酸,分子量为765.33–1525.68 Da。先前的报道表明,大多数源自食物蛋白的抗氧化肽是由2-20个氨基酸组成,分子量为500-1800 Da,本实验结果与其相一致。此外,研究表明低分子量肽具有很强的抗氧化活性,这可能是由于空间位阻以及低分子量肽与自由基之间容易发生反应所致。
图9-(1)和(2)是通过测定DPPH和ABTS自由基清除活性方法验证其抗氧化活性,可以看出这些肽均显示出一定的抗氧化活性,并且HLDSYLGK(Q2),DTYIRQPW(Q4)和MYPGIAD(Q6)的ABTS清除活性的IC50(29.13 ± 0.49 µmol,36.23 ± 1.86 µmol和26.40 ± 0.59µmol)甚至超过阳性对照谷胱甘肽(39.16 ± 2.11 µmol)。这些肽中都含有Tyr残基,表明肽段中Tyr残基的存在与强大的清除ABTS
表2具有抗氧化潜力的LC-MS/MS鉴定的肽的特征
。
3、3D结构确定、分子对接及功能确定
首先,使用PEP-FOLD V3.5(http://bioserv.rpbs.univ-paris-diderot.fr/services/PEP-FOLD3/)建立肽段的3D结构模型,然后使用PyMOL软件获得了预测的3D结构图的图像。最后,鸭肝蛋白水解肽与DPPH和ABTS的分子对接。将肽和配体分子(DPPH和ABTS)通过AutoDock Tools软件(http://autodock.scripps.edu/)进行分子对接。配体分子(DPPH和ABTS)的3D结构从PubChem(https://pubchem.ncbi.nlm.nih.gov)检索。ABTS的PubChem CID为5,360,881,DPPH为2,735,032。
表3和4是6条新的鸭肝抗氧化肽的计算机中评估的理化性质和生物学潜力。结果表明,所鉴定肽的疏水性为+10.11 ~ +20.30 kcal/mol,P1~P5的亲水性为-0.30 ~ -1.44kcal/mol,P6的亲水性为0.20 kcal/mol。结果表明这6条新肽热稳定性良好。所有已鉴定的鸭肝抗氧化肽显示出良好的ACE(血管紧张素转换酶)、抗氧化和DPP-IV(dipeptidylpeptidase IV)能力。如图10-(1)所示,Q1具有两个β-转角和β-折叠,但是除Q1外,其它鸭肝肽均具有α-螺旋结构。肽的不同空间构象会影响其生物学活性,α-螺旋在肽的抗氧化活性中起关键作用。因此,这就解释了这几条鸭肝肽具有抗氧化特性的原因。此外,Q2和Q5的3D结构具有两个完整的α-螺旋,Q6同时具有α-螺旋和β-转角,这可能是具有极高的ABTS自由基清除能力的原因。Q1出现两个β转角,其中S6残基和S12残基暴露于外部介质,这可能是其极高的DPPH清除能力的原因。
图10-(2)和(3)分别是6条鸭肝抗氧化肽与DPPH和ABTS的分子对接。分子对接结果表明,这些肽与自由基之间建立了氢键。肽(Q1-Q6)的活性中心的氨基酸残基(TRP-11,LYS-8,PRO-4,ARG-5,HIS-9,MET-1)分别与DPPH相互作用形成氢键平均键长为2.19 Å。Q1-Q6与ABTS在氨基酸残基(GLU-2,ASP-3,ILE-6,THR-2,HIS-9,ALA-6)上分别形成氢键,平均键长为2.17 Å。DTYIRQPW(Q4)/MYPGIAD(Q6)与ABTS之间形成了两个氢键。从以上分子对接的结果可以看出,肽的自由基清除活性与形成的氢键数目和对接位置上的氨基酸残基有关。
表3模拟得到的6条新的抗氧化肽的理化性质
。
表4模拟得到的6条新抗氧化肽的生物学活性
。
4、6条抗氧化肽对HepG2细胞氧化损伤的保护作用
在H
表5引物序列
。
鸭肝抗氧化肽对HepG2细胞存活率的影响如图11-(1)所示,各处理组的细胞存活率均在90%以上,不会对HepG2细胞产生毒害作用。如图11-(2)所示,过氧化氢容易穿透细胞膜,刺激细胞产生氧化应激,导致细胞凋亡,与对照组相比,损伤组细胞活力为47.99%。除Q1组(1 μmol/L)外,其余各组细胞活力均显著高于损伤组。其中Q5组(500 μmol/L)的细胞存活率是损伤组的1.76倍。CCK-8实验结果显示,抗氧化肽预处理对H
机体中活性氧积累可导致氧化损伤、正常代谢和生理机能失调。如图12-(2)所示,与对照组相比,H
表6鸭肝抗氧化肽对H
。
SOD是抵抗氧自由基的第一道防线,可以有效消除自由基并使人体细胞免受氧化损伤。由上述表6可知,对照组的SOD水平为49.98 ± 0.13 U/mg prot.,而H
从图13-(1)和(2)可知,对HepG2细胞使用三种浓度的DTYIRQPW(Q4)培养24 h后,结果显示:CAT、SOD mRNA水平升高,与鸭肝抗氧化肽(Q4)浓度呈正相关。低浓度组(20 µmol/L)与对照组的SOD基因表达没有表现出显著性差异,中浓度和高浓度组均与对照组有显著性差异,这几个浓度的基因表达量均远远高于损伤组。在CAT酶的基因表达中,Q4中浓度组(100 µmol/L)与对照组(control组)没有显著性差异,高浓度组(500 µmol/L)中mRNA的表达量远远高于对照组和损伤组。因此可见,鸭肝抗氧化肽预处理能通过增加CAT和SOD水平,有效增强HepG2细胞的抗氧化防御系统的活性。
肿瘤坏死因子(TNF-α)和细胞内白介素1β与炎症反应有关,而炎症反应又与氧化应激有着密切的关系,TNF-α可直接诱导ROS的产生,ROS的积累造成细胞氧化损伤,导致细胞坏死凋亡。由图13-(3)可知,H
由图13-(4)可知,H
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
