用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化标志物
文献发布时间:2023-06-19 19:27:02
技术领域
本申请属于医药技术领域,尤其涉及用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化标志物。
背景技术
肝癌即肝脏恶性肿瘤,可分为原发性和继发性两大类。原发性肝脏恶性肿瘤起源于肝脏的上皮或间叶组织,前者称为原发性肝癌,是我国高发的,危害极大的恶性肿瘤;后者称为肉瘤,与原发性肝癌相比较较为少见。对于肝癌患者而言,如果早期发现和诊断肝癌,就更有可能接受根治性治疗(手术、消融等),其治疗效果和预后均明显优于晚期肝癌。因此,肝癌的早期诊断意义非常重大。
肿瘤患者的血循环中还可检测到游离循环肿瘤DNA(circulating tumor DNA,ctDNA),由于ctDNA携带有与原发肿瘤组织相一致的分子遗传学改变,并且能全面地反映患者体内肿瘤细胞的遗传信息和演变进程,可以作为理想的肿瘤标志物,用于肿瘤的诊断、分子分型、疗效评价和追踪以及预后评估。
发明内容
鉴于此,本申请公开了用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化标志物,本申请筛选出肝癌患者ctDNA中与肝动脉灌注化疗治疗敏感性相关的甲基化位点,构建疗效预测甲基化位点组合,验证其有效性,并开发相应的临床检测的检测试剂和试剂盒。
本申请第一方面提供了一种用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化标志物,所述ctDNA甲基化标志物由BMPR1A和PLAC8组成。
本申请第二方面提供了一种用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化检测试剂,包括用于检测BMPR1A基因甲基化的第一试剂和用于检测PLAC8基因甲基化的第二试剂。
作为优选,所述第一试剂包括检测BMPR1A基因甲基化的特异性引物和第一特异性探针;所述第二试剂包括检测PLAC8基因甲基化的特异性引物和第二特异性探针。
作为优选,所述检测BMPR1A基因甲基化的特异性引物的序列如SEQ ID NO:1所示和SEQ ID NO:2所示;所述第一特异性探针的序列如SEQ ID NO:3所示和SEQ ID NO:4所示。
作为优选,所述检测PLAC8基因甲基化的特异性引物的序列如SEQ ID NO:5所示和SEQ ID NO:6所示;所述第二特异性探针的序列如SEQ ID NO:7所示和SEQ ID NO:8所示。
具体的,SEQ ID NO:1~SEQ ID NO:8的序列如下:
SEQ ID NO:1GATAGTTTGTTTTGTGTTT;
SEQ ID NO:2CTTCTAATTCAAATAACAACA;
SEQ ID NO:3FAM-TATGTAYGTCGGGATTTTT-BQ1;
SEQ ID NO:4HEX-ATATGTAYGTTGGGATTTTT-BQ1;
SEQ ID NO:5AAAGGGGAGAGGTAA;
SEQ ID NO:6CCACTTCTACTAAATTACTCTA;
SEQ ID NO:7FAM-GTTTTTATCGTAGGGTATAGT-BQ1;
SEQ ID NO:8HEX-TGTTTTTATTGTAGGGTATAGT-BQ1。
本申请第三方面提供了一种用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化试剂盒,包括:所述ctDNA甲基化检测试剂。
作为优选,所述试剂盒是ddPCR试剂盒、RT-PCR试剂盒、DNA芯片试剂盒、ELISA试剂盒、ctDNA试剂盒或DNA/RNA甲基化修饰试剂盒。
本申请第四方面提供了一种用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的设备,包括:测定单元和分析输出单元;
测定单元,用于测定从目标受试者的生物样品中BMPR1A基因的甲基化率以及PLAC8基因的甲基化率;
判断输出单元,用于对所述BMPR1A的甲基化率和所述PLAC8的甲基化率进行判断并输出受试者的肝癌信息或受试者的信息。
作为优选,所述判断输出单元具体用于将所述BMPR1A的甲基化率与5.5%判断大小,若所述BMPR1A的甲基化率≥5.5%,则输出所述受试者的肝癌阳性结果;
所述判断输出单元具体用于判断所述BMPR1A的甲基化率是否在预置范围内,且将所述PLAC8的甲基化率与10.0%判断大小;若4.0%≤所述BMPR1A的甲基化率<5.5%,且所述PLAC8的甲基化率≥10%,则输出所述受试者的肝癌阳性结果。
作为优选,所述判断输出单元具体用于将所述BMPR1A的甲基化率与4.0%判断大小,且将所述PLAC8的甲基化率与10.0%判断大小;若所述BMPR1A的甲基化率<4.0%,且所述PLAC8的甲基化率≥10%,则输出所述受试者的肝癌阴性结果;
所述判断输出单元具体用于将所述BMPR1A的甲基化率与5.5%判断大小,且将所述PLAC8的甲基化率与10.0%判断大小;若所述BMPR1A的甲基化率<5.5%,且所述PLAC8的甲基化率<10%,则输出所述受试者的肝癌阴性结果。
本申请第五方面公开了所述ctDNA甲基化标志物在制备诊断肝癌试剂中的应用,所述ctDNA甲基化标志物由BMPR1A和PLAC8组成。
本申请第六方面公开了所述ctDNA甲基化标志物在制备预测肝动脉灌注化疗药物敏感性试剂中的应用,所述ctDNA甲基化标志物由BMPR1A和PLAC8组成。
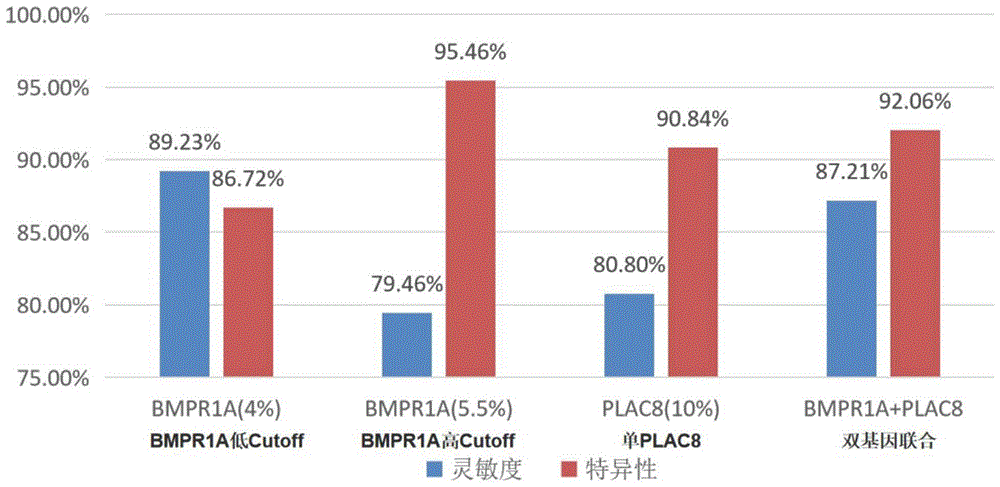
本申请提供的设备,判断BMPR1A基因甲基化率≥5.5%时,PLAC8基因甲基化率<10.0%或≥10.0%,结果判定为阳性;4.0%≤BMPR1A基因甲基化率<5.5%时,PLAC8基因甲基化率≥10.0%,结果也判定为阳性。BMPR1A基因甲基化率<4.0%时,PLAC8基因甲基化率≥10.0%,结果判定为阴性;BMPR1A基因甲基化率<5.5%时,PLAC8基因甲基化率<10.0%,结果也判定为阴性。这一诊断模型对肝癌的诊断敏感性为87.21%,特异性为92.06%,相对BMPR1A低Cutoff值(4%),双基因模型灵敏度降低2.02%,特异性提高5.34%;相对BMPR1A高Cutoff值(5.5%),双基因模型灵敏度提高7.75%,特异性仅降低3.40%;相对PLAC8单独Cutoff值(10%),双基因模型灵敏度提高6.41%,特异性提高1.22%。
本申请针对现有技术中缺少高效的诊断肝癌、预测治疗效果的试剂和方法的问题,公开了用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化检测试剂、试剂盒。本申请发现:ctDNA甲基化标志物—BMPR1A和PLAC8可用于诊断肝癌、预测肝动脉灌注化疗药物敏感性。本实施例显示,采用双基因BMPR1A和PLAC8的甲基化检测可用于诊断肝癌、预测肝动脉灌注化疗药物敏感性。结果可知双基因BMPR1A和PLAC8的甲基化符合预置的阳性阈值下,对肝癌具有高准确性和特异性的诊断效果,对于患者化疗疗效预测较传统CT/MR更具时效性。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示本申请实施例提供的用于构建肝癌诊断模型的ctDNA甲基化位点及其对应基因;
图2示本申请实施例提供的ctDNA肝癌诊断模型对肝癌和正常人群的诊断效果,其中,a图为训练组715例肝癌和560例正常标本检测结果列联表;b图为验证组383例肝癌和275例正常标本检测结果列联表;c图为诊断模型在训练组中的受试者曲线;d图为诊断模型在验证组中的接收者操作特征曲线ROC;e图为10个甲基化位点在训练组中的Heatmap;f图为10个甲基化位点在验证组中的Heatmap;
图3示本申请实施例提供的BMPR1A(左)和PLAC8(右)基因ddPCR检测甲基化水平对肝癌的诊断效果;
图4示本申请实施例的BMPR1A(左)和PLAC8(右)基因在不同疾病人群中的甲基化水平;
图5示本申请实施例提供的双基因甲基化联合诊断模型较单基因诊断肝癌的敏感性和特异性;
图6示本申请实施例提供的BMPR1A和PLAC8双基因甲基化诊断模型临床试验前性能验证结果;
图7示本申请实施例提供的临床试验ITD人群1155例样本构成情况;
图8示本申请实施例提供的临床试验ITD人群及PPS人群样本收集流程;
图9示本申请实施例提供的HAIC患者影像学评估及相关甲基化探针变化率;
图10示本申请实施例提供的影像评估SD组患者的进一步区分。
具体实施方式
本申请提供了及用于诊断肝癌、预测肝动脉灌注化疗药物敏感性的ctDNA甲基化标志物,用于解决缺少高效的诊断肝癌、预测治疗效果的试剂和方法的缺陷。
下面将对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
其中,以下实施例所用试剂均为市售。
实施例1
本申请实施例提供了血清ctDNA肝癌诊断相关甲基化标志物的筛选实验,具体包括:
1、首先从全基因组水平上对来自TCGA数据库的肝癌组织和正常血液DNA的485,000个CpG位点甲基化水平进行了比较,筛选出差异性最显著的候选位点;设计相应的锁式探针(Padlock probe),对近两千例肝癌和正常人血浆中提取的微量ctDNA进行了甲基化PCR扩增和测序,确定了这些位点的甲基化水平,最后分别筛选出10个和8个位点建立了诊断模型和生存预后模型(图1)。由10个标志物构建的诊断模型,在训练组715例肝癌患者和560例正常人中的诊断敏感性和特异性分别达到了85.7%和94.3%,在验证组383例肝癌患者和275例正常人中的诊断敏感性和特异性分别达到了83.3%和90.5%,均明显高于现有肝癌血清标志物AFP(图2)。
2、本实施例首先针对NGS筛选出的10个肝癌诊断位点,利用ddPCR进行了特异性的检测,希望进一步降低位点数量(便于临床检测和应用),选择适用于微滴式数字PCR(ddPCR)检测的标志物。
3、收集了348例样本,其中肝癌患者血清174例,健康人群血清174例,利用ddPCR对10个候选基因位点进行了甲基化水平的检测,发现其中两个基因位点的甲基化水平诊断肝癌的准确率最高,分别是BMPR1A(Gene ID:657)和PLAC8(Gene ID:51316),其接收者操作特征曲线(ROC)下面积(AUC)为10个位点中最高的,分别为0.958和0.938,其余位点的AUC分别为:Chr6:170(0.719),PSD(0.879),KLF3(0.723),ATXN1(0.869),ATAD2(0.844),Chr6:3(0.755),ARHGAP25(0.673),Chr8:20(0.844)。因此决定选择BMPR1A和PLAC8作为筛选后的诊断位点,进行后续验证试验,结果如图3所示。
4、由图3可见,BMPR1A和PLAC8基因ddPCR检测甲基化水平诊断肝癌的AUC接近原来由10个基因构建的诊断模型(训练组0.966,验证组0.944),原因可能有:1.样本量为1.5ml血清,并经过制备优化和标准化,第一次离心:≥3000转/分钟5分钟,第二次离心:≥10000g10分钟,提高了ctDNA含量并减少了其他有形细胞DNA成分对结果的影响;2.对ctDNA提取流程进行优化,在EZ DNA Methylation-Lightning Kit基础上,改进各组分成分,进一步提高了ctDNA的提取效率;3.针对已知位点设计的探针可通过ddPCR高效扩增目标基因,较NGS同时检测数百个位点的甲基化水平更精准。
实施例2
本申请实施例提供了BMPR1A和PLAC8基因的临床试验中最佳的阳性阈值(Cutoff值),具体步骤包括:
1、本实施例收集了892例血清样本,其中肝癌组293例(Ⅰ期61例、Ⅱ期72例、Ⅲ期96例、Ⅳ期68例),良性肝病(血管瘤、肝硬化等)198例,其他肿瘤104例,正常健康人群293例,进行BMPR1A和PLAC8基因甲基化水平检测。结果显示,两者的甲基化水平在肝癌组显著高于其他对照组(图4)。
两个基因单独检测,取甲基化水平不同的Cutoff值诊断肝癌的敏感性和特异性见表1,显示随着甲基化率Cutoff值升高,诊断肝癌的敏感性逐渐降低,特异性逐渐升高。BMPR1A基因的甲基化水平在4.0~5.5%之间特异性和灵敏度不够理想,考虑引入PLAC8基因,建立联合诊断模型后,对肝癌的诊断特异性不低于90%。
表1.BMPR1A和PLAC8基因甲基化水平的不同Cutoff诊断肝癌的敏感性和特异性
因此,综合两个基因甲基化率进行双重判定,即BMPR1A基因甲基化率≥5.5%时,PLAC8基因甲基化率<10.0%或≥10.0%,结果判定为阳性;4.0%≤BMPR1A基因甲基化率<5.5%时,PLAC8基因甲基化率≥10.0%,结果也判定为阳性。BMPR1A基因甲基化率<4.0%时,PLAC8基因甲基化率≥10.0%,结果判定为阴性;BMPR1A基因甲基化率<5.5%时,PLAC8基因甲基化率<10.0%,结果也判定为阴性(见表2)。这一诊断模型对肝癌的诊断敏感性为87.21%,特异性为92.06%(见图5),相对BMPR1A低Cutoff值(4%),双基因模型灵敏度降低2.02%,特异性提高5.34%;相对BMPR1A高Cutoff值(5.5%),双基因模型灵敏度提高7.75%,特异性仅降低3.40%;相对PLAC8单独Cutoff值(10%),双基因模型灵敏度提高6.41%,特异性提高1.22%。
表2.BMPR1A和PLAC8基因甲基化水平联合诊断模型
2、根据BMPR1A和PLAC8基因甲基化水平双重判断原则,892例临床样本的敏感性和特异性结果见表3。结果显示对于Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期肝癌的诊断敏感性分别为88.52%,90.28%,87.50%,82.35%,肝癌组整体诊断敏感性为87.21%。对于正常健康人、良性肝病组和其他癌症组的诊断特异性分别为93.52%,95.45%和81.73%,非肝癌组整体诊断特异性为92.06%。
表3.BMPR1A和PLAC8基因甲基化水平对不同样本诊断的敏感性和特异性
3、为开展后续的前瞻性临床试验,评价BMPR1A和PLAC8双基因甲基化法对肝癌的诊断效果,本实施例从中山大学肿瘤防治中心收集了769例血清样本进行临床试验前的性能验证,目的在于进一步确定双基因甲基化诊断模型的Cutoff值设置是否合理。769例标本包括肝癌组289例(Ⅰ期91例、Ⅱ期99例、Ⅲ期72例、Ⅳ期27例),良性肝病(血管瘤、肝硬化等)227例,其他肿瘤49例,正常健康人群204例。按照预设Cutoff值及判定原则,769例样本的检测结果见表4。结果显示,全组样本的灵敏度,即真阳性率=A/(A+C)×100%=91.00%;特异性,即真阴性率=D/(B+D)×100%=92.50%;诊断准确率=(A+D)/(A+B+C+D)×100%=91.94%。对Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期肝癌的诊断敏感性分别为90.11%,90.91%,93.06%和88.89%,对正常健康人、良性肝病组和其他癌症的诊断特异性分别为96.57%,90.75%和81.63%(见图6),显示双基因甲基化水平的诊断Cutoff值符合预期,满足开展临床试验的要求。
实施例3
本申请实施例提供了BMPR1A和PLAC8双基因甲基化标志物应用于多中心的临床诊断中进行验证试验,具体包括:
1、为在更大样本人群中验证BMPR1A和PLAC8双基因甲基化诊断模型的真实效果,开展了多中心的临床试验,分别从中山大学肿瘤防治中心、广州医科大学附属第一医院、解放军总医院第三医学中心收集了原发性肝癌(病例组),其他肝脏疾病、其他癌种和健康人群(对照组)的血清标本共1155例,意向入组人群ITD(intention-to-diagnose)构成情况为:肝癌组420例(Ⅰ期135例、Ⅱ期82例、Ⅲ期160例、Ⅳ期43例),良性肝病(血管瘤、慢乙肝、肝硬化等)385例,其他肿瘤74例,正常健康人群276例(见图7)。遵循研究方案人群PPS(Per-Protocol set),为1155例ITD人群剔除7例违背入选标准,52例质控不合格和3例PCR结果油滴数不够后的1093例样本,样本收集流程见图8,各中心入组样本情况见表4。其中,临床试验ITD人群及PPS人群样本收集流程如图8所示。
表4临床试验各中心样本完成情况汇总
注:中心1:中山大学肿瘤防治中心,中心2:广州医科大学附属第一医院,中心3:解放军总医院第三医学中心。
2、将双基因甲基化诊断模型与临床诊断金标准对比,ITD人群和PPS人群的检测结果见表5,结果显示在ITD人群中,甲基化诊断模型的敏感性为95.48%,特异性为96.87%;在PPS人群中,甲基化诊断模型的敏感性为95.21%,特异性为96.84%,提示甲基化诊断模型对于原发性肝癌诊断效果理想,符合临床应用需求。
表5.双基因甲基化诊断模型在ITD人群和PPS人群中的检测结果
3、进一步分析双基因甲基化诊断模型对于不同肿瘤分期的肝癌患者的阳性符合率(表6),可见对于中期肝癌(Ⅱ期和Ⅲ期),诊断模型在ITD和PPS人群中的阳性符合率分别为100.00%,96.88%和100%,96.75%,较Ⅰ期和Ⅳ期患者的92.59%,90.70%和92.00%,90.24%明显为高,提示这一诊断模型在中期肝癌患者的准确性较早期或晚期患者均高,可能更加适合用来对中期肝癌患者的手术切除效果进行评价以及用于术后复发的监测。
表6.双基因甲基化诊断模型对不同分期肝癌患者的诊断阳性符合率
实施例4
本申请实施例提供了肝动脉灌注化疗的肝癌患者进行分析
1、本实施例进一步纳入了50例接受肝动脉灌注化疗的肝癌患者进行分析。按照传统影像学评估,在肝动脉灌注化疗(HAIC)治疗6-8周肿瘤评价为纳入50例,其中肿瘤评价部分缓解(partial response,PR)患者11人,疾病稳定(stable disease,SD)患者25人,疾病进展(progressive disease,PD)患者14人,按肿瘤评价分组后各组的在生存上有明显差异。同时,留取各组HAIC治疗前及治疗后3-7天的血标本,以计算ctDNA甲基化率的变化。结果如图9和图10所示。结果表明,本申请开发的试剂盒,其探针甲基化率变化与最终影像学肿瘤评估高度相符,但在SD组中存在部分不一致的现象。
本实施例所用的引物及探针序列如下:
BMPR1A基因对应的引物探针序列包括:
引物1-F 5'GATAGTTTGTTTTGTGTTT 3'(SEQ ID NO:1);
引物1-R 5'CTTCTAATTCAAATAACAACA 3'(SEQ ID NO:2);
探针1-M 5'FAM-TATGTAYGTCGGGATTTTT-BQ13',FAM标记(SEQ ID NO:3);
探针1-NM 5'HEX-ATATGTAYGTTGGGATTTTT-BQ13',HEX标记(SEQ ID NO:4)。
PLAC8基因对应的引物探针序列包括:
引物2-F 5'AAAGGGGAGAGGTAA 3'(SEQ ID NO:5);
引物2-R 5'CCACTTCTACTAAATTACTCTA 3'(SEQ ID NO:6);
探针2-M 5'FAM-GTTTTTATCGTAGGGTATAGT-BQ13',FAM标记(SEQ ID NO:7);
探针2-NM 5'HEX-TGTTTTTATTGTAGGGTATAGT-BQ13',HEX标记(SEQ ID NO:8)。
本实施例所用的试剂盒的成分如下:
2、本实施例进一步将SD组按照探针甲基化变化水平进行分组,其中明显下调组9人(SD-组2),无明显下调组16人(SD-组1),将SD组进一步区分后,并进行生存分析,发现PR组与SD-组2、SD-组1与PD组都无明显差异(P=0.388、P=0.108),而SD-组1与SD-组2存在明显差异(P=0.011)。因此,本实施例初步认为,ctDNA甲基化试剂盒在预测肝动脉灌注化疗疗效上与传统影像学评价高度一致,具有更快的时效性及准确性。
以上所述仅是本申请的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
- 用于肝癌诊断以及肝癌预后预测的生物标志物
- 用于诊断肝癌和预测肝癌转移的血清miRNA标志物及其检测试剂盒
