一种EGFR抑制剂、组合物及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种用于治疗卵巢癌的化合物、组合物及其应用,特别是涉及一种EGFR抑制剂、组合物及其应用。
背景技术
癌症精准医疗是当今全球最炙手可热的研究领域,主要的理念是根据癌症患者基因组学,在分子水平设计治疗方案,以达到降低疾病风险和更有效的治疗癌症。“合成致死”是在精准医疗框架内的一种安全、有效抗癌的新概念,具有巨大的应用潜力。
“合成致死”是指两个基因中的任何一个单独的干扰不会影响细胞存活,但同时干扰两个基因会导致细胞死亡。因此,通过靶向合成致死基因突变的伴侣蛋白,将选择性地杀死癌细胞,同时保留正常细胞。例如部分肿瘤患者的肿瘤细胞会在BRCA1/2处产生突变,而BRCA1/2对HR修复DNA双链断裂(DSBs)起重要作用。多聚ADP核糖聚合酶(PARP)是一种参与DNA单链断裂修复的酶。PARP抑制后阻断DNA单链断裂的修复,从而诱导DNA双链断裂(DSB)。通过对BRCA1/2突变肿瘤细胞使用PARP抑制剂,可阻断此类肿瘤细胞PARP的表达,进而阻碍DNA单链断裂的修复,使肿瘤细胞DNA单链和双链断裂的修复机制同时损伤,产生合成致死性。因此奥拉帕尼成为首个被批准用于治疗BRCA基因缺陷相关的晚期卵巢癌的PARP抑制剂(PARPi)。
但卵巢癌基因图谱表示,仅有少数的卵巢癌患者BRCA1/2发生突变,意味着大部分BRCA1/2野生型卵巢癌患者对PARP抑制剂不敏感,奥拉帕尼等PARP抑制剂只能适用于少量卵巢癌患者,严重限制了PARP抑制剂的广泛应用。
目前,临床前研究已经评估了几种改善PARP抑制剂疗效的方法,例如,Riches LC等证明使用丝氨酸/苏氨酸激酶ataxia毛细血管扩张突变(ATM)抑制剂AZD0156阻碍奥拉帕尼诱导的DNA损伤的修复,导致DNA双链断裂信号升高、细胞周期阻滞和细胞凋亡。ATM是一个关键的DNA双链断裂修复蛋白激酶,在正常情况下,ATM主要以非活性二聚体的形式存在于细胞核中,当DNA发生双链断裂时,ATM被MRE11-NBS1-RAD50(MRN)复合体招募到染色质中,在染色质中进行自动磷酸化,分解成催化活性单体。ATM信号转导通过磷酸化RAD51、BRCA等多种效应蛋白,介导S、G1/S和S/G2M检查点,并促进DNA修复蛋白向损伤部位招募。由于ATM在DSB信号转导中的重要作用,因此通过ATM抑制剂增强DNA损伤因子(包括PARP抑制剂)的活性是一个很有前途的治疗方案。然而,Steven T表明尽管ATM,RAD51、BRCA是无可争议的重要的基因毒性药物抗癌介质,但鉴于这些分子在正常细胞中也同样发挥重要功能,通过直接靶向这些分子来降低癌细胞对扩展奥拉帕尼适应症或治疗其耐药的努力本质上是有限的。因此找到对癌细胞中的DNADSB修复至关重要,但对正常细胞中的修复却是可有可无的ATM、RAD51、BRCA底物可以为扩展奥拉帕尼适应症提供方案。
EGFR是一种受体酪氨酸激酶,研究表明EGFR及其下游信号通路在多种人类癌症中存在异常过表达,且与患者放化疗耐药密切相关。EGFR通过与DNA损伤修复相关蛋白Rad51,BRCA1等相互作用促进DNA修复和肿瘤细胞的生存。
发明内容
本发明提供了一种EGFR抑制剂、组合物及其应用,以通过对EGFR的抑制,提高化疗药物对卵巢癌的抑制活性。
本发明提供了一种EGFR抑制剂,所述EGFR抑制剂用于对EGFR进行抑制,所述EGFR抑制剂至少包括一种双胍类化合物,所述双胍类化合物结构式为:
其中R
进一步地,所述芳香环基为苯基。
进一步地,所述烷氧基上含卤素。
更进一步地,所述卤素为氟。
更进一步地,所述R
进一步地,所述R
本发明还公开一种组合物,包括上述EGFR抑制剂,所述组合物还包括至少一种PARP抑制剂。
进一步地,所述PARP抑制剂为奥拉帕尼。
本发明另一方面还公开上述组合物的应用,所述组合物用于治疗卵巢癌。
进一步地,所述卵巢癌至少部分为EGFR基因可正常表达的卵巢癌细胞。
本发明相对于现有技术,采用双胍类化合物,对EGFR基因进行沉默,从而降低卵巢癌细胞对DNA的修复功能,从而提高PARP抑制剂对卵巢癌细胞的抑制性能。
附图说明
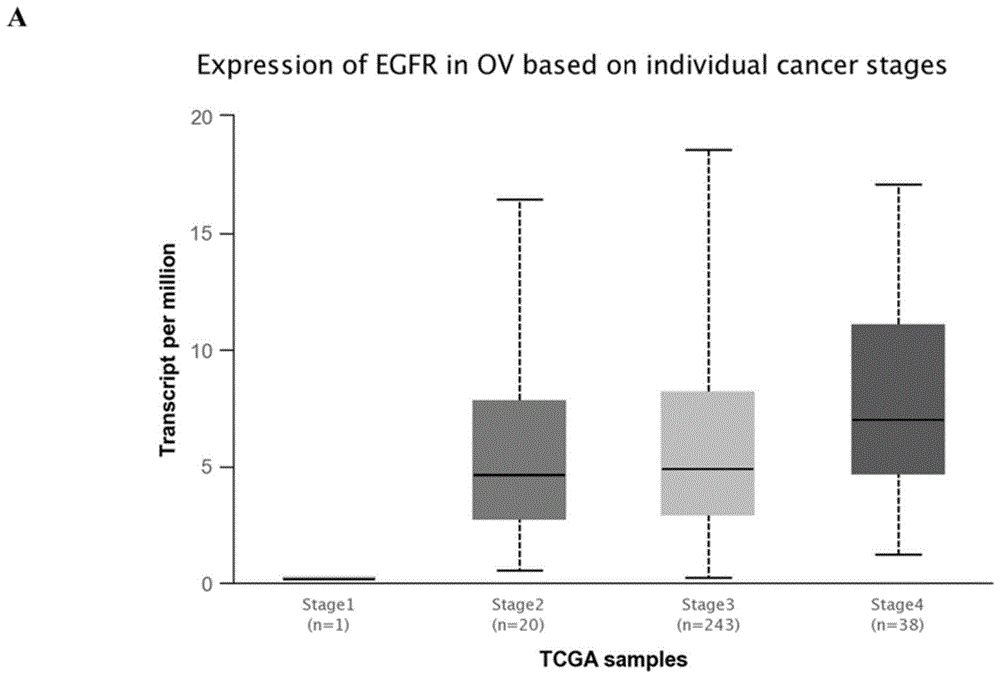
图1-A为TCGA数据库分EGFR表达与卵巢癌患者分级相关性图;
图1-B为EGFR在正常卵巢细胞及卵巢癌细胞的基础表达图;
图1-C、图1-D为奥拉帕尼在卵巢癌细胞SKOV3,OVCAR3,A2780及正常细胞IOSE80,HUVEC的活性图;
图1-E、图1-F为通过MTT、克隆集落形成实验比较沉默EGFR后卵巢癌细胞对奥拉帕尼敏感性的变化图;
图1-G为沉默EGFR后,WB观察DNA损伤修复相关蛋白变化图;
图2-A为4C的化学结构式;
图2-B为分子对接预测4C,氯胍与EGFR蛋白的结合位点;
图2-C为4C处理后,WB检测核相关蛋白表达水平图;
图2-D、2-E为通过MTT、克隆集落形成实验检测4C在卵巢癌细胞SKOV3,OVCAR3,A2780及正常细胞IOSE80,HUVEC的活性图;
图3-A为MTT检测4C与奥拉帕尼在卵巢癌细胞中的联用效果图;
图3-B为4C与奥拉帕尼联用指数图;
图3-C为克隆实验检测4C与奥拉帕尼在卵巢癌细胞中的联用效果图;
图3-D、3-E为体内实验检测4C与奥拉帕尼在卵巢癌细胞中的联用效果图;
图4-A为4C预处理12h后再奥拉帕尼处理12h,WB检测相关蛋白表达水平图;
图4-B为4C预处理12h后再奥拉帕尼处理12h,免疫荧光检测相关蛋白表达水平图;
图4-C为4C预处理12h后再奥拉帕尼处理12h,通过核质分离实验分离细胞质及细胞核,WB实验检测相关蛋白表达水平图。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。
本发明实施例公开了一种EGFR抑制剂,所述EGFR抑制剂用于对EGFR基因进行抑制,所述EGFR抑制剂至少包括一种双胍类化合物,所述双胍类化合物结构式为:
其中R
其中,EGFR抑制剂可由一种或多种化合物组成,在本发明实施例中,EGFR抑制剂仅包括双胍类化合物,但本领域技术人员可基于实际使用需要,在双胍类化合物基础上向EGFR抑制剂中增加其它的化合物,例如制剂等。
可选的,所述芳香环基为苯基。
可选的,所述烷氧基上含卤素。
特别的,所述卤素为氟。
特别的,所述R
可选的,所述R
其中,本发明实施例R
本发明实施例还公开一种组合物,包括上述EGFR抑制剂,所述组合物还包括至少一种PARP抑制剂。
可选的,所述PARP抑制剂为奥拉帕尼。
其中,本领域技术人员可基于实际需要,采用除奥拉帕尼外的其它PARP抑制剂,也可采用包括奥拉帕尼在内的多种PARP抑制剂混合药物。
本发明实施例另一方面还公开上述组合物的应用,所述组合物用于治疗卵巢癌。
可选的,所述卵巢癌至少部分为EGFR高表达的卵巢癌细胞。
其中,卵巢癌具体为BRCA野生型卵巢癌,在EGFR位点不存在突变或该突变不影响EGFR基因位点的正常表达。
为进一步说明本发明实施例的具体效果,现以
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。所述奥拉帕尼购自Selleck公司。
为探求EGFR在卵巢癌患者中的临床意义,本发明实施例在进行4C测试前,采用TCGA生物信息学分析,发现EGFR与卵巢癌患者分级呈正相关,表明EGFR表达水平与卵巢癌患者的恶化度密切相关(图1-A)。同时,如图1-B所示,EGFR在BRCA1/2野生型卵巢癌细胞SKOV3与OVCAR3细胞中高表达,而奥拉帕尼在EGFR高表达的SKOV3与OVCAR3活性较差,在EGFR低表达的A2780活性较好(图1-C、图1-D),表明奥拉帕尼活性与EGFR表达密切相关。为了进一步揭示EGFR水平对奥拉帕尼活性的影响,通过稳转对EGFR进行沉默后,再检测奥拉帕尼对EGFR沉默后卵巢癌细胞的生物活性。结果如图1-E、图1-F所示,证明EGFR的下调增强了奥拉帕尼对卵巢癌细胞的抑制作用。进一步机制研究表明沉默EGFR后,DNA损伤修复相关蛋白p-ATM,p-BRCA1,Rad51表达下调。因此,沉默EGFR后,奥拉帕尼在BRCA野生型的卵巢癌细胞中活性增加。
实施例1:4C和奥拉帕尼对BRCA1野生型卵巢癌细胞体外抗肿瘤联用测试
本发明实施例1运用MTT方法,在卵巢癌SKOV3细胞株上,将4C和奥拉帕尼进行联用,对比单用与联用的体外抗肿瘤作用。本发明实施例具体利用CompuSyn软件,4C选择2个浓度,奥拉帕尼选择5个浓度(浓度具体见图3A所示),计算CI值。
具体操作如下:
S101.在DMEM培养基中加入10%的胎牛血清溶液,将SKOV3细胞以6000个/孔/200μL的密度接种于96孔板中;
S102.在温度为37℃,5%CO
其中,联用组为10μL 4C+10μL奥拉帕尼,每个浓度至少设三个复孔以减少实验误差;另设对照组(加细胞不加药)和空白组(不加细胞也不加药,仅含培养基);
S103.37℃,5%CO
S104.去掉培养基,加入150μL二甲亚砜,震荡混匀15min,酶标仪检测每孔OD值,检测波长490nm;
S105.根据OD值读数,计算细胞的存活率,并使用Grapad Prism 6计算IC
S106.利用CompuSyn软件,计算CI值。
结果如图3-A所示,4C与奥拉帕尼在BRCA1野生型卵巢癌细胞中有较强的协同抑制作用,CI值<0.5,说明有强的协同作用。此外,1μM的4C即可以有效提高奥拉帕尼对BRCA1野生型卵巢癌细胞的抑制作用,因此4C具有用量少,联用效果显著的特点。
实施例2:克隆形成试验
本发明实施例2采用克隆形成试验,在BRCA1野生型卵巢癌细胞SKOV3中,比较4C与奥拉帕尼单独用药和联合用药的抗肿瘤作用。
具体操作如下:
S201.2000个细胞接种于24孔板中,0.5mL培养液混匀,每组设3个复孔;
S202.24 h待细胞贴壁后,将药物用新鲜培养基稀释后,按照每孔500μL的添加量,加入上述已加细胞的培养板中;4C溶液浓度为μM,奥拉帕尼溶液浓度为4μM,联用组为250μL4C溶液+250μL奥拉帕尼溶液混合而成;
S203.设置给药作用时间为7天,在37℃,5%CO
S204.弃上清,用PBS洗2次;
S205.每孔加入10%多聚甲醛2mL,固定15min;
S206.去除固定液,0.5mL结晶紫染液染色15min;
S207.清水洗去染色液,室温晾干;拍照并采用酶标仪检测吸光值,波长为550nm。
结果如图3-C所示,与单用4C或奥拉帕尼相比,两药联用组进一步抑制肿瘤细胞增殖。
实施例3:动物模型试验
本发明实施例3构建SKOV3卵巢癌裸鼠模型,研究动物体内4C与奥拉帕尼联用抗肿瘤作用。
具体操作如下:
S301.收集生长状态良好的SKOV3细胞,培养基重悬细胞并计数,置于冰上;
S302.将细胞混匀,向体重18g 20g BALB/c雌性裸鼠(购自湖南斯莱克景达实验动物有限责任公司)腋下注射5×10
S303.待裸鼠皮下长出肿瘤70-100mm3(约10天),开始给药,给药体积100μL;实施组别分别为:溶媒组;4C 8mg/kg组;奥拉帕尼100mg/kg组;4C 8mg/kg+奥拉帕尼100mg/kg组。给药频率为一周5次,4C 8mg/kg腹腔注射,奥拉帕尼100mg/kg灌胃给药,一周5次,持续3周;
S304.使用游标卡尺测量肿瘤大小,每天记录1次,图3-E记录了给药第14天的肿瘤组织大小;记录肿瘤的长度(L)和宽度(W),肿瘤大小可计算为肿瘤体积=(L×W
S305.处死裸鼠并将肿瘤取出,计算肿瘤重量,作统计分析。
结果如图3-D、3-E所示,化合物4C与奥拉帕尼联用组肿瘤体积明显小于单用组,化合物4C与奥拉帕尼联用可有效抑制裸鼠的肿瘤生长。
实施例4:Western blot检测EGFR,ATM/Rad51/BRCA的核表达水平
试验具体步骤如下:
S401.设置四个组(设置4C、奥拉帕尼、4C+奥拉帕尼的处理组,同时设置无药物处理组为对照组),细胞水平4C的浓度为8μM,奥拉帕尼的浓度为80μM;
S402.在药物处理适当时间(本发明实施例4C先处理12h后,加入奥拉帕尼处理12h)后,收集细胞提取蛋白,western blot检测相关蛋白表达水平。
结果如图4-C所示,单用奥拉帕尼虽然会引起DNA损伤,但细胞同时会通过上调EGFR蛋白,提高DNA损伤修复相关蛋白ATM/Rad51/BRCA蛋白的含量,实现对DNA修复,而在4C联用的条件下,可有效抑制EGFR蛋白的生成,进而使DNA损伤修复相关蛋白ATM/Rad51/BRCA无法上调,从而实现癌细胞对奥拉帕尼的增敏。
综上所述,本发明实施例的4C能促进EGFR蛋白降解,有效抑制EGFR蛋白入核,阻断ATM/Rad51/BRCA介导的DNA损伤修复,进而显著提升卵巢癌细胞对奥拉帕尼的敏感性。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对其限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,技术人员阅读本申请说明书后依然可以对本发明的具体实施方式进行修改或者等同替换,但这些修改或变更均未脱离本发明申请待批权利要求保护范围之内。
- 一种Src酪氨酸激酶抑制剂晶型、其制备方法及药物组合物
- 一种抗结核化合物及其在制备抗结核药物中的应用以及一种抗结核药物组合物
- 含cMet抑制剂、HDAC抑制剂与EGFR酪氨酸激酶抑制剂的药物组合物及其应用
- 含cMet抑制剂、HDAC抑制剂与EGFR酪氨酸激酶抑制剂的药物组合物及其应用
