使用IL-17拮抗剂抑制银屑病关节炎患者的结构损伤进展
文献发布时间:2023-06-19 19:28:50
本案是申请日为2015年09月08日、申请号为2015800479201、发明名称为“使用IL-17拮抗剂抑制银屑病关节炎患者的结构损伤进展”的专利申请的分案申请。
本公开要求2014年9月10日提交的美国临时专利申请号62/048,512的优先权,所述专利的公开内容通过引用全文纳入本文。
技术领域
本公开涉及银屑病关节炎(PsA)患者(例如,之前用生物制剂如TNFα抑制剂治疗的患者,和之前未用生物制剂治疗的患者)中抑制结构损伤进展的方法,采用IL-17拮抗剂如苏金单抗。
发明背景
PsA是影响周边关节、结缔组织和中轴骨的慢性、全身性炎性疾病,可能伴随有皮肤和指甲的干癣(Boehncke和Menter(2013),Am J Clin Dermatol;14:377–88;Gladman等.(2005)Ann Rheum Dis.;64(Suppl 2):ii14–17)。PsA是多方面疾病,包括滑膜炎、附着点炎、指炎、脊椎炎、葡萄膜炎和炎症性肠病。传统的疾病缓解性抗风湿药物(DMARD)包括氨甲蝶呤(MTX)、柳氮磺胺吡啶、环孢素和来氟米特,因为这些药物仅部分控制已确立的疾病,不适合许多患者(Mease PJ(2008)《银屑病关节炎》(Psoriatic Arthritis).收录于:Klippel等编.《风湿性疾病引论》(Primer on Rheumatic Diseases).第13版.纽约:施普林格科学(Springer Science),第170-192页)。肿瘤坏死因子(TNF)抑制剂近年来改善了PsA管理(Mease(2013)Curr Opin Rheumatol.;25:287-96;Mease和Armstrong(2014)Drugs 2014a;74:423-41;Gossec等.(2012)Ann Rheum Dis;71:4–12;Menter等.(2011)J Am AcadDermatol 2011;65:137–74),但并非所有患者响应或耐受这些药剂(即约40%PsA患者)且许多患者继续经历身体机能的显著损伤、功能障碍和生活质量下降((Boehncke和Menter(2013)Am J Clin Dermatol 2013;14:377–88;Gladman等.(2005)Ann Rheum Dis.;64(增刊2):ii14–17)。
约三分之二PsA患者经历进展性和不可逆结构损伤(如侵蚀、关节间隙狭窄(JSN)、骨质溶解、关节僵硬等),伴有不同程度的功能障碍。PsA开始的2年内,几乎50%患者呈现≥1处侵蚀,历经10年随访后,55%发展出≥5处变形关节(Kavanaugh等(2014)Ann.Rheum.Dis.73:1000-1006)。一些疗法显示在未经历过TNF治疗的患者中预防结构损伤(如优特克单抗,参见Kavanaugh等.(2014),同上),目前,没有生物制品在之前接触过TNF的PsA患者(即TNF不充分应答者[TNF-IR])中防止结构损伤进展。
发明内容
鉴于以上所述,需要开发抑制PsA相关结构损伤进展的新疗法,尤其是针对TNF-IR的PsA患者。
越来越多证据涉及PsA发病机理中的白介素-17A。在患者的循环、关节及银屑病皮肤斑块中发现白介素-17A生成细胞的水平增加(Jandus(2008)Arthritis Rheum;58:2307-17;Kagami(2010)J Invest Dermatol;130:1373-83;Lin(2011)J Immunol;187:490-500;Noordenbos(2012)Arthritis Rheum;64:99–109),且显示该增加与疾病活动性和结构损伤的量度相关(Menon等.(2014)Arthritis Rheumatol.;66:1272-81)。此外,2期研究证明抑制白介素-17A配体(McInnes等.(2014)Ann Rheum Dis 2014;73:349–56)或受体(Mease等.(2014)N Engl J Med;370:2295-306)可改善PsA的体征和症状,尽管之前未显示白介素-17A抑制对结构损伤的效果。
苏金单抗(AIN457)是抑制白介素-17A活性的高亲和性全人单克隆抗人抗体。在近期PsA概念验证(PoC)研究(AIN457A2206)(实施例1)中,苏金单抗不满足其主要疗效终点(第6周时活性剂相比安慰剂的ACR20应答者比例)。然而,使用改良给药方案的更大研究(实施例2)目前显示苏金单抗对治疗PsA体征和症状都高度有效。此外,放射学数据(实施例3-4)表明苏金单抗是显示明显抑制PsA患者结构损伤进展的首例生物制品,无论先前TNF抑制剂疗法状态(未经历过TNF治疗相比先前TNF治疗)或同步氨甲蝶呤给药如何。据我们所知,苏金单抗是在先前经TNFα拮抗剂治疗的PsA患者(如TNF-IR患者)中显示抑制结构损伤进展的首例生物制品。例如,用优特克单抗的PsA试验在先前接触TNFα拮抗剂的患者中不显示抑制关节损伤的放射学进展,优特克单抗是拮抗性抗IL-12/23p40单克隆抗体。由于IL-23诱导初始CD4(+)T细胞分化成产生IL-17的高致病性辅助T细胞(Th17/Th(IL-17)),苏金单抗在先前接触TNFα拮抗剂的患者中抑制关节损伤放射学进展这一事实是出乎意料的,优特克单抗在这些患者中不曾抑制。
因此,本文公开了抑制PsA患者结构损伤进展的方法,包括向所需患者给予IL-17拮抗剂。本文还公开了以下方法:在PsA患者中减少活跃PsA体征和症状,抑制PsA患者结构(如骨和/或关节)损伤进展,和/或提高PsA患者身体机能,包括向所需患者给予IL-17拮抗剂。在所公开应用、方法和药盒的一些实施方式中,所述患者未接受过生物制品。在所公开应用、方法和药盒的一些实施方式中,所述患者经历过生物制品。在所公开应用、方法和药盒的一些实施方式中,所述患者之前未用TNFα拮抗剂治疗。在所公开应用、方法和药盒的一些实施方式中,所述患者之前用TNFα拮抗剂治疗。在所公开应用、方法和药盒的一些实施方式中,所述患者不充分响应先前TNFα拮抗剂治疗(TNF不充分应答者[TNF-IR])。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展通过van der Heijde银屑病关节炎改良总Sharp评分(mTSS)测量。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展通过侵蚀和关节间隙狭窄(JSN)评分测量。在所公开应用、方法和药盒的一些实施方式中,侵蚀、关节间隙狭窄、杯中铅笔现象、关节增宽、关节狭窄、半脱位、骨增生、骨质溶解和/或关节僵硬的进展受到抑制。在一些实施方式中,所公开方法还包括给予患者DMARD,如氨甲蝶呤(MTX)。在所公开应用、方法和药盒的一些实施方式中,所述IL-17拮抗剂在第0、2和4周中以约10mg/kg每隔一周静脉内(i.v.)给予患者,之后在第8周开始以约75mg、约150mg或约300mg每月(每4周)皮下(s.c.)给予患者。在所公开应用、方法和药盒的一些实施方式中,所述IL-17拮抗剂在第0、1、2和3周中以约75mg、约150mg或约300mg每周s.c.给予患者,之后在第4周开始以约75mg、约150mg或约300mg每月(每4周)s.c.给予患者。在所公开应用、方法和药盒的一些实施方式中,所述患者伴发银屑病(如伴发中度到重度斑块型银屑病)。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展定义为mTSS相比基线变化≤0.5。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展定义为侵蚀评分相比基线变化≤0.3。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展定义为JSN评分相比基线变化≤0.2。在所公开应用、方法和药盒的一些实施方式中,根据之前已给予TNFα拮抗剂的患者,选择患者用于治疗。在所公开应用、方法和药盒的一些实施方式中,IL-17抗体如苏金单抗作为液体药物组合物给药(例如,从冻干剂重建或不从冻干剂重建,优选不从冻干剂重建)。
在所公开应用、方法和药盒的一些实施方式中,所述IL-17拮抗剂是IL-17抗体或其抗原结合片段。在所公开应用、方法和药盒的一些实施方式中,所述IL-17抗体或其抗原结合片段选自下组:a)结合IL-17表位的IL-17抗体或其抗原结合片段,所述表位包括Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129;b)结合IL-17表位的IL-17抗体或其抗原结合片段,所述表位包括Tyr43,Tyr44,Arg46,Ala79,Asp80;c)结合IL-17同二聚体表位的IL-17抗体或其抗原结合片段,所述同二聚体具有2条成熟IL-17蛋白链,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80;d)结合IL-17同二聚体表位的IL-17抗体或其抗原结合片段,所述同二聚体具有2条成熟IL-17蛋白链,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80,其中所述IL-17抗体或其抗原结合片段具有约100-200pM的K
本文还公开抑制PsA患者结构损伤进展的方法,包括向患者每月给予约75mg–约300mg苏金单抗(如约150mg-约300mg,例如约75mg、约150mg、约300mg),其中所述患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括向患者每月给予约75mg–约300mg(如约150mg-约300mg,例如约75mg、约150mg、约300mg)苏金单抗,其中所述患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括向患者每月给予约75mg–约300mg(如约150mg-约300mg,例如约75mg、约150mg、约300mg)苏金单抗,其中根据之前用TNFα拮抗剂治疗来选择患者用于治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括向患者每月选择性给予约75mg–约300mg(如约150mg-约300mg,例如约75mg、约150mg、约300mg)苏金单抗,这是根据患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括通过皮下注射向患者每月给予约150mg或约300mg(如约150mg-约300mg,例如约75mg、约150mg、约300mg)苏金单抗,初始给药在第0、1、2和3周,然后是第4周开始的每月给药。在一些实施方式中,所述患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括通过静脉注射在第0、2和4周向患者给予约10mg/kg苏金单抗,之后从第8周开始通过皮下注射向患者给予约150mg或约300mg苏金单抗。在一些实施方式中,所述患者之前用TNFα拮抗剂治疗。
附图简要说明
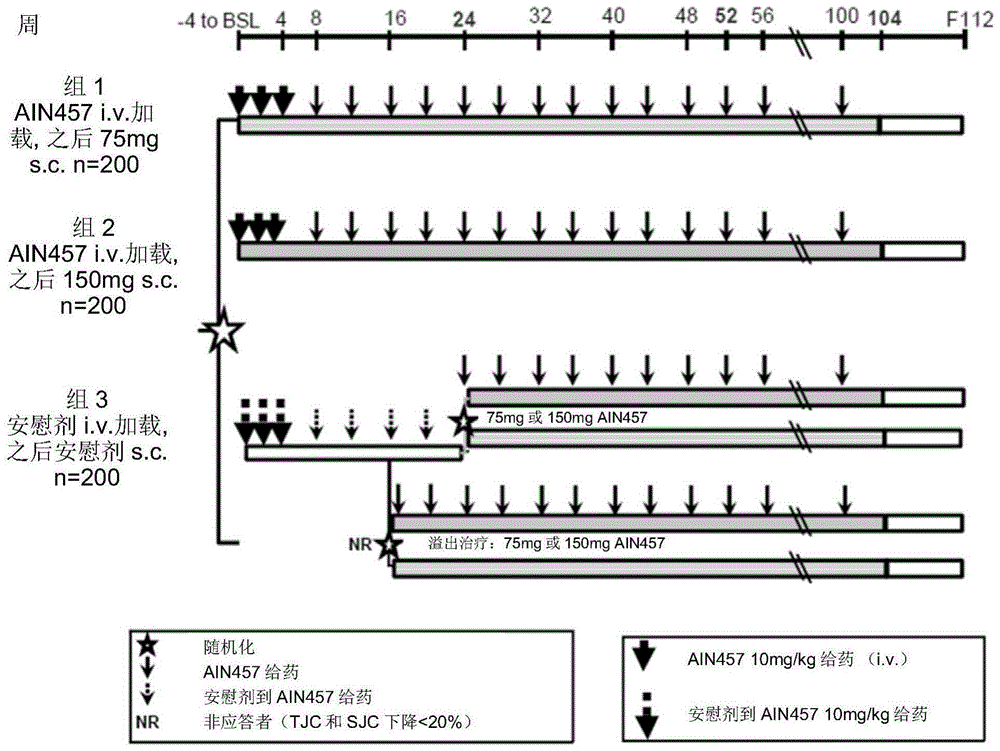
图1.AIN457F2306研究设计。
图2A-C.美国风湿病学会(ACR)随着时间的反应,从基线到第24周(安慰剂对照期),并基线时随机分配苏金单抗的对象而言到第52周。显示随着时间有ACR反应标准20%(图2A)、50%(图2B)和70%(图2C)改善(分别为ACR 20、ACR50和ACR 70)的对象比例。缺失数据填补为到第24周的无应答;从第24周到第52周报告观察数据。*P<0.05,**P<0.01,和***P<0.001,与安慰剂相比。
图3A-B.改良总Sharp评分(vdH-mTSS)从基线到第24周(安慰剂对照期)的平均变化,就在基线随机分配苏金单抗的对象而言到第52周。显示第24周(图3A)和第52周(图3B)时vdH-mTSS相比基线的平均变化。第24周的统计分析用非参数ANCOVA模型评估,线性外推用于缺失数据。到第52周的数据代表仅在基线随机分配苏金单抗的对象。*P<0.05相比安慰剂。
图4A-B.在未接受过生物制品和经历过生物制品的对象中到第24周的ACR反应(无应答者填补分析)。对于a)未接受过生物制品的对象(图4A)和经历过生物制品(图4B)的对象,显示随着时间有ACR反应标准20%、50%和70%改善(分别为ACR 20、ACR 50和ACR 70)的对象比例。缺失数据填补为无应答。*P<0.05,**P<0.01,***P<0.001,与安慰剂相比。就经历过生物制品的对象而言,在第24周的ACR 70反应与安慰剂没有统计比较是可能的,这归因于安慰剂组中缺乏应答者。
图5A-B.在伴随和没有伴随MTX的对象中到第24周随着时间的ACR反应(无应答者填补分析)。对于接受同步MTX治疗的对象(图5A)和不接受同步MTX治疗的对象(图5B),显示随着时间有ACR反应标准20%、50%和70%改善(分别为ACR 20、ACR 50和ACR 70)的对象比例。缺失数据填补为无应答。*P<0.05,**P<0.01,***P<0.001,与安慰剂相比。
图6.第24周时,苏金单抗75mg和150mg在抑制关节结构损伤进展上优于安慰剂,如vdH-mTSS所测。全人群(FAS)。
图7.第24周总vdH-mTSS评分的累积分布图。
图8.随着时间的总vdH-mTSS进展。
图9A-B.苏金单抗显示在未经历过TNF治疗(图9A)和TNF不充分应答者(图9B)中都显著抑制结构损伤,如vdH-mTSS所测。
图10A-B.在2个时间段即基线到第24周(图10A)和第24周到第52周(图10B)中,X射线完成者(即在基线、第16/24周和第52周有X射线测量的患者)的mTSS平均(+标准偏差)变化。IV,静脉内;mTSS,改良总Sharp评分;SC,皮下;SD,标准偏差。
发明详述
本公开的目的是提供抑制银屑病关节炎(PsA)患者中结构损伤(如骨和/或关节)的方法,使用IL-17拮抗剂如苏金单抗。
术语“包括”涵盖“包含”以及“由…组成”,例如组合物“包括”X,可仅由X组成或可包含一些额外组分,如X+Y。
本文所用的短语“抑制结构损伤进展”与“防止结构损伤进展”同义,用于指减少、消除或减缓PsA相关骨和/或关节损伤。这类骨和/或关节损伤包括例如侵蚀、关节间隙狭窄(JSN)、杯中铅笔现象、关节增宽、关节狭窄、半脱位、骨增生、骨质溶解和/或关节僵硬。有多种放射学评分法用于测量PsA患者的结构损伤进展,如改良Steinbrocker、sharp评分、mTSS(也称为vdH-mTSS)和Ratingen评分(参见例如van der Heijde(2005)Ann.Rheum.Dis.64:ii61-ii64)。在一些实施方式中,mTSS(也称为vdH-mTSS)用于评价PsA患者中的结构损伤进展。在一些实施方式中,抑制结构损伤进展定义为vdH-mTSS相比基线变化<0.57,≤0.5,≤0.3,≤0.25,≤0.20,≤0.15,≤0.13,≤0.10,≤0.05或≤0.02,且可包括随着时间维持此效果。相比基线的变化能在任何给定时间点测量,如治疗开始后24周,治疗开始后52周。在一些实施方式中,抑制结构进展定义为mTSS评分相比基线变化≤0.5。
抑制结构损伤进展也可通过分析特定骨和关节损伤类型(如侵蚀、关节间隙狭窄(JSN)、杯中铅笔现象、关节增宽、关节狭窄、半脱位、骨增生、骨质溶解和/或关节僵硬)评估。在一些实施方式中,侵蚀的放射成像用于评价PsA患者的结构损伤进展。在一些实施方式中,抑制结构损伤进展定义为侵蚀评分相比基线变化<0.35,≤0.30,≤0.25,≤0.2,≤0.15,
除了放射线成像,其它用于呈现骨和/或关节结构变化的方法包括MRI和超声,如能量多普勒和灰阶超声(PDUS)。用于评估骨和/或关节结构变化的评分系统依赖于由医生选择的呈现模式,如应用PDUS时,OMERACT-EULAR综合PDUS评分可用于评估滑液活性。
涉及数值x的术语“约”指例如+/-10%。当用于数值范围或数字列表前面时,术语“约”应用于该系列的各数字,如短语“约1-5”应解释为“约1-约5”,或短语“约1、2、3、4”应解释为“约1、约2、约3、约4等”。
单词“基本”不排除“完全”,如组合物“基本没有”Y可以是完全没有Y。必要时,单词“基本”可从本公开定义中省略。
本文所用的术语“抗体”指全抗体。天然产生的“抗体”是糖蛋白,包括由二硫键相互连接的至少2条重(H)链和2条轻(L)链。每条重链由重链可变区(本文简称为V
本文所用的术语抗体的“抗原结合片段”指保留特异结合抗原(如IL-17)能力的抗体片段(包括单链)。已显示抗体的抗原结合功能可由全长抗体的片段行使。术语抗体的“抗原结合片段”所涵盖的结合片段示例包括:Fab片段,由V
本文所用的“分离抗体”所指抗体基本不含其它有不同抗原特异性的抗体(例如,特异结合IL-17的分离抗体基本不含特异结合IL-17以外抗原的抗体)。本文所用的术语“单克隆抗体”或“单克隆抗体组合物”指制备单一分子组成的抗体分子。本文所用的术语“人抗体”意在包括有可变区中框架和CDR区均获自人源序列的抗体,。“人抗体”不需由人、人组织或人细胞生成。本公开的人抗体可包括不由人序列编码的氨基酸残基(例如,引入突变,这是通过体外随机或定点突变,通过抗体基因重组期间在连接处体内加入N核苷酸,或通过体内体细胞突变)。在所公开工艺和组合物的一些实施方式中,所述IL-17抗体是人抗体、分离抗体和/或单克隆抗体。
术语“IL-17”指IL-17A,之前称为CTLA8,包括来自多个物种(如人、小鼠和猴)的野生型IL-17A、IL-17A的多态变体以及IL-17A的功能等价物。本公开所述IL-17A的功能等价物优选与野生型IL-17A(如人IL-17A)具有至少约65%,75%,85%,95%,96%,97%,98%或甚至99%总序列同一性,且基本保留诱导人真皮成纤维细胞生成IL-6的能力。
术语“K
术语“亲和性”指单一抗原位点处抗体与抗原之间的相互作用强度。在各抗原位点内,抗体“臂”可变区通过弱非共价力与抗原在多个位点相互作用;相互作用越多,亲和性越强。评估抗体对多个物种IL-17的结合亲和性的标准试验为本领域已知,包括例如ELISA、蛋白质印迹和RIA。抗体的结合动力学(如结合亲和性)也能用本领域已知标准试验评价,如
如根据本领域已知和本文所述方法所测定,“抑制”一种或多种这些IL-17功能特性(如生化、免疫化学、细胞、生理或其它生物活性等)的抗体应理解成涉及相对于没有抗体时(或当存在具有不相关特异性的对照抗体时)特定活性的统计显著性减少。抑制IL-17活性的抗体可引起所测参数的统计显著性减少,如至少约10%,至少50%、80%或90%,在所公开方法和组合物的某些实施方式中,所用IL-17抗体可抑制超过95%、98%或99%的IL-17功能活性。
本文所用的“抑制IL-6”指IL-17抗体或其抗原结合片段(如苏金单抗)降低原代人真皮成纤维细胞的IL-6生成的能力。原代人(真皮)成纤维细胞的IL-6生成取决于IL-17(Hwang等,(2004)Arthritis Res Ther;6:R120-128)。简言之,在多个浓度的IL-17结合分子或带Fc部分的人IL-17存在的条件下,人真皮成纤维细胞接受重组IL-17刺激。嵌合抗CD25抗体
除非另有说明,术语“衍生物”用于定义IL-17抗体或其抗原结合片段的氨基酸序列变体和共价修饰(如聚乙二醇化、脱酰胺化、羟基化、磷酸化、甲基化等),IL-17抗体或其抗原结合片段如根据本公开的苏金单抗或具有特定序列(如可变域)。“功能衍生物”包括定性生物活性与所公开IL-17抗体相同的分子。功能衍生物包括本文所公开IL-17抗体的片段和肽类似物。片段包括本公开所述多肽序列内的区域,例如具有指定序列。本文所述IL-17抗体的功能衍生物(如苏金单抗的功能衍生物)优选包括与本文所公开IL-17抗体或其抗原结合片段(如表1的V
短语“基本相同”指相关氨基酸或核苷酸序列(如V
涉及天然多肽和其衍生物的“同一性”在本文定义为在比对序列和引入缺口(若需要)以实现最大同一性百分比后,且不考虑任何保守取代作为序列同一性的一部分,候选序列中与对应天然多肽残基相同的氨基酸残基百分比。N-或C-末端延伸或插入均不应理解为降低同一性。熟知用于比对的方法和计算机程序。同一性百分比能通过标准比对算法测定,例如Altshul等.((1990)J.Mol.Biol.,215:403 410)所述的基本局部比对搜索工具(BLAST);Needleman等.((1970)J.Mol.Biol.,48:444 453)的算法;或Meyers等.((1988)Comput.Appl.Biosci.,4:1117)的算法。一组参数可以是Blosum 62打分矩阵,缺口罚分为12,缺口延伸罚分为4且移码罚分为5。两个氨基酸或核苷酸序列之间的同一性百分比也能用E.Meyers和W.Miller((1989)CABIOS,4:11-17)算法测定,所述算法纳入ALIGN程序(2.0版),使用PAM120权重残基表(weight residue table),缺口长度罚分为12且缺口罚分为4。
“氨基酸”指所有天然产生的L-α-氨基酸,例如且包括D-氨基酸。短语“氨基酸序列变体”指氨基酸序列相较本公开所述序列有一些差异的分子。本公开所述抗体的氨基酸序列变体,例如具有指定序列的变体,仍具有结合人IL-17的能力,或例如抑制IL-17诱导的人真皮成纤维细胞生成IL-6。氨基酸序列变体包括取代变体(在本公开所述多肽移出至少一个氨基酸残基并且在同一位置插入不同氨基酸)、插入变体(紧邻本公开所述多肽特定位置的氨基酸处插入一个或多个氨基酸的那些)和缺失变体(在本公开所述多肽中移出一个或多个氨基酸的那些)。
本文所用的“每月”用于指平均30天或4周,如上下文所确定。
本文所用的短语“未接受过生物制品”指之前未用生物制剂如优特克单抗、TNFα抑制剂等治疗的PsA患者。本文所用的短语“经历过生物制品”指之前就PsA用生物制剂如优特克单抗、TNFα抑制剂等治疗的PsA患者。本文所用的短语“之前未用TNF拮抗剂治疗”和“未接受过TNF治疗”指之前未就PsA用TNFα抑制剂治疗的PsA患者。本文所用的短语“之前用TNF拮抗剂治疗”和“经历过TNF”指之前用TNFα抑制剂(如英夫利昔单抗、依那西普、阿达木单抗、赛妥珠单抗、戈利木单抗)治疗的PsA患者。其包括就ITNFα抑制剂治疗而言难治或具有不充分应答的患者,以及出于安全或耐受性原因停止TNFα抑制剂治疗的患者。本文所用的短语“对先前TNF拮抗剂治疗具有不充分应答”、“TNF不充分应答者”和“TNF-IR”指PsA患者之前就PsA用TNFα抑制剂(如英夫利昔单抗、依那西普、阿达木单抗、赛妥珠单抗、戈利木单抗)治疗,但其症状(如皮肤和/或关节症状)未得到TNFα抑制剂充分控制(如患者有活跃PsA,尽管用批准剂量的抗TNF剂治疗至少4周、至少8周、至少3个月、至少14周或至少4个月)。在所公开方法、药盒、IL-17拮抗剂和应用的一些实施方式中,所述患者未接受过生物制品、经历过生物制品、未接受过TNF治疗、经历过TNF或TNF-IR。
如本文所用,关于患者的“选择”和“选定”用于指从更大患者组中特别选择具体患者,基于(由于)该具体患者具有预定标准。类似地,“选择性治疗”指向具有特定疾病的患者提供治疗,其中所述患者从更大患者组中特别选出,基于该具体患者具有预定标准。类似地,“选择性给药”指将药物给予从更大患者组中特别选择的患者,基于(由于)该具体患者具有预定标准。选择、选择性治疗和选择性给药是指向患者递送个性化疗法,基于患者个人史(如在先治疗干预,如用生物制剂在先治疗,如用TNFα拮抗剂在先治疗)和/或生物学,而不是仅根据患者有特定疾病来递送标准治疗方案。关于本文所用治疗方法,选择不指具有特定标准的患者的偶然治疗,而是指根据患者有特定标准而向患者给予治疗的慎重选择。因此,选择性治疗/给药不同于标准治疗/给药,后者向有给定疾病的全部患者递送特定药物,无论其历史和/或生物学如何。
如本文所用,“基于之前用TNF拮抗剂治疗的患者来选择患者用于治疗”等用于指根据特定患者之前暴露于TNFα拮抗剂,从更大组或PsA患者中选择特定PsA患者。在所公开方法、药盒、IL-17拮抗剂和应用的一些实施方式中,根据之前给予TNFα拮抗剂的患者,选择PsA患者用IL-17拮抗剂(如苏金单抗)治疗。
本文所用的“DMARD”指疾病调节性抗风湿药,如氨甲蝶呤。
本文所用的“活跃PsA”指活跃银屑病关节炎,定义为>3个关节肿胀和>3个关节压痛。在一些实施方式中,所述待治疗的患者具有活跃PsA。
如本文所用,具有“伴发银屑病”的患者指额外有斑块型银屑病的PsA患者。在所公开方法、药盒、IL-17拮抗剂和应用的一些实施方式中,所述患者伴发银屑病,如伴发中度到重度斑块型银屑病。临床医师通常定义中度到重度银屑病为患者体表面积(BSA)>10或银屑病面积和严重性指数(PASI)>10,连同皮肤病生活质量指数(DLQI)>10(参见例如Mrowietz等.(2011)Arch.Dermatol.Res.303:1–10)。
IL-17拮抗剂
多个所公开工艺、药盒和方法采用IL-17拮抗剂,如IL-17结合分子(例如可溶性IL-17受体、IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)。在一些实施方式中,所述IL-17拮抗剂是IL-17结合分子,优选IL-17抗体或其抗原结合片段。
在一个实施方式中,所述IL-17抗体或其抗原结合片段包括含高变区CDR1、CDR2和CDR3的至少一个免疫球蛋白重链可变域(V
在一个实施方式中,所述IL-17抗体或其抗原结合片段包括至少一个免疫球蛋白(Ig)V
在一个实施方式中,所述IL-17抗体或其抗原结合片段包括:a)含SEQ ID NO:8所示氨基酸序列的免疫球蛋白重链可变域(V
为便于参考,下表1提供苏金单抗单克隆抗体的高变区氨基酸序列,根据Kabat定义且如X射线分析和Chothia及同事的方法所测。
表1:苏金单抗单克隆抗体的高变区氨基酸序列
在优选实施方式中,所述恒定区结构域优选还包括合适的人恒定区结构域,如“免疫学感兴趣的蛋白序列(Sequences of Proteins of Immunological Interest)”中所述,Kabat E.A.等,美国卫生和人类服务部,公共卫生署,国立卫生研究院。编码苏金单抗VL的DNA如SEQ ID NO:9所示。编码苏金单抗V
在一些实施方式中,所述IL-17抗体或其抗原结合片段(如苏金单抗)包括SEQ IDNO:10的3个CDR。在其它实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:8的3个CDR。在其它实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:10的3个CDR和SEQ ID NO:8的3个CDR。SEQ ID NO:8和SEQ ID NO:10中的CDR可参见表1。
在一些实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:14的轻链。在其它实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:15的重链。在其它实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:14的轻链和SEQ ID NO:15的重链结构域。在一些实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:14的3个CDR。在其它实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:15的3个CDR。在其它实施方式中,所述IL-17抗体或其抗原结合片段包括SEQ ID NO:14的3个CDR和SEQID NO:15的3个CDR。SEQ ID NO:14和SEQ ID NO:15中的CDR可参见表1。
高变区可关联任何种类的框架区,尽管优选人来源。合适的框架区描述于KabatE.A.等,同上。优选的重链框架是人重链框架,例如苏金单抗抗体的。例如,其依次由FR1(SEQ ID NO:8的氨基酸1-30)、FR2(SEQ ID NO:8的氨基酸36-49)、FR3(SEQ ID NO:8的氨基酸67-98)和FR4(SEQ ID NO:8的氨基酸117-127)区组成。考虑通过X射线分析测定的苏金单抗高变区,另一优选重链框架依次由FR1-x(SEQ ID NO:8的氨基酸1-25)、FR2-x(SEQ IDNO:8的氨基酸36-49)、FR3-x(SEQ ID NO:8的氨基酸61-95)和FR4(SEQ ID NO:8的氨基酸119-127)区组成。以类似方式,轻链框架依次由FR1’(SEQ ID NO:10的氨基酸1-23)、FR2’(SEQ ID NO:10的氨基酸36-50)、FR3’(SEQ ID NO:10的氨基酸58-89)和FR4’(SEQ ID NO:10的氨基酸99-109)区组成。
在一个实施方式中,所述IL-17抗体或其抗原结合片段(如苏金单抗)是人IL-17抗体,包括至少:a)免疫球蛋白重链或其片段,包括依次含高变区CDR1、CDR2和CDR3的可变域以及人重链恒定部分或其片段;所述CDR1具有氨基酸序列SEQ ID NO:1,所述CDR2具有氨基酸序列SEQ ID NO:2且所述CDR3具有氨基酸序列SEQ ID NO:3;或b)免疫球蛋白轻链或其片段,包括依次含高变区CDR1’、CDR2’和CDR3’的可变域以及人轻链恒定部分或其片段,所述CDR1’具有氨基酸序列SEQ ID NO:4,所述CDR2’具有氨基酸序列SEQ ID NO:5且所述CDR3’具有氨基酸序列SEQ ID NO:6。
在一个实施方式中,所述IL-17抗体或其抗原结合片段选自含抗原结合位点的单链抗体或其抗原结合片段,包括:a)依次含高变区CDR1、CDR2和CDR3的可变域的第一结构域,所述CDR1具有氨基酸序列SEQ ID NO:1,所述CDR2具有氨基酸序列SEQ ID NO:2且所述CDR3具有氨基酸序列SEQ ID NO:3;和b)依次含高变区CDR1’、CDR2’和CDR3’的第二结构域,所述CDR1’具有氨基酸序列SEQ ID NO:4,所述CDR2’具有氨基酸序列SEQ ID NO:5且所述CDR3’具有氨基酸序列SEQ ID NO:6;和c)肽接头,结合第一结构域N末端尽头和第二结构域C末端尽头或第一结构域C末端尽头和第二结构域N末端尽头。
或者,用于所公开方法的IL-17抗体或其抗原结合片段可包括本文所示序列的IL-17抗体衍生物(如苏金单抗的聚乙二醇化形式)。或者,用于所公开方法的IL-17抗体或其抗原结合片段的V
或者,用于所公开方法的IL-17抗体或其抗原结合片段可以是本文所示参比IL-17抗体的氨基酸序列变体。本公开还包括IL-17抗体或其抗原结合片段(如苏金单抗),其中苏金单抗V
在一些实施方式中,所述IL-17抗体或其抗原结合片段如苏金单抗结合成熟人IL-17表位,该表位包括Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129。在一些实施方式中,所述IL-17抗体如苏金单抗结合成熟人IL-17表位,该表位包括Tyr43,Tyr44,Arg46,Ala79,Asp80。在一些实施方式中,所述IL-17抗体如苏金单抗结合有2条成熟人IL-17链的IL-17同二聚体表位,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80。用于定义这些表位的残基编号方案是基于以成熟蛋白(即IL-17A缺乏23氨基酸的N末端信号肽并开始于甘氨酸)的第一氨基酸作为残基一。未成熟IL-17A的序列示于Swiss-Prot记录Q16552。在一些实施方式中,所述IL-17抗体具有约100-200pM的K
用于所公开方法的尤其优选IL-17抗体或其抗原结合片段是人抗体,特别是苏金单抗,如WO 2006/013107的实施例1和2所述。苏金单抗是IgG1/κ同种型的重组高亲和性、全人单克隆抗人白介素-17A(IL-17A,IL-17)抗体,目前在临床试验中用于治疗免疫介导的炎性病症。苏金单抗(参见例如WO2006/013107和WO2007/117749)对IL-17有极高亲和性,即K
用于所公开方法、药盒和方案的其它优选IL-17拮抗剂是broadalumab和美国专利号7,767,206(WO08054603)所示的其它拮抗剂以及美国专利号8,057,794;8,003,099;8,110,191;和7,838,638及美国公开专利申请号20120034656和2011002729所示的IL-17抗体,所述专利通过引用全文纳入本文。
IL-17拮抗剂的治疗方法和应用
所公开的IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17抗体或其抗原结合片段)可体外、离体使用,或纳入药物组合物并给予个体(人患者)体内以抑制PsA患者的结构损伤进展,如之前未用TNF抑制剂治疗的PsA患者(未经历过TNF治疗患者)和之前用TNF抑制剂治疗的PsA患者,如用TNF抑制剂治疗但有不充分应答(如失败或不太令人满意)的患者(TNF-IR患者)。
所述IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)在联合药学上可接受载体时可用作药物组合物。除了IL-17拮抗剂,这种组合物还包含载体、多种稀释剂、填充剂、盐、缓冲剂、稳定剂、增溶剂和本领域熟知的其它材料。载体特性取决于给药途径。用于所公开方法的药物组合物还可包含额外治疗剂以治疗特定靶疾病。例如,药物组合物还可包括抗炎剂。这类额外因子和/或试剂可纳入药物组合物来与IL-17结合分子产生协同效应,或尽可能减少IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)导致的副作用。
用于所公开方法的药物组合物可以常规方式生产。在一个实施方式中,所述药物组合物以冻干形式提供。对于立即给药,其溶于合适水载体,例如注射用无菌水或无菌缓冲生理盐水。如果认为需要形成比团注更大体积的溶液以输注给药,配制时将人血清白蛋白或患者自身肝素化血液纳入盐水可能是有利的。存在过量的这类生理惰性蛋白可通过吸附在用于输注溶液的容器壁和线管来防止抗体损失。如果使用白蛋白,合适浓度是0.5-4.5重量%的盐水溶液。其它制剂包括液体或冻干制剂。
抗体如IL-17抗体通常以易于胃肠外给药的水性形式或给药前用合适稀释剂重建的冻干剂配制。在所公开方法和应用的一些实施方式中,所述IL-17拮抗剂如IL-17抗体例如苏金单抗配制为冻干剂。合适的冻干剂制剂能在小液体体积(如1ml)中重建以允许皮下给药并能提供低抗体集聚水平的溶液。使用抗体作为药物活性成分目前普遍存在,包括产品HERCEPTIN
合适剂量可变,其依赖于例如待采用的特定IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)、宿主、给药模式和所治疗病症性质及严重度、患者经历的先前治疗性质。最终,主治医师会决定治疗各个体患者的IL-17拮抗剂量。在一些实施方式中,所述主治医师可给予低剂量IL-17拮抗剂并观察患者反应。在其它实施方式中,所述给予患者的IL-17拮抗剂初始剂量较高,随后向下滴定直至出现复发体征。可给予更大剂量的IL-17拮抗剂,直至患者获得最优治疗效果,且剂量一般不再进一步增加。
在本公开一些治疗方法或应用的实践中,向患者如哺乳动物(例如人)给予治疗有效量的IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)。应理解所公开方法提供用IL-17拮抗剂(如苏金单抗)治疗PsA患者,这不妨碍患者是否根本上被IL-17拮抗剂治疗,例如这种IL-17拮抗剂疗法是否必需是单一疗法。确实,如果选择患者用IL-17拮抗剂治疗,则IL-17拮抗剂(如苏金单抗)可根据本公开方法给予给药,单独或联合其它药剂和疗法以治疗PsA患者,如联合至少一种额外PsA剂如免疫抑制剂、疾病调节性抗风湿药(DMARD)(如MTX)、止痛药(如曲马朵或醋氨酚)、类固醇(如强的松)、非甾体抗炎药(NSAID)、细胞因子拮抗剂、促骨合成剂、抗骨再吸收制剂,和其组合(如双联和三联疗法)。当与一种或多种额外药剂共给药时,IL-17拮抗剂可与其它药剂同时或依序给药。如果依序给药,主治医生会决定给予IL-17拮抗剂与其它药剂的合适顺序以及共递送的合适剂量。
与苏金单抗联用治疗PsA患者的非甾体抗炎药和止痛药包括丙酸衍生物、乙酸衍生物、烯醇酸衍生物、芬那酸衍生物、Cox抑制剂如罗美昔布、布洛芬、非诺洛芬、酮洛芬、氟比洛芬、奥沙普秦、吲哚美辛、舒林酸、依托度酸、酮咯酸、纳布美通、阿司匹林、萘普生、伐地考昔、依托考昔、MK0966;罗非考昔、对乙酰氨基酚、塞来昔布、双氯芬酸、曲马朵、吡罗昔康、美洛昔康、替诺昔康、屈恶昔康、氯诺昔康、伊索昔康、甲芬那酸、甲氯芬那酸、氟芬那酸、托芬那酸、伐地考昔、帕瑞考昔、依托度酸、吲哚美辛、阿司匹林、布洛芬、非罗考昔。与IL-17拮抗剂如苏金单抗联用治疗PsA患者的DMARD包括氨甲蝶呤(MTX)、抗疟药(如羟氯喹和氯喹)、柳氮磺胺吡啶、来氟米特、硫唑嘌呤、环孢菌素,金盐、米诺环素、环磷酰胺,D-青霉胺、米诺环素、金诺芬、他克莫司、硫代苯酸金钠(myocrisin)、苯丁酸氮芥。与IL-17拮抗剂如苏金单抗联用治疗PsA患者的类固醇(如糖皮质激素)包括泼尼松龙、强的松、地塞米松、皮质醇、可的松、氢化可的松、甲泼尼龙、倍他米松、去炎松、倍氯米松、氟氢可的松、去氧皮质酮、醛固酮。
与IL-17拮抗剂如苏金单抗联用治疗PsA患者的生物药剂包括阿达木单抗
IL-17拮抗剂如苏金单抗可方便地胃肠外、静脉内_(例如进入肘前或其它外周静脉)、肌肉内或皮下给药。用本公开药物组合物的静脉内(i.v.)疗法持续时间可根据所治疗疾病严重度以及各个体患者的状况和个人反应而变化。还考虑用本公开药物组合物的皮下(s.c.)疗法。卫生保健提供者会决定i.v.或s.c.疗法的合适持续时间和治疗给药时间,使用本公开药物组合物。
PCT申请号PCT/US2011/064307提供了治疗PsA患者的优选给药和治疗方案(包括诱导和维持方案),所述申请通过引用纳入本文,因为其涉及剂量和方案。
在一个实施方式中,所述IL-17拮抗剂(如苏金单抗)在第0、2和4周中以约10mg/kg每隔一周静脉内(i.v.)给予患者,之后在第8周开始以约75mg-约300mg(如约75mg、约150mg、约300mg)每月皮下(s.c.)给予患者。此方式中,患者在第0、2和4周中以约10mg/kgi.v.给药,随后患者在第8、12、16、20周中s.c.给药约75mg-约300mg(如约75mg、约150mg、约300mg)IL-17拮抗剂(如苏金单抗)。
在另一实施方式中,所述IL-17拮抗剂(如苏金单抗)在第0、1、2和3周中以约75mg-约300mg(如约75mg、约150mg、约300mg)每周s.c.给予患者,之后在第4周开始以约75mg-约300mg(如约75mg、约150mg、约300mg)每月(每4周)s.c.给予患者。此方式中,患者在第0、1、2、3、4、8、12、16、20等周中s.c.给药约75mg-约300mg(如约75mg、约150mg、约300mg)IL-17拮抗剂(如苏金单抗)。
或者,所述IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)可给予患者而无加载方案(loading regimen),如苏金单抗可以约75mg-约300mg(如约75mg、约150mg、约300mg)每4周(每月)s.c.给予患者。此方式中,患者在第0、4、8、12、16、20等周中s.c.给药约75mg-约300mg(如约75mg、约150mg、约300mg)IL-17拮抗剂(如苏金单抗)。
应理解某些患者可能需要剂量递增(如在诱导和/或维持期),例如,对IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)治疗显示不充分应答的患者。因此,苏金单抗的s.c.剂量可大于约75mg-约300mg s.c.,如约80mg、约100mg、约125mg、约175mg、约200mg、约250mg、约350mg、约400mg等;类似地,i.v.剂量可大于约10mg/kg,如约11mg/kg,12mg/kg,15mg/kg,20mg/kg,25mg/kg,30mg/kg,35mg/kg等。还应理解某些患者也可能需要剂量减少(如在诱导和/或维持期),例如,对IL-17拮抗剂(如苏金单抗)治疗显示不良事件或不良反应的患者。因此,苏金单抗剂量可小于约75mg-约300mg s.c.,如约25mg、约50mg、约80mg、约100mg、约125mg、约175mg、约200mg、250mg等;类似地,i.v.剂量可小于约10mg/kg,如约9mg/kg,8mg/kg,5mg/kg,4mg/kg,3mg/kg,2mg/kg,1mg/kg等。在一些实施方式中,所述IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)可以初始剂量给予患者,如s.c.递送的75mg或150mg,随后若需要,剂量提高到150mg或300mg,由医生确定。
在一些实施方式中,所采用的剂量由特定患者决定。例如,在一些实施方式中,伴发中度到重度斑块型银屑病的患者优选给予300mg剂量的IL-17抗体(如苏金单抗),所述患者之前用生物制剂(如TNFα拮抗剂)治疗失败或之前不充分响应生物制剂(如TNFα拮抗剂)。
给药时间一般从第一剂苏金单抗当天(也称为“基线”)衡量。然而,卫生保健提供者通常使用不同命名惯例来识别给药安排,如表2所示。
表2-给药方案的常见命名惯例。加粗项指本文所用的命名惯例。
应注意,第0周可能被一些卫生保健提供者称为第1周,而第0天可能被一些卫生保健提供者称为第1天。因此,当提及同一给药方案时,不同的医生可能会将剂量定为在例如第3周中/第21天,第3周中/第22天,第4周中/第21天,第4周中/第22天给予。
为了保持一致性,给药的第一周在本文称为第0周,而给药的第一天称为第1天。然而,技术人员应理解此命名惯例仅用于保持一致性且不应构成限制,即每周给药是提供IL-17抗体周剂量,无论医生称特定周为“第1周”还是“第2周”。此外,在优选给药方案中,所述抗体在第0、1、2、3、4、8、12、16、20等周中给予。一些提供者可指此方案为每周给予抗体持续5周,随后在第8周开始为每月(或每4周),而其他人可指此方案为每周给予抗体持续4周,随后在第4周开始为每月(或每4周)。技术人员应理解不同命名惯例仍然标识同一方案。技术人员也应理解在第0、1、2、3和4周中每周给药然后每4周给药与在第0、1、2和3中每周给药然后在第4周开始每4周给药,是同一方案。
因此,本文公开了抑制PsA患者中结构损伤进展的方法,包括向有需要的患者给予IL-17拮抗剂。本文还公开了减少PsA患者中活跃PsA体征和症状,抑制PsA患者结构(如骨和/或关节)损伤进展,和提高PsA患者身体机能的方法,包括向有需要的患者给予IL-17拮抗剂。在上述方法的一些实施方式中,所述患者未接受过生物制品。在所公开应用、方法和药盒的一些实施方式中,所述患者经历过生物制品。在所公开应用、方法和药盒的一些实施方式中,所述患者之前未用TNFα拮抗剂治疗。在所公开应用、方法和药盒的一些实施方式中,所述患者之前用TNFα拮抗剂治疗。在所公开应用、方法和药盒的一些实施方式中,所述患者不充分响应先前TNFα拮抗剂治疗(TNF不充分应答者[TNF-IR])。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展通过van der Heijde银屑病关节炎改良总Sharp评分(mTSS)测量。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展通过侵蚀和关节间隙狭窄(JSN)评分测量。在所公开应用、方法和药盒的一些实施方式中,侵蚀、关节间隙狭窄、杯中铅笔现象、关节增宽、关节狭窄、半脱位、骨增生、骨质溶解和/或关节僵硬的进展受到抑制。在一些实施方式中,所公开方法还包括额外给予患者DMARD,如氨甲蝶呤(MTX)。在所公开应用、方法和药盒的一些实施方式中,所述IL-17拮抗剂在第0、2和4周中以约10mg/kg每隔一周静脉内(i.v.)给予患者,之后在第8周开始以约75mg、约150mg或约300mg每月皮下(s.c.)给予患者。在所公开应用、方法和药盒的一些实施方式中,所述IL-17拮抗剂在第0、1、2和3周中以约75mg、约150mg或约300mg每周s.c.给予患者,之后在第4周开始以约75mg、约150mg或约300mg每月s.c.给予患者。在所公开应用、方法和药盒的一些实施方式中,所述患者伴发银屑病。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展定义为mTSS相比基线变化≤0.5。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展定义为侵蚀评分相比基线变化≤0.3。在所公开应用、方法和药盒的一些实施方式中,抑制结构损伤进展定义为JSN评分相比基线变化≤0.2。在一些实施方式中,所述患者根据之前用TNFα拮抗剂治疗来选择用于治疗。在一些实施方式中,所述患者根据之前用TNFα拮抗剂治疗来选择性给予IL-17拮抗剂(苏金单抗)。
在所公开应用、方法和药盒的一些实施方式中,所述IL-17拮抗剂是IL-17抗体或其抗原结合片段。在所公开应用、方法和药盒的一些实施方式中,所述IL-17抗体或其抗原结合片段选自下组:a)结合IL-17表位的IL-17抗体或其抗原结合片段,所述表位包括Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129;b)结合IL-17表位的IL-17抗体或其抗原结合片段,所述表位包括Tyr43,Tyr44,Arg46,Ala79,Asp80;c)结合IL-17同二聚体表位的IL-17抗体或其抗原结合片段,所述同二聚体具有2条成熟IL-17蛋白链,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80;d)结合IL-17同二聚体表位的IL-17抗体或其抗原结合片段,所述同二聚体具有2条成熟IL-17蛋白链,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80,其中所述IL-17抗体或其抗原结合片段具有约100-200pM的K
本文还公开抑制PsA患者结构损伤进展的方法,包括向患者每月给予约75mg–约300mg苏金单抗,其中所述患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括通过皮下注射向患者每月给予约150mg或约300mg苏金单抗,初始给药在第0、1、2和3周,然后是第4周开始的每月给药,其中所述患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括通过静脉注射在第0、2和4周向患者给予约10mg/kg苏金单抗,之后通过皮下注射从第8周开始向患者给予约150mg或约300mg苏金单抗,其中所述患者之前用TNFα拮抗剂治疗。
本文还公开IL-17拮抗剂(苏金单抗)在生产抑制PsA患者结构损伤进展的药物中的应用,其中所述PsA患者之前用TNFα拮抗剂治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括向患者每月给予约75mg–约300mg苏金单抗,其中根据之前用TNFα拮抗剂治疗来选择患者用于治疗。
本文还公开抑制PsA患者结构损伤进展的方法,包括选择性向患者每月给予约75mg–约300mg苏金单抗,其中根据之前用TNFα拮抗剂治疗来选择患者用于治疗。
本文还公开IL-17拮抗剂(如苏金单抗)在生产抑制PsA患者(如之前用TNFα拮抗剂治疗的PsA患者)结构损伤进展的药物中的应用,其中所述药物配制成包括容器,各容器具有足够量的IL-17拮抗剂以允许递送每单位剂量至少约75mg–约300mg(如约75mg、约150mg、约300mg)IL-17拮抗剂(如苏金单抗)。
本文还公开IL-17拮抗剂(如苏金单抗)在生产抑制PsA患者(如之前用TNFα拮抗剂治疗的患者)结构损伤进展的药物中的应用,其中所述药物配制成包括容器,各容器具有足够量的IL-17拮抗剂以允许皮下递送每单位剂量至少约75mg–约300mg(如约75mg、约150mg、约300mg)IL-17拮抗剂(如苏金单抗)。
本文还公开IL-17拮抗剂(如苏金单抗)在生产抑制PsA患者(如之前用TNFα拮抗剂治疗的患者)结构损伤进展的药物中的应用,其中所述药物配制成包括容器,各容器具有足够量的IL-17拮抗剂以允许递送每单位剂量至少约10mg/kg。
本文还公开IL-17拮抗剂(如苏金单抗)在生产抑制PsA患者(如之前用TNFα拮抗剂治疗的患者)结构损伤进展的药物中的应用,其中所述药物配制成允许静脉内递送每单位剂量约10mg/kg的剂量。
本文所用的短语“配制成允许[给药途径]递送[指定剂量]的剂量”用于指给定药物组合物能用于通过指定给药途径(如s.c.或i.v.)提供所需剂量的IL-17拮抗剂如IL-17抗体例如苏金单抗。例如,若所需皮下剂量是300mg,则临床医师可使用2ml浓度为150mg/ml的IL-17抗体制剂,1ml浓度为300mg/ml的IL-17抗体制剂,0.5ml浓度为600mg/ml的IL-17抗体制剂等。在各个这种情况下,这些IL-17抗体制剂浓度足以允许皮下递送IL-17抗体。皮下递送通常需要递送体积量小于约2ml,优选约1ml或更少体积。
如本文所用,“容器有足够量IL-17拮抗剂以允许递送[指定剂量]”指给定容器(如小瓶、笔、注射器)其中所放置IL-17拮抗剂(如作为药物组合物一部分)的体积能用于提供所需剂量。例如,若所需剂量是150mg,则临床医师可自含有75mg/ml浓度IL-17抗体制剂的容器(如预装注射器或自助注射器)使用2ml,自含有150mg/ml浓度IL-17抗体制剂的容器(如预装注射器或自助注射器)使用1ml,自含有300mg/ml浓度IL-17抗体制剂的容器(如预装注射器或自助注射器)使用0.5ml。在各情况下,这些容器(如预装注射器或自助注射器)具有足够量的IL-17拮抗剂以允许递送所需150mg剂量。
本文公开IL-17拮抗剂(如苏金单抗)用于生产治疗患者PsA的药物,其中所述药物配制成有容器,各容器具有足够量的IL-17拮抗剂以允许递送每单位剂量至少约150mg–约300mg IL-17拮抗剂(如苏金单抗)。
本文公开IL-17拮抗剂(如苏金单抗)用于生产治疗患者PsA的药物,其中所述药物配制成有容器,各容器具有足够量的IL-17拮抗剂(如苏金单抗)以允许递送每单位剂量至少约10mg/kg。
本文公开IL-17拮抗剂(如苏金单抗)用于生产治疗患者PsA的药物,其中所述药物配制成允许静脉内递送每单位剂量约10mg/kg的剂量。
本文公开IL-17拮抗剂(如苏金单抗)用于生产治疗PsA的药物,其中所述药物配制成允许皮下递送每单位剂量约150mg–约300mg IL-17拮抗剂的剂量。
药盒
本公开还涵盖防止PsA患者中结构损伤(如骨和关节)的药盒。这类药盒包括IL-17拮抗剂如IL-17结合分子(例如IL-17抗体或其抗原结合片段如苏金单抗)或IL-17受体结合分子(例如IL-17受体抗体或其抗原结合片段)(如液体或冻干形式)或含IL-17拮抗剂(如上所述)的药物组合物。另外,这类药盒可包括给予IL-17拮抗剂(如自助注射器、注射器和小瓶、预装注射器、预装注射笔)的工具和使用说明。这些药盒可包含额外治疗剂(如上所述)用于治疗PsA,例如,与所装IL-17拮抗剂如IL-17结合分子(例如IL-17抗体,如苏金单抗)联合递送。这类药盒还可包括IL-17拮抗剂(如IL-17抗体例如苏金单抗)给药说明以抑制PsA患者(如未经历过TNF治疗和/或TNF-IR PsA患者)结构损伤进展。这种说明可提供所述剂量(如10mg/kg,75mg,150mg,300mg)、给药途径(如i.v.或s.c.)和给药方案(如在第0、2和4周中以约10mg/kg每隔一周i.v.给予,之后在第8周开始以约75mg、约150mg或约300mg每月s.c.给予;或在第0、1、2和3周中以约75mg、约150mg或约300mg每周s.c.给予,之后在第4周开始以约75mg、约150mg或约300mg每月s.c.给予患者),与所装IL-17拮抗剂如IL-17结合分子(例如IL-17抗体,如苏金单抗)一同使用。
短语“给药工具”用于指示任何向患者系统性给予药物的可用的器具或容器,包括但不限于预装注射器、小瓶和注射器、注射笔、自助注射器(例如其中有注射器)、i.v.滴注和袋、泵等。使用这类物品,患者可自我给药(即自己给药)或医生可给与药物。
本文公开用于抑制PsA患者结构损伤进展的药盒,其包括IL-17拮抗剂(如IL-17结合分子,例如IL-17抗体或其抗原结合片段如苏金单抗)。在一些实施方式中,所述药盒还包括向患者给予IL-17拮抗剂的工具。在一些实施方式中,所述药盒还包括给予IL-17拮抗剂的说明,其中所述说明指示IL-17拮抗剂(如IL-17结合分子例如IL-17抗体或其抗原结合片段如苏金单抗)在第0、2和4周中以约10mg/kg每隔一周静脉内(i.v.)给予患者(如未经历过TNF治疗和/或经历过TNF的患者),之后在第8周开始以约75mg–约300mg(如约75mg、约150mg或约300mg)每月皮下(s.c.)给予患者。在一些实施方式中,所述药盒还包括给予IL-17拮抗剂的说明,其中所述说明指示IL-17拮抗剂(如IL-17结合分子例如IL-17抗体或其抗原结合片段如苏金单抗)在第0、1、2和3周中以约75mg–约300mg(如约75mg、约150mg或约300mg)每周s.c.给予患者,之后在第4周开始以约75mg–约300mg(如约75mg、约150mg或约300mg)每月s.c.给予患者。
通述
在所公开方法、治疗、方案、应用和药盒的优选实施方式中,所述IL-17拮抗剂是IL-17结合分子。在优选实施方式中,所述IL-17结合分子是IL-17抗体或其抗原结合片段。在所公开方法、治疗、方案、应用和药盒的优选实施方式中,所述IL-17抗体或其抗原结合片段选自下组:a)结合IL-17表位的IL-17抗体或其抗原结合片段,所述表位包括Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129;b)结合IL-17表位的IL-17抗体或其抗原结合片段,所述表位包括Tyr43,Tyr44,Arg46,Ala79,Asp80;c)结合IL-17同二聚体表位的IL-17抗体或其抗原结合片段,所述同二聚体具有2条成熟IL-17蛋白链,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80;d)结合IL-17同二聚体表位的IL-17抗体或其抗原结合片段,所述同二聚体具有2条成熟IL-17蛋白链,所述表位包括一条链上的Leu74,Tyr85,His86,Met87,Asn88,Val124,Thr125,Pro126,Ile127,Val128,His129和另一条链上的Tyr43,Tyr44,Arg46,Ala79,Asp80,其中所述IL-17结合分子具有约100-200pM的K
在所公开应用、方法和药盒的优选实施方式中,所述IL-17抗体或其抗原结合片段是IgG
一个或多个本公开实施方式的细节示于以上所附描述中。尽管与本文所述类似或等同的任何方法和材料能用于实践或测试本公开,现在描述优选的方法和材料。通过描述和权利要求可清楚了解本公开的其它特征、目的和优势。在本说明书和所附权利要求中,单数形式包括复数指示物,除非上下文另有明确说明。除非另有定义,本文所用的全部技术和科学术语具有与本公开所属领域普通技术人员通常理解相同的含义。本说明书引用的所有专利和出版物通过引用纳入。提供以下实施例以更充分阐述本公开优选实施方式。这些实施例不应对所公开专利主题的范围构成限制,该范围如所附权利要求所定义。
实施例
实施例1:PsA试验CAIN4572206概念验证
实施例1.1–研究设计CAIN4572206
这是多剂量(2次输注间隔3周)10mg/kg AIN457的随机、双盲、安慰剂对照、多中心的概念验证研究,用于治疗根据目前提倡的临床试验分类标准(CASPAR)诊断为有活跃PsA的患者。招募符合以下标准的中度到重度PsA患者:(i)CASPAR标准诊断有银屑病关节炎(Taylor W等(2006)Arthritis Rheum 54:2665-73);对该标准的修改部分是至少3个周边关节的肿胀和压痛;(ii)PGA≥40,(iii)炎性疼痛≥40;(iv),至少一个DMARD以最大耐受剂量给予至少3个月时,疾病不能充分控制;(v)RF≤100IU及CCP ELISA试验阴性。根据OMERACT 8共识,疗效评价基于以下合格的评估域:1.周边关节受影响(68/68关节计数的ACR反应标准,PsARC(Clegg等(1996)Arthritis Rheum 39:2013-20),有待纳入关节计数的DIP关节,即78/76关节计数);DAS28;2.皮肤评估(PASI评分)(Feldman和Krueger(2005)Ann.Rheum.Dis.64:ii65-ii68);3.疼痛(VAS);4.功能:SF36躯体部分;5.通过VAS的患者总体评估(PGA);和6.HAQ
压痛78关节计数和肿胀76关节计数
将脚的远端指间关节和手的腕掌关节分别加入68个压痛和66个肿胀关节的常规ACR关节计数,产生78和76关节计数。因此,用于压痛评估的关节包括手的远端指间、近端指间和掌指关节,脚的跖趾关节,腕掌和腕关节(分开计数),肘,肩膀,肩锁,胸锁,臀部,膝盖,胫骨距骨和跗中关节。评估所有这些关节的肿胀,除了臀部。关节压痛和肿胀分级为存在(1)或缺失(0)。ACR评分系统的其它个体元素即患者VAS疼痛评分、患者总体评价、医生全面评估、健康评估问卷(HAQ)、急性期反应物、C反应蛋白(CRP)或红细胞沉降率(ESR)与它们用于类风湿性关节炎标准试验的方式没有变化。为获得ACR 20、50或70反应,压痛和肿胀关节计数以及五个个体元素得分(患者VAS疼痛评分,医生和患者总体评价,健康评估问卷(HAQ)和急性期反应物(ESR或CRP))中的三个改善至少20%、50%或70%。
除了ACR和PsARC,DAS28根据以下28个关节的压痛和肿胀评估来计算:掌指I-V(10),拇指指间(2),手近端指间II-V(8),手腕(2),肘(2),肩膀(2)和膝盖(2)。
ACR20,ACR50,ACR70应答者定义
对象定义为ACR20应答者,当且仅当持有以下3个条件:1.其在压痛关节数上(基于68个关节)有≥20%改善;2.其在肿胀关节数上(基于66个关节)有≥20%改善;3.其在下列5项中的3个上有≥20%改善:
·患者总体评价(VAS量表检测,0-100)
·医生全面评估(VAS量表检测,0-100)
·疼痛(VAS量表检测,0-100)
·功能障碍(如健康评估问卷所测)
·急性期反应物(如CRP所测)
ACR50和ACR70应答者以类似方式定义,改善分别为≥50%和≥70%。
PsARC应答者定义
对象定义为PsARC应答者,当且仅当其在下列4个因子中的2个(至少一个因子是关节计数)上有改善并且剩余因子不恶化
·患者总体评价(0-100VAS量表,改善定义为减少至少20个单位)
·医生全面评估(0-100VAS量表,改善定义为减少至少20个单位)
·压痛78关节计数(改善定义为减少至少30%)
·肿胀76关节计数(改善定义为减少至少30%)
满足4个应答者定义中每一个的对象比例由治疗组和时间点概括。呈现这些比例对时间的图。
DAS28评分
DAS28评分用以下公式获得:
DAS28=0.56*√(压痛28)+0.28√(肿胀28)+0.36*loge(CRP+1)+0.014*GH+0.96,其中压痛28=压痛关节计数(基于28个关节),肿胀28=肿胀关节计数(基于28个关节),CRP=C反应蛋白(以mg/L测量)和GH=患者总体评价(VAS量表检测,0-100)
患者疼痛强度的评价
患者疼痛评价用100mm VAS进行,范围从无疼痛到疼痛难以忍受。在研究者的场所,以mm测量离量表左边缘的距离并且所述值录入eCRF。
患者疾病活动性的总体评价
患者疾病活动性的总体评价用100mm VAS进行,范围从不严重到非常严重,在问题“过去一周中你的整体健康受影响有多严重”之后。在研究者的场所,以mm测量离量表左边缘的距离并且所述值录入eCRF。
疾病活动性的医生全面评估
疾病活动性的医生全面评估用100mm VAS进行,范围从没有疾病活动性到最高疾病活动性,在问题“考虑疾病影响你的患者的所有方式,就他或她今天情况如何在量表上画一条线”之后。为增强客观性,当医生自己对患者评估时,不允许其知道特定患者疾病活动的总体评价。然后,研究者以mm测量离量表左边缘的距离并且所述值录入eCRF。
C反应蛋白(CRP)
获得血液用于此评价的以鉴定炎症存在、确定其严重度和监测对治疗的反应。由于此试验结果对研究人员解盲,中心实验室的结果仅提供用于筛选和基线。仅在数据库锁后显示治疗期中收集的样品CRP结果。
红细胞沉降率(ESR)
获得血液以测量ESR,其有助于诊断炎性疾病并用于监测疾病活动和对疗法的反应。用中心实验室提供的标准试剂盒本地测量ESR。
疾病活动评分28(DAS28)和缓和期患者
DAS28根据评定量表进行,如(Aletaha D,Smolen J(2005).Clin.Exp.Rheumatol;23(5Suppl 39):S100-S108;Aletaha等(2005).Arthritis Rheum.;52(9):2625-36)所述。在研究第6和24周/结束时测定缓和期患者(DAS28≤2.6)百分数。
Maastricht强直性脊柱炎附着点评分(MASES)
Maastricht强直性脊柱炎附着点评分(MASES)(Heuft-Dorenbosch L等(2003)AnnRheum Dis 62:127-32;Gladman DD(2007)从Mander指数发展而来,包括13个位点评估。纳入MASES指数的附着点位置是:第1肋骨软骨、第7肋骨软骨、髂后上棘、髂前上棘、髂嵴(以上都双侧评价)、第5腰椎棘突、近端跟腱(双侧)。
SPARCC(加拿大SpA研究联盟)
SPARCC(加拿大SpA研究联盟)(Maksymowych等.(2003)J.Rheumatology30:1356-63)评估18个附着点位置:肱骨内和外上髁、冈上肌插入、近端跟腱、大转子、股骨内和外侧髁、跖腱膜插入、髌骨股四头肌插入、髌骨下极、胫骨结节。
利兹指炎仪器(LDI)
利兹指炎仪器(LDI)(Helliwell等(2005).J Rheumatol 32:1745-50)基础测量受影响指周长与对侧手或足的指周长之比,采用10%最小差异来定义指炎指。周长之比乘以压痛评分,使用LDI修正,LDI是二元计分(1用于压痛,0用于非压痛)。如果认为两侧都涉及,所述数字会与表中提供的数据对比。此修正称为LDI基础并应用于该研究。LDI需要测量指周长的工具(可获自www.rehaboutlet.com,美国佛罗里达州迈阿密)。
银屑面积和严重性指数(PASI)
PASI(Feldman和Krueger(2005)Ann.Rheum.Dis.64:ii65-ii68)评价4块体表面积(头、躯干及上下肢)的银屑病程度以及斑块红斑、剥落和厚度的程度。PASI评分说明体表面积受红斑、剥落和厚度影响的程度以及这些量度的严重性。得分范围从0(无疾病)到72(疾病最重)。
实施例1.2-苏金单抗改善PsA的体征和症状
CAIN4572206评价苏金单抗抑制白介素-17A的安全性和初步功效,白介素-17A是治疗PsA的新靶点。42名满足CASPAR标准的活跃PsA患者随机2:1接受2次苏金单抗(10mg/kg)或安慰剂注射,间隔3周给予。主要疗效终点是第6周的ACR20应答者比例,活性相比安慰剂(单侧p<0.01)。35名(83.3%)患者(25个用苏金单抗,10个用安慰剂)完成研究。5名患者(4个苏金单抗和1个安慰剂)由于违反方案而从疗效分析中排除,7名(3个苏金单抗和4个安慰剂)由于缺乏功效或撤回知情同意书而提前中止。人口统计数据和基线特征在组之间平衡,包括参数:均值±SD SJC(苏金单抗vs.安慰剂):8.3±5.6vs.9.5±5.4;TJC 23.5±19.4vs.22.6±11.0;DAS28 4.8±1.2vs.4.8±1.2;MASES 3.0±4.1vs.3.4±2.3。在用苏金单抗的23、11和21名患者以及用安慰剂的11、5和10名患者中分别存在并发的银屑病、之前的TNFi暴露和与DMARDS联合给药。用苏金单抗vs.安慰剂的ACR20应答者在第6周是39%vs.23%(P=0.27),第12周是39%vs.15%,第28周是43%vs.18%。用苏金单抗vs.安慰剂的ACR50和ACR70应答者在第6周分别是17%vs.8%和9%vs.0%。第6周的CRP下降方面,用苏金单抗(基线vs.第6周的中值[范围]:4.9[0.3,43.0]vs.3.0[0.2,15.2])的下降大于安慰剂(6.2[1.3,39.7]vs.5.0[0.8,29.6])。
整体的不良事件(AE)率相当,苏金单抗26(93%)vs.安慰剂11(79%)。在4名苏金单抗患者和1名安慰剂患者中报告了7次严重AE。在16名(57%)用苏金单抗和7名(50%)用安慰剂的患者中报告了感染。总之,主要终点并未满足,尽管患者显示迅速和持续的临床评分及CRP水平改善,多至第28周。苏金单抗的安全性令人满意。
实施例2:PsA中AIN457F2306(FUTURE 1)试验的苏金单抗结果
实施例2.1:FUTURE 1概要
在此双盲、3期研究中,606个对象随机(1:1:1)至i.v.给予苏金单抗10mg/kg(第0、2、4周),然后每4周s.c.给予苏金单抗150mg(苏金单抗10mg/kg i.v.→150mg s.c.)或75mg(苏金单抗10mg/kg i.v.→75mg s.c),或采用同一给药安排的安慰剂。主要终点是第24周的美国风湿病学会反应标准提高20%(ACR 20)。
就第24周的ACR 20反应率而言,用苏金单抗10mg/kg i.v.→150mg s.c(50.0%)和苏金单抗10mg/kg i.v.→75mg s.c(50.5%)显著高于安慰剂(17.3%;P<0.001),早在第1周就观察到明显改善。用苏金单抗的ACR 50和ACR 70反应率也较高。在未接受过生物制品的对象和先前不充分响应生物制品的对象中都观察到改善。第24周时,苏金单抗相较安慰剂显著抑制疾病放射学进展(P<0.05)。对于皮肤银屑、附着点炎、指炎、疾病活动评分、身体功能和生活质量,也观察用苏金单抗到第24周时的显著改善。改善持续到第52周。苏金单抗总体耐受良好,没有意外的安全情况。
苏金单抗体在银屑病关节炎的关键临床领域中提供迅速、显著和持续的改善,包括放射学进展,验证白介素-17A作为此疾病背景中的治疗靶点。
实施例2.2:FUTURE 1的详细讨论
对象为18岁或以上,根据银屑病关节炎分类标准[CASPAR](Taylor等.(2006)Arthritis Rheum 2006;38:727–35)诊断有银屑病关节炎和活跃疾病,定义为具有3个或更多压痛关节和3个或更多肿胀关节,即使用非甾体抗炎药、疾病缓解性抗风湿药和/或TNF抑制剂治疗。只要剂量稳定,允许同时口服皮质类固醇(每天≤10mg强的松或等效物)和氨甲蝶呤(每周≤25mg)。之前接受过TNF抑制剂(经历过生物制品)的对象必须经历不充分应答或出于安全或耐受性原因停止治疗。
关键排除标准包括:先前用TNF抑制剂以外的生物免疫调节剂治疗;用大于3种不同TNF抑制剂治疗;银屑病关节炎以外的活跃炎性疾病;随机分配前2周内的活跃感染,或正在进行的、慢性或复发感染史。
4周筛选期后,对象以1:1:1比例随机分入2个苏金单抗治疗组之一或安慰剂组。研究设计示于图1。苏金单抗治疗的对象在基线(第0周)和第2及4周接受10mg/kg静脉内剂量,之后是每4周皮下给予苏金单抗150mg(苏金单抗10mg/kg i.v.→150mg s.c.)或75mg(苏金单抗10mg/kg i.v.→75mg s.c.);安慰剂组的对象根据同一静脉内和皮下给药安排治疗。在第16周,所有对象分类(以盲方式)为应答者或非应答者,前者定义为压痛和肿胀关节数相比基线改善至少20%。用安慰剂治疗的对象重新随机(1:1)每4周皮下接受苏金单抗150mg或75mg,从第16周(非应答者)或第24周(应答者)开始。对象根据先前TNF抑制剂暴露进行分层,约70%对象需要是未接受过生物制品。
在各研究访问中进行功效和安全评估直到第52周。主要疗效终点是第24周时实现美国风湿病学会反应标准提高20%的对象比例(ACR 20;Felson等.Arthritis Rheum1995;38:727-35)。第24周的二级疗效评估包括:ACR 50反应;在基线时有至少3%体表面积受银屑影响的对象亚组中,银屑面积和严重性指数得分改善75%和90%(PASI 75和PASI90;Weisman等.J Dermatolog Treat.2003;14:158-65);在基线时存在指炎(由指炎性关节数评价)和附着点炎(由四点附着点炎指数评价)的对象中这些特征的存在;28关节疾病活动评分相比基线的变化,用C反应蛋白(DAS28-CRP;Wells等.Ann Rehum Dis 2009;68:954-6);生活质量,用医疗效果研究36项简易健康调查问卷(SF-36)版本2[Ware等.Med Care1992;30:473–83]评价;身体功能,用健康评估问卷功能障碍指数(HAQ-DI;Fries等.Arthritis Rheum 1980:23:137-45)评价。放射学进展用van der Heijde银屑病关节炎改良总Sharp评分(mTSS,vdH-mTSS;van der Heijde等.Arthritis Rheum2005;52:49–60)评价。在基线、第16或24周(取决于反应)和第52周进行手/腕和脚的放射学评估。图像由2个独立读者集中打分。探索性疗效评估包括第24周的ACR70反应率及侵蚀和关节间隙狭窄的放射学评估,以及随着时间和超过第24周的各疗效终点评估。就关键疗效终点评估进行基于先前生物疗法的预先指定亚组分析。进行数个其它探索性评估但本文未描述,包括药代动力学测量。
安全性通过不良事件、严重不良事件和常规血液学及实验室值评估。用国家癌症研究所不良事件通用术语标准4.0版将不良事件严重性分级。潜在的主要不良心脏事件由独立专家委员会评判。
600个对象的样本大小估计以双侧,I型α误差为0.05来检测ACR 20反应率改善27%的效能有99%。对于第24周的疗效评价,统计分析使用非应答者填补用于二元变量,混合效果重复测量模型用于连续变量,以及线性外推用于放射学数据,根据预定义分层假设检验策略以调整多重性。除非另有说明,第24周后报告观测数据。安全性分析包括所有随机分入研究接受至少一剂研究药物的对象。
共筛选817个对象,其中606个随机分配(n=202/研究臂);553(91.3%)个对象完成24周评估期且515(85.0%)个完成52周研究期。
基线人口统计数据、疾病特征和先前或联合用药在研究组间类似(表3)。约一半(53.6%)的随机对象有影响其体表面积至少3%的银屑,53.4%有指炎且61.4%有附着点炎。约三分之二(70.5%)的对象未接受过生物制品且59.4%同步接受氨甲蝶呤。
第24周时,相较安慰剂,接受苏金单抗10mg/kg i.v.→150mg s.c和苏金单抗10mg/kg i.v.→75mg s.c.的对象有更高比例实现ACR 20反应(50.0%和50.5%相比17.3%;P<0.001;表4),早至第1周观察到显著改善。第24周时,相比安慰剂,用苏金单抗的ACR 50和ACR 70反应率也显著更高(表4;图2)。第24周时就所有其它预先指定的二级终点而言,观察到2种苏金单抗剂量相比安慰剂都有显著改善,包括PASI 75和PASI 90反应,DAS28-CRP、SF-36躯体部分评分和HAQ-DI评分相比基线的变化,有指炎和附着点炎的对象比例(表4)。直至第24周苏金单抗剂量之间在临床反应方面没有显著差异。
表3.基线时的对象人口统计数据和疾病特征。
*注,一个对象接受一剂英利昔单抗,随后由于补给原因中止,而不是由于不充分应答。英利昔单抗剂量记录为在先药物,但对象报告为未接受过生物制品。BSA,体表面积;DAS28-CRP,基于C反应蛋白的28关节疾病活动评分;HAQ-DI,健康评估问卷功能障碍指数;PASI,银屑面积和严重性指数;PGA,医生全面评估;PsA,银屑病关节炎;SD,标准差;SJC,肿胀关节数;TJC,压痛关节数;TNF,肿瘤坏死因子;VAS,视觉模拟量表。
表4.第24周(安慰剂对照期)时数种关节炎、银屑病和患者报告结果之间的疗效比较。
*P<0.05相比安慰剂;**P<0.01相比安慰剂;***P<0.001相比安慰剂
各组中N=202;/>
苏金单抗10mg/kg i.v.→75mg s.c.组中N=181和安慰剂组中N=179。最小临床重要差异就SF-36躯体部分评分而言是≥2.5,就HAQ-DI评分而言是-0.35。由于缺乏经历过生物制品的对象实现ACR 70或PASI 90反应(用安慰剂),对终点的治疗间统计分析进行费希尔精确检验。
a
ACR 20/50/70,美国风湿病学会反应标准的20%/50%/70%改善;经历过生物制品,记载的不充分应答或对TNF抑制剂缺乏安全/耐受性;DAS28-CRP,基于C反应蛋白的28关节疾病活动性评分;HAQ-DI,健康评估问卷功能障碍指数;LS,最小平方;MCID,最小临床重要差异;mTSS,改良总Sharp评分;PASI 75/90,银屑面积和严重性指数的75%/90%改善;SE,标准误;SF-36PCS,简易36项躯体部分总评;TNF,肿瘤坏死因子。
第24周时,2个苏金单抗治疗组的对象相较安慰剂治疗对象经历明显较少的放射学进展,如mTSS相比基线的变化所测。在整个52周中维持改善(图3)。
第24周时,相比安慰剂,观察到用苏金单抗的改善,无论先前是否暴露于生物制品。在未接受过生物制品和经历过生物制品的对象中,用2个剂量苏金单抗的ACR反应率都比安慰剂更高,尽管未接受过生物制品的对象中反应幅度更大(图4)。在有和没有同时使用氨甲蝶呤的情况下,观察到用苏金单抗的ACR反应率相比安慰剂显著改善,2个人群中观察到类似反应(图5)。
苏金单抗治疗的临床益处在整个52周治疗中维持(表5)。第52周时,对于苏金单抗10mg/kg i.v.→150mg s.c.,ACR 20、ACR 50和ACR 70反应率分别是69.5%,50.0%和28.2%,对于苏金单抗10mg/kg i.v.→75mg s.c.,ACR 20、ACR50和ACR 70反应率分别是66.9%,38.4%和25.6%,使用所观测的分析(表5)。
表5.在基线随机分配苏金单抗的对象于第52周观测的疗效数据汇总。ACR20/50/70,美国风湿病学会反应标准的20%/50%/70%改善;DAS28-CRP,基于C反应蛋白的28关节疾病活动性评分;HAQ-DI,健康评估问卷功能障碍指数;LS,最小平方;PASI 75/90,银屑面积和严重性指数的75%/90%改善;SE,标准误;SF-36PCS,简易36项躯体部分总评。
实施例3:第24周和第52周的PsA试验AIN457F2306(FUTURE 1)放射学结果汇总
606个有中度到重度PsA的成人随机分入安慰剂(PBO)或2个苏金单抗治疗臂之一:苏金单抗10mg/kg i.v.然后是75mg s.c.(10IV→75SC)或150mg s.c.(10IV→150SC)。所有患者在第16周评估关节反应(基于压痛和肿胀关节数≥20%改善)。PBO治疗患者在第16周(非应答者)或第24周(应答者)重新随机分配苏金单抗75或150mg s.c.。van der Heijde改良总Sharp评分(vdH-mTSS,mTSS)以及侵蚀和关节间隙狭窄(JSN)评分在基线、第16/24周(取决于反应)和第52周测定。苏金单抗从基线到第24周对放射学进展的影响用非参数ANCOVA模型评估,线性外推用于在第16周进行x射线评估的患者。探索性分析评价没有结构进展(定义为mTSS相比基线的变化≤0.5)和随着时间维持此效果的患者比例。mTSS、侵蚀和JSN评分相比基线的变化证明,苏金单抗治疗的患者从基线到第24周的进展在统计上显著小于PBO治疗的患者,无论患者之前是否接受过用TNF抑制剂的在先疗法、采用苏金单抗单一疗法或同时接受氨甲蝶呤(MTX;表6)。对关节结构损伤的抑制用苏金单抗维持到第52周。分析转换成苏金单抗的PBO患者显示,患者转换成苏金单抗时,PBO组的mTSS相比基线平均变化在从基线到第24周(平均增加0.48)高于第24周到第52周时间段(平均减少–0.03),提供对疗效的额外支持。分析在第16/24周和第52周进行x射线的患者(X射线完成者)显示从随机化到第24周vs.第24周到第52周时间段的未经历进展(在X射线完成者中使用≤0.5的阈值)的患者比例,在苏金单抗组中一贯高:对于10IV→75SC分别为92.3%vs.85.8%,对于10IV→150SC分别为82.3%vs.85.7%。在初始随机分配到PBO的患者中,75.7%从随机化到第24周没有进展且在用苏金单抗积极治疗后从第24周到第52周时间段增加至86.8%(P<0.05)。阈值≤0.5在读取误差边际内,被认为对PsA临床有意义,并在PsA的其它生物制品研究中用于定量放射学进展的抑制(Mease等.(2009))。
这些结果证明多至第24周观察到苏金单抗的放射学益处,无论先前抗TNF暴露如何。从第24周到第52周,未经历过TNF-α抑制剂治疗亚组中用苏金单抗观察到持续放射学进展抑制的程度高于TNF-α抑制剂不充分应答者的患者。
实施例4:苏金单抗对PsA患者中结构损伤抑制的其它分析(FUTURE 1)
进一步分析以确定苏金单抗在第24周和第52周对关节结构损伤的效果。如图6所示,在全分析集(FAS)中,2个苏金单抗75mg&150mg剂量在第24周的侵蚀评分、关节间隙狭窄评分(75mg)和van der Heijde改良总Sharp评分(mTSS,vdH-mTSS)相比安慰剂有显著改善。
总vdH-mTSS评分的累积分布图(图7)也称为“S曲线”,显示个体患者数据,表明是否有异常值推动均值。灰色圆圈代表安慰剂患者,可见相较10mg/kg-150或-75组,更多的这些患者有相比基线的更大变化(指示结构损伤进展)。2个主要异常值(一个在安慰剂中,一个在苏金单抗中)不改变总体结果,意味着结果不由在这段时间内进展大的少数安慰剂患者推动。
如图8所示,10mg/kg→150mg和→75mg组相较安慰剂都随着时间展示出降低的总vdH-mTSS进展。应注意到第24周,所有安慰剂患者转换成苏金单抗75或150mg s.c.。这些安慰剂转换患者中相比基线的变化在第24周开始减少。这也示于表7。因此,用苏金单抗的s.c.治疗(有或没有负荷剂量)显示抑制PsA相关结构损伤进展。
图9提供抑制结构损伤的分析,如第24周时在TNF-IR(图9A)和未经历过TNF治疗(图9B)的患者中通过vdH-mTSS所测。10mg/kg→150mg和→75mg组-分开或合并-相较安慰剂都展示随着时间相比基线的平均变化减少。应注意苏金单抗在未经历过TNF治疗和TNF-IRPsA患者(加框)中显示显著抑制结构损伤。这也示于表8。据我们所知,苏金单抗是显示在之前用TNF-α抑制剂治疗的PsA患者(如TNF-IR患者)中抑制结构损伤进展的第一个生物制品。苏金单抗也显示显著抑制患者结构损伤,无论是否联合MTX治疗(表9)。
X射线完成者定义为在第16或24周和第52周进行x射线评估的患者。X射线完成者数量就10IV→150SC组而言是175(86.6%),10IV→75SC组是169(83.7%)且安慰剂组是152(75.3%)。线性外推应用于第24周终点的患者数在苏金单抗10IV→150SC组中是55,苏金单抗10IV→75SC组是40且安慰剂组是109。来自X射线完成者的数据证明用苏金单抗的持续疗效多至1年(图10)。转换成苏金单抗的安慰剂患者在第24周(包括线性外推用于非应答者)和第52周之间的平均mTSS变化(图10B)是–0.03,相比之下安慰剂段(基线到第24周[图10A])是0.48,指示苏金单抗抑制放射学疾病进展(图10)。
来自X射线完成者的数据显示,高比例的苏金单抗组患者从随机化到第24周和从第24周到第52周没有经历进展。10IV→150SC苏金单抗组中,82.3%患者从随机化到第24周不显示进展且85.7%患者从第24周到第52周不显示进展。10IV→75SC苏金单抗组中不显示进展的患者比例分别是92.3%和85.8%。安慰剂治疗患者在苏金单抗治疗后无结构进展的比例从75.7%(从随机化到第24周)显著增加到86.8%(从第24周到第52周)(P<0.05)。
在此报告的FUTURE 1试验1年结果证明,用苏金单抗的抗IL-17A疗法抑制PsA患者的放射学疾病进展。第24周所见治疗放射学益处持续久至1年,并且无论先前抗TNF治疗如何都观察到。注意到在接受联合MTX疗法的患者以及没有接受过氨甲蝶呤的治疗患者中也有改善。安慰剂治疗患者的关节结构损伤进展通过转换成苏金单抗治疗得到抑制,表明延迟治疗仍有益且苏金单抗加载方案对实现此结果并非必需。此外,探索性分析显示高比例的苏金单抗治疗患者没有经历结构进展。
近期的系统性综述突出了TNF阻断剂对PsA结构损伤的抑制效果(Goulabchand等(2014)Ann Rheum Dis 73:414–9)。然而,一些患者中的抗TNF治疗失败、功效丧失和不耐受意味着迫切需要具有不同作用机制的疗法(Mease等(2014)Drugs 74:423–41;Saad等(2009)Arthritis Res Ther 11:R52;Fagerli等(2013)Ann Rheum Dis 72:1840–4)。为此,本研究结果表明选择性抑制IL-17A对PsA患者有益并可能提供额外治疗机会。
/>
表7:总Sharp评分(mTSS)X射线完成者在F2306研究中从第24周到第52周的变化。相比W24的变化=从基线到第52周的变化(有可评估情况)减去从基线到第24周的变化(用线性外推)。
表8:第24周时按TNFα状态的总Sharp评分(mTSS)。
/>
表9:第24周时按联用MTX的总Sharp评分(mTSS)
实施例5:临床试验CAIN457F2312(FUTURE 2):苏金单抗在3期随机、多中心、双盲、安慰剂对照的研究中改善活跃PsA,使用皮下给药方案:第24周结果
目的是在FUTURE 2(NCT01752634)中评估s.c.加载和维持施用苏金单抗的功效和安全性,FUTURE 2是活跃PsA患者的随机、双盲、安慰剂(PBO)对照的3期研究。
397个患有活跃PsA的成人随机分配到在基线(第0周),第1、2、3、4周和之后的每4周的苏金单抗(300、150或75mg)或PBO。随机化按先前暴露于抗TNF疗法来分层。主要终点是第24周的ACR20反应。次要终点包括PASI 75/90、用C反应蛋白的疾病活动性评分28(DAS28-CRP)、简易36项躯体部分总评(SF-36PCS)、健康评估问卷功能障碍指数(HAQ-DI)、ACR50,指炎和附着点炎。主要和次要终点纳入分层检验分析以调整多重性。
在第24周,用苏金单抗300、150和75mg的ACR20反应显著高于PBO:分别为54.0%,51.0%和29.3%vs.15.3%(对于苏金单抗300和150mg,P<0.0001;对于75mg vs PBO,P<0.05)。苏金单抗300和150mg相对于PBO也提高次要终点,包括PASI 75/90评分和DAS-28CRP显著改善(表10)。治疗突发AE的暴露调整率(最大苏金单抗暴露:372天)在苏金单抗(合并)和安慰剂治疗对象中分别是每100患者-年222.2和309.3例。相应的严重AE率是7.8和8.8。
苏金单抗300和150mg s.c.显示了PsA体征和症状的临床显著改善。苏金单抗的安全性与先前报道的一致。
表10.FUTURE 2选定24周疗效结果汇总
- 使用IL-17拮抗剂抑制银屑病关节炎患者的结构损伤进展
- 使用IL-17拮抗剂抑制银屑病关节炎患者的结构损伤进展
