化合物作为或制备大麻素受体激动剂或拮抗剂中的应用
文献发布时间:2023-06-19 19:28:50
本申请是中国发明专利申请的分案申请,原申请日为2019年04月09日,申请号:201910280591.5,发明创造名称:化合物作为或制备大麻素受体激动剂或拮抗剂中的应用,公开号:CN111789860A。
技术领域
本发明涉及真菌及植物中靶向活性分子的发现及应用,具体地说是反柄紫芝和竹灵芝中,一种大麻素受体新激动剂和三种新拮抗剂的发现及应用,所述的大麻素受体的新天然激动剂为Kfb77,新天然拮抗剂为Kfb28,Kfb68和Kga1。所述应用包括治疗神经衰弱、失眠健忘、心脑血管疾病(如高血压病、高血脂症)、炎症、氧化衰老、肥胖/代谢失常等疾病中的一种或两种以上。
背景技术
作为内源性大麻素系统中两种重要的受体,大麻素I型和II型受体(cannabinoidreceptors,CB1和CB2)属于G蛋白偶联受体中A类视紫红质样家族,广泛分布于多种组织,介导多种生理功能。CB1主要分布于中枢神经系统(如大脑),调节神经递质释放;CB2主要分布于免疫组织和细胞,发挥免疫调节作用。在神经调节方面,内源性大麻素系统是情绪稳态和认知功能的基础
天然产物一直是药物开发中最主要、最有效的来源。自然界的植物和真菌中的化合物,种类繁多,结构丰富,为发现先导化合物以至药物研发提供了附有创造力的基础。就内源性大麻素系统来说,该系统及其包含的内源性大麻素及受体,都是以植物大麻(Cannabis sativa)命名的。大麻中富含百余种大麻素,其中四氢大麻酚(Tetrahydrocannabinol)是大麻中的主要精神活性物质
长久以来,植物与真菌被灵活应用于传统治疗,在维护精神健康与提高免疫力、增强体能方面,功效显著。比如灵芝类真菌,被用于抗衰老、保护心血管疾病等治疗
目前,关于本发明发现的灵芝中的四种天然化合物在大麻素I型和大麻素II型受体的活性与功能尚未报道。
参考文献
1.Ibarra-Lecue,I.;Pilar-Cuellar,F.;Muguruza,C.;Florensa-Zanuy,E.;Diaz,A.;Uriguen,L.;Castro,E.;Pazos,A.;Callado,L.F.,The endocannabinoid systemin mental disorders:Evidence from human brain studies.Biochemicalpharmacology 2018,157,97-107.
2.Aso,E.;Ozaita,A.;Serra,M.A.;Maldonado,R.,Genes differentiallyexpressed in CB1 knockout mice:involvement in the depressive-likephenotype.Eur Neuropsychopharmacol 2011,21(1),11-22.
3.Valverde,O.;Torrens,M.,CB1 receptor-deficient mice as a model fordepression.Neuroscience 2012,204,193-206.
4.Bhattacharyya,S.;Egerton,A.;Kim,E.;Rosso,L.;Riano Barros,D.;Hammers,A.;Brammer,M.;Turkheimer,F.E.;Howes,O.D.;McGuire,P.,Acute inductionof anxiety in humans by delta-9-tetrahydrocannabinol related to amygdalarcannabinoid-1(CB1)receptors.Sci Rep 2017,7(1),15025.
5.Di Marzo,V.;Despres,J.P.,CB1 antagonists for obesity--what lessonshave we learned from rimonabant?Nat Rev Endocrinol 2009,5(11),633-8.
6.Rossi,F.;Bellini,G.;Luongo,L.;Manzo,I.;Tolone,S.;Tortora,C.;Bernardo,M.E.;Grandone,A.;Conforti,A.;Docimo,L.;Nobili,B.;Perrone,L.;Locatelli,F.;Maione,S.;Del Giudice,E.M.,Cannabinoid Receptor 2 as AntiobesityTarget:Inflammation,Fat Storage,and Browning Modulation.J Clin EndocrinolMetab 2016,101(9),3469-78.
7.Cabral,G.A.;Griffin-Thomas,L.,Emerging role of the cannabinoidreceptor CB2 in immune regulation:therapeutic prospects forneuroinflammation.Expert Rev Mol Med 2009,11,e3.
8.Ziring,D.;Wei,B.;Velazquez,P.;Schrage,M.;Buckley,N.E.;Braun,J.,Formation of B and T cell subsets require the cannabinoid receptorCB2.Immunogenetics 2006,58(9),714-25.
9.Ofek,O.;Karsak,M.;Leclerc,N.;Fogel,M.;Frenkel,B.;Wright,K.;Tam,J.;Attar-Namdar,M.;Kram,V.;Shohami,E.;Mechoulam,R.;Zimmer,A.;Bab,I.,Peripheralcannabinoid receptor,CB2,regulates bone mass.Proceedings of the NationalAcademy of Sciences of the United States of America 2006,103(3),696-701.10.Schaich,C.L.;Shaltout,H.A.;Brosnihan,K.B.;Howlett,A.C.;Diz,D.I.,Acuteand chronic systemic CB1 cannabinoid receptor blockade improves bloodpressure regulation and metabolic profile in hypertensive(mRen2)27rats.Physiol Rep 2014,2(8).
11.Steffens,S.;Pacher,P.,Targeting cannabinoid receptor CB(2)incardiovascular disorders:promises and controversies.British journal ofpharmacology 2012,167(2),313-23.
12.Carbone,F.;Mach,F.;Vuilleumier,N.;Montecucco,F.,Cannabinoidreceptor type 2 activation in atherosclerosis and acute cardiovasculardiseases.Current medicinal chemistry 2014,21(35),4046-58.
13.Lafaye,G.;Karila,L.;Blecha,L.;Benyamina,A.,Cannabis,cannabinoids,and health.Dialogues Clin Neurosci 2017,19(3),309-316.
14.Blessing,E.M.;Steenkamp,M.M.;Manzanares,J.;Marmar,C.R.,Cannabidiolas a Potential Treatment for Anxiety Disorders.Neurotherapeutics 2015,12(4),825-36.
15.Rong,C.;Lee,Y.;Carmona,N.E.;Cha,D.S.;Ragguett,R.M.;Rosenblat,J.D.;Mansur,R.B.;Ho,R.C.;McIntyre,R.S.,Cannabidiol in medical marijuana:Researchvistas and potential opportunities.Pharmacological research:the officialjournal of the Italian Pharmacological Society 2017,121,213-218.
16.Sharma,C.;Sadek,B.;Goyal,S.N.;Sinha,S.;Kamal,M.A.;Ojha,S.,SmallMolecules from Nature Targeting G-Protein Coupled Cannabinoid Receptors:Potential Leads for Drug Discovery and Development.Evidence-basedcomplementary and alternative medicine:eCAM 2015,2015,238482.
17.da Silva,K.A.;Paszcuk,A.F.;Passos,G.F.;Silva,E.S.;Bento,A.F.;Meotti,F.C.;Calixto,J.B.,Activation of cannabinoid receptors by thepentacyclic triterpene alpha,beta-amyrin inhibits inflammatory andneuropathic persistent pain in mice.Pain 2011,152(8),1872-87.
18.Thakur,G.A.;Duclos,R.I.,Jr.;Makriyannis,A.,Natural cannabinoids:templates for drug discovery.Life sciences 2005,78(5),454-66.
19.Lull,C.;Wichers,H.J.;Savelkoul,H.F.J.,Antiinflammatory andimmunomodulating properties of fungal metabolites.Mediat Inflamm 2005,(2),63-80.
20.Brooks,N.A.;Wilcox,G.;Walker,K.Z.;Ashton,J.F.;Cox,M.B.;Stojanovska,L.,Beneficial effects of Lepidium meyenii(Maca)on psychologicalsymptoms and measures of sexual dysfunction in postmenopausal women are notrelated to estrogen or androgen content.Menopause 2008,15(6),1157-1162.
发明内容
本发明提供了4个涉及天然产物中大麻素受体的大麻素,其结构如下:
化合物作为或制备大麻素受体激动剂或大麻素拮抗剂中的应用,所述大麻素受体激动剂以Kfb77为活性成分;所述大麻素拮抗剂以含有下述物质中的一种或两种以上为活性成分:Kfb68,Kfb28或Kga1;化合物结构式如上所示。
所述激动剂还包括有药物学上可接受的载体和/或赋形剂。
所述拮抗剂还包括有药物学上可接受的载体和/或赋形剂。
所述化合物Kfb77在CB1上有激动活性并具有CB1亚型选择性;具有亚型选择性的化合物能区分同一系列的受体的不同亚型,即大麻素受体中的大麻素I型受体和II型受体,具有更好的特异性;CB1选择性的激动剂可用于治疗疼痛、神经退行性疾病、厌食等中的一种或两种以上。
所述拮抗剂对CB1的拮抗作用强弱顺序为Kga1>Kfb68,对CB2的拮抗作用强弱为Kfb28≈Kfb68。
所述激动剂Kfb77对CB1的激动活性在细胞水平的EC
所述拮抗剂Kfb68对CB1和CB2的拮抗活性在细胞水平的IC
所述化合物Kfb77,Kfb68,Kfb28或Kga1均来自天然真菌灵芝中,由灵芝中制备获得。
大麻素受体激动剂或拮抗剂在制备下述疾病药物中的应用,其特征在于:包括神经衰弱、失眠健忘、顽固性疼痛、运动性神经疾病、心脑血管疾病(如高血压病、高血脂症的一种或两种以上病症)、炎症、氧化衰老、肥胖/代谢失常等疾病中的一种或两种以上病症的治疗;
所述大麻素受体激动剂以Kfb77为活性成分;
所述大麻素受体拮抗剂含有下述物质中的一种或两种以上为活性成分:Kfb68,Kfb28或Kga1;
化合物结构如下所示:
本发明还提供了这几个天然化合物对大麻素I型受体和大麻素II型受体的活性和功能。灵芝对于神经系统有调节作用,缓解失眠健忘,调节神经衰弱;对免疫系统有调节作用,提高机体免疫力,在治疗心脑血管疾病(如高血压病、高血脂症)、抗氧化、抗炎方面起效。目前研究表明,CB1在中枢神经系统中高表达,对运动功能、学习和记忆、神经内分泌等具有调制作用;CB2主要在外周免疫系统中表达,有消炎、免疫抑制、免疫调节等作用;大麻素系统参与治疗精神性疾病、肥胖/代谢失常相关疾病、免疫系统调节、及心血管疾病。据此,本发明提到的CB1和CB2的新天然激动剂和拮抗剂为这些疾病的药物研发提供了候选化合物。
附图说明
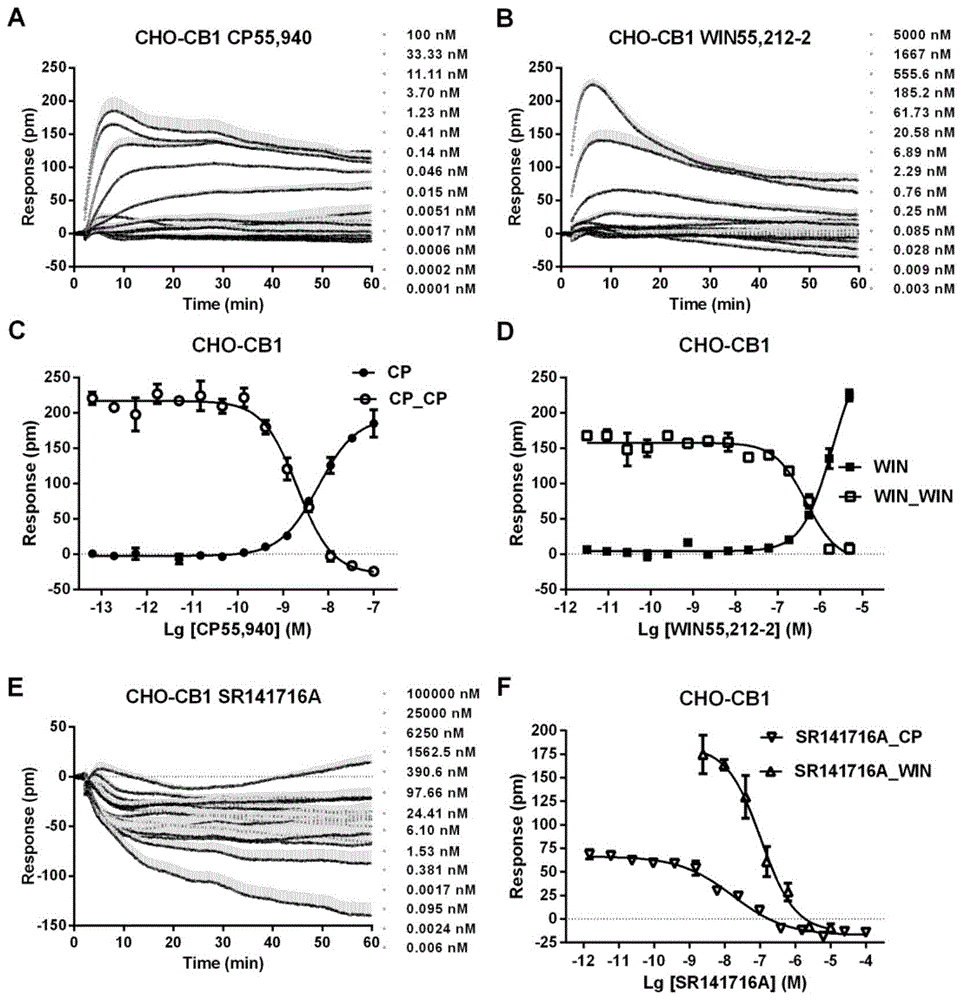
图1CHO-CB1细胞的靶点模型表征A-激动剂CP55,940的DMR响应信号;B-激动剂WIN55,212-2的DMR响应信号;C-CP55,940的剂量响应曲线(实心方块),及预处理一小时后,100nM的CP55,940的剂量响应曲线(空心方块);D-WIN55,212-2的剂量响应曲线(实心方块),及预处理一小时后,1μM的WIN55,212-2的剂量响应曲线(空心方块);E-拮抗剂SR141716A的DMR响应信号;F-SR141716A预处理一小时后,100nM的CP55,940(空心下三角)和1μM的WIN55,212-2(空心上三角)的剂量响应曲线
图2CHO-CB2细胞的靶点模型表征A-激动剂CP55,940的DMR响应信号;B-激动剂WIN55,212-2的DMR响应信号;C-CP55,940的剂量响应曲线(实心圆形),及预处理一小时后,100nM的CP55,940的剂量响应曲线(空心圆形);D-WIN55,212-2的剂量响应曲线(实心圆形),及预处理一小时后,200nM的WIN55,212-2的剂量响应曲线(空心圆形);E-拮抗剂SR144528的DMR响应信号;F-SR144528预处理一小时后,100nM的CP55,940(空心下三角)和200nM的WIN55,212-2(空心上三角)的剂量响应曲线
图3天然化合物结构(第一部分36个)
图4天然化合物结构(第二部分20个)
图5天然化合物结构(第三部分26个)
图6天然化合物在CHO-CB1细胞和CHO-CB2细胞上的初步筛选A-化合物在CHO-CB1细胞的DMR响应信号;B-化合物预处理一小时后,50nM的CP55,940在CHO-CB1细胞的DMR响应信号;C-化合物在CHO-CB2细胞的DMR响应信号;D-化合物预处理一小时后,50nM的CP55,940在CHO-CB2细胞的DMR响应信号
图7活性化合物在CHO-CB1细胞和CHO-CB2细胞上的活性与功能A-Kfb77在CHO-CB1细胞的剂量响应曲线(实心圆形),及Kga1(空心方块)、Kfb68(空心三角)和Kfb77(空心圆形)预处理一小时后,50nM的CP55,940在CHO-CB1细胞的剂量响应曲线;B-拮抗剂SR141716A预处理一小时后,100μM的Kfb77在CHO-CB1细胞的剂量响应曲线;C-A-Kfb77在CHO-CB2细胞的剂量响应曲线(实心圆形),及Kfb28(空心菱形)、Kfb68(空心三角)和Kfb77(空心圆形)预处理一小时后,200nM的WIN55,212-2在CHO-CB2细胞的剂量响应曲线;D-Kfb68预处理一小时后,WIN55,212-2(空心上三角)和CP55,940(空心下三角)在CHO-CB2细胞的剂量响应曲线。
具体实施方式
现结合实例,对本发明做进一步说明。实例更详细的说明本发明,但不以任何形式限制本发明。
实施例1:大麻素I型受体和大麻素II型受体筛选模型的构建
材料:激动剂探针CP55,940购于Sigma-Aldrich,WIN55,212-2购于AbsinBioscience Inc.;拮抗剂探针SR141716A和SR144528购于Tocris Biosciences。本实验室在CHO(Chinese Hamster Ovary,中国仓鼠卵巢细胞)中分别稳定转染大麻素I型受体和大麻素II型受体,获得CHO-CB1和CHO-CB2细胞株【转染过程参考文献Holmen,S.L.,Vanbrocklin,M.W.,Eversole,R.R.,Stapleton,S.R.,Ginsberg,L.C.,1995.EfficientLipid-Mediated Transfection of DNA into Primary Rat Hepatocytes.In Vitro CellDev-An 31(5),347-351.】。检测平台为康宁(Corning)第三代
转染细胞CHO-CB1高表达CB1受体,激动探针为CP55,940和WIN55,212-2,选择性拮抗探针为SR141716A。本发明基于无标记细胞整合药理学技术,在CHO-CB1细胞上使用探针CP55,950,WIN55,212-2和SR141716A建立激动分析、脱敏分析和拮抗分析的模型,为后续植物来源和真菌来源的天然化合物的筛选奠定基础。将处于对数生长期的CHO-CB1细胞接种于康宁384微孔细胞板的每个微孔中,每孔接种体积40μL,每孔接种细胞数目10
激动分析是将梯度稀释的激动剂加入CHO-CB1细胞(接种于384微孔细胞板的细胞培养体系),实时监测激动剂加入细胞一小时内的DMR响应信号。CP55,940作为激动剂探针时,梯度稀释的、在细胞培养体系的最终浓度为100nM,33.33nM,11.11nM,3.70nM,1.23nM,0.41nM,0.14nM,0.046nM,0.015nM,0.0051nM,0.0017nM,0.0006nM,0.0002nM和0.0001nM;WIN55,212-2作为激动剂探针时,梯度稀释的、在细胞培养体系的最终浓度为5,000nM,1,667nM,555.6nM,185.2nM,61.73nM,20.58nM,6.89nM,2.29nM,0.76nM,0.25nM,0.085nM,0.028nM,0.009nM和0.003nM。
脱敏分析为不同浓度的激动剂预处理CHO-CB1一小时后,再加入恒定浓度的激动剂(预估激动剂的EC
拮抗分析为梯度稀释的拮抗剂SR141716A预处理CHO-CB1一小时后,再加入恒定浓度的激动剂,实时监测DMR响应信号一小时。SR141716A梯度稀释的、在细胞培养体系的最终浓度为100μM,25μM,6.25μM,1.56μM,390.6nM,97.66nM,24.41nM,6.10nM,1.53nM,0.381nM,0.095nM,0.024nM,0.006nM和0.001nM,加入细胞培养体系一小时后,再加入恒定的、在细胞培养体系内最终浓度为100nM的激动剂CP55,940,记录一小时内细胞的响应信号。SR141716A梯度稀释的、在细胞培养体系的最终浓度为10μM,2.5μM,625nM,156nM,39.06nM,9.77nM和2.44nM,加入细胞培养体系一小时后,再加入恒定的、在细胞培养体系内最终浓度为1μM的激动剂WIN55,212-2,记录一小时内细胞的响应信号。
所获得大麻素I型受体的激动剂的DMR特征谱见图1A(CP55,940)和图1B(WIN55,212-2),CP55,940的激动分析、脱敏分析的DMR剂量曲线见图1C,WIN55,212-2的激动分析和脱敏分析的DMR的剂量曲线见图1D。拮抗剂SR141716A的DMR特征谱见图1E,恒定浓度激动剂引起的DMR剂量曲线见图1F。由图1A,1C和1F可得,CP55,940加入CHO-CB1细胞后引发DMR响应,信号在8分钟达到峰值,取各个浓度在8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-response Stimulation选项拟合得到剂量依赖的激动曲线;一小时后,加入恒定浓度的CP55,940,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism6软件中用Nonlinear Regression的Dose-response Inhibition选项拟合得到剂量依赖的脱敏曲线;SR141716A加入CHO-CB1细胞一小时后,加入恒定浓度的CP55,940,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-response Inhibition选项拟合得到剂量依赖的拮抗曲线。由图1C和1F可得,CP55,940的激动分析的EC
图1B,1D和1F可得,WIN55,212-2加入CHO-CB1细胞后引发DMR响应,信号在8分钟达到峰值,取各个浓度在8分钟时的DMR读数,在GraphPad Prism 6软件中用NonlinearRegression的Dose-response Stimulation选项拟合得到剂量依赖的激动曲线;一小时后,加入恒定浓度的WIN55,212-2,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPadPrism 6软件中用Nonlinear Regression的Dose-response Inhibition选项拟合得到剂量依赖的脱敏曲线;SR141716A加入CHO-CB1细胞一小时后,加入恒定浓度的WIN55,212-2,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用NonlinearRegression的Dose-response Inhibition选项拟合得到剂量依赖的拮抗曲线。由图1D和1F可得的激动分析的EC
转染细胞CHO-CB2高表达CB2受体。激动探针为CP55,940和WIN55,212-2,选择性拮抗探针为SR144528。本发明基于无标记细胞整合药理学技术,在CHO-CB2细胞上使用探针CP55,950,WIN55,212-2和SR144528建立激动分析、脱敏分析和拮抗分析的模型,为后续植物来源和真菌来源的天然化合物的筛选奠定基础。将处于对数生长期的CHO-CB2细胞接种于康宁384微孔细胞板的每个微孔中,每孔接种体积40μL,每孔接种细胞数目10
激动分析是将梯度稀释的激动剂加入CHO-CB2细胞(接种于384微孔细胞板的细胞培养体系),实时监测激动剂加入细胞一小时内的DMR响应信号。CP55,940作为激动剂探针时,梯度稀释的、在细胞培养体系的最终浓度为100nM,33.33nM,11.11nM,3.70nM,1.23nM,0.41nM,0.14nM,0.046nM,0.015nM,0.0051nM,0.0017nM,0.0006nM,0.0002nM和0.0001nM;WIN55,212-2作为激动剂探针时,梯度稀释的、在细胞培养体系的最终浓度为5,000nM,1,667nM,555.6nM,185.2nM,61.73nM,20.58nM,6.86nM,2.29nM,0.76nM,0.25nM,0.085nM,0.028nM,0.009nM和0.003nM。
脱敏分析为不同浓度的药物预处理CHO-CB2一小时后,再加入恒定浓度的激动剂(预估激动剂的EC
拮抗分析为梯度稀释的拮抗剂SR144528预处理CHO-CB2一小时后,再加入恒定浓度的激动剂,实时监测DMR响应信号一小时。SR144528梯度稀释的、在细胞培养体系的最终浓度为100μM,25μM,6.25μM,1.56μM,390.6nM,97.66nM,24.41nM,6.10nM,1.53nM,0.381nM,0.095nM,0.024nM,0.006nM和0.001nM,加入细胞培养体系一小时后,再加入恒定的、在细胞培养体系内最终浓度为100nM的激动剂CP55,940,记录一小时内细胞的响应信号。SR144528梯度稀释的、在细胞培养体系的最终浓度为100μM,25μM,6.25μM,1.56μM,390.6nM,97.66nM,24.41nM,6.10nM,1.53nM,0.381nM,0.095nM,0.024nM,0.006nM和0.001nM,加入细胞培养体系一小时后,再加入恒定的、在细胞培养体系内最终浓度为200nM的激动剂WIN55,212-2,记录一小时内细胞的响应信号。
所获得大麻素II型受体的激动剂的DMR特征谱见图2A(CP55,940)和图2B(WIN55,212-2),CP55,940的激动分析、脱敏分析的DMR剂量曲线见图2C,WIN55,212-2的激动分析和脱敏分析的DMR的剂量曲线见图2D。拮抗剂SR144528的DMR特征谱见图2E,恒定浓度激动剂引起的DMR剂量曲线见图2F。由图2A,2C和2F可得,CP55,940加入CHO-CB2细胞后引发DMR响应,信号在8分钟达到峰值,取各个浓度在8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-response Stimulation选项拟合得到剂量依赖的激动曲线;一小时后,加入恒定浓度的CP55,940,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-response Inhibition选项拟合得到剂量依赖的脱敏曲线;SR144528加入CHO-CB2细胞一小时后,加入恒定浓度的CP55,940,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-response Inhibition选项拟合得到剂量依赖的拮抗曲线。由图2C和2F可得,CP55,940的激动分析的EC
图2B,2D和2F可得,WIN55,212-2加入CHO-CB2细胞后引发DMR响应,信号在8分钟达到峰值,取各个浓度在8分钟时的DMR读数,在GraphPad Prism 6软件中用NonlinearRegression的Dose-response Stimulation选项拟合得到剂量依赖的激动曲线;一小时后,加入恒定浓度的WIN55,212-2,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPadPrism 6软件中用Nonlinear Regression的Dose-response Inhibition选项拟合得到剂量依赖的脱敏曲线;SR144528加入CHO-CB2细胞一小时后,加入恒定浓度的WIN55,212-2,信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用NonlinearRegression的Dose-response Inhibition选项拟合得到剂量依赖的拮抗曲线。由图2D和2F可得,WIN55,212-2的激动分析的EC
实施例2:来源于五种植物和五种真菌的天然化合物在大麻素受体I型受体和大麻素II型受体模型上的初步筛选
材料:来源于五种植物和五种真菌的82个天然化合物均由于中国科学院昆明植物研究所提供。五种植物为红花籽油饼(Carthamus tinctorius L)、青阳参(Cynanchumotophyllum Schneid.)、咖啡(Coffee Arabica)、青刺果(Prinsepia utilis Royle)、玛咖(Lepidium meyenii,maca);五种真菌为竹灵芝(Ganoderma hainanense)、薄树灵芝(Ganoderma capense)、反柄紫芝(Ganoderma cochlear)、无柄灵芝(Ganodermaresinaceum)和树舌灵芝(Ganoderma applanatum)。天然化合物结构见图3~5【天然化合物的分离、纯化及表征相关信息参考文献:
Dong,J.R.,Peng,X.R.,Li,L.,Lu,S.Y.,Zhou,L.,Qiu,M.H.,2018.C21 steroidalglycosides with cytotoxic activities from Cynanchum otophyllum.Bioorganic&medicinal chemistry letters 28(9),1520-1524;
Li,L.,Li,H.,Peng,X.R.,Hou,B.,Yu,M.Y.,Dong,J.R.,Li,X.N.,Yang,J.,Qiu,M.H.,2016.(+/-)-Ganoapplanin,a Pair of Polycyclic Meroterpenoid Enantiomersfrom Ganoderma applanatum.Organic Letters 18(23),6078-6081;
Li,L.,Peng,X.R.,Dong,J.R.,Lu,S.Y.,Li,X.N.,Zhou,L.,Qiu,M.H.,2018.Rearranged lanostane-type triterpenoids with anti-hepatic fibrosisactivities from Ganoderma applanatum.Rsc Adv 8(55),31287-31295.;
Peng,X.,Li,L.,Dong,J.,Lu,S.,Lu,J.,Li,X.,Zhou,L.,Qiu,M.,2019.Lanostane-type triterpenoids from the fruiting bodies of Ganodermaapplanatum.Phytochemistry 157,103-110;
Peng,X.,Li,L.,Wang,X.,Zhu,G.,Li,Z.,Qiu,M.,2016.Antioxidantfarnesylated hydroquinones from Ganoderma capense.Fitoterapia 111,18-23;
Peng,X.,Liu,J.,Wang,C.,Han,Z.,Shu,Y.,Li,X.,Zhou,L.,Qiu,M.,2015.Unusual prenylated phenols with antioxidant activities from Ganodermacochlear.Food Chem 171,251-257;
Peng,X.,Wang,X.,Chen,L.,Yang,H.,Li,L.,Lu,S.,Zhou,L.,Qiu,M.,2018.Racemic meroterpenoids from Ganoderma cochlear.Fitoterapia 127,286-292;
Peng,X.R.,Liu,J.Q.,Wan,L.S.,Li,X.N.,Yan,Y.X.,Qiu,M.H.,2014.Four newpolycyclic meroterpenoids from Ganoderma cochlear.Org Lett 16(20),5262-5265;
Peng,X.R.,Wang,X.,Dong,J.R.,Qin,X.J.,Li,Z.R.,Yang,H.,Zhou,L.,Qiu,M.H.,2017.Rare Hybrid Dimers with Anti-Acetylcholinesterase Activities from aSafflower(Carthamus tinctorius L.)Seed Oil Cake.J Agr Food Chem 65(43),9453-9459;
Peng,X.R.,Wang,X.,Zhou,L.,Hou,B.,Zuo,Z.L.,Qiu,M.H.,2015.Ganocochlearic acid A,a rearranged hexanorlanostane triterpenoid,andcytotoxic triterpenoids from the fruiting bodies of Ganoderma cochlear.RscAdv 5(115),95212-95222;
Tian,X.X.,Peng,X.R.,Yu,M.Y.,Huang,Y.J.,Wang,X.,Zhou,L.,Qiu,M.H.,2018.Hydantoin and thioamide analogues from Lepidium meyenii.Phytochem Lett25,70-73;
Yu,M.Y.,Qin,X.J.,Peng,X.R.,Wang,X.,Tian,X.X.,Li,Z.R.,Qiu,M.H.,2017.Macathiohydantoins B-K,novel thiohydantoin derivatives from Lepidiummeyenii.Tetrahedron 73(30),4392-4397】。
转染细胞CHO-CB1高表达CB1受体,激动探针为CP55,940。将处于对数生长期的CHO-CB1细胞接种于康宁384微孔细胞板的每个微孔中,每孔接种体积40μL,每孔接种细胞数目10
汇总所有天然化合物样品在50μM浓度时,加入CHO-CB1细胞所产生的DMR响应信号强度,参照探针分子CP55,940的DMR响应信号强度换算成百分比(DMR%=化合物的DMR/探针分子的DMR×100%),见图6A;汇总所有样品预处理CHO-CB1细胞一小时后,再加入50nM的CP55,940所产生的DMR信号响应强度,参照探针分子CP55,940的DMR响应信号强度换算成百分比(DMR%=化合物的DMR/探针分子的DMR×100%),见图6B。在图6B中,Kag32,Kag33,Kag56,Kag57,Kcx34,Kfb1,Kfb2,Kfb18,Kfb19,Kfb28,Kfb29,Kfb77,Kga1,Kgx6,Kmk22,Kmk38,Kmk38-1,Kmk38-2,Kmk38-3,Kqys10,Kqys31,Kqys4,Kqys50,Kqys74和Kzr12共25个化合物,在预处理CHO-CB1细胞一小时后,可以显著降低CP55,940在细胞的DMR响应信号,幅度≥60%。
转染细胞CHO-CB2高表达CB2受体,激动探针为CP55,940。将处于对数生长期的CHO-CB2细胞接种于康宁384微孔细胞板的每个微孔中,每孔接种体积40μL,每孔接种细胞数目10
汇总所有天然化合物样品在50μM浓度时,加入CHO-CB2细胞所产生的DMR响应信号强度,参照探针分子CP55,940的DMR响应信号强度换算成百分比(DMR%=化合物的DMR/探针分子的DMR×100%),见图6C;汇总所有样品预处理CHO-CB2细胞一小时后,再加入50nM的CP55,940所产生的DMR信号响应强度,参照探针分子CP55,940的DMR响应信号强度换算成百分比(DMR%=化合物的DMR/探针分子的DMR×100%),见图6D。在图6D中,Kag33,Kag57,Kcx34,Kfb1,Kfb2,Kfb18,Kfb19,Kfb28,Kfb29,Kfb68,Kfb69,Kfb77,Kga1,Kga3,Kmk22,Kmk38,Kmk38-1,Kmk38-2,Kmk38-3,Kqys1,Kqys10,Kqys4,Kqys50,Kqys5a,Kqys74,Kzr12和Kzr30共27个化合物,在预处理CHO-CB2细胞一小时后,可以显著降低CP55,940在细胞的DMR响应信号,幅度≥60%。
将上述CHO-CB1模型筛选出的25个化合物与CHO-CB2模型筛选出的27个化合物进行比对,综合得出共有31个天然化合物呈现大麻素I型受体和/或大麻素II型受体活性。选择另外八个参与精神性疾病、代谢相关疾病、免疫系统调节及神经退行性疾病相关研究的GPCR靶点进行天然化合物的活性筛选。【八个GPCR靶点的信息参考文献:
Bidlack,J.M.,Khimich,M.,Parkhill,A.L.,Sumagin,S.,Sun,B.,Tipton,C.M.,2006.Opioid receptors and signaling on cells from the immune system.Journalof neuroimmune pharmacology:the official journal of the Society onNeuroImmune Pharmacology 1(3),260-269.
Ferstl,R.,Frei,R.,Schiavi,E.,Konieczna,P.,Barcik,W.,Ziegler,M.,Lauener,R.P.,Chassard,C.,Lacroix,C.,Akdis,C.A.,O'Mahony,L.,2014.Histaminereceptor 2is a key influence in immune responses to intestinal histamine-secreting microbes.J Allergy Clin Immunol 134(3),744-746e743.
Ghislain,J.,Poitout,V.,2017.The Role and Future of FFA1 as aTherapeutic Target.Handb Exp Pharmacol 236,159-180.
Mackenzie,A.E.,Milligan,G.,2017.The emerging pharmacology andfunction of GPR35 in the nervous system.Neuropharmacology 113(Pt B),661-671.
Mori,A.,Sekito,A.,Sakamoto,K.,Ishii,K.,Nakahara,T.,2017.Stimulationof beta1-and beta2-adrenoceptors dilates retinal blood vessels inrats.Naunyn-Schmiedeberg's archives of pharmacology 390(5),527-533.
Ninkovic,J.,Roy,S.,2013.Role of the mu-opioid receptor in opioidmodulation of immune function.Amino Acids 45(1),9-24.
Pronin,A.N.,Wang,Q.,Slepak,V.Z.,2017.Teaching an Old Drug New Tricks:Agonism,Antagonism,and Biased Signaling of Pilocarpine through M3 MuscarinicAcetylcholine Receptor.Molecular pharmacology 92(5),601-612.
Rangel-Barajas,C.,Coronel,I.,Floran,B.,2015.Dopamine Receptors andNeurodegeneration.Aging Dis 6(5),349-368.】
靶点有的源于内源细胞表达,有的通过CHO或HEK293(Human embryonic kidney293,人胚胎肾细胞)的细胞转染,包括human colon cancer cell line HT29-GPR35(人源结肠癌细胞中内源表达的孤儿受体GPR35,G protein-coupled receptor 35),HT29-M3(人源结肠癌细胞中内源表达的毒蕈碱受体M3,Muscarinic acetylcholine 3receptor),CHO-K1-D2(CHO细胞转染的多巴胺受体D2,Dopamine 2receptor),the human epidermoidcarcinoma cell line A431-β2-adrenoceptor(人源表皮癌细胞中内源表达的β2肾上腺素受体),HEK293-H2(HEK293细胞转染的组胺受体H2,Histamine 2receptor),HEK293-FFA1(HEK293细胞转染的自由脂肪酸受体FFA1,Free fatty acid 1receptor),HEK293-μOPR和HEK293-δOPR(HEK293细胞转染的阿片受体μOPR和δOPR,μandδopioid receptors)。HT29细胞采用McCoy’s 5A完全培养基培养完全培养基:McCoy’s 5A培养基,含有10%胎牛血清,1%青霉素/链霉素双抗,即100mL完全培养基,含有10mL胎牛血清,100μL 100X青霉素/链霉素双抗(青霉素100mg/mL,链霉素50mg/mL)。CHO转染细胞采用F12K完全培养基:Ham’s F12K培养基,含有10%胎牛血清,1%青霉素/链霉素双抗,即100mL完全培养基,含有10mL胎牛血清,100μL 100X青霉素/链霉素双抗(青霉素100mg/mL,链霉素50mg/mL)。A431细胞和HEK293转染细胞采用DMEM完全培养基:Dulbecco's Modified Eagle's培养基,含有10%胎牛血清,1%青霉素/链霉素双抗,即100mL完全培养基,含有10mL胎牛血清,100μL 100X青霉素/链霉素双抗(青霉素100mg/mL,链霉素50mg/mL)。
初筛选出的31个天然化合物在上述八个GPCR靶点上进行激动和脱敏实验,实验步骤参考CB1和CB2靶点的实验。综合化合物在共十个靶点的实验结果,24个化合物在多靶点呈现活性,包括Kag32,Kag33,Kga56,Kag57,Kcx34,Kfb1,Kfb2,Kfb18,Kfb19,Kfb29,Kfb69,Kga3,Kgx6,Kmk22,Kmk38,Kqys1,Kqys10,Kqys4,Kqys31,Kqys50,Kqys5a,Kqys74,Kzr12和Kzr30。这些天然化合物对大麻素受体的靶点选择性较差,故后续不再赘述。虽然化合物Kmk38-1,Kmk38-2和Kmk38-3在多靶点比较中,依然有较好的对大麻素受体的靶点选择性,但它们属于玛卡酰胺(macamides,来源玛咖),已被报道是内源性大麻素系统中的脂肪酸酰胺水解酶的抑制剂,故这三个化合物后续不再赘述。最终筛选出来源于反柄紫芝的Kfb28,Kfb68,Kfb77和竹灵芝的Kga1,这四个天然化合物作为候选活性化合物。
实施例3:活性化合物对大麻素I型和大麻素II型受体的功能与活性表征
将Kfb28,Kfb68,Kfb77和Kga1在CHO-CB1细胞上进行剂量测试,CP55,940作为CHO-CB1细胞的激动剂探针分子。将处于对数生长期的CHO-CB1细胞接种于康宁384微孔细胞板的每个微孔中,每孔接种体积40μL,每孔接种细胞数目10
激动分析是将梯度稀释的化合物加入CHO-CB1细胞(接种于384微孔细胞板的细胞培养体系),实时监测激动剂加入细胞一小时内的DMR响应信号。每个化合物的梯度稀释、在细胞培养体系的最终浓度为100μM,50μM,25μM,12.5μM,6.25μM,3.13μM和1.56μM。
脱敏分析为不同浓度的化合物预处理CHO-CB1一小时后,再加入恒定浓度的激动剂(预估激动剂的EC
在CHO-CB1细胞培养体系中,加入化合物Kfb28、Kfb68或Kga1没有产生DMR响应信号。脱敏分析中,恒定浓度的激动剂CP55,940加入Kfb68或Kga1预处理一小时后的细胞中,产生剂量依赖的响应信号,见图7A(分别为空心三角和空心方块),Kfb68和Kga1对激动剂CP55,940的DMR信号的拮抗幅度约为100pm。CP55,940引起的信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-responseInhibition选项拟合得到剂量依赖的脱敏曲线。由图7A可得,Kfb68和Kga1的IC
在CHO-CB1细胞培养体系中,加入化合物Kfb77产生了负向DMR响应信号,该组负向信号呈剂量依赖关系,见图7A(实心圆形);Kfb77预处理细胞一小时后,加入恒定浓度的激动剂CP55,940,产生剂量依赖的拮抗CP55,940的DMR响应信号,见图7A(空心圆形)。拮抗分析中,拮抗剂SR141716A先加入CHO-CB1细胞培养体系,一小时后细胞状态达到稳定(基线归零),再加入恒定的、在细胞培养体系内最终浓度为100μM的Kfb77。记录一小时内Kfb77引起DMR响应信号,取各浓度在8分钟的DMR读数,在GraphPad Prism 6软件中用NonlinearRegression的Dose-response Inhibition选项拟合拮抗曲线,见图7B。SR141716A预处理细胞一小时后,能剂量依赖的拮抗Kfb77在细胞的信号响应,可见Kfb77和SR141716A作用靶点一致,即CB1靶点。Kfb77有CB1靶点激动活性,然而作用机理不同于激动剂探针CP55,940。Kfb77引起的信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-response Stimulation和Inhibition选项拟合得到剂量依赖的激动和脱敏曲线。由图7A得,Kfb77在CHO-CB1细胞上的EC
将Kfb28,Kfb68,Kfb77和Kga1在CHO-CB2细胞上进行剂量测试,WIN55,212-2作为CHO-CB2细胞的激动剂探针分子。。将处于对数生长期的CHO-CB2细胞接种于康宁384微孔细胞板的每个微孔中,每孔接种体积40μL,每孔接种细胞数目10
激动分析是将梯度稀释的化合物加入CHO-CB2细胞(接种于384微孔细胞板的细胞培养体系),实时监测激动剂加入细胞一小时内的DMR响应信号。每个化合物的梯度稀释、在细胞培养体系的最终浓度为100μM,33.33μM,11.11μM,3.70μM,1.23μM,0.41μM和0.14μM。
脱敏分析为不同浓度的化合物预处理CHO-CB2一小时后,再加入恒定浓度的激动剂(预估激动剂的EC
在CHO-CB2细胞培养体系中,加入化合物Kga1、Kfb28或Kfb68没有产生DMR响应信号。脱敏分析中,恒定浓度的激动剂WIN55,212-2加入Kfb68或Kfb28预处理一小时后的细胞中,产生剂量依赖的拮抗响应信号,见图7C(分别为空心三角和空心菱形),Kfb28和Kfb68基本完全拮抗WIN55,212-2的DMR信号。WIN55,212-2引起的信号在8分钟达到峰值,取8分钟时的DMR读数,在GraphPad Prism 6软件中用Nonlinear Regression的Dose-responseInhibition选项拟合得到剂量依赖的脱敏曲线。由图7C可得,Kfb68和Kfb28的IC
在CHO-CB2细胞培养体系中,加入化合物Kfb77产生了负向DMR响应信号,该组负向信号呈剂量依赖关系,见图7C(实心圆形);Kfb77预处理细胞一小时后,加入恒定浓度的激动剂WIN55,212-2,Kfb77不能剂量依赖地拮抗WIN55,212-2,见图7C(空心圆形)。可见Kfb77不能使CB2对WIN22,212-2脱敏,即Kfb77不直接作用于CB2靶点。
在CHO-CB2细胞培养体系中,对于化合物Kfb68,另用激动剂CP55,940作为探针分子进行拮抗分析。Kfb68的梯度稀释、在细胞培养体系的最终浓度为100μM,33.33μM,11.11μM,3.70μM,1.23μM,0.41μM和0.14μM,加入细胞培养体系一小时后,再加入恒定的、在细胞培养体系内最终浓度为50nM的CP55,940,记录一小时内细胞的响应信号。与WIN55,212-2作为探针分子的拮抗结果相比(图7D空心上三角),Kfb68只在最大浓度(100μM)时能基本完全拮抗CP55,940的DMR响应信号,其他浓度时没有明显改变CP55,940的DMR响应信号(图7D空心下三角)。由于拮抗曲线不完整,IC
化合物Kfb68在CHO-CB1细胞和CHO-CB2细胞上呈现拮抗活性,为大麻素I型和大麻素II型受体的非选择性拮抗剂。化合物Kga1在CHO-CB1细胞呈现拮抗活性,在CHO-CB2细胞无活性,该化合物为大麻素I型受体选择性拮抗剂。化合物Kfb28在CHO-CB1细胞无活性,在CHO-CB2细胞呈现拮抗活性,该化合物为大麻素II型受体选择性拮抗剂。化合物Kfb77在CHO-CB1呈现激动活性,其作用机理不同于激动剂探针CP55,940,在CHO-CB2上无活性,该化合物为较为特殊的大麻素I型受体激动剂。
- 一种调节大麻素受体活动的化合物中间体的制备方法
- 化合物作为或制备大麻素受体激动剂或拮抗剂中的应用
- II型大麻素受体激动剂在制备治疗高血压脑出血药物中的应用
