m6A的结合蛋白及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,尤其是涉及一种m6A的结合蛋白及其应用。
背景技术
随着经典杂交瘤技术的使用,兔单克隆抗体的使用在科研、病理检测等方面更加广泛。同时单克隆抗体还被广泛作为高特异性的诊断工具所使用,并且作为治疗手段用于病毒感染、肿瘤、自身免疫疾病、代谢疾病、神经性疾病。
但由于受到兔骨髓瘤细胞的限制,目前使用杂交瘤技术进行兔单克隆抗体开发的公司非常有限。为了规避兔B细胞杂交瘤技术专利和技术障碍,其他基于单个B细胞的抗体发现技术被建立。
单个B细胞体外培养、通过微流控技术进行单个B细胞筛选是目前常用的两种单个B细胞分选方案。单个B细胞体外培养技术需要B细胞富集、饲养层细胞构建、细胞因子刺激等成熟方案,整个方案中需要优化B细胞富集方案、饲养层细胞活性、细胞因子刺激方案进行建立和优化,相关技术难点突破难度大、试剂配比优化周期长。而使用微流控技术进行的单克隆抗体开发,主要以近年来由Berkely Lights公司开发的Beacon平台为例,可通过单个B细胞的微流控操作,整合单个B细胞PCR技术,进行重组抗体开发,但其主要的缺点在于Beacon设备极其昂贵,同时该平台细胞筛选通量较低,一次只能进行几万个细胞筛选。
基于以上,具备便捷、高通量特点的抗体筛选新技术满足新的抗体发现需求非常迫切。流式细胞分选具有可以通过不同荧光标记进行高通量细胞分选的特点,能够在短时间对几十万到几千万的细胞群进行分选,通过B细胞表面膜结合免疫球蛋白和特异性荧光标记抗原筛选得到的靶B细胞,进行分离及体外单细胞RNA提前和扩增,得到重组抗体序列信息,可以大大提高从免疫动物中得到特定抗原抗体序列的速度。因此,基于流式细胞分选进行单个B细胞分离的抗体开发方案建立很有必要。
有鉴于此,特提出本发明。
发明内容
本发明的第一目的在于提供一种m6A(N6-甲基腺苷)的结合蛋白,该结合蛋白特异性好,与m6A亲和力高。
本发明的第二目的在于提供一种上述结合蛋白在制备m6A检测产品中的应用。
本发明的第三目的在于提供一种用于检测m6A的ELISA试剂盒。
本发明的第四目的在于提供一种编码所述结合蛋白的基因。
本发明的第五目的在于提供一种重组质粒。
本发明的第六目的在于提供一种细胞系。
本发明的第七目的在于提供上述结合蛋白的制备方法。
第一方面,本发明提供了一种m6A的结合蛋白,所述结合蛋白的可变区包括:具有如SEQ ID NO.1所示氨基酸序列的互补决定区CDR1-VH、具有如SEQ ID NO.2所示氨基酸序列的互补决定区CDR2-VH、具有如SEQ ID NO.3所示氨基酸序列的互补决定区CDR3-VH、具有如SEQ ID NO.4所示氨基酸序列的互补决定区CDR1-VL、具有如SEQ ID NO.5所示氨基酸序列的互补决定区CDR2-VL和具有如SEQ ID NO.6所示氨基酸序列的互补决定区CDR3-VL。
作为进一步技术方案,所述可变区包括具有如SEQ ID NO.7所示氨基酸序列的重链可变区VH。
作为进一步技术方案,所述可变区包括具有如SEQ ID NO.8所示氨基酸序列的轻链可变区VL。
第二方面,本发明提供了上述结合蛋白在制备m6A检测产品中的应用。
作为进一步技术方案,所述产品包括免疫层析试纸和ELISA试剂盒。
第三方面,本发明提供了一种用于检测m6A的ELISA试剂盒,所述试剂盒以所述的结合蛋白作为捕获蛋白。
第四方面,本发明提供了一种编码所述结合蛋白的基因,所述基因具有如SEQ IDNO.9和SEQ ID NO.10所示的核酸序列。
第五方面,本发明提供了一种重组质粒,所述重组质粒包括载体和所述的基因。
第六方面,本发明提供了一种细胞系,所述细胞系表达所述的结合蛋白。
第七方面,本发明提供了一种结合蛋白的制备方法,包括:在培养基中培养所述的细胞系,然后分离得到所述结合蛋白。
与现有技术相比,本发明具有如下有益效果:
本发明提供的m6A的结合蛋白,能够特异性识别m6A,与m6A亲和力高,能够用于m6A检测产品的制备。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为N6-甲基腺苷结构式;
图2为实施例1提供的SDS-PAGE检测结果;
图3为实施例5提供的抗原荧光标记流程图;
图4为实施例6提供的检测结果;
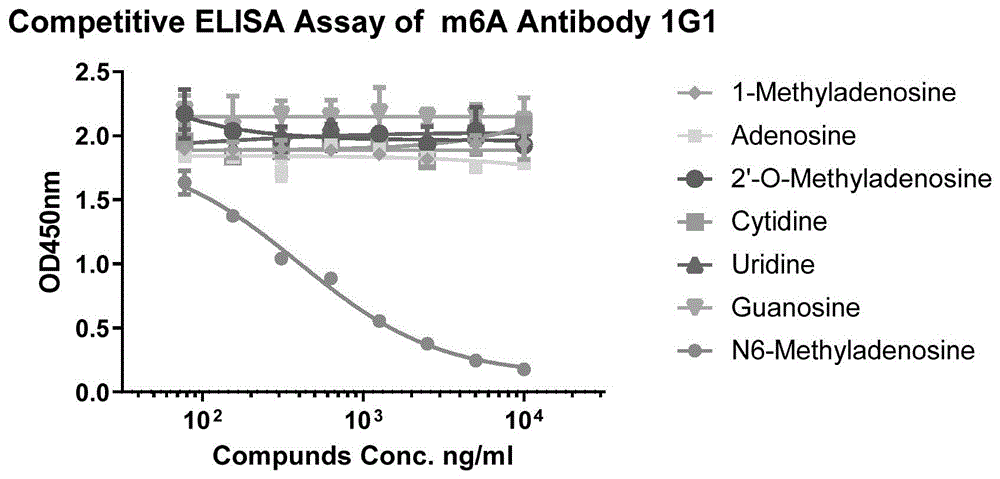
图5为实施例9提供的竞争ELISA检测结果;
图6为m6A小分子结构类似物结构式;
图7为实施例12提供的1G1抗体特异性检测结果。
具体实施方式
下面将结合实施方式和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施方式和实施例仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是,抗体的“可变区”或“可变结构域”是指抗体的重链或轻链的氨基端结构域。重链的可变结构域可以被称为“VH”。轻链的可变结构域可以被称为“VL”。这些结构域通常是抗体的最可变的部分,并含有抗原结合位点。轻链或重链可变区由被三个称为“互补决定区”或“CDR”的高变区打断的构架区构成。抗体的构架区,即构成要件轻链和重链的组合的构架区,起到定位和对齐CDR的作用,所述CDR主要负责与抗原的结合。
“构架”或“FR”区意味着抗体可变结构域的排除被定义为CDR的那些区域之外的区域。每个抗体可变结构域构架可以被进一步细分成被CDR分隔开的毗邻区域(FR1、FR2、FR3和FR4)。
通常情况下,重链和轻链的可变区VL/VH可由以下编号的CDR与FR按如下组合排列连接获得:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
在本发明中,CDR1-VH、CDR2-VH和CDR3-VH分别指重链可变区的三个高变区,相应的,CDR1-VL、CDR2-VL和CDR3-VL分别指轻链可变区的三个高变区。
第一方面,本发明提供了一种m6A的结合蛋白,所述结合蛋白的可变区包括:具有如SEQ ID NO.1所示氨基酸序列的互补决定区CDR1-VH、具有如SEQ ID NO.2所示氨基酸序列的互补决定区CDR2-VH、具有如SEQ ID NO.3所示氨基酸序列的互补决定区CDR3-VH、具有如SEQ ID NO.4所示氨基酸序列的互补决定区CDR1-VL、具有如SEQ ID NO.5所示氨基酸序列的互补决定区CDR2-VL和具有如SEQ ID NO.6所示氨基酸序列的互补决定区CDR3-VL。
上述可变区的各个序列如表1所示:
表1
本发明提供的m6A的结合蛋白,能够特异性识别m6A,与m6A亲和力高,能够用于m6A的检测。
在一些优选的实施方式中,所述可变区包括具有如SEQ ID NO.7所示氨基酸序列的重链可变区VH。
可变区的重链可变区VH的氨基酸序列如下:
QSVEESGGRLVTPGTPLTLTCTASGFSTSYYHMSWVRQVPGKGLEW IGISSPGGTTYYASWAKGRFTISKTSTTVDLKITSLTTEDTATYFCVRGWSS SSKFMLWGQGTLVTVSS(SEQ ID NO.7)。
在一些优选的实施方式中,所述可变区包括具有如SEQ ID NO.8所示氨基酸序列的轻链可变区VL。
可变区的轻链可变区VL的氨基酸序列如下:
DVVVTQTPASVSEPVGGTVTINCQASQNVYNNLAWYQQKPGQPPK LLIYDASALASGVPSRFSGSGSGTEFTLTISGVQCDDAATYYCQGGYYYY NYIGGFGGGTEVVVK(SEQ ID NO.8)。
在一些优选的实施方式中,所述结合蛋白还包括轻链恒定区和重链恒定区。恒定区与可变区组合得到完整的抗体。
第二方面,本发明提供了上述结合蛋白在制备m6A检测产品中的应用。
本发明提供的m6A的结合蛋白,能够特异性识别m6A,与m6A亲和力高,因此能够用于m6A检测产品的制备。
在一些优选的实施方式中,所述产品包括但不限于免疫层析试纸和ELISA试剂盒,或者本领域技术人员所熟知的其他产品。
第三方面,本发明提供了一种用于检测m6A的ELISA试剂盒,所述试剂盒以所述的结合蛋白作为捕获蛋白。
本发明提供的ELISA试剂盒灵敏度高,检测准确。
第四方面,本发明提供了一种编码所述结合蛋白的基因,所述基因具有如SEQ IDNO.9和SEQ ID NO.10所示的核酸序列:
cagtcggtggaggagtccgggggtcgcctggtcacgcctgggacacccctgacactcacctgcacagcctctggattctccaccagttactaccacatgagttgggtccgccaggttccagggaaggggctggaatggatcggaatcagtagtcctggtggtaccacatactatgcgagctgggcaaaaggccgattcaccatctccaaaacctcgactacggtggatctgaaaatcaccagtctgacaaccgaggacacggccacctatttctgtgtcagaggatggagtagtagtagtaaatttatgttgtggggccaaggcaccctggtcaccgtctcctcag(SEQ ID NO.9)。
gatgtggtggtgacccagactccagcctccgtgtctgaacctgtgggaggcacagtcaccatcaattgccaggccagtcagaacgtttacaacaatttagcctggtatcagcagaaaccagggcagcctcccaagctcctgatctatgatgcatccgctctggcatctggggtcccatcgcggttcagcggcagtggatctgggacagaattcactctcaccatcagcggcgtgcagtgtgacgatgctgccacttactactgtcaaggcggttactattattataattatattggtggttttggcggagggaccgaggtggtggtcaaag(SEQ ID NO.10)。
第五方面,本发明提供了一种重组质粒,所述重组质粒包括载体和所述的基因,基因的序列如SEQ ID NO.9和SEQ ID NO.10所示。
第六方面,本发明提供了一种细胞系,所述细胞系表达所述的结合蛋白。
该细胞系能够用于m6A结合蛋白的制备。
第七方面,本发明提供了一种结合蛋白的制备方法,包括:在培养基中培养所述的细胞系,然后分离得到所述结合蛋白。
由于细胞系能够表达上述结合蛋白,对细胞系进行培养能够获得富含结合蛋白的发酵液,再经分离后获得结合蛋白。该制备方法简单方便。
下面通过具体的实施例和对比例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
实施例1免疫原及检测抗原的制备
N6-甲基腺苷m6A(图1)是腺苷的甲基化修饰物,其是真核生物细胞mRNA中最常见的修饰,目前常通过抗体进行其在mRNA中的含量或变化的检测。m6A作为小分子抗原,其分子量只为281.27道尔顿,单独免疫无法引起充分的免疫反应。OVA(ovalbumin)即鸡卵清白蛋白是比较稳定的可溶性白蛋白,其分子量约42.7KDa,是一种比较常用的弱抗原化合物载体蛋白。本研究将m6A与OVA偶联作为一个整体来引起兔子的免疫反应。后期使用m6A与BSA(Bovine Serum Albumin)牛血清白蛋白偶联验证抗体是否特异性地只针对小分子而并非载体蛋白OVA。
试剂:OVA,BSA,偶联试剂CDI(羰基二咪唑),DMSO,1×PBS(pH7.2-7.4)。
耗材:15mL进口离心管,1.5mL EP管,移液器吸头,透析袋。
设备:电子分析天平,移液枪,水浴锅,水平摇床,4℃冰箱,-20℃冰箱,透析夹。
样品:m6A小分子。
抗原的制备:
步骤a):将待偶联的小分子m6A,偶联试剂CDI(羰基二咪唑),载体蛋白OVA或BSA从冰箱取出,平衡至室温。
步骤b):称取5mg小分子m6A,用0.2ml的DMSO溶解,备用。
步骤c):称取50mg的CDI(羰基二咪唑),用500ul的DMSO溶解,加入溶解好的m6A小分子,混合,置于37℃水浴锅水浴反应2h。
步骤d):称取OVA或BSA5mg,分别用8ml的10mM PBS(pH7.2-7.4)溶解,将活化好的m6A小分子滴加入OVA或BSA蛋白溶液中,水平摇床上室温反应24h。
步骤e):反应结束后用3L 1×PBS(pH7.2-7.4)溶液透析置换3次。
步骤f):将上述交联好的m6A-BSA交联复合物和m6A-OVA交联复合物置于1.5mL EP管中,加1×PBS至1mL,标记好项目号、浓度和日期,待免疫、检测备用。
抗原的检测:将交联m6A-BSA,m6A-OVA进行SDS-PAGE检测。结果:如图2所示,m6A-BSA和m6A-OVA的分子量略高于未交联的BSA和OVA。
实施例2兔子免疫和血清采取
试剂:佐剂,75%酒精。
耗材:注射器。
样品:m6A-OVA抗原。
兔子免疫:
步骤a):动物选择,兔子采用新西兰白兔,体重2.5Kg左右青壮年。动物选择毛色光泽,活动自如的健康动物。挑选好动物,先饲养2周左右以适应环境。
步骤b):实验前准备,并将兔子做好标记。
步骤c):将抗原从-20℃冰箱中拿出,常温溶解,避免反复冻融。并将注射器做好标记,写上项目号和动物号。
步骤d):抽取抗原(抗原完全混匀),首免抗原浓度为1mg/ml,兔子为0.5ml/只,二免至四免抗原量减半。
步骤e):抽取佐剂,佐剂和抗原为1:1体积比抽取。首免采用完全佐剂,二免至四免采用不完全佐剂。抽取时,佐剂要充分混合均匀后再抽入注射器。
步骤f):二个注射器用针筒连接管对接后进行完全乳化,乳化标准为:乳化好的免疫原滴入37℃水中不分散为合格。
步骤g):兔子采用多点皮下注射,每点为0.2ml。首免后第14天进行二免,二免到三免间隔时间为7天。兔子经历六次免疫后采血进行效价检测。
步骤h):采小样血清的步骤:将实验兔在固定架内保定,用手轻拍耳部,使耳部中央动脉扩张。用75%的酒精消毒,左手固定兔耳,右手持注射器,耳中央动脉离末端1/3之处进针,与动脉平行,向心方向刺入动脉。一次取血量8ml,取血后用棉球压迫止血。
实施例3兔血清效价检测
兔子血清针对小分子效价通过间接ELISA方法检测,血清1:64000稀释条件下OD450nm值超过0.6的兔子即为效价合格,可进行下一步操作。
试剂:羊抗兔-HRP(华安生物:HA1001)、TMB底物(Sigma:T2885)、Tris(上海生工:A501492)、甘氨酸(上海生工:GB0235)、BSA(上海生工:A500023-0100)、吐温-20(上海生工:A600560)NaHCO
耗材:酶标板(杭州生友)。
设备:电热恒温培养箱(上海森信:DRP-9162型)、酶标仪器(MD:Cmax plus)。
间接ELISA操作:
步骤a):m6A-BSA用包被缓冲液稀释至2μg/mL,50μL/well的量加入到酶标板中,盖好盖子,4℃包被过夜。
步骤b):甩干孔中液体,150μL/well的量往酶标板中加入1%
BSA/TBS,放入37℃电热恒温培养箱中恒温封闭1h。
步骤c):甩干孔中液体,将不同稀释比例的血清50μL/well的量加入到酶标板。盖好盖子,放入37℃恒温培养箱孵育30min。
步骤d):甩干一抗混合液,按180μL/well的量往酶标板中加入洗涤液(1×TBST),洗涤酶标板2次。1% BSA将羊抗兔-HRP稀释至工作浓度(1:30000),50μL/well的量加入到酶标板中,盖好盖子,放入37℃恒温培养箱孵育45min。
步骤e):显色、终止并读数,弃去孔中液体,按180μL/well的量往酶标板中加入洗涤液,洗涤酶标板3次;于各反应孔中加入100μL新配制的TMB显色底物,37℃恒温孵育10min;随后加入90μL/well的终止液终止反应,并在酶标仪上测定450nm处的OD值。
结果显示,如表2所示,两只兔子效价(1:64000)均达到要求。
表2
实施例4兔外周血淋巴细胞(PBMC)的分离
试剂:兔外周血淋巴细胞分离液试剂盒(Solarbio:P8760)、红细胞裂解液(Solarbio:R1010)、PBS(BasalMedia:B310KJ-500ml)。
耗材:50mL离心管(BD:352070)、10mL移液管(杭州兰杰柯:352070)。
设备:生物安全柜(苏净:BSC-1300IIB2)、离心机(Thermo:THM#75004530)。
兔外周血淋巴细胞(PBMC)的分离:
步骤a):第六次免疫后效价最好的兔子取抗凝血20ml,置于冰上,取等体积PBS稀释全血。
步骤b):在离心管中加入等体积兔外周淋巴细胞分离液,将稀释后的血液平铺到分离液液面上方。
步骤c):水平转子1800rpm,室温下离心30min。
步骤d):离心后将出现明显的分层:最上层是稀释的血浆层,中间是透明的分离液层,血浆与分离液之间的白膜层即为淋巴细胞层,离心管底部是红细胞与粒细胞。小心的吸取白膜层细胞到50mL洁净的离心管中,10mL PBS洗涤白膜层细胞。1500rpm,离心5min。
步骤e):弃上清,20mL的PBS重悬细胞1500rpm,离心5min。重复步骤e)后弃上清备用。
步骤f):加入5ml红细胞裂解液,轻轻涡旋或颠倒混匀。37℃放置5分钟,红细胞裂解后,溶液应该是清亮透明的。
步骤g):1500rpm离心5分钟以沉淀白细胞,小心吸弃上清液。
步骤h):使用20mL的PBS重悬细胞1500rpm,离心5min。
步骤i):重复步骤h)后弃上清,分离得到的外周血淋巴细胞备用。
实施例5抗原荧光标记
实验所使用的方案是将生物素偶联到小分子偶联载体蛋白(m6A-BSA)上,如图3所示,通过链霉亲和素和生物素的结合作用使m6A-BSA分子带上荧光染料后用于细胞分选实验。
试剂:小分子、BSA、DMSO、CDI、1×PBS(PH=7.4)、生物素EZ-Link Sulfo-NHS-LC-LC-Biotin。
耗材:EP管,移液器吸头,30KD超滤管。
设备:电子分析天平,移液枪,4℃冰箱,-20℃冰箱,混样器。
m6A-OVA偶联生物素:
步骤a):将一定量如(1mg)小分子溶于一定量如(50ul)DMSO中。
步骤b):称取一定量BSA(小分子:BSA=1mg:1mg),用PBS溶解到2mg/ml。
步骤c):称取一定量CDI(小分子:BSA:CDI=1mg:1mg:10mg)完全溶于DMSO中,浓度为50mg/ml,并将其加入到小分子溶液中反应2h。
步骤d):将反应液转移到PBS溶解好的BSA组分中,反应24h。将反应液用30KD超滤管换液成1×PBS待用。
步骤e):称取20倍BSA摩尔量的EZ-Link Sulfo-NHS-LC-LC-Biotin溶于超纯水中,浓度为10mg/ml,并将其加入上述混合液中反应1h,将反应液加入30KD超滤管超滤换液。
荧光标记的m6A-BSA制备
试剂:生物素化的m6A-BSA,链霉亲和素-Brilliant Violet 421
耗材:EP管,移液器吸头。
设备:移液枪。
步骤a):取0.8ul生物素化的m6A-BSA分别与1ul的链霉亲和素-Brilliant Violet421
步骤b):再取0.5ul BSA-Biotin加入到混匀体系中,封闭过量的链霉亲和素-Brilliant Violet 421
步骤c):EP管中生物素化的m6A-BSA与荧光染料标记的链霉亲和素结合物静置待后续实验使用。
实施例6 m6A特异性结合的B细胞分选
抗原阳性B细胞通过T细胞表面标志物阴性选择,B细胞表面免疫球蛋白阳性选择后再通过荧光染料标记的分选抗原,将特异性的B细胞从外周血单核细胞细胞中分选得到。
试剂:PBS(Basal Media:B310KJ-500ml)、胎牛血清(四季青:11011-8611)、小鼠抗兔CD4抗体-FITC、小鼠抗兔IgG-PE,小鼠抗兔IgM-Biotin、链霉亲和素-PE/Cy7、BrilliantViolet 421
耗材:15mL离心管(BD:352097)、EP管(AXYGEN:MCT-150-C)。
设备:生物安全柜(苏净:BSC-1300IIB2)、流式分选仪(Sony:MA900)、离心机(Thermo:THM#75004530)。
m6A特异性结合B细胞分选
步骤a):设置本次实验的流式分选指标(IgG、IgM、m6A-BSA)和实验分组(空白细胞对照组、补偿单阳管对照组、减一荧光对照组、实验组)。
步骤b):IgM和抗原(m6A-BSA)阳性指标需先将IgM-Biotin和抗原(m6A-BSA)-Biotin分别与链霉亲和素-PE/Cy7和Brilliant Violet 421
步骤c):取外周血淋巴细胞,用10mLPBS重悬浮,细胞计数后将细胞分装在1.5mLEP管中离心,1500rpm,离心5min。
步骤d):小心弃去上清,用100uLPBS重悬浮。
步骤e):根据步骤a设置的实验分组分别加入对应抗体,轻轻地涡旋混匀。
步骤f):室温孵育20min后,加800uLPBS重悬浮,1500rpm,离心5min。
步骤g):小心弃去上清,1mL的PBS重悬细胞,1500rpm,离心5min。
步骤h):重复步骤g后小心弃去上清,实验组加入1mL含有2%FBS的PBS重悬浮,其他组加入200uL含有2%FBS的PBS重悬浮。
步骤i):冰上放置,上机。
步骤j):在流式分选仪上通过空白细胞对照组和补偿单阳管对照组调节荧光补偿,通过减一荧光对照组圈门。最后上实验组样本,分选出抗原双阳性细胞群,如图4所示(图A:圈选的兔PBMC淋巴细胞群通过FSC-W和FSC-A去除粘连细胞;图B:得到FITC和PE-Cy7双阴性细胞;图D:圈选PE阳性细胞;图E:圈选抗原阳性细胞进行单细胞分离、收集)。
实施例7单个B细胞裂解
试剂:DTT,Digitonin,Rnase Inhibitor,Oligo(dT)20VN,Random hexamers,DEPC水。
耗材:PCR板,移液器吸头。
设备:PCR仪。
步骤a):按表配制单细胞裂解液,分装至PCR板孔中。
表3单细胞裂解液
步骤b):分选单细胞打入PCR板孔裂解液中,冰上备用。
步骤c):将上述96孔PCR板置于-80℃冰箱中速冻,直至板上所有样品均已冻上,再置于37℃金属浴中至融化。如此反复冻融3次后,置于冰上。
实施例8单个B细胞cDNA获取和抗体表达TAP片段制备
试剂:PrimeScript TMⅡ1st Strand cDNASynthesis Kit(TAKARA:6210A),RNaseinhibitor,dNTP,H
耗材:PCR板,移液器吸头。
设备:PCR仪。
单个B细胞cDNA获取:
步骤a):将上一步样品置于PCR仪中,65℃孵育5min,结束后立即置于冰上至少2min;
步骤b):按下表配制反应体系,cDNA合成体系
表4 cDNA合成体系
步骤c):将样品置于PCR仪中,42℃孵育1h,80℃热失活5s,结束后短期存于-20℃冰箱中;长期需放在-80℃冰箱中保存。
试剂:Taq DNA Polymerase(TAKARA:R001A);2×Phanta Flash Master Mix(Dyeplus/minus)(诺唯赞:P520/P510);6×Loading Buffer(TAKARA:9156);DL2000 DNAMarker(TAKARA:3427A);TAE缓冲液、琼脂糖。
耗材:PCR板,移液器吸头。
设备:PCR仪,水平电泳仪,凝胶成像仪。
抗体表达TAP片段制备:
通过PCR的方式将抗体表达所需要的元件(如启动子序列、终止序列)与抗体表达序列进行整合、扩增,含有拼接片段的PCR产物(TAP片段)可直接用于悬浮293F体系转染。
实施例9 TAP片段细胞转染和ELISA测定
试剂:Expi293
耗材:96孔深孔板,移液器吸头。
设备:恒温摇床,电动移液器。
TAP片段细胞转染:
步骤a):将Expi293F培养基提前置于37℃水浴锅温育。显微镜下观察细胞状态和细胞生长情况,根据当天细胞生长量及后续转染实验所需,确定当天细胞扩增实验传代比例,一般转染前一天转接密度控制在2x10
根据转接的细胞量选择最适规格的细胞摇瓶,一般培养体积不超过摇瓶体积的1/3,不低于摇瓶体积的1/5。根据细胞密度加入预热好的Expi293培养基使细胞终密度在2x10
步骤b):转染当日,将Expi293培养基,室温避光提前预热。确定好需要转染的细胞量,准备相应数量的96孔深孔板。根据细胞计数操作确定细胞密度,加入预热好的培养基稀释细胞,使其细胞终密度为3x10
步骤c):上清通过间接ELISA和竞争ELISA测定对小分子m6A识别的特异性,结果如表5和图5所示。间接ELISA和竞争ELISA结果显示,这些克隆对m6A小分子识别特异,而其他结构类似物(如图6所示)几乎不识别,尤其是1G1的OD450值最高,最终克隆1G1进行抗体重轻链可变区测序并进行质粒构建和抗体生产。
表5
/>
实施例10重轻链可变区测序
试剂:TAE缓冲液,琼脂糖,核酸染料。
耗材:移液器吸头。
设备:核酸电泳仪,核酸成像仪。
重轻链可变区测序:
提取抗体核酸序列,送基因测序公司获得1G1重链和轻链的可变区核酸和蛋白序列。
其中,重链可变区VH的氨基酸序列如SEQ ID NO.7所示,轻链可变区VL的氨基酸序列如SEQ ID NO.8,重链可变区VH的核酸序列如SEQ ID NO.9所示,轻链可变区VL的核酸序列如SEQ ID NO.10。
实施例11克隆1G1表达质粒构建和生产
根据重轻链可变区测序结果,送至基因合成公司将其构建到含有信号肽及恒定区的表达载体中。将合成后的质粒按照实施例9中描述的转染方式进行大量生产,加入的DNA量根据生产体积调整。培养4-7天收获上清进行纯化。
实施例12 1G1抗体特异性检测
通过m6A小分子和其他结构类似物进行竞争ELISA实验确认1G1抗体针对m6A小分子的结合是特异的,而对其他结构类似物几乎不交叉结合。
试剂:羊抗兔-HRP(华安生物:HA1001)、TMB底物(Sigma:T2885)、Tris(上海生工:A501492)、甘氨酸(上海生工:GB0235)、BSA(上海生工:A500023-0100)、吐温-20(上海生工:A600560)NaHCO
耗材:酶标板(杭州生友)。
设备:电热恒温培养箱(上海森信:DRP-9162型)、酶标仪器(MD:Cmax plus)。
间接ELISA操作:
使用竞争ELISA方法确认1G1抗体对m6A小分子的结合特异性。
间接竞争ELISA操作:
步骤a):包被:m6A-BSA用包被缓冲液稀释至2μg/mL,50μL/well的量加入到酶标板中,盖好盖子,4℃包被过夜。
步骤b):封闭:甩干孔中液体,150μL/well的量往酶标板中加入1%BSA/TBS,放入37℃电热恒温培养箱中恒温封闭1h。
步骤c):加样:甩干孔中液体,用PBS将抗m6A单克隆抗体进行梯度稀释,然后与等体积梯度稀释的竞争剂混合(m6A小分子和其他结构类似物分子使用PBS稀释),PBS作为对照组),室温静置10min;取100μL混合物加入酶标板,37℃反应45分钟。
步骤d):加入二抗:甩干一抗混合液,按180μL/well的量往酶标板中加入洗涤液(1×TBST),洗涤酶标板2次。1% BSA将羊抗兔-HRP稀释至工作浓度(1:30000),50μL/well的量加入到酶标板中,盖好盖子,放入37℃恒温培养箱孵育45min。
步骤e):显色、终止并读数:弃去孔中液体,按180μL/well的量往酶标板中加入洗涤液,洗涤酶标板3次;于各反应孔中加入100μL新配制的TMB显色底物,37℃恒温孵育10min;随后加入90μL/well的终止液终止反应,并在酶标仪上测定450nm处的OD值。
结果显示,如图7所示,只有m6A小分子竞争结合1G1抗体,OD值明显降低,说明1G1抗体对m6A小分子的特异性识别。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
